ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу получения активного фармацевтического ингредиента, известного как абакавир. Способ основан на формировании пуринового кольца в специфических условиях.
УРОВЕНЬ ТЕХНИКИ
Абакавир представляет собой Международное Непатентованное Название {(1S,4R)-4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил]циклопент-2-енил}метанола и имеет номер CAS 136470-78-5. Сульфат абакавира представляет собой сильнодействующий селективный ингибитор ВИЧ-1 и ВИЧ-2 и может использоваться в лечении инфицированных вирусом иммунодефицита человека (ВИЧ).
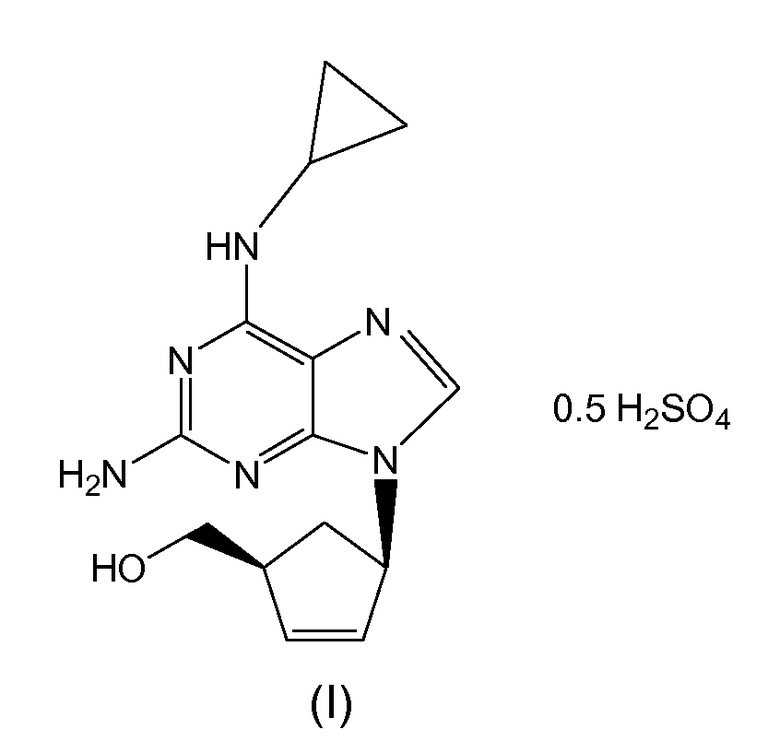
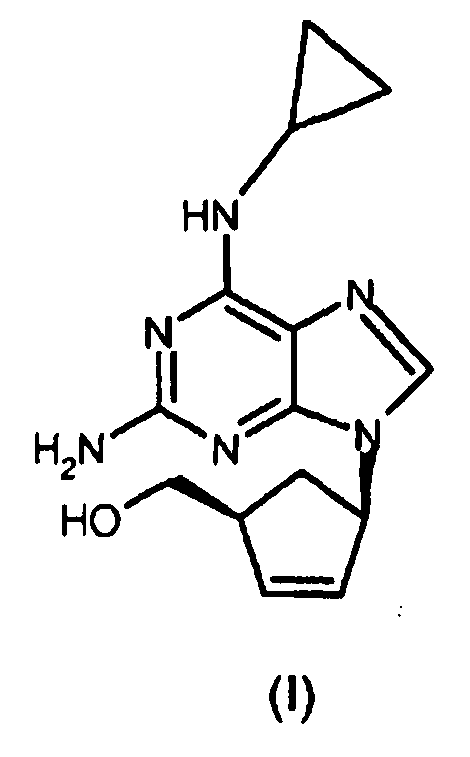
Структура соли гемисульфата абакавира представлена формулой (I):
Патентный документ EP 434450-A раскрывает некоторые 9-замещенные-2-аминопурины, включая абакавир и его соли, способы его получения, и фармацевтические композиции, использующие эти соединения.
В известном уровне техники известны различные способы получения абакавира. В некоторых из них абакавир получают, исходя из соответствующего пиримидинового соединения, посредством способа, включающего взаимодействие указанного соединения или полученного из него промежуточного соединения с остатком аналога сахара, циклизацию для формирования имидазольного кольца и введение циклопропиламиногруппы в 6 положение пуринового кольца.
В известном уровне техники описано несколько способов, осуществляющих циклизацию промежуточных соединений абакавира. Согласно патентному документу EP 434450-A циклизация некоторых промежуточных соединений абакавира, включая следующие промежуточные соединения, где R представляет собой циклопропиламин или хлорид,
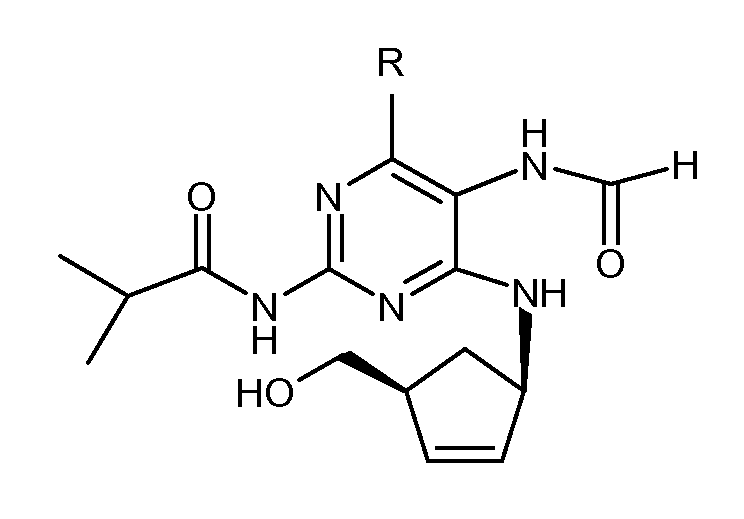
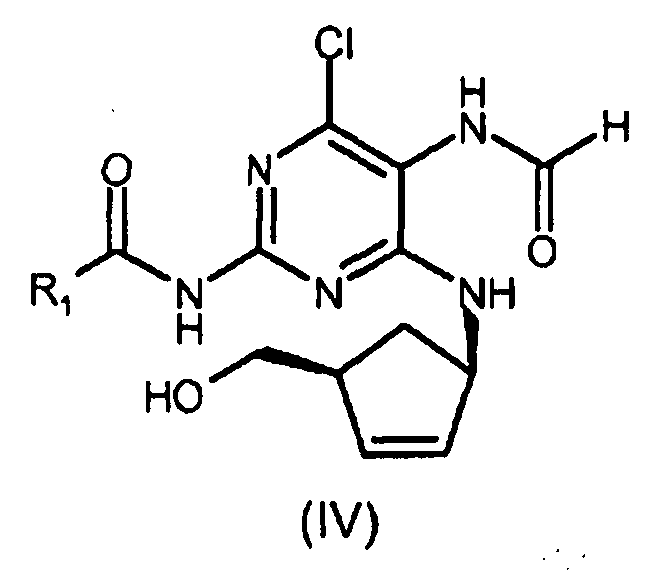
проводится с использованием муравьиной кислоты или химически активных производных муравьиной кислоты, необязательно в присутствии сорастворителя и сильной безводной кислоты, такой как этансульфоновая кислота. Отсутствует специфический пример, где циклизацию проводят в присутствии безводной кислоты. Пример 27 иллюстрирует циклизацию (+)-(1R,4S)-цис-N-[4-хлор-5-формамид-6-{[4-(гидроксиметил)-2-циклопентен-1-ил]амино}-2-пиримидинил]изобутирамида с использованием триэтилортоформиата и концентрированной водной соляной кислоты, таким образом аминогруппа в 5 положении пиримидина гидролизуется и соединение циклизуется. Основным недостатком является образование нескольких побочных продуктов, оказывающее влияние на выход и чистоту получаемого соединения.
Патентный документ EP 741710-A описывает циклизацию N-{2-амино-4-хлор-6-[(1R,4S)-4-(гидроксиметил)циклопент-2-ениламино]пиримидин-5-ил}формамида со следующей формулой:
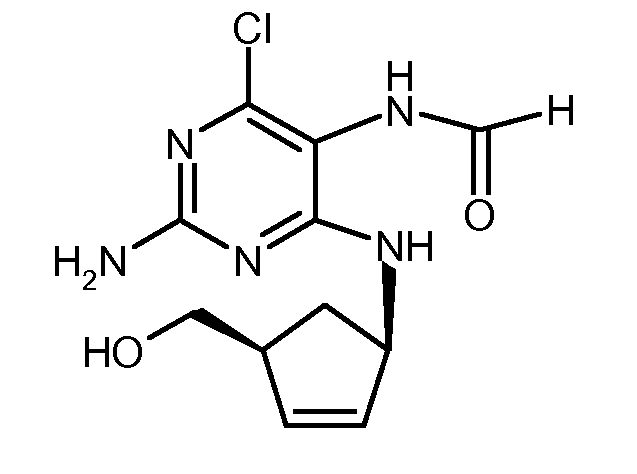
с использованием таких же условий циклизации, как в предыдущей патентной заявке, то есть триэтилортоформиат и концентрированная соляная кислота.
Те же самые авторы обеих патентных заявок утверждают в более поздней публикации (ср. S.M. Daluge с соавторами, Nucleosides, Nucleotides & nucleic acids 2000, vol.19, стр. 297-327), что циклизация N-{2-амино-4-хлор-6-[(1R,4S)-4-(гидроксиметил)циклопент-2-ениламино]пиримидин-5-ил}формамида протекает гладко в триэтилортоформиате и концентрированной водной соляной кислоте, но он не циклизуется в этилортоформиате с безводными кислотами, например этансульфоновой кислотой, концентрированной серной кислотой или безводной хлороводородной кислотой. Согласно указанному документу быстрое образование циклического соединения при использовании концентрированной водной соляной кислоты предполагает, что конформация исходного материала может быть неблагоприятной для циклизации и что добавление воды разрушает внутренние водородные связи и облегчает циклизацию.
Патентный документ WO 2005/023811 описывает циклизацию [(1S,4R)-4-(2,5-диамино-6-хлорпиримидин-4-иламино)циклопент-2-енил]метанола следующей формулы
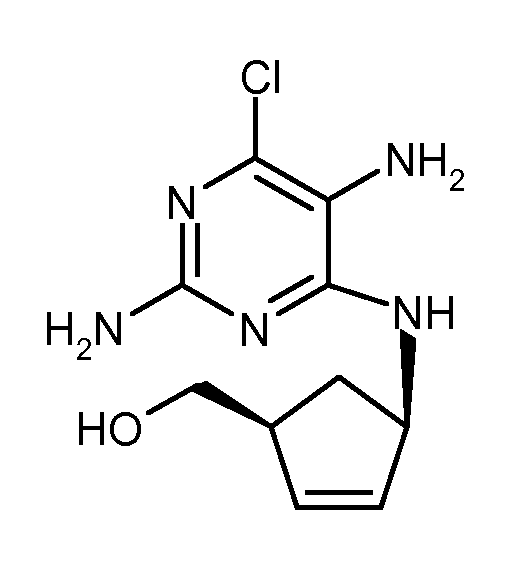
с использованием триэтилортоформиата и каталитического количества безводной или концентрированной хлороводородной кислоты, проводя циклизацию предпочтительно в апротонном неполярном растворителе. В отличие от исходного материала вышеупомянутых патентных заявок, в этом случае аминогруппы во 2 и в 5 положениях незащищены.
Несмотря на раскрытия этих документов известного уровня техники, разработка новых способов циклизации промежуточных соединений абакавира, в частности, промежуточных соединений, имеющих защищенные ацильной группой аминогруппы во 2 и в 5 положениях пиримидина, представляет собой все еще развивающуюся область, так как известные способы обладают низкими выходами и чистотой, как было отмечено выше. Таким образом, желательно создание нового способа циклизации указанных промежуточных соединений абакавира для получения пуриновой структуры.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что циклизация пиримидинового промежуточного соединения абакавира, N-{4-хлор-5-формамидо-6-[(1R,4S)-4-(гидроксиметил)циклопент-2-ениламино]пиримидин-2-ил}изобутирамида, протекает с высоким выходом и по существу без образования побочных продуктов, при использовании раствора безводной хлороводородной кислоты в изопропаноле и триэтилортоформиата в отсутствии воды. Способ включает удаление формильной группы при 5-аминогруппе пиримидина посредством сольволиза в отсутствии воды и циклизацию полученного соединения, используя циклизующий агент, такой как триэтилортоформиат. Неожиданно оказалось, что в отличие от установленного для предшествующего уровня техники, циклизация протекает эффективно при использовании безводной кислоты. Присутствие спирта позволяет проводить снятие защиты/циклизацию, избегая недостатков известных методов, формируя пуриновое кольцо с высоким выходом и высокой чистотой.
Таким образом, настоящее изобретение относится к способу получения абакавира формулы (I) или его фармацевтически приемлемых солей, или их сольватов,
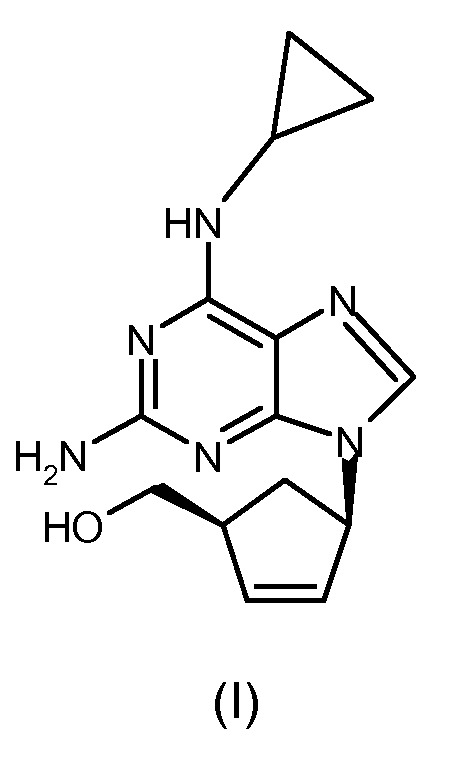
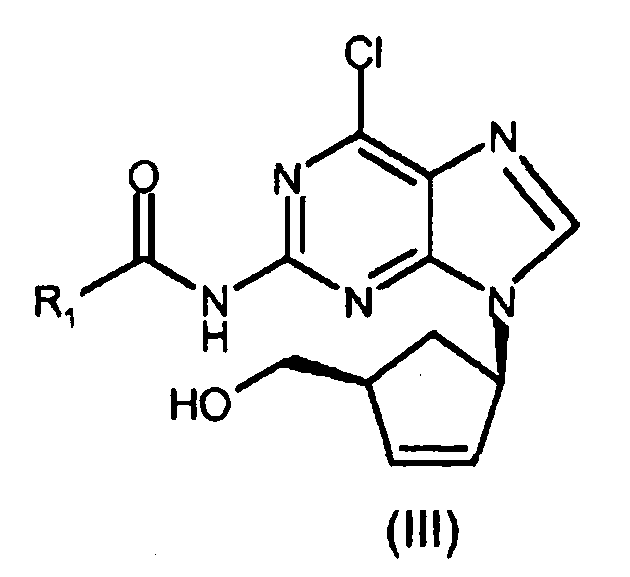
включающему стадию замыкания цикла в соединении формулы (IV) посредством взаимодействия указанного соединения формулы (IV) с раствором безводной хлороводородной кислоты в (C1-C6)-спирте, и затем с три(C1-C4)-алкилортоформиатом в безводных условиях с получением соединения формулы (III), где R1 представляет собой (C1-C4)-алкильный радикал.
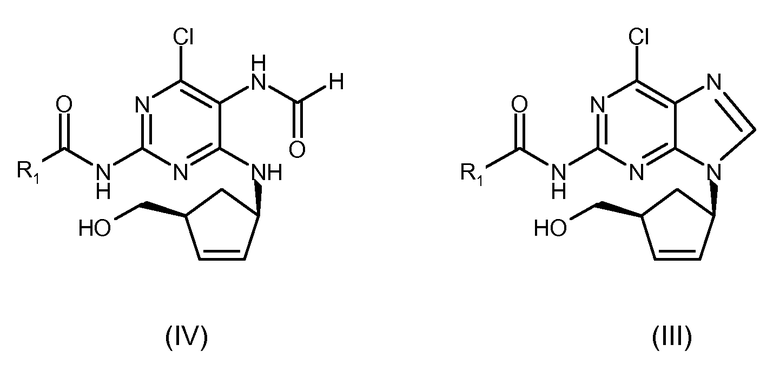
Среди замечательных преимущественных особенностей настоящего изобретения можно привести следующие: (i) циклизация, проводимая в указанных безводных условиях, более эффективна; (ii) пониженное образование примесей; в условиях реакции настоящего изобретения имеет место сольволиз с низким образованием побочных продуктов; (iii) отсутствие рацемизации; (iv) требуется меньшее количество циклизующего агента; и (v) требуется меньше времени на проведение реакции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В конкретном варианте осуществления настоящего изобретения способ получения абакавира (I) или его фармацевтически приемлемых солей, или их сольватов, включает замыкание цикла в соединении формулы (IV), где R1=изопропил, то есть N-{4-хлор-5-формамидо-6-[(1R,4S)-4-(гидроксиметил)циклопент-2-ениламино]пиримидин-2-ил}изобутирамида с формулой (IVa).
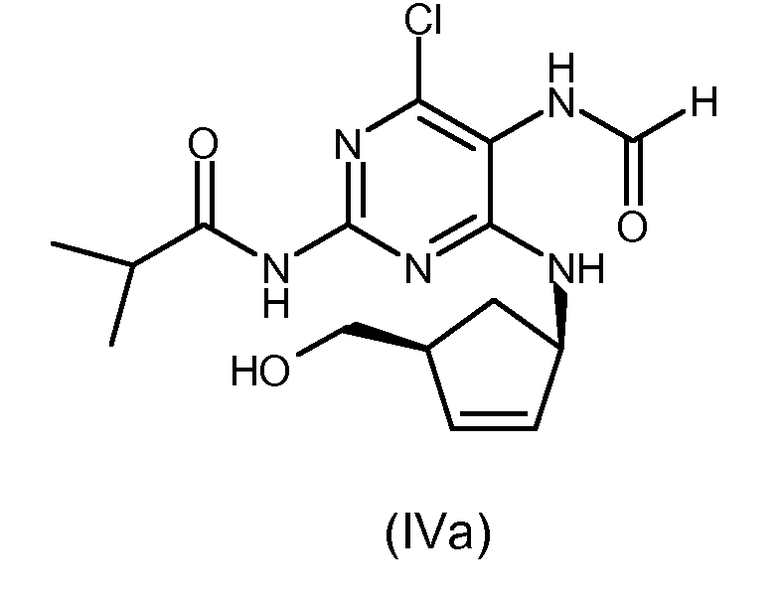
В предпочтительном варианте осуществления замыкание цикла в соединении формулы (IV) проводится посредством сначала взаимодействия указанного соединения формулы (IV) с раствором безводной хлороводородной кислоты в изопропаноле для удаления формильной группы при аминогруппе в 5 положении пиримидина, и затем с триэтилортоформиатом.
Обычно реакция сольволиза для удаления защитной группы при 5-аминогруппе проводится с избытком хлороводородной кислоты. Как правило, используют от 1 до 25 моль раствора хлороводородной кислоты в спирте на 1 моль исходного материала. В предпочтительном варианте осуществления молярное соотношение составляет 6:1. Предпочтительно реакцию сольволиза проводят в диапазоне температур от комнатной (приблизительно 20-25°С) до температуры кипения с холодильником. Более предпочтительно, реакцию проводят при температуре в интервале приблизительно 30-50°С.
Обычно реакцию с три(C1-C4)-алкилортоформиатом проводят в диапазоне температур приблизительно 0°С-30°С. Более предпочтительно, при температуре 5-10°С. В предпочтительном варианте осуществления используют циклизующий агент в количестве 2-5 моль циклизующего агента на 1 моль исходного материала.
Несмотря на то, что раствор хлороводородной кислоты в (C1-C6)-спирте и три(C1-C4)-алкилортоформиат могут быть добавлены одновременно, наилучшие результаты получают при последовательном добавлении раствора хлороводородной кислоты в (C1-C6)-спирте и три(C1-C4)-алкилортоформиата. Таким образом, в конкретном варианте осуществления после добавления раствора хлороводородной кислоты в изопропаноле реакционную смесь перемешивают по меньшей мере 10 минут перед добавлением триэтилортоформиата. Предпочтительно смесь перемешивают приблизительно 2 часа перед добавлением триэтилортоформиата.
Как показано в примерах, при проведении циклизации в безводных условиях очень резко увеличивается выход и также химическая чистота получаемого соединения. Кроме того, значительно уменьшается необходимое количество циклизующего агента.
Соединение формулы (IVa) можно получить согласно описанному Примеру 23 в Европейской патентной заявке EP 921121-A. Соединения формулы (IV) могут быть получены аналогично.
В предпочтительном варианте осуществления настоящего изобретения вышеупомянутый способ получения абакавира или его фармацевтически приемлемых солей, или их сольватов, дополнительно включает следующие стадии:
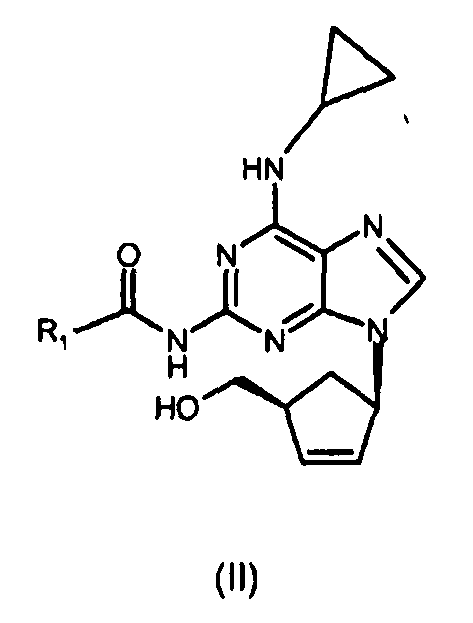
(i) реакцию соединения формулы (III) с циклопропиламином с получением соединения формулы (II), где R1 представляет собой (C1-C4)-алкильный радикал;
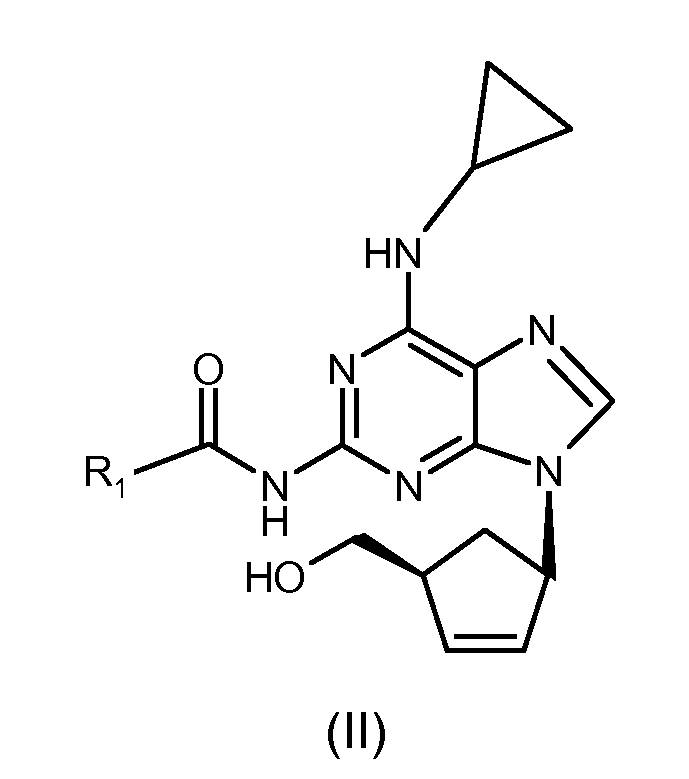
(ii) гидролиз амида формулы (II) с получением абакавира (I) или его соли; и, если требуется, конверсию абакавира (I) в свободной форме в соль, или конверсию полученной согласно настоящему способу соли абакавира (I) в свободную форму абакавира (I) или в другую соль.
Таким образом, полученное выше на стадии циклизации соединение формулы (III) может быть, например, превращено в абакавир посредством взаимодействия с циклопропиламином, обычно в присутствии основания и подходящего растворителя, с последующим гидролизом полученного соединения для получения абакавира или его солей. Гидролиз можно проводить в кислых условиях, как описано, например, в Примере 28 Европейской патентной заявке EP 434450-A.
Абакавир можно выделить из реакционной среды в виде фармацевтически приемлемой соли, предпочтительно гемисульфатной соли. Гемисульфатная соль {(1S,4R)-4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил]циклопент-2-енил}метанола I обозначает соль, образуемую между {(1S,4R)-4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил]циклопент-2-енил}метанолом и серной кислотой в стехиометрическом соотношении 2:1. В качестве альтернативы соединение формулы (I) можно выделить из реакционной среды в виде свободного основания. Когда требуется фармацевтически приемлемая соль, ее также можно получить из основной формы абакавира посредством обработки соответствующей кислотой. Предпочтительная соль представляет собой гемисульфатную соль абакавира, полученную посредством обработки основной формы абакавира серной кислотой в стехиометрическом соотношении 2:1. В качестве альтернативы соль абакавира (I), получаемого согласно настоящему способу, можно превратить в другую соль.
Наиболее подходящие условия для воплощения указанного способа варьируются в зависимости от параметров, учитываемых экспертом в данном уровне техники, таких как, например, концентрация реакционной смеси, температура, используемый в реакции растворитель и выделение продукта и тому подобные. Они могут быть легко определены упомянутым специалистом в данном уровне техники с помощью примеров, приведенных в этом Описании.
Везде в Описании и Формуле Изобретения слово «включает» и вариации этого слова не предназначены для исключения иных технических особенностей, добавок, компонентов или стадий. Реферат настоящей патентной заявки полностью включен в текст настоящего документа в виде ссылки. Дополнительные объекты, преимущества и особенности настоящего изобретения будут очевидны квалифицированному в данном уровне техники после рассмотрения Описания или освоены посредством практического использования изобретения.
ПРИМЕРЫ
Сравнительный Пример 1. Получение (-)-N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамида с использованием водной HCl
В атмосфере азота N-{4-хлор-5-формамидо-6-[(1R,4S)-4-(гидроксиметил)циклопент-2-ениламино]пиримидин-2-ил}изобутирамид (2,0 г, 5,65 ммоль) растворили в изопропаноле (14 мл) и 35% HCl (3 мл, 33,92 ммоль). Смесь нагревали в течение 2 часов при 40-42°С. Полученный раствор охладили до 8-10°С, затем добавили триэтилортоформиат (2,8 мл, 16,95 ммоль) и перемешивали реакционную смесь при этой температуре в течение 2 часов. HPLC анализ показал отсутствие химической реакции, тогда добавили еще триэтилортоформиата (21,6 мл, 130 ммоль) и перемешивали при 8-10°С в течение более 2 часов. Затем медленно добавили NaHCO3 (2,9 г, 33,92 ммоль), перемешивали 30 минут и отфильтровали соли. К полученному прозрачному раствору добавили NaHCO3 (475 мг, 5,65 ммоль) и циклопропиламин (2 мл, 28,3 ммоль), смесь кипятили с обратным холодильником в течение 1 часа и затем отфильтровали соли. Фильтрат упарили, добавили к остатку изопропанол (10 мл) и сконцентрировали в два раза досуха. Сироп растворили в горячем изопропаноле (15 мл). Эту смесь охладили до 0-2°С и отфильтровали полученную суспензию. Твердый остаток высушили в вакууме при 30°С. Было получено 0,428 г (21%) (-)-N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамида в виде розового порошка. HPLC анализ: 87,7%+5,1% Абакавира.
Пример 1. Получение (-)-N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамида с использованием раствора HCl в изопропаноле
В атмосфере азота N-{4-хлор-5-формамидо-6-[(1R,4S)-4-(гидроксиметил)циклопент-2-ениламино]пиримидин-2-ил}изобутирамид (20,0 г, 56,53 ммоль) растворили в безводном 2М растворе HCl в изопропаноле (170 мл, 339,17 ммоль). Смесь нагревали в течение 2 часов при 40-42°С. Полученный раствор охладили до 8-10°С, затем добавили триэтилортоформиат (28,2 мл, 169,59 ммоль) и перемешивали реакционную смесь при этой температуре в течение 2 часов. Затем медленно добавили NaHCO3 (28,50 г, 339,17 ммоль), перемешивали 30 минут и отфильтровали соли. К полученному прозрачному раствору добавили NaHCO3 (4,75 г, 56,53 ммоль) и циклопропиламин (19,6 мл, 282,65 ммоль), смесь кипятили с обратным холодильником в течение 1 часа и затем отфильтровали соли. Раствор упарили и растворили сироп в горячем изопропаноле (200 мл). Эту смесь охладили до 0-2°С и отфильтровали полученную суспензию. Твердый остаток высушили в вакууме при 30°С. Было получено 14,42 г (72%) (-)-N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамида в виде белого порошка. HPLC анализ: 94,4% + 4,0% Абакавира.
Пример 2. Получение (-)-N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамида
В атмосфере азота N-{4-хлор-5-формамидо-6-[(1R,4S)-4-(гидроксиметил)циклопент-2-ениламино]пиримидин-2-ил}изобутирамид (15 г, 42,4 ммоль) растворили в безводном 1N растворе HCl в изопропаноле (254 мл, 254,4 ммоль) и нагревали в течение 2 часов при 40-42°С. Полученный раствор охладили до 5-10°С и добавили триэтилортоформиат (21 мл, 127,2 ммоль). Полученную смесь перемешивали при температуре 5-10°С в течение 2 часов. Затем медленно добавили NaHCO3 (21,37 г, 254,4 ммоль), перемешивали 30 минут и отфильтровали соли. К полученному прозрачному раствору добавили NaHCO3 (3,56 г, 42,43 ммоль) и циклопропиламин (14,7 мл, 212 ммоль), смесь кипятили с обратным холодильником в течение 1 часа и затем отфильтровали соли. Раствор упарили и растворили сироп в горячем изопропаноле (120 мл). Эту смесь охладили до 0-2°С и отфильтровали полученную суспензию. Твердый остаток высушили в вакууме при 30°С. Было получено 10,97 г (73%) (-)-N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамида в виде белого порошка. HPLC анализ: 95,0%+3,8% Абакавира.
Пример 3. Получение гемисульфата абакавира
N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамид (6,56 г, 18,40 ммоль) суспендировали в смеси изопропанола (32,8 мл) и 10% растворе NaOH (36,1 мл, 92,0 ммоль). Смесь кипятили с обратным холодильником в течение 1 часа. Полученный раствор охладили до 20-25°С и добавили трет-бутилметиловый эфир (32,8 мл). Слои отделили и добавили по каплям 96% H2SO4 (0,61 мл, 11,03 ммоль) к органическому слою. Эту смесь охладили до 0-5°С и отфильтровали полученную суспензию. Твердый остаток высушили в вакууме при 40°С. Гемисульфат абакавира (5,98 г, 97%) был получен в виде белого порошка.
Пример 4. Получение гемисульфата абакавира
N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамид (6,56 г, 18,40 ммоль) суспендировали в смеси изопропанола (32,8 мл) и 10% растворе NaOH (36,1 мл, 92,0 ммоль). Смесь кипятили с обратным холодильником в течение 1 часа. Полученный раствор охладили до 20-25°С и добавили толуол (32,8 мл). Слои отделили и добавили по каплям 96% H2SO4 (0,61 мл, 11,03 ммоль) к органическому слою. Эту смесь охладили до 0-5°С и отфильтровали полученную суспензию. Твердый остаток высушили в вакууме при 40°С. Гемисульфат абакавира (5,42 г, 88%) был получен в виде белого порошка.
Пример 5. Получение абакавира
N-{6-(циклопропиламино)-9-[(1R,4S)-4-(гидроксиметил)циклопент-2-енил]-9H-пурин-2-ил}изобутирамид (1,0 г, 2,80 ммоль) суспендировали в смеси изопропанола (2 мл) и 10% растворе NaOH (1,1 мл, 2,80 ммоль). Смесь кипятили с обратным холодильником в течение 1 часа. Полученный раствор охладили до 20-25°С и добавили трет-бутилметиловый эфир (2 мл). Удалили водный слой, органическую фазу охладили до 0-5°С и отфильтровали полученную суспензию. Твердый остаток высушили в вакууме при 40°С. Абакавир (0,62 г, 77%) был получен в виде белого порошка.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АБАКАВИРА | 2007 |
|
RU2434869C2 |
| ЭНАНТИОМЕРНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2091386C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНЫХ СОЕДИНЕНИЙ ИЛИ ИХ ПРОИЗВОДНЫХ | 1990 |
|
RU2068849C1 |
| ХЛОРПИРИМИДИНОВЫЕ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2140913C1 |
| ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ И 7-ДЕАЗАПУРИНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2606514C2 |
| ДИДЕЗОКСИДИДЕГИДРОКАРБОЦИКЛИЧЕСКИЕ НУКЛЕОЗИДЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1989 |
|
RU2114846C1 |
| 4'-ЗАМЕЩЕННЫЕ НУКЛЕОЗИДНЫЕ ИНГИБИТОРЫ ОБРАТНОЙ ТРАНСКРИПТАЗЫ И ИХ ПОЛУЧЕНИЕ | 2016 |
|
RU2720811C2 |
| АДЕНОЗИНОВОЕ ПРОИЗВОДНОЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕГО | 2020 |
|
RU2824528C2 |
| ЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ОБЛАДАЮЩАЯ АНТИВИРУСНЫМ ДЕЙСТВИЕМ | 1993 |
|
RU2141952C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО 1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ | 2004 |
|
RU2310654C1 |
Изобретение относится к улучшенному способу получения абакавира формулы (I), или его солей, или его сольватов. Абакавир обладает свойствами сильнодействующего селективного ингибитора ВИЧ-1 и ВИЧ-2 и может использоваться при лечении инфицированных вирусом ВИЧ. Способ включает i) стадию замыкания цикла в соединении формулы (IV) посредством сначала взаимодействия указанного соединения (IV) 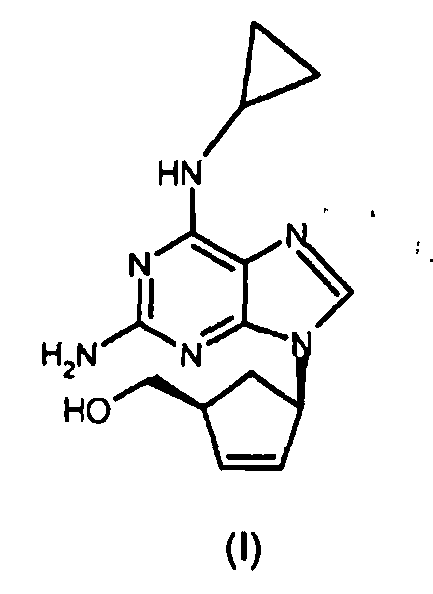
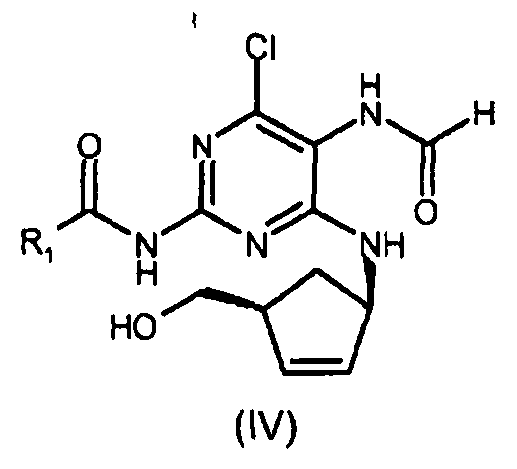
с раствором безводной хлороводородной кислоты в (C1-C6)-спирте, предпочтительно в изопропаноле, и затем с три(C1-C4)-алкилортоформиатом в безводных условиях с получением соединения формулы (III), ii) взаимодействие соединения формулы (III) с циклопропиламином с получением соединения формулы (II) и iii) гидролиз соединения формулы (II) с получением абакавира (I) или его соли.
R1 представляет собой (C1-C4)-алкильный радикал, предпочтительно изопропил. Способ получить целевой продукт с более высоким выходом и высоким качеством. 11 з.п. ф-лы, 6 пр.
1. Способ получения абакавира формулы (I), или его фармацевтически приемлемой соли, или его сольвата,
включающий i) стадию замыкания цикла в соединении формулы (IV) посредством сначала взаимодействия указанного соединения (IV) с раствором безводной хлороводородной кислоты в (C1-C6)-спирте и затем с три(C1-C4)-алкилортоформиатом в безводных условиях с получением соединения формулы (III)

где R1 представляет собой (C1-C4)-алкильный радикал,
ii) взаимодействие соединения формулы (III) с циклопропиламином с получением соединения формулы (II)
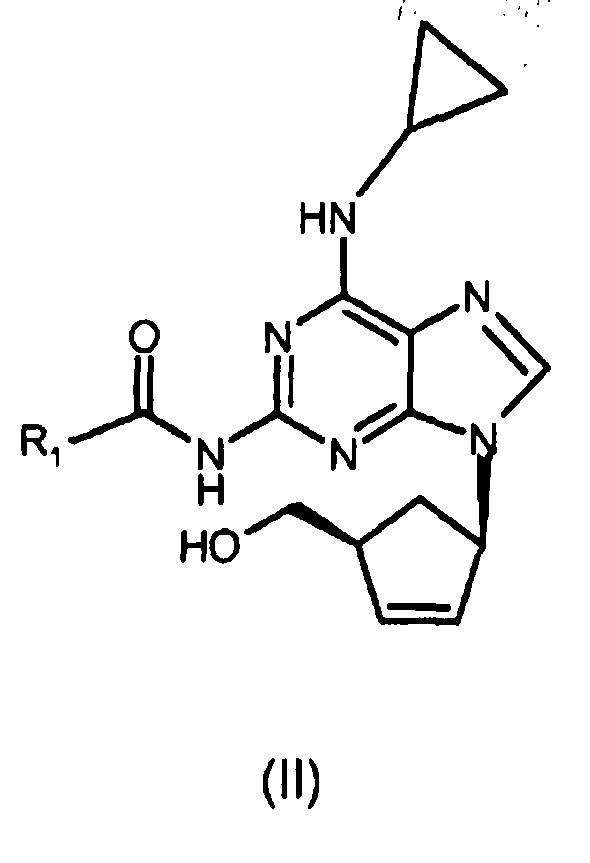
где R1 представляет собой (C1-C4)-алкильный радикал; и
iii) гидролиз соединения формулы (II) с получением абакавира (I) или его соли; и, если требуется, конверсию абакавира (I) в свободной форме в соль или конверсию полученной согласно настоящему способу соли абакавира (I) в свободную форму абакавира (I) или в другую соль.
2. Способ получения по п.1, где R1 представляет собой изопропил.
3. Способ получения по п.1, где (C1-C6)-спирт представляет собой изопропанол.
4. Способ получения по п.1, где три(C1-C4)-алкилортоформиат представляет собой триэтилортоформиат.
5. Способ получения по п.1, где реакцию с раствором безводной хлороводородной кислоты в (C1-C6)-спирте проводят в диапазоне температур от комнатной до температуры кипения с обратным холодильником с последующей реакцией с три(C1-C4)-алкилортоформиатом в диапазоне температур 0-30°C.
6. Способ получения по п.2, где (C1-C6)-спирт представляет собой изопропанол.
7. Способ получения по п.2, где три(C1-C4)-алкилортоформиат представляет собой триэтилортоформиат.
8. Способ получения по п.6, где три(C1-C4)-алкилортоформиат представляет собой триэтилортоформиат.
9. Способ получения по п.8, где реакцию с раствором безводной хлороводородной кислоты в (C1-C6)-спирте проводят в диапазоне температур от комнатной до температуры кипения с обратным холодильником с последующей реакцией с три(C1-C4)-алкилортоформиатом в диапазоне температур 0-30°C.
10. Способ получения по п.2, дополнительно включающий следующие стадии:
(i) реакцию соединения формулы (III) с циклопропиламином с получением соединения формулы (II)
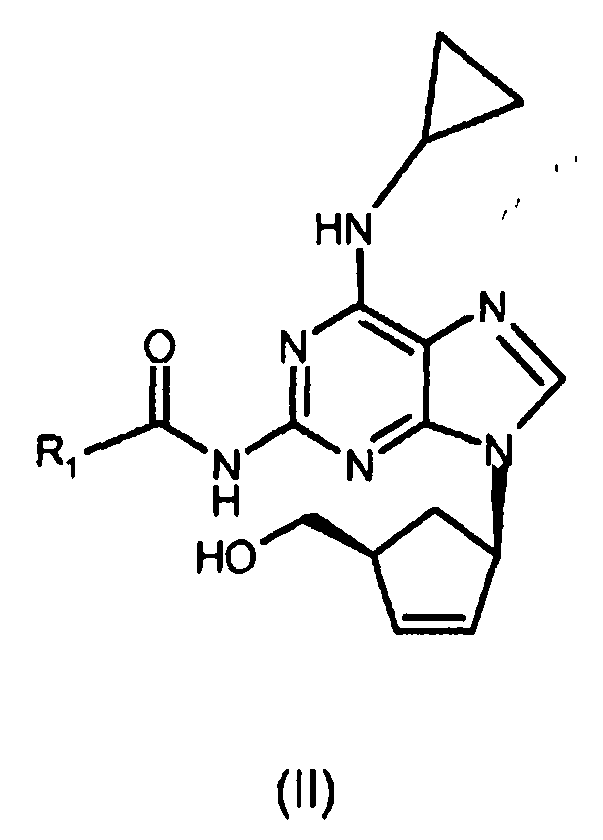
где R1 представляет собой изопропил;
(ii) гидролиз соединения формулы (II) с получением абакавира (I) или его соли; и, если требуется, конверсию абакавира (I) в свободной форме в соль или конверсию полученной согласно настоящему способу соли абакавира (I) в свободную форму абакавира (I) или в другую соль.
11. Способ получения по п.8, дополнительно включающий следующие стадии:
(i) реакцию соединения формулы (III) с циклопропиламином с получением соединения формулы (II)
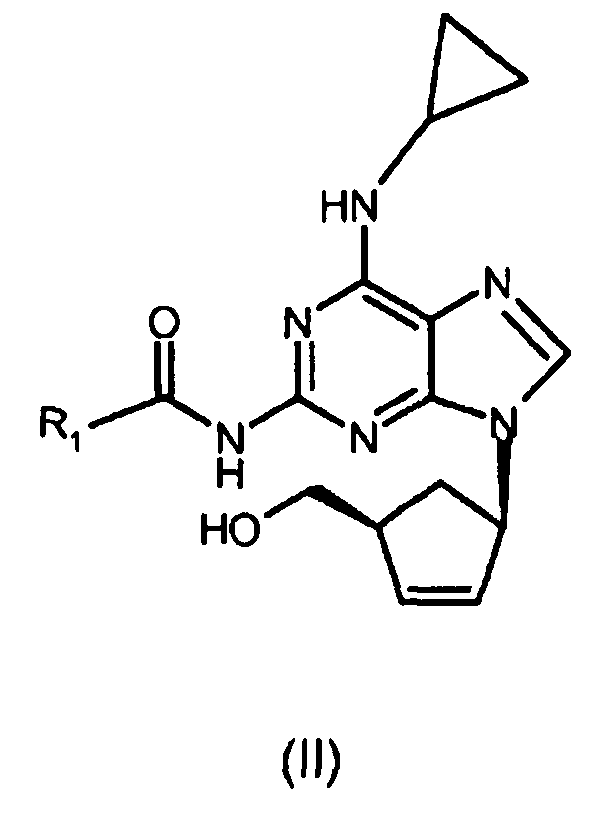
где R1 представляет собой изопропил;
(ii) гидролиз соединения формулы (II) с получением абакавира (I) или его соли; и, если требуется, конверсию абакавира (I) в свободной форме в соль или конверсию полученной согласно настоящему способу соли абакавира (I) в свободную форму абакавира (I) или в другую соль.
12. Способ получения по п.9, дополнительно включающий следующие стадии:
(i) реакцию соединения формулы (III) с циклопропиламином с получением соединения формулы (II)
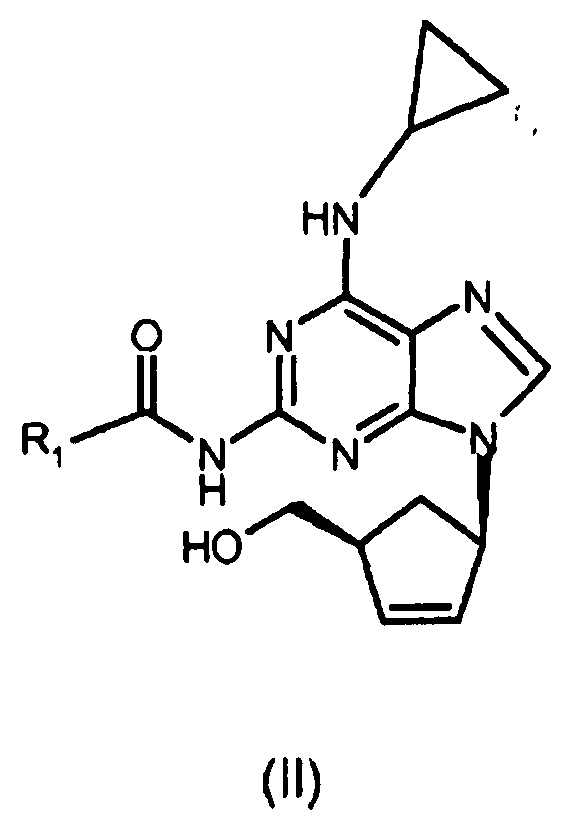
где R1 представляет собой изопропил;
(ii) гидролиз соединения формулы (II) с получением абакавира (I) или его соли; и, если требуется, конверсию абакавира (I) в свободной форме в соль или конверсию полученной согласно настоящему способу соли абакавира (I) в свободную форму абакавира (I) или в другую соль.
| ЭНАНТИОМЕРНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2091386C1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| DALUGE S M et al | |||
| "An EFFICIENT, SCALABLE SYNTHESIS OF THE HIV REVERSE TRANSCRIPTASE INHIBITOR ZIAGEN (1592U89" NUCLEOSIDES, NUCLEOTIDES and NUCLEIC ACIDS, 2000, v.19, no.1/2, p.297-327 | |||
| МАШИНА ПОСТОЯННОГО ТОКА С РЕГУЛИРУЕМЫМ СОПРОТИВЛЕНИЕМ МАГНИТНОЙ ЦЕПИ | 1923 |
|
SU6973A1 |
Авторы
Даты
2012-04-10—Публикация
2007-12-20—Подача