Изобретение относится к улучшенному способу получения 4-(2,3-диметилбензил)-1Н-имидазола, известного также как детомидин и соответствующего формуле I
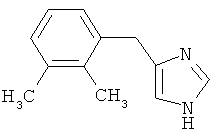
Детомидин относится к группе α2-пресинаптических агонистов и является действующим началом ветеринарного препарата Домоседан, используемого для седатации и/или анальгезии при проведении диагностических или терапевтических манипуляций у лошадей и собак.
В патенте US №4443466, опубл. 15.02.1983, описано несколько способов получения бензилзамещенных имидазолов, в том числе детомидина. Согласно одному из них хлорметилимидазол подвергают реакции с соответствующим производным бензола в органическом растворителе с добавлением основания, такого как карбонат натрия. Другой способ заключается в гидролизе неорганической кислотой N-ацильного производного бензилимидазола в водной среде. Можно также получить детомидин реакцией формамида с соответствующим оксазольным соединением. Описан также способ, заключающийся в реакции имидазол-4-карбальдегида с 2,3-фенилмагнийхлоридом, с получением соответствующего гидроксипроизводного, которое на второй стадии восстанавливают до детомидина водородом в присутствии катализатора гидрогенизации, такого как оксид платины, палладий на угле или никель Ренея. Выход детомидина в указанном патенте не указан.
В патенте US №4584383 (опубл. 22.04.1986) описывается получение детомидина реакцией 1-бензилимидазол-5-карбоксальдегида с реактивом Гриньяра с последующим восстановлением полученного соединения. Выход детомидина по патенту US №4584383 в расчете на исходный альдегид составляет 60%.
В CN 101747280 А (опубл. 23.06.2010) 1H-имидазол-4-илформамид подвергают реакции с реактивом Гриньяра, полученным из 1-бром-2,3-диметилбензола с получением -4-(2,3-диметилбензоил)имидазола, который восстанавливают и получают с высоким выходом детомидин.
Недостатками известных способов является использование реактива Гриньяра, который обладает высокой активностью и вследствие этого затруднено использование известных способов в промышленности, либо невысокий выход целевого соединения.
Задачей данного изобретения является разработка нового метода синтеза детомидина, отличающегося простотой и высоким выходом целевого соединения.
Решение поставленной задачи достигается заявленным способом получения детомидина взаимодействием N-триметилсилилимидазола с соединением формулы II
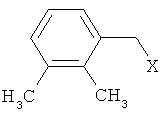
где X - Cl, Br, ОН,
в присутствии четыреххлористого титана при комнатной температуре в среде хлорсодержащих органических растворителей, таких как хлороформ, хлористый метилен, 1,1-дихлорэтилен. При этом мольное отношение четыреххлористого титана к N-триметилсилилимидазолу должно быть максимальным, но не превышать 0,95.
При мольном отношении четыреххлористого титана к N-триметилсилилимидазолу, равном 1,0 и выше, происходит резкое снижение выхода детомидина;
- увеличение мольного соотношения N-триметилсилилимидазола к соединению формулы II от 1,5 до 5,0 повышает выход детомидина;
- в качестве органического растворителя обычно могут быть использованы хлористый метилен, хлороформ, 1,1-дихлорэтилен. При этом соотношение растворитель/реагент не оказывает заметного влияния на выход целевого вещества;
- температура процесса в интервале 0-40°С не оказывает заметного влияния на выход целевого вещества.
При обработке полученного детомидина нетоксичной фармацевтически приемлемой кислотой, такой как соляная кислота, бромистоводородная, щавелевая, могут быть получены соответствующие нетоксичные фармацевтически приемлемые соли.
Экспериментальная часть.
Описываемый способ иллюстрируется следующими примерами.
Пример 1.
4-(2,3-Диметилбензил)-1Н-имидазол
К раствору 56,0 г (0,40 моль) N-триметилсилилимидазола в 150 мл хлороформа при комнатной температуре при перемешивании в течение 30 минут добавляют раствор 68,4 г (0,36 моль) четыреххлористого титана в 100 мл хлороформа. Перемешивают реакционную смесь 30 минут, после чего добавляют по каплям раствор 15,5 г (0,10 моль) 2,3-диметилбензилхлорида в 50 мл хлороформа. Реакционную смесь перемешивают 3 часа и выливают в 300 мл ледяной воды.
Водный слой отделяют, подщелачивают до рН>8, обрабатывают серным эфиром (3×100 мл), эфирный слой отделяют.
Растворитель из хлороформенного раствора удаляют в вакууме, к остатку добавляют 200 мл 10% раствора едкого натра, образовавшуюся смесь обрабатывают серным эфиром (3×100 мл), эфирный слой отделяют.
Объединенные эфирные вытяжки обрабатывают 10% раствором уксусной кислоты (3×50 мл), водный слой отделяют и подщелачивают до рН>8, выделившийся детомидин экстрагируют хлористым метиленом (3×50 мл), органический слой сушат над Na2SO4 и удаляют растворитель. Получают 15,3 г (82% в расчете на 2,3-диметилбензилхлорид) 4-(2,3-диметилбензил)-lH-имидазола в виде светло-желтого кристаллического вещества.
ЯМР Н1 (CDCl3): δ 2,19 (s, 3H, C6H5-СН3), 2,30 (s, 3H, C6H5-СН3), 3,97 (s, 2H, СН2), 6,61 (s, 1H, Im, C-5), 7,06 (m, 3Harom), 7,47 (s, 1H, Im, C-2), 10,50 (br s, 1H, NH); Тпл 153-158°С (гидрохлорид).
Пример 2
4-(2,3-Диметилбензил)-1Н-имидазол
Синтез и выделение аналогичны примеру 1.
Вместо 2,3-диметилбензилхлорида используют 19,9 г (0,10 моль) 2,3-диметилбензилбромида. Выход 15,0 г 4-(2,3-диметилбензил)-1Н-имидазола (детомидина) (80% в расчете на 2,3-диметилбензилбромид).
Пример 3
4-(2,3-Диметилбензил)-1Н-имидазол
Синтез и выделение аналогичны примеру 1.
Вместо 2,3-диметилбензилхлорида используют 13,6 г (0,10 моль) 2,3-диметилбензилового спирта. Выход 15,9 г 4-(2,3-диметилбензил)-1Н-имидазола (детомидина) (85% в расчете на 2,3-диметилбензиловый спирт).
Как видно из вышеприведенных примеров, предложенный новый способ получения детомидина отличается простотой и пригоден для получения целевого продукта с высоким выходом.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ МЕДЕТОМИДИНА ИЛИ ЕГО НЕТОКСИЧНЫХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 2010 |
|
RU2448094C1 |
| СПОСОБ СИНТЕЗА N,N-ДИЗАМЕЩЕННЫХ АМИНОМЕТИЛСТИРОЛОВ ИЛИ АЛЬФА-АМИНОМЕТИЛСТИРОЛОВ | 2014 |
|
RU2673231C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННОГО ИМИДАЗОПИРИДИНА | 2001 |
|
RU2275372C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛОСАРТАНА | 2006 |
|
RU2412940C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗО[1,2-А]ПИРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ, СПОСОБ ИНГИБИРОВАНИЯ СЕКРЕЦИИ ЖЕЛУДОЧНОЙ КИСЛОТЫ, СПОСОБ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЙ, В КОТОРЫЕ ВОВЛЕЧЕНО ИНФИЦИРОВАНИЕ H.PYLORI | 1998 |
|
RU2193036C2 |
| ЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1992 |
|
RU2120440C1 |
| ДИАЛКИЛ(АРИЛ)-ЦИС-2-(2-ГИДРОКСИАРИЛ)-2-АЛКИЛ(АРИЛ)ЭТЕНИЛФОСФИНОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2329271C1 |
| СПОСОБ УТИЛИЗАЦИИ ХЛОРОРГАНИЧЕСКИХ ОТХОДОВ ПРОИЗВОДСТВА ЭПИХЛОРГИДРИНА (ВАРИАНТЫ) | 2008 |
|
RU2374276C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИ-АЛЬФА-ОЛЕФИНОВ И СОПОЛИМЕРОВ АЛЬФА-ОЛЕФИНОВ С ДИЕНАМИ С ИСПОЛЬЗОВАНИЕМ ИНИЦИИРУЮЩЕЙ СИСТЕМЫ НА ОСНОВЕ ИОННЫХ ЖИДКОСТЕЙ | 2012 |
|
RU2542581C2 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДНОГО СОЕДИНЕНИЯ | 2008 |
|
RU2451681C2 |
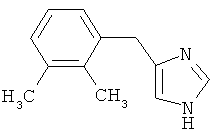
Настоящее изобретение относится к способу получения 4-(2,3-диметилбензил)-1Н-имидазола, известного также под названием детомидин, соответствующего формуле I

который заключается в том, что триметилсилилимидазол алкилируют соединением формулы II

где X - Cl, Br, ОН, в присутствии четыреххлористого титана в среде хлорсодержащего органического растворителя, при этом мольное отношение четыреххлористого титана к N-триметилсилилимидазолу должно быть максимальным, но не превышать 0,95. Технический результат: разработан новый способ получения детомидина, отличающийся высоким выходом целевого продукта. 2 з.п. ф-лы, 3 пр.
1. Способ получения детомидина формулы I
взаимодействием N-триметилсилилимидазола с соединением формулы II
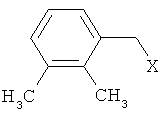
где X: Cl, Br, ОН
в присутствии четыреххлористого титана при комнатной температуре в среде хлорсодержащих органических растворителей, при этом мольное отношение четыреххлористого титана к N-триметилсилилимидазолу должно быть максимальным, но не превышать 0,95.
2. Способ по п.1, отличающийся тем, что в качестве хлорсодержащих органических растворителей используют хлороформ, хлористый метилен и 1,1-дихлорэтилен.
3. Способ по п.1, отличающийся тем, что мольное соотношение триметилсилилимидазола и соединения формулы II составляет от 1,5 до 5,0.
| Способ получения борной кислоты | 1947 |
|
SU72615A1 |
| Способ получения производных имидазола | 1981 |
|
SU1014472A3 |
| Способ получения производных имидазола или их гидрохлоридов | 1980 |
|
SU997607A3 |
Авторы
Даты
2012-04-20—Публикация
2010-12-09—Подача