Изобретение относится к фармацевтической химии и химии природных соединений и может быть использовано для очистки и фракционирования веществ, находящих применение в медицине.
Известен сорбент, предназначенный для хроматографии белков, и способ его получения при использовании готового торгового продукта сефарозы (Sepharose. RTM. CL-6B, производитель Pharmacia). Способ получения заключается в отмывании сефарозы, ее активации и ряда последовательных химических реакций, приводящих к присоединению Ni2+, в концентрации примерно 7,1 микромоль/мл геля [пат. США 72452, 1989].
Недостаток данного сорбента заключается в том, что он предназначен для сорбции белков, имеющих только «якорные» участки, а способ его получения является многостадийным и длительным.
Известен сорбент и способ его получения на основе целлюлозного носителя, обработанного перманганатом калия с образованием слоя диоксида марганца на носителе с дальнейшей обработкой раствором ферроцианида калия в присутствии уксусной кислоты [п. РФ 2172208, МПК B01J 20/02, опубл. 2001.08.20].
Недостаток этого сорбента заключается в том, что он не стабилен при значениях pH выше 8, а целлюлозная матрица нестабильна в органических растворителях.
Наиболее близким по техническим характеристикам прототипом является способ получения наноалмазного сорбента. Известен сорбент, включающий иммобилизацию наночастиц алмаза на полимерной матрице, где в качестве матрицы используют полисахаридную матрицу. В качестве полисахаридной матрицы используют сефарозу 2В. Процесс проводят в хроматографической колонке [RU 2352387 C1, B01J 20/02 B01J 20/281, опубл. 20.04.2009 (прототип)].
К недостаткам сорбента, изготавливаемого по данному способу, относится неустойчивость полисахаридной матрицы к органическим растворителям и растворам с pH выше 8 и ниже 6, вымывание наноалмазные частиц в результате высокой солюбилизации низкомолекулярными веществами, свойства сорбента и полимерная матрица позволяют работать только с высокомолекулярными - белковыми молекулами.
Техническим результатом изобретения является создание полифункционального наноалмазного сорбента с закрепленными наноалмазными частицами, способного более селективно адсорбировать молекулы, в том числе с молекулярной массой ниже 1000 Da, а так же различающегося физико-химическими свойствами, выполнять работы с использованием различных органических элюентов в широких диапазонах значений pH.
Технический результат достигается тем, что в сорбенте для хроматографии, содержащем наночастицы алмаза, иммобилизованные на полимерной полисахаридной матрице, новым является то, что сорбент, содержащий наночастицы алмаза, подвергается обработке эпоксиреагентом (эпоксидной перешивке), что позволяет закрепить наночастицы и повысить специфичность сорбента за счет последующей иммобилизации по остаточным концевым группам спейсера (вставки) и требуемого специфического лиганда.
Технический результат достигается также и тем, что в способе получения сорбента для хроматографии, включающем иммобилизацию наночастиц алмаза на полимерной матрице, новым является то, что на используемый в качестве матрицы поперечносшитый полисахаридный сорбент последовательно иммобилизуют детонационные наноалмазы (ДНА), закрепляют их в структуре матрицы обработкой эпоксиреагентом и дополнительно присоединяют на остаточные эпоксигруппы вещество вставку и вещество лиганд. В качестве полисахаридной матрицы используют: сефарозу Sepharose® CL 4В или Sephadex® LH-20. Данные матрицы стабильным в широком диапазоне значений pH, а так же в среде органических растворителей, что позволяет использовать обозначенный тип сорбентов для последующей химической модификации.
Процесс получения сорбента с детонационными наноалмазами состоит из нескольких стадий и заключается в создании контакта частиц гидрозоля наноалмаза с матрицей, удалении не связавшихся с матрицей наноалмазов, этапом обработки матрицы с иммобилизованными наноалмазами эпоксидирующим реагентом и присоединением вставки по остаточным эпоксигруппам и присоединением вещества - лиганда.
Отличием от известного прототипа является использование агарозной или декстрановой матрицы стабильными в среде органических растворителей и широком диапазоне значений pH, с последующей обработкой гидрозолем детонационных наноалмазов эпоксидирующим реагентом и последующим присоединением вставки и специфического лиганда. Модифицированный таким способом сорбент в отличие от прототипа обладает специфичностью, а так же может быть использован для хроматографической очистки и выделения низкомолекулярных органических веществ вторичных метаболитов растений и лекарственных препаратов.
Сравнение заявляемых технических решений с прототипом позволило установить их соответствие критерию «новизна».
Получение сорбента с детонационными наноалмазами происходит по следующим этапам:
отмытая от консервантов (дистиллированной водой не менее 3 раз) поперечносшитая агароза (Sepharose® CL 4В) или оксипропилированный декстрановый сорбент (Sephadex® LH-20) в набухшем состоянии переносят в реакционную колбу, куда добавляют раствор детонационных наноалмазов, предварительно обработанных ультразвуком до образования гидрозоля. Реакционную смесь перемешивают при температуре 60°C в течение 1 часа на роторном испарителе. После этого гель промывают от непрореагировавших частиц на стеклянном фильтре трехкратным объемом бидистиллированной воды. Переносят в реакционную колбу, куда добавляют эпоксиреагент, раствор 0,5 М раствор щелочи и поверхностно-активное вещество, увеличивающее качество перешивки. Эпоксиактивацию проводят при температуре 50°С в течение 1 ч. В зависимости от поставленной задачи в качестве эпоксидирующего реагента может быть использован: 1-хлор 2,3-эпоксипропан (эпихлоргидрин (ЭХГ)), или диглицидиловый эфир 1,2-этандиола (ДГЭЭД).
На следующем этапе свободные эпоксигруппы блокируют присоединением вещества - вставки, позволяющей увеличить расстояние между лигандом и поверхностью матрицы.
На заключительном этапе модификации к вставке присоединяется вещество лиганд.
Пример 1.
Получение сорбента.
В качестве носителя использован сорбент на основе поперечносшитой агарозы - сефароза® CL 4В. Синтез адсорбента осуществляли по следующей методике: 50 мл приготовленного геля адсорбента отмывали от консервантов (дистиллированной водой не менее 3 раз). Промытый гель переносят в реакционную колбу, куда добавляют раствор детонационных наноалмазов, предварительно обработанных ультразвуком до образования гидрозоля. Реакционную смесь перемешивают при температуре 60°C в течение 1 часа на роторном испарителе. После этого гель последовательно промывают от непрореагировавших частиц на стеклянном фильтре трехкратным объемом бидистилированной воды, 100 мл воды очищенной, 50 мл смеси, состоящей из 0,5 М раствора натрия гидроксида и 25% раствора диметилсульфоксида (ДМСО). Промытый гель переносили в круглодонную колбу, содержащую реакционную смесь, состоящую из раствора натрия гидроксида 0,5 М в 25% ДМСО, 20 мл диглицидиловый эфир 1,2-этандиола (ДГЭЭД), и 10 мл водного раствора тетрабутиламмония бромида (последний является катализатором данного процесса). Реакционную смесь перемешивали на роторном испарителе при температуре 50°С в течение 1 ч.
После этого реакционную смесь переносят на стеклянный фильтр и промывают раствором натрия гидроксида в ДМСО, диметилформамидом и не менее чем трехкратным объемом дистиллированной воды. Обработанный гель переносили на стеклянный фильтр и последовательно промывали 80 мл смеси раствора 25% ДМСО в 0,5 М растворе натрия гидроксида, 200 мл насыщенного раствора натрия тетрабората, 40 мл 50% водного раствора ДМСО и окончательно отмывали дистиллированной водой до отрицательной фенолфталеиновой пробы промывных вод.
Определение остаточных эпоксигрупп проводили титриметрически по образованию солей Бунте и определили концентрацию эпоксигрупп на уровне 20-25 мкмоль/мл упакованного геля адсорбента.
В качестве спейсера (вставки) использовали гидразид салициловой кислоты. Для этого навеску гидразид салициловой кислоты 0,25 г растворили в 8,0 мл ДМСО и добавили 2,0 мл насыщенного раствора натрия тетрабората. Полученный таким образом раствор гидразида салициловой кислоты (ГСК) внесли в эпоксигель. Реакционную смесь перемешивали на роторном испарителе при t=40-45°C в течение 1,5 ч. После этого гель тщательно отмывали до отрицательной реакции промывных вод с ионами железа (III).
Иммобилизацию лиганда - соединения с ароматической аминогруппой, лекарственного препарата прокаин (новокаин) проводили в следующей последовательности. Для этого гель, промытый тетраборатом натрия на стеклянном фильтре, поместили в реакционную колбу (холодовая баня), содержащую равное количество тетрабората натрия. Одновременно 0,9 г прокаина растворяли в 0,2 М растворе хлористоводородной кислоты и добавили по каплям 15 мл охлажденного раствора 5% натрия нитрита, полученную азосоль прокаина в объеме 25 мл на холоду, при перемешивании объединяли с гелем, контролируя значение pH и поддерживая на уровне не менее 10. Реакционная смесь была оставлена на 30 минут при 4-5°C. Затем полученный окрашенный сорбент последовательно отмывали 0,1 М растворами натрия гидроксида, хлористоводородной кислоты, 50% раствором ДМСО и 50% раствором диметилформамида. После этого он окончательно отмыт водой, очищенной до pH 7. Синтезированный гель обратимо изменяет свою окраску в зависимости от значений pH среды. Так, в щелочной среде интенсивность окраски усиливалась до желто-оранжевого цвета. В кислотных растворах он приобретает лимонно-желтую окраску. Полученный сорбент имеет следующую аббревиатуру: сефароза® CL 4В-ДНА-ГСК-Прокаин.
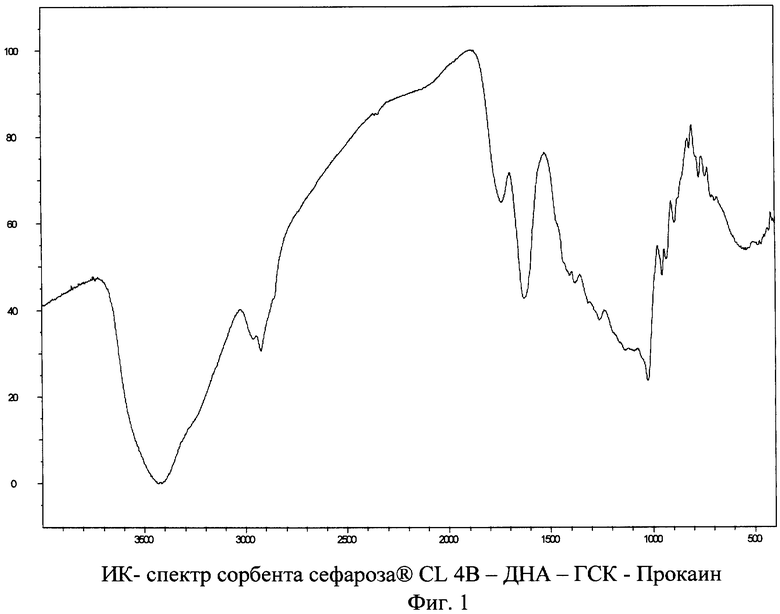
Структурные свойства полученного сорбента дополняют его ИК-спектры, полученные в режиме диффузного отражения (см. фигура 1). Характерной особенностью ИК-спектра полученного сорбента является наличие полос поглощения слабой интенсивности при 815 см-1, 952 см-1, а так же полос поглощения средней и сильной интенсивности 1022,9 см-1, 1738 см-1. Исходная матрица - носитель (Сефарозы CL-4B) обладает иным набором полос поглощения.
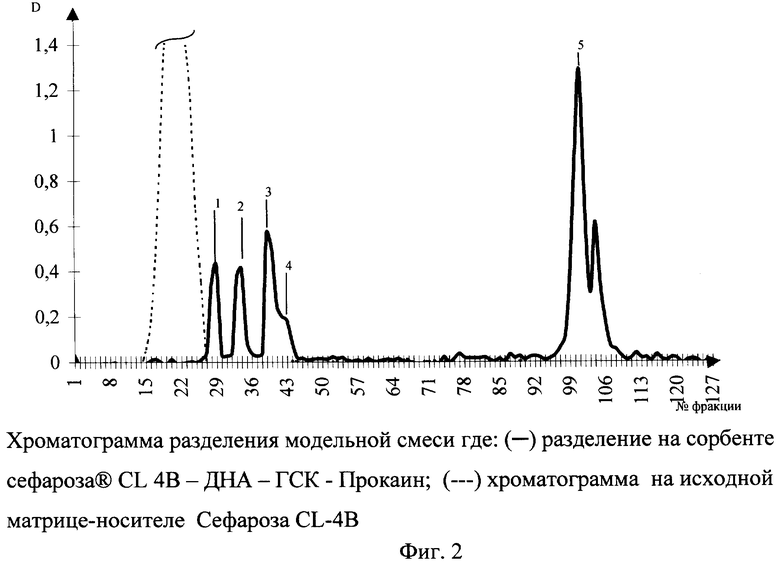
Хроматографические свойства полученного сорбента поясняются разделением модельной смеси, состоящей из следующих компонентов: гипоксантин-рибозид (А), 4-хлор-N-(2фурилметил)-5-сульфамоилантраниловая кислота (фуросемид) (Б), 2[2,6дихлорфенил)амино]-фенилуксусной кислоты натриевая соль (ортофен) (В), 9α фтор-16α-метилпреднизолон (дексаметазон) (Г), рутин (Д), содержание веществ составило 0,02 г/мл. Использована хроматографическая колонка для обычной жидкостной хроматографии низкого давления (250×5 мм LKB Pharmacia, Швеция). Элюцию последовательно осуществляли водой бидистиллированной и градиентом спирта изопропилового в 0,1 М растворе кислоты хлористоводородной. Фракции собирали с помощью коллектора фракций Diafrac - 002 по 0,5 мл. Анализ выделенных фракций осуществляли с использованием спектрофотометра СФ-2000 (Россия) по ключевым длинам волн 240, 275, 325, 340 нм. Пиковые фракции анализировали в диапазоне 190-410 нм с разрешением 0,1 нм. Полученная хроматограмма представлена на фигуре 2. Порядок выхода веществ с колонки следующий: 1) гипоксантин-рибозид (Инозин); 2) фуросемид; 3) ортофен; 4) дексаметазон; 5) рутин. В контрольном опыте, используя немодифицированный сорбент сефарозу CL-4B, разделения модельной смеси отмечено не было.
Пример 2.
Получение сорбента.
В качестве носителя использовался сорбент сефадекс Sephadex® LH-20. Синтез адсорбента осуществляли по следующей методике: 50 мл приготовленного геля адсорбента отмывали от консервантов (бидистиллированной водой не менее 3 раз). Промытый гель переносили в реакционную колбу, куда добавляют раствор детонационных наноалмазов, предварительно обработанных ультразвуком до образования гидрозоля. Реакционную смесь перемешивают при температуре 50°C в течение 1 часа на роторном испарителе. После этого гель последовательно промыли от непрореагировавших частиц на стеклянном фильтре трехкратным объемом бидистилированной воды, 100 мл воды очищенной, 50 мл смеси, состоящей из 0,5 М раствора натрия гидроксида и 25% раствора диметилсульфоксида (ДМСО). Промытый гель переносили в круглодонную колбу, содержащую реакционную смесь, состоящую из раствора натрия гидроксида 0,5 М в 25% ДМСО, 22 мл эпихлоргидрина (ЭХГ), и 20 мл водного раствора тетрабутиламмония бромида (последний является катализатором данного процесса). Реакционную смесь перемешивали на роторном испарителе при температуре 50°С в течение 1 ч.
После этого реакционную смесь переносят на стеклянный фильтр и промывают раствором натрия гидроксида в диметилсульфоксиде, диметилформамидом и не менее чем трехкратным объемом дистиллированной воды. Активированный гель, имеющий желтоватый оттенок, переносили на стеклянный фильтр и последовательно промывали 80 мл смеси раствора 25% ДМСО в 0,5 М растворе натрия гидроксида, 200 мл насыщенного раствора натрия тетрабората, 40 мл 50% водного раствора ДМСО и окончательно отмывали дистиллированной водой до отрицательной фенолфталеиновой пробы промывных вод.
Определение остаточных эпоксигрупп проводили титриметрически по образованию солей Бунте и определили концентрацию эпоксигрупп на уровне 30-35 мкмоль/мл упакованного геля адсорбента.
В качестве спейсера (вставки) использовали n-нитробензгидразид (n-НБГ). Для этого навеску n-нитробензгидразида 0,3 г растворили в 8,0 мл ДМСО и добавили 2,0 мл насыщенного раствора натрия тетрабората. Полученный таким образом раствор n-нитробензгидразид внесли в эпоксигель. Реакционную смесь перемешивали на роторном испарителе при t=45°C в течение 1,5 ч. После этого гель тщательно отмывали до отрицательной реакции промывных вод с реактивом Инмана-Динтзиса.
Химическая модификация n-нитрогрупп синтезированного нитрогеля проведена с использованием в качестве восстановителя натрия дитионит.
Иммобилизацию лиганда - соединения со свободным фенольным гидроксил (например, вещества группы флавоноидов) дигидрокверцетин на амино гель проводили в следующей последовательности. Для этого гель, промытый охлажденным раствором кислоты хлороводородной 0,1 М на стеклянном фильтре, поместили в реакционную колбу (холодовая баня), содержащую равное количество 0,1 М раствора кислоты хлороводородной, и добавляли 15 мл охлажденного раствора 5% натрия нитрита. Одновременно 2,0 г дигидрокверцетина растворяли в 1 М растворе натрия гидроксида. Полученный щелочной раствор лиганда при интенсивном перемешивании одномоментно внесли в колбу с диазотированным гелем. Реакционная смесь была оставлена на 30 минут при 4-5°C. Полученный окрашенный сорбент последовательно отмывали 0,1М растворами натрия гидроксида, хлористоводородной кислоты, 50% раствором ДМСО и 50% раствором диметилформамида. После этого он окончательно отмыт водой очищенной до pH 7. Синтезированный гель азо адсорбент аффинного типа с наноалмазами обратимо изменяет свою окраску в зависимости от значений pH среды. Так, в щелочной среде интенсивность окраски усиливалась до желто-оранжевого цвета. В кислотных растворах он приобретает лимонно-желтую окраску. Полученный сорбент имеет следующую аббревиатуру: Sephadex® LH-20-ЭХГ-n-НБГ- дигидрокверцетин.
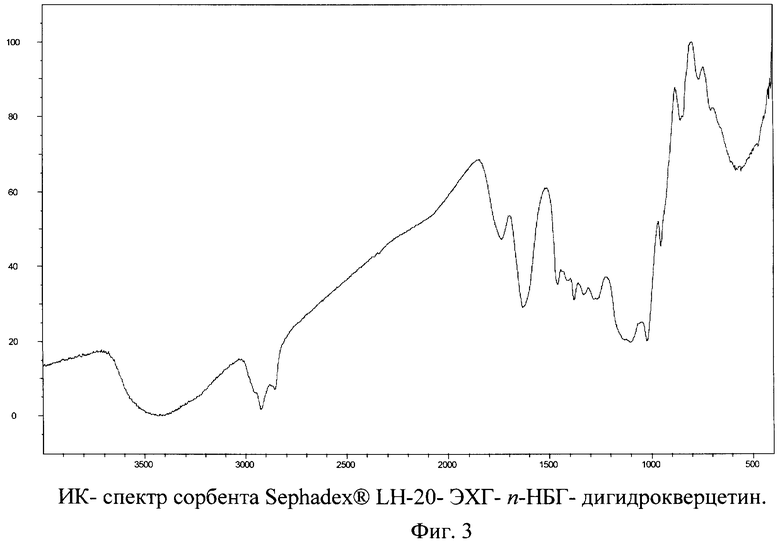
Полученный сорбент характеризуется следующей особенностью ИК-спектров, представленных на фигуре 3. Наличием полос поглощения слабой интенсивности при 953 см-1, а так же характерной полосы 1738 см-1. Исходная матрица - носитель (Сефадекс LH-20) обладает иным набором полос поглощения.
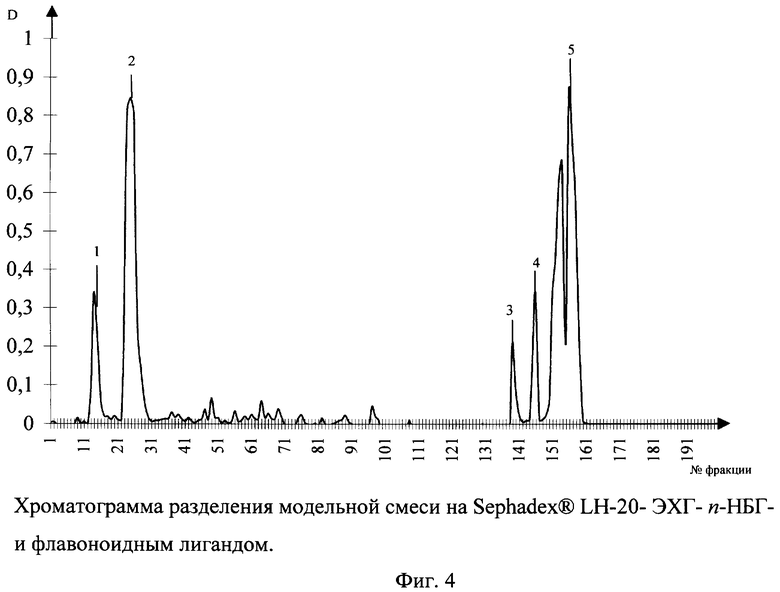
Хроматографические свойства полученного сорбента были проанализированы при разделении модельной смеси, состоящей из компонентов и условиях, указанных в примере 1. Порядок выхода веществ осуществлялся в следующем порядке: в режиме водной элюции 1) дексаметазон; 2) инозин; выход с колонки веществ, содержащих ароматический фрагмент; 3) фуросемид; 4) ортофен; 5) рутин осуществлялся только в режиме градиентного элюирования изопропиловым спиртом. Хроматограмма разделения представлена на фигуре 4.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАНОАЛМАЗНЫЙ СОРБЕНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2007 |
|
RU2352387C1 |
| СПОСОБ ОЧИСТКИ И ФРАКЦИОНИРОВАНИЯ ГУМИНОВЫХ КИСЛОТ И ГУМИНОПОДОБНЫХ ВЕЩЕСТВ | 2009 |
|
RU2413564C2 |
| СПОСОБ ИММОБИЛИЗАЦИИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ НА ПОВЕРХНОСТЬ ДЕТОНАЦИОННЫХ НАНОАЛМАЗОВ | 2013 |
|
RU2561592C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ПРИРОДНЫХ И РЕКОМБИНАНТНЫХ БЕЛКОВ И ДРУГИХ БИОЛОГИЧЕСКИХ СОЕДИНЕНИЙ | 2007 |
|
RU2366713C2 |
| СОРБЕНТ, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ НАНОАЛМАЗНЫЙ МАТЕРИАЛ (ВАРИАНТЫ), СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ. | 2013 |
|
RU2569510C2 |
| Способ удаления эндотоксинов из биологических жидкостей с помощью ковалентно иммобилизованного лизоцима в качестве лиганда | 2018 |
|
RU2684639C1 |
| Способ ковалентной иммобилизации лизоцима для последующего применения иммобилизованного лизоцима для снижения бактериальной обсемененности биологических жидкостей | 2018 |
|
RU2694883C1 |
| СУСПЕНЗИЯ АГРЕГАТОВ НАНОАЛМАЗОВ И ДИСПЕРСИЯ НАНОАЛМАЗОВ ОДНОЦИФРОВОГО НАНОРАЗМЕРА | 2015 |
|
RU2700528C2 |
| АКТИВИРОВАННАЯ МАТРИЦА ДЛЯ ИММОБИЛИЗАЦИИ БЕЛКОВ | 1981 |
|
SU1280834A1 |
| НАНОАЛМАЗЫ, ИМЕЮЩИЕ КИСЛОТНУЮ ФУНКЦИОНАЛЬНУЮ ГРУППУ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2696439C2 |
Изобретение относится к материалам, предназначенным для сорбции и хроматографического разделения. Наноалмазный сорбент содержит иммобилизованные на полисахаридной матрице наноалмазы детонационного синтеза, вставку и специфические лиганды. Сорбент получают обработкой отмытой сефарозы наноалмазным гидрозолем с последующим эпоксидированием, присоединением вставки и лиганда. Техническим результатом является создание полифункционального наноалмазного сорбента аффинного типа для использования в адсорбционной и распределительной хроматографии, в том числе и для низкомолекулярных молекул. 2 з.п. ф-лы, 4 ил., 2 пр.
1. Сорбент для хроматографии, содержащий сшитую полисахаридную матрицу с иммобилизованными на ней наноалмазами, полученными путем детонационного синтеза, отличающийся тем, что в качестве матрицы он содержит Sepharose CL 4В или Sephadex LH-20, при этом матрица, содержащая наноалмазы, эпоксидирована, и свободные эпоксигруппы блокированы введением вставки с присоединенным к ней лигандом.
2. Сорбент по п.1, отличающийся тем, что вставка выполнена на основе гидразида салициловой кислоты, при этом присоединенный лиганд представляет собой прокаин (новакаин).
3. Сорбент по п.1, отличающийся тем, что вставка выполнена на основе n-нитробензгидразида, при этом присоединенный лиганд представляет собой флаваноиды, например дигидрокверцитин.
| НАНОАЛМАЗНЫЙ СОРБЕНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2007 |
|
RU2352387C1 |
| КУЗНЕЦОВ П.В | |||
| и др | |||
| Полимерные адсорбенты аффинного типа в исследовании физиологически активных веществ, изучение качества лекарственного средства ФИБС на эпоксиазоадсорбентах нового поколения | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| КЛЯЩИЦКИЙ Б.А | |||
| Аффинная хроматография гликозидаз, Биоорганическая химия, том 6, | |||
Авторы
Даты
2012-05-27—Публикация
2009-12-21—Подача