Изобретение относится к области клеточной молекулярной биологии и касается веществ, обладающих способностью ингибировать активность р53 и индуцировать активность АР-1 ядерных факторов транскрипции.


Большое число различных факторов и сигнальных путей могут приводить к организованной гибели (апоптозу) про-раковой или опухолевой клетки в результате воздействия на нее хемопревентивных противоопухолевых препаратов. Один из наиболее важных сигнальных путей проходит через ядерный фактор транскрипции р53, который является регулятором клеточного роста, и принимает самое непосредственное участие в индукции ареста клеточного цикла и апоптоза в ответ на повреждение ДНК клетки [Levine A.J. Cell 1997, 88, 323; Prives C.; Hall, P.A. The Journal of Pathology 1999, 187, 112; Vousden K.H. Cell 2000, 103, 691]. Ядерный фактор р53 участвует в хемопревентивных эффектах многих природных канцер-превентивных соединений [Huang С.; Ма W.Y; Goranson A.; Dong Z. Carcinogenesis 1999, 20, 237; Qin J.; Chen H.-G.; Yan Q.; Deng, M.; Liu J.; Doerge S.; Ма W.; Dong Z.; Li, D.W. Cancer Res. 2008, 68, 4150; He Z.; Ma, W.-Y; Hashimoto Т.; Bode A.M.; Yang C.S.; Dong Z. Cancer Res. 2003, 63, 4396]. С другой стороны, некоторые хемопревентивные природные вещества, такие как джинджерол, куркумин, дженистеин, а также полипренилированные бензохиноны и гидрохиноны, оказывают канцер-превентивный эффект через ингибирование активности р53 ядерного фактора [Park Y.J.; Wen J.; Bang S.; Park S.W.; Song S.Y. Yonsei Med. J. 2006, 47, 688; Tsvetkov P.; Asher G.; Reiss V.; Shaul Y; Sachs L.; Lotem J. Proc. Natl. Acad. Sci. USA 2005, 102, 5535; Lian E; Li Y; Bhuiyan M.; Sarkar F.H. Nutr. Cancer 1999, 33, 125; Fedorov S.N.; Radchenko O.S.; Shubina L.K.; Balaneva N.N.; Bode A.M.; Stonik V.A.; Dong Z. Pharm. Res. 2006, 23, 70]. Известно, что недостаток активного р53 или его мутации происходят во многих видах опухолевых клеток человека. С этой точки зрения, тот факт, что раково-превентивный эффект некоторых хемопревентивных препаратов не зависит от р53 ядерного фактора, является очень интересным и важным. Ведь известно, что раково-превентивные вещества, действующие по механизму, не зависящему от р53, могут преодолевать устойчивость к лекарствам многих линий опухолевых клеток. К примеру, это было показано ранее при исследовании воздействия джинджерола на ВхРС-3 клетки рака поджелудочной железы человека, содержащие мутировавший р53 ядерный фактор [Park Y.J.; Wen J.; Bang S.; Park S.W; Song S.Y. Yonsei Med J. 2006, 47, 688].
АР-1 ядерный фактор транскрипции также регулирует множество клеточных процессов, включая пролиферацию, дифференциацию и апоптоз. В отличие от р53 ядерный фактор АР-1 сначала рассматривался исключительно как онкогенный [Dong Z.; Birrer M.J.; Watts R.G.; Matrisian L.M.; Colburn N.H. Proc. Natl. Acad. Sci. USA 1994, 91, 609; Dong Z.; Watts R.G.; Sun Y.; Colburn N.H. Int. J. Oncol. 1995, 7, 359; Dong Z.; Lavrovsky V.; Colburn, N.H. Carcinogenesis 1995, 16, 749; Young M.R.; Li J.J.; Rincon M.; Flavell R.A.; Sathyanarayana B.K.; Hunziker R.; Colburn N. Proc. Natl. Acad. Sci. USA 1999, 96, 9827]. Однако недавно было показано, что некоторые из белков, входящих в состав АР-1, такие как Jun-B и c-Fos, обладают способностью подавлять развитие опухолей как в опытах in vitro, так и in vivo [Chiu R.; Angel P; Karin M. Cell 1989, 59, 979; Passegue E.; Jochum W; Schorpp-Kistner, M.; Mohle-Steinlein U.; Wagner E.F. Cell 2001, 104, 21]. Активирование другого белка из состава АР-1, а именно c-Jun, является необходимым условием для индукции апоптоза в опухолевых клетках человека HL-60 и PC-12 [Le-Niculescu H.; Bonfoco, E.; Kasuya Y; Claret F.X.; Green D.R.; Karin M. Mol. Cel. Biol. 1999, 19, 751; Kondo Т.; Matsuda Т.; Kitano Т.; Takahashi A.; Tashima M.; Ishikura H.; Umehara H.; Domae N.; Uchiyama Т.; Okazaki T. J. Biol. Chem. 2000, 275, 7668]. Активирование АР-1 и NF-κВ ядерных факторов востребовано при апоптозе, индуцированном ДНК-повреждающими веществами, а также церамидами в Т-лимфоцитах и Jurkat Т клетках [Kasibhatla S.; Brunner Т.; Genestie L.; Echeverri F.; Mahboubi A.; Green D.R. Mol. Cell 1998, 1, 543; Manna S.K.; Sah N.K.; Aggarwal B.B. J. Biol. Chem. 2000, 275, 1329]. И, наконец, некоторые широко используемые в медицинской практике противоопухолевые лекарственные препараты, такие как винбластин и винкристин, механизм действия которых основан на ингибировании микротрубочек, также активируют АР-1 ядерный фактор в опухолевых клетках. Это активирование необходимо для эффективного апоптоза, индуцируемого этими лекарственными препаратами в клетках опухолей [Fan M.; Goodwin M.E.; Birrer M.J.; Chambers T.C. Cancer Res. 2001, 61, 4450; Zhu B.K.; Wang P.; Zhang X.D.; Jiang C.C.; Chen L.H.; Avery-Kiejda K.A.; Watts R.; Hersey P. Anticancer Drugs 2008, 19, 189].
В качестве противоопухолевых препаратов в последнее время все большее внимание привлекают морские природные соединения и их синтетические аналоги и производные, которые способны воздействовать на ядерные факторы транскрипции в клетках и вследствие этого вызывать апоптоз трансформированных и раковых клеток.
Впервые фаскаплизин (1) был выделен в 1988 году из морской губки Fascaplysinopsis Bergquist sp., собранной в южной части Тихого Океана близ островов Фиджи. Было показано, что этот красный пигмент является пентациклическим алкалоидом (1). Его структура, представляющая собой плоскую сопряженную систему, была установлена с помощью спектральных методов и рентгеноструктурного анализа [Hörmann A., Chaudhuri В., Fretz H. DNA binding of the marine sponge pigment fascaplysin. // Bioorg. Med. Chem. 2001. Vol.9. P.917; Roll D.M., Ireland C.M., Lu H.S. M., Clardy J. Fascaplysin, an unusual antimicrobial pigment from the marine sponge Fascaplysinopsis sp. // J. Org. Chem. 1988. Vol.53. P.3276-3278].
3-Бромофаскаплизин (2) впервые был выделен в 2003 году из асцидии Didemnum sp. [Segraves N.L., Lopez S., Johnson T.A., Said S.A., Fu X., Schmitz F.J., Pietraszkiewicz H., Valeriote F.A., Crews P. Structures and cytotoxicities of fascaplysin and related alkaloids from two marine phyla - Fascaplysinopsis sponges and Didemnum tunicates. // Tetrahedron Lett. 2003. Vol.44. P.3471-3475]. Подобные соединения, как оказалось позже, встречаются довольно часто среди метаболитов морских губок. Так, в 2004 году было сообщено о выделении 12 новых и 7 ранее известных алкалоидов фаскаплизинового типа.
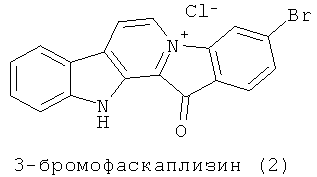
Алкалоиды фаскаплизинового типа обладают разносторонней биологической активностью и, в частности, привлекают внимание ученых своими противоопухолевыми свойствами. Лучше всего изучена биологическая активность фаскаплизина. Выяснилось, что он обладает очень широким спектром действия, включающим противобактериальную (против Staphylococcus aureus, Escherichia coli, Candida albicans, Saccharomyces cerevisiae и т.д.), противомалярийную, противогрибковую, противовирусную и противоопухолевую активности [Segraves N.L., Lopez S., Johnson T.A., Said S.A., Fu X., Schmitz F., Pietraszkiewicz H., Valeriote F.A., Crews P. Structures and cytotoxicities of fascaplysin and related alkaloids from two marine phyla - Fascaplysinopsis sponges and Didemnum tunicates. // Tetrahedron Lett. 2003. Vol.44. P.3471-3475]. Именно противоопухолевая активность и вызывает наибольший интерес. Так, фаскаплизин проявляет цитотоксические свойства против таких опухолевых клеток, как: MALME-3M (меланома, IC50 0,03 мкг/мл), МКФ 7 (рак молочной железы, IС50 0,14 мкг/мл), OVCAR-3 (рак яичников, IС50 0,16 мкг/мл), А549 (рак легких, IС50 0,38 мкг/мл), L-1210 (лейкемия, IC50 0.2 мкг/мл) [Charan R.D., McKee T.C., Gustafson K.R., Pannell L.K., Boyd M.R. Thorectandramine, a novel β-carboline alkaloid from the marine sponge Thorectandra sp. // Tetrahedron Lett. 2002. Vol.43. P.5201-5204].
Механизм действия фаскаплизина на процессы, происходящие в клетке, достаточно хорошо изучен. Было показано, что фаскаплизин является селективным ингибитором циклинзависимой киназы 4 (CDK 4), которая является ключевым ферментом в регуляции перехода между фазами Go и Gi в ходе клеточного цикла [Aubry С., Jenkins P.R., Mahale S., Chaudhuri В., Sutcliffe M.J. New fascaplysin-based CDK4-specific inhibitors: design, synthesis, and biological activity. // Chem. Commun. 2004. P.1696-1697]. Для успешного прохождения этой точки необходимо наличие особых факторов транскрипции, относимых к группе E2F. Их непрерывному синтезу препятствует белок ретинобластома (pRB). Именно циклинзависимая киназа 4 в комплексе с циклином D1 проводит фосфорилирование этого белка, что вызывает его дезактивацию и в свою очередь приводит к высвобождению факторов Е2F, прохождению точки G0/G1 и в дальнейшем ведет к клеточному делению. В нормальной клетке предусмотрена система регуляции активности CDK 4 природными ингибиторами этого фермента, такими как р16. При мутациях иногда возникает сбой в работе данной системы, клетка начинает бесконтрольно делиться, что приводит к возникновению злокачественной опухоли. Использование низкомолекулярных ингибиторов CDK4 существенно тормозит и даже останавливает рост опухоли. В этой связи фаскаплизин представляет огромный интерес как потенциальное лекарственное средство при лечении злокачественных новообразований.
Изучение действия фаскаплизина на асцитный вариант карциномы Эрлиха в условиях in vivo показало его малую активность против этой разновидности раковых опухолей [Попов A.M., Макарьева Т.Н., Федореев С.А., Стоник В.А. Противоопухолевая и цитостатическая активности низкомолекулярных метаболитов из морских тропических губок. // Химиотерапия опухолей в СССР. 1991. Т.56. С.61-66].
В настоящее время большое внимание уделяется аналогам фаскаплизина. Однако относительно их биологической активности известно гораздо меньше, чем о биологической активности фаскаплизина.
О биологической активности 3-бромофаскаплизина до сих пор было известно немногое. Сообщалось лишь, что наряду с другими производными фаскаплизина, 3-бромофаскаплизин был протестирован на цитотоксическую активность методом STS (Solid Tumor Selectivity). В этом исследовании он оказался менее активным, чем фаскаплизин. В экспериментах использовались мышиные опухолевые С38 клетки и опухолевые клетки человека H116 [Segraves N.L., Lopez S., Johnson T.A., Said S.A., Fu X., Schmitz F.J., Pietraszkiewicz H., Valeriote F.A., Crews P. Structures and cytotoxicities of fascaplysin and related alkaloids from two marine phyla - Fascaplysinopsis sponges and Didemnum tunicates. // Tetrahedron Lett. 2003. Vol.44. P.3471-3475]. О молекулярном механизме цитотоксического действия 3-бромофаскаплизина (2) в литературе сведений нет.
Опубликована также международная заявка, в которой описано получение, установление структуры и применение некоторых производных фаскаплизина в качестве терапевтических противоопухолевых средств [Chaudhuri В., Mahale S. G. Fascaplysin derivatives and their use in the treatment of cancer. PCT Int. App.; WO 2009/022104 A1]. Однако использование 3-бромфаскаплизина (2) в качестве средства, ингибирующего активность р53 и индуцирующего активность АР-1 ядерных факторов транскрипции, не описано.
Авторами в доступной патентной и другой научно-технической литературе не найдено указание на использование экстрактов, содержащих 3-бромофаскаплизин или индивидуального 3-бромофаскаплизина в качестве средства, ингибирующего активность р53 и индуцирующего активность АР-1 ядерных факторов транскрипции.
Задача изобретения - расширение спектра веществ, используемых в области клеточной молекулярной биологии в качестве инструментов исследования ядерных факторов транскрипции р53 и АР-1.
Задача решена применением 3-бромофаскаплизина (2) в качестве средства, ингибирующего активность р53 и индуцирующего активность АР-1 ядерных факторов транскрипции.
Новое назначение 3-бромофаскаплизина в качестве средства, обладающего способностью ингибировать активность р53 и индуцировать активность АР-1 ядерных факторов транскрипции, не вытекает с очевидностью из его известных свойств и обнаружено авторами впервые.
3-бромофаскаплизин (2), использованный для изучения его свойств по ингибированию активности р53 и индуцированию активности АР-1 ядерных факторов транскрипции, был получен нами синтетическим путем [Zhidkov M.E., Baranova O.V., Balaneva N.N., Fedorov S.N., Radchenko O.S., and Dubovitskii S.V. The first syntheses of 3-bromofascaplysin, 10-bromofascaplysin and 3,10-dibromofascaplysin-marine alkaloids from Fascaplysinopsis reticulata and Didemnum sp. by application of a simple and effective approach to the pyrido[1,2-a:3,4-b']diindole system. // Tetrahedron Lett. 2007. V.48. P.7998-8000]. Синтез 3-бромофаскаплизина (2) состоит из 4-х стадий и основан на формировании, исходя из соответствующим образом замещенных фенилуксусной кислоты и триптамина, пиридо[1,2-а:3,4-b']дииндольной системы, которая является скелетной основой алкалоида. Общий выход 3-бромофаскаплизина (2) составляет 43%.
Технический результат, обеспечиваемый изобретением, заключается в способности 3-бромофаскаплизина (2) ингибировать активность р53 и индуцировать активность АР-1 ядерных факторов транскрипции.
Изобретение расширяет спектр веществ, используемых в области клеточной молекулярной биологии в качестве инструментов исследования ядерных факторов транскрипции р53 и АР-1.
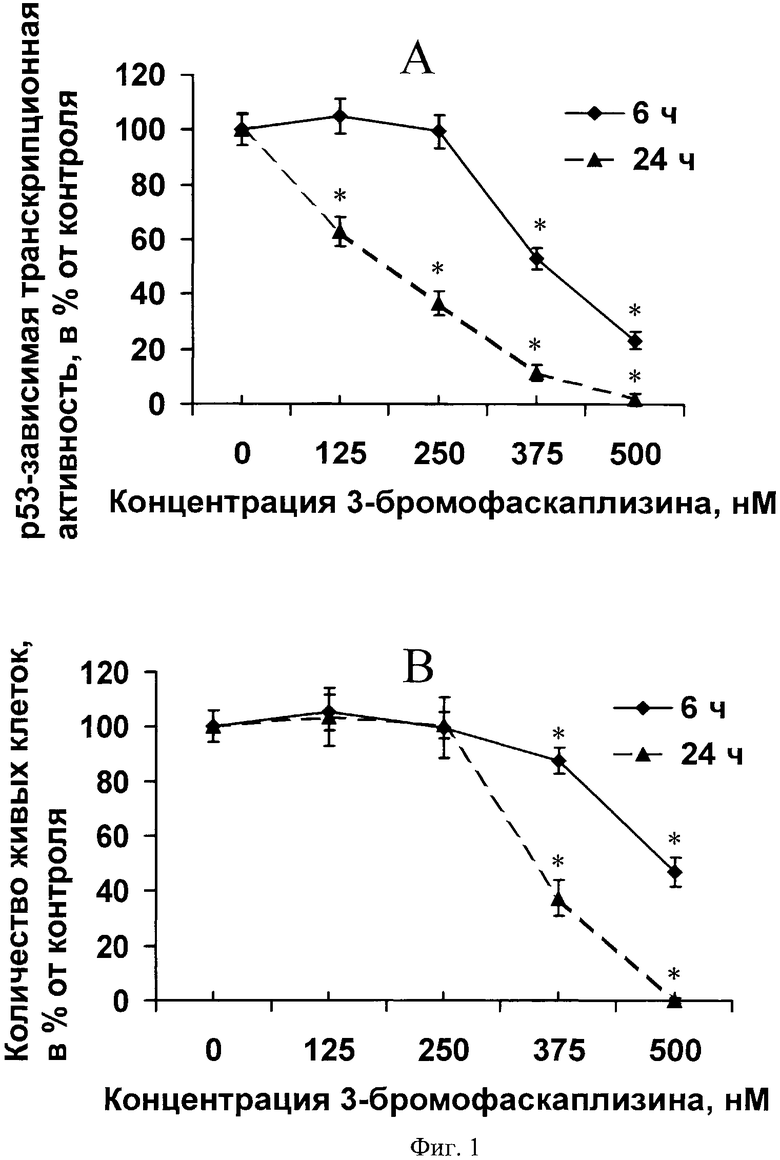
На фиг.1 представлено доз-зависимое и время-зависимое ингибирование 3-бромофаскаплизином (2) активности ядерного фактора транскрипции р53 (А) и жизнеспособности JB6 Сl41 р53 клеток (В).
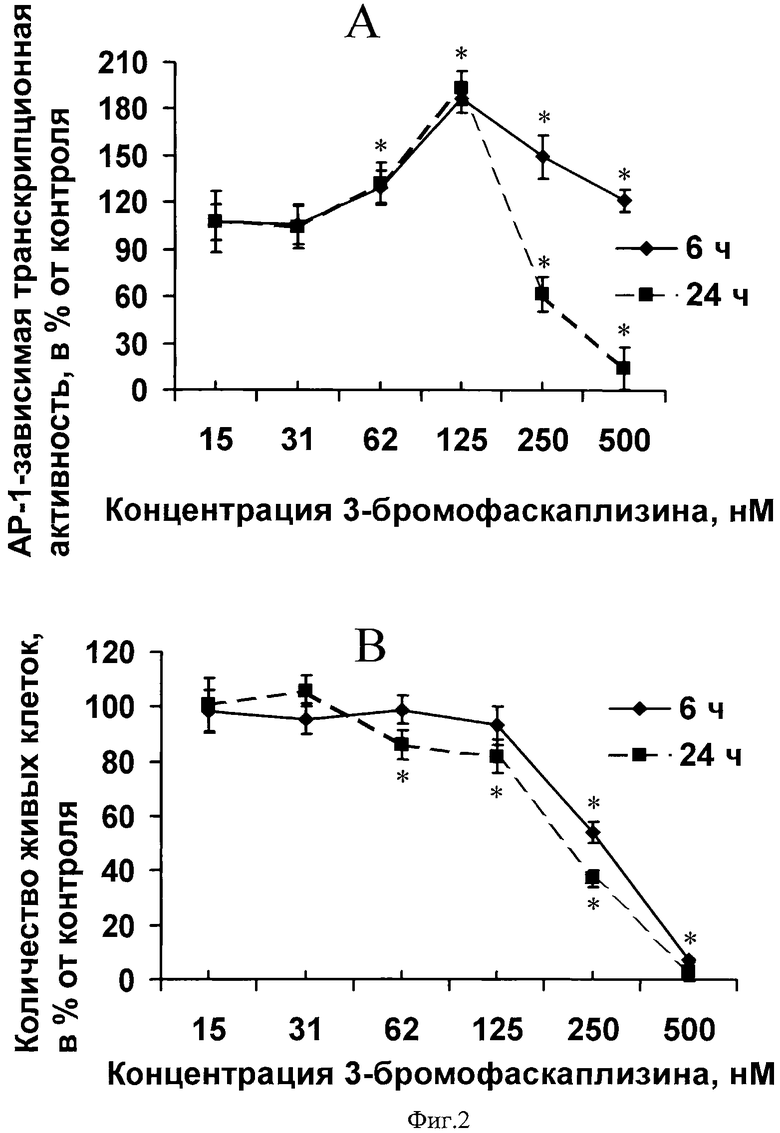
На фиг.2 представлено доз-зависимое и время-зависимое активирование 3-бромофаскаплизином (2) активности ядерного фактора транскрипции АР-1 (А) и ингибирование жизнеспособности JB6 Cl41 АР-1 клеток (В).
Исследование биологической активности 3-бромофаскаплизина (2)
I. Материалы и методы
1. Принятые сокращения
ДМСО - Диметилсульфоксид
ТФУ - Трифторуксусная кислота
АТФ - аденозинтрифосфат
ДТТ - дитиотреитол
EDTA - этилендиаминтетрауксусная кислота
СоА - коэнзим А
FBS - Fetal bovine serum (сыворотка бычьих эмбрионов)
HPLC - High performance liquid chromatography (высокоэффективная жидкостная хроматография)
IC50 - Inhibition concentration 50% (концентрация, вызывающая гибель 50% клеток)
PBS - Phosphate-buffered saline (фосфатно-солевой буфер)
нМ - нонамоль/литр
мкМ - микромоль/литр
мМ - миллимоль/литр
М - моль/литр
мкл - микролитр
мл - милилитр
SD - стандартное отклонение от среднего
PBS - фосфатно-солевой буферный раствор
MEM - питательная среда для культивирования клеток млекопитающих
МТТ - 3-(4,5-диметилтиазолил)-2,5-дифенилтетразолиум бромид (реагент для определения цитотоксичности)
MTS - 5-(3-карбоксиметоксифенил)-2-(4,5-диметилтиазолил)-3-(4-сульфлфенил) тетразолиум, внутренняя соль (реагент для определения цитотоксичности)
2. Клеточные культуры
Мышиные эпителиальные клетки JB6 P+ Cl41 и их стабильные трансфектанты JB6 Cl41 р53, JB6 Cl41 АР-1 выращивались в инкубаторе Sanyo MCO-15AC в монослое при 37°С и в атмосфере 5% СО2.
Для клеток линий JB6 P+ Cl41, JB6 Cl41 р53 и JB6 Cl41 АР-1 использовалась среда MEM, содержащая 5% FBS, 2 mM раствора L-глутамина и 15 мкг/мл гентамицина.
3. Приготовление растворов веществ
Базовый (стоковый) раствор 3-бромофаскаплизина (2) с концентрацией вещества 20 мМ готовили в ДМСО, из которого получали растворы нужной концентрации разбавлением в культуральной среде. Содержание ДМСО в разбавленных растворах не превышало 0,5% во всех опытах.
4. Определение цитотоксической активности MTS методом
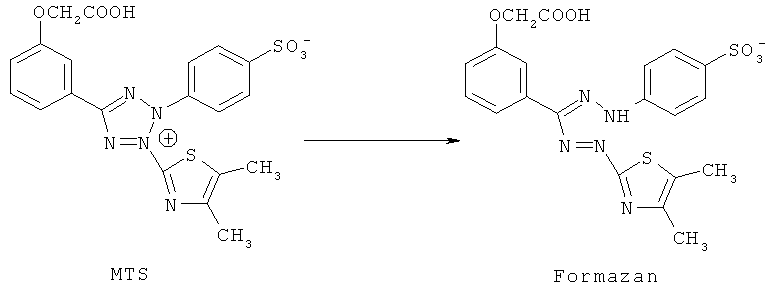
Для определения цитотоксической активности исследуемого вещества использовали стандартный MTS-метод (усовершенствованная модификация МТТ-метода) [Barltrop J.A., Owen T.C., Cory A.H., Cory J.G. 5-(3-Carboxymethoxyphenyl)-2-(4,5-dimethylthiazolyl)-3-(4-sulfophenyl) tetrazolium, inner sault (MTS) and related analogs of 3-(4,5-dimethylthiazolyl)-2,5-diphenyltetrazolium bromide (MTT) reducing to purple water-soluble formazans as cell-viability indicators. // Bioorg. Med. Chem. Lett. 1991. №11. P.611-614]. Метод основан на способности живых клеток перерабатывать MTS-реагент (желтая окраска, λmax 382 нм) в формазан (красная окраска, λmax=492 нм).
Схема переработки MTS-реагента живыми (метаболитически-активными) клетками в формазан.
Описание метода:
А. Приготовление планшета с клетками: Из бутыли, в которой выращивали клетки, с помощью пипетки Пастера удаляли клеточную среду, затем клетки промывали 5 мл PBS и добавляли 2 мл 0,25% раствора трипсина в PBS. Затем клетки с раствором трипсина инкубировали в течение 5 минут при 37°С в атмосфере 5% СО2, после этого осторожно перемешивали с помощью пипетки и к полученной суспензии клеток добавляли 8 мл соответствующей клеточной среды. Открепившиеся в процессе трипсинизации клетки переносили в пробирку и центрифугировали при 1000 об/мин в течение 10 мин. Далее с помощью пипетки Пастера удаляли супернатант и добавляли 5 мл соответствующей среды. После перемешивания считали концентрацию клеток в получившейся суспензии с помощью камеры Горяева.
Далее, путем смешивания необходимых объемов полученной суспензии клеток и соответствующей среды готовили клеточную суспензию с концентрацией - 6×104 кл/мл для загрузки в планшет.
Далее клетки высевали в 96-луночный планшет в лунки В1-H12, по 100 мкл клеточной суспензии на 1 лунку. Таким образом, количество клеток на 1 лунку в обоих случаях составляло 6000 клеток. В лунки A1-А12 добавляли соответствующую среду по 100 мкл.
Планшеты инкубировали при 37°С в атмосфере 5% СО2 в течение 1 суток.
Б. Приготовление растворов веществ: На аналитических весах брали навеску исследуемого вещества и растворяли ее в необходимом объеме ДМСО так, чтобы концентрация вещества в полученном растворе была 20 мМ. Далее приготавливали растворы вещества соответствующих концентраций в соответствующей питательной среде.
В. Загрузка веществ в планшет: Из всех лунок с помощью пипетки Пастера удаляли клеточную среду и в лунки С1-H12 помещали приготовленные ранее растворы с исследуемым веществом по 100 мкл в каждую лунку, по 3 лунки с одной и той же концентрацией вещества. В лунки В1-В12 и A1-А12 добавляли по 100 мкл соответствующей среды без вещества (эти лунки служат в качестве контрольных).
После этого планшеты инкубировали при 37°С в атмосфере 5% СO2 в течение 1 суток.
Г. Получение результатов: По завершении инкубирования в каждую лунку добавляли по 20 мкл MTS-реагента. Затем планшеты инкубировали при 37°С в атмосфере 5% СO2 еще в течение 2 часов. После чего оптическую плотность среды в каждой лунке регистрировали с помощью спектрофотометрического планшетного ридера при 492 нм (интенсивность поглощения, обусловленного наличием формазана) и 690 нм (результат использовали в качестве фонового показателя). Интенсивность окраски формазана при 492 нм прямо пропорциональна количеству оставшихся живых (метаболически-активных) клеток [Barltrop J.A., Owen Т.С., Cory А.Н., Cory J.G. 5-(3-Carboxymethoxyphenyl)-2-(4,5-dimethylthiazolyl)-3-(4-sulfophenyl) tetrazolium, inner sault (MTS) and related analogs of 3-(4,5-dimethylthiazolyl)-2,5-diphenyltetrazolium bromide (MTT) reducing to purple water-soluble formazans as cell-viability indicators. // Bioorg. Med. Chem. Lett. 1991. №11. P.611-614]. Для определения цитотоксической активности вещества использовали также соответствующие спектрофотометрические показатели контрольных лунок на планшете: лунок с нулевым контролем (А1-А12), в которые не высевали клетки и не добавляли вещества, но добавляли MTS-реагент, и лунок со 100%-ным контролем (B1-В12), в которые высевали клетки в том же количестве, что и в экспериментальные, не добавляли вещества, но также добавляли MTS-реагент.
Д. Обработка результатов: Для вычисления количества живых клеток, оставшихся в экспериментальных лунках:
1. Из значения интенсивности поглощения среды при 492 нм в каждой лунке вычитали значение интенсивности поглощения среды при 690 нм в соответствующей лунке.
2. Находили среднее значение полученных в пункте 1 результатов для лунок с нулевым контролем и вычитали его из значений, полученных в пункте 1 для всех остальных лунок.
3. Вычисляли среднее значение полученных в пункте 2 результатов для лунок со 100%-ным контролем, Iк.
4. Вычисляли количество живых клеток в каждой экспериментальной лунке (N), в процентах по сравнению с контрольными лунками, по формуле:
N=(IЭ/IК)×100%,
где IЭ - это интенсивность поголощения среды в каждой экспериментальной лунке, полученная в пункте 2;
IК - среднее значение полученных в пункте 3 результатов для лунок со 100%-ным контролем.
Для каждой клеточной линии было проведено два независимых эксперимента.
5. Определение р53- и АР-1-зависимой транскрипционной активности в JB6 Cl41 р53 и JB6 Сl41 АР-1 клетках
Способность 3-бромофаскаплизина оказывать эффект на р53- или АР-1-зависимую транскрипционную активность в JB6 Cl41 клетках оценивали с помощью люциферазного метода. JB6 Сl41 р53 или JB6 Сl41 АР-1 клетки (6×103) в виде суспензии в 100 мкл 5% FBS-MEM были добавлены в каждую лунку 96-луночного планшета. Планшеты инкубировали в течение 12 часов и затем обрабатывали различными концентрациями веществ, растворенных в 100 мкл свежей среды 5% FBS-MEM. После инкубирования с веществами в течение 24 часов удаляли среду из лунок и клетки экстрагировали в течение 1 часа при комнатной температуре с помощью 100 мкл/лунку лизисного буферного раствора (0,1 М калий-фосфатный буферный раствор с pH 7,8; 1% тритон Х-100; 1 мМ ДТТ; 2 мМ EDTA). Затем 30 мкл лизата из каждой лунки были перенесены в соответствующие лунки планшета для люминесцентного анализа, и люциферазную активность в них измеряли при добавлении в каждую лунку 100 мкл люциферинового буферного раствора (0,47 мМ D-люциферина; 20 мМ трицина; 1,07 мМ магний карбонат гидроксид пентагидрата (MgCO3)4×Mg(OH)2×5H2O; 2,67 мМ MgSO4×7Н2O; 33,3 мМ ДТТ; 0,53 мМ АТФ; 0,27 мМ СоА; 0,1 мМ EDTA (pH 7,8).
II. Результаты исследования биологической активности 3-бромофаскаплизина и их обсуждение
Цитотоксическая активность
Цитотоксическая активность 3-бромофаскаплизина (2) по отношению к JB6 P+ Cl41 р53 и JB6 Р+ Cl41 АР-1 нормальным клеткам мыши была изучена MTS-методом. Результаты представлены на фиг.1, В и фиг 2, В в виде количества живых клеток в зависимости от концентрации исследуемого вещества в среде, а также от времени инкубирования 3-бромофаскаплизина (2) с клетками по сравнению с контрольными, необработанными клетками.
Для каждого значения, отражающего процент живых клеток относительно контроля, указано стандартное отклонение от среднего. Астериск (*) указывает на результат, статистически достоверно отличающийся от контроля, p<0.05 (Манн-Уитни U-тест).
Необходимо отметить, что цитотоксическая активность 3-бромофаскаплизина (2) по отношению к JB6 Р+ Cl41 р53 и JB6 Р+ Сl41 АР-1 нормальным клеткам мыши ранее не изучалась и приводится впервые.
Влияние на транскрипционную активность ядерных факторов р53 и АР-1
Эффект, оказываемый 3-бромофаскаплизином (2) на р53- или АР-1 - зависимую транскрипционную активность, был изучен в JB6 Сl41 р53 или JB6 Сl41 АР-1 клетках со стабильно экспрессированным люциферазным репортерным геном, контролируемым р53- или АР-1 ДНК-связанной последовательностью.
Было показано, что 3-бромофаскаплизин (2) в активных концентрациях 250-500 нМ доз-зависимым и время-зависимым образом ингибировал базовую р53-зависимую транскрипционную активность (фиг.1, А). Данные на фиг.1, А представлены в виде р53-зависимой транскрипционой активности в процентах, в зависимости от конценрации 3-бромофаскаплизина и от времени по сравнению с контрольными, необработанными клетками. Каждая точка на графиках на фиг.1 представляет собой соответствующее значение ±SD, полученное в результате обработки шести образцов из двух независимых экспериментов. Исходя из данных, показанных на фиг.1, 90-95% JB6 Cl41 р53 клеток были живыми после 6 часовой обработки активными концентрациями 375-500 нМ 3-бромофаскаплизина (2). В данных условиях активность р53 в этих клетках была ингибирована до уровня 30-60% от контрольной. После 24-часовой обработки клеток даже сравнительно низкие концентрации 3-бромофаскаплизина (2) 125-250 нМ вызывали понижение активности р53 на 40-60% по сравнению с контролем (фиг.1, А). Это указывает на возможность использования 3-бромофаскаплизина (2) в качестве ингибитора активности р53 ядерного фактора транскрипции при исследованиях в области клеточной молекулярной биологии.
Было также показано, что 3-бромофаскаплизин (2) доз-зависимым и время-зависимым образом индуцировал базовую АР-1-зависимую транскрипционную активность (фиг.2, А). Данные на фиг.2, А представлены в виде АР-1-зависимой транскрипционой активности (А), в процентах, в зависимости от конценрации 3-бромофаскаплизина и от времени по сравнению с контрольными, необработанными клетками. Каждая точка на графиках на фиг.2 прдставляет собой соответствующее значение ±SD, полученное в результате обработки шести образцов из двух независимых экспериментов. Исходя из данных, показанных на фиг.2, после 6 часовой обработки JB6 Сl41 АР-1 клеток активными концентрациями 125-500 нМ 3-бромофаскаплизина (2) АР-1 активность увеличивалась в 1,5-2,3 раза по сравнению с контролем. После 24-часовой обработки клеток 125 нМ концентрация 3-бромофаскаплизина (2) также вызывала двукратное увеличение активности АР-1 по сравнению с контролем (фиг.2, А). Это указывает на возможность использования 3-бромофаскаплизина (2) в качестве индуктора активности АР-1 ядерного фактора транскрипции при исследованиях в области клеточной молекулярной биологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ПРЕДОТВРАЩАЮЩЕЕ ТРАНСФОРМАЦИЮ НОРМАЛЬНЫХ КЛЕТОК МЛЕКОПИТАЮЩИХ В ОПУХОЛЕВЫЕ | 2010 |
|
RU2429839C1 |
| СРЕДСТВО, ПРЕДОТВРАЩАЮЩЕЕ ТРАНСФОРМАЦИЮ НОРМАЛЬНЫХ КЛЕТОК МЛЕКОПИТАЮЩИХ В ОПУХОЛЕВЫЕ | 2010 |
|
RU2429840C1 |
| ГЛИКОЗИДНЫЕ ПРОИЗВОДНЫЕ 1,2-ДИТИОЛ-3-ТИОНА ИЛИ 1,2-ДИТИОЛ-3-ОНА И ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ИХ ОСНОВЕ | 2013 |
|
RU2534525C9 |
| ТЕРАПЕВТИЧЕСКИЕ ХИНОНЫ | 2005 |
|
RU2411229C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2414920C1 |
| Способ использования 4-((5,10-диметил-6-оксо-6,10-дигидро-5Н-пиримидо[5,4-b]тиено[3,2-e][1,4]диазепин-2-ил)амино)бензолсульфонамида (XMU-MP-1) для подавления роста клеток лимфомы Беркитта | 2023 |
|
RU2814013C1 |
| ИНГИБИТОР ПРОТЕИНКИНАЗЫ ТОРК С НАПРАВЛЕННЫМ ХЕМОПРЕВЕНТИВНЫМ ДЕЙСТВИЕМ IN VITRO | 2014 |
|
RU2566268C1 |
| СПОСОБ УВЕЛИЧЕНИЯ ПРОЛИФЕРАТИВНОЙ АКТИВНОСТИ КЛЕТОК МОРСКИХ БЕСПОЗВОНОЧНЫХ | 2002 |
|
RU2205873C1 |
| ЛИНИЯ КЛЕТОК PIGAS, СОДЕРЖАЩАЯ СТАБИЛЬНО ИНТЕГРИРОВАННЫЙ В ГЕНОМ САЙТ СВЯЗЫВАНИЯ ТРАНСКРИПЦИОННОГО ФАКТОРА STAT-1 | 2015 |
|
RU2619643C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ КЛЕТОК НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКИХ К ДЕЙСТВИЮ ПРЕПАРАТОВ, РЕАКТИВИРУЮЩИХ БЕЛОК р53 | 2012 |
|
RU2509808C1 |
Изобретение относится к области клеточной молекулярной биологии и представляет собой применение 3-бромофаскаплизина в качестве средства, ингибирующего активность р53 ядерного фактора транскрипции и индуцирующего активность АР-1 ядерного фактора транскрипции. Изобретение обеспечивает расширение арсенала средств, ингибирующих активность р53 ядерного фактора транскрипции и индуцирующих активность АР-1 ядерного фактора транскрипции. 2 ил.
Применение 3-бромофаскаплизина в качестве средства, ингибирующего активность р53 ядерного фактора транскрипции и индуцирующего активность АР-1 ядерного фактора транскрипции.
| Жидков М.Е | |||
| и др | |||
| Синтез бромофаскаплизинов-цитотоксических алкалоидов из морских беспозвоночных | |||
| Исследования в области физико-химической биологии и биотехнологии | |||
| Тезисы докладов II региональной научной конференции» | |||
| Владивосток ДВО РАН, 2006, с.47, 48 | |||
| US 2006211757 A1, 21.09.2006 | |||
| KR 20090017928 A, 19.02.2009 | |||
| ПРИМЕНЕНИЕ (R)-АРИЛПРОПИОНОВЫХ КИСЛОТ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЛЮДЕЙ И ЖИВОТНЫХ, НА КОТОРЫЕ МОЖНО ОКАЗЫВАТЬ ТЕРАПЕВТИЧЕСКОЕ ВОЗДЕЙСТВИЕ ПУТЕМ ИНГИБИРОВАНИЯ АКТИВАЦИИ NF-κВ | 2000 |
|
RU2250103C2 |
Авторы
Даты
2012-08-10—Публикация
2011-03-09—Подача