ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к большому одноразовому биореактору для культивирования клеток/тканей и, в частности, к большому биореактору для культивирования клеток растений.
УРОВЕНЬ ТЕХНИКИ
Культуры клеток и тканей обычно используют для коммерческого производства различных соединений, включая, например, гормоны, ферменты, белки, антигены, пищевые добавки и натуральные пестициды.
Технология, в настоящее время используемая для производства культур клеток и/или тканей в промышленном масштабе, основана на повторном использовании биореакторных систем из стекла или нержавеющей стали, которые требуют больших расходов на создание и техническое обслуживание. Такие биореакторные системы требуют очистки и дезинфекции после производства каждой партии и более интенсивной очистки при замене продукта из-за необходимости дорогостоящего и затратного по времени подтверждения чистоты и присутствия остатка чистящего агента после очистки.
Кроме того, эти типы промышленных биореакторных систем используют сложные и дорогостоящие технологии смешивания, например мешалками с дорогостоящими и сложными стерильными уплотнениями; некоторые дорогостоящие биореакторы содержат сложную эрлифтную конструкцию, предназначенную для перемешивания и насыщения газом среды посредством подачи газа в биореактор. Однако давление газа, размер пузырей и создание нежелательных сдвиговых сил в среде обуславливают необходимость применения сложных технологий аэрации. Кроме того, такие биореакторы разработаны по пиковому объему, который необходим в данное время. Таким образом возникают проблемы при переходе от пилотного биореактора к большому биореактору, или когда возникает необходимость увеличить объем производства до величины, превышающей вместимость существующих биореакторов. Текущая альтернатива большому биореактору заключается в объединении некоторого количества небольших модульных биореакторов из стекла или нержавеющей стали, совокупный объем которых соответствует требованиям, и при некоторой степени гибкости для увеличения или уменьшения совокупной вместимости. Однако использование нескольких небольших биореакторов увеличивает стоимость установки и время технического обслуживания, и таким образом использование нескольких небольших биореакторов требует больше расходов и трудозатрат, чем использование одного более вместительного биореактора. Из-за этих ограничений культивирование клеток растений в известных биореакторах приводит к относительно дорогостоящим извлекаемым продуктам, включая как вторичные метаболиты, так и рекомбинантные белки, которые не могут конкурировать в продаже с такими же продуктами, полученными с использованием альтернативных производственных систем.
В настоящее время единственным фармацевтическим веществом из рекомбинантного белка на основе культуры, производимым в биореакторах из клеток растений, является коммерческая противовирусная вакцина для использования ветеринарами при лечении атипичной чумы птиц. Кроме этой вакцины в настоящее время существуют только немного продуктов из вторичных метаболитов, производимых из культур клеток в биореакторах, например, растительные метаболиты паклитаксел (Таксол) и Шиконин.
В коммерческом масштабе в биореакторных системах традиционно используют камеры роста с постоянными или полупостоянными условиями. Хотя из уровня техники широко известны одноразовые камеры роста, их обычно используют для мелкомасштабного производства, например при домашнем пивоварении и при лабораторных экспериментах. В небольших биореакторах обычно используется одноразовый мешок, который может быть использован в лабораторных условиях.
Также были предложены одноразовые биореакторы, подходящие для использования при повышенных объемах. Требования к перемешиванию и аэрации питательной среды, которые становятся все более жесткими с увеличением объема реактора, решены различными способами в известных системах. Компании Applikon Biotechnology (Нидерланды) и Stedim Inc. (Франция) предлагают одноразовую биореакторную систему Appliflex®, в которой используются 50-литровые гибкие мешки для культур, которые рассчитаны на размещение на моторизованной платформе, которая покачивает мешок для обеспечения аэрации и перемешивания питательной среды. Сходный одноразовый биореактор предлагается компанией Wave Biotech, LLD (Сомерсет, штат Нью-Джерси, США), в котором используются мешки для культур объемом до 1000 л, которые также аэрируются и перемешиваются с помощью моторизованной платформы. Компания Ну-clone Inc. (Логан, штат Юта, США) в сотрудничестве с компанией Baxter Biosciences предлагает одноразовый мешок для культуры (одноразовый биореактор "SUB"), предназначенный для культуры животных клеток объемом до 250 л, который предназначен для модернизации биореакторных сосудов из нержавеющей стали. Аэрация и перемешивание обеспечиваются неодноразовым лопастным рабочим колесом, прикрепленным к сложному приводному устройству, введенному мешок с культурой. В патентной заявке США №2005/0272146 на имя Ходжа и др. (Hodge et al.) раскрыт одноразовый биореактор вместимостью 150 л, имеющий лопастное рабочее колесо или другое механическое средство для перемешивания. Еще один тип одноразового биореактора имеет U-образный мешок и устройство, подобное крану, для перемешивания и аэрации питательной среды посредством возвратно-поступательного подъема сторон. Еще одно техническое решение основано на находящемся под давлением обруча, окружающего гибкий мешок с культурой, который надувается и сдувается через регулярные интервалы времени, обеспечивая перемешивающее движение сжимающего типа.
Во всех вышеупомянутых системах системы опоры и аэрации/перемешивания сложные, дорогостоящие, узконаправленные и ограниченные по мощности. Так, хотя сам реакторный сосуд может быть одноразовым, использование этих систем требует дорогостоящей наладки и технического обслуживания.
Также были предложены одноразовые биореакторные устройства, в которых для перемешивания и аэрации культуры используется воздух, но проблема заключается в адаптации аэрации и перемешивания воздушными пузырями к большим объемам. Многие биореакторы меньшего объема обеспечивают достаточную аэрацию при одном входе для газа и рассекателе или другом типе диффузора для пузырей газа (см., например, биореактор «Зета» (Zeta), предлагаемый компанией Osmotec, Израиль (Agritech Israel, выпуск №1, Осень 1997 г., стр.19)). Одним недостатком таких систем является то, что аэрация осуществляется путем введения очень мелких пузырей воздуха (от диффузора), что приводит к повреждению клеток, особенно в случае культур клеток растений, которые особенно чувствительны к сдвиговым силам.
Белки для использования в фармацевтике традиционно производят в системах экспрессии животных клеток или бактерий. Однако из-за относительной простоты внедрения генов в растения и клетки растений для массового производства белков и пептидов с использованием, например, систем молекулярной биологии растений, таких как способ Agrobacterium, технология клеток растений становится все более популярной как альтернативная система экспрессии белков (Ма, J. K. С., Drake, P.M.W., and Christou, P. (2003) Nature reviews 4, 794-805).
Культура клеток растений отличается от культуры клеток бактерий или млекопитающих не только требованиями к метаболизму, но и как функция исключительной хрупкости в общем крупных клеток растений при сдвиговых силах, возникающих в традиционном промышленном биореакторе. Так, с одной стороны, важно обеспечивать адекватное перемешивание культур клеток растений, чтобы добиться достаточной аэрации всех аспектов культуры клеток растений, а с другой стороны, это необходимо делать с учетом хрупких клеток растений, выращенных на культуре.
Таким образом, существует постоянная потребность в усовершенствовании существующих систем и устройств для одноразовой культуры клеток/тканей, чтобы получить повышенный выход при улучшенном качестве продукта, а также повысить эффективность по стоимости. Настоящее изобретение предлагает одноразовый биореактор большого объема, но с функцией повторного использования, эффективный при использовании с различными клетками и культурами клеток для производства рекомбинантного белка, которое решает задачи, относящиеся к увеличению объема одноразового реактора.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно одному аспекту настоящего изобретения предложено одноразовое устройство для культивирования и сбора растительной ткани и/или клеток, которое содержит нежесткую емкость, имеющую объем по меньшей мере 400 л и снабженную каналами для газообмена и каналом для сбора, позволяющими использовать это устройство непрерывно в течение по меньшей мере двух последовательных циклов культивирования/сбора, причем устройство рассчитано и выполнено так, чтобы сохранять насыщение кислородом и сдвиговые силы, подходящие для культивирования растительной ткани и/или клеток.
Согласно другому аспекту настоящего изобретения предложен способ культивирования и сбора растительной ткани и/или растительных клеток в объеме больше 400 л, причем этот способ включает: (а) предоставление одноразовой нежесткой емкости, имеющей объем по меньшей мере 400 л и снабженной каналами для газообмена и каналом для сбора, позволяющими использовать упомянутое устройство непрерывно в течение по меньшей мере двух последовательных циклов культивирования/сбора, причем устройство рассчитано и выполнено так, чтобы сохранять насыщение кислородом и сдвиговые силы, подходящие для культивирования растительной ткани и/или клеток; (b) подачу инокулянта через упомянутый канал для сбора; (с) предоставление стерильной питательной среды и/или стерильных добавок; (d) по желанию, освещение упомянутой емкости наружным источником света и (е) выращивания упомянутых клеток и/или ткани в упомянутой среде до требуемого объема выхода. Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, насыщение кислородом и сдвиговые силы, подходящие для культивирования растительной ткани и/или клеток, поддерживаются сочетанием значений или диапазонов значений следующих параметров:
a) отношение высоты к объему;
b) давление газа на входе;
c) плотность газовых входов на площадь поперечного сечения;
d) скорость аэрации на входе и
e) объем пузырей газа на входе.
Согласно другому аспекту настоящего изобретения предложена система культивирования растительных клеток, включающая одноразовое устройство для культивирования и сбора растительной ткани и/или клеток и питательную среду для культивирования упомянутой растительной ткани и/или клеток.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, система, кроме того, включает суспензию растительных клеток или культуру ткани, выращиваемую на упомянутой среде.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, культура растительных клеток содержит растительные клетки, полученные из корня растения.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, растительные клетки выбирают из группы, состоящей из клеток корня, клеток сельдерея, клеток имбиря, клеток хрена и клеток моркови, трансформированных Agrobacterium rihzogenes.
Согласно другим признакам некоторых вариантов осуществления настоящего изобретения, растительными клетками являются клетки табака, более предпочтительно клетками Nicotiana tabaccum.
Согласно другим признакам некоторых вариантов осуществления настоящего изобретения, клетки табака экспрессируют человеческую рекомбинантную ацетилхолинэстеразу. Человеческой рекомбинантной ацетилхолинэстеразой может быть ацетилхолинэстераза-R. Ацетилхолинэстераза-R может иметь аминокислотную последовательность SEQ ID NO: 9.
Согласно другим признакам некоторых вариантов осуществления настоящего изобретения клетки табака содержат последовательность нуклеиновой кислоты SEQ ID NO: 9, кодирующую полипептид.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, значения или диапазон значений параметров выбирают по меньшей мере из одного из следующих значений или диапазонов значений:
a) отношение высоты к объему: приблизительно 0,06-1 см/л;
b) давление газа на входе: приблизительно 1-5 бар;
c) плотность газовых входов на площадь поперечного сечения: приблизительно 20-70 входов на кв. метр;
d) скорость аэрации на входе: приблизительно 0,05-0,12 объемов газа на объем среды в минуту;
e) объем пузырей газа на входе: приблизительно 20-1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, насыщение кислородом составляет по меньшей мере 15% объема на объем в жидкости, содержащейся в емкости.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, указанным сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и давление газа на входе приблизительно от 1 до 5 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и скорость аэрации на входе приблизительно от 0,05 до 0,12 объемов газа на объем среды в минуту.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л и объем пузырей газа на входе приблизительно от 20 куб. мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже сочетание кроме того имеет параметр объема пузырей газа на входе приблизительно от 20 куб. мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание, кроме того, имеет параметр давления газа на входе приблизительно от 1 до 5 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание, кроме того, имеет параметр плотности газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание, кроме того, имеет параметр скорости аэрации на входе приблизительно от 0,05 до 0,12 объемов газа на объем среды в минуту.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетание включает отношение высоты к объему приблизительно от 0,06 до 1 см/л, давление газа на входе приблизительно от 1 бар до 5 бар, плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м и объем пузырей газа на входе приблизительно от 20 мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, сочетанием является отношение высоты к объему приблизительно от 0,06 до 1 см/л, давление газа на входе приблизительно от 1 бар до 5 бар, плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв. м до 70 входов на кв. м, скорость аэрации на входе приблизительно от 0,05 до 0,12 объемов газа на объем среды в минуту и объем пузырей газа на входе приблизительно от 20 куб. мм до 1800 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, отношение высоты к объему составляет приблизительно от 0,1 см/л до 0,5 см/л.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже отношение высоты к объему составляет приблизительно 0,44 см/л.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, давление газа на входе составляет приблизительно от 1,5 бар до 4 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, давление газа на входе составляет приблизительно от 1,5 бар до 2,5 бар.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, плотность газовых входов на площадь поперечного сечения составляет приблизительно от 40 на 1 кв. м до 60 на 1 кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, плотность газовых входов на площадь поперечного сечения составляет 55 на 1 кв. м.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, расход газа при барботаже составляет приблизительно от 20 л/мин до 50 л/мин, более предпочтительно 30 л/мин.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, объем пузырей газа на входе составляет приблизительно 300 куб. мм.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, одноразовая емкость является прозрачной.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, емкость изготовлена из материала, выбираемого из группы, состоящей из полиэтилена, поликарбоната, сополимера полиэтилена и нейлона, ПВХ и ЭВА.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, емкость изготовлена из ламината, содержащего более одного слоя упомянутых материалов.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, устройство, кроме того, содержит опорную конструкцию для поддержки упомянутого устройства.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, опорная конструкция содержит жесткую цилиндрическую раму, имеющую коническое основание.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, канал сбора расположен на днище емкости.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, упомянутый канал сбора расположен рядом с днищем емкости так, что в конце каждого цикла сбора остатки среды, содержащей клетки и/или ткань, автоматически остается на днище емкости до уровня, ниже уровня устройства сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, упомянутое днище является в сущности коническим.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, упомянутое днище имеет форму усеченного конуса.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, емкость имеет внутренний наполняемый объем приблизительно от 400 л до 30000 л, предпочтительно от 500 л до 8000 л и наиболее предпочтительно около 1000 л.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, способ, кроме того, включает проверку на загрязняющие вещества и/или проверку качества клеток/тканей, которые произведены в упомянутой емкости.
Если найдены загрязнители, или если клетки/ткани имеют невысокое качество, устройство и его содержимое утилизируют; если загрязнители не найдены, осуществляют сбор части среды, содержащей клетки и/или ткань.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, при сборе упомянутой части в емкости оставляют остаток среды, содержащей клетки и/или ткань, причем упомянутый остаток среды служит в качестве инокулянта для следующего цикла культивирования/сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, способ, кроме того, включает: предоставление стерильной питательной среды и/или стерильных добавок для следующего цикла культивирования/сбора и повтор цикла выращивания до тех пор, пока не будут найдены загрязняющие вещества, или пока производимые клетки/ткани не будут иметь плохое качество, после чего устройство и его содержимое утилизируют.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, стерильный воздух подают через упомянутые каналы газообмена непрерывно в течение по меньшей мере одного цикла культивирования/сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, стерильный воздух подают через некоторое количество газовых входов импульсами в течение по меньшей мере одного цикла культивирования/сбора.
Согласно другим признакам предпочтительных вариантов осуществления изобретения, указанным ниже, устройство не имеет механических средств для перемешивания и аэрации питательной среды.
Настоящее изобретение успешно решает недостатки известных конфигураций путем обеспечения большого объема, одноразового биореактора, но с возможностью повторного использования, эффективного для работы с различными культурами клеток для производства рекомбинантного белка, а также предлагает способы и системы его использования.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Теперь изобретение будет описано только для примера со ссылками на прилагаемые чертежи. При конкретной ссылке на подробные чертежи подчеркивается, что приведенные данные показаны только для примера и для иллюстративного описания предпочтительных вариантов осуществления настоящего изобретения, и представлены таким образом, который считается наиболее полезным и легко понятным описанием принципов и концептуальных аспектов изобретения. В этой связи не делается попыток показать конструктивные детали изобретения более подробно, чем это необходимо для базового понимания изобретения, причем такое описание, взятое вместе с чертежами, делает понятным для специалистов в данной области, как несколько форм изобретения могут быть осуществлены на практике.
На чертежах:
на ФИГ.1 показаны основные компоненты иллюстративного варианта осуществления устройства настоящего изобретения в поперечном разрезе;
на ФИГ.2 показан вид спереди основных компонентов иллюстративного варианта осуществления устройства настоящего изобретения и иллюстративной опорной конструкции;
на ФИГ.3 показана гистограмма превосходного насыщения кислородом культур растительных клеток при использовании большого одноразового биореактора. Клетки моркови инокулировали в питательные среды в биореакторы разного объема: колбы Эрленмейера (синие колонки), 10-литровые реакторы (РХ-10, красные колонки); 100-литровые реакторы (РХ-100, белые колонки) и 400-литровые реакторы (РХ-400, оранжевые колонки) и культивировали в течение 3-4 суток при оптимальных условиях для каждой системы (см. раздел "Материалы и способы" ниже). Каждый реактор оснащен стерильным кремниевым чипом [(каталожный номер SFPST3YOPSUP (компания Presens Presision Sensing GmbH)] для определения насыщения O2 в указанные дни [O2 измеряли, используя Fibox 3 (компания Presens Presision Sensing GmbH)]. Отметьте, превосходные уровни насыщения O2 в больших (РХ-100 и РХ-400) биореакторах;
на ФИГ.4 показана фотография вестернблоттинга производства рекомбинантной GCD с использованием большого одноразового биореактора. По 5 мкл проб сырых экстрактов культур клеток на 4 или 7 день взяли из биореакторов разного объема, подготовили как сказано ниже (см. раздел "Материалы и способы"), разделили электрофорезом в ПААГ, нанесли на нитроцеллюлозную блоттинг-мембрану и подвергли реакции со специфическим поликлональным антителом кролика против GCD. Полосы визуализировали с помощью хемилюминисцентного субстрата SuperSignal West Pico. Дорожка 1 - 10-литровый реактор с барботированием; Дорожка 2 - 10-литровый реактор с проходным отверстием 8 мм; Дорожка 3 - 10-литровый реактор с 100% кислорода, добавленного с дня 4; Дорожки 4 и 5 - 400-литровый реактор, день 4; Дорожка 6 - 400-литровый реактор, день 7; Дорожки 7 и 8 - 100-литровый реактор, день 7; Дорожки 9 и 10 - prGCD стандарт 25 нг. Отметьте значительный выход GCD в большом одноразовом биореакторе по сравнению с 10- и 100-литровыми реакторами;
на ФИГ.5а-5b показаны результаты обращенно-фазной хроматографии (ОФХ), показывающие устранение Antifoam-C с использованием ионообменной хроматографии. 0,075% эмульсию Antifoam С (Dow Corning®, Корнинг, штат Нью-Йорк) загрузили в 15-мл катионообменную колонку (компания Bio Rad, США), и пробы протекающего, промывочного и солево-градиентного элюата (0,2 М NaCl; 1,2 М NaCl и 12% EtOH в 1,2 М NaCl) контролировали при 262 нм для детектирования Antifoam-C. На Фиг.5а показано детектирование Antifoam-C в растворе, загруженном в колонку. На Фиг.5b показано детектирование Antifoam-C при протекании через колонку. Отметьте отсутствие удерживания Antifoam-C в колонке;
на ФИГ.6 показаны результаты анализа в ДСН-ПААГ, показывающие идентичность GCD, произведенной в больших одноразовых биореакторах. Пробы GCD из 400-литровых реакторов (Дорожка 1,10 мкг), 80-литровых реакторов (дорожки 2 и 3, 10 мкг и 20 мкг соответственно), и коммерчески приготовленный глюкоцереброзидазы Cerezyme® (10 нг и 20 нг) (дорожки 4 и 5, 10 мкг и 20 мкг соответственно) разделили в геле ДСН-ПААГ. Полосы визуализировали путем окрашивания кумасси бриллиантовым голубым. Дорожка 6 представляет маркеры молекулярной массы. Отметьте электрофорезную идентичность GCD из больших биореакторов, малых биореакторов и препарата коммерческой глюкоцереброзидазы;
на ФИГ.7 показаны результаты вестерн-блоттинга, показывающие идентичность GCD, произведенной в больших одноразовых биореакторах. Пробы GCD из 400-литровых реакторов (Дорожки 1 и 2, 50 нг и 100 нг соответственно), 80-литровых реакторов (дорожки 3 и 4, 50 нг и 100 нг соответственно) и коммерчески приготовленной глюкоцереброзидазы Cerezyme® (дорожки 5 и 6, 50 нг и 100 нг соответственно) разделили в ДСН-ПААГ, нанесли на нитроцеллюлозную блоттинг-мембрану и провели реакцию со специфическим поликлональным антителом кролика против GCD. Полосы визуализировали с помощью хемилюминисцентного субстрата SuperSignal West Pico. Отметьте электрофорезную и иммунологическую идентичность GCD из больших реакторов, малых реакторов и коммерческого препарата глюкоцереброзидазы Cerezyme®);
на ФИГ.8a-8d приведены графики, показывающие пептидное картирование (триптический гидролизат) глюкоцереброзидазы, полученной в больших одноразовых биореакторах. Пробы глюкоцереброзидазы, собранные из малых одноразовых биореакторов (80-литровых) и больших одноразовых биореакторов (400-литровых), гидролизовали с протеазой, отделяли в колонке Jupiter 4u Proteo 90A для ОФХ (Phenomenex, 00G-4396-E0) для получения "пептидной карты", и фрагменты контролировали при 214 нм и 280 нм. На Фиг.8а и 8b приведены профили глюкоцереброзидазы, полученной в 10-литровых биореакторах (8а, детектирование при 214 нм; 8b, детектирование при 280 нм). На Фиг.8c и 8d приведены профили глюкоцереброзидазы, полученной в 400-литровых биореакторах (Фиг.8c - детектирование при 214 нм, Фиг 8d - детектирование при 280 нм). Отметьте идентичность продукта, полученного в больших и малых биореакторах;
на Фиг.9а-9b приведены графики, показывающие результаты ОФХ-анализа глюкоцереброзидазы, полученной в больших одноразовых биореакторах. Глюкоцереброзидазу, собранную из больших одноразовых биореакторов (400-литровых), очищали, как сказано ниже, анализировали в колонке С-4 ОФХ и контролировали при 214 нм (Фиг.9а) и 280 нм (Фиг.9b). Отметьте, что prGCD проявляется как одиночный пик с временем выдержки 64,12 минуты, подобно пику стандартной prGCD (64,70 минуты);
на ФИГ.10 приведена фотография геля для ИЭФ, показывающая превосходную чистоту prGCD, полученной в большом одноразовом биореакторе. Пробы prGCD, полученные в большом одноразовом биореакторе (400-литровом) и очищенные в 5-колонном процессе очистки, описанном ниже, разделяли в геле для изоэлектрического фокусирования вместе с prGCD из малого одноразового биореактора (10-литрового). Дорожка 2 - большой биореактор, 3-я ступень очистки; Дорожка 3 - большой биореактор, 4-я ступень очистки; Дорожка 4 - большой биореактор, 5-я ступень очистки; Дорожка 5 - малый биореактор; Дорожки 1 и 6, стандарты для изоэлектрических точек при ИЭФ. Отметьте идентичность и высокий уровень чистоты prGCD из большого одноразового биореактора на всех ступенях очистки;
на ФИГ.11 приведены анализы вестерн-блоттинга, показывающие чистоту prGCD, полученной в большом одноразовом биореакторе. Пробы GCD из 400-литровых реакторов (дорожки 1 и 2, 50 нг и 100 нг соответственно), 80-литровых реакторов (дорожки 3 и 4, 50 нг и 100 нг соответственно), коммерчески приготовленной глюкоцереброзидазы Cerezyme (дорожки 5 и 6, 50 нг и 100 нг соответственно) и хост-белки моркови (CHP) (дорожки 7 и 8, 50 нг и 100 нг соответственно) разделяли на ДСН-ПААГ, блотировали и проводили реакцию со специфическим поликлональным антителом против СНР. Полосы визуализировали с использованием хемилюминисцентного субстрата SuperSignal West Pico. Отметьте отсутствие примесей в большом одноразовом биореакторе, как и во всех остальных препаратах prGCD;
на ФИГ.12 приведена фотография донного конца иллюстративного одноразового биореактора настоящего изобретения, показывающая многочисленные газовые входы для аэрации и перемешивания питательной среды и иллюстративную жесткую коническую опорную конструкцию;
на ФИГ.13 приведена фотография батареи иллюстративных больших одноразовых биореакторов настоящего изобретения;
на ФИГ.14 приведена фотография иллюстративного биореактора настоящего изобретения, показывающая повторно используемый канал сбора;
на ФИГ.15 приведена фотография вестерн-блоттинга, показывающая иммунодетектирование рекомбинантной человеческой рекомбинантной ацетилхолинэстеразы (AChE), экспрессированной в растении. 50 (дорожки 3 и 7), 100 (дорожки 2 и 6) и 200 нг (дорожки 1 и 5) рекомбинантной человеческой AChE-R, полученной в большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения (дорожки 1-3) и коммерчески доступной рекомбинантной человеческой AChE-S (дорожки 4-6) были детектированы с использованием аффинно-очищенного козьего поликлонального антитела против пептида на N-конце AChE человеческого происхождения (компания Santa-Cruz Biotechnology, Санта-Круз, штат Калифорния) (идентично в AChE-R и AChE-S). Дорожка 4 является стандартами молекулярной массы. Сильное связывание антитела очевидно во всех пробах;
на ФИГ.16 приведена фотография окрашивания неспецифического белка Flamingo™ с помощью ДСН-ПААГ геля в человеческой рекомбинантной AChE-R, экспрессированной в растении, которая была получена в большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения, по сравнению с профилем коммерчески доступной AChE-S. Экспрессированная в растении AChE-R (дорожки 1-3) и произведенная из клеток млекопитающего AChE-S (дорожки 5-7) были разделены, как показано на Фиг.13, и окрашены реагентами Flamingo™. Отметьте, что профиль миграции AChE-R соответствует профилю миграции AChE-R, детектированному иммунологическим анализом с использованием антител против AChE (Фиг.13, выше). Кроме того, одиночная полоса на геле, показанная на Фиг.13, указывает на эффективность очистки;
на ФИГ.17 показаны результаты анализа по Карновски с окрашиванием гелем для детектирования каталитической активности ацетилхолинэстеразы в растительных клетках, культивированных в большом одноразовом биореакторе. Каталитически активная ацетилхолинэстераза-R была очищена от клеток BY-2, собранных из посеянных партий клеток, культивированных в 400-литровом большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения. Убывающие количества белка из клеток (дорожки 1 и 4=200 нг; дорожки 2 и 5=100 нг, дорожки 3 и 6=50 нг) были разделены на 10% нативном полиакриламидном геле в неденатурирующих условиях, промыты и обработаны для выявления каталитической активности ацетилхолина (окрашивание по Карновски). Соответствующие количества ацетилхолина-S (дорожки 4-6) были включены в качестве контрольных. Электрофорез AChE-R и AChE-S выполняли в 10% нативном полиакриламидном геле в неденатурирующих условиях. Гели были проведены при 4°С, промыты 3 раза водой и инкубированы в течение 1 часа при перемешивании в буферном растворе, содержащем ацетилтиохолин (0,5 мг/мл; Sigma), ацетате натрия (65 мМ, рН 6,0; Sigma), цитрате натрия (5 мМ; Sigma), сульфате меди (3 мМ; Sigma) и феррицианиде калия (0,5 мМ; Riedel De Haen). Каталитическую активность детектировали визуально. Верхняя стрелка указывает миграцию тетрамера AChE-S. Нижняя стрелка указывает миграцию мономерной AChE.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к одноразовому устройству с возможностью повторного использования для культивирования растительных тканей или клеток. В частности, устройство настоящего изобретения включает нежесткую емкость, имеющую некоторые размеры и каналы газообмена, предназначенные для поддержания концентрации растворенного кислорода и сдвиговых сил, подходящих для культивирования растительных тканей или клеток в объеме 400 л или больше питательной среды. Такое устройство может быть использовано для культивирования трансформированных растительных клеток с целью производства рекомбинантных, полученных из растений, биологически активных материалов (например, фармацевтических средств) из клеток и/или питательной среды. Также предложена система культивирования растительных клеток с использованием устройства настоящего изобретения.
Принципы и работу настоящего изобретения можно лучше понять со ссылками на чертежи и описания.
Перед объяснением по меньшей мере одного варианта осуществления в деталях необходимо понять, что изобретение не ограничено в его применении подробностями, изложенными в последующем описании или Примерах. Изобретение может иметь другие варианты осуществления и может быть осуществлено на практике разными способами. Кроме того, необходимо понимать, что используемые в настоящем описании фразеология и терминология предназначены только для описания и не должны рассматриваться как ограничительные.
Как сказано выше, увеличение объемов одноразовых биореакторов требует уникальных решений проблем аэрации и перемешивания. В некоторых известных биореакторах для этой цели используется газ. В патентной заявке США №2005/0282269, поданной Проулксом и др. (Proulx et al.) раскрыт одноразовый биореактор, имеющий многочисленные газовые входы с встроенными диффузорами и фильтрами на входных каналах в нижней части емкости для обеспечения аэрации и перемешивания. Такая конфигурация имеет ограничения в том, что фильтры, находящиеся в контакте с жидкой средой, проявляют тенденцию к забиванию и не обеспечивают требуемой подачи газа. Не раскрыты ни объем, ни размеры биореактора. Еще один тип одноразового биореактора с использованием газа для аэрации и перемешивания предложен компанией Cellexus Biosystems, PCC (Кембридж, Англия). Этот биореактор представляет собой гибкий мешок, имеющий неразъемную трубку барботера, прикрепленную вдоль внутреннего нижнего конца устройства и предназначенную для подачи воздуха или газа для аэрации и перемешивания. Биореакторные мешки Cellexus отличаются уникальной асимметричной геометрией, в которой большинство объема жидкости в мешке концентрируется в верхней половине биореактора. Эта конструкция требует специально разработанного опорного кожуха (Cellmaker Lite™) для работы.
В патенте США №6432698, выданном Гоглеру и др. (Gaugler et al.) раскрыт гибкий одноразовый мешок для культивирования нематод. Этот мешок снабжен газовым входом и диффузором в форме трубки для аэрации и перемешивания питательной среды. Предусмотрены объемы до 200 л, хотя практическое осуществление не предложено. Конкретные размеры не раскрыты.
В патентной заявке США №2005/0272146, поданной Хеджем и др. (Hodge et al.) раскрыт 150-литровый одноразовый биореактор, имеющий интегрированные в него лопасти крыльчатки для перемешивания. Перемешивание питательной среды в биореакторах крыльчаткой, как известно, создает сдвиговые силы, неподходящие для культивирования растительных клеток.
В патенте США №6391683, выданном Шаалтиэлю и др. (Shaaltiel et al.) (который включен в настоящий документ путем ссылки в полном объеме), раскрыты одноразовые устройства для культивирования, содержащие нежесткие мешки, имеющие газовые входные и выходные каналы, причем устройства могут быть использованы как одноразово, так и для нескольких циклов культивирования и сбора. В устройстве используется воздух под давлением с тщательно регулируемыми объемом и количеством пузырей для перемешивания и аэрации культуры. Эффективная культура трансформированных растительных клеток точно экспрессирует различные гетерологичные рекомбинантные белки (млекопитающих и не млекопитающих) с использованием биореакторов, описанных Шаалтиэлем (см. патент США №6391683, патентную заявку США №10/784295; Международные патентные заявки РСТ WO2004/091475, WO2005/080544 и WO 2006/040761, которые все включены в настоящий документ путем ссылки в полном объеме). Однако Шаалтиэль и др. в патенте 6691683 раскрывает конструкцию, подходящую для малых и средних объемов, ограничивая выход синтезируемых в них рекомбинантных белков.
При осуществлении настоящего изобретения на практике его авторы разработали большой одноразовый биореактор с возможностью повторного использования, выполненный из прозрачных нежестких материалов. Биореактор имеет каналы для отбора проб, позволяющие использовать его в течение по меньшей мере двух последовательных циклов культивирования, конкретные размеры и каналы газообмена, подающие газ в количестве, достаточном для перемешивания и аэрации культуры клеток в биореакторе при подходящей концентрации растворенного кислорода и подходящими сдвиговыми силами для эффективного выращивания растительных клеток в объемах, превышающих 400 л.
Так, согласно одному аспекту настоящего изобретения предложено одноразовое устройство для культивирования и сбора растительных тканей и/или клеток.
Устройство настоящего изобретения включает нежесткую емкость, имеющую объем не меньше 400 л и снабженную каналами газообмена и каналом сбора, позволяющими непрерывно использовать устройство в течение по меньшей мере двух последовательных циклов культивирования/сбора.
Хотя данное устройство можно использовать для культивирования любого типа клеток или ткани, оно предназначено для эффективного крупномасштабного культивирования растительных клеток и тканей.
Насыщение среды кислородом имеет особо важное значение для эффективного роста клеток и экспрессии рекомбинантных белков, и поэтому критично для надлежащей работы биореакторов и их использования в производстве рекомбинантных клеток. Насыщение кислородом биореакторов для выращивания культур растительных клеток еще более важно, поскольку растительные клетки более восприимчивы к колебаниям в насыщении кислородом, чем бактерии или клетки млекопитающих (см. Шлатманн и др. (Schlatmann et al), Biotech. Bioeng., 1995; 45:435-39). Кроме того, растительные клетки восприимчивы к гидродинамической атмосфере в известных биореакторах, вероятнее всего из-за более крупных размеров растительных клеток, экстенсивной вакуализации и аггрегации. Таким образом, хотя аэрация питательной среды путем подачи пузырей газа в емкость также обеспечивает перемешивание, можно избежать возникновения сдвиговых сил, неблагоприятных для хрупких растительных клеток. Доказано, что растительные клетки на культуре восприимчивы к сублетальным сдвиговым силам, реагируя на них характеристической "сублитической" реакцией, которая в свою очередь значительно ограничивает эффективность биореакторов (Намдев и Дулоп (Namdev and Dulop), App. Biochem и Biotech, Part A, Frontiers in Bioprocessing, 1995).
Устройство настоящего изобретения поддерживает насыщение кислородом и сдвиговые силы, подходящие для культивирования растительных тканей и/или клеток в объемах от 400 л и больше, путем применения параметров или сочетания параметров, критичных для определения насыщения кислородом и сдвиговых сил в культуре.
Насыщение кислородом и сдвиговые силы, подходящие для культивирования растительных тканей и/или клеток в устройстве, поддерживаются сочетанием значений или диапазонов значений: а) отношения высоты к объему; b) давлением газа на входе; с) плотностью газовых входов на площадь поперечного сечения; d) скоростью аэрации на входе и е) объемом пузырей газа на входе.
Отношение высоты к объему.
Способы механического перемешивания не подходят для биореакторов растительных клеток, особенно при обработке больших объемов среды. Аэрация и перемешивание питательной среды в большом биореакторе могут быть осуществлены путем движения пузырей газа через среду. Чем более широким будет контакт пузыря газа со средой, тем больше будет потенциал для газообмена, и тем более эффективным будет перемешивающее действие газа в среде. Так, хотя отношение высоты к объему у меньших биореакторов может позволять повышенную гибкость, отношение высоты к объему у биореакторных устройств с большими объемами (400 л и больше) должно поддерживаться в диапазоне приблизительно от 0,06 до 1 см/л. Отношение высоты к объему можно вычислить по высоте (длине) емкости устройства и средней площади поперечного сечения устройства. Используемый здесь термин "объем устройства" означает высоту, умноженную на площадь поперечного сечения. Например, для биореактора с высотой (длиной) 200 см и объемом 400 л (имеющего, например, средний радиус приблизительно 25 см) отношение высоты к объему составляет 200/400 или 0,5; для биореактора, имеющего высоту 300 см и объем 3000 л, отношение высоты к объему составляет 300/3000 или 0,1. Примеры диапазонов отношений высоты к объему, подходящих для биореактора настоящего изобретения, составляют приблизительно 0,06-1 см/л, предпочтительно приблизительно 0,1-0,5, наиболее предпочтительно приблизительно 0,44 см/л.
Кроме того, понимается, что отношение высоты к объему может быть вычислено с использованием или общего потенциально наполняемого внутреннего объема емкости или с использованием определенной его части, которая является рабочим, функционально наполняемом внутренним объемом емкости без свободного пространства, обычно находящегося выше уровня жидкости в биореакторе.
Давление газа на входе.
Чтобы подавать достаточно газа (например, воздуха или кислорода) для перемешивания и аэрации питательной среды в большом биореакторе, давление газа на входе (или входах) должно быть достаточным для преодоления направленной вниз силы колонны жидкости в биореакторе, и в то же время необходимо избегать сдвиговых сил, связанных с созданием чрезмерно большого количества пузырей или создания пузырей размера, неподходящего для культивирования растительных клеток. Большие биореакторы настоящего изобретения, имеющие отношение высоты к объему, подходящее для культивирования растительных клеток, требуют повышенного давления газа на входе по сравнению с меньшими биореакторами. Давление газа выражается в барах, и 1 бар равен 100000 паскалей (Па) или 1000000 дин/см2. Манометры давления для контроля и регуляторы давления для управления давлением газа на входах хорошо известны в данной области техники и доступны в широкой продаже. Примерами диапазонов давления газа, подходящих для биореактора настоящего изобретения, являются приблизительно 1,5 бар - 4 бар, более предпочтительно приблизительно 1,5 бар - 2,5 бар.
Плотность газовых входов на площадь поперечного сечения.
Биореакторы небольшого объема обычно имеют один или несколько газовых входов для подачи требуемого объема газа для перемешивания и аэрации питательной среды в сосуд биореактора. С другой стороны, биореакторы большого объема, такие как устройства настоящего изобретения, требуют большей плотности газовых входов для того, чтобы преодолевать сживающие силы колонны питательной среды в устройстве и достигать диапазонов давления газа, требуемых для перемешивания и аэрации, подходящих для использования при культивировании растительных клеток. Чтобы обеспечить управление давлением газа на входах и поддержание оптимального размера пузырей для перемешивания и аэрации питательной среды в большом объеме биореактора, необходимо наличие некоторого количества газовых входов, расположенных с заданной плотностью на одноразовой нежесткой емкости устройства. Плотность газовых входов выражается как количество входов на кв. м наружной поверхности емкости устройства. Примерами диапазонов плотности газовых входов, подходящих для использования в биореакторе настоящего изобретения, являются приблизительно от 20 входов на кв. м поверхности емкости до 70 входов на кв. м. Предпочтительно, плотность газовых входов на площадь поперечного сечения составляет 40-60 входов на кв. м, более предпочтительно 55 входов на кв. м.
Скорость аэрации на входе.
И повышенная аэрация в общем (т.е. наличие более быстрого газообмена), и повышенное насыщение кислородом, в частности, увеличивают скорость роста клеток на культуре. Биореакторы меньшего объема для культивирования растительных клеток обычно подают воздух для аэрации с расходом 0,15-0,3 о/о/мин (объем воздуха/объем среды/минута) на газовом входе с увеличением скорости аэрации при увеличении объема. Однако эффективность пузырей газа для содействия циркуляции клеток в меньших замкнутых объемах отличается от таковой в больших эквивалентных объемах, так как непропорциональная скорость аэрации требуется для содействия циркуляции воздуха и распределению кислорода в большом объеме по сравнению с эквивалентным объемом образованным некоторым количеством меньших объемов при том же объеме питательной среды.
При осуществлении настоящего изобретения на практике авторы неожиданно обнаружили, что пропорциональное увеличение скорости аэрации (о/о/мин) при увеличении объема дает улучшенные результаты в уменьшении скорости аэрации (о/о/мин) в больших биореакторах. Примерами диапазонов скоростей аэрации на газовых входах, подходящих для культивирования растительных клеток в большом биореакторе, составляют приблизительно 0,05-0,12 о/о/мин и предпочтительно от 0,07 о/о/мин до 0,1 о/о/мин. Преимущество таких пониженных скоростей аэрации заключается в повышенном выходе из больших биореакторов, а также в повышении эффективности использования электроэнергии, что имеет большое значение при промышленном культивировании.
Объем пузырей газа на входе.
Важность подходящих перемешивающих устройств для больших биореакторов нельзя переоценить. В некоторых случаях, особенно в отношении растительных клеток, размер пузырей газа имеет большое значение для эффективного культивирования и выращивания клеток в биореакторе. Небольшие пузыри могут повреждать растительные клетки, и средний размер пузыря не меньше 20 куб. мм в сущности решает эту потенциальную проблему. Так, вместе с давлением газа и количеством входов, управление объемом пузырей газа на входе важно для достижения перемешивания и аэрации питательной среды, эффективных для роста растительных клеток. Хотя размер пузырей на газовом входе будет изменяться в зависимости от использования устройства, примерами подходящих диапазонов объемов пузырей газа на входе являются от 20 до более 1800 куб. мм, предпочтительно приблизительно от 40 куб. мм до 1000 куб. мм, более предпочтительно приблизительно от 100 куб. мм до 500 куб. мм, наиболее предпочтительно приблизительно 300 куб. мм. В тех случаях, когда необходимы пузыри меньшего объема, можно использовать барботер на газовом входе для уменьшения размера пузырей, но не ниже подходящего размера для больших биореакторов.
Поэтому одноразовый биореактор настоящего изобретения имеет ряд преимуществ над известными устройствами, включая без ограничения обеспечение условий больших объемов культивирования при поддержании превосходных аэрации и немеханического перемешивания культуры растительных клеток и среды в соответствии с указанными здесь параметрами, чем достигается превосходный выход и чистота культивированных клеток и продуктов, получаемых из клеток.
На Фиг.1 показан вариант осуществления устройства настоящего изобретения, которое именуется ниже "устройство 10".
Как показано на Фиг.1, устройство 10 включает емкость 12, которая используется для культивирования и сбора растительных тканей и/или клеток. На Фиг.1 емкость 12 показана частично наполненной жидкостью и поэтому находится в надутом (и относительно жестком) состоянии, но необходимо сказать, что емкость 12 предпочтительно выполнена как нежесткая емкость (например, она выполнена из гибких материалов). Давление содержимого емкости 12 на ее стенки поддерживает форму емкости 12. Когда емкость 12 пустая или наполнена частично, она из-за ее нежесткой конструкции может быть частично или полностью сложена. Этот признак емкости 12 облегчает ее транспортировку и хранение в пустом состоянии. Емкость 12 имеет внутренний объем приблизительно от 400 л до 30000 л, более предпочтительно приблизительно от 500 л до 8000 л, наиболее предпочтительно приблизительно от 600 до 3000 л. Емкость 12 может иметь типичное отношение высоты к объему приблизительно 0,06-1 см/л.
Емкость 12 предпочтительно выполнена из полимера, такого как полиэтилен, поликарбонат, сополимер полиэтилена и нейлона, поливинилхлорида (ПВХ), этилвинилацетата (EVA) или этиленвинилового спирта (EVOH). Можно использовать разные сорта, плотности и типы полимеров, например полиэтилен низкой плотности (LDPE), полиэтилен очень низкой плотности (VLDPE), полиэтилен сверхнизкой плотности (ULDPE), линейный полиэтилен низкой плотности (LLDPE) и др. Емкость 12 может быть изготовлена путем сварки листов полимера, выдувным формованием расплава полимеров или любым другим стандартным способом изготовления из пластика-полимера, известным в данной области.
В предпочтительной конфигурации емкость 12 выполнена из ламината, содержащего несколько слоев из одного или нескольких типов полимеров. Ламинат может содержать 2, 3, 4 и до 7, 9, 15 или больше слоев, которые могут быть изготовлены из одинаковых или разных гибких материалов разной толщины, причем материалы и толщину выбирают, например, исходя из объема жидкости в емкости 12. Слои могут быть получены путем совместной экструзии. Ламинаты могут иметь конкретную гладкость или шероховатость внутренней и наружной поверхностей, повышенную прочность на разрыв, упругость, мягкость, гибкость, жесткость, прочность, способность к обработке и т.д. Можно выбрать материал, имеющий низкие уровни или, предпочтительно, не имеющий неактивированных животных веществ, способствующих обработке. Вещества, способствующие скольжению, и/или вещества, препятствующие блокировке, такие как кварц или диатомовая земля, могут быть включены в слои ламината для уменьшения трения и/или предотвращения самослипания.
Емкость 12 настоящего изобретения может быть изготовлена из материалов, придающих ей прозрачное или полупрозрачное свойство. В некоторых вариантах осуществления материал может быть непрозрачным, если свет будет повреждать клетки продукта. В данном контексте прозрачным считается материал, который передает большинство света, если не весь, а полупрозрачным считается материал, который передает некоторое количество света, но не весь свет. В одном варианте осуществления устройство предназначено для растительных клеток в культуре, которые не имеют способности к фотосинтезу. В другом варианте осуществления, в котором устройство используют для культивирования других типов клеток, например клеток мха или клеток водорослей, в устройстве можно выращивать фотосинтетические бактерии, имеющие способность к фотосинтезу. Предпочтительно, свет, поступающий во внутренний объем емкости, имеет длину волны, подходящую для фотосинтетических и других собирающих свет пигментов растительных клеток, культивируемых в биореакторе. Свет также может потребоваться для производства вторичных метаболитов, например антоцианина, клетками винограда. Более предпочтительно, емкость 12 выполнена из материалов, позволяющих осуществлять визуальное или инструментальное (например, спектрофотометрическое) наблюдение и/или контроль за внутренним объемом, чтобы выявлять изменения в культуре и/или питательной среде, потенциально указывающие на состояние культуры (например, цвет, коагуляция клеток, помутнение из-за загрязнения).
Емкость 12 может быть изготовлена в любой желательной конфигурации, причем предпочтительной является коническая рукавная конфигурация, которая имеет верх 14 и днище 16 (коническое на Фиг.1), соединенные двумя боковыми стенками 18, которые плоские, когда емкость 12 пустая и имеют, в сущности, цилиндрическую форму, когда емкость 12 полная. Также можно использовать и другие формы поперечного сечения, такие как прямоугольная или многоугольная.
Будет понятно, что цилиндрическая форма наиболее подходит для емкостей, обеспечивающих культивирование клеток с наиболее равномерным и незатрудненным протеканием жидкости, для перемешивания с минимальной турбулентностью и созданием нежелательных сдвиговых сил, повреждающих растительные клетки. Предпочтительно, днище 16 имеет форму, которая минимизирует образование осадка. Например, днище 16 может иметь форму усеченного конуса (как показано на Фиг.1), по меньшей мере имеющего стенку или стенки с уклоном вверх. При осуществлении изобретения на практике автор обнаружил, что такая форма превосходит коническую форму тем, что удается избежать образование осадка клеток, которые могут усиливать распад и смерть клеток, что повлияет на общую жизнестойкость культуры. Альтернативно, днище 16 может иметь в общем цилиндрическую или выпуклую форму. Вышеуказанные конфигурации днища 16 позволяют газу, подаваемому в емкость 12 рядом с днищем 16, создавать перемешивающее движение в содержимом емкости, что эффективно препятствует образованию осадка. Тем не менее, днище 16 может быть в сущности плоским в других вариантах осуществления настоящего изобретения.
Емкость 12 может быть изготовлена путем соединения/сварки двух панелей (образующих боковые стенки 18) из подходящего материала. Например, два листа полимерного материала могут быть вырезаны по удлиненной прямоугольной форме и помещены друг на друга. Затем листы соединяют способом сплавления, известным в данной области, для образования швов по краям двух более длинных сторон и по периферии одного из более коротких концов, снова параллельно и со смещением внутрь для образования шва на верху 14 емкости.
Днище 16 емкости может быть изготовлено путем сплавления другого короткого конца листов по двум наклонным линиям швов, взаимно сходящихся от швов на длинных сторонах. По желанию, две наклонные линии швов могут быть соединены выше их гребня другим наплавленным швом, приблизительно прямоугольным к швам длинных сторон. Перед соединением сплавлением двух листов жесткие пластиковые выступы могут быть приварены в местах, соответствующих точкам крепления соответствующих входных и выходных каналов (описано ниже).
Емкость 12 также может быть изготовлена из непрерывного рукава гибкого полимерного материала, что устраняет необходимость в сварке швов на длинных сторонах емкости и обеспечивает непрерывное круглое поперечное сечение на большей части высоты емкости. Использование рукава материала для изготовления емкости желательно потому, что отсутствие сварных швов минимизирует турбулентность и сдвиговые силы во время аэрации и перемешивания питательной среды.
Как показано на Фиг.1, емкость 12, кроме того, имеет канал 19I для сбора по меньшей мере части среды, содержащей клетки и/или ткань, что позволяет использовать устройство 10 непрерывно в течение по меньшей мере двух последовательных циклов культивирования и сбора без необходимости очистки, стерилизации и/или проверки между циклами. Альтернативно, сбор можно осуществлять через дополнительный канал сбора (19II), расположенный на днище биореактора для слива всего содержимого биореактора, что позволяет собрать всю культуру из биореактора. Остающаяся вторая часть среды, содержащей клетки и/или ткань, служит в качестве инокулянта для следующего цикла культивирования и сбора, в котором могут быть добавлены питательная среда и/или требуемые добавки, как сказано ниже. Каналы сбора 19 также могут использоваться для введения исходного объема инокулянта в емкость, а также для обеспечения протекания собираемого материала через них и из емкости.
Каналы сбора 19 имеют трубку сбора 20 с входом 22, который сообщен по жидкости с внутренним объемом емкости 12, и выходом 24, который расположен вне емкости 12. Альтернативно, каналы сбора 19 могут иметь форму одного проходного отверстия, вваренного в емкость 12, которое контактирует с внутренним объемом с внутренней стороны и имеет выход на наружной стороне емкости. Трубка сбора 20 может быть изготовлена из полимерного материала или сплава, известного в данной области. Поскольку сбор часто затрудняет присутствие комков клеток трубку сбора 20 предпочтительно изготавливают с большим внутренним диаметром (например, порядка 1-10 см) и/или с определенной упругостью, которая позволяет удалять засоры. Положение каналов сбора 19 выбирают исходя из объема емкости 12, чтобы остающаяся часть среды и клеток и/или ткани составляла определенную часть объема емкости 12 (например, 5-35%).
Канал сбора 19 может быть расположен рядом с днищем емкости 12, что позволяет собрать большую часть содержимого емкости 12, при этом сохраняя часть среды, содержащей клетки и/или ткани для использования в качестве инокулянта.
Альтернативно или дополнительно, канал сбора 19II может быть расположен ближе к днищу 16 емкости 12, и оператор может вручную обеспечивать, чтобы подходящая часть среды, содержащей клетки и/или ткани, оставалась в емкости 12 после отбора желательной части среды и клеток и/или ткани. Наличие канала 19II в положении ближе к днищу 16 позволяет удалять всю или почти всю среду.
Будет понятно, что хотя указанные положения каналов сбора 19 и 19II представлены выше как альтернативные, они оба могут быть включены в одно устройство 10, давая оператору альтернативные каналы сбора.
Канал сбора 19, кроме того, содержит регулятор потока 26. Регулятором 26 может являться, например, клапан для регулирования потока материала в емкость 12 или из нее через каналы сбора 19. Поток также можно регулировать через асептический соединитель, который изготовлен из прочного стерилизуемого материала, такого как стекло, нержавеющая сталь, жесткий пластик и т.д. Каналы сбора 19 также могут содержать средство для предотвращения загрязнения (не показано), такое как жидкостная ловушка, чтобы предотвращать случайное попадание материала в емкость 12 после сбора.
Емкость 12 может иметь дополнительный канал сбора, который сходен по конструкции с каналами сбора 19 и может быть расположен рядом с каналом сбора 19. Емкость 12, кроме того, имеет (по желанию) дополнительный вход 51 для введения среды или добавок. В некоторых вариантах осуществления дополнительный вход 51 расположен в верхней части емкости 12 рядом со свободным пространством над питательной средой. В других вариантах осуществления дополнительный вход 51 расположен ближе к средней части или днищу емкости 12. В других вариантах осуществления дополнительный вход 51 также может иметь средство для предотвращения загрязнения (не показано), такое как жидкостная ловушка, чтобы предотвращать случайное попадание материала в емкость 12 во время или после добавления среды и т.д.
Устройство 10, кроме того, имеет каналы газообмена для введения и выведения газов. Каналы газообмена имеют по меньшей мере один канал введения газа 28 для пропускания газа (воздуха, кислорода или других газов) через среду с целью аэрации и перемешивания культуры растительных клеток и по меньшей мере один канал выпуска газа 30 для удаления газа, который прошел через содержимое емкости 12 (например, питательную среду и клетки). Каналы впуска и выпуска газа могут быть оснащены фильтром 49, подробно описанным в настоящем документе. В одном варианте осуществления предусмотрены несколько газовых входов для более хорошего распределения давления воздуха при обеспечении необходимого притока воздушных пузырей.
Каналы впуска газа 28 могут быть соединены с источником подачи газа (например, насосом) посредством трубы или труб подачи газа.
Канал впуска газа 28 может быть изготовлен из гибкого (например, силикон) или жесткого материала (например, нержавеющая сталь). Газовый вход 34 (34I) соответствует каналу впуска газа 28(I) в положении I, и газовый вход 34(II) соответствует каналу впуска газа 28(II), в положении II, и предназначен для подачи пузырей газа в количестве, достаточном для аэрации и перемешивания питательной среды и предотвращения образования осадка без создания нежелательных сдвиговых сил, как сказано выше. Газовый вход 34 может иметь разную форму (узкий, широкий, скошенный, конический, круглый и т.д.), чтобы обеспечивать подачу пузырей требуемой формы и размера. Альтернативно, он может быть изготовлен как одна деталь с разными диаметрами внутреннего и наружного отверстий, как сказано для канала сбора 19.
Каналы газообмена 28 и 30, каналы сбора 19 и дополнительные пробоотборные каналы формируют путем создания отверстия в поверхности емкости 12 и укрепления этого отверстия вокруг канала с помощью дополнительного жесткого или нежесткого материала, известного в данной области.
Для обеспечения подходящего перемешивания и аэрации могут быть предусмотрены несколько каналов впуска газа 28 с плотностью 20-70 входов на кв. м. Каналы впуска газа 28 могут быть расположены по периметру емкости 12 на определенном расстоянии от ее днища 16. Расположение каналов впуска газа определяется исходя из объема и высоты емкости, а также из типа аэрации, необходимой для конкретной культуры растительных клеток. Каналы впуска газа 28 могут быть расположены на расстоянии 15-65 см от днища 16 емкости. В одном варианте осуществления изобретения по меньшей мере один из каналов впуска газа расположен ниже уровня канала сбора 18.
При необходимости могут быть предусмотрены дополнительные каналы впуска газа 28, например, для емкостей очень большой высоты или большого объема, чтобы подавать повышенные объемы газа без увеличения давления газа на входе или объема пузырей газа. Дополнительные каналы впуска газа 28 могут быть расположены в любом месте на поверхности емкости 12 и предпочтительно в пределах нижней половины высоты емкости 12, чтобы обеспечивать достаточное перемешивание и аэрацию среды. Такая конфигурация с некоторым количество каналов впуска газа в положениях I [28(I)] и II [28(II)], имеющая газовые входы 34(I) и 34 (II) соответственно, расположенные на некотором расстоянии друг от друга, обеспечивает эффективное перемешивание и аэрацию культура растительных клеток. Каналы для впуска газа могут, кроме того, содержать средство для предотвращения загрязнения, такое как фильтр 49 или ловушка, (не показано), которое предотвращает попадание газа, жидкости или твердых частиц (например, микробов, присутствующих в воздухе) внутрь емкости 12 и в питательную среду.
Емкость 12 имеет канал выпуска газа 30 для вентиляции и удаления газа, скопившегося над питательной средой. Канал выпуска газа 30 расположен в верхней половине, предпочтительно в верхней трети, емкости 12 в месте над уровнем жидкости (например, питательной среды), чтобы сообщаться по жидкости со свободным пространством над питательной средой. Наружное отверстие выпуска газа 46 канала выпуска газа 30 может быть открыто в атмосферу, и поток выпускаемого газа в канале выпуска газа 30 не регулируется. Дополнительно и альтернативно, канал выпуска газа 30 может, кроме того, содержать регулятор выпуска газа 48 (например, клапан давления или зажим), который регулирует поток газа из емкости 12 и может использоваться для создания положительного давления газа в емкости 12, таким образом поддерживая емкость 12 в надутом состоянии и в желательной цилиндрической форме. Канал выпуска газа 30 может, кроме того, иметь средство предотвращения загрязнения, такое как фильтр 49 или ловушка, которое предотвращает попадание газа, жидкости или твердых частиц (например, микробов, присутствующих в воздухе) внутрь емкости 12 и в питательную среду.
Поскольку емкость 12 настоящего изобретения предназначена для использования с объемами от 400 л и до нескольких тысяч литров питательной среды, и поскольку она гибкая, устройство 10, кроме того, включает опорную конструкцию для поддержки емкости 12.
Как показано на Фиг.2, опора 50 может иметь коническую конструкцию, которая предназначена для поддержки емкости 12 без оказания усилий на емкость 12 или ее содержимое.
Опора 50 может быть изготовлена из стали, дерева, пластика или керамики. Опора может быть изготовлена из легкой цилиндрической или эллиптической трубки, образующей решетчатую конструкцию из опорных элементов в форме колец (52) и стержней (54). Альтернативно, опорные элементы могут иметь форму пластин, соединенных с вертикальными стержневыми элементами и с горизонтальными кольцевыми элементами. Пластины могут быть непрерывными, в сущности создающими опору в форме оболочки, или могут быть расположены как перекладины, образуя кольца широких опорных элементов на некотором расстоянии друг от друга. Опорная конструкция 50 может быть свободно стоящей или может быть прикреплена к роликам (не показаны) для возможности перемещения, или она может быть прикреплена к жесткой конструкции, такой как стена, пол, колонна и т.д.
Емкость 12 является одноразовой и предназначена для утилизации после использования (в течение одного или нескольких циклов культивирования) при минимальных потерях и ущерба для окружающей среды. Устройства, изготовленные из пластика, например, такого как гибкий пластик, используемый в настоящем устройстве, относительно недорогие и могут поэтому быть утилизированы после использования с очень небольшим экономическим ущербом, если это требуется. Утилизация таких биореакторных устройств обычно не создает экономических неудобств для пользователя, поскольку даже низкая капитальная стоимость таких предметов компенсируется легкостью их использования, хранения и другими практическими соображениями. Утилизация выгодна тем, что она устраняет необходимость тщательной промывки дезинфицирующими средствами и другими едкими химикатами, которые могут загрязнять окружающую среду. Так, полимерные одноразовые биореакторные устройства, такие как емкость 12, могут быть легко переработаны, что снижает загрязнение окружающей среды при их использовании.
Хотя емкость 12 может быть простерилизована и повторно использована, она, предпочтительно, предлагается в стерилизованной форме, что устраняет необходимость в дорогостоящих и отнимающих много времени процессах стерилизации. Стерилизация нежесткой емкости может быть выполнена с использованием мокрых и/или сухих процессов стерилизации. Предпочтительно, стерилизацию выполняют сухим процессом, подходящим для использования с гибкими пластическими материалами, упомянутыми в настоящем документе, таким как обработка гамма-излучением или электронным пучком, газом (например, этиленоксидом) и др., которые хорошо известны в данной области.
Согласно предпочтительным вариантам осуществления настоящего изобретения, работа вышеописанного отдельного устройства и/или батареи устройств управляется компьютером (не показан). Компьютер дополнительно и предпочтительно должен быть способен контролировать такие параметры работы батареи и/или устройства согласно настоящему изобретению, как одно или несколько из температуры, количества и времени поступления газа или сочетания газов в емкость, количество газа и время его выхода из емкости, количества и времени добавления по меньшей мере одного материала (питательные вещества, питательная среда и т.д.) и/или количество света. Компьютер также может быть способен детектировать количество получаемых отходов.
Компьютер предпочтительно соединен с разными измерительными приборами при эксплуатации настоящего изобретения, например с системой для автоматической или полуавтоматической эксплуатации настоящего изобретения. Например, компьютер предпочтительно соединен с прибором (не показан) или приборами для контроля расхода газа или сочетания газов. Этот прибор предпочтительно соединен с трубой, идущей от подходящего источника подачи воздуха, и контролирует поток воздуха или другого газа в трубе.
Компьютер также предпочтительно соединен с термометром, который предпочтительно присутствует в окружающей среде емкости 12, но более предпочтительно не в емкости 12. Компьютер также дополнительно и предпочтительно должен быть способен управлять механизмом регулирования температуры, таким как нагреватель и/или охладитель.
Компьютер дополнительно и предпочтительно соединен с прибором, управляющим потоком среды и/или других питательных веществ из емкости для питательных веществ/среды в емкость 12.
Компьютер предпочтительно соединен по меньшей мере с одним каналом емкости и более предпочтительно по меньшей мере с каналом сбора 19. Компьютер дополнительно может управлять автоматизированным средством отбора проб и/или сбора для удаления части содержимого емкости из дополнительного пробоотборного канала, для проверки и/или сбора (не показан). Компьютер также может быть дополнительно соединен с анализатором для анализа отбираемой части содержимого, например, чтобы обеспечивать обратную связь для работы компьютера.
Как сказано выше, устройство 10 предназначено для культивирования культур растительных клеток. Питательной средой, подходящей для большого объема культуры растительных клеток в устройстве настоящего изобретения, может быть любая питательная среда для растительных клеток, известная в данной области. Конкретными, но не ограничивающими примерами подходящей питательной среды являются среды Murashige и Skoog (компания Sigma Ltd, Сент-Луис, штат Миссури, США), среда Anderson, среды Schenk и Hildebrandt и др. Многие питательные среды для растительной ткани имеются в продаже (см., например, Phytotechnology Laboratories, Шони-Мишн, штат Кентукки, США).
Фраза "культура растительных клеток" относится к любому из диких типов (встречающихся в природе) растительных клеток или генетически модифицированных растительных клеток (например, способных к стабильному или временному экспрессированию экзогенных генов). Предпочтительно, она относится к культурам клеток, которые вырабатывают активный ингредиент, который коммерчески желателен для использования в фармацевтической промышленности (лекарство или АФИ лекарства), пищевой промышленности (например, вкусовое вещество, ароматизатор), сельском хозяйстве (например, пестицид), косметике и др.
Предпочтительно, культура растительных клеток содержит растительные клетки, полученные из растительной ткани, такой как меристема корня или листа. Более предпочтительно, растительные клетки выбирают из группы, состоящей из клетки корня, трансформированной Agrobacterium rihzogenes, клетки сельдерея, имбиря, табака, люцерны, томата, салата, хрена и моркови.
Дополнительные культуры клеток, которые могут быть выращены в настоящем изобретении, включают дрожжи, мох, водоросли, фотосинтезирующие бактерии.
Культуры растительных клеток, подходящие для использования с устройствами и способами настоящего изобретения включают без ограничения устоявшиеся клеточные линии и клеточные линии, полученные из корней, листьев, стебля, цветов и т.п. растений. Неограничительными примерами устоявшихся клеточных линий являются Nicotiana tabacum L. cv Bright Yellow-2 (BY-2) и Nicotiana tabacum L. cv. Petit Havana.
Будет понятно, что повышенное давление газа на входе, повышенная плотность газовых входов, повышенная скорость аэрации газом и повышенный объем газа, требующегося для перемешивания и аэрации в больших биореакторах настоящего изобретения, могут представлять проблему образования пены в среде растительных клеток, которая может повреждать клетки и содержимое среды. Способы, известные в данной области для ингибирования пенообразования, включают без ограничения использование противопенных добавок, таких как силиконы, органические фосфаты и спирты, которые заставляют мелкие пузыри сливаться в более крупные, наносящие меньше вреда. Противопенные добавки пищевого сорта, обычно используемые в промышленности и переработке пищи, включают, например, полидиметилсилоксан и симетикон. Использование противопенных добавок в большом одноразовом биореакторе настоящего изобретения подробно описано в разделе "Примеры", ниже.
Настоящее изобретение также относится к способу культивирования и сбора растительных клеток в большом одноразовом биореакторе. Это устройство дополнительно и предпочтительно выполнено в соответствии с устройством, описанным выше, наиболее предпочтительно в соответствии с устройством, описанным в Примере 1, ниже. В этом способе растительные клетки предпочтительно помещают в емкость устройства согласно настоящему изобретению. Дополнительно и более предпочтительно, растительные клетки культивируют в суспензии.
Согласно предпочтительным вариантам осуществления настоящего изобретения, растительные клетки культивируют в суспензии в жидкой среде с добавлением по меньшей мере одного стерильного газа или сочетания газов по мере необходимости. Дополнительно и предпочтительно, стерильный газ содержит сочетание стерильных газов, которое более предпочтительно содержит стерильный воздух. Стерильный газ и/или сочетание газов предпочтительно добавляют в емкость через газовый вход, предпочтительно соединенный со стерилизующим фильтром (предпочтительно, 0,2 мкм), в ходе каждого цикла, или непрерывно или партиями, как сказано выше.
Стерильную питательную среду и/или стерильные добавки предпочтительно помещают в емкость и переносят через дополнительный вход 51 в биореактор, предпочтительно через стерилизационный фильтр или фильтры, как сказано выше.
Растительные клетки (например, аксенического инокулянта) дополнительно и предпочтительно вводят через средство отбора. Дополнительно и предпочтительно, растительные клетки в емкости (12) могут быть подвергнуты воздействию света, например, от наружного источника света (источника освещения вне емкости), в частности если емкость прозрачная и/или полупрозрачная. Дополнительно, источник света не используют, и емкость находится в темноте.
Клетки выращивают до желательного выхода клеток и/или материала, вырабатываемого клетками, такого как белок или вторичный метаболит.
Согласно предпочтительным вариантам осуществления, излишний воздух и/или отходящие газы предпочтительно выводятся из емкости через газовый выход, по желанию через фильтр, дополнительно и более предпочтительно непрерывно и/или с интервалами.
Также дополнительно и предпочтительно, материал в емкости (такой как питательная среда) проверяют на один или несколько загрязнителей и/или на качество клеток и/или продукта клеток, которые производят в емкости. Более предпочтительно, если один или несколько загрязнителей присутствуют в культуре или клетках, и/или если продукт клеток имеет плохое качество, устройство и его содержимое утилизируют.
В соответствующее время, в частности, если загрязнители и/или клетки плохого качества, и/или продукт плохого качества не обнаружены, по меньшей мере первая часть материала в емкости предпочтительно собирают, например, среду, содержащую клетки и/или продукт клеток. Более предпочтительно, остающаяся вторая часть материала, например среды, содержащей клетки и/или продукт клеток, остается в емкости, и эта вторая часть может дополнительно служить в качестве инокулянта для следующего цикла культивирования/сбора. После этого стерильная питательная среда и/или стерильные добавки могут быть поданы для следующего цикла культивирования/сбора через дополнительный вход 51, по желанию соединенный с фильтром 49 для предотвращения загрязнения.
Вышеописанный цикл по желанию выполняют более одного раза. Дополнительно и предпочтительно, предложенный способ позволяет культивировать и/или собирать клетки анаэробно.
Для анаэробного варианта осуществления через газовые входы устройства подают инертный газ вместо кислорода или воздуха. Для по меньшей мере одного устройства выполняют следующий процесс. Аксенический инокулянт вводят в устройство через канал сбора. Затем стерильную питательную среду и/или стерильные добавки вводят в устройство по общему трубопроводу ввода добавок. Дополнительно устройство освещают, как сказано выше.
Клетки в устройстве выращивают в среде до желательного выхода клеток и/или продукта клеток. Дополнительно и предпочтительно, излишний воздух и/или отходящие газы выводят из устройства, по желанию через фильтр, более предпочтительно непрерывно через канал выпуска газа.
Как и в вышеописанном способе, материал в емкости контролируют на наличие одного или нескольких загрязнителей и/или на наличие клеток плохого качества и/или продукт плохого качества, и при наличии такового емкость и ее содержимое предпочтительно утилизируют. Также как и в вышеописанном способе клетки и/или продукт клеток предпочтительно собирают в подходящее время, например когда получено желательное количество продукта клеток.
Система очистки воды обычно подает деионизированную и, в сущности, эндотоксическую свободную воду в резервуар, содержащий концентрированную среду, и затем разбавленная среда закачивается в устройство 10 через дополнительный вход. Фильтры, обычно 0,2 мкм, установлены в подающих трубах и также непосредственно перед входом для минимизации риска загрязнения содержимого емкости в каждом устройстве 10. Альтернативно или дополнительно может быть установлен клапан для минимизации этого риска.
Для первого цикла культивирования в каждом устройстве 10 инокулянт, обычно достаточный объем пробы того типа клеток, который необходимо собрать в устройстве 10, предварительно смешивают со средой или водой в предварительно стерилизованной емкости и вводят в устройство 10, обычно через канал сбора, но альтернативно или дополнительно через отдельный дополнительный вход. Затем в устройство 10 вводят среду через канал сбора или через дополнительный вход. Для последующих циклов вводят только среду и/или добавки, как сказано выше.
Воздушный компрессор обычно подает в сущности стерилизованный воздух или газы в каждое устройство 10 через ряд устройств: фильтр грубой очистки для удаления частиц, сушилку и увлажнитель для удаления влажности и фильтр тонкой очистки, обычно 0,2 мкм, для удаления загрязнителей. Предпочтительно, еще один фильтр установлен сразу же перед газовым входом для снижения риска загрязнения содержимого емкости. Для каждого устройства 10 все соединения с емкостью 12, т.е. с каналами впуска газа, дополнительным входом и предпочтительно также с каналом выпуска газа и с устройством сбора, стерилизуют перед использованием, и стерильность поддерживают при соединении с периферийным оборудованием, включая, например, оборудование для подачи воздуха и вытяжки, путем выполнения соединений в кожухе с ламинарным потоком воздуха.
Контроль температуры для каждого устройства 10 предпочтительно осуществляет подходящий блок обработки воздуха. Устройства дополнительного освещения могут быть подходящими люминесцентными лампами, расположенными вокруг устройства 10, когда это необходимо для роста клеток или производства соединения. В каждом цикле культивирования в каждом устройстве 10 содержимое каждой емкости 12 обычно аэрируют и перемешивают в течение от 3 до 14 суток или больше в условиях контролируемой температуры и освещения. Условия и продолжительность культивирования определяют исходя из индивидуальных требований к каждому циклу культивирования, таких как тип культивируемых клеток, получаемый рекомбинантный продукт, концентрация инокулянта и т.д.
В конце цикла культивирования в каждом устройстве 10 соответствующий канал сбора обычно соединяют с предварительно стерилизованной атмосферой с помощью подходящих соединителей, которые стерилизуют до и во время соединения, как сказано выше. Затем выполняют сбор, оставляя приблизительно от 2,5% до 45%, хотя обычно приблизительно от 10% до 35%, клеток и/или ткани для использования в качестве инокулянта в следующем цикле.
Собранные клетки/ткани и/или продукты клеток затем могут быть дополнительно высушены или экстрагированы, если это необходимо.
Еще одним дополнительным аспектом является добавление чистого кислорода в процессе культивирования клеток, более предпочтительно на третий или четвертый день после начала культивирования.
Примером предпочтительного типа клеток для культивирования в большом одноразовом биореакторе изобретения являются трансформированные клетки моркови, описанные в разделе "Примеры" ниже. Как сказано в упомянутом разделе, эти клетки моркови трансформированы Agrobacterium tumefaciens, которые экспрессируют экзогенный ген, кодирующий человеческую глюкоцереброзидазу (hGCD). В еще одном варианте осуществления одного аспекта изобретения типом клеток является Nicotiana tabacum. В еще одном варианте осуществления клетками Nicotinia tabacum являются клетки BY-2. Способы трансформации и экспрессии экзогенных генов в моркови и других типах клеток, подходящие для использования с большими одноразовыми биореакторами настоящего изобретения, хорошо известны в данной области. Трансформация и экспрессия биологически активных экзогенных белков в моркови и других культурах клеток с использованием одноразовых биореакторов раскрыты в патентной заявке США №10/784295 и в публикации РСТ WO 2004/096978, которые включены в настоящий документ в полном объеме.
В разделе "Примеры", ниже, продемонстрировано использование настоящего устройства для культивирования клеток вышеуказанной моркови и табака Nicotiana tabaccum. Как там сказано, культивирование трансгенных клеток моркови и табака в устройстве 10 большого биореактора, имеющем объем больше 400 л, привело к превосходному выходу и чистоте рекомбинантного белка. Клетки моркови, экспрессирующие человеческую глюкоцереброзидазу, и клетки табака, экспрессирующие ацетилхолинэстеразу-R, культивировали в большом одноразовом биореакторе и малом одноразовом биореакторе, и условия культивирования, выходы и продукты анализировали и сравнивали (см. Примеры 2 и 3). Результаты показывают, что большой одноразовый биореактор настоящего изобретения обеспечивает повышенное насыщение питательной среды кислородом при значительно меньшей скорости аэрации на входе, до 30% в течение по меньшей мере 7 суток культивирования, и повышенную эффективность культивирования, приводящую к повышенному выходу рекомбинантного белкового продукта. Анализ рекомбинантного белка путем пептидного картирования (Фиг.8), ИЭФ (Фиг.10), ДСН-ПААГ и иммунологическим анализом (Фиг.7 и 15-17) и хроматографией (Фиг.6 и 9) показал, что ферментные препараты глюкоцереброзидазы и ацетилхолинэстеразы из клеток, собранных из большого одноразового биореактора, идентичны стандартному препарату, полученному по стандартной технологии, что явно указывает на единообразие и идентичность ферментных препаратов, полученных из клеток, собранных из биореакторов на 80 л, 400 л и 800 л. Ферментные препараты из большого одноразового биореактора также показали сравнимую, если не превосходящую, каталитическую активность и специфическую активность (см. таблицу 5 и Фиг.17). Кроме того, показано, что рекомбинантная β-глюкоцереброзидаза, произведенная в больших одноразовых биореакторах настоящего изобретения, содержит недетектируемые уровни клеток-хозяев белка моркови, не менее чистые чем β-глюкоцереброзидаза, произведенная стандартными способами производства (Фиг.11). Так, большой одноразовый биореактор настоящего изобретения может обеспечивать точные, эффективные и даже превосходные условия для наращивания масштаба культивирования растительных клеток, экспрессирующих рекомбинантные белки, разработанные для меньших и гораздо меньших объемов.
Примеры
Ссылка сделана на последующие примеры, которые вместе с вышеприведенным описанием иллюстрируют изобретение неограничительным образом.
В общем, используемая здесь номенклатура и лабораторные процедуры в настоящем изобретении включают молекулярные, биохимические, микробиологические методы и методы рекомбинантных ДНК. Такие методы широко освещаются в литературе. См., например, "Молекулярное клонирование: Лабораторное руководство" Сэмбрук и др. (Sambrook et al.), (1989); "Текущие протоколы в молекулярной биологии" Т. I-II под ред. Осубель P.M. (Ausubel R. M., ed.) (1994); Осубель и др. (Ausubel et al.), "Текущие протоколы в молекулярной биологии", Изд. John Wiley и Sons, Балтимор, штат Мэриленд, США (1989); Пербаль (Perbal), "Практическое руководство по молекулярному клонированию", Изд. John Wiley & Sons, Нью-Йорк (1988); Уотсон и др. (Watson et al.), "Рекомбинантные ДНК", Scientific American Books, Нью-Йорк; Биррен и др. (Birren et al.) (под ред.) "Анализ генома: Серия лабораторных руководств", Т. 1-4, Cold Sprinr Harbor Laboratory Press, Нью-Йорк (1998); методологии, изложенные в патентах США №4666828; 4683202; 4801531; 5192659 и 5272057; "Биология клетки: лабораторный справочник", Т. I-III, под ред. Селлис Дж. И. (Cellis, J.Е.), (1994); "Культивирование животных клеток - Руководство по основным методам" Фрешни (Freshney), Wiley-Liss, Нью-Йорк (1994), Третье издание; "Текущие протоколы в иммунологии", Т. I-III, под ред. Колиган Дж. И. (Coligan J. Е.), (1994); Стайтс и др. (Stites et al.), "Базовая и клиническая иммунология" (8 издание), Appleton & Lange, Норуок, штат Коннектикут, США (1994); Мишель и Шииги (Mishell and Shiigi) (ред.), "Избранные методы клеточной иммунологии", W. H. Freeman and Co., Нью-Йорк (1980); известные способы иммунологического анализа описаны в патентной и научной литературе, см., например, патенты США №3791932; 3839153; 3850752; 3850578; 3853987; 3867517; 3879262; 3901654; 3935074; 3984533; 3996345; 4034074; 4098876; 4879219; 5011771 и 5281521; "Синтез олигонуклеотидов" под ред. Гейт М.Дж. (Gait, M.J.), (1984); "Гибридизация нуклеиновых кислот" под ред. Хеймс Б.Д. и Хиггинс С.Дж. (Hames В. D., Higgins S. J.), (1985); "Транскрипция и трансляция" под ред. Хеймс Б.Д. и Хиггинс С.Дж. (Hames, В.D., Higgins S.J.), (1984); "Культивирование животных клеток" под ред. Фрешни Р. Ай. (Freshney, R.I.), (1986); "Иммобилизованные клетки и ферменты" IRL Press, (1986); "Практическое руководство по молекулярному клонированию" Пербал Б., (1984) и "Способы ферментологии" Т. 1-317, Academic Press; "Протоколы ПЦР: руководство по способам и применению", Academic Press, Сан-Диего, штат Калифорния, США (1990); Маршак и др. (Marshak et al.), "Стратегии очистки и характеризации белков - Руководство по лабораторному курсу" CSHL Press (1996); которые все включены в настоящий документ в полном объеме путем ссылки. Другие общие ссылки представлены в тексте настоящего документа. Изложенные в них процедуры считаются известными в данной области и даны для удобства читателя. Вся содержащаяся в них информация включена в настоящий документ путем ссылки.
ПРИМЕР 1
Эффективное культивирование растительных клеток в большом одноразовом биореакторе
Для проверки параметров выращивания, выхода и характеристик культур и клеточных продуктов в большом одноразовом биореакторе, морковь, экспрессирующую человеческую глюкоцереброзидазу, культивировали в большом биореакторе и меньшем биореакторе. Условия культивирования, выход и продукты анализировали и сравнивали.
Материалы и способы экспериментов
Трансформация и культивирование моркови, экспрессирующей GCD: Трансформация и культивирование клеток были осуществлены как сказано в Примере 2.
Высококачественное выращивание культуры в биореакторе приблизительно 1 см (в диаметре) каллюса генетически модифицированное моркови, содержащего ген rh-GCD, поместили на среду агара в 9-сантиметровой чашке, содержащей 4,4 г/л среды MSD (компания Duchefa, Хаарлем, Нидерланды), 9,9 мг/л тиамина HCl (Duchefa), 0,5 мг фолиевой кислоты (компания Sigma Ltd, Сент-Луис, штат Миссури), 0,5 мг/л биотина (Duchefa), 0,8 г/л гидролизата казеина (Duchefa), сахар 30 г/л и гормоны 2-4 D (Sigma). Каллюс выращивали в течение 14 суток при 25°С.
Суспензию культуры клеток готовили путем суб-культивирования трансформированного каллюса в жидкой среде MSD, содержащей 0,2 мг/л 2,4-дихлоруксусной кислоты, известной в данной области. Суспензию культуры клеток затем культивировали в 250-миллиметровой колбе Эрленмейера, начиная с рабочего объема 25 мл и увеличив объем до 50 мл через 7 суток культивирования при 25°C с частотой встряхивания 60 об/мин. Впоследствии объем культуры клеток увеличили до 300 мл в 1-литровой колбе Эрленмейера при тех же условиях.
Инокулирование малого биореактора (10 л) [см. WO98/13469], содержащего 4 л среды MSD, осуществили путем добавления 400 мл суспензий клеток, взятых из двух 1-литровых колб Эрленмейера, которые культивировали в течение семи суток. После недели культивирования при 25°C с потоком воздуха 1 л/мин среду MDS дополнили до 10 л, и культивирование продолжили при тех же условиях. После дополнительного культивирования в течение пяти суток большинство клеток собрали путем пропускания сред с клетками через сетку 80 мкм. Лишнюю среду отжали и брикет клеток хранили при -70°С.
Противопенная добавка.
Для того чтобы избежать образования пены, использовали медицинскую эмульсию "Antifoam С" (полидиметилсилоксан-ПДМС, компания Dow Corning, Мидленд, штат Мичиган), которая содержала 30% симетикона Фармакопеи США, метилцеллюлозу, сорбиновую кислоту и воду. Противопенную добавку добавили в среду биореактора на 400 л в концентрации 10 частей на миллион.
Анализ противопенной добавки.
Эмульсия "Antifoam С" (ПДМС) используется в качестве ветрогонного средства и является ингредиентом нестандартных пищевых продуктов. Присутствие ПДМС оценивали в соответствии с требованиями Фармакопеи США для симетиконовых эмульсий. 450 мл раствора 0,075% ПДМС загрузили в 15-миллиметровую катионно-обменную хроматографическую колонку (Macro-Prep® High S Support, BioRad, Геркулес, штат Калифорния). Аликвоты для анализа ПДМС отбирали из загрузки, проточных (несвязанных материалов) и с трех этапов элюирования 0,2 М NaCl, 1,2 М NaCl и 12% этанола в 1,2 М NaCl.
Аликвотные пробы собранной культуры на разных этапах хроматографии (загрузка, проточный этап, промывка и элюирование) собирали и анализировали на присутствие ПДМС, используя способ ОФХ, с колонкой С4, контролируемой при 262 нм (пик поглощения эмульсии "Antifoam С").
ДСН-ПААГ.
Электрофорез в натрийдодецилсульфатполиакриламидном геле (ДСН-ПААГ) разделяет белки главным образом по их молекулярной массе. Кроме того, этот способ дает большие объемы информации по приблизительной чистоте и составу белков. Идентичность молекулярной массы и модель белковых примесей в prGCD, полученной из клеток, собранных в большом одноразовом биореакторе, исследовали анализом ДСН-ПААГ с использованием окрашивания кумасси бриллиантовым голубым в соответствии со стандартными протоколами разделения в геле. Вкратце, гели SDS состоят из концентрирующего геля (3%) и разделяющего геля (12%). Буферным раствором был Tris/SDS, pH 8,3, загрузочным буферным раствором был глицерин-Трис-меркаптоэтанол, pH 6,8.
Обращенно-фазная хроматография (ОФХ).
ОФХ применяется для отделения цельного белка и других компонентов от раствора белка. Точное время выдержки каждого соединения является типичным и позволяет определить идентичность и чистоту представляющего интерес белка. Характеристический пик и время выдержки растительной рекомбинантной глюкоцереброзидазы (prGCD) определяли путем использования колонки стационарной фазы С-4 (Phenomenex Jupiter 5u С4 proteo 300A 4.6×250 мМ Phenomenex, Торанс, штат Калифорния) с градиентом подвижной фазы: А; 0,1% TFA/H2O и В; 0,1% TFA/ацетонитрил. Детектирование белка осуществляли с помощью спектрофотометра с диодной матрицей на двух длинах волн: 214 нм и 280 нм.
Подготовка поликлональных антител.
Рекомбинантную GCD (75 мкг, Cerezyme™ Genzyme, Кембридж, штат Массачусетс) суспендировали в 3 мл полного адъюванта Фрейнда (Difco, Voigt, Лоренс, штат Канзас) и впрыскивали двум кроликам с повторным впрыскиванием через две недели. У кроликов брали кровь приблизительно через 10 суток после повторной инъекции и повторно с интервалом одна неделя до тех пор, пока титр антител не начинал снижаться. После удаления сгустка сыворотку разделяли на аликвоты и хранили при -20°С.
Вестерн-блоттинг.
Вестерн-блоттинг выполняли для идентификации молекул растительной рекомбинантной GCD (prGCD), очищенных от клеток, собранных в большом одноразовом биореакторе, в сравнении с ранее произведенными партиями и с коммерческой человеческой β-глюкоцереброзидазой (Cerezyme®, Genzyme, Кембридж, штат Массачусетс) путем использования специфических аффинных очищенных антител к GCD. Перенос белка выполняли в сущности так, как сказано выше. Вкратце, перенос из геля в нитроцеллюлозу выполняли при 100 вольт в течение 90 минут при 4°С. После переноса мембраны инкубировали в блокирующем буферном растворе [1% сухого молока, 0,1% Tween 20 (Номер по каталогу: Р1379; компания Sigma Ltd, Сент-Луис, штат Миссури) в фосфатном буферном растворе]. Белки затем иммунодетектировали путем инкубации с антителом к GCD, промывали и проводили реакцию с подходящим вторичным антителом (таким как козьим к кролику (цельная молекула) HRP (номер по каталогу: А-4914). Блоты затем проявляли реагентами ECL (RPN 2209, Amersham, Pharmacia Biotech UK LTD), и для визуализации использовали авторадиографию.
Сравнение между производством prGCD в разных биореакторах и при разных режимах аэрации.
Рекомбинантные клетки, экспрессирующие prGCD, выращивали в биоректорах различного объема (10 л, 100 л, 400 л) в течение 4-7 суток. Клетки выращивали в трех разных 10-литровых биореакторах при разных режимах аэрации (с барботером; с проходным отверстием 8 мм; с добавлением 100% кислорода с дня 4). Пробы необработанных экстрактов (5 мкл) отбирали на день 4 или день 7, разделяли в ПААГ, блотировали на нитроцеллюлозную блоттинг-мембрану вместе с 25 нг стандартной prGCD и проводили реакцию со специфическим поликлональным телом кролика к GCD. Полосы визуализировали с помощью хемилюминисцентного субстрата SuperSignal West Pico (Pierce Biotechnology, Рокфорд, штат Иллюнойс).
Растворенный кислород.
Количества растворенного кислорода отражены в единицах Kla: dC/dT=Kla, (Cs-C), где Cs - уровень насыщения кислородом в мг/л и С - фактическая концентрация кислорода в мг/л.
Скорость аэрации.
Скорость аэрации, определенную как объем воздуха при давлении 1 атм на объем жидкости в минуту (объем на объем в минуту) на газовом входе, вычисляли путем деления расхода воздуха на входе на рабочий объем биореактора.
Определение оптимальной скорости аэрации.
Для определения оптимальных скоростей аэрации осуществляли оптимизацию при каждом увеличении объема (от 100 л до больших биореакторов 400 л и 800 л) путем увеличения потока воздуха для достижения скорости аэрации в биореакторе меньшего объема и изменения скорости аэрации до достижения оптимальных заданных параметров. Эффект разных скоростей аэрации проверяли на физических параметрах, включая уровень пенообразования, уровень турбулентности жидкости, сопротивление фильтра выходящему потоку воздуха и расширение биореактора. Биологические параметра включали кривую роста культивируемых клеток, создаваемую по ежедневным записям свежей клеточной массы (г/л) в течение цикла выращивания (7 суток) и выхода белковых продуктов через 7 суток. Для получения оптимальной скорости аэрации сравнивали 10-15 циклов роста.
Результаты
Культивирование в больших одноразовых биореакторах требует пониженных скоростей аэрации.
Аксиома культивирования клеток заключается в том, что повышенные скорости аэрации повышают скорость роста клеток в культуре. Биореакторы меньшего объема для культивирования растительных клеток обычно подают воздух со скоростью 0,15-0,3 о/о/мин. Неожиданно, когда эффективность культивирования в биореакторах различных объемов оценивали по диапазону скоростей аэрации, подходящих для улучшения циркуляции воздуха и распределения кислорода при поддержании минимальной сдвиговой силы, было обнаружено, что оптимальные скорости аэрации для больших биореакторов были пропорционально ниже, чем для биореакторов меньшего объема. В таблице 1 показано, что тогда как в биореакторах меньшего объема (до 100 л) увеличение объема требует увеличения скорости аэрации для поддержания эффективности, в больших биореакторах (400 л и больше) оптимальные скорости аэрации фактически снижаются с увеличением объема биореактора. Такое снижение выгодно для культивирования в промышленном масштабе из-за способности уменьшать сдвиговые силы и повышения энергоэффективности.
Большой одноразовый биореактор обеспечивает превосходные уровни насыщения кислородом.
Правильные сочетания параметров при введении, перемешивании и вентиляции газа в биореакторе очень важны для эффективной работы большого одноразового биореактора настоящего изобретения. Объем пузырей, скорость аэрации, давление газа на входе, давление газа в пузырях и путь пузырей через питательную среду должны быть сбалансированы для оптимизации аэрации и перемешивания, а также для минимизации деструктивных сдвиговых сил и турбулентности в суспензии. Для оценки этих параметров определяли уровни насыщения кислородом.
На Фиг.3 показано насыщение кислородом в процентах среды в 400-литровом большом одноразовом биореакторе по сравнению с насыщением кислородом среды в биореакторе меньшего объема (колба Эрленмейера, 10-литровый биореактор и 100-литровый биореактор), измеренное в аликвотах, взятых во время инокуляции (день 0) и после 3, 4 и 7 суток культивирования. Давление и расход воздуха составляли 35 л/мин в большом биореакторе и 10 л/мин в 10- и 100-литровом реакторах. Снижение насыщения после инокуляции, а также содержание клеток в суспензии увеличились пропорционально, что является хорошо известным явлением. Все же несмотря на постепенное снижение за 7 суток, большой одноразовый биореактор явно создает условия для превосходного насыщения среды кислородом, превышая по этому показателю на 30% в любое время до 7 суток после инокуляции.
В таблице 2 показано, что 800-литровый биореактор достигает еще больших уровней насыщения кислородом, выраженных как Kla (мг/л) по сравнению с биореактором меньшего объема. Это превосходство поддерживается во всем диапазоне скоростей аэрации.
Большой одноразовый биореактор дает превосходный выход рекомбинантных белков.
Чтобы определить влияние культивирования в большом одноразовом биореакторе на эффективность производства рекомбинантных белков в культуре, экстракты суспензии из каждого реактора были разделены методом ДСН-ПААГ, блотированы и проанализированы иммунодетектированием с антителом к человеческой глюкоцереброзидазе (GCD). Сравнение выхода рекомбинантного продукта в 400-литровом большом одноразовом биореакторе (Фиг.4, дорожки 4-6), и выходом в 10-литровом (Фиг.4, дорожки 1-3) и 100-литровом (Фиг.4, дорожки 7 и 8) реакторах четко показывает повышенные уровни белков и более эффективное использование среды в большом биореакторе. Действительно, выход GCD в большом биореакторе на 4 и 7 сутки культивирования (дорожки 4, 5 и 6 соответственно) был лучше, чем выход в 10-литровом реакторе с увеличенным входным газовым отверстием (Фиг.4, дорожка 2) и добавлением О2 с дня 4 (Фиг.4, дорожка 3).
Эти результаты показывают, что большой одноразовый биореактор настоящего изобретения обеспечивает повышенное насыщение питательной среды кислородом и повышенную эффективность культивирования, что приводит к повышенному выходу рекомбинантного белкового продукта и повышенной энергоэффективности.
Эффективное и простое удаление противопенной добавки из питательной среды в большом одноразовом биореакторе.
При использовании повышенного давления воздуха для аэрации в большом одноразовом биореакторе вопрос вспенивания среды, которого необходимо избегать по многим причинам, требует внимания. Противопенная добавка (10 частей на миллион) была добавлена к среде для выращивания клеток при переносе в 400-литровый биореактор.
Нижний уровень детектирования с использованием стандартных лабораторных методов, таких как ВЭЖХ и атомная абсорбция, составляет приблизительно 7 частей на миллион.
Чтобы подтвердить, что сбор и очистка рекомбинантного продукта из большого одноразового биореактора способны устранить остаток противопенной добавки, большой избыток противопенной добавки ПДМС проходили начальные этапы очистки с контролем присутствия противопенной добавки.
На Фиг.5а представлены результаты ОФХ-анализа противопенной добавки ПДМС (0,075%) в аликвоте загрузочного раствора катионно-обменной колонки. Время выдержки (пиковое) составило 22,531 минуты. На Фиг.5b показана противопенная добавка в потоке в колонке (время выдержки 22,554 минуты) с размером пика и поглощением при 262 нм сходными с загруженным материалом. ПДМС не была обнаружена в пробах на любом из трех последующих этапов элюирования (0,2 М NaCl, 1,2 М NaCl и 12% этанола в 1,2 М NaCl). В таблице 3 четко видно, что ПДМС не оставалась в колонке.
Эти результаты четко показывают, что противопенный остаток легко удаляется из среды и остается ниже детектируемых уровней с первых этапов выделения и очистки.
ПРИМЕР 2
Эффективная экспрессия человеческой глюкоцереброзидазы в суспензии моркови при использовании большого одноразового биореактора
В этом примере приведено описание экспериментов, выполненных с трансформированными растительными клетками, культивированными в большом одноразовом биореакторе настоящего изобретения согласно некоторым вариантам осуществления.
Материалы и экспериментальные методы
Плазмидные векторы: *СЕ-Т - был сконструирован из плазмида СЕ, полученного от профессора Галили (Galili) (патент США №5367110 от 22 ноября 1994 г.).
Плазмид СЕ был гидролизован с SalI. Липкий конец SalI. был сделан "тупым" с использованием большого фрагмента ДНК-полимеразы I. Затем плазмид был гидролизован с PstI и сшит с фрагментом ДНК, кодирующим сигнал клетки-мишени ER от базового гена эндохитиназы [Arabidopsis thaliana] ATGAAGACTAATCTTTTTCTCTTTCTCATCTTTTCACTTCTCCTATCATTATCCTCGGCCGAATTC (SEQ ID NO: 6), и сигнал вакуолярной клетки-мишени от хитиназы А табака: GATCTTTTAGTCGATACTATG (SEQ ID NO: 5), гидролизованной с SmaI и PstI.
*pGREENII - получен от д-ра П.Муллино (Dr. P.Mullineaux) [Роджер П.Хелленс и др. (Roger P.Hellens et al.), (2000) Plant Mol. Bio. 42:819-832]. Экспрессия из вектора pGREEN II контролируется промотором 35S от мозаичного вируса цветной капусты, омега-трансляционным усилителем TMV (мозаичный вирус табака) и терминаторной последовательностью синтазы октопина от Agrobacterium tumefaciens.
кДНК человеческой глюкоцереброзидазы (hGCD): человеческая глюкоцереброзидаза была получена от АТСС (номер доступа: 65696), GC-2.2 [GCS-2kb; lambda-EZZ-gamma3 Homo sapiens], содержащего бета-кислоту глюкозидазы [глюкоцереброзидазу]. Длина вставки (kb): 2,20; Ткань: фибробласт WI-38.
Конструкция плазмида экспрессии hGCD: кДНК-кодирование для hGCD (номер клона АТТС: 65696) было усилено с использованием переднего: 5' CAGAATTCGCCCGCCCCTGCA 3' (SEQ ID NO: 3) и обратного: 5' CTCAGATCTTGGCGATGCCACA 3' (SEQ ID NO: 4) праймеров. Очищенный продукт полимеразной цепной реакции (ПЦР) ДНК был гидролизован эндонуклеазами EcoRI и BglII (см. последовательности распознавания, подчеркнутые в праймерах) и вшит в промежуточный вектор, имеющий экспрессионную кассету СЕ-Т, гидролизованную теми же ферментами. Экспрессионную кассету вырезали и элюировали из промежуточного вектора и вшили в двоичный вектор pGREENII, используя рестрикционные ферменты SmaI и XbaI, формируя конечный экспрессивный вектор. Сопротивление канамицина передается геном NPTII, возбуждаемым nos-промотором, полученным вместе с вектором pGREEN, для получения экспрессионной кассеты.
Была определена последовательность полученного плазмида для обеспечения точного слияния сигналов с использованием следующих праймеров секвенирования: 5' 35S промотор: 5' CTCAGAAGACCAGAGGGC 3' (SEQ ID NO: 1), и 3' терминатор: 5' CAAAGCGGCCATCGTGC 3' (SEQ ID NO: 2).
Создание каллюса моркови и суспензий культур клеток.
Создание каллюса моркови и суспензий культур клеток мы выполнили в соответствии с описанием Торреса (Torres K.С.) (Методы культивирования тканей садовых культур, стр.111, 169).
Трансформация моркови и изоляция трансформированных клеток.
Трансформацию моркови осуществили путем инфильтрации Agrobacterium, используя адаптацию способа, описанного выше [Вюртеле Э.С. и Булка К. (Wurtele E.S. and Bulka K.) Plant Sci. 61:253-262 (1989)]. Клетки, растущие в жидкой среде, использовали в течение всего процесса вместо каллюсов. Время инкубации и роста были адаптированы для трансформации клеток в жидкой культуре. Вкратце, Agrobacteria трансформировали вектором pGREEN II путем электропорации [Ден Дулк-Ра А. и Хоойкаас. П. Дж. (den Dulk-Ra A. and Hooykaas P.J.) Methods Mol. Biol. 55:63-72 (1995)] и затем отбирали, используя канамицин. После этого морковь трансформировали с помощью Agrobacteria и отбирали, используя антибиотик парамомицин в жидкой среде.
Скрининг трансформированной моркови для выделения каллюсов, экспрессирующих высокие уровни GCD.
Клетки гомогенизировали в буферном растворе SDS, и полученные экстракты белков отделяли на ДСН-ПААГ [Лаеммли У. (Laemmli U.), (1970) Nature 227:680-685] и переносили на нитроцеллюлозную мембрану (Hybond С Nitrocellulose, 0,45 мкм. Номер по каталогу: RPN203C; Amersham, Pharmacia Biotech UK LTD). Вестерн-блоттинг для детектирования GCD выполняли с использованием поликлональных антител к hGCD (описано ниже).
Культивирование и увеличение количества клеток в больших биореакторах: культивирование клеток осуществляли как сказано в Примере 1, выше.
Анализ белков.
Анализ идентичности и чистоты белков осуществляли как сказано в Примере 1, выше.
Масс-спектрометрия: масс-спектрометрический анализ выполняли методом "время-пролетной" масс-спектрометрии с применением ионизации лазерной десорбцией при содействии матрицы (MALDI-TOF), используя масс-спектрометр (4700, Applied Biosystems, Фостер-Сити, штат Калифорния) и масс-спектрометр с ионной ловушкой (LCQ classic, Finnigan, Сан-Хосе, штат Калифорния).
Пептидное картирование или фингерпринтинг белков с использованием ОФХ.
Пептидное картирование является способом анализа пептидов, возникающих при протеолитическом гидролизе белка, после чего проводят ОФХ для получения разделения с высоким разрешением, которое воспроизводится с четким профилем, называемым "фингерпринтинг". Как высоко специфический способ идентификации, этот анализ служит для подтверждения идентичности ферментного препарата, полученного стандартным способом производства и от клеток, собранных в 400-литровом биореакторе (PX-400-GC-2; в рамках данного способа). prGCD гидролизовали с трипсином путем инкубации в массовом отношении 1:50 с трипсином в 50 мМ (NH4)2CO3 (pH 8,0) в течение 6 часов при 37°C с последующей инкубацией в течение ночи при комнатной температуре.
Для ОФХ-анализа 50 мкг гидролизованного пептида загрузили в колонку С-18 (колонка: Phenomenex Jupiter 4u proteo 90A 4.6×250 мМ, Phenomenex, Торанс, штат Калифорния), и пептиды разделили и детектировали как сказано выше.
ИЭФ.
Изоэлектрическое фокусирование (ИЭФ) является способом разделения белков на основе их зарядов в электрическом поле. ИЭФ применяют в качестве идентификационного инструмента и для обеспечения гомогенности белка, демонстрируемой моделью с правильным pI-диапазоном. Изоэлектрическое фокусирование prGCD и Cerezyme® проводили по стандартному протоколу. Вкратце, для идентификации изоэлектрической точки (pI) prGCD очищенный фермент анализировали в полиакридамидном ИЭФ-геле с диапазоном рН 3-10 (Bio-Rad Laboratories, Геркулес, штат Калифорния), используя определенные анодный и катодный буферы и стандартные pI (Amersham Pharmacia Biotech UK LTD). К каждой пробе prGCD и Cerezyme® добавляли 0,05% таурохолевой кислоты (слабый анионный детергент) для повышения подвижности в геле.
Характер исчерченности белков prGCD и Cerezyme® визуализировали окрашиванием с помощью кумасси Bio-Safe™ (Bio-Rad Laboratories, Геркулес, штат Калифорния) согласно инструкциям изготовителя. Точку pI каждой полосы белка оценивали, используя стандартные белки из набора для калибровки ИЭФ с высоким диапазоном pI 5-10,5 (Amersham Pharmacia Biotech UK LTD). Определяли сходство характера исчерченности prGCD и коммерчески производимого Cerezyme®. Характер исчерченности prGCD также исследовали на единообразие партий.
Анализ ферментной активности.
β-глюкоцереброзидаза катализирует гидролиз гликолипидного глюкоцереброзида до глюкозы и керамида. Для оценки каталитической активности рекомбинантной глюкоцереброзидазы применяли ферментный анализ с использованием синтетического субстрата с целью оценки каждой партии. Ферментная единица определяется как количество фермента, которое катализирует гидролиз одной микромоли паранитрофенил-β-D-глюкопиранозида (pNP-Glc) синтетического субстрата в минуту при 37°C.
Результаты
Характеризация рекомбинантной глюкоцереброзидазы из большого одноразового биореактора.
Чтобы определить оптимальный характер улучшенных условий культивирования в большом одноразовом биореакторе и для проверки надежности и воспроизводимости этих условий, молекулярные и физико-химические характеристики рекомбинантного продукта, полученного в больших одноразовых биореакторах, сравнивали с препаратами, полученными в биореакторах меньшего объема.
Молекулярная масса глюкоцереброзидазы, определенная масс-спектрометрией. Масс-спектрометический анализ использовали для определения массы белка без необходимости использования стандартов белков. Использовали два способа масс-спектрометрии для определения молекулярной массы фермента, полученного из клеток, собранных в 400-литровом биореакторе, и данные сравнивали с данными глюкоцереброзидазы, полученной в реакторах меньшего объема. Все ферментные препараты изолировали и очищали таким же образом.
В таблице 4 приведены данные по молекулярной массе нескольких партий ферментов, полученных обоими способами, классическим LCQ и MALDI-TOF. Партии prGCD, полученные из клеток, собранных в 400-литровом биореакторе, указаны PX400-GC.
Результаты масс-спектрометрии показывают, что оценка молекулярной массы белка во всех препаратах составляет приблизительно 60 800 а.е.м. и остается неизменной в партиях, полученных из клеток, собранных в 400-литровом биореакторе и 80-литровом биореакторе. Эта молекулярная масса согласуется с гликозилированным полипептидом, имеющим 506 аминокислот и вносящим 56642,6 а.е.м., и добавлением гликановых структур, вносящих остальные 4158 а.е.м. (около 7%).
Идентификация, определение молекулярной массы и чистоты способами ДСН-ПААГ и вестерн-блоттинг.
Идентичность молекулярной массы и модель чистоты белка глюкоцереброзидазы, полученной из клеток, собранных в 400-литровом биореакторе, были исследованы способом ДСН-ПААГ с окрашиванием кумасси бриллиантовым голубым.
На Фиг.6 показаны результаты ДСН-ПААГ с окрашиванием кумасси бриллиантовым голубым стандартного ферментного препарата (PLX-GC-016-0505 DS), церезима и глюкоцереброзидазы, полученной из клеток, собранных в 400-литровом большом одноразовом биореакторе (PX-400-GC-2).
Фиг.6 далее подтверждает, что prGCD из клеток, культивированных в большом биореакторе, имеет свойства, почти идентичные свойствам GCD, полученной другими способами. Миграция белка в каждой партии была сходной, с оцененной молекулярной массой 60 900 а.е.м. Кроме того, модель полос белка идентична для всех партий из стандартного и 400-литрового биореакторов, не показывая присутствия белковых примесей в ферменте, полученном из клеток, собранных в 400-литровом биореакторе. Иммунодетектирование белков, разделенных способом ДСН-ПААГ (вестерн-блоттинг), с помощью антитела к глюкоцереброзидазе выполняли для идентификации молекул β-глюкоцереброзидазы, очищенных от клеток, собранных в 400-литровом биореакторе, в сравнении с ранее произведенными партиями и с коммерческой человеческой β-глюкоцереброзидазой (Cerezyme®, Genzyme), используя специфически аффинно очищенные антитела к β-глюкоцереброзидазе.
На Фиг.7 показаны результаты вестерн-блоттинга с использованием специфических антител кролика к β-глюкоцереброзидазе для детектирования стандартной β-глюкоцереброзидазы (PLX-GC-016-0505 DS), Cerezyme® и белка, полученного из клеток, собранных в 400-литровом биореакторе (PX-400-GC-2). Полосы белка, идентифицированные специфическим антителом, идентичны для всех партий из стандартного и 400-литрового биореакторов. Этот анализ не раскрыл дополнительных ухудшенных полос в белке фермента, полученном из клеток, собранных в 400-литровом биореакторе.
Так, согласно ДСН-ПААГ и иммунологическому анализу, нет доказательств разницы в идентичности и чистоте между ферментом, произведенным из клеток, собранных в стандартном (80-литровый) биореакторе и в 400-литровом биореакторе.
Пептидное картирование или "фингерпринтинг" белка с использованием обращенно-фазной хроматографии (ОФХ).
Чтобы подтвердить идентичность ферментного препарата, произведенного по стандартному производственному процессу (80 л), и препарата из клеток, собранных в 400-литровом биореакторе (PX-400-GC-2), фингерпринтинг белка выполнили на prGCD, полученной из клеток, собранных в 80 и 400-литровом биореакторах.
На Фиг.8а и 8b показан типичный профиль триптической карты коммерческой глюкоцереброзидазы (PLX-GC-016-0505 DS), полученный на хроматографической колонке С-18. На Фиг.8а показаны разделенные пептиды, контролируемые при 214 нм (пептидные связи), и на Фиг.8b показаны разделенные пептиды, контролируемые при 280 нм (триптофан и тирозин). На Фиг.8c и 8d представлена триптическая карта глюкоцереброзидазы, приготовленной из клеток, собранных в 400-литровом биореакторе (PX-400-GC-2), контролируемой при 214 нм (Фиг.8c) и 280 нм (Фиг.8d). Таким образом, пептидная карта ферментных препаратов глюкоцереброзидазы из клеток, собранных в большом одноразовом биореакторе, идентична пептидной карте стандартного препарата, полученного по стандартной технологии, что явно указывает на однообразие и идентичность ферментных препаратов, полученных из клеток, собранных в 80-литровом и 400-литровом биореакторах.
Обращенно-фазная хроматография (ОФХ).
Дальнейшее определение характеристик белков, полученных из клеток, культивированных в 400-литровом большом биореакторе было осуществлено путем ОФХ.
На Фиг.9а и 9b представлены хроматограммы при 214 нм (9а) и 280 нм (9b) глюкоцереброзидазы, очищенной от клеток, собранных в 400-литровом биореакторе (PX-400-GC-2). На хроматограмме ферментного белка, полученного в большом одноразовом биореакторе, фермент проявляется как один целый пик с временем выдержки 64, 12 минуты, подобному времени выдержки ранее полученного фермента глюкоцереброзидазы, 64, 70 минуты.
Таким образом, в стандартных условиях хроматографии рекомбинантную глюкоцереброзидазу, полученную в большом одноразовом биореакторе и стандартном одноразовом биореакторе, элюировали при одинаковом времени выдержки. Появление одного целого пика совпадает с результатами анализа, выполненного на предыдущих партиях ферментных препаратов. Форма и размер небольших пиков примесей сходны с таковыми у стандарта глюкоцереброзидазы, и уровень примеси находится в пределах требуемых спецификаций.
Изоэлектрическое фокусирование (ИЭФ).
Чтобы далее идентифицировать и обеспечить гомогенность рекомбинантного белка, продуцируемого клетками, культивированными в большом биореакторе настоящего изобретения, определили диапазон pI профиля исчерченности глюкоцереброзидазы из клеток, собранных в большом 400-литровом биореакторе (PX-400-GC-2), и из клеток, собранных в стандартном 80-литровом биореакторе (PLX-GC-016-0505DS).
На Фиг.10 показана модель полос рI, визуализированная путем окрашивания кумасси бриллиантовым голубым проб фермента из препаратов, полученных в стандартном биореакторе (PLX-GC-016-0505DS), и из клеток, собранных в 400-литровом биореакторе (PX-400-GC-2) на различных этапах очистки (после 3, 4 и 5 очистной колонки, указанных как С-3, С-4 и С-5 соответственно). Профили фермента, полученного в биореакторе стандартного объема, и фермента, полученного из клеток, культивированных в 400-литровом биореакторе, идентичны по количеству полос, модели и интенсивности каждой аналогичной полосы. Таким образом, модели изоформ ИЭФ ферментов, полученных в большом одноразовом биореакторе и из ранее произведенных препаратов, идентичны.
Анализ ферментной активности.
Для оценки каталитической активности рекомбинантной глюкоцереброзидазы, полученной в большом биореакторе, применили ферментный анализ с использованием синтетического субстрата с β-D-глюкопиранозидом (pNP-Glc). В таблице 5 показаны данные по специфической активности глюкоцереброзидазы, полученной из клеток, собранных в 400-литровом биореакторе (PX-400-GC) и в биореакторах стандартного объема.
Таким образом, специфическая активность фермента, полученного из клеток, собранных в 400-литровом биореакторе, находится в диапазоне активности фермента, полученного в стандартных биореакторах. Более того, при сравнении параметров выращивания трех партий prGCD, экспрессирующей культуры клеток, выращенных в 800-литровом биореакторе, с значениями культур, выращенных в 400-литровом биореакторе, как показано в таблице 6, параметры проводимости, осмотического давления и выхода (клеток и белка) находились в том же диапазоне как и культуры из двух больших одноразовых биореакторов.
β-глюкоцереброзидаза из большого одноразового биореактора не содержит белков клеток-хозяев.
Для детектирования белков клеток-хозяев моркови (СНР) был разработан чувствительный иммуноанализ, способный детектировать широкий диапазон белковых примесей. Поликлональное антитело для этого анализа было создано из белкового препарата, полученного из нетрансформированных клеток моркови (клеток моркови, не содержащих конструкцию β-глюкоцереброзидазы). Эти поликлональные антитела разделяли для придания специфического связывания полипептидному ядру белков, но не надосадочным жидкостям/остаткам сахаров, для предотвращения перекрестной реакции с сахарами, прикрепленными к рекомбинантной β-глюкоцереброзидазе.
Препарат клеток-хозяев моркови (СНР) использовали как эталонный стандарт для белковых примесей, относящихся к клеткам-хозяевам и как антиген для приготовления поликлональных антител, используемых в иммуноанализе.
На Фиг.11 показана реакционная способность специфического белкового антитела к клеткам-хозяевам и партий β-глюкоцереброзидазы, проанализированных способами ДСН-ПААГ и вестерн-блоттинга со специфическими антителами против клеток-хозяев моркови. Анализировали партии β-глюкоцереброзидазы (PLX-GC-016-0505 DS) из биореакторов стандартного объема и партии β-глюкоцереброзидазы из клеток, собранных в 400-литровом биореакторе (PX-400-GC-2), а также пробы экстракта белка клеток-хозяев моркови. Четыре основных белковых полосы идентифицированы в пробах белка клеток-хозяев моркови (Фиг.11, дорожки 7 и 8), однако ни одна из соответствующих полос белка СНР не детектирована в любой из проб β-глюкоцереброзидазы, указывая на то, что рекомбинантная β-глюкоцереброзидаза, произведенная в больших одноразовых биореакторах настоящего изобретения, содержит недетектируемые уровни белков клеток-хозяев моркови и не менее чистая чем β-глюкоцереброзидаза, произведенная стандартными способами.
ПРИМЕР 3
Эффективная экспрессия человеческой ацетилхолинэстеразы в суспензии клеток BY-2 с использованием большого одноразового биореактора
Этот пример содержит описание экспериментов, которые были выполнены с клетками Nicotiana tabaccum BY-2, трансформированными с человеческой ацетилхолинэстеразы, культивированной в большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения.
Материалы и способы экспериментов
кДНК: кДНК, кодирующая введенный "совместно прочитанный" вариант человеческой ацетилхолинэстеразы (AChE-R), была получена от д-ра Эрмона Сорек (Dr. Hermona Soreq), Израильский университет Иерусалима, Израиль (компания Yissum Technology Transfer Company Израильского университета Иерусалима, № рТМ240).
Последовательность этого гена была оптимизирована к растениям и включает нативную лидерную последовательность в ER (33 аминокислоты на N-конце, SEQ ID NO: 7, вырождающиеся в зрелом белке), и последовательность выдержки ER (SEKDEL; SEQ ID NO: 8), соединенную с С-концом рекомбинантного гена (SEQ ID NO: 9). Конструкция плазмида экспрессии ацетилхолинэстеразы - плазмид pBluescript SK+ (номер по каталогу: 212205, Stratagene, Ла-Йолла, штат Калифорния) использовали в качестве остова для построения кассеты экспрессии в растении. Кассета экспрессии в растении с необходимыми элементами для экспрессии высокого уровня была встроена в плазмид pBluescript SK+. Эта кассета экспрессии (КЭ) включает промотор CaMV35S, усилитель трансляции Omega, конец транскрипции и сигнал полиаденилирования синфазного гена Agrobacterium tumefaciens Octopine (КЭ cassette).
AChE-R, субклонированная в вектор экспрессии Bluescript®, содержащий кассету экспрессии, путем ПЦР-усиления AChE-R с использованием праймеров, содержащих сайты рестрикции Sal I и PstI, показанные жирным шрифтом с подчеркиванием (передний праймер: 5'-CGGCGTCGACACAAGAGGCCTCCACAAT-3' (SEQ ID NO: 10), обратный праймер: 5'-CCCCCTGCAGCTAGAGTTCATCCTTCTC-3' (SEQ ID NO: 11). Кассета экспрессии с последовательностью, кодирующей AChE-R, затем была удалена из промежуточного вектора и далее субклонирована с использованием NotI и Асс651 в двоичный вектор pGREENII nos-Kana (Хелленс и др. (Hellens et al.), 2000), как сказано в настоящем документе. Положительные клоны были выбраны с использованием ПЦР и рестрикционного анализа.
Трансформация, скрининг и культивирование Ache-R, экспрессирующей клетки BY-2.
Трансформация Agrobacterium перед инфильтрацией клеток BY2 cells была выполнена, как сказано выше (ден Дулк-Рас и Хоойкаас (den Dulk-Ras and Hooykaas), 1995). Сопротивление канамицина, приданное геном NPTII, возбуждаемым nos-промотором, полученным вместе с вектором pGREEN, было использовано для скрининга и выбора трансформантов.
Инфильтрация с Agrobacterium генетически модифицированных клеток Nicotiana tabaccum (линия BY2) и последующее культивирование были осуществлены в сущности так, как описано для трансформации клеток моркови в Примере 2, выше. Скрининг на каллюсы, экспрессирующие высокие уровни Ache-R, был осуществлен с использованием анализа каталитической активности Элмана и вестерн-блоттинга, описанных в настоящем документе. Суспензии культур выбранных клеток выдерживали как суспензии по 50 мл в колбах Эрленмейера на 250 мл при постоянном перемешивании и контролируемой температуре, 25±2°C, на орбитальном шейкере (80 об/мин). Производственный процесс включал фазу роста в среде, содержащей антибиотики паромомицин и цефотаксим в качестве селективных агентов.
Наращивание при росте культуры в биореакторе.
Наращивание культуры до 10 л проводили постепенно. Сначала инокулят в виде 200-400 мл суспензии клеток ввели в 12-литровый биореактор, содержащий 3,6-9,8 л среды. После 7 суток культивирования (25±2°С, 1,5 л/мин стерильного воздуха) объем среды довели до 10 л, и культивирование продолжили в тех же условиях в течение еще 7 суток. 400-литровый биореактор инокулировали 10 л суспензии клеток и потом постепенно пополняли средой до 350 л, продолжая культивирование в тех же условиях.
Противопенную добавку (10 частей на миллион) добавили в среду роста клеток при переводе в 400-литровый биореактор. В качестве противопенной добавки использовали медицинскую эмульсию "Antifoam С" (полидиметилсилоксан - ПДМС).
Вестерн-блоттинг.
Вестерн-блоттинг проводили с аффинно очищенным козьим поликлональным антителом к пептиду на N-конце AChE человеческого происхождения (Santa-Cruz Biotechnology, Санта-Крус, штат Калифорния). N-конец идентичен во всех формах AChE, таким образом это антитело может распознавать и AChE-R. Детектирование выполнили с помощью набора ECL для детектирования (Pierce).
ДСН-ПААГ выполняли на стандартных условиях. AChE-S и AChE-R проанализировали на 10% ДСН-ПААГ. Электрофорез выполнили с использованием вертикального устройства Criterion™ для электрофореза клеток (Bio-Rad Laboratories) с предварительно смешанным буферным раствором трис-глицин-SDS для электрофореза (Bio-Rad Laboratories). 10% акриламидные гели приготовили, используя готовые растворы 40% акриламид/бис и 10% раствора SDS. Перенос белков из бис-акриламидных гелей на нитроцеллюлозную мембрану выполнили, используя систему сухого блоттинга iBlot™ (Invitrogen), используя готовый план Р3 блоттера. Перенос выполнили при комнатной температуре за 8 минут. После переноса белков на мембрану последнюю блокировали, промыли и связали с первичным и вторичным антителом, используя набор One-step™ Complete Western Kit (GenScript Corporation). Первичное антитело (N-19; Санта-Крус, Калифорния) добавили в рабочий раствор One-step™ (GenScript) разбавленным в пропорции 1:200. Детектирование выполнили с помощью набора ECL detection kit (Pierce). Иммунореактивность AChE-R сравнили с иммунореактивностью коммерческой человеческой рекомбинантной AChE-S (Sigma). Полосы детектировали, используя систему получения молекулярных изображений Gel Doc XR (Bio-Rad Laboratories).
Окрашивание флуоресцентным гелем Flamingo™.
Окрашивание флуоресцентным гелем Flamingo™ (Bio-Rad Laboratories) является высокочувствительным неспецифическим способом окрашивания белков. AChE-R (партии 9-11) загрузили в нескольких концентрациях (50, 100 и 200 нг/проба) для сравнения с коммерческой человеческой рекомбинантной AChE-S (Sigma). Пробы анализировали на 10% ДСН-ПААГ по стандартной процедуре, описанной в настоящем документе, и окрасили флуоресцентным гелем Flamingo™ согласно инструкциям изготовителя.
Анализ Эллмана.
Реагент Эллмана использовали для модификаций свободных тиолов в белках (Эллман и др. (Ellman, et al.), 1961). Он быстро образует дисульфидную связь с тиолом и высвобождает тиолат, который имеет характерный цвет, который можно измерить на 405 нм. Анализ Эллмана проводили для измерения активности AChE-R и концентрации активного фермента в пробах необработанного гомогената, а также для определения концентрации активного фермента в очищенных пробах. Единица фермента определена как количество фермента, которое катализирует гидролиз одной микромоли иодида ацетилтиохолина синтетического субстрата [(2-меркаптоэтил)триметиламмония иодид ацетат] в (2-меркаптоэтил)триметиламмония иодид и уксусную кислоту в минуту при комнатной температуре и рН=7,4. Каталитическую активность AChE-R определили, используя ацетилтиохолина иодид (Sigma, Сент-Луис, Миссури) в качестве субстрата. Пробы исследовали на каталитическую активность AChE в концентрациях приблизительно 60 нг/мл (очищенная проба) или 50-100 нг/мл (необработанный гомогенат) и растворили в фосфатном буферном растворе (0,1 М; рН=7,4; 0,025% БСА) после спектрофотометрии по способу, разработанному Эллманом и др. (1961). В этом способе AChE, ацетилтиохолина иодид (20 мМ) и реагент Эллмана - ДТНБ [5-5'-дитио-бис (2-нитробензоат); 9 мМ; Sigma] смешали, контролировали гидролиз с помощью спектрофотометра, измеряя оптическую плотность на 405 нм с интервалами в 2 мин в течение 20 мин. Негативные контрольные пробы содержали все компоненты за исключением проверяемого экстракта. Результаты, нанесенные на график относительно времени и начальных скоростей, вычислили по наклону линейной части графика. Единицу активности каждого препарата AChE вычислили по следующему уравнению:
Реагент Эллмана с использованием специфического ингибитора AChE - ДЭФХ. ДЭФХ (7-(O,O-диэтил-фосфинилокси)-1-метилхинолиниума метилсульфат) является мощным необратимым ингибитором AChE и используется для контроля ее активности. Титрование активного сайта растворов фермента выполнили в присутствии фосфатного буферного раствора (0,1 М; рН=7,4; 0,025% БСА) путем добавления разных количеств ДЭФХ (0,2-0,8 нМ). Активность измерили, используя вышеописанный анализ Эллмана. Процент ингибирования нанесли на график против концентрации ингибитора. ДЭФХ реагирует с AChE-R в соотношении 1:1. Эти значения использовали для определения концентрации AChE-R, выраженной в микромолях.
Активность холинэстеразы с использованием окрашивания по Карновски. Активность холинэстеразы путем окрашивания по Карновски и Рутс (Karnovsky and Roots, 1964) является специфическим методом, используемым для визуального детектирования активности холинэстеразы (AChE и BChE). В этом методе сложные эфиры тиохолина используют в качестве субстратов, и он основан на восстановлении феррицианида до ферроцианида тиохолинолм, высвобождаемым активность холинэстеразы. Образовавшийся ферроцианид захватывается медью с образованием ферроцианида меди, который после этого виден невооруженным глазом.
Нативный (не денатурирующий) ПААГ.
Нативный электрофорез в полиакриламидном геле (ПААГ) используется для белков размером от 5000 до 2000000 а.е.м. из-за единого размера пор, создаваемых полиакриламидным гелем. В отличие от ДСН-ПААГ, нативный электрофорез в геле не использует заряженного денатутирующего агента. Разделяемые молекулы поэтому различаются по молекулярной массе и собственному заряду. Поскольку белки остаются в нативном состоянии при разделении, они могут детектироваться не только обычными реагентами, окрашивающими белки, но и реагентами, использующими специфические каталитические свойства фермента.
Результаты
Профиль рекомбинантной Ache-R.
Белок рекомбинантной AChE-R, полученный способами настоящего изобретения, был оценен при молекулярной массе 64000 а.е.м., как показано на Фиг.15 (дорожки 1-3). Контрольная AChE-S (дорожки 5-7), тетрамер в нейтральных условиях, был восстановлен в ДСН-ПААГ до его мономеров, и таким образом мигрировал в AChE-R, поскольку мономер AChE-S имеет молекулярную массу приблизительно 70000 а.е.м., на 6000 а.е.м. больше, чем AChE-R. Так, AChE-R, экспрессированная в клетках BY2 табака в большом одноразовом биореакторе, имеет сходную 3-мерную структуру (определена по электрофоретической подвижности) с рекомбинантной человеческой AChE-S, экспрессированной в клетках HEK 293 (Sigma) в ее мономерной форме.
Неспецифическое окрашивание Flamingo™ дополнительно проверяет профиль миграции рекомбинантной AChE-R, экспрессированной в растении, поскольку детектируемые полосы имеют ту же модель миграции, которая была определена иммуноанализом с использованием антител к AChE (Фиг.16). Кроме того, одиночная полоса окрашивания, наблюдавшаяся на геле, которая показана на Фиг.16, указывает на существенную эффективность очистки белка фермента, экспрессированного в растении.
Активность рекомбинантной AChE-R.
На Фиг.17 показана каталитическая идентичность экспрессированной в растении AChE-R и экспрессированных в клетках млекопитающего полипептидов AChE-S при использовании окрашивания по Крановски. На гешль были загружены 50 нг (дорожки 3 и 6), 100 нг (дорожки 2 и 5) и 200 нг (дорожки 1 и 4) AChE-R. Активность была очевидной во всех трех концентрациях, подтверждая активность AchE-R, очищенной от клеток BY-2, собранных в большом биореакторе настоящего изобретения. Коммерческая человеческая рекомбинантная AChE-S появляется в ее тетрамерной форме (верхняя стрелка), таким образом мигрируя медленнее, чем мономеры AChE-R (нижняя стрелка), и сохраняет свою активность. Менее выраженная полоса, детектированная в дорожках 4-6, мигрирующая идентично полосе мономеров AChE-R (дорожки 1-3), указывает, что экспрессированные в растениях мономеры AChE-S не только идентичны по размеру, но и каталитически активны одинаково с коммерческой человеческой рекомбинантной AChE-S.
В таблице 7 показано сравнение активности экспрессированной в растении AChE-R и ее концентрация в партиях, произведенных в биореакторах небольшого объема, и партиях, произведенных в большом одноразовом биореакторе согласно одному варианту осуществления настоящего изобретения, которые были проверены анализом активности по Эллману с использованием ингибирования ДЭФХ. Таблица 7 четко показывает значительно увеличенный выход белка AChE (выраженный как мг белка/кг клеток) в большом устройстве для культивирования без уменьшения в диапазоне ферментной активности.
Таким образом, эти результаты, взятые вместе, также поддерживают значительные преимущества культивирования трансгенных растительных клеток в большом одноразовом биореакторе согласно некоторым вариантам осуществления настоящего изобретения из-за точной и высокоэффективной экспрессии и послетрансляционной обработки рекомбинантных белков, в то же время устраняя многие недостатки систем меньшего объема и систем экспрессии на основе животных клеток.
СПРАВОЧНЫЕ МАТЕРИАЛЫ
Ма, J. K. С., Drake, P.M.W., и Christou, P. (2003) Nature reviews 4, 794-805
Патентная заявка США №2005/0282269 на имя Проулкса и др. (Proulx et al.)
Патентная заявка США №2005/0272146 на имя Ходжа и др. (Hodge et al.)
Патент США №6,432,698 на имя Гоглера и др. (Gaugler et al.)
Шлатманн и др. (Schlatmann et al.), Biotech. Bioeng., 1995; 45:435-39
Намдев и Дулоп (Namdev and Dulop), App. Biochem and Biotech, Part A, Frontiers in Bioprocessing, 1995
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КУЛЬТИВИРОВАНИЯ АДГЕЗИОННЫХ КЛЕТОК | 2010 |
|
RU2612154C2 |
| ПРОДУЦИРОВАНИЕ ВЫСОКОМАННОЗНЫХ БЕЛКОВ В РАСТИТЕЛЬНЫХ КУЛЬТУРАХ | 2009 |
|
RU2535342C2 |
| ПРОДУЦИРОВАНИЕ ВЫСОКОМАННОЗНЫХ БЕЛКОВ В РАСТИТЕЛЬНЫХ КУЛЬТУРАХ | 2004 |
|
RU2385928C2 |
| СПОСОБ ПЕРФУЗИОННОЙ ФИЛЬТРАЦИИ ДЛЯ НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ КУЛЬТУР КЛЕТОК | 2022 |
|
RU2794425C1 |
| МАЛОМАСШТАБНЫЙ СПОСОБ КУЛЬТИВИРОВАНИЯ СУСПЕНДИРОВАННЫХ КЛЕТОК | 2016 |
|
RU2730656C2 |
| СИСТЕМА ПЕРФУЗИОННОЙ ФИЛЬТРАЦИИ ДЛЯ НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ КУЛЬТУР КЛЕТОК | 2022 |
|
RU2800874C1 |
| МЕТОДИКА КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2017 |
|
RU2709378C1 |
| УЛУЧШЕННАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2011 |
|
RU2563353C2 |
| УЛУЧШЕННАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2011 |
|
RU2798069C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2018 |
|
RU2758674C2 |





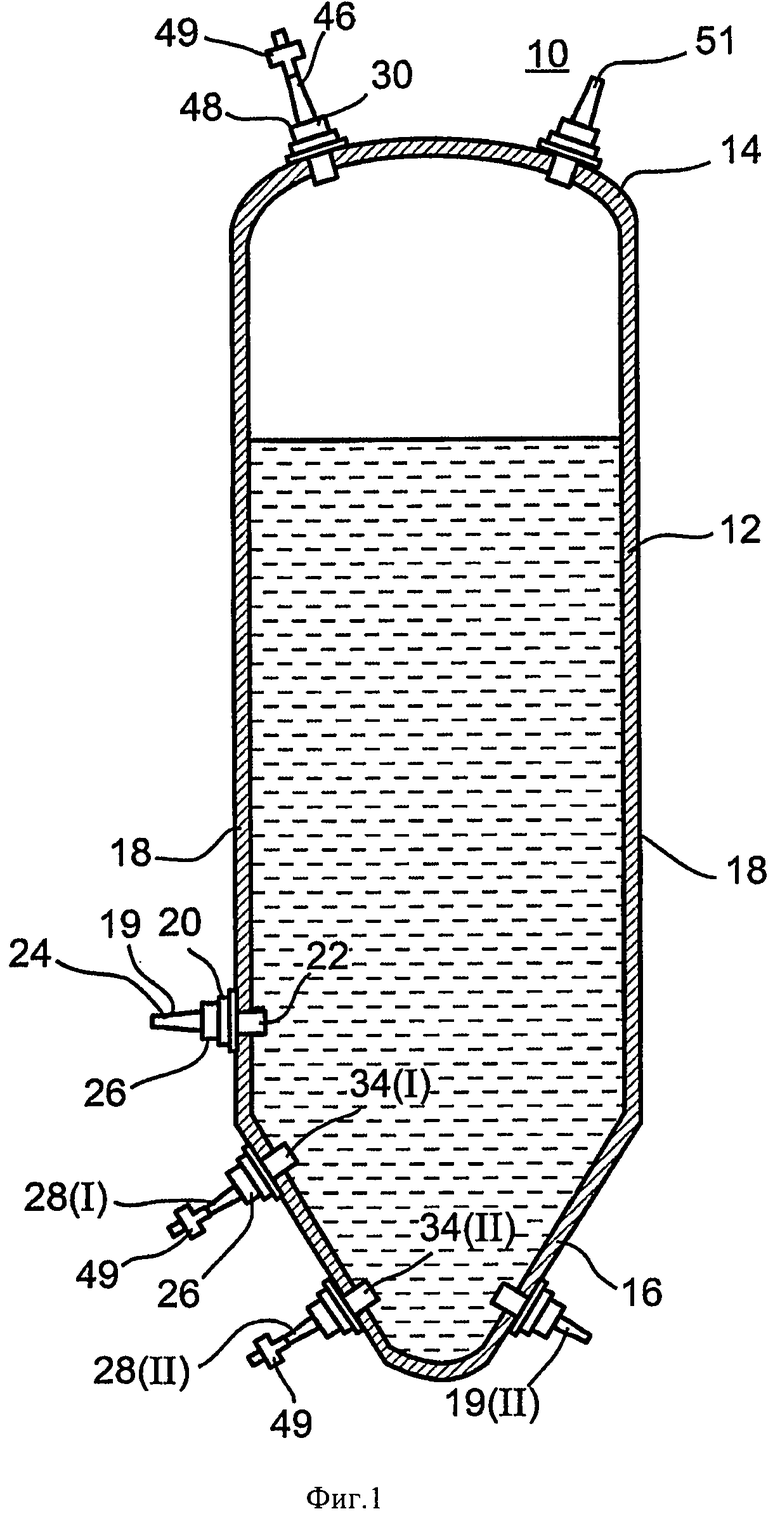
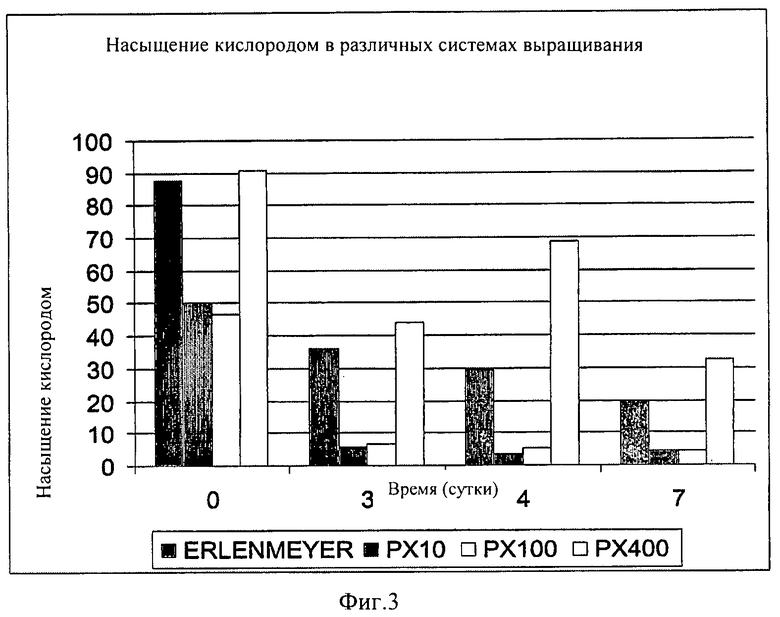
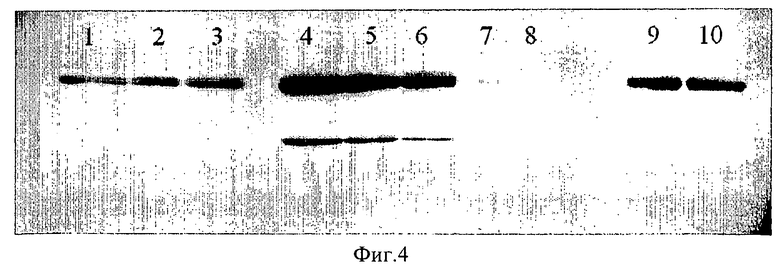
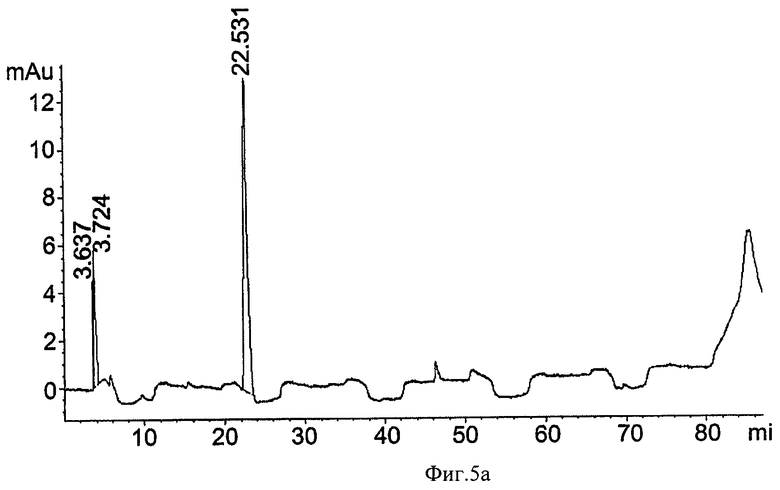
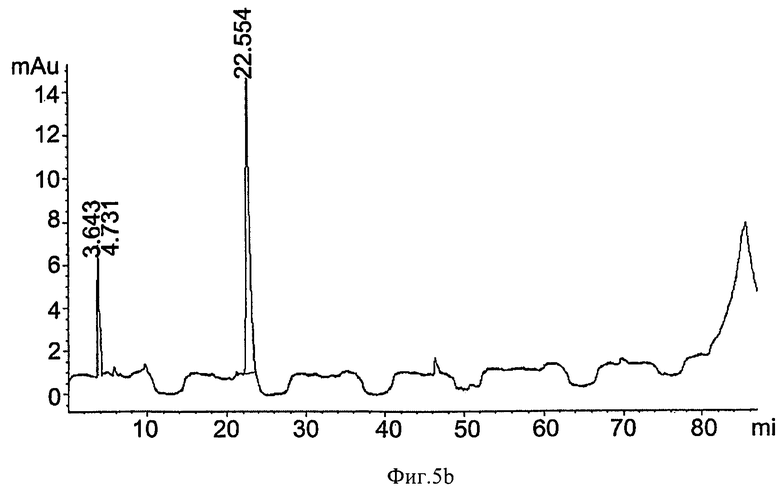


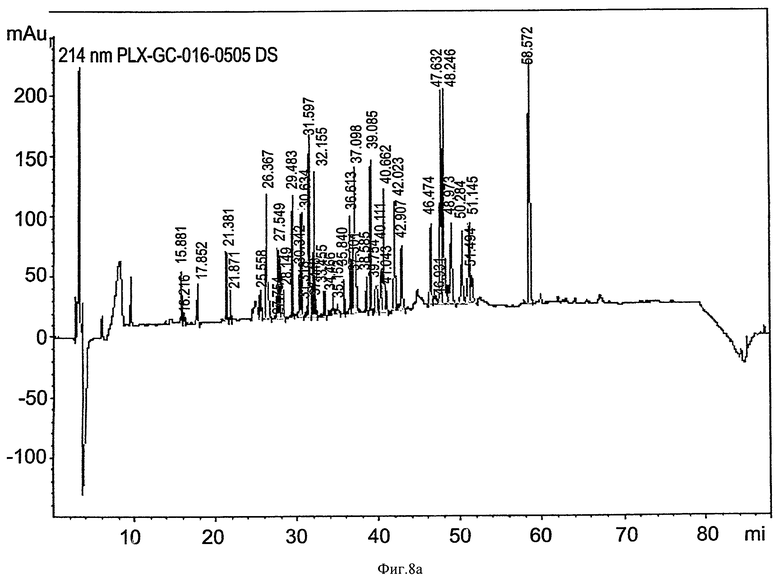

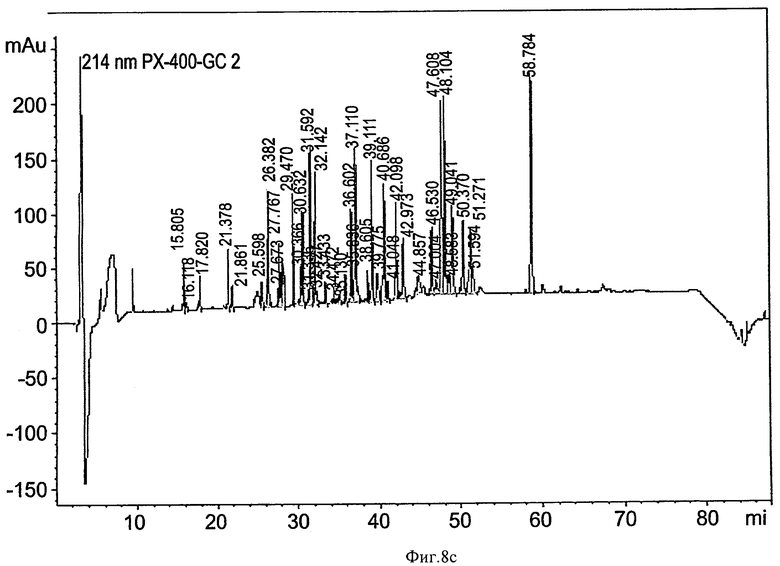
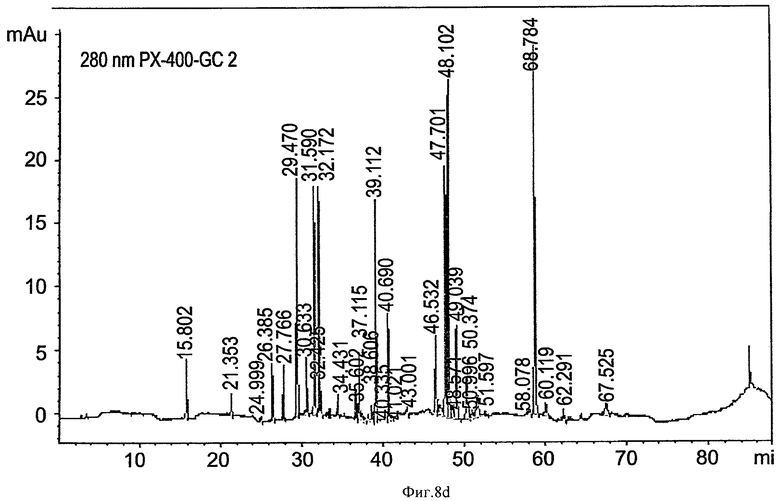
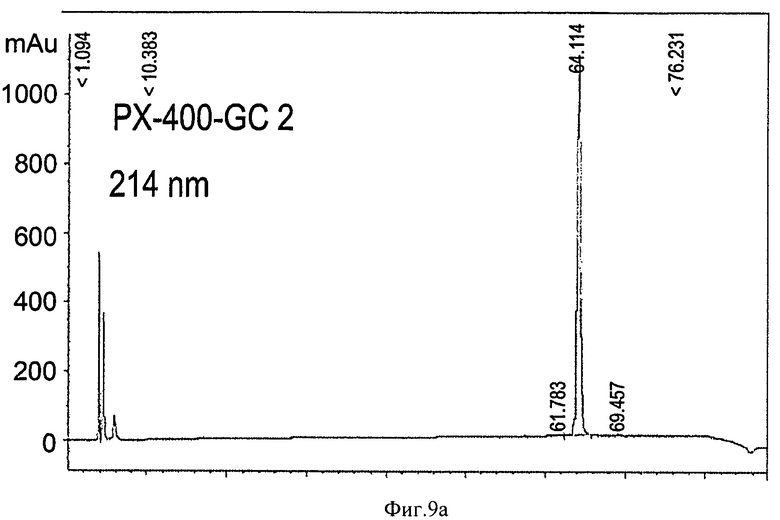
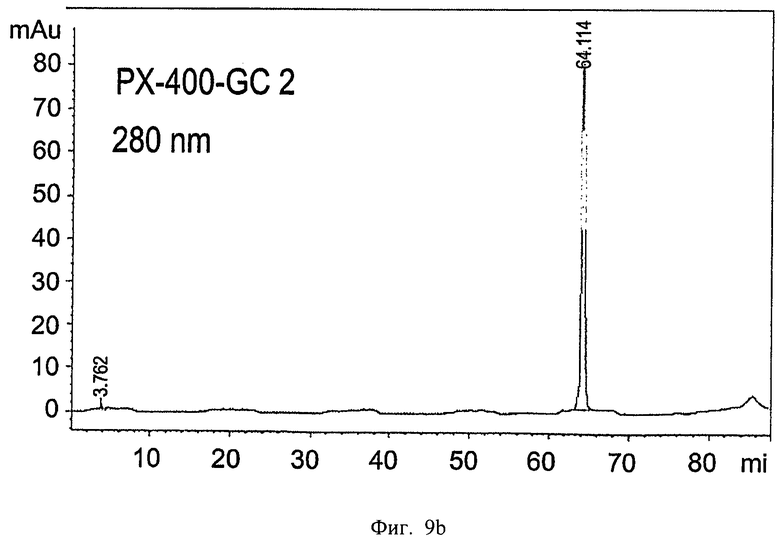
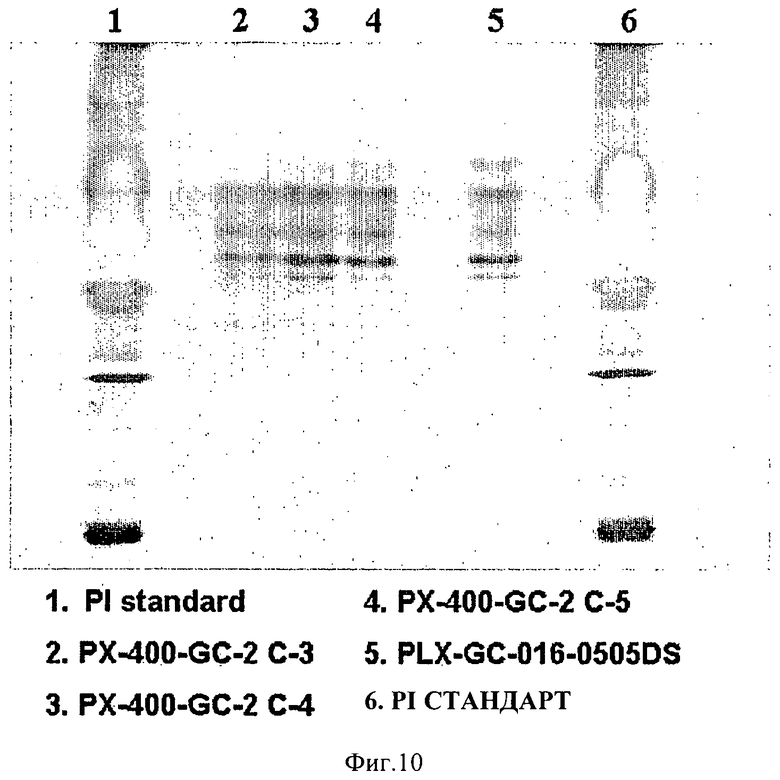
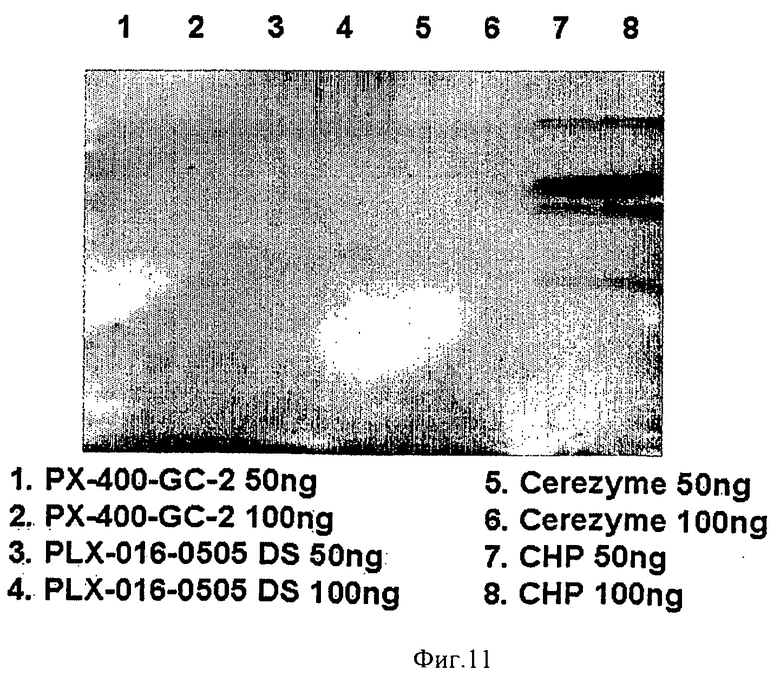



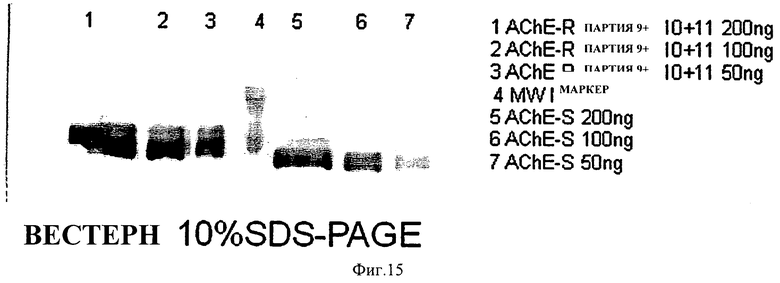
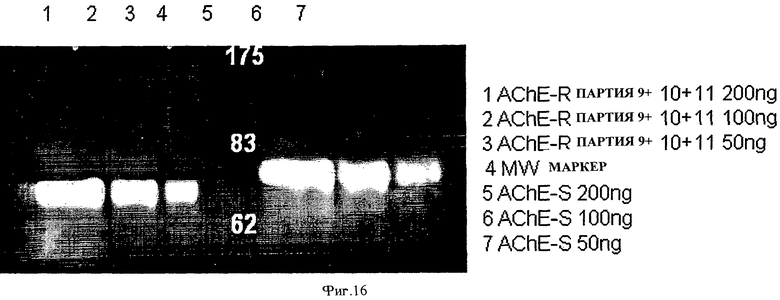
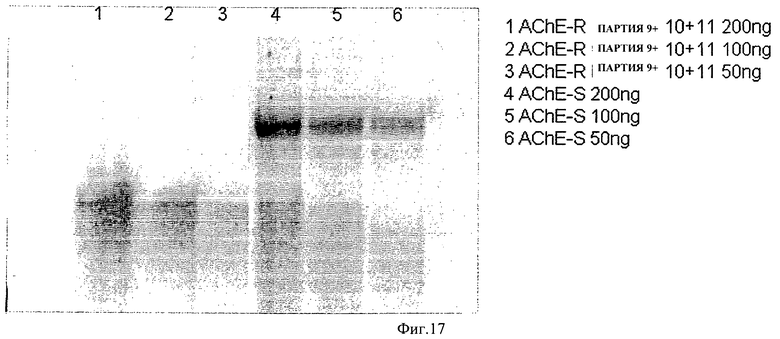
Группа изобретений относится к области биотехнологии, в частности, для культивирования клеток/тканей, а также клеток растений. Одноразовое устройство для культивирования и сбора растительной ткани и/или клеток содержит нежесткую емкость объемом не менее 400 л, имеющую каналы газообмена и канал сбора. Устройство выполнено с возможностью использования непрерывно в течение по меньшей мере двух последовательных циклов культивирования/сбора при значении или диапазона значений параметров, выбираемых по меньшей мере из одних следующих значений или диапазонов значений: отношение высоты к объему приблизительно от 0,06 до 1 см/л; давление газа на входе приблизительно от 1 бар до 5 бар; плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на кв.м до 70 входов на кв.м; скорость аэрации на входе приблизительно от 0,05 до 0,12 объема газа на объем среды в минуту; объем пузыря газа на входе приблизительно от 20 куб.мм до 1800 куб.мм. В способе и системе культивирования и сбора растительной ткани и/или растительных клеток использовано одноразовое устройство. Изобретения позволяют обеспечить повышенный выход целевого продукта при одновременном снижении стоимости. 3 н. и 18 з.п. ф-лы, 7 табл., 17 ил.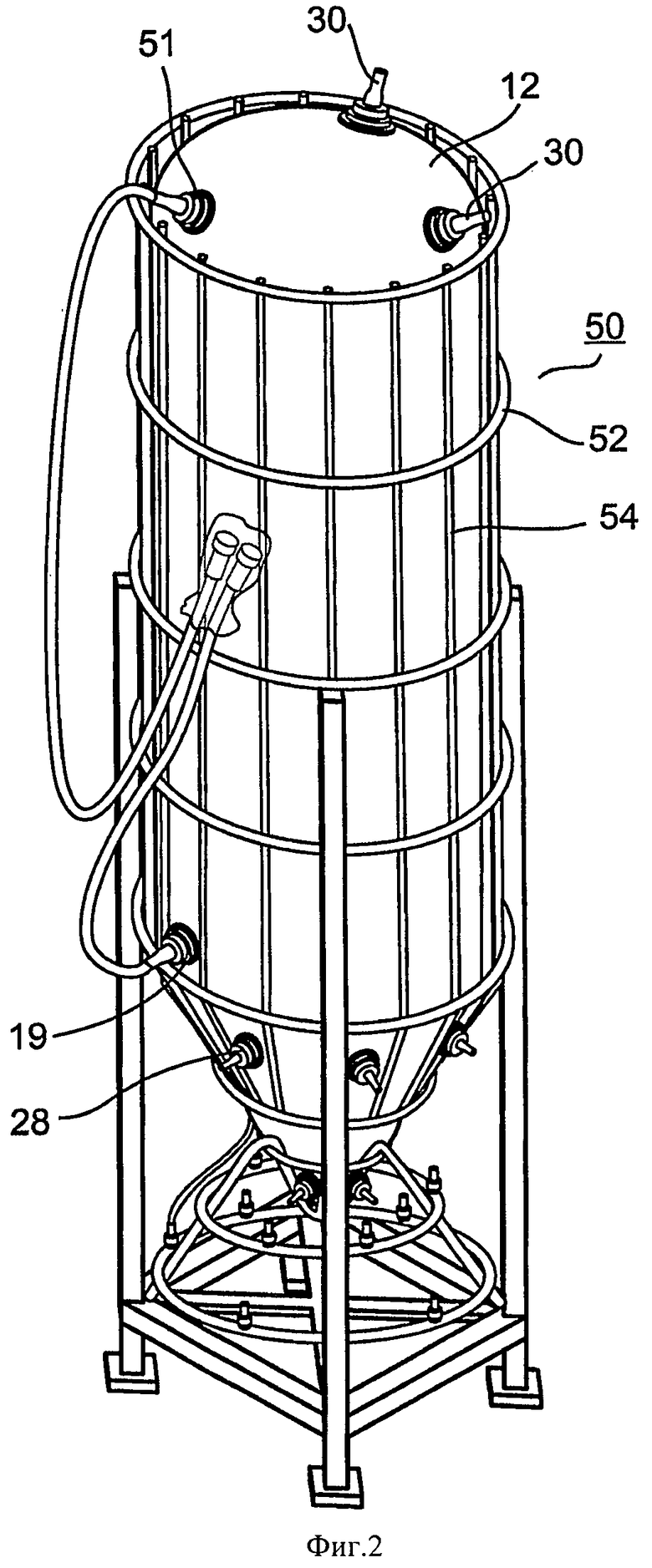
1. Одноразовое устройство для культивирования и сбора растительной ткани и/или клеток, содержащее нежесткую емкость объемом по меньшей мере 400 л и снабженную каналами газообмена и каналом сбора, позволяющим использовать упомянутое устройство непрерывно в течение по меньшей мере двух последовательных циклов культивирования/сбора, причем устройство разработано и выполнено так, что имеет значения или диапазон значений параметров, выбираемые по меньшей мере из одних следующих значений или диапазонов значений:
а) отношение высоты к объему приблизительно от 0,06 до 1 см/л,
b) давление газа на входе приблизительно от 1 бар до 5 бар,
с) плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на м2 до 70 входов на м2,
d) скорость аэрации на входе приблизительно от 0,05 до 0,12 объема газа на объем среды в минуту и
е) объем пузыря газа на входе приблизительно от 20 мм3 до 1800 мм3.
2. Одноразовое устройство по п.1, отличающееся тем, что упомянутое насыщение кислородом составляет по меньшей мере 15% объема на объем жидкости, содержащейся в упомянутой емкости.
3. Устройство по п.2, отличающееся тем, что упомянутое отношение высоты к объему составляет приблизительно 0,44 см/л.
4. Устройство по п.1, отличающееся тем, что упомянутое давление газа на входе составляет приблизительно от 1,5 бар до 2,5 бар.
5. Устройство по п.1, отличающееся тем, что упомянутая скорость аэрации составляет приблизительно от 0,07 до 0,10 объема газа на объем среды в минуту.
6. Устройство по п.1, кроме того, содержащее опорную конструкцию для поддержки упомянутого устройства, причем упомянутая опорная конструкция включает жесткую цилиндрическую раму, имеющую коническое основание.
7. Устройство по п.1, отличающееся тем, что упомянутое днище имеет форму в сущности усеченного конуса.
8. Устройство по любому из пп.1-7, отличающееся тем, что аэрация и перемешивание среды для культуры не осуществляется крыльчаткой.
9. Устройство по п.1, отличающееся тем, что упомянутое отношение высоты к объему составляет приблизительно 0,44 см/л и упомянутое давление газа на входе составляет приблизительно от 1 бар до 5 бар.
10. Устройство по п.1, отличающееся тем, что упомянутое отношение высоты к объему составляет приблизительно 0,44 см/л и плотность газовых входов на площадь поперечного сечения приблизительно от 20 входов на м2 до 70 входов на м2.
11. Устройство по п.1, отличающееся тем, что упомянутое отношение высоты к объему составляет приблизительно 0,44 см/л и упомянутая скорость аэрации на входе приблизительно от 0,07 до 0,12 объема газа на объем среды в минуту.
12. Устройство по п.1, отличающееся тем, что упомянутое отношение высоты к объему составляет приблизительно 0,44 см/л, упомянутое давление газа на входе составляет приблизительно от 1,5 бар до 2,5 бар, плотность газовых входов на площадь поперечного сечения приблизительно 55 входов на м2, и упомянутая скорость аэрации на входе приблизительно от 0,07 до 0,12 объема газа на объем среды в минуту.
13. Устройство по п.1, где упомянутый контейнер имеет внутренний наполняемый объем от 400 л до 30000 л.
14. Устройство по п.1, где упомянутый контейнер имеет внутренний наполняемый объем от 500 л до 8000 л.
15. Устройство по п.1, где упомянутый контейнер имеет внутренний наполняемый объем 1000 л.
16. Способ культивирования и сбора растительной ткани и/или растительных клеток в объеме больше 400 л, причем способ включает:
(a) предоставление одноразовой нежесткой емкости по любому из пп.1-8,
(b) подачу инокулянта через упомянутый канал сбора,
(c) подачу стерильной среды для культуры и/или стерильных добавок,
(d) освещение, по желанию, упомянутой емкости наружным светом и
(e) выращивание упомянутых клеток и/или ткани в упомянутой среде до требуемого выхода.
17. Система культивирования растительных клеток, включающая устройство по любому из пп.1-8, причем среда для культивирования подходит для культивирования упомянутой растительной ткани и/или клеток, и суспензию растительных клеток или культуры ткани, выращиваемых в упомянутой среде.
18. Система культивирования растительных клеток по п.17, отличающаяся тем, что упомянутые растительные клетки экспрессируют рекомбинантный белок.
19. Система культивирования растительных клеток по п.18, отличающаяся тем, что упомянутые растительные клетки выбирают из группы, состоящей из трансформированных Agrobacterium rihzogenes клеток корня, клеток сельдерея, клеток имбиря, клеток хрена, клеток табака и клеток моркови.
20. Система культивирования растительных клеток по одному из пп.18 или 19, отличающаяся тем, что упомянутые клетки экспрессируют человеческую рекомбинантную ацетилхолинэстеразу.
21. Система культивирования растительных клеток по п.20, отличающаяся тем, что упомянутой человеческой рекомбинантной ацетилхолинэстеразой является ацетилхолинэстераза-R.
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| SU 6432698 В1, 13.08.2002 | |||
| RU 2006147234 A, 20.07.2008. | |||
Авторы
Даты
2012-11-27—Публикация
2008-05-05—Подача