Перекрестные ссылки на связанные заявки
По настоящей заявке испрашивается приоритет предварительной заявки США № 60/879904, поданной 11 января 2007, которая этим включена сюда в качестве ссылки в полном объеме.
Область изобретения
Изобретение относится к использованию неочищенного глицерина в качестве источника углерода для роста клеток в культуре и производства белков в таких клеточных культурах.
Предпосылки изобретения
В определенных молекулярных биотехнологических способах клетки растут в средах для культивирования и используются для производства желаемых белков. Производимые желаемые белки могут быть выделены и использованы во множестве промышленных и медицинских применений. Например, желаемый белок можно использовать в качестве терапевтического белка, такого как антитело или фермент, и использовать в промышленных применениях, таких как применение для очистки (например, прачечных детергентов), применение при производстве бумаги, применение для кормления животных, применение при выпекании хлеба, способы гидролиза крахмала и другие способы, которые требуют больших количеств специального фермента.
Производство больших количеств белка с использованием рекомбинантных клеток или нерекомбинантных клеток часто требует, чтобы клетки культивировались в среде, содержащей источник углерода, источник азота и другие питательные вещества, например аминокислоты, витамины, минералы и т.д., которые требуются для роста этих клеток. Многие клеточные культуры содержат в себе глюкозу или комбинацию из глюкозы и других субстратов в качестве источника углерода в клеточной культуре или в качестве кормового субстрата в клеточной культуре.
Настоящее изобретение относится к альтернативному источнику углерода для использования в клеточных культурах. Здесь исследователи раскрывают, что добавление неочищенного глицерина в питательные среды или в качестве единственного источника углерода или в сочетании с другими сахарами (например, глюкозой) можно использовать в качестве источника углерода для производства желаемых белков посредством роста клеток в культурах. Использование неочищенного глицерина в культурах клеток принесет огромную коммерческую выгоду.
Краткое изложение сущности изобретения
Предоставлена среда для культивирования, содержащая неочищенный глицерин. В определенных вариантах осуществления неочищенный глицерин может быть единственным источником углерода среды. В других вариантах осуществления среда для культивирования может содержать, в дополнение к неочищенному глицерину, один или несколько вторичных источников углерода, таких как 6-углеродные сахара, включая в качестве неограничивающих примеров глюкозу, галактозу, фруктозу, сорбозу и маннозу, или комбинацию 6-углеродных сахаров, таких как глюкоза и фруктоза (сахароза), целлюлоза, лактоза и т.п. В других вариантах осуществления среда для культивирования может содержать, в дополнение к неочищенному глицерину, один или несколько вторичных источников углерода, таких как источники белка (например, соя и/или зерновые).
Предоставлена клеточная культура, содержащая целевую среду для культивирования, содержащую неочищенный глицерин. В определенных вариантах осуществления клеточная культура включает: множество клеток, которые в конкретных вариантах осуществления могут содержать рекомбинантную нуклеиновую кислоту для производства желаемого белка, и среда для культивирования содержит неочищенный глицерин. В определенных вариантах осуществления клетки клеточной культуры могут представлять собой бактериальные клетки или клетки грибов. Рекомбинантная нуклеиновая кислота может содержать экспрессирующую кассету, содержащую в оперативной связи: a) промоторный участок, b) кодирующий участок, кодирующий желаемый белок; и c) терминирующий участок.
Белок, продуцируемый рекомбинантными клетками может быть нативным по отношению к клеткам или гетерологичным по отношению к клеткам, и, в определенных вариантах осуществления, белок может являться внутриклеточным или секретироваться из клеток в среду для культивирования. Например, белок может представлять собой промышленный фермент, терапевтический белок, репортерный белок, селективный маркер, пищевую добавку или продукт питания.
Также предоставлен способ производства белка. В общих терминах, этот способ включает в себя поддержание описанной выше клеточной культуры с целью обеспечения производства желаемого белка. В определенных случаях белок может быть выделен из среды для культивирования.
Описанная выше содержащая неочищенный глицерин среда для культивирования может быть изготовлена комбинированием, например смешиванием, неочищенного глицерина с другими компонентами, требующимися для роста клеток, например источником азота и других питательных веществ и воды.
В некоторых вариантах осуществления описанная выше клеточная культура может быть изготовлена комбинированием, например смешиванием: a) неочищенного глицерина и b) культуры клеток, содержащих нуклеиновую кислоту (например, рекомбинантную нуклеиновую кислоту) для производства желаемого белка. В других вариантах осуществления описанная выше клеточная культура может быть изготовлена комбинированием (например, инокуляцией) среда для культивирования клеток, содержащей неочищенный глицерин, с клетками, которые содержат рекомбинантную нуклеиновую кислоту для производства белка. Способы культивирования могут представлять собой культивирование в замкнутом объеме, подпитываемое культивирование, или способы непрерывного культивирования.
Краткое описание чертежей
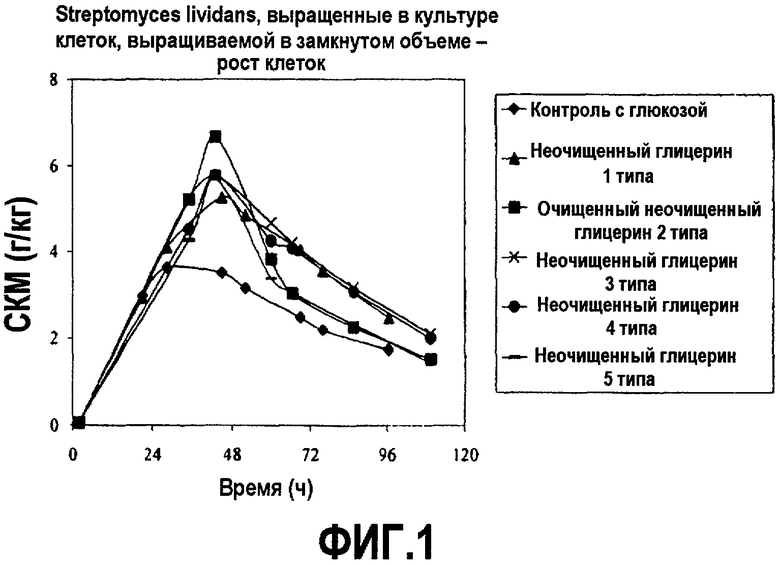
Фиг.1 изображает рост клеточной массы клеток рекомбинантного Streptomyces lividans в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени (DCW; граммы клеток/кг), культивируемой в среде, содержащей неочищенный глицерин или глюкозу, как описано в примере 1.
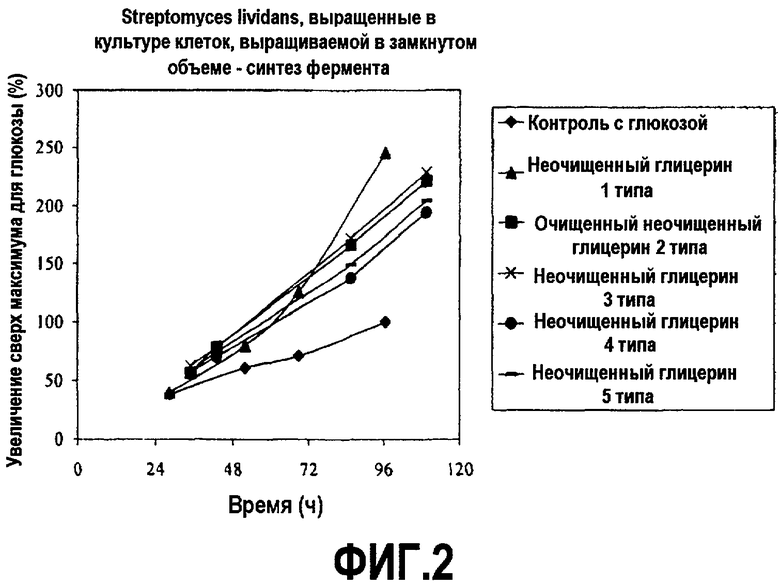
Фиг.2 изображает количество целлюлазы, секретированной с помощью Streptomyces lividans, выращенными в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени, культивированной в среде, содержащей неочищенный глицерин или глюкозу (% увеличения относительно максимальной глюкозы), как описано в примере 1. Все точки на графике изображены по отношению к самому высокому уровню белка, произведенному в среде с глюкозой, который взят за 100%.
Фиг.3 изображает рост клеточной массы рекомбинантных клеток Streptomyces lividans в подпитываемой культуре клеток в зависимости от времени (DCW; граммы клеток/кг), культивированных в среде, содержащей неочищенный глицерин или глюкозу, как описано в примере 2.
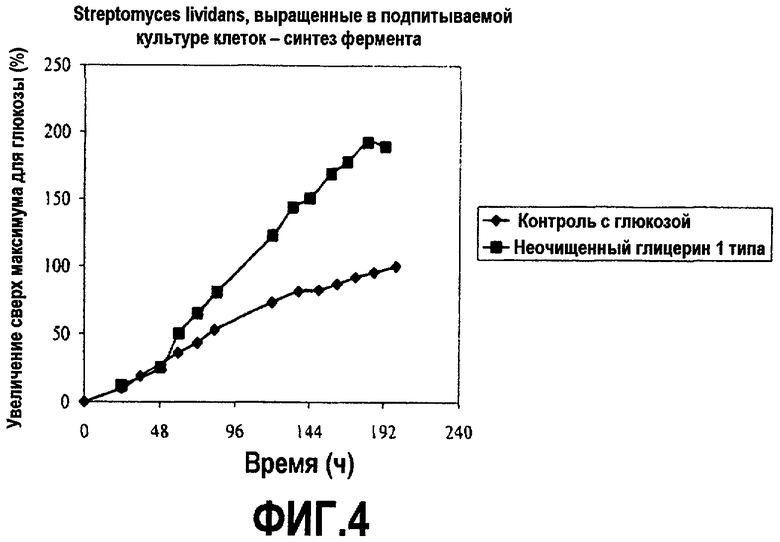
Фиг.4 изображает количество целлюлазы, секретированной с помощью Streptomyces lividans, выращенных в подпитываемой культуре клеток в зависимости от времени, культивированных в среде, содержащей неочищенный глицерин или глюкозу (% увеличения относительно максимальной глюкозы), как описано в примере 2. Все точки на графике изображены по отношению к самому высокому уровню белка, произведенного в среде с глюкозой, который взят за 100%.
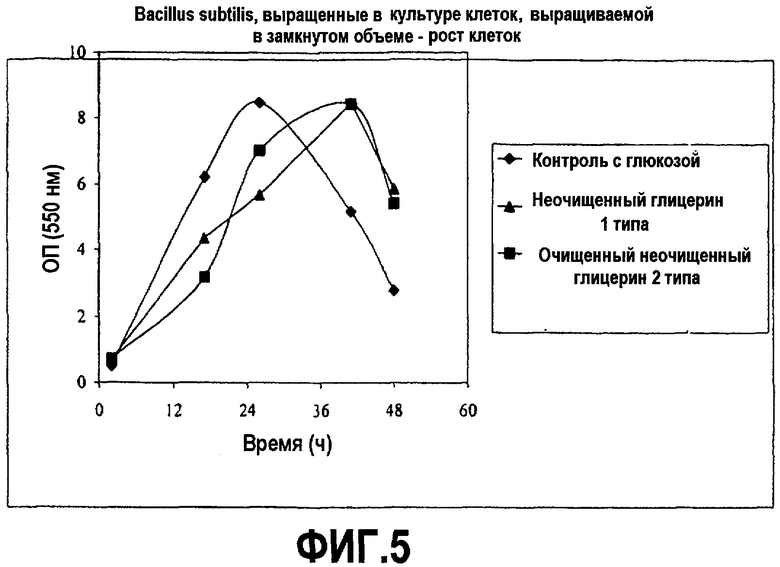
Фиг.5 изображает рост клеточной массы рекомбинантных клеток Bacillus subtilis, выросших в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени (оптическая плотность при 550 нм), культивированных в среде, содержащей неочищенный глицерин или глюкозу, как описано в примере 3.
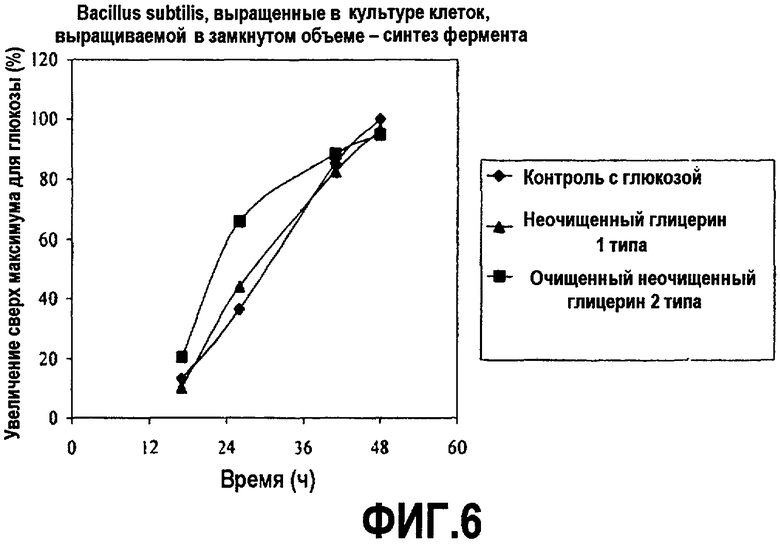
Фиг.6 изображает количество протеазы, секретированной с помощью Bacillus subtilis, выросших в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени, культивированных в среде, содержащей неочищенный глицерин или глюкозу (% увеличения относительно максимальной глюкозы), как описано в примере 3. Все точки на графике изображены по отношению к самому высокому уровню белка, произведенного в среде с глюкозой, который принят за 100%.
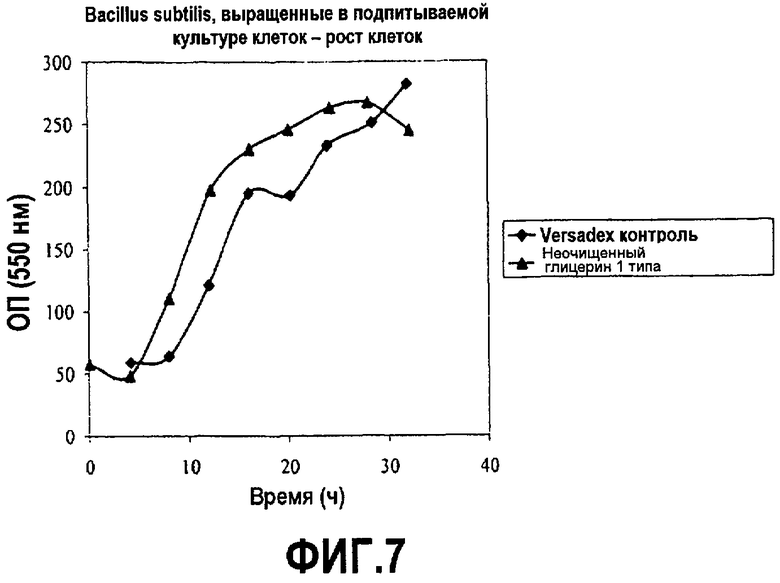
Фиг.7 изображает рост клеточной массы рекомбинантных клеток Bacillus subtilis, выросших в подпитываемой культуре клеток, в зависимости от времени (оптическая плотность при 550 нм), культивированных в среде, содержащей неочищенный глицерин или глюкозу, как описано в примере 4.
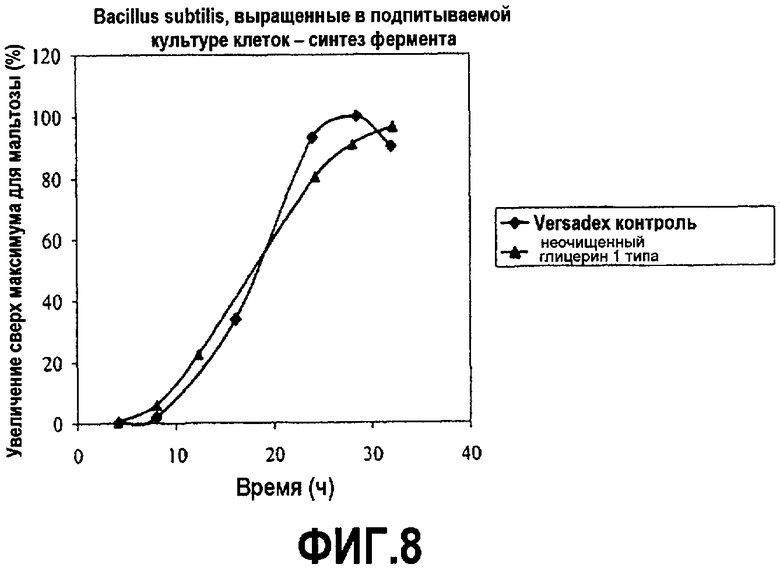
Фиг.8 изображает количество протеазы, секретированной с помощью Bacillus subtilis, выросших в подпитываемой культуре клеток, в зависимости от времени, культивированных в среде, содержащей неочищенный глицерин или глюкозу (versadex) (% увеличения относительно максимума versadex), как описано в примере 4. Все точки на графике изображены по отношению к самому высокому уровню белка, произведенного в среде с versadex, который принят за 100%.
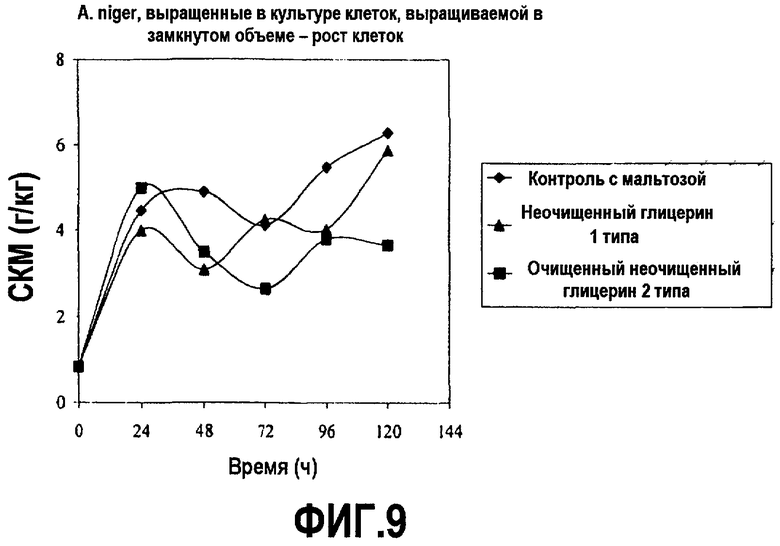
Фиг.9 изображает рост клеточной массы нерекомбинантных клеток Aspergillus niger, выросших в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени (DCW; граммы клеток/кг), культивированных в среде, содержащей неочищенный глицерин или мальтозу, как описано в примере 6.
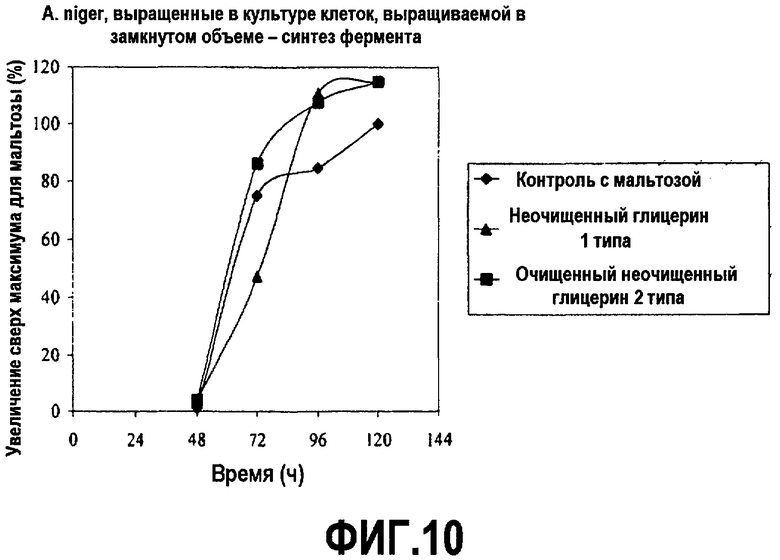
Фиг.10 изображает количество глюкоамилазы, секретированной с помощью Aspergillus niger, выращенных в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени, культивированных в среде, содержащей неочищенный глицерин или мальтозу (% увеличения максимума мальтозы), как описано в примере 6. Все точки на графике изображены по отношению к самому высокому уровню белка, произведенного в среде с мальтозой, который принят за 100%.
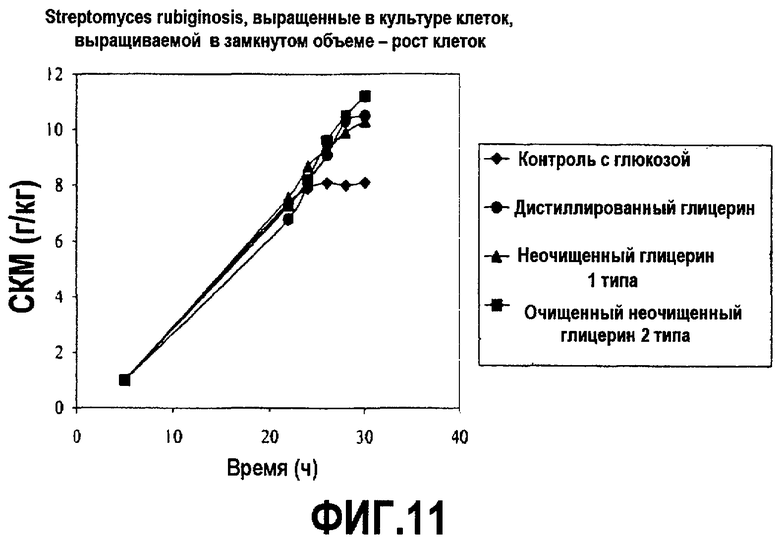
Фиг.11 изображает рост клеточной массы рекомбинантных клеток Streptomyces rubigenosis, выросших в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени (DCW; граммы клеток/кг), культивированных в среде, содержащей неочищенный глицерин или глюкозу, как описано в примере 7.
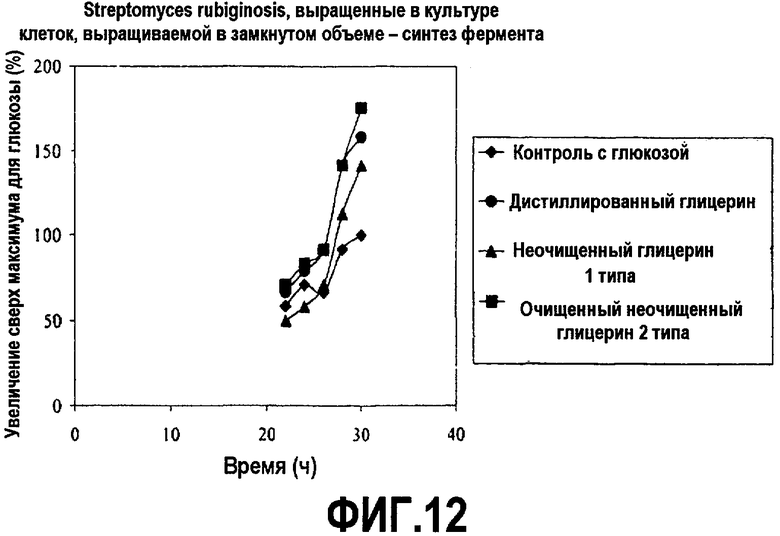
Фиг.12 изображает количество внутриклеточной глюкозоизомеразы, секретированной с помощью Streptomyces rubigenosis, выросших в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени, культивированных в среде, содержащей неочищенный глицерин или глюкозу (% увеличения относительно максимальной глюкозы), как описано в примере 7. Все точки на графике изображены по отношению к самому высокому уровню белка, произведенного в среде с глюкозой, который принят за 100%.
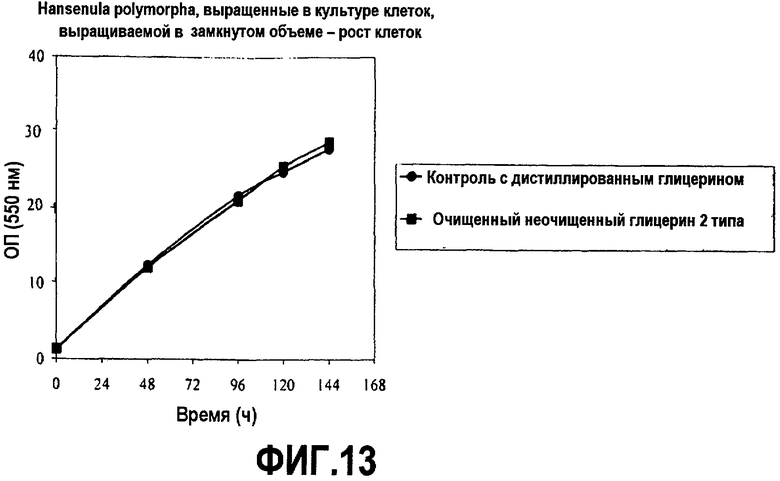
Фиг.13 изображает рост клеточной массы рекомбинантных клеток Hansenula polymorpha, выросших в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени (оптическая плотность при 550 нм), культивированных в среде, содержащей дистиллированный или неочищенный глицерин, как описано в примере 8.
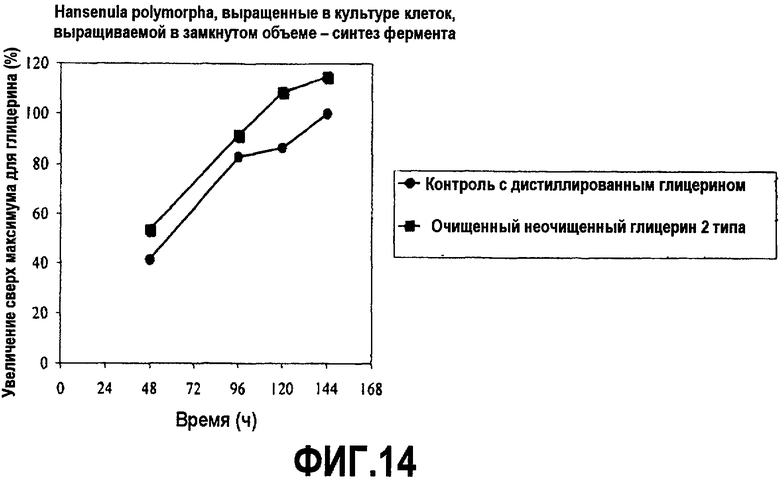
Фиг.14 изображает количество липазы, секретированной с помощью Hansenula polymorpha, выросших в культуре клеток, выращиваемой в замкнутом объеме, в зависимости от времени, культивированных в среде, содержащей дистиллированный или неочищенный глицерин (% увеличения относительно максимального глицерина), как описано в примере 8. Все точки на графике изображены по отношению к самому высокому уровню белка, произведенного в среде с дистиллированным глицерином, который принят за 100%.
Подробное описание
Определения
Пока здесь не определено обратное, все технические и научные термины, использованные здесь, обладают теми же значениями, что и в обычном понимании специалиста в данной области, к которой принадлежит это изобретение. Singleton, et al, DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994), и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991) предоставляют с помощью общих словарей значения для многих терминов, использованных в этом изобретении. Также дается ссылка на Atkinson et al., Biochemical Engineering and Biotechnology Handbook, 2nd Ed, Stockton Press (1991) в качестве основной ссылки. Несмотря на то, что можно использовать любые способы и материалы, схожие или равнозначные таковым, описываемым в настоящем документе, в осуществлении или тестировании по настоящему изобретению, предпочтительные способы и материалы описаны.
Все патенты и публикации, включая все последовательности, раскрытые в этих патентах и публикациях, упомянутые здесь, в прямой форме включены по ссылке.
Числовые диапазоны включают числа, ограничивающие диапазон. Если не указано иначе, нуклеиновые кислоты написаны слева направо в направлении от 5' к 3'; аминокислотные последовательности написаны слева направо в направлении от амино к карбокси соответственно.
Предоставленные здесь заголовки не являются ограничениями для множества аспектов или вариантов осуществления изобретения, которые могут быть включены по ссылке в описание в качестве целого. Таким образом, термины, определенные непосредственно ниже, являются в описании наиболее полно определенными по ссылке в качестве целого.
«Глицерин» относится к (C3H8O3) 1,2,3-пропану, также известному как 1,2,3-тригидроксипропан. Также термин взаимозаменяемо используется с «глицерином» и «глицерином».
Термин «неочищенный глицерин» определен здесь как водный раствор, обладающий % чистоты менее чем 99% (об./об.), например, по меньшей мере 25% и менее чем 95% глицерин (об./об.), от 95% до 98% глицерин (об./об.), от 95% до 99% глицерин (об./об.), или от 98% до 99% глицерин (об./об.).
Термин «очищенный глицерин», как применяют в настоящем документе, обозначает «неочищенный глицерин», содержащий менее чем 1% соли (мас./об.).
Термин «дистиллированный глицерин» определен здесь как водный раствор глицерина, обладающий % чистоты, равным 95% или более (об./об.) (больше чем приблизительно 95% и до 100% глицерина (об./об.)).
Термин «среда для культивирования» определен здесь как искусственная смесь, жидкая или твердая, которая содержит источник углерода, источник азота другие питательные вещества, например, аминокислоты, витамины, минералы и т.д., необходимые для культивирования клеток. Среда для культивирования не содержит клетки. Среда для культивирования может инокулироваться с клетками для производства клеточной культуры, которая содержит клетки и среду для культивирования.
Термины «клеточная культура» и «культура клеток» используют взаимозаменяемо для описания жидкой смеси, содержащей живые клетки, обычно одного типа, и среду для культивирования. Клеточные культуры могут быть созданы инокуляцией среды для культивирования с клетками. Клетки клеточной культуры метаболически активны, однако они способны или не способны активно делиться или расти. Клеточная культура существует in vitro.
Термин «замкнутый объем» описывает клеточную культуру, выращиваемую в замкнутом объеме, к которой перед началом запуска цикла ферментации добавляют субстрат в твердой или в концентрированной жидкой форме. Культура клеток, выращиваемая в замкнутом объеме, запускается посредством инокуляции клеток в среду для культивирования без последующего внесения питательных веществ. Концентрации питательных веществ и метаболитов в среде для культивирования зависят от начальной концентрации в замкнутом объеме и последующего изменения смеси питательного корма в результате влияния клеточной ферментации. Термин «подпитываемая» описывает выращиваемую в замкнутом объеме клеточную культуру, к которой в ходе цикла ферментации периодически или непрерывно добавляют субстрат в твердой или концентрированной жидкой форме. Подпитываемая культура клеток инициируется посредством инокуляции клеток в среду, но в ней имеет место последующее внесение питательных веществ, например, внесение концентрированного питательного корма. Однако отсутствует систематическое удаление культуральной жидкости или клеток.
Термин «непрерывная клеточная культура» или «непрерывная культура» обозначает культуру, отличающуюся как непрерывным внесением жидкого питательного корма, так и непрерывным оттоком жидкости.
Термин «сосуд» обозначает любую пригодную емкость для культивирования клеток, включая, в качестве неограничивающих примеров, баки, бутылки, колбы, пакеты, биореакторы и любые другие пригодные резервуары для проведения способов по настоящему изобретению.
Термин «промоторы» определен здесь как нуклеиновая кислота, которая направляет в клетке транскрипцию нижележащего полинуклеотида. В определенных случаях полинуклеотид может содержать кодирующую последовательность и промоторы могут направлять транскрипцию кодирующей последовательности в транслируемую РНК.
Термин «изолированный» как определено в настоящем документе обозначает соединение, белок, клетку, последовательность нуклеиновой кислоты или аминокислот, которые удалены из, по меньшей мере, одного компонента, с которым они ассоциированы в естественных условиях.
Термин «кодирующая последовательность» определен здесь как нуклеиновая кислота, которая когда размещена под управлением соответствующей управляющей последовательности, включая промоторы, транскрибируется в мРНК, которая может транслироваться в полипептид. Кодирующая последовательность может содержать одну открытую рамку считывания или несколько открытых рамок считывания, например, разделенных интронами. Кодирующая последовательность может представлять собой, например, кДНК, геномную ДНК, синтетическую ДНК или рекомбинантную ДНК. Как правило, кодирующая последовательность начинается у инициирующего кодона (например, ATG) и заканчивается у терминирующего кодона (например, UAA, UAG и UGA).
Термин «рекомбинант» относится к полинуклеотиду или полипептиду, который не встречается в клетке-хозяине в естественных условиях. Рекомбинантная молекула может содержать две или более встречающихся в природе последовательности, которые соединены вместе в порядке, не встречающемся в естественных условиях.
Термин «гетерологичные» относится к элементам, которые соединены друг с другом неестественным образом. Например, если рекомбинантная клетка-хозяин синтезирует гетерологичный белок, этот белок не производится в немутантной клетке-хозяине того же типа, гетерологичные промоторы представляют собой промоторы, которые не присутствуют в нуклеиновой кислоте, которая является эндогенной для дикого типа клетки-хозяина, и промоторы, функционально связанные с гетерологичной кодирующей последовательностью, представляют собой промоторы, которые функционально связаны с кодирующей последовательностью, с которой они обычно функционально не связаны в немутантной клетке-хозяине.
Термин «функционально связан» относится к расположению элементов, которое позволяет им находиться в функциональной связи. Например, промоторы функционально связаны с кодирующей последовательностью, если они управляют транскрипцией последовательности, и сигнальная последовательность функционально связана с белком, если сигнальная последовательность направляет белок через систему секреции клетки-хозяина.
Термин «нуклеиновая кислота» включает в себя ДНК, РНК, одинарные или двойные цепочки и их модификации. Здесь термины «нуклеиновая кислота» и «полинуклеотид» можно использовать взаимозаменяемо.
Термин «ДНК-конструкция», как применяют в настоящем документе, обозначает последовательность нуклеиновой кислоты, которая включает по меньшей мере два полинуклеотидных фрагмента ДНК.
Как применяют в настоящем документе, термин «репортер» относится к белку, который легко обнаруживается и измеряется. В определенных случаях, репортер может быть определен оптически, например, с помощью флуоресценции, люминесценции или колориметрически.
Как применяют в настоящем документе, термин «селективный маркер» относится к биополимеру, полипептиду или полинуклеотиду, который позволяет выбирать клетки-хозяев, которые содержат биополимер, из других клеток, которые не содержат биополимер. Селективные маркеры обеспечивают устойчивость к токсичным соединениям, таким как антибиотики, гербициды и т.п.
Термин «сигнальная последовательность» или «сигнальный пептид» относится к последовательности аминокислот в положении на N-конце белка, которая облегчает секрецию зрелой формы белка из клетки. У зрелой формы внеклеточного белка отсутствует сигнальная последовательность, которая отщепляется в ходе процесса секреции.
Термин «вектор» определен здесь как полинуклеотид, созданный для переноса последовательности нуклеиновой кислоты, подлежащей введению в один или несколько типов клеток. Векторы включают клонирующие векторы, экспрессирующие векторы, челночные векторы, плазмиды, фаги или вирусные частицы, ДНК-конструкции, кассеты и т.п. Экспрессирующие векторы могут содержать регуляторные последовательности, такие как промоторы, сигнальные последовательности, кодирующие последовательности и терминаторы транскрипции.
«Экспрессирующий вектор», как применяют в настоящем документе, обозначает ДНК-конструкцию, содержащую кодирующую последовательность, которая функционально связана подходящими управляющими последовательностями, способными осуществлять экспрессию белка в подходящем хозяине. Такие управляющие последовательности могут включать в себя промоторы для осуществления транскрипции, дополнительные операторные последовательности для управления транскрипцией, последовательность, кодирующую соответствующий сайт связывания с рибосомой, энхансеры и последовательности, которые управляют терминацией транскрипции и трансляции.
Как применяют в настоящем документе, термины «полипептид» и «белок» используется взаимозаменяемо и включает в себя указание на полимер из любого числа аминокислотных остатков. Термины применяются к полимерам аминокислот, в которых один или несколько аминокислотных остатков являются искусственными химическими аналогами соответствующих встречающихся в природе аминокислот, а также к встречающимся в природе полимерам аминокислот. Термины также применяются к полимерам, содержащим консервативные аминокислотные замены, такие чтобы полипептид оставался функциональным. «Пептиды» представляют собой полипептиды, имеющие менее чем 50 аминокислотных остатков.
«Клетка-хозяин» относится к соответствующему хозяину для экспрессирующего вектора, содержащего ДНК-конструкцию, кодирующую желаемый белок. Клетка-хозяин может относиться к любому типу клеток.
Термин «мицелиальные грибы» относится ко всем мицелиальным формам подразделения Eumycotina (см., Alexopoulos, C. J. (1962), INTRODUCTORY MYCOLOGY, Wiley, New York). Эти грибы характеризуются вегетативным мицелием с клеточной стенкой, состоящей из хитина, глюканов и других сложных полисахаридов. Мицелиальные грибы по настоящему изобретению морфологически, физиологически и генетически отличаются от дрожжей. Вегетативный рост мицелиальных грибов осуществляется посредством удлинения гифов и катаболизм углерода является облигатно аэробным.
«Непатогенный» штамм представляет собой штамм, который является непатогенным для человека.
Среды для культивирования
Как указано выше, предоставлена среда для культивирования, содержащая неочищенный глицерин. Среда для культивирования может содержать источник азота, неочищенный глицерин и другие питательные вещества, например аминокислоты, витамины, минералы и т.д., необходимые для культуры клеток. Неочищенный глицерин можно использовать в качестве источника углерода для клеток, выращиваемых в среде для культивирования.
В определенных вариантах осуществления среда для культивирования может содержать дополнительный источник углерода, например сахар, для роста клеток. Таким образом, в определенных вариантах осуществления неочищенный глицерин может являться единственным источником углерода для клеток. В других вариантах осуществления неочищенный глицерин может присутствовать вместе с одним или несколькими другими вторичными источниками углерода для клеток.
В образцовых вариантах осуществления неочищенный глицерин в среде для культивирования может обладать процентом чистоты глицерина, равным от 25% до 85% (об./об.); также от 25% до 50% (об./об.); также от 50% до 75% (об./об.); также от 75% до 85% (об./об.); также от 85% до 90% (об./об.), или также от 90% до менее чем 95% (об./об.). В некоторых вариантах осуществления неочищенный глицерин может обладать чистотой глицерина, равной от 95% до 98% (об./об.). В некоторых вариантах осуществления неочищенный глицерин может обладать чистотой глицерина, равной менее чем 99% (об./об.).
В определенных вариантах осуществления неочищенный глицерин может содержать соль (например, KCl или NaCl; натрия или калия сульфат, фосфат, или нитрат) в концентрации до 12% (мас./об.), например, в диапазоне от 1% до 10% (мас./об.); от 1% до 5% (мас./об.); от 5% до 8% (мас./об.) или от 8% до 12% (мас./об.). Очищенный глицерин содержит менее чем 1% соли (мас./об.), например, соль в концентрации в диапазоне от 0,01% до 0,1% (мас./об.), от 0,1% до 0,5% (мас./об.) или от 0,5% до менее чем 1% (мас./об.). В одном из вариантов осуществления неочищенный глицерин практически не содержит соли (от 0 до 0,01% или от 0 до 0,001% соли).
Несмотря на то, что в предпочтительных вариантах осуществления в средах для культивирования и клеточной культуре используется неочищенный глицерин, дистиллированный глицерин можно использовать в определенных вариантах осуществления. В некоторых вариантах осуществления дистиллированный глицерин, который определен как обладающий чистотой, равной 95% или более, может обладать чистотой, равной, по меньшей мере, 95% и менее чем 99,5% (об./об.), например, больше чем 95% до 97% глицерина (об./об.), от 97% до 99% глицерина (об./об.) или от 99% до менее чем 99,5% глицерина (об./об.). В некоторых вариантах осуществления дистиллированный глицерин, который используется в способах, включенных в изобретение, будет обладать чистотой, равной по меньшей мере 99,5%, например, по меньшей мере 99,6%, по меньшей мере 99,7% или по меньшей мере 99,9% глицерина (об./об.). Глицерин, обладающий % чистоты в пределах определенных выше диапазонов может обозначаться как технический сорт глицерина (например, от более чем 95% до менее чем 99,5%) и фармацевтический сорт глицерина (например, от по меньшей мере 99,5% глицерина до по меньшей мере 99,9% глицерина (об./об.).
Количество неочищенного глицерина, присутствующего в среде для культивирования, может значительно меняться в зависимости от используемых способов выращивания, например, выращены ли клетки в культуре клеток, выращиваемой в замкнутом объеме (например, в колбе с шейкером), непрерывной культуре или подпитываемой культуре клеток. В определенных вариантах осуществления среда для культивирования может содержать от 0,1% до 75% неочищенного глицерина (об./об.), например от 0,5% до 2% неочищенного глицерина (в особенности, если клеточная культура выращена непрерывным или подпитываемым способом, в которых источник углерода быстро используется клетками, культивируемыми в среде, от 2% до 5% неочищенного глицерина, от 5% до 10% неочищенного глицерина, от 10% до 30% неочищенного глицерина, от 30% до 50% неочищенного глицерина или от 50% до 75% неочищенного глицерина. В некоторых вариантах осуществления концентрация неочищенного глицерина является любой примерно от 0,1, 0,5, 1, 5, 10, 15, 20, или 25% (об./об.) примерно до 50, 55, 60, 65, 70, 75, или 80% (об./об.). В некоторых вариантах осуществления клетки выращены в процессе с периодической ферментацией, и среда для культивирования содержит примерно от 1% приблизительно до 5% неочищенного глицерина (об./об.). В некоторых вариантах осуществления, клетки выращены в подпитываемом процессе с периодической ферментацией и среда для культивирования содержит примерно от 20% приблизительно до 50% неочищенного глицерина (об./об.).
Если вторичный источник углерода присутствует в среде для культивирования, вторичный источник углерода может представлять собой сахар, например глюкозу, галактозу, фруктозу, мальтозу, ксилозу, арабинозу, декстрозу или сахарозу и т.д. Если вторичный источник углерода присутствует в среде для культивирования, вторичный источник углерода и неочищенный глицерин могут присутствовать в относительных молярных концентрациях в диапазоне от 1:99 (например, 1 молекула вторичного источника углерода на 99 молекул глицерина) до 99:1 (например, 99 молекул вторичного источника углерода на 1 молекулу глицерина). Например, вторичный источник углерода и неочищенный глицерин могут присутствовать в относительных молярных концентрациях в диапазоне от 1:99 до 1:10, от 1:10 до 1:2, от 1:2 до 2:1, от 10:1 до 2: 1 или от 10:1 до 99:1, например. В некоторых предпочтительных вариантах осуществления, вторичный источник углерода будет глюкозой и, в особенности, когда клеточная культура содержит клетки грибов, некоторое количество глюкозы будет предоставлено в качестве источника углерода. В некоторых предпочтительных вариантах осуществления отношение неочищенного глицерина к глюкозе будет в пределах от 1:4 до 4:1 и также от 2:1 до 1:2.
Идентичность и подходящие концентрации других компонентов, которые могут быть использованы в обсуждаемой клеточной среде для культивирования, например, источник азота и другие питательные вещества, и т.д., как правило, зависят от типа клеток, которые будут выращиваться в среде для культивирования. Как правило, такие компоненты хорошо известны в данной области (см., например, Ausubel, et al., Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995; Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, 1989 Cold Spring Harbor, N. Y.; Talbot, Molecular and Cellular Biology of Filamentous Fungi: A Practical Approach, Oxford University Press, 2001; Kinghorn and Turner, Applied Molecular Genetics of Filamentous Fungi, Cambridge University Press, 1992; и Bacillus (Biotechnology Handbooks) by Colin R. Harwood, Plenum Press, 1989; Bacillus subtilis: From Genes to Cells, Sonenshein, A.L., Hoch, J.A. and Losick, R ASM (2001), а также, например, Ilmen et al., Appl. Environ. Microbiol. 1997 63:1298-1306; O'Herrin et al. Hum. Immunol. 1996 51:63-72; Westers et al., J. Biotechnol. 2006 123:211-24 и Yang et al., Biochim. Biophys. Acta 2004 1703:43-51). Условия культивирования для заданного типа клеток также можно найти в научной литературе и/или в источнике грибов, таком как American Type Culture Collection (ATCC) и Fungal Genetics Stock Center.
Образцовые компоненты, которые могут быть использованы в средах для культивирования, включают в качестве неограничивающих примеров: экстракт из микробных, животных или растительных клеток, например, соевая мука, соевый белок, соевый концентрат, кукурузный экстракт, кукурузная мука, кукурузный глютен, дрожжевой экстракт, соевая мука, хлопковая мука, арахисовая мука, картофельный белок, сыворотка, рыбная мука, бактотриптон, бактопентон и т.д., соли, например KH2PO4, MgSO4, CaCl2, NaCl, FeCl3, MgCl2, MnCl2, другие соединения, например тиамина хлорид, биотин, витамин B12, NaH2PO4 H3BO3, ZnSO4, Na2MoO4 и CuSO4, и, необязательно, один или несколько вторичных источников углерода, как указано выше. В определенных случаях, источник углерода известной среды для культивирования может быть замещен глицерином (например, неочищенным глицерином). Среды для культивирования, содержащие неочищенный глицерин, приведены ниже.
Как будет описано во всех подробностях ниже, среда для культивирования может быть использована для культивирования клеток, которые cодержат рекомбинантную нуклеиновую кислоту для экспрессии белка. Так как в определенных вариантах осуществления рекомбинантная нуклеиновая кислота может содержать селективный маркер для того, чтобы отбирать клетки, содержащие рекомбинантную нуклеиновую кислоту, среда для культивирования также может содержать селективный агент, например, антибиотик, такой как ампициллин, тетрациклин, канамицин, гигромицин, блеомицин, хлорамфеникол, стрептомицин или флеомицин или гербицид, устойчивость к которому обеспечивает селективный маркер клетки. В определенных случаях, среда для культивирования также может содержать белок, секретируемый клетками. Как будет описано во всех подробностях ниже, белок может быть эндогенным по отношению к клеткам, или неэндогенным по отношению к клеткам.
В конкретных вариантах осуществления среда для культивирования может быть специально составлена для культивирования конкретных клеток (например, клеток-хозяев, которые содержат рекомбинантную нуклеиновую кислоту для синтеза белка). Как будет описано во всех подробностях ниже, такие клетки-хозяева включают, в качестве неограничивающих примеров, определенные клетки-хозяева бактерий и грибов.
Глицерин (например, неочищенный глицерин), присутствующий в обсуждаемой среде для культивирования, может быть из любого источника. В конкретных вариантах осуществления глицерин (например, неочищенный глицерин), присутствующий в обсуждаемой среде для культивирования, может быть побочным продуктом способов производства биотоплива или мыла, т.е. в качестве побочного продукта синтеза горючих алкилэфиров с помощью трансэтерификации растительных и/или животных триглицеридов, или в качестве побочного продукта получения солей жирных кислот с помощью сапонификации растительных и/или животных триглицеридов. Коммерческие источники глицерина доступны, например, в Novance (France), Reidel-de Haen (Germany), Sigma-Aldrich и ADM.
Обсуждаемая среда для культивирования может быть изготовлена с использованием любого подходящего способа. В одном из вариантов осуществления все компоненты среды для культивирования, включая неочищенный глицерин и воду, могут быть объединены и стерилизованы, например, автоклавированы или профильтрованы перед использованием. В другом варианте осуществления неочищенный глицерин может быть добавлен в другие компоненты среды для выращивания перед использованием. Среда может содержать агар или другое застывающее средство, если среда представляет собой твердую среду.
Клеточные культуры
Клеточная культура содержит: a) множество клеток-хозяев и b) предоставленные описанные выше среда для культивирования. В определенных вариантах осуществления клетки могут содержать рекомбинантную нуклеиновую кислоту для синтеза белка.
В конкретных вариантах осуществления обсуждаемая клетка-хозяин может представлять собой бактериальную клетку, включая грамположительные и грамотрицательные бактериальные клетки следующих видов: Bacillus sp., включая в качестве неограничивающих примеров, B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus, and B. thuringiensis; Streptomyces sp., включая в качестве неограничивающих примеров: S. lividans, S. carbophilus, S. rubigenosus, and S. helvaticus; Pantoea sp., включая P. citrea; Gluconobacter sp.; Erwinia sp.; и E. coli.
В других вариантах осуществления обсуждаемая клетка-хозяин может быть клеткой грибов следующих видов: Trichoderma sp., (например, Trichoderma reesei (ранее классифицированная как T. longibrachiatum и также известная в настоящее время как Hypocrea jecorina), Trichoderma viride, Trichoderma koningii, and Trichoderma harzianum)); Penicillium sp., Humicola sp. (например, Humicola insolens and Humicola grisea); Chrysosporium sp. (например, C. lucknowense), Gliocladium sp., Aspergillus sp. (например, Aspergillus oryzae, Aspergillus niger, Aspergillus nidulans, Aspergillus kawachi, Aspergillus aculeatus, Aspergillus japonicus, Aspergillus sojae, and Aspergillus awamori), Fusarium sp., Mucor sp., Neurospora sp., Hypocrea sp., или Emericella sp., среди других.
Известны способы для культивирования таких клеток, включая подходящие компоненты сред для культивирования, которые можно использовать для культивирования этих клеток.
Как указано выше, клетки клеточной культуры могут содержать рекомбинантную нуклеиновую кислоту для экспрессирования белка. В определенных вариантах осуществления рекомбинантная нуклеиновая кислота может содержать экспрессирующую кассету для экспрессирования белка, т.е. промоторы, кодирующую последовательность (т.е. полинуклеотид, кодирующий белок) и терминатор, где промоторы, кодирующая последовательность и терминатор функционально связаны так, чтобы кодирующая последовательность транскрибировалась для синтеза РНК, и эта РНК транслировалась для синтеза белка. Каждый из промоторов, кодирующей последовательности и терминатора независимо могут быть эндогенными (т.е. нативными) или неэндогенными по отношению к клетке-хозяину. Также белок может быть эндогенным (т.е. нативным) или неэндогенным по отношению к клетке-хозяину. В определенных вариантах осуществления кодирующая последовательность может быть с оптимизированными кодонами для экспрессии белка в особой клетке-хозяине. Так как таблицы использования кодонов перечисляют использование каждого кодона во многих клетках известны в данной области (см., например, Nakamura et al., Nucl. Acids Res. 2000 28: 292) или их легко получить, такие нуклеиновые кислоты могут быть быстро созданы, давая аминокислотную последовательность белка, подлежащего экспрессии.
Кодируемый белок может быть ферментом, терапевтическим белком, репортерным белком, селективным маркером, пищевой добавкой или продуктом питания или т.п.
В одном из вариантов осуществления белок может представлять собой фермент, такой как карбогидраза, например, α-амилаза, β-амилаза, целлюлаза; декстраназа, α-глюкозидаза, α-галактозидаза, глюкоамилаза, гемицеллюлаза, пентозаназа, ксиланаза, инвертаза, лактаза, наринганаза, пектиназа или пуллуланаза; протеаза, такая как кислая протеаза, щелочная протеаза, бромелаин, фицин, нейтральная протеаза, папаин, пепсин, пептидаза, реннет, реннин, химозин, субтилизин, термолизин, аспарагиновая протеиназа или трипсин; липаза или эстераза, такая как триглицеридаза, фосфолипаза, pregastric эстераза, фосфатаза, фитаза, амидаза, иминоацилаза, глютаминаза, лизозим, или пенициллиновая ацилаза; изомераза, такая как глюкозоизомераза; оксидоредуктазы, например оксидаза аминокислот, каталаза, хлорпероксидаза, оксидаза глюкозы, гидроксистероиддегидрогеназа или пероксидаза; лиаза, такая как ацетолактатдекарбоксилаза, аспарагиновая β-декарбоксилаза, фумараза или гистадаза; трансфераза, такая как циклодекстрин гликозилтрансфераза; или лигаза, например. В конкретных вариантах осуществления белок может представлять собой аминопептидазу, карбоксипептидазу, хитиназу, кутиназу, дезоксирибонуклеазу, α-галактозидазу, β-галактозидазу, β-глюкозидазу, лакказу, маннозидазу, мутаназу, пектинолитический фермент, полифенолоксидазу, рибонуклеазу или трансглутаминазу, например.
В других вариантах осуществления белок может представлять собой терапевтический белок (т.е. белок, обладающий терапевтической биологической активностью). Примеры соответствующих терапевтических белков включают: эритропоэтин, цитокины, такие как интерферон-α, интерферон-β, интерферон-γ, интерферон-o, и гранулоцитарный CSF, GM-CSF, факторы свертывания, такие как фактор VIII, фактор IX, и человеческий C белок, антитромбин III, тромбин, растворимая α-цепь IgE-рецептора, IgG, фрагменты IgG, IgG fusions, IgM, IgA, интерлейкины, урокиназу, химазу и urea ингибитор трипсина, IGF-связывающий белок, эпидермальный фактор роста, фактор, высвобождающий гормон роста, белок, слитный с аннексином V, ангиостатин, сосудистый эндотелиальный фактор роста-2, миелоидный прогениторный ингибирующий фактор-1, остеопротегерин, α-1-антитрипсин, α-фетопротеины, ДНКазу II, kringle 3 человеческого плазминогена, глюкоцериброзидазу, TNF-связывающий белок 1, фолликулостимулирующий гормон, антиген 4-Ig, ассоциированный с цитотоксическим T-лимфоцитом, трансмембранный активатор и модулятор кальция и лиганд циклофилина, растворимый TNF рецептор Fc fusion, глюкагонподобный белок 1 и агонист рецептора IL-2. Белки антител, (полипептиды, содержащие каркасную область из гена иммуноглобулина или его фрагменты, которые специфически связываются и распознают антиген (например, моноклональные антитела, которые могут быть гуманизированы), представляют особый интерес.
В дополнительном варианте осуществления белок может представлять собой репортерный белок. Такие репортерные белки могут определяться, например, оптически или колоригенно. В этом варианте осуществления, белок может представлять собой β-галактозидазу (lacZ), β-глюкуронидазу (GUS), люциферазу, щелочную фосфатазу, нопалинсинтазу (NOS), хлорамфеникол ацетилтрансферазу (ХАТ), пероксидазу хрена (ПХ) или зеленый флуоресцентный белок, например зеленый флуоресцентный белок (GFP) или их производные.
Примеры селективных маркеров включают, в качестве неограничивающих примеров, такие, которые дают противомикробную резистентность (например, резистентность к гигромицину, блеомицину, хлорамфениколу или флеомицину), и белки, которые дают метаболическую пользу, например, amdS, argB и pyr4. Селективные маркеры дополнительно описаны в Kelley et al., (1985) EMBO J. 4: 475-479; Penttila et al., (1987) Gene 61: 155-164 и Kinghorn et al. (1992) Applied Molecular Genetics of Filamentous Fungi, Blackie Academic and Professional, Chapman and Hall, London.
В определенных вариантах осуществления кодирующая последовательность может кодировать слитный белок. В некоторых из этих вариантов осуществления, слитный белок может быть предоставлен для секреции белка из клетки-хозяина, в которой он экспрессируется и сам по себе может содержать сигнальную последовательность, функционально связанную с N-концом белка, где сигнальная последовательность содержит последовательность аминокислот, которая направляет белок в секреторную систему клетки-хозяина, что приводит к секреции белка из клетки-хозяина в среду, в которой клетка-хозяин растет. Сигнальная последовательность вырезается из слитного белка перед секретированием белка. Использованная сигнальная последовательность может быть эндогенной или неэндогенной по отношению к клетке-хозяину и, в определенных вариантах осуществления может представлять собой сигнальную последовательность белка, о котором известно, что он интенсивно секретируется из клетки-хозяина. В конкретных вариантах осуществления сигнальная последовательность белка может представлять собой любую сигнальную последовательность, которая облегчает секрецию белка из клетки-хозяина мицеллярного гриба (например, Trichoderma или Aspergillus) или бактериальной (например, Bacillus или Streptomyces) клетки-хозяина. Такие сигнальные последовательности включают в качестве неограничивающих примеров: сигнальную последовательность целлобиогидролазы I, целлобиогидролазы II, эндоглюканаз I, эндоглюканаз II, эндоглюканаз III, α-амилазы, аспартиловой протеазы, глюкоамилазы, маннаназы, гликозидазы и эндопептидазы B ячменя (см. Saarelainen, Appl. Environ. Microbiol. 1997 63: 4938-4940), например. Другие сигнальные последовательности представляют собой такие, которые происходят из гена (glaA) амилоглюкозидазы (AG) грибов, ген α-фактора (дрожжей, например, Saccharomyces, Kluyveromyces и Hansenula) или ген α-амилазы (Bacillus). Поэтому в определенных вариантах осуществления обсуждаемая рекомбинантная нуклеиновая кислота может содержать: нуклеиновую кислоту, кодирующую сигнальную последовательность, которая функционально связана с нуклеиновой кислотой, кодирующей белок, где при трансляции нуклеиновой кислоты в клетке-хозяине синтезируется слитный белок, содержащий белок, обладающий N-концевой сигнальной последовательностью для секреции белка из клетки-хозяина.
В конкретных вариантах осуществления слитный белок может дополнительно содержать «белок-носитель», который представляет собой часть белка, который является эндогенным по отношению к клетке-хозяину и интенсивно ей секретируется. Подходящие белки-носители включают таковые из маннаназы I T. reesei (Man5A или MANI), целлобиогидролазы II T. reesei (Cel6A или CBHII) (см., например, Paloheimo et al. Appl. Environ. Microbiol. 2003 December; 69(12): 7073-7082) или целлобиогидролазы I T. reesei (CBHI). В одном из вариантов осуществления белок-носитель представляет собой процессированный CBH1 белок из T. reesei, который включает фрагмент ядра CBH1 и часть линкерного фрагмента CBH1. Таким образом, предоставлен слитный белок, содержащий, от амино-конца к карбокси-концу, сигнальную последовательность, белок-носитель и целевой белок в оперативной связи, а также нуклеиновую кислоту, кодирующую тоже самое.
Обсуждаемая рекомбинантная нуклеиновая кислота может быть представлена в векторе, или интегрирована в геном клетки-хозяина. Рекомбинантная нуклеиновая кислота может быть представлена в векторе, например фаге, плазмиде, вирусном или ретровирусном векторе, который автономно реплицируется в клетке-хозяине. Векторы для экспрессии рекомбинантных белков хорошо известны в данной области (Ausubel, et al., Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995; Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.).
Так как описанные выше среды для культивирования содержат неочищенный глицерин, который, в определенных вариантах осуществления, может представлять собой глицеринсодержащий побочный продукт реакций, используемых для изготовления биотоплива или мыла, среды для культивирования, в определенных вариантах осуществления, могут содержать следовые, определяемые количества, например, менее чем 1%, менее чем 0,5%, менее чем 0,2%, менее чем 0,1%, менее чем 0,05%, менее чем 0,01%, менее чем 0,005%, менее чем 0,001%, или менее чем 0,0005% (об./об.) использованных в них компонентов, или других продуктов или побочных продуктов этих реакций. Например, в определенных вариантах осуществления, обсуждаемая среда для культивирования может содержать следовые количества алкилэфиров или алкиловых солей жирных кислот, обнаруженных в триглицеридах растительных масел, например масел из семян рапса, соевых бобов, thiol mustard, пальмового масла, конопляного масла, масла ятрофы, отработанного масла для жарки или животных жиров, например сала, лярда, желтого топленого сала или рыбьего жира, мыла, катализатор реакции, например метоксид натрия или силикат натрия, или спирт, например этанол или метанол, жирная кислота, зола, сульфаты, фосфаты, ацетаты и e-метокси, 1,2-пропандиол, в зависимости от реакции, используемой для синтеза неочищенного глицерина.
Способы
Описанная выше клеточная культура может быть приготовлена с использованием множества различных способов. Например, в определенных вариантах осуществления среда для культивирования, содержащая неочищенный глицерин, может быть приготовлена, например, смешиванием всех компонентов среды для культивирования вместе в воде, с добавлением неочищенного глицерина, и последующим инокулированием среды для культивирования с клетками-хозяевами. Клеточная культура может поддерживаться при подходящих условиях для роста клеток в сосуде (например, в инкубаторе с шейкером при соответствующей температуре, например комнатной температуре, 30°C или 37°C в биореакторах).
В других вариантах осуществления неочищенный глицерин может быть добавлен к (например, размешан в) культуре клеток. В этих вариантах осуществления неочищенный глицерин может быть объединен с клеточной культурой быстро, например в течение нескольких секунд, или постепенно, например в течение нескольких минут или часов. По существу, в определенных вариантах осуществления обсуждаемые способы могут включать в себя культивирование клеток при отсутствии неочищенного глицерина (т.е. при использовании источника углерода, который не является неочищенным глицерином), и с последующим добавлением неочищенного глицерина к клеткам. В других вариантах осуществления клетки культивируются в присутствие неочищенного глицерина в течение периода времени (например, минут или часов) и затем к культуре добавляют другой источник углерода. Как указано выше, неочищенный глицерин может являться или не являться единственным источником углерода для клеток клеточной культуры.
В конкретных вариантах осуществления перед использованием неочищенный глицерин может быть получен из удаленного места, например, из оборудования для производства мыла или биотоплива, которое находится в месте, удаленном относительно места, в котором находится клеточная культура, например в другом городе или штате. Неочищенный глицерин может храниться и стерилизоваться перед использованием.
Также предоставлены способы использования описанной выше клеточной культуры для синтеза белка. В определенных вариантах осуществления обсуждаемые способы синтеза белка включают:
поддержание вышеописанной клеточной культуры для обеспечения синтеза белка. В определенных вариантах осуществления и как указано выше, белок может секретироваться в среду для культивирования. По существу, определенные варианты осуществления способа включают этап выделения белка из среды для культивирования. Синтезированный клетками белок может быть использован во множестве способов.
В некоторых вариантах осуществления клетки могут культивироваться в замкнутом объеме или в условиях непрерывной ферментации. Классические способы ферментации в замкнутом объеме используют закрытую систему, где среда для культивирования стерилизуется перед началом цикла ферментации, среда инокулируется с желаемым организмом(-ами), и ферментация происходит без последующего добавления в среду любых компонентов. В определенных случаях, pH и содержание кислорода, но не содержание источника углерода, среды для выращивания могут изменяться во время способов в замкнутом объеме. Метаболиты и клеточная биомасса замкнутой системы меняются непрерывно вплоть до того момента, когда ферментация останавливается. В замкнутой системе, клетки обычно развиваются на протяжении статической lag-фазы до интенсивного роста log-фазы и, наконец, до стационарной фазы, где скорость роста уменьшается или останавливается. Без обработки клетки в стационарной фазе со временем умирают. В общих чертах, клетки в log- и стационарной фазах синтезируют больше всего белка.
Вариацией стандартной замкнутой системы является «подпитываемая ферментационная» система. В этой системе питательные вещества (например, источник углерода, такой как неочищенный глицерин, источник азота, соли, O2 или другие питательные вещества) добавляются, когда их концентрация в культуре опускается ниже порога. Подпитываемые системы полезны, когда катаболическая репрессия способна ингибировать метаболизм клеток и где в среде желательно иметь ограниченные количества питательных веществ. Величина текущей концентрации питательных веществ в подпитываемых системах устанавливается на основании изменений измеримых факторов, таких как pH, растворенный кислород и парциальное давление газообразных отходов, таких как CO2. Замкнутая и подпитываемая ферментации распространены и известны в данной области.
Непрерывная ферментация представляет собой открытую систему, где определенная среда для культивирования, содержащая неочищенный глицерин, непрерывно добавляется в биореактор и равные количества кондиционированной среды удаляются одновременно для обработки. Как правило, непрерывная ферментация поддерживает культуры при постоянной высокой плотности, где клетки в основном находятся в log-фазе роста.
Непрерывная ферментация делает возможной корректировку одного фактора или любого количества факторов, которые влияют на рост клеток и/или конечную концентрацию продукта. Например, в одном из вариантов осуществления лимитирующее питательное вещество, такое как источник углерода (неочищенный глицерин) или источник азота, поддерживается на фиксированном уровне и для всех других параметров допускаются средние значения. В других системах количество факторов, влияющих на рост, может меняться непрерывно до тех пор, пока концентрация клеток, измеряемая по мутности среды, сохраняется постоянной. Непрерывные системы стремятся поддерживать условия устойчивого режима роста. Таким образом, потери клеток из-за отбора среды могут быть уравновешены за счет скорости роста клеток в ферментации. Известны способы корректировки питательных веществ и факторов роста для процесса непрерывной ферментации, а также способы максимизации скорости образования продукта.
Реакция ферментации представляет собой аэробный процесс, в который молекулярный кислород может доставляться, например, с помощью газа, содержащего молекулярный кислород, такого как воздух или воздух, обогащенный кислородом. Несмотря на то, что скорость аэрации может изменяться в больших пределах, аэрация, как правило, проводится со скоростью, которая находится в диапазоне приблизительно от 0,5 до 10, предпочтительно примерно от 0,5 до 7, объемов (при давлении, используемом при 25°C) кислородсодержащего газа на объем жидкости в ферментере в минуту. Это количество основано на воздухе с нормальным содержанием кислорода, поставляемом в реактор, и в пересчете на чистый кислород соответствующая скорость должна составлять примерно от 0,1 до 1,7 объемов (при используемом давлении и при 25°C) кислорода на объем жидкости в ферментере в минуту. Диапазон давлений, используемых для процесса микробиологической конверсии, может изменяться в широких пределах. Как правило, давление находится в пределах примерно от 0 до 50 фунтов/дюйм2.
Температура ферментации может слегка изменяться, но для мицелиальных грибов и бактерий температура, как правило, будет находиться в пределах от 20°C до 45°C, в зависимости от штамма и организма.
Источник азота, который необходим микроорганизмам, может представлять собой любое азотосодержащее соединение или соединения, способные высвобождать азот в форме, пригодной для метаболического использования микроорганизмом. Несмотря на то, что можно использовать множество органических соединений-источников азота, таких как гидролизаты белков, обычно используются недорогие азотосодержащие соединения, такие как аммиак, аммония гидроксид, карбамид аммония сульфат, аммония фосфат, аммония хлорид и другие соединения аммония. Для широкомасштабных операций можно использовать аммиачный газ, и он может использоваться для барботирования через водную ферментационную среду.
Диапазон pH для водной микробной ферментации должен находиться в примерном диапазоне pH от 2,0 до 8,0. Для некоторых микроорганизмов pH будет находиться в диапазоне pH от 3,5 до 6,0 и для других микроорганизмов предпочтительным pH будет pH от 6,0 до 7,5. Хотя средне время ферментации будет значительно изменяться в зависимости от рассматриваемого типа культуры или ферментации, в основном время цикла будет находить между 12 и 400 часами.
Тип используемого ферментера не является критическим, хотя можно использовать, например, 15L Biolafitte (Saint-Germain-en-Laye-, France). В некоторых вариантах осуществления ферментационный бульон, как правило, будет содержать продукты распада клеток, включая клетки и различные суспендированные твердые частицы и, возможно, другие составляющие биомассы, а также желаемый белок. Белок может быть выделен из среды для выращивания с помощью любого подходящего способа, например с помощью преципитации, центрифугирования, аффинности, фильтрации или любого другого известного в данной области способа.
В некоторых вариантах осуществления ферментация будет включать индуцирующий питательный состав для стимуляции экспрессии желаемых белков в определенных клетках-хозяевах. Например, когда Trichoderma представляет собой клетку-хозяина и, в частности, когда Trichoderma используется в качестве клетки-хозяина для синтеза генов целлюлазы, может быть использован индуцирующий питательный состав со ссылкой на WO 04/035070, опубликованный 29 апреля 2004 года.
В некоторых вариантах осуществления использование среды для культивирования, содержащей неочищенный глицерин, обеспечивает большое количество клеточной массы и/или секретированного белка, чем другие среды для культивирования, которые содержат только основанный на сахаре источник углерода. Например, в определенных вариантах осуществления, клетки, культивированные в среде для культивирования, содержащей неочищенный глицерин, могут производить, по меньшей мере, на 2% больше белка, по меньшей мере, на 5% больше белка, по меньшей мере, на 10% больше белка, по меньшей мере, на 50% больше белка, по меньшей мере, на 100% больше белка или, по меньшей мере, на 1000% больше белка, чем эквивалентная культура, содержащая основанный на сахаре источник углерода (например, сахарозу или глюкозу), т.е. клеточная культура, содержащая такие же клетки, культивированные в эквивалентной содержащей сахар среде при таких же условиях за такое же количество времени. Более конкретно, клеточная культура, содержащая неочищенный глицерин в качестве единственного источника углерода, может синтезировать, по меньшей мере на 5% больше белка, чем эквивалентная культура, содержащая 6-углеродный сахар (например, глюкозу) или смесь 6-углеродных сахаров (например, сахарозу, глюкозу, фруктозу) в качестве единственного источника углерода. В некоторых вариантах осуществления клеточная масса будет такой же или большей для клеток, выращенных в среде, содержащей неочищенный глицерин, по сравнению с эквивалентными клетками, выращенными в основанном на сахаре источнике углерода (например, глюкозе или сахарозе без глицерина). Например, клеточная масса, измеряемая в граммах клеток/кг может составлять 1%, 2%, 3% 5% 10%, 20% или более для клеток, выращенных с глицериновой подкормкой, по сравнению с глюкозной подкормкой, при измерении за тот же период времени (например, за 20, 30 или 40 часов).
ПРИМЕРЫ
Для того чтобы дополнительно иллюстрировать настоящее изобретение и его преимущества, следующие конкретные примеры даны с пониманием того, что они приведены для иллюстрирования настоящего изобретения и в любом случае не должны восприниматься в качестве ограничивающих объем изобретения.
Материалы и способы, пригодные для поддержания и роста бактериальных культур, хорошо известны в данной области. Способы, пригодные для использования в следующих примерах могут быть найдены в «Manual of Methods for General Bacteriology» (Phillipp Gerhardt, R.G.E. Murray, Ralph N. Costilow, Eugene W. Nester, Willis A. Wood, Noel R. Krieg, and G. Briggs Phillips, eds.), American Society for Microbiology, Washington, D.C. (1994) или Thomas D. «Brock in Biotechnology: A Textbook of Industrial Microbiology, Second Edition» (1989) Sinauer Associates, Inc., Sunderland, Mass. Все реактивы и материалы, использованные для роста и поддержания бактериальных клеток были приобретены в Sigma Aldrich (St. Louis, Mo.), GD (Franklin Lakes, N.J.), или в QBiogene (Irvine, CA), если не указано иначе.
В нижеследующем раскрытии и экспериментальной части применяются следующие сокращения: °C (градус по Цельсию); об/мин (оборотов в минуту); H2O (вода); dH2O (деионизированная вода); dIH2O (деионизированная вода, Milli-Q фильтрация); а.к. или А.К. (аминокислота); п.н. (пара нуклеотидов); т.п.н. (тысяча пар нуклеотидов); кД (килодальтон); г или гм (грамм); мкг (микрограмм); мг (миллиграмм); мкл (микролитр); мл (миллилитр); мл (миллиметр); мкм (микрометр); M (моль); мМ (миллимоль); мкМ (микромоль); V (вольт); MW (молекулярная масса); сек(-ы) или с(-ы) (секунда/секунды); мин(-ы) или м(-ы) (минута/минуты); ч(-ы) или ч(-ы) (час/часы); DIFCO (DIFCO Laboratories); мас./об. (масса/объем); и об./об. (объем/объем); ККД (количество кислорода, использованное для дыхания микроорганизмами на единицу объема ферментера в единицу времени); РК% (количество кислорода, растворенного в ферментационном бульоне относительно максимального количества, которое возможно растворить, измеренное с помощью мембранного зонда).
Использованные в нижеследующих примерах источники неочищенного глицерина предоставлены в таблице 1.
Пример 1
Streptomyces lividans, выращенные в культуре клеток, выращиваемой в замкнутом объеме
Клетки Streptomyces lividans, экспрессирующие нейтральную целлюлазу из Cellulomonas, культивировали при аэробных submerged условиях с помощью обыкновенной ферментации в замкнутом объеме в 500 мл встряхиваемых колбах с 50 мл рабочим объемом. Питательная среда, содержащая дрожжевой экстракт (Biospringer B), аммония сульфат, лимонную кислоту и магния сульфат, в твердой форме и раствор борной кислоты, лимонной кислоты, гептагидрат сульфата железа, марганца хлорид, цинка сульфат и или 1% (мас./об.) глюкозу или неочищенный глицерин.
Дается отдельная ссылка на пример 16 в патенте США № 7135309 и пример 2 в PCT заявке № WO 06/071598A1 для подробного описания культуры и среды для синтеза, которая была использована для клеточных культур. Вкратце, посредством инокуляции из двухдневных ТСА-плашек (триптиказно-соевый агар, BBL #11043) культуры выращивали во встряхиваемых колбах с насыщенной средой. Другие насыщенные среды представляют собой или ТСБ (триптиказно-соевый бульон; BBL #11768), жидкий бульон (который содержит в одном литре: 16 г трипторна, 10 г дрожжевого экстракта и 5 г NaCl), среду B (ТСБ с добавкой на литр: 10,0 г глицерина, 2 мл модифицированного Balch's Trace-Element раствора, в котором NTA заменяется лимонной кислотой, состав модифицированного Balch's Trace-Element раствора можно найти в «Methods for General and Molecular Bacteriology» (P. Gerhardt et al., eds, p.158, American Society for Microbiology, Washington, D.C. (1994)). Посредством инокуляции из двухдневных жидких ТСБ культур, с использованием 1/30 (об./об.) инокулята культуры выращивали во встряхиваемых колбах с минимальной средой. Минимальная среда представляет собой или: MM322 (которая содержит на литр: 12,0 г глицерина, 11,3 г K2HPO4, 1,0 г (NH4)2SO4, 0,2 г дрожжевого экстракта Difco, 0,1 г NaCl и 10 мл модифицированного Balch's Trace-Element раствора, модифицированного как указано выше, конечный pH 6,7 (HCl)); среду D (среда MM322 с добавлением 2 г Na2CO3/л конечный pH 7,2); или среду E (среда Dm, конечный pH 6,4). Среды B и C и минимальную среду фильтровали-стерилизовали, другие среды автоклавировали.
Кроме того, подходящие условия культивирования можно найти в научной литературе, такой как Sambrook (1989), выше; Kieser et al. (2000) Practical Streptomyces Genetics, John Innes Foundation, Norwich, UK; и из American Type Culture Collection (ATCC), www.atcc.org.
Встряхиваемые колбы инкубировали при 30°C и энергично встряхивали. Образцы брали в течение пятидневного курса и анализировали рост клеток (СКМ) и синтез белка посредством оценки активности целлюлазы. DCW измеряли с использованием OMNIMARK μWave (Omnimark Instruments Corporation, Tempe, AZ). Активность целлюлазы определяли согласно стандартному способу (см. микротитровальный плашечный тест, описанный в PCT заявках № PCT/US2005/045859 и WO 06/071598). Результаты представлены на фиг.1 и 2.
Пример 2
Streptomyces lividans, выращенные в подпитываемой культуре клеток
Streptomyces lividans, экспрессирующий нейтральную целлюлазу из Cellulomonas, культивировали при аэробных submerged условиях с помощью обыкновенной подпитываемой ферментации в питательной среде, которая описана выше в примере 1. 14 л замкнутые ферментации кормили 60% мас./мас. глюкозной подкормкой (декстроза Cargill DE99) или эквивалентным 60% мас./мас. неочищенным глицерином. Кормление начинали при скорости потребления кислорода, равной 20 (ККД в ммоль/л-ч). Скорость кормления снижали в течение нескольких часов. Скорость кормления задавали относительно равной углеродной основы для глицеринового кормления. pH удерживали около pH 7,0 с использованием 28% масс/об аммония гидроксида. Температуру ферментации удерживали около 32°C при интенсивном встряхивании. Другие разнообразные параметры, такие как pH, РК%, воздушный поток и давление отслеживали на всем протяжении всего процесса. РК% поддерживали выше 30. Образцы брали в течение пятидневного курса и анализировали рост клеток (СКМ) и синтез белка. Графики на фиг.3 и 4 показывают результаты этих экспериментов.
Пример 3
Bacillus subtilis, выращенные в культуре клеток, выращиваемой в замкнутом объеме
Клетки микроорганизма Bacillus subtilis, экспрессирующие сериновую протеазу B. Amyloliquefaciens, культивировали при аэробных submerged условиях с помощью обыкновенной ферментации в 500 мл встряхиваемых колбах с 50 мл рабочим объемом. Питательная среда содержала 7 г/л соевой муки (Cargill), 0,03 г/л магния сульфата, 0,22 г/л двуосновного калия фосфата, 21 г/л одноосновного натрия фосфата и 16 г/л двуосновного в твердой форме и раствор мочевины 3,6 г/л, 5% глюкозу или неочищенный глицерин. pH автоклавирования составил 7,5. Глюкозу или глицерин добавили после стерилизации соевой муки и солевой среды, включая мочевину. Другие рецепты включают рецепты, описанные в Arbige et al., Fermentation of Bacillus, стр.871-891 и Ferrari et al., Commercial Production of Extracellular Enzymes, стр.917-937, как в Sonenshein et al., Bacillus subtilis, так и в «Other Gram-positive Bacteria: Biochemistry, Physiology и Molecular Genetics», (1993) American Society for Microbiology. Отдельная ссылка дается на пример 17 в патенте США № 7135309 для описания культуры и получения среды, которую можно использовать.
Встряхиваемую колбу поместили при 37°C и встряхивали при 170 об/мин (2” shaker throw). Образцы отбирали в течение двухдневного курса и анализировали рост клеток (оптическая плотность при 550 нм; «ОП550») и синтез белка. Оптическую плотность измеряли с использованием Spectronic Genesys 2 при 550 нм (Sprectronic Analytical Instruments, Garforth, West Yorkshire, UK). Оптическая плотность (ОП) также может быть измерена с помощью способов, которые хорошо известны в данной области, например, как описано в «Manual of Methods for General Bacteriology» (Phillipp Gerhardt, R.G.E. Murray, Ralph N. Costilow, Eugene W. Nester, Willis A. Wood, Noel R. Krieg, and G. Briggs Phillips, eds.). Синтез белка также определяли, как описано в Estell et al. (1985) J. Biol. Chem. 260(11):6518-21. Графики на фиг.5 и 6 показывают результаты этих экспериментов.
Пример 4
Bacillus subtilis, выращенные в подпитываемой культуре клеток
Микроорганизм Bacillus subtilis., экспрессирующий сериновую протеазу B. amyloliquefaciens, культивировали при аэробных submerged условиях с помощью подпитываемой ферментации в основном, как описано K. Anstrup (1974) «Industrial Aspects of Biochemistry», B. Spencer, ed., стр.23-46, в питательной среде, содержащей 0-15% соевой муки (Cargill), 5-25 г/л фосфата натрия и калия, 0,5-4 г/л магния сульфата и раствор лимонной кислоты 5-15 г/л, хлорид железа и марганца хлорид. Перед ферментацией среду мацерировали в течение 90 минут с использованием смеси ферментов, включающей целлюлазы, гемицеллюлазы и пектиназы (см., WO95/04134). 14 л замкнутые ферментации кормили 60% мас./мас. глюкозной подкормкой (декстроза Cargill DE99), versadex greens или инвертным сахаром или эквивалентным 60% мас./мас. неочищенным глицерином (побочный продукт Biodiesel). Кормление начинали, когда глюкоза или глицерин не определялись в замкнутом объеме. Скорость кормления снижалась в течение нескольких часов. Скорость кормления регулировалась таким образом, чтобы добавлять неочищенный глицерин на равную углеродную основу. pH удерживали около 7 с использованием 28% мас./об. Аммония гидроксида. В случае вспенивания в среду добавляли пеногасители (Mazu DF 204, 1-3 г/л). Температуру ферментации удерживали около 37°C и встряхивали при 750 об/мин. Другие разнообразные параметры, такие как pH, РК%, воздушный поток и давление отслеживались на всем протяжении всего процесса. РК% удерживали выше 20. Образцы брали в течение двухдневного курса и анализировали рост клеток (ОП 550 нм) и синтез белка. Рост клеток и синтез белка измеряли, как описано в примере 3. Графики на фиг.7 и 8 показывают результаты этих экспериментов.
Пример 5
T. reesei, выращенные в культуре клеток, выращиваемой в замкнутом объеме
Клетки Trichoderma reesei, экспрессирующие глюкоамилазу Trichoderma, культивировали с помощью ферментации в замкнутом объеме во встряхиваемой колбе. Трансформанты поддерживались на минимальной среде Вогеля (Davis et al., (1970) Methods in Enzymology 17A, стр.79-143 и Davis, Rowland, Neurospora, Contributions of a Model Organism, Oxford University Press (2000)). Встряхиваемые колбы с перегородками с 50 мл или лактозной среды или среды Proflo инокулировали кусочками агара с культурой грибов. Встряхиваемую колбу инкубировали при 30°C и встряхивали при 170 об/мин (2” shaker throw). Образцы брали в течение четырехдневного курса и анализировали рост клеток (сухая клеточная масса) и ферментативную активность. Сухую клеточную массу (СКМ) определяли согласно стандартному способу посредством измерения веса до и после процесса сушки в г/кг (MVEV1ARK Instrument Corporation μWave).
Лактозная среда состоит из: 10 г/л лактозы; 2 г/л пептона; 1 г/л дрожжевого экстракта; 15 г/л KH2PO4; 2 г/л (NH4)2SO4; 0,3 г/л MgSO4·7H2O; 0,3 г/л CaCl2·2H2O; 1 мл/л стокового раствора металлических микроэлементов.
Среда Proflo состоит из: 22,5 г/л Proflo; 30 г/л лактозы; 6,5 г/л (NH4)2SO4; 2 г/л KH2PO4; 0,3 г/л MgSO4·7H2O; 0,2 г/л CaCl2; 0,72 г/л CaCO3; 1 мл/л стокового раствора металлических микроэлементов и 2 мл/л 10% Tween 80.
T. reesei стоковый раствор металлических микроэлементов, использованный в обеих средах, содержит г/л FeSO4·7H2O; MnSO4·H2O 1,6; 1,4 г/л ZnSO4·7H2O; 2,8 г/л CoCl2·6H2O.
В обеих средах pH довели до 5,5 с использованием 28% мас./об. Аммония гидроксида или 5 н. HCl. Глюкозу или неочищенный глицерин добавляли до конечной концентрации 1,5% в каждую среду в качестве дополнительного источника углерода, поддерживающего рост.
Пример 6
A. niger, выращенные в культуре клеток, выращиваемой в замкнутом объеме
Клетки гриба Aspergillus niger, экспрессирующие глюкоамилазу Aspergillus, культивировали при аэробных submerged условиях с помощью обыкновенной замкнутой ферментации во встряхиваемых колбах, содержащих 50 мл A. niger в подходящей питательной среде, в течение 5 дней. Среда содержала источник углерода, например, мальтозу или неочищенный глицерин, источник азота и неорганические соли с использованием процедур, известных в данной области. Подходящие среды доступны у коммерческих поставщиков или могут быть приготовлены согласно опубликованным составам, например, в каталогах American Type Culture Collection или, как описано в Ward et al. Bio/Technology 8:435-440 (1990), в патенте США № 5360732 или в патенте США № 7135309Bl в примерах 22 и 23.
Питательная среда, использованная в этом исследовании, содержала promosoy 100 (цельный соевый концентрат, Central Soya Co., Chicago, IL; см. патент США № 3971856) и аммония сульфат, безводный магния сульфат, (три)цитрат натрия, фосфат натрия, как описано в Ward et al. (2004) Appl. Environ. Microbiol 70(5):2567-76 и 5% (мас./об.) мальтозы или неочищенного глицерина в качестве эквивалентного заместителя. pH довели до 4,8 с помощью 5 н. HCl. Среду буферизовали при pH 4,5 фосфатом натрия. 1-3 г/л Mazu DF60-P (Mazur Chemicals, Inc., Gurnee, 111.) добавили в качестве пеногасителя. Клетки росли в течение 5 дней при 30°C и 170 об/мин (2” shaker throw) при энергичном встряхивании. Образцы брали в течение пятидневного курса и анализировали рост клеток (СКМ) и синтез глюкоамилазы с помощью стандартных тестов (см. Ward et al. (2004) Appl. Environ. Microbiol. 70(5):2567-76). Результаты представлены на фиг.9 и 10.
Пример 7
Streptomyces rubiginosis, выращенные в культуре клеток, выращиваемой в замкнутом объеме
Клетки Streptomyces rubiginosis, экспрессирующие глюкозоизомеразу Streptomyces rubiginosis, культивировали при аэробных submerged условиях с помощью обыкновенной ферментации в замкнутом объеме в 500 мл встряхиваемых колбах с 50 мл рабочим объемом. Колбы начали с 10% инокулятом из 24-часовой посевной колбы и культивировали в подходящих питательных средах в течение 5 дней. Питательные среды содержали 4 г/л дрожжевого экстракта (BD), 2,2 г/л церелозы, 6 г/л картофельного декстрозного крахмала, 0,5 г/л технического агара и 3,5 г/л аммония сульфата и в колбу добавили или 1,4% (мас./об.) глюкозу или неочищенный глицерин. pH довели до 6 с помощью 5 н. HCl.
Кроме того, подходящие культуральные условия можно найти в научной литературе, такой как Sambrook, (1982) выше; T. Kieser, M.J. Bibb, M.J. Buttner, K.F. Chater, and D. A. Hopwood, et al., (2000) PRACTICAL STREPTOMYCES GENETICS. John Innes Foundation, Norwich UK; и/или из American Type Culture Collection (ATCC; www.atcc.org).
Встряхиваемые колбы инкубировали при 30°C и энергично встряхивали. В качестве пеногасителя добавили 1 каплю на литр Mazu DF60-P (Mazur Chemicals, Inc., Gurnee, 111.). Образцы брали в течение 30-часового курса и рост клеток (СКМ) и синтез белка анализировали посредством оценки активности глюкозоизомеразы. Активность глюкозоизомеразы определяли согласно стандартным способам (патенты США № 4610965, 5384257, 5310665). Результаты представлены на фиг.11 и 12.
Пример 8
Hansenula polymorpha, выращенные в культуре клеток, выращиваемой в замкнутом объеме
Hansenula polymorpha, экспрессирующие рекомбинантную липазу грибов (PCT заявка № WO 2005/087918), выращивали в аэробных submerged условиях с помощью обыкновенной ферментации в замкнутом объеме в среде YPD (DIFCO). Клетки культивировали в 2,8-литровой встряхиваемой колбе с перегородками fernbach с рабочим объемом 0,75 литра. Среду довели до pH 6,1 с помощью NaOH или H2SO4. Культуры инкубировали при 26°C и энергично встряхивали при 170 об/мин (2” shaker throw). В качестве пеногасителя добавили одну каплю на литр Mazu DF204. Образцы брали в течение шестидневного курса и анализировали рост клеток (ОП 550 нм) и синтез белка. Активность липазы определяли согласно «тесту TIPU» (PCT заявка № WO 2005/087918). Результаты приведены на фиг.13 и 14.
Хотя вышеупомянутое изобретение было описано в некоторых деталях с помощью иллюстраций и примеров для целей ясности и понятности, специалистам в данной области будет очевидно, что определенные изменения и модификации могут выполняться без отступления от сути и объема изобретения. Поэтому, описание не должно восприниматься в качестве ограничивающего объем изобретения, который описывается прилагаемой формулой изобретения.
Все публикации, патенты и патентные заявки, цитированные здесь, таким образом, в качестве ссылки включены в их полноте для всех целей и как если бы каждая отдельная публикация, патент или патентная заявка были специально и отдельно указывались, чтобы быть включенными по ссылке.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ ИЗОПРЕНА | 2008 |
|
RU2545699C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2005 |
|
RU2433185C2 |
| СПОСОБ АМПЛИФИЦИРОВАНИЯ ЛОКУСОВ В БАКТЕРИАЛЬНОЙ КЛЕТКЕ | 2009 |
|
RU2577985C2 |
| ПРИМЕНЕНИЕ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ | 2005 |
|
RU2406759C2 |
| ДОБАВЛЕНИЕ ЖЕЛЕЗА ДЛЯ УЛУЧШЕНИЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2012 |
|
RU2663794C2 |
| ПОЛУЧЕНИЕ ЛИЗОГЛИКОЛИПИДА И БИОКОНВЕРСИЯ ГЛИКОЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА | 2005 |
|
RU2548805C2 |
| ЛИПОЛИТИЧЕСКИЕ ФЕРМЕНТЫ, ИХ ПРИМЕНЕНИЕ ПРИ ИСПОЛЬЗОВАНИИ ПИЩЕВЫХ ПРОДУКТОВ | 2010 |
|
RU2538144C2 |
| РЕКОМБИНАНТНАЯ КЛЕТКА ДЛЯ ПРОИЗВОДСТВА ФЕНОЛЬНОГО СОЕДИНЕНИЯ И СПОСОБ ПРОИЗВОДСТВА ФЕНОЛЬНОГО СОЕДИНЕНИЯ | 2012 |
|
RU2628097C2 |
| ВАРИАНТЫ ИЗОПРЕНСИНТАЗЫ, ПРИМЕНЯЕМЫЕ ДЛЯ УЛУЧШЕНИЯ ПРОДУЦИРОВАНИЯ ИЗОПРЕНА МИКРООРГАНИЗМАМИ | 2009 |
|
RU2516343C2 |
| МЕТОДИКА КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2017 |
|
RU2709378C1 |

Для получения белка проводят культивирование бактериальной клетки-хозяина, содержащей рекомбинантную нуклеиновую кислоту, в среде, содержащей неочищенный глицерин в качестве источника углерода, и выделение белка, экспрессируемого клеткой. Неочищенный глицерин представляет собой побочный продукт производства биотоплива или мыла, который присутствует в среде в концентрации от 0,1% до 75% (об/об). Культивирование ведут в условиях замкнутого объема, подпитывания или непрерывной ферментации. Бактериальную клетку выбирают из Streptomyces lividans, Bacillus subtilis и Streptomyces rubiginosis. Изобретение обеспечивает повышение накопления биомассы клеток и продукцию белка в культуре. 10 з.п. ф-лы, 14 ил., 8 пр.
1. Способ получения белка, включающий культивирование бактериальной клетки-хозяина в среде для культивирования, которая содержит неочищенный глицерин в качестве источника углерода, где указанный неочищенный глицерин представляет собой побочный продукт производства биотоплива или мыла, и где указанная бактериальная клетка-хозяин содержит рекомбинантную нуклеиновую кислоту, которая кодирует указанный белок, и выделение указанного белка, экспрессируемого клеткой.
2. Способ по п.1, который включает:
добавление неочищенного глицерина к среде для культивирования, инокулирование среды для культивирования бактериальной клеткой-хозяином, или
приготовление клеточной культуры бактериальной клетки-хозяина в среде для культивирования, и добавление неочищенного глицерина к культуре, и последующее культивирование.
3. Способ по п.1 или 2, где указанный неочищенный глицерин предоставлен в качестве единственного источника углерода в среде для культивирования.
4. Способ по п.1 или 2, где среда для культивирования дополнительно содержит углевод в качестве источника углерода в дополнение к указанному неочищенному глицерину.
5. Способ по п.1 или 2, где указанную бактериальную клетку выбирают из Streptomyces lividans, Bacillus subtilis и Streptomyces rubiginosis.
6. Способ по п.1 или 2, где указанный белок представляет собой фермент.
7. Способ по п.1 или 2, где клетку-хозяина культивируют в условиях замкнутого объема, подпитывания или непрерывной ферментации.
8. Способ по п.1 или 2, где указанный белок является нативным по отношению к указанной клетке-хозяину.
9. Способ по п.1 или 2, где указанный белок является гетерологичным по отношению к указанной клетке-хозяину.
10. Способ по п.1 или 2, где указанный белок секретируется в среду для культивирования и где выделение белка осуществляют из среды для культивирования.
11. Способ по п.1 или 2, где указанный неочищенный глицерин присутствует в указанной среде для культивирования в концентрации от 0,1% до 75% (об./об.).
| PARRO V et al | |||
| Overproduction purification of an agarase of bacterial origin | |||
| Journal of Biotechnology, 02.10.1997, vol.58 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ГЕН ПЕПТИДООБРАЗУЮЩЕГО ФЕРМЕНТА, ПЕПТИДООБРАЗУЮЩИЙ ФЕРМЕНТ И СПОСОБ ПОЛУЧЕНИЯ ДИПЕПТИДА | 2002 |
|
RU2280077C2 |
Авторы
Даты
2012-12-27—Публикация
2008-01-10—Подача