Изобретение относится к производным 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила, фармацевтическим композициям, содержащим их, а также применению указанных производных для получения лекарственного средства для лечения связанных к катепсином S и/или катепсином К заболеваний, таких как остеопороз, атеросклероз, ожирение, воспаление и иммунные нарушения, такие как ревматоидный артрит, псориаз, волчанка, астма и хроническая боль, такая как невропатическая боль.
Цистеинпротеазы представляют собой класс пептидаз, характеризующихся присутствием остатка цистеина в каталитическом сайте фермента, эти пептидазы связаны с нормальным разрушением и процессированием белков. Многие патологические нарушения или заболевания являются результатом аномальной активности цистеинпротеаз, такой как сверхэкспрессия или повышенная активация. Цистеинкатепсины, например катепсин B, K, L, S, V, F, являются классом лизосомных ферментов, которые принимают участие в различных нарушениях, включающих воспаление, аутоиммунные заболевания, например, ревматоидный артрит, псориаз, астму, остеоартрит, остеопороз, опухоли, коронарное заболевание, атеросклероз и инфекционные заболевания.
Катепсин S сильно экспрессируется в антиген-представляющих клетках лимфатических тканей, главным образом в лизосомах (Bromme et al., Science, 5, 789, 1996; Riese, et al., Immunity, 4, 357, 1996). В антиген-представляющих клетках катепсин S играет основную роль в презентации антигена деградацией инвариантной цепи, которая связана с главным комплексом гистосовместимости класса II. Мыши с дефицитом катепсина S являются здоровыми и нормальными во многих отношениях, но проявляют недостаточности в иммунных функциях и демонстрируют заметную резистентность к развитию индуцированного коллагеном артрита (Nakagawa et al., Immunity, 10, 207, 1999; Shi et al., Immunity, 10, 197, 1999; Yang et al., 174, 1729, 2005). Ингибиторы катепсина S являются эффективными в модели астмы (Riese et al., J. Clin. Invest. 101, 2351, 1998). Блокирование деградации инвариантной цепи должно специфически уменьшать презентацию антигена CD4-клеткам и как таковое должно уменьшать нежелательные побочные действия других иммуносупрессивных лекарственных средств, таких как стероиды. В последней патентной публикации (Johnson & Johnson, US 2007/0117785) было показано, что ингибиторы катепсина S блокируют презентацию нескольких общих (суммарных) аллергенных экстрактов в анализе ex vivo человека, тем самым подтверждая применение ингибиторов катепсина S для лечения некоторых аллергенных состояний, таких как ревматоидный артрит, псориаз. В отличие от большинства других лизосомных протеаз, которые являются активными только в кислотных условиях, активность катепсина S проявляется в широком значении рН, оптимальное значение которого достигается при щелочном значении рН. Эта особенность дает возможность катепсину S функционировать внутри и вне лизосом (Broemme et al., Febs Lett., 286, 189, 1991). Особенность широкого спектра рН и высокая эластазная активность внеклеточного катепсина S также могут содействовать экстенсивному реструктурированию архитектуры внеклеточного матрикса. В результате этого обнаружено, что катепсин S разрушает все основные компоненты внеклеточного матрикса и принимает участие в патогенной реакции, которая приводит к атеросклерозу, ожирению, эмфиземе и хроническому закупоривающему легочному заболеванию и раку (Shi, et al., Atherosclerosis, 186, 411, 2006; Clement et al., Clin Chem Lab Med., 45(3), 328, 2007; Chang et al., J Cancer Mol., 3(1), 5, 2007; Shi et al., Immunity, 10, 197, 1999; Zheng et al., J Clin. Invest., 106, 1081, 2000; Libby et al., J Clin Invest 102, 576, 1998; Sukhova et al., ibid, 111, 897, 2003). Было описано, что уровень катепсина S сыворотки (крови) значительно увеличивается у пациентов как с атеросклерозом, так и диабетом, и модулирующая активность катепсина S может иметь терапевтическое применение при лечении пациентов с этими общими заболеваниями (Shi, et al., Atherosclerosis, 186, 411, 2006; Clement et al., Clin Chem Lab Med., 45(3), 328, 2007). Катепсин S был показан при боли (WO 2003020278; Clark et al., PNAS, 104, 10655, 2007), ходе развития рака, например, ангиогенезе, метастазе, росте и пролиферации клеток (Johnston et al., Am J Path., 163, 175, 2003; Kos et al., Brit J Cancer, 85, 1193, 2001).
Другие цистеинкатепсины, например катепсин К, обладает сильной коллагенолитической, эластазной и гелатиназной активностями (Bromme et al., J. Biol, Chem, 271, 2126-2132, 1996) и преимущественно экспрессируется в остеокластах (Bromme and Okamoto, Biol. Chem. Hopp-Seyler, 376, 379-384, 1995). Он расщепляет ключевые белки костной матрицы, включающие коллаген типа I и II (Kaffienah et al., Biochem. J. 331, 727-732, 1998), желатин, остеопонтин и остеонектин, и как таковой участвует в метаболизме внеклеточного матрикса, необходимого для нормального роста и ремоделирования костей (Bossard et al., J. Biol. Chem. 271, 12517-12524, 1996). Ингибирование катепсина К должно привести к уменьшению опосредуемого остеокластами резорбции костей. Поэтому ингибиторы катепсина К могут представлять собой новые терапевтические агенты для лечения патологических состояний у человека, таких как остеопороз, рак, остеоартрит. Sukhova et al. (J. Clin. Invest. 102, 576-583, 1998) показали, что клетки (макрофаги), которые мигрируют в развивающиеся атеросклеротические бляшки человека и накапливаются в них, синтезируют также сильнодействующие эластазы катепсин К и S. Деградация матрицы, особенно в волокнистой головке таких бляшек, является решающим процессом в дестабилизации атеросклеротического повреждения. Таким образом, метаболизм компонентов внеклеточного матрикса, коллагена и эластина, которые придают структурную целостность при повреждении волокнистой головки, может критически влиять на клинические проявления атеросклероза, такие как тромбоз коронарной артерии, в результате разрыва атеросклеротической бляшки. Ингибирование катепсинов К и S у мест бляшек, склонных к разрыву, может таким образом представлять собой эффективный путь предотвращения таких случаев.
Производные 4-аминопиримидин-2-карбонитрила описаны в качестве ингибиторов катепсинов К и/или S в международной патентной заявке WO 03/020278 (Novartis Pharma GMBH), тогда как структурно родственные производные 4-аминопиримидин-2-карбонитрила были недавно описаны в WO04/000819 (ASTRAZENECA AB) в качестве ингибиторов катепсина S. Пирролопиримидины также описаны в качестве ингибиторов катепсинов К и/или S в WO 03/020721 (Novartis Pharma GMBH) и WO 04/000843 (ASTRAZENECA AB). Недавно карбонитрилзамещенные бициклические азотсодержащие ароматические системы были описаны в Международной патентной заявке WO 05/085210 (Ono Pharmaceutical Co.) в качестве ингибиторов цистеинпротеазы, применимых при лечении остеопороза.
В данной области остается потребность в дополнительных ингибиторах катепсина, особенно в соединениях, имеющих предпочтительную ингибирующую активность для катепсина S по сравнению с катепсином К.
С этой целью настоящее изобретение предлагает производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила, имеющие общую формулу I
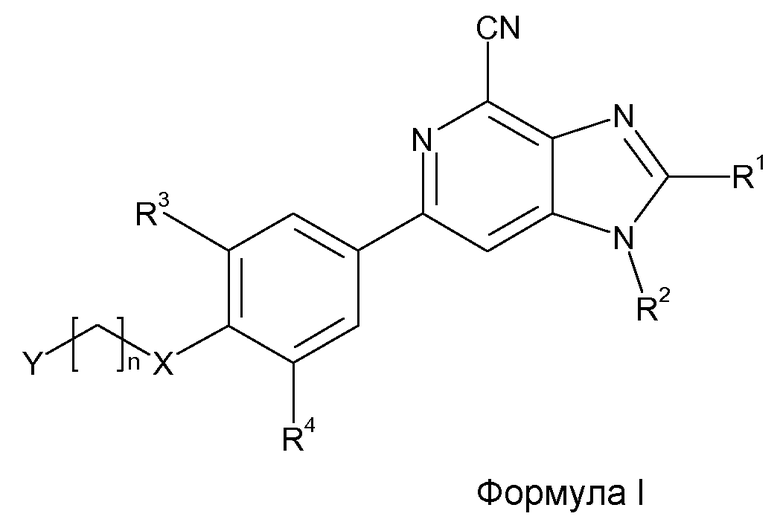
где
R1 представляет собой H или (C1-3)алкил;
R2 представляет собой H или (C1-3)алкил;
R3 представляет собой галоген или (C1-4)алкил, необязательно замещенный одним или несколькими атомами галогена;
R4 представляет собой H, галоген или CN;
X представляет собой CH2, O или S;
n равно 1-5;
Y выбран из OH, CN, (C1-3)алкилкарбонила, NR5R6 и Z, где
Z представляет собой насыщенное 5-или-6-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, выбранных из O, S и NR7, где кольцо может быт замещено OH, оксо, (C1-3)алкилом, гидрокси(C1-3)алкилом или (C1-3)алкилокси(C1-3)алкилом; или где
Z представляет собой ароматическое 5- или 6-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, выбранных из O, S и N, где кольцо может быть замещено OH, (C1-3)алкилом или гидрокси(C1-3)алкилом;
R5 и R6 независимо представляют собой H, (C3-8)циклоалкил или (C1-6)алкил, необязательно замещенный галогеном, OH, CF3, (C3-8)циклоалкилом, (C1-6)алкилокси, CONR14R15, NR14R15, SO2R16, 5- или 6-членную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из O, S и N, или 5- или 6-членную насыщенную гетероциклическую группу, содержащую гетероатом, выбранный из O, S или NR8; или
R5 и R6 вместе с атомом азота, с которым они связаны, образуют 4-10-членное насыщенное гетероциклическое кольцо, необязательно дополнительно содержащее 1-3 гетероатома, выбранных из O, S и NR9, причем кольцо необязательно замещено OH, оксо, (C1-4)алкилом, гидрокси(C1-3)алкилом, (C3-8)циклоалкилом, CONR10R11 или NR10R11;
R7 представляет собой H, (C1-3)алкил или гидрокси(C1-3)алкил;
R8 представляет собой H, (C1-3)алкил или гидрокси(C1-3)алкил;
R9 представляет собой H, (C1-3)алкил, (C3-8)циклоалкил, гидрокси(C1-3)алкил, (C1-3)алкокси(C1-3)алкил, (C1-6)алкилкарбонил, (C1-6)алкилоксикарбонил, CONR12R13, CH2CONR12R13 или 5- или 6-членную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из O, S и N;
R10 и R11 независимо представляют собой H или (C1-3)алкил;
R12 и R13 независимо представляют собой H или (C1-3)алкил; или
R12 и R13 вместе с атомом азота, с которым они связаны, образуют 4-8-членное насыщенное гетероциклическое кольцо, необязательно дополнительно содержащее гетероатом, выбранный из O и S;
R14 и R15 независимо представляют собой H или (C1-3)алкил; или
R14 и R15 вместе с атомом азота, с которым они связаны, образуют 4-8-членное насыщенное гетероциклическое кольцо, необязательно дополнительно содержащее гетероатом, выбранный из O и S;
R16 представляет собой (C1-3)алкил; или их фармацевтически приемлемые соли.
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила изобретения являются ингибиторами катепсина S и катепсина К и поэтому их можно применять для получения лекарственного средства для лечения остеопороза, атеросклероза, воспаления и иммунных нарушений, таких как ревматоидный артрит, псориаз, астма и хроническая боль, такая как невропатическая боль.
Термин «(С1-6)алкил», применяемый в определении формулы I, означает разветвленную или неразветвленную алкильную группу, имеющую 1-6 атомов углерода, подобную гексилу, пентилу, 3-метилбутилу, бутилу, изобутилу, третичному бутилу, пропилу, изопропилу, этилу и метилу.
Термин «(С1-4)алкил» означает разветвленную или неразветвленную алкильную группу, имеющую 1-4 атома углерода, подобную бутилу, изобутилу, третичному бутилу, пропилу, изопропилу, этилу и метилу.
Термин «(С1-3)алкил» означает разветвленную или неразветвленную алкильную группу, имеющую 1-3 атома углерода, подобную пропилу, изопропилу, этилу и метилу.
В терминах «(С1-3)алкилкарбонил» и «(С1-3)алкилокси(С1-3)алкил» в каждом случае (С1-3)алкил имеет такое же значение, как указано ранее.
Термин «гидрокси(С1-3)алкил» означает (С1-3)алкильную группу, как указано ранее, замещенную гидроксигруппой. Предпочтительной гидрокси(С1-3)алкильной группой является гидроксиметил.
В терминах «(С1-6)алкилокси», «(С1-6)алкилкарбонил» и «(С1-6)алкилоксикарбонил» (С1-6)алкил имеет такое же значение, как указано ранее.
Термин «(С3-8)циклоалкил» означает циклоалкильную группу, имеющую 3-8 атомов углерода, такую как циклооктил, циклогептил, циклогексил, циклопентил, циклобутил и циклопропил.
Термин «(С6-10)арил» означает радикал, образованный из ароматической группы, имеющей 6-10 атомов углерода, подобный, например, фенилу и нафтилу.
В определении формулы I Z может быть насыщенным 5- или 6-членным гетероциклическим кольцом, содержащим 1-3 гетероатома, выбранных из О, S и NR7. Примерами таких гетероциклических колец, которые присоединены через атом углерода, являются морфолинил, пиперазинил, пиперидинил, пирролидинил, тиоморфолинил, 4-тиоморфолинил, гексагидро-1,4-оксазепинил, гомопиперазинил, имидазолидинил, тетрагидрофуранил и тетрагидротиазолил.
В определении формулы I Z может быть ароматическим 5- или 6-членным гетероциклическим кольцом, содержащим 1-3 гетероатома, выбранных из О, S и N. Примерами таких ароматических гетероциклических колец, которые присоединены через атом углерода или азота, являются пиридил, имидазолил, пиразолил, пиримидинил, тиазолил, изотиазолил, оксазолил, изоксазолил, тиенил, оксадиазолил и тому подобное. Предпочтительными кольцами являются 2-пиридил, 3-пиридил, 1,3-тиазол-2-ил, 1,2-оксазол-3-ил, имидазол-1-ил, тетрагидробензоимидазол-1-ил и 5-метилизоксазол-3-ил.
В определении формулы I R5 и R6 вместе с атомом азота, с которым они связаны, могут образовывать 4-10-членное насыщенное гетероциклическое кольцо, такое как кольцо азетидина, пирролидина, пиперидина или 1Н-азепина. Такие кольца могут содержать 1-3 дополнительных гетероатома, выбранных из О, S и NR9, для образования таких колец, как кольцо морфолина, тиоморфолина, 4-диоксо-4-тиоморфолина, гексагидро-1,4-оксазепина, пиперазина, гомопиперазина, имидазолидина или тетрагидротиазола. В определение этих колец включены также системы спироколец, такие как 1-оксо-2,8-диазаспиро[4,5]дец-8-ил, 2,4-диоксо-1,3,8-триазаспиро[4,5]дец-8-ил, 2,4-диоксо-1,3,8-триазаспиро[4,5]дец-3-ил, 6,9-диазаспиро[4,5]дец-9-ил и тому подобное, а также системы конденсированных колец, такие как гексагидропирроло[1,2-a]пиразин-2-ил и тому подобное.
Термин «5- или 6-членная гетероарильная группа», применяемая в определении R5 и R6 и в определении R9, означает ароматическое 5- или 6-членное кольцо, имеющее 1-3 гетероатома, выбранных из азота, кислорода и серы. Примерами таких гетероарильных групп являются пиридил, имидазолил, пиразолил, пиримидинил, тиазолил, изотиазолил, оксазолил, изоксазолил, тиенил, оксадиазолил и тому подобное. Предпочтительными гетероарильными группами являются 2-пиридил, 3-пиридил, 1,3-тиазол-2-ил, 1,2-оксазол-3-ил и 5-метилизоксазол-3-ил.
В определении формулы I R12 и R13 вместе с атомом азота, с которым они связаны, могут образовывать 4-8-членное насыщенное гетероциклическое кольцо, такое как кольцо азетидина, пирролидина, пиперидина или 1Н-азепина. Такие кольца могут дополнительно содержать гетероатом, выбранный из О и S, для образования таких колец, как кольцо морфолина, тиоморфолина, гексагидро-1,4-оксазепина или тетрагидротиазола.
В определении формулы I R14 и R15 могут образовывать вместе с атомом азота, с которым они связаны, 4-8-членное насыщенное гетероциклическое кольцо, такое как кольцо азетидина, пирролидина, пиперидина или 1Н-азепина. Такие кольца могут дополнительно содержать гетероатом, выбранный из О и S, для образования колец, таких как кольцо морфолина, тиоморфолина, гексагидро-1,4-оксазепина или тетрагидротиазола.
Термин «галоген» означает F, Cl, Br или I. Когда галоген является заместителем в алкильной группе, предпочтительным является атом F. Предпочтительной галогензамещенной алкильной группой является трифторметил.
Предпочтительными в изобретении являются соединения согласно формуле I, в которой R1 представляет собой Н. Следующими предпочтительными являются соединения формулы I, в которой R3 представляет собой CF3 и R4 представляет собой Н. Предпочтительными являются также соединения изобретения, у которых Х представляет собой О и n равно 1 или 2 или 3. Особенно предпочтительными являются соединения изобретения, у которых Y представляет собой NR5R6.
В частности, предпочтительными производными 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила изобретения являются
- 6-[4-(3-диметиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 1-метил-6-[4-(3-пирролидин-1-илпропокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 6-[4-(3-N,N-диэтиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 1-метил-6-[3-(трифторметил)-4-(3-(3,3,4-триметилпиперазин-1-ил)пропокси)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 6-{4-[3-(3,3-диметилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 6-{4-[3-(цис-3,5-диметилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 1-метил-6-{4-[3-(4-метилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 6-{4-[3-(4-этилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 1-метил-6-(4-{3-[4-(N-метиламинокарбонил)пиперидин-1-ил]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 6-{4-[3-(2-этилимидазол-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 6-{4-[2-(цис-3,5-диметилпиперазин-1-ил)этокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 1-метил-6-{4-[2-(8-метил-2,4-диоксо-1,3,8-триазаспиро[4.5]дец-3-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 1-метил-6-[4-(пиридин-2-илметокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- 6-{4-[3-(4-этилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил;
- гидрохлорид 1-метил-6-{3-(трифторметил)-4-[(3-(S)-изопропилпиперазин-1-ил)пропокси]фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила;
- 2,2,2-трифторацетат 6-(4-(2-(1-этилпиперидин-4-ил)этокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила и
- 1-метил-6-[4-(6-метилпиридин-2-илметокси)-3-трифторметилфенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил или их фармацевтически приемлемые соли.
Изобретение в следующем аспекте относится к фармацевтическим композициям, содержащим производное 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила, имеющее общую формулу I, или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемыми вспомогательными средствами.
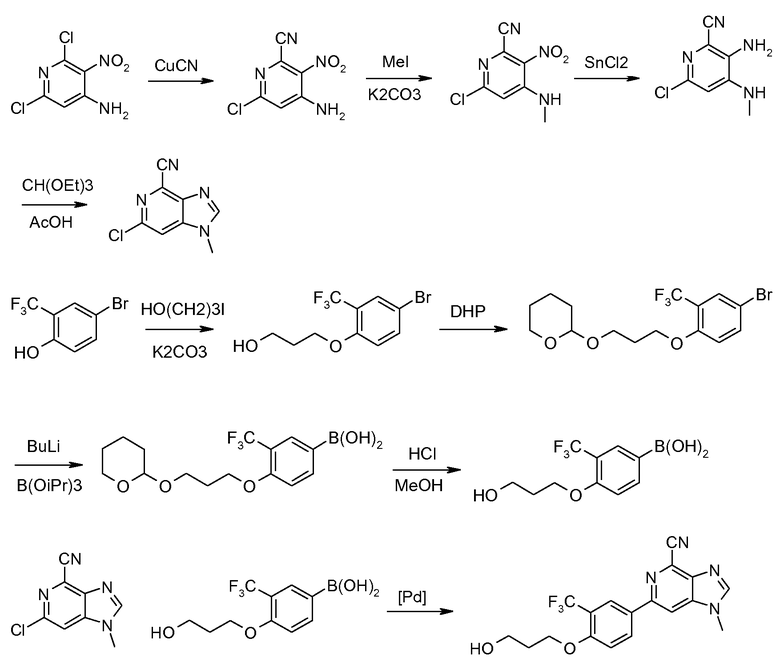
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила общей формулы I, где R2 представляет собой Н, можно получить способами, изображенными на схемах 1, 2 и 3. Селективное цианирование 4-амино-2,6-дихлор-3-нитропиридина (II) (см. схему 1) цианидом меди дает 4-амино-6-хлор-2-циано-3-нитропиридин (III), из которого 6-хлор-3,4-диаминопиридин-2-карбонитрил (VI) получают после восстановления нитрогруппы либо гидрированием (с применением Pd/C-H2) или применением SnCl2 или восстанавливающих агентов на основе Fe.
Схема 1
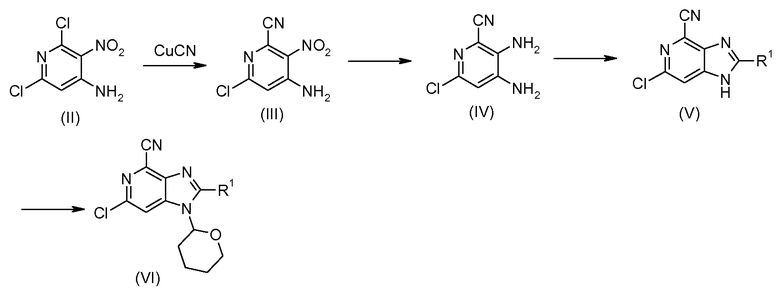
Циклизация производного 3,4-диаминопиридина (IV) с ортоэфиром, катализируемая кислотой Льюиса, такой как трифлат иттербия, или протоновой кислотой, такой как уксусная кислота, дает требуемый имидазопиридиновый промежуточный продукт (V), где R1 имеет значения, указанные ранее. NH имидазопиридина соединения (V) затем защищают тетрагидропиранильной (ТНР) группой, получая при этом соединение (VI) в смеси с N3-замещенным продуктом. Эту смесь региоизомеров можно применять без разделения, поскольку при конечном удалении защитной группы ТНР оба изомера дадут одно и то же соединение.
Схема 2
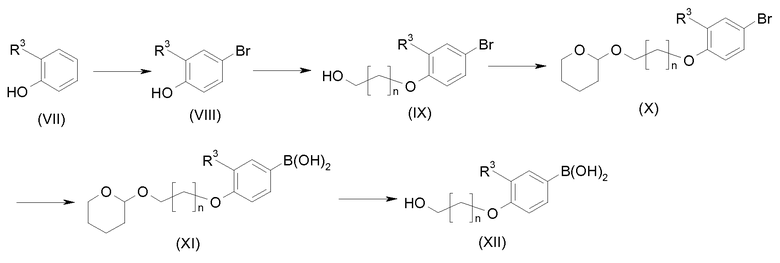
Структурный блок для 6-фенильного заместителя соединения формулы (I), т.е. производное бороновой кислоты формулы (XII), можно синтезировать, как показано на схеме 2. Бромирование 2-замещенного фенола формулы (VII), где R3 имеет значения, указанные ранее, бромом или другим агентом бромирования дает производные 4-бромфенола (VIII) в качестве продукта. Гидроксиалкилирование (VIII) гидроксиалкилгалогенидами и карбонатом калия в качестве основания дает соединение формулы (IХ), гидроксигруппу которого затем защищают группой ТНР в стандартных условиях, получая при этом соединение формулы (Х). Литирование последнего бутиллитием с последующей реакцией с триизопропилборатом и обработкой разбавленной уксусной кислотой в воде дает производное бороновой кислоты формулы (ХI) с высоким выходом. Защитную группу ТНР затем удаляют нагреванием соединения формулы (XI) в 1 М хлористоводородной кислоте в метаноле, получая при этом производное бороновой кислоты формулы (ХII) с высоким выходом.
Схема 3
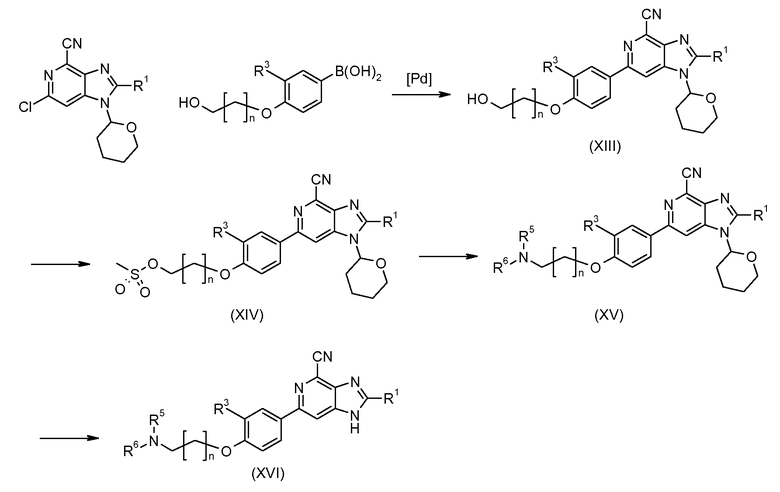
Посредством применения катализируемой палладием реакции сочетания Сузуки между ключевыми промежуточными продуктами формулы VI (схема 1) и формулы (XII; см. схему 2), как показано на схеме 3, получают производное 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила формулы (XIII). Реакция спиртовой функциональной группы в этих соединениях с метансульфонилхлоридом в дихлорметане или тетрагидрофуране, или NMP с триизопропилэтиламином в качестве основания дает метансульфонатное производное формулы (XIV), из которого реакцией со вторичным или первичным амином или другими нуклеофилами получают соединение формулы (XV). Удаление тетрагидропиранильной защитной группы дает соединение формулы (XVI), которое является соединением изобретения согласно формуле I, в которой Y представляет собой NR5R6 и Х представляет собой О.
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила общей формулы I, где R2 представляет собой (С1-3)алкил, можно получить путем синтеза, указанным на схеме 4. N-Алкилирование 4-амино-6-хлор-2-циано-3-нитропиридина (II) подходящим алкилгалогенидом и основанием, таким как карбонат калия, в подходящем растворителе, таком как ацетонитрил или диметилформамид, дает соединение формулы (XVII) в качестве продукта. Последующее восстановление нитрогруппы гидрированием с помощью палладия-на-угле или с применением SnCl2 или Fe/H+ дает соединение формулы (XVIII) с высоким выходом. Соединение (XIX) затем получали из соединения (XVIII) конденсацией с ортоэфиром, катализируемой кислотой, такой как уксусная кислота, или трифлатом иттербия, при нагревании. Сочетание Сузуки соединения формулы (XIX) с производным бороновой кислоты формулы (XII) дает соединение формулы (XX). Из соединения (ХХ) затем получали метансульфонат формулы (XXI), и замещение сульфоната амином или другими азотными нуклеофилами дает соединение формулы (XXII), которое является соединением согласно формуле (I) изобретения, в которой Y представляет собой NR5R6 и Х представляет собой О.
Схема 4
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила общей формулы I, где Х представляет собой метилен (СН2), можно получить, как указано на схеме 5.
Схема 5
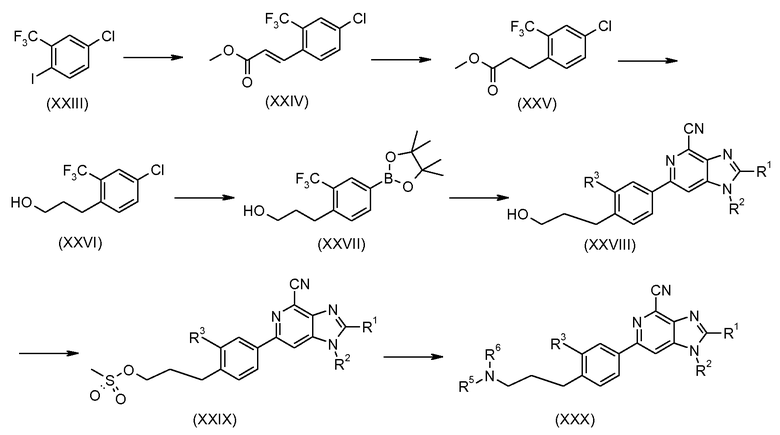
Реакция Хека 4-хлор-2-трифторметилфенилиодида с метилакрилатом с применением палладиевого катализатора дает замещенный метилциннамат формулы (XXIV), который при гидрировании с палладием-на-угле в качестве катализатора дает метил-3-(4-хлор-2-трифторметилфенил)пропионат (XXV) с высоким выходом, который затем восстанавливают с применением диизобутилалюминийгидрида, получая при этом соответствующий спирт формулы (XXVI), который затем превращают в соответствующее производное эфира бороновой кислоты формулы (XXVII). Сочетание Сузуки между (XXVII) и соединением формулы (XIX) дает соединение формулы (XXVIII), которое можно превратить в метансульфонат формулы (XXIX) и затем в соединение изобретения согласно формуле (ХХХ) с применением способов, описываемых ранее.
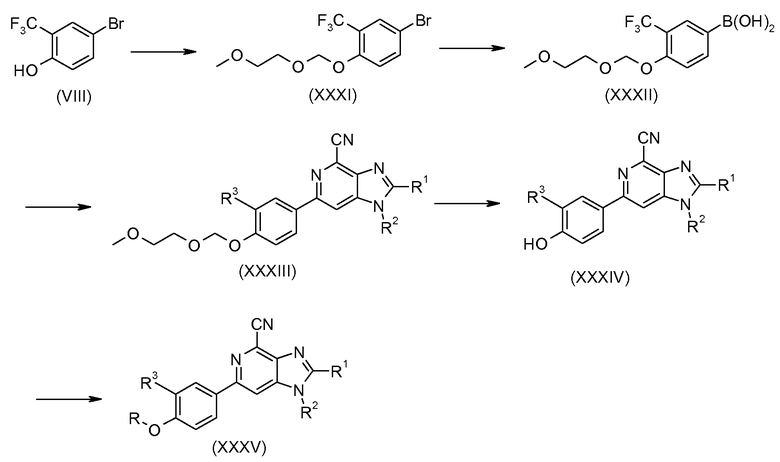
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила общей формулы I изобретения можно также получить посредством промежуточного фенольного производного формулы (XXXIV), как показано на схеме 6. Этот промежуточный продукт получают, исходя из 4-бром-2-трифторметилфенола (VIII): после защиты фенольной гидроксигруппы в виде простой эфирной группы метоксиэтоксиметокси (МЕМО) (XXXI) соединение превращают в производное бороновой кислоты (формула XXXII) способом, описываемым выше (схема 2). Последующее сочетание Сузуки с соединением формулы (XIX) дает соединение формулы (XXXIII), у которого группу МЕМО затем удаляют с применением разбавленной водной хлористоводородной кислоты. Образовавшееся промежуточное соединение формулы (XXXIV) можно превратить в производное либо алкилированием, реакцией Мицунобу, либо с применением дополнительных способов, известных в данной области, для получения дополнительных соединений формулы (XXXV), в которой R представляет собой Y-[CH2]n- или его предшественник.
Схема 6
Для соединения формулы (XXXV), в которой R содержит первичный или вторичный амин, спирт или карбоновую кислоту, эти функциональные группы может быть необходимо временно защитить. Подходящие защитные группы известны в данной области, например, из публикации Wuts, P.G.M. and Greene, T.W.: Protective Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999.
Образовавшийся первичный или вторичный амин, спирт или карбоновую кислоту можно затем применять для превращения в следующее производное, как показано схемой 7, например алкилированием или восстановительным алкилированием.
Схема 7
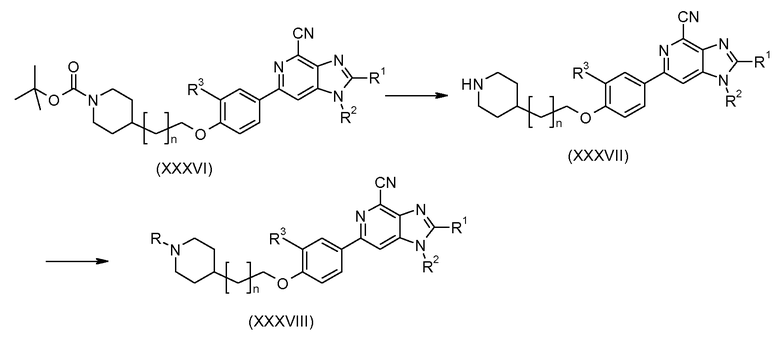
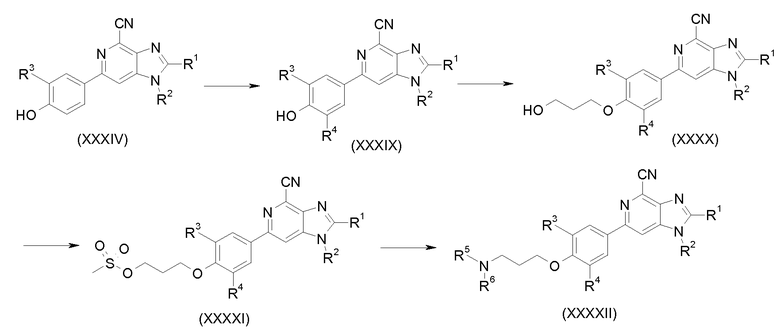
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила общей формулы I, в которой R4 не является протоном, можно получить посредством промежуточного продукта формулы (XXXIV), как показано на схеме 8. Галогенирования и цианирования соединения формулы (XXXIV) в положении R4 соответствующими реагентами можно достичь с применением стандартных условий из литературы для получения соединения формулы (XXXIX). Дальнейшее превращение соединения (ХХХIX), как показано на схеме 8 и как подробно описано выше, приводит к требуемому конечному продукту формулы (XXXXII) через промежуточные продукты формул (ХХХХ) и (ХХХХI).
Схема 8
При получении производного 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила общей формулы I, в которой группа R1 или R2, или R4, или R5, или R6 содержит основный атом азота аминогруппы, такой атом азота должен быть временно защищен, такой как, например, лабильная к действию кислоты трет-бутилоксикарбонильная (Вос) защитная группа. Другие подходящие защитные группы для функциональных групп, которые должны быть временно защищены во время синтеза, являются известными в данной области, например, из публикации Wuts, P.G.M. and Greene, T.W.: Protective Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999.
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила изобретения, которые могут быть в форме свободного основания, можно выделить из реакционной смеси в форме фармацевтически приемлемой соли. Фармацевтически приемлемые соли, такие как кислотно-аддитивные соли, можно затем получить обработкой свободного основания формулы I органической или неорганической кислотой, такой как, но без ограничения перечисленным, хлорид водорода, бромид водорода, иодид водорода, серная кислота, фосфорная кислота, уксусная кислота, трифторуксусная кислота, пропионовая кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота и аскорбиновая кислота.
Подходящими солями производных 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила формулы I, в которой присутствует карбоксилатная группа, могут быть соли щелочных металлов, таких как соль натрия, калия или лития, или может быть соль, полученная из комбинации с органическим основанием, таким как триметиламин, триэтиламин и тому подобное.
Соединения изобретения могут существовать в сольватированных, а также в несольватированных формах, включающих гидратированные формы. Обычно сольватированные формы являются эквивалентными несольватированным формам, и предполагается, что они включены в объем настоящего изобретения. Соединения настоящего изобретения могут существовать в аморфных формах, но могут быть также возможны их множественные кристаллические формы. В общем, все физические формы являются эквивалентными для применений, предполагаемых настоящим изобретением, и предполагается, что эти формы находятся в пределах объема данного изобретения.
Производные 6-фенил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила изобретения и их соли могут содержать центр хиральности в одной или нескольких боковых цепях и поэтому их можно получить в виде чистого энантиомера или в виде смеси энантиомеров, или в виде смеси, содержащей диастереомеры. Способы асимметричного синтеза, посредством которых получают чистые стереоизомеры, хорошо известны в данной области, например, синтез с хиральным индуцированием или синтез, исходящий из хиральных промежуточных продуктов, энантиоселективные ферментативные превращения, разделение стереоизомеров или энантиомеров с применением хроматографии на хиральных средах. Такие способы описаны, например, в Chirality in Industry (edited by A.N. Collins, G.N. Sheldrake and J. Crosby, 1992; John Wiley).
Обнаружено, что соединения изобретения являются ингибиторами катепсина S и катепсина К человека и поэтому в следующем аспекте изобретения могут быть применимыми в терапии и особенно для получения лекарственного средства для лечения аутоиммунного заболевания, хронического обструктивного легочного заболевания, боли, рака, ожирения, остеопороза, атеросклероза и родственных, зависимых от катепсина S и К, нарушений, таких как ревматоидный артрит, псориаз, астма и IBD.
Соединения изобретения можно вводить энтерально или парентерально и для человека предпочтительно при суточной дозе 0,001-100 мг на кг массы тела, предпочтительно 0,01-10 мг на кг массы тела. В смеси с фармацевтически приемлемыми вспомогательными средствами, например, как описано в стандартной ссылке, Gennaro et al., Remington's Pharmaceutical Sciences, (20th ed., Lippincott Williams & Wilkins, 2000, см. особенно Part 5: Pharmaceutical Manufacturing), соединения можно прессовать для получения твердых унифицированных доз, таких как пилюли, таблетки, или подвергнуть обработке для получения капсул или суппозиториев. При помощи фармацевтически подходящих жидкостей соединения можно также применять в форме раствора, суспензии, эмульсии, например, для применения в качестве препарата для инъекции или в виде спрея, например, для применения в качестве назального спрея. Для изготовления единиц дозирования, например таблеток, предполагается применение общепринятых добавок, таких как наполнители, красящие вещества, полимерные связующие вещества и тому подобное. В общем, можно применять любую фармацевтически приемлемую добавку, которая не препятствует функции активных соединений.
Подходящие носители, с которыми можно вводить композиции, включают лактозу, крахмал, производные целлюлозы и тому подобное или их смеси, применяемые в подходящих количествах.
Изобретение далее иллюстрируется следующими примерами.
Способы
Общие химические методики
Все реагенты либо были куплены из обычных коммерческих источников, либо были синтезированы согласно литературным методикам с применением коммерческих источников. Протонные ЯМР (1Н ЯМР) получали на спектрометре Bruker DPX 400 с отнесением к внутреннему стандарту тетраметилсилану (TMS). Масс-спектры регистрировали на Shimadzu LC-8A (ВЭЖХ) PE Sciex API 150EX ЖХ/МС. Аналитический анализ ЖХ/МС с обращенной фазой проводили на колонке С18 LUNA (5 мкм; 30 × 4,6 мм) в градиентных условиях (от смеси 90% воды/0,1% муравьиной кислоты до смеси 90% ацетонитрила/0,1% муравьиной кислоты) при скорости потока 4 мл/мин.
Аббревиатуры
Диметилформамид (ДМФА), N-метилпирролидинон (NMP), дихлорметан (DCM), диметилсульфоксид (ДМСО), тетрагидрофуран (ТГФ), 1,2-диметоксиэтан (DME), высокоэффективная жидкостная хроматография (ВЭЖХ), диизопропилэтиламин (DIPEA), триэтиламин (ТЕА), уширенный (ушир.), синглет (с), дублет (д), триплет (т), трифторуксусная кислота (TFA), трет-бутилоксикарбонил (Вос), метансульфонат (MsO), трифторметансульфонат (TfO), метоксиэтоксиметокси (МЕМО), тетрагидропиран (ТНР), N-хлорсукцинимид (NCS), сильная катионообменная смола (SCX), сильная анионообменная смола (SAX), дейтерированный ДМСО (ДМСО), дейтерированный метанол (CD3OD), дейтерированный хлороформ (CDCl3), метил (Ме), этил (Et), изопропил (iPr).
ПРИМЕР 1
6-[4-(3-Гидроксипропокси)-3-(трифторметил)фенил]-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил
A: 4-Амино-6-хлор-3-нитропиридин-2-карбонитрил
Перемешиваемую суспензию 4-амино-2,6-дихлор-3-нитропиридина (17,5 г, 84,1 ммоль) и цианида меди (I) (15,1 г, 168,3 ммоль) в 170 мл 1-метил-2-пирролидинона помещали в масляную баню, предварительно нагретую до 180°С, и перемешивание продолжали в течение 12 минут. Смеси давали возможность охладиться и разбавляли этилацетатом (700 мл) и водой (700 мл) и образовавшуюся суспензию фильтровали. Органический слой отделяли и далее промывали водой (500 мл) и 0,1 н HCl (500 мл). Органический слой затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая при этом коричневое твердое вещество, которое промывали диэтиловым эфиром и дихлорметаном, получая при этом 4-амино-6-хлор-3-нитропиридин-2-карбонитрил (8 г).
1H ЯМР (ДМСO) δ: 8,8-7,7 (ушир.с, 2H), 7,18 (с, 1H).
B: 6-Хлор-4-метиламино-3-нитропиридин-2-карбонитрил
Перемешиваемую смесь 4-амино-6-хлор-3-нитропиридин-2-карбонитрила (12,5 г), карбоната калия (17,4 г) и йодметана (22,5 г) в ацетонитриле (150 мл) нагревали при 80°С в течение 3 часов. В этой точке добавляли другую порцию йодметана (22,5 г); смесь нагревали при перемешивании в течение еще 2 часа. Смесь затем разбавляли этилацетатом (500 мл) и промывали водой (150 мл). Органический слой затем сушили над сульфатом натрия, растворитель удаляли при пониженном давлении, получая при этом предполагаемый продукт, 4-метиламино-6-хлор-3-нитропиридин-2-карбонитрил (13 г).
1H ЯМР (CD3OD) δ: 7,2 (с, 1H), 3,02 (с, 3H). МС m/z 213 (М+H).
C: 3-Амино-6-хлор-4-метиламинопиридин-2-карбонитрил
Дигидрат хлорида олова(II) (21 г) добавляли к суспензии 6-хлор-4-метиламино-3-нитропиридин-2-карбонитрила (6,6 г) в этаноле (150 мл). Смесь перемешивали при комнатной температуре в течение 3 часов. К указанному выше, окрашенному в красно-коричневый цвет раствору затем добавляли этилацетат (1000 мл) с последующим добавлением 10% водного гидроксида аммония (200 мл). Органический слой отделяли, липкую твердую подушку промывали этилацетатом (5 × 200 мл). Объединенный органический слой затем промывали насыщенным водным раствором хлорида натрия (2 × 200 мл), сушили над сульфатом натрия, растворитель удаляли, получая при этом коричневое твердое вещество в качестве предполагаемого продукта (5,7 г).
1H ЯМР (CD3OD) δ: 6,45 (с, 1H), 2,89 (с, 3H).
D: 6-Хлор-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил
Суспензию 3-амино-6-хлор-4-метиламинопиридин-2-карбонитрила (1,8 г) в DCM (5 мл), уксусной кислоте (1,5 мл) и триэтилортоформиате (10 мл) нагревали в микроволновых условиях при 150°С в течение 30 минут. Смесь затем разбавляли этилацетатом (200 мл), промывали 10% карбонатом натрия (100 мл), сушили над сульфатом натрия, растворитель удаляли при пониженном давлении, к остатку затем добавляли DCM (5 мл), некоторое количество продукта разбивали на куски и собирали фильтрованием (0,5 г), остальную часть затем пропускали через колонку с силикагелем с применением смеси этилацетат-гептан (55:45) в качестве элюента, получая при этом еще 0,8 г предполагаемого продукта (всего 1,3 г продукта).
1H ЯМР (CDCl3) δ: 8,1 (с, 1H), 7,6 (с, 1H), 3,93 (с, 3H). МС m/z 193 (М+H).
E: 3-(4-Бром-2-(трифторметил)фенокси)пропан-1-ол
3-Йодпропанол (11,23 г) добавляли к смеси 4-бром-2-(трифторметил)фенола (15 г) и карбоната калия (17,2 г) в ацетонитриле (150 мл). Вышеуказанную смесь кипятили с обратным холодильником в течение 4 часов, затем разбавляли этилацетатом (500 мл) и водой (300 мл). Органический слой отделяли, сушили над сульфатом магния, растворитель удаляли при пониженном давлении, получая при этом предполагаемый продукт, достаточно чистый для применения в следующей стадии (18,6 г).
1H ЯМР (CDCl3) δ: 7,67 (д, 1H), 7,58 (дд, 1H), 6,90 (дд, 1H), 4,18 (т, 2H), 3,87 (кв., 2H), 2,07 (тт, 2H).
F: 2-[3-(4-Бром-2-(трифторметил)фенокси)пропокси]тeтрагидро-2H-пиран
Смесь 3-(4-бром-2-(трифторметил)фенокси)пропан-1-ола (12 г), 3,4-дигидро-2Н-пирана (6,75 г) и гидрата п-толуолсульфоновой кислоты (0,76 г) в ТГФ (100 мл) перемешивали при комнатной температуре в течение 1 часа, затем разбавляли 10% карбонатом натрия (50 мл) и экстрагировали этилацетатом (2 × 150 мл). Органический слой затем сушили над сульфатом натрия, растворитель удаляли при пониженном давлении, получая при этом предполагаемый продукт (15 г).
1H ЯМР (CDCl3) δ: 7,67 (д, 1H), 7,56 (дд, 1H), 6,90 (дд, 1H), 4,56 (дд, 1H), 4,15 (т, 2H), 3,75-4,0 (м, 2H), 3,4-3,65 (м, 2H), 2,10 (м, 2H), 1,4-2,0 (м, 6H).
G: 4-(3-(Тeтрагидро-2H-пиран-2-илокси)пропокси)-3-(трифторметил)фенилбороновая кислота
BuLi (2,5 М, 19,1 мл) добавляли по каплям к раствору 2-(3-(4-бром-2-(трифторметил)фенокси)пропокси)тeтрагидро-2H-пирана (16,6 г) в ТГФ при -78°С в атмосфере N2 в течение 3 минут. После перемешивания при -78°С в течение еще 10 минут затем по каплям в течение 3 минут при -78°С добавляли триизопропилборат (11 мл). Смесь перемешивали при -78°С в течение дополнительных 20 минут, затем медленно нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 30 минут. Смесь затем гасили уксусной кислотой (10% в воде, 20 мл), экстрагировали EtOAc (200 мл), промывали насыщенным раствором соли (100 мл × 5), сушили над сульфатом натрия, растворитель удаляли при пониженном давлении, остаток растворяли в толуоле и затем растворитель удаляли в вакууме для захватывания им следов уксусной кислоты (повторяли 3 раза, до отсутствия запаха уксусной кислоты). Продукт по данным ЯМР содержит 3 набора пиков продукта, которые, как предполагается, относятся к мономеру, димеру и тримеру продукта.
1H ЯМР (CDCl3) δ: 7,8-8,4 (3×с и 3×д, 2H), 6,9-7,2 (3×д, 1H), 4,6 (м, 1H), 3,4-4,3 (м, 6H), 2,1-2,3 (м, 2H), 1,4-1,9 (м, 6H).
H: 4-(3-Гидроксипропокси)-3-(трифторметил)фенилбороновая кислота
4-(3-(Тeтрaгидро-2H-пиран-2-илокси)пропокси)-3-(трифторметил)фенилбороновую кислоту (30,6 г) добавляли к хлористоводородной кислоте (1 М в МеОН) и смесь нагревали при 50°С в течение 40 минут. Растворитель и HCl затем удаляли при пониженном давлении и остаток (20,3 г) применяли в следующей стадии без дополнительной очистки. Протонный ЯМР показал 2 набора пиков продукта, которые, как предполагается, относятся к мономеру и димеру или тримеру продукта. 1H ЯМР (CDCl3 (0,7 мл) + CD3ОD (0,2 мл)) δ: 7,7-8,0 (2×д и 2×с, 2H), 7,0 (2×д, 1H), 4,22 (т, 2H), 3,86 (т, 2H), 3,48 (тт, 2H).
I: 6-[4-(3-Гидроксипропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
Смесь 6-хлор-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила (6 г), 4-(3-гидроксипропокси)-3-(трифторметил)фенилбороновой кислоты (12,3 г), трис(дибензилиденацетон)дипалладия (1,42 г), трициклогексилфосфина (1,05 г) и трикалийфосфата (13,2 г) в диоксане (60 мл) и воде (24 мл) нагревали при 100°С в атмосфере N2 в течение 4 часов. Смесь затем разбавляли этилацетатом (400 мл), органический слой отделяли и растворитель удаляли при пониженном давлении, к остатку затем добавляли метанол (50 мл), продукт кристаллизовали и собирали фильтрованием (7,7 г).
1H ЯМР (ДМСО) δ: 8,67 (с, 1H), 8,60 (с, 1H), 8,43 (д, 1H), 8,37 (с, 1H), 7,41 (д, 1H), 4,55 (т, 1H), 4,25 (т, 2H), 3,99 (с, 3H), 3,58 (кв., 2H), 1,92 (тт, 2H). МС m/z 377 (М+H).
ПРИМЕР 2a
Соль HCl 6-[4-(3-диметиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
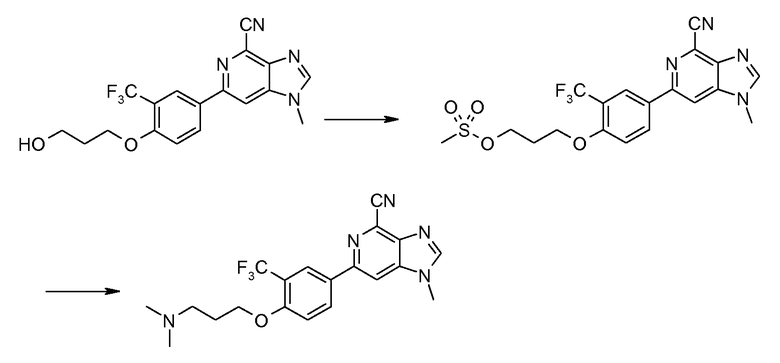
A: 3-[4-(4-Циано-1-метил-1Н-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси]пропилметансульфонат
Метансульфонилхлорид (2,65 г) добавляли по каплям к раствору 6-[4-(3-гидроксипропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила (6,7 г) и диизопропилэтиламина (9,7 мл) в NMP (40 мл). Смесь перемешивали при комнатной температуре в течение 3 часов. После добавления льда (100 г) твердый продукт собирали фильтрованием, промывали холодным этанолом (20 мл), получая при этом 3-[4-(4-циано-1-метил-1Н-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси]пропилметансульфонат (7,4 г).
1H ЯМР (ДМСО) δ: 8,69 (с, 1H), 8,62 (с, 1H), 8,45 (д, 1H), 8,41 (с, 1H), 7,47 (д, 1H), 4,40 (т, 1H), 4,32 (т, 2H), 3,99 (с, 3H), 3,18 (с, 3H), 2,21 (тт, 2H).
B: Соль HCl 6-[4-(3-диметиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Смесь 3-[4-(4-циано-1-метил-1Н-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси]пропилметансульфоната (300 мг) и диметиламина (2 М раствор в ТГФ, 1,65 мл) в NMP (3 мл) нагревали при 100°С в микроволновых условиях в течение 20 минут. Продукт затем очищали ВЭЖХ, получая при этом 6-[4-(3-диметиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли TFA. Вышеуказанную соль TFA затем растворяли в МеОН (3 мл) и пропускали через колонку с сильным катионообменником (SCX). После промывания метанолом для удаления остатка TFA продукт промывали 2 М аммиаком в метаноле. Затем после удаления растворителя получали свободное основание 6-[4-(3-диметиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила. Это свободное основание затем растворяли в смеси ТГФ-MeOH (5:1, 4 мл) и добавляли 2 М HCl в диэтиловом эфире (1 мл). После удаления всего растворителя при пониженном давлении соль HCl 6-[4-(3-диметиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила (110 мг) получали в виде белого твердого вещества.
1H ЯМР (CD3OD) δ: 8,52 (с, 1H), 8,62 (с, 1H), 8,35-8,45 (м, 3H), 7,36 (д, 1H), 4,35 (т, 2H), 4,04 (с, 3H), 3,39 (т, 2H), 2,97 (с, 6H), 2,33 (тт, 2H). МС m/z 404 (М+H).
Методику, описанную в примере 2а , далее применяли с использованием подходящих производных вторичных аминов для получения нижеследующих соединений в виде либо соли TFA, свободного основания или соли HCl.
2b : Соль TFA 1-метил-6-[4-(3-морфолин-4-илпропокси)-3-(трифторметил)фенил]-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (CD3OD) δ: 8,44 (с, 1H), 8,28-8,4 (м, 3H), 7,31 (д, 1H), 4,33 (т, 2H), 4,1 (ушир., 2H), 4,02 (с, 3H), 3,8 (ушир., 2H), 3,55 (ушир., 2H), 3,42 (т, 2H), 3,22 (ушир., 2H), 2,35 (тт, 2H). MС m/z 446 (M+1).
2c : Соль TFA 1-метил-6-[4-(3-пирролидин-1-илпропокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,32 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,7 (ушир., 2H), 3,45 (т, 2H), 3,15 (ушир., 2H), 2,32 (тт, 2H), 2,2 (ушир., 2H), 2,1 (ушир., 2H). МС m/z 430 (М+H).
2d : Соль TFA 6-{4-[3-((S)-2-гидроксиметилпирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,30 (д, 1H), 4,30 (м, 2H), 4,02 (с, 3H), 3,91 (дд, 1H), 3,6-3,8 (м, 4H), 3,3 (м, 2H), 2,35 (м, 2H), 2,25 (м, 1H), 2,17 (м, 1H), 2,06 (м, 1H), 1,95 (м, 1H). МС m/z 460 (М+H).
2e : Соль TFA 6-{4-[3-((R)-2-гидроксиметилпирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,30 (д, 1H), 4,30 (м, 2H), 4,02 (с, 3H), 3,91 (дд, 1H), 3,6-3,8 (м, 4H), 3,3 (м, 2H), 2,35 (м, 2H), 2,25 (м, 1H), 2,17 (м, 1H), 2,06 (м, 1H), 1,95 (м, 1H). МС m/z 460 (М+H).
2f : Соль TFA 1-метил-6-{4-[3-(4-метилпиперидин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,30 (д, 1H), 4,31 (т, 2H), 4,02 (с, 3H), 3,61 (ушир. д, 2H), 3,32 (т, 2H), 3,02 (т ушир., 2H), 2,3 (тт, 2H), 1,95 (д ушир., 2H), 1,74 (м, 1H), 1,47 (м, 2H), 1,0 (д, 3H). МС m/z 458 (М+H).
2g : Соль TFA 6-{4-[3-(N-этил-N-метиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,32 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,47 (м, 1H), 3,2-3,4 (м, 3H), 2,94 (с, 3H), 2,33 (м, 2H), 1,38 (т, 3H). МС m/z 418 (М+H).
2h : Соль TFA 6-{4-[3-(N-изопропил-N-метиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,3-8,4 (м, 3H), 7,31 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,69 (м, 1H), 3,5 (м, 1H), 3,3 (м, 1H), 2,87 (с, 3H), 2,3 (м, 2H), 1,40 (д, 3H), 1,38 (д, 3H). МС m/z 432 (М+H).
2i Соль TFA 6-{4-[3-(N-циклогексил-N-метиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,3-8,4 (м, 3H), 7,31 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,5 (м, 1H), 3,3 (м, 2H), 2,9 (с, 3H), 2,3 (м, 2H), 2,1 (м, 2H), 1,95 (м, 2H), 1,75 (м, 1H), 1,2-1,65 (м, 5H). МС m/z 472 (М+H).
2j : Соль TFA 6-{4-[3-(4-гидроксипиперидин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,3-8,4 (м, 3H), 7,32 (д, 1H), 4,32 (т, 2H), 4,1 (т, 0,5H), 4,02 (с, 3H), 3,85 (м, 0,5H), 3,66 (м, 1H), 3,45 (м, 1H), 3,35 (м, 3H), 3,12 (т ушир., 1H), 2,35 (м, 2H), 2,2 (м, 1H), 2,0 (м, 2H), 1,75 (м, 1H). МС m/z 460 (М+H).
2k : Соль TFA 6-{4-[3-(N-изопропил-N-2-метоксиэтиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,35-8,45 (м, 3H), 7,34 (д, 1H), 4,33 (т, 2H), 4,03 (с, 3H), 3,65-3,9 (м, 3H), 3,25-3,55 (м, 4H), 3,46 (перекрывания с м атомов H, с, 3H), 2,35 (м, 2H), 1,40 (д, 6H). МС m/z 476 (М+H).
2l : Соль TFA 6-{4-[3-(N,N-бис-(2-метоксиэтил)амино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,31 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,77 (т, 4H), 3,5-3,65 (м, 6H), 3,42 (с, 6H), 2,33 (м, 2H). МС m/z 492 (М+H).
2m : Соль TFA 6-{4-[3-(N-2-гидроксиэтил-N-изопропиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,35-8,45 (м, 3H), 7,33 (д, 1H), 4,33 (т, 2H), 4,02 (с, 3H), 3,75-3,95 (м, 3H), 3,35-3,5 (м, 3H), 3,25 (м, 1H), 2,35 (м, 2H), 1,41 (д, 6H). МС m/z 462 (М+H).
2n : Соль TFA 6-{4-[3-(цис-2,6-диметилморфолин-4-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,28-8,4 (м, 3H), 7,31 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,9 (м, 2H), 3,56 (д, 2H), 3,4 (т, 2H), 2,78 (т, 2H), 2,36 (м, 2H), 1,27 (д, 6H). МС m/z 474 (М+1).
2o : Соль TFA 6-{4-[3-(4-оксоимидазолидин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,28-8,4 (м, 3H), 7,31 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,97 (с, 2H), 3,55 (т, 2H), 2,32 (м, 2H). МС m/z 445 (М+1).
2p : Соль TFA 6-{4-[3-(1-оксо-2,8-диазаспиро[4,5]дец-8-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
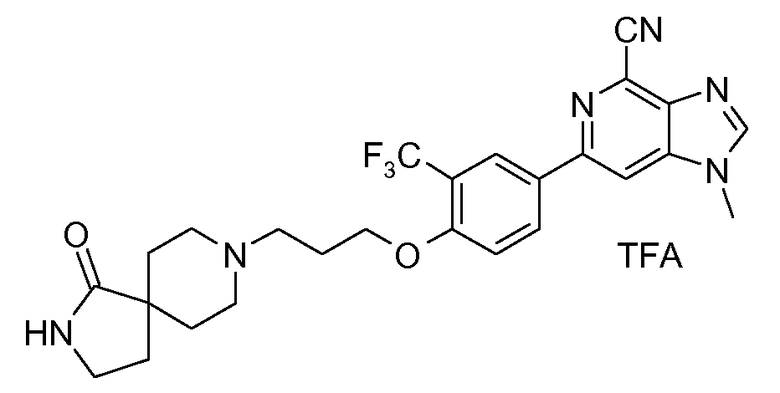
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,3-8,4 (м, 3H), 7,33 (д, 1H), 4,33 (т, 2H), 4,02 (с, 3H), 3,7 (м, 2H), 3,55 (м, 1H), 3,4 (м, 3H), 3,15 (м, 1H), 2,37 (м, 2H), 1,8-2,3 (м, 6H). МС m/z 513 (М+H).
2q .: Соль TFA 6-{4-[3-(2,4-диоксо-1,3,8-триазаспиро[4,5]дец-8-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
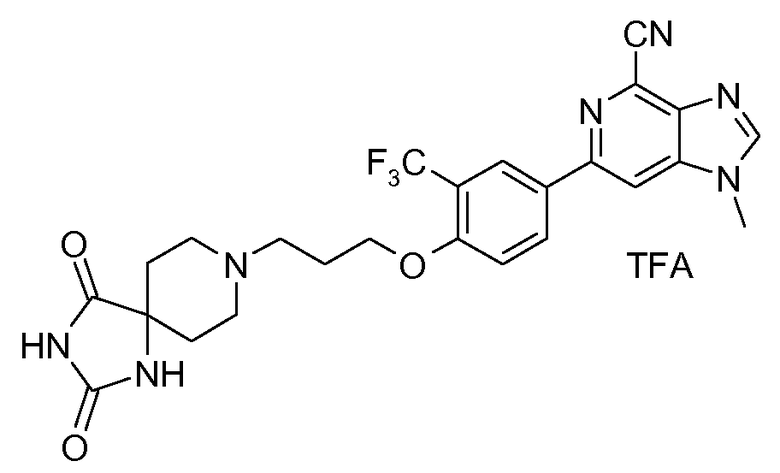
1H ЯМР (СD3OD) δ: 8,46 (с, 1H), 8,35-8,45 (м, 3H), 7,36 (д, 1H), 4,34 (т, 2H), 4,03 (с, 3H), 3,6-3,85 (м, 2H), 3,45 (м, 1H), 3,2 (м, 1H), 2,35 (м, 3H), 2,1 (м, 1H). МС m/z 528 (М+H).
2r : Соль TFA 1-метил-6-{4-[3-(5-оксо[1,4]диазепан-1-ил)пропокси]-3-(трифторметил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,36 (м, 2H), 2,86 (м, 2H), 3,38-3,62 (ушир. м, 4H), 3,44 (т, 2H), 3,58 (м, 2H), 4,02 (с, 3H), 4,33 (т, 2H), 7,35 (д, 1H), 8,39 (м, 1H), 8,40 (с, 2H), 8,45 (с, 1H). МС m/z 473 (М+1).
2s : Соль TFA 1-метил-6-{4-[3-(2-метил-1-оксо-2,8-диазаспиро[4,5]дец-8-ил)пропокси]-3-(трифтормeтил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
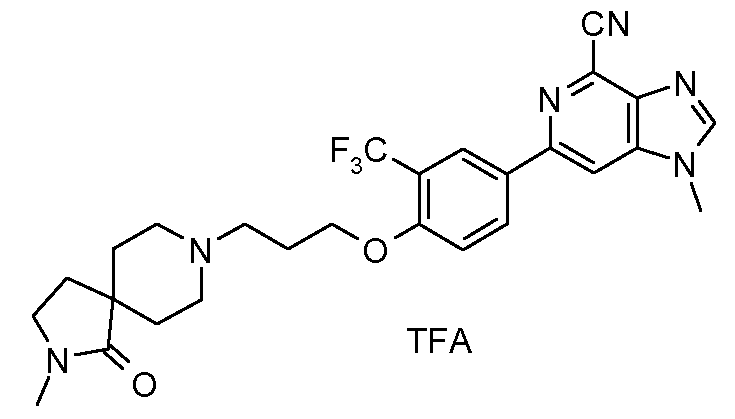
1H ЯМР (СD3OD) δ: 1,74-2,22 (ушир. м, 6H), 2,35 (м, 2H), 2,86 (с, 3H), 3,15 (м, 1H), 3,34-3,56 (ушир. м, 5H), 3,62-3,78 (ушир. м, 2H), 4,02 (с, 3H), 4,33 (т, 2H), 7,35 (д, 1H), 8,37 (м, 1H), 8,40 (с, 2H), 8,45 (с, 1H). МС m/z 527 (М+1).
2t : Соль TFA 1-метил-6-{4-[3-((R)-2-метилпиперидин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
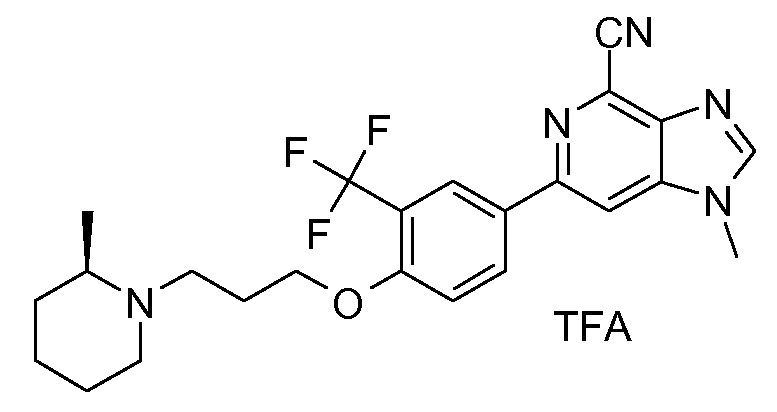
1H ЯМР (СD3OD) δ: 8,43 (с, 1H), 8,34 (ушир. с, 3H), 7,30 (д, 1H), 4,32 (м, 2H), 4,01 (с, 3H), 3,75 (м, 0,5H), 3,60 (м, 2H), 3,35 (м, 1H), 3,30 (м, 0,5H), 3,12 (м, 1H), 2,35 (м, 1H), 2,25 (м, 1H), 2,02 (м, 2H), 1,80 (м, 2H), 1,65 (м, 2H), 1,44 (д, 2H), 1,40 (д, 1H). МС m/z 458 (М+1).
2u : Соль HCl 6-[4-(3-N,N-диэтиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
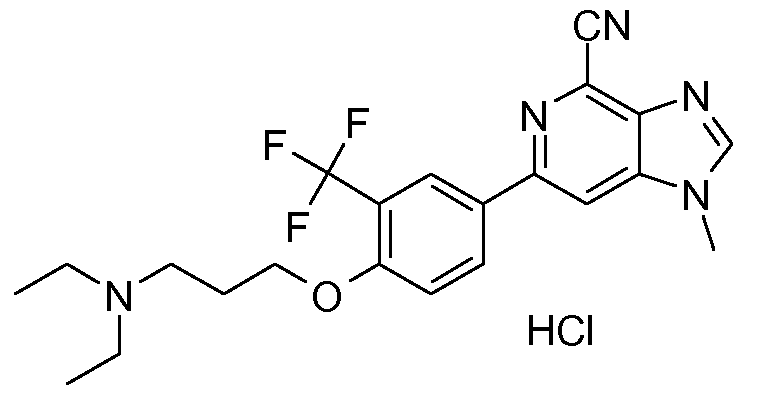
1H ЯМР (СD3OD) δ: 8,76 (с, 1H), 8,51 (с, 1H), 8,43 (с, 1H), 8,41 (д, 1H), 7,37 (д, 1H), 4,34 (т, 2H), 4,08 (с, 3H), 3,41 (т, 2H), 3,31 (кв., 4H), 2,30 (м, 2H), 1,38 (т, 6H). МС m/z 432 (М+1).
Методику, описанную в примере 2а , далее применяли с использованием подходящих производных первичных аминов для получения нижеследующих соединений в виде либо соли TFA, нейтрального соединения, либо соли HCl.
ПРИМЕР 3a
3а : Соль TFA 6-[4-(3-N-метиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,28-8,4 (м, 3H), 7,31 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,25 (т, 2H), 2,78 (с, 3H), 2,28 (м, 2H). МС m/z 390 (М+1).
3b : Соль TFA 6-[4-(3-N-циклобутиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,28-8,4 (м, 3H), 7,31 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,85 (м, 1H), 3,17 (т, 2H), 2,47 (м, 2H), 2,15-2,31 (м, 4H), 1,95 (м, 2H). МС m/z 430 (М+1).
3c : Соль TFA 6-{4-[3-(2,2-дифторэтиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,32 (м, 2H), 3,38 (м, 2H), 3,49 (кв., 2H), 3,64 (т, 2H), 4,00 (с, 3H), 4,38 (т, 2H), 6,30 (м, 3H), 7,35 (д, 1H), 8,39 (дд, 1H), 8,40 (с, 2H), 8,45 (с, 1H). МС m/z 440 (М+1).
3d : Соль TFA 1-метил-6-(4-{3-[(пиридин-2-илметил)амино]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,35 (м, 2H), 3,38 (м, 2H), 4,02 (с, 3H), 4,35 (т, 2H), 4,45 (с, 2H), 7,34 (д, 1H), 7,42 (м, 1H), 7,48 (д, 1H), 7,87 (м, 1H), 8,37 (дд, 1H), 8,38 (с, 2H), 8,44 (с, 1H), 8,62 (д, 1H). МС m/z 467 (М+1).
3e : Соль TFA 6-{4-[3-((R)-втор-бутиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 1,04 (т, 3H), 1,35 (д, 3H), 1,60 (м, 1H), 1,70 (м, 1H), 2,27 (м, 2H), 3,26 (м, 3H), 4,02 (с, 3H), 4,34 (т, 2H), 7,34 (д, 1H), 8,38 (дд, 1H), 8,39 (с, 2H), 8,45 (с, 1H). МС m/z 432 (М+1).
3f : Соль TFA 6-{4-[3-((R)-2-гидроксипропиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 1,25 (д, 3H), 2,30 (м, 2H), 3,05 (дд, 2H), 3,31 (м, 2H), 4,02 (с, 3H), 4,05 (м, 1H), 4,33 (т, 2H), 7,33 (д, 1H), 8,37 (дд, 1H), 8,38 (с, 2H), 8,45 (с, 1H). МС m/z 434,5 (М+1).
3g : Соль TFA 6-{4-[3-((S)-2-метокси-1-метилэтиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 1,37 (д, 3H), 2,28 (м, 2H), 3,31 (м, 2H), 3,43 (с, 3H), 3,46-3,56 (м, 2H), 3,67 (дд, 1H), 4,02 (с, 3H), 4,33 (т, 2H), 7,33 (д, 1H), 8,37 (дд, 1H), 8,38 (с, 2H), 8,45 (с, 1H). МС m/z 448 (М+1).
3h : Соль TFA 1-метил-6-{4-[3-(1-метилпиперидин-4-иламино)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
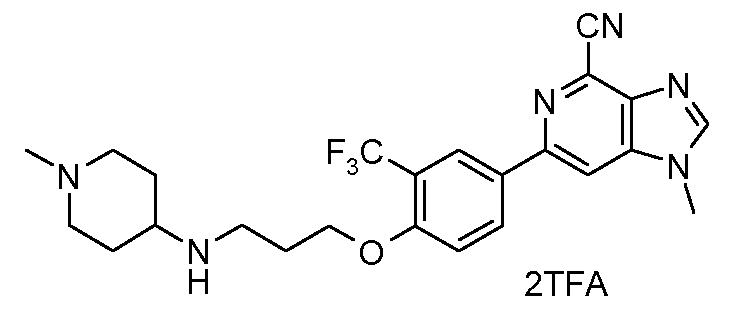
1H ЯМР (СD3OD) δ: 2,00 (м, 2H), 2,30 (м, 2H), 2,41 (м, 2H), 2,91 (с, 3H), 3,07-3,22 (м, 2H), 3,35 (м, 2H), 3,53 (м, 1H), 3,68 (м, 2H), 4,02 (с, 3H), 4,34 (т, 2H), 7,33 (д, 1H), 8,37 (дд, 1H), 8,39 (с, 2H), 8,45 (с, 1H). МС m/z 473 (М+1).
3i : Соль TFA 1-метил-6-[4-(3-{[(S)-1-(тeтрагидрофуран-2-ил)метил]амино}пропокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 1,65 (м, 1H), 1,98 (м, 2H), 2,15 (м, 1H), 2,29 (м, 2H), 3,00-3,26 (м, 2H), 3,31 (м, 2H), 3,83 (м, 1H), 3,94 (м, 1H), 4,02 (с, 3H), 4,17 (м, 1H), 4,33 (т, 2H), 7,33 (д, 1H), 8,37 (дд, 1H), 8,38 (с, 2H), 8,44 (с, 1H). МС m/z 460 (М+1).
3j : Соль TFA 6-(4-{3-[(1-гидроксициклопропилметил)амино]пропокси}-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 0,74 (т, 1H), 0,91 (т, 1H), 2,32 (м, 2H), 2,97 (с, 2H), 3,35 (м, 2H), 4,02 (с, 3H), 4,34 (м, 2H), 7,35 (д, 1H), 8,39 (дд, 1H), 8,40 (с, 2H), 8,45 (с, 1H). МС m/z 446 (М+1).
3k : Соль TFA 6-{4-[3-(4-гидроксициклогексиламино)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 1,32-1,52 (м, 4H), 2,07 (м, 2H), 2,16 (м, 2H), 2,26 (м, 2H), 3,13 (м, 1H), 3,30 (м, 2H), 3,57 (м, 1H), 4,02 (с, 3H), 4,36 (т, 2H), 7,35 (д, 1H), 8,39 (дд, 1H), 8,41 (с, 2H), 8,45 (с, 1H). МС m/z 474 (М+1).
ПРИМЕР 4a
Гидрохлорид 1-метил-6-{3-(трифторметил)-4-[3-(3,3,4-триметилпиперазин-1-ил)пропокси]фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
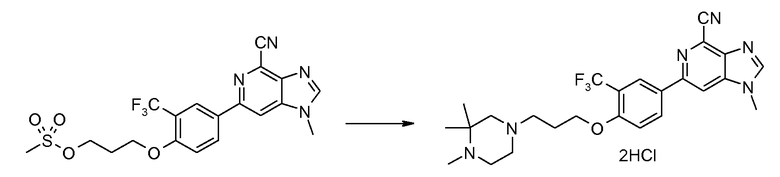
Смесь 3-(4-(4-циано-1-метил-1Н-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)пропилметансульфоната (200 мг) и 1,2,2-триметилпиперазина (226 мг) в NМP (2 мл) нагревали при 120°С в микроволновых условиях в течение 20 минут. Продукт затем очищали ВЭЖХ, получая при этом 1-метил-6-{3-(трифторметил)-4-[3-(3,3,4-триметилпиперазин-1-ил)пропокси]фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли ТFA. Вышеуказанную соль ТFA затем растворяли в МeOH (3 мл) и пропускали через колонку сильного катионообменника. После промывания метанолом для удаления остатка TFA продукт промывали 2 М аммиаком в мeтаноле. Затем после удаления растворителя получали свободное основание 1-метил-6-{3-(трифторметил)-4-[3-(3,3,4-триметилпиперазин-1-ил)пропокси]фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрила. Это свободное основание затем растворяли в смеси ТГФ-МeOH (5:1, 4 мл) и добавляли 2 М HCl в диэтиловом эфире (1 мл). После удаления всего растворителя при пониженном давлении гидрохлорид 1-метил-6-{3-(трифторметил)-4-[3-(3,3,4-триметилпиперазин-1-ил)пропокси]фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрила (125 мг) получали в виде белого твердого вещества.
1H ЯМР (СD3OD) δ: 8,73 (с, 1H), 8,50 (с, 1H), 8,42 (с, 1H), 8,40 (д, 1H), 7,38 (д, 1H), 4,35 (т, 2H), 4,08 (с, 3H), 3,2-4,0 (ушир., 4H, атомы Н кольца пиперазина), 3,7 (с ушир., 2H), 3,45 (т, 2H), 2,93 (с, 3H), 2,4 (м, 2H), 1,62 (с, 6H). МС m/z 487 (М+H).
Методику, описанную в примере 4а , далее применяли с использованием подходящих производных пиперазина для получения нижеследующих соединений в виде либо соли TFA, свободного основания, либо соли HCl.
4b : Гидрохлорид 6-{4-[3-(3,3-диметилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Данную реакцию проводили при комнатной температуре в течение 72 часов.
1H ЯМР (СD3OD) δ: 8,64 (с, 1H), 8,46 (с, 1H), 8,42 (с, 1H), 8,40 (д, 1H), 7,38 (д, 1H), 4,36 (т, 2H), 4,06 (с, 3H), 3,66 (с ушир., 2H), 3,45 (т, 2H), 3,3-3,7 (ушир., 4H, атомы Н кольца пиперазина), 2,45 (м, 2H), 1,62 (с, 6H). МС m/z 473 (М+H).
4c: Гидрохлорид 6-{4-[3-(цис-3,5-диметилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
Данную реакцию проводили при комнатной температуре в течение 72 часов.
1H ЯМР (СD3OD) δ: 8,64 (с, 1H), 8,47 (с, 1H), 8,44 (с, 1H), 8,42 (д, 1H), 7,40 (д, 1H), 4,40 (т, 2H), 4,08 (с, 3H), 3,95 (д, 2H), 3,90 (м, 2H), 3,56 (т, 2H), 3,27 (м, 2H), 2,48 (м, 2H), 1,51 (д, 6H). МС m/z 473 (М+H).
4d : Гидрохлорид 1-метил-6-{4-[3-(пиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Данную реакцию проводили при комнатной температуре в течение 72 часов.
1H ЯМР (СD3OD) δ: 8,85 (с, 1H), 8,53 (с, 1H), 8,42 (с, 1H), 8,40 (д, 1H), 7,39 (д, 1H), 4,38 (т, 2H), 4,10 (с, 3H), 3,7 (ушир., 2H), 3,55 (т, 2H), 3,2-4,0 (ушир., 8H, атомы Н пиперазина), 2,45 (м, 2H). МС m/z 445 (М+H).
4e : Гидрохлорид 1-метил-6-{4-[3-(4-метилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,59 (с, 1H), 8,45 (с, 1H), 8,42 (с, 1H), 8,40 (д, 1H), 7,39 (д, 1H), 4,37 (т, 2H), 4,05 (с, 3H), 3,2-4,1 (ушир., 8H, атомы Н пиперазина), 3,5 (м, 2H), 3,05 (с, 3H), 2,45 (м, 2H). МС m/z 459 (М+H).
4f : Гидрохлорид 6-{4-[3-(4-этилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,84 (с, 1H), 8,52 (с, 1H), 8,41 (с, 1H), 8,40 (д, 1H), 7,39 (д, 1H), 4,38 (т, 2H), 4,10 (с, 3H), 3,2-4,1 (ушир., 8H, атомы Н пиперазина), 3,55 (т, 2H), 3,40 (кв., 2H), 2,45 (м, 2H), 1,44 (т, 3H). МС m/z 473 (М+H).
4g : Гидрохлорид 6-(4-{3-[4-(2-гидроксиэтил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,71 (с, 1H), 8,49 (с, 1H), 8,42 (с, 1H), 8,40 (д, 1H), 7,39 (д, 1H), 4,38 (т, 2H), 4,07 (с, 3H), 3,96 (м, 2H), 3,2-4,1 (ушир., 8H, атомы Н пиперазина), 3,54 (т, 2H), 3,47 (м, 2H), 2,45 (м, 2H). МС m/z 489 (М+H).
4h : Соль TFA 1-метил-6-(4-{3-[4-(2-метоксиэтил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,32 (д, 1H), 4,30 (т, 2H), 4,02 (с, 3H), 3,71 (т, 2H), 3,45 (м, 2H), 3,40 (с, 3H), 3,2-3,5 (ушир., 8H), 3,17 (т, 2H), 2,25 (м, 2H). МС m/z 503 (М+H).
4i : Соль TFA 6-{4-[3-(4-изопропилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,30 (д, 1H), 4,31 (т, 2H), 4,02 (с, 3H), 3,3-3,7 (ушир., 9H, атомы Н пиперазина + i-PrCH), 3,23 (т, 2H), 2,30 (м, 2H), 1,40 (д, 6H). МС m/z 487 (М+H).
4j : Соль TFA 1-метил-6-(4-{3-[4-(2-метоксиэтил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,32 (д, 1H), 4,30 (т, 2H), 4,02 (с, 3H), 3,71 (т, 2H), 3,45 (м, 2H), 3,40 (с, 3H), 3,2-3,5 (ушир., 8H), 3,17 (т, 2H), 2,25 (м, 2H). МС m/z 503 (М+H).
4k : Соль TFA 1-метил-6-(4-{3-[4-(2-оксо-2-пирролидин-1-илэтил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,3-8,4 (м, 3H), 7,30 (д, 1H), 4,32 (м, 2H), 4,02 (с, 3H), 3,76 (с, 2H), 3,45 (кв., 4H), 3,40 (м, 5H), 3,31 (м, 5H), 2,3 (м, 2H), 2,0 (м, 2H), 1,9 (м, 2H). МС m/z 556 (М+H).
4l : Соль TFA 1-метил-6-{4-[3-(4-пиримидин-2-илпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,42 (д, 2H), 8,3-8,4 (м, 3H), 7,33 (д, 1H), 6,74 (т, 1H), 4,34 (т, 2H), 4,02 (с, 3H), 3,0-3,7 (ушир., 8H, атомы Н пиперазина), 3,45 (т, 2H), 2,37 (м, 2H). МС m/z 523 (М+H).
4m : Соль TFA 1-метил-6-{4-[3-(4-пиридин-2-илпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,46 (с, 1H), 8,35-8,45 (м, 3H), 8,17 (дд, 1H), 7,80 (т, 1H), 7,37 (д, 1H), 7,10 (д, 1H), 6,91 (т, 1H), 4,36 (т, 2H), 4,03 (с, 3H), 3,7-4,1 (ушир., 8H, атомы Н пиперазина), 3,45 (т, 2H), 2,40 (м, 2H). МС m/z 522 (М+H).
4n : 1-Метил-6-{4-[3-(3-оксопиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,46 (с, 1H), 8,69 (с, 1H), 8,62 (с, 1H), 8,35-8,5 (м, 2H), 7,52 (д, 1H), 4,25 (т, 2H), 3,99 (с, 3H), 3,2 (ушир., 2H), 2,98 (ушир., 2H), 2,6 (ушир., 4H), 2,0 (ушир., 2H). МС m/z 459 (М+H).
4o : Соль TFA 6-{4-[3-(4-ацетилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,43 (с, 1H), 8,3-8,4 (м, 3H), 7,28 (д, 1H), 4,32 (т, 2H), 4,01 (с, 3H), 3,1-3,7 (ушир., 8H, атомы Н пиперазина), 3,45 (т, 2H), 2,38 (м, 2H), 2,17 (с, 3H). МС m/z 487 (М+H).
4p : Соль TFA 6-(4-{3-[4-(этоксикарбонил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,3-8,4 (м, 3H), 7,30 (д, 1H), 4,32 (т, 2H), 4,19 (кв., 2H), 4,02 (с, 3H), 3,1-3,7 (ушир., 8H, атомы Н пиперазина), 3,43 (т, 2H), 2,38 (м, 2H), 1,29 (т, 3H). МС m/z 517 (М+H).
4q .: Соль TFA 6-(4-{3-[4-(диметиламинокарбонил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,36 (м, 2H), 2,91 (с, 6H), 3,29-3,32 (м, 7H), 3,43 (м, 3H), 4,02 (с, 3H), 4,33 (т, 2H), 7,33 (д, 1H), 8,37 (м, 1H), 8,38 (с, 2H), 8,45 (с, 1H). МС m/z 516 (М+1).
4r : Соль TFA 1-метил-6-{4-[3-(4-пиридин-4-илпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,39 (м, 2H), 3,44 (м, 2H), 3,54 (ушир. с, 4H), 4,02 (с, 3H), 4,07 (ушир. с, 4H), 4,36 (т, 2H), 7,31 (д, 2H), 7,35 (д, 1H), 8,27 (д, 2H), 8,39 (дд, 1H), 8,41 (с, 2H), 8,45 (с, 1H). МС m/z 522 (М+1).
4s : Соль TFA 1-метил-6-{4-[3-(6-метил-6,9-диазаспиро[4,5]дец-9-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
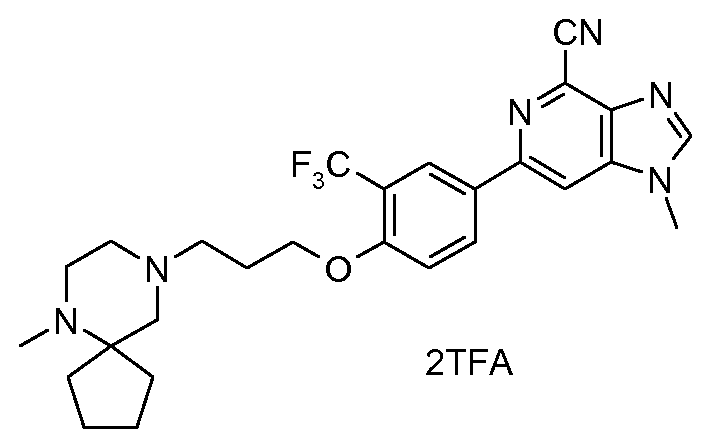
1H ЯМР (СD3OD) δ: 1,62-1,84 (ушир. м, 4H), 1,84-2,02 (ушир. м, 4H), 2,08 (м, 2H), 2,58-3,00 (ушир. м, 6H), 2,73 (т, 2H), 2,82 (с, 3H), 4,02 (с, 3H), 4,28 (т, 2H), 7,33 (д, 1H), 8,36 (дд, 1H), 8,39 (с, 2H), 8,45 (с, 1H). МС m/z 513 (М+1).
4t : Соль TFA 6-{4-[(R)-3-(гексагидропирроло[1,2-a]пиразин-2-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 1,88 (м, 1H), 2,08-2,30 (ушир. м, 5H), 2,80 (т, 1H), 2,95 (т, 1H), 3,06 (м, 2H), 3,18 (м, 1H), 3,30 (м, 2H), 3,40-3,65 (ушир. м, 4H), 4,02 (с, 3H), 4,30 (т, 2H), 7,32 (д, 1H), 8,35 (м, 1H), 8,38 (с, 2H), 8,45 (с, 1H).
МС m/z 485 (М+1).
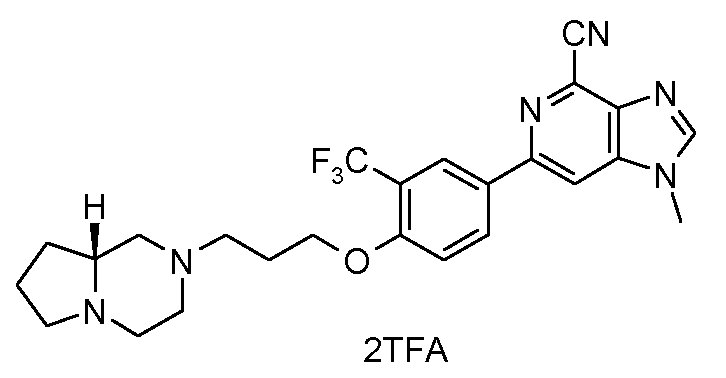
ПРИМЕР 5a
Гидрохлорид 1-метил-6-(4-{3-[4-(N-метиламинокарбонил)пиперидин-1-ил]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
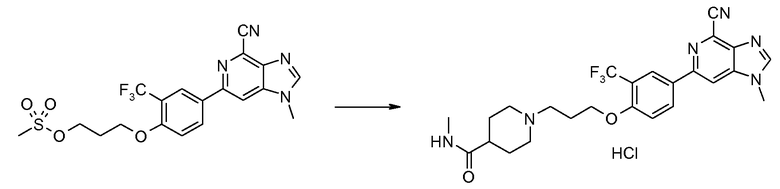
Смесь 3-[4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил]-2-(трифторметил)фенокси)пропилмeтансульфоната (83 мг) и N-метилпиперидин-4-карбоксамида (78 мг) в NМP (1 мл) нагревали при 120°С в микроволновых условиях в течение 20 минут. Продукт затем очищали ВЭЖХ, получая при этом ожидаемый продукт, 1-метил-6-(4-{3-[4-(N-метиламинокарбонил)пиперидин-1-ил]пропокси}-3-(трифторметил)фенил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрил, в виде соли TFA. Вышеуказанную соль ТFA затем растворяли в МeOH (3 мл) и пропускали через колонку сильного катионообменника. После промывания метанолом для удаления остатка ТFA продукт промывали 2 М аммиаком в метаноле. Затем после удаления растворителя получали свободное основание 1-метил-6-(4-{3-[4-(N-метиламинокарбонил)пиперидин-1-ил]пропокси}-3-(трифторметил)фенил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрила. Это свободное основание растворяли в смеси ТГФ-МeOH (5:1, 4 мл) и затем добавляли 2 М HCl в диэтиловом эфире (1 мл). После удаления всего растворителя при пониженном давлении гидрохлорид 1-метил-6-(4-{3-[4-(N-метиламинокарбонил)пиперидин-1-ил]пропокси)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрил (64 мг) получали в виде белого твердого вещества. 1H ЯМР (СD3OD) δ: 8,66 (с, 1H), 8,48 (с, 1H), 8,42 (с, 1H), 8,40 (д, 1H), 7,33 (д, 1H), 4,33 (т, 2H), 4,06 (с, 3H), 3,70 (д ушир., 2H), 3,49 (ушир., 1H), 3,37 (т, 2H), 3,08 (т, 2H), 2,74 (с, 3H), 2,55 (м, 1H), 2,35 (м, 2H), 2,1 (м, 2H), 2,0 (м, 2H). МС m/z 501 (М+H).
Методику, описанную в примере 5а , далее применяли с использованием подходящих производных амина для получения нижеследующего соединения в виде либо соли TFA, свободного основания, либо соли HCl.
5b : Соль TFA 6-(4-{3-[(R)-2-(аминокарбонил)пирролидин-1-ил]пропокси}-3-(трифторметил)фенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (ДМСО) δ: 8,71 (с, 1H), 8,64 (с, 1H), 8,48 (д, 1H), 8,42 (с, 1H), 8,12 (с, 1H), 7,88 (с, 1H), 7,42 (д, 1H), 4,35 (м, 2H), 4,12 (м, 1H), 3,99 (с, 3H), 3,69 (ушир. м, 1H), 3,38 (ушир. м, 2H), 3,25 (ушир. м, 1H), 2,49 (м, 1H), 2,18 (м, 2H), 2,08 (м, 1H), 1,88 (м, 2H). МС m/z 473 (М+1).
ПРИМЕР 6a
Соль TFA 6-(4-{3-[N-(2-диметиламиноэтил)-N-метиламино]пропокси}-3-(трифторметил)фенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
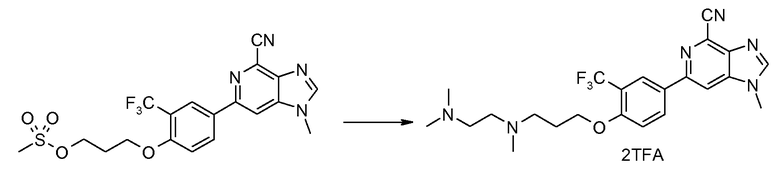
Смесь 3-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)пропилметансульфоната (20 мг) и N,N',N'- триметилэтилендиамина (22 мг) в NМP (1 мл) нагревали при 100°С в микроволновых условиях в течение 20 минут. Продукт затем очищали ВЭЖХ, получая при этом 6-(4-{3-[N-(2-диметиламиноэтил)-N-метиламино]пропокси}-3-(трифторметил)фенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли ТFA.
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,28-8,38 (м, 3H), 7,30 (д, 1H), 4,32 (т, 2H), 4,02 (с, 3H), 3,70 (м, 4H), 3,48 (т, 2H), 3,03 (с, 3H), 2,98 (с, 6H), 2,39 (м, 2H). МС m/z 461 (М+H).
Методику, описанную в примере 6а , далее применяли с использованием подходящих производных бисамина для получения нижеследующих соединений в виде либо соли TFA, свободного основания, либо соли HCl.
6b : Соль TFA 1-метил-6-(4-{3-[N-(2-морфолин-4-илэтил)амино]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
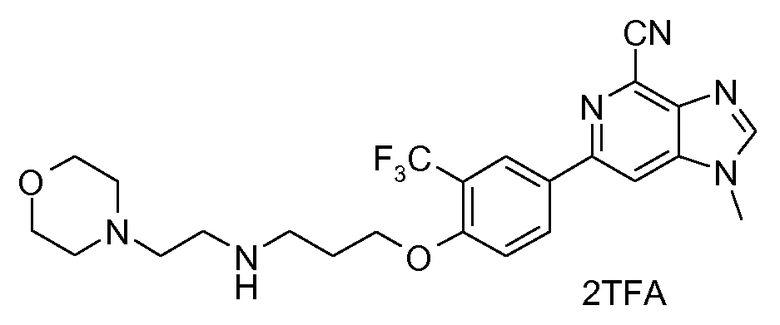
1H ЯМР (СD3OD) δ: 8,44 (с, 1H), 8,25-8,38 (м, 3H), 7,29 (д, 1H), 4,33 (т, 2H), 4,01 (с, 3H), 3,94 (т, 4H), 3,58 (т, 2H), 3,51 (т, 2H), 3,3-3,45 (м, 6H), 2,32 (м, 2H). МС m/z 489 (М+H).
6c : Соль TFA 1-метил-6-(4-{3-[4-(пирролидин-1-ил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,35-8,43 (м, 3H), 7,32 (д, 1H), 4,33 (т, 2H), 4,03 (с, 3H), 3,7 (м, 2H), 3,48 (м, 1H), 3,38 (т, 2H), 3,7 (ушир., 2H), 3,15 (ушир., 4H), 2,5 (м, 2H), 2,35 (м, 2H), 2,0-2,3 (м, 6H). МС m/z 513 (М+H).
6d : Соль TFA 6-[4-(3-[1,4]дазепан-1-илпропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,33-8,45 (м, 4H), 7,32 (д, 1H), 4,34 (т, 2H), 4,02 (с, 3H), 3,76 (м, 2H), 3,68 (м, 2H), 3,57 (м, 2H), 3,47 (4H), 2,35 (м, 4H). МС m/z 459 (М+H).
6e : Соль TFA 1-метил-6-{4-[3-(4-метил[1,4]диазепан-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,33 (м, 4H), 2,99 (с, 3H), 3,40 (т, 2H), 3,51 (ушир. с, 4H), 3,75 (с, 4H), 4,02 (с, 3H), 4,33 (т, 2H), 7,34 (д, 1H), 8,37 (дд, 1H), 8,39 (с, 2H), 8,45 (с, 1H). МС m/z 473 (М+1).
6f : Соль TFA 6-{4-[(1R,5S)-3-(3,8-диазабицикло[3.2.1]окт-3-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,01 (м, 4H), 2,10 (м, 2H), 2,48 (д, 2H), 2,68 (т, 2H), 2,93 (д, 2H), 3,99 (ушир. с, 2H), 4,03 (с, 3H), 4,28 (т, 2H), 7,34 (д, 1H), 8,37 (м, 1H), 8,39 (с, 2H), 8,44 (с, 1H). МС m/z 471 (М+1).
6g : Соль TFA 6-{4-[3-((S)-3-диметиламинопирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,35 (м, 3H), 2,66 (м, 1H), 2,98 (с, 6H), 3,30 (м, 2H), 3,50 (м, 2H), 3,70-4,00 (ушир. м, 2H), 4,02 (с, 3H), 4,18 (м, 1H), 4,33 (т, 2H), 7,33 (д, 1H), 8,36 (м, 1H), 8,38 (с, 2H), 8,45 (с, 1H). МС m/z 473 (М+1).
6h : Соль TFA 6-{4-[3-((R)-3-диметиламинопирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 2,35 (м, 3H), 2,66 (м, 1H), 2,96 (с, 6H), 3,30 (м, 2H), 3,50 (м, 2H), 3,70-4,00 (ушир. м, 2H), 4,02 (с, 3H), 4,18 (м, 1H), 4,33 (т, 2H), 7,33 (д, 1H), 8,36 (дд, 1H), 8,38 (с, 2H), 8,45 (с, 1H). МС m/z 473 (М+1).
ПРИМЕР 7a
Соль TFA 1-метил-6-{4-[3-(2-метилимидазол-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Смесь 3-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)пропилметансульфоната (20 мг) и 2-метилимидазола (22 мг) в NМP (1 мл) нагревали при 120°С в микроволновых условиях в течение 50 минут. Продукт затем очищали ВЭЖХ, получая при этом ожидаемый продукт, 1-метил-6-{4-[3-(2-метилимидазол-1-ил)пропокси]-3-(трифторметил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли ТFA.
1H ЯМР (СD3OD) δ: 8,48 (с, 1H), 8,35-8,45 (м, 3H), 7,54 (д, 1H), 7,48 (д, 1H), 7,35 (д, 1H), 4,43 (т, 2H), 4,31 (т, 2H), 4,06 (с, 3H), 2,68 (с, 3H), 2,48 (м, 2H). МС m/z 441 (М+H).
Методику, описанную в примере 7а , далее применяли с использованием подходящих исходных веществ для получения нижеследующих соединений в виде соли TFA.
7b : Соль TFA 6-{4-[3-(2-этилимидазол-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,35-8,44 (м, 3H), 7,54 (д, 1H), 7,48 (д, 1H), 7,35 (д, 1H), 4,42 (т, 2H), 4,29 (т, 2H), 4,03 (с, 3H), 3,04 (кв., 2H), 2,68 (с, 3H), 2,43 (м, 2H), 1,39 (т, 3H). МС m/z 455 (М+H).
7c : Соль TFA 1-метил-6-{4-[3-(4,5,6,7-тeтрагидробензоимидазол-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,56 (с, 1H), 8,45 (с, 1H), 8,35-8,43 (м, 3H), 7,32 (д, 1H), 4,35 (т, 2H), 4,28 (т, 2H), 4,03 (с, 3H), 2,65 (м, 4H), 2,37 (м, 2H), 1,90 (м, 4H). МС m/z 481 (М+H).
ПРИМЕР 8
6-[4-(2-Гидроксиэтокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
A: 2-(4-Бром-2-(трифторметил)фенокси)этанол
2-Бромэтанол (23,3 г) добавляли к смеси 4-бром-2-(трифторметил)фенола (30 г) и карбоната калия (34,4 г) в aцeтoнитриле (200 мл). Вышеуказанную смесь кипятили с обратным холодильником в течение 8 часов, затем добавляли другую порцию 2-бромэтанола (8 г) и продолжали кипячение с обратным холодильником в течение еще 6 часов. После разбавления этилацетатом (500 мл) смесь промывали водой (300 мл), затем 0,1 М гидроксидом натрия (200 мл). Органический слой сушили над сульфатом магния, растворитель удаляли при пониженном давлении, остаток растворяли в гептане при нагревании, 2-(4-бром-2-(трифторметил)фенокси)этанол кристаллизовали и собирали фильтрованием (17 г).
1H ЯМР (СDCl3) δ: 7,69 (д, 1H), 7,59 (дд, 1H), 6,90 (д, 1H), 4,15 (т, 2H), 3,97 (т, 2H).
B: 2-(2-(4-Бром-2-(трифторметил)фенокси)этокси)тетрагидро-2H-пиран
Смесь 2-(4-бром-2-(трифторметил)фенокси)этанола (16 г), 3,4-дигидро-2H-пирана (9,5 г) и гидрат п-толуолсульфоновой кислоты (0,5 г) в ТГФ (100 мл) перемешивали при комнатной температуре в течение 1 часа, затем разбавляли 5% бикарбонатом натрия (300 мл) и экстрагировали этилацетатом (500 мл). Органический слой затем сушили над сульфатом натрия, растворитель удаляли в вакууме, получая при этом предполагаемый продукт (21 г).
1H ЯМР (СDCl3) δ: 7,67 (д, 1H), 7,58 (дд, 1H), 6,93 (д, 1H), 4,71 (м, 1H), 4,23 (т, 2H), 4,08 (м, 1H), 3,75-3,95 (м, 2H), 3,53 (м, 1H), 1,5-1,9 (м, 6H).
C: 4-(2-(Тетрагидро-2H-пиран-2-илокси)этокси)-3-(трифторметил)фенилбороновая кислота
BuLi (2,5 М, 6 мл) добавляли по каплям к раствору 2-(2-(4-бром-2-(трифторметил)фенокси)этокси)тетрагидро-2H-пирана (5 г) в ТГФ (50 мл) при -78°С в атмосфере N2 в течение 3 минут. После перемешивания при -78°С в течение еще 10 минут затем в течение 2 минут при -78°С по каплям добавляли триизопропилборат (3,8 мл). Смесь перемешивали при -78°С в течение еще 30 минут, затем медленно нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 30 минут. Смесь затем гасили уксусной кислотой (10% в воде, 20 мл), экстрагировали EtOAc (300 мл), промывали водой (200 мл × 3), сушили над сульфатом натрия, растворитель удаляли при пониженном давлении, остаток растворяли в толуоле и затем растворитель удаляли при пониженном давлении для удаления с ним следов уксусной кислоты (повторяли 3 раза, до тех пор, пока не стало запаха уксусной кислоты) (4,5 г).
1H ЯМР (СDCl3) δ: 8,38 (м, 1H), 8,33 (м, 1H), 7,16 (м, 1H), 4,74 (м, 1H), 4,22 (м, 2H), 4,08 (м, 1H), 3,92-3,80 (м, 2H), 3,56-3,50 (м, 1H), 1,90-1,68 (м, 2H), 1,65-1,48 (м, 4H).
D: 4-(2-Гидроксиэтокси)-3-(трифторметил)фенилбороновая кислота
4-(2-(Тeтрагидро-2H-пиран-2-илокси)этокси)-3-(трифторметил)фенилбороновую кислоту (8 г) добавляли к хлористоводородной кислоте (1 М в МeOH) и смесь нагревали при 60°С в течение 60 минут. Растворитель и HCl затем удаляли при пониженном давлении и остаток (5,52 г) применяли для следующей стадии без дополнительной очистки.
1H ЯМР (CDCl3 (0,7 мл) + CD3OD (0,2 мл)) δ: 7,97 (с, 1H), 7,88 (д, 1H), 7,0 (д, 1H), 4,19 (т, 2H), 3,98 (т, 2H).
E: 6-[4-(2-Гидроксиэтокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
Смесь 6-хлор-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила (0,75 г), 4-(2-гидроксиэтокси)-3-(трифторметил)фенилбороновой кислоты (1,46 г), трис(дибензилиденацетон)дипалладия (0,18 г), трициклогексилфосфина (0,13 г) и трикалийфосфата (1,65 г) в диоксане (7,5 мл) и воде (3 мл) нагревали при 100°С в атмосфере N2 в течение 3 часов. Смесь затем разбавляли этилацетатом (100 мл), органический слой отделяли и растворитель удаляли при пониженном давлении, остаток затем пропускали через колонку силикагеля с применением смеси DCМ-МeOH (3%) в качестве элюента, получая при этом 6-[4-(2-гидроксиэтокси)-3-(трифторметил)фенил]-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (1,07 г).
1H ЯМР (ДМСО) δ: 8,65 (с, 1H), 8,60 (с, 1H), 8,40 (д, 1H), 8,39 (с, 1H), 7,43 (д, 1H), 4,9 (т, 1H), 4,25 (т, 1H), 3,97 (с, 3H), 3,30 (м, 1H). МС m/z 363 (М+H).
ПРИМЕР 9a
Соль TFA 6-{4-[2-(6,9-диазаспиро[4,5]дец-9-ил)этокси]-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
A: 2-(4-(4-Циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфонат
Мeтансульфонилхлорид (0,23 мл) добавляли по каплям к раствору 6-(4-(2-гидроксиэтокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила (0,77 г) и диизопропилэтилaмина (1,2 мл) в NМP (6 мл). Смесь перемешивали при комнатной температуре в течение 3 часов. После добавления холодной воды (20 мл) твердый продукт собирали фильтрованием, промывали холодным этанолом (20 мл), получая при этом 2-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфонат (0,89 г). 1H ЯМР (ДМСО) δ: 8,72 (с, 1H), 8,64 (с, 1H), 8,47 (д, 1H), 8,43 (с, 1H), 7,48 (д, 1H), 4,58 (т, 2H), 4,51 (т, 2H), 3,99 (с, 3H), 3,23 (с, 3H). МС m/z 441 (М+1).
B: Соль TFA 6-{4-[2-(6,9-диазаспиро[4,5]дец-9-ил)этокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Смесь 2-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфоната (20 мг) и 6,9-диазаспиро[4,5]декана (33 мг) в NМP (1 мл) перемешивали при комнатной температуре в течение 72 часов. Продукт затем очищали ВЭЖХ, получая при этом предполагаемый продукт, 6-{4-[2-(6,9-диазаспиро[4,5]дец-9-ил)этокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил, в виде соли ТFA. 1H ЯМР (CD3OD) δ: 8,45 (с, 1H), 8,3-8,43 (м, 3H), 7,34 (д, 1H), 4,36 (т, 2H), 4,02 (с, 3H), 3,26 (т, 2H), 3,02 (т, 2H), 2,90 (ушир., 2H), 2,77 (с, 2H), 2,05 (м, 2H), 1,6-1,9 (м, 6H). МС m/z 485 (М+H).
Методику, описанную в примере 9а , далее применяли с использованием подходящих производных амина для получения нижеследующих соединений в виде либо соли TFA, свободного основания, либо соли HCl.
9b : Соль TFA 6-{4-[2-(3,3-диметилпиперазин-1-ил)этокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
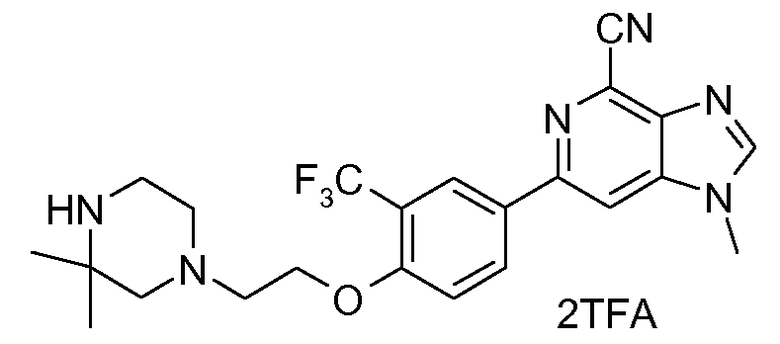
1H ЯМР (CD3OD) δ: 8,45 (с, 1H), 8,3-8,43 (м, 3H), 7,34 (д, 1H), 4,36 (т, 2H), 4,02 (с, 3H), 3,28 (т, 2H), 3,02 (т, 2H), 2,92 (ушир., 2H), 2,75 (с, 2H), 1,42 (с, 6H). МС m/z 459 (М+H).
9c : Соль TFA 1-метил-6-{4-[2-(пиперазин-1-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (CD3CN) δ: 8,60 (с, 1H), 8,56 (д, 1H), 8,48 (с, 1H), 8,45 (с, 1H), 7,51 (д, 1H), 4,72 (т, 2H), 4,14 (с, 3H), 3,58-3,73 (м, 10H). МС m/z 431 (М+H).
9d : 6-{4-[2-(цис-3,5-Диметилпиперазин-1-ил)этокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CDCl3) δ: 8,28 (д, 1H), 8,22 (с, 1H), 8,08 (с, 1H), 7,87 (с, 1H), 7,12 (д, 1H), 4,28 (т, 2H), 3,99 (с, 3H), 3,49 (с, 1H), 2,85-3,05 (м, 6H), 1,88 (т, 2H), 1,09 (д, 6H). МС m/z 459 (М+H).
9e : 6-{4-[2-(4-Изопропилпиперазин-1-ил)этокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CDСl3) δ: 8,27 (д, 1H), 8,22 (с, 1H), 8,08 (с, 1H), 7,87 (с, 1H), 7,11 (д, 1H), 4,28 (т, 2H), 3,99 (с, 3H), 2,92 (т, 2H), 2,5-2,8 (ушир., 9H, атомы H пиперазина + СН изопропила), 1,08 (д, 6H). МС m/z 473 (М+H).
ПРИМЕР 10a
Соль TFA 1-метил-6-{4-[2-(2-метилимидазол-1-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
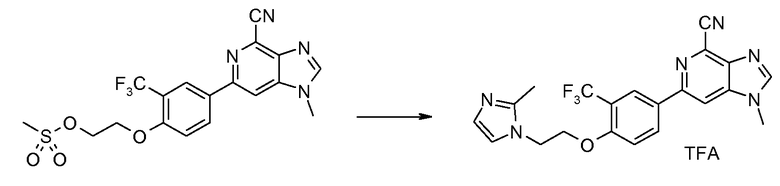
Смесь 2-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфонат (20 мг) и 2-метилимидазола (20 мг) в NМP (1 мл) нагревали с применением микроволновых условий при 120°С в течение 40 минут. Продукт затем очищали ВЭЖХ, получая при этом предполагаемый продукт, 1-метил-6-{4-[2-(2-метилимидазол-1-ил)этокси]-3-(трифторметил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил, в виде соли ТFA.
1H ЯМР (CD3OD) δ: 8,45 (с, 1H), 8,3-8,43 (м, 3H), 7,61 (д, 1H), 7,50 (д, 1H), 7,37 (д, 1H), 4,69 (т, 2H), 4,59 (т, 2H), 4,02 (с, 3H), 2,75 (с, 3H). МС m/z 427 (М+H).
Методику, описанную в примере 10а , далее применяли с использованием подходящих производных амина/имидазола для получения нижеследующих соединений в виде либо соли TFA, соли HCl, либо нейтрального соединения.
10b : Соль TFA 1-метил-6-{4-[2-(4,5,6,7-тeтрагидробензимидазол-1-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
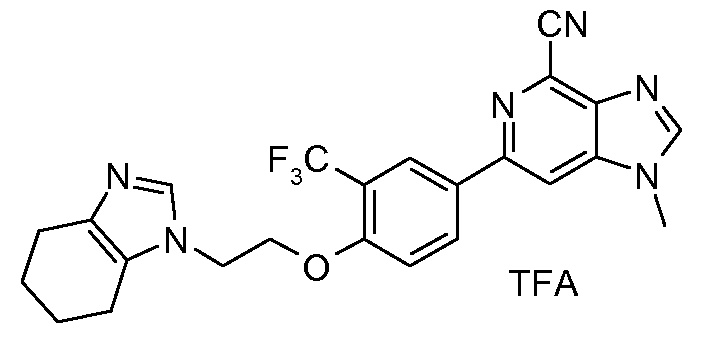
1H ЯМР (CD3OD) δ: 8,76 (с, 1H), 8,46 (с, 1H), 8,3-8,43 (м, 3H), 7,36 (д, 1H), 4,66 (т, 2H), 4,55 (т, 2H), 4,02 (с, 3H), 2,76 (м, 2H), 2,68 (м, 2H), 1,85-2,05 (м, 4H). МС m/z 467 (М+H).
10c : 1-Метил-6-{4-[2-(4-(2-метоксиэтил)пиперазин-1-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CDСl3) δ: 8,27 (д, 1H), 8,22 (с, 1H), 8,08 (с, 1H), 7,87 (с, 1H), 7,11 (д, 1H), 4,28 (т, 2H), 3,99 (с, 3H), 3,53 (т, 2H), 3,36 (с, 3H), 2,92 (т, 2H), 2,5-2,8 (ушир., 10H). МС m/z 489 (М+H).
10d : 6-(4-{2-[4-(2-Гидроксиэтил)пиперазин-1-ил]этокси}-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c1пиридин-4-карбонитрил
1H ЯМР (CDСl3) δ: 8,27 (д, 1H), 8,22 (с, 1H), 8,08 (с, 1H), 7,87 (с, 1H), 7,12 (д, 1H), 4,28 (т, 2H), 3,99 (с, 3H), 3,65 (т, 2H), 2,92 (т, 2H), 2,5-2,8 (ушир., 10H). МС m/z 475 (М+H).
10e : 1-Метил-6-(4-{2-[4-(пиридин-4-ил)пиперазин-1-ил]этокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,72 (с, 1H), 8,64 (с, 1H), 8,44 (м, 1H), 8,42 (с, 1H), 8,15 (д, 2H), 7,49 (м, 1H), 6,83 (д, 2H), 4,37 (м, 2H), 3,99 (с, 3H), 3,30 (м, 4H), 2,84 (м, 2H), 2,66 (м, 4H). МС m/z 508 (М+1).
ПРИМЕР 11
1-Метил-6-{4-[2-(8-метил-2,4-диоксо-1,3,8-триазаспиро[4.5]дец-3-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
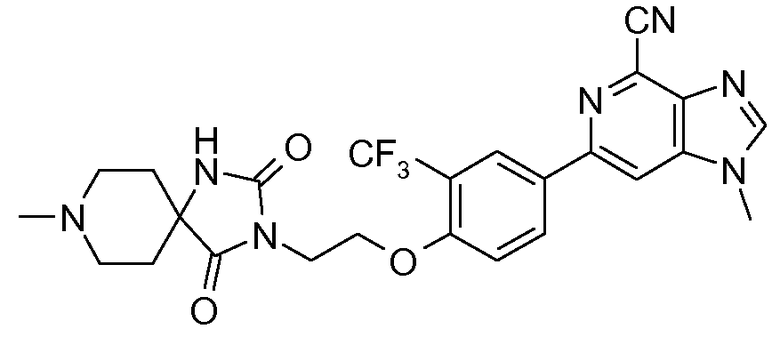
Раствор 8-метил-1,3,8-триазаспиро[4.5]декан-2,4-диона (40 мг) в ДМФА (0,6 мл) добавляли к раствору 2-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфоната (50 мг) в ДМФА (0,4 мл), K2CO3 (41 мг) и иодида тетрабутиламмония (ТBAI, 26 мг). Смесь перемешивали при 90°С в течение 14 часов. Сырую смесь сразу очищали препаративной ВЭЖХ (ВЭЖХ: колонка XBridge МS C18 30×100 мм, 5 мкм, элюент: A: NH4HCO3, 10 ммоль, pH=9,5/B: ацетонитрил, фокусированный градиент/8 минут/50 мл/мин), получая при этом 1-метил-6-{4-[2-(8-метил-2,4-диоксо-1,3,8-триазаспиро[4.5]дец-3-ил)этокси]-3-(трифторметил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (20 мг).
1H ЯМР (ДМСО) δ: 8,77 (ушир. с, 1H), 8,72 (с, 1H), 8,64 (с, 1H), 8,43 (м, 1H), 8,39 (с, 1H), 8,16 (ушир. с, 1H), 7,47 (м, 1H), 4,41 (м, 2H), 3,99 (с, 3H), 3,81 (м, 2H), 2,73 (м, 2H), 2,33 (м, 2H), 2,23 (с, 3H), 1,86 (м, 2H), 1,51 (м, 2H). МС m/z 528 (М+1).
ПРИМЕР 12
6-{4-[2-(2,4-Диоксо-1,3,8-триазаспиро[4.5]дец-3-ил)этокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
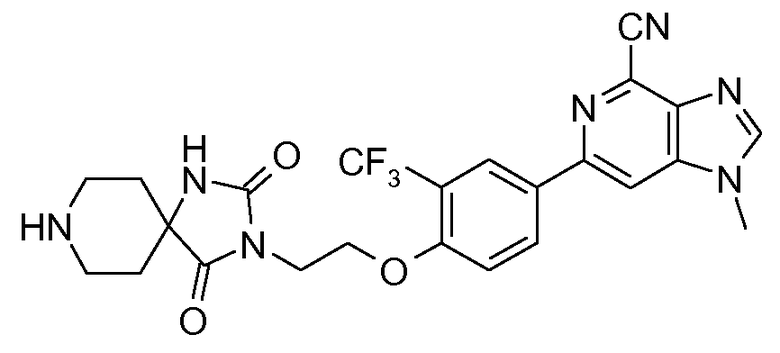
Раствор 8-трет-бутоксикарбонил-1,3,8-триазаспиро[4.5]декан-2,4-диона (75 мг) в ДМФА (1 мл) добавляли к раствору 2-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфоната (90 мг) в ДМФА (1 мл), K2CO3 (83 мг) и ТBAI (48 мг). Смесь перемешивали на протяжении ночи при 90°С. Растворитель удаляли при пониженном давлении. Остаток распределяли между этилацетатом (50 мл) и насыщенным раствором Na2CO3 (20 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая при этом трет-бутиловый эфир 3-(2-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-трифторметилфенокси)этил)-2,4-диоксо-1,3,8-триазаспиро[4.5]декан-8-карбоновой кислоты (70 мг). Сырой продукт растворяли в МeOH (2 мл) и добавляли 5 н раствор HCl в iPrOH (0,05 мл). Смесь перемешивали 2 часа при 60°С, затем растворитель выпаривали при пониженном давлении. Сырой продукт сразу очищали препаративной ВЭЖХ (ВЭЖХ: колонка XBridge МС C18 30×100 мм, 5 мкм, элюент: A: NH4HCO3, 10 ммоль, pH=9,5/B: ацетонитрил, сфокусированный градиент/8 минут/50 мл/мин), получая при этом 6-{4-[2-(2,4-диоксо-1,3,8-триазаспиро[4.5]дец-3-ил)этокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (23 мг).
1H ЯМР (ДМСО) δ: 8,82 (ушир. с, 1H), 8,71 (с, 1H), 8,64 (с, 1H), 8,43 (м, 1H), 8,38 (с, 1H), 7,47 (м, 1H), 4,41 (м, 2H), 3,89 (с, 3H), 3,80 (м, 2H), 2,87 (м, 2H), 2,71 (м, 2H), 1,73 (м, 2H), 1,38 (м, 2H). МС m/z 514 (М+1).
ПРИМЕР 13a
Гидрохлорид 1-метил-6-{4-[2-(6-метилпиридин-2-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
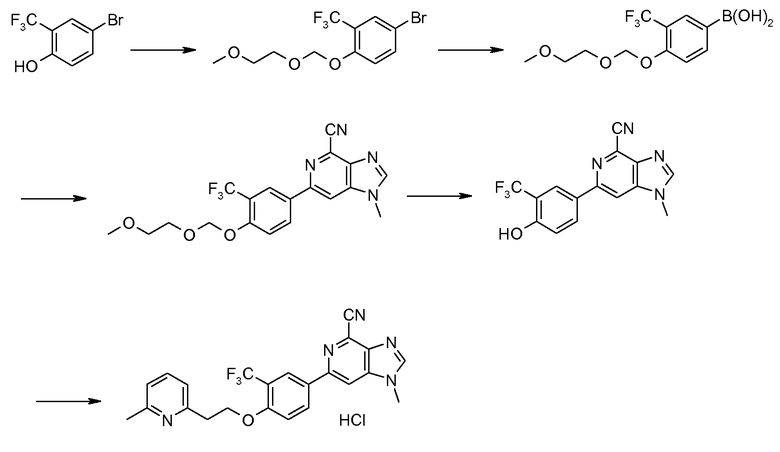
A: 4-Бром-1-(2-метоксиэтоксиметокси)-2-трифторметилбензол
Гидрид натрия (60% масс./масс. дисперсия в минеральном масле, 0,96 г) добавляли к раствору 4-бром-2-трифторметилфенола (5,0 г) в сухом ТГФ (200 мл) и смесь перемешивали в течение 30 минут. Затем добавляли 1-хлорметокси-2-метоксиэтан (2,85 мл) и смесь перемешивали в течение 1 часа при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток растворяли в воде и трет-бутилметиловом простом эфире, органический слой промывали насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении, получая при этом 4-бром-1-(2-метоксиэтоксиметокси)-2-трифторметилбензол (6,4 г) в виде масла.
1H ЯМР (CDCl3) δ: 7,69 (м, 1H), 7,53 (м, 1H), 7,19 (м, 1H), 5,33 (с, 2H), 3,83 (м, 2H), 3,55 (м, 2H), 3,37 (с, 3H).
B: 4-(2-Метоксиэтоксиметокси)-3-трифторметилфенилбороновая кислота
н-Бутиллитий (2,5 М раствор в гексане, 91,2 мл) добавляли по каплям к раствору 4-бром-1-(2-метоксиэтоксиметокси)-2-трифторметилбензолу (30 г) в сухом ТГФ (335 мл) при -78°С в атмосфере азота. Смесь затем перемешивали при -78°С в течение еще 30 минут. Затем при -78°С в атмосфере азота медленно добавляли триизопропилборат (101 мл), смеси затем позволяли медленно нагреться до комнатной температуры и перемешивали при такой температуре на протяжении ночи. После добавления воды (300 мл) смесь экстрагировали этилацетатом (300 мл × 3). Объединенные органические слои сушили над сульфатом натрия. После удаления растворителя при пониженном давлении остаток пропускали через колонку силикагеля с применением DCМ-МeOH в качестве элюента, получая при этом 4-(2-метоксиэтоксиметокси)-3-трифторметилфенилбороновую кислоту (14,4 г).
1H ЯМР (CDCl3) δ: 8,38 (м, 1H), 8,33 (м, 1H), 7,42 (м, 1H), 5,46 (с, 2H), 3,86 (м, 2H), 3,56 (м, 2H), 3,38 (с, 3H).
C: 6-(4-(2-Метоксиэтоксиметокси)-3-трифторметилфенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
Смесь 6-хлор-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила (5,9 г), 4-(2-метоксиэтоксиметокси)-3-трифторметилфенилбороновой кислоты (9,92 г), фосфата калия (11,1 г), трис(дибензилиденацетон)дипалладия (1,4 г) и трициклогексилфосфина (1,03 г) в диоксане (190 мл) и воде (60 мл) нагревали при 100°С в атмосфере азота в течение 2 часов. После охлаждения до комнатной температуры смесь затем экстрагировали этилацетатом (500 мл × 2), объединенные органические слои сушили над сульфатом натрия и растворитель затем удаляли при пониженном давлении. К остатку затем добавляли метанол (20 мл) и твердый продукт, 6-(4-(2-метоксиэтоксиметокси)-3-трифторметилфенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил, собирали фильтрованием (8,95 г).
1H ЯМР (CDCl3) δ: 8,27 (м, 1H), 8,19 (м, 1H), 8,10 (с, 1H), 7,88 (с, 1H), 7,42 (м, 1H), 5,44 (с, 2H), 3,99 (с, 3H), 3,88 (м, 2H), 3,58 (м, 2H), 3,38 (с, 3H). МС m/z 407 (М+1).
D: 6-(4-Гидрокси-3-трифторметилфенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил
6-(4-(2-Метоксиэтоксиметокси)-3-трифторметилфенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил (7,5 г) добавляли к смешанному растворителю из ТГФ (300 мл) и 1 М HCl (водная). Смесь нагревали до 65°С до полного исчезновения всего исходного соединения. После добавления насыщенного раствора хлорида натрия (200 мл) смесь экстрагировали этилацетатом (300 мл × 3) и объединенные органические слои затем сушили над сульфатом натрия, растворитель удаляли при пониженном давлении и остаток растирали в простом эфире. Продукт, 6-(4-гидрокси-3-трифторметилфенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (5,9 г), собирали фильтрованием.
1H ЯМР (CD3OD) δ: 8,45 (с, 1H); 8,34 (с, 1H); 8,29 (с, 1H); 8,20 (м, 1H); 7,09 (м, 1H); 4,04 (с, 3H). МС m/z 319 (М+1).
E: Гидрохлорид 1-метил-6-{4-[2-(6-метилпиридин-2-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Диизопропилазодикарбоксилат (80 мг) добавляли при перемешивании при комнатной температуре в атмосфере азота к смеси 6-(4-гидрокси-3-трифторметилфенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила (42 мг), связанного со смолой трифенилфосфина (3 ммоль/г, 130 мг) и 2-(6-метилпиридин-2-ил)этанола (54 мг) в DCМ (2 мл). Смесь затем встряхивали в течение 8 часов. После отделения смолы фильтрованием фильтрат концентрировали при пониженном давлении и остаток очищали ВЭЖХ, получая при этом 1-метил-6-{4-[2-(6-метилпиридин-2-ил)этокси]-3-(трифторметил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли ТFA. Эту соль затем превращали в свободное основание и соль HCl с применением методики, описанной в примере 2.
1H ЯМР (CD3OD) δ: 8,52 (с, 1H), 8,35-8,5 (м, 4H), 7,92 (д, 1H), 7,82 (д, 1H), 7,39 (д, 1H), 4,63 (т, 2H), 4,03 (с, 3H), 3,61 (т, 2H), 2,83 (с, 3H). МС m/z 438 (М+1).
Методику, описанную в примере 13а , далее применяли с использованием подходящих производных спиртов для получения нижеследующих соединений в виде либо соли TFA, нейтрального соединения, либо соли HCl.
13b : Гидрохлорид 1-метил-6-{4-[2-(5-метилпиридин-2-ил)этокси]-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (CD3OD) δ: 8,68 (с, 1H), 8,59 (с, 1H), 8,35-8,5 (м, 4H), 8,03 (д, 1H), 7,38 (д, 1H), 4,64 (т, 2H), 4,04 (с, 3H), 3,60 (т, 2H), 2,57 (с, 3H). МС m/z 438 (М+1).
13c : Гидрохлорид 1-метил-6-[4-(пиридин-2-илметокси)-3-(трифторметил)фенил]-1Н-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (ДМСО) δ: 8,72 (с, 1H), 8,69 (д, 1H), 8,64 (с, 1H), 8,45-8,5 (м, 2H), 8,03 (т, 1H), 7,66 (д, 1H), 7,55 (д, 1H), 7,49 (т, 1H), 5,49 (с, 2H), 3,99 (с, 3H). МС m/z 410 (М+1).
13d : Гидрохлорид 1-метил-6-{4-[2-(пиридин-2-ил)этокси]-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (ДМСО) δ: 8,80 (д, 1H), 8,70 (с, 1H), 8,63 (с, 1H), 8,45 (дд, 1H), 8,3-8,4 (м, 2H), 7,9 (д, 1H), 7,76 (т, 1H), 7,5 (д, 1H), 4,67 (т, 2H), 3,99 (с, 3H), 3,51 (т, 2H). МС m/z 424 (М+1).
13e : 1-Метил-6-{4-[2-(4-метилтиазол-5-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,86 (с, 1H), 8,72 (с, 1H), 8,64 (с, 1H), 8,44 (д, 1H), 8,40 (с, 1H), 7,44 (д, 1H), 4,38 (т, 2H), 3,99 (с, 3H), 3,29 (т, 2H), 2,37 (с, 3H). МС m/z 444 (М+1).
13f : 6-[4-(1,5-Диметил-1H-пиразол-3-илметокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,72 (с, 1H), 8,64 (с, 1H), 8,43 (д, 1H), 8,40 (с, 1H), 7,59 (д, 1H), 6,11 (с, 1H), 5,19 (с, 2H), 3,99 (с, 3H), 3,72 (с, 3H), 2,24 (с, 3H). МС m/z 427 (М+1).
13g : 1-Метил-6-{4-[(S)-5-оксо-2-пирролидин-2-илметокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,73 (с, 1H), 8,65 (с, 1H), 8,46 (д, 1H), 8,43 (с, 1H), 7,71 (с, 1H), 7,45 (д, 1H), 4,16 (с, 2H), 3,99 (с, 3H), 3,95 (ушир., 1H), 1,9-2,4 (м, 4H). МС m/z 416 (М+1).
13h : 1-Метил-6-[4-(тeтрагидрофуран-3-илметокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,72 (с, 1H), 8,65 (с, 1H), 8,44 (д, 1H), 8,41 (с, 1H), 7,45 (д, 1H), 4,21 (дд, 1H), 4,18 (дд, 1H), 3,99 (с, 3H), 3,80 (м, 2H), 3,71 (дд, 1H), 3,67 (дд, 1H), 2,70 (м, 1H), 2,06 (м, 1H), 1,72 (м, 1H). МС m/z 403 (М+1).
13i : 6-[4-(3-Цианопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,73 (с, 1H), 8,65 (с, 1H), 8,45 (д, 1H), 8,42 (с, 1H), 7,47 (д, 1H), 4,28 (т, 2H), 3,99 (с, 3H), 2,67 (т, 2H), 2,11 (м, 2H). МС m/z 386 (М+1).
13j : 1-Метил-6-[4-(4-оксопентокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,72 (с, 1H), 8,64 (с, 1H), 8,45 (д, 1H), 8,41 (с, 1H), 7,42 (д, 1H), 4,18 (т, 2H), 3,99 (с, 3H), 2,64 (т, 2H), 2,12 (с, 3H), 1,95 (м, 2H). МС m/z 403 (М+1).
13k : 6-[4-(4-Цианобензокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,73 (с, 1H), 8,65 (с, 1H), 8,46 (д, 1H), 8,45 (с, 1H), 7,95 (д, 2H), 7,67 (д, 2H), 7,52 (д, 1H), 5,50 (с, 2H), 3,99 (с, 3H). МС m/z 434 (М+1).
13l : 1-Метил-6-{4-[3-(2-оксопирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CD3OD) δ: 8,47 (с, 1H), 8,38 (с, 1H+1H), 8,35 (д, 1H), 7,30 (д, 1H), 4,23 (т, 2H), 4,05 (с, 3H), 3,5-3,6 (м, 4H), 2,41 (т, 2H), 2,05-2,2 (м, 4H). МС m/z 444 (М+1).
13m : 1-Метил-6-{4-[2-(2-оксопирролидин-1-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CDCl3) δ: 8,23-8,31 (м, 2H), 8,08 (с, 1H), 7,87 (с, 1H), 7,11 (д, 1H), 4,29 (т, 2H), 3,98 (с, 3H), 3,75 (т, 2H), 3,64 (т, 2H), 2,40 (т, 2H), 2,06 (м, 2H). МС m/z 430 (М+1).
ПРИМЕР 14a
Гидрохлорид 1-метил-6-{4-[2-(пиперидин-4-ил)этокси]-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила
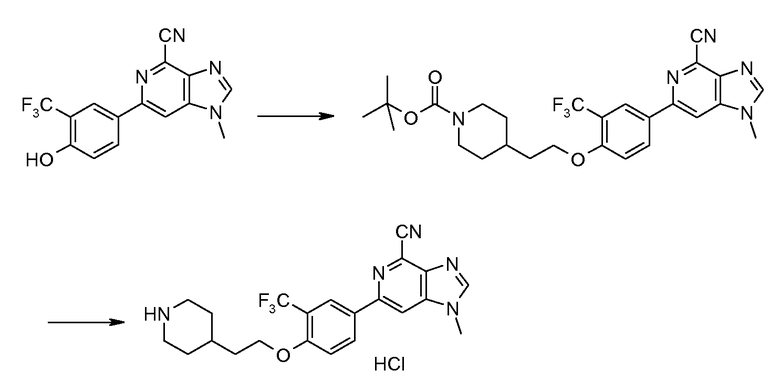
Диизопропилазодикарбоксилат (380 мг) добавляли при перемешивании при комнатной температуре в атмосфере азота к смеси 6-(4-гидрокси-3-трифторметилфенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила (300 мг), связанного со смолой трифенилфосфина (3 ммоль/г, 630 мг) и трет-бутил-4-(2-гидроксиэтил)пиперидин-1-карбоксилата (430 мг) в DCМ (2 мл). Смесь затем встряхивали в течение 8 часов. После отделения смолы фильтрованием фильтрат концентрировали при пониженном давлении, остаток снова растворяли в DCM (5 мл) и к этому раствору затем добавляли трифторуксусную кислоту (3 мл). После перемешивания при комнатной температуре в течение 10 минут весь растворитель и избыточную трифторуксусную кислоту удаляли при пониженном давлении. Остаток растворяли в NMP (5 мл) и очищали ВЭЖХ, получая при этом 1-метил-6-{4-[2-(пиперидин-4-ил)этокси]-3-(трифторметил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли ТFA. Эту соль затем превращали в свободное основание и соль HCl (230 мг) с применением методики, описанной в примере 2.
1H ЯМР (CD3OD) δ: 8,73 (с, 1H), 8,47 (с, 1H), 8,40 (с, 1H), 8,39 (д, 1H), 7,35 (д, 1H), 4,29 (т, 2H), 4,07 (с, 3H), 3,42 (дм, 2H), 3,00 (т, 2H), 2,06 (д, 2H), 1,98 (м, 2H), 1,90 (т, 2H), 1,50 (м, 2H). МС m/z 430 (М+1).
Методику, описанную в примере 14а , далее применяли с использованием подходящих производных спирта для получения нижеследующего соединения.
14b : 1-Метил-6-{4-[(пиперидин-4-ил)метокси)]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,71 (с, 1H), 8,64 (с, 1H), 8,44 (д, 1H), 8,41 (с, 1H), 7,42 (д, 1H), 4,02 (д, 2H), 3,98 (с, 3H), 3,00 (д, 2H), 2,55 (м, 2H), 1,90 (м, 1H), 1,75 (д, 2H), 1,25 (м, 2H). МС m/z 416 (М+1).
ПРИМЕР 15
6-[4-(3-Гидроксипропил)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
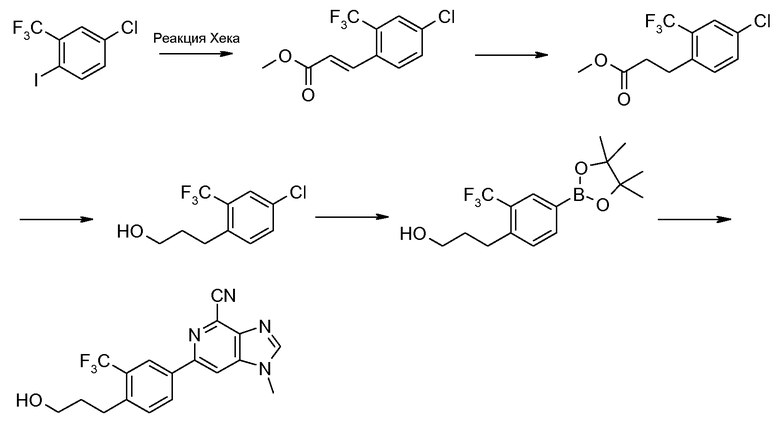
A: (E)-Метил 3-(4-хлор-2-(трифторметил)фенил)акрилат
Смесь 4-хлор-1-йод-2-(трифторметил)бензола (15 г), метилакрилата (6,74 г), хлорида тeтрабутиламмония (14 г), ацетата палладия (0,22 г) и карбоната калия (13,6 г) в ДМФА (150 мл) перемешивали при комнатной температуре в течение 4 дней. После разбавления простым эфиром (1 л) смесь промывали водой (5 × 200 мл), затем сушили над сульфатом натрия и растворитель удаляли при пониженном давлении. Остаток пропускали через колонку силикагеля с применением смеси 5:1 гептан:EtOAc в качестве элюента, получая при этом (E)-метил-3-(4-хлор-2-(трифторметил)фенил)акрилат (13 г).
1H ЯМР (CDCl3) δ: 7,99 (д, 1H), 7,70 (с, 1H), 7,65 (д, 1H), 7,56 (д, 1H), 6,4 (д, 1H), 3,83 (с, 3H).
B: Метил 3-(4-хлор-2-(трифторметил)фенил)пропанoaт
Смесь (E)-метил-3-(4-хлор-2-(трифторметил)фенил)акрилата (5 г) и палладия-на-угле (10%, сухой, 2 г) в этилацетате (50 мл) перемешивали под давлением водорода из баллона в течение 3 часов. После фильтрования фильтрат концентрировали, получая при этом метил-3-(4-хлор-2-(трифторметил)фенил)пропанoaт (5 г).
1H ЯМР (CDCl3) δ: 7,62 (с, 1H), 7,45 (д, 1H), 7,30 (д, 1H), 3,69 (с, 3H), 3,10 (т, 2H), 2,61 (т, 2H).
C: 3-(4-Хлор-2-(трифторметил)фенил)пропан-1-ол
Диизобутилалюминийгидрид (20% в толуоле, 34 мл) добавляли по каплям к раствору метил-3-(4-хлор-2-(трифторметил)фенил)пропаноата (5 г) в DCM (150 мл) при -78°С в атмосфере азота в течение 10 минут. Смесь затем перемешивали при -78°С в течение 1 часа перед нагреванием до комнатной температуры. Смесь затем осторожно наливали на дробленый лед (500 г). После добавления 5 М HCl до рН 2 смесь экстрагировали DCM (200 мл × 3), объединенный слой DCM затем сушили над сульфатом натрия, растворитель затем удаляли при пониженном давлении. Остаток был достаточно чистым для следующей стадии (4,5 г).
1H ЯМР (CDCl3) δ: 7,60 (с, 1H), 7,44 (д, 1H), 7,30 (д, 1H), 3,71 (т, 2H), 2,85 (т, 2H), 1,87 (м, 2H).
D: 3-(4-(4,4,5,5-тeтраметил-1,3,2-диоксаборолан-2-ил)-2-(трифторметил)фенил)пропан-1-ол
Смесь 3-(4-хлор-2-(трифторметил)фенил)пропан-1-ола (1 г), трис(дибензилиденацетон)дипалладия (0,192 г), трициклогексилфосфина (0,141 г), ацетата калия (0,62 г) и бис(пинаколато)дибора (1,17 г) в высушенном диоксане (15 мл) нагревали при 80°С в течение 6 часов. После разбавления этилацетатом (100 мл), промывания водой (100 мл), насыщенным раствором соли (100 мл), затем сушки над сульфатом натрия растворитель удаляли при пониженном давлении и остаток пропускали через колонку силикагеля с применением смеси гептан:EtOAc (4:1) в качестве элюента, получая при этом 3-(4-(4,4,5,5-тeтрaметил-1,3,2-диоксаборолан-2-ил)-2-(трифторметил)фенил)пропан-1-ол (1 г).
1H ЯМР (CDCl3) δ: 8,06 (с, 1H), 7,9 (д, 1H), 7,37 (д, 1H), 3,72 (т, 2H), 2,9 (т, 2H), 1,9 (м, 2H), 1,35 (с, 12H).
E: 6-[4-(3-Гидроксипропил)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
6-Хлор-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил (1,29 г), 3-(4-(4,4,5,5-тeтрaметил-1,3,2-диоксаборолан-2-ил)-2-(трифторметил)фенил)пропан-1-ол (2,432 г), трис(дибензилиденацетон)дипалладий (0,307 г), трициклогексилфосфин (0,225 г) и фосфат калия (2,417 г) суспендировали в диоксане (20 мл) и воде (8 мл). Реакционную смесь помещали в атмосферу азота и нагревали для кипячения с обратным холодильником (110°С) в течение 1,5 часа. Смеси давали возможность охладиться до комнатной температуры, затем разбавляли EtOAc (500 мл), фильтровали через целит и промывали водой (200 мл). Органический слой сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. Твердый остаток промывали простым эфиром, получая при этом 6-[4-(3-гидроксипропил)-3-(трифторметил)фенил]-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (1,5 г).
1H ЯМР (CD3OD) δ: 8,46 (с, 1H), 8,45 (с, 1H), 8,44 (с, 1H), 8,31 (д, 1H), 7,60 (д, 1H), 4,04 (с, 3H), 3,66 (т, 2H), 2,94 (т, 2H), 1,90 (м, 2H).
ПРИМЕР 16a
1-Метил-6-{4-[3-(3-оксопиперазин-1-ил)пропил]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
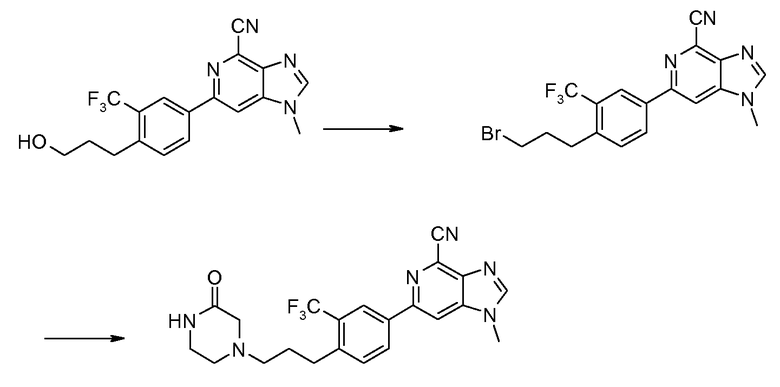
A: 6-(4-(3-Бромпропил)-3-(трифторметил)фенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил
6-[4-(3-Гидроксипропил)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил (1,3 г) осторожно нагревали в ТГФ (36 мл) до растворения всего соединения и затем раствор охлаждали до 0°С на ледяной бане. Добавляли тетрабромид углерода (2,4 г) с последующим добавлением трифенилфосфина (1,9 г). Смесь перемешивали при 0°С в течение 15 минут и затем при комнатной температуре в течение 20 минут до тех пор, пока мутная суспензия не стала прозрачной жидкостью. Реакционную смесь разбавляли ДCМ (100 мл) и промывали водой (100 мл × 2). Органический слой сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. Остаток затем пропускали через колонку (колонка 100 г SiO2, градиент от смеси 1:1 EtOAc/гептан до EtOAc), получая при этом 6-(4-(3-бромпропил)-3-(трифторметил)фенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (1,2 г) в виде белого твердого вещества.
1H ЯМР (ДМСО) δ: 8,77 (с, 1H), 8,66 (с, 1H), 8,46 (с, 1H), 8,40 (д, 1H), 7,69 (д, 1H), 4,00 (с, 3H), 3,65 (т, 2H), 2,95 (т, 2H), 2,17 (м, 2H).
B: 1-Метил-6-{4-[3-(3-оксопиперазин-1-ил)пропил]-3-трифторметилфенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
6-(4-(3-Бромпропил)-3-(трифторметил)фенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (50 мг) и 2-оксопиперазин (103 мг) в ДМФА (750 мкл) нагревали при 100°С в микроволновых условиях в течение 25 минут. Очистка препаративной ЖХ-МС с основной фазой давала 1-метил-6-{4-[3-(3-оксопиперазин-1-ил)пропил]-3-трифторметилфенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (15 мг).
1H ЯМР (CD3OD) δ: 8,45 (с, 1H), 8,43 (с, 1H), 8,42 (с, 1H), 8,29 (д, 1H), 7,60 (д, 1H), 4,03 (с, 3H), 3,34 (т, 2H), 3,12 (с, 2H), 2,91 (т, 2H), 2,70 (т, 2H), 2,56 (т, 2H), 1,90 (м, 2H). МС m/z 443 (М+1).
Методику, описанную в примере 16а , далее применяли с использованием подходящих производных амина для получения нижеследующих соединений в виде либо соли TFA, свободного основания, либо соли HCl с применением способа, описанного в примере 2.
16b : 6-[4-(3-(Диметиламино)пропил)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CD3OD) δ: 8,45 (с, 2H), 8,43 (с, 1H), 8,29 (д, 1H), 7,60 (д, 1H), 4,03 (с, 3H), 2,88 (т, 2H), 2,57 (т, 2H), 2,35 (с, 6H), 1,90 (м, 2H). МС m/z 388 (М+1).
16c : 1-Метил-6-[4-(3-морфолин-4-илпропил)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CD3OD) δ: 8,45 (с, 1H), 8,44 (с, 1H), 8,42 (с, 1H), 8,30 (д, 1H), 7,60 (д, 1H), 4,03 (с, 3H), 3,72 (т, 4H), 2,90 (т, 2H), 2,54 (м, 6H), 1,92 (м, 2H). МС m/z 430,6 (М+1).
16d : 1-Метил-6-{4-[3-(4-метилпиперазин-1-ил)пропил]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,76 (с, 1H), 8,65 (с, 1H), 8,43 (с, 1H), 8,39 (д, 1H), 7,68 (д, 1H), 4,00 (с, 3H), 2,83 (т, 2H), 2,36 (м, 10H), 2,16 (с, 3H), 1,77 (м, 2H). МС m/z 443 (М+1).
16e : Соль TFA 6-(4-{3-[4-(2-метоксиэтил)пиперазин-1-ил]пропил}-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (ДМСО) δ: 8,78 (с, 1H), 8,67 (с, 1H), 8,48 (с, 1H), 8,45 (д, 1H), 7,71 (д, 1H), 4,01 (с, 3H), 3,63 (т, 2H), 3,30 (с, 3H), 3,28 (ушир. м, 8H), 3,21 (ушир. м, 2H), 3,09 (ушир. м, 2H), 2,86 (т, 2H), 1,99 (м, 2H). МС m/z 487,5 (М+1).
16f : 6-(4-{3-[N-(2-диметиламино-2-оксоэтил)-N-метиламино]пропил}-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,75 (с, 1H), 8,65 (с, 1H), 8,43 (с, 1H), 8,39 (д, 1H), 7,67 (д, 1H), 4,00 (с, 3H), 3,23 (с, 2H), 3,03 (с, 3H), 2,82 (м, 5H), 2,51 (ушир. м, 2H), 2,25 (с, 3H), 1,78 (м, 2H). МС m/z 459 (М+1).
Нижеследующее соединение очищали с применением кислотной ВЭЖХ в виде соли TFA.
16g : Соль TFA 1-метил-6-[4-(3-пиперазин-1-илпропил)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (ДМСО) δ: 8,79 (с, 1H), 8,67 (с, 1H), 8,48 (с, 1H), 8,44 (д, 1H), 7,71 (д, 1H), 4,01 (с, 3H), 3,35 (ушир. м, 8H), 3,19 (ушир. м, 2H), 2,87 (т, 2H), 2,01 (ушир. м, 2H). МС m/z 429,4 (М+1).
ПРИМЕР 17
1-Метил-6-{4-[2-(2-оксооксазолидин-3-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
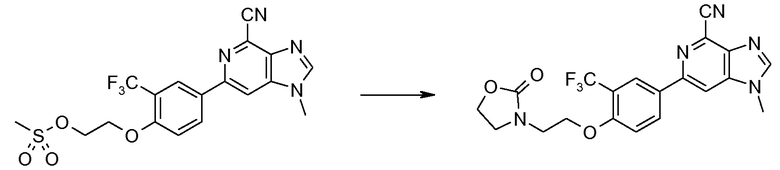
К оксазолидин-2-ону (29,7 мг) в NМP (1 мл) добавляли гидрид натрия (60% в парафиновом масле, 13,6 мг). После перемешивания при комнатной температуре в течение 10 минут затем добавляли 2-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфонат (100 мг) и смесь перемешивали при комнатной температуре в течение 14 часов. Смесь сразу очищали с применением ВЭЖХ, получая при этом 1-метил-6-{4-[2-(2-оксооксазолидин-3-ил)этокси]-3-(трифторметил)фенил}-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (10 мг).
1H ЯМР (ДМСО) δ: 8,70 (с, 1H), 8,63 (с, 1H), 8,45 (д, 1H), 8,41 (с, 1H), 7,47 (д, 1H), 4,37 (т, 2H), 4,27 (т, 2H), 3,99 (с, 3H), 3,67 (т, 2H), 3,61 (т, 2H). МС m/z 432 (М+1).
ПРИМЕР 18a
Гидрохлорид 1-метил-6-{4-[3-(2-оксопиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
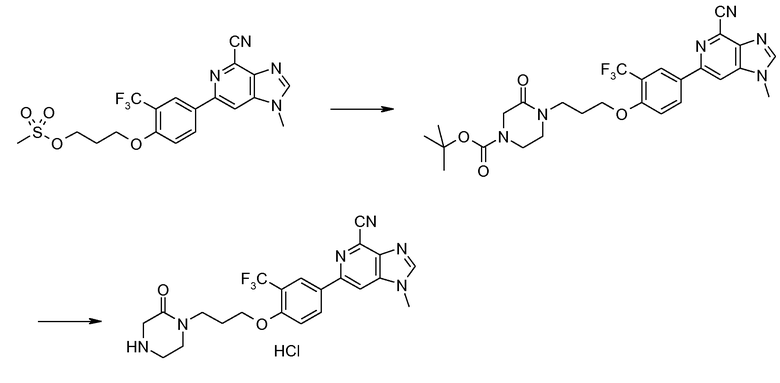
К трет-бутил-3-оксопиперазин-1-карбоксилату (106 мг) в NМP (2 мл) добавляли гидрид натрия (60% в парафиновом масле, 22 мг). После перемешивания при комнатной температуре в течение 10 минут добавляли 3-(4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)пропилметансульфонат (200 мг) и смесь перемешивали при комнатной температуре в течение 14 часов. После разбавления этилацетатом (50 мл) смесь промывали водой (20 мл). Органический слой затем отделяли, растворитель удаляли в вакууме, к остатку затем добавляли смесь 1:1 DCМ:ТFA (4 мл). После перемешивания при комнатной температуре в течение 5 минут весь растворитель удаляли при пониженном давлении, остаток растворяли в МeOH (2 мл) и очищали ВЭЖХ, получая при этом 1-метил-6-{4-[3-(2-оксопиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли ТFA. Эту соль ТFA превращали в соль HCl с применением способа, описанного выше (пример 2).
1H ЯМР (MeOD) δ: 8,53 (с, 1H), 8,42 (с, 1H), 8,40 (с, 1H), 8,37 (д, 1H), 7,35 (д, 1H), 4,26 (т, 2H), 4,04 (с, 3H), 3,83 (с, 2H), 3,65-3,8 (м, 4H), 3,56 (т, 2H), 2,18 (м, 2H). МС m/z 459 (М+1).
Методику, описанную в примере 18а , далее применяли с использованием 2-(4-(4-циано-1-метил-1Н-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)этилметансульфоната для получения нижеследующего соединения в виде соли TFA.
18b : Соль TFA 1-метил-6-{4-[2-(2-оксопиперазин-1-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (ДМСО) δ: 8,71 (с, 1H), 8,64 (с, 1H), 8,46 (д, 1H), 8,44 (с, 1H), 7,45 (д, 1H), 4,36 (т, 2H), 3,99 (с, 3H), 3,80 (т, 2H), 3,77 (с, 1H), 3,70 (д, 2H), 3,41 (т, 2H). МС m/z 445 (М+1).
ПРИМЕР 19
Соль TFA 6-{4-[3-(3,3-диметил-2-оксопиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
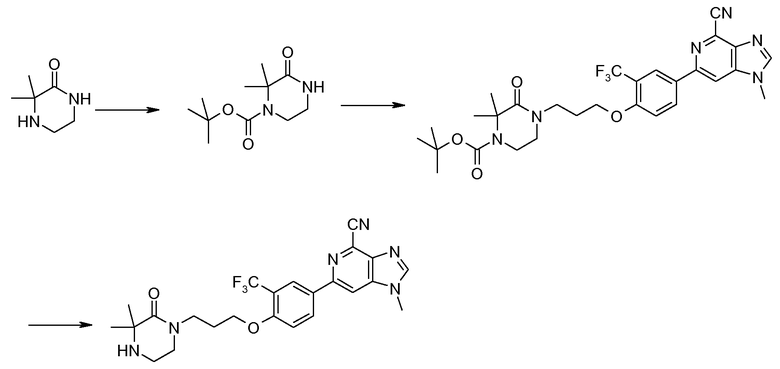
A: трет-Бутил-2,2-диметил-3-оксопиперазин-1-карбоксилат
Ди-трет-бутилдикарбонат (4 г) добавляли к раствору гидрохлорида 3,3-диметилпиперазин-2-она (3 г) и DIPEA (3 мл) в смеси DCМ-МeOH (100 мл-30 мл). Смесь перемешивали при комнатной температуре в течение 2 дней, затем промывали водой (100 мл × 2), органический слой сушили над сульфатом натрия, растворитель удаляли и остаток затем пропускали через колонку силикагеля с применением смеси 9:1 DCM:MeOH в качестве элюента, получая при этом трет-бутил-2,2-диметил-3-оксопиперазин-1-карбоксилат (3,6 г).
1H ЯМР (СDCl3) δ: 3,2-3,35 (ушир., 2H), 3,35-3,4 (ушир., 2H), 1,50 (с), 1,47 (с), 1,44 (с).
B: Соль TFA 6-{4-[3-(3,3-диметил-2-оксопиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Методику, описанную в примере 18а , затем применяли с использованием трет-бутил-2,2-диметил-3-оксопиперазин-1-карбоксилата для получения 6-{4-[3-(3,3-диметил-2-оксопиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила в виде соли ТFA.
1H ЯМР (СD3OD) δ: 8,45 (с, 1H), 8,35-8,43 (м, 3H), 7,32 (д, 1H), 4,26 (т, 2H), 4,02 (с, 3H), 3,6-3,75 (м, 6H), 2,17 (м, 2H), 1,62 (с, 6H). МС m/z 487 (М+1).
Пример 20a
6-[4-(3-Морфолин-4-илпропокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил
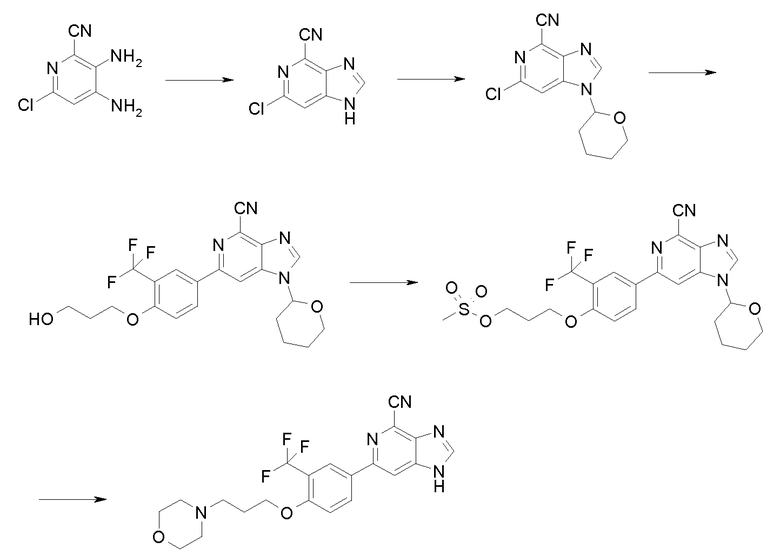
A: 6-Хлор-1H-имидазо[4,5-c]пиридин-4-карбонитрил
Смесь 3,4-диамино-6-хлорпиколинонитрила (3,2 г), триэтилортоформиата (16 мл) и AcOH (5,4 мл) нагревали до 150°С в DCМ (16 мл) в микроволновых условиях в течение 15 минут. Растворитель выпаривали, остаток растворяли в EtOAc (250 мл) и промывали водой (150 мл). Органический слой сушили над сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая при этом 6-хлор-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (2,2 г).
1H ЯМР (ДМСО) δ: 8,72 (с, 1H), 8,06 (с, 1H).
B: 6-Хлор-1-(тeтрагидро-2H-пиран-2-ил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрил
6-Хлор-1H-имидазо[4,5-с]пиридин-4-карбонитрил (620 мг) и моногидрат п-толуолсульфоновой кислоты (10 мг) суспендировали в этилацетате (10 мл) и нагревали до 60°С. По каплям добавляли 3,4-дигидро-2H-пиран (0,48 мл) и реакционную смесь перемешивали при 60°С на протяжении ночи. Реакцию гасили 5 мл гидроксида аммония перед добавлением воды (100 мл) и этилацетата (200 мл). Органический слой отделяли, сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. Сырой продукт растворяли в минимальном объеме EtOAc и добавляли гептан. Образовавшееся коричневое твердое вещество собирали фильтрованием, получая при этом 6-хлор-1-(тетрагидро-2H-пиран-2-ил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (630 мг).
1H ЯМР (ДМСО) δ: 8,92 (с, 1H), 8,30 (с, 1H), 5,80 (д, 1H), 4,05 (м, 1H), 3,75 (м, 1H), 2,19 (м, 1H), 2,11 (м, 1H), 1,62 (м, 4H).
C: 6-[4-(3-Гидроксипропокси)-3-(трифторметил)фенил]-1-(тeтрагидро-2H-пиран-2-ил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрил
6-Хлор-1-(тeтрагидро-2H-пиран-2-ил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (1,4 г), 4-(3-гидроксипропокси)-3-(трифторметил)фенилбороновую кислоту (2,2 г), трис(дибензилиденацетон)дипалладий (0,25 г), трициклогексилфосфин (0,18 г) и фосфат калия (2 г) добавляли к диоксану (20 мл) и воде (6 мл) и смесь нагревали для кипячения с обратным холодильником в атмосфере азота в течение двух часов. Реакционную смесь разбавляли EtOAc (200 мл), фильтровали через целит и промывали водой (150 мл). Органический слой сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. Сырой продукт очищали флэш-хроматографией с применением смеси EtOAc:гептан в качестве элюента, получая при этом 6-[4-(3-гидроксипропокси)-3-(трифторметил)фенил]-1-(тeтрагидро-2H-пиран-2-ил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрил (1,5 г).
МС m/z 447 (М+1).
D: 3-(4-(4-Циано-1-(тeтрагидро-2H-пиран-2-ил)-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)пропилметансульфонат
К раствору 6-(4-(3-гидроксипропокси)-3-(трифторметил)фенил)-1-(тeтрагидро-2H-пиран-2-ил)-1H-имидазо[4,5-c]пиридин-4-карбонитрила (670 мг) и DIPEA (1,4 мл) в NМP (7,5 мл) при 0°С добавляли метансульфонилхлорид (0,2 мл). Смесь перемешивали в течение 45 минут при комнатной температуре, затем разбавляли EtOAc (75 мл) и промывали насыщенным бикарбонатом натрия (70 мл) с последующим промыванием водой (2 × 40 мл). Органический слой сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении, получая при этом 3-(4-(4-циано-1-(тeтрагидро-2H-пиран-2-ил)-1Н-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)пропилметансульфонат (720 мг).
МС m/z 525 (М+1).
E: Соль TFA 6-{4-[3-(3,3-диметил-2-оксопиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
Смесь 3-(4-(4-циано-1-(тeтрагидро-2H-пиран-2-ил)-1H-имидазо[4,5-c]пиридин-6-ил)-2-(трифторметил)фенокси)пропилметансульфоната (23 мг) и морфолина (20 мкл) в NМP (500 мкл) нагревали при 120°С в микроволновых условиях в течение 20 минут. Затем добавляли водный HCl (2М, 500 мкл) и смесь перемешивали в течение 2 часов при 50°С. Смесь затем очищали с применением препаративной ВЭЖХ, получая при этом продукт, 6-[4-(3-морфолин-4-илпропокси)-3-(трифторметил)фенил]-1Н-имидазо[4,5-c]пиридин-4-карбонитрил, в виде соли ТFA, которую затем превращали в свободное основание с применением способа, описанного в примере 2.
1H ЯМР (ДМСО) δ: 8,66 (с, 1H), 8,47 (с, 1H), 8,38 (д, 1H), 8,34 (с, 1H), 7,40 (д, 1H), 4,24 (т, 2H), 3,57 (ушир. м, 4H), 2,45 (т, 2H), 2,37 (ушир. м, 4H), 1,92 (м, 2H). МС m/z 432 (М+1).
Методику, описанную в примере 20а , далее применяли с использованием подходящих аминов для получения нижеследующих соединений в виде либо соли TFA, свободного основания, либо соли HCl.
20b : Соль TFA 6-[4-(3-этиламинопропокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,53 (с, 1H), 8,36 (м, 2H), 8,30 (с, 1H), 7,35 (д, 1H), 4,33 (т, 2H), 3,26 (т, 2H), 3,12 (кв., 2H), 2,28 (м, 2H), 1,34 (т, 3H). МС m/z 390 (М+1).
20c : 6-{4-[3-((R)-2-Гидроксиметилпирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,66 (с, 1H), 8,47 (с, 1H), 8,38 (д, 1H), 8,34 (с, 1H), 7,41 (д, 1H), 4,25 (м, 2H), 3,40 (м, 1H), 3,25 (м, 1H), 3,15 (м, 1H), 3,05 (м, 1H), 2,60 (м, 1H), 2,49 (м, 1H), 2,31 (м, 1H), 1,95 (м, 2H), 1,85 (м, 1H), 1,70 (м, 1H), 1,60 (м, 2H). МС m/z 446 (М+1).
20d : Соль TFA 6-[4-(3-пергидро-1,4-оксазепин-4-илпропокси)-3-(трифторметил)фенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,53 (с, 1H), 8,36 (с, 1H), 8,33 (д, 1H), 8,31 (с, 1H), 7,35 (д, 1H), 4,33 (т, 2H), 3,94 (ушир. м, 4H), 3,63 (ушир. м, 2H), 3,48 (т, 2H), 3,36 (ушир. м, 2H), 2,35 (ушир. м, 2H), 2,19 (ушир. м, 2H). МС m/z 446 (М+1).
20e : Соль TFA 6-{4-[3-(3,3-дифторпирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,53 (с, 1H), 8,36 (с, 1H), 8,34 (д, 1H), 8,31 (с, 1H), 7,35 (д, 1H), 4,33 (т, 2H), 3,95 (ушир. м, 2H), 3,75 (ушир. м, 2H), 3,49 (т, 2H), 2,69 (м, 2H), 2,32 (м, 2H). МС m/z 452,5 (М+1).
20f: 6-{4-[3-(4-Этилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,64 (с, 1H), 8,45 (с, 1H), 8,38 (д, 1H), 8,34 (с, 1H), 7,39 (д, 1H), 4,22 (т, 2H), 2,45 (т, 2H), 2,39 (ушир. м, 8H), 2,31 (м, 2H), 1,91 (м, 2H), 0,98 (т, 3H).
МС m/z 459 (М+1).
20g : 6-(4-{3-[4-(2-Метоксиэтил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,66 (с, 1H), 8,46 (с, 1H), 8,35 (д, 1H), 8,33 (с, 1H), 7,39 (д, 1H), 4,22 (т, 2H), 3,41 (т, 2H), 3,22 (с, 3H), 2,46 (ушир. м, 12H), 1,91 (м, 2H). МС m/z 489 (М+1).
20h : 6-(4-{3-[4-(2-Оксо-2-пирролидин-1-илэтил)пиперазин-1-ил]пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,66 (с, 1H), 8,46 (с, 1H), 8,35 (д, 1H), 8,33 (с, 1H), 7,40 (д, 1H), 4,23 (т, 2H), 3,46 (т, 2H), 3,25 (м, 2H), 3,06 (с, 2H), 2,47 (м, 2H), 2,40 (ушир. м, 8H), 1,91 (м, 2H), 1,84 (м, 2H), 1,74 (м, 2H). МС m/z 542 (М+1).
20i : Соль TFA 6-{4-[3-(4-гидроксипиперидин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (СD3OD) δ: 8,52 (с, 1H), 8,31 (с, 1H), 8,28 (д, 1H), 8,26 (с, 1H), 7,30 (д, 1H), 4,31 (т, 2H), 4,12 (ушир. с, 0,5H), 3,88 (ушир. м, 0,5H), 3,62 (ушир. д, 1H), 3,45 (ушир. д, 1H), 3,35 (ушир. м, 3H), 3,11 (ушир. т, 1H), 2,32 (ушир. м, 2H), 2,18 (ушир. д, 1H), 1,98 (ушир. м, 2H), 1,71 (ушир. м, 1H). МС m/z 446 (М+1).
20j : 6-{4-[3-((S)-3-диметиламинопирролидин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,65 (с, 1H), 8,46 (с, 1H), 8,38 (д, 1H), 8,34 (с, 1H), 7,39 (д, 1H), 4,23 (т, 2H), 2,80 (м, 1H), 2,70 (т, 1H), 2,61 (м, 3H), 2,47 (м, 1H), 2,38 (м, 1H), 2,16 (с, 6H), 1,92 (м, 3H), 1,60 (м, 1H). МС m/z 459 (М+1).
ПРИМЕР 21
6-{3-Хлор-4-[3-(пиперазин-1-ил)пропокси]-5-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
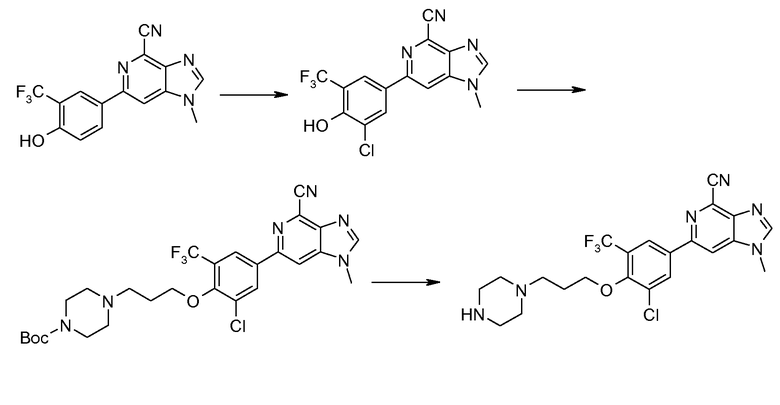
A: 6-(3-Хлор-4-гидрокси-5-трифторметилфенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил
N-Хлорсукцинимид (84 мг) добавляли к раствору 6-(4-гидрокси-3-трифторметилфенил)-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрила (200 мг) в ДМФА (4 мл). Смесь перемешивали при комнатной температуре в течение 24 часов, затем добавляли этилацетат (50 мл) и воду (20 мл) и органический слой промывали дважды водой (2 × 20 мл) и насыщенным раствором соли (20 мл), затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая при этом неочищенный 6-(3-хлор-4-гидрокси-5-трифторметилфенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил (165 мг), который загрязнен исходным соединением. Полученное соединение применяли для следующей стадии без дополнительной очистки.
МС m/z 353 (М+1).
B: трет-Бутиловый эфир 4-(3-гидроксипропил)пиперазин-1-карбоновой кислоты
Ди-трет-бутилдикарбонат (1,50 г) добавляли к раствору 3-(1-пиперазин)пропанола (1,00 г) в ТГФ (50 мл) при 0°С. Смесь перемешивали на протяжении ночи при комнатной температуре, затем растворитель удаляли при пониженном давлении, получая при этом трет-бутиловый эфир 4-(3-гидроксипропил)пиперазин-1-карбоновой кислоты (1,66 г).
1H ЯМР (CD3CN) δ: 3,81 (м, 2H); 3,43 (м, 4H); 2,62 (м, 2H); 2,47 (м, 4H); 1,73 (м, 2H); 1,45 (с, 9H).
C: трет-Бутиловый эфир 4-(3-бромпропил)пиперазин-1-карбоновой кислоты
В атмосфере азота раствор трифенилфосфина (0,94 г) в ТГФ (4 мл) медленно добавляли к смеси трет-бутилового эфира 4-(3-гидроксипропил)пиперазин-1-карбоновой кислоты (0,80 г) и тетрабромметана (1,19 г) в ТГФ (15 мл). Смесь перемешивали при комнатной температуре в течение 16 часов, затем добавляли этилацетат (100 мл) и насыщенный раствор карбоната натрия (30 мл) и органический слой промывали насыщенным раствором соли, затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле (элюент: смесь 8/2 циклогексан/этилацетат), получая при этом трет-бутиловый эфир 4-(3-бромпропил)пиперазин-1-карбоновой кислоты (0,66 г).
1H ЯМР (CD3CN) δ: 3,47 (м, 2H); 3,42 (м, 4H); 2,48 (м, 2H); 2,38 (м, 4H); 2,02 (м, 2H); 1,46 (с, 9H).
D: трет-Бутиловый эфир 4-{3-[2-хлор-4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-6-трифторметилфенокси]пропил}пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(3-бромпропил)пиперазин-1-карбоновой кислоты (172 мг) добавляли к смеси 6-(3-хлор-4-гидрокси-5-трифторметилфенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила (165 мг) и карбоната калия (130 мг) в ацетонитриле (15 мл). Смесь кипятили с обратным холодильником в течение 4 часов, затем добавляли этилацетат (50 мл) и воду (30 мл) и органический слой промывали насыщенным раствором соли, затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая при этом сырой продукт, трет-бутиловый эфир 4-{3-[2-хлор-4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-6-трифторметилфенокси]пропил}пиперазин-1-карбоновой кислоты.
МС m/z 579 (М+1).
E: 6-{3-Хлор-4-[3-(пиперазин-1-ил)пропокси]-5-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
Сырой продукт, трет-бутиловый эфир 4-{3-[2-хлор-4-(4-циано-1-метил-1H-имидазо[4,5-c]пиридин-6-ил)-6-трифторметилфенокси]пропил}пиперазин-1-карбоновой кислоты, растворяли в МeOH (7 мл) и добавляли 5 н раствор HCl в iPrOH (7,6 мл). Смесь перемешивали 3 часа при комнатной температуре, затем растворитель выпаривали при пониженном давлении. Сырой продукт сразу очищали препаративной ВЭЖХ (ВЭЖХ: колонка XBridge МS C18, 30×100 мм, 5 мкм, элюент: A: NH4HCO3, 10 ммоль, pH=9,5/B: ацетонитрил, фокусированный градиент/8 минут/50 мл/мин), получая при этом 6-{3-хлор-4-[3-(пиперазин-1-ил)пропокси]-5-(трифторметил)фенил}-1-метил-1Н-имидазо[4,5-c]пиридин-4-карбонитрил.
1H ЯМР (CDCl3) δ: 8,34 (с, 1H), 8,16 (с, 1H), 8,13 (с, 1H), 7,91 (с, 1H), 4,20 (т, 2H), 4,01 (с, 3H), 2,93 (т, 4H), 2,60 (т, 2H), 2,49 (ушир., 4H), 2,09 (т, 2H). МС m/z 479 (М+H). МС m/z 479 (М+1).
Методику, описанную в примере 7а , далее применяли с использованием подходящих исходных веществ для получения нижеследующего соединения.
ПРИМЕР 22
6-(4-(3-(3,5-Диметил-1H-пиразол-1-ил)пропокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО-d6) δ: 8,72 (с, 1H), 8,64 (с, 1H), 8,44 (д, 1H), 8,43 (с, 1H), 7,41 (д, 1H), 5,79 (с, 1H), 4,17 (т, 2H), 4,10 (т, 2H), 3,99 (с, 3H), 2,19 (м, 2H), 2,15 (с, 3H), 2,09 (с, 3H). МС m/z 455,2 (М+1).
Методику, описанную в примере 4а , далее применяли с использованием подходящих производных пиперазина для получения нижеследующих соединений в виде либо соли TFA, свободного основания или соли HCl.
ПРИМЕР 23
Гидрохлорид 1-метил-6-{3-(трифторметил)-4-[(3-(S)-изопропилпиперазин-1-ил)пропокси]фенил}-1H-имидазо[4,5-c]пиридин-4-карбонитрила
1H ЯМР (МеОD) δ: 8,83 (с, 1H), 8,52 (с, 1H), 8,41 (с, 1H), 8,40 (д, 1H), 7,40 (д, 1H), 4,37 (м, 2H), 4,09 (с, 3H), 3,93 (м, 2H), 3,76 (м, 1H), 3,67 (м, 2H), 3,45-3,6 (м, 3H), 3,37 (т, 1H), 2,45 (м, 2H), 2,10 (м, 1H), 1,16 (д, 3H), 1,14 (д, 3H). МС m/z 487 (М+1).
ПРИМЕР 24
2,2,2-Трифторацетат 6-(4-(2-(1-этилпиперидин-4-ил)этокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрила
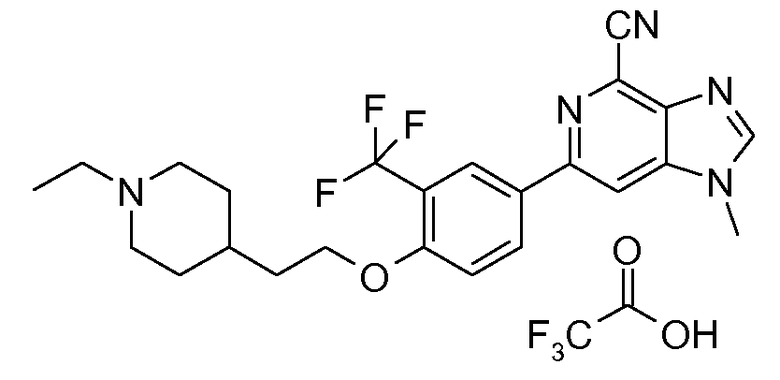
Гидрохлорид 1-метил-6-{4-[2-(пиперидин-4-ил)этокси]-3-(трифторметил)фенил)-1Н-имидазо[4,5-c]пиридин-4-карбонитрила (20 мг), этилиодид (10 мг) и карбонат калия (20 мг) в ацетонитриле (1 мл) перемешивали при комнатной температуре в течение 20 часов. После удаления твердого вещества фильтрованием фильтрат очищали ВЭЖХ, получая при этом 6-{4-[2-(1-этилпиперидин-4-ил)этокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил в виде соли ТFA.
1H ЯМР (CD3OD) δ: 8,45 (с, 1H), 8,38 (с, 2H), 8,37 (д, 1H), 7,33 (д, 1H), 4,28 (т, 2H), 4,02 (с, 3H), 3,62 (м, 2H), 3,18 (кв., 2H), 2,95 (м, 2H), 2,14 (м, 2H), 2,0 (м, 1H), 1,9 (м, 2H), 1,55 (м, 2H), 1,35 (т, 3H). МС m/z 458 (М+1).
Методику, описанную в примере 13а , далее применяли с использованием подходящих производных спиртов для получения нижеследующих соединений в виде либо соли TFA, нейтрального соединения, либо соли HCl.
ПРИМЕР 25a
1-Метил-6-[4-(6-метилпиридин-2-илметокси)-3-трифторметилфенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил
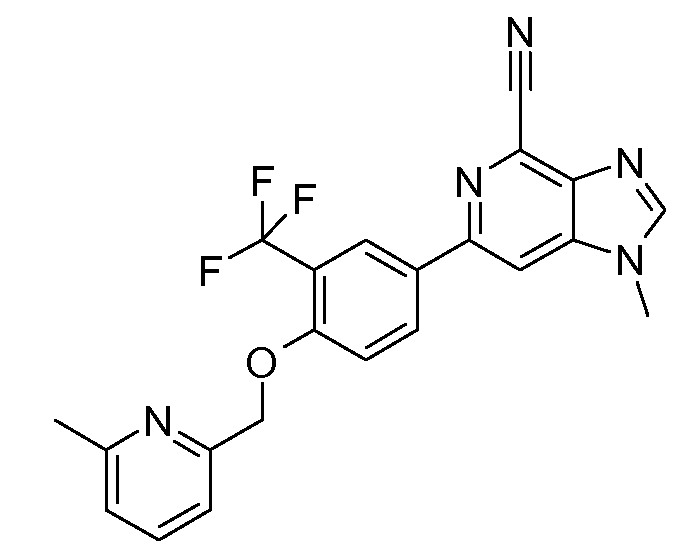
1H ЯМР (ДМСО) δ: 8,74 (с, 1H), 8,65 (с, 1H), 8,44 (д, 2H), 7,78 (т, 1H), 7,52 (д, 1H), 7,31 (д, 1H), 7,23 (д, 1H), 5,40 (с, 2H), 3,99 (с, 3H), 2,50 (с, 3H). МС m/z 424,0 (М+1).
ПРИМЕР 25b
1-Метил-6-[4-(пиримидин-2-илметокси)-3-трифторметилфенил]-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (ДМСО) δ: 8,86 (д, 2H), 8,70 (с, 1H), 8,64 (с, 1H), 8,42 (с, 1H), 8,35 (д, 1H), 7,49 (т, 1H), 7,38 (д, 1H), 5,56 (с, 2H), 3,98 (с, 3H). МС m/z 411,0 (М+1).
ПРИМЕР 25c
6-(4-((5-Изопропилизоксазол-3-ил)метокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CDCl3) δ: 8,28 (1H, с); 8,23 (1H, д); 8,10 (1H, с); 7,88 (1H, с); 7,24 (1H, д); 6,12 (1H, с); 5,31 (2H, с); 3,99 (3H, с); 3,08 (1H, м); 1,32 (6H, д). МС m/z 442 (М+1).
ПРИМЕР 25d
6-(4-((3-Изопропилизоксазол-5-ил)метокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
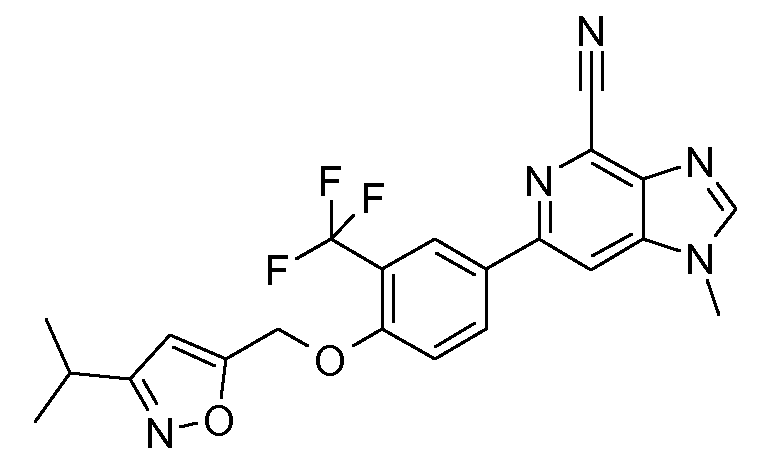
1H ЯМР (CDCl3) δ: 8,27 (1H, с); 8,26 (1H, д); 8,09 (1H, с); 7,89 (1H, с); 7,18 (1H, д); 6,27 (1H, с); 5,30 (2H, с); 4,00 (3H, с); 3,08 (1H, м); 1,30 (6H, д). МС m/z 442 (М+1).
ПРИМЕР 25е
6-(4-((3-Изопропил-1,2,4-оксадиазол-5-ил)метокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-c]пиридин-4-карбонитрил
1H ЯМР (CDСl3) δ: 8,29 (1H, д); 8,26 (1H, с); 8,10 (1H, д); 7,89 (1H, с); 7,23 (1H, д); 5,44 (2H, с); 4,00 (3H, с); 3,15 (1H, м); 1,35 (6H, д). МС m/z 443 (М+1).
ПРИМЕР 26
Методика анализа катепсина S
Ингибирующую активность соединений изобретения демонстрировали in vitro измерением ингибирования рекомбинантного катепсина S человека следующим образом. В 384-луночный титрационный микропланшет добавляют 10 мкл 100 мкМ раствора испытуемого соединения в буфере для анализа (100 мМ ацетат натрия, рН 5,5, 5 мМ EDTA, 5 мМ дитиотреитол) с 10% диметилсульфоксида (ДМСО) плюс 20 мкл 250 мкМ раствора субстрата Z-Val-Val-Arg-AMC (7-амидокумариновое производное трипептида N-бензилоксикарбонил-Val-Val-Arg-OH) в буфере для анализа и 45 мкл буфера для анализа. Затем в лунки добавляют по 25 мкл 2 мг/л раствора активированного рекомбинантного катепсина S человека в буфере для анализа, получая конечную концентрацию ингибитора 10 мкМ.
Ферментативную активность определяют измерением флуоресценции выделенного аминометилкумарина при 440 нМ с применением возбуждения при 390 нМ при времени 20 минут. Процентную ферментативную активность вычисляли сравнением этой активности с активностью раствора, не содержащего ингибитор. Соединения затем подвергают анализу с кривой зависимости “доза-эффект” для определения величин IC50 для активных соединений (где IC50 является концентрацией испытуемого соединения, вызывающей 50% ингибирование ферментативной активности). Соединения изобретения обычно имеют рIC50 (отрицательный логарифм концентрации IC50) для ингибирования катепсина S человека больше чем 6. Большинство соединений изобретения имеют рIC50 больше чем 7, например, приведенные в качестве примеров соединения примеров 1, 2a, 2c, 2u, 4a, 4b, 4c, 4e, 4f, 5a, 7b, 9d, 11, 12, 13c, 20f.
ПРИМЕР 27
Методика анализа катепсина К
Ингибирующую активность соединений изобретения демонстрировали in vitro измерением ингибирования рекомбинантного катепсина К человека следующим образом. В 384-луночный титрационный микропланшет добавляют 5 мкл 100 мкМ раствора испытуемого соединения в буфере для анализа (100 мМ ацетат натрия, рН 5,5, 5 мМ EDTA, 5 мМ дитиотреитол) с 10% диметилсульфоксида (ДМСО) плюс 10 мкл 100 мкМ раствора субстрата Z-Phe-Arg-AMC (7-аминокумариновое производное дипептида N-бензилоксикарбонил-Phe-Arg-OH) в буфере для анализа и 25 мкл буфера для анализа. Затем в лунки добавляют по 10 мкл 1 мг/л раствора активированного рекомбинантного катепсина К человека в буфере для анализа, получая конечную концентрацию ингибитора 10 мкМ.
Ферментативную активность определяют измерением флуоресценции выделенного аминометилкумарина при 440 нМ с применением возбуждения при 390 нМ при времени 10 минут. Процентную ферментативную активность вычисляли сравнением этой активности с активностью раствора, не содержащего ингибитор. Соединения затем подвергают анализу, используя кривую зависимости “доза-эффект” для определения величин IC50 для активных соединений (где IC50 является концентрацией испытуемого соединения, вызывающей 50% ингибирование ферментативной активности). Соединения изобретения имеют рIC50 (отрицательный логарифм концентрации IC50) для ингибирования катепсина К человека меньше чем 7.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 6-ФЕНИЛ-1Н-ИМИДАЗО[4,5,-с] ПИРИДИН-4-КАРБОНИТРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА К И S | 2007 |
|
RU2400482C2 |
| НОВЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ИХ СОДЕРЖАЩИЕ, ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2014 |
|
RU2675818C2 |
| БИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ SUV39H2 | 2016 |
|
RU2729187C1 |
| ИСПОЛЬЗОВАНИЕ ЛИГАНДОВ РЕЦЕПТОРА ЕР4 ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ IL-6 ЗАБОЛЕВАНИЙ | 2003 |
|
RU2285527C2 |
| НОВЫЕ СОЕДИНЕНИЯ И ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2785126C2 |
| ИНГИБИТОРЫ АКТИВНОСТИ АКТ | 2010 |
|
RU2579513C2 |
| ПЕРВИЧНЫЕ КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ BТK | 2014 |
|
RU2708395C2 |
| АГОНИСТЫ РЕЦЕПТОРА GLP-1 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2740135C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИН-2-ОНА, ОБЛАДАЮЩИЕ mTOR ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2009 |
|
RU2478636C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
Изобретение относится к области органической химии, а именно к новым производным 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила формулы I или к их фармацевтически приемлемым солям, где R1 представляет собой H; R2 представляет собой (C1-3)алкил; R3 представляет собой (C1-4)алкил, необязательно замещенный тремя атомами галогена; R4 представляет собой H; Х представляет собой O; n равно 1 или 2 или 3; Y выбран из OH, NR5R6 и Z, где Z представляет собой насыщенное 5- или 6-членное гетероциклическое кольцо, содержащее 1 гетероатом, выбранный из NR7, где кольцо может быть замещено оксо, (C1-3)алкилом, гидрокси(C1-3)алкилом; или где Z представляет собой ароматическое 5- или 6-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, выбранных из N, где кольцо может быть замещено (C1-3)алкилом; R5 и R6 независимо представляют собой H, (C3-8)циклоалкил или (C1-6)алкил, необязательно замещенный 1-2 раза галогеном, ОН, (C1-6)алкилокси, CONR14R15, NR14R15 или 6-членную насыщенную гетероциклическую группу, содержащую гетероатом, выбранный из NR8; или R5 и R6 вместе с атомом азота, с которым они связаны, образуют 5-10-членное насыщенное гетероциклическое кольцо, необязательно дополнительно содержащее 1, 3 гетероатома, выбранных из NR9, причем кольцо необязательно замещено OH, оксо, (C1-4)алкилом, гидрокси(C1-3)алкилом, CONR10R11 или NR10R11; R7 представляет собой H; R8 представляет собой (C1-3)алкил; R9 представляет собой H, (C1-3)алкил, гидрокси(C1-3)алкил, (C1-3)алкокси(C1-3)алкил, (C1-6)алкилкарбонил, (C1-6)алкилоксикарбонил, CONR12R13 или 6-членную гетероарильную группу, содержащую 1-2 гетероатома, выбранных из N; R10 и R11 независимо представляют собой H или (C1-3)алкил; R12 и R13 независимо представляют собой (C1-3)алкил; или R14 и R15 независимо представляют собой (С1-3)алкил. Также изобретение относится к применению производного 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила формулы I и к фармацевтической композиции на его основе. Технический результат: получены новые производные 6-фенил-1Н-имидазо[4,5-с]пиридин-4-карбонитрила, полезные для лечения остеопороза, атеросклероза, воспаления и иммунных нарушений, таких как ревматоидный артрит, псориаз, и хронической боли, такой как невропатическая боль. 3 н. и 6 з.п. ф-лы, 31 пр.
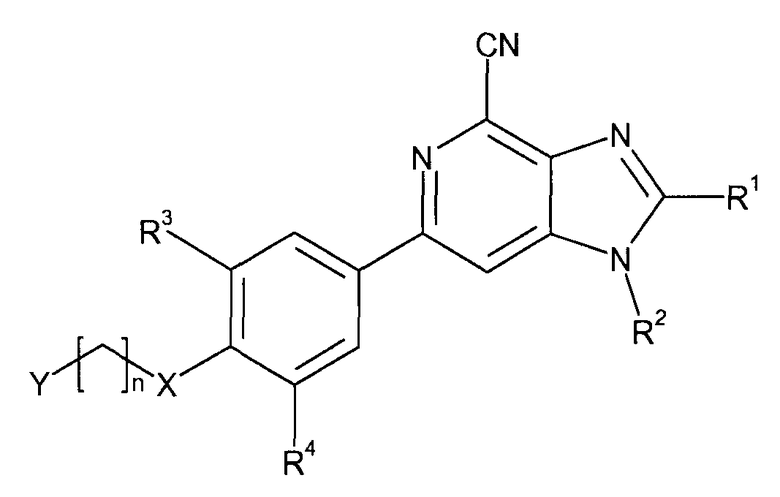
1. Производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила, имеющее общую формулу I
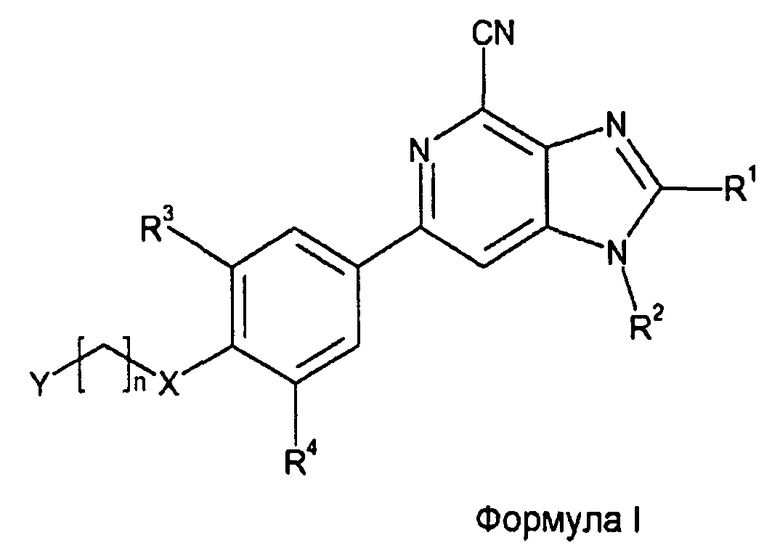
где R1 представляет собой H;
R2 представляет собой (C1-3)алкил;
R3 представляет собой (C1-4)алкил, необязательно замещенный тремя атомами галогена;
R4 представляет собой H;
X представляет собой O;
n равно 1 или 2 или 3;
Y выбран из OH, NR5R6 и Z, где
Z представляет собой насыщенное 5- или 6-членное гетероциклическое кольцо, содержащее 1 гетероатом, выбранный из NR7, где кольцо может быть замещено оксо, (C1-3)алкилом, гидрокси(C1-3)алкилом; или где
Z представляет собой ароматическое 5- или 6-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, выбранных из N, где кольцо может быть замещено (C1-3)алкилом;
R5 и R6 независимо представляют собой H, (C3-8)циклоалкил или (C1-6)алкил, необязательно замещенный 1-2 раза галогеном, OH, (C1-6)алкилокси, CONR14R15, NR14R15 или 6-членную насыщенную гетероциклическую группу, содержащую гетероатом, выбранный из NR8; или
R5 и R6 вместе с атомом азота, с которым они связаны, образуют 5-10-членное насыщенное гетероциклическое кольцо, необязательно дополнительно содержащее 1, 3 гетероатома, выбранных из NR9, причем кольцо необязательно замещено OH, оксо, (C1-4)алкилом, гидрокси(C1-3)алкилом, CONR10R11 или NR10R11;
R7 представляет собой H;
R8 представляет собой (C1-3)алкил;
R9 представляет собой H, (C1-3)алкил, гидрокси(C1-3)алкил, (C1-3)алкокси(C1-3)алкил, (C1-6)алкилкарбонил, (C1-6)алкилоксикарбонил, CONR12R13 или 6-членную гетероарильную группу, содержащую 1-2 гетероатома, выбранных из N;
R10 и R11 независимо представляют собой H или (C1-3)алкил;
R12 и R13 независимо представляют собой (C1-3)алкил; или
R14 и R15 независимо представляют собой (C1-3)алкил; или
или их фармацевтически приемлемые соли.
2. Производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по п.1, где R3 представляет собой CF3 и R4 представляет собой H.
3. Производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по п.1, где Y представляет собой NR5R6.
4. Производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по п.1, где Y представляет собой Z, и где Z представляет собой пиридил.
5. Производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по п.1, которое выбрано из
- 6-[4-(3-диметиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 1-метил-6-[4-(3-пирролидин-1-илпропокси)-3-(трифторметил)-фенил]-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 6-[4-(3-N,N-диэтиламинопропокси)-3-(трифторметил)фенил]-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 1-метил-6-[3-(трифторметил)-4-(3-(3,3,4-триметил-пиперазин-1-ил)пропокси)фенил]-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 6-{4-[3-(3,3-диметилпиперазин-1-ил)пропокси]-3-(трифторметил)-фенил}-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 6-{4-[3-(цис-3,5-диметилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 1-метил-6-{4-[3-(4-метилпиперазин-1-ил)пропокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 6-{4-[3-(4-этилпиперазин-1-ил)пропокси]-3-(трифторметил)-фенил}-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 1-метил-6-(4-{3-[4-(N-метиламинокарбонил)пиперидин-1-ил]-пропокси}-3-(трифторметил)фенил)-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 6-{4-[3-(2-этилимидазол-1-ил)пропокси]-3-(трифторметил)-фенил}-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 6-{4-[2-(цис-3,5-диметилпиперазин-1-ил)этокси]-3-(трифторметил)-фенил}-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 1-метил-6-{4-[2-(8-метил-2,4-диоксо-1,3,8-триазаспиро-[4.5]дец-3-ил)этокси]-3-(трифторметил)фенил}-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 1-метил-6-[4-(пиридин-2-илметокси)-3-(трифторметил)-фенил]-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 6-{4-[3-(4-этилпиперазин-1-ил)пропокси]-3-(трифторметил)-фенил}-1Н-имидазо[4,5-с]пиридин-4-карбонитрила;
- гидрохлорида 1-метил-6-{3-(трифторметил)-4-[(3-(S)-изопропил-пиперазин-1-ил)пропокси]фенил}-1H-имидазо[4,5-с]пиридин-4-карбонитрила;
- 2,2,2-трифторацетата 6-(4-(2-(1-этилпиперидин-4-ил)этокси)-3-(трифторметил)фенил)-1-метил-1H-имидазо[4,5-с]пиридин-4-карбонитрила и
- 1-метил-6-[4-(6-метилпиридин-2-илметокси)-3-трифторметил-фенил]-1H-имидазо[4,5-с]пиридин-4-карбонитрила
или их фармацевтически приемлемых солей.
6. Производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по любому из пп.1-5 для применения в терапии для лечения остеопороза, атеросклероза, воспаления и иммунных нарушений, таких как ревматоидный артрит, псориаз, и хронической боли, такой как невропатическая боль.
7. Применение производного 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по любому из пп.1-5 для изготовления лекарственного средства для лечения остеопороза, атеросклероза, воспаления и иммунных нарушений, таких как ревматоидный артрит, псориаз, и хронической боли, такой как невропатическая боль.
8. Фармацевтическая композиция для лечения остеопороза, атеросклероза, воспаления и иммунных нарушений, таких как ревматоидный артрит, псориаз, и хронической боли, такой как невропатическая боль, содержащая производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по любому из пп.1-5 или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемыми вспомогательными веществами.
9. Производное 6-фенил-1H-имидазо[4,5-с]пиридин-4-карбонитрила по любому из пп.1-5 для применения при лечении остеопороза, атеросклероза, воспаления и иммунных нарушений, таких как ревматоидный артрит, псориаз, и хронической боли, такой как невропатическая боль.
| Способ лечения больных страдающих лимфедемой нижних конечностей | 1989 |
|
SU1724264A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Литейная форма | 1984 |
|
SU1214319A1 |
| АВТОМАТИЧЕСКАЯ ТЕЛЕФОННАЯ СТАНЦИЯ | 1927 |
|
SU7157A1 |
| RU 2005133441 A, 10.05.2006 | |||
| Ручная грузовая тележка | 1940 |
|
SU62972A1 |
Авторы
Даты
2013-06-20—Публикация
2008-07-14—Подача