Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям 7'-окса-2',12'-диазатетрацикло[6.5.1.01,5.08,12]тетрадекана и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем, а также после углубленного изучения и в медицинской практике.
1. Известны структурные аналоги заявленных соединений, получаемые взаимодействием 3-ароил-1H-пирроло[2,1-c] [1,4]бензоксазин-1,2,4-трионов (Ia, б) с α-енаминоэфирами (IIa-в) в абсолютном бензоле в течение 20-25 минут (Журнал органической химии. 2008. Том 44. С 1197). Синтез структурных аналогов осуществляется по следующей схеме:
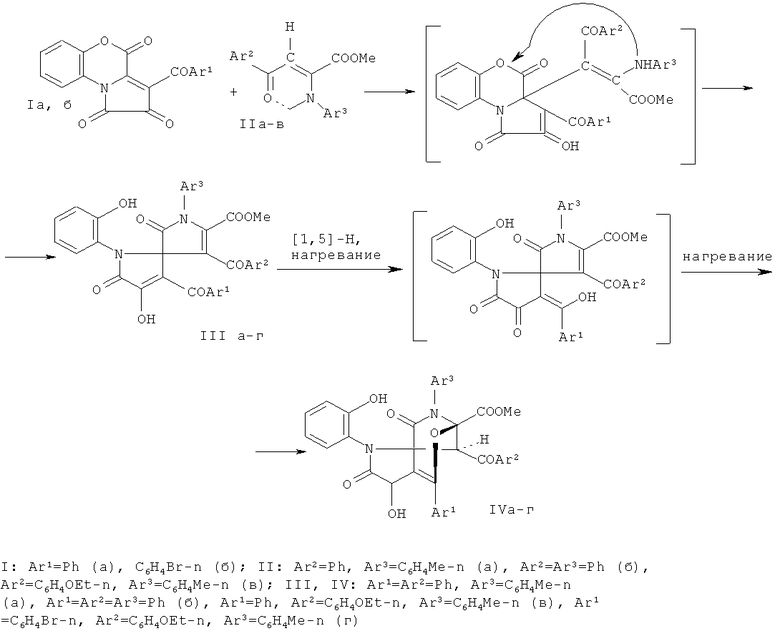 К недостаткам данного способа относится невозможность получения мостиковых аналогов пирролизидиновых алкалоидов.
К недостаткам данного способа относится невозможность получения мостиковых аналогов пирролизидиновых алкалоидов.
Задачей изобретения является разработка способа синтеза 6'-арил-2'-(2-гидроксифенил)-11',11'-диметил-3',4,4',13'-тетраоксоспиро[2,5-циклогекса-диен-1,9'-(7,-окса-2',12'-диазатетрацикло[6.5.1.01,5.08,12]тетрадец-5'-ен]-14'-карбоксилатов, которые являются мостиковыми аналогами пирролизидиновых алкалоидов.
Поставленная задача осуществляется путем кипячения 3-ароил-1H-пирроло[2,1-с][1,4]бензоксазин-1,2,4-трионов (Ia, б) с (Z) этил 2-(3,3-диметил-8-оксо-2-азаспиро[4.5]дека-6,9-диен-1-илиден)ацетатом (II), взятыми в соотношении 1:1 по схеме
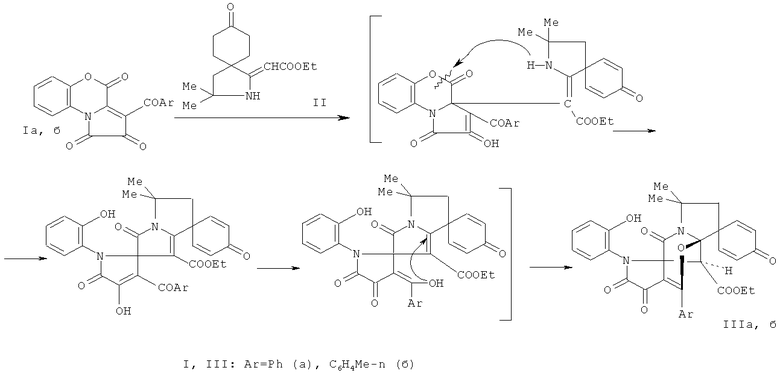
Процесс ведут при температуре 79-80°C, а в качестве растворителя используют абсолютный бензол. Данная реакция сопровождается присоединением активированной группы β-CH эфира спиропирролина (II) к атому углерода в положении 3a пирролобензоксазинтрионов (Ia, б) с последующим замыканием пиррольного цикла путем внутримолекулярной атаки аминогруппой енаминофрагмента лактонной карбонильной группы бензоксазинонового цикла пирролобензоксазинтрионов и его раскрытия по связи C4-O5. На второй стадии происходит внутримолекулярное нуклеофильное присоединение енольной группы ОН к активированной двойной связи.
Из патентной и технической литературы не были выявлены способы получения 6'-арил-2'-(2-гидроксифенил)-11',11'-диметил-3',4,4'13'-тетраоксоспиро[2,5-циклогексадиен-1,9'-(7'-окса-2',12'-диазатетрацикло[6.5.1.01,5.08,12]тетрадец-5'-ен]-14'-карбоксилатов, имеющие сходные признаки с заявляемым способом, а именно не использовался исходный продукт - (Z) этил 2-(3,3-диметил-8-оксо-2-азаспиро[4.5]дека-6,9-диен-1-илиден)ацетат, который в данном случае при взаимодействии с 3-ароил-1H-пирроло[2,1-c] [1,4]бензоксазин-1,2,4-трионами приводит к образованию мостиковых аналогов пирролизидиновых алкалоидов, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. Этил 2'-(2-гидроксифенил)-11',11'-диметил-3',4,4',13'-тетраоксо-6'-фенилспиро[2,5-циклогексадиен-1,9'-(7'-окса-2',12'-диазатетрацикло[6.5.1.01,5.08,12]тетрадец-5'-ен]-14'-карбоксилат (IIIa).
Раствор 1.0 ммоль 3-бензоил-1H-пирроло[2,1-с][1,4]бензоксазин-1,2,4-триона (Ia) и 1.0 ммоль (Z) этил 2-(3,3-диметил-8-оксо-2-азаспиро[4.5]дека-6,9-диен-1-илиден)ацетата (II) в 20 мл абсолютного бензола кипятили 5 мин, охлаждали, выпавший осадок соединения (IIIa) отфильтровывали. Выход 97%, т.пл. 180-182°C (из этилацетата).
ИК-спектр, см-1: 3228 (OH), 1725 (COOEt, C3'=O, С4'=O, C13'=O), 1665 (С4=O).
Спектр ЯМР 1H, δ, м.д.: 0.96 т (3H, OCH2 Me, J 6.9 Гц), 1.32 с, 1.54 с (6Н, 2Ме), 2.54 центр АВ-система (2Н, С10'Н2), 3.65 с (1H, C14'H), 3.87 к (2Н, ОСН 2Ме, J 7.0 Гц), 6.30-7.93 гр.с (13Н, Ph+2C6H4), 9.92 с (1Н, OH фенол.).
Найдено, %: C 68.12; H 4.98; N 4.63. C33H28N2O8.
Вычислено, %: C 68.27; H 4.86; N 4.82.
Пример 2. Этил 2'-гидроксифенил)(-11',11'-диметил-3',4,4',13'-тетраоксо-6'-(4-толил)спиро[2,5-циклогексадиен-1,9'-(7,-окса-2',12'-диазатетрацикло[6.5.1.01,5.08,12]тетрадец-5'-ен]-14'-карбоксилат (IIIб).
Раствор 1.0 ммоль 3-n-метилбензоил-1H-пирроло[2,1-с][1,4]бензоксазин-1,2,4-триона (Iб) и 1.0 ммоль (Z) этил 2-(3,3-диметил-8-оксо-2-азаспиро[4.5]дека-6,9-диен-1-илиден)ацетата (II) в 20 мл абсолютного бензола кипятили 2 мин, охлаждали, выпавший осадок соединения (IIIб) отфильтровывали. Выход 95%, т.пл. 178-179°C (из этилацетата).
ИК-спектр, см-1: 3205 (OH), 1726 (COOEt, С3'=O, C4'=O, С13'=O), 1673 (C4=0).
Спектр ЯМР 1H, δ, м.д.: 0.95 т (3H, OCH2 Me, J 6.9 Гц), 1.30 с, 1.53 с (6Н, 2Ме), 1.98 с (3H, 4-MeC6H4), 2.52 центр АВ-система (2Н, С10'Н2), 3.65 с (1H, C14'H), 3.86 к (2Н, OCH 2Me, J 7.0 Гц), 6.31-7.88 гр.с (12Н, 3C6H4), 9.91 с (1Н, OH фенол.).
Найдено, %: C 68.48; H 5.27; N 4.52. C34H30N2O8.
Вычислено, %: C 68.68; H 5.09; N 4.71.
Предлагаемый способ достаточно прост в осуществлении, одностадиен и позволяет получить 6'-арил-2'-(2-гидроксифенил)-11',11'-диметил-3',4,4',13'-тетраоксоспиро[2,5-циклогексадиен-1,9'-(7'-окса-2', 12'-диазатетрацикло[6.5.1.01,5.08,12]тетрадец-5'-ен]-14'-карбоксилаты практически с количественным выходом, которые найдут применение в качестве исходных продуктов для синтеза гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств.
Изобретение относится к 6'-Арил-2'-(2-гидроксифенил)-11',11'-диметил-3',4,4',13'-тетраоксоспиро[2,5-циклогексадиен-1,9'-(7'-окса- 2',12'-диазатетрацикло[6.5.1.01,5.08,12]-тетрадец-5'-ен]-14'-карбоксилатам общей формулы (IIIа,б) и к способу их получения, которые могут быть использованы в качестве анальгезирующих средств. 2 н.п. ф-лы, 2 пр.
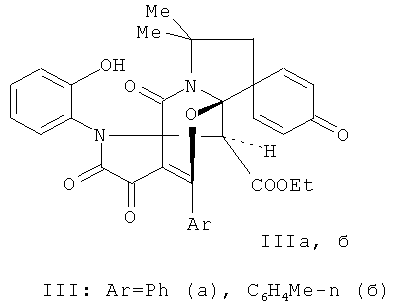
1. 6'-Арил-2'-(2-гидроксифенил)-11',11'-диметил-3',4,4',13'-тетраоксоспиро[2,5-циклогексадиен-1,9'-(7'-окса-2',12'-диазатетрацикло [6.5.1.01,5.08,12]-тетрадец-5'-ен)]14'-карбоксилаты общей формулы (IIIа,б), проявляющие анальгетическую активность:
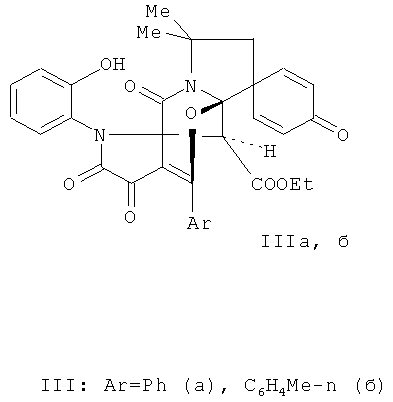
2. Способ получения 6'-арил-2'-(2-гидроксифенил)-11',11'-диметил-3',4,4',13'-тетраоксоспиро[2,5-циклогексадиен-1,9'-(7'-окса-2,12'-диазатетрацикло[6.5.1.01,5.08,12]-тетрадец-5'-ен)]-14'-карбоксилатов общей формулы (IIIа,б):
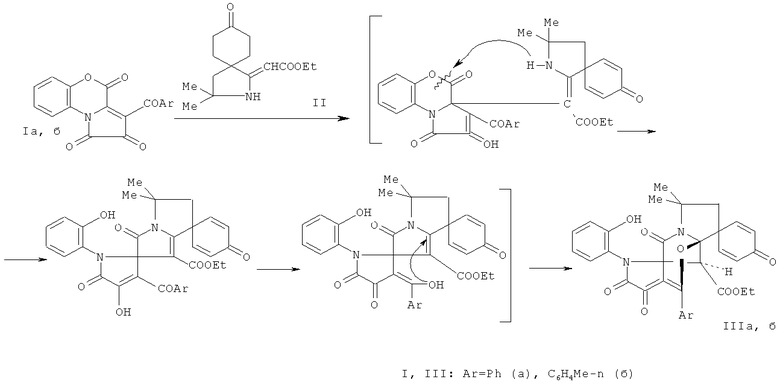 отличающийся тем, что 3-ароил-1Н-пирроло[2,1-c][1,4]бензоксазин-1,2,4-трионы (Iа,б) подвергают взаимодействию (Z) этил 2-(3,3-диметил-8-оксо-2-азаспиро[4.5]дека-6,9-диен-1-илиден)ацетата (II).
отличающийся тем, что 3-ароил-1Н-пирроло[2,1-c][1,4]бензоксазин-1,2,4-трионы (Iа,б) подвергают взаимодействию (Z) этил 2-(3,3-диметил-8-оксо-2-азаспиро[4.5]дека-6,9-диен-1-илиден)ацетата (II).
| Рачева Н.Л., Алиев З.Г., Масливец А.Н | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| LXI | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| - Журнал органической химии, 2008, т.44, вып.8, с.1197-1201. | |||
Авторы
Даты
2013-06-20—Публикация
2011-12-29—Подача