Изобретение относится к биохимии и молекулярной биологии прокариотической клетки и может быть применено к анализу молекулярно-генетических механизмов формирования структуры клетки прокариот и роли белковых компонентов в их организации, а также особенностей ремоделирования генома, что является необходимым для раскрытия путей регулирования механизмов воздействия макро- и микроорганизмов, а также поиску новых мишеней для лекарственных средств и разработке экологически безопасных лечебных препаратов.
Известен способ получения ядерных фракций, обладающих протеиназной и ингибирующей активностью [1], в котором в супраструктурах клеточных ядер растений были определены протеолитическая и ингибиторная активности. Недостатком этого способа является, то что анализ осуществлялся в суммарных фракциях белков клеточных ядер растений, без разделения их на гистоновые и негистоновые белки с помощью ионообменной хроматографии на амберлите ИРЦ-50.
Известен способ препаративного выделения основных (положительно заряженных) белков клеточных ядер растений [2], в котором был описан способ фракционирования гистонов с помощью ионообменной хроматографии на колонке с амберлитом ИРЦ-50. Недостатком способа является то, что в полученных ядерных фракциях не была определена ингибитор-трипсиновая активность.
Известен способ получения фракции из клеток Escherichia coli [3], обладающей ингибирующей протеазы активностью. Недостатком этого способа является, то, что не было проведено разделение полученных белков на положительно заряженные (основные) и неосновные (отрицательно заряженные и нейтральные) с помощью ионообменной хроматографии на колонке с амберлитом ИРЦ-50.
Вышеуказанный способ получения фракции из клеток Escherichia coli [3], обладающей ингибирующей протеазы активностью, был принят за основу, в котором первоначально проводят консервацию клеток в присутствии забуференного 80-90% глицерина с последующим снятием клеточных оболочек 3% тритоном Х-100, экстракцию возрастающими концентрациями солей: 0,14 М, 0,35 М; 2 М NaCl, 6 М гуанидин гидрохлоридом с 0,1% β-меркаптоэтанолом, аффинную хроматографию на сефарозе 4 В с иммобилизованным трипсином и последующей оценкой в элюатах ингибирующей протеазы активности.
Цель изобретения - предлагается способ для получения положительно заряженных белковых фракций с ингибитор-трипсиновой активностью в растущей популяции Escherichia coli.
Указанная цель достигается тем, что в способе получения положительно заряженных белковых фракций с ингибитор-трипсиновой активностью в растущей популяции Escherichia coli первоначально проводят консервацию клеток в присутствии забуференного 80-90% глицерина с последующим снятием клеточных оболочек 3% тритоном Х-100, экстракцию возрастающими концентрациями солей: 0,14 М, 0,35 М; 2 М NaCl, 6 М гуанидин гидрохлоридом с 0,1% β-меркаптоэтанолом, выделяют из вышеперечисленных фракций положительно заряженные белки с помощью ионообменной хроматографии с амберлитом ИРЦ-50 в прерывистом градиенте гуанидин гидрохлорида: 6%, 8,9%, 10,6%, 13% на 0,1 М калий-фосфатном буфере рН 6,8 и определяют в них ингибитор-трипсиновую активность.
Изобретение иллюстрируется следующим примером.
Пример. Опыты проводили на протяжении жизненного цикла клеток штамма Е.coli JC-158 (Hfr PO1, thil, serA6, lасI22, relAl) [4], предоставленного Ступак И.В. и Ступак Е.Э., выращивание культуры проводилось Тропыниной Т.С. (Институт биологии УНЦ РАН, лаборатория математической и молекулярной генетики) и штамма E.coli 5а, предоставленного Маркушевой Т.В. (Институт биологии УНЦ РАН, группа генетики микроорганизмов). В работе для выращивания использовалась богатая питательная среда LB (Луриа-Бертани). В 1 литре дистиллированной воды растворялись при помешивании (на магнитной мешалке типа MM 2А): бакто-триптон (Difco, США) -10 г; дрожжевой экстракт (Difco, США) - 5 г; NaCl - 10 г, рН до 7,5. Среда стерилизовалась при 120-123°C, при давлении пара 1 атм в стандартном автоклаве.
Бактериальные клетки, использованные в эксперименте, первоначально находились в агаризованных столбиках LB (на 1 литр среды 1,5 г агар-агара, Difco, США) и хранились при температуре 4°C. При такой температуре и практически полном отсутствии кислорода происходит замедление всех физиологических процессов в клетках. Для того, чтобы перевести клетки в "нормальное физиологическое состояние", а именно, аэробное дыхание, бактериальную культуру из агаризованного столбика в стерильных условиях переносили с помощью бактериологической петли в жидкую среду LB в объеме 5 мл, находящуюся в химической пробирке объемом 20 мл, закрывали ватно-марлевой пробкой и инкубировали при 37°C, 160 об/мин на лабораторном термостатируемом встряхивателе (П5.10-Э5960) в течение 16 часов. Отдельно выросшая хорошо сформировавшаяся колония бактерий с агаризованной среды LB пересевалась с помощью бактериологической петли в жидкую среду LB в объеме 5 мл и инкубировалась при 37°C, 160 об/мин 7 часов. Затем 100 мкл подросшей культуры клеток пересевалось в свежую жидкую среду LB в объеме 5 мл и инкубировалось при 37°C, 160 об/мин 16 часов. 2 мл культуры клеток вносилось в кювету с рабочей длиной 5,075 мм, и измерялась оптическая плотность на колориметре фотоэлектрическом концентрационном (КФК-2) при длине волны 590 нм. Это значение составляло 1,0. В свежую жидкую среду LB в объеме 120 мл в 500 мл колбе высевалось 120 мкл 16 часовой культуры, и проводилось инкубирование при 37°C, 160 об/мин в течение 7 часов 10 минут. Первая проба была взята через 50 минут после начала инкубирования. Оптическая плотность первой пробы составляла 0,005. Для дальнейшего анализа отбирались образцы в объеме 1,5 мл. Клетки осаждались центрифугированием при 12000 об/мин на центрифуге Эппендорф в течение 5 мин. Надосадочная жидкость удалялась, осадки подсушивались. К осадкам добавлялось по 50 мкл среды следующего состава: 80-90% глицерин на 0,01 М трис-HCl буфере рН 6.8 с добавлением 0.005 М MgCl2; 0.025 М KCl; 0.003 М CaCl2; 0.005 М NaCl для консервации клеток при минус 25°C. Последующие пробы отбирались через каждые 20 минут в течение 7 часов 10 минут. Далее осадки клеток промывали 3% тритоном Х-100 в среде следующего состава: 0.02М триэтаноламин (ТЭА)·HCl рН 6.8; 0.005 М MgCl2; 0.025 М KCl; 0.003 М CaCl2; 0.005 М NaCl рН 6,8; встряхивали в течение 30 мин на микрошейкере (Micro-shaker type 326 m, Польша), с последующим центрифугированием при 4000 об/мин (К-23, ГДР) в течение 20 мин для снятия клеточной оболочки, после чего осадок дважды промывали в среде следующего состава: 0.005 М MgCl2; 0.025 М KCl; 0.003 М CaCl2; 0.005 М NaCl; 0,01 М трис-HCl рН 6.8 с последующим центрифугированием при вышеуказанных условиях.
Бактериоплазматические белки экстрагировали 0,14 М NaCl, 0.01 М трис-HCl рН 6.8 буфером. Фракцию, непрочносвязанную с клеточным остатком, выделяли путем экстракции осадка 0,35 М NaCl, 0.01 М трис-HCl рН 6.8 буфером. Далее осадок фракционировали суспендированием в трис-HCl буфере с 2 M NaCl, получая фракцию, прочносвязанную с клеточным остатком. В осадке оставалась фракция, содержащая клеточный остаток с клеточной оболочкой. Последующую экстракцию проводили 6 М гуанидин гидрохлоридом с 0,1% β-меркаптоэтанолом на трис-HCl буфере. В вышеуказанном буфере осадок растворялся полностью. Клеточные фракции хранили при -196°С в азоте.
Количество белка определяли по связыванию белка с кумасси ярко-синим G (Loba, Австрия) [1]. Метод использовался в случае микронаноколичественного определения белка.
Полученные фракции пропускали через колонку с амберлитом ИРЦ-50 (Serva). ИРЦ-50 - полиментакриловая синтетическая смола со свободными карбоксильными группами. Смола использовалась в виде порошка, получаемого при размалывании в шаровой мельнице. Размельченная смола просеивалась через сито 200 меш, после чего многократно промывалась водой для удаления мельчайших частиц, высушивалась и промывалась ацетоном. Для достижения большей хроматографической эффективности проводили циклизацию. К 100 г смолы добавляли 500 мл 4н. NaOH, перемешивали в течение 3 ч с последующим отмыванием на фильтре водой до нейтральной реакции и переводили в кислую форму, пропуская через нее 500 мл 4 М HCl, избыток НО удаляли промыванием водой. Этой смолой заполняли колонку размером 0,4×4,5 см. На колонку наносили белок в количестве 20-50 мкг, растворенный в 6% гуанидин гидрохлориде на 0,1 М калий-фосфатном буфере рН 6,8. Скорость элюции составляла 6 мл/ч. Препаративное отделение основных белков протеома клеток Е.coli проводили в прерывистом градиенте гуанидин гидрохлорида: 6%, 8,9%, 10,6%, 13% на 0,1 М калий-фосфатном буфере рН 6,8. Содержание белка в элюатах определяли методом Бредфорд в нашей модификации [1]. В работе использовался отечественный препарат гуанидин гидрохлорида (Диаэм), который предварительно был очищен. Неперекристаллизованный препарат имеет высокое поглощение в ультрафиолете. Перекристаллизация проводилась по методу, описанному Луком [5]. Концентрацию гуанидин гидрохлорида определяли рефрактометрически при комнатной температуре. Расчет концентрации велся исходя из рефрактометрического индекса [6], используя следующее соотношение:
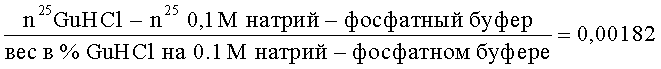
где n25Gu HCl - показатель преломления гуанидин гидрохлорида (величина, зависящая от концентрации препарата); n25 0,1 М натрий-фосфатный буфер_ - показатель преломления этого буфера (величина, постоянная для данной концентрации); показатель 25 указывает на температуру, при которой проводились рефрактометрические исследования.
Описанным методом удалось отделить положительно заряженные белки от отрицательно заряженных и нейтральных в полученных, как описано выше, супрамолекулярных структурах (Бп, HC-I НС-II, КО). В результате было получено 4 фракции: 1 - фракция незадержавшихся (отрицательно заряженных и нейтральных) белков, полученная элюцией 6% концентрации гуанидин гидрохлорида, и 3 фракции белков, полученных элюцией 8,9%, 10,6% и 13% концентрации гуанидин гидрохлорида (положительно заряженные белки). В полученных фракциях белков из супрамолекулярных структур растущей популяции Escherichia coli была определена ингибитор-трипсиновая активность. Ингибитор-трипсиновую активность определяли по скорости ингибирования расщепления трипсином низкомолекулярного белка протамина («Calbiochem», США) [1] (молекула которого состоит из 33 аминокислот: 22-х молекул Arg; 4-х молекул Ser; 3-х молекул Pro; по 2 молекулы Glu и Vat).
Активность выражали в нмоль аргинина·c-1·мг-1 белка.
Ход анализа: 0,02-0,025%» раствор протаминсульфата готовили на 0,1 М фосфатном буфере рН 7,0. К 0,5 мл клеточного экстракта (в 0,1 М фосфатном буфере рН 7,0) добавляли 0,2 мл протаминсульфата и 0,0002% раствор трипсина (СПОФА, ЧССР) в объеме 0.2 мл, приготовленный также на 0,1 М фосфатном буфере рН 7,0. В связи с тем, что партии трипсина отличались по ферментативной активности, для каждой партии концентрация искомой активности трипсина (показания оптической плотности реакционной смеси должны находиться в пределах 0,02-0,05 (ФЭК-56М)) подбиралась индивидуально. Пробы инкубировали при 37° в течение 20 мин. Реакцию прекращали добавлением 0,7 мл 20% ТХУ (трихлоруксусная кислота). В контрольные пробы протаминсульфат вносили после добавления ТХУ. Мерой активности фермента служило количество растворимых в ТХУ аргининсодержащих пептидов, образующихся из протаминсульфата при его расщеплении трипсином или трипсиноподобными белками. После добавления холодной 20% ТХУ опытные и контрольные пробы тщательно перемешивали и центрифугировали при 1500 g в течение 15 мин. Все операции проводили при 0-4°C. К 0,5 мл прозрачного центрифугата добавляли 1,25 мл 0,04% раствора 8-оксихинолина ("Реахим") (приготовленного в день опыта путем пятикратного разведения холодной дистиллированной водой 0,2% раствора 8-оксихинолина, растворенного в 96° этаноле), затем в пробу вносили 0,25 мл 10% NaOH, перемешивали и оставляли стоять в течение 2 мин, после этого добавляли 0,05 мл NaBrO (приготовленного путем растворения 1 г брома в 100 мл 5% NaOH) и через 15 с вносили 0,25 мл 40% мочевины, еще через 40 с - 2,75 мл холодной дистиллированной воды. После 5 мин стояния определяли оптическую плотность растворов при А490 (ФЭК-56 М, СССР).
С помощью калибровочной кривой, значения оптической плотности при А490 переводили в количество мкмолей аргинина в пробе. В качестве стандарта для калибровочного графика использовали D,L-аргинин ("Reanal", Венгрия).
Активность ингибиторов трипсина выражали в нмоль аргинина·с-1·мг-1 белка. Определение активности ингибиторов трипсина рассчитывали по формуле:

ΔСк - нг аргинина, образующегося при инкубации (в течение 20 мин при 37°C) протаминсульфата и трипсина; нг аргинина находили по калибровочной кривой;
ΔCо - нг аргинина, образующегося при инкубации (в течение 20 мин при 37°C) протаминсульфата, трипсина и клеточного экстракта; нг аргинина находили по калибровочной кривой;
V - объем (мл) реакционной смеси;
V1 - объем (мл) ТХУ фильтрата, взятого для анализа;
Т - время инкубации в с;
V2 - объем (мл) клеточного экстракта;
174,2 - молекулярная масса аргинина;
Б - количество белка (мг) в 1 мл клеточного экстракта.
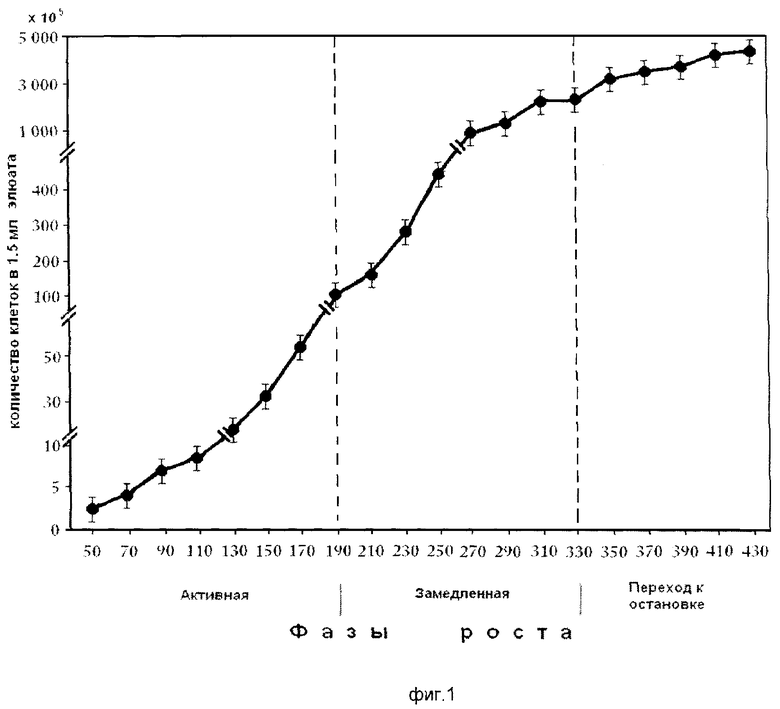
На фиг.1 представлена кривая роста штамма Е.coli JC-158. На оси ординат показана оптическая плотность периодической культуры. На оси абсцисс показан возраст периодической культуры в мин, измеряемой в течение 7 часов 10 минут в растущей культуре клеток на фоне фаз роста растущей популяции E.coli.
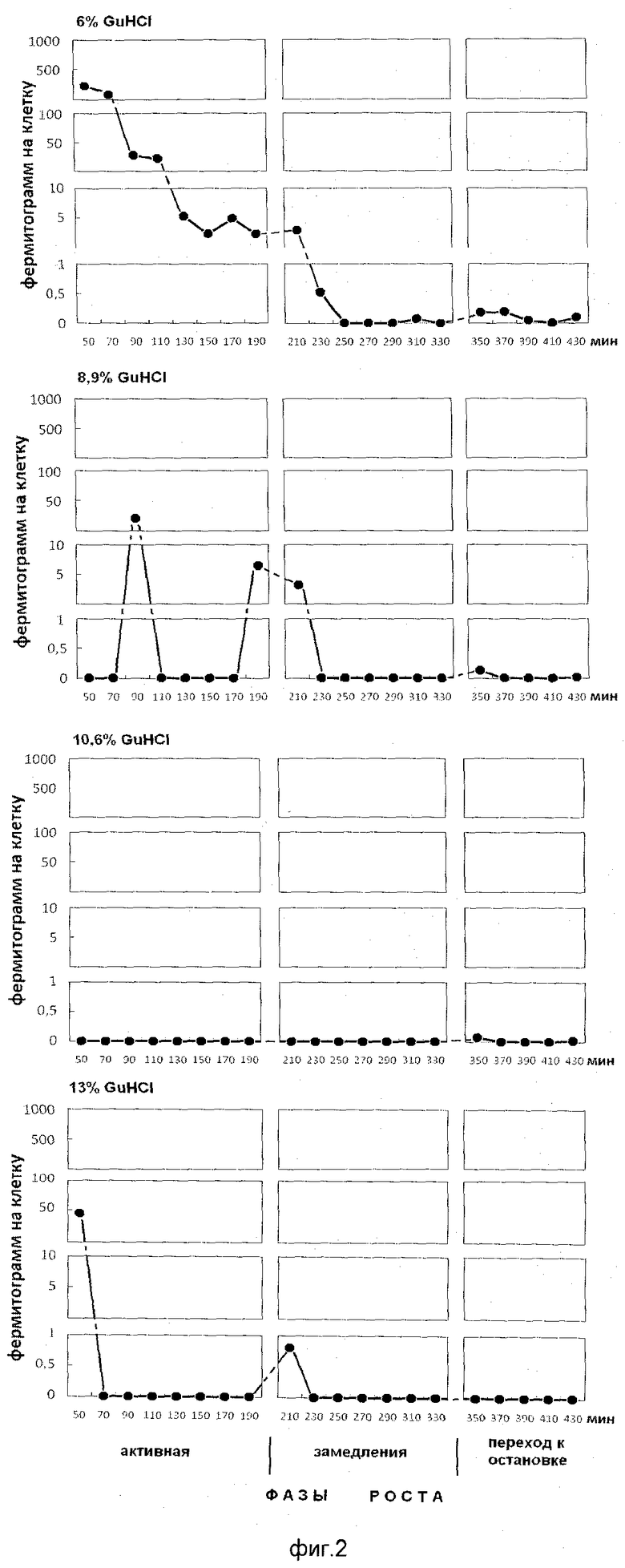
На фиг.2 показано содержание белка в ступенчато-градиентных фракциях гуанидин гидрохлорида (6%, 8,9%, 10,6%, 13% GuHCl), элюированных из бактериаплазмы растущей популяции E.coli. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин. На оси ординат - содержание белка на 1 клетку, фермитограмм.
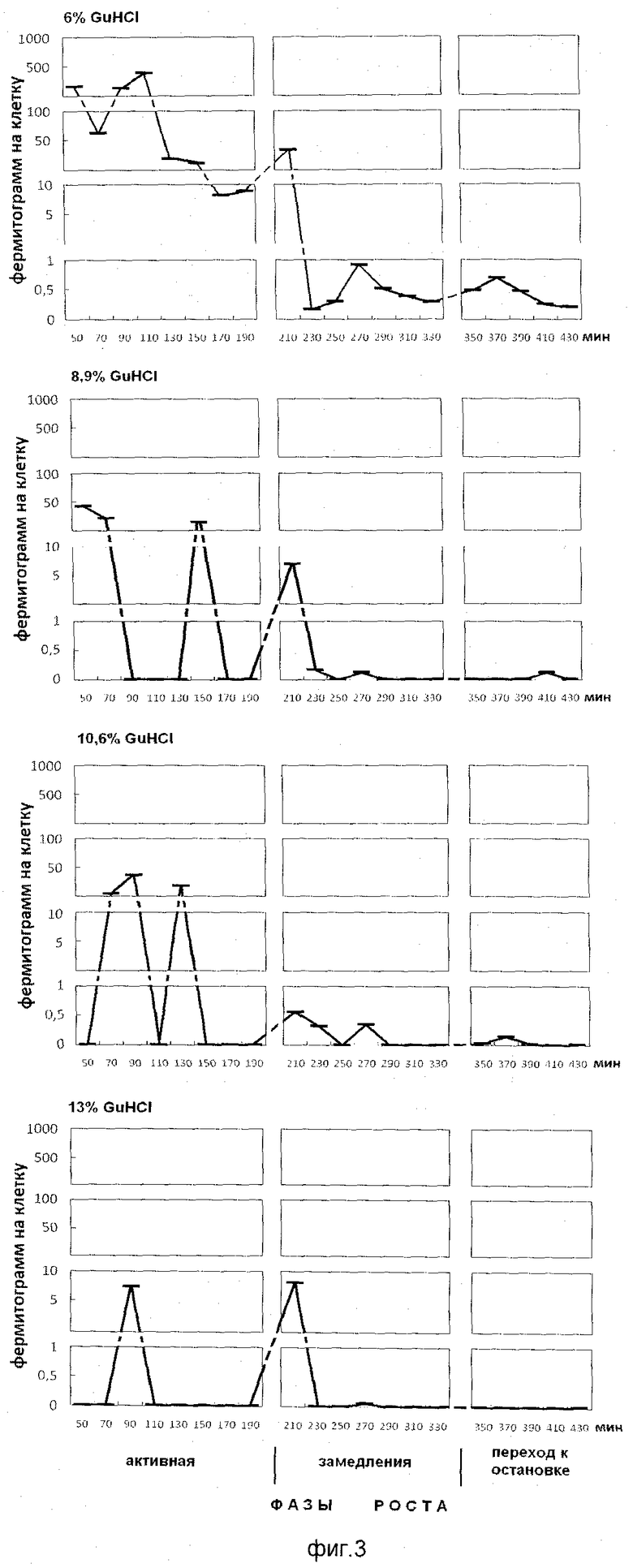
На фиг.3 показано содержание белка в ступенчато-градиентных фракциях гуанидин гидрохлорида (6%, 8,9%, 10,6%, 13% GuHCl), элюированных из супраструктур непрочносвязанных с клеточным остатком растущей популяции E.coli. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин. На оси ординат - содержание белка на 1 клетку, фермитограмм.
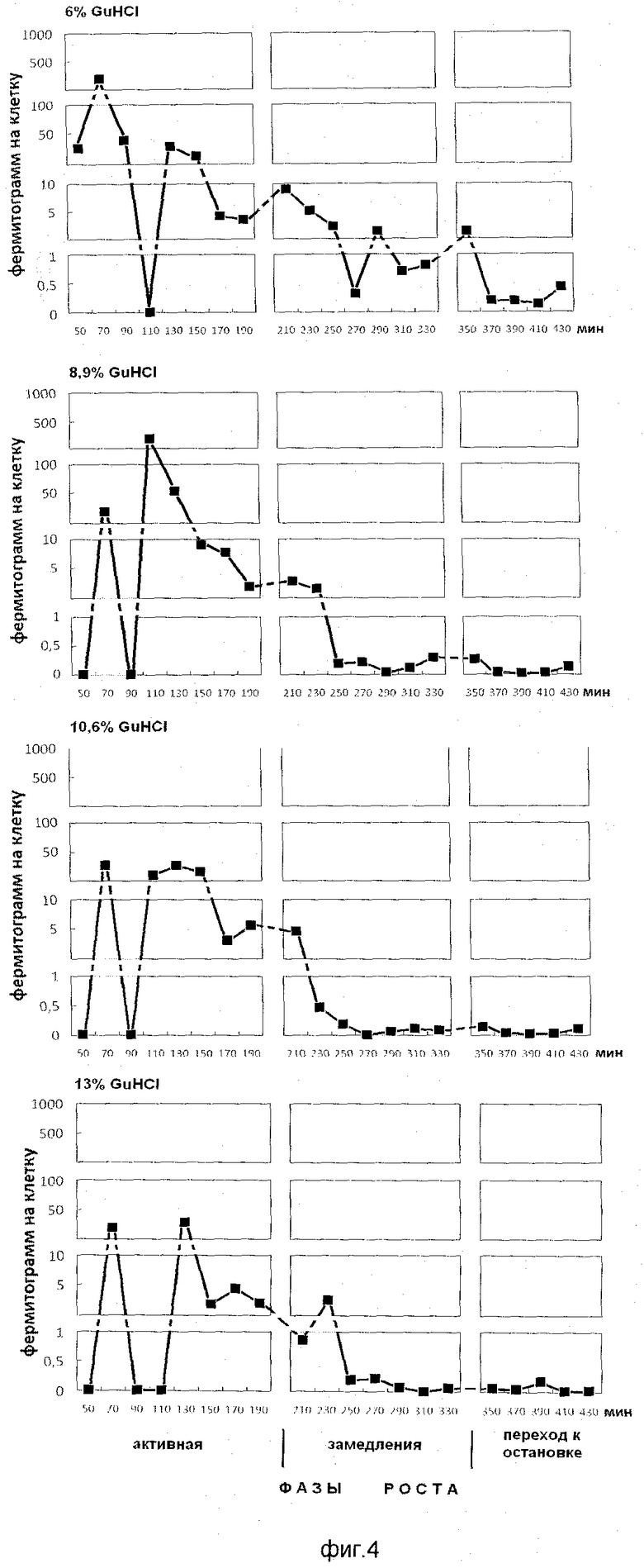
На фиг.4 показано содержание белка в ступенчато-градиентных фракциях гуанидин гидрохлорида (6%, 8,9%, 10,6%, 13% GuHCl), элюированных из супраструктур, прочносвязанных с клеточным остатком растущей популяции E.coli. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин. На оси ординат - содержание белка на 1 клетку, фермитограмм
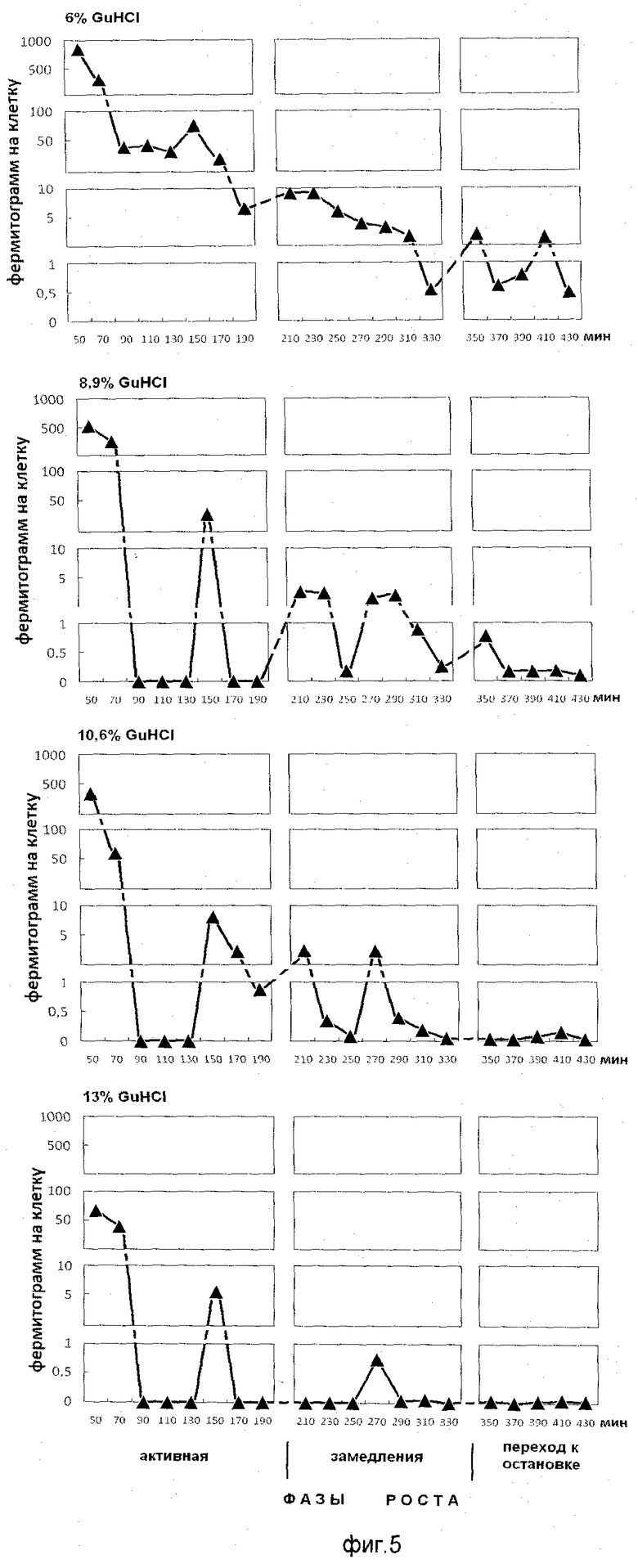
На фиг.5 показано содержание белка в ступенчато-градиентных фракциях гуанидин гидрохлорида (6%, 8,9%, 10,6%, 13% GuHCl), элюированных из клеточного остатка растущей популяции E.coli. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин. На оси ординат - содержание белка на 1 клетку, фермитограмм.
Анализ фигур 2-5 показывает, что фракции положительно заряженных белков выделяются при следующих концентрациях гуанидин гидрохлорида: 8,9%, 10,6%, 13%, на 0,1 М калий-фосфатном буфере рН 6,8; пик, полученный элюцией 6% гуанидингидрохлорида, - это незадержавшиеся (отрицательно заряженные и нейтральные) белки супрамолекулярных структур.
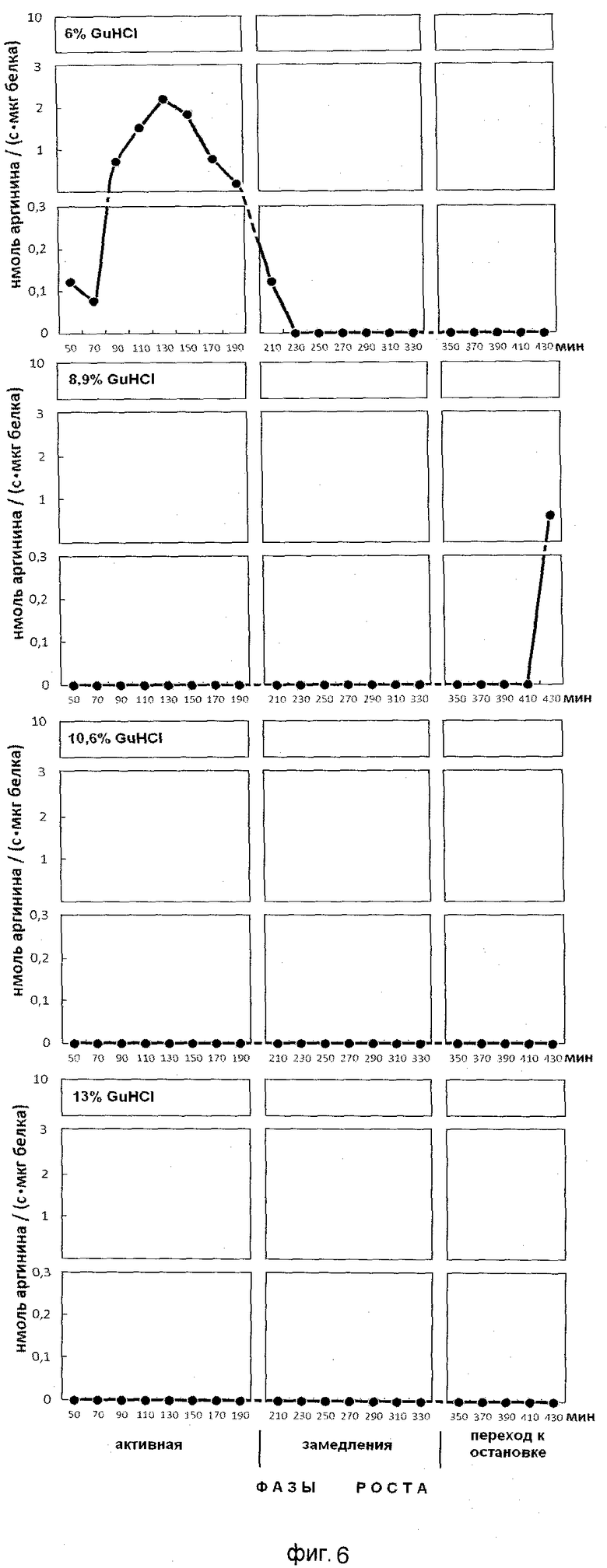
Эффективность последовательной ступенчатой экстракции положительно заряженных белков из бактериоплазмы, обладающих ингибитор-трипсиновой активностью, показана на фиг.6. На оси ординат показана активность, выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин.
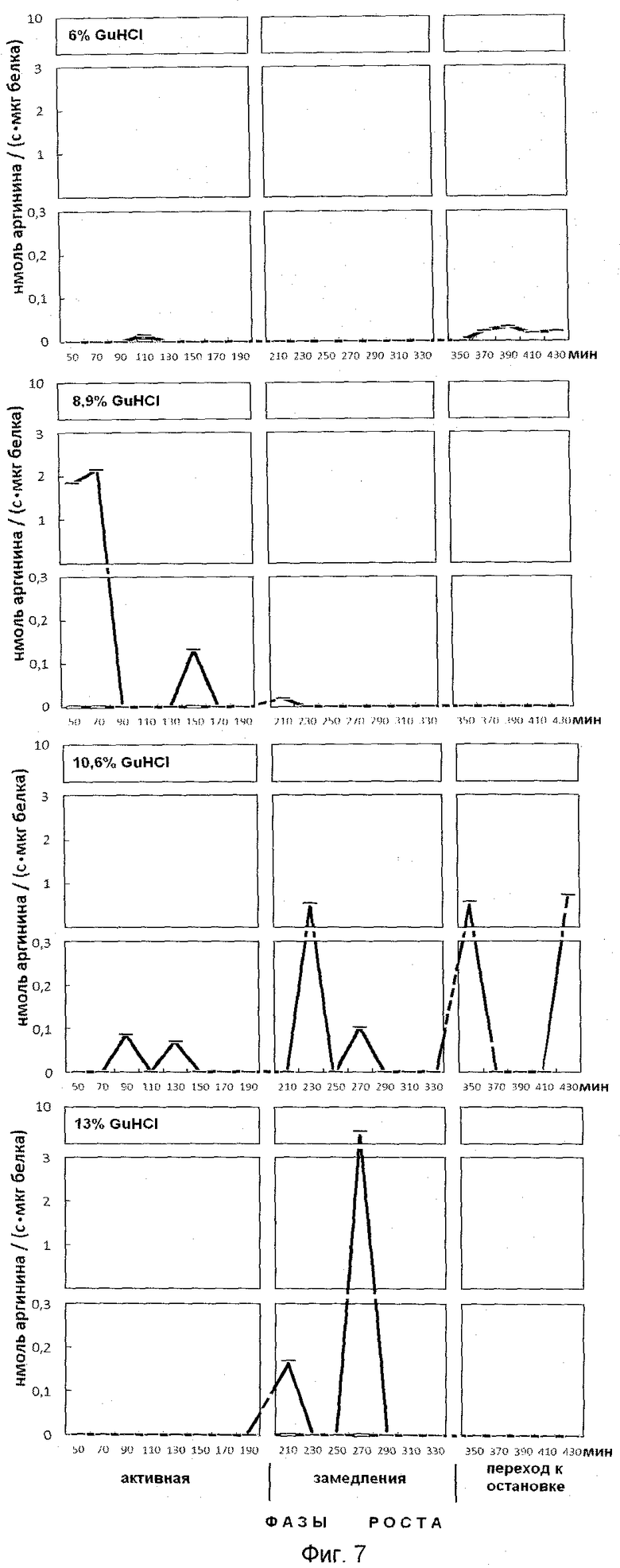
На фиг.7 представлена эффективность последовательной ступенчатой экстракции положительно заряженных белков из супраструктур, непрочносвязанных с клеточным остатком, обладающих ингибитор-трипсиновой активностью. На оси ординат показана активность, выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин.
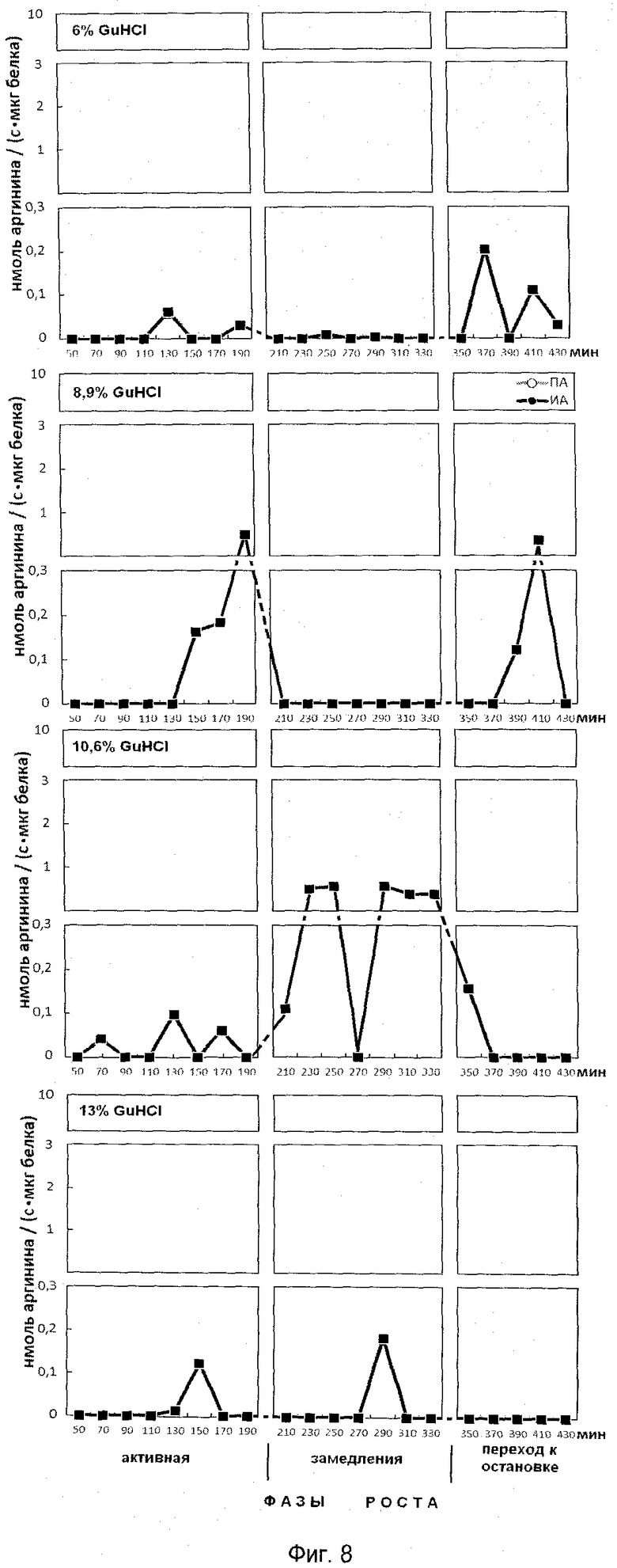
На фиг.8 представлена эффективность последовательной ступенчатой экстракции положительно заряженных из супраструктур, прочносвязанных с клеточным остатком, обладающих ингибитор-трипсиновой активностью. На оси ординат показана активность, выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин.
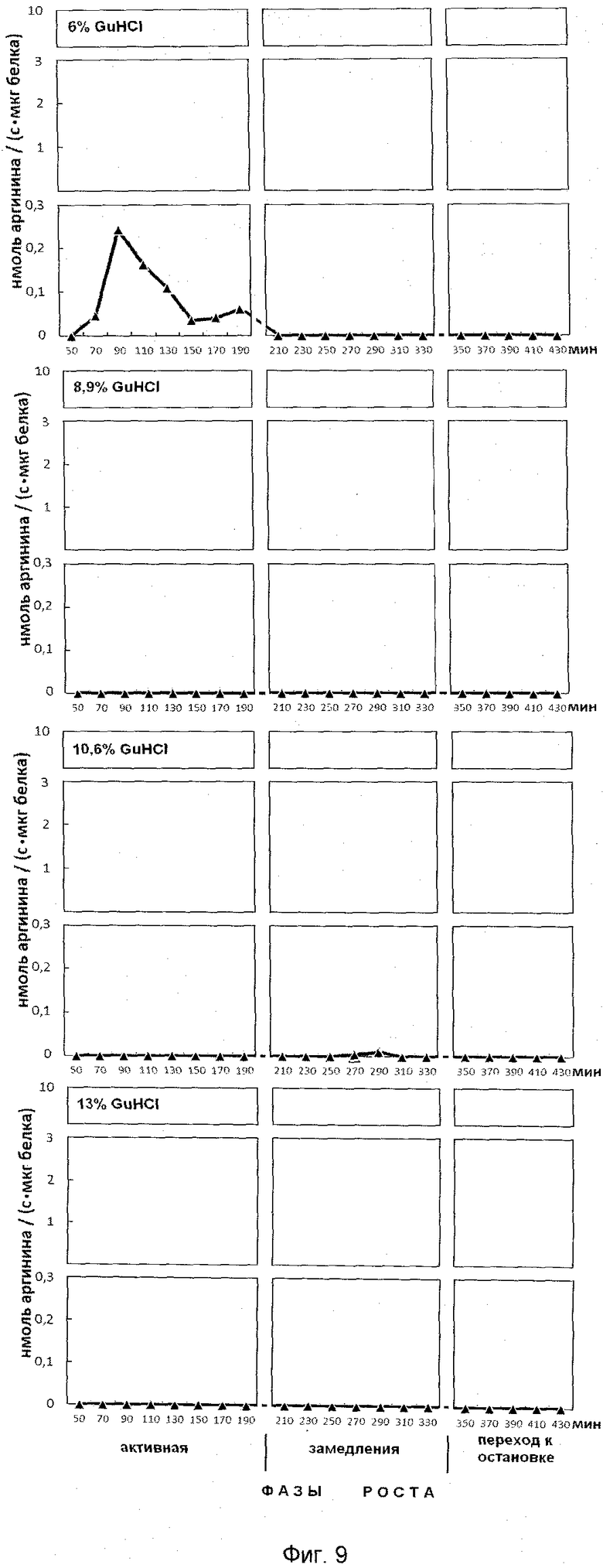
На фиг.9 представлена эффективность последовательной ступенчатой экстракции положительно заряженных белков из клеточного остатка, обладающих ингибитор-трипсиновой активностью. На оси ординат показана активность, выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время роста популяции E.coli с обозначением фаз роста, мин.
Анализ фигур 6-9 показывает, что в период роста периодической культуры активно происходят процессы ингибирования протеолиза как в положительно заряженных белках, так и белках, имеющих отрицательные и нейтральные заряды. Известно, что аргинин в составе белков активно участвует в процессах, структурирующих упаковку ДНК, особенно при модификации гуанидиновой группы. Сжатие или растяжение нуклеопротеидных супраструктур способно экранировать гидрофобные или гидрофильные поверхности белка для межмолекулярных взаимодействий и тем самым влиять на плотность упаковки ДНК и ее транскрипционную активность.
Метод [2] позволил получить фракции, обогащенные гистоном H1, гистонами Н2А и Н2В, гистонами Н3 и Н4. Мы полагаем, что заявленный подход позволит идентифицировать гистоноподобные белки в прокариотической клетки, определить их роль в метаболизме клетки, участие в укладке и структурировании нуклеоида в процессе роста бактериальной популяции и определение аминокислотного состава полученных белков. Знание биохимических процессов, происходящих на разных фазах роста популяции бактерий, позволяет раскрыть пути регулирования механизмов воздействия макро- и микроорганизмов, а также способствует поиску новых мишеней для лекарственных средств, что дает возможность управления бактериальными сообществами, населяющими человеческий организм.
Источники информации
1. Иванова Э.А., Вафина Г.Х. Способ получения ядерный фракций, обладающих протеиназной и ингибирующей активностью. Авторское свидетельство 1733471 // Б.И. 1992, Т.18, С.96.
2. Иванова Э.А., Вафина Г.Х. Способ препаративного выделения основных белков из супраструктур клеточных ядер растений. Патент № 2408602 // Опубликовано: 10.01.2011. Бюл. №1.
3. Иванова Э.А., Вафина Г.Х., Тропынина Т.С. Способ получения фракции из клеток E.coli, обладающей ингибирующей протеазы активностью. Патент № 2437934 // Опубликовано: 27.12.2011. Бюл. №36.
4. Myrphy D.B., Pembroke J.T. Transfer of the IncJ plasmid R391 to recombination deficient E.coli K12; evidence that R391 behaves as a cohjugal transposon // FEMS Microbiology Letters, 1995, V.134, P.153-158.
5. Luck J.M., Rasmussen P.S., Satake K., Tsvetikov A.N. Further studies on the fractionation of calf thymus histone // The J. of Biological Chemistry. 1958, V.233, N 6, P.1407-1414.
6. Bonner J., Chalkley G.R., Dahmus M., Fambrough D., Fujimura F., Huang R.C., Huberman J., Jensen R., Marushige K., Ohlenbusch H., Olivera B., Widholm J. Isolation and characterization of chromosomal nucleoproteins // Methods Enzymology. 1968, Acad. Press. New York. V. XII, part B, sec. V, ch. VII, P.25-31.
Изобретение относится к области биохимии и молекулярной биологии прокариотической клетки и касается способа получения положительно заряженных белковых фракций с ингибирующей в отношении трипсина активностью в растущей популяции Escherichia coli. Способ включает консервацию клеток в присутствии забуференного 80-90% глицерина с последующим снятием клеточных оболочек 3% тритоном Х-100, экстракцию возрастающими концентрациями солей: 0,14 М, 0,35 М; 2 М NaCl, 6 М гуанидин гидрохлоридом с 0,1% в-меркаптоэтанолом, выделение из вышеперечисленных фракций положительно заряженных белков с помощью ионообменной хроматографии с амберлитом ИРЦ-50 в прерывистом градиенте гуанидин гидрохлорида: 6%, 8,9%, 10,6%, 13% в 0,1 М калий-фосфатном буфере рН 6,8 и определение в них ингибирующей в отношении трипсина активности. Представленное изобретение может быть применено к анализу молекулярно-генетических механизмов формирования структуры клетки прокариот и роли белковых компонентов в их организации, а также особенностей ремоделирования генома. 9 ил., 1 пр.
Способ получения положительно заряженных белковых фракций с ингибирующей в отношении трипсина активностью в растущей популяции Escherichia coli, включающий консервацию клеток в присутствии забуференного 80-90%-ного глицерина с последующим снятием клеточных оболочек 3%-ным тритоном Х-100, экстракцию возрастающими концентрациями солей: 0,14 М, 0,35 М; 2 М NaCl, 6 М гуанидин гидрохлоридом с 0,1%-ным в-меркаптоэтанолом, выделение из вышеперечисленных фракций положительно заряженных белков с помощью ионообменной хроматографии с амберлитом ИРЦ-50 в прерывистом градиенте гуанидин гидрохлорида: 6%, 8,9%, 10,6%, 13% в 0,1 М калий-фосфатном буфере рН 6,8 и определение в них ингибирующей в отношении трипсина активности.
| СПОСОБ ПОЛУЧЕНИЯ ФРАКЦИИ ИЗ КЛЕТОК Escherichia coli, ОБЛАДАЮЩЕЙ ИНГИБИРУЮЩЕЙ ПРОТЕАЗЫ АКТИВНОСТЬЮ | 2010 |
|
RU2437934C1 |
| СПОСОБ ПРЕПАРАТИВНОГО ВЫДЕЛЕНИЯ ОСНОВНЫХ БЕЛКОВ ИЗ СУПРАСТРУКТУР КЛЕТОЧНЫХ ЯДЕР РАСТЕНИЙ | 2009 |
|
RU2408602C1 |
| J | |||
| MURRAY LUCK et al., Further Studies on the Fractionation of Calf Thymus Histone, J | |||
| of Biological Chemistry, 1958, V.233, No.6, p.p.1407-1414. | |||
Авторы
Даты
2013-07-20—Публикация
2012-01-31—Подача