Изобретение относится к биохимии и молекулярной биологии прокариотической клетки и может быть применено к анализу молекулярно-генетических механизмов формирования структуры клетки прокариот и роли углеводных компонентов в их организации, что является необходимым для раскрытия путей регулирования механизмов взаимодействия макро- и микроорганизмов, а также поиску новых мишеней для лекарственных средств и разработке экологически безопасных лечебных препаратов.
Известен способ определения гексоз [1], в котором в результате кислотного гидролиза и цветной реакции с антроном образуются окрашенные продукты. Недостаток этого метода заключается в довольно низкой чувствительности (100 мкг) при указанном соотношении кислота-тиомочевина-антрон.
Известен способ определения гексоз [2], основанный на способности в присутствии концентрированной серной кислоты давать с антроном окрашенные продукты. Недостаток этого метода заключается в том, что в качестве объектов, содержащих гексозы, используются химически синтезированные реагенты - гексозы с довольно высокой концентрацией 100-200 мкг/мл.
Известен способ определения общего количества углеводов в бактериальных клетках [3]. Недостатком этого метода является то, что бактериальные клетки не фракционировались на субмолекулярные структуры для выяснения преимущественной локализации улеводных компонентов внутри бактериальной клетки, а также и то, что этот метод с низким порогом чувствительности, так как позволяет определять углеводы в концентрации 10-100 мкг/мл.
Известен способ определения углеводов [4] в клеточных ядрах. Недостаток этого метода заключается в том, что получение супрамолекулярных структур осуществляется из клеточных ядер растений, а не из безъядерной прокариотической клетки, оболочка которой не может быть снята 0,5% тритоном Х-100.
Вышеуказанный способ определения углеводных компонентов был принят за основу, в котором углеводсодержащие компоненты извлекают из клеточных ядер, предварительно законсервированных в тканях проростков пшеницы глицериновой средой, затем выделенных и очищенных в градиенте плотности глицерина с последующей последовательной экстракцией ядерных фракций 0,14 М (нуклеоплазма), 0,35 М (хроматин I) и 2 М (хроматин II) хлористым натрием, 6 М гуанидин гидрохлоридом в присутствии 0,1% β-меркаптоэтанола (ядерный матрикс); 0,5 н. NaOH (ядерно-цитоплазматический остаток) и определением в них содержания углеводов.
Недостатком этого способа является то, что гомогенизация неприемлема для клеток прокариот, т.к. культура уже состоит из отдельных клеток, не объединенных в ткань, 0.5% тритон Х-100 не снимает клеточную оболочку прокариотической клетки, экстракция фракций 0,5 н. гидроксидом натрия невозможна, т.к. клеточный остаток целиком растворяется в 6 М гуанидин гидрохлориде с 0,1% β-меркаптоэтанолом.
Целью изобретения является расширение спектра сравнительных методов, позволяющих определить внутриклеточную локализацию гексозосодержащего компонента при чувствительности метода 0,4-1 мкг/мл.
Указанная цель достигается тем, что в способе определения гексоз в супрамолекулярных структурах клеток Escherichia coli первоначально у консервированных в присутствии забуференного 80-90% глицерина клеток снимают клеточную оболочку 3% тритоном Х-100 с последующей последовательной экстракцией клеточных супрамолекулярных структур возрастающими концентрациями солей: 0,14 М (бактериоплазма); 0,35 М (непрочно связанные с клеточным остатком); 2 М NaCl (прочно связанные с клеточным остатком), 6 М гуанидин гидрохлоридом с 0,1% β-меркаптоэтанолом (клеточный остаток) и определением в них содержания гексоз.
Изобретение иллюстрируется следующим примером.
Пример. Опыты проводили на протяжении роста популяции клеток штамма E. coli HB101 (F- ara14 galK2 hsdS20(rB- mB-) lacY1 leuB6 mtl-1 proA2 recA13 rpsL20(StrR) supE44,9,14 thi-1 xyl-5 Δ(mcrC-mrr), полученного из Всесоюзной коллекции микроорганизмов (Пущино) и предоставленного Маркушевой Т.В. (Институт биологии УНЦ РАН, группа генетики микроорганизмов), штамма Е. coli JC-158 (Hfr PO1, thi1, serA6, lacI22, relA1), предоставленного Ступак И.В. и Ступак Е.Э. (Институт биологии УНЦ РАН, лаборатория математической и молекулярной генетики). Культивирование штамма Е. coli HB101 проводилось в жидких питательных средах LB и М9. Бактериальные клетки, использованные в эксперименте, первоначально находились в столбиках с агаризованной средой LB (Луриа-Бертани): в 1 литре дистиллированной воды растворялись при помешивании (на магнитной мешалке типа MM 2A) бакто-триптон (Difco, США) - 10 г, дрожжевой экстракт (Difco, США) - 5 г, хлорид натрия (хч, "Реахим") - 10 г. Доведение рН до 7,5 проводилось с помощью 1 М гидрооксида натрия (хч, «Реахим»). Среда стерилизовалась при 120-123°C при давлении пара 1 атм в стандартном автоклаве. На 1 литр среды добавляли 1,5 г агар-агара (Difco, США). Культура хранилась при температуре 4°C. Из агаризованного столбика в стерильных условиях клетки переносили с помощью бактериологической петли в жидкую среду LB в объеме 5 мл, находящуюся в химической пробирке объемом 20 мл, закрывали ватно-марлевой пробкой и инкубировали при 37°C, 120 об/мин на термостатируемой установке (УВМТ-12-250) в течение 16 часов. Из жидкой 16 часовой культуры штамм HB101 рассевался «штрихом» до отдельных колоний на агаризованную среду LB с добавлением антибиотика стрептомицина (Str) в концентрации 25 мкг/мл в чашки Петри и инкубировался при 37°C 16 часов.
Выросшая хорошо сформировавшаяся отдельная колония бактерий с помощью бактериологической петли пересевалась в жидкую среду LB с добавлением антибиотика Str в концентрации 25 мкг/мл в объеме 5 мл и инкубировалось при 37°C, 120 об/мин 16 часов. 100 мкл культуры вносилось в жидкую минимальную среду М9 в объеме 5 мл и инкубировалось при 25°C, 120 об/мин 16 часов. Состав среды М9: Na2HPO4 (хч, «Реахим») - 6 г, KH2PO4 (хч, «Реахим») - 3 г, NaCl (хч, «Реахим») - 0,5 г, NH4Cl (хч, «Реахим») - 1 г на 1 л дистиллированной воды. Среда стерилизовалась при 120-123°C, при давлении пара 1 атм в стандартном автоклаве. После охлаждения в 1 л среды добавляли растворы, стерилизованные отдельно: 0,01 М CaCl2 - 10 мл, 1М MgSO4·7H2O - 1 мл, 20% раствор глюкозы ("Biorad"), витамины до конечной концентрации 1 мкг/мл, аминокислоты - до конечной концентрации 40 мкг/мл и антибиотик Str в концентрации 25 мкг/мл.
В свежую жидкую среду М9 в объеме 50 мл в 300 мл колбе высевалось 600 мкл 16 часовой культуры и проводилось инкубирование при 25°C, 120 об/мин в течение 6 суток.
Первая проба была взята через сутки в объеме 1,5 мл. Последующие пробы отбирались на вторые, четвертые и шестые сутки. Контроль роста культур проводился с использованием фотоколориметра КФК-2 по изменению оптической плотности клеточной суспензии OD590 при длине волны 590 нм и чувствительности, равной 2. Надосадочная жидкость удалялась, осадок подсушивался. К осадкам добавлялось по 50 мкл среды следующего состава: 80-90% глицерин на 0,01 М трис-HCl буфере рН 6.8 с добавлением 0.005 М MgCl2; 0.025 М KCl; 0.003 М CaCl2; 0.005 М NaCl для консервации клеток при минус 25°C.
Далее осадки клеток промывали 3% тритоном Х-100 в среде следующего состава: 0.02М триэтаноламин (ТЭА)·HCl pH 6.8; 0.005 М MgCl2; 0.025 М KCl; 0.003 М CaCl2; 0.005 М NaCl pH 6,8; встряхивали в течение 30 мин на микрошейкере (Micro-shaker type 326 m, Польша) с последующим центрифугированием при 4000 об/мин (К-23, ГДР) в течение 20 мин для снятия клеточной оболочки, после чего осадок дважды промывали в среде следующего состава: 0.005 М MgCl2; 0.025 М KCl; 0.003 М CaCl2; 0.005 М NaCl; 0,01 М трис-HCl pH 6.8 с последующим центрифугированием при вышеуказанных условиях. Более низкие концентрации тритона Х-100 не снимали оболочки клеток E. coli.
Цитоплазматические белки экстрагировали 0,14 М NaCl, 0.01 М трис-HCl pH 6.8 буфером. Фракцию, непрочно связанную с клеточным остатком, выделяли путем экстракции осадка 0,35 М NaCl, 0.01 М трис-HCl pH 6.8 буфером. Далее осадок фракционировали суспендированием в трис-HCl буфере с 2 М NaCl. В осадке оставалась фракция, содержащая клеточный остаток с клеточной оболочкой. Последующую экстракцию проводили 6 М гуанидин гидрохлоридом с 0,1% β-меркаптоэтанолом на трис-HCl буфере. В вышеуказанном буфере осадок растворялся полностью. Клеточные фракции хранили при -196° в азоте.
В вышеуказанных фракциях проводили кислотный гидролиз и цветную реакцию с антроном. Метод [1] является одним из распространенных. Сущность метода заключается в том, что при кипячении в присутствии концентрированной серной кислоты от пептидов отщепляются гликозильные группировки, легко распадающиеся на моносахара. При действии на моносахара соединений, содержащих H-группы, в кислой среде образуются тиоацетали, которые при взаимодействии с антроном дают продукты, окрашенные в синий цвет, имеющие оптимальное поглощение (особенно для гексоз) при А620. Прямое применение исходной методики [1] в наших условиях не дало результатов. Поэтому были поставлены эксперименты, выявляющие оптимальные условия проведения реакции. По литературным данным чистый антрон имеет температуру плавления 163°C (бесцветные иглы), 154°C [5,6].
Продажный препарат антрона ("Реахим", 1987), по-видимому, вследствие большого количества примесей вместо белых игл имел кристаллы желтого цвета с температурой плавления 105-110°C. Тонкослойная хроматография на силуфоле (Silufol UW 254, "Reanal") дала две полосы. Очистка продажного препарата антрона достигалась несколькими способами (табл.1). Нам удалось очистить продажный препарат только до tпл 145°C. Кристаллы оказались стойкими при хранении.
Последующую постановку реакции проводили с очищенным антроном tпл 145°C и перекристаллизованной тиомочевиной tпл 180°C. Концентрацию серной кислоты и тиомочевины подбирали эмпирически (табл.2), руководствуясь тем, что антроновая реакция является избирательной для гексоз с максимумом поглощения при А620, и тем, что ароматические аминокислоты, белки, пентозы (рибоза, ксилоза), гексозамины, уроновые кислоты не проявляют максимума поглощения при А620 [2].
На основании данных, приведенных в таблице 2, для постановки метода были выбраны концентрации тиомочевины - 2 г (%) и серной кислоты - 74,2%. Серная кислота должна быть достаточно концентрированной, так как в случае дальнейшего разбавления выпадают кристаллы тиомочевины. Для работы подходит продажная серная кислота 92% с плотностью 1,83.
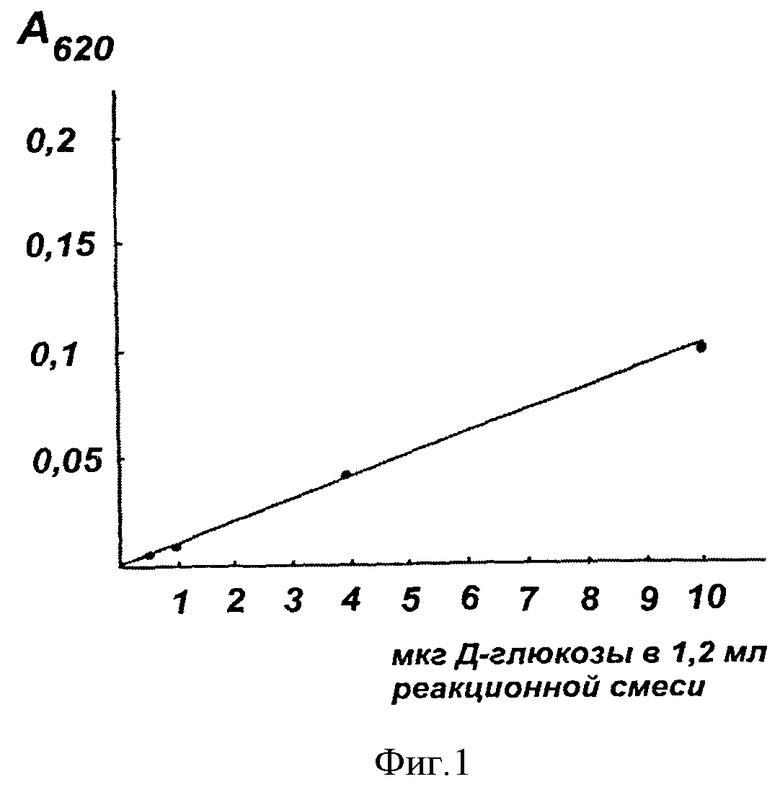
Для определения микронаноколичеств гексоз (0,4-1 мкг/мл) антроновым методом, построена стандартная калибровочная кривая по Д-глюкозе ("Serva", 1988) (фиг.1).
Приготовление антронового реактива: 72 мл серной кислоты (по объему) осторожно добавляется к 25 мл дистиллированной воды. Смесь охлаждают до 35°C и добавляют 50 мг антрона, перемешивают до растворения, затем добавляют 2 г тиомочевины, перемешивают до растворения. Реактив готовится перед опытом.
Ход реакции
К 0,2 мл исследуемого раствора прибавляют 1 мл антронового реактива, быстро перемешивают и охлаждают на ледяной бане до 0°C. Затем ставят в кипящую водяную баню на 15 мин. Быстро охлаждают до комнатной температуры t-20°C. Развивающуюся синюю окраску колориметрируют на СФ-26 (ЛОМО, СССР) против дистиллированной воды при А620.
Контроль 1: 0,2 мл 0,05 М трис-HCl pH 8,0+1 мл антронового реактива
Контроль 2: 0,2 мл пробы+1 мл (74,2% H2SO4+2% тиомочевина; без антрона).
Содержание гексоз в анализируемых пробах оценивали из расчета на 1 клетку по формуле:
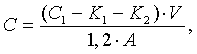
где
C - количество гексоз (мкг) в супрамолекулярных структурах на 1 клетку;
1,2 - объем реакционной смеси (мл), содержащей 0,2 мл пробы, взятой для анализа;
C1 - количество гексоз (мкг), найденных по стандартной кривой (фиг.1) в общем объеме реакционной смеси;
V - общий объем анализируемого экстракта (мл);
A - количество клеток, взятых в анализ.
K1-контроль 1; K2-контроль 2 - показания оптической плотности переводили на показания, найденные по стандартной кривой (фиг.1).
Метод устойчив, не дает резких колебаний. Интенсивность окраски проб сохраняется в течение 1,5 ч, затем понижается.
Табл. 1 иллюстрирует способы очистки продажного препарата антрона (Реахим).
На табл.2 показана эффективность концентраций серной кислоты и тиомочевины на антроновую реакцию.
На фиг.1 показана стандартная калибровочная кривая по Д-глюкозе. Чувствительность метода составляет 0,4-1 мкг/мл.
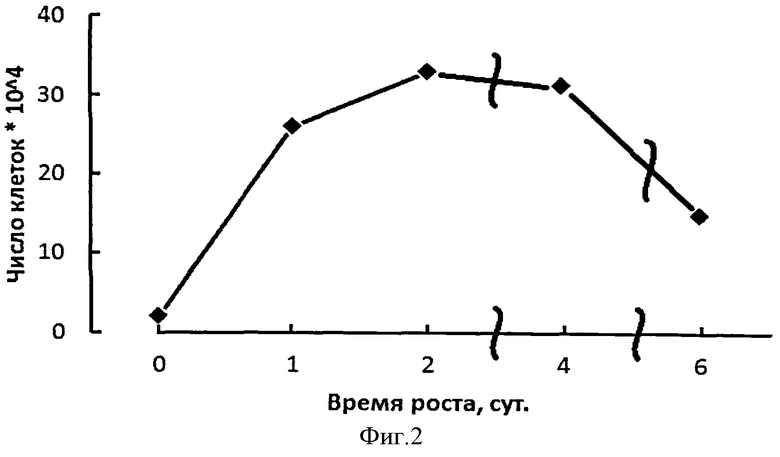
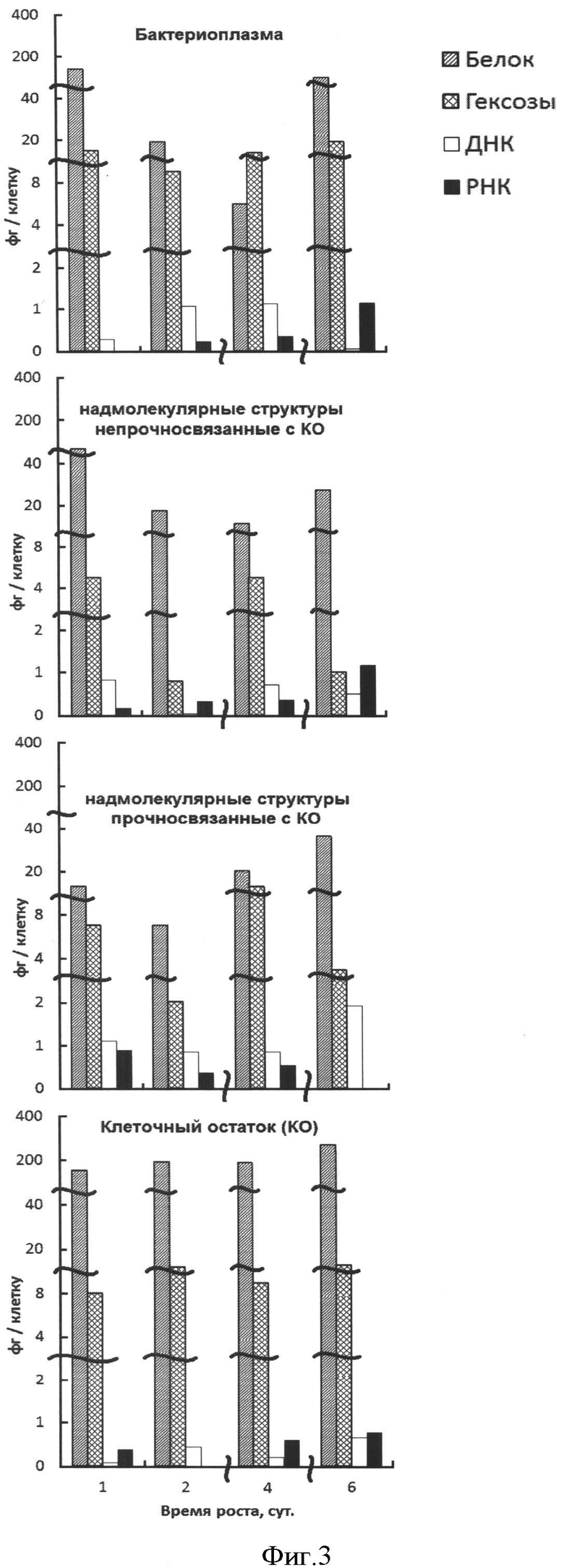
На фиг.2 представлена кривая роста штамма E. coli HB101. На оси ординат показана оптическая плотность периодической культуры. На оси абсцисс показан возраст периодической культуры в сутках.
На фиг.3 представлена динамика содержания белкового, углеводного компонентов, ДНК и РНК на протяжении роста популяции клеток Е. coli HB101. Количество белка определяли по связыванию белка с кумасси ярко-синим G (Loba, Австрия) [7, 8]. Для определения ДНК и РНК использовали метод А.С. Спирина [9]. Так как этот методический подход был нами разработан для клеточных ядер растений и методы, его составляющие, отстандартизованы для определения наномикроколичеств, то мы сочли уместным привести данные по белку, ДНК и РНК на протяжении роста популяции E. coli HB101, чтобы дать полную характеристику полученных супраструктур. Для более точной трактовки графика нами представлена табл.3 с количественными показателями биоорганического состава бактериальной клетки E. coli в периодической культуре.
Исследование супрамолекулярных структур на содержание углеводного компонента включает предварительную консервацию клеток в глицериновой среде, снятие клеточной оболочки и выделение из них клеточных фракций возрастающими концентрациями солей. Фиг.2 иллюстрирует динамику роста периодической культуры, анализ фиг.3 (табл.3) показывает соотношения белок/гексозы в течение фазы активного роста, фазы замедления и стационарной фазы роста популяции бактериальных клеток в периодической культуре. Показано изменение соотношения белок/гексозы на уровне всех супраструктур клеток популяции E. coli. Интерес представляет динамика изменения соотношения белок/гексозы на уровне генетических и транскрипционных супраструктур клеток E. coli.
Предложенный способ рекомендуется в исследовании молекулярно-генетических механизмов формирования прокариотической структуры клетки и роли углеводных компонентов в их организации. Полученные данные могут быть полезны в моделировании структуры (3D-фолдинг) и динамики биомакромолекул. Знание биохимических процессов, происходящих на разных фазах роста популяции бактерий, позволяет раскрыть пути регулирования механизмов взаимодействия макро- и микроорганизмов, что дает возможность управления бактериальными сообществами, населяющими человеческий организм.
Изобретение относится к биохимии и молекулярной биологии. Проводят консервацию клеток Escherichia coli в присутствии забуференного 80-90% глицерина. Снимают клеточные оболочки 3% тритоном Х-100. Последовательно экстрагируют клеточные супрамолекулярные структуры возрастающими концентрациями солей: 0,14 М (бактериоплазма), 0,35 М (непрочно связанные с клеточным остатком), 2 М NaCl (прочно связанные с клеточным остатком), 6 М гуанидин гидрохлоридом с 0,1% β-меркаптоэтанолом (клеточный остаток). Проводят кислотный гидролиз в вышеперечисленных фракциях. Проводят антроновый метод, предварительно очистив препарат антрон. Строят калибровочный график и определяют количество гексоз с помощью расчетной формулы. Изобретение позволяет определить количество гексоз в супрамолекулярных структурах бактериальной клетки Escherichia coli. 3 ил., 3 табл., 1 пр.
Способ определения гексоз в супрамолекулярных структурах клеток Escherichia coli, включающий консервацию клеток в присутствии забуференного 80-90% глицерина, снятие клеточных оболочек 3% тритоном Х-100 с последующей последовательной экстракцией клеточных супрамолекулярных структур возрастающими концентрациями солей: 0,14 М (бактериоплазма); 0,35 М (непрочно связанные с клеточным остатком); 2 М NaCl (прочно связанные с клеточным остатком), 6 М гуанидин гидрохлоридом с 0,1% β-меркаптоэтанолом (клеточный остаток), проведением в вышеперечисленных фракциях кислотного гидролиза и определением в них количества гексоз с помощью антронового метода с предварительной очисткой препарата антрона, построением калибровочного графика и применением расчетной формулы

где
С - количество гексоз (мкг) в супрамолекулярных структурах на 1 клетку;
1,2 - объем реакционной смеси (мл), содержащей 0,2 мл пробы, взятой для анализа;
С1 - количество гексоз (мкг), найденное по стандартной кривой (фиг.1) в общем объеме реакционной смеси;
V - общий объем анализируемого экстракта (мл);
А - количество клеток, взятых в анализ.
| СПОСОБ ПОЛУЧЕНИЯ ФРАКЦИИ ИЗ КЛЕТОК E.COLI, ОБЛАДАЮЩЕЙ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2410428C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УГЛЕВОДНЫХ КОМПОНЕНТОВ В КЛЕТОЧНЫХ ЯДРАХ | 1992 |
|
RU2108571C1 |
| Электрическое устройство для контроля караульной службы сторожей | 1926 |
|
SU4934A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| GSCHAEDLER A | |||
| et al | |||
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
| J | |||
| Ind | |||
| Microbiol., Jul | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
Авторы
Даты
2014-04-10—Публикация
2012-05-12—Подача