Область техники
Настоящее изобретение относится к дрожжевому экстракту, содержащему γ-Glu-X-Gly или γ-Glu-X, и к способу его получения. Дрожжевой экстракт согласно настоящему изобретению применим в области производства пищевых продуктов, таких как приправы и продукты для здоровья.
Предшествующий уровень техники
Дрожжевой экстракт придает пищевым продуктам «atsumi» (густоту), вкус «umami» и широко используется в качестве приправы в области пищевых продуктов. Известно, что особенно глутатион (далее также упоминается как «GSH»), представляющий собой трипептид, состоящий из глутаминовой кислоты, цистеина и глицина, придает пищевым продуктам вкус «kokumi» (Ueda et al., Agric. Biol. Chem., 54, 163-169 (1990), Ueda et al., Biosci. Biotechnolo. Biochem., 61, 1977-1980 (1997)), и разрабатываются различные приправы, содержащие GSH.
Между тем, хоть и сообщалось, что кальцийчувствительный рецептор (CaSR), являющийся G-белком класса С, реагирует на GSH (Wang et al., Journal of Biological Chemistry, 281, 8864-8870 (2006)), его физиологическая роль не ясна. Кроме того, этот CaSR присутствует также и в клетках языка, и считают, что это свидетельствует о его роли в ощущении вкуса (Gabriel et al., Biochemical and Biophysical Research Communications, 378, 414-418 (2009)). Далее, недавно было показано, что CaSR участвует в различении людьми вкуса «kokumi» (Ohsu et al., Journal of Biological Chemistry, 285, 1016-1022 (2010)). В этой работе показано, что не только GSH, который уже известен как вещество со вкусом «kokumi», но, видимо, и несколько соединений γ-глутамила реагируют с CaSR. Кроме того, показано, что эти пептиды, имеющие общую формулу γ-Glu-X или γ-Glu-X-Gly (X представляет собой аминокислоту или производное аминокислоты, отличные от Cys и его производных), например, γ-Glu-Met, γ-Glu-Thr, γ-Glu-Val-Gly, и т.д. придают вкус «kokumi» (WO2007/055393). Кроме того, показано, что группа эфиров S- или O-карбоксиалкилированных пептидов γ-глутамила или β-аспарагила также являются соединениями со вкусом «kokumi» (WO2007/042288). Хотя эти пептиды придают пищевым продуктам вкус «kokumi» подобно GSH, в отличие от GSH, в их составе нет восстановленной SH-группы. Известно, что вещество, имеющее в своем составе восстановленную SH-группу, как, например, GSH, как правило, нестабильно и его титр снижается по мере образования дисульфидных связей (WO2007/042288). Однако γ-Glu-X, γ-Glu-X-Gly и т.д., которые считаются полезными как пептиды, придающие вкус «kokumi», не имеющие в своем составе восстановленной SH-группы, стабильны.
Что касается пищевых продуктов, содержащих γ-Glu дипептид, имеется сообщение о том, что различные γ-Glu дипептиды обнаружены в сыре Гауда, созревавшем в течение длительного периода, такого как 44 недели (Toelstede, S and Hofmann, Т, J. Agric. Food. Chem., 2009). В этой работе сообщается о том, что определены различные γ-Glu дипептиды, такие как γ-Glu-Ala, γ-Glu-Glu и γ-Glu-Gln, и определено содержание γ-Glu дипептидов - максимум 3590 мкмоль/кг. Это значение соответствует 0.088% сухого вещества.
Однако какой-либо дрожжевой экстракт, содержащий γ-Glu-X или γ-Glu-X-Gly в количестве, достаточном для придания вкуса «kokumi» не известен.
Кроме того, известно, что синтез и разложение глутатиона, одного из γ-глутамил-соединений, катализируется множеством ферментов, названных ферментами цикла γ-глутамила. В частности, известно, что γ-глутамилтранспептидаза переносит глутамат в γ-положении GSH к другому соединению, имеющему аминогруппу, с разложением GSH до цистеинилглицина (Protein Nucleic acid Enzyme, 1988-7, VOL. 33, NO. 9, ISSN 003909450, Special Issue «Epoch of glutathione research», pp.1432-1433). Считается, что если соединение, имеющее аминогруппу, в этой реакции перегруппировки - аминокислота, в качестве побочного продукта может образовываться дипептид γ-Glu-X. Однако поиски микроорганизмов, эффективно продуцирующих γ-Glu-X, не имели успеха, частично по причине того, что γ-Glu-X является побочным продуктом.
Сведения, касающиеся дипептида γ-Glu-X, включают анализ культуральной жидкости Micrococcus glutamicus (Ronald et al., Journal of Biological Chemistry, 240, p.2508-2511 (1965)). В этой работе приводятся сведения о том, что культуральную жидкость наносили на различные колонки для отделения пептидов и т.д., чтобы выделить γ-Glu-Glu, γ-Glu-Val и γ-Glu-Leu. Однако они были обнаружены в результате разделения на разных колонках, и неизвестно, в каком количестве они содержались в среде.
Кроме того, фермент, ответственный за биосинтез GSH, выделили из Streptococcus agalactiae и Clostridium acetobutylicum и проанализировали его субстратную специфичность (Kino et al., JBB research communications, 352, pp.351-359 (2007)). В биосинтезе GSH обычно принимают участие два вида ферментов, γ-глутамилцистеинсинтетаза, соединяющая Glu и Cys с образованием γ-Glu-Cys, и глутатионсинтетаза, соединяющая образовавшийся γ-Glu-Cys и Gly с образованием GSH. Однако в вышеупомянутых двух видах микроорганизмов имеется уникальный фермент, соответствующий гибриду γ-глутамилцистеинсинтетазы и глутатионсинтетазы. Имеются данные о том, что согласно результатам анализа in vitro, узнавание субстрата этим ферментом слабо выражено, например, он также узнает другие аминокислоты (не только Cys) и в результате может образовывать γ-Glu-X и γ-Glu-X-Gly. Однако это результаты теста in vitro, и не описаны примеры продукции этими микроорганизмами определяемых количеств пептидов, таких как γ-Glu-X и γ-Glu-X-Gly, внутри клеток, содержащих много соединений с аминогруппой помимо целевой X.
Дрожжевые экстракты являются приправами, широко использующимися в области пищевых продуктов, высоко ценящимися потребителями. Следовательно, в качестве носителя γ-Glu-X-Gly или γ-Glu-X, форма дрожжевого экстракта более предпочтительна. Примеры исследований по использованию таких экстрактов включают работы с минералосодержащими дрожжами. Известно, что если в среду добавить металл, дрожжи транспортируют его в клетку (В. Volesky, H.A., Appl. Microbiol. BiotechnoL, 42;797-806 (1995)). В частности, если следовые количества таких элементов как цинк, железо, медь, марганец, селен, молибден и хром, добавляются в среду, дрожжи могут использоваться в качестве источника элемента, обогащение которым пищевых продуктов желательно (Japanese Patent Laid-open (Kokai) No.2004-298014). С учетом этого факта развиваются способы получения минералосодержащих дрожжей (Japanese Patent Laid-open No.54-157890, Japanese Patent Laid-open No.60-75279, Japanese Patent Publication (Kokoku) No.6-16702).
Кроме того, обогащая дрожжи этими элементами, можно получать и преимущества, касающиеся вкусовых качеств. Например, в выложенной патентной заявке Японии No.8-332081 описаны дрожжи с высоким содержанием марганца. В ней описано, что хотя на рынке имеются пищевые продукты, обогащенные марганцем за счет добавления соли марганца, поскольку это неорганическая соль, следствием ее добавления является сильная горечь и вяжущие свойства, и регулярно потреблять их намного труднее, чем природные марганецсодержащие пищевые продукты, и раскрывается технология получения природного материала путем обогащения дрожжей марганцем. Что касается питательной ценности, технология раскрыта в выложенной патентной заявке Японии No.2008-99578. Согласно приведенным в заявке данным, хотя цинк вносит вклад в улучшение вкусовых ощущений, улучшение генеративной функции, и т.д., по-видимому, нельзя считать, что он сейчас потребляется в достаточном количестве. Если цинк добавляют в процессе культивирования дрожжей, дрожжи транспортируют цинк в клетки, но водорастворимый цинк не аккумулируется в дрожжах в чистом виде, а связывается с белком или аминокислотой и накапливается в высоких концентрациях в виде аморфного цинка. Видимо, такой аморфный цинк более эффективно абсорбируется в организме по сравнению с кристаллическим цинком. Как результат, включением цинка в дрожжи может быть получена улучшенная абсорбция по сравнению с потреблением цинка в чистом виде.
Как описано выше, различные преимущества могут быть получены за счет поглощения дрожжами целевого вещества и добавления дрожжей (в форме дрожжей или дрожжевого экстракта) в пищевые продукты. Однако в отличие от минералов, являющихся значимыми компонентами питания, способность дрожжей поглощать аминокислоту или пептид находится под сложным контролем, и считается, что трудно просто применить к ним вышеупомянутую технологию.
Среди исследований дипептидов и трипептидов дрожжей многие касаются образования GSH или γ-Glu-Cys. В качестве примера можно привести работу, в которой приводятся данные о том, что содержание GSH увеличили путем мутагенеза дрожжей Saccharomyces и отбора штамма, обладающего повышенной устойчивостью к цинку (выложенная патентная заявка Японии No.02-295480), сообщение о том, что супрессия экспрессии гена МЕТ25 была дерепрессирована благодаря мутантному гену МЕТ30, вследствие чего было увеличено внутриклеточное содержание γ-Glu-Cys (патентная заявка Японии No.2002-282743), и т.д. Кроме того, последние научные открытия включают данные о транспорте GSH через HGT1p. Хотя GSH и его димер, GSSG, транспортировались в клетки через HGT1p, на транспорт GSH транспортером HGT1p не влияло даже присутствие чрезмерного количества аминокислот, различных дипептидов и трипептидов. Следовательно, считается, что HGT1p является не неспецифическим транспортером, как полагали ранее, а транспортером, специфическим по отношению к GSH (Bourbouloux et al., Journal of Biological Chemistry, 275, pp.13259-13265 (2000)). Кроме того, также проведен поиск активных участков HGTIp (Kaur et al., FEMS Yeast Res., 9, 849-866 (2009)).
Как описано выше, хотя имеются сведения о многих открытиях, связанных с GSH и его предшественником, практически нет сведений о дрожжевых клетках, содержащих такие вещества, как γ-Glu-X и γ-Glu-X-Gly, и способе получения экстракта из этих клеток.
Краткое описание изобретения
Цели настоящего изобретения включают предоставление дрожжевого экстракта, содержащего γ-Glu-X или γ-Glu-X-Gly, и предоставление способа получения упомянутого экстракта.
Вышеупомянутый цели были достигнуты обнаружением того факта, что дрожжи транспортируют γ-Glu-X и γ-Glu-X-Gly (X представляет собой отличную от Cys аминокислоту или ее производное, то же относится к описанию, приведенному ниже) в клетку, и дрожжевой экстракт, содержащий γ-Glu-X или γ-Glu-X-Gly, может быть получен путем приготовления из указанных дрожжей, культивированных в среде, содержащей γ-Glu-X или γ-Glu-X-Gly. Кроме того, обнаружено, что если дрожжи культивируют в среде, содержащей γ-Glu-X или X-Gly, эти соединения транспортируются в клетки, и γ-Glu-X-Gly может образовываться в энзиматической реакции внутри клеток. Кроме того, также обнаружено, что дрожжевой экстракт, содержащий γ-Glu-X или γ-Glu-X-Gly, может быть получен при взаимодействии γ-глутамилтрансферазы с дрожжевым экстрактом, к которому добавлена аминокислота или пептид, выбранные из группы, состоящей из Х и X-Gly.
Целью настоящего изобретения является предоставление дрожжевого экстракта, содержащего пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, в количестве 0.005% или более от сухого веса дрожжевого экстракта, отличающегося тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных.
Также целью настоящего изобретения является предоставление описанного выше дрожжевого экстракта, содержащего пептид в количестве 0.02% или выше.
Также целью настоящего изобретения является предоставление описанного выше дрожжевого экстракта, отличающегося тем, что Х - это Val.
Также целью настоящего изобретения является предоставление описанного выше дрожжевого экстракта, отличающегося тем, что указанными дрожжами являются Saccharomyces cerevisiae.
Также целью настоящего изобретения является предоставление способа получения дрожжевого экстракта, содержащего пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, включающего выращивание дрожжей в питательной среде, содержащей пептид, выбранный из группы, состоящей из γ-Glu-X, γ-Glu-X-Gly и X-Gly, и приготовление из полученных клеток дрожжевого экстракта, отличающегося тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная питательная среда содержит 0.1 ppm (parts per million, 0,0001%) или более указанного пептида, и указанный дрожжевой экстракт содержит пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, в количестве 0.005% или более от сухого веса дрожжевого экстракта.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что Х - это Val.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что дрожжи модифицированы таким образом, что способность транспортировать указанный пептид в клетку в модифицированных дрожжах увеличена.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что активность HGT1p в указанных дрожжах повышена.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанными дрожжами являются Saccharomyces cerevisiae.
Также целью настоящего изобретения является предоставление способа получения дрожжевого экстракта, содержащего пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, включающего взаимодействие γ-глутамилтрансферазы с дрожжевым экстрактом, использующимся в качестве сырья, к которому добавлены аминокислота или пептид, выбранные из группы, состоящей из Х и X-Gly, отличающегося тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанные аминокислота или пептид добавлены в количестве 1% или более от сухого веса дрожжевого экстракта, и указанный дрожжевой экстракт содержит пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, в количестве 0.005% или более от сухого веса дрожжевого экстракта.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что Х - это Val.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанными дрожжами являются Saccharomyces cerevisiae.
Согласно настоящему изобретению, можно получить дрожжевой экстракт, содержащий γ-Glu-X или/и γ-Glu-X-Gly. Дрожжевой экстракт, содержащий эти пептиды, обладает превосходным вкусом «kokumi».
Кроме того, дрожжевой экстракт, содержащий γ-Glu-X, также полезен в качестве сырья для получения дрожжевого экстракта, содержащего γ-Glu-X-Gly.
Краткое описание рисунков
На Фигуре 1 показаны масс-хроматограммы стандартных образцов γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly.
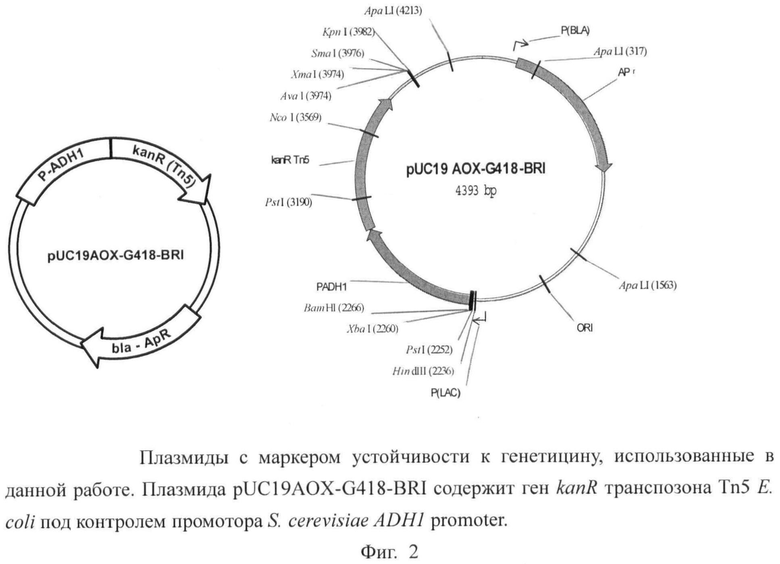
На Фигуре 2 показана структура плазмиды pUC19AOX-G418-BRI.
На Фигуре 3 показана структура плазмиды pKS-URA3-13.
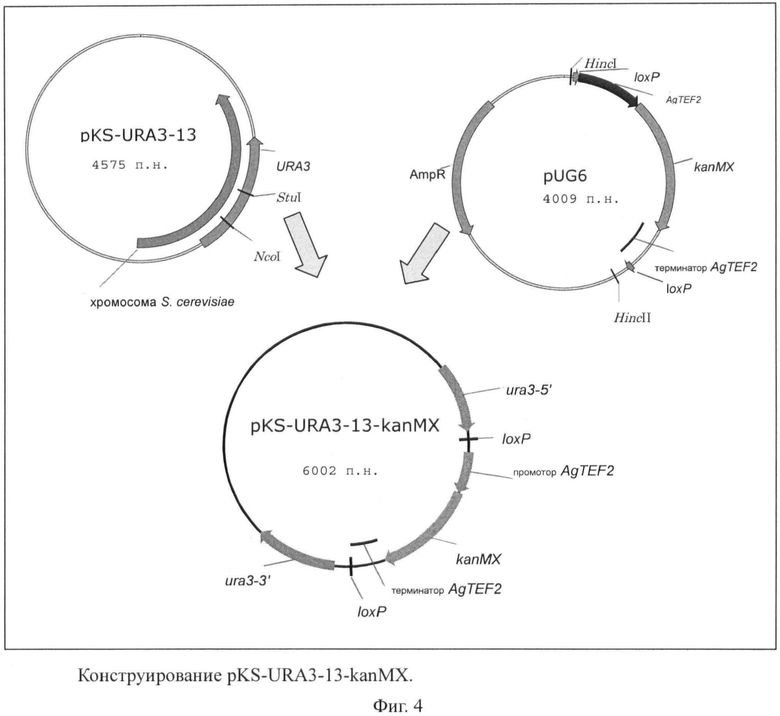
На Фигуре 4 показано конструирование плазмиды pKS-URA3-13-kanMX.
На Фигуре 5 показано конструирование плазмиды pLoxP-PADH1-kanR5.
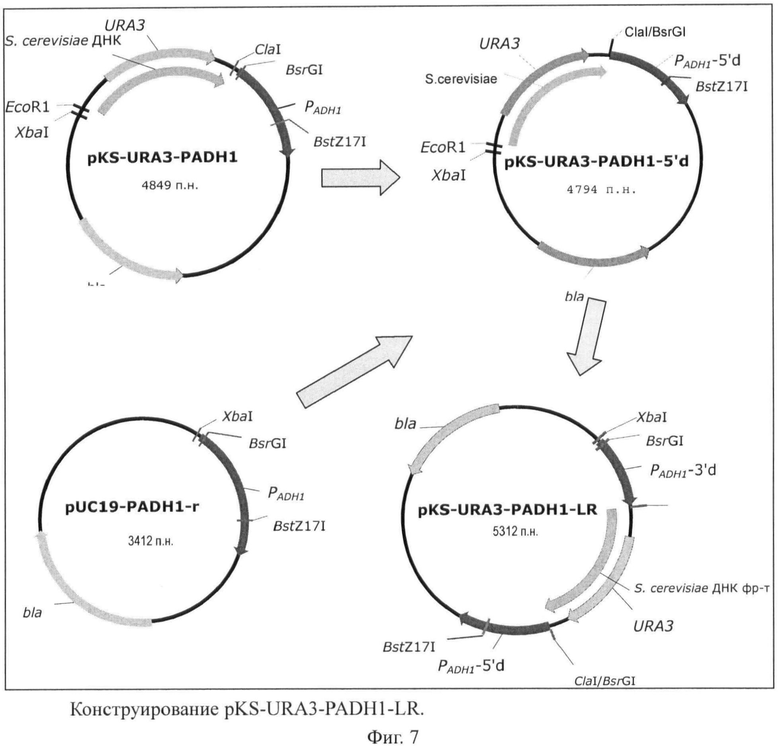
На Фигуре 6 показано конструирование плазмиды pKS-URA3-PADH1-LR.
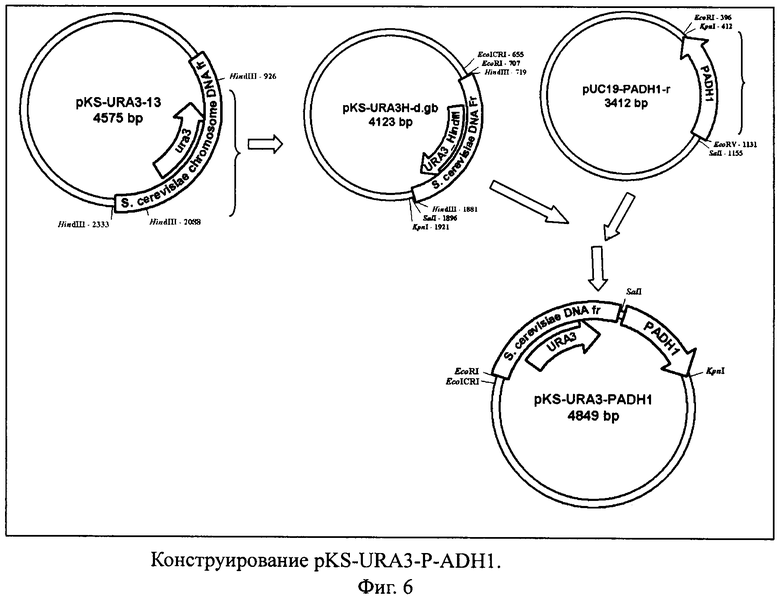
На Фигуре 7 показано конструирование плазмиды pKS-URA3-P-ADH1.
На Фигуре 8 показана схема получения фрагмента ДНК, использованного для замены промотора.
Подробное описание изобретения
Дрожжевой экстракт согласно настоящему изобретению содержит пептиды, выбранные из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, в количестве 0.005% или более от сухого веса дрожжевого экстракта, отличающиеся тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных. Дрожжевой экстракт согласно настоящему изобретению содержит пептид предпочтительно в количестве не менее 0.005%, более предпочтительно - не менее 0.02%, еще более предпочтительно - не менее 0.1%, особенно предпочтительно - не менее 0.5% сухого веса дрожжевого экстракта.
Дрожжи, использующиеся в качестве сырья для получения дрожжевого экстракта согласно настоящему изобретению, - те же дрожжи, что и использующиеся в описанном ниже способе настоящего изобретения.
Glu и Gly пептида представляют собой глутаминовую кислоту и глицин соответственно. Символ «-» обозначает пептидную связь, «γ» в обозначении γ-Glu означает, что другая аминокислота связывается через карбокси-группу глутаминовой кислоты в γ-положении.
«X» представляет собой любую из 19 природных аминокислот или их производных, за исключением Cys и его производных. Cys представляет собой цистеин, и примеры его производных включают α-аминобутировую кислоту, β-аминобутировую кислоту, и т.д. Вышеупомянутые аминокислоты за исключением Cys и его производных включают нейтральные аминокислоты, такие как глицин (Gly), аланин (Аlа), валин (Val), лейцин (Leu), изолейцин (Ilе), серии (Ser), треонин (Thr), метионин (Met), аспарагин (Asn), глутамин (Gln) и пролин (Pro), кислые аминокислоты, такие как аспарагиновая кислота (Asp) и глутаминовая кислота (Glu), основные аминокислоты, такие как лизин (Lys), аргинин (Arg) и гистидин (His), и ароматические аминокислоты, такие как фенилаланин (Phe), тирозин (Туr) и триптофан (Тrр). В частности, когда Х-гидрофобная аминокислота, эффект вкуса «kokumi» пептида сильнее, и такой пептид предпочтительней. Примеры таких гидрофобных аминокислот включают Val, Ala, Leu, Phe, и т.д.
Примеры производных аминокислот включают, например, норвалин (nVal), норлейцин (nLeu), тертлейцин (tLeu), гидроксипролин (Hyp), и т.д.
Среди вышеупомянутых пептидов наиболее предпочтительны γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly.
Кроме того, все вышеупомянутые аминокислоты и производные аминокислот являются L-изомерами.
Форма дрожжевого экстракта настоящего изобретения особым образом не ограничивается, и он может быть в виде порошка или раствора. Дрожжевой экстракт настоящего изобретения может использоваться так же, как и традиционные дрожжевые экстракты, например, в виде приправ, пищевых добавок, продуктов для здоровья, и т.д. Дрожжевой экстракт настоящего изобретения обладает превосходным свойством придания вкуса «kokumi». Поскольку свойство придания вкуса «kokumi» значительно усиливается при наличии вкуса «umami» или соленого вкуса, в дрожжевой экстракт могут быть добавлены вещества, придающие вкус «umami», такие как L-глутамат натрия и нуклеотиды, и/или соленые вещества, такие как хлорид натрия. Кроме того, вещества, придающие вкус «umami», могут добавляться к приправам, пищевым добавкам или продуктам для здоровья вместе с экстрактом настоящего изобретения.
Как показано в разделе «Примеры», дрожжевой экстракт, содержащий γ-Glu-Val-Gly, особенно раствор, содержащий дрожжевой экстракт, полученный описанным ниже способом согласно настоящему изобретению, имеет более выраженные свойства придания вкуса «kokumi» по сравнению с раствором γ-Glu-Val-Gly с такой же концентрацией γ-Glu-Val-Gly. Это доказывает эффективность дрожжевого экстракта настоящего изобретения.
Дрожжевой экстракт настоящего изобретения может быть получен, например, описанными ниже способами настоящего изобретения.
Первый способ согласно настоящему изобретению - способ получения дрожжевого экстракта, содержащего пептид, выбранный из группы, состоящей из γ-Glu-X-Gly и γ-Glu-X, включающий выращивание дрожжей в питательной среде, содержащей пептид, выбранный из группы, состоящей из γ-Glu-X-Gly, γ-Glu-X и X-Gly, и приготовление из полученных клеток дрожжевого экстракта, при этом Х представляет собой отличную от Cys и его производных аминокислоту или производное аминокислоты.
Для выбора дрожжей нет особенных ограничений при условии, что дрожжи могут транспортировать в клетку γ-Glu-X, γ-Glu-X-Gly или X-Gly. Примеры включают дрожжи, принадлежащие к роду Saccharomyces, такие как Saccharomyces cerevisiae, принадлежащие к роду Candida, такие как Candida utilis, принадлежащие к роду Pichia, такие как Pichia pastoris, и принадлежащие к роду Schizosaccharomyces, такие как Schizosaccharomyces pombe. Из них особенно предпочтительны Saccharomyces cerevisiae и Candida utilis, часто использующиеся для получения дрожжевого экстракта. Дрожжи настоящего изобретения могут быть гаплоидными или могут иметь диплоидность или более высокую полиплоидность.
Дрожжи могут быть любым штаммом дикого типа или мутантным штаммом при условии, что эти дрожжи могут транспортировать в клетки γ-Glu-X, γ-Glu-X-Gly или X-Gly и накапливать в клетках γ-Glu-X и/или γ-Glu-X-Gly. Примеры мутантных штаммов включают штамм, в котором усилены активности γ-глутамилцистеинсинтетазы (GSH1) и/или глутатионсинтетазы (GSH2). Дрожжи также могут быть модифицированы с целью улучшения транспорта γ-Glu-X, γ-Glu-X-Gly или X-Gly в клетки. Транспорт γ-Glu-X, γ-Glu-X-Gly или X-Gly может быть улучшен путем увеличения активности белка, принимающего участие в транспорте этих пептидов. Хотя считалось, что HGT1p является транспортером, специфичном по отношению к GSH, показано, что при увеличении активности HGT1p, транспорт γ-Glu-Val-Gly улучшается, как показано в разделе примеров. Следовательно, существует возможность, что при увеличении активности HGT1p улучшается транспорт в клетку не только γ-Glu-Val-Gly, но и γ-Glu-X, γ-Glu-X-Gly и/или X-Gly. Методы увеличения активности вышеупомянутого фермента или белка включают усиление его экспрессии путем замещения на хромосоме промотора гена, кодирующего фермент или белок, на более сильный промотор, усиление его экспрессии путем вставки целевого гена в хромосому для увеличения числа его копий до двух и более, усиление его экспрессии путем введения в дрожжи плазмиды, содержащей целевой ген, и т.п.
В качестве промотора высокоактивный тип традиционного промотора может быть получен с использованием репортерного гена или могут использоваться известные промоторы, обеспечивающие высокую экспрессию, такие как PGK1, PDC1, TDH3, TEF1 и НХТ7. С другой стороны, можно использовать плазмиду с ориджином репликации CEN4 или многокопийную плазмиду с ориджином репликации 2 мкм ДНК. Кроме того, можно использовать транспозон для введения целевого гена в любую область хромосомы или целевой ген может быть введен с использованием в качестве целевой последовательности кДНК, присутствующей в клетке в 150 копиях.
Усиление активности γ-глутамилцистеинсинтетазы раскрыто, например, в патенте США No.7,553,638; Otake Y. et al., Bioscience and Industry, volume 50, No.10, pp.989-994, 1992, и т.д. Хотя разрушение гена глутатионсинтетазы раскрыто в патенте США No.7,553,638, активность глутатионсинтетазы может быть усилена таким же образом, как и активность γ-глутамилцистеинсинтетазы. Активность HGT1p также может быть усилена подобным образом.
Нуклеотидные последовательности генов, кодирующих GSH1 и GSH2 Saccharomyces cerevisiae, раскрыты в базе данных Saccharomyces Genome Database (http://www.yeastgenome.org/). Нуклеотидные последовательности генов, кодирующих GSH1 и GSH2 Candida utilis, раскрыты в патенете США No.7,553,638. Нуклеотидная последовательнось гена, кодирующего GSH2 Saccharomyces cerevisiae, представлена в Перечне последовательностей под номером SEQ ID NO: 19. Аминокислотная последовательность, кодируемая этой нуклеотидной последовательностью, представлена в Перечне последовательностей под номером SEQ ID NO:20.
Последовательность гена, кодирующего HGT1p, может быть получена из базы данных Saccharomyces Genome Database (http://www.yeastgenome.org/). Эта нуклеотидная последовательность также может быть получена как GSH11, ОРТ1 и т.п., синонимы HGT1p. Последовательность, раскрытая как GSH11 Saccharomyces cerevisiae, представлена в Перечне последовательностей под номером SEQ ID NO: 21. Кроме того, аминокислотная последовательность, кодируемая этой нуклеотидной последовательностью, представлена в Перечне последовательностей под номером SEQ ID NO:22.
Способ получения дрожжевого экстракта разъясняется ниже.
Дрожжи выращивают в питательной среде, содержащей пептид. Состав питательной среды особым образом не ограничен, при условии, что выбирается среда, в которой дрожжи могут размножаться, и нет ограничений по SD среде, описанной в Примерах, и может использоваться среда, обычно используемая в производстве.
При выращивании дрожжей в вышеупомянутую питательную среду добавляют γ-Glu-X, γ-Glu-X-Gly или X-Gly. Можно добавлять один из видов этих пептидов или смесь из двух и более видов. Эти пептиды могут содержаться в питательной среде с начала культивирования или могут добавляться в питательную среду в любой момент в процессе культивирования. Когда указанные пептиды добавляют в питательную среду в процессе культивирования, предпочтительно добавлять их за 0-50 ч до окончания культивирования (0 часов означает, что культивирование прекращают сразу после добавления), более предпочтительно за 0.1-24 ч до окончания культивирования, особенно предпочтительно за 0.5-6 ч до окончания культивирования. Кроме того, при добавлении указанных пептидов в процессе культивирования они могут добавляться в непрерывном режиме.
Перед культивированием в питательной среде, содержащей указанные пептиды, может быть осуществлено предварительное культивирование. Питательная среда, использующаяся для предварительного культивирования, может содержать либо не содержать указанные пептиды.
Указанные пептиды обычно добавляют в питательную среду в количестве не менее 0.1 ppm, предпочтительно не менее 0.5 ppm, более предпочтительно не менее 1 ppm, еще более предпочтительно не менее 10 ppm, наиболее предпочтительно не менее 50 ppm, в выражении конечной концентрации в питательной среде в момент добавления. Хотя высшие пределы количества указанных пептидов особым образом не лимитируются, в качестве примера можно привести значение не более 100,000 или 50,000 ppm исходя из стоимости продукции, обычно не более 10,000 ppm, предпочтительно не более 1,000 ppm, более предпочтительно не более 500 ppm.
Условия культивирования могут быть такими же, что и обычно принятые при производстве дрожжевых экстрактов, они могут быть разными в зависимости от использующихся дрожжей. Можно использовать любые способы культивирования, такие как культивирование в периодической культуре, культивирование в периодической культуре с добавлением субстрата и непрерывное культивирование. Когда использующимися дрожжами являются Saccharomyces cerevisiae, предпочтительно аэробное культивирование со встряхиванием и т.п. при 25-35°С, более предпочтительно при 27-33°С, еще более предпочтительно при 28-32°С.
Если дрожжи культивируются, как описано выше, в клетках дрожжей накапливаются γ-Glu-X или/и γ-Glu-X-Gly. Когда γ-Glu-X или X-Gly добавляют в питательную среду, эти пептиды накапливаются в клетках, и, кроме того, также накапливается γ-Glu-X-Gly. Предполагается, что причина этого в том, что γ-Glu-X-Gly образуется из γ-Glu-X и X-Gly, транспортированных в клетку, при действии внутриклеточной γ-глутамилтрансферазы. Как показано в разделе Примеров, содержание γ-Glu-Val и γ-Glu-Val-Gly в дрожжах не коррелировало с содержанием в клетках GSH, и, следовательно, считается, что дрожжевые экстракты, полученные традиционными способами, не содержат γ-Glu-X или γ-Glu-X-Gly в высоких концентрациях, даже если их получают из дрожжей, содержащих GSH в высоких концентрациях.
Дрожжевой экстракт может быть приготовлен из полученных дрожжей таким же способом, что и использующийся при традиционном производстве дрожжевых экстрактов. Дрожжевой экстракт можно получать методом экстракции из клеток горячей водой и обработки экстракта, или методом разрушения клеток и обработки полученного в результате разрушения продукта. Кроме того, полученный дрожжевой экстракт можно при необходимости сконцентрировать или высушить с получением порошка.
Описанным выше способом получен дрожжевой экстракт, в котором увеличено содержание γ-Glu-X или/и γ-Glu-X-Gly. В наилучшем способе воплощения изобретения дрожжевой экстракт содержит γ-Glu-X или/и γ-Glu-X-Gly в суммарной концентрации не менее 0.005%, более предпочтительно не менее 0.02%, еще более предпочтительно не менее 0.1%, особенно предпочтительно не менее 0.5% сухого веса дрожжевого экстракта.
При воздействии γ-глутамилтрансферазы на содержащий γ-Glu-X дрожжевой экстракт, полученный, как описано выше, можно получить дрожжевой экстракт, содержащий γ-Glu-X-Gly.
Второй способ согласно настоящему изобретению - способ получения дрожжевого экстракта, содержащего пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, включающий воздействие γ-глутамилтрансферазы на дрожжевой экстракт, к которому добавлена аминокислота или пептид, выбранные из группы, состоящей из Х и X-Gly, где Х представляет собой аминокислоту или производное аминокислоты, отличные от Cys и его производных.
При воздействии γ-глутамилтрансферазы на Х или X-Gly образуется γ-Glu-X или γ-Glu-X-Gly. Следовательно, дрожжевой экстракт, содержащий γ-Glu-X или γ-Glu-X-Gly, может быть также получен при воздействии γ-глутамилтрансферазы на дрожжевой экстракт, содержащий Х или X-Gly. Дрожжевой экстракт, содержащий Х и/или X-Gly, может быть получен из дрожжей, выращенных в питательной среде, содержащей Х и/или X-Gly, или при добавлении Х и/или X-Gly к дрожжевому экстракту, использующемуся в качестве сырья.
Дрожжевой экстракт, использующийся в качестве сырья, может быть любым дрожжевым экстрактом, полученным традиционным способом.
К использующемуся в качестве сырья дрожжевому экстракту может быть добавлен один вид Х или X-Gly или смесь любых двух и более их видов. Х и/или X-Gly добавляют в суммарном количестве не менее 1%, предпочтительно не менее 5%, более предпочтительно не менее 10% сухого веса использующегося в качестве сырья дрожжевого экстракта.
Реакцию, катализируемую γ-глутамилтрансферазой, проводят в водном растворителе, таком как вода или буфер. Конкретно, например, использующийся в качестве сырья дрожжевой экстракт растворяют в водном растворителе и добавляют γ-глутамилтрансферазу. Условия реакции определяются в соответствии с использующейся γ-глутамилтрансферазой. Реакцию обычно проводят при рН 3-9 и температуре 15-70°С в течение 1-300 мин, предпочтительно при рН 5-8 и температуре 30-70°С в течение 5-150 мин.
Концентрация использующегося в качестве сырья дрожжевого экстракта может определяться удобством обращения. Указанная концентрация обычно составляет 0.1-50%, предпочтительно 0.5-20%, от сухого веса использующегося в качестве сырья дрожжевого экстракта.
Примеры γ-глутамилтрансферазы включают глутаминазу, γ-глутамилтранспептидазу (γ-GTP), и т.д. Что касается количества фермента, в случае γ-GTP, это обычно 0.001-1000 Ед/мл, предпочтительно 0.005-100 Ед/мл, более предпочтительно 0.01-25 Ед/мл, наиболее предпочтительно Ед/мл, где 1 Ед соответствует активности, при которой за 1 мин в растворе при рН 8.5 и температуре 25°С освобождается 1.0 мкМ р-нитроанилина из γ-глутамил-р-нитроанилида (определение дано в Sigma General Catalogue, 2008-2009 Edition, p.917). Количество глутаминазы также может быть определено тем же способом, что и для γ-GTP.
После ферментативной реакции может проводиться либо не проводиться обработка для инактивации γ-глутамилтрансферазы, например тепловая обработка при 80-100°С.
В качестве субстрата γ-глутамилтрансферазы в реакционную смесь можно добавить соединение γ-глутамил, например, GSH. GSH, содержащийся в дрожжевом экстракте, также может быть использован в качестве субстрата. В этом случае можно использовать дрожжевой экстракт, приготовленный из дрожжей, в которых увеличено содержание GSH, например, дрожжей, в которых усилены активности GSH1 или/и GSH2. Хотя более высокое содержание GSH в дрожжевом экстракте более предпочтительно, обычно это 1-50%, предпочтительно 1-30%, и более предпочтительно 5-20%, от сухого веса дрожжевого экстракта.
Таким описанным выше способом получают дрожжевой экстракт, в котором увеличено содержание γ-Glu-X или/и γ-Glu-X-Gly. В наилучшем способе осуществления изобретения дрожжевой экстракт содержит γ-Glu-X или/и γ-Glu-X-Gly в суммарном количестве не менее 0.005%, более предпочтительно не менее 0.02%, еще более предпочтительно не менее 0.1%, наиболее предпочтительно не менее 0.5% сухого веса дрожжевого экстракта.
Полученный дрожжевой экстракт при необходимости может быть сконцентрирован или высушен для получения порошка.
Примеры
Настоящее изобретение более подробно описано ниже со ссылкой на последующие Примеры, которые не ограничивают каким-либо образом рамки настоящего изобретения.
Пример 1: Определение γ-Glu-Val-Gly и γ-Glu-Val в различных дрожжевых экстрактах
Было измерено содержание γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly в различных дрожжевых экстрактах. Измерение проводили путем получения флуоресцентных производных пептидов с использованием 6-аминохинолил-N-гидроксисукцинимидилкарбамата (AQC), и их определение с использованием LC-MS/MS в соответствии с описанным ниже способом. К 2.5 мкл каждого раствора различных дрожжевых экстрактов, разведенных до соотвествующей концентрации или к 2.5 мкл каждого стандартного раствора, содержащего γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly соответственно, добавляли 2.5 мкл Milli-Q воды, 5 мкл 5 мкМ раствора внутреннего стандартного вещества (L-аланин-3,3,3-d3, Sigma (Ala-D3), DL-валин-2,3,4,4,4,5,5,5-d8, Sigma (Val-d8), оба меченые стабильным изотопом) и 30 мкл боратного буфера (прилагаемого к AccQ-Fluor (зарегистрированный товарный знак) Reagent Kit, Nihon Waters). К каждой смеси добавляли 10 мкл раствора реагента AQC (приготовленного путем растворения порошка вышеупомянутого реагента в 1 мл ацетонитрила). Полученную смесь нагревали при 55°С в течение 10 мин и затем к смеси добавляли 100 мкл 0.1% водного раствора муравьиной кислоты для приготовления образцов для анализа.
Затем приготовленный, как описано выше, образец сепарировали методом обращенно-фазовой высокоэффективной жидкостной хроматографии, описанным ниже, и затем помещали в масс-спектрофотометр. Условия сепарации описаны ниже.
(1) ВЭЖХ: Agilent 1200 Series
(2) Разделительная колонка: Unison UK-Phenyl, внутренний диаметр: 2.0 мм, длина: 100 мм, размер частиц: 3 мкм (Imtakt)
(3) Температура колонки: 40°С
(4) Подвижная фаза А: водный раствор, полученный при доведении 25 мМ раствора муравьиной кислоты до рН 6.0 с использованием водного раствора аммиака
(5) Подвижная фаза В: метанол
(6) Скорость протока: 0.25 мл/мин
(7) Условия элюции: элюцию проводили с использованием смеси подвижной фазы А и подвижной фазы В. Отношение мобильной фазы В к смеси следующее: 0 мин (5%), 0-17 мин (5-40%), 17-17.1 мин (40-80%), 17.1-19 мин (80%), 19-19.1 мин (80-5%), 19.1-27 мин (5%).
Затем, производные соединения γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly, элюированные при вышеупомянутых условиях разделения, помещали в масс-анализатор и определяли их количество методом масс-хроматографии. Условия определения были следующие.
(1) Масс-анализатор: АВ Sciex API3200 QTRAP
(2) Способ детекции: Контроль заданных ионов (режим определения положительных ионов)
(3) Заданный ион: Таблица 1
Количество производных соединений γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly определяли с использованием программы Analyst ver. 1.4.2 (AB Sciex). В качестве внутреннего стандартного вещества для количественного определения использовали производное соединение Ala-d3 в случае γ-Glu-Val-Gly и γ-Glu-Val и производное соединение Val-d8 в случае Val-Gly, соответственно. Результаты представлены в Таблице 2. В этой таблице «ND» означает, что количество было меньше предела определения (то же будет применимо далее). Результаты анализа (масс-хромато граммы) производных внутренних стандартных аминокислот, γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly стандартных образцов показаны на Фиг.1.
Как видно из Таблицы 2, содержание γ-Glu-Val-Gly в различных дрожжевых экстрактах составляло максимум несколько ppm, содержание γ-Glu-Val и Val-Gly составляло максимум несколько десятков ppm, и таким образом исследованные экстракты практически не содержали γ-Glu-Val-Gly, γ-Glu-Val и Val-Gly.
Пример 2: Определение γ-Glu-Val-Gly и γ-Glu-Val в клетках различных дрожжей
Кроме того, определили внутриклеточное содержание γ-Glu-Val-Gly и γ-Glu-Val в различных дрожжах. Что касается штаммов, в качестве стандартного штамма использовали штамм Saccharomyces cerevisiae S288C, а в качестве штамма с высоким содержанием GSH использовали штамм Saccharomyces cerevisiae AJ14819 (депонированный при международном депонировании как штамм FERM ВР-08502). Штамм S288C хранится в независимом административном агентстве. National Institute of Technology and Evaluation, Biological Resource Center (NBRC, NITE Biological Resource Center, 2-5-8 Kazusakamatari, Kisarazu-shi, Chiba-ken, 292-0818, Japan) под номером NBRC 1136, где его можно получить. Этот штамм также хранится в коллекции American Type Culture Collection (12301 Parklawn Drive, Rockville, Maryland 20852, United States of America) под номером АТСС 26108, где его можно получить. Штамм АJ14819 был получен в результате мутагенеза моноплоидного дрожжевого штамма, полученного из коммерчески доступного штамма Saccharomyces cerevisiae с EMS, и последующего отбора мутантного штамма, в котором экспрессия гена МЕТ25 не подавляется метионином, полученный штамм депонирован в независимом административном агенстве Agency of Industrial Science and Technology, International Patent Organism Depository, Central 6, 1-1-1, Higashi, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) 11 сентября 2002 под инвентарным номером FERM P-19007. Затем в соответствии с Будапештским Договором было проведено международное депонирование штамма 1 октября 2003 г. под инвентарным номером FERM ВР-08502 (патент Японии No.4352877).
Вышеупомянутые штаммы по одной петле биомассы клеток инокулировали в питательную среду SD (50 мл среды в колбах Sakaguchi объемом 500 мл) и выращивали при 30°С в течение 24 ч со встряхиванием при скорости 120 об/мин.
Состав среды SD:
Глюкоза 2%
Азотные основания 1-кратная концентрация
Азотные основания в 10-кратной концентрации получали путем растворения смеси 1.7 г Bacto Yeast Nitrogen Base w/o Amino Acids and Ammonium Sulfate (Difco) и 5 г сульфата аммония в 100 мл стерилизованной воды, доводили рН раствора до 5.2 и стерилизовали методом фильтрации.
Определяли поглощение полученной жидкой культуры, культуру инокулировали в среду SD (400 мл в конических колбах объемом 2 л с отбойниками) в таком количестве, чтобы значение OD660 в начале культивирования было 0.01 (поглощение определяли с использованием DU640 SPECTROPHTOMETER, BECKMAN COULTER), культивировали при 30°С в течение 19 ч со встряхиванием на роторной качалке при скорости 120 об/мин. Из полученной культуры 400 OD Ед клеток (1 OD Ед определяется как количество клеток, содержащихся в 1 мл культуры, значение OD660 которой составляет 1) собирали клетки с использованием центрифугирования. Супернатант удаляли насколько возможно и оставшиеся клетки суспендировали в 45 мл Milli-Q воды. Клетки повторно собирали с использованием центрифугирования и ресуспендировали в 45 мл Milli-Q воды. Путем трехкратного повторения этой операции клетки полностью отмывали от питательной среды. Полученные отмытые клетки суспендировали в 1.5 мл Milli-Q воды, суспензию прогревали при 70°С в течение 10 мин. На этой стадии экстрагировались содержащиеся в клетках экстрагируемые компоненты. Затем экстракт и оставшиеся клетки разделяли с использованием центрифугирования.
Фрагменты клеток удаляли из экстракта с использованием центрифугирования с фильтрационной мембраной с размером пор 10 кДа (Amicon Ultra - 0.5 мл 10К, MILLIPORE, Catalogue Number UFC501096)), полученную фракцию обрабатывали AQC реагентом так же, как описано в Примере 1, и определяли γ-Glu-Val-Gly и γ-Glu-Val методом LC-MS/MS. Отдельно определяли количество GSH в клетке традиционным методом (производное GSH в экстракте получали с использованием флуоресцентного реагента ABD-F, связывающегося с тиольной группой, сепарировали и определяли его количество с использованием ВЭЖХ). Кроме того, определяли сухой вес клеток после высушивания отмытых клеток при 104°С в течение 4 ч. С учетом количества γ-Glu-Val-Gly и γ-Glu-Val в дрожжевом экстракте, приготовленном из клеток, содержащихся в определенном объеме культуры, и измеренного, как описано выше, сухого веса клеток рассчитывали содержание этих пептидов. Результаты представлены в Таблице 3.
В результате корреляции между содержанием γ-Glu-Val-Gly или γ-Glu-Val и содержанием GSH не обнаружено.
Пример 3: Добавление γ-Glu-Val-Gly к штамму S288C (1)
Петлю биомассы клеток штамма S288C инокулировали в среду SD (50 мл в колбах Sakaguchi объемом 500 мл) и выращивали при 30°С в течение 24 ч со встряхиванием при скорости 120 об/мин. Определяли поглощение полученной жидкой культуры, культуру инокулировали в среду SD (400 мл в конических колбах объемом 2 л с отбойниками) в таком количестве, чтобы значение ОD660 в начале культивирования было 0.01, культивировали при 30°С в течение 16 ч со встряхиванием на роторной качалке при скорости 120 об/мин. К питательной среде SD заранее добавляли γ-Glu-Val-Gly (Kokusan Chemistry) до конечной концентрации 100 ppm.
Для вышеописанной культуры рассчитали содержание γ-Glu-Val-Gly в высушенных клетках так же, как описано в Примере 2. В результате содержание γ-Glu-Val-Gly оказалось приблизительно 20,000 ppm (=2%).
Кроме того, когда измерили содержание γ-Glu-Val-Gly в отмывающем растворе после различных стадий отмывания, содержание оказалось 0.01 ppm, т.е. ниже предела определения, после трехкратного центрифугирования. Клетки отмыли еще раз, и это гарантировало практически полное удаление γ-Glu-Val-Gly в процессе отмывки путем четырехкратной сепарации и предотвращение его попадания в экстракт клеток.
Пример 4: Добавление γ-Glu-Val-Gly к штамму S288C (2)
Петлю биомассы клеток штамма S288C инокулировали в среду SD (50 мл в колбах Sakaguchi объемом 500 мл) и выращивали при 30°С в течение 24 ч со встряхиванием при скорости 120 об/мин. Определяли поглощение полученной жидкой культуры, культуру инокулировали в среду SD (400 мл в конических колбах объемом 2 л с отбойниками) в таком количестве, чтобы значение ОD660 в начале культивирования было 0.01, культивировали при 30°С в течение 19 ч со встряхиванием на роторной качалке при скорости 120 об/мин. После 19 ч добавляли водные растворы γ-Glu-Val-Gly различных концентраций для получения заданнных концентраций и продолжали культивирование в течение 1 ч. Для этих культур рассчитали содержание γ-Glu-Val-Gly в высушенных клетках так же, как описано в Примере 2. Кроме того, рассчитали содержание сухих веществ в экстракте и также количество γ-Glu-Val-Gly в сухих веществах. Результаты представлены в Таблице 4.
Из представленных результатов видно, что чем больше количество добавленного γ-Glu-Val-Gly, тем больше содержание γ-Glu-Val-Gly в высушенных клетках и в сухом веществе экстракта.
Пример 5: Получение дрожжевого экстракта, содержащего γ-Glu-Val-Gly
Получили дрожжевой экстракт из клеток, выращенных с добавлением в среду γ-Glu-Val-Gly. Петлю биомассы клеток штамма S288C инокулировали в среду SD (50 мл в колбах Sakaguchi объемом 500 мл) и выращивали при 30°С в течение 24 ч со встряхиванием при скорости 120 об/мин. Определяли поглощение полученной жидкой культуры, культуру инокулировали в среду SD (400 мл в конических колбах объемом 2 л с отбойниками, 12 колб) в таком количестве, чтобы значение ОD660 в начале культивирования было 0.01, культивировали при 30°С в течение 19 ч со встряхиванием на роторной качалке при скорости 120 об/мин. После 19 ч добавляли водный раствор γ-Glu-Val-Gly до конечной концентрации 50 ppm и продолжали культивирование в течение 1 ч.
Клетки собирали из полученной культуры и отмывали так же, как описано в Примере 2. Отмытые клетки в количестве 400 OD Ед суспендировали в 1.5 мл Milli-Q воды. Эту суспензию выдерживали при 70°С в течение 10 мин для получения экстракта из дрожжевых клеток. Кроме того, суспензию центрифугировали для удаления остатков клеток и таким образом собирали только экстракт. Определяли концентрацию содержащегося в этом экстракте γ-Glu-Val-Gly (в экстракте, полученном в эксперименте с добавлением γ-Glu-Val-Gly), она составляла приблизительно 300 ppm, а содержание сухих веществ - приблизительно 1%. Значение концентрации γ-Glu-Val-Gly в экстракте, полученном таким же образом, но без добавления в культуральную жидкость γ-Glu-Val-Gly (в экстракте, полученном в эксперименте без добавления γ-Glu-Val-Gly) было ниже предела определения, а содержание сухих веществ - приблизительно 1%.
Экстракты, приготовленные, как описано выше, были оценены на наличие вкуса «kokumi» в присутствии MSG (глутамат натрия) следующим образом. В качестве контроля использовали водный раствор, содержащий 0.2% MSG и 0.5% NaCl, и его органолептические свойства были оценены как соответствующие 0.0. Затем водный раствор, содержащий 0.2% MSG, 0.5% NaCl и 10 ppm γ-Glu-Val-Gly, использовали как стандартный раствор для вкуса «kokumi», и его органолептические свойства были оценены как соответствующие 3.0. Используя эти два вида растворов в качестве стандартов интенсивности вкуса «kokumi», оценивали интенсивность вкуса «kokumi» дрожжевого экстракта. Интенсивность вкуса «kokumi» экстрактов оценивали с использованием в качестве тестируемого образца водного раствора, содержащего дрожжевой экстракт, 0.2% MSG и 0.5% NaCl. Количество в тестируемом образце экстракта, полученного в эксперименте с добавлением, соответствовало концентрации γ-Glu-Val-Gly 10 ppm. Количество в тестируемом образце экстракта, полученного в эксперименте без добавления, было таким, что содержание сухих веществ было таким же, что и в тестируемом образце экстракта, полученного в эксперименте с добавлением. Итак, концентрации γ-Glu-Val-Gly в стандартном растворе для вкуса «kokumi» и в тестируемом образце, содержащем экстракт, полученный в эксперименте с добавлением, были одинаковыми, и содержание твердых веществ в тестируемом образце, содержащем экстракт, полученный в эксперименте с добавлением, и в тестируемом образце, содержащем экстракт, полученный в эксперименте без добавления, было одинаковым.
Приготовленные, как описано выше, тестируемые образцы были оценены на вкус «kokumi» четырьмя членами специального жюри. В результате, все четверо членов жюри сделали заключение о том, что вкус «kokumi» экстракта, полученного в эксперименте с добавлением, был сильнее, чем в образце с такой же концентрацией γ-Glu-Val-Gly. Кроме того, для оценки вкуса «kokumi» как начальный и средний вкус «kokumi» и послевкусие «kokumi» использовали оценки, выставленные четырьмя членами жюри по каждому типу вкуса. Результаты представлены в Таблице 5. Начальный и средний вкус означают вкус, ощущаемый в течение 0-4 сек после дегустации, а послевкусие означает вкус, ощущаемый через 5 сек и позже. Как видно из представленных результатов, по оценкам членов жюри, начальный и средний вкус «kokumi» и послевкусие «kokumi» экстракта, полученного с добавлением γ-Glu-Val-Gly в процессе культивирования, были сильнее из-за того, что γ-Glu-Val-Gly метаболизировался особым образом, или из-за синергизма γ-Glu-Val-Gly и какого-то компонента дрожжевого экстракта.
Пример 6: Добавление γ-Glu-Val к штамму S288C (1)
Петлю биомассы клеток штамма S288C инокулировали в среду SD (50 мл в колбах Sakaguchi объемом 500 мл) и выращивали при 30°С в течение 24 ч со встряхиванием при скорости 120 об/мин. Определяли поглощение полученной жидкой культуры, культуру инокулировали в среду SD (400 мл в конических колбах объемом 2 л с отбойниками) в таком количестве, чтобы значение OD660 в начале культивирования было 0.01, культивировали при 30°С в течение 24 ч со встряхиванием на роторной качалке при скорости 120 об/мин. К питательной среде SD заранее добавляли γ-Glu-Val (Bachem) до конечной концентрации 100 ppm.
Для вышеописанной культуры рассчитали содержание γ-Glu-Val и γ-Glu-Val-Gly в высушенных клетках так же, как описано в Примере 2. Результаты представлены в Таблице 6.
Из представленных результатов видно, что часть поглощенного дрожжевыми клетками γ-Glu-Val была модифицирована в γ-Glu-Val-Gly.
Пример 7: Добавление γ-Glu-Val к штамму S288C (2)
Петлю биомассы клеток штамма S288C инокулировали в среду SD (50 мл в колбах Sakaguchi объемом 500 мл) и выращивали при 30°С в течение 24 ч со встряхиванием при скорости 120 об/мин. Определяли поглощение полученной жидкой культуры, культуру инокулировали в среду SD (400 мл в конических колбах объемом 2 л с отбойниками) в таком количестве, чтобы значение OD660 в начале культивирования было 0.01, культивировали при 30°С в течение 19 ч со встряхиванием на роторной качалке при скорости 120 об/мин. После 19 ч добавляли водные растворы γ-Glu-Val различных концентраций для получения заданных концентраций и продолжали культивирование в течение 1 ч. Для этих культур рассчитали содержание γ-Glu-Val в высушенных клетках так же, как описано в Примере 2. Кроме того, рассчитали содержание сухих веществ в экстракте и также количество γ-Glu-Val в сухих веществах. Результаты представлены в Таблице 7.
Из представленных результатов видно, что чем больше количество добавленного γ-Glu-Val, тем больше содержание γ-Glu-Val в высушенных клетках и в сухом веществе экстракта.
Пример 8: Добавление Val-Gly к штамму S288C (1)
Петлю биомассы клеток штамма S288C инокулировали в среду SD (используемый при приготовлении среды SD сульфат аммония заменили пролином (конечная концентрация пролина была 0.1 г/л), 50 мл в колбах Sakaguchi объемом 500 мл) и выращивали при 30°С в течение 24 ч со встряхиванием при скорости 120 об/мин. Определяли поглощение полученной жидкой культуры, культуру инокулировали в среду SD (400 мл в конических колбах объемом 2 л с отбойниками) в таком количестве, чтобы значение OD660 в начале культивирования было 0.01, культивировали при 30°С в течение 24 ч со встряхиванием на роторной качалке при скорости 120 об/мин. К питательной среде SD заранее добавляли Val-Gly (Bachem) до конечной концентрации 100 ppm.
Для вышеописанной культуры рассчитали содержание γ-Glu-Val-Gly в высушенных клетках так же, как описано в Примере 2. Результаты представлены в Таблице 8.
Когда в среду добавляли Val-Gly, в дрожжевых клетках накапливался γ-Glu-Val-Gly.
Пример 9: Дрожжевой экстракт, полученный с добавлением Val-Gly, на который воздействовала γ-глутамилтрансфераза
Приготовили 1% водный раствор дрожжевого экстракта, в котором содержание GSH было около 8% (в сухом веществе), и довели значение рН до 7.0 с использованием NaOH. К этому раствору добавили порошкообразный Val-Gly до конечных концентраций 400 ppm, 800 ppm и 4000 ppm для приготовления тестируемых образцов. Водный раствор дрожжевого экстракта, полученного без добавления Val-Gly, также использовали в качестве контроля. К этим тестируемым образцам добавляли глутаминазу (Glutaminase Daiwa SD-C100S, Daiwa kasei) в количестве 1 мг/мл и проводили ферментативную реакцию при 37°С в течение 120 мин. Кроме того, вместо глутаминазы добавляли γ-GTP (γ-глутамилтранспептидаза почек лошади, Sigma, Code G9270-100UN) в количестве 0.05 мг/мл и проводили ферментативную реакцию также при 37°С в течение 120 мин. Реакционные смеси сразу после реакции охлаждали на льду и определяли содержание γ-Glu-Val-Gly, GSH и Cys-Gly.
Как видно из результатов, представленных в следующих таблицах, γ-Glu-Val-Gly почти не образовывался в экспериментах без добавления Val-Gly, но с увеличением количества добавляемого Val-Gly образование γ-Glu-Val-Gly становилось видимым. Когда использовали γ-GTP, продукция γ-Glu-Val-Gly была особенно заметна.
Если вместо Val-Gly добавляли Val или nVal и проводили ферментативную реакцию сходным образом, также образовывались γ-Glu-Val или γ-Glu-nVal.
Пример 10: Добавление γ-Glu-Val к штамму с усиленной экспрессией GSH2
Для усиления экспрессии GSH2 можно использовать следующую процедуру. 1) Получение ауксотрофного по урацилу штамма (ura3 мутанта) из штамма S288C.
Ауксотрофный по урацилу штамм можно получить путем высева клеток штамма Saccharomyces cerevisiae, обработанного мутагеном с использованием традиционного способа, на агаризованную среду, содержащую 5-FOA, и отбора из выросших штаммов ura3 мутантов (см, например, METHODS IN YEAST GENETICS, 2000 EDITION, p.179). Ауксотрофный по урацилу штамм также может быть получен путем введения прилегающей к гену URA3 ДНК, не содержащей ген URA3, в штамм S288C с последующим разрушением гена URA3, как показано ниже.
Сначала область перед геном URA3 величиной 500 п.н. амплифицировали в ПЦР с использованием праймеров, представленных в Перечне последовательностей под номерами SEQ ID NO:1 и SEQ ID NO:2, и хромосомной ДНК штамма S288C в качестве матрицы. Кроме того, область после гена URA3 величиной 500 п.н. также амплифицировали в ПЦР с использованием праймеров, представленных в Перечне последовательностей под номерами SEQ ID NO:3 и SEQ ID NO:4. Использовали следующие условия для ПЦР: 25 циклов: денатурация при 94°С в течение 10 сек, отжиг при 55°С в течение 10 сек, элонгация при 72°С в течение 1 мин. Затем для получения фрагмента ДНК величиной 1 т.п.н., состоящего из области перед геном URA3 величиной 500 п.н. и области после гена URA3 величиной 500 п.н., провели ПЦР перекрывающихся фрагментов с использованием полученных двух фрагментов ДНК, очищенных путем осаждения этанолом, в качестве матриц и праймеров, представленных в Перечне последовательностей под номерами SEQ ID NO:5 и SEQ ID NO:6. Штамм S288C трансформировали этим фрагментом ДНК и затем культивировали в течение ночи в среде SD с добавлением урацила, затем клетки высевали на чашки со средой 5-FOA. Из полученных трансформантов получили ura3Δ0 штамм.
2) Получение плазмиды, использующейся в качестве матрицы для замены промотора.
Сначала локус URA3 амплифицировали в ПЦР с использованием праймеров SEQ ID NO:7 и SEQ ID NO:8 и хромосомной ДНК штамма дикого типа Saccharomyces cerevisiae в качестве матрицы (25 циклов: денатурация: 94°С в течение 10 сек, отжиг при 50°С в течение 10 сек, элонгация при 72°С в течение 1 мин). Полученный фрагмент ДНК очищали путем осаждения этанолом, затем обрабатывали рестриктазами SphI и EcoRI, продукт ПЦР встраивали в плазмиду pUC19 по сайтам SphI-EcoRI для получения pUC19-URA3. Затем амплифицировали область PGK1 промотора с использованием хромосомной ДНК штамма дикого типа Saccharomyces cerevisiae в качестве матрицы и праймеров SEQ ID NO:9 и SEQ ID NO:10. Этот фрагмент ДНК обрабатывали рестриктазой PstI, и встраивали в pUC19-URA3, обработанную рестриктазой PstI с обработкой сайта PstI щелочной фосфатазой кишечника теленка, для получения pUC19-PGK1p-URA3. Сходным образом промотор PGK1, амплифицированный с использованием праймеров SEQ ID NO:11 и SEQ ID NO:12, обрабатывали рестриктазой AatII и встраивали в pUC19-PGK1p-URA, обработанный рестриктазой AatII с обработкой сайта AatII щелочной фосфатазой кишечника теленка, для получения pUC19-PGK1p-URA3-PGK1p. Когда полученную плазмиду секвенировали, была подтверждена нуклеотидная последовательность, ожидаемая в случае использования в качестве матрицы хромосомной ДНК штамма S288C. Следовательно, даже при использовании в качестве матрицы хромосомной ДНК штамма S288C вместо хромосомной ДНК штамма дикого типа можно получить подобную плазмиду.
3) Введение промотора PGK1 в ген GSH2 на хромосоме
Провели ПЦР с использованием праймера SEQ ID NO:13, на 5'-конце которого находится последовательность перед геном GSH2, праймера SEQ ID NO:14, содержащего часть последовательности открытой рамки считывания, начинающейся со стартового кодона гена GSH2, и C19-PGK1p-URA3-PGK1p в качестве матрицы (25 циклов: денатурация при 94°С в течение 10 сек, отжиг при 60°С в течение 10 сек, элонгация при 72°С в течение 4 мин) для получения фрагмента ДНК, содержащего ген URA3 между промоторами PGK1. Штамм ura3Δ0 может быть трансформирован этим фрагментом ДНК, после чего его высевают на чашки со средой SD для получения трансформантов, и из трансформантов может быть получен штамм, в котором промотор гена GSH2 замещен конструкцией промотор PGK1 -URA3-промотор PGK1.
4) Удаление селективного маркера URA3 и замена промотора гена GSH2
Штамм, в котором промотор гена GSH2 замещен конструкцией промотор PGK1-URA3-промотор PGK1 выращивали в течение ночи на среде SD с добавлением урацила, соответствующий объем полученной культуры высевали на чашки со средой 5-FOA. Из выросших колоний можно получить штамм, в котором ген URA3 удален за счет гомологичной рекомбинации между введенными промоторами PGK1 и промотор GSH2 замещен промотором PGK1. Кроме того, путем введения в полученный штамм фрагмента ДНК, амплифицированного с использованием хромосомы штамма дикого типа в качестве матрицы и праймеров SEQ ID NO:15 и SEQ ID NO:16, можно получить штамм, генотип которого такой же, как генотип штамма ura3Δ0 за исключением того, что ген URA3 дикого типа и промотор GSH2 замещен промотором PGK1.
С использованием этого штамма описанным выше способом получили дрожжевой экстракт и оценили его так же, как описано в Примерах 3, 4 и 6-8.
Пример 11: Добавление γ-Glu-Val-Gly к штамму с усиленной экспрессией HGT1
Штамм с усиленной экспрессией HGT1p может быть получен таким же образом, как описано в Примере 10. Конкретно, путем проведения ПЦР с использованием pUC19-PGK1p-URA3-PGK1p в качестве матрицы, праймера SEQ ID NO:17, на 5'-конце которого находится последовательность перед геном GSH1, и праймера SEQ ID NO:18, содержащего часть последовательности открытой рамки считывания, начинающейся со стартового кодона гена GSH11, и введения полученного фрагмента ДНК в спорулирующие клетки дрожжей получены клетки, в которых промотор GSH11 замещен промотором PGK1.
С использованием этого штамма описанным выше способом получили дрожжевой экстракт и оценили его так же, как описано в Примерах 3, 4 и 6-8.
Пример 12: Увеличение активности транспорта γ-Glu-Val-Gly в HGT1p- или РКТ2-модифицированном штамме.
Влияние HGT1p, который считается специфичным по отношению к GSH транспортером, и транспортера пептидов, PTR2, на накопление γ-Glu-Val-Gly оценивали следующим образом.
1) Получение мутанта, ауксотрофного по урацилу (ura3 мутанта) из штамма S288C
Кассету с геном устойчивости к генетицину (G418) (РADH1-kanR) амплифицировали в ПЦР с использованием pUC19AOX-G418-BRI (Фиг.2, SEQ ID NO:23) в качестве матрицы и праймеров URA3Km-L1 (SEQ ID NO:24) и URA3Km-R2 (SEQ ID NO:25).
40 нуклеотидов на 5'-конце праймера URA3Km-L1 гомологичны области перед геном URA3, 40 нуклеотидов на 5'-конце праймера URA3Km-R2 комплементарны области за геном URA3.
Полученный фрагмент ДНК использовали для трансформации штамма S.cerevisiae S288C. Трансформанты отбирали на чашках со средой YPD, содержащей 200 мкг/мл G418. Делецию гена URA3 подтверждали в ПЦР с праймерами ura3up2 (SEQ ID NO:26) и ura3dn2 (SEQ ID NO:27).
Получили штамм S288C ura3Δ0::PADH1-kanR, который может упоминаться и как S288C ura3Δ0. Этот штамм использовали для конструирования штаммов с повышенной экспрессией HGT1p или PTR2.
С другой стороны, с целью использования для конструирования штамма с делецией HGT1p или PTR2 еще один ауксотрофный по урацилу мутант был получен следующим образом. Фрагмент, содержащий ген URA3 с областями промотора и терминатора, амплифицировали в ПЦР с использованием хромосомной ДНК штамма S288C в качестве матрицы и вышеупомянутых праймеров ura3up2 и ura3dn2. Этот фрагмент клонировали по сайту Smal в pBluescript II KS (+) и подтверждали правильность конструкции секвенированием. Получили плазмиду pKS-URA3-13 (Фиг.3, SEQ ID NO:28).
Плазмиду pKS-URA3-13 обрабатывали рестрикзами StuI и NcoI и затем обрабатывали фрагментом Кленова ДНК полимеразы I, чтобы затупить NcoI сайт. Полученный фрагмент величиной 4,38 т.п.н. лигировали с HincII - HincII фрагментом pUG6 величиной 1,64 т.п.н. [Gűldener, U., Heck, S., Fiedler, Т., Beinhauer, J., and Hegemann, J.H. 1996. A new efficient gene disruption cassette for repeated use in budding yeast. Nucleic Acids Research 24, 2519-2524], содержащим модуль loxP-kanMX-loxP. Полученная плазмида упоминается как pKS-URA3-13-kanMX. Карта и схема конструирования этой плазмиды показаны на Фиг.4, SEQ ID NO:29.
Затем ген kanMX, фланкированный фрагментами гена URA3, амплифицировали в ПЦР с использованием вышеупомянутых праймеров ura3up2 и ura3dn2 и плазмиды pKS-URA3-13-kanMX в качестве матрицы. Полученный фрагмент использовали для трансформации штамма S.cerevisiae S288C, затем отбирали трансформанты на среде YPD, содержащей 200 мкг/мл G418. В результате был получен штамм, производный от S288C, с делецией 227 нуклеотидов кодирующей области гена URA3. Эта делеция упоминается как ura3Δ227::loxP-kanMX-loxP. Для делеции маркера kanMX полученный штамм трансформировали плазмидой pSH47 [Gűldener, U., Heck, S., Fiedler, Т., Beinhauer, J., and Hegemann, J.H. 1996. A new efficient gene disruption cassette for repeated use in budding yeast. Nucleic Acids Research 24, 2519-2524], содержащей ген, кодирующий Сrе-рекомбиназу, под контролем промотора GAL1 и ген URA3 в качестве селективного маркера. Вырезание маркера осуществили после индукции синтеза Сrе-рекомбиназы вследствие переноса клеток со среды YPD на среду YPG (содержащую галактозу). Полученный штамм, из которого удалили плазмиду pSH47, назвали S288C ura3Δ227::lохР.
2) Получение мутантного штамма с делецией HGT1p
Фрагмент ДНК, содержащий кассету Agleu2-CaURA3-Agleu2, амплифицировали в ПЦР с использованием плазмиды pAG61 [Goldstein, A.L., Pan, X., and McCusker, J.H. 1999. Heterologous URA3MX cassettes for gene replacement in Saccharomyces cerevisiae. Yeast 15, 507-511] в качестве матрицы и праймеров hgtl-pUG6u (SEQ ID NO:30) и hgtl-pUG6d (SEQ ID NO:31).
47 нуклеотида на 5'-конце праймера hgtl-pUG6u гомологичны 5'-области гена HGT1p, 44 нуклеотида на 5'-конце праймера hgtl-pUG6d комплементарны 3'-области HGT1.
Полученный фрагмент использовали для трансформации штамма S288C ura3Δ227::lохР.Трансформантов отбирали на чашках со средой SD. Полученный штамм S288C ura3Δ227::lохР HGT1Δ1981::Agleu2-CaURA3-Agleu2 с делецией нуклеотидов с 1981 по 2400 кодирующей области гена HGT1 назвали S288C HGT1Δ. Делецию в гене HGT1p подтверждали в ПЦР с использованием праймеров hgt1-51 (SEQ ID NO:32) и hgt1-33 (SEQ ID NO:33).
3) Получение мутантного штамма с делецией PTR2
Модуль PADH1-kanR из плазмиды pUC19AOX-G418-BRI вырезали с использованием рестриктаз ХbаI и SacI и субклонировали по тем же сайтам в плазмиде pUG6. Полученную плазмиду назвали pLoxP-PADH1-kanR5 (Фиг.5).
Фрагмент ДНК, содержащий модуль loxP-PADH1-kanR-loxP, амплифицировали в ПЦР с использованием плазмиды pLoxP-PADH1-kanR5 в качестве матрицы и праймеров ptr2-pUG6u (SEQ ID NO:34) и ptr2-pUG6d (SEQ ID NO:35).
47 нуклеотидов на 5'-конце праймера hgt1-pUG6u гомологичны 5'-области гена PTR2, 44 нуклеотида на 5'-конце праймера hgt1-pUG6d комплементарны 3'-области гена PTR2.
Полученный фрагмент использовали для трансформации штамма S288C ura3Δ227::lохР. Трансформантов отбирали на чашках со средой SD с добавлением 200 мкг/мл G418. Полученный штамм S288C ura3Δ227::lохР ptr2Δ967::loxP-PADH1-kanR-loxP с делецией нуклеотидов с 967 по 1806 кодирующей области гена PTR2 назвали S288C рtr2Δ.
Делецию в гене PTR2 подтверждали в ПЦР с использованием праймеров ptr2-51 (SEQ ID NO:36) и ptr2-31 (SEQ ID NO:37).
4) Получение мутантных штаммов с делецией HGT1p или PTR2 из штамма S288C
Штамм S288C НСТ1Δ рtr2Δ сконструировали подобным же образом, что и штамм S288C рtr2Δ, но в качестве реципиентного штамма для трансформации использовали штамм S288C HGT1Δ.
5) Получение штамма с повышенной продукцией HGT1
Фрагмент ДНК, содержащий промотор ADH1, амплифицировали в ПЦР с использованием хромосомной ДНК штамма S. cerevisiae S288C в качестве матрицы и праймеров adhlLl (SEQ ID NO:38) и adhlRl (SEQ ID NO:39). Полученный фрагмент клонировали по SmaI сайту в плазмиде pUC19 и правильность конструкции подтверждали секвенированием. Полученную плазмиду назвали pUC19-PADH1-r (Фиг.6).
Фрагмент HindIII-HindIII плазмиды pKS-URA3-13 величиной 1,16 т.п.н. субклонировали по сайту HindIII в плазмиде pBluescript II KS(+) с получением pKS-URA3H-d. Фрагмент KpnI-SalI плазмиды pUC19-PADH1-r клонировали по SalI-KpnI сайтам в pKS-URA3H-d. Полученную плазмиду pKS-URA3-P-ADH1 (Фиг.7).
Затем плазмиду pKS-URA3-PADH1 обрабатывали рестриктазами СlаI и BsrGI. После рестрикции плазмиду обрабатывали фрагментом Кленова ДНК полимеразы I для того, чтобы концы были тупые, и лигировали. Полученную плазмиду, pKS-URA3-PADH1-5'd, обрабатывали рестриктазой EcoRI, обрабатывали фрагментом Кленова ДНК полимеразы I, затем обрабатывали рестриктазой ХbаI. Полученный фрагмент лигировали с фрагментом PADH1, вырезанным из плазмиды pUC19-PADH1-r с использованием рестриктаз ХbаI и BstZ17I. Таким образом была получена плазмида pKS-URA3-PADH1-LR (Фиг.6).
Фрагмент ДНК, содержащий кассету PADH1-URA3-PADH1, амплифицировали в ПЦР с использованием плазмиды pKS-URA3-PADH1-LR в качестве матрицы и праймеров PADH1-HGT1 (SEQ ID NO:40) и HGT1-PADH1 (SEQ ID NO:41).
40 нуклеотидов на 5'-конце праймера PADH1-HGT1 комплементарны 40 первым нуклеотидам кодирующей области HGT1, 40 нуклеотидов на 5'-конце праймера HGT1-PADH1 гомологичны обасти перед геном HGT1.
Фрагмент ДНК, содержащий область перед геном HGT1, амплифицировали в ПЦР с использованием хромосомной ДНК штамма S. cerevisiae S288C в качестве матрицы и праймеров hgt53 (SEQ ID NO:42) и hgt33 (SEQ ID NO:43).
Затем фрагменты, полученные, как описано выше, соединяли с использованием ПЦР (использовали праймеры hgt53 и PADH1-HGT1) как описано в [Shevchuk, N.A., Bryksin, A.V., Nusinovich, Y.A., Cabello, F.C., Sutherland M., Ladisch S. 2004. Construction of long DNA molecules using long PCR-based fusion of several fragments simultaneously. Nucleic Acids Res.32(2):e19]. Полученный фрагмент использовали для трансформации штамма S288C ura3Δ0::PADH1-kanR. Трансформанты отбирали на чашках со средой SD. В результате был получен штамм S288C ura3Δ0::PADH1-kanR PADH1-URA3-PADH1-HGT1. Штамм назвали S288C PADH1-HGT1.
Схема эксперимента по замене промотора показана на Фиг.8. Праймер hgt53 соответствует Праймеру 1, праймер hgt33 соответствует Праймеру 2, праймер HGT1-PADH1 соответствует Праймеру 3, праймер PADH1-HGT1 соответствует Праймеру 4.
6) Получение штамма с повышенной продукцией PTR2
Замену нативного промотора PTR2 осуществили так же, как замену промотора HGT1p (Фиг.8).
Использованные праймеры:
ptr52 (SEQ ID NO:44), соответствует Праймеру 1;
ptr32 (SEQ ID NO:45), соответствует Праймеру 2;
PTR2-PADH1 (SEQ ID NO:46), соответствует Праймеру 3;
PADH1-PTR2 (SEQ ID NO:7), соответствует Праймеру 4;
40 нуклеотидов на 5'-конце праймера PADH1-PTR2 комплементарны 40 первым нуклеотидам кодирующей области PTR2, 30 нуклеотидов на 5'-конце праймера PTR2-PADH1 гомологичны области перед геном PTR2.
7) Оценка мутантов
Каждый штамм выращивали в пробирках объемом 50 мл с 5 мл среды SD с добавлением γ-Glu-Val-Gly до конечной концентрации 100 ppm. В пробирки засевали ночную культуру соответствующего штамма до начальной плотности OD600=0.5 и помещали на качалку при 240 об/мин, 30°С. Культивировали в течение 7 ч. Затем клетки из 2 мл культуры собирали с использованием центрифугирования и трижды отмывали milliQ водой. Отмытые клетки суспендировали в 1 мл milliQ-воды и инкубировали при 70°С в течение 10 мин на водяной бане для экстракции внутриклеточного содержимого. После отделения экстракта от клеточного дебриса путем центрифугирования водную фазу переносили в чистый виал и подвергали вакуумной сушке. Таким образом готовили сухой экстракт. Затем измеряли γ-Glu-Val-Gly в сухом экстракте с использованием метода LC-MS/MS. Процедура подробно описана ниже.
Оборудование:
Масс-спектрометр: Triple Quadrupole Agilent 6410
ВЭЖХ:Аgilent 1200
Колонки: Thermo Hypersil-Keystone C18 100 мм*2.1 мм*5 мкм
1. Образец растворяли в 100 мкл воды, затем добавляли 100 мкл ацетонитрила (MeCN) и центрифугировали.
2. 190 мкл супернатанта переносили в новую пробирку и высушивали.
3. Высушенную массу растворяли в 40 мкл воды.
4. Для получения производного 20 мкл полученного раствора смешивали с 60 мкл буфера и 80 мкл реагента для получения производного и инкубировали при 55°С в течение 10 мин.
5. После инкубирования для того, чтобы остановить реакцию получения производного AQC, добавляли 200 мкл 0.1% раствора НСООН в воде.
40 мкл полученного раствора использовали для ВЭЖХ и анализировали в элюанте γ-Glu-Val-Gly с использованием MS/MS детектора.
Условия ВЭЖХ:
Подвижная фаза А - 0.1% НСООН в H2O
Подвижная фаза В - 0.1% НСООН в MeCN.
Скорость протока - 0.250 мл/мин
С использованием этих данных рассчитали внутриклеточное содержание γ-Glu-Val-Gly. Результаты представлены в Таблицах 13 и 14. Показано, что ген HGT1p существенен для транспорта γ-Glu-Val-Gly из питательной среды, а ген PTR2 не существенен.
Пример 13: Влияние добавления γ-Glu-Val-Gly к штамму с увеличенной продукцией HGT1p
S288C PADH1-HGT1, штамм с увеличенной продукцией HGT1p, полученный в Примере 12, и его родительский штамм S288C оценивали по их способности к транспорту внутрь клетки γ-Glu-Val-Gly таким же образом, как в Примере 4. Количество добавленного в питательную среду γ-Glu-Val-Gly - конечная концентрация 100 ppm. В результате внутриклеточное содержание γ-Glu-Val-Gly в S288C было около 0.9% на сухой вес, а внутриклеточное содержание γ-Glu-Val-Gly в S288C PADH1-HGT1 на сухой вес было около 4.9%. Этот результат подтвердил влияние повышенной продукции HGT1p.






































Изобретение относится к области биотехнологии и биохимии. Представлены альтернативные способы получения дрожжевого экстракта для придания пищевым продуктам вкуса “kokumi”, содержащего пептид γ-Glu-X или γ-Glu-X-Gly. Один вариант представленных способов включает выращивание дрожжей в питательной среде, содержащей пептид, выбранный из группы, состоящей из γ-Glu-X, γ-Glu-X-Gly и X-Gly, и приготовление из полученных клеток дрожжевого экстракта. Другой вариант включает воздействие γ-глутамилтрансферазы на дрожжевой экстракт, содержащий X или X-Gly, полученный из дрожжей, выращенных в питательной среде, к которой добавлены аминокислота X или пептид X-Gly. Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных. Описан дрожжевой экстракт для придания пищевым продуктам вкуса “kokumi”, полученный указанными способами, содержащий пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, в количестве 0.005% или более сухого веса дрожжевого экстракта, отличающийся тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных. Изобретение позволяет получить дрожжевой экстракт, содержащий пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, в количестве 0.005% или более от сухого веса дрожжевого экстракта, из очищенных от питательной среды клеток дрожжей. 5 н. и 19 з.п. ф-лы, 8 ил., 14 табл., 13 пр.
1. Способ получения дрожжевого экстракта для придания пищевым продуктам вкуса “kokumi”, содержащего пептид γ-Glu-X, включающий выращивание дрожжей в питательной среде, содержащей пептид, выбранный из группы, состоящей из γ-Glu-X, γ-Glu-X-Gly и X-Gly, и приготовление из полученных клеток дрожжевого экстракта, отличающийся тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных.
2. Способ по п.1, отличающийся тем, что указанная питательная среда содержит 0.1 ppm или более указанного пептида, и указанный дрожжевой экстракт содержит пептид γ-Glu-X в количестве 0.005% или более от сухого веса дрожжевого экстракта.
3. Способ по п.1 или 2, отличающийся тем, что Х - это Val.
4. Способ по п.1, отличающийся тем, что дрожжи модифицированы таким образом, что в модифицированных дрожжах усилена способность транспортировать указанный пептид в клетку.
5. Способ по п.4, отличающийся тем, что в указанных дрожжах повышена активность HGT1p.
6. Способ по п.1, отличающийся тем, что указанными дрожжами являются дрожжи Saccharomyces cerevisiae.
7. Способ получения дрожжевого экстракта для придания пищевым продуктам вкуса “kokumi”, содержащего пептид γ-Glu-X-Gly, включающий выращивание дрожжей в питательной среде, содержащей пептид, выбранный из группы, состоящей из γ-Glu-X, γ-Glu-X-Gly и X-Gly, и приготовление из полученных клеток дрожжевого экстракта, отличающийся тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных.
8. Способ по п.7, отличающийся тем, что указанная питательная среда содержит 0.1 ppm или более указанного пептида, и указанный дрожжевой экстракт содержит пептид γ-Glu-X-Gly в количестве 0.005% или более от сухого веса дрожжевого экстракта.
9. Способ по п.7 или 8, отличающийся тем, что Х - это Val.
10. Способ по п.7, отличающийся тем, что дрожжи модифицированы таким образом, что в модифицированных дрожжах усилена способность транспортировать указанный пептид в клетку.
11. Способ по п.10, отличающийся тем, что в указанных дрожжах повышена активность HGT1p.
12. Способ по п.7, отличающийся тем, что указанными дрожжами являются дрожжи Saccharomyces cerevisiae.
13. Способ получения дрожжевого экстракта для придания пищевым продуктам вкуса “kokumi”, содержащего пептид, γ-Glu-X, включающий воздействие γ-глутамилтрансферазы на дрожжевой экстракт, содержащий X или X-Gly, полученный из дрожжей, выращенных в питательной среде, к которой добавлены аминокислота или пептид, выбранные из группы, состоящей из X или X-Gly, отличающийся тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных.
14. Способ по п.13, отличающийся тем, что указанные аминокислота или пептид добавлены в количестве 1% или более сухого веса дрожжевого экстракта и указанный дрожжевой экстракт содержит пептид γ-Glu-X в количестве 0.005% или более от сухого веса дрожжевого экстракта.
15. Способ по п.13 или 14, отличающийся тем, что Х - это Val.
16. Способ по п.13, отличающийся тем, что указанными дрожжами являются дрожжи Saccharomyces cerevisiae.
17. Способ получения дрожжевого экстракта для придания пищевым продуктам вкуса “kokumi”, содержащего пептид, γ-Glu-X-Gly, включающий воздействие γ-глутамилтрансферазы на дрожжевой экстракт, содержащий X или X-Gly, полученный из дрожжей, выращенных в питательной среде, к которой добавлены аминокислота или пептид, выбранные из группы, состоящей из X или X-Gly, отличающийся тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных.
18. Способ по п.17, отличающийся тем, что указанные аминокислота или пептид добавлены в количестве 1% или более сухого веса дрожжевого экстракта и указанный дрожжевой экстракт содержит пептид γ-Glu-X-Gly в количестве 0.005% или более от сухого веса дрожжевого экстракта.
19. Способ по п.17 или 18, отличающийся тем, что Х - это Val.
20. Способ по п.17, отличающийся тем, что указанными дрожжами являются дрожжи Saccharomyces cerevisiae.
21. Дрожжевой экстракт для придания пищевым продуктам вкуса “kokumi”, содержащий пептид, выбранный из группы, состоящей из γ-Glu-X и γ-Glu-X-Gly, в количестве 0.005% или более сухого веса дрожжевого экстракта, отличающийся тем, что Х представляет собой аминокислоту или ее производное, отличные от Cys и его производных, полученный по любому из способов по пп.1, 7, 13 или 17.
22. Дрожжевой экстракт по п.21, содержащий пептид в количестве 0.02% или выше.
23. Дрожжевой экстракт по п.21, отличающийся тем, что Х - это Val.
24. Дрожжевой экстракт по п.21, отличающийся тем, что указанными дрожжами являются дрожжи Saccharomyces cerevisiae.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| СПОСОБ ПОЛУЧЕНИЯ ДРОЖЖЕВОГО НИЗКОМОЛЕКУЛЯРНОГО ЭКСТРАКТА И ВЕЩЕСТВО, ПОЛУЧАЕМОЕ ЭТИМ СПОСОБОМ | 1996 |
|
RU2148636C1 |
| ALTON MEISTER and MARY E | |||
| ANDERSON, "GLUTATHIONE", Ann | |||
| Rev | |||
| Biochem., 1983, 52: 711-760 | |||
| RU 2070875 С1, 27.12.1996 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| HIDEYUKI SUZUKI et al | |||
| "Use of Bacterial gamma-Glutamyltranspeptidase for Enzymatic Synthesis of | |||
Авторы
Даты
2013-10-27—Публикация
2010-07-05—Подача