Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу получения N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метилацетамида который используется в качестве промежуточного соединения для получения фармацевтических соединений.
Уровень техники
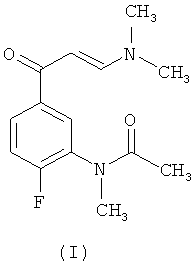
Соединение формулы (I), N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метилацетамид, является ключевым промежуточным соединением в получении галоидированных пиразоло[1,5-а]пиримидинов, обладающих высоким сродством к рецепторам ГАМКА, которые раскрыты в заявке на патент ЕР 1736475 А1.
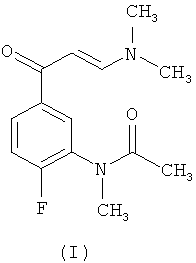
Соединение (II), N-{2-фтор-5-[3-(тиофен)-2-карбонил-пиразоло[1,5-а]пиримидин-7-ил]фенил}-N-метилацетамид, которое было впервые описано в вышеупомянутой заявке на патент, особенно полезно для лечения или профилактики беспокойства, эпилепсии, нарушений сна и бессонницы, для индуцирования седативного гипноза, анестезии и расслабления мышц, а также для модулирования необходимого времени засыпания и длительности сна.
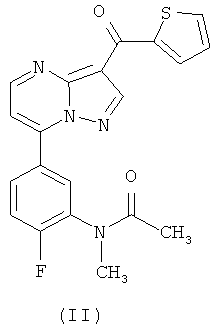
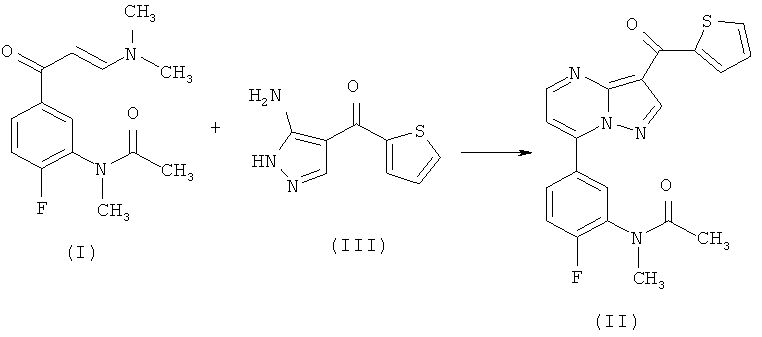
В вышеупомянутой заявке на патент конечное соединение (II) получено реакцией соединения (I)

с (5-амино-1Н-пиразол-4-ил)тиофен-2-ил-метаноном формулы (III)
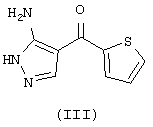
в ледяной уксусной кислоте. В свою очередь, промежуточное соединение (I) получено с помощью двухстадийной реакции N-(5-ацетил-2-фторфенил)-ацетамида формулы (IV)
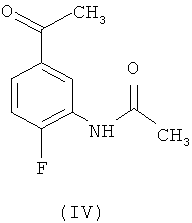
который обрабатывают избытком N,N-диметилформамид диметилацеталя (NNДМФ-ДМА) и затем подвергают N-метилированию образующееся соединение N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-ацетамид, формулы (V)

йодистым метилом в диметилформамиде (ДМФ) в атмосфере инертного газа при 0°C в присутствии гидрида натрия (Пример получения 1).
Использование опасных реактивов, таких как йодистый метил и гидрид натрия, специальные экспериментальные условия, например, необходимость низкой температуры (0°C), и неудобство осуществления в инертной атмосферы превращении соединения (V) в соединение (I) делают способ, раскрытый в заявке на патент ЕР 1736475 А1 нецелесообразным для промышленного производства N-{2-фтор-5-[3-(тиофен)-2-карбонил-пиразоло[1,5-а]пиримидин-7-ил]фенил}-N-метилацетамида (II). Кроме того, другие недостатки этого способа заключаются в том, что ключевое промежуточное соединение (I) из (IV), включая образование (V), получается с полным выходом 40%, и чистота, определенная методом ВЭЖХ, составляет 94,9%.
Таким образом в настоящее время существует потребность разработки нового способа получения промежуточного соединения (I), который позволит избежать использования опасных материалов и является действительно эффективным с точки зрения промышленного производства.
Изобретатели настоящего изобретения обнаружили новый способ получения соединения (I), который более экологичен и легко может быть адаптирован для промышленного производства чем существующие способы и обеспечивает высокий выход и чистоту конечного продукта.
Раскрытие изобретения
Целью настоящего изобретения является разработка нового легко применимого в промышленности и безвредного для окружающей среды способа получения N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метилацетамида (I), который обеспечивает высокий выход и необходимую чистоту продукта.
Также целью настоящего изобретения является новый способ получения N-{2-фтор-5-[3-(тиофен)-2-карбонил-пиразоло[1,5-а]пиримидин-7-ил]фенил}-N-метилацетамида (II).
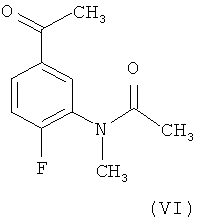
Другой целью настоящего изобретения является новое промежуточное соединение N-(5-ацетил-2-фторфенил)-N-метилацетамид (VI).
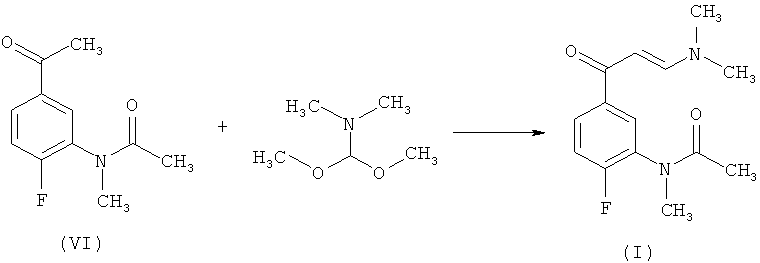
Способ получения N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метил-ацетамид (I) согласно настоящему изобретению включает реакцию соединения формулы (VI)

с избытком NNДМФ-ДМА в соотношении 1,5÷2,5 моля NNДМФ-ДМА на моль соединения (VI) под нагревом с обратным холодильником, сопровождаемая добавлением неполярного ароматического растворителя, выбранного из группы, включающей толуол, о-ксилол, м-ксилол, п-ксилол, этилбензол, стирол, кумол, и их смеси, при температуре в пределах от 70 до 90°C, и затем неполярного алифатического растворителя, выбранного из группы, включающей н-гексан, н-гептан, н-октан, 2,5-диметилгексан, циклогексан, метилциклогексан и их смеси, при той же самой температуре.
В предпочтительном воплощении соотношение NNДМФ-ДМА к соединению (VI) представляет собой 2 моля на моль соединения (VI).
В других предпочтительных воплощениях в качестве неполярного ароматического растворителя выбирают толуол, температура реакции представляет собой 80°C, и неполярный алифатический растворитель представляет собой н-гептан.
В другом предпочтительном воплощении настоящего изобретения соединение (VI) получено способом, включающим реакцию соединения формулы (IV)

с метилирующим реагентом, выбранным из группы, включающей метил п-толуолсульфонат, метил о-нитробензолсульфонат, метил м-нитробензолсульфонат, метил п-нитробензолсульфонат и метил метансульфонат в полярном апротонном растворителе, выбранном из группы, включающей ацетонитрил, бензонитрил, диметилформамид, ди метил сульфоксид, диоксан, N-метил-2-пирролидон, пропионитрил, тетрагидрофуран и их смеси, сопровождаемая нейтрализацией основанием, выбранным из группы, включающей гидроксид натрия, гидроксид калия, гидроксид кальция, углекислый натрий, углекислый калий, углекислый кальций, двууглекислый натрий, двууглекислый калий и двууглекислый кальций.
Реакция метилирования осуществляется добавлением основания при температуре 10-50°C в соотношении от 1,0 до 1,5 моля относительно субстрата (IV), в присутствии метилирующего реагента, который находится в соотношении от 1,0 до 1,5 моля относительно субстрата (IV).
В других предпочтительных воплощениях температура реакции представляет собой 30°C, выбранный метилирующий реагент представляет собой метил п-толуолсульфонат, который используется в соотношении 1,1 моля на моль соединения (IV), полярный апротонный растворитель представляет собой ацетонитрил, основание - гидроксид натрия, который используется в соотношении 1,1 моля на моль соединения (IV) и добавляется после добавления метилирующего реагента.
Вторым объектом изобретения является способ получения N-{2-фтор-5-[3-(тиофен)-2-карбонил-пиразоло[1,5-а]пиримидин-7-ил]фенил}-N-метил-ацетамида (II)

включающий реакцию соединения формулы (IV)

с метилирующим реагентом, выбранным из группы, включающей метил п-толуолсульфонат, метил о-нитробензолсульфонат, метил м-нитробензолсульфонат, метил п-нитробензолсульфонат и метил метасульфонат в соотношении от 1,0 до 1,5 молей относительно субстрата (IV), при температуре 10-50°C, в полярном апротонном растворителе, выбранным из группы, включающей ацетонитрил, бензонитрил, диметилформамид, диметилсульфоксид, диоксан, N-метил-2-пирролидон, пропионитрил и тетрагидрофуран и их смеси, сопровождаемая нейтрализацией основанием, выбранным из группы, включающей гидроксид натрия, гидроксид калия, гидроксид кальция, углекислый натрий, углекислый калий, углекислый кальций, двууглекислый натрий, двууглекислый калий и двууглекислый кальций, при соотношении от 1,0 до 1,5 молей относительно субстрата (IV), с образованием соединения формулы (VI),
реакцию образовавшегося соединения формулы (VI)
с избытком NNДМФ-ДМА при соотношении 1,5÷2,5 моля NNДМФ-ДМА на моль соединения (VI) под под нагревом с обратным холодильником, сопровождаемая добавлением неполярного ароматического растворителя, выбранного из группы, включающей толуол, о-ксилол, м-ксилол, п-ксилол, этилбензол, стирол, кумол, и их смеси, при температуре в пределах от 70 до 90°C, и затем неполярного алифатического растворителя, выбранного из группы, включающей н-гексан, н-гептан, н-октан, 2,5-диметилгексан, циклогексан, метилциклогексан и их смеси, при той же самой температуре, с образованием соединения формулы (I), и
реакцию образовавшегося соединения формулы (I)

с соединением формулы (III)

в ледяной уксусной кислоте при температуре в диапазоне от 60 до 90°C в течение 2-6 часов, и добавления алифатического спирта, выбранного из группы, включающей изопропанол, этиловый спирт, н-пропанол и метанол, с образованием соединения формулы (II).
В предпочтительном воплощении второго объекта изобретения выбраны следующие условия:
на стадии образования соединения (VI) сначала добавляют метил п-толуолсульфонат в качестве метилирующего реагента в пропорции 1,1 моля на моль соединения (IV) при температуре 30°C в ацетонитриле в качестве полярного апротонного растворителя, и затем добавляют гидроксид натрия в качестве основания, при соотношении 1,1 моль на моль соединения (IV),
на стадии образования соединения (I) пропорция NNDMF-DMA составляет 2 моля на моль соединения (VI), толуол используется в качестве неполярного ароматического растворителя, температура составляет 80°C, и n-гептан используется в качестве неполярного алифатического растворителя,
на стадии образования (II) температура составляет 75°C, интервал времени составляет 4 часа, и изопропанол выбран в качестве алифатического спирта.
Авторы настоящего изобретения неожиданно обнаружили, что комбинация простой перестановки в порядке реакций, которые приводят к получению (I) из (IV) через (VI), вместо того, чтобы получать (I) из (IV) через (V) как описано в Примере получения 1 из заявки на патент ЕР 1736475 А1, последующее использование метилсульфоната в качестве метилирующего реагента, предпочтительно метил п-толуолсульфонта, вместо йодистого метила как описано в вышесказанном Примере получения 1, использование слабого основания (щелочного или щелочноземельного бикарбоната, карбоната или гидроксида) вместо щелочного гидрида как описано в вышесказанном Примере получения 1, и добавление указанного основания впоследствии вместе с добавлением метилирующего реагента, дает преимущества, заключающиеся в высоком суммарном выходе (83%) и высокой чистоте (согласно методу ВЭЖХ, 99,7%) соединения (I).
Высокая чистота, достигнутая этим новым способом, базируется, кроме факта, что метилирование выполнено на соединении кетона (IV), которое более устойчиво, чем соединение енамина (V) из способа заявки на патент ЕР 1736475 А1, на факте, что условия метилирования могут предотвратить формирование нестабильного аниона из ацетамидной группы, и нуклеофильная замена атома фтора соединения (IV) может быть минимизирована.
Кроме того, изменения, представленные в настоящем изобретении позволяют избежать использования опасных реактивов, которые могут нанести ущерб людям и среде, а также специальных условий осуществления способа, таких как температура и необходимость инертной атмосферы. Разработанный способ, очень выгоден и обладает неоспоримыми преимуществами в свравнении с уровнем техники, так как обеспечивает более эффективное и безопасное получение конечного проукта.
Преимущества настоящего изобретения по сравнению с заявкой на патент ЕР1736475А1 представлены в Таблице 1.
Третий объект настоящего изобретения представляет собой новое промежуточное соединение, N-(5-ацетил-2-фторфенил)-N-метилацетамид, формулы (VI)

Осуществление изобретения
Пример 1. Синтез N-(5-ацетил-2-фторфенил)-N-метилацетамида (VI)

В 800 мл ацетонитрила были растворены 80 г (0,41 моль) N-(5-ацетил-2-фторфенил)-N-ацетамида (IV) (US 2005070555) и 83,77 г (0,45 моль) метил п-толуолсульфоната. Полученная смесь была охлаждена до 15-20°C, и 18,00 г (0,45 моля) гидроксида натрия были добавлены. Затем смесь была нагрета до 30°C и находилась при перемешивании в течение 15 часов. Тонкослойная хроматография (этилацетат: н-гептан 70:30), подтвердила прохождение реакции. Смесь была охлаждена до 15-20°C, и были добавлены 400 мл воды. Ацетонитрил был главным образом отогнан при пониженном давлении, и полученный водный раствор был экстрагирован хлористым метиленом (2×400 мл). Экстрагированная органическая фаза была собрана и сначала отмыта 400 мл 5%-ого водного раствора кислого бикарбоната натрия и затем 2×400 мл воды. Смесь была сконцентрирована почти до степени высушивания при пониженном давлении, и полученный сырой продукт был кристаллизован растворением при 50°C в смеси 48 мл толуола и 282 мл н-гептана и медленным охлаждением до 15°C. Выпавший осадок был отфильтрован, отмыт холодной смесью (10-15°С) из 40 мл толуола и 248 мл н-гептана, и затем высушен под вакуумом при 30°С. Был получен белый осадок (78 г, 91%-ый выход) с точкой плавления=75,5-76,5°С.
МС(ES)m/z=210(МН+)
1Н ЯМР (400 МГц, Cl3CD): δ 1,81 (3H, c), 2,55 (3Н, с), 3,17 (3Н, с), 7,23 (1Н, т, J=8,4 Гц), 7,83 (1Н, дд, J=7,6 Гц, J'=2,4 Гц), 7,90 (1Н, м).
ВЭЖХ=99,9%
Пример 2. Синтез N-[5-(3-диметиламино-акрилоил)-2фторфенил]-N-метил-ацетамида (I)
75,0 г (0,36 моль) N-(5-ацетил-2-фторфенил)-N-метилацетамида (VI) были растворены в 96,3 мл (86,4 г, 0,72 моль) NNДМФ-ДМА. Полученный раствор нагревался с обратным холодильником в течение 8 часов. При температуре 80°C, были добавлены 400 мл толуола, и затем, при той же самой температуре, медленно добавлялись 400 мл н-гептана. Полученный раствор медленно охлаждался до 15-20°C. Бело-желтоватый осадок, полученный перекристаллизацией, был отфильтрован, отмыт 263 мл смеси толуол: н-гептана (1:1), и затем высушен под вакуумом в 40°C. Был получен бело-желтоватый осадок (84,1 г, выход 91,7%) с точкой плавления равной 131-132°C.
МС (ES) m/z=265 (МН+)
1Н ЯМР (400 МГц, Cl3CD): δ 1,81 (3Н, с), 2,90 (3Н, с), 3,10 (3Н, с), 3,20 (ЗН, с), 5,57 (1Н, д, J=12 Гц), 7,14 (1Н, т, J=8,8 Гц), 7,74-7,85 (3Н, м).
ВЭЖХ=99,7%
Пример 3. Синтез N-{2-фтор-5-[3-(тиофен)-2-карбонил-пиразоло[1,5-а]пиримидин-7-ил]фенил}-N-метилацетамида (II)
Смесь 10 г (0,038 моль) N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метилацетамида (I) и 9,6 г (0,038 моля) (5-амино-1Н-пиразол-4-ил)тиофен-2-ил-метанола (III) в 30 мл ледяной уксусной кислоты была нагрета до 75°C в течение 4 часов. Затем 30 мл изопропанола были добавлены, и выпавший осадок был отфильтрован, отмыт 90 мл изопропанола и высушен под вакуумом при 40°C. Был получен бело-желтоватый осадок (12,9 г, выход 86,5%) с точкой плавления равной 158-159°C.
МС (ES)m/z=395 (МН+)
1Н ЯМР (400 МГц, Cl3CD): δ 1,92 (3Н, с), 3,24 (3Н, с), 7,09 (1Н, д, J=4,4 Гц), 7,12-7,14 (1Н, м), 7,36 (1Н, т, J=8,8 Гц), 7,64 (1Н, д, J=4,8 Гц), 7,97-8,01 (2Н, м), 8,07 (1Н, дд, J=2,0 Гц, J=7,6 Гц), 8,64 (1Н, с), 8,75 (1Н, д, J=4 Гц). ВЭЖХ=99,7%
Изобретение относится к способу получения N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метилацетамида формулы (I). Способ осуществляют путем взаимодействия N-(5-ацетил-2-фторфенил)-N-метилацетамида формулы (VI) с избытком N,N-диметилформамида диметилацеталя (NNДМФ-ДМА) в присутствии неполярного растворителя при температуре от 70 до 90°С. Изобретение раскрывает способ получения соединения N-{2-фтор-5-[3-(тиофен)-2-карбонил-пиразоло[1,5-а]пиримидин-7-ил]фенил}-N-метилацетамида формулы (II), который включает метилирование N-(5-ацетил-2-фторфенил)-ацетамида при температуре от 15 до 50°С, взаимодействие полученного соединения формулы (VI) с NNДМФ-ДМА и реакции полученного соединения (I) с (5-амино-1Н-пиразол-4-ил)тиофен-2-ил-метаноном в ледяной уксусной кислоте при температуре от 60 до 90°С в присутствии алифатического спирта. Также изобретение относится к промежуточному соединению формулы (VI). Технический результат - усовершенствованный способ получения N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метилацетамида, который является промежуточным соединением в синтезе соединений со сродством к рецептору ГАМКА. 3 н. и 12 з.п. ф-лы.



1. Способ получения N-[5-(3-диметиламино-акрилоил)-2-фторфенил]-N-метилацетамида формулы (I)
включающий реакцию соединения формулы (VI)
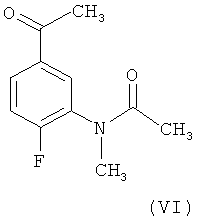
с избытком N,N-диметилформамида диметилацеталя (NNДМФ-ДМА) в соотношении 1,5÷2,5 моля NNДМФ-ДМА на моль соединения (VI) при нагреве с обратным холодильником, сопровождаемую добавлением неполярного ароматического растворителя, выбранного из группы, включающей толуол, о-ксилол, м-ксилол, п-ксилол, этилбензол, стирол, кумол и их смеси, при температуре в пределах от 70 до 90°C, и затем неполярного алифатического растворителя, выбранного из группы, включающей н-гексан, н-гептан, н-октан, 2,5-диметилгексан, циклогексан, метилциклогексан и их смеси, при той же самой температуре.
2. Способ по п.1, в котором отношение NNДМФ-ДМА к соединению (VI) составляет 2 моля на моль соединения (VI).
3. Способ по п.1 или 2, в котором неполярный ароматический растворитель представляет собой толуол.
4. Способ по п.1 или 2, в котором температура равна 80°C.
5. Способ по п.1 или 2, в котором неполярный алифатический растворитель представляет собой н-гептан.
6. Способ по п.1, в котором соединение формулы (VI) получено способом, включающим реакцию соединения формулы (IV)
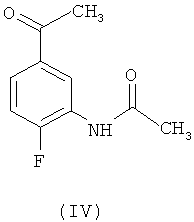
с метилирующим реагентом, выбранным из группы, включающей метил п-толуолсульфоната, метил о-нитробензолсульфоната, метил м-нитробензолсульфоната, метил п-нитробензолсульфоната и метил метансульфоната, в полярном апротонном растворителе, выбранном из группы, включающей ацетонитрил, бензонитрил, диметилформамид, диметилсульфоксид, диоксан, N-метил-2-пирролидон, пропионитрил, тетрагидрофуран и их смеси, при соотношении от 1,0 до 1,5 моль метилирующего реагента на моль соединения (IV), при температуре 15-50°C, сопровождаемую нейтрализацией при той же самой температуре основанием, выбранным из группы, включающей гидроксид натрия, гидроксид калия, гидроксид кальция, углекислый натрий, углекислый калий, углекислый кальций, двууглекислый натрий, двууглекислый калий и двууглекислый кальций, при соотношении от 1,0 до 1,5 молей основания на моль соединения (IV).
7. Способ по п.6, в котором метилирующий реагент представляет собой метил п-толуолсульфонат.
8. Способ по п.6 или 7, в котором соотношение метил п-толуолсульфоната к соединению (IV) составляет 1,1 моль на моль соединения (IV).
9. Способ по п.6 или 7, в котором полярный апротонный растворитель представляет собой ацетонитрил.
10. Способ по п.6 или 7, в котором основание представляет собой гидроксид натрия.
11. Способ по п.10, в котором соотношение гидроксида натрия и соединения (IV) составляет 1,1 моль на моль соединения (IV).
12. Способ по п.6 или 7, в котором температура равна 30°C.
13. Способ получения N-{2-фтор-5-[3-(тиофен)-2-карбонил-пиразоло [1,5-а]пиримидин-7-ил]фенил}-N-метилацетамида (II)

включающий реакцию соединения формулы (IV)
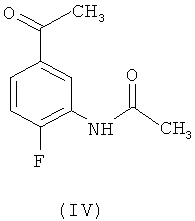
с метилирующим реагентом, выбранным из группы, включающей метил п-толуолсульфоната, метил о-нитробензолсульфоната, метил м-нитробензолсульфоната, метил п-нитробензолсульфоната и метил метансульфоната, в полярном апротонном растворителе, выбранном из группы, включающей ацетонитрил, бензонитрил, диметилформамид, диметилсульфоксид, диоксан, N-метил-2-пирролидон, пропионитрил, тетрагидрофуран и их смесей, при соотношении от 1,0 до 1,5 моль метилирующего реагента на моль соединения (IV), при температуре 10-50°C, сопровождаемую нейтрализацией при той же самой температуре основанием, выбранным из группы, включающей гидроксид натрия, гидроксид калия, гидроксид кальция, углекислый натрий, углекислый калий, углекислый кальций, двууглекислый натрий, двууглекислый калий и двууглекислый кальций, при соотношении от 1,0 до 1,5 молей основания на моль соединения (IV), с образованием соединения формулы (VI),
реакцию полученного соединения формулы (VI)

с избытком N,N-диметилформамида диметилацеталя (NNДМФ-ДМА) в соотношении 1,5÷2,5 моля NNДМФ-ДМА на моль соединения (VI) при нагреве с обратным холодильником, сопровождаемую добавлением неполярного ароматического растворителя, выбранного из группы, включающей толуол, о-ксилол, м-ксилол, п-ксилол, этилбензол, стирол, кумол и их смеси, при температуре в пределах от 70 до 90°C, и затем неполярного алифатического растворителя, выбранного из группы, включающей н-гексан, н-гептан, н-октан, 2,5-диметилгексан, циклогексан, метилциклогексан и их смеси, при той же самой температуре, с образованием соединения формулы (I),
реакцию полученного соединения формулы (I)

с соединением формулы (III)

в ледяной уксусной кислоте при температуре в диапазоне от 60 до 90°C в течение 2-6 ч, и добавления алифатического спирта, выбранного из группы, включающей изопропанол, этиловый спирт, н-пропанол и метанол, с образованием соединения формулы (II).
14. Способ по п.13, в котором
на стадии образования соединения формулы (VI) метил п-толуолсульфонат используют в качестве метилирующего реагента в пропорции 1,1 моль на моль соединения (IV), в качестве полярного апротонного растворителя используют ацетонитрил, температура равна 30°C и гидроксид натрия используют в качестве основания, при соотношении 1,1 моль на моль соединения (IV),
на стадии образования соединения формулы (I) соотношение NNДМФ-ДМА к соединению (VI) составляет 2 моля на моль соединения (VI), в качестве ароматического растворителя используют толуол, температура равна 80°C, и неполярный алифатический растворитель представляет собой н-гептан и
на стадии образования соединения формулы (II) температура равна 75°C, интервал времени составляет 4 ч, и алифатический спирт представляет собой изопропанол.
15. N-(5-ацетил-2-фторфенил)-N-метилацетамид, имеющий формулу (VI)

| Устройство для взвешивания и наклона ложа инкубатора | 1988 |
|
SU1736475A1 |
| Способ получения производных @ -пиразоло /1,5- @ /пиримидина или их солей (его варианты) | 1983 |
|
SU1301315A3 |
| ЭЛЕКТРИЧЕСКАЯ ЛЕБЕДКА | 1927 |
|
SU9519A1 |
| US 6399621 B1, 04.06.2002. | |||
Авторы
Даты
2014-01-10—Публикация
2010-01-11—Подача