Изобретение относится к генетической инженерии и биотехнологии и может быть использовано в производстве сельскохозяйственных культур для конструирования штаммов микроорганизмов, которые найдут применение в сельском хозяйстве.
Известна плазмида, определяющая повышенный синтез пролина.
Недостатком данной плазмиды является то, что она не обеспечивает повышенную осмоустойчивость бактериальной клетки.
Техническим результатом, достигнутым при реализации изобретения, является получение новой плазмиды, обеспечивающей сочетание двух полезных свойств у микроорганизмов повышенного синтеза пролина и повышенной осмоустойчивости.
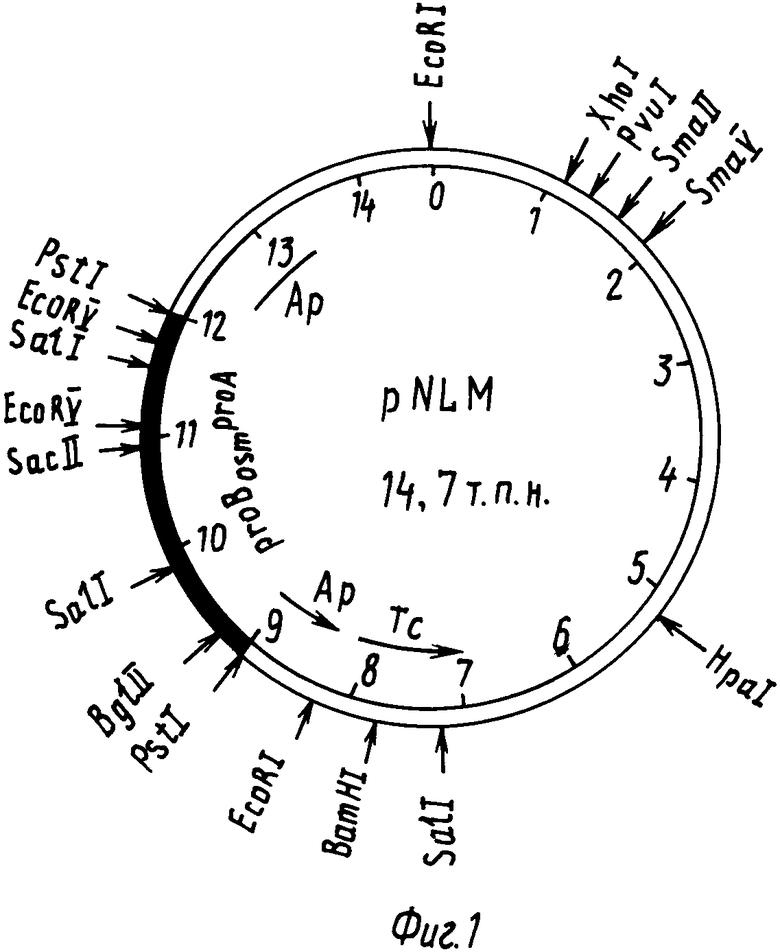
Согласно изобретению получена и идентифицирована новая мутация в гене proB Escherichia coli; мутантный ген proBosm клонирован в составе фазмиды λ pSL51M и реклонирован в составе плазмиды pNLM. Полученная новая рекомбинантная плазмида рNLM имеет размер 14,78 т.п.н. и содержит PstI-фрагмент векторной плазмиды pLM1 размером 11,7 т.п.н. и РstI фрагмент хромосомной ДНК. Е. coli размером 3041 п.н. Этот фрагмент содержит гены биосинтеза пролина proBosmproA.
уникальные сайты EcoRI, PstI, BglII и SalGI,
генетические маркеры:
ген tet, обеспечивающий устойчивость к тетрациклину,
гены proBosmproA, кодирующие ферменты синтеза пролина,
неконъюгативна,
стабильна в 100% клеток при 100 генерациях.
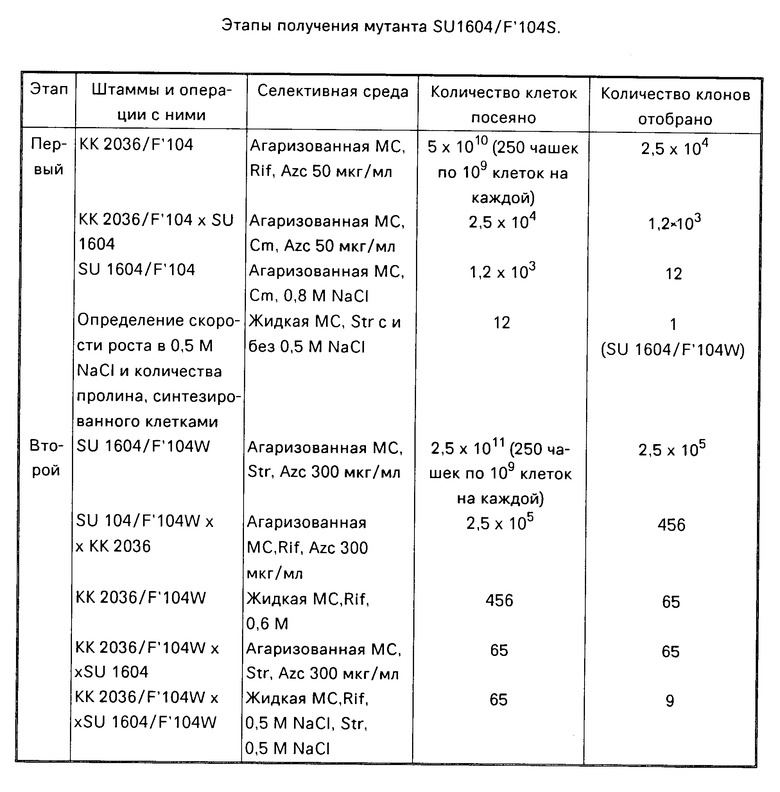
На фиг. 1 представлена физическая карта плазмиды pNLM, указаны известные регуляторные области и существенные для идентификации плазмиды генетические маркеры (закрашенная часть клонированный фрагмент, стрелками указаны сайты, узнавания рестриктаз).
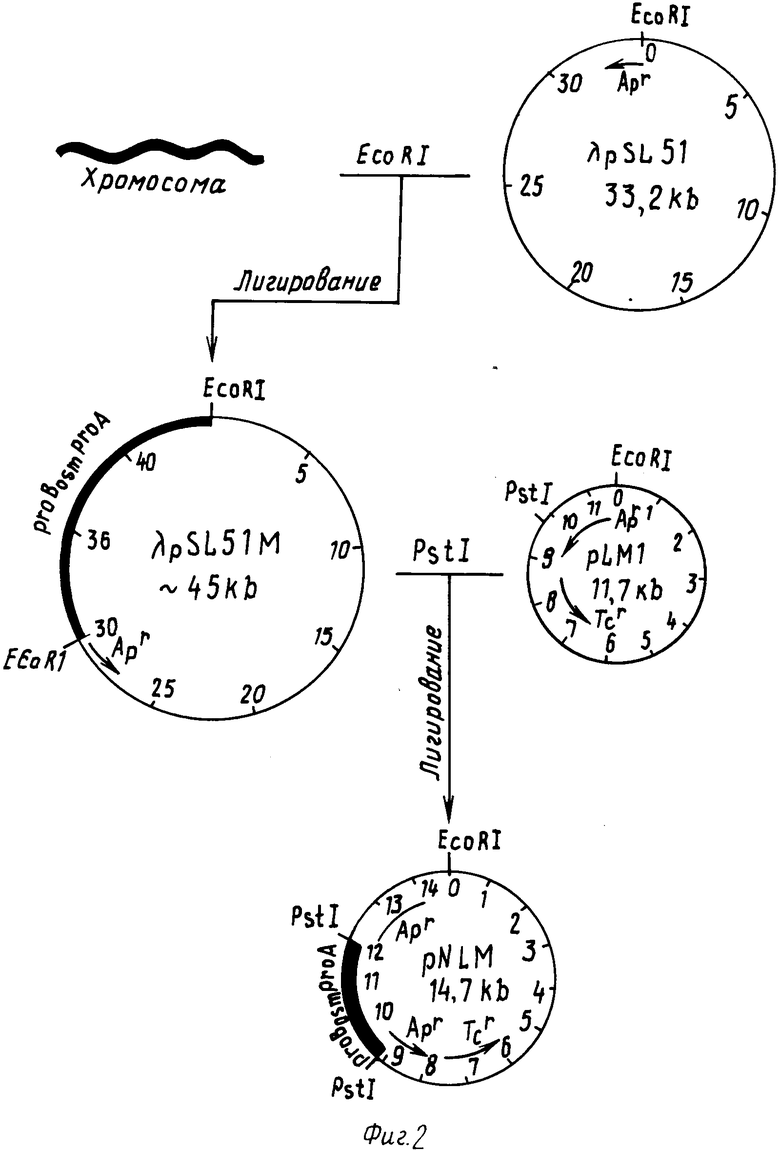
На фиг. 2 представлена схема клонирования и реклонирования оперона proBosmproA.
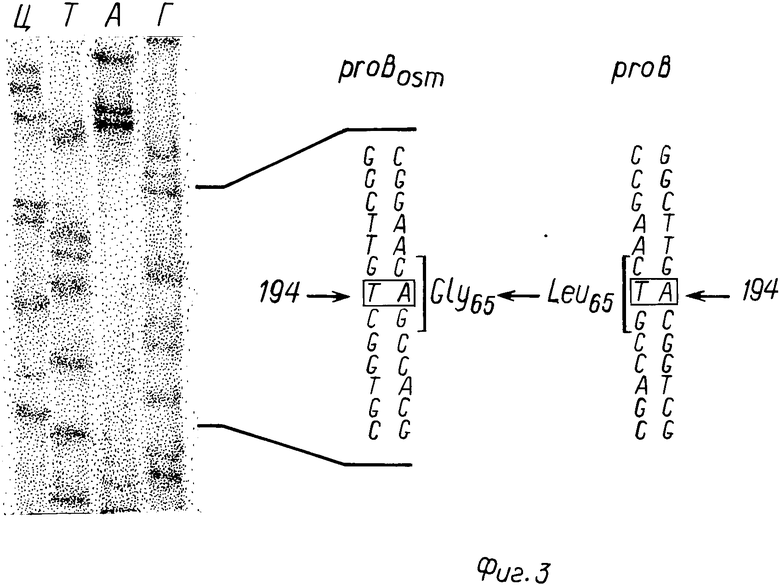
На фиг. 3 представлены результаты определения замены нуклеотида в гене proBosm, изображен автограф фрагментов ДНК в районе мутации, последовательность комплементарных нитей ДНК в данном районе гена proBosm и ее сравнение с аналогичной последовательностью гена proB.
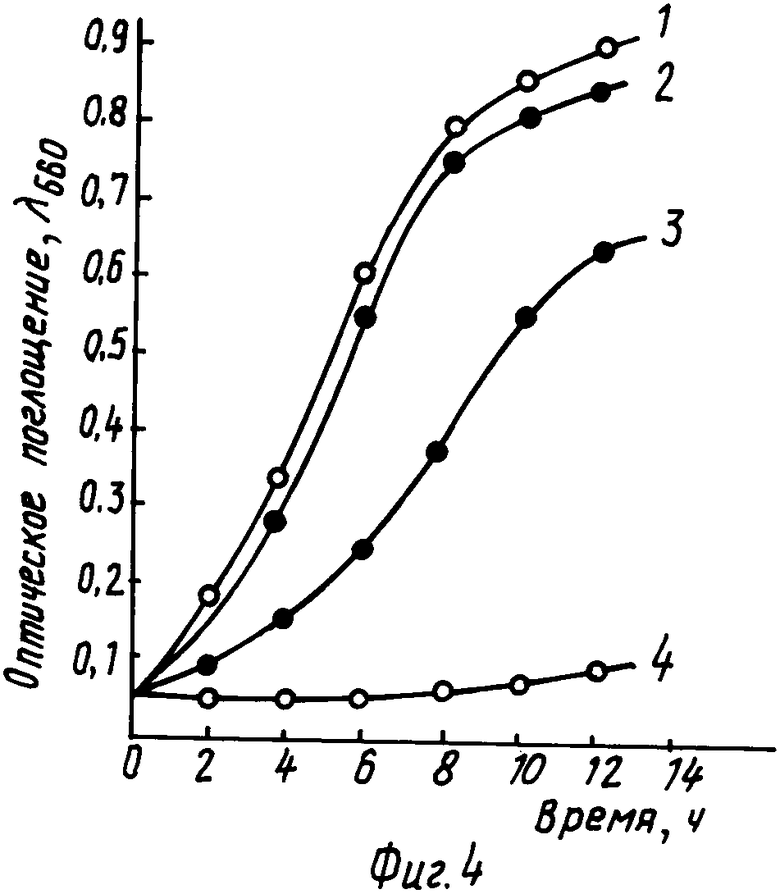
На фиг. 4 графически изображена динамика роста клеток НВ101/pNLM и HB101/pLMpro в минимальной среде без NaCl и с 0,6 М NaCl. Кривая 1 НВ101/pLMpro в минимальной среде без NaCl; 2 HB101/pNLM в минимальной среде без NaCl; 3 HB101/pNLM в минимальной среде с 0,6 М NaCl; 4 HB101/pLMpro в минимальной среде с 0,6 M NaCl.
П р и м е р 1. Получение osm-мутации в гене proB E.coli.
Этапы получения osm-мутации в гене proB приведены в таблице. В начале первого этапа проводят скрещивание клеток реципиентного штамма pro- KK2036 с клетками донорного штамма KL702/F'104. Для этого ночную культуру клеток выращивают в среде LB (10 г триптона, 10 г NaCl и 5 г дрожжевого экстракта на 1 л), разводят в отношении: донорские клетки 1:40, реципиентные клетки 1: 20. Инкубируют их при 37оС до тех пор, пока плотность культуры донора не достигнет 2х108 3х108 клеток/мл. Конъюгационную смесь готовят смешиванием в аналитической пробирке 0,5 мл каждой из культур. Клетки инкубируют 30 мин при 37оС. После инкубации клетки промывают физраствором и высевают по 0,1 мл разведений 10-3, 10-4 и 10-5 на чашки с агаризованной минимальной средой (МС) (Na2HPO4 6 г, КН2РО4 3 г, NH4Cl 1 г, витамин В1 40 мг, глюкоза 40 мг на 1 л) и рифампицином (50 мкг/мл).
Выросшие клетки КК2036/F'104 являются Pro+. Их высевают на МС, содержащую аналог пролина L-азетидин-2-карбоксиловую кислоту (АКК) (50 мкг/мл) и рифампицин. Выросшие клетки являются мутантными по гену proB (γ-глутамилкиназа) и гену putA (пролиновая пермеаза). Отделения мутантов по гену proB от мутантов по гену putA проводят скрещивание клеток штамма КК2036/F'104 с клетками штамма SU1604. Скрещивание проводят на чашках Петри с помощью репликатора. Для этого 100 мкл клеток реципиентного штамма SU1604 растирают шпателем на чашки с МС, содержащей хлорамфеникол (100 мкг/мл) и 50 мкг АКК. На полученный газон репликатором наносят донорские клетки КК2036/F'104. Выросшие клетки SU1604/F'104 высевают на агаризованную МС, содержащую хлорамфеникол и 0,8 М NaCl. Клетки выросших клонов выращивают в жидкой МС, содержащей стрептомицин (100 мкг/мл) и 0,5 М NaCl. Определяют скорость роста клеток каждого клона и отбирают самый быстрорастущий. Клетки этого клона обозначили SU1604/F'104W и использовали для второго этапа отбора (таблица).
На втором этапе отбора клетки SU1604/F'104W, выращенные в течение ночи, высевают на агаризованную МС, содержащую стрептомицин и Act 300 мкг/мл. Выросшие клетки SU1604/F'104 скрещивают с клетками КК2036 с помощью репликатора на чашки с МС-агаром, содержащим 300 мкг/мл Асt и рифампицином (100 мкг/мл). Клетки выросших 456 клонов КК2036/ /F'104W выращивают в жидкой МС, содержащей рифампицин и 0,6 М NaCl. Выросшие 65 клонов скрещивают с клетками SU1604 с помощью репликатора на агаризованную МС, содержащую 300 мкг/мл Azt и 100 мкл/мл стрептомицина. Клетки выросших 65 клонов SU1604/F'104W высевают в жидкую МС, содержащую стрептомицин и 0,5 М NaCl. Клетки выросших клонов выращивают на той же среде с 0,6 М NaCl и определяют их скорость роста. Среди них отбирают 1 с наибольшей скоростью роста и использовали его для дальнейшего изучения. Клон обозначили SU1604/F'104S (таблица).
Определение уровня синтеза пролина данными клетками показало, что они синтезируют пролина в 500 раз больше, чем клетки, содержащие ген proB дикого типа. Результаты экспериментов по локализации мутации показали, что в гене proBosm произошла замена Т на А в положении 194, что приводит к замене Лей на Гли в положении 65 аминокислотной последовательности γ-глутамилкиназы, кодируемой данным геном (фиг.3).
П р и м е р 2. Клонирование гена proBosm. Конструирование рекомбинантной плазмиды pNLM.
Схема конструирования рекомбинантной плазмиды pNLM приведена на фиг. 2. Суммарную хромосомную ДНК штамма SU1604/F'104S подвергают полному гидролизу рестриктазой EcoRI путем инкубации 0,1 мкг ДНК со 100 ед. фермента в общем объеме смеси 100 мкл, содержащей трис-HCl 100 мМ рН 7,5; NaCl 50 мМ и MgCl 10 мМ в течение ночи (14 ч) при 37оС. Полученную смесь обрабатывают фенолом, ДНК из водной фазы осаждают добавлением 10 мкл Na-ацетата (рН 8,0) в 200 мкл этанола. Осадок ДНК растворяют в буфере для легирования.
Аналогичным образом гидролизуют 10 мкл ДНК фазмиды λ pSL51. Гидролиз ведут в объеме 50 мкл в течение 1 ч. 20 мкл гидролизованной хромосомной ДНК сливают с 2 мкл гидролизованной ДНК фазмиды λ pSL51, добавляют 1,5 мкл буфера для легирования (0,5 М трис-HCl рН 7,9; 0,1 М MgCl2; 0,1 М DTT, 1 мМ АТМ), 1 мкл и инкубировали 18 ч при 16оС.
Полученную рекомбинантную фазмиду λ pSL51M передают методом трансформации в клетки лизогенного штамма Е.coli КК2036 (λ+) pro-A-. Для этого к полученной лигазной смеси добавляют 100 мкл компетентных клеток штамма НВ 101 proB-A-, инкубируют 30 мин при 4оС, затем 2 мин при 42оС, добавляют 1 мл L-бульона и инкубируют 1 ч при 37оС. После подращивания клетки промывают в 5 мл МС и высевают на агаризованную МС, содержащую ампициллин (100 мкл/мл). Выросшие клоны рассеивают до отдельных колоний, из которых выращивают ночную культуру для выделения ДНК. Выделенную фазмидную ДНК используют для реклонирования оперона proBosmproA.
Для реклонирования оперона proBosmproA фазмиду λ pSL51М гидролизуют рестриктазой PstI. Для этого к 10 мкл фазмидной ДНК добавляют 20 ед. рестриктазы. Общий объем смеси равен 50 мкл. Она содержит трис-HCl рН 7,5 мМ; 100 мМ NaCl, 10 мМ MgCl2; 100 мкг/мл альбумин. Аналогичным образом рестрикцируют ДНК плазмиды рLM1. Рестрикцированную ДНК обрабатывают фенолом и осаждают этанолом, как описано выше. Осадок ДНК растворяют в буфере для легирования и проводят легирование. Гибридную плазмиду pNLM переносят методом трансформации в клетки штамма E.coli HB101 и высевают на чашки с агаризованной МС, содержащей 10 мкг/мл тетрациклина и инкубируют при 37оС в течение ночи. Из выросших клонов выделяют плазмидную ДНК для анализа.
П р и м е р 3. Построение физической карты плазмиды pNLM.
1-5 мкг ДНК плазмиды подвергают гидролизу соответствующей рестриктазой в условиях, рекомендованных заводом-изготовителем. По окончании гидролиза смесь фрагментов ДНК обрабатывают фенолом (рН 7,0) и осаждают этанолом. Для последующего гидролиза ДНК растворяют в буфере, рекомендованном для соответствующей рестриктазы. Смесь фрагментов ДНК фракционируют в 0,7%-ном агарозном геле в трис-боратном буфере при напряженности электрического поля 2-3 В/см (фиг.1).
П р и м е р 4. Анализ осмоустойчивости штамма Е.coli HB101/pNLM.
Проверку осмоустойчивости рекомбинантного штамма Е. coli HB 101/pNLM проводят в МС, содержащей 0,6 М NaCl. Увеличение количества клеток в процессе роста бактериальной культуры определяют с помощью измерения поглощения света в ФЭК с зеленым фильтром N6 (λ560 нм) в кювете объемом 1 мл. Плотность клеток измеряют через каждые 2 ч в течение 14 ч. За скорость роста (генерация/ч) принимали время удвоения количества клеток в лагарифмической фазе роста.
Усредненные данные трех независимых экспериментов приведены на фиг. 4. В качестве контроля используют рекомбинантные клетки НВ101/pLMpro, содержащие плазмиду pLMpro. Эта плазмида аналогична по размеру и структуре плазмиде pNLM, но содержит оперон proBA дикого типа. Скорость роста клеток НВ101/pNLM в МС без NaCl составляет 0,6 генерации/ч, а клеток НВ101pLMpro 0,8 генерации/ч. В МС с 0,6 М NaCl скорость роста HB101/pNLM составляет 0,43 генерации/ч, а НВ101/pLMpro 0,07 генерации/ч.
Таким образом, полученная рекомбинантная плазмида pNLM определяет не только повышенный уровень синтеза пролина, но также и повышенный уровень осмоустойчивости клеток бактерий. Эта плазмида может быть использована для конструирования рекомбинантных штаммов различных полезных бактерий, перспективных для применения в сельском хозяйстве.

Назначение: изобретение относится к генетической инженерии и биотехнологии и может быть использовано в производстве сельскохозяйственных культур для конструирования штаммов микроорганизмов, которые найдут применение в сельском хозяйстве. Сущность изобретения: сконструирована рекомбинантная плазмида pNLM размером 14,7 т.п.н. которая обеспечивает повышенный синтез пролина и повышенную осмоустойчивость бактериальной клетки. Плазмида содержит PstI фрагмент векторной плазмиды pLMI размером 11,7 т.п.н и PstI фрагмент хромосомной ДНК фактора F'104 штамма E. coli SU 1604 размером 3041 п.н. Фрагмент содержит гены биосинтеза пролина pro F′104 pro A, сайты eco PI, PstI, BgIII и SalGI, генетические маркеры ген tet, обеспечивающий устойчивость к тетрациклину. Плазмида стабильна в 100% клеток при 100 генерациях. 4 ил. 1 табл.
РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PNLM, КОДИРУЮЩАЯ ПРОЛИН, размером 14,7 т. п. н. содержащая PstI фрагмент вектора pLM 1 размером 11,7 т.п.н. Pst I - фрагмент хромосомной ДНК фактора F ' 104 штамма E.coli Su 1604 размером 3041 п.н. сайты рестрикции два участка расщепления рестриктазой Sal I, расположенных на расстоянии 1509 п.н. один от другого; два участка расщепления рестриктазой Eco PV, расположенных на расстоянии 989 п.н. один от другого; один участок расщепления рестриктазой Cla I, расположенный на расстоянии 1747 п. н. против часовой стрелки от левого Pst I-сайта; один участок расщепления рестриктазой Bgl II, расположенный на расстоянии 2981 п.н. от левого Pst I-сайта; регуляторные элементы промотор, последовательность Шайно Долгарно и терминатор оперона pro Bosm pro A, генетические маркеры ген tet обеспечивающий устойчивость к тетрациклину.
| J | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| Упругое экипажное колесо | 1918 |
|
SU156A1 |
Авторы
Даты
1995-07-20—Публикация
1992-12-15—Подача