Область техники, к которой относится изобретение
Это изобретение относится к способам сохранения целостности пептидов в пищеварительном канале. В частности, оно касается применения определенных соединений в качестве ингибиторов протеаз пищеварительного канала.
Уровень техники
Нижеследующее обсуждение уровня техники имеет целью лишь облегчение понимания настоящего изобретения. Обсуждение не является признанием или допущением того, что какие-либо из упоминаемых данных являются или были частью общеизвестного уровня техники на момент даты приоритета заявки.
Пептиды, в частности полипептиды, такие как белки, становятся все более и более признанными желательными средствами для лечения заболеваний, развивающихся в пищеварительном канале (желудочно-кишечном тракте). Белковая терапия часто основана на натуральных продуктах с долгой историей лекарственного применения, которые имеют более высокие показатели безопасности, чем малые молекулы, которые были недавно синтезированы и чье влияние на организм в значительной степени неизвестно. Кроме того, белки могут демонстрировать высокую степень специфики и селективности и в то же время могут быть разработаны таким образом, чтобы использовать преимущество их большого размера для проявления мультифункциональности, позволяя им взаимодействовать одновременно с двумя или более различными мишенями.
Белки с антиоксидантной активностью, такие как супероксид-дисмутаза, являются примерами таких терапевтических применений. Другими примерами являются моноклональные антитела, которые могут действовать как противоинфекционное средство путем связывания с сайтами инфекционных организмов, внедряющихся в пищеварительный канал. Альтернативно, такие антитела могут связывать рецепторные сайты интестинальных клеток и препятствовать процессам адгезии и образования колоний инфекционных организмов. Кроме того, эти антитела могут взаимодействовать с клетками иммунной системы для стимулирования их активности в противодействии инфекционным заболеваниям. Другие типы терапевтических пептидов включают пептидные гормоны, такие как подавляющие аппетит средства.
Одной серьезной помехой к применению пептидов в кишечнике является их крайняя восприимчивость к протеазам пищеварительного канала. Эти протеазы могут быть найдены как в желудке (например, пепсин), так и в верхних отделах кишечника и служат для обеспечения расщепления в пищеварительном тракте пептидов проглоченной пищи протеолизом на аминокислоты, которые могут поглощаться как питательные вещества в рецептор-опосредованных механизмах.
Если предполагаемое место приложения действия терапевтического или профилактического пептида является тонким кишечником, тогда пептид может быть защищен от разрушения в желудке путем помещения его внутрь покрытой энтеросолюбильной оболочкой капсулы, таблетки или другого средства, которое устойчиво к растворению при низких значениях рН, имеющихся в желудке, но распадается при более высоких рН для высвобождения пептида в тонком кишечнике, например, двенадцатиперстной кишке, тонкой кишке или подвздошной кишке. Однако действие протеаз, находящихся в тонком кишечнике (в особенности сериновых протеаз, трипсина, химотрипсина, эластазы и карбоксипептидазы), является таким, что они могут быстро разрушить и уничтожить пептиды, и средства предотвращения их разрушения протеазами могли бы заметно усилить их эффективность.
Несмотря на то что имеется много средств, действующих как ингибиторы протеаз, которые известны специалисту в области техники, немного, если таковые есть вообще, являются пригодными для такого именно применения. Большинство известных ингибиторов, например антипаин, лейпептин, используются только для исследовательских целей и не пригодны для введения человеку. Некоторые ингибиторы, например диизопропилфторфосфат или фенилметилсульфонилфторид имеют высокий уровень эффективности, но имеют очень широкий спектр действия, таким образом, имеется риск их нежелательного воздействия на другие части тела в дополнение к пищеварительному каналу. С другой стороны, другие ингибиторы, такие как новый класс ингибиторов протеаз, используемый в лечении HIV, являются настолько селективными по виду протеаз, которые ингибируют, что не оказывают влияния на сериновые протеазы в пищеварительном канале. Два ингибитора сериновых протеаз, которые могут вводиться людям, являются апротинином и трипсиновым ингибитором из соевых бобов. Однако они относительно дороги при синтезе и должны быть включены в лекарственное средство в таком количестве, что стоимость конечного продукта будет препятствовать производству лекарственного средства для рутинного ежедневного применения.
Настоящее изобретение стремится решить или по меньшей мере улучшить одну или более из проблем, связанных со средствами, имеющимися в известном уровне техники.
Описание изобретения
Авторы изобретения установили, что определенные соединения, чье взаимодействие с протеазами пищеварительного канала не было ранее признано, как ни удивительно, ингибируют протеазы пищеварительного канала. Это делает возможным их применение для защиты пептидов от протеолиза (то есть расщепления протеазами пищеварительного канала). Соединения, идентифицированные как имеющие такую активность, являются бигуанидами, определенными желчными кислотами и фармацевтически приемлемыми солями этих соединений.
Следовательно, настоящее изобретение предоставляет соединение для применения в качестве ингибитора одной или более протеаз пищеварительного канала, где соединение является желчной кислотой, бигуанидом или фармацевтически приемлемой солью желчной кислоты или бигуанида, где указанная желчная кислота имеет формулу (I)
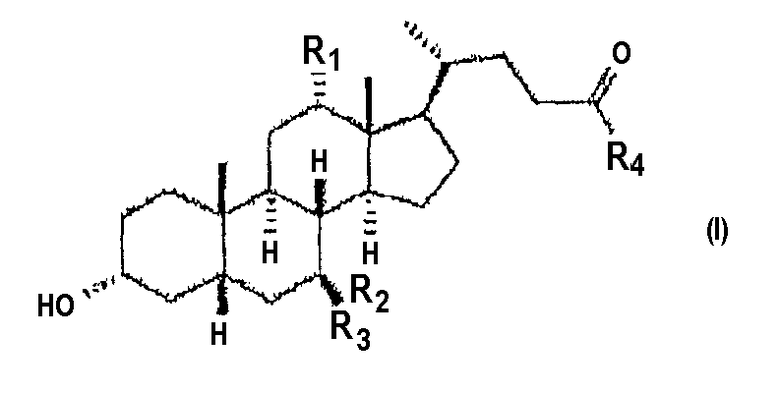
где R1, R2 и R3, каждый, выбраны из -H и -OH и R4 выбран из -OH и -NHCH2CO2H, где, если R1 и R2 являются OH и R3 является H, тогда R4 должен быть -NHCH2CO2H.
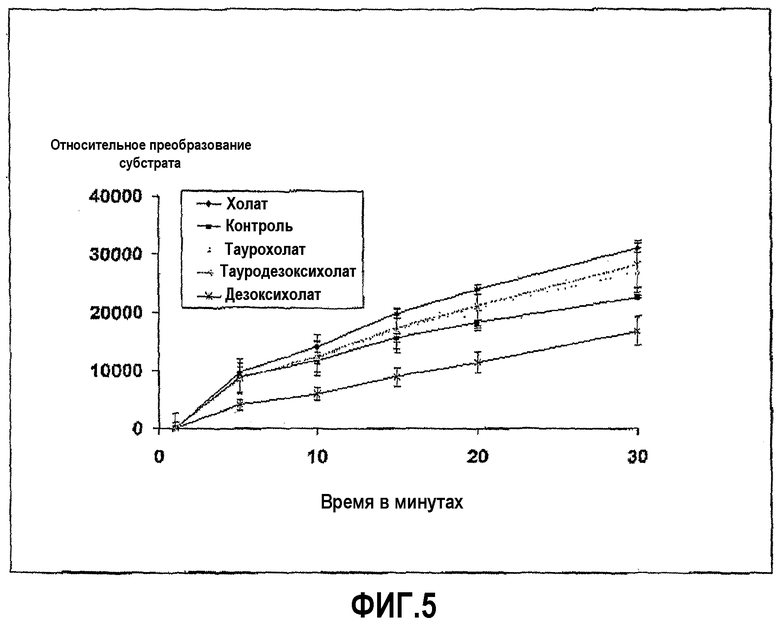
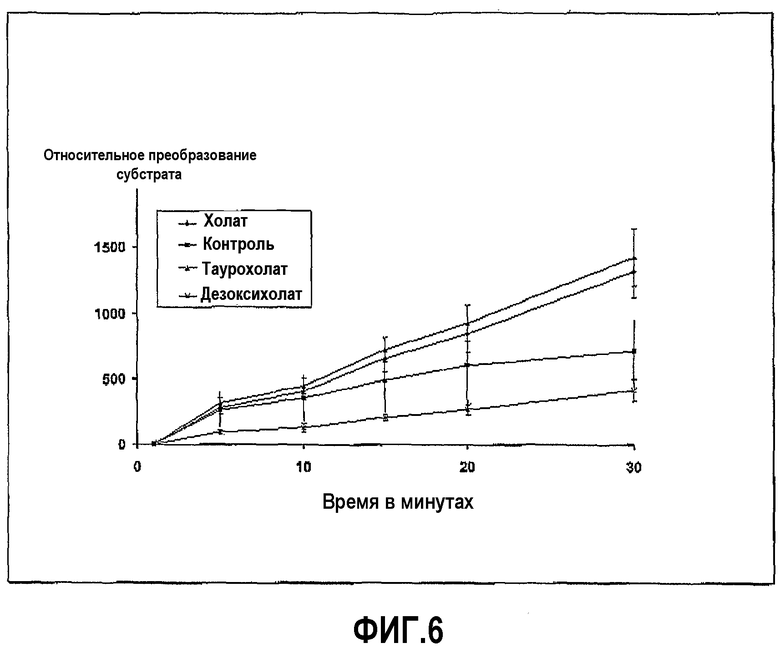
Механизм, по которому соединения по изобретению ингибируют протеазы пищеварительного канала, является структура-специфическим, предположительно результатом прямого связывающего взаимодействия между соединением и рецепторными сайтами на протеазах. Доказательством этого является тот факт, что другие желчные кислоты, такие как холевая кислота, таурохолевая кислота и тауродезоксихолевая кислота, не имеют такого ингибирующего эффекта (см. фиг.5 и 6). Так, несмотря на то что ингибирующий эффект проявляется при относительно высоких концентрациях желчной кислоты, бигуанид, или его производные, один может исключить неспецифические пути ингибирования, основанные на, например, поверхностном взаимодействии или изменении рН. При определенных условиях ингибирование протеазной активности может достигать 100%.
Ингибирующая активность может быть продемонстрирована с использованием флуорогенных или хромогенных пептидных субстратов. Ингибирующие эффекты могут наблюдаться для диапазона различных пептидных субстратов, означая, что эффект не является результатом специфического взаимодействия между пептидным субстратом и ингибитором.
Как замечено выше, соединения по настоящему изобретению служат для применения в качестве ингибиторов одной или более протеаз пищеварительного канала. Обычно они ингибируют все протеазы пищеварительного канала, то есть они служат для применения в ингибировании протеаз пищеварительного канала в целом. Термин «протеазы пищеварительного канала» относится к тем протеазам, которые найдены в пищеварительном канале. В этом случае и во всех других случаях, когда в этой заявке используется термин «пищеварительный канал», он обозначает желудочно-кишечный тракт и предпочтительно обозначает тонкий кишечник, такой как двенадцатиперстная кишка, тонкую кишку или подвздошную кишку.
Так, предпочтительно протеазы пищеварительного канала являются протеазами тонкого кишечника, то есть протеазами, найденными в тонком кишечнике. Предпочтительно протеазы являются сериновыми протеазами. Указанные сериновые протеазы могут быть выбраны из трипсина, химотрипсина, эластазы, карбоксипептидазы и их комбинаций. В основном, соединение по настоящему изобретению служит для применения для ингибирования протеолиза пептида в основном в пищеварительном канале указанными одной или более протеазами.
Когда соединение по настоящему изобретению является желчной кислотой формулы (I) или ее фармацевтически приемлемой солью, предпочтительно по меньшей мере один из R2 и R3 является -Н. Также предпочтительно, что по меньшей мере один из R1, R2 и R3 является -ОН. Также предпочтительно, что не более чем два из R1-R4 являются -ОН. В основном, соединение по настоящему изобретению является желчной кислотой формулы (I), где
- по меньшей мере один из R2 и R3 является -Н,
- по меньшей мере один из R1, R2 и R3 является -ОН и
- не более чем два из R1-R4 являются -ОН,
или ее фармацевтически приемлемой солью. Более предпочтительно оно является желчной кислотой или солью, выбранной из хенодезоксихолевой кислоты, дезоксихолевой кислоты, урсодезоксихолевой кислоты, гликохенодезоксихолевой кислоты, гликодезоксихолевой кислоты, гликохолевой кислоты и их фармацевтически приемлемых солей. Более предпочтительно оно выбрано из хенодезоксихолевой кислоты, дезоксихолевой кислоты и их фармацевтически приемлемых солей. Наиболее предпочтительно оно является хенодезоксихолатом или его фармацевтически приемлемой солью.
Когда упоминаются фармацевтически приемлемые соли желчных кислот, то может быть использован соответствующий фармацевтически приемлемый положительно заряженный ион. В основном используется щелочной металл, такой как натрий или калий. Альтернативно могут быть использованы противоионы, например ион аммония, хотя это и является менее предпочтительным. Когда соединение по настоящему изобретению является желчной кислотой или ее фармацевтически приемлемой солью, соль обычно используется более предпочтительно, чем кислота, хотя те же самые виды анионов образуются в пищеварительном канале в любом случае; представлена ли соль или кислота, сопряженная с основанием, зависит от рН среды.
Когда соединение по настоящему изобретению является бигуанидом или его фармацевтически приемлемой солью, предпочтительно бигуанид имеет следующую формулу:
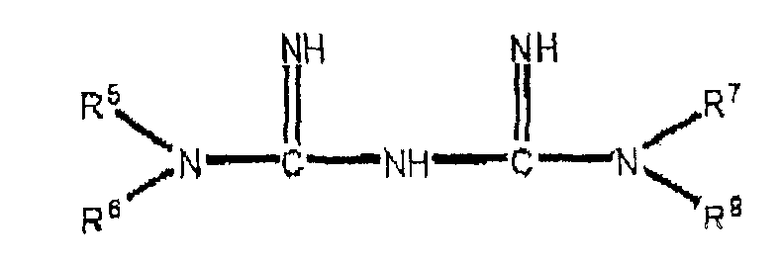
где R5, R6, R7 и R8 являются каждый независимо выбранными из водорода, необязательно замещенного алкила, необязательно замещенного фенила, этиленгликоля, диэтиленгликоля, триэтиленгликоля и тетраэтиленгликоля, за исключением того, что один из R5, R6, R7 и R8 может быть
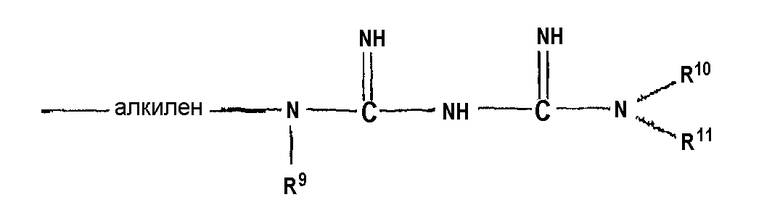
где R9, R10 и R11 являются каждый независимо выбранными из водорода, необязательно замещенного алкила, необязательно замещенного фенила, этиленгликоля, диэтиленгликоля, триэтиленгликоля и тетраэтиленгликоля.
Предпочтительно, когда необязательно замещенные алкильные и фенильные группы замещены, 1-3 заместителя присутствуют и заместители выбраны из галогена, гидрокси и амино. Алкильные или алкиленовые группы могут быть насыщенными или ненасыщенными, с прямой или разветвленной цепью и предпочтительно имеющими от 1 до 6 углеродов. Алкиленовые группы являются в основном насыщенными и также в основном имеют прямую цепь. Наиболее предпочтительно в этом варианте осуществления бигуанид является метформином, фенформином или хлоргексидином или их фармацевтически приемлемыми солями. Фармацевтически приемлемые соли являются, соответственно, хлоридом, бромидом, иодидом или солями органических кислот, такими как ацетат, пропионат, мезилат (метилсульфонат) или глюкуронат.
Способность соединений по изобретению ингибировать протеазы пищеварительного канала и, в частности, их способность ингибировать протеолиз пептидов протеазами пищеварительного канала делает их особенно удобными для совместного введения с пептидами с профилактической или терапевтической активностью против заболеваний или состояний, когда мишенью для пептида является пищеварительный канал, например, заболевания или состояния пищеварительного канала или такого, которое обнаруживается в пищеварительном канале. В этом аспекте изобретения соединения по настоящему изобретению могут быть скомбинированы с пептидом перед введением, в фармацевтической композиции. Альтернативно соединения по настоящему изобретению могут быть введены раздельно с пептидом, протеолиз которого подлежит ингибированию, до тех пор, пока оба из них в одно время присутствуют в пищеварительном канале, таким образом, что ингибирование протеолиза имеет протективный эффект для пептида.
Настоящее изобретение также предоставляет способ ингибирования одной или более протеаз, который является в основном способом ингибирования протеолиза пептида (в основном в пищеварительном канале) одной или более протеазами пищеварительного канала, способ, который включает введение субъекту соединения по настоящему изобретению или фармацевтической композиции по настоящему изобретению.
В целом настоящее изобретение связано с лечением людей, например, где упоминается «пищеварительный канал», это обычно относится к пищеварительному каналу человека, несмотря на то что один аспект изобретения связан с лечением не являющихся человеком животных. В связи с этим субъект, в отношении которого настоящее изобретение может найти лекарственное применение, включает, в качестве иллюстрации людей, млекопитающих, животных-компаньонов и птиц.
Соответственно, настоящее изобретение также предоставляет продукт, содержащий (а) соединение по настоящему изобретению, как описано здесь, и (b) пептид, где (а) и (b) приготовлены для одновременного, раздельного или последовательного применения в лечении или предотвращении заболевания или состояния, в основном заболевания или состояния пищеварительного канала.
В одном аспекте настоящее изобретение предоставляет фармацевтическую композицию, включающую соединение по настоящему изобретению вместе с пептидом (протеолиз которого подлежит ингибированию соединением по настоящему изобретению). В основном в этом варианте осуществления концентрация соединения по настоящему изобретению в композиции составляет по меньшей мере 20 мг/мл. Обычно это 100 мг/мл или менее. Концентрация пептида, очевидно, зависит от природы и предполагаемого эффекта пептида и от возраста, размера и анамнеза пациента.
Когда соединение по настоящему изобретению, как определено выше, является желчной кислотой или ее фармацевтически приемлемой солью, его концентрация в композиции составляет предпочтительно 20-100 мг/мл. Дополнительно, желчная кислота или ее фармацевтически приемлемая соль может быть представлена в композиции в количестве по меньшей мере 50% масс., предпочтительно от 60 до 95% масс. и более предпочтительно от 80 до 90% масс.
Другой аспект изобретения предоставляет фармацевтическую композицию, включающую
(i) пептид или полипептид; и
(ii) соединение, выбранное из урсодезоксихолевой кислоты, гликохенодезоксихолата, гликодезоксихолата, гликохолата и их фармацевтически приемлемых солей,
где указанное соединение представлено в композиции в концентрации от 20 до 100 мг/мл. Несмотря на то что желчные кислоты и их производные в компоненте (ii) известны, они никогда ранее не применялись в таких высоких концентрациях.
В еще одной форме изобретение относится к применению (i) пептида или полипептида и (ii) желчной кислоты или ее фармацевтически приемлемой соли для получения лекарственного средства, где указанная желчная кислота или ее фармацевтически приемлемая соль представлена в композиции в концентрации от 20 до 100 мг/мл, и композиция составлена для доставки через кишечник.
В этой форме по изобретению желчная кислота является предпочтительно одной или более из урсодезоксихолевой кислоты, гликохенодезоксихолата, гликодезоксихолата, гликохолата и их фармацевтически приемлемых солей.
Когда соединение по настоящему изобретению, как определено выше, является бигуанидом или его фармацевтически приемлемой солью, его концентрация составляет предпочтительно 20-100 мг/мл. Более того, бигуанид или его фармацевтически приемлемая соль могут быть представлены в композиции в количестве по меньшей мере 50% масс., предпочтительно от 60 до 95% масс. и более предпочтительно от 80 до 90% масс.
Другой аспект изобретения предоставляет фармацевтическую композицию, включающую
(i) пептид или полипептид; и
(ii) соединение, выбранное из метформина, фенформина или хлоргексидина или их фармацевтически приемлемых солей,
где указанное соединение представлено в композиции в концентрации от 20 до 100 мг/мл.
В еще одной форме изобретение относится к применению (i) пептида или полипептида и (ii) бигуанида или его фармацевтически приемлемой соли для получения лекарственного средства, где указанный бигуанид или его фармацевтически приемлемая соль представлены в композиции в концентрации от 20 до 100 мг/мл, и композиция составлена для доставки через кишечник.
В этой форме по изобретению бигуанид является предпочтительно одним или более из метформина, фенформина или хлоргексидина или их фармацевтически приемлемых солей.
Обычно фармацевтическая композиция по настоящему изобретению подходит для перорального введения. В этом варианте осуществления для успешного применения соединения по изобретению для защиты пептида от деградации протеазами пищеварительного канала желательно для соединения по изобретению быть одновременно введенным с пептидом внутри основы, которая делает возможным интактное прохождение через желудок. Такая основа может быть таблеткой, капсулой или драже, покрытыми в случае необходимости энтеросолюбильной пленкой, которая устойчива к растворению при условиях, присутствующих в желудке, но которая способна разрушаться и высвобождать содержимое в тонком кишечнике. Поскольку изобретение разработано как таблетки, они могут быть непокрытыми или покрытыми с использованием известных техник для задержки распада и всасывания в кишечнике и, таким образом, предоставления поддерживающего действия в течение длительного периода. Например, может быть использован такой обеспечивающий отставание по времени материал, как глицерил моностеарат или глицерил дистеарат.
Фармацевтические композиции по настоящему изобретению, которые подходят для перорального введения, являются предпочтительно покрытыми энтеросолюбильным покрытием, которое становится растворимым при рН от 3 до 7. Более предпочтительно покрытие становится растворимым при рН от 4 до 6,5 и наиболее предпочтительно от 5 до 6. Подходящие энтеросолюбильные покрытия известны в области техники. Соединения по настоящему изобретению обычно разработаны с таким энтеросолюбильным покрытием.
Фармацевтическая композиция по настоящему изобретению может содержать другие стандартные фармацевтические вспомогательные вещества в смеси для предоставления композиции в форме порошка, жидкости, геля, пасты, воска или суспензии. Например, фармацевтические вспомогательные вещества, допускающие усиление разжижения соединения по изобретению или пептида, или которые действуют как антиоксиданты, консерванты, вещества, способствующие скольжению (например, стеарат магния, стеариновая кислота или тальк), вещества, способствующие набуханию, дезинтегрирующие средства (например, кукурузный крахмал или альгиновая кислота), связывающие вещества (например, крахмал, желатин или камедь) и так далее могут быть также включены в фармацевтические композиции по настоящему изобретению.
Как используется здесь, термин «пептид» относится к амиду, получаемому из двух или более молекул аминокарбоксильных кислот, которые могут быть одинаковыми или разными, путем формирования ковалентной связи от карбонильного углерода одной к атому азота другой с формальной потерей воды. Молекулы аминокислот могут быть D- или L-формы. Обычно пептиды получаются из α-аминокислот, но они также могут быть получены из не α-аминокислот или из смеси α-аминокислот и не α-аминокислот. Предпочтительно пептиды получают из природных аминокислот. В одном аспекте аминокислоты получаемы или получены путем химической модификации природных аминокислот после того, как синтезирован пептид.
В одном варианте осуществления пептиды являются полипептидами, то есть пептидами с 10 или более аминокислотными остатками. В предпочтительном аспекте этого варианта осуществления полипептид является белком. В другом варианте осуществления пептид имеет 2-9 аминокислотных остатков.
Иллюстративные пептиды и полипептиды, которые имеют особенную применимость по настоящему изобретению, включают такие молекулы, как инсулин; кальцитонин; человеческий сывороточный альбумин; гормон роста; факторы, стимулирующие выделение гормона роста; галанин; гормон паращитовидной железы; пептид YY; оксинтомодулин; белки свертывания крови, такие как киноген, протромбин, фибриноген, Фактор VII, Фактор VIII или Фактор IX; эритропоэтины и EPO миметики; колониестимулирующие факторы, включая GCSF и GMCSF; тромбоцитарные факторы роста; эпидермальные факторы роста; факторы роста фибробластов; трансформирующие факторы роста; GLP-I, GLP-2; эксендин; лептин; GAG; цитокины; инсулинподобные факторы роста; кость- и хрящ-индуцирующие факторы; нейротрофические факторы; интерлейкины, включая IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; интерфероны, включая интерферон-гамма, интерферон-Ia, интерферон-альфа; TNF-альфа; TNF-бета; TGF-бета; фрагменты A и B холерного токсина; фрагменты A и B энтеротоксина E. coli; секретин; ферменты, включая гистон деацетилазу, супероксид дисмутазу, каталазу, аденозин деаминазу, тимидинкиназу, цитозин деаминазу, протеазы, липазы, карбогидразы, нуклеотидазы, полимеразы, киназы и фосфатазы; транспортные или связывающие белки, особенно те, которые связывают и/или транспортируют витамин, ион металла, аминокислоту, или липид или липопротеин, такие как белок-переносчик сложных эфиров холестерина, белок-переносчик фосфолипидов, HDL связывающий белок; белки соединительной ткани, такие как коллаген, эластин или фибронектин; белок мышц, такой как актин, миозин, дистрофин или минидистрофин; нейрональные, печеночные, сердечные или адипоцитные белки; цитостатический белок; цитохром; белок, который в состоянии вызвать репликацию, рост или дифференцировку клеток; сигнальная молекула, такая как внутриклеточный сигнальный белок или внеклеточный сигнальный белок (например, гормон); трофические факторы, такие как BDNF, CNTF5NGF, IGF, GMF, aFGF, bFGF, VEGF, NT3, T3 и HARP; аполипопротеины; молекулы антител; рецепторы в растворимой форме, такие как T-клеточные рецепторы и рецепторы для цитокинов, интерферонов или хемокинов; белки или пептиды, содержащие аллергенные антигенные детерминанты и фрагменты; и производные, конъюгаты и разновидности последовательности любого из вышеупомянутых. Эти и другие белки могут быть получены из человеческого, растительного, животного, бактериального или грибкового источников и экстрагированы из естественных источников, подготовлены как рекомбинанты, путем ферментации или химически синтезированы.
Поскольку соединения по настоящему изобретению ингибируют протеолиз, который предусматривает разрушение пептидных связей, они могут быть использованы для ингибирования протеолиза любого пептида. Предпочтительно пептид является тем, который имеет благоприятный эффект, когда помещен в пищеварительный канал. Благоприятный эффект может быть, например, терапевтическим, косметическим или превентивным, таким как профилактический или контрацептивный. Пептид может быть природным (биологическим), синтетическим или полусинтетическим по происхождению.
В основном пептид служит для применения в профилактике или лечении заболеваний или состояний пищеварительного канала, или которые обнаруживаются в пищеварительном канале. Так, пептид может применяться для лечения болезни Крона или инфекции пищеварительного канала или части пищеварительного канала, например, это может быть пептидный антибиотик. В одном аспекте пептид может быть циклическим пептидом. Такие циклические пептиды могут применяться при раке или при воспалительных заболеваниях кишечника, таких как болезнь Крона, воспалительная болезнь кишечника и тому подобных. Как должно быть понятно, однако, настоящее изобретение работает со всеми пептидами, поэтому нет ограничения по типу используемого пептида.
В области техники известно, что циклические пептиды имеют конформацию, которая является более стесненной, чем линейные пептиды. Свобода движения концов пептида в циклическом пептиде ограничена, поскольку они связаны друг с другом химически. В варианте изобретения пептид, использованный в изобретении, является циклическим пептидом, имеющим кольцо из по меньшей мере шести аминокислот, где кольцо включает множество аминокислотных доменов, где каждый домен включает по меньшей мере эпитопобразующие аминокислоты и две или более ассоциированные функциональные группы. Аминокислоты, задействованные в циклическом пептиде, могут быть любыми из природных аминокислот, замещенных производных, аналогов и их L или D форм.
Циклические пептиды такого типа, описанные детально в PCT/GB 2007/003592, являются предпочтительно выбранными для применения в этом изобретении. Содержание и раскрытие сущности изобретения в PCT/GB 2007/003592 включено здесь посредством ссылки.
Фармацевтические композиции по настоящему изобретению могут быть получены путем приготовления главным образом безводной смеси, содержащей пептид и соединение по настоящему изобретению. В зависимости от желаемой лекарственной формы композиции затем может быть нужно заполнить непокрытые капсулы смесью и после этого покрыть капсулы соответствующей полимерной смесью для достижения определенных свойств проницаемости. В зависимости от природы использованных дополнительных вспомогательных веществ, фармацевтическая композиция по изобретению может быть в жидкой, твердой, полутвердой или гелевой форме.
Общие сведения
Специалисту в области техники будет понятно, что описанное здесь изобретение является поддающимся вариациям и модификациям, отличным от тех, что конкретно описаны здесь. Изобретение включает все подобные вариации и модификации. Изобретение также включает все шаги и особенности, указанные или обозначенные в описании, в отдельности или совместно и любые и все комбинации или любые два или более шага или особенности.
В контексте данного описания, если не оговорено обратное, термин «включать» или его варианты, такие как «включает» или «включающий», должны пониматься как подразумевающие заключение заданного целого или группы целых, но не исключение любых других целых или группы целых. Также отмечено, что в этом раскрытии и особенно в формуле изобретения и/или в параграфах такие термины, как «включает», «включенный», «включая» и тому подобные, могут принимать значения, используемые в патентном праве США; например, они могут обозначать «содержит», «содержащийся», «содержащий» и тому подобное; и что термины, такие как «состоящий в основном из» и «состоит в основном из», имеют значение, приписываемое им в патентном праве США, например, они допускают не только точно перечисленные составные части, но исключают составные части, которые известны в области техники или которые оказывают влияние на основные и новаторские характеристики изобретения.
Более того, в контексте раннего описания и формулы изобретения, если не оговорено обратное, термин «содержать» или варианты, такие как «содержит» или «содержащий», должны пониматься как подразумевающие заключение заданного целого или группы целых, но не исключение любых других целых или группы целых.
Другие определения отдельных терминов, использованных здесь, могут быть найдены в описании изобретения и применяться на всем его протяжении. Если не указано обратного, все технические термины, использованные здесь, имеют то же значение, что обычно понятно специалисту в области техники, к которой относится изобретение.
Краткое описание чертежей
Теперь будут описаны особенности изобретения, только в качестве примеров, на основании нижеследующего описания и чертежей.
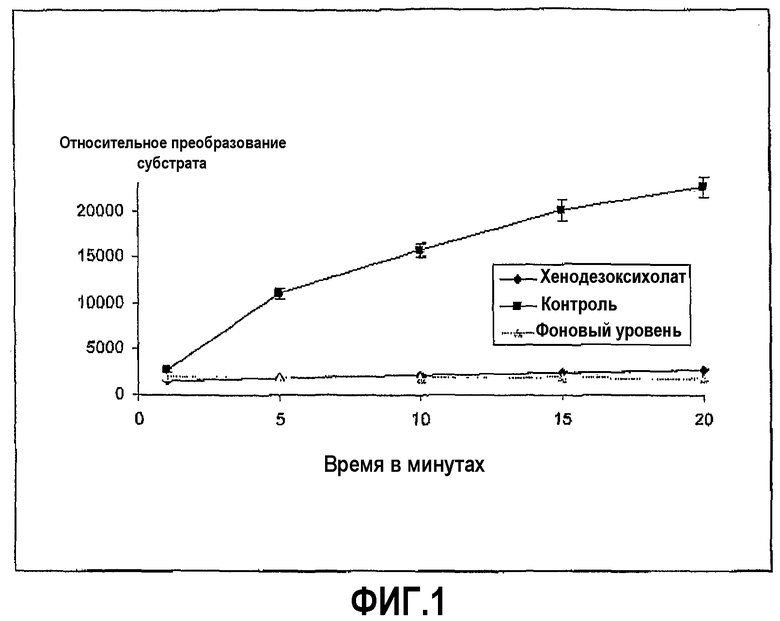
Фиг.1 иллюстрирует ингибирование трипсина хенодезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой Z-L-Arg 7-амидо-4-метилкумарин HCI хенодезоксихолат в концентрации 100 мг/мл.
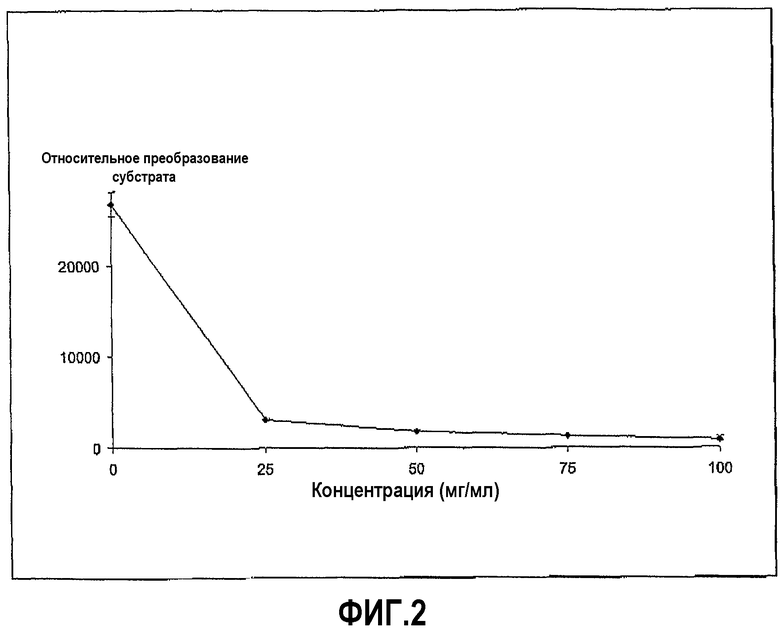
Фиг.2 иллюстрирует ингибирование трипсиновой активности хенодезоксихолатом. Доза-зависимая кривая представлена для пептидного субстрата Z-L-Arg 7-амидо-4-метилкумарин HCI, где время инкубации составляет 20 минут.
Фиг.3 иллюстрирует ингибирование химотрипсина хенодезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой глутарил-L-фенилаланин 4-метил-7-кумариниламид хенодезоксихолат в концентрации 100 мг/мл.
Фиг.4 иллюстрирует ингибирование активности химотрипсина хенодезоксихолатом. Доза-зависимая кривая представлена для пептидного субстрата - глутарил-L-фенилаланин 4-метил-7-кумариниламида в течение инкубационного времени 20 минут.
Фиг.5 иллюстрирует ингибирование трипсина дезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой Z-L-Arg 7-амидо-4-метилкумарин HCI дезоксихолат в концентрации 25 мг/мл.
Фиг.6 иллюстрирует ингибирование химотрипсина дезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой глутарил-L-фенилаланин 4-метил-7-кумариниламид желчную соль в концентрации 25 мг/мл.
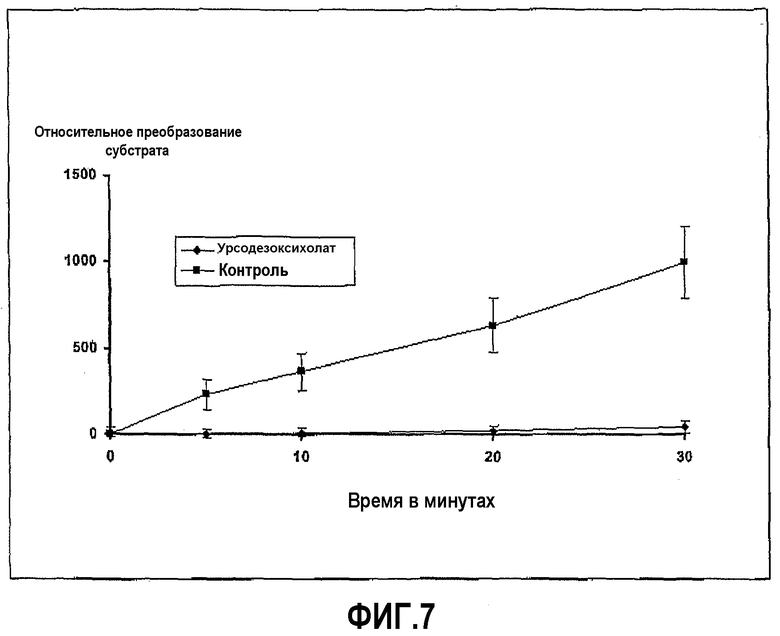
Фиг.7 иллюстрирует ингибирование активности трипсина урсодезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой Z-L-Arg 7-амидо-4-метилкумарин HCI желчную соль в концентрации 25 мг/мл.
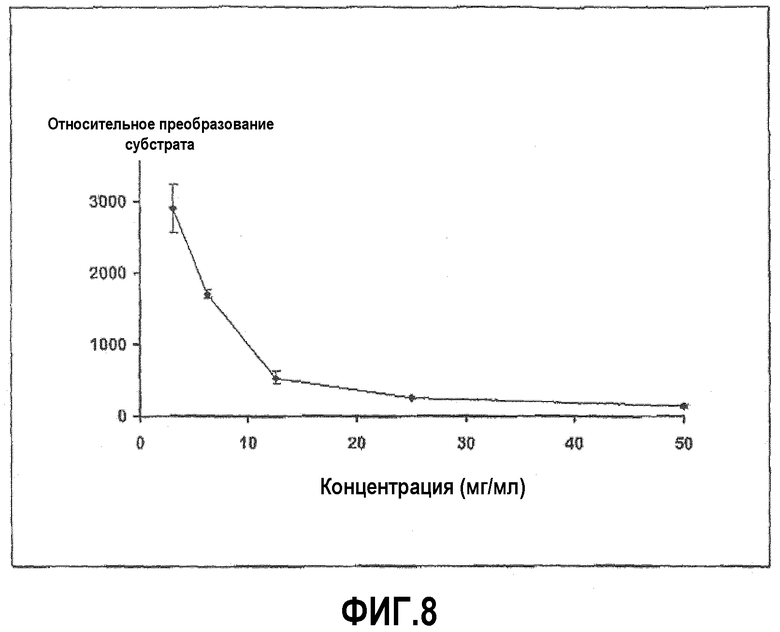
Фиг.8 иллюстрирует ингибирование активности трипсина урсодезоксихолатом. Доза-зависимая кривая представлена для пептидного субстрата Z-L-Arg 7-амидо-4-метилкумарин HCI со временем инкубации 20 минут.
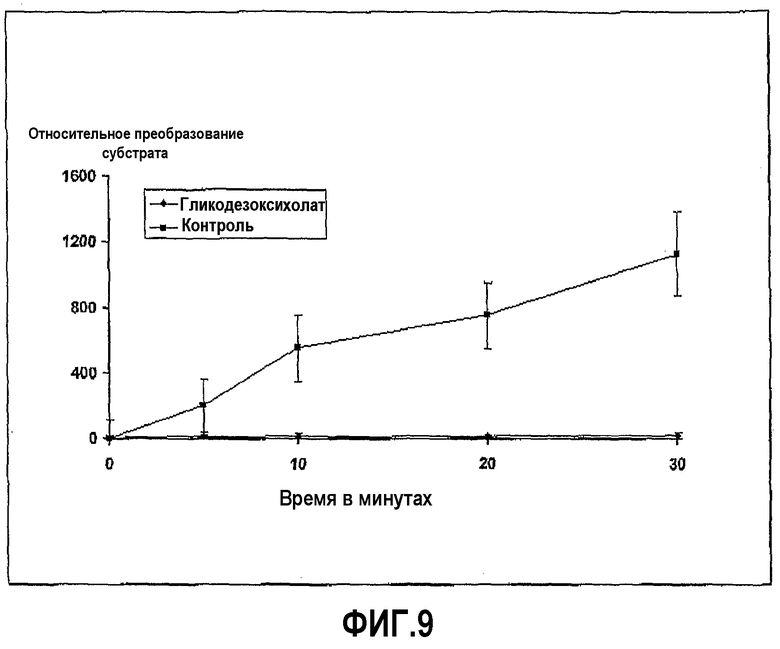
Фиг.9 иллюстрирует ингибирование активности трипсина гликодезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой Z-L-Arg 7-амидо-4-метилкумарин HCI желчную соль в концентрации 25 мг/мл.
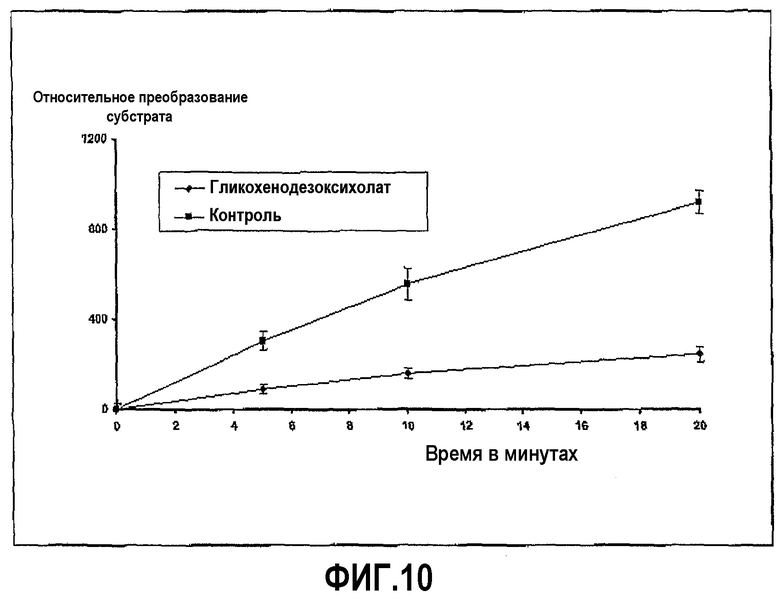
Фиг.10 иллюстрирует ингибирование активности трипсина гликохенодезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой Z-L-Arg 7-амидо-4-метилкумарин HCI, и время инкубации 20 минут.
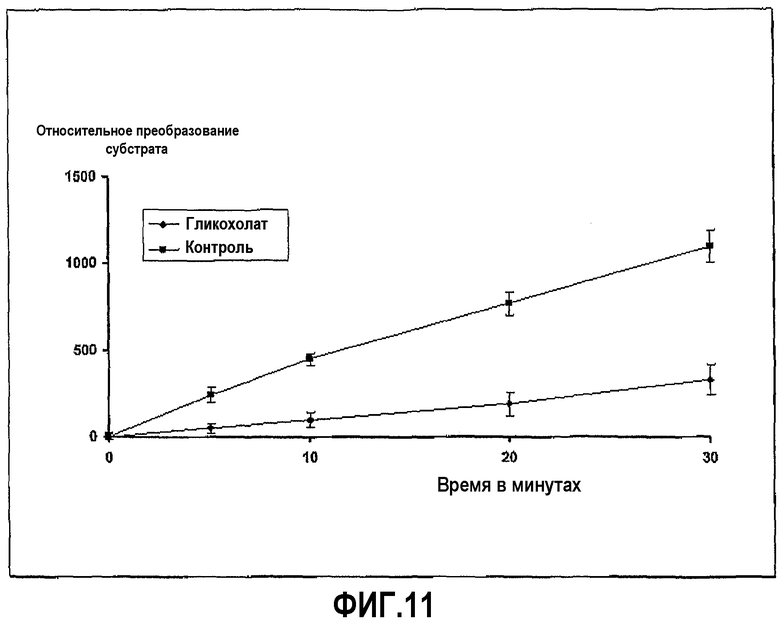
Фиг.11 иллюстрирует ингибирование активности трипсина гликохолатом в ходе развития реакции, где пептидный субстрат представляет собой Z-L-Arg 7-амидо-4-метилкумарин HCI, и время инкубации 20 минут.
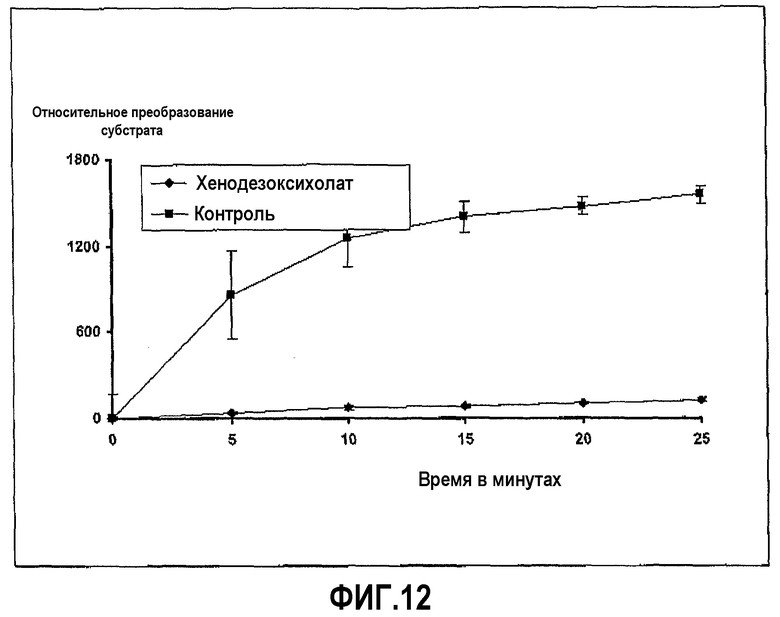
Фиг.12 иллюстрирует ингибирование активности химотрипсина хенодезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой Вос-β-бензил-Asp-Pro-Arg-7-амидо-4-метилкумарин HCI, и время инкубации 20 минут.
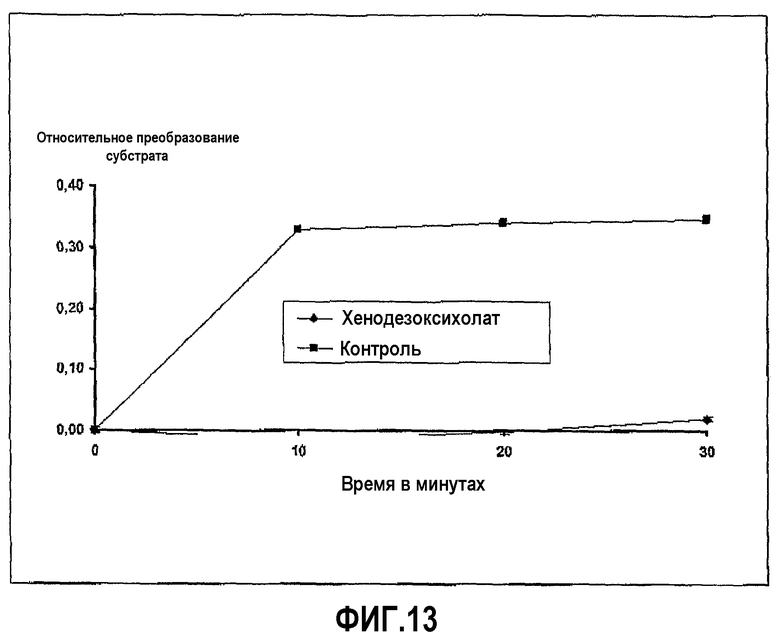
Фиг.13 иллюстрирует ингибирование активности тромбина хенодезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой N-бензоил-Phe-Val-Arg-п-нитроанилид гидрохлорид, и время инкубации 20 минут.
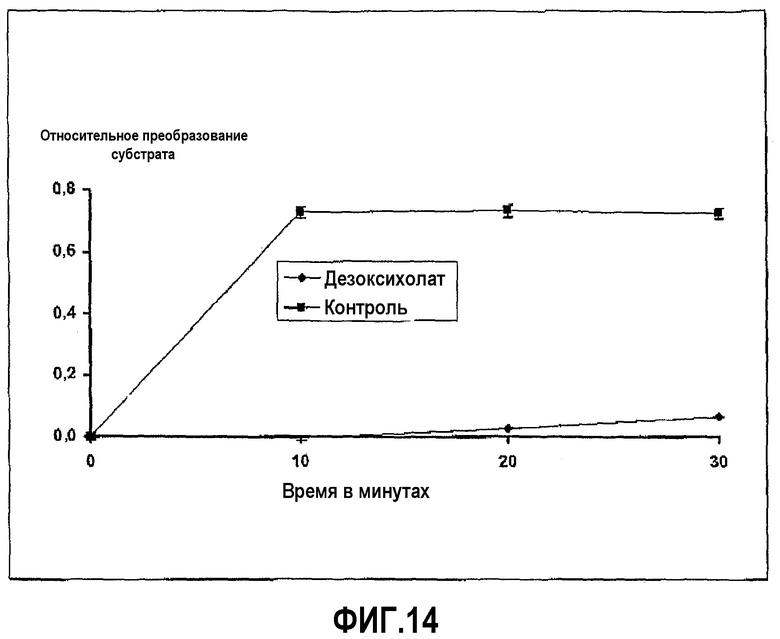
Фиг.14 иллюстрирует ингибирование активности тромбина дезоксихолатом в ходе развития реакции, где пептидный субстрат представляет собой N-бензоил-Phe-Val-Arg-п-нитроанилид гидрохлорид, и время инкубации 20 минут.
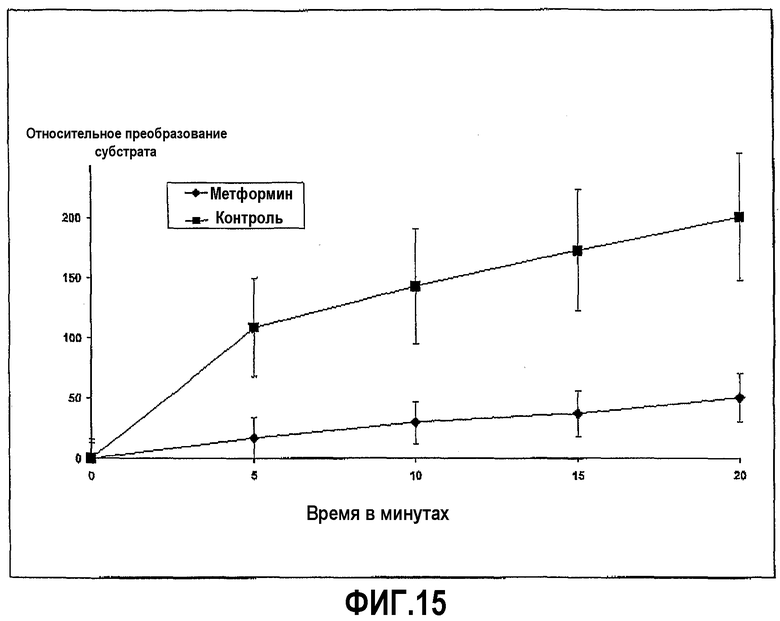
Фиг.15 иллюстрирует ингибирование активности трипсина метформином в ходе развития реакции, где пептидный субстрат представляет собой Z-L-Arg 7-амидо-4-метилкумарин HCI, и время инкубации 20 минут.
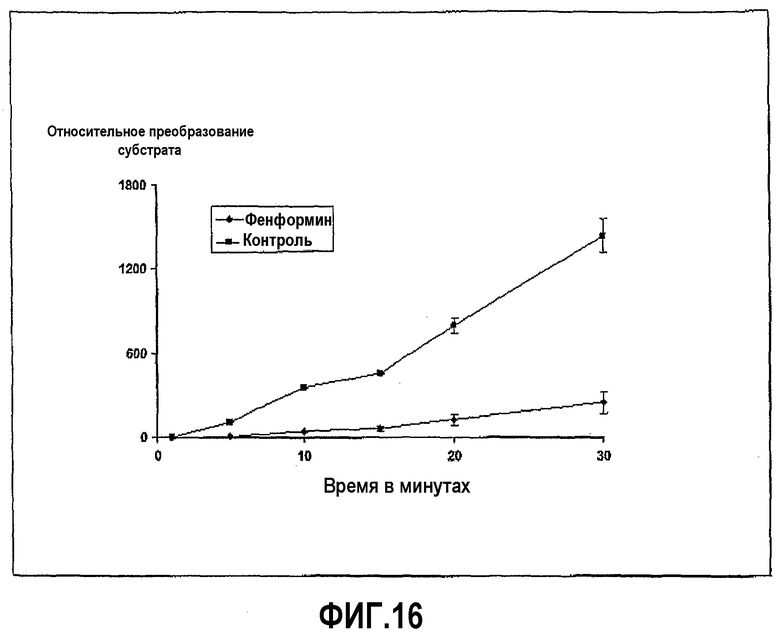
Фиг.16 иллюстрирует ингибирование активности трипсина фенформином в ходе развития реакции, где пептидный субстрат представляет собой Z-L-аргинин 4-метил-7-кумариниламид, и время инкубации 20 минут.
Иллюстративные варианты осуществления изобретения
Нижеследующие примеры служат для иллюстрации настоящего изобретения и не должны толковаться как ограничивающие. В примерах 1-9, 12 и 13 прогресс ферментативной реакции определяли путем флуориметрического измерения появления продукта реакции (амино-4-метилкумарина) при использовании длины волны возбуждения 365 нм и волны эмиссии 440 нм (обрыв при 435 нм) на приборе Spectramax Gemini XS от Molecular Devices.
Пример 1
Трипсин из бычьей поджелудочной железы растворили в Hanks Balanced Salt Solution (HBSS) в концентрации 0,02 мг/мл. Субстрат Z-L-аргинин 4-метил-7-кумариниламид растворили в HBSS в концентрации 0,01 мг/мл, и хенодезоксихолат натрия растворили в диапазоне концентраций, начиная с 100 мг/мл. Анализ проводили в лунках 96-луночных черных пластиковых микропланшетов, в которых 20 мкл раствора фермента и 60 мкл желчной соли смешали вместе и затем добавили при перемешивании 20 мкл субстрата, в начале реакции, которая продолжалась при комнатной температуре в течение 30 минут, с замерами в различных промежуточных моментах времени. Ингибирование ферментативной активности показано на фиг.1, и доза-зависимая кривая для хенодезоксихолата в различных концентрациях представлена на фиг.2.
Пример 2
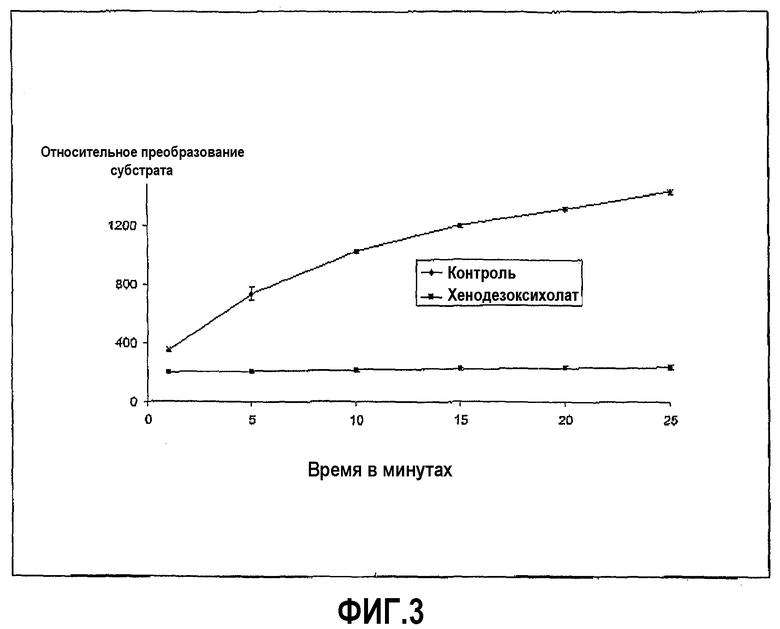
Пример 1 повторили с химотрипсином в качестве протеазы (вместо трипсина) и с глутарил-L-фенилаланин 4-метил-7-кумариниламидом в качестве субстрата.
Ингибирование ферментативной активности хенодезоксихолата с течением времени показано на фиг.3, и доза-зависимая кривая для хенодезоксихолата в различных концентрациях представлена на фиг.4.
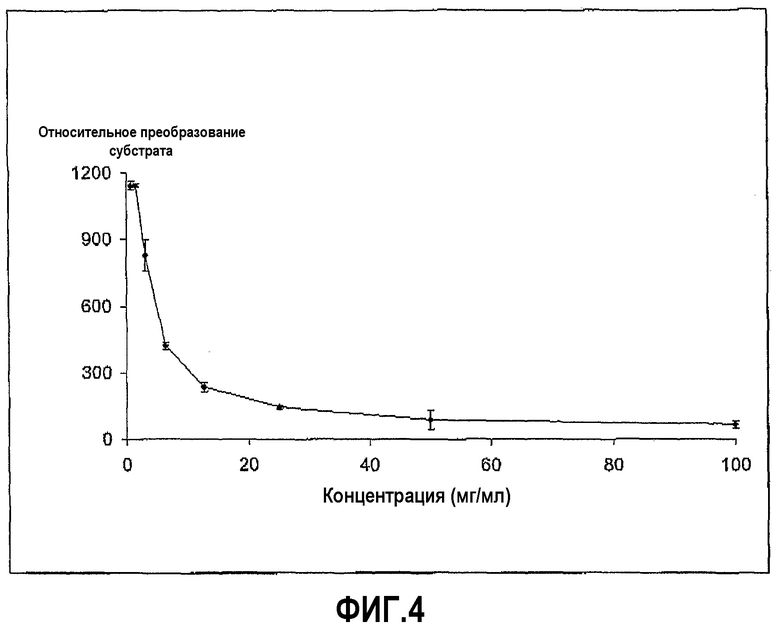
Пример 3
Пример 1 повторили с дезоксихолатом натрия вместо хенодезоксихолата натрия. Ингибирование ферментативной активности дезоксихолатом с течением времени показано на фиг.5. Фиг.5 также содержит результаты, когда вместо дезоксихолата использовали холат, таурохолат и тауродезоксихолат, показывающие, что эти три соединения не ингибируют трипсин.
Пример 4
Пример 2 повторили с дезоксихолатом натрия вместо хенодезоксихолата натрия. Ингибирование ферментативной активности дезоксихолата с течением времени показано на фиг.6. Фиг.6 также содержит результаты, когда вместо дезоксихолата использовали холат и таурохолат, показывающие, что эти два соединения не ингибируют химотрипсин.
Пример 5
Трипсин из бычьей поджелудочной железы растворили в HBSS в концентрации 0,02 мг/мл. Субстрат Z-L-аргинин 4-метил-7-кумариниламид растворили в HBSS в концентрации 0,01 мг/мл, и урсодезоксихолат натрия растворили в диапазоне концентраций, начиная с 50 мг/мл. Анализ проводили в лунках 96-луночных черных пластиковых микропланшетов, в которых 20 мкл раствора фермента и 100 мкл желчной соли смешали вместе и затем добавили при перемешивании 20 мкл субстрата в начале реакции, которая продолжалась при 37°С в течение 30 минут, с замерами в различных промежуточных моментах времени. Ингибирование ферментативной активности урсодезоксихолатом с течением времени показано на фиг.7, и доза-зависимая кривая для урсодезоксихолата в различных концентрациях представлена на фиг.8.
Пример 6
Трипсин из бычьей поджелудочной железы растворили в HBSS в концентрации 0,02 мг/мл. Субстрат Z-L-аргинин 4-метил-7-кумариниламид растворили в HBSS в концентрации 0,01 мг/мл, и гликодезоксихолат натрия растворили в диапазоне концентраций, начиная с 100 мг/мл. Анализ проводили в лунках 96-луночных черных пластиковых микропланшетов, в которых 20 мкл раствора фермента и 100 мкл желчной соли смешали вместе и затем добавили при перемешивании 20 мкл субстрата в начале реакции, которая продолжалась при 37°С в течение 30 минут, с замерами в различных промежуточных моментах времени. Ингибирование ферментативной активности гликодезоксихолатом с течением времени показано на фиг.9.
Пример 7
Пример 5 повторили с гликохенодезоксихолатом натрия вместо урсодезоксихолата натрия. Ингибирование ферментативной активности гликохенодезоксихолатом с течением времени показано на фиг.10.
Пример 8
Пример 6 повторили с гликохолатом натрия вместо гликодезоксихолата натрия. Ингибирование ферментативной активности гликохолатом с течением времени показано на фиг.11.
Пример 9
Химотрипсин из бычьей плазмы растворили в HBSS в концентрации 0,02 мг/мл. Субстрат Вос-β-бензил-Asp-Pro-Arg-7-амидо-4-метилкумарин растворили в HBSS в концентрации 0,01 мг/мл, и хенодезоксихолат натрия растворили в концентрации 100 мг/мл. Анализ проводили в лунках 96-луночных прозрачных пластиковых микропланшетов, в которых 20 мкл раствора фермента и 60 мкл желчной соли смешивали вместе и затем добавляли при перемешивании 20 мкл субстрата в начале реакции, которая продолжалась при 37°С в течение 30 минут, с замерами в различные промежуточные моменты времени. Ингибирование ферментативной активности хенодезоксихолатом с течением времени показано на фиг.12.
Пример 10
Тромбин из бычьей плазмы растворили в HBSS в концентрации 0,5 мг/мл. Субстрат N-бензоил-Phe-Val-Arg-п-нитроанилид гидрохлорид растворили в HBSS в концентрации 0,5 мг/мл, и хенодезоксихолат натрия растворили в диапазоне концентраций, начиная с 100 мг/мл. Анализ проводили в лунках 96-луночных прозрачных пластиковых микропланшетов, в которых 50 мкл раствора фермента и 100 мкл желчной соли смешивали вместе и затем добавляли при перемешивании 50 мкл субстрата в начале реакции, которая продолжалась при 37°С в течение 30 минут, с замерами в различные промежуточные моменты времени. Развитие ферментативной реакции определяли путем калориметрического измерения появления продукта реакции (п-нитроанилина) при длине волны 405 нм на Anthos reader 2001 от Anthos Labtec Instruments. Ингибирование ферментативной активности хенодезоксихолатом с течением времени показано на фиг.13.
Пример 11
Пример 10 повторили с дезоксихолатом натрия вместо хенодезоксихолата натрия. Ингибирование ферментативной активности дезоксихолатом с течением времени показано на фиг.14.
Пример 12
Пример 9 повторили с трипсином (вместо химотрипсина) из бычьей плазмы, Z-L-аргинин 4-метил-7-кумариниламидом в качестве субстрата и метформином в качестве ингибитора. Ингибирование ферментативной активности метформином с течением времени показано на фиг.15.
Пример 13
Трипсин из бычьей поджелудочной железы растворили в HBSS в концентрации 0,02 мг/мл. Субстрат Z-L-аргинин 4-метил-7-кумариниламид растворили в HBSS в концентрации 0,01 мг/мл, и фенформин растворили в концентрации 100 мг/мл. Анализ проводили в лунках 96-луночных черных пластиковых микропланшетов, в которых 20 мкл раствора фермента и 100 мкл желчной соли смешали вместе и затем добавили при перемешивании 20 мкл субстрата в начале реакции, которая продолжалась при 37°С в течение 30 минут, с замерами в различные промежуточные моменты времени. Ингибирование ферментативной активности фенформином с течением времени показано на фиг.16.
Модификации и вариации такие, как были бы очевидны специалисту в области техники, считаются лежащими в объеме настоящего изобретения.
Изобретение относится к способам сохранения целостности пептидов в пищеварительном канале путем применения хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликодезоксихолевой кислоты, гликохенодезоксихолевой кислоты или бигуанида, которые ингибируют одну или более сериновые протеазы кишечника. 7 н. и 20 з.п. ф-лы, 16 ил., 13 пр.
1. Применение соединения для ингибирования одной или более сериновых протеаз кишечника, где указанное соединение представляет собой желчную кислоту или фармацевтически приемлемую соль желчной кислоты, где указанная желчная кислота выбрана из группы, состоящей из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликодезоксихолевой кислоты, гликохенодезоксихолевой кислоты или фармацевтически приемлемой соли этих соединений.
2. Применение соединения для ингибирования одной или более сериновых протеаз кишечника, где указанное соединение представляет собой бигуанид или фармацевтически приемлемую соль бигуанида.
3. Применение по п.2, где бигуанид или его фармацевтически приемлемая соль имеет следующую формулу:
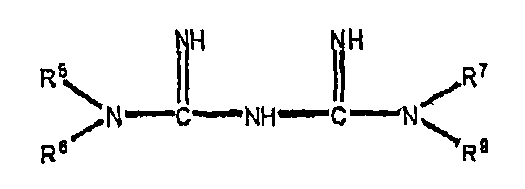
где R5, R6, R7 и R8 являются, каждый, независимо выбранными из водорода, необязательно замещенного алкила, необязательно замещенного фенила, этиленгликоля, диэтиленгликоля, триэтиленгликоля и тетраэтиленгликоля, за исключением того, что один из R5, R6, R7 и R8 является
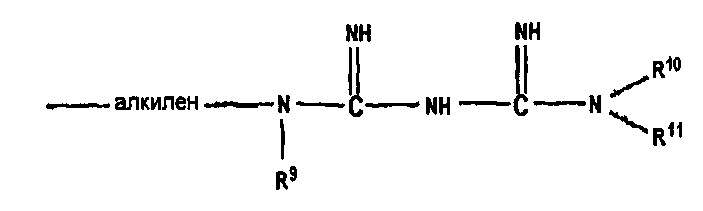
где R9, R10 и R11 являются, каждый, независимо выбранными из водорода, необязательно замещенного алкила, необязательно замещенного фенила, этиленгликоля, диэтиленгликоля, триэтиленгликоля и тетраэтиленгликоля.
4. Применение по п.2, где бигуанид является метформином, фенформином или хлоргексидином или их фармацевтически приемлемыми солями.
5. Продукт, обеспечивающий сохранение целостности пептидов в пищеварительном канале путем ингибирования одной или более сериновых протеаз кишечника, содержащий (а) соединение, представляющее собой желчную кислоту или фармацевтически приемлемую соль желчной кислоты, где указанная желчная кислота выбрана из группы, состоящей из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликодезоксихолевой кислоты, гликохенодезоксихолевой кислоты или фармацевтически приемлемой соли этих соединений, или соединение, представляющее собой бигуанид или фармацевтически приемлемую соль бигуанида, и (b) пептид или полипептид, где (а) и (b) приготовлены для одновременной, раздельной или последовательной доставки субъекту, подверженному заболеванию или состоянию пищеварительного канала.
6. Продукт по п.5, где соединение представлено в концентрации от примерно 20 до 100 мг/мл.
7. Продукт по п.5, где соединение представлено в количестве по меньшей мере 50% масс.
8. Продукт по п.5, где соединение представлено в количестве по меньшей мере от 60 до 95% масс.
9. Продукт по п.5, где соединение представлено в количестве по меньшей мере от 80 до 90% масс.
10. Продукт по п.5, где соединение выбрано из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликохенодезоксихолевой кислоты, гликодезоксихолевой кислоты или фармацевтически приемлемых солей этих соединений.
11. Продукт по п.5, где соединение выбрано из метформина, фенформина или хлоргексидина или их фармацевтически приемлемых солей.
12. Продукт по п.5, где пептид является циклическим пептидом.
13. Фармацевтическая композиция, обеспечивающая сохранение целостности пептидов в пищеварительном канале путем ингибирования одной или более сериновых протеаз кишечника, содержащая (а) соединение, представляющее собой желчную кислоту или фармацевтически приемлемую соль желчной кислоты, где указанная желчная кислота выбрана из группы, состоящей из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликодезоксихолевой кислоты, гликохенодезоксихолевой кислоты или фармацевтически приемлемой соли этих соединений, или соединение, представляющее собой бигуанид или фармацевтически приемлемую соль бигуанида, и (b) пептид или полипептид, где (а) и (b) приготовлены для одновременной, раздельной или последовательной доставки субъекту, подверженному заболеванию или состоянию пищеварительного канала.
14. Фармацевтическая композиция по п.13, где соединение представлено в концентрации от примерно 20 до 100 мг/мл.
15. Фармацевтическая композиция по п.13, где соединение представлено в количестве по меньшей мере 50% масс.
16. Фармацевтическая композиция по п.13, где соединение представлено в количестве по меньшей мере от 60 до 95% масс.
17. Фармацевтическая композиция по п.13, где соединение представлено в количестве по меньшей мере от 80 до 90% масс.
18. Фармацевтическая композиция по п.13, где соединение выбрано из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликохенодезоксихолевой кислоты, гликодезоксихолевой кислоты или фармацевтически приемлемых солей этих соединений.
19. Фармацевтическая композиция по п.13, где соединение выбрано из метформина, фенформина или хлоргексидина или их фармацевтически приемлемых солей.
20. Фармацевтическая композиция по п.13, где пептид является циклическим пептидом.
21. Способ ингибирования одной или более сериновых протеаз кишечника, включающий этап введения субъекту соединения, представляющего собой желчную кислоту или фармацевтически приемлемую соль желчной кислоты, где указанная желчная кислота выбрана из группы, состоящей из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликодезоксихолевой кислоты, гликохенодезоксихолевой кислоты или фармацевтически приемлемой соли этих соединений, или соединения, представляющего собой бигуанид или фармацевтически приемлемую соль бигуанида, или фармацевтической композиции по любому из пп.13-20.
22. Применение: (i) пептида или полипептида; и (ii) желчной кислоты или ее фармацевтически приемлемой соли, где указанная желчная кислота выбрана из группы, состоящей из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликодезоксихолевой кислоты, гликохенодезоксихолевой кислоты или фармацевтически приемлемой соли этих соединений, для получения лекарственного средства, обеспечивающего сохранение целостности пептидов в пищеварительном канале путем ингибирования одной или более сериновых протеаз кишечника, где указанная желчная кислота или ее фармацевтически приемлемая соль присутствует в композиции в концентрации от 20 до 100 мг/мл, и композиция составлена для доставки пептида в кишечник.
23. Применение по п.22, где желчная кислота выбрана из одной или более из хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, гликохенодезоксихолевой кислоты, гликодезоксихолевой кислоты или фармацевтически приемлемой соли этих соединений.
24. Применение по п.22, где пептид является циклическим пептидом.
25. Применение: (i) пептида или полипептида; и (ii) бигуанида или его фармацевтически приемлемой соли для получения лекарственного средства, обеспечивающего сохранение целостности пептидов в пищеварительном канале путем ингибирования одной или более сериновых протеаз кишечника, где указанный бигуанид или его фармацевтически приемлемая соль присутствует в композиции в концентрации от 20 до 100 мг/мл, и композиция составлена для доставки пептида в кишечник.
26. Применение по п.25, где бигуанид является предпочтительно одним или более из метформина, фенформина или хлоргексидина или их фармацевтически приемлемых солей.
27. Применение по п.25, где пептид является циклическим пептидом.
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| US 6156731 A, 05.12.2000 | |||
| Способ многомерного измерения | 1966 |
|
SU462071A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СОЕДИНЕННЫЕ С ЖЕЛЧНЫМИ КИСЛОТАМИ ПРОИЗВОДНЫЕ ПРОПАНОЛАМИНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1999 |
|
RU2234512C2 |
| ETO T ET AL: "Inhibition of pepsin activity by ursodeoxycholic acids and | |||
Авторы
Даты
2014-08-10—Публикация
2009-10-01—Подача