Область техники, к которой относится изобретение
[0001] Изобретение относится к 2,5-дизамещенным арилсульфонамидам, которые можно использовать для модулирования активности CCR3, и к содержащим их фармацевтическим композициям. Также изобретение относится к способам их применения для лечения, профилактики или улучшения одного или нескольких симптомов при CCR3-опосредованном нарушении, заболевании или состоянии.
Предпосылки создания изобретения
[0002] Хемокиновый рецептор CC 3 (CCR3) представляет собой семи-трансмембранный G белок - сдвоенный рецептор, который связывается со множеством C-C хемокинов, включая эотаксин (CCL11), эотаксин-3 (CCL26), MCP-3 (CCL7), MCP-4 (CCL13) и RANTES (CCL5). Известно, что CCR3 является основным хемокиновым рецетором, экспрессируемым на аллергических воспалительных клетках, включая эозинофилы, базофилы, тучные клетки и Т-хэлперные CD4+ клетки 2-типа (Combadiere et al., J. Biol. Chem. 1995, 270, 16491-16494; Post et al., J. Immunol. 1995, 155, 5299-5305). Эозинофилы вовлечены в патогенез ряда аллергических заболеваний, таких как бронхиальная астма (Durham and Kay, Clin. Allergy 1985, 15, 411-418; Kroegel et al., J. Allergy Clin. Immunol. 1994, 93, 725-734), аллергический ринит (Durham, Clin. Exp. Allergy 1998, 28 Suppl. 2, 11-16), атопический дерматит (Leung, J. Allergy Clin. Immunol. 1999, 104, S99-108) и эозинофильный гастроэнтерит (Bischoff et al., Am. J. Gastro. 1999, 94, 3521-3529). Показано, что активированные эозинофилы высвобождают главный основный белок (MBP), который блокирует мускариновые рецепторы М2 (M2Rs) на нервах, повышая высвобождение ацетилхолина и усиливая вагусно-опосредованный бронхостеноз (Evans et al., J. Clin. Invest. 1997, 100, 2254-2262).
[0003] В многочисленных сообщениях указывается на то, что CCR3 играет важную роль в аллергических состояниях. Например, сообщалось, что у пациентов как с атопической, так и с неатопической астмой наблюдается повышение уровней как мРНК, так и белка CCR3 и его лигандов - эотаксина, эотаксина-2, RANTES и MCP-4 (Ying et al., J. Immunol. 1999, 99, 6321-6329). Также было показано, что делеция гена CCR3 уменьшает увеличение численности эозинофилов на острой модели экспериментальной астмы (Humbles et al., Proc. Natl. Acad. Sci. USA 2002, 99, 1479-1484; Ma et al., J. Clin. Invest. 2002, 109, 621-628; Pope et al., J. Immunol. 2005, 175, 5341-5350; Fulkerson et al., Proc. Natl. Acad. Sci. USA 2006, 103, 16418-16423). Кроме того, исследования показали, что антагонисты CCR3, такие как анти-CCR3 моноклональные антитела, блокируют связывание CCR3-лигандов с любым из трансфектантов CCR3 и эозинофилов, блокируя таким образом хемотаксис эозинофилов, индуцированный С-С хемокинами, такими как эотаксин, RANTES или MCP-3 (Heath et al., J. Clin. Invest. 1997, 99, 178-184; Grimaldi et al., J. Leukocyte Biol. 1999, 65, 846-853; Justice et al., Am. J. Physiol. 2003, 284, L168-L178). Соответственно, антагонисты CCR3 потенциально можно использовать для лечения воспалительных заболеваний, таких как аллергический ринит и аллергическая астма. Помимо этого антагонисты CCR3 потенциально также можно использовать для блокирования инфекции клеток, экспрессирующих CCR3, некоторыми микроорганизмами, такими как ВИЧ, поскольку известно, что CCR3 является входным сорецептором для некоторых микроорганизмов.
Сущность изобретения
[0004] Изобретение относится к 2,5-дизамещенному арилсульфонамиду формулы Ia:
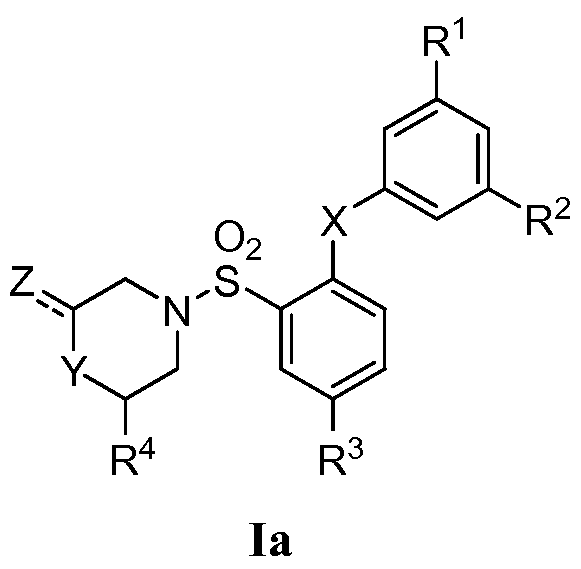
или его фармацевтически приемлемой соли, сольвату, гидрату, стереоизомеру или таутомеру; где
X представляет собой S, SO или SO2;
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =О, CO2R6 или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или C1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R1 и R2 независимо представляют собой галоген, С1-6 алкил или С1-6 галогеналкил;
R3 представляет собой CN или NO2;
R4 представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R5 представляет собой водород или С1-6 алкил; и
R6 представляет собой водород или С1-6 алкил.
[0005] Также изобретение относится к 2,5-дизамещенному арилсульфонамиду формулы I:

или его фармацевтически приемлемой соли, сольвату, гидрату, стереоизомеру или таутомеру; где
X представляет собой S, SO или SO2;
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =О или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R1 и R2 независимо представляют собой галоген, С1-6 алкил или С1-6 галогеналкил;
R3 представляет собой CN или NO2;
R4 представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; и
R5 представляет собой водород или С1-6 алкил.
[0006] Также изобретение относится к 2,5-дизамещенному арилсульфонамиду формулы II или его фармацевтически приемлемой соли, сольвату, гидрату, стереоизомеру или таутомеру:
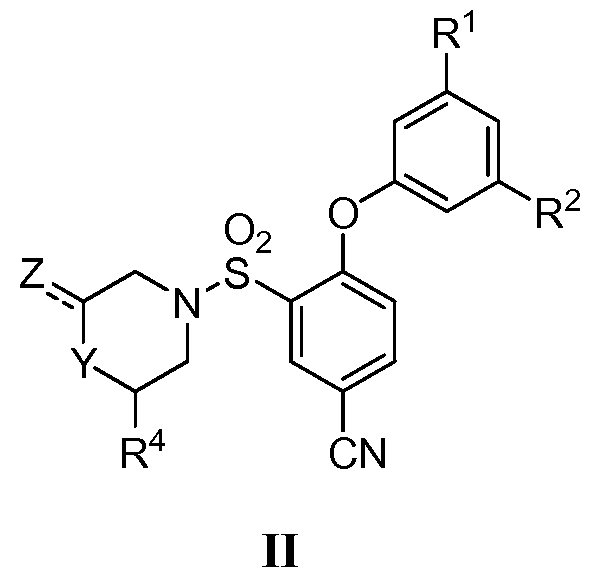
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =О или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R1 и R2 независимо представляют собой галоген, С1-6 алкил или С1-6 галогеналкил;
R4 представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; и
R5 представляет собой водород или С1-6 алкил;
при условии, что если Y представляет собой CH2, по крайней мере один из Z и R4 представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном.
[0007] Также изобретение относится к фармацевтическим композициям, включающим описанное здесь соединение, например, соединение формулы Ia, формулы I или формулы II или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер или таутомер в сочетании с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
[0008] Далее изобретение относится к способу модулирования активности CCR3, включающему контактирование CCR3 с терапевтически эффективным количеством описанного здесь соединения, например, соединения формулы Ia, формулы I или формулы II или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера.
[0009] Кроме того, изобретение относится к способу лечения, профилактики или улучшения одного или нескольких симптомов CCR3-опосредованного нарушения, заболевания или состояния у субъекта, включающему введение субъекту терапевтически эффективного количества описанного здесь соединения, например, соединения формулы Ia, формулы I или формулы II или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера.
Подробное описание изобретения
[0010] Для облегчения понимания приведенного описания ниже определен ряд терминов.
[0011] Обычно использованная в описании номенклатура и описанные здесь лабораторные способы органической химии, медицинской химии и фармакологии представляют собой те, которые хорошо известны и обычно используются в данной области. Если не определено другого, все использованные в описании технические и научные термины обычно имеют такое же значение, как это обычно понимается обычным специалистом в той области, к которой относится изобретение. В тех случаях, когда существует множество определений для используемого в описании термина, здесь доминируют определения, приведенные в данном разделе, если не указано другого.
[0012] Термин "субъект" относится к животному, включая, но не ограничиваясь указанным, примата (например, человека), корову, свинью, овцу, козу, лошадь, собаку, кролика, крысу или мышь. Термины "субъект" и «пациент» использованы в данном описании взаимозаменяемо при упоминании, например, субъекта-млекопитающего, такого как субъект-человек, в одном варианте осуществления, человека.
[0013] Подразумевается, что термины "лечить," "лечение" и "проведение лечения" включают облегчение или прекращение нарушения, заболевания или состояния или уменьшение или искоренение причин(ы) самого нарушения, заболевания или состояния.
[0014] Подразумевается, что термины «предотвращать», «предотвращение» и «профилактика» относятся к способу приостановки и/или предотвращения начала нарушения, заболевания или состояния и/или сопутствующих ему симптомов, не допуская у субъекта появления нарушения, заболевания или состояния или снижая риск появления у субъекта нарушения, заболевания или состояния.
[0015] Подразумевается, что термин «терапевтически эффективное количество» включает количество соединения, которое, при введении, является достаточным для предотвращения развития или облегчения в определенной степени одного или нескольких симптомов нарушения, заболевания или состояния, подвергаемого лечению. Термин «терапевтически эффективное количество» также относится к количеству соединения, которое является достаточным для того, чтобы вызвать биологическую или медицинскую ответную реакцию биологической молекулы (например, белка, фермента, РНК или ДНК), клетки, ткани, системы, животного или человека, которая является значимой с точки зрения исследователя, ветеринара, лечащего врача или клинициста.
[0016] Термины "фармацевтически приемлемый носитель," "фармацевтически приемлемый эксципиент," "физиологически приемлемый носитель" или "физиологически приемлемый эксципиент" относятся к фармацевтически приемлемому веществу, композиции или переносчику, такому как жидкий или твердый наполнитель, разбавитель, растворитель или инкапсулирующий материал. В одном варианте осуществления, каждый компонент является «фармацевтически приемлемым» в том смысле, что он является совместимым с другими ингредиентами фармацевтического препарата и подходящим для использования в контакте с тканями или органами людей и животных без избыточной токсичности, раздражения, аллергической реакции, иммуногенности или без других проблем или осложнений, соответствуя резонному соотношению польза/риск. См. Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins: Philadelphia, PA, 2005; Handbook of Pharmaceutical Excipients, 5th Edition, Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association: 2005; и Handbook of Pharmaceutical Additives, 3rd Edition, Ash and Ash Eds., Gower Publishing Company: 2007; Pharmaceutical Preformulation and Formulation, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2004.
[0017] Термин "примерно" или "приблизительно" означает допустимую ошибку для определенной величины, определенной обычным специалистом в данной области, которая зависит частично от того, каким образом измеряют или определяют данное значение. В некоторых вариантах осуществления, термин "примерно" или "приблизительно" находится в пределах 1, 2, 3 или 4 стандартных отклонений. В некоторых вариантах осуществления, термин "примерно" или "приблизительно" находится в пределах 50%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5% или 0,05% от данного значения или диапазона.
[0018] Термины «активный ингредиент» и «активное вещество» относятся к соединению, которое вводят субъекту, по отдельности или в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами, для лечения, профилактики или облегчения одного или нескольких симптомов состояния, нарушения или заболевания. Как использовано в данном описании, термины «активный ингредиент» и «активное вещество» могут относиться к оптически активному изомеру описываемого соединения.
[0019] Термины «лекарственное средство», «терапевтический агент» и «химиотерапевтический агент» относятся к соединению или его фармацевтической композиции, которые вводят субъекту для лечения, профилактики или облегчения одного или нескольких симптомов состояния, нарушения или заболевания.
[0020] Термин "алкил" относится к линейному или разветвленному насыщенному одновалентному углеводородному радикалу, где алкилен необязательно может быть замещенным, как указано в данном описании. Термин "алкил" также охватывает как линейные, так и разветвленные алкилы, если не указано другого. В некоторых вариантах осуществления, алкил представляет собой линейный, насыщенный одновалентный углеводородный радикал, который содержит 1-20 (C1-20), 1-15 (C1-15), 1-10 (C1-10) или 1-6 (C1-6) атомов углерода, или разветвленный насыщенный одновалентный углеводородный радикал, который содержит 3-20 (C3-20), 3-15 (C3-15), 3-10 (C3-10) или 3-6 (C3-6) атомов углерода. Как использовано в данном описании, термины «линейные С1-6 и разветвленные С3-6 алкильные группы» также относятся к «низшему алкилу». Примеры алкильных групп включают, но не ограничиваются указанным, метил, этил, пропил (включая все изомерные формы), н-пропил, изопропил, бутил (включая все изомерные формы), н-бутил, изобутил, втор-бутил, трет-бутил, пентил (включая все изомерные формы) и гексил (включая все изомерные формы). Например, термин С1-6 алкил относится к линейному насыщенному одновалентному углеводородному радикалу из 1-6 атомов углерода или разветвленному насыщенному одновалентному углеводородному радикалу из 3-6 атомов углерода.
[0021] Термин "алкенил" относится к линейному или разветвленному одновалентному углеводородному радикалу, который содержит одну или несколько, в одном варианте осуществления, одну-пять, углерод-углеродных двойных связей. Алкенил необязательно может быть замещенным, как описано в данном изобретении. Термин "алкенил" также охватывает радикалы, имеющие «цис» или «транс» конфигурации или, альтернативно, "Z" и "E" конфигурации, как понятно обычным специалистам в данной области. Как использовано в данном описании, термин "алкенил" охватывает как линейные, так и разветвленные алкенилы, если не указано другого. Например, термин «C2-6 алкенил» относится к линейному ненасыщенному одновалентному углеводородному радикалу из 2-6 атомов углерода или разветвленному ненасыщенному одновалентному углеводородному радикалу из 3-6 атомов углерода. В некоторых вариантах осуществления, алкенил представляет собой линейный одновалентный углеводородный радикал из 2-20 (C2-20), 2-15 (C2-15), 2-10 (C2-10) или 2-6 (C2-6) атомов углерода или разветвленный одновалентный углеводородный радикал из 3-20 (C3-20), 3-15 (C3-15), 3-10 (C3-10) или 3-6 (C3-6) атомов углерода. Примеры алкенильных групп включают, но не ограничиваются указанным, этенил, пропен-1-ил, пропен-2-ил, аллил, бутенил и 4-метилбутенил.
[0022] Термин "алкинил" относится к линейному или разветвленному одновалентному углеводородному радикалу, который содержит одну или несколько, в одном варианте осуществления, одну-пять, углерод-углеродных тройных связей. Алкинил необязательно может быть замещенным, как описано в данном изобретении. Термин "алкинил" также охватывает как линейные, так и разветвленные алкинилы, если не указано другого. В некоторых вариантах осуществления, алкинил представляет собой линейный одновалентный углеводородный радикал из 2-20 (C2-20), 2-15 (C2-15), 2-10 (C2-10) или 2-6 (C2-6) атомов углерода или разветвленный одновалентный углеводородный радикал из 3-20 (C3-20), 3-15 (C3-15), 3-10 (C3-10) или 3-6 (C3-6) атомов углерода. Примеры алкинильных групп включают, но не ограничиваются указанным, этинил (-C≡CH) и пропаргил (-CH2C≡CH). Например, термин «C2-6 алкинил» относится к линейному ненасыщенному одновалентному углеводородному радикалу из 2-6 атомов углерода или разветвленному ненасыщенному одновалентному углеводородному радикалу из 3-6 атомов углерода.
[0023] Термин "циклоалкил" относится к циклическому насыщенному мостиковому и/или не мостиковому одновалентному углеводородному радикалу, который необязательно может быть замещенным, как описано в данном изобретении. В некоторых вариантах осуществления, циклоалкил содержит от 3 до 20 (C3-20), от 3 до 15 (C3-15), от 3 до 10 (C3-10) или от 3 до 7 (C3-7) атомов углерода. Примеры циклоалкильных групп включают, но не ограничиваются указанным, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, декалинил и адамантил.
[0024] Термин "арил" относится к моноциклической ароматической группе и/или мультициклической одновалентной ароматической группе, которая содержит по крайней мере одно ароматическое углеводородное кольцо. В некоторых вариантах осуществления, арил содержит от 6 до 20 (C6-20), от 6 до 15 (C6-15) или от 6 до 10 (C6-10) кольцевых атомов. Примеры арильных групп включают, но не ограничиваются указанным, фенил, нафтил, флуоренил, азуленил, фенантрил, пиренил, бифенил и терфенил. Термин «арил» также относится к бициклическим или трициклическим углеродным кольцам, где одно из данных колец является ароматическим, а другие могут быть насыщенными, частично насыщенными или ароматическими, например, дигидронафтил, инденил, инданил или тетрагидронафтил (тетралинил). В некоторых вариантах осуществления, арил необязательно может быть замещенным, как описано в данном изобретении.
[0025] Термин "гетероарил" относится к моноциклической ароматической группе и/или мультициклической ароматической группе, которая содержит по крайней мере одно ароматическое кольцо, где по крайней мере одно ароматическое кольцо содержит один или несколько гетероатомов, независимо выбранных из O, S и N. Каждое кольцо гетероарильной группы может содержать один или два атома О, один или два атома S и/или от одного до четырех атомов N при условии, что общее число гетероатомов в каждом кольце составляет четыре или меньше, и каждое кольцо содержит по крайней мере один атом углерода. В некоторых вариантах осуществления, гетероарил содержит от 5 до 20, от 5 до 15 или от 5 до 10 кольцевых атомов. Примеры моноциклических гетероарильных групп включают, но не ограничиваются указанным, пирролил, пиразолил, пиразолинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, фуранил, тиенил, оксадиазолил, пиридил, пиразинил, пиримидинил, пиридазинил и триазинил. Примеры бициклических гетероарильных групп включают, но не ограничиваются указанным, индолил, бензотиазолил, бензоксазолил, бензотиенил, хинолинил, тетрагидроизохинолинил, изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофуранил, изобензофуранил, хромонил, кумаринил, циннолинил, хиноксалинил, индазолил, пуринил, пирролопиридинил, фуропиридинил, тиенопиридинил, дигидроизоиндолил, и тетрагидрохинолинил. Примеры трициклических гетероарильных групп включают, но не ограничиваются указанным, карбазолил, бензиндолил, фенантроллинил, акридинил, фенантридинил и ксантенил. В некоторых вариантах осуществления, гетероарил также необязательно может быть замещенным, как указано в данном описании.
[0026] Термин "гетероциклил" или "гетероциклический" относится к моноциклической неароматической кольцевой системе и/или мультициклической кольцевой системе, которая содержит по крайней мере одно неароматическое кольцо, где одно или несколько из атомов, образующих неароматическое кольцо, представляют собой гетероатомы, независимо выбранные из O, S или N; а оставшиеся атомы представляют собой атомы углерода. В некоторых вариантах осуществления, гетероциклил или гетероциклическая группа содержит от 3 до 20, от 3 до 15, от 3 до 10, от 3 до 8, от 4 до 7 или от 5 до 6 кольцевых атомов. В некоторых вариантах осуществления, гетероциклил представляет собой моноциклическую, бициклическую, трициклическую или тетрациклическую систему, которая может включать конденсированную или мостиковую кольцевую систему, и в которой атомы азота или серы необязательно могут быть окисленными, атомы азота необязательно могут быть кватернизованными, и некоторые циклы могут быть частично или полностью насыщенными или ароматическими. Гетероциклил может быть присоединен к основной структуре через любой гетероатом или атом углерода, что приводит к созданию стабильного соединения. Примеры таких гетероциклических радикалов включают, но не ограничиваются указанным, акридинил, азепинил, бензимидазолил, бензиндолил, бензоизоксазолил, бензизоксазинил, бензодиоксанил, бензодиоксолил, бензофуранонил, бензофуранил, бензонафтофуранил, бензопиранонил, бензопиранил, бензотетрагидрофуранил, бензотетрагидротиенил, бензотиадиазолил, бензотиазолил, бензотиофенил, бензотриазолил, бензотиопиранил, бензоксазинил, бензоксазолил, бензотиазолил, β-карболинил, карбазолил, хроманил, хромонил, циннолинил, кумаринил, декагидроизохинолинил, дибензофуранил, дигидробензизотиазинил, дигидробензизоксазинил, дигидрофурил, дигидропиранил, диоксоланил, дигидропиразинил, дигидропиридинил, дигидропиразолил, дигидропиримидинил, дигидропирролил, диоксоланил, 1,4-дитианил, фуранонил, фуранил, имидазолидинил, имидазолинил, имидазолил, имидазопиридинил, имидазотиазолил, индазолил, индолинил, индолизинил, индолил, изобензотетрагидрофуранил, изобензотетрагидротиенил, изобензотиенил, изохроманил, изокумаринил, изоиндолинил, изоиндолил, изохинолинил, изотиазолидинил, изотиазолил, изоксазолидинил, изоксазолил, морфолинил, нафтиридинил, октагидроиндолил, октагидроизоиндолил, оксадиазолил, оксазолидинонил, оксазолидинил, оксазолопиридинил, оксазолил, оксиранил, перимидинил, фенантридинил, фенантролинил, фенарсазинил, феназинил, фенотиазинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, 4-пиперидонил, птеридинил, пуринил, пиразинил, пиразолидинил, пиразолил, пиридазинил, пиридинил, пиридопиридинил, пиримидинил, пирролидинил, пирролинил, пирролил, хиназолинил, хинолинил, хиноксалинил, хинуклидинил, тетрагидрофурил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидропиранил, тетрагидротиенил, тетразолил, тиадиазолопиримидинил, тиадиазолил, тиаморфолинил, тиазолидинил, тиазолил, тиенил, триазинил, триазолил и 1,3,5-тритианил. В некоторых вариантах осуществления, гетероцикл необязательно может быть замещенным, как указано в данном описании.
[0027] Термин "алкокси" относится к радикалу -OR, где R представляет собой, например, алкил, алкенил, алкинил, циклоалкил, арил, гетероарил или гетероциклил, каждый из которых определен в данном описании. Примеры алкокси групп включают, но не ограничиваются указанным, метокси, этокси, пропокси, н-пропокси, 2-пропокси, н-бутокси, изобутокси, трет-бутокси, циклогексилокси, фенокси, бензокси и 2-нафтилокси. В некоторых вариантах осуществления, алкокси необязательно может быть замещенным, как указано в данном описании. В некоторых вариантах осуществления, алкокси представляет собой С1-6 алкилокси.
[0028] Термин "галоген", "галогенид" или "гало-" относится к фтору, хлору, брому и/или иоду.
[0029] Подразумевается, что термин "необязательно замещенный" означает, что группа, такая как алкильная, алкенильная, алкинильная, циклоалкильная, арильная, гетероарильная, гетероциклическая или алкокси группа, может быть замещена одним или несколькими заместителями, независимо выбранными, например, из (a) алкила, алкенила, алкинила, циклоалкила, арила, гетероарила и гетероциклила, каждый из которых необязательно является замещенным одним или несколькими, в одном варианте осуществления, одним, двумя, тремя или четырьмя заместителями Q; и (b) галогена, циано (-CN), нитро (-NO2), -C(О)Ra, -C(O)ORa, -C(O)NRbRc, -C(NRa)NRbRc, -ORa, -OC(O)Ra, -OC(O)ORa, -OC(O)NRbRc, -OC(=NRa)NRbRc, -OS(O)Ra, -OS(O)2Ra, -OS(O)NRbRc, -OS(O)2NRbRc, -NRbRc, -NRaC(O)Rd, -NRaC(O)ORd, -NRaC(O)NRbRc, -NRaC(=NRd)NRbRc, -NRaS(O)Rd, -NRaS(O)2Rd, -NRaS(O)NRbRc, -NRaS(O)2NRbRc, -SRa, -S(O)Ra, -S(O)2Ra, -S(O)NRbRc, и -S(O)2NRbRc, где каждый Ra, Rb, Rc и Rd независимо представляет собой (i) водород; (ii) С1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-14 арил, гетероарил или гетероциклил, каждый из которых необязательно является замещенным одним или несколькими, в одном варианте осуществления, одним, двумя, тремя или четырьмя заместителями Q; или (iii) Rb и Rc вместе с атомом N, с которым они соединены, образуют гетероцикл, необязательно замещенный одним или несколькими, в одном варианте осуществления, одним, двумя, тремя или четырьмя заместителями Q. Как использовано в данном описании, все группы, которые могут быть замещенными, являются «необязательно замещенными», если не указано другого.
[0030] В одном варианте осуществления, каждый Q независимо выбирают из группы, состоящей из (a) циано, галогена и нитро; и (b) C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C3-7 циклоалкила, C6-14 арила, гетероарила и гетероциклила; и -C(O)Re, -C(O)ORe, -C(O)NRfRg, -C(NRe)NRfRg, -ORe, -OC(O)Re, -OC(O)ORe, -OC(О)NRfRg, -OC(=NRe)NRfRg, -OS(O)Re, -OS(O)2Re, -OS(О)NRfRg, -OS(О)2NRfRg, -NRfRg, -NReC(О)Rh, -NReC(О)ORh, -NReC(О)NRfRg, -NReC(=NRh)NRfRg, -NReS(О)Rh, -NReS(O)2Rh, -NReS(О)NRfRg, -NReS(O)2NRfRg, -SRe, -S(O)Re, -S(O)2Re, -S(О)NRfRg, и -S(О)2NRfRg; где каждый Re, Rf, Rg и Rh независимо представляет собой (i) водород; (ii) C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-14 арил, гетероарил или гетероцикл; или (iii) Rf и Rg вместе с атомом N, с которым они соединены, образуют гетероциклил.
[0031] В некоторых вариантах осуществления, выражения "оптически активный" и "энантиомерно активный" относится к совокупности молекул, которая имеет энантиомерный избыток не меньше чем примерно 50%, не меньше чем примерно 70%, не меньше чем примерно 80%, не меньше чем примерно 90%, не меньше чем примерно 91%, не меньше чем примерно 92%, не меньше чем примерно 93%, не меньше чем примерно 94%, не меньше чем примерно 95%, не меньше чем примерно 96%, не меньше чем примерно 97%, не меньше чем примерно 98%, не меньше чем примерно 99%, не меньше чем примерно 99,5% или не меньше чем примерно 99,8%. В некоторых вариантах осуществления, соединение содержит примерно 95% или больше желаемого энантиомера и примерно 5% или меньше менее предпочтительного энантиомера из расчета на общий вес рассматриваемого рацемата.
[0032] При описании оптически активного соединения приставки R и S используются для обозначения абсолютной конфигурации молекулы относительно ее хирального центра(ов). Знаки (+) и (-) используются для обозначения оптического вращения соединения, то есть направления, в котором оптически активное соединение вращает плоскость поляризованного света. Приставка (-) указывает, что соединение является левовращающим, то есть соединение вращает плоскость поляризованного света налево или против часовой стрелки. Приставка (+) указывает, что соединение является правовращающим, то есть соединение вращает плоскость поляризованного света направо или по часовой стрелке. Однако знаки оптического вращения (+) и (-) не относятся к абсолютной конфигурации молекулы R и S.
[0033] Термин "сольват" относится к разработанному в изобретении соединению или его соли, которое дополнительно включает стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. В том случае, где растворитель представляет собой воду, сольват представляет собой гидрат.
[0034] Термин "существующий в природе" или "природный", когда он используется по отношению к биологическим веществам, таким как молекулы нуклеиновой кислоты, полипептидов, клеток-хозяев и тому подобного, относится к веществам, которые выявлены в природе и не управляются человеком. Аналогично, термин «не существующие в природе» или «неприродные» относится к материалу, который не выявлен в природе, или который был структурно модифицирован или синтезирован человеком.
[0035] Термин "CCR3" относится к хемокиновому рецептору CC3 или его варианту, который способен опосредовать клеточную ответную реакцию на множество хемокинов, включая, но не ограничиваясь указанным, эотаксин (CCL11), эотаксин-3 (CCL26), MCP-3 (CCL7), MCP-4 (CCL13) и RANTES (CCL5). Варианты CCR3 включают белки, по существу гомологичные природному CCR3, т.е. белки, имеющие одну или несколько делеций, вставок или замен из природных или неприродных аминокислот (например, производные, гомологи и фрагменты CCR3) по сравнению с последовательностью аминокислот природного CCR3. Последовательность аминокислот варианта CCR3 является идентичной по меньшей мере на 80%, идентичной по меньшей мере на 90% или идентичной по меньшей мере на 95% последовательности природного CCR3.
[0036] Термин "антагонист CCR3" относится к соединению, которое, например, частично или полностью блокирует, снижает, предотвращает, ингибирует и уменьшает активность CCR3. Термин "антагонист CCR3" также относится к соединению, которое связывается, задерживает активацию, дезактивирует или десенсибилизирует рецептор CCR3. Антагонист CCR3 может действовать, мешая взаимодействию рецептора CCR3 и его хемокинового лиганда, включая, но не ограничиваясь указанным, эотаксин (CCL11), эотаксин-3 (CCL26), MCP-3 (CCL7), MCP-4 (CCL13) и/или RANTES (CCL5).
[0037] Термины "CCR3-опосредованное нарушение или заболевание» и «состояние, нарушение или заболевание, опосредованное CCR3» относятся к состоянию, нарушению или заболеванию, характеризуемому неподходящей, например, ниже или выше нормальной, активностью CCR3. Неподходящая функциональная активность CCR3 может возникать в результате экспрессии CCR3 в клетках, которые обычно не экспрессируют CCR3, повышенной экспрессии CCR3 или степени внутриклеточной активации, приводя, например, к воспалительным или связанным с иммунной системой нарушениям или заболеваниям; или в результате пониженной экспрессии CCR3. CCR3-опосредованное состояние, нарушение или заболевание может быть полностью или частично опосредованным неподходящей активностью CCR3. В частности, CCR3-опосредованное состояние, нарушение или заболевание представляет собой то, при котором модулирование рецептора CCR3 приводит к некоторому влиянию на лежащее в основе состояние или нарушение, например, антагонист или агонист приводит к некоторому улучшению по крайней мере у некоторых пациентов, подвергаемых лечению.
Соединения
[0038] Изобретение относится к 2,5-дизамещенным арилсульфонамидам, которые можно использовать для модулирования активности CCR3. Также изобретение относится к фармацевтическим композициям, которые включают соединения, и к способам применения соединений и композиций для лечения CCR3-опосредованного нарушения, заболевания или состояния.
[0039] В одном варианте осуществления изобретение относится к 2,5-дизамещенному арилсульфонамиду формулы Ia:
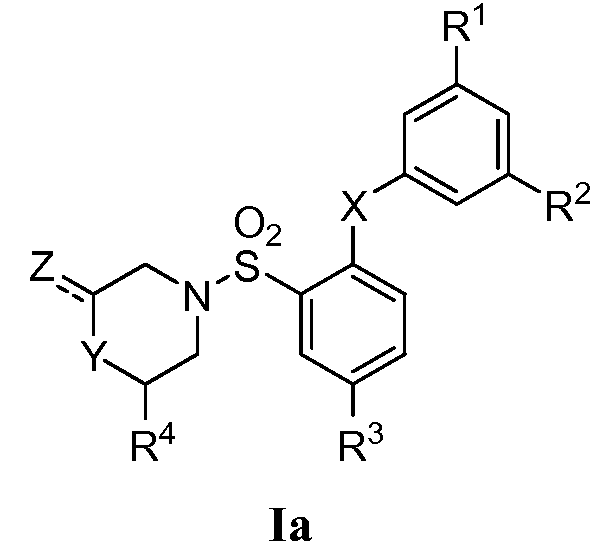
или его фармацевтически приемлемой соли, сольвату, гидрату, стереоизомеру или таутомеру; где
X представляет собой S, SO или SO2;
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =О, CO2R6 или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или C1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R1 и R2 независимо представляют собой галоген, С1-6 алкил или С1-6 галогеналкил;
R3 представляет собой CN или NO2;
R4 представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R5 представляет собой водород или С1-6 алкил; и
R6 представляет собой водород или С1-6 алкил.
[0040] В некоторых вариантах осуществления формулы Ia, X представляет собой S. В некоторых вариантах осуществления формулы Ia, X представляет собой SO. В некоторых вариантах осуществления формулы Ia, X представляет собой SO2.
[0041] В некоторых вариантах осуществления формулы Ia, Y представляет собой NR5. В вариантах осуществления формулы Ia, где Y представляет собой NR5, Z представляет собой =О или С1-6 алкил, необязательно замещенный. В одном варианте осуществления формулы Ia, где Y представляет собой NR5, Z представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В одном варианте осуществления формулы Ia, где Y представляет собой NR5, Z представляет собой -CH3. В другом варианте осуществления формулы Ia, где Y представляет собой NR5, Z представляет собой CO2R6. В одном варианте осуществления формулы Ia, где Y представляет собой NR5 и Z представляет собой CO2R6, R6 представляет собой СН3. В одном варианте осуществления формулы Ia, где Y представляет собой NR5, Z представляет собой CO2CH3. В другом варианте осуществления формулы Ia, где Y представляет собой NR5, Z представляет собой =О. В различных вариантах осуществления формулы Ia, где Y представляет собой NR5, R5 представляет собой водород или С1-6 алкил. В некоторых вариантах осуществления формулы Ia, где Y представляет собой NR5, R5 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы Ia, где Y представляет собой NR5, R5 представляет собой водород. В некоторых вариантах осуществления формулы Ia, где Y представляет собой NR5, R5 представляет собой метил. В некоторых вариантах осуществления формулы I, где Y представляет собой NR5, R5 представляет собой изопропил.
[0042] В некоторых вариантах осуществления формулы Ia, Y представляет собой CH2, CHF, CHCH3, O, S или SO2. В вариантах осуществления формулы Ia, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой водород или С1-6 алкил, необязательно замещенный. В некоторых вариантах осуществления формулы Ia, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой водород. В некоторых вариантах осуществления формулы Ia, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В некоторых вариантах осуществления формулы Ia, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой метил. В некоторых вариантах осуществления формулы I, Y представляет собой CH2. В некоторых вариантах осуществления формулы Ia, Y представляет собой CHF. В некоторых вариантах осуществления формулы Ia, Y представляет собой CHCH3. В некоторых вариантах осуществления формулы Ia, Y представляет собой O. В некоторых вариантах осуществления формулы Ia, Y представляет собой S. В некоторых вариантах осуществления формулы Ia, Y представляет собой SO2.
[0043] В некоторых вариантах осуществления формулы Ia, R1 представляет собой галоген, С1-6 алкил или С1-6 галогеналкил. В некоторых вариантах осуществления формулы Ia, R1 представляет собой галоген. В некоторых вариантах осуществления формулы Ia, R1 представляет собой фтор или хлор. В некоторых вариантах осуществления формулы Ia, R1 представляет собой хлор. В некоторых вариантах осуществления формулы Ia, R1 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы Ia, R1 представляет собой метил. В некоторых вариантах осуществления формулы Ia, R1 представляет собой С1-6 галогеналкил. В некоторых вариантах осуществления формулы Ia, R1 представляет собой трифторметил.
[0044] В некоторых вариантах осуществления формулы Ia, R2 представляет собой галоген, С1-6 алкил или С1-6 галогеналкил. В некоторых вариантах осуществления формулы Ia, R2 представляет собой галоген. В некоторых вариантах осуществления формулы Ia, R2 представляет собой фтор или хлор. В некоторых вариантах осуществления формулы Ia, R2 представляет собой хлор. В некоторых вариантах осуществления формулы Ia, R2 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы Ia, R2 представляет собой метил. В некоторых вариантах осуществления формулы Ia, R2 представляет собой С1-6 галогеналкил. В некоторых вариантах осуществления формулы Ia, R2 представляет собой трифторметил.
[0045] В некоторых вариантах осуществления формулы Ia, R1 и R2 являются разными. В некоторых вариантах осуществления формулы Ia, R1 и R2 являются одинаковыми. В некоторых вариантах осуществления формулы Ia, оба R1 и R2 представляют собой хлор. В некоторых вариантах осуществления формулы Ia, оба R1 и R2 представляют собой метил. В некоторых вариантах осуществления формулы Ia, оба R1 и R2 представляют собой трифторметил.
[0046] В некоторых вариантах осуществления формулы Ia, R3 представляет собой циано. В некоторых вариантах осуществления формулы Ia, R3 представляет собой нитро.
[0047] В некоторых вариантах осуществления формулы Ia, R4 представляет собой водород или С1-6 алкил, необязательно замещенный. В некоторых вариантах осуществления формулы Ia, R4 представляет собой водород. В некоторых вариантах осуществления формулы Ia, R4 представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В некоторых вариантах осуществления формулы Ia, R4 представляет собой метил.
[0048] В другом варианте осуществления, настоящее изобретение относится 2,5-дизамещенному арилсульфонамиду формулы I или его фармацевтически приемлемой соли, сольвату, гидрату, стереоизомеру или таутомеру:
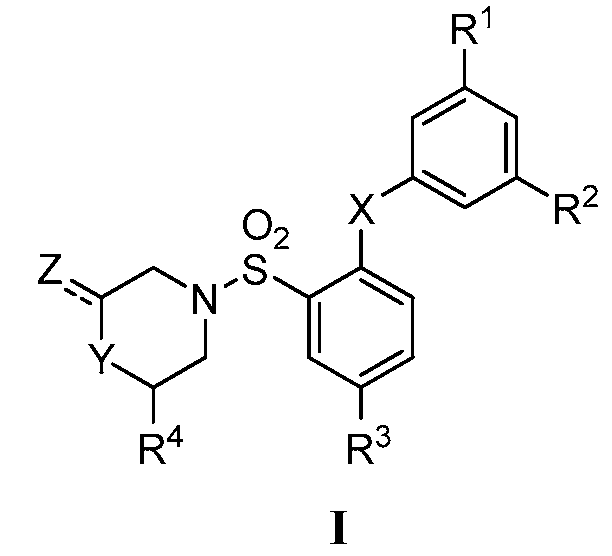
где
X представляет собой S, SO или SO2;
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =О или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R1 и R2 независимо представляют собой галоген, С1-6 алкил или С1-6 галогеналкил;
R3 представляет собой CN или NO2;
R4 представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; и
R5 представляет собой водород или С1-6 алкил.
[0049] В некоторых вариантах осуществления формулы I, X представляет собой S. В некоторых вариантах осуществления формулы I, X представляет собой SO. В некоторых вариантах осуществления формулы I, X представляет собой SO2.
[0050] В некоторых вариантах осуществления формулы I, Y представляет собой NR5. В вариантах осуществления формулы I, где Y представляет собой NR5, Z представляет собой =О или С1-6 алкил, необязательно замещенный. В одном варианте осуществления формулы I, где Y представляет собой NR5, Z представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В одном варианте осуществления формулы I, где Y представляет собой NR5, Z представляет собой -CH3. В другом варианте осуществления формулы I, где Y представляет собой NR5, Z представляет собой =О. В различных вариантах осуществления формулы I, где Y представляет собой NR5, R5 представляет собой водород или С1-6 алкил. В некоторых вариантах осуществления формулы I, где Y представляет собой NR5, R5 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы I, где Y представляет собой NR5, R5 представляет собой водород. В некоторых вариантах осуществления формулы I, где Y представляет собой NR5, R5 представляет собой метил. В некоторых вариантах осуществления формулы I, где Y представляет собой NR5, R5 представляет собой изопропил.
[0051] В некоторых вариантах осуществления формулы I, Y представляет собой CH2, CHF, CHCH3, O, S или SO2. В вариантах осуществления формулы I, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой водород или С1-6 алкил, необязательно замещенный. В некоторых вариантах осуществления формулы I, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой водород. В некоторых вариантах осуществления формулы I, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В некоторых вариантах осуществления формулы I, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой метил. В некоторых вариантах осуществления формулы I, Y представляет собой CH2. В некоторых вариантах осуществления формулы I, Y представляет собой CHF. В некоторых вариантах осуществления формулы I, Y представляет собой CHCH3. В некоторых вариантах осуществления формулы I, Y представляет собой O. В некоторых вариантах осуществления формулы I, Y представляет собой S. В некоторых вариантах осуществления формулы I, Y представляет собой SO2.
[0052] В некоторых вариантах осуществления формулы I, R1 представляет собой галоген, С1-6 алкил или С1-6 галогеналкил. В некоторых вариантах осуществления формулы I, R1 представляет собой галоген. В некоторых вариантах осуществления формулы I, R1 представляет собой фтор или хлор. В некоторых вариантах осуществления формулы I, R1 представляет собой хлор. В некоторых вариантах осуществления формулы I, R1 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы I, R1 представляет собой метил. В некоторых вариантах осуществления формулы I, R1 представляет собой С1-6 галогеналкил. В некоторых вариантах осуществления формулы I, R1 представляет собой трифторметил.
[0053] В некоторых вариантах осуществления формулы I, R2 представляет собой галоген, С1-6 алкил или С1-6 галогеналкил. В некоторых вариантах осуществления формулы I, R2 представляет собой галоген. В некоторых вариантах осуществления формулы I, R2 представляет собой фтор или хлор. В некоторых вариантах осуществления формулы I, R2 представляет собой хлор. В некоторых вариантах осуществления формулы I, R2 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы I, R2 представляет собой метил. В некоторых вариантах осуществления формулы I, R2 представляет собой С1-6 галогеналкил. В некоторых вариантах осуществления формулы I, R2 представляет собой трифторметил.
[0054] В некоторых вариантах осуществления формулы I, R1 и R2 являются разными. В некоторых вариантах осуществления формулы I, R1 и R2 являются одинаковыми. В некоторых вариантах осуществления формулы I, оба R1 и R2 представляют собой хлор. В некоторых вариантах осуществления формулы I, оба R1 и R2 представляют собой метил. В некоторых вариантах осуществления формулы I, оба R1 и R2 представляют собой трифторметил.
[0055] В некоторых вариантах осуществления формулы I, R3 представляет собой циано. В некоторых вариантах осуществления формулы I, R3 представляет собой нитро.
[0056] В некоторых вариантах осуществления формулы I, R4 представляет собой водород или С1-6 алкил, необязательно замещенный. В некоторых вариантах осуществления формулы I, R4 представляет собой водород. В некоторых вариантах осуществления формулы I, R4 представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В некоторых вариантах осуществления формулы I, R4 представляет собой метил.
[0057] В другом варианте осуществления, настоящее изобретение относится к 2,5-дизамещенному арилсульфонамиду формулы II или его фармацевтически приемлемой соли, сольвату, гидрату, стереоизомеру или таутомеру:

где Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =О или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном;
R1 и R2 независимо представляют собой галоген, С1-6 алкил или С1-6 галогеналкил;
R4 представляет собой водород или С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном; и
R5 представляет собой водород или С1-6 алкил;
при условии, что если Y представляет собой CH2, по крайней мере один из Z и R4 представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном.
[0058] В некоторых вариантах осуществления формулы II, Y представляет собой NR5. В вариантах осуществления формулы II, где Y представляет собой NR5, Z представляет собой =О или С1-6 алкил, необязательно замещенный. В одном варианте осуществления формулы II, где Y представляет собой NR5, Z представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В одном варианте осуществления формулы II, где Y представляет собой NR5, Z представляет собой -CH3. В другом варианте осуществления формулы II, где Y представляет собой NR5, Z представляет собой =О. В различных вариантах осуществления формулы II, где Y представляет собой NR5, R5 представляет собой водород или С1-6 алкил. В некоторых вариантах осуществления формулы II, где Y представляет собой NR5, R5 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы II, где Y представляет собой NR5, R5 представляет собой водород. В некоторых вариантах осуществления формулы II, где Y представляет собой NR5, R5 представляет собой метил. В некоторых вариантах осуществления формулы II, где Y представляет собой NR5, R5 представляет собой изопропил.
[0059] В некоторых вариантах осуществления формулы II, Y представляет собой CH2, CHF, CHCH3, O, S или SO2. В вариантах осуществления формулы II, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой водород или С1-6 алкил, необязательно замещенный. В некоторых вариантах осуществления формулы II, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой водород. В некоторых вариантах осуществления формулы II, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В некоторых вариантах осуществления формулы II, где Y представляет собой CH2, CHF, CHCH3, O, S или SO2, Z представляет собой метил. В некоторых вариантах осуществления формулы II, Y представляет собой CH2. В вариантах осуществления формулы II, где Y представляет собой CH2, по крайней мере один из Z и R4 представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В некоторых вариантах осуществления формулы II, Y представляет собой CHF. В некоторых вариантах осуществления формулы II, Y представляет собой CHCH3. В некоторых вариантах осуществления формулы II, Y представляет собой O. В некоторых вариантах осуществления формулы II, Y представляет собой S. В некоторых вариантах осуществления формулы II, Y представляет собой SO2.
[0060] В некоторых вариантах осуществления формулы II, R1 представляет собой галоген, С1-6 алкил или С1-6 галогеналкил. В некоторых вариантах осуществления формулы II, R1 представляет собой галоген. В некоторых вариантах осуществления формулы II, R1 представляет собой фтор или хлор. В некоторых вариантах осуществления формулы II, R1 представляет собой хлор. В некоторых вариантах осуществления формулы II, R1 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы II, R1 представляет собой метил. В некоторых вариантах осуществления формулы II, R1 представляет собой С1-6 галогеналкил. В некоторых вариантах осуществления формулы II, R1 представляет собой трифторметил.
[0061] В некоторых вариантах осуществления формулы II, R2 представляет собой галоген, С1-6 алкил или С1-6 галогеналкил. В некоторых вариантах осуществления формулы II, R2 представляет собой галоген. В некоторых вариантах осуществления формулы II, R2 представляет собой фтор или хлор. В некоторых вариантах осуществления формулы II, R2 представляет собой хлор. В некоторых вариантах осуществления формулы II, R2 представляет собой С1-6 алкил. В некоторых вариантах осуществления формулы II, R2 представляет собой метил. В некоторых вариантах осуществления формулы II, R2 представляет собой С1-6 галогеналкил. В некоторых вариантах осуществления формулы II, R2 представляет собой трифторметил.
[0062] В некоторых вариантах осуществления формулы II, R1 и R2 являются разными. В некоторых вариантах осуществления формулы II, R1 и R2 являются одинаковыми. В некоторых вариантах осуществления формулы II, оба R1 и R2 представляют собой хлор. В некоторых вариантах осуществления формулы II, оба R1 и R2 представляют собой метил. В некоторых вариантах осуществления формулы II, оба R1 и R2 представляют собой трифторметил.
[0063] В некоторых вариантах осуществления формулы II, R4 представляет собой водород или С1-6 алкил, необязательно замещенный. В некоторых вариантах осуществления формулы II, R4 представляет собой водород. В некоторых вариантах осуществления формулы II, R4 представляет собой С1-6 алкил, необязательно замещенный арилом, гидрокси, карбокси, алкокси, карбамоилом или галогеном. В некоторых вариантах осуществления формулы II, R4 представляет собой метил.
[0064] В некоторых вариантах осуществления, изобретение относится к соединению, выбранному из группы, состоящей из:


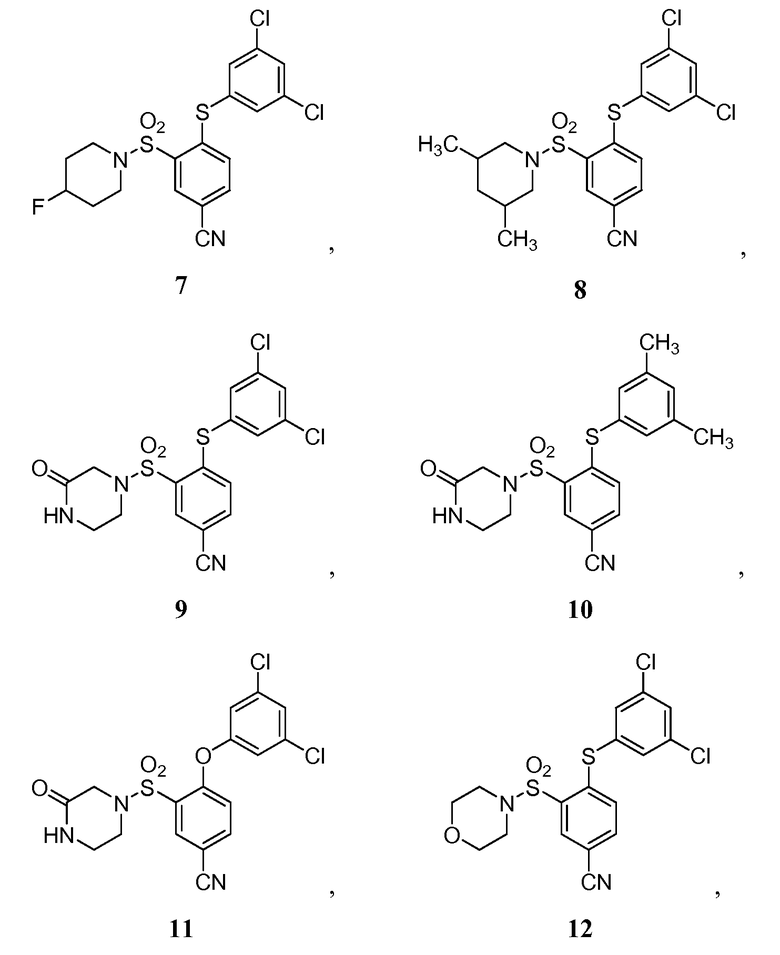

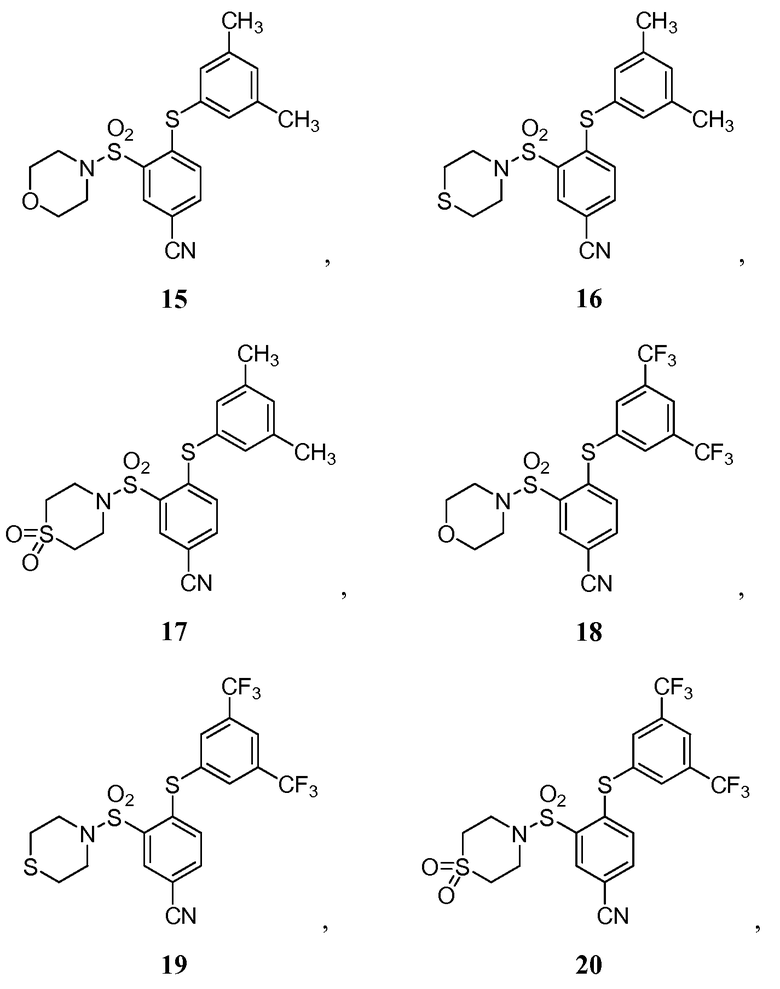




или его фармацевтически приемлемой соли, сольвату, гидрату, стереоизомеру или таутомеру.
[0065] Подразумевается, что разработанные в изобретении соединения охватывают все возможные стереоизомеры, если не определена определенная стереохимия. В том случае, когда разработанные в изобретении соединения содержат алкенильную или алкениленовую группу, соединение может существовать в виде одного или в виде смеси геометрических цис/транс (или Z/E) изомеров. В том случае, когда структурные изомеры превращаются друг в друга через низкий энергетический барьер, соединение может существовать в виде единственного таутомера или в виде смеси таутомеров. Это может быть результатом протонной таутомерии в соединении, которое содержит, например, имино, кето или оксимную группу; или так называемой валентной таутомерии в соединении, которое содержит ароматический фрагмент. Отсюда следует, что одно соединение может проявлять более одного типа изомерии.
[0066] Разработанные в изобретении соединения могут быть энантиомерно чистыми, например, в виде единственного энантиомера или единственного стереоизомера, или представлять собой стереоизомерные смеси, например, смесь энантиомеров, например, рацемическую смесь двух энантиомеров или смесь двух или более диастереомеров. По существу, специалисту в данной области будет понятно, что введение соединения в его (R) форме эквивалентно, для соединений, которые подвергаются эпимеризации in vivo, введению соединения в его (S) форме. Общепринятые методы получения/выделения индивидуальных энантиомеров включают синтез из подходящего оптически чистого предшественника, асимметрический синтез из ахиральных исходных веществ или разделение энатиомерной смеси, например, хиральная хроматография, перекристаллизация, разделение, образование диастереомерной соли или переведение в диастереомерные аддукты с последующим разделением.
[0067] Разработанные в изобретении соединения также могут быть изотопно меченными по одному или нескольким сайтам молекулы. В некоторых вариантах осуществления, разработанные в изобретении соединения могут быть селективно дейтерированы по сайту, который замедляет скорость метаболической деактивации, например, для увеличения циркуляционного периода полувыведения in vivo.
[0068] Когда разработанное в изобретении соединение содержит кислотный или основный фрагмент, оно также может быть получено в виде фармацевтически приемлемой соли (см., Berge et al., J. Pharm. Sci. 1977, 66, 1-19; и "Handbook of Pharmaceutical Salts, Properties, and Use," Stahl and Wermuth, Ed.; Wiley-VCH and VHCA, Zurich, 2002).
[0069] Подходящие кислоты для использования при получении фармацевтически приемлемых солей включают, но не ограничиваются указанным, уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, борную кислоту, (+)-камфорную кислоту, камфорсульфоновую кислоту, (+)-(1S)-камфор-10-сульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, циклогексансульфаминовую кислоту, додецилсерную кислоту, этан-1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2-гидрокси-этансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактуроновую кислоту, гентизиновую кислоту, глюкогептановую кислоту, D-глюконовую кислоту, D-глюкуроновую кислоту, L-глутаминовую кислоту, α-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, хлористоводородную кислоту, иодистоводородную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, лауровую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, перхлорную кислоту, фосфорную кислоту, L-пироглутаминовую кислоту, сахарную кислоту, салициловую кислоту, 4-амино-салициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту, ундециленовую кислоту и валериановую кислоту.
[0070] Подходящие основания для использования при получении фармацевтически приемлемых солей включают, но не ограничиваясь указанным, неорганические основания, такие как гидроксид магния, гидроксид кальция, гидроксид калия, гидроксид цинка или гидроксид натрия; и органические основания, такие как первичные, вторичные, третичные и четвертичные алифатические и ароматические амины, включая L-аргинин, бенетамин, бензатин, холин, деанол, диэтаноламин, диэтиламин, диметиламин, дипропиламин, диизопропиламин, 2-(диэтиламино)этанол, этаноламин, этиламин, этилендиамин, изопропиламин, N-метил-глюкамин, гидрабамин, 1Н-имидазол, L-лизин, морфолин, 4-(2-гидроксиэтил)морфолин, метиламин, пиперидин, пиперазин, пропиламин, пирролидин, 1-(2-гидроксиэтил)пирролидин, пиридин, хинуклидин, хинолин, изохинолин, вторичные амины, триэтаноламин, триметиламин, триэтиламин, N-метил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол и трометамин.
[0071] Разработанное в изобретении соединение также может быть получено в виде пролекарства, которое представляет собой функциональное производное соединения, например, формулы I или формулы II, и легко превращается в исходное соединение in vivo. Пролекарства часто используют, поскольку в некоторых ситуациях их можно легче применять, чем исходное соединение. Они, например, могут быть биодоступными при пероральном введении, тогда как исходное соединение не является биодоступным. Пролекартво также может обладать более высокой растворимостью в фармацевтических композициях по сравнению с исходным соединением. Пролекарство может превращаться в исходное лекарственное средство по различным механизмам, включая энзиматические процессы и метаболический гидролиз. Смотри, Harper, Progress in Drug Research 1962, 4, 221-294; Morozowich et al. in "Design of Biopharmaceutical Properties through Prodrugs and Analogs," Roche Ed., APHA Acad. Pharm. Sci. 1977; "Bioreversible Carriers in Drug in Drug Design, Theory and Application," Roche Ed., APHA Acad. Pharm. Sci. 1987; "Design of Prodrugs," Bundgaard, Elsevier, 1985; Wang et al., Curr. Pharm. Design 1999, 5, 265-287; Pauletti et al., Adv. Drug. Delivery Rev. 1997, 27, 235-256; Mizen et al., Pharm. Biotech. 1998, 11, 345-365; Gaignault et al., Pract. Med. Chem. 1996, 671-696; Asgharnejad in "Transport Processes in Pharmaceutical Systems," Amidon et al., Ed., Marcell Dekker, 185-218, 2000; Balant et al., Eur. J. Drug Metab. Pharmacokinet. 1990, 15, 143-53; Balimane and Sinko, Adv. Drug Delivery Rev. 1999, 39, 183-209; Browne, Clin. Neuropharmacol. 1997, 20, 1-12; Bundgaard, Arch. Pharm. Chem. 1979, 86, 1-39; Bundgaard, Controlled Drug Delivery 1987, 17, 179-96; Bundgaard, Adv. Drug Delivery Rev. 1992, 8, 1-38; Fleisher et al., Adv. Drug Delivery Rev. 1996, 19, 115-130; Fleisher et al., Methods Enzymol. 1985, 112, 360-381; Farquhar et al., J. Pharm. Sci. 1983, 72, 324-325; Freeman et al., J. Chem. Soc, Chem. Commun. 1991, 875-877; Friis and Bundgaard, Eur. J. Pharm. Sci. 1996, 4, 49-59; Gangwar et al., Des. Biopharm. Prop. Prodrugs Analogs, 1977, 409-421; Nathwani and Wood, Drugs 1993, 45, 866-94; Sinhababu and Thakker, Adv. Drug Delivery Rev. 1996, 19, 241-273; Stella et al., Drugs 1985, 29, 455-73; Tan et al., Adv. Drug Delivery Rev. 1999, 39, 117-151; Taylor, Adv. Drug Delivery Rev. 1996, 19, 131-148; Valentino and Borchardt, Drug Discovery Today 1997, 2, 148-155; Wiebe and Knaus, Adv. Drug Delivery Rev. 1999, 39, 63-80; и Waller et al., Br. J. Clin. Pharmac. 1989, 28, 497-507.
Способы синтеза
[0072] Разработанные в данном изобретении соединения могут быть получены, выделены или синтезированы любыми способами, известными специалисту в данной области. Например, соединение формулы Ia или формулы I может быть получено по синтетической схеме, как проиллюстрировано на схеме 1. На первой стадии нитробензол взаимодействует с 1,3,5-тризамещенным бензолом в присутствии основания (такого как карбонат калия или гидрид натрия) в реакции ароматического замещения. Продукт - нитроарил, восстанавливают с использованием восстановителя (такого как TiCl2 или гидросульфит натрия) в анилин, который затем преобразовывают в сульфонилхлорид по реакции Зандмейера. Соединение формулы Ia или формулы I образуется по реакции сульфонилхлорида с подходящим азотсодержащим гетероциклом в присутствии основания, такого как триэтиламин.
Схема 1

[0073] Соединение формулы II может быть получено по синтетической схеме, аналогичной проиллюстрированной на схеме 1.
[0074] Соединение формулы Ia или формулы I также может быть получено по синтетической схеме, проиллюстрированной на схеме 2. На первой стадии, анилин первоначально преобразовывают в сульфонилхлорид посредством реакции Зандмейера. Впоследствии сульфонилхлорид подвергают взаимодействию с подходящим азотсодержащим гетероциклом в присутствии основания, такого как триэтиламин, с образованием 2-хлор-5-замещенного сульфонамида, который затем подвергают взаимодействию с подходящим 1,3,5-тризамещенным бензолом по реакции ароматического замещения в присутствии основания, такого как карбонат калия или гидрид натрия, с образованием соединения формулы Ia или формулы I.
Схема 2

[0075] Соединение формулы II может быть получено по синтетической схеме, аналогичной проиллюстрированной на схеме 2.
Фармацевтические композиции
[0076] Изобретение относится к фармацевтическим композициям, включающим разработанное в изобретении соединение, например, соединение формулы Ia, формулы I или формулы II, или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер или таутомер, в качестве активного ингредиента в сочетании с фармацевтически приемлемым переносчиком, носителем, разбавителем или эксципиентом или их смесью.
[0077] Разработанное в данном изобретении соединение можно вводить само по себе или в сочетании вместе с одним или несколькими разработанными в данном изобретении соединениями. Фармацевтическая композиция, которая включает разработанное в изобретении соединение, например, соединение формулы Ia, формулы I или формулы II, может быть получена в различных препаративных лекарственных формах для перорального, парентерального или местного введения. Фармацевтические композиции также могут быть получены в виде модифицированных препаративных лекарственных форм, включая препаративные лекарственные формы замедленного, отсроченного, пролонгированного, продолжительного, импульсного, контролируемого, ускоренного и быстрого, направленного, программируемого высвобождения и удерживаемые в желудке препаративные лекарственные формы. Данные препаративные лекарственные формы могут быть получены в соответствии с общепринятыми способами и методами, известными специалистам в данной области (см. Remington: The Science and Practice of Pharmacy, выше; Modified-Release Drug Deliver Technology, Rathbone et al., Eds., Drugs и the Pharmaceutical Science, Marcel Dekker, Inc.: New York, NY, 2003; Vol. 126).
[0078] В одном варианте осуществления, фармацевтические композиции разработаны в виде препаративной лекарственной формы для перорального введения, которая включает разработанное в изобретении соединение, например, соединение формулы Ia, формулы I или формулы II, или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер или таутомер, и один или несколько фармацевтически приемлемых эксципиентов или носителей.
[0079] В другом варианте осуществления, фармацевтические композиции получены в препаративной лекарственной форме для парентерального введения, которая включает разработанное в изобретении соединение, например, соединение формулы Ia, формулы I или формулы II или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер или таутомер и один или несколько фармацевтически приемлемых эксципиентов или носителей.
[0080] В следующем варианте осуществления, фармацевтические композиции получены в препаративной лекарственной форме для местного введения, которая включает разработанное в изобретении соединение, например, соединение формулы Ia, формулы I или формулы II или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер или таутомер и один или несколько фармацевтически приемлемых эксципиентов или носителей; и один или несколько фармацевтически приемлемых эксципиентов или носителей.
[0081] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде единичной препаративной лекарственной формы или многодозовой препаративной лекарственной формы. Термин «единичная препаративная лекарственная форма», как он использован в данном описании, относится к физически дискретной единице, подходящей для введения субъекту - человеку и животному, и упакованной индивидуально, как это известно в данной области. Каждая единичная препаративная лекарственная форма содержит предварительно определенное количество активного ингредиента(ов), достаточное для оказания желаемого терапевтического действия, в сочетании с требуемыми фармацевтическими носителями или эксципиентами. Примеры единичной препаративной лекарственной формы включают ампулу, шприц и индивидуально упакованную таблетку или капсулу. Единичную препаративную лекарственную форму можно вводить частями или вводить их множество. Множественная препаративная лекарственная форма представляет собой множество идентичных единичных препаративных лекарственных форм, упакованных в единственный контейнер для введения в виде отдельных единичных препаративных лекарственных форм. Примеры множественных препаративных лекарственных форм включают пузырек, бутылку с таблетками или капсулами или бутылку с пинтами или галлонами.
[0082] Разработанные в данном изобретении фармацевтические композиции можно вводить один раз или множество раз через промежутки времени. Следует понимать, что точная дозировка и продолжительность лечения может изменяться с возрастом, весом и состоянием пациента, подвергаемого лечению, и может быть определена эмпирически с использованием известных протоколов тестирования или экстраполяцией данных тестов in vivo или in vitro или диагностических данных. Дополнительно следует понимать, что для любого конкретного индивидуума определенные режимы дозировки следует корректировать с течением времени в соответствии с необходимостью индивидуума и профессиональным суждением специалиста, вводящего или следящего за введением препаратов.
A. Пероральное введение
[0083] Разработанные в данном изобретении фармацевтические композиции могут быть получены в твердой, полутвердой или жидкой препаративных лекарственных формах для перорального введения. Как использовано в данном описании, пероральное введение также включает буккальное, лингвальное и сублингвальное введение. Подходящие пероральные препаративные лекарственные формы включают, но не ограничиваются указанным, таблетки, быстрорастворимые во рту таблетки, жевательные таблетки, капсулы, пилюли, лепешки, пастилки, облатки, подушечки, пеллеты, жевательную резинку с лекарственным средством, объемные порошки, шипучие или нешипучие порошки или гранулы, растворы, эмульсии, суспензии, облатки, карамельные крошки, эликсиры и сиропы. Помимо активного ингредиента(ов) фармацевтические композиции могут содержать один или несколько фармацевтически приемлемых носителей или эксципиентов, включая, но не ограничиваясь указанным, связующие вещества, наполнители, разбавители, дезинтегрирующие агенты, смачивающие агенты, лубриканты, глиданты, красители, ингибиторы изменения цвета, подсластители и ароматизаторы.
[0084] Связующие вещества или грануляторы придают таблетке связывающую способность, гарантирующую сохранность таблетки во время прессования. Подходящие связующие вещества или грануляторы включают, но не ограничиваются указанным, крахмалы, такие как кукурузный крахмал, картофельный крахмал и предварительно желатинизированный крахмал (например, STARCH 1500); желатин; сахара, такие как сахароза, глюкоза, декстроза, мелисса и лактоза; природные и синтетические камеди, такие как гуммиарабик, альгиновая кислота, альгинаты, экстракт ирландского мха (карраген), панваровую камедь, камедь гхатти, смесь растворов камедей шелухи изабгола, карбоксиметилцеллюлозу, метилцеллюлозу, поливинилпирролидон (PVP), вигум, арабиногалактан из древесины лиственницы, порошковую трагакантовую камедь и гуаровую камедь; целлюлозы, такие как этилцеллюлоза, ацетат целлюлозы, кальций карбоксиметилцеллюлоза, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиэтилцеллюлоза (HEC), гидроксипропилцеллюлоза (HPC), гидроксипропилметилцеллюлоза (HPMC); микрокристаллические целлюлозы, такие как AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (FMC Corp., Marcus Hook, PA); и их смеси. Подходящие наполнители включают, но не ограничиваются указанным, тальк, карбонат кальция, микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, предварительно желатинизированный крахмал и их смеси. Связующее вещество и наполнитель могут присутствовать в разработанной в изобретении композиции в количестве от примерно 50 примерно до 99% по весу.
[0085] Подходящие разбавители включают, но не ограничиваются указанным, дикальций фосфат, сульфат кальция, лактозу, сорбит, сахарозу, инозитол, целлюлозу, каолин, маннит, хлорид натрия, сухой крахмал и порошкообразный сахар. Некоторые разбавители, такие как маннит, лактоза, сорбит, сахароза и инозитол, когда они присутствуют в достаточных количествах, могут придавать свойства некоторым прессованным таблеткам, которые дают возможность разрушения во рту при жевании. Такие прессованные таблетки можно использовать в качестве жевательных таблеток.
[0086] Подходящие дезинтегрирующие агенты включают, но не ограничиваются указанным, агар; бентонит; целлюлозы, такие как метилцеллюлоза и карбоксиметилцеллюлоза; древесные продукты; природную губку; катионообменные смолы; альгиновую кислоту; камеди, такие как гуаровая камедь и вигум HV; цитрусовую мякоть; сшитые целлюлозы, такие как кроскармеллоза; сшитые полимеры, такие как кросповидон; сшитые крахмалы; карбонат кальция; микрокристаллическую целлюлозу, такую как крахмалгликолят натрия; полакрилин калия; крахмалы, такие как кукурузный крахмал, картофельный крахмал, тапиоковый крахмал и предварительно желированный крахмал; глины; лигнины и их смеси. Количество дезинтегрирующего агента в разработанных в изобретении фармацевтических композициях изменяется в зависимости от типа препарата и легко определяется обычными специалистами в данной области. Разработанные в изобретении композиции могут содержать от примерно 0,5 примерно до 15% или от примерно 1 примерно до 5% по весу дезинтегрирующего агента.
[0087] Подходящие лубриканты включают, но не ограничиваются указанным, стеарат кальция; стеарат магния; нефть; светлые нефтяные продукты; глицерин; сорбит; маннит; гликоли, такие как глицеринбегенат и полиэтиленгликоль (ПЭГ); стеариновую кислоту; лаурилсульфат натрия; тальк; гидрированное растительное масло, включая арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; стеарат цинка; этилолеат; этиллаурат; агар; крахмал; ликоподий; диоксид кремния или сликагели, такие как AEROSIL® 200 (W.R. Grace Co., Baltimore, MD) и CAB-O-SIL® (Cabot Co. of Boston, MA); и их смеси. Разработанные в данном изобретении композиции могут содержать примерно от 0,1 примерно до 5% лубриканта по весу.
[0088] Подходящие глиданты (регулятор сыпучести) включают коллоидный диоксид кремния, CAB-O-SIL® (Cabot Co. of Boston, MA) и не содержащий асбеста тальк. Красители включают любой из одобренных сертифицированных растворимых в воде красителей FD&C и не растворимые в воде красители FD&C, суспендированные в гидрате оксида алюминия, красочные лаки и их смеси. Красочный лак представляет собой комбинацию адсорбированного растворимого в воде красителя на водном оксиде тяжелого металла, что приводит к образованию нерастворимой формы красителя. Ароматизаторы включают природные ароматизаторы, экстрагированные из растений, таких как фрукты, и синтетические смеси соединений, которые дают ощущение приятного вкуса, такие как мятное масло и метилсалицилат. Подсластители включают сахарозу, лактозу, маннит, сиропы, глицерин и искусственные подсластители, такие как сахарин и аспартам. Подходящие эмульгаторы включают желатин, гуммиарабик, трагакантовую камедь, бентонит и поверхностно-активные вещества, такие как полиоксиэтиленсорбит моноолеат (TWEEN® 20), полиоксиэтиленсорбит моноолеат 80 (TWEEN® 80) и триэтаноламинолеат. Суспендирующие и диспергирующие агенты включают карбоксиметилцеллюлозу натрия, пектин, трагакантовую камедь, вигум, гуммиарабик, карбометилцеллюлозу натрия, гидроксипропилметилцеллюлозу и поливинилпирролидон. Консерванты включают глицерин, метил- и пропилпарабен, бензойную кислоту, бензоат натрия и спирт. Смачивающие агенты включают моностеарат пропиленгликоля, сорбитанмоноолеат, монолаурат диэтиленгликоля и полиоксиэтиленовый лауриловый простой эфир. Растворители включают глицерин, сорбит, этиловый спирт и сироп. Примеры неводных жидкостей, используемых в эмульсиях, включают нефть и хлопковое масло. Органические кислоты включают лимонную и винную кислоту. Источники диоксида углерода включают бикарбонат натрия и карбонат натрия.
[0089] Следует понимать, что многие носители и эксципиенты могут выполнять несколько функций даже в одном и том же препарате.
[0090] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде прессованных таблеток, растертых в порошок таблеток, жевательных пастилок, быстро растворяющихся таблеток, прессованных таблеток сложной структуры или таблеток с растворимой в кишечнике оболочкой, таблеток с сахарной оболочкой или с пленочным покрытием. Таблетки с растворимой в кишечнике оболочкой представляют собой прессованные таблетки, покрытые веществами, которые устойчивы к действию кислоты в желудке, но растворяются и разрушаются в кишечнике, таким образом защищая активные ингредиенты от кислой окружающей среды желудка. Оболочки для растворения в кишечнике включают, но не ограничиваются указанным, жирные кислоты, жиры, фенилсалицилат, воски, шеллак, аммонированный шеллак и ацетатфталаты целлюлозы. Таблетки с сахарной оболочкой представляют собой прессованные таблетки, окруженные покрытием из сахара, которое может быть полезным для маскировки неприятного вкуса или запаха и для защиты таблетки от окисления. Таблетки с пленочным покрытием представляют собой прессованные таблетки, которые покрыты тонким слоем или пленкой растворимого в воде вещества. Пленочные покрытия включают, но не ограничиваются указанным, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу натрия, полиэтиленгликоль 4000 и ацетатфталат целлюлозы. Пленочные покрытия придают те же самые общие характеристики, что и сахарные покрытия. Прессованные таблетки сложной структуры представляют собой прессованные таблетки, полученные более чем в одном цикле прессования, включая слоистые таблетки и таблетки с прессованным покрытием или сухим покрытием.
[0091] Таблетированные препаративные лекарственные формы могут быть получены из активного ингредиента в порошкообразной, кристаллической или гранулированной формах, самого по себе или в комбинации с одним или несколькими описанными здесь носителями или эксципиентами, включая связующие вещества, дезинтегрирующие вещества, контролирующие высвобождение полимеры, лубриканты, разбавители и/или красители. Ароматизаторы и подсластители являются особенно полезными при получении жевательных таблеток и пастилок.
[0092] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде мягких или твердых капсул, которые могут быть изготовлены из желатина, метилцеллюлозы, крахмала или альгината кальция. Твердая желатиновая капсула, также известная как капсула сухого наполнения (СНК), состоит из двух секций, одна перемещающаяся над другой, тем самым полностью размещая в оболочке активный ингредиент. Мягкая эластичная капсула (МЭК) является мягкой, шарообразной оболочкой, такой как желатиновая оболочка, которая пластифицирована за счет добавления глицерина, сорбита или аналогичного многоатомного спирта. Мягкие желатиновые оболочки могут содержать консервант для предотвращения роста микроорганизмов. Подходящими консервантами являются описанные в данном описании, включая метил- и пропилпарабены и сорбиновую кислоту. Разработанные в данном изобретении жидкие, полутвердые и твердые препаративные лекарственные формы могут быть заключены в капсулу. Подходящие жидкие и полутвердые препаративные лекарственные формы включают растворы и суспензии в пропиленкарбонате, растительных маслах или триглицеридах. Капсулы, содержащие такие растворы, могут быть получены, как описано в патентах США №№4328245; 4409239 и 4410545. Капсулы также могут быть покрыты оболочкой, как известно специалисту в данной области, для модификации или поддержания растворения активного ингредиента.
[0093] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде жидких и полутвердых препаративных лекарственных форм, включая эмульсии, растворы, суспензии, эликсиры и сиропы. Эмульсия представляет собой двухфазную систему, в которой одна жидкость диспергирована в виде небольших шариков в другой жидкости, и может представлять собой масло-в-воде или воду-в-масле. Эмульсии могут включать фармацевтически приемлемую неводную жидкость или растворитель, эмульгирующий агент и консервант. Суспензии могут включать фармацевтически приемлемый суспендирующий агент и консервант. Водные спиртовые растворы могут включать фармацевтически приемлемый ацеталь, такой как ди(низший алкил)ацеталь низшего алкильного альдегида, например, диэтилацеталь ацетальдегида; и смешивающийся с водой растворитель, имеющий одну или несколько гидроксильных групп, такой как пропиленгликоль и этанол. Эликсиры представляют собой прозрачные подслащенные и водно-спиртовые растворы. Сиропы представляют собой концентрированные водные растворы сахара, например, сахарозы, и могут также содержать консервант. Жидкая препаративная лекарственная форма, например, раствор в полиэтиленгликоле может быть разбавлена достаточным количеством фармацевтически приемлемого жидкого носителя, например, воды, чтобы была возможность удобно отмерять при введении.
[0094] Другие используемые жидкие и полутвердые препаративные лекарственные формы включают, но не ограничиваются указанным, формы, содержащие разработанный в данном изобретении активный ингредиент(ы) и диалкилированный моно- или поли-алкиленгликоль включая, 1,2-диметоксиметан, диглим, триглим, тетраглим, диметиловый эфир полиэтиленгликоля-350, диметиловый эфир полиэтиленгликоля-550, диметиловый эфир полиэтиленгликоля-750, где цифры 350, 550 и 750 относятся к примерной усредненной молекулярной массе полиэтиленгликоля. Данные препараты могут дополнительно включать один или несколько антиоксидантов, таких как бутильный гидрокситолуол (BHT), бутильный гидроксианизол (BHA), пропилгаллат, витамин Е, гидрохинон, гидркосикумарины, этаноламин, лецитин, цефалин, аскорбиновая кислота, яблочная кислота, сорбит, фосфорная кислота, бисульфит, метабисульфит натрия, тиодипропионовая кислота и ее эфиры и дитиокарбаматы.
[0095] Разработанные в данном изобретении фармацевтические композиции для перорального введения также могут быть представлены в виде липосомов, мицелл, микросфер или наносистем. Мицеллярные препаративные лекарственные формы могут быть получены, как описано в патенте США № 6350458.
[0096] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде нешипучих или шипучих гранул и порошков для преобразования в жидкую препаративную лекарственную форму. Фармацевтически приемлемые носители и эксципиенты, используемые в нешипучих гранулах или порошках, могут включать разбавители, подсластители и смачивающие агенты. Фармацевтически приемлемые носители и эксципиенты, используемые в шипучих гранулах или порошках, могут включать органические кислоты и источник диоксида углерода.
[0097] Красители и ароматизаторы можно использовать во всех из вышеуказанных препаративных лекарственных форм.
[0098] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде форм немедленного или модифицированного высвобождения, включая формы замедленного, продолжительного, импульсного, контролируемого, направленного и программируемого высвобождения.
[0099] Рецептура разработанных в данном изобретении фармацевтических композиций может быть составлена совместно с другими активными ингредиентами, которые не уменьшают желаемое терапевтическое действие или вместе с веществами, которые дополняют желаемое действие.
B. Парентеральное введение
[0100] Разработанные в данном изобретении фармацевтические композиции можно вводить парентерально посредством инъекции, инфузии или имплантации, для местного или системного введения. Парентеральное введение, как этот термин используется в настоящем описании, включает внутривенное, внутриартериальное, внутрибрюшинное, внутритекальное, внутривентикулярное, внутриуретальное, внутригрудинное, внутричерепное, внутримышечное, внутрисиновиальное, внутривезикальное и подкожное введение.
[0101] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде любой препаративной лекарственной формы, подходящей для парентерального введения, включая растворы, суспензии, эмульсии, мицеллы, липосомы, микросферы, наносистемы и твердые формы, подходящие для получения растворов или суспензий в жидкости перед инъекцией. Такие препаративные лекарственные формы могут быть получены в соответствии с обычными способами, известными специалистам в области фармацевтической науки (см., Remington: The Science and Practice of Pharmacy, выше).
[0102] Фармацевтические композиции, предназначенные для парентерального введения, могут включать один или несколько фармацевтически приемлемых носителей и эксципиентов, включая, но не ограничиваясь указанным, водные носители, смешиваемые с водой носители, неводные носители, антибактериальные агенты или консерванты против роста микроорганизмов, стабилизаторы, усилители растворимости, изотонические агенты, буферные агенты, антиоксиданты, местные анестетики, суспендирующие и диспергирующие агенты, смачивающие и эмульгирующие агенты, комплексообразующие агенты, изолирующие и хелатирующие агенты, криопротекторы, лиопротекторы, загустители, регулирующие рН агенты и инертные газы.
[0103] Подходящие водные носители включают, но не ограничиваются указанным, воду, содержащий соли раствор, физиологический раствор или забуференный фосфатом физиологический раствор (PBS), раствор хлорида натрия для инъекции, раствор Рингера для инъекции, изотонический раствор декстрозы для инъекции, стерильную воду для инъекции, содержащие декстрозу и лактаты раствор Рингера для инъекции. Неводные носители включают, но не ограничиваются указанным, нелетучие масла растительного происхождения, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, арахисовое масло, масло мяты перечной, сафлоровое масло, кунжутное масло, соевое масло, гидрированные растительные масла, гидрированное соевое масло и триглицериды средней длины кокосового масла и пальмовое масло (семян). Смешиваемые с водой носители включают, но не ограничиваются указанным, этанол, 1,3-бутандиол, жидкий полиэтиленгликоль (например, полиэтиленгликоль 300 и полиэтиленгликоль 400), пропиленгликоль, глицерин, N-метил-2-пирролидон, N,N-диметилацетамид и диметилсульфоксид.
[0104] Подходящие антибактериальные агенты и консерванты включают, но не ограничиваются указанным, фенолы, крезолы, ртутные препараты, бензиловый спирт, хлорбутанол, метил- и пропил-п-гидркосибензоаты, тимерозал, хлорид бензалкония (например, хлорид бензетония) метил- и пропилпарабены и сорбиновую кислоту. Подходящие изотонические агенты включают, но не ограничиваются указанным, хлорид натрия, глицерин и декстрозу. Подходящие буферные агенты включают, но не ограничиваются указанным, фосфат и цитрат. Подходящие антиоксиданты представляют собой указанные в данном описании, включая бисульфит и метабисульфит натрия. Подходящие местные анестетики включают, но не ограничиваются указанным, гидрохлорид прокаина. Подходящие суспендирующие и диспергирующие агенты представляют собой указанные в данном описании, включая карбоксиметилцеллюлозу, гидроксипропил метилцеллюлозу и поливинилпирролидон. Подходящие эмульгирующие агенты включают указанные в данном описании, включая полиоксиэтиленсорбит монолаурат, полиоксиэтиленсорбит моноолеат 80 и триэтаноламинолеат. Подходящие изолирующие или хелатирующие агенты включают, но не ограничиваются указанным, ЭДТА. Подходящие регулирующие рН агенты включают, но не ограничиваются указанным, гидроксид натрия, хлористоводородную кислоту, лимонную кислоту и молочную кислоту. Подходящие комплексообразующие агенты включают, но не ограничиваются указанным, циклодекстрины, включая α-циклодекстрин, β-циклодекстрин, гидркосипропил-β-циклодекстрин, сульфобутилэфир β-циклодекстрин, сульфобутиловый простой эфир 7--β-циклодекстрина (CAPTISOL®, CyDex, Lenexa, KS).
[0105] Разработанные в данном изобретении композиции могут быть получены для введения в виде единственной или множества дозировок. Препараты, содержащие одну дозировку, могут быть запакованы в ампулу, пузырек или шприц. Парентеральные препараты, содержащие множество дозировок, должны содержать антибактериальный агент в бактериостатических или фунгистатических концентрациях. Все парентеральные препараты должны быть стерильными, как это известно и практикуется в данной области.
[0106] В одном варианте осуществления, фармацевтические композиции получают в виде готовых к применению стерильных растворов. В другом варианте осуществления, фармацевтические композиции получают в виде стерильных сухих растворимых продуктов, включая лиофилизованные порошки и таблетки для подкожных инъекций, влагосодержание которых восстанавливают с использованием носителя перед применением. Еще в одном варианте осуществления, фармацевтические композиции получают в виде готовых к применению стерильных суспензий. Еще в одном варианте осуществления, фармацевтические композиции получают в виде стерильных сухих нерастворимых продуктов, влагосодержание которых восстанавливают с использованием носителя перед применением. В следующем варианте осуществления, фармацевтические композиции получают в виде готовых к применению стерильных эмульсий.
[0107] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде форм немедленного или модифицированного высвобождения, включая формы замедленного, продолжительного, импульсного, контролируемого, направленного и программируемого высвобождения.
[0108] Фармацевтические композиции могут быть получены в виде суспензии, твердого, полутвердого вещества или тиксотропной жидкости для введения в виде имплантированного депо. В одном варианте осуществления разработанные в данном изобретении композиции диспергируют в твердой инертной матрице, которая окружена внешней полимерной мембраной, которая не растворима в жидкостях организма, но дает возможность диффундировать через нее активному ингредиенту фармацевтических композиций.
[0109] Подходящие внутренние матрицы включают полиметилметакрилат, полибутилметакрилат, пластифицированный или не пластифицированный поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерефталат, природную резину, полиизопрен, полиизобутилен, полибутадиен, полиэтилен, сополимеры этилена-винилацетата, силиконовые резины, полидиметилсилоксаны, силиконкарбонатные сополимеры, гидрофильные полимеры, такие как гидрогели эфиров акриловой и метакриловой кислоты, коллаген, сшитый поливиниловый спирт и сшитый, частично гидролизованный поливинилацетат.
[0110] Подходящие внешние полимерные мембраны включают полиэтилен, полипропилен, сополимеры этилен/пропилен, сополимеры этилен/этилакрилат, сополимеры этилен/винилацетат, силиконовые резины, полидиметилсилоксаны, неопреновую резину, хлорированный полиэтилен, поливинилхлорид, сополимеры винилхлорида с винилацетатом, винилиденхлоридом, этиленом и пропиленом, иономерный полиэтилентерефталат, бутильную резину, эпихлоргидриновые резины, сополимер этилена/винилового спирта, терполимер этилен/винилацетат/виниловый спирт и сополимер этилен/винилоксиэтанол.
C. Местное введение
[0111] Разработанные в данном изобретении фармацевтические композиции можно применять местно на коже, отверстиях внутренних органов или слизистой. Местное введение, как оно использовано в данном описании, включает (внутри)кожное, конъюнктивное внутрироговичное, внутриглазное, офтальмологическое, ушное, чрезкожное, назальное, влагалищное, уретральное, респираторное и ректальное введение.
[0112] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде любых препаративных лекарственных форм, подходящих для местного введения для обеспечения местного или системного действия, включая эмульсии, растворы, суспензии, кремы, гели, гидрогели, мази, опудривающие порошки, повязки, эликсиры, лосьоны, суспензии, настойки, пасты, пены, пленки, аэрозоли, растворы для спринцевания, спреи, суппозитории, перевязочные материалы, кожные пластыри. Местные препараты разработанных в данном изобретении фармацевтических композиций также включают липосомы, мицеллы, микросферы, наносистемы и их смеси.
[0113] Фармацевтически приемлемые носители и эксципиенты для применения в местных препаратах, разработанных в данном изобретении, включают, но не ограничиваются указанным, водные переносчики, смешивающиеся с водой переносчики, неводные переносчики, антибактериальные агенты или консерванты против роста микроорганизмов, стабилизаторы, усилители растворимости, изотонические агенты, буферные агенты, антиоксиданты, местные анестетики, суспендирующие и диспергирующие агенты, смечивающие или эмульгирующие агенты, комплексообразующие агенты, изолирующие или хелатирующие агенты, усилители проницаемости, криопротекторы, лиопротекторы, загустители и инертные газы.
[0114] Фармацевтические композиции также можно вводить местным образом с помощью электропорации, ионофореза, фонофореза, сонофореза или с помощью микроиглы или безигольной инъекции, такой как, например, POWDERJECTTM (Chiron Corp., Emeryville, CA) и BIOJECTTM (Bioject Medical Technologies Inc., Tualatin, OR).
[0115] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде мазей, кремов и гелей. Подходящие переносчики для мазей включают масляные или углеводородные переносчики, включая лярд, бензоинированный лярд, оливковое масло, хлопковое масло и другие масла, медицинский вазелин, эмульгирующие или абсорбирующие переносчики, такие как гидрофильный вазелин, гидроксистеаринсульфат и безводный ланолин, удаляющие воду переносчики, такие как гидрофильная мазь; водорастворимые переносчики для мазей, включая полиэтиленгликоли с различной молекулярной массой; эмульсионные переносчики, либо эмульсии вода-в-масле (В/М), либо эмульсии масло-в-воде (М/В), включая цетиловый спирт, глицерилмоностеарат, ланолин и стеариновую кислоту (см. Remington: The Science and Practice of Pharmacy, выше). Данные переносчики являются мягчительными средствами, но обычно требуют добавления антиоксидантов и консервантов.
[0116] Подходящей основой для крема могут быть эмульсии масло-в-воде или вода-в-масле. Переносчики крема могут быть смываемыми водой и содержать масляную фазу, эмульгатор и водную фазу. Масляную фазу также называют «внутренней» фазой, которая обычно состоит из вазелина и жирного спирта, такого как цетиловый или стеариловый спирт. Водная фаза обычно, хотя это не является обязательным, превышает по объему масляную фазу и обычно содержит увлажнитель. Эмульгатор в составе крема может представлять собой неионное, анионное, катионное или амфотерное поверхностно-активное вещество.
[0117] Гели представляют собой полутвердые системы суспензионного типа. Однофазные гели содержат органические макромолекулы, распределенные по существу однородно в жидком носителе. Подходящие гелеобразующие агенты включают сшитые полимеры акриловой кислоты, такие как карбомеры, карбоксиполиалкилены, CARBOPOL®; гидрофильные полимеры, такие как поэтиленоксиды, сополимеры полиоксиэтилен-полиоксипропилен и поливиниловый спирт; целлюлозные полимеры, такие как гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы и метилцеллюлоза; камеди, такие как трагакантовая и ксантановая камедь; альгинат натрия и желатин. Для получения однородного геля могут быть добавлены диспергирующие агенты, такие как спирт и глицерин, или гелеобразующий агент может быть распределен путем растирания, механического смешивания и/или перемешивания.
[0118] Разработанные в данном изобретении композиции можно вводить ректально, уретрально, влагалищно или перивагинально в виде суппозиториев, пессариев, свеч, припарок или сухих припарок, паст, порошков, повязок, кремов, пластырей, контрацептивов, мазей, растворов, эмульсий, суспензий, тампонов, гелей, пен, спреев или клизм. Данные препаративные лекарственные формы могут быть получены с использованием общепринятых способов, как описано в Remington: The Science and Practice of Pharmacy, см. выше.
[0119] Ректальные, уретральные и влагалищные суппозитории представляют собой твердые продукты для вставления в отверстия организма, которые являются твердыми при обычной температуре, но плавятся или размягчаются при температуре тела, высвобождая активный(ые) ингредиент(ы) внутри отверстий. Фармацевтически приемлемые носители, используемые в ректальных и влагалищных суппозиториях, включают основы или переносчики, такие как придающие жесткость агенты, которые обеспечивают температуру плавления в области температуры тела и которые вводят в состав разработанных в данном изобретении фармацевтических композиций, антиоксиданты, описанные в данном описании, включая бисульфит и метабисульфит натрия. Подходящие переносчики включают, но не ограничиваются указанным, масло какао (диметилксантиновое масло), глицерин-желатин, карбовоск (полиоксиэтиленгликоль), спермацет, парафин, белый и желтый воск и подходящие смеси моно-, ди- и триглицеридов жирных кислот, гидрогели, такие как поливиниловый спирт, гидроксиэтилметакрилат, полиакриловая кислота; глицериновый желатин. Можно использовать комбинации различных переносчиков. Ректальные и влагалищные суппозитории могут быть получены методом прессования или формования. Типичный вес ректального и влагалищного суппозиториев составляет от примерно 2 до примерно 3 г.
[0120] Разработанные в данном изобретении фармацевтические композиции можно применять офтальмологически в виде растворов, суспензий, мазей, эмульсий, гелеобразующих растворов, порошков для получения растворов, гелей, глазных вставок и имплантатов.
[0121] Разработанные в данном изобретении фармацевтические композиции можно вводить внутриназально или с помощью ингалятора в дыхательный тракт. Фармацевтические композиции могут быть получены в виде аэрозоля или раствора для доставки с использованием контейнера под давлением, насоса, распылителя, пульверизатора, такого как пульверизатор с использованием электрогидродинамики для получения мельчайшего аэрозоля, или небулайзера, сами по себе или в сочетании с подходящим пропеллентом, таким как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Фармацевтические композиции также могут быть получены в виде сухого порошка для вдувания, сами по себе или в комбинации с инертным носителем таким как лактоза или фосфолипиды; и капель для носа. Для внутриназального применения порошок может включать биоадгезивный агент, включая хитозан или циклодекстрин.
[0122] Растворы или суспензии для применения в контейнере под давлением, насосе, спреевом распылителе, пульверизаторе или небулайзере могут быть получены с содержанием этанола, водного этанола или подходящего альтернативного агента для диспергирования, солюбилизации или продолжительного выделения содержащегося в них активного ингредиента, пропеллента в качестве растворителя и/или поверхностно-активного вещества, такого как сорбиттриолеат, олеиновая кислота или олигомолочная кислота.
[0123] Разработанные в данном изобретении фармацевтические композиции могут быть измельчены в микродисперсное состояние с размером, подходящим для доставки путем ингаляции, такой как примерно 50 микрометров или менее, или примерно 10 микрометров или менее. Частицы такого размера могут быть получены с использованием метода измельчения, известного специалистам в данной области, таких как измельчение в спиральной струйной мельнице, измельчение в вихревой мельнице с ожиженным слоем, процесс обработки в сверхкритической жидкости для образования наночастиц, гомогенизация под высоким давлением или сушка распылением.
[0124] Капсулы, блистеры и картриджи для применения в ингаляторе или инсуффляторе могут быть получены таким образом, чтобы они содержали порошкообразную смесь разработанных в изобретении фармацевтических композиций; подходящую порошкообразную основу, такую как лактоза или крахмал; и модификатор эксплуатационных свойств, такой как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в виде моногидрата. Другие подходящие эксципиенты или носители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Разработанные в данном изобретении фармацевтические композиции для ингаляционного/внутриназального введения могут дополнительно содержать подходящий ароматизатор, такой как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия.
[0125] Разработанные в данном изобретении фармацевтические композиции для местного применения могут быть получены для немедленного высвобождения или модифицированного высвобождения, включая замедленное, продолжительное, импульсное, контролируемое, направленное и программируемое высвобождение.
D. Модифицированное высвобождение
[0126] Разработанные в данном изобретении фармацевтические композиции могут быть получены в виде препаративных лекарственных форм с модифицированным высвобождением. Как использовано в данном описании, термин «модифицированное высвобождение» относится к препаративной лекарственной форме, в которой скорость или место высвобождения активного(ых) ингредиента(ов) отличается от такового для препаративной лекарственной формы немедленного высвобождения при введении одним и тем же способом. Препаративные лекарственные формы модифицированного высвобождения включают препаративные лекарственные формы замедленного, отсроченного, пролонгированного, продолжительного, импульсного, контролируемого, ускоренного и быстрого, направленного, программируемого высвобождения и удерживаемые в желудке. Фармацевтические композиции в препаративных лекарственных формах модифицированного высвобождения могут быть получены с использованием множества устройств модифицированного высвобождения и методов, известных специалистам в данной области, включая, но не ограничиваясь указанным, устройства с матрично-контролируемым высвобождением, устройства с осмотически контролируемым высвобождением, состоящие из множества частиц устройства контролируемого высвобождения, ионообменные смолы, растворимые в кишечнике оболочки, многослойные оболочки, микросферы, липосомы и их комбинации. Скорость высвобождения активного ингредиента(ов) также можно модифицировать за счет изменения размера частиц и полиморфизма активного(ых) ингредиента(ов).
[0127] Примеры модифицированного высвобождения включают, но не ограничиваются указанным, описанные в патентах США №№: 3845770; 3916899; 3536809; 3598123; 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556; 5639480; 5733566; 5739108; 5891474; 5922356; 5972891; 5980945; 5993855; 6045830; 6087324; 6113943; 6197350; 6248363; 6264970; 6267981; 6376461; 6419961; 6589548; 6613358 и 6699500.
1. Матрично-контролируемые устройства высвобождения
[0128] Разработанные в данном изобретении фармацевтические композиции в препаративной лекарственной форме модифицированного высвобождения могут быть изготовлены с использованием матрично-контролируемого устройства высвобождения, известного специалистам в данной области (см. Takada et al. in "Encyclopedia of Controlled Drug Delivery," Vol. 2, Mathiowitz Ed., Wiley, 1999).
[0129] В одном варианте осуществления, разработанные в данном изобретении фармацевтические композиции в препаративной лекарственной форме модифицированного высвобождения получают с использованием эродируемого матричного устройства, которое представляет собой набухаемые в воде, эродируемые или растворимые полимеры, включая синтетические полимеры, и природные полимеры и их производные, такие как полисахариды и белки.
[0130] Материалы, используемые для образования эродируемой матрицы, включают, но не ограничиваются указанным, хитин, хитозан, декстран и паллулан, агаровую камедь, гуммиарабик, карайскую камедь, камедь плодов рожкового дерева, трагакантовую камедь, карраген, камедь гхатти, гуаровую камедь, ксантановую камедь и склероглюкан; крахмалы, такие как декстрин и мальтодекстрин; гидрофильные коллоиды, такие как пектин; фосфатиды, такие как лецитин; альгинаты; альгинат пропиленгликоля; желатин; коллаген; и целлюлозы, такие как этилцеллюлоза (ЭЦ), метилэтилцеллюлоза (МЭЦ), карбоксиметилцеллюлоза (КМЦ), КМЕЦ, гидроксиэтилцеллюлоза (ГЭЦ), гидроксипропилцеллюлоза (ГПЦ), ацетат целлюлозы (ЦА), пропионат целлюлозы (ЦП), бутират целлюлозы (ЦБ), ацетат-бутират целлюлозы (ЦАБ), ЦАП, ЦАТ, гидроксипропилметилцеллюлоза (ГПМЦ), ГПМЦП, ГПМЦАС, ацетат тримеллитат гидроксипропилметилцеллюлозы (ГПМЦАТ) и этилгидроксиэтилцеллюлоза (ЭГЭЦ); поливинилпирроллидон; поливиниловый спирт; поливинилацетат; сложные эфиры глицерина и жирных кислот; полиакриламид; полиакриловая кислота; сополимеры этакриловой и метакриловой кислот (EUDRAGIT®, Rohm America, Inc., Piscataway, NJ); поли(2-гидроксиэтил-метакрилат); полилактиды; сополимеры L-глутаминовой кислоты и этил-L-глутамата; разлагаемые сополимеры молочной кислоты-гликолевой кислоты; поли-D-(-)-3-гидроксибутановая кислота; и другие производные акриловой кислоты, такие как гомополимеры и сополимеры бутилметакрилата, метилметакрилата, этилметакрилата, этилакрилата, (2-диметиламиноэтил)метакрилата и (триметиламиноэтил)метакрилат хлорида.
[0131] В следующих вариантах осуществления фармацевтические композиции получают с использованием неэродируемого матричного устройства. Активный(ые) ингредиент(ы) растворяют или диспергируют в инертной матрице, и они высвобождаются главным образом за счет диффузии через инертную матрицу после введения. Материалы, подходящие для использования в неэродируемом матричном устройстве, включают, но не ограничиваются указанным, нерастворимые пластики, такие как полиэтилен, полипропилен, полиизопрен, полиизобутилен, полибутадиен, полиметилметакрилат, полибутилметакрилат, хлорированный полиэтилен, поливинилхлорид, сополимеры метилакрилата и метилметакрилата, сополимеры этилена и винилацетата, сополимеры этилен/пропилен, сополимеры этилен/этилакрилат, сополимеры винилхлорида с винилацетатом, винилиденхлоридом, этиленом и пропиленом, иономерный полиэтилентерефталат, бутильная резина, эпихлоргидриновая резина, сополимеры этилен/виниловый спирт, терполимер этилен/винилацетат/виниловый спирт и сополимер этилен/винилоксиэтанол, поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерефталат, природная резина, силиконовые резины, полидиметилсилоксаны, силиконкарбонатные сополимеры и гидрофильные полимеры, такие как этилцеллюлоза, ацетат целлюлозы, кросповидон и сшитый частично гидролизованный поливинилацетат, и жирные соединения, такие как карнаубский воск, микрокристаллический воск и триглицериды.
[0132] В матричных системах контролируемого высвобождения желаемую кинетику высвобождения можно контролировать, например, за счет типа используемого полимера, вязкости полимера, размера частиц полимера и/или активного(ых) ингредиента(ов), соотношения активного(ых) ингредиента(ов) относительно полимера, и других эксципиентов или носителей в композициях.
[0133] Разработанные в данном изобретении фармацевтические композиции в препаративной лекарственной форме модифицированного высвобождения могут быть получены способами, известными специалистам в данной области, включая прямое прессование, сухое или влажное гранулирование с последующим прессованием, гранулирование в расплаве с последующим прессованием.
2. Осмотические устройства контролируемого высвобождения
[0134] Разработанные в данном изобретении фармацевтические композиции в препаративной лекарственной форме модифицированного высвобождения могут быть получены с использованием осмотического устройства контролируемого высвобождения, включая однокамерную систему, двухкамерную систему, асимметрическую мембранную технологию (AMT) и системы с вытесняемым ядром (ECS). Обычно такие устройства имеют по крайней мере два компонента: (a) ядро, которое содержит активный(ые) ингредиент(ы); и (b) полупроницаемую мембрану с по крайней мере одним входным отверстием. Полупроницаемая мембрана контролирует приток воды к ядру из водной окружающей среды использования таким образом, чтобы вызвать высвобождение посредством вытеснения через входное(ые) отверстие(ия).
[0135] Помимо активного ингредиента(ов) ядро осмотического устройства необязательно включает осмотический агент, который создает движущую силу для транспорта воды из окружающей среды применения в ядро устройства. Одним из классов осмотических агентов являются водонабухаемые гидрофильные полимеры, которые также упоминаются как «осмополимеры» и «гидрогели», включая, но не ограничиваясь указанным, гидрофильные винильные и акриловые полимеры, полисахариды, такие как альгинат кальция, полиэтиленоксид (ПЭО), полиэтиленгликоль (ПЭГ), полипропиленгликоль (ППГ), поли(2-гидроксиэтилметакрилат), поли(акриловая) кислота, поли(метакриловая) кислота, поливинилпирролидон (ПВП), сшитый ПВП, поливиниловый спирт (ПВС), сополимеры ПВС/ПВП, сополимеры ПВС/ПВП с гидрофобными мономерами, такими как метилметакрилат и винилацетат, гидрофильные полиуретаны, содержащие большие ПЭО блоки, кроскармеллоза натрия, карраген, гидроксиэтилцеллюлоза (ГЭЦ), гидроксипропилцеллюлоза (ГПЦ), гидроксипропилметилцеллюлоза (ГПМЦ), карбоксиметилцеллюлоза (КМЦ) и карбоксиэтилцеллюлоза (КЭЦ), альгинат натрия, поликарбофил, желатин, ксантановая камедь и гликоляткрахмал натрия.
[0136] Другим классом осмотических агентов являются осмогены, которые способны всасывать воду для влияния на градиент осмотического давления через барьер окружающего покрытия. Подходящие осмотические агенты включают, но не ограничиваются указанным, неорганические соли, такие как сульфат магния, хлорид магния, хлорид кальция, хлорид натрия, хлорид лития, сульфат калия, фосфаты калия, карбонат натрия, сульфит натрия, сульфат лития, хлорид калия и сульфат натрия; сахара, такие как декстроза, фруктоза, глюкоза, инозитол, лактоза, мальтоза, маннит, раффиноза, сорбит, сахароза, трегалоза и ксилит; органические кислоты, такие как аскорбиновая кислота, бензойная кислота, фумаровая кислота, лимонная кислота, малеиновая кислота, себациновая кислота, сорбиновая кислота, адипиновая кислота, эдетовая кислота, глутаминовая кислота, п-толуолсульфоновая кислота, янтарная кислота и винная кислота; мочевина и их смеси.
[0137] Осмотические агенты с различной скоростью растворения можно использовать для влияния на то, как быстро активный(ые) ингредиент(ы) первоначально доставляется из препаративной лекарственной формы. Например, аморфные сахара, такие как MANNOGEMTM EZ (SPI Pharma, Lewes, DE) можно использовать для обеспечения более быстрой доставки во время первой пары часов для оказания желаемого терапевтического действия в кратчайшие сроки и постепенного и постоянного высвобождения оставшейся части для поддержания желаемого уровня терапевтического или профилактического действия на протяжении увеличенного промежутка времени. В таком случае, активный(ые) ингредиент(ы) высвобождается с такой скоростью, чтобы заменить количество активного ингредиента, которое подверглось метаболизму и было выведено из организма.
[0138] Ядро также может включать большое множество других эксципиентов и носителей, как описано в данном описании, для усиления действия препаративной лекарственной формы или для содействия стабильности или обработке.
[0139] Вещества, используемые для образования полупроницаемой мембраны, включают различного сорта акрилы, винилы, простые эфиры, полиамиды, сложные полиэфиры и производные целлюлозы, которые являются водопроницаемыми и нерастворимыми в воде при физиологически значимых рН, или становятся не растворимыми в воде при химическом изменении, таком как сшивание. Примеры подходящих полимеров, используемых для образования покрытия, включают пластифицированные, непластифицированные и усиленные ацетат целлюлозу (ЦА), диацетат целлюлозу, триацетат целлюлозу, пропионат ЦА, нитрат целлюлозу, ацетат-бутират целлюлозу (ЦАБ), этилкарбамат ЦА, ЦАП, метилкарбамат ЦА, сукцинат ЦА, ацетат тримеллитат целлюлозу (ЦАТ), диметиламиноацетат ЦА, этилкарбонат ЦА, хлорацетат ЦА, этилоксалат ЦА, метилсульфонат ЦА, бутилсульфонат ЦА, п-толуолсульфонат ЦА, ацетат агара, триацетат амилозы, ацетат бета-глюкана, триацетат бета-глюкана, диметилацетат ацетальдегида, триацетат камеди плодов рожкового дерева, гидроксилированный этилен-винилацетат, ЭЦ, ПЭГ, ППГ, сополимеры ПЭГ/ППГ, ПВР, НЭЦ, ГПЦ, КМЦ, КМЭЦ, ГПМЦ, ГПМЦП, ГПМЦАС, ГПМЦАТ, поли(акриловые) кислоты и эфиры и поли(метакриловые) кислоты и эфиры и их сополимеры, крахмал, декстран, декстрин, хитозан, коллаген, желатин, полиалкены, простые полиэфиры, полисульфоны, полиэфирные сульфоны, полистиролы, поливинилгалогениды, поливиниловые сложные и простые эфиры, природные воски и синтетические воски.
[0140] Полупроницаемая мембрана также может представлять собой гидрофобную микропористую мембрану, где поры по существу наполнены газом и не смачиваются водной средой, но являются проницаемыми для водного пара, как описано в патенте США № 5798119. Такие гидрофобные, но проницаемые для водного пара мембраны обычно состоят из гидрофобных полимеров, таких как полиалкены, полиэтилен, полипропилен, политетрафторэтилен, производные полиакриловой кислоты, простые полиэфиры, полисульфоны, полиэфирные сульфоны, полистиролы, поливинилгалогениды, поливинилиденфторид, поливиниловые простые и сложные эфиры, природные воски и синтетические воски.
[0141] Входное(ые) отверстие(я) в полупроницаемой мембране могут быть получены после нанесения покрытия с помощью механического или лазерного просверливания. Входное(ые) отверстие(я) также могут быть получены in situ за счет эрозии заглушек водорастворимого материала или за счет разрыва более тонкой части мембраны над углублениями в ядре. Помимо этого, входные отверстия могут быть получены во время процесса нанесения покрытия, как в случае асимметрических мембранных оболочек типа, описанного в патентах США №№ 5612059 и 5698220.
[0142] Общее количество высвобождающегося активного(ых) ингредиента(ов) и скорость высвобождения по существу можно модулировать за счет толщины и пористости полупроницаемой мембраны, состава ядра и числа, размера и положения входных отверстий.
[0143] Фармацевтические композиции в препаративных лекарственных формах с осмотически контролируемым высвобождением могут дополнительно включать дополнительные обычные эксципиенты или носители, как указано в данном описании, для того, чтобы способствовать эксплуатационным характеристикам или обработке состава.
[0144] Препаративные лекарственные формы с осмотически контролируемым высвобождением могут быть получены в соответствии с общепринятыми способами и методами, известными специалистам в данной области (см. Remington: The Science and Practice of Pharmacy, выше; Santus and Baker, J. Controlled Release 1995, 55, 1-21; Verma et al., Drug Development and Industrial Pharmacy 2000, 26, 695-708; Verma et al., J. Controlled Release 2002, 79, 7-27).
[0145] В некоторых вариантах осуществления, разработанные в данном изобретении фармацевтические композиции получают в виде препаративной лекарственной формы с AMT-контролируемым высвобождением, которая содержит асимметрическую осмотическую мембрану, которая покрывает ядро, включающее в себя активный(ые) ингредиент(ы) и другие фармацевтически приемлемые эксципиенты или носители. (См. патент США № 5612059 и WO 2002/17918). Препаративные лекарственные формы с АМТ-контролируемым высвобождением могут быть получены в соответствии с общепринятыми способами и методами, известными специалистам в данной области, включая прямое прессование, сухое гранулирование, влажное гранулирование и метод нанесения покрытия путем обработки погружением.
[0146] В некоторых вариантах осуществления, разработанные в данном изобретении фармацевтические композиции получают в виде препаративной лекарственной формы с ESC-контролируемым высвобождением, которая включает осмотическую мембрану, которая покрывает ядро, включающее активный(ые) ингредиент(ы), гидроксиэтилцеллюлозу и другие фармацевтически приемлемые эксципиенты или носители.
3. Устройства контролируемого высвобождения, состоящие из множества частиц
[0147] Разработанные в данном изобретении фармацевтические композиции в виде препаративной лекарственной формы модифицированного высвобождения могут быть получены в виде устройства контролируемого высвобождения, состоящего из множества частиц, которое включает множество частиц, гранул или шариков, размером от примерно 10 мкм до примерно 3 мм, от примерно 50 мкм до примерно 2,5 мм или от примерно 100 мкм до примерно 1 мм в диаметре. Такое множество частиц может быть получено способами, известными специалистам в данной области, включая влажное и сухое гранулирование, экструзию/сферонизацию, вальцовое уплотнение, плавление-замораживание и с помощью нанесения покрытия распылением на зародышевые ядра. (См. например, Multiparticulate Oral Drug Delivery; Marcel Dekker: 1994; и Pharmaceutical Pelletization Technology; Marcel Dekker: 1989).
[0148] Другие эксципиенты или носители, как указано в данном описании, могут быть смешаны с фармацевтическими композициями для того, чтобы оказать содействие при переработке и образовании множества частиц. Полученные частицы сами составляют устройство из множества частиц или они могут быть покрыты различными пленкообразующими материалами, такими как растворимые в кишечнике полимеры, набухаемые в воде и растворимые в воде полимеры. Множество частиц в дальнейшем может быть обработано для получения капсулы или таблетки.
4. Направленная доставка
[0149] Разработанные в данном изобретении фармацевтические композиции также могут быть составлены таким образом, чтобы направляться к определенной ткани, рецептору или в другую область организма субъекта, подвергаемого лечению, включая системы доставки на основе липосомов, высвобождаемых эритроцитов и антител. Примеры включают, но не ограничиваются указанным, патенты США №№ 6316652; 6274552; 6271359; 6253872; 6139865; 6131570; 6120751; 6071495; 6060082; 6048736; 6039975; 6004534; 5985307; 5972366; 5900252; 5840674; 5759542 и 5709874.
Способы применения
[0150] В одном варианте осуществления, изобретение относится к способу лечения, профилактики или улучшения симптомов нарушения, заболевания или состояния, связанного с CCR3, у субъекта, который включает введение субъекту терапевтически эффективного количества разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера. В одном варианте осуществления, субъект представляет собой млекопитающее. В другом варианте осуществления, субъект представляет собой человека.
[0151] В другом варианте осуществления, изобретение относится к способу лечения, профилактики или улучшения симптомов нарушения, заболевания или состояния, дающего ответную реакцию на модулирование активности CCR3, у субъекта, включающему введение субъекту терапевтически эффективного количества разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера. В одном варианте осуществления, субъект представляет собой млекопитающее. В другом варианте осуществления, субъект представляет собой человека.
[0152] Еще в одном варианте осуществления, изобретение относится к способу лечения, профилактики или улучшения симптомов нарушения, заболевания или состояния, опосредованного рецетором CCR3, у субъекта, включающему введение субъекту терапевтически эффективного количества разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера. В одном варианте осуществления, субъект представляет собой млекопитающее. В другом варианте осуществления, субъект представляет собой человека.
[0153] Еще в одном варианте осуществления, изобретение относится к способу лечения, профилактики или улучшения симптомов связанного с эозинофилами нарушения, заболевания или состояния у субъекта, включающему введение субъекту терапевтически эффективного количества разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера. В одном варианте осуществления, субъект представляет собой млекопитающее. В другом варианте осуществления, субъект представляет собой человека.
[0154] В следующем варианте осуществления, изобретение относится к способу лечения, профилактики или улучшения симптомов связанного с базофилами нарушения, заболевания или состояния у субъекта, включающему введение субъекту терапевтически эффективного количества разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера. В одном варианте осуществления, субъект представляет собой млекопитающее. В другом варианте осуществления, субъект представляет собой человека.
[0155] Еще в одном варианте осуществления, изобретение относится к способу лечения, профилактики или улучшения симптомов связанного с тучными клетками нарушения, заболевания или состояния у субъекта, включающему введение субъекту терапевтически эффективного количества разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера. В одном варианте осуществления, субъект представляет собой млекопитающее. В другом варианте осуществления, субъект представляет собой человека.
[0156] Еще в одном варианте осуществления, изобретение относится к способу лечения, профилактики или улучшения симптомов воспалительного заболевания у субъекта, включающему введение субъекту терапевтически эффективного количества разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера. В одном варианте осуществления, субъект представляет собой млекопитающее. В другом варианте осуществления, субъект представляет собой человека.
[0157] Нарушения, заболевания или состояния, подвергаемые лечению с помощью разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II, или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера, включают, но не ограничиваются указанным, (1) воспалительные или аллергические заболевания, включая анафилаксию и связанные с гиперчувствительностью заболевания, атопический дерматит, крапивницу, лекарственную аллергию, аллергию на укусы насекомых, пищевую аллергию (включая глютеновую болезнь и тому подобное) и мастоцитоз; (2) воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, илеит и энтерит; (3) васкулиты и синдром Бехета; (4) псориаз и воспалительные дерматозы, включая дерматит, экзему, атопический дерматит, аллергический контактный дерматит, крапивницу, вирусные кожные патологии, включая производные вируса папиломы человека, ВИЧ или РСВ (респираторный синцитиальный вирус), бактериальные, грибковые и другие паразитические кожные патологии и кожную красную волчанку; (5) астму и респираторные аллергические заболевания, включая аллергическую астму, вызванную физической нагрузкой астму, аллергический ринит, воспаление среднего уха, аллергический конъюнктивит, связанные с гиперчувствительностью заболевания легких и хроническое обструктивное заболевание легких; (6) аутоиммунные заболевания, включая артрит (включая ревматоидный и псориатический), системную красную волчанку, диабет типа I, бульбоспинальный паралич, рассеянный склероз, болезнь Граве и гломерулонефрит; (7) отторжение трансплантата (включая отторжение гомотрансплантата и реакцию трансплантат-против-хозяина), например, отторжение пересаженной кожи, отторжение трансплантированного плотного органа, отторжение трансплантата костного мозга; (8) лихорадку; (9) сердечно-сосудистые заболевания, включая острую сердечную недостаточность, гипотензию, повышенное кровяное давление, стенокардию, инфаркт миокарда, кардиомиопатию, застойную сердечную недостаточность, атеросклероз, заболевание коронарных артерий, рестеноз и сосудистый стеноз; (10) церебрально-васкулярные нарушения, включая травматическое повреждение мозга, инсульт, ишемическое реперфузионное повреждение и аневризму; (11) рак молочной железы, кожи, предстательной железы, шеи, матки, яичников, яичек, мочевого пузыря, легкого, печени, гортани, ротовой полости, ободочной кишки и желудочно-кишечного тракта (например, пищевода, желудка, поджелудочной железы), мозга, щитовидной железы, крови и лимфатической системы; (12) фиброз, заболевание соединительной ткани и саркоидоз, (13) болезненные состояния гениталий и репродуктивной системы, включая эректильную дисфункцию; (14) желудочно-кишечные нарушения, включая гастрит, язву, тошноту, панкреатит и рвоту; (15) неврологические нарушения, включая болезнь Альцгеймера; (16) нарушения сна, включая бессонницу, нарколепсию, синдром апноэ во сне и синдром Пиквика; (17) боль; (18) почечные нарушения; (19) глазные заболевания, включая глаукому; и (20) инфекционные заболевания, включая ВИЧ.
[0158] В некоторых вариантах осуществления, нарушение, заболевание или состояние выбирают из группы, состоящей из астмы, аллергической астмы, вызванной физической нагрузкой астмы, аллергического ринита, многолетнего аллергического ринита, сезонного аллергического ринита, атопического дерматита, контактной гиперчувствительности, контактного дерматита, конъюнктивита, аллергического конъюнктивита, эозинофильного бронхита, пищевой аллергии, эозинофильного гастроэнтерита, воспалительного заболевания кишечника, язвенного колита, болезни Крона, мастоцитоза, синдрома гипер IgE, системной красной волчанки, псориаза, угрей, рассеянного склероза, отторжения трансплантата, реперфузионного повреждения, хронического обструктивного заболевания легких, синдрома Чурга-Страусса, синусита, базофильного лейкоза, хронической крапивницы, базофильного лейкоцитоза, псориаза, экземы, ХОЗЛ (хроническое обструктивное заболевание легких), артрита, ревматоидного артрита, псориатического артрита и остеоартрита.
[0159] В некоторых вариантах осуществления, нарушение, заболевание или состояние представляет собой астму, вызванную физической активностью астму, аллергический ринит, атопический дерматит, хроническое обструктивное заболевание легких или аллергический конъюнктивит.
[0160] В некоторых вариантах осуществления, нарушение, заболевание или состояние представляет собой воспалительное или иммунорегулируемое заболевание. В некоторых вариантах осуществления, нарушение, заболевание или состояние представляет собой астму, ринит, аллергическое заболевание или аутоиммунную патологию. В некоторых вариантах осуществления, нарушение, заболевание или состояние представляет собой ВИЧ, гранулему легких или болезнь Альцгеймера.
[0161] В различных вариантах осуществления способы лечения вышеуказанных нарушений, заболеваний или состояний включают лечение субъекта с помощью фармацевтической композиции, включающей разработанное в изобретении соединение, например, соединение формулы I или формулы II, или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер или таутомер, в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами или носителями.
[0162] В зависимости от нарушения, заболевания или состояния для лечения и состояния субъекта, разработанные в изобретении соединения или фармацевтические композиции можно вводить посредством перорального, парентерального (например, внутримышечно, внутрибрюшинно, внутривенно, интрацеребрально, с помощью внутрицистернальной инъекции или инфузии, подкожной инъекции или импланта), ингаляционного, назального, влагалищного, ректального, сублингвального или местного (например, чрезкожного или местного) путей введения и они могут быть получены индивидуально или совместно, в виде подходящих дозированных лекарственных форм, с фармацевтически приемлемыми эксципиентами, носителями, вспомогательными веществами и переносчиками, подходящими для каждого из путей введения. Также изобретение относится к введению разработанных в изобретении соединений или композиций в виде депо-препаратов, в которых активный ингредиент высвобождается в течение определенного промежутка времени.
[0163] Для лечения, профилактики или улучшения одного или нескольких симптомов астмы, аллергического ринита, экземы, псориаза, атопического дерматита, лихорадки, сепсиса, системной красной волчанки, диабета, ревматоидного артрита, рассеянного склероза, атеросклероза, отторжения трансплантата, воспалительного заболевания кишечника, рака или других состояний, нарушений или заболеваний, связанных с рецептором CCR3, подходящий уровень дозировки обычно колеблется от примерно 0,001 до 100 мг на кг веса тела субъекта в день (мг/кг в день), от примерно 0,01 примерно до 75 мг/кг в день, от примерно 0,1 примерно до 50 мг/кг в день, от примерно 0,5 примерно до 25 мг/кг в день или от примерно 1 примерно до 20 мг/кг в день, который можно вводить в виде единственной или множества дозировок. В данном диапазоне дозировка может колебаться от примерно 0,005 примерно до 0,05, от примерно 0,05 примерно до 0,5, от примерно 0,5 примерно до 5,0, от примерно 1 примерно до 15, от примерно 1 примерно до 20, или от примерно 1 примерно до 50 мг/кг в день. В некоторых вариантах осуществления, уровень дозировки колеблется от примерно 0,001 примерно до 100 мг/кг в день. В некоторых вариантах осуществления, уровень дозировки колеблется от примерно 0,01 примерно до 75 мг/кг в день. В некоторых вариантах осуществления, уровень дозировки колеблется от примерно 0,1 примерно до 50 мг/кг в день. В некоторых вариантах осуществления, уровень дозировки колеблется от примерно 0,5 примерно до 25 мг/кг в день. В некоторых вариантах осуществления, уровень дозировки колеблется от примерно 1 примерно до 20 мг/кг в день.
[0164] Для перорального введения разработанные в изобретении композиции могут быть получены в виде таблеток, содержащих примерно от 1,0 примерно до 1000 мг активного ингредиента, в одном варианте осуществления, примерно 1, примерно 5, примерно 10, примерно 15, примерно 20, примерно 25, примерно 50, примерно 75, примерно 100, примерно 150, примерно 200, примерно 250, примерно 300, примерно 400, примерно 500, примерно 600, примерно 750, примерно 800, примерно 900 и примерно 1000 мг активного ингредиента для симптоматического регулирования дозировки для пациента, подвергаемого лечению. Фармацевтические композиции можно вводить в режиме от 1 до 4 раз в день, включая один, два, три раза и четыре раза в день.
[0165] Следует однако понимать, что конкретный уровень дозировки и частота введения дозы для любого конкретного пациента могут меняться и будут зависеть от факторов, включая активность конкретного используемого соединения, метаболическую стабильность и продолжительность действия данного соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, способ и время введения, скорость выведения, лекарственную комбинацию, тяжесть конкретного состояния и хозяина, подвергаемого лечению.
[0166] Также настоящее изобретение относится к способам модулирования активности CCR3, включающим контактирование рецептора CCR3 с разработанным в изобретении соединением, например, соединением формулы Ia, формулы I или формулы II, включая его энантиомер, смесь энантиомеров, смесь двух или более диастереомеров, таутомер или смесь двух или более таутомеров, или его фармацевтически приемлемой солью, сольватом, гидратом или пролекарством. В одном варианте осуществления, рецептор CCR3 экспрессируется клеткой.
[0167] Разработанные в данном изобретении соединения, например, соединение формулы Ia, формулы I или формулы II, или его фармацевтически приемлемая соль, сольват, гидрат, стереоизомер или таутомер, также могут быть объединены и использованы в комбинации с другими агентами, используемыми при лечении, профилактике или для улучшения одного или нескольких симптомов нарушений, заболеваний или состояний, при которых можно использовать разработанные в изобретении соединения, включая астму, аллергический ринит, экзему, псориаз, атопический дерматит, лихорадку, сепсис, системную красную волчанку, диабет, ревматоидный артрит, рассеянный склероз, атеросклероз, отторжение трансплантата, воспалительное заболевание кишечника, рак, инфекционные заболевания и отмеченные выше патологии.
[0168] В некоторых вариантах осуществления, разработанные в данном изобретении соединения могут быть объединены вместе с одним или несколькими стероидными лекарственными средствами, известными в данной области, включая, но не ограничиваясь указанным группу, включающую альдостерон, беклометазон, бетаметазон, дезоксикортикостерон ацетат, флудрокортизон, гидрокортизон (кортизол), преднизолон, преднизон, метилпреднизолон, дексаметазон и триамцинолон.
[0169] В некоторых вариантах осуществления, разработанные в изобретении соединения могут быть объединены с одним или несколькими антибактериальными агентами, известными в данной области, включая, но не ограничиваясь указанным, группу, включающую амикацин, амоксициллин, ампициллин, арсфенамин, азитромицин, азтреонам, азлоциллин, бацитрацин, карбенициллин, цефаклор, цефадроксил, цефамандол, цефазолин, цефалексин, цефдинир, цефдиторин, цефепим, цефиксим, цефоперазон, цефотаксим, цефокситин, цефподоксим, цефпрозил, цефтазидим, цефтибутен, цефтизоксим, цефтриаксон, цефуроксим, хлорамфеникол, циластин, ципрофлоксацин, кларитромицин, клиндамицин, клоксациллин, колистин, дальфопристин, демеклоциклин, диклоксациллин, диритромицин, доксициклин, эритромицин, энгофлоксацин, эртепенем, этамбутол, флуклоксациллин, фосфомицин, фуразолидон, гатифлоксацин, гелдамицин, дентамицин, гербимицин, имипенем, изониазид, канамицин, левофлоксацин, линезолид, ломефлоксацин, лоракарбеф, мафенид, моксифлоксацин, меропенем, метронидазол, мезлоциллин, миноциклин, мупироцин, нафциллин, неомицин, нетилмицин, нитрофурантоин, норфлоксацин, офлоксацин, окситетрациклин, пенициллин, пиперациллин, платенсимицин, полимиксин В, пронтоцил, пиразинамид, квинупристин, рифампин, рокситромицин, спектиномицин, стрептомицин, сульфацетамид, сульфаметизол, сульфаметоксазол, теикопланин, телитромицин, тетрациклин, тикарциллин, тобрамицин, триметоприм, тролеандомицин, тровафлоксацин и ванкомицин.
[0170] В некоторых вариантах осуществления, разработанные в изобретении соединения могут быть объединены с одним или несколькими противогрибковыми агентами, известными в данной области, включая, но не ограничиваясь указанным, группу, включающую аморолфин, амфотерицин В, анидулафунгин, бифоназол, бутенафин, бутоконазол, каспофунгин, циклопирокс, клотримазол, эконазол, фентиконазол, филипин, флуконазол, изоконазол, интраконазол, кетоконазол, микафунгин, миконазол, нафтифин, натамицин, нистатин, оксиконазол, равуконазол, позаконазол, римоцидин, сертаконазол, салконазол, тербинафин, терконазол, тиоконазол и вориконазол.
[0171] В некоторых вариантах осуществления, разработанные в изобретении соединения могут быть объединены с одним или несколькими антикоагулянтами, известными в данной области, включая, но не ограничиваясь указанным, группу, включающую аценокумарол, аргатробан, бивалирудин, лепирудин, фондапаринукс, гепарин, фениндион, варфарин и ксимелагатран.
[0172] В некоторых вариантах осуществления, разработанные в изобретении соединения могут быть объединены с одним или несколькими тромболитиками, известными в данной области, включая, но не ограничиваясь указанным, группу, включающую анистреплазу, ретеплазу, т-РА (активаза алтеплазы), стрептокиназу, тенектеплазу и урокиназу.
[0173] В некоторых вариантах осуществления, разработанные в изобретении соединения могут быть объединены с одним или несколькими нестероидными противовоспалительными агентами, известными в данной области, включая, но не ограничиваясь указанным, ацеклофенак, ацеметацин, амоксиприн, аспирин, азапропазон, бенорилат, бромфенак, карпрофен, целекоксиб, холинмагний салицилат, диклофенак, дифлунизал, этодолак, эторикоксиб, файсламин, фенбутен, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, лорноксикам, локсопрофен, лумиракоксиб, меклофенаминовая кислота, мефенаминовая кислота, мелоксикам, метамизол, метилсалицилат, салицилат магния, набуметон, напроксен, нимесулид, оксифенбутазон, парекоксиб, фенилбутазон, пироксикам, салицилсалицилат, сулиндак, сулфинпиразон, супрофен, теноксикам, тиапрофеновая кислота и толметин.
[0174] В некоторых вариантах осуществления, разработанные в изобретении соединения могут быть объединены с одним или несколькими антитромбоцитарными агентами, известными в данной области, включая, но не ограничиваясь указанным, абциксимаб, цилостазол, клопидогрель, дипиридамол, тиклопидин и тирофибин.
[0175] Разработанные в данном изобретении соединения также можно вводить в сочетании с другими классами соединений, включая, но не ограничиваясь указанным, ингибиторы эндотелин-превращающего фермента (ECE), такие как фосфорамидон; антагонисты тромбоксанового рецептора, такие как ифетробан; модуляторы калиевых каналов; ингибиторы тромбина, такие как гирудин; ингибиторы фактора роста, такие как модуляторы активности PDGF; антагонисты тромбоцит-активирующего фактора; антитромбоцитарные агенты, такие как блокаторы GPIIb/IIIa (например, абциксимаб, эптифибатид и тирофибан), антагонисты P2Y(AC) (например, клопидогрель, тиклопидин и CS-747) и аспирин; антикоагулянты, такие как варфарин; гепарины низкого молекулярного веса, такие как эноксапарин; ингибиторы фактора VIIa и ингибиторы фактора Xa; ингибиторы ренина; ингибиторы нейтральной эндопептидазы (NEP); ингибиторы вазопептидазы (двойные ингибиторы NEP-ACE), такие как омапатрилат и гемопатрилат; ингибиторы редуктазы HMG CoA, такие как правастатин, ловастатин, аторвастатин, симвастатин, NK-104 (также известный под названиями итивастатин, нисвастатин или нисбастатин) и ZD-4522 (также известный как розувастатин, атавастатин или висастатин); ингибиторы скваленсинтазы; фибраты; вещества, усиливающие экскрецию желчной кислоты, такие как квестран; ниацин; антиатеросклеротические агенты, такие как ингибиторы ACAT; ингибиторы MTP; блокаторы кальциевых каналов, такие как амлодипинбузилат; активаторы калиевых каналов; альфа-адренергические агенты; бета-адренергические агенты, такие как карведилол и метопролол; антиаритмические агенты; диуретики, такие как хлортиазид, гидрохлортиазид, флуметиазид, гидрофлуметиазид бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид, бензотиазид, этакриновая кислота, тикринафен, хлорталидон, фуросенид, музолимин, буметанид, триамтерен, амилорид и спиронолактон; тромболитические агенты, такие как плазминогенный активатор тканей (tPA), рекомбинантный tPA, стрептокиназа, урокиназа, проурокиназа и анизоилированный комплекс активатор плазминогенстрептокиназы (APSAC); антидиабетические агенты, такие как бигуаниды (например, метформин), ингибиторы глюкозидазы (например, акарбоза), инсулины, меглитиниды (например, репаглинид), сульфонилмочевины (например, глимепирид, глубурид и глипизид), тиозолидендионы (например, троглитазон, розиглитазон и пиоглитазон) и агонисты PPAR-гамма; антагонисты минералокортикоидного рецептора, такие как спиронолактон и эплеренон; стимуляторы секреции гормона роста; ингибиторы aP2; ингибиторы фосфодиэстеразы, такие как ингибиторы PDE III (например, цилостазол) и ингибиторы PDE V (например, силденафил, тадалафил и варденафил); ингибиторы протеинтирозинкиназы; противовоспалительные агенты, антипролиферативные агенты, такие как метотрексат, FK506 (такролимус), микофенолят мофетил; химиотерапевтические агенты; иммуносуппресанты; противораковые агенты и цитотоксические агенты (например, алкилирующие агенты, такие как хлорметин, алкилсульфонаты, нитрозомочевины, этиленимины и триазены); антиметаболиты, такие как фолятные антагонисты, аналоги пурина и аналоги пиримидина; антибиотики, такие как антрациклины, блеомицины, митомицин, дактиномицин и пликамицин; ферменты, такие как L-аспарагиназа; ингибиторы фарнезил-протеинтрансферазы; гормональные агенты, такие как глюкокортикоиды (например, кортизон), эстрогены/антиэстрогены, андрогены/антиандрогены, прогестины и антагонисты лютеинизирующего гормона-высвобождающих гормонов и октреотидацетат; разрушающие микротрубочки агенты, такие как эктеинасцидины; стабилизирующие микротрубочки агенты, такие как пацитаксель, доцетаксель и эпотилоны A-F; продукты растительного происхождения, такие как алкалоиды винка, эпиподофиллотоксины и таксаны; и ингибиторы топоизомеразы; ингибиторы пренил-протеинтрансферазы; и циклоспорины; стероиды, такие как преднизон и дексаметазон; цитотоксические лекарственные средства, такие как азатиоприн и циклофосфамид; ингибиторы TNF-альфа, такие как тенидап; антитела против TNF или растворимые рецепторы TNF, такие как этанерцепт, рапамицин и лефлунимид; и ингибиторы циклооксигеназы-2 (COX-2), такие как целекоксиб и рофекоксиб; и смешанные агенты, такие как гидроксимочевина, прокарбазин, митотан, гексаметилмеламин; соединения золота, координационные комплексы платины, такие как цисплатин, сатраплатин и карбоплатин.
[0176] Подобные другие агенты или лекарственные средства можно вводить с помощью пути введения и в количестве, обычно для них используемых, одновременно или последовательно с разработанными в изобретении соединениями, например, соединением формулы Ia, формулы I или формулы II, включая единственный энантиомер, смесь энантиомеров или смесь диастереомеров; или его фармацевтически приемлемой солью, сольватом или пролекарством. Когда разработанное в изобретении соединение используется одновременно с одним или несколькими другими лекарственными средствами, можно использовать фармацевтическую композицию, содержащую такие другие лекарственные средства помимо разработанного в изобретении соединения, но это не является обязательным. Соответственно, разработанные в данном изобретении фармацевтические композиции включают те, которые также содержат один или несколько других активных ингредиентов или терапевтических агентов, помимо разработанного в изобретении соединения.
[0177] Весовое соотношение разработанного в изобретении соединения ко второму активному ингредиенту может изменяться и будет зависеть от эффективной дозы каждого ингредиента. Обычно будет использоваться эффективная доза каждого из них. Так, например, когда разработанное в изобретении соединение объединяют с НСПВС, весовое соотношение соединения к НСПВС может варьироваться от примерно 1000:1 примерно до 1:1000, или примерно от 200:1 примерно до 1:200. Комбинации разработанного в изобретении соединения и других активных ингредиентов обычно будет находиться также в рамках вышеуказанного диапазона, но в каждом случае следует использовать эффективную дозу каждого активного ингредиента.
[0178] Разработанные в данном изобретении соединения также могут быть обеспечены в виде изделия производства с использованием упаковочных материалов, хорошо известных специалистам в данной области. (См., например, патенты США №№ 5323907; 5052558 и 5033252). Примеры фармацевтических упаковочных материалов включают, но не ограничиваются указанным, блистерные упаковки, бутылочки, тюбики, ингаляторы, насосы, пакеты, пузырьки, контейнеры, шприцы и любые упаковочные материалы, подходящие для выбранного препарата и предлагаемого способа введения и лечения.
[0179] Настоящее изобретение также относится к наборам, которые при использовании практикующим врачом могут упростить введение субъекту подходящих количеств активных ингредиентов. В некоторых вариантах осуществления, разработанный в данном изобретении набор включает контейнер и препаративную лекарственную форму разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера.
[0180] В некоторых вариантах осуществления, набор включает контейнер, содержащий препаративную лекарственную форму разработанного в изобретении соединения, например, соединения формулы Ia, формулы I или формулы II или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера, в контейнере содержится один или несколько других терапевтических агентов, указанных в данном описании.
[0181] Разработанные в данном изобретении наборы могут дополнительно включать устройства, которые используются для введения активных ингредиентов. Примеры таких устройств включают, но не ограничиваются указанным, шприцы, безигольные инъекционные пакеты для капельниц, пластыри и ингаляторы. Разработанные в данном изобретении наборы также могут включать кондомы для введения активных ингредиентов.
[0182] Разработанные в данном изобретении наборы могут дополнительно включать фармацевтически приемлемые носители, которые можно использовать для введения одного или нескольких активных ингредиентов. Например, если активный ингредиент находится в твердой форме, влагосодержание которой должно быть восстановлено для парентерального введения, набор может включать герметически закрытый контейнер с подходящим носителем, в котором может быть растворен активный ингредиент для образования не содержащего частиц стерильного раствора, который является подходящим для парентерального введения. Примеры фармацевтически приемлемых носителей включают, но не ограничиваются указанным: водные носители, включая, но не ограничиваясь указанным, воду для инъекций, соответствующую фармакопее Соединенных Штатов, раствор хлорида натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и лактатный раствор Рингера для инъекций; смешивающиеся с водой носители, включая, но не ограничиваясь указанным, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, включая, но не ограничиваясь указанным, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
[0183] Описание будет дополнительно понятно на примере следующих неограничивающих примеров.
ПРИМЕРЫ
[0184] Как использовано в данном описании, символы и условные обозначения, использованные в данных способах, схемах и примерах, вне зависимости от того, было ли определено конкретно определенное сокращение, соответствуют используемым в современной научной литературе, например, в журнале американского химического общества (Journal of the American Chemical Society) или в журнале биологической химии (Journal of Biological Chemistry). В частности, но без ограничения, следующие сокращения могут быть использованы в примерах и по всему тексту данного описания: г (граммы); мг (миллиграммы); мл (миллилитры); мкл (микролитры); мМ (миллимолярный); мкМ (микромолярный); нМ (наномолярный); эквив. (эквивалент); Гц (герцы); МГц (мегагерцы); ммоль (милимоли); ч или час (часы); мин (минуты); MC (масс-спектрометрия); ESI (ионизация методом электрораспыления); ТСХ (тонкослойная хроматография); Rt (время удерживания); SiO2 (диоксид кремния); ТГФ (тетрагидрофуран); CDCl3 (дейтерированный хлороформ); ДХМ (дихлорметан); ДМФ (диметилформамид); ДМСО (диметилсульфоксид); EtOAc (этилацетат); CHCl3 (хлороформ); ДМФ (N,N-диметилформамид); MeOH (метанол); HCl (хлористоводородная кислота); LiOH (гидроксид лития); MgSO4 (сульфат магния); NaH (гидрид натрия); NaOH (гидроксид натрия); NaHCO3 (бикарбонат натрия); DIPEA (N,N-диизопропилэтиламин); ТЭА (триэтиламин); ДБУ (1,8-диазабицикло[5.4.0]ундец-7-ен); CDI (карбонилдиимидазол); TBTU (тетрафторборат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония); Me (метил); Et (этил); tBu (трет-бутил); Boc (трет-бутоксикарбонил); Bn (бензил); TsO (тозилат); DIAD (диизопропилазодикарбоксилат), DEAD (диэтилазодикарбоксилат), PPh3 (трифенилфосфин), PNBA (п-нитробензойная кислота) и PNB (п-нитробензоил).
[0185] Во всех следующих примерах можно использовать стандартные методы обработки и очистки, известные специалистам в данной области. Если не указано другого, все температуры выражены в °С (градусы Цельсия). Все реакции проводили при комнатной температуре, если не указано другого. Проиллюстрированные в данном описании синтетические методологии предназначены для иллюстрации применяемой химии для использования в конкретных примерах и не указывают на объем изобретения.
ПРИМЕР 1
Получение соединения 9
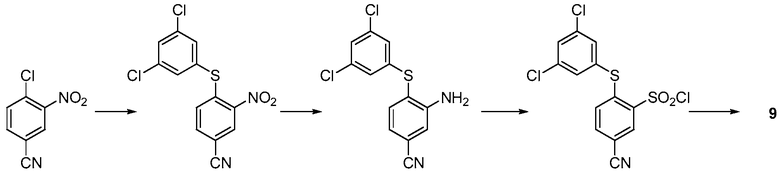
[0186] 1) Получение 4-(3,5-дихлорфенилтио)-3-нитробензонитрила. - 3,5-Дихлортиофенол (11,772 г, 65,74 ммоль) растворяли в ТГФ (80 мл), охлаждали на ледяной бане и добавляли NaH (2,629 г, 109,56 ммоль). Полученную таким образом реакционную смесь перемешивали в течение 5 минут, после чего добавляли 4-хлор-3-нитробензонитрил (10,000 г, 54,78 ммоль), затем перемешивали дополнительно в течение 15 минут и затем нагревали до комнатной температуры. Через 3 дня реакционную смесь конденсировали в вакууме для удаления органического растворителя. Полученную суспензию фильтровали и отфильтрованное твердое вещество промывали водой, получая продукт в виде желтого порошка (17,200 г, 86,5% чистота по данным ВЭЖХ, 96,6% выход). 1H-ЯМР: (500 МГц, ДМСО-d6) 8,77 (д, J=1 Гц, 1H), 7,99 (дд, J1=8 Гц, J1=2 Гц, 1H), 7,89 (т, J1=J2=1 Гц, 1H), 7,80 (д, J=2 Гц, 2H), 7,13 (д, J=9 Гц, 1H).
[0187] 2) Получение 4-(3,5-дихлорфенилтио)-3-аминобензонитрила. - Гидросульфит натрия (35,000 г, 201,02 ммоль) растворяли в минимальном количестве воды (150 мл), к которой добавляли раствор 4-(3,5-дихлорфенилтио)-3-нитробензонитрила (17,200 г, 52,90 ммоль) в ТГФ (200 мл). Полученную таким образом реакционную смесь нагревали и выдерживали при 90°С в течение 18 часов, после чего летучие компоненты удаляли в вакууме. Отделенные твердые вещества собирали фильтрованием под давлением и промывали водой, получая продукт в виде желтого порошка. (15,387 г, 93,3% чистота по данным ВЭЖХ, 98,5% выход). 1H-ЯМР: (500 МГц, ДМСО-d6) 7,51 (д, J=8 Гц, 1H), 7,43 (т, J1=J2=1 Гц, 1H), 7,14 (д, J=1 Гц, 1H), 7,07 (д, J=1 Гц, 2H), 6,96 (дд, J1=8 Гц, J2=2 Гц, 1H), 6,02 (с, 2H).
[0188] 3) Получение 5-циано-2-(3,5-дихлорфенилтио)бензол-1-сульфонилхлорида. - 4-(3,5-Дихлорфенилтио)-3-аминобензонитрил (8,000 г, 27,10 ммоль) суспендировали в смеси, состоящей из 50 мл каждого из воды и концентрированной HCl, и затем охлаждали на ледяной бане. К перемешиваемой суспензии в кислоте добавляли по каплям раствор нитрита натрия (5,610 г, 81,30 ммоль) в 50 мл воды. Полученную таким образом реакционную смесь перемешивали в течение часа на ледяной бане. В отдельной емкости SO2 барботировали в уксусную кислоту (150 мл) в течение часа, к которой затем добавляли хлорид меди (II) (2,310 г, 13,55 ммоль). Раствор меди (II) затем перемешивали в течение 10 минут, при этом раствор становился сине-зеленым, указывая на полное насыщение. Сине-зеленую реакционную смесь охлаждали на ледяной бане. Первую реакционную смесь (раствор диазосоединения) добавляли по каплям во вторую реакционную смесь (насыщенная уксусная кислота), через которую барботировали SO2. Источник газообразного SO2 удаляли, полученную таким образом реакционную смесь перемешивали в течение часа до момента прекращения выделения газа и затем медленно выливали раствор в интенсивно перемешиваемую ледяную воду. Полученную суспензию затем фильтровали и отфильтрованное твердое вещество промывали водой, получая продукт в виде желтого порошка (6,850 г, 90% чистота для 1Н ЯМР, 66,8% выход). 1H-ЯМР: (500 МГц, ДМСО-d6) 8,05 (д, J=2 Гц, 1H), 7,72 (т, J1=J2=1 Гц, 1H), 7,64 (дд, J1=8 Гц, J2=2 Гц, 1H), 7,54 (д, J=1 Гц, 2H), 6,97 (д, J=8 Гц, 1H).
[0189] 4) Получение соединения 9 - Раствор 5-циано-2-(3,5-дихлорфенил-тио)бензол-1-сульфонилхлорида (1,500 г, 3,96 ммоль) в 20 мл CH2Cl2 добавляли по каплям со скоростью 0,200 мл/мин к перемешиваемому раствору 2-пиперазинона (0,396 г, 3,96 ммоль) и триэтиламина (0,823 мл, 5,94 ммоль) в 5 мл CH2Cl2. Полученную таким образом реакционную смесь перемешивали в течение 17 часов, при этом в коричневом растворе образовывался белый осадок. Твердое вещество отфильтровывали и промывали минимальным количеством CH2Cl2, получая соединение 9 в виде белого порошка (1,071 г, 92,3% чистота по данным ВЭЖХ, 61,2% выход). 1H-ЯМР: (500 МГц, ДМСО-d6) 8,34 (д, J=2 Гц, 1H), 8,13 (с, 1H), 7,93 (дд, J1=8 Гц, J2=2 Гц, 1H), 7,84 (т, J1=J2=2 Гц, 1H), 7,75 (д, J=2 Гц, 2H), 7,14 (д, J=8 Гц, 1H), 3,90 (с, 2H), 3,60 (м, 2H), 3,21 (м, 2H). ESI-Масс-спектр: 414 (M+1)+.
ПРИМЕР 2
Получение соединения 24
[0190] 1) Получение 2-хлор-5-нитробензол-1-сульфонилхлорида. - К раствору 2-хлор-5-нитроанилина (5,000 г, 28,97 ммоль) в 45 мл уксусной кислоты добавляли 35 мл HCl. Полученный раствор охлаждали на ледяной бане и к нему при перемешивании добавляли раствор нитрита натрия (5,997 г, 86,91 ммоль) в 15 мл воды. Полученную таким образом реакционную смесь перемешивали на ледяной бане в течение 1 часа. В отдельной емкости SO2 барботировали в уксусную кислоту (40 мл). Через 30 минут добавляли хлорид меди (II) (1,435 г, 14,49 ммоль), и раствор становился темно-сине-зеленым, указывая на полное насыщение. Сине-зеленую реакционную смесь охлаждали на ледяной бане. Первую реакционную смесь (раствор диазосоединения) добавляли по каплям во вторую реакционную смесь (насыщенная уксусная кислота), через которую барботировали SO2. Источник газообразного SO2 удаляли, полученную таким образом реакционную смесь перемешивали в течение часа до момента прекращения выделения газа и затем медленно выливали раствор в интенсивно перемешиваемую ледяную воду. Полученный раствор затем перемешивали до момента расплавления льда и фильтровали, получая розовый порошок. Порошок промывали большим количеством воды, получая продукт в виде светло-розового порошка. (4,902 г, 87,3% чистота по данным ВЭЖХ, 66,2% выход). 1H-ЯМР: (500 МГц, ДМСО-d6) 8,61 (д, J=3 Гц, 1H), 8,16 (дд, J1=9 Гц, J2=3 Гц, 1H), 7,70 (д, J=9 Гц, 1H).
[0191] 2) Получение 4-(2-хлор-5-нитрофенилсульфонил)тиоморфолина. К раствору 2-хлор-5-нитробензол-1-сульфонилхлорида (0,200 г, 0,78 ммоль) в 8 мл CH2Cl2 добавляли тиоморфолин (0,111 мл, 1,17 ммоль) и триэтиламин (0,162 мл, 1,17 ммоль). Полученную таким образом реакционную смесь перемешивали при комнатной температуре в течение 18 часов и очищали колоночной хроматографией (8%-->15%-->20% EtOAc в гексанах). Фракции, содержащие целевой продукт, объединяли и конденсировали в вакууме, затем растирали с EtOAc и гексанами. Твердое вещество отфильтровывали, получая продукт в виде светло-желтого порошка. (0,139 г, 99,6% чистота по данным ВЭЖХ, 55,2% выход). 1H-ЯМР: (500 МГц, ДМСО-d6) 8,62 (д, J=3 Гц, 1H), 8,47 (дд, J1=9 Гц, J2=3 Гц, 1H), 8,01 (д, J=9 Гц, 1H), 3,54 (м, 4H), 2,65 (м, 4H).
[0192] 3) Получение соединения 24. Раствор 3,5-дихлортиофенола (0,047 г, 0,26 ммоль) в 8 мл ТГФ охлаждали на ледяной бане. К этому раствору добавляли NaH (0,011 г, 0,44 ммоль). Раствор затем перемешивали в течение 5 минут, после чего добавляли 4-(2-хлор-5-нитрофенилсульфонил)тиоморфолин (0,0700 г, 0,22 ммоль). Полученную таким образом реакционную смесь перемешивали в течение 10 минут, нагревали до комнатной температуры и затем перемешивали дополнительно в течение 18 часов. Реакционную смесь конденсировали в вакууме и растирали с EtOAc и гексанами. Твердые вещества отфильтровывали, получая продукт в виде белого порошка (0,096 г, 97,1% чистота по данным ВЭЖХ, 93,7% выход). 1H-ЯМР: (500 МГц, ДМСО-d6) 8,52 (д, J=1 Гц, 1H), 8,29 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,88 (т, J1=J2=1 Гц, 1H), 7,78 (д, J=1 Гц, 2H), 7,23 (д, J=9 Гц, 1H), 3,59 (м, 4H), 2,70 (м, 4H).
ПРИМЕР 3
Физические характеристики
[0193] Указанные ниже соединения были получены способами, аналогичными указанным выше для соединений 9 и 24.
[0194] Соединение 1 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,22 (д, J=1 Гц, 1H), 7,91 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,84 (т, J1=J2=1 Гц, 1H), 7,71 (д, J=1 Гц, 2H), 7,12 (д, J=8 Гц, 1H), 3,26 (м, 4H), 1,56 (м, 4H), 1,49 (м, 2H). ESI-Масс-спектр: 427 (M+1)+.
[0195] Соединение 2 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,47 (д, J=8 Гц, 1H), 8,40 (дд, J1=7 Гц, J2=1 Гц, 1H), 8,33 (д, J=1 Гц, 1H), 7,83 (т, J1=J2=1 Гц, 1H), 7,75 (д, J=1 Гц, 2H), 3,19 (м, 4H), 1,54 (м, 4H), 1,46 (м, 2H). ESI-Масс-спектр: 358 (M+1)+.
[0196] Соединение 3 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,71 (д, J=8 Гц, 1H), 8,48 (дд, J1=7 Гц, J2=1 Гц, 1H), 8,42 (д, J=1 Гц, 1H), 8,03 (т, J1=J2=1 Гц, 1H), 7,90 (д, J=1 Гц, 2H), 3,27 (м, 4H), 1,50 (м, 6H), ESI-Масс-спектр: 459 (M+1)+.
[0197] Соединение 4 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,18 (д, J=1 Гц, 1H), 7,85 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,23 (с, 3H), 6,92 (д, J=8 Гц, 1H), 3,26 (м, 4H), 2,32 (с, 6H), 1,56 (м, 4H), 1,50 (м, 2H). ESI-Масс-спектр: 343 (M+1)+.
[0198] Соединение 5 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,19 (д, J=2 Гц, 1H), 7,85 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,22 (с, 3H), 6,93 (д, J=8 Гц, 1H), 3,78 (м, 2H), 2,76 (м, 2H), 2,32 (с, 6H), 1,68 (м, 2H), 1,49 (м, 1H), 1,13 (м, 2H), 0,89 (д, J=7 Гц, 3H). ESI-Масс-спектр: 441 (M+1)+.
[0199] Соединение 6 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,23 (д, J=1 Гц, 1H), 7,92 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,84 (с, 1H), 7,69 (с, 2H), 7,15 (д, J=8 Гц, 1H), 3,77 (м, 2H), 2,78 (м, 2H), 1,69 (м, 2H), 1,47 (м, 1H), 1,10 (м, 2H), 0,88 (д, J=7 Гц, 3H). ESI-Масс-спектр: 441 (M+1)+.
[0200] Соединение 7 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,27 (д, J=1 Гц, 1H), 7,92 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,85 (т, J1=J2=1 Гц, 1H), 7,73 (д, J=1 Гц, 2H), 7,13 (д, J=8 Гц, 1H), 4,87 (м, 0,5H), 4,78 (м, 0,5H), 3,40 (м, 4H), 1,94 (м, 2H), 1,79 (м, 2H). ESI-Масс-спектр: 335 (M+1)+.
[0201] Соединение 8 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8 8,26 (д, J=1 Гц, 1H), 7,91 (дд, J1=5 Гц, J2=1 Гц, 1H), 7,84 (т, J1=J2=1 Гц, 1H), 7,68 (д, J=1 Гц, 2H), 7,14 (д, J=8 Гц, 1H), 3,74 (м, 2H), 2,32 (т, J1=J2=12 Гц, 2H), 1,70 (м, 1H), 1,61 (м, 2H), 0,84 (д, J=7 Гц, 6H), 0,68 (м, 1H). ESI-Масс-спектр: 455 (M+1)+.
[0202] Соединение 10 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,29 (д, J=1 Гц, 1H), 8,14 (с, 1H), 7,88 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,24 (с, 2H), 7,22 (с, 1H), 6,93 (д, J=8 Гц, 1H), 3,90 (с, 2H), 3,59 (м, 2H), 3,20 (м, 2H), 2,32 (с, 6H). ESI-Масс-спектр: 443 (M+1)+.
[0203] Соединение 11 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,33 (д, J=1 Гц, 1H), 8,13 (дд, J1=7 Гц, J2=1 Гц, 1H), 8,11 (с, 1H), 7,57 (т, J1=J2=1 Гц, 1H), 7,40 (д, J=1 Гц, 2H), 7,30 (д, J=9 Гц, 1H), 3,81 (с, 2H), 3,52 (м, 2H), 3,11 (м, 2H). ESI-Масс-спектр: 467 (M+1)+.
[0204] Соединение 12 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,23 (с, 1H), 7,94 (д, J=10 Гц, 1H), 7,85 (с, 1H), 7,77 (с, 2H), 7,14 (д, J=8 Гц, 1H), 3,66 (м, 4H), 3,27 (м, 4H). ESI-Масс-спектр: 369 (M+1)+.
[0205] Соединение 13 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,26 (д, J=1 Гц, 1H), 7,92 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,85 (т, J1=J2=1 Гц, 1H), 7,75 (д, J=1 Гц, 2H), 7,14 (д, J=8 Гц, 1H), 3,58 (м, 4H), 2,68 (м, 4H).
[0206] Соединение 14 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,34 (д, J=1 Гц, 1H), 7,94 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,85 (т, J1=J2=1 Гц, 1H), 7,79 (д, J=1 Гц, 2H), 7,16 (д, J=8 Гц, 1H), 3,84 (м, 4H), 3,29 (м, 4H). ESI-Масс-спектр: 475 (M-1)-.
[0207] Соединение 15 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,19 (с, 1H), 7,88 (д, J=10 Гц, 1H), 7,26 (с, 2H), 7,23 (с, 1H), 6,94 (д, J=8 Гц, 1H), 3,66 (м, 4H), 3,26 (м, 4H), 2,33 (м, 6H). ESI-Масс-спектр: 343 (M+1)+.
[0208] Соединение 16 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,22 (д, J=1 Гц, 1H), 7,87 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,24 (с, 2H), 7,22 (с, 1H), 6,94 (д, J=8 Гц, 1H), 3,58 (м, 4H), 2,69 (м, 4H), 2,32 (с, 6H). ESI-Масс-спектр: 343 (M+1)+.
[0209] Соединение 17 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,30 (д, J=1 Гц, 1H), 7,89 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,26 (с, 2H), 7,23 (с, 1H), 6,96 (д, J=8 Гц, 1H), 3,83 (м, 4H), 3,30 (м, 4H), 2,32 (с, 6H). ESI-Масс-спектр: 500 (M+1)+.
[0210] Соединение 18 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,36 (с, 2H), 8,31 (с, 1H), 8,26 (д, J=1 Гц, 1H), 7,92 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,14 (д, J=8 Гц, 1H), 3,66 (м, 4H), 3,29 (м, 4H).
[0211] Соединение 19 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,33 (с, 2H), 8,30 (м, 2H), 7,91 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,16 (д, J=8 Гц, 1H), 3,60 (м, 4H), 2,70 (м, 4H).
[0212] Соединение 20 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,37 (м, 3H), 8,31 (с, 1H), 7,93 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,17 (д, J=8 Гц, 1H), 3,86 (м, 4H), 3,30 (м, 4H).
[0213] Соединение 21 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,28 (д, J=1 Гц, 1H), 8,12 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,56 (т, J1=J2=1 Гц, 1H), 7,38 (д, J=1 Гц, 1H), 7,32 (д, J=9 Гц, 1H), 3,48 (м, 4H), 2,65 (м, 4H).
[0214] Соединение 22 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,24 (д, J=1 Гц, 1H), 8,03 (дд, J1=7 Гц, J2=1 Гц, 1H), 6,99 (м, 2H), 6,84 (с, 2H), 3,50 (м, 4H), 2,65 (м, 4H), 2,30 (с, 6H). ESI-Масс-спектр: 327 (M+1)+.
[0215] Соединение 23 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,33 (д, J=1 Гц, 1H), 8,14 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,57 (т, J1=J2=1 Гц, 1H), 7,42 (д, J=1 Гц, 2H), 7,33 (д, J=9 Гц, 1H), 3,73 (м, 4H), 3,26 (м, 4H). ESI-Масс-спектр: 526 (M+1)+.
[0216] Соединение 25 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,52 (д, J=1 Гц, 1H), 8,27 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,27 (с, 2H), 7,24 (с, 1H), 7,04 (д, J=9 Гц, 1H), 3,59 (м, 4H), 2,70 (м, 4H), 2,33 (с, 6H). ESI-Масс-спектр: 363 (M+1)+.
[0217] Соединение 26 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,29 (д, J=1 Гц, 1H), 8,05 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,02 (д, J=9 Гц, 1H), 6,98 (с, 1H), 6,85 (с, 2H), 3,74 (м, 4H), 3,26 (м, 4H), 2,30 (с, 6H). ESI-Масс-спектр: 484 (M+1)+.
[0218] Соединение 27 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,23 (д, J=1 Гц, 1H), 7,92 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,85 (т, J1=J2=1 Гц, 1H), 7,70 (д, J=1 Гц, 2H), 7,14 (д, J=8 Гц, 1H), 3,59 (м, 2H), 2,91 (м, 1H), 2,67 (м, 3H), 2,32 (м, 1H), 2,26 (м, 1H), 0,95 (д, J=6 Гц, 3H). ESI-Масс-спектр: 442 (M+1)+.
[0219] Соединение 30 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,57 (д, J=1 Гц, 1H), 8,31 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,89 (т, J1=J2=1 Гц, 1H), 7,83 (д, J=1 Гц, 1H), 7,24 (д, J=9 Гц, 1H), 3,86 (м, 4H), 3,30 (м, 4H). ESI-Масс-спектр: 495 (M-1)-.
[0220] Соединение 31 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,22 (с, 1H), 7,92 (дд, J1=8 Гц, J2=1 Гц, 1H), 7,83 (с, 1H), 7,72 (с, 1H), 7,13 (д, J=8 Гц, 1H), 3,25 (с, 3H), 3,16 (м, 2H), 2,92 (с, 1H), 2,73 (м, 2H), 1,23 (м, 2H). ESI-Масс-спектр: 469 (M+1)+.
[0221] Соединение 32 - 1H-ЯМР: (500 МГц, ДМСО-d6) 8,26 (д, J=1 Гц, 1H), 7,93 (дд, J1=7 Гц, J2=1 Гц, 1H), 7,86 (т, J1=J2=1 Гц, 1H), 7,73 (д, J=1 Гц, 2H), 7,13 (д, J=8 Гц, 1H), 3,59 (м, 1H), 3,57 (с, 3H), 3,28 (м, 1H), 3,23 (м, 1H), 3,13 (м, 1H), 2,98 (м, 1H), 2,83 (м, 1H), 2,68 (м, 1H). ESI-Масс-спектр: 376 (M-1)-.
ПРИМЕР 4
Анализ связывания рецептора CCR3
[0222] Клетки промывали один раз PBS и повторно суспендировали в связывающем буфере (25 мМ HEPES, pH 7,6, 5 мМ MgCl2, 1 мМ CaCl2, 0,5% BSA, 0,1% NaN3). 100 мл суспензии клеток (2×105 клеток/лунка) и 0,1 нМ [125I]-меченого эотаксина/CCL11 человека (удельная активность 2000 Ки/ммоль) смешивали в 96-луночном полипропиленовом планшете с U-дном и инкубировали в течение 60 минут при комнатной температуре для протекания реакции связывания. Суспензию клеток затем переносили в планшет для фильтрования (#MAFB, Millipore) и промывали 3 раза связывающим буфером, содержащим 0,5 M NaCl, добавляли сцинтиллятор и радиоактивность подсчитывали на TopCount (Packard). Для определения неспецифического связывания клеточную суспензию и [125I]-меченый эотаксин/CCL11 человека инкубировали в присутствии 500 нМ немеченого эотаксина/CCL11 человека. См. Iino et al., "Molecular cloning and functional characterization of cynomolgus monkey (Macaca fascicularis) CC chemokine receptor, CCR3," Cytokine 2002, 19, 276-286.
[0223] Биологические результаты суммированы в таблице 1, где A представляет значение не больше чем 50 нМ, и B представляет значение больше чем 50 нМ, но не больше чем 500 нМ, C представляет значение больше чем 500 нМ, но не больше чем 5 мкМ, и D представляет значение больше чем 5 мкМ.
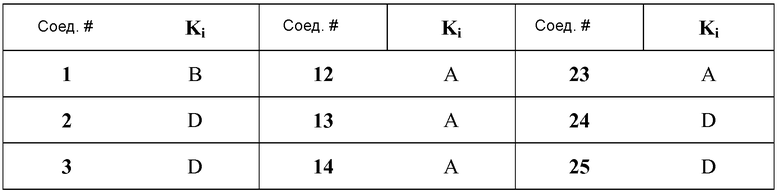
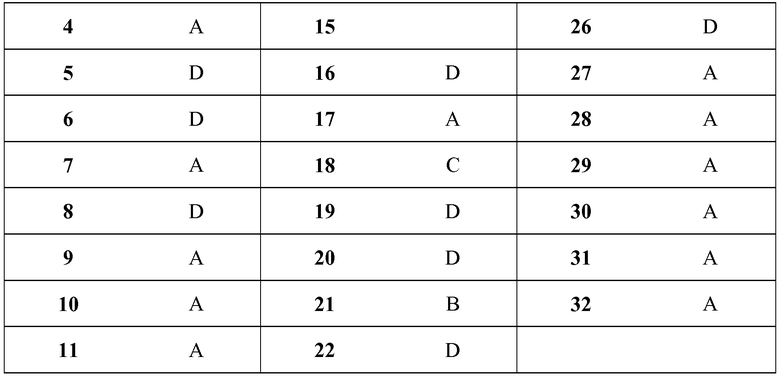
[0224] Указанные выше примеры приведены, чтобы дать обычному специалисту в данной области полную информацию и описание того, как получать и использовать заявленные варианты осуществления, и не предназначены для ограничения объема раскрываемой в данном описании информации. Предполагается, что модификации, которые очевидны для специалистов в данной области, входят в объем нижеследующей формулы изобретения. Все публикации, патенты и патентные заявки, процитированные в данном описании, включены в него путем ссылки, как если бы каждая такая публикация, патент или патентная заявка были конкретно и индивидуально указаны, как входящие в данное описание путем ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,5-ДИЗАМЕЩЕННЫЕ АРИЛСУЛЬФОНАМИДНЫЕ АНТАГОНИСТЫ CCR3 | 2010 |
|
RU2532515C2 |
| НОВЫЕ ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2006 |
|
RU2434006C2 |
| АНТАГОНИСТЫ АРИЛСУЛЬФОНАМИДА CCR3 | 2010 |
|
RU2539591C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ 8-ГЕТЕРОАРИЛКСАНТИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2004 |
|
RU2357969C2 |
| ПРОИЗВОДНЫЕ ДИПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, АНТИГИПЕРТОНИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2098424C1 |
| ИНГИБИТОРЫ РЕЦЕПТОРОВ ERBB | 2019 |
|
RU2810215C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ФЛОРОГЛЮЦИНА, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ЛИГАНДА СЕЛЕКТИНА | 2006 |
|
RU2418584C2 |
| ДИГИДРОПИРИДОФТАЛАЗИНОНОВЫЕ ИНГИБИТОРЫ ПОЛИ(АДФ-РИБОЗА)ПОЛИМЕРАЗЫ | 2009 |
|
RU2514937C2 |
| ПРОИЗВОДНЫЕ ПИРАЗИНА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ ATR | 2009 |
|
RU2604066C2 |
| ИНДАЗОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ FGFR, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2015 |
|
RU2719428C2 |
Изобретение относится к 2,5-дизамещенным арилсульфонамидам формулы (Ia) или к его фармацевтически приемлемым солям, сольватам, гидратам, стереоизомерам или таутомерам, где X представляет собой S, SO или SO2; Y и Z представляют собой (i) Y представляет собой NR5; и Z представляет собой =O, CO2R6 или C1-6алкил; или (ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или C1-6алкил; R1 и R2 каждый независимо представляют собой галоген, C1-6алкил или C1-6 галогеналкил; R3 представляет собой CN или NO2; R4 представляет собой водород или C1-6алкил; R5 представляет собой водород или C1-6алкил; и R6 представляет собой водород или C1-6алкил. Также изобретение относится к соединениям формул (I) и (II), значения радикалов которых указаны в формуле изобретения, конкретным соединениям, фармацевтической композиции на основе соединения формулы (Ia), (I) и (II), способу модулирования активности CCR3. Технический результат: получены новые соединения, обладающие полезными биологическими свойствами. 7 н. и 11 з.п. ф-лы,1 табл., 3 пр.



1. Соединение формулы Ia или его фармацевтически приемлемая соль, сольват, гидрат, стереоизомер или таутомер:

где
X представляет собой S, SO или SO2;
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =O, CO2R6 или C1-6алкил; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или C1-6алкил;
R1 и R2 каждый независимо представляют собой галоген, C1-6алкил или C1-6 галогеналкил;
R3 представляет собой CN или NO2;
R4 представляет собой водород или C1-6алкил;
R5 представляет собой водород или C1-6алкил; и
R6 представляет собой водород или C1-6алкил.
2. Соединение формулы I или его фармацевтически приемлемая соль, сольват, гидрат, стереоизомер или таутомер:

где
X представляет собой S, SO или SO2;
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =O или C1-6алкил; или
(ii) Y представляет собой CH2, CHF, CHCH3, O, S или SO2; и Z представляет собой водород или C1-6алкил;
R1 и R2 каждый независимо представляют собой галоген, C1-6алкил или C1-6галогеналкил;
R3 представляет собой CN или NO2;
R4 представляет собой водород или C1-6алкил; и
R5 представляет собой водород или C1-6алкил.
3. Соединение по п.1 или 2, где X представляет собой S.
4. Соединение по п.1 или 2, где R3 представляет собой CN.
5. Соединение по п.1 или 2, где R3 представляет собой NO2.
6. Соединение формулы II или его фармацевтически приемлемая соль, сольват, гидрат, стереоизомер или таутомер:

где
Y и Z представляют собой
(i) Y представляет собой NR5; и Z представляет собой =O; или
(ii) Y представляет собой S или SO2; и Z представляет собой водород;
R1 и R2 каждый независимо представляют собой галоген или C1-6алкил;
R4 представляет собой водород;
R5 представляет собой водород.
7. Соединение по п.6, где Y представляет собой NR5.
8. Соединение по п.6, где Y представляет собой S.
9. Соединение по п.6, где Y представляет собой SO2.
10. Соединение по п.6, где R1 и R2 представляют собой Cl.
11. Соединение по п.6, где R1 и R2 представляют собой CH3.
12. Соединение, выбранное из группы, состоящей из:

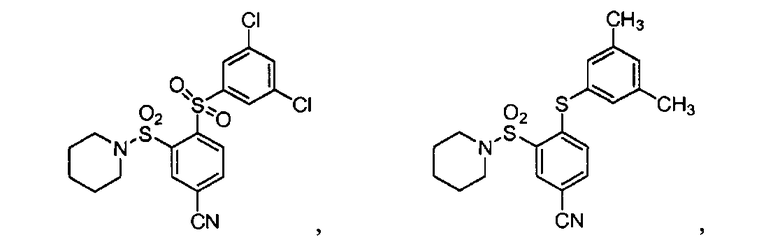




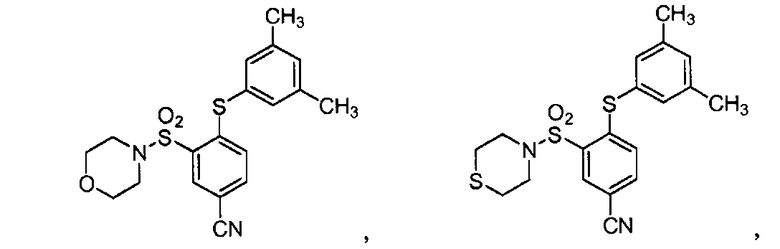
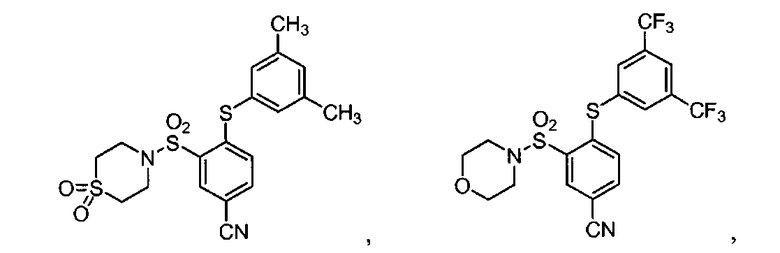

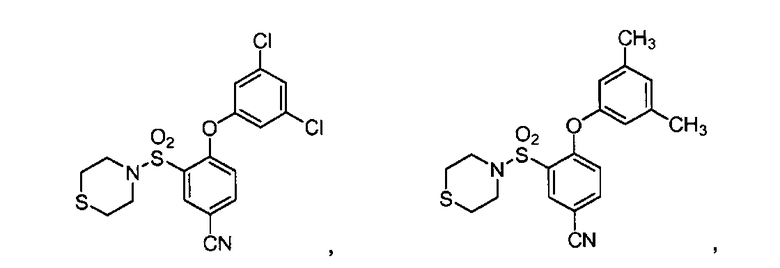

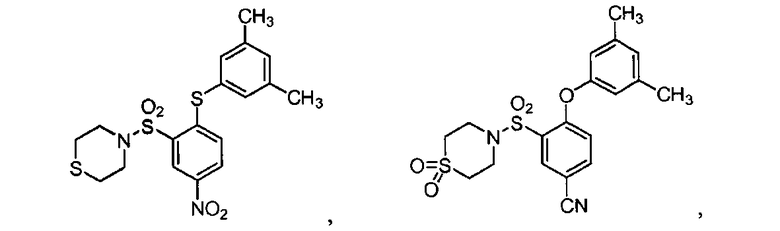

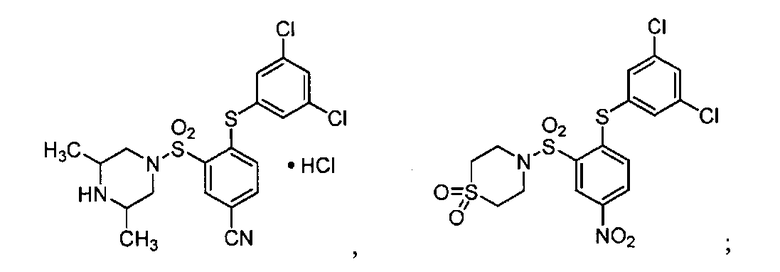

или его фармацевтически приемлемая соль, сольват, гидрат, стереоизомер или таутомер.
13. Фармацевтическая композиция для лечения, профилактики, или облегчения одного или более симптомов, связанного с CCR3 нарушения, заболевания или состояния, включающая соединение по любому из пп.1, 2 и 6 и один или несколько фармацевтически приемлемых носителей и эксципиентов.
14. Способ лечения, профилактики или облегчения одного или нескольких симптомов связанного с CCR3 нарушения, заболевания или состояния у субъекта, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1, 2 и 6.
15. Способ по п.14, где нарушение или заболевание представляет собой воспалительное или иммунорегулируемое нарушение или заболевание.
16. Способ по п.14, где нарушение или заболевание представляет собой астму, ринит, аллергическое заболевание или аутоиммунную патологию.
17. Способ по п.14 где соединение или композицию вводят перорально, парентерально или местно.
18. Способ модулирования активности CCR3, включающий контактирование рецептора CCR3 с соединением по любому из пп.1, 2 и 6.
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| RU 2004138546 A, 10.09.2005 | |||
| RU 2005131501 A, 27.05.2006 | |||
| Способ получения производных 1-фенилсульфонил-2-пиперидинона | 1990 |
|
SU1757463A3 |
Авторы
Даты
2014-08-27—Публикация
2010-04-21—Подача