Настоящее изобретение относится к соединениям, композициям и способам модуляции in vitro и in vivo процессов, опосредуемых молекулами адгезии клеток. Описанные низкомолекулярные соединения включают диметокси- и дигидроксифенильные субъединицы и эффективно модулируют функции, опосредуемые молекулами адгезии клеток.
Опосредуемые молекулами адгезии клеток функции являются частью комплексного каскада, приводящего к миграции циркулирующих белых кровяных клеток (лейкоцитов) из кровотока в окружающую ткань (трансмиграция). Физиологически, трансмиграция лейкоцитов является критически важной для гомеостаза и иммунологической регуляции или контроля в живых организмах, включая людей. Лимфоциты, например, констуитивно направляют кровоток в лимфатические ткани для контроля вредных антигенов. Однако при патологических случаях, например локальном или системном воспалении и/или повреждении васкулярной системы, регуляция этого фундаментального процесса нарушается, по меньшей мере, частично вследствие повышенной поверхностной экспрессии Е- и Р-селектина. Следовательно, чрезмерная трансмиграция лейкоцитов приводит к патологическому клеточному инфильтрату с последующим повреждением ткани при некоторых клинически релевантных условиях. Патологические состояния, такие как острое повреждение легких (ALI), острый респираторный дистресс-синдром (ARDS), бронхиальная астма (астма), хроническое обструктивное заболевание легких (COPD), псориаз, ревматоидный артрит и сепсис, все связаны с воспалением ткани, индуцированным и поддерживаемым патологически активированными лейкоцитами, инфильтрующими соответствующую ткань. Кроме того, инфильтрация эксагрегированных лейкоцитов способствует патогенезу ишемического-реперфузионного повреждения (IRI), связанного с трансплантацией органа, экстракорпоральным кровообращением или подкожной внутрипросветной ангиопластикой.
Для трансмиграции лейкоциты должны связываться со стенкой сосудистого эндотелия, чтобы диффундировать через клеточную оболочку капилляра в окружающую ткань. Следовательно, лейкоциты должны катиться по клеточной оболочке и затем прилипать к клеточной оболочке эндотелия (начальный процесс прокатывания или «связывания»). Это основное событие в трансмиграции опосредуется молекулами адгезии клеток семейства селектинов. Помимо непосредственного связывания с эндотелием лейкоциты могут прилипать к другим лейкоцитам, частицам-лейкоцитам, тромбоцитам или образованным из тромбоцитов частицам, которые уже прилипли к эндотелию.
Семейство селектиновых молекул адгезии состоит из трех структурно родственных, кальций-зависимых, связывающих углеводы белков клеточной поверхности, селектинов Е, P и L. Е-селектин экспрессируется только на воспаленном эндотелии, Р-селектин экспрессируется на воспаленном эндотелии, а также на тромбоцитах и L-селектин экспрессируется на лейкоцитах. Селектины состоят из аминоконцевого лектинового домена, домена, подобного эпидермальному фактору роста (EGF), вариабельного числа повторов, относящихся к рецептору комплемента, гидрофобного трансмембранного домена и С-концевого цитоплазматического домена. Предполагается, что связывающие взаимодействия, приводящие к адгезии лейкоцитов, опосредуются контактированием лектинового домена селектинов и различных углеводных лигандов на поверхности лейкоцитов. Все три селектина могут связываться с низкой аффинностью с углеводом сиалил-Lewisx (sLex), гликозильной частью, присутствующей на поверхности большинства лейкоцитов. Структурно родственную гликозильную часть, сиалил-Lewisa (sLea), преимущественно обнаруживают на поверхности раковых клеток [K. Okazaki et al., J Surg. Res., 1998, 78(1). 78-84; R.P. McEver et al., Glycoconjugate Journal, 1997, 14(5), 585-591]. В случае Р-селектина описан гликопротеиновый лиганд с явной высокой аффинностью [R.P. McEver, R.D. Cummings, J. Clin. Invest., 1997, 100, 485-492], так называемый гликопротеиновый лиганд-1 Р-селектина (PSGL-1), который способствует связыванию селектина с высокой аффинностью посредством его sLex-части, а также посредством частей его пептидных компонентов, в особенности остатков сульфатированного тирозина [R.P. McEver, Ernst Schering Res. Found. Workshop, 2004, 44, 137-147]. PSGL-I является одним из наиболее важных лигандов селектинов, связывающихся с самой высокой аффинностью с Р-селектином, но он связывается также с Е- и L-селектином [G. Constantin; Drug News Perspect; 2004; 17(9); 579-586]. Он является гомодимерным сиаломуцином, преимущественно экспрессируемым на лейкоцитах.
При воспалительных заболеваниях разрегулированная трансмиграция, по меньшей мере, частично опосредуется повышенной экспрессией Е- и Р-селектина на поверхности клеток. В противоположность их низкой базальной экспрессии экспрессия Е- и Р-селектина во время воспаления регулируется возрастающим образом, что приводит к значительному привлечению лейкоцитов в воспаленную ткань. Хотя для борьбы с инфекцией требуется опосредуемая селектином адгезия клеток, имеют место различные ситуации, в которых такая адгезия клеток является нежелательной или избыточной и приводит к серьезному повреждению ткани вместо заживления. В случае многих острых, а также хронических воспалительных расстройств [например, астмы, хронического обструктивного заболевания легких (COPD), псориаза и т.д.] показана связь между инфильтрацией активированных лейкоцитов в ткань одновременно с заметным повышением экспрессии в ткани соответствующих молекул адгезии, конкретно Е- и Р-селектина [Muller et al., J. Pathol., 2002, 198(2), 270-275; Di Stefano et al., Am. J. Respir. Crit. Care. Med., 1994, 149(3) 803-810; Terajima et al., Arch. Dermatol. Res., 1998, 290, 246-252].
Инфильтрация лейкоцитов может также играть роль в симптомах воспаления во время трансплантации и отторжения трансплантата. Кроме того, процесс свертывания крови дополнительно стимулируется связыванием лейкоцит-лейкоцит и лейкоцит-тромбоцит, которое имеет место, поскольку лейкоциты имеют как L-селектин, так и его соответствующий лиганд PSGL-1, и поэтому они могут взаимодействовать друг с другом через PSGL-1 и могут также связываться с тромбоцитами, которые содержат Р-селектин.
Следовательно, модуляция опосредуемой селектином адгезии клеток и других опосредуемых селектином функций, например активация лейкоцитов, предоставляет перспективную возможность препятствовать каскаду воспаления и останавливать его на очень ранней стадии. Являющиеся антагонистами селектина низкомолекулярные соединения должны модулировать все три селектина одновременно как антагонисты пан-селектина, чтобы преодолеть различия между этими селектинами [M. Sperandio et al., Vascular Disease Prevention, 2004, 1, 185-195].
Помимо sLex/sLea природный, имеющий высокую аффинность лиганд PSGL-1 является другой матричной структурой для разработки низкомолекулярных антагонистов селектинов. По сравнению с sLex/sLea PSGL-1 проявляет высокую аффинность для всех трех селектинов. Поэтому для поиска и выявления новых низкомолекулярных лекарственных средств, которые конкурируют с PSGL-1 и подобными PSGL-1 лигандами, перспективной стратегией является разработка нового класса эффективных антагонистов пан-селектина для лечения воспалительных расстройств. Антагонисты селектина можно разработать с применением селектинов, а также с применением лиганда, подобного PSGL-1, в качестве матричной структуры, поскольку предполагается, что они модулируют связывание между селектинами и PSGL-1 или другими лигандами с одинаковыми механизмами связывания.
Новые низкомолекулярные антагонисты селектинов должны удовлетворять определенным требованиям для того, чтобы быть подобными лекарственным средствам и иметь потенциальную пероральную биологическую доступность. Термин подобие лекарственному средству описан в литературе [Lipinski; Adv. Drug Dev. Rev., 1997, 23, 3-25]. Предполагается, что помимо других молекулярных свойств, пассивно транспортируемые молекулы имеют среднюю относительную молекулярную массу меньше чем 500, чтобы быть подобным лекарственному средству. Согласно этим правилам обычно соединения с относительной молекулярной массой меньше 500 или немного выше 500 считают низкомолекулярными соединениями. Маловероятно, что соединения с относительной молекулярной массой выше 500 являются перорально биологически доступными. Присутствие имеющих высокую полярность углеводных частей или пептидного компонента также не соответствует концепции подобия лекарственным средствам [H. Ulbrich et al., Trends Pharmacol. Sci, 2003, 24(12), 640-647; D. Slee et al., J. Med. Chem., 2001, 44, 2094-2107]. То же самое является причиной невозможности разработки лекарственных средств на основе антител, поскольку они являются полипептидами и поэтому пероральное введение их является проблематичным. Кроме того, требуемые соединения должны быть стабильными во время прохождения через желудочно-кишечный тракт, так чтобы они могли усваиваться/абсорбироваться позднее клетками тонкой кишки. Это не имеет место в случае большинства гликозидных молекул и пептидных структур.
Были проведены различные исследования для разработки имеющих низкую молекулярную массу соединений с модулирующим действием на опосредуемые селектинами процессы. Эти соединения включают дисалицилаты и С-гликозиды на основе дисалицилатов [WO 99/29706], бензиламиносульфоновые кислоты [WO 03/097658], дигликозилированные 1,2-диолы [WO 97/01569], замещенные 5-членные гетероциклы [WO 00/33836], маннопиранозилоксифенилбензойные кислоты [EP 0758243 В1], соединения на основе пиперазина (US 6432957В1], пептиды, являющиеся производными галловой кислоты [WO 2004/018502], производные галловой кислоты [C.C.M. Appeldoorn et al., Circulation 2005, 111, 106-112; EP 1481669A1] и хинной кислоты [N. Kaila et al., J. Med. Chem. 2005, 48, 4346-4357]. Однако ни одно из этих антагонизирующих селектины соединений до сих пор не прошло успешно клинические испытания [S.J. Romano, Treat. Respir Med 2005, 4(2), 85-94; M. P. Schön, Therapeutics and Clinical Risk Management, 2005, 1(3), 201-208]. Это является результатом того факта, что многие из этих структур были разработаны на основе матрицы sLex с низкой эффективностью. Возможно, что поэтому sLex-имитирующие структуры обнаруживают низкую эффективность. Другие соединения проявляют специфичность против разных членов семейства селектинов, но проявляя антагонизм только для выбранных селектинов, могут не проявлять антагонизм для других селектинов [M.P. Schön, Therapeutics and Clinical Risk Management, 2005, 1(3), 201-208]. Кроме того, большинство соединений, разработанных до настоящего времени, имеют высокие молекулярные массы и часто содержат углеводы и/или пептиды, что придает им склонность к деградации и модификации под действием пептидаз и/или гликозидаз. Содержащие углеводы структуры имеют дополнительные недостатки, такие как высокая степень хиральности, аномерности и низкая вероятность переноса через липидные бислои. Подобные недостатки известны для содержащих пептиды соединений. Некоторые другие соединения, разработанные для создания антагонизма для опосредуемых селектинами процессов, содержат структуры пирогаллола и катехина. Эти структуры имеют склонность к процессам окисления [Kumamoto M. et al., Biosci. Biotechnol. Biochem., 2001, 65(1), 126-132], что затрудняет фармацевтическую разработку этих соединений. Кроме того, известно, что соединения со структурами пирогаллола, такие как галловая кислота, являются цитотоксическими [E. Sergediene et al., FEBS Letters, 1999, 462, 392-396] и индуцируют апоптоз [K. Satoh et al., Anticancer Research, 1997, 17, 2487-2490; N. Sakaguchi et al., Biochemical Pharmacology, 1998, 55, 1973-1981]. Основным соединением в области антагонистов селектинов является бимосиамоза [S.J. Romano, Treat. Respir Med 2005, 4(2), 85-94]. В настоящее время бимосиамоза [D. Bock et al., New Drugs, 2003, D04, 28, p.28; EP 0840606 Bl] является наиболее продвинутым соединением в клинических исследованиях. Последние исследования подтверждают гипотезу, что бимосиамозу можно рассматривать как миметик PSGL-1 [E. Aydt, G. Wolff; Pathobiology; 2002-2003; 70; 297-301]. Это отличает бимосиамозу от других антагонистов селектинов. Однако она является высокомолекулярным соединением с углеводной структурой. По-видимому, у антагониста пан-селектина бимосиамозы отсутствует пероральная биологическая доступность. Некоторые наблюдения указывают на то, что бимосиамоза проявляет хорошую аффинность для Р-селектина и умеренную аффинность для Е- и L-селектина.
Имеется острая лекарственная потребность в новых, очень сильнодействующих пан-селектиновых антагонистах, которые модулируют опосредуемую селектином функцию, например селектинзависимую адгезию клеток, и в разработке способов, применяющих такие соединения для модуляции состояний, связанных с взаимодействием селектин-лиганд. Большинство из доступных противовоспалительных фармацевтических средств, которые являются доступными на рынке, включают главным образом кортикостероиды или NSAID (нестероидные противовоспалительные лекарственные средства), имеющие несколько серьезных отрицательных/побочных действий и имеющие в качестве мишени различные стадии воспалительного каскада. В отличие от этого модуляция функции селектина является терапевтической концепцией, вмешивающейся в воспалительный каскад на очень ранней стадии. Почти все перспективные антагонисты селектинов до сих пор не стали продаваемыми лекарственными средствами, главным образом вследствие низкой эффективности и/или высокой молекулярной массы, которая вызывает проблемы в системе абсорбция-распределение-метаболизм-экскреция (ADME) и тем самым в пероральной биологической доступности, требуемой для лечения большинства воспалительных нарушений, подобных ревматоидному артриту, септическому шоку, атеросклерозу, повреждениям при реперфузии и многим другим.
Задачей изобретения является предоставление новых низкомолекулярных соединений, особенно негликозилированных/негликозидных и непептидных соединений, которые способны эффективно создавать антагонизм опосредуемым селектинами процессам и которые имеют меньше отрицательных побочных действий во время их применения, чем соединения известного уровня техники.
В отличие от большинства sLeX-имитирующих соединений, разработанных в данной области, соединения данного изобретения не восприимчивы к действию гликозидаз или пептидаз. Большинство из антагонистов селектина, разработанных до сих пор, структурно и биологически основаны на свойствах sLex или sLea. Поэтому эти полученные соединения проявляли низкую биологическую активность, подобную их матричным структурам. Данное изобретение, однако, предоставляет новые, сильнодействующие, низкомолекулярные и подобные лекарственным средствам пан-селектиновые антагонисты, которые изобретены на основе биологических анализов in vitro, имитирующих PSGL-1 и подобные PSGL-1 лиганды или любые лиганды, имеющие sLex или sLea и тирозинсульфатные мотивы [N.V. Bovin; Biochem Soc Symp.; 2002; (69): 143-60. N.V. Bovin; Glycoconj. J; 1998; 15(5); 431-46. T.V. Pochechueva et al.; Bioorg Med Chem Lett; 2003; 13(10); 1709-12. G. Weitz-Schmidt et al.; Anal. Biochem.; 1996; 238; 184-190].
Настоящее изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно соединение, имеющее общую структуру формулы (Ia), или (Ib), или (IIa), или (IIb), и фармацевтически приемлемый носитель, который является пригодным в терапии.
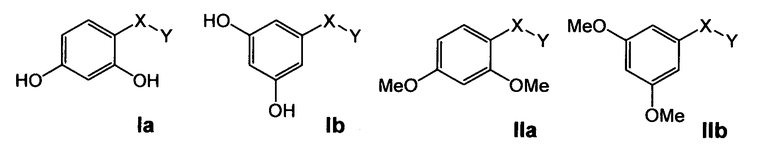
где символы и заместители имеют нижеследующие значения:
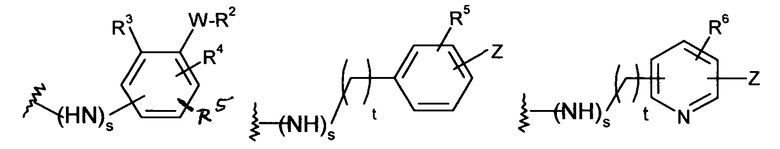
-Х- представляет собой
(а)
где m равно 0, 1; n равно целому числу от 1 до 3;
(b)
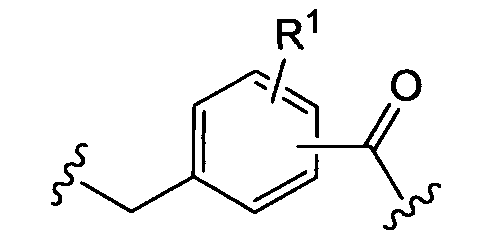
где «кольцо» представляет собой
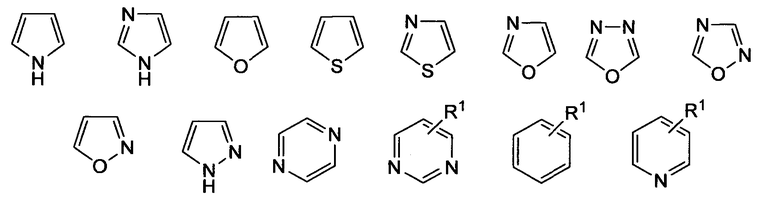
где R1 представляет собой Н, NO2, CF3, F, Cl, Br, I, CN, CH3, NH2, NHалкил, NHарил, NНацил и k равно 0, 1;
(с)
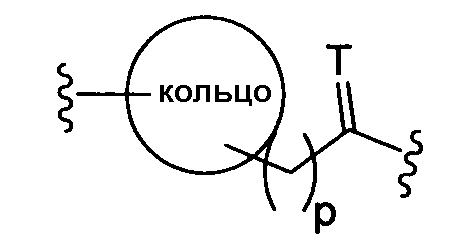
где Т представляет собой О, S или [H,H]; р равно 0, 1, 2;
(d)
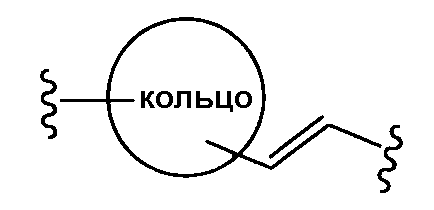
где двойная связь имеет Е- или Z-конфигурацию;
(е)
(f)
где -Е- представляет собой -(СН2-)qNH- и q равно 0, 1, 2, 3;
-Y представляет собой
(а)
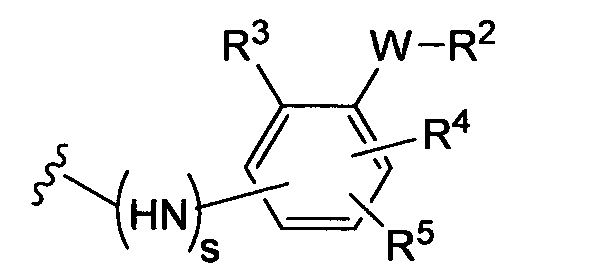
где s равно 0 или 1,
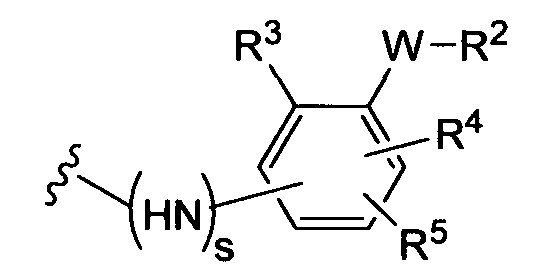
R2 представляет собой CO2H, CO2алкил, CO2арил, CO2NH2, CO2аралкил, SO3H, SO2NH2, PO(OH)2, 1-H-тетразолил-, CHO, COCH3, CH2OH, NH2, NHалкил, N(алкил)алкил', OCH3, CH2OCH3, SH, F, Cl, Br, I, CH3, CH2CH3, CN, CF3;
R3 независимо от R2 представляет собой H, CH3, CH2CH3, CF3, F, Cl, Br, I, CN, NO2 и
R4 независимо от R2 и R3 представляет собой H, CH3, CH2CH3, CF3, F, Cl, Br, I, CN, NO2, R2,
R5 представляет собой H, NO2, CF3, F, Cl, Br, I, CN, CH3, OCH3, SH, NH2
и -W- представляет собой -(CH2-)V, цис-СН=СН- или транс-СН=СН-, где v равно 0, 1, 2;
в случае, когда -W- представляет собой цис-CH=CH- или транс-CH=CH-, R2 не может быть NH2 или SH;
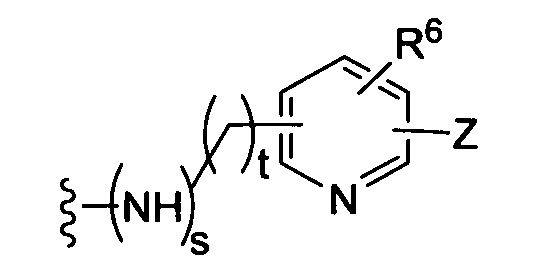
(b)
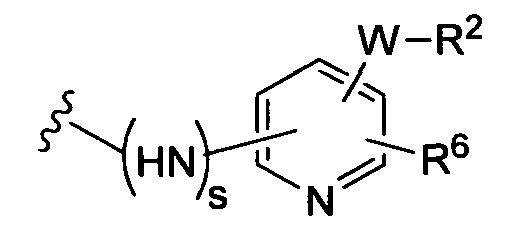
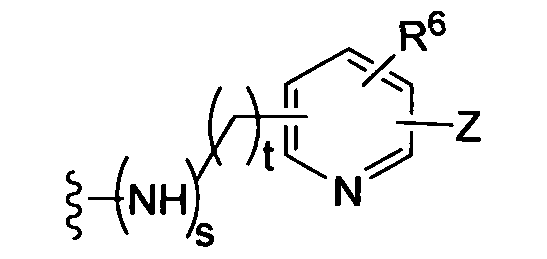
где R6 независимо от R2 представляет собой Н, F, Cl, Me, трет-Bu, CN, NH2;
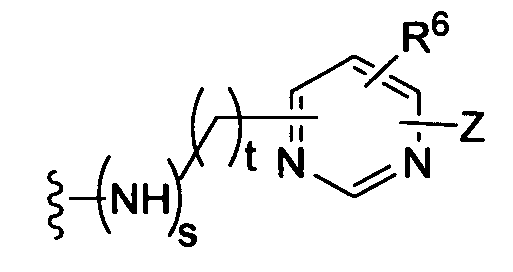
(c)
(d)
(е)
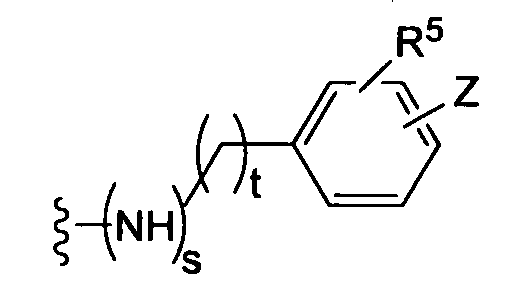
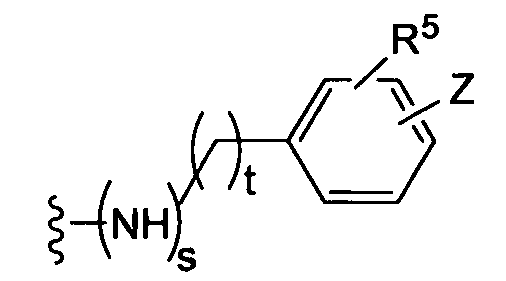
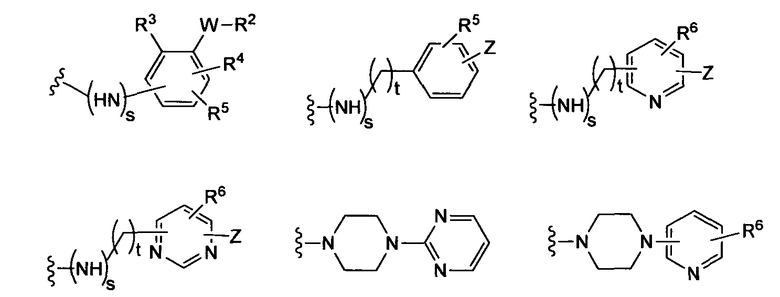
где t равно 0, 1, 2;
(f)
(g)
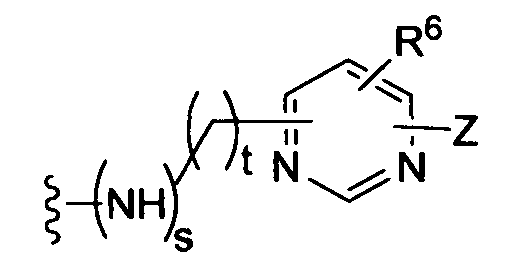
-Z представляет собой
(i)
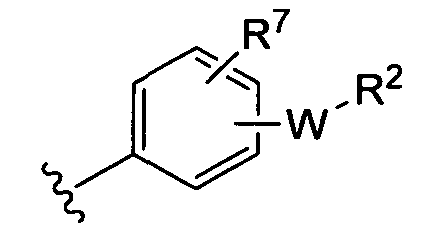
R7 независимо от R2 представляет собой H, NO2, CF3, F, Cl, Br, I, CN, CH3, OCH3, SH, NH2,
(ii)
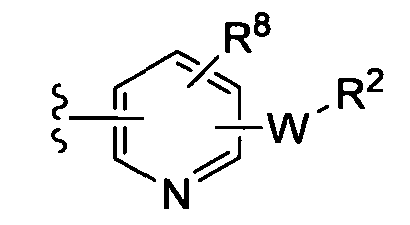
R8 независимо от R2 представляет собой H, F, Cl, Me, трет-Bu, CN, NH2,
(iii)
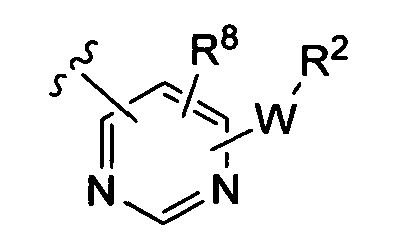
(iv)
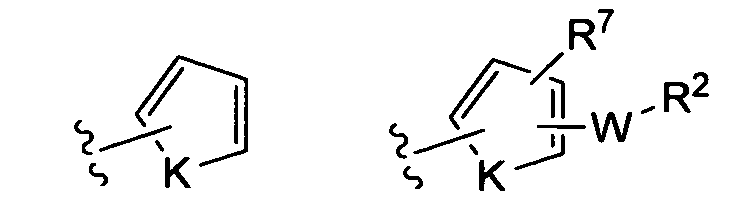
где K представляет собой NH, NMe, O, S,
(v)
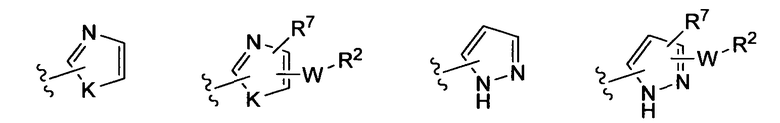
(vi)
(vii)
-W-R2,
или фармацевтически приемлемые соли, сложные эфиры или амиды и пролекарства вышеуказанных соединений формулы (Ia), или (Ib), или (IIa), или (IIb).
В следующем варианте осуществления изобретение относится к фармацевтическим композициям, включающим, по меньшей мере, одно соединение формулы (Ia), или (Ib), или (IIa), или (IIb) и фармацевтически приемлемый носитель, который является пригодным в терапии,
где символы и заместители имеют нижеследующие значения:
-Х- представляет собой
(а)
где m равно 0, 1; n равно целому числу от 1 до 3;
(b)
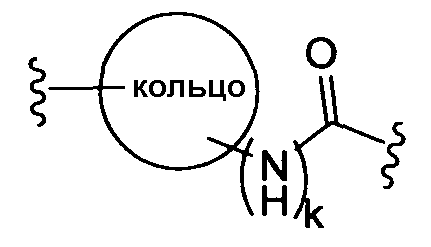
где «кольцо» представляет собой
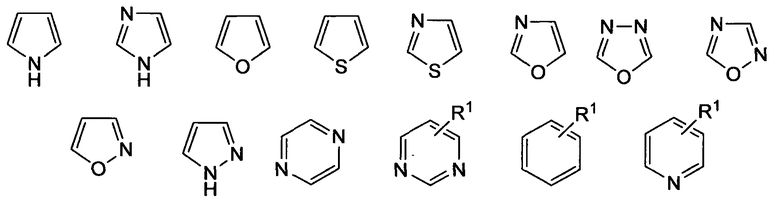
где R1 представляет собой Н, NO2, CF3, F, Cl, Br, I, CN, CH3, NH2, NHалкил, NHарил, NНацил и k равно 0, 1;
(с)
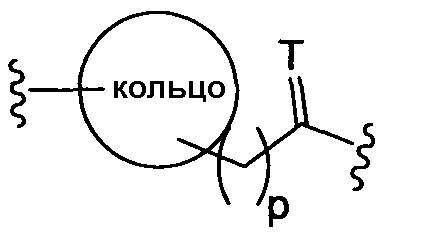
где Т представляет собой О, S или [H,H]; р равно 0, 1, 2;
(d)
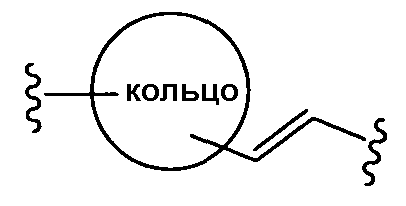
где двойная связь имеет либо Е-, либо Z-конфигурацию;
-Y представляет собой
(а)
где s равно 0 или 1,
R2 представляет собой CO2H, CO2алкил, CO2арил, CO2NH2, CO2аралкил, SO3H, SO2NH2, PO(OH)2, 1-H-тетразолил-, CHO, COCH3, CH2OH, NH2, NHалкил, N(алкил)алкил', OCH3, CH2OCH3, SH, F, Cl, Br, I, CH3, CH2CH3, CN, CF3,
R3 независимо от R2 представляет собой H, CH3, CH2CH3, CF3, F, Cl, Br, I, CN, NO2 и
R4 независимо от R2 и R3 представляет собой H, CH3, CH2CH3, CF3, F, Cl, Br, I, CN, NO2, R2,
R5 представляет собой H, NO2, CF3, F, Cl, Br, I, CN, CH3, OCH3, SH, NH2
и -W- представляет собой -(CH2-)V, цис-СН=СН- или транс-СН=СН- и v равно 0, 1, 2,
в случае, когда -W- представляет собой цис-CH=CH- или транс-CH=CH-, R2 не может быть NH2 или SH;
(е)
где t равно 0, 1, 2;
(f)
(g)
-Z представляет собой
(i)
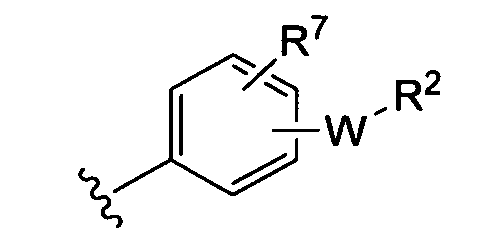
где R7 независимо от R2 представляет собой H, NO2, CF3, F, Cl, Br, I, CN, CH3, OCH3, SH, NH2;
(iv)

где K представляет собой NH, NMe, O, S;
(v)
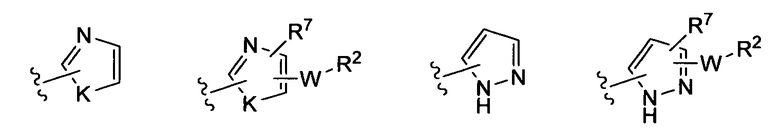
или фармацевтически приемлемые соли, сложные эфиры или амиды и пролекарства вышеуказанных соединений формул (Ia), или (Ib), или (IIa), или (IIb).
Предпочтительные фармацевтические композиции включают соединения формулы (IIIa), или (IIIb), или (IVa), или (IVb)
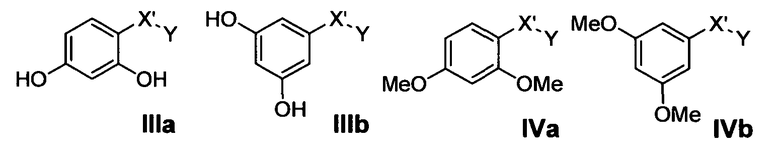
где -Y имеет значения, указанные выше, и где -Х'- представляет собой Х(а), Х(b), Х(c) и Х(d), которые имеют значения, указанные выше. Предпочтительно -Х'- представляет собой Х(а), Х(b) и Х(с).
Следующие предпочтительные фармацевтические композиции включают соединения формулы (А1), (А2), (В1), (В2), (С1), (С2), (D1) или (D2)
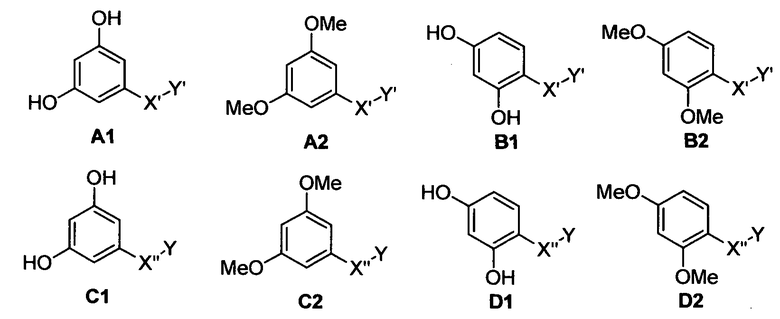
где -Х'- и -Y имеют значения, указанные выше, и где -X”- представляет собой
и где -Y' представляет собой
где все индексы, символы и заместители имеют значения, указанные выше.
Изобретение относится также к фармацевтическим композициям, где соединения имеют формулу (А1), или (А2), или (В1), или (В2), или (С1), или (С2), или (D1), или (D2)
где -Х'- и -Y имеют значения, указанные выше, и где -X”- представляет собой
и где -Y' представляет собой
где все индексы, символы и заместители имеют значения, указанные выше.
Особенно предпочтительные фармацевтические композиции включают соединения формулы (Е1), (Е2), (F1) или (F2)
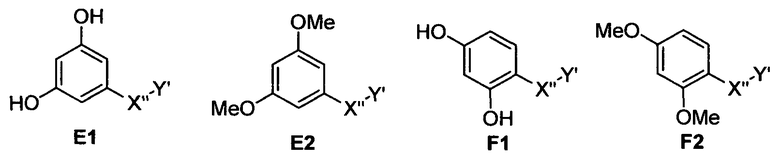
где -X”- и -Y' имеют значения, указанные выше.
Самые предпочтительные фармацевтические композиции включают соединения формулы (G1), (G2), (H1) или (H2)
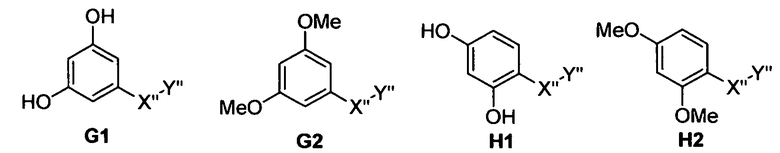
где -Х”- имеет значения, указанные выше, и -Y” представляет собой

где R9 представляет собой CO2H, CO2алкил, CO2арил, CO2NH2, CO2аралкил, CH2SO3H, CH2SO2NH2, CH2PO(OH)2, 1-H-тетразолил, CHO, COCH3, CH2OH, CH2NH2, СН2NHалкил, CH2N(алкил)алкил', CH2OCH3, CH2SH.
Следующим аспектом изобретения являются фармацевтические композиции, где соединения имеют формулу (G1), или (G2), или (Н1), или (Н2)
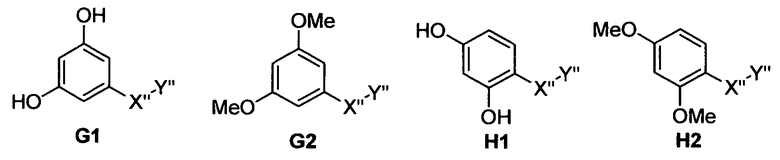
где -Х”- имеет значения, указанные выше, и -Y” представляет собой
где R9 представляет собой CO2H, CO2алкил, CO2арил, CO2NH2, CO2аралкил, CH2SO3H, CH2SO2NH2, CH2PO(OH)2, 1-H-тетразолил, CHO, COCH3, CH2OH, CH2NH2, СН2NHалкил, CH2N(алкил)алкил', CH2OCH3, CH2SH,
где все индексы, символы и заместители имеют значения, указанные выше.
Эти химические соединения (Е1), (Е2), (F1), (F2), (G1), (G2), (H1) и (Н2) также сами являются новыми соединениями.
Все соединения, описываемые выше, обладают способностью модулировать адгезию клеток и модулируют связывание, опосредуемое селектином, а также PSFL-1-подобным лигандом. Соединения обладают способностью модулировать взаимодействие селектинов с sLex/sLea, а также взаимодействие между селектинами и тирозинсульфатными остатками. Поэтому они являются полезными для лечения острых и хронических воспалительных расстройств, а также других патологических состояний, в которых играют роль опосредуемые селектином процессы.
Термин «фармацевтический» включает также диагностические применения.
Термин «фармацевтический» включает также профилактические применения для предупреждения патологических состояний, в которых играют роль опосредуемые селектином процессы.
Термин «фармацевтический» включает также применения, в которых соединения настоящего изобретения можно применять в качестве наполнителей для доставки лекарственного средства в орган-мишень для диагностических или терапевтических целей.
В следующем предпочтительном варианте изобретение относится к фармацевтическим композициям, включающим, по меньшей мере, одно соединение формулы (А1), (А2), (В1), (В2), (С1), (С2), (D1), (D2), (E1), (E2), (F1), (F2), (G1), (G2), (H1) или (Н2).
Изобретение предлагает фармацевтические композиции, включающие соединения формулы (Ia), или (Ib), или (IIa), или (IIb) и в предпочтительном варианте формулы (IIIa), или (IIIb), или (IVa), или (IVb).
В следующем предпочтительном варианте изобретение предлагает фармацевтические композиции, включающие, по меньшей мере, одно соединение формулы (А1), (А2), (В1), (В2), (С1), (С2), (D1) или (D2).
В особенно предпочтительном варианте изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно соединение формулы (E1), (E2), (F1) или (F2).
В самом особенно предпочтительном варианте изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно соединение формулы (G1), (G2), (H1) или (Н2).
Настоящее изобретение далее предоставляет способ модуляции связывания Р-селектина, L-селектина или Е-селектина с sLex или sLea и тирозинсульфатными остатками, включающий стадию введения пациенту эффективного количества, по меньшей мере, одного соединения, имеющего структуру формулы (Ia), или (Ib), или (IIa), или (IIb), для модуляции связывания Р-, Е- или L-селектина с sLex или sLea и тирозинсульфатом. Обнаружено, что соединения, имеющие формулу (Ia), или (Ib), или (IIa), или (IIb), показанную выше, действуют как модуляторы связывания Е-, Р- или L-селектина.
Применяемые здесь термины «алкил» будут означать одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода, включающую, но не ограничивающуюся перечисленным, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и тому подобное. «Алкилы» не зависят друг от друга и могут быть разными или идентичными.
Термин «арил» будет означать карбоциклические и гетероциклические ароматические группы, включающие, но не ограничивающиеся перечисленным, фенил, 1-нафтил, 2-нафтил, флуоренил, (1,2)-дигидронафтил, инденил, инданил, тиенил, бензотиенил, тиенопиридил и тому подобное.
Термин «аралкил» (называемый также арилалкил) будет означать арильную группу, присоединенную к алкильной группе, и включает, но не ограничивается перечисленным, бензил, 1-нафтилметил, 2-нафтилметил, фторбензил, хлорбензил, бромбензил, иодбензил, алкоксибензил (где «алкокси» означает метокси, этокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси и тому подобное), гидроксибензил, аминобензил, нитробензил, гуанидинобензил, флуоренилметил, фенилметил(бензил), 1-фенилэтил, 2-фенилэтил, 1-нафтилэтил и тому подобное.
Термин «ацил» будет означать -(СНО), или -(С=О)-алкил, или -(С=О)-арил, или -(С=О)-аралкил и включает, но не ограничивается перечисленным, формил, ацетил, н-пропионил, изопропионил, н-бутирил, изобутирил, пивалоил, бензоил, 4-нитробензоил и тому подобное.
Применяемый здесь термин «фармацевтически приемлемые соли, сложные эфиры, амиды и пролекарства» относится к таким карбоксилатным солям, аддитивным солям аминокислот, сложным эфирам, амидам и пролекарствам соединений настоящего изобретения, которые в пределах объема исследовательской лекарственной оценки являются подходящими для применения в контакте с тканями пациентов без чрезмерной токсичности, раздражения, аллергической реакции и тому подобное, имеют приемлемое отношение польза/риск и являются эффективными для их предназначенного применения, а также, когда возможно, цвиттерионным формам соединений настоящего изобретения. Термин «соли» относится к относительно нетоксичным аддитивным солям соединений настоящего изобретения и неорганических и органических кислот. Эти соли можно получить in situ во время последнего выделения и очистки соединений или отдельно реакцией очищенных соединений в их свободной форме с подходящей неорганической или органической кислотой или основанием и выделением, таким образом, образованных солей. Репрезентативные соли соединений настоящего изобретения включают гидробромидные, гидрохлоридные, сульфатные, бисульфатные, нитратные, ацетатные, оксалатные, валератные, пальмитатные, стеаратные, лауратные, боратные, бензоатные, лактатные, фосфатные, тозилатные, цитратные, малеатные, фумаратные, сукцинатные, тартратные, нафтилатные, мезилатные, глюкогептонатные, лактиобионатные, лаурилсульфонатные соли и тому подобное. Они могут включать катионы на основе щелочных и щелочноземельных металлов, таких как натрий, литий, калий, кальций, магний и тому подобное, а также нетоксичные катионы аммония, четвертичного аммония и аминов, включающие, но не ограничивающиеся перечисленным, катионы аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, триметиламина, триэтиламина, этиламина и тому подобное.
Примеры фармацевтически приемлемых, нетоксичных сложных эфиров соединений данного изобретения включают С1-, С2-, С3-, С4-, С5- и С6-алкиловые сложные эфиры, где алкильная группа имеет неразветвленную или разветвленную цепь. Приемлемые сложные эфиры включают также С5-, С6- и С7-циклоалкиловые эфиры, а также арилалкиловые эфиры, такие как, но без ограничения указанным, бензиловый эфир. С1-, С2-, С3-, С4-, С5- и С6-алкиловые сложные эфиры являются предпочтительными. Сложные эфиры соединений настоящего изобретения можно получить согласно общепринятым методам.
Примеры фармацевтически приемлемых, нетоксичных амидов соединений данного изобретения включают амиды, полученные из аммиака, первичных С1-, С2-, С3-, С4-, С5- и С6-алкиламинов и вторичных С1-, С2-, С3-, С4-, С5- и С6-диалкиламинов, где алкильные группы имеют неразветвленные или разветвленные цепи. В случае вторичных аминов амин может быть также в форме 5- или 6-членного гетероцикла, содержащего один атом азота. Предпочтительными являются амиды, полученные из аммиака, первичных С1-, С2- и С3-алкиламидов и вторичных С1-С2-диалкиламидов. Амиды соединений настоящего изобретения можно получить согласно общепринятым методам.
Термин «пролекарство» относится к одному или нескольким соединениям, которые быстро превращаются in vitro и превращаются из неактивного в активное состояние in vivo с образованием «исходного» соединения указанной выше формулы (Ia), или (Ib), или (IIa), или (IIb), например, гидролизом в крови или метаболизмом in vivo.
Предполагается также, что фармацевтически активные композиции могут содержать соединение настоящего изобретения или другие соединения, которые модулируют связывание Е-селектина, или Р-селектина, или L-селектина или конкурируют с таким связыванием.
Фармацевтически активные композиции настоящего изобретения включают фармацевтически приемлемый носитель и соединение формулы (Ia), или (Ib), или (IIa), или (IIb), в результате чего фармацевтически приемлемым носителем может быть также лекарственно подходящая наночастица, дендример, липосома, микропузырек или полиэтиленгликоль (ПЭГ). Фармацевтические композиции настоящего изобретения могут включать одно или несколько соединений, имеющих указанную выше структуру (Ia), или (Ib), или (IIa), или (IIb), в сочетании с одним или несколькими физиологически приемлемыми носителями, адъювантами или наполнителями, которые в целом называют здесь носителями, для парентеральной инъекции, для перорального введения в твердой или жидкой форме, для ректального или местного введения и тому подобное.
Композиции можно вводить людям и животным либо перорально, ректально, парентерально (внутривенно, внутримышечно, внутрикожно или подкожно), внутриполостным путем, интравагинально, внутрибрюшинно, местно (порошки, мази или капли) либо трансбуккально или ингаляцией (распылением или назальным спреем).
Композиции, подходящие для парентеральной инъекции, могут включать физиологически приемлемые стерильные водные или неводные растворы, стабилизаторы, антиоксиданты, консерванты (например, аскорбиновую кислоту, сульфит натрия, гидросульфит натрия, бензиловый спирт, EDTA), дисперсии, суспензии или эмульсии и стерильные порошки для пересоздания в стерильный инъецируемый раствор или дисперсию. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиол (пропиленгликоль, полиэтиленгликоль, глицерин и тому подобное), их подходящие смеси, растительные масла (такие как оливковое масло или масло канолы) и инъецируемые органические сложные эфиры, такие как этилолеат. Подходящую текучесть можно поддерживать, например, применением покрытия, такого как лецитин, поддерживанием требуемого размера частиц в случае дисперсий и применением поверхностно-активных веществ.
Эти композиции могут содержать также адъюванты, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие агенты. Предотвращение действий микроорганизмов можно гарантировать различными антибактериальными и антигрибковыми агентами, например парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и тому подобное. Может быть также желательно включение изотонических агентов, например сахаров, хлорида натрия и тому подобное. Пролонгированную абсорбцию инъецируемой фармацевтической формы можно достичь применением агентов, задерживающих абсорбцию, например моностеарата алюминия и желатина.
При желании и для более эффективного распределения соединения можно включать в системы для замедленного или регулируемого по времени высвобождения или для доставки к органу-мишени, такие как полимерные матрицы, липосомы и микросферы. Их можно стерилизовать, например, фильтрованием через задерживающий бактерии фильтр или введением стерилизующих агентов в форме стерильной воды или некоторых других стерильных инъецируемых сред непосредственно перед применением.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение или пролекарство смешивают, по меньшей мере, с одним инертным обычным эксципиентом (или носителем), таким как цитрат натрия или дикальцийфосфат, или (i) наполнителями или разбавителями, такими как, например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (ii) связывающими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, (iii) увлажнителями, такими как, например, глицерин, (iv) дезинтегрирующими агентами, такими как, например, агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые комплексные силикаты и карбонат натрия, (v) замедлители растворения, такие как, например, парафин, (vi) ускорители абсорбции, такие как, например, соединения четвертичного аммония, (vii) смачивающие агенты, такие как, например, цетиловый спирт и моностеарат глицерина, (viii) адсорбенты, такие как, например, каолин и бентонит, и (ix) смазывающие вещества, такие как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственные формы могут включать также буферные агенты.
Твердые композиции подобного типа можно также применять в качестве наполнителей в мягких и твердых наполняемых желатиновых капсулах с применением эксципиентов, таких как лактоза или молочные сахара, а также полиэтиленгликоли с высокой молекулярной массой и тому подобное. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, можно получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие, хорошо известные в данной области. Они могут содержать агенты, придающие композиции непрозрачность, и могут быть также такими композициями, которые высвобождают активное соединение или соединения в определенной части кишечного тракта замедленным образом. Примерами «внедряющихся» композиций, которые можно применять, являются полимерные вещества и воски. Активные соединения могут быть также, если это приемлемо, в микрокапсулированной форме с одним или несколькими указанными выше эксципиентами.
Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области, такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, в частности, хлопковое масло, арахисовое масло, кукурузное масло, оливковое масло, масло канолы, касторовое масло и кунжутное масло, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и эфиры жирных кислот сорбитана или смеси этих веществ и тому подобное. Помимо таких инертных разбавителей, композиции могут включать также адъюванты, такие как увлажняющие агенты, эмульгирующие и суспендирующие агенты, подслащивающие агенты, корригенты и отдушки.
Суспензии, помимо активных соединений, могут содержать суспендирующие агенты, например этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар, трагакант или смеси этих веществ и тому подобное.
Композициями для ректального введения предпочтительно являются суппозитории, которые можно получить смешиванием соединений настоящего изобретения с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при обычной температуре, но жидкими при температуре тела и поэтому плавятся в ректальной или вагинальной полости и высвобождают активный компонент. Лекарственные формы для местного введения соединения данного изобретения включают мази, порошок, спреи и формы для ингаляции.
Активный компонент смешивают в стерильных условиях с физиологически приемлемым носителем и любыми необходимыми консервантами, буферами или пропеллентами, если они могут быть необходимы. Офтальмические препараты, глазные мази, суспензии, порошок и растворы также рассматриваются как включенные в объем данного изобретения.
Соединения настоящего изобретения можно также включать в липосомы или связать с ними или вводить в форме липосом. Как известно в данной области, липосомы обычно получают из фосфолипидов или других липидных веществ. Липосомы образуются моно- или многослойными гидратированными жидкими кристаллами, которые диспергируют в водной среде. Можно применять любой нетоксичный, физиологически приемлемый метаболизированный липид, способный образовывать липосомы. Настоящие композиции в форме липосом могут содержать, помимо связывающих селектин антагонистов настоящего изобретения, стабилизаторы, консерванты, эксципиенты и тому подобное. Предпочтительными липидами являются фосфолипиды и фосфатидилхолины (лецитины), как природные, так и синтетические. Методы образования липосом хорошо известны в данной области техники.
Непарентеральные лекарственные формы могут содержать также повышающий биологическую доступность агент (например, модуляторы ферментов, антиоксиданты), подходящий для защиты соединений от разрушения. Действительные уровни доз активного ингредиента в композиции настоящего изобретения можно варьировать так, чтобы получить количество активного ингредиента, которое является эффективным для достижения требуемой терапевтической реакции для конкретной композиции и способа введения. Следовательно, выбранный уровень дозы зависит от требуемого терапевтического действия, от пути введения, от требуемой продолжительности лечения и других факторов. Общая суточная доза соединений данного изобретения, введенная хозяину в виде одной или разделенных доз, может быть в диапазоне до 50 мг на кг массы тела. Композиции в виде стандартных лекарственных форм могут содержать такие их субмногократные количества, которые можно применять для получения суточной дозы. Должно быть понятно, однако, что определенный уровень дозы для любого конкретного пациента, независимо от того, является ли он человеком или другим животным, будет зависеть от целого ряда факторов, включающих массу тела, общее состояние здоровья, пол, режим питания, время и путь введения, скорости абсорбции и экскреции, комбинацию с другими лекарственными средствами и тяжесть конкретного, подвергаемого лечению заболевания.
В частности, соединения настоящего изобретения можно применять для лечения целого ряда заболеваний, относящихся к воспалению и межклеточному распознаванию и адгезии. Например, соединения настоящего изобретения можно вводить пациенту для лечения хронического обструктивного заболевания легких (COPD), острого повреждения легких (ALI), при экстракорпоральном кровообращении, лечения острого респираторного дистресс-синдрома (ARDS), болезни Крона, септического шока, сепсиса, хронических воспалительных заболеваний, таких как псориаз, атопический дерматит и ревматоидный артрит, и реперфузионного повреждения, которое имеет место после сердечных приступов, мозговых кровоизлияний, атеросклероза и трансплантации органов, травматического шока, недостаточности деятельности многих органов, аутоиммунных заболеваний, подобных рассеянному склерозу, при подкожной внутрипросветной ангиопластике, лечения астмы и воспалительного заболевания кишечника. В каждом случае эффективное количество соединений настоящего изобретения вводят либо как таковое, либо как часть фармацевтически активной композиции, пациенту, нуждающемуся в таком лечении. Понятно также, что пациенту, нуждающемуся в таком введении, можно вводить комбинацию соединений. Соединения настоящего изобретения можно также вводить для лечения других заболеваний, которые связаны с межклеточной адгезией. Поскольку настоящие соединения модулируют связывание Е-селектина, или Р-селектина, или L-селектина, любое заболевание, которое связано с этим взаимодействием, можно потенциально лечить модуляцией такого связывающего взаимодействия.
Помимо обнаружения на некоторых лейкоцитах, sLea обнаружен на различных раковых клетках, в том числе раковых клетках легких и толстой кишки. Было высказано предположение, что адгезия клеток, включающая участие sLea, может принимать участие в метастазах некоторых раковых заболеваний, и антагонисты связывания sLea могут быть полезными при лечении некоторых форм рака.
Применение активных ингредиентов согласно изобретению в косметических или местных дерматологических композициях с эффективным содержанием активного ингредиента согласно изобретению неожиданно предоставляет возможность эффективного лечения, а также профилактики старения кожи, вызванного внешними и внутренними факторами.
Изобретение, в частности, относится к применению соединения формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерной формы для получения косметической или дерматологической композиции.
Применяемое количество активного соединения или его стереоизомерной формы соответствует количеству, требуемому для получения желаемого результата при применении косметических или дерматологических композиций. Специалист в данной области способен определить это эффективное количество, которое зависит от применяемого производного, индивидуума, на которого его наносят, и времени его применения. Для обеспечения порядка величины в косметических или дерматологических композициях согласно изобретению соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму можно вводить в количестве, составляющем от 0,001 до 40% мас., предпочтительно 0,005 - 30% мас. и более предпочтительно от 0,01 до 20% мас.
Следующий аспект включает косметические композиции, включающие соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму и, по меньшей мере, один косметически переносимый компонент, например косметически переносимый компонент для нанесений на кожу.
Количества различных компонентов физиологической среды косметической композиции согласно изобретению являются количествами, обычно применяемыми в рассматриваемых областях. Когда косметической композицией является эмульсия, содержание масляной фазы может составлять от 2 до 80% мас. и предпочтительно от 5 до 50% мас. относительно общей массы косметической композиции.
Таким образом, косметическая композиция должна содержать нетоксичную физиологически приемлемую среду, которую можно наносить на кожу человека. Для местного нанесения на кожу косметическая композиция может быть в форме раствора, суспензии, эмульсии или дисперсии с более или менее текучей консистенцией и особенно жидкой или полужидкой консистенцией, полученной диспергированием масляной фазы в водной фазе (масло/вода) или наоборот (вода/масло), или же в форме геля. Можно также применять косметическую композицию в форме мусса или в форме спрея или аэрозоля, в таком случае включающая находящийся под давлением пропеллент. Композиции могут быть также в форме лосьона для ухода за волосами, шампуня или кондиционера для волос, жидкого или твердого мыла, косметической маски или пенообразующего крема или геля для мытья волос. Они могут быть также в форме краски для волос или краски для бровей и ресниц.
Косметические композиции изобретения могут также включать один или несколько других ингредиентов, обычно применяемых в рассматриваемых областях и выбранных из добавок к препаратам, например загустители водной фазы, или масляной фазы, или гелеобразующие агенты, красители, которые растворимы в среде косметической композиции, твердые частицы, такие как минеральные или органические наполнители или пигменты в форме микрочастиц или наночастиц, консерванты, душистые вещества, гидротопы или электролиты, нейтрализующие средства (подкисляющие или подщелачивающие агенты), пропелленты, анионогенные, катионогенные или амфотерные поверхностно-активные вещества, полимеры, в частности водорастворимые или вододиспергируемые анионогенные, неионогенные, катионогенные или амфотерные пленкообразующие полимеры, минеральные или органические соли, хелатирующие агенты; их смеси.
Косметические композиции можно применять для ингибирования микровоспалительного цикла. Поэтому настоящее изобретение относится также к косметическим композициям, включающим соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму, которые применяют для косметического лечения или косметической профилактики микровоспалительных состояний.
Косметические композиции, включающие соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму, которые применяют для косметического лечения или косметической профилактики старения кожи, вызванной внутренними факторами, также являются предметом настоящего изобретения. Внутренними факторами, ответственными за старение кожи, являются генетически программированные детерминанты, включающие возраст, гормональное состояние и физиологические факторы.
Помимо косметически неактивных ингредиентов, косметические композиции настоящего изобретения могут включать также один или несколько косметически активных ингредиентов с благотворным действием на кожу. Поэтому настоящее изобретение относится к косметическим композициям, включающим соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму и, по меньшей мере, один дополнительный косметически активный ингредиент, например УФ-защитное средство или белки.
Дерматологические композиции, включающие соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму и, по меньшей мере, один дерматологически переносимый компонент, например дерматологически переносимый компонент для применения на коже, также являются предметом изобретения.
Дерматологически переносимые компоненты, которые можно применять для дерматологических композиций, описанных здесь, являются идентичными косметически переносимым компонентам, указываемым в данном изобретении.
Следующим вариантом осуществления данного изобретения являются дерматологические композиции, включающие соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму, которые применяют для дерматологического лечения, дерматологического диагноза или дерматологической профилактики микровоспалительных состояний.
В частности, изобретение включает дерматологические композиции, включающие соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму, которые применяют для дерматологического лечения, дерматологического диагноза или дерматологической профилактики зуда и старения кожи, вызванного внешними факторами. Внешние факторы включают в общем факторы окружающей среды; более конкретно вызывающее старение кожи воздействие ультрафиолетовых лучей вследствие солнечного облучения, действия света или любого другого излучения, атмосферное загрязнение, раны, инфекции, травматизм, гипоксия, дым сигарет, гормональное состояние как реакция на внутренние факторы, нейропептиды, электромагнитные поля, гравитация, образ жизни (например, избыточное потребление алкоголя), периодически повторяющиеся лицевые выражения, положения тела во время сна и физиологические стресс-факторы.
Помимо дерматологически неактивных ингредиентов, дерматологические композиции могут включать также дерматологически или фармацевтически активные ингредиенты. Поэтому настоящее изобретение относится также к дерматологическим композициям, включающим соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму и, по меньшей мере, один дополнительный дерматологически или фармацевтически активный ингредиент. Дерматологически или фармацевтически активные ингредиенты, которые можно применять для дерматологических композиций, описанных здесь, определяют как косметически активные ингредиенты, указанные выше. Дерматологически или фармацевтически активные ингредиенты могут быть идентичными косметически активным ингредиентам, указываемым в данном изобретении.
Другим объектом настоящего изобретения являются дерматологические композиции, включающие соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму и, по меньшей мере, один дополнительный дерматологически или фармацевтически активный ингредиент, характеризующийся тем, что его применяют для дерматологического лечения, дерматологического диагноза или дерматологической профилактики микровоспалительных состояний.
В частности, настоящее изобретение относится к дерматологическим композициям, включающим соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму и, по меньшей мере, один дополнительный дерматологически или фармацевтически активный ингредиент, характеризующийся тем, что его применяют для дерматологического лечения, дерматологического диагноза или дерматологической профилактики зуда и старения кожи, вызванных внешними факторами.
Старение кожи может быть вызвано комбинацией внутренних и внешних факторов. Поэтому настоящее изобретение относится также к дерматологическим композициям, включающим соединение формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерную форму и, по меньшей мере, один дополнительный фармацевтически или косметически активный ингредиент, характеризующийся тем, что его применяют для косметического и дерматологического лечения и косметической и дерматологической профилактики старения кожи, вызванного комбинацией внутренних и внешних факторов.
Другим вариантом осуществления данного изобретения является способ получения косметической композиции смешиванием соединения формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерной формы, по меньшей мере, одного косметически переносимого компонента и, в конце концов, дополнительных косметически активных ингредиентов.
В частности, объектом данного изобретения является способ получения косметической композиции смешиванием соединения формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерной формы, по меньшей мере, одного косметически переносимого компонента и, в конце концов, дополнительных косметически активных ингредиентов, где композиция включает от 0,01 до 20% мас. соединения формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерной формы в расчете на общую массу композиции.
Следующий аспект относится к способу получения дерматологической композиции смешиванием соединения формулы (Ia), или (Ib), или (IIa), или (IIb) или его стереоизомерной формы, по меньшей мере, одного дерматологически переносимого компонента и в конце концов дополнительных косметически активных ингредиентов.
Многие из соединений настоящего изобретения можно синтезировать согласно следующим общим синтетическим схемам.
Схема 1
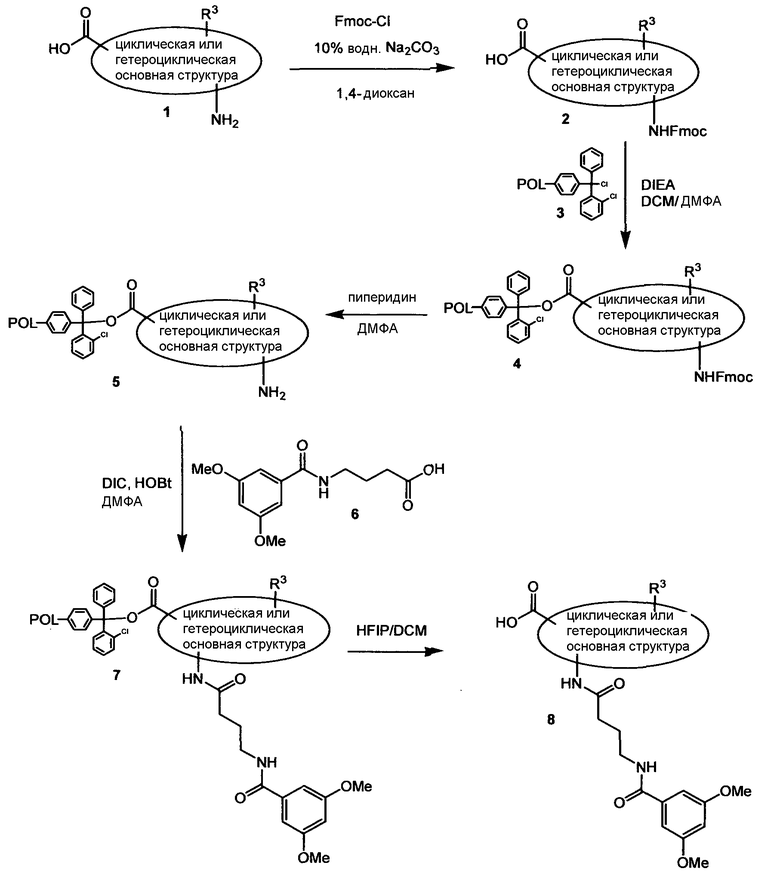
По схеме 1 аминокислоту типа (1) подвергают реакции с Fmoc-Cl в диоксане в основных условиях (10% Na2CO3 в воде) с получением соответствующей N-Fmoc-защищенной кислоты (2). Карбоновую кислоту (2) иммобилизуют на 2-хлортритилхлоридной смоле (3) с образованием закрепленного на твердой фазе 2-хлортритилового сложного эфира (4). Снятие защиты у (4) пиперидином в ДМФА дает амин типа (5). Дальнейшая реакция амина (5) с карбоновой кислотой (6) в стандартных условиях конденсации (DIC и HOBt в ДМФА) дает амид (7), который легко отщепляют от смолы гексафторизопропанолом (HFIP) в дихлорметане, получая при этом карбоновые кислоты типа (8). В альтернативном случае для стадии реакции амидной конденсации можно применять N'-(3-диметиламинопропил)-N-этилкарбодиимид (EDC), триэтиламин и 4-диметиламинопиридин (DMAP) в хлорированном растворителе. Последовательность синтеза, показанную на схеме 1 и приводящую к соединениям, подобным (8), применяют не только для строительных блоков Y-H, подобных (1), но ее обычно применяют для всех других строительных блоков типа Y-H, имеющих функциональную группу карбоновой кислоты и функциональную NH2-группу.
Схема 2
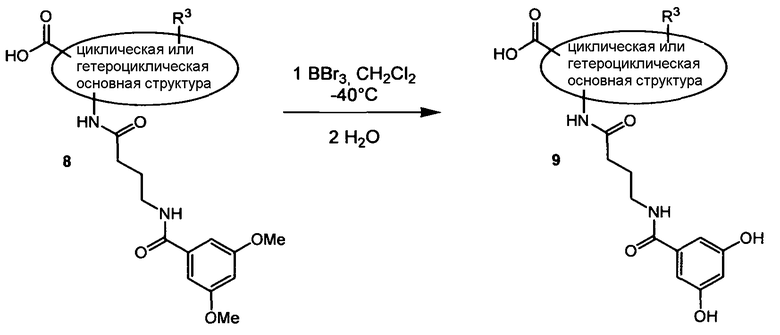
По схеме 2 карбоновые кислоты типа (8) подвергают реакции с трибромидом бора в дихлорметане при -40°С, получая при этом после водной обработки соответствующие деметилированные кислоты типа (9). Последовательность синтеза, показанную на схеме 2 и приводящую к соединениям, подобным (9), применяют не только для строительных блоков Х-Y-H и Y-H, подобных (8), но ее обычно применяют для всех других строительных блоков типа Х-Y-H и Y-H.
Схема 3
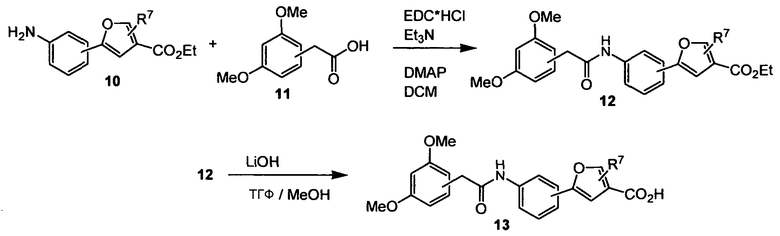
По схеме 3 анилин типа (10) подвергают реакции в условиях инертной атмосферы с N'-(3-диметиламинопропил)-N-этилкарбодиимидом (EDC), триэтиламином, 4-диметиламинопиридином (DMAP) и карбоновой кислотой типа (11) в дихлорметане, получая при этом амид типа (12). Дальнейший гидролиз сложного эфира (12) водным LiOH и ТГФ и МеОН дает карбоновые кислоты типа (13).
Схема 4
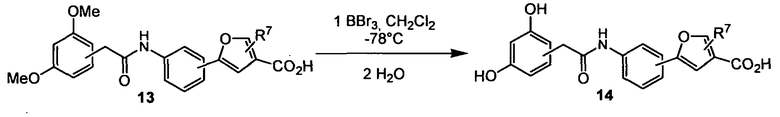
По схеме 4 карбоновые кислоты типа (13) подвергают реакции с трибромидом бора в дихлорметане при -40°С, получая при этом после водной обработки соответствующие деметилированные кислоты типа (14). Последовательность синтеза, показанную на схеме 4 и приводящую к соединениям, подобным (14), применяют не только для строительных блоков Х-Y-H и Y-H, подобных (13), но ее обычно применяют для всех других строительных блоков типа Х-Y-H и Y-H.
Настоящее изобретение, кроме того, иллюстрируется нижеследующими репрезентативными примерами.
Пример 1
3-[4-(3,5-Дигидроксибензоиламино)бутириламино]бензойная кислота (21) и метиловый эфир 3-[4-(3,5-дигидроксибензоиламино)бутириламино]бензойной кислоты (22)
Схема 5
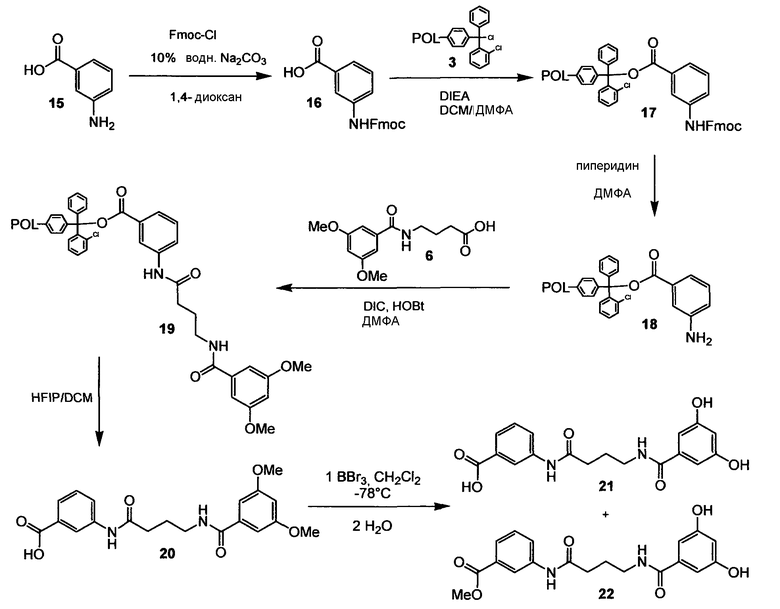
Стадия 1. 3-Аминобензойную кислоту ((15); 1,00 г, 7,30 ммоль) растворяют в 1,4-диоксане (12,0 мл) и 10% водном Na2CO3 (20,8 мл) и добавляют Fmoc-Cl (2,26 г, 8,76 ммоль). Реакционную смесь перемешивают в течение 2,5 ч при комнатной температуре. К смеси добавляют 1М водный HCl (42,0 мл) и экстрагируют ее EtOAc (3 раза). Объединенные органические слои промывают 1М водным HCl, водой и насыщенным раствором соли, объединенные водные слои экстрагируют снова один раз EtOAc, объединенные органические слои сушат Na2SO4 и растворитель удаляют при пониженном давлении. Оставшийся неочищенный продукт промывают охлажденным льдом EtOAc и сушат в вакууме, создаваемом масляным насосом, получая при этом (16) в виде белого твердого вещества (1,61 г, 61%). Дополнительную очистку не применяют. [M. Nichifor; E. H. Schacht; Tetrahedron; 1994; 50; 12; 3747-3760]. 1H ЯМР (400 МГц, ДМСО-d6): 4,31 (т, 1H, J=6,6 Гц); 4,49 (д, 2H, J=6,6 Гц); 7,31-7,45 (м, 5H); 7,56 (д, 1H, J=7,6 Гц); 7,60-7,70 (ушир.м, 1H); 7,75 (д, 2H, J=7,3 Гц); 7,90 (д, 2H, J=7,3 Гц); 8,11 (с, 1H); 9,88 (с, 1H).
Стадия 2. (16) (180 мг, 0,5 ммоль) растворяют в DCM (0,5 мл) и ДМФА (0,25 мл) при комнатной температуре в предварительно высушенной ампуле, добавляют DIEA (0,52 мл, 1,5 ммоль) и этот раствор добавляют к полимеру 2-хлортритилхлорид-полистирол (3) (82 мг, 0,13 ммоль (нагрузка 1,6 ммоль/г)), который предварительно подвергают набуханию в DCM (0,15 мл). Реакционную суспензию встряхивают в течение 14 ч при комнатной температуре. Связанный со смолой продукт (17) промывают смесью DCM/MeOH/DIEA (17+2+1, 3 раза), DCM (один раз), ДМФА (3 раза) и снова DCM (дважды) и сушат в вакууме [т.е. Novabiochem® 2000 Catalog; 2000; S15-Sl8].
Стадия 3. Все количество смолы (17) со стадии 2 суспендируют в ДМФА (0,4 мл) и пиперидине (0,1 мл) и суспензию встряхивают в течение 1,5 ч при комнатной температуре. Связанный со смолой продукт (18) промывают ДМФА (3 раза) и DCM (3 раза в течение 30 мин) и сушат в вакууме.
Стадия 4. Все количество смолы (18) со стадии 3 снова подвергают набуханию в ДМФА (0,8 мл) в течение 20 мин. Кислоту (6) (158 мг, 0,59 ммоль) и HOBt (90 мг, 0,59 ммоль) растворяют в ДМФА (2,8 мл) при комнатной температуре, добавляют DIC (75 мг, 0,59 ммоль), перемешивают в течение 15 мин и этот раствор добавляют к предварительно набухшей смоле (18). Суспензию смолы осторожно встряхивают в течение 20 ч при комнатной температуре. Связанный со смолой продукт (19) промывают ДМФА (3 раза) и DCM (4 раза) и сушат в вакууме.
Стадия 5. Все количество смолы (19) со стадии 4 суспендируют в 1,5 мл DCM+HFIP (2+1) и суспензию встряхивают в течение 45 мин при комнатной температуре. Оставшийся раствор отделяют фильтрованием и смолу промывают один раз DCM. Методику отщепления повторяют и промывание проводят один раз. Растворитель объединенных фильтратов выпаривают при пониженном давлении, получая при этом неочищенный продукт (20). Дополнительную очистку не проводят.
Стадия 6. (Нижеследующую реакцию проводят в атмосфере безводного N2). Все количество неочищенного продукта (20) со стадии 5 суспендируют в безводном DCM (2,0 мл), суспензию охлаждают до -40°С и добавляют к ней BBr3 (0,15 мл, 1,59 ммоль). Реакционную суспензию встряхивают в течение 1 ч при -40°С, 2 ч при -25°С и 30 мин при +5°С. При энергичном перемешивании добавляют по каплям воду с последующим добавлением МеОН. Растворитель удаляют при пониженном давлении. Очистка сырого продукта препаративной ОФ-ВЭЖХ (градиент, вода/MeCN, 95:5) дает 3-[4-(3,5-дигидроксибензоиламино)бутириламино]бензойную кислоту (21) (8,9 мг, выход 19% после 5 стадий) и метиловый эфир 3-[4-(3,5-дигидроксибензоиламино)бутириламино]бензойной кислоты (22) (3,0 мг, выход 6% после 5 стадий), оба в виде белых твердых веществ. 1H ЯМР (400 МГц, CD3OD) (21): 2,03 (квинт, 2H, J=7,1 Гц); 2,51 (т, 2H, J=7,5 Гц); 3,47 (т, 2H, J=6,7 Гц); 6,44 (ушир.с, 1H); 6,75 (ушир.с, 2H); 7,44 (дд, 1H, J1=8,3 Гц, J2=7,8 Гц); 7,78 (д, 1H, J=7,8 Гц); 7,85 (д, 1H, J=8,6 Гц); 8,26 (ушир.с, 1H); (22): 2,03 (квинт, 2H, J=6,9 Гц); 2,51 (т, 2H, J=7,5 Гц); 3,47 (т, 2H, J=6,9 Гц); 3,94 (с, 3H); 6,43 (ушир.т, 1H, J=2,0 Гц); 6,74 (д, 2H, J=2,0 Гц); 7,44 (т, 1H, J=8,1 Гц); 7,77 (д, 1H, J=7,6 Гц); 7,83 (ушир.д, 1H, J=8,1 Гц); 8,28 (ушир.с, 1H).
ПРИМЕР 2
{4-[4-(3,5-Дигидроксибензоиламино)бутирил]пиперазин-1-ил}уксусная кислота (23)
Схема 6
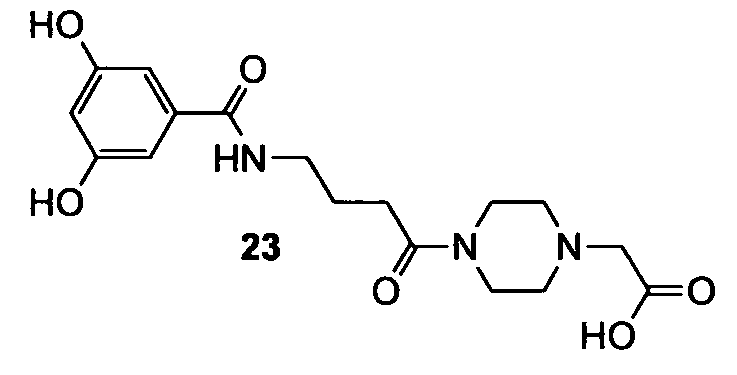
Согласно методике, описанной в примере 1, {4-[4-(3,5-дигидроксибензоиламино)бутирил]пиперазин-1-ил}уксусную кислоту (23) получают в виде желтоватого масла (6,8 мг, выход 14% после 5 стадий). 1H ЯМР (400 МГц, CD3OD): 1,96 (квинт, 2H, J=6,7 Гц); 2,54 (т, 2H, J=6,9 Гц); 3,41-3,51 (м, 4H); 3,90 (ушир.с, 4H); 4,12 (с, 2H); 6,46 (ушир.с, 1H); 6,74 (д, 2H, J=2,0 Гц).
ПРИМЕР 3
4-[4-(3,5-Дигидроксибензоиламино)бутириламино]бензойная кислота (24)
Схема 7
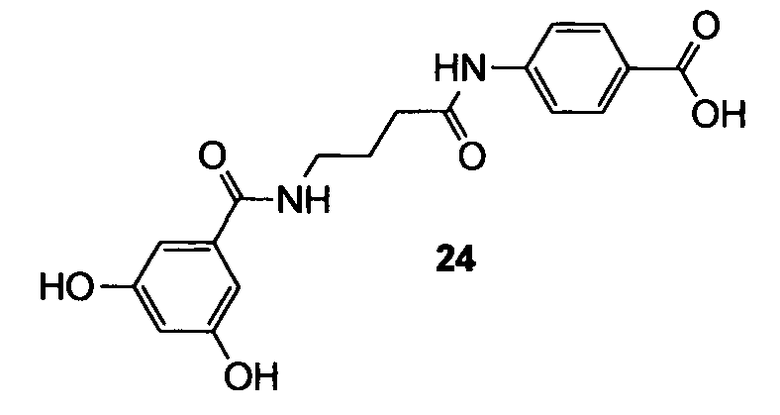
Согласно методике, описанной в примере 1, 4-[4-(3,5-дигидроксибензоиламино)бутириламино]бензойную кислоту (24) получают в виде белого твердого вещества (1,2 мг, выход 2% после 5 стадий). 1H ЯМР (400 МГц, CD3OD): 2,03 (квинт, 2H, J=6,9 Гц); 2,52 (т, 2H, J=7,8 Гц); 3,47 (т, 2H, J=6,6 Гц); 6,44 (ушир.с, 1H); 6,75 (ушир.с, 2H); 7,71 (д, 2H, J=8,3 Гц); 7,99 (д, 2H, J=8,3 Гц).
ПРИМЕР 4
Этиловый эфир 5-{4-[2-(2,4-диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновой кислоты (27) и 5-{4-[2-(2,4-диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновая кислота (28)
Схема 8
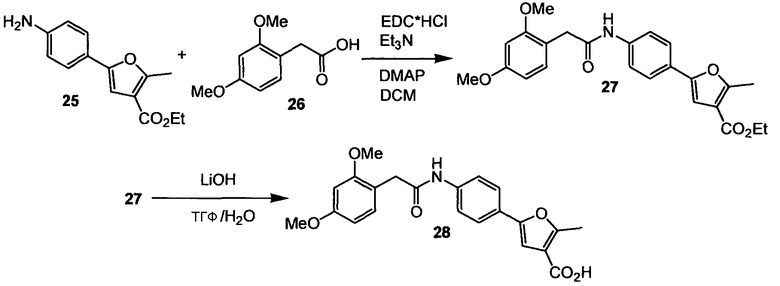
Стадия 1. (Нижеследующую реакцию проводят в безводной атмосфере N2). Гидрохлорид EDC (117 мг, 0,61 ммоль) и триэтиламин (85 мкл, 0,61 ммоль) растворяют в безводном дихлорметане (2,0 мл) и раствор перемешивают в течение 5 мин при комнатной температуре. Добавляют кислоту (26) (84 мг, 0,43 ммоль) и DMAP (8 мг, 0,06 ммоль) и смесь перемешивают в течение 10 мин. Добавляют этиловый сложный эфир (25) (100 мг, 0,41 ммоль) и реакционный раствор перемешивают на протяжении ночи при комнатной температуре. Реакционный раствор гидролизуют насыщенным водным NH4Cl с последующим гидролизом водой, слои разделяют, водный слой экстрагируют дихлорметаном (3 раза) и промывают объединенные органические слои водой и насыщенным раствором соли и сушат Na2SO4. Растворитель удаляют при пониженном давлении. Сырой продукт очищают препаративной радиальной хроматографией (силикагель 60PF, EtOAc/CyH, 1+1), получая при этом этиловый эфир 5-{4-[2-(2,4-диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновой кислоты (27) в виде желтого твердого вещества. (153 мг, 88%). [K.C. Nicolaou; P.S. Baran; Y.L. Zhong; K. Sugita; J Am. Chem. Soc.; 2002; 124; 10; 2212-2220]. 1H ЯМР (400 МГц, CDCl3): 1,34 (т, 3H, J=7,2 Гц); 2,61 (с, 3H); 3,63 (с, 2H); 3,81 (с, 3H); 3,89 (с, 3H); 4,28 (кв, 2H, J=7,2 Гц); 6,48-6,53 (м, 2H); 6,77 (с, 1H); 7,19 (д, 1H, J=8,1 Гц); 7,42 (д, 2H, J=8,6 Гц); 7,52 (д, 2H, J=8,8 Гц); 7,60 (ушир.с, 1H).
Стадия 2. Этиловый эфир 5-{4-[2-(2,4-диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновой кислоты (27) (150 мг, 0,35 ммоль) в МеОН (0,5 мл) растворяют в МеОН (0,5 мл) и ТГФ (8 мл) при комнатной температуре и добавляют 1М водный LiOH (3,6 мл, 3,6 ммоль). Реакционную смесь перемешивают 18 ч при комнатной температуре. Реакционную смесь гасят (охлаждающая баня) 2М водным HCl. Смесь экстрагируют EtOAc (3×), объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4, получая при этом 5-{4-[2-(2,4-диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновую кислоту (28) (136 мг, 97%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD): 2,66 (с, 3H); 3,65 (с, 2H); 3,83 (с, 3H); 3,86 (с, 3H); 6,54 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,59 (д, 1H, J=2,3 Гц); 6,91 (д, 1H); 7,18 (д, 1H, J=8,3 Гц); 7,64 (с, 4H).
ПРИМЕР 5
5-{4-[2-(2,4-Дигидроксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновая кислота (29)
Схема 9
(Нижеследующую реакцию проводят в безводной атмосфере N2). 5-{4-[2-(2,4-Диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновую кислоту (28) (100 мг, 0,25 ммоль) растворяют в безводном DCM (2,5 мл), раствор охлаждают до -78°С и по каплям добавляют BBr3 (95 мкл, 1,01 ммоль). Реакционную смесь перемешивают в течение 30 мин при -78°С и после медленного нагревания в течение дополнительных 2 ч при комнатной температуре. По каплям добавляют ледяную воду, слои разделяют и водный слой экстрагируют DCM (3 раза). Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают препаративной ОФ-ВЭЖХ (градиент, вода/CH3CN, 95:5 - 5:95), получая при этом 5-{4-[2-(2,4-дигидроксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновую кислоту (29) (30 мг, 32%). 1H ЯМР (400 МГц, CD3OD): 2,65 (с, 3H); 3,62 (с, 2H); 6,33 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,39 (д, 1H, J=2,3 Гц); 6,89 (с, 1H); 7,02 (д, 1H, J=8,3 Гц); 7,62 (с, 4H).
ПРИМЕР 6
5-{4-[2-(3,5-Диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновая кислота (30)
Схема 10
Согласно методике, описанной в примере 4, 5-{4-[2-(3,5-диметоксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновую кислоту (30) получают в виде белого твердого вещества (138 мг, выход 85% после двух стадий). 1H ЯМР (400 МГц, CD3OD): 2,66 (с, 3H); 3,65 (с, 2H); 3,81 (с, 6H); 6,43 (т, 1H, J=2,0 Гц); 6,58 (д, 2H, J=2,0 Гц); 6,92 (с, 1H); 7,65 (с, 4H).
ПРИМЕР 7
5-{4-[2-(3,5-Дигидроксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновая кислота (31)
Схема 11
Согласно методике, описанной в примере 5, 5-{4-[2-(3,5-дигидроксифенил)ацетиламино]фенил}-2-метилфуран-3-карбоновую кислоту (31) получают в виде белого твердого вещества (57 мг, выход 55%). 1H ЯМР (400 МГц, CD3OD): 2,66 (с, 3H); 3,57 (с, 2H); 6,22 (т, 1H, J=2,0 Гц); 6,35 (д, 2H, J=2,0 Гц); 6,91 (с, 1H); 7,65 (с, 4H).
Ниже описано получение промежуточных соединений.
Метиловый эфир [5-(2-аминофенил)тиофен-2-ил]уксусной кислоты (43)
Схема 13

Стадия 1. (Нижеследующую реакцию проводят в безводной атмосфере N2). Метиловый эфир тиофен-2-илуксусной кислоты (41) (2,0 г, 12,8 ммоль) растворяют в безводном хлороформе (9,0 мл) и ледяной уксусной кислоте (9,0 мл), порциями добавляют N-бромсукцинимид (2,3 г, 13,0 ммоль) и смесь перемешивают в течение 3 дней при комнатной температуре. К реакционной смеси добавляют воду, слои разделяют и водный слой экстрагируют дихлорметаном. Объединенный органический слой несколько раз промывают 1М водным NaOH и водой и один раз насыщенным раствором соли и сушат Na2SO4. Очисткой сырого продукта препаративной радиальной хроматографией (силикагель 60PF, CyH/EtOAc, 5+1) получают метиловый эфир (5-бромтиофен-2-ил)уксусной кислоты (42) в виде желтого масла (2,46 г, 81%), который применяют без любой дополнительной очистки. 1H ЯМР (400 МГц, CDCl3): 3,71 (с, 3H); 3,75 (с, 2H); 6,67 (д, 1H, J=3,8 Гц); 6,88 (д, 1H, J=3,8 Гц).
Стадия 2. (Нижеследующую реакцию проводят в атмосфере N2). Затем этанол (3,7 мл), тетракис(трифенилфосфин)палладий(0) (289 мг, 0,25 ммоль) и декагидрат Na2CO3 (4,0 г, 14,0 ммоль), растворенный в воде (5,2 мл), добавляют к раствору гидрохлорида 2-аминобензолбороновой кислоты (910 мг, 5,25 ммоль) в толуоле (52 мл). Реакционную смесь осторожно дегазируют (5 раз) и снова продувают струей N2. Добавляют раствор метилового эфира (5-бромтиофен-2-ил)уксусной кислоты (42) (1,17 г, 5,0 ммоль) в толуоле (4,5 мл). Смесь снова дегазируют (5 раз) и перемешивают в течение 22 ч при 100°С. Реакционный раствор распределяют между EtOAc и насыщенным раствором соли и отделенный водный слой экстрагируют EtOAc (3 раза). Объединенный органический слой промывают водой и насыщенным раствором соли и сушат Na2SO4. Очисткой сырого продукта препаративной радиальной хроматографией (силикагель 60PF, CyH/EtOAc, 5+1) получают метиловый эфир [5-(2-аминофенил)тиофен-2-ил]уксусной кислоты (43) в виде коричневого масла (634 мг, 51%). 1H ЯМР (400 МГц, CDCl3): 3,73 (с, 3H); 3,83 (с, 2H); 3,92-4,07 (ушир.с, 2H); 6,74 (д, 1H); 6,76 (тд, 1H, J1=7,6 Гц, J2=1,3 Гц); 6,92 (д, 1H, J=3,5 Гц); 7,02 (д, 1H, J=3,5 Гц); 7,11 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,23 (дд, 14H, J1=7,6 Гц, J2=1,5 Гц).
Метиловый эфир 5-(2-аминофенил)тиофен-2-карбоновой кислоты (45)
Схема 14
Стадия 1. 5-Бромтиофен-2-карбоновую кислоту (1,50 г, 7,24 ммоль) растворяют в МеОН (10 мл) и добавляют концентрированную серную кислоту (0,39 мл, 7,24 ммоль). Реакционную смесь перемешивают в течение 20 ч при 75°С. Смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и остаток растворяют в EtOAc. Органический слой промывают 3 раза 5% водным Na2CO3 и объединенный водный слой экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли и сушат Na2SO4. Растворитель удаляют при пониженном давлении и остаток сушат без дополнительной очистки в вакууме, создаваемом масляным насосом, получая при этом сложный эфир (44) в виде белого твердого вещества (1,48 г, 92%). 1H ЯМР (400 МГц, CDCl3): 3,85 (с, 3H); 7,05 (д, 1H, J=4,0 Гц); 7,53 (д, 1H, J=4,0 Гц).
Стадия 2. (Нижеследующую реакцию проводят в атмосфере N2). Тетракис(трифенилфосфин)палладий(0) (510 мг, 0,45 ммоль) и сложный эфир (44) (1,97 г, 8,91 ммоль) растворяют в DME (16 мл), реакционную смесь осторожно дегазируют (5 раз) и продувают струей N2. Добавляют 2-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фениламин (2,15 г, 9,80 ммоль) и 1М водный раствор NaHCO3 (27,0 мл, 27,0 ммоль), реакционную смесь снова осторожно дегазируют (5 раз) и продувают струей N2. Смесь перемешивают в течение 18 ч при 95°С. Смесь охлаждают до комнатной температуры, распределяют между EtOAc и водой и отделенный водный слой экстрагируют EtOAc (3 раза). Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают флэш-хроматографией (силикагель 60, CyH/EtOAc, 5+1), получая при этом метиловый эфир 5-(2-аминофенил)тиофен-2-карбоновой кислоты (45) в виде желтого твердого вещества (1,41 г, 67%). ЯМР (400 МГц, CDCl3): 3,88 (с, 3H); 4,00 (ушир.с, 2H); 6,73-6,82 (м, 2H); 7,13-7,21 (м, 2H); 7,26 (дд, 1H, J1=7,6 Гц, J2=1,0 Гц); 7,78 (д, 1H, J=3,8 Гц).
Метиловый эфир 5-(4-аминофенил)-2-метилфуран-3-карбоновой кислоты (47)
Схема 15
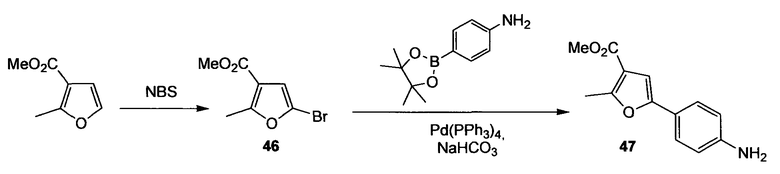
Стадия 1. (Нижеследующую реакцию проводят в отсутствие света). Метиловый эфир 2-метилфуран-3-карбоновой кислоты (3,60 мл, 28,5 ммоль) растворяют в хлороформе (20 мл) и ледяной уксусной кислоте (20 мл) и порциями добавляют NBS (6,90 г, 38,8 ммоль) в течение 95 мин. Реакционную суспензию перемешивают в течение дополнительных 19 ч при комнатной температуре. К реакционной смеси добавляют воду и водный слой экстрагируют дихлорметаном (2 раза), объединенный органический слой промывают 2М водным NaOH, водой (3 раза) и насыщенным раствором соли и сушат Na2SO4, получая при этом метиловый эфир 5-бром-2-метилфуран-3-карбоновой кислоты (46) (4,90 г, 78%) в виде красно-коричневого масла. Дополнительную очистку не проводят. 1H ЯМР (400 МГц, CDCl3): 2,54 (с, 3H); 3,80 (с, 3H); 6,53 (с, 1H).
Стадия 2. (Нижеследующую реакцию проводят в атмосфере N2). Pd(PPh3)4 (1,26 г, 1,09 ммоль) и метиловый эфир 5-бром-2-метилфуран-3-карбоновой кислоты (46) (4,77 г, 21,77 ммоль) растворяют в DME (116 мл) и раствор перемешивают в течение 15 мин при комнатной температуре. Добавляют 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фениламин (5,25 г, 23,96 ммоль) с последующим добавлением водного 1М раствора бикарбоната натрия (65,4 мл, 65,3 ммоль). Реакционную смесь осторожно дегазируют, продувают струей N2 (5 раз) и перемешивают в течение 4 ч при 95°С (кипячение с обратным холодильником). Реакционную смесь охлаждают до комнатной температуры, органический растворитель удаляют при пониженном давлении и остаток распределяют между водой и EtOAc. Водный слой экстрагируют EtOAc (3 раза), объединенный органический слой промывают водой и насыщенным раствором соли и сушат Na2SO4. Полученный сырой продукт очищают флэш-хроматографией (силикагель 60, EtOAc/CyH, 1+2), получая при этом метиловый эфир 5-(4-аминофенил)-2-метилфуран-3-карбоновой кислоты (47) (2,35 г, 46%) в виде желто-коричневого твердого вещества. 1H ЯМР (400 МГц, CDCl3): 2,60 (с, 3H); 3,74 (ушир.с, 2H); 3,82 (с, 3H); 6,64 (с, 1H); 6,67 (дт, 1H, J1=8,6 Гц, J2=2,3 Гц); 7,42 (дт, 2H, J1=8,8 Гц, J2=2,3 Гц).
2-Тиофен-2-илфениламин (48)
Схема 16
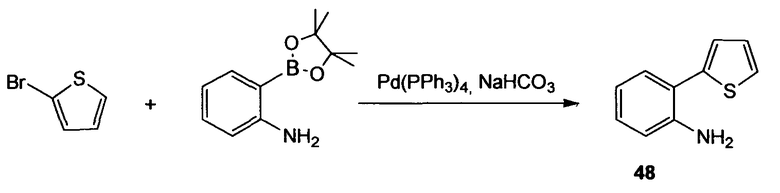
(Нижеследующую реакцию проводят в атмосфере N2). Тетракис(трифенилфосфин)палладий(0) (297 мг, 0,26 ммоль) и 2-бромтиофен (837 мг, 5,13 ммоль) растворяют в DME (42 мл), реакционную смесь осторожно дегазируют (5 раз) и продувают струей N2. После 10 мин перемешивания добавляют 2-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фениламин (1,24 г, 5,64 ммоль) и 1М водный раствор NaHCO3 (15,4 мл, 15,4 ммоль), реакционную смесь снова осторожно дегазируют (5 раз) и продувают струей N2. Смесь перемешивают в течение 3 ч при 95°С. Смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и остаток распределяют между EtOAc и водой. Отделенный водный слой экстрагируют EtOAc (3 раза). Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают флэш-хроматографией (силикагель 60, CyH/EtOAc, 15+1), получая при этом 2-тиофен-2-илфениламин (48) в виде коричневого твердого вещества (825 мг, 92%). 1H ЯМР (400 МГц, CDCl3): 4,40-6,00 (м, 2H); 6,88 (тд, 1H, J1=7,6 Гц, J2=1,0 Гц); 6,93 (дд, 1H, J1=8,0 Гц, J2=1,0 Гц); 7,07 (дд, 1H, J1=5,3 Гц, J2=3,5 Гц); 7,17 (тд, 1H, J1=8,0 Гц, J2=1,5 Гц); 7,22 (дд, 1H, J1=3,5 Гц, J2=1,3 Гц); 7,30 (дд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,33 (дд, 1H, J1=5,3 Гц, J2=1,3 Гц).
Метиловый эфир [5-(3-аминофенил)тиофен-2-ил]уксусной кислоты (50)
Схема 17
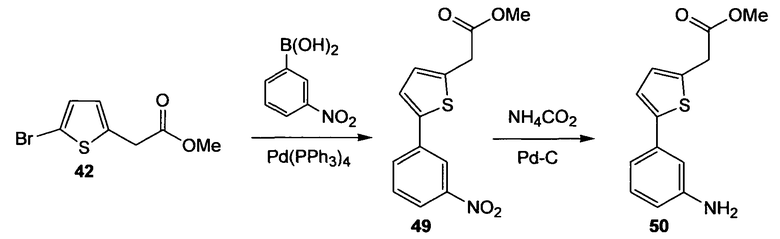
Стадия 1. (Нижеследующую реакцию проводят в атмосфере N2). Тетракис(трифенилфосфин)палладий(0) (1,12 г, 0,97 ммоль) и сложный эфир (42) (4,57 г, 19,44 ммоль) растворяют в толуоле (200 мл) и EtOH (20,0 мл), реакционную смесь осторожно дегазируют (5 раз) и продувают струей N2. Добавляют 3-нитрофенилбороновую кислоту (3,57 г, 21,38 ммоль) и 3М водный раствор Na2CO3 (18,1 мл, 54,3 ммоль), реакционную смесь снова осторожно дегазируют (5 раз) и продувают струей N2. Смесь перемешивают в течение 18 ч при 100°С. Реакционный раствор распределяют между EtOAc и водой и экстрагируют отделенный водный слой EtOAc (3 раза). Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Полученный сырой продукт очищают препаративной радиальной хроматографией (силикагель, EtOAc/CyH, 1+5), получая при этом метиловый эфир [5-(3-нитрофенил)тиофен-2-ил]уксусной кислоты (49) в виде желтого твердого вещества (3,15 г, 58%). 1H ЯМР (400 МГц, CDCl3): 3,75 (с, 3H); 3,85 (с, 2H); 6,94 (ушир.д, 1H, J=3,8 Гц); 7,27 (д, 1H, J=3,8 Гц); 7,51 (т, 1H, J=8,0 Гц); 7,84 (ддд, 1H, J1=7,8 Гц, J2=1,5 Гц, J3=0,8 Гц); 8,08 (ддд, 1H, J1=8,3 Гц, J2=2,1 Гц, J3=1,0 Гц); 8,39 (т, 1H, J=1,9 Гц).
Стадия 2. (Нижеследующую реакцию проводят в атмосфере N2). Метиловый эфир [5-(3-нитрофенил)тиофен-2-ил]уксусной кислоты (49) (3,15 г, 11,35 ммоль) растворяют в МеОН (225 мл) и добавляют Pd на угле (содержание Pd 10% (мас./мас.), 1,20 г, 1,13 ммоль) с последующим добавлением NH4CO2H (7,15 г, 113,4 ммоль) при комнатной температуре. Реакционную смесь осторожно дегазируют (продувают струей N2) и перемешивают в течение 22 ч при комнатной температуре. Реакционную смесь фильтруют через невысокий слой целита и растворитель удаляют. Полученный сырой продукт очищают препаративной радиальной хроматографией (силикагель, EtOAc/CyH, 1+3), получая при этом метиловый эфир [5-(3-аминофенил)тиофен-2-ил]уксусной кислоты (50) (2,08 г, 74%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3): 3,73 (с, 3H); 3,81 (с, 2H); 6,59 (дд, 1H, J1=7,8 Гц, J2=2,0 Гц); 6,86 (ушир.д, 1H, J=3,5 Гц); 6,88 (т, 1H, J=1,9 Гц); 6,97 (ушир.д, 1H, J=7,6 Гц); 7,09 (д, 1H, J=3,5 Гц); 7,13 (т, 1H, J=7,7 Гц).
Метиловый эфир 5-(6-аминопиридин-3-ил)-2-метилфуран-3-карбоновой кислоты (51)
Схема 18
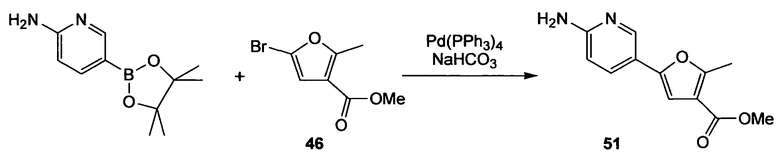
Стадия 1. (Нижеследующую реакцию проводят в атмосфере N2). 5-(4,4,5,5-Тетраметил[1,3,2]диоксаборолан-2-ил)пиридин-2-иламин (500 мг, 2,27 ммоль) и тетракис(трифенилфосфин)палладий(0) (114 мг, 0,10 ммоль) растворяют в DME (12,5 мл). Реакционную смесь осторожно дегазируют (5 раз) и продувают струей N2. Смесь перемешивают 10 мин при комнатной температуре, добавляют метиловый эфир 5-бром-2-метилфуран-3-карбоновой кислоты (46) (433 мг, 2,00 ммоль) и 1М водный раствор NaHCO3 (5,9 мл, 5,9 ммоль), реакционную смесь снова осторожно дегазируют (3 раза) и продувают струей N2. Смесь перемешивают в течение 3 ч при 95°С. Смесь охлаждают до комнатной температуры, разбавляют EtOAc и фильтруют через невысокий слой диоксида кремния. Растворитель удаляют при пониженном давлении и сырой продукт очищают препаративной радиальной хроматографией (силикагель 60PF, CyH/EtOAc, 2+1), получая при этом метиловый эфир 5-(6-аминопиридин-3-ил)-2-метилфуран-3-карбоновой кислоты (51) в виде желтого твердого вещества (382 мг, 82%). 1H ЯМР (400 МГц, CDCl3): 2,61 (с, 3H); 3,82 (с, 3H); 4,55 (ушир.с, 2H); 6,51 (д, 1H, J=8,6 Гц); 6,69 (с, 1H); 7,65 (дд, 1H, J1=8,6 Гц, J2=2,3 Гц); 8,35 (д, 1H, J=2,3 Гц).
2',4'-Диметоксибифенил-3-карбонилхлорид (54)
Схема 19
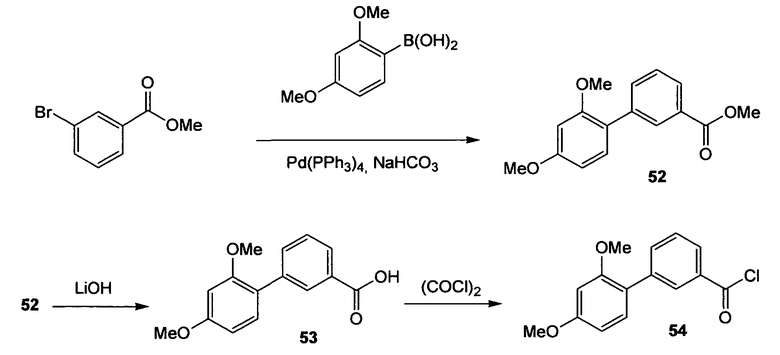
Стадия 1. (Нижеследующую реакцию проводят в атмосфере N2). Тетракис(трифенилфосфин)палладий(0) (410 мг, 0,35 ммоль) и метил-3-бромбензоат (2,51 г, 11,7 ммоль) растворяют в DME (22 мл). Добавляют 2,4-диметоксифенилбороновую кислоту (2,50 г, 13,7 ммоль) и 1М водный раствор NaHCO3 (35,5 мл, 35,5 ммоль), реакционную смесь осторожно дегазируют (5 раз) и продувают струей N2. Смесь перемешивают в течение 2,5 ч при 100°С. Реакционный раствор охлаждают до комнатной температуры, распределяют между EtOAc и водой и отделенный водный слой несколько раз экстрагируют EtOAc. Объединенный органический слой промывают насыщенным раствором соли и сушат его Na2SO4. Сырой продукт очищают флэш-хроматографией (силикагель 60, CyH/EtOAc, 7+1, затем 4+1), получая при этом бифенил (52) в виде желтого масла (2,95 г, 93%). 1H ЯМР (400 МГц, CDCl3): 3,78 (с, 3H); 3,84 (с, 3H); 3,90 (с, 3H); 6,55 (с, 1H); 6,56 (дд, 1H, J1=7,6 Гц, J2=2,3 Гц); 7,23 (дд, 1H, J1=7,6 Гц, J2=1,0 Гц); 7,43 (т, 1H, J=7,8 Гц); 7,68 (дт, 1H, J1=7,8 Гц, J2=1,5 Гц); 7,94 (дт, 1H, J1=7,8 Гц, J2=1,5 Гц); 8,14 (т, 1H, J=1,5 Гц).
Стадия 2. Метиловый эфир 2',4'-диметоксибифенил-3-карбоновой кислоты (52) (2,95 г, 10,8 ммоль) растворяют в MeCN (110 мл) при комнатной температуре и добавляют 1М водный LiOH (154 мл, 154 ммоль). Реакционную смесь перемешивают на протяжении ночи при комнатной температуре и 1 час при 50°С. Реакционную смесь гасят (охлаждающая баня) 1М водным HCl (160 мл, до достижения рН приблизительно 3). Смесь экстрагируют EtOAc (3×), объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4, получая при этом 2',4'-диметоксибифенил-3-карбоновую кислоту (53) в виде белого твердого вещества (2,59 г, 93%). 1H ЯМР (400 МГц, CDCl3): 3,79 (с, 3H); 3,84 (с, 3H); 6,55 (с, 1H); 6,54-6,58 (м, 1H); 7,23-7,26 (м, 1H); 7,46 (т, 1H, J=7,8 Гц); 7,73 (дт, 1H, J1=7,8 Гц, J2=1,5 Гц); 7,98 (дт, 1H, J1=7,8 Гц, J2=1,5 Гц); 8,19 (т, 1H, J=1,5 Гц).
Стадия 3. (Нижеследующую реакцию проводят в безводной атмосфере N2). 2',4'-Диметоксибифенил-3-карбоновую кислоту (53) (2,59 г, 10,0 ммоль) растворяют в безводном дихлорметане (71 мл) и добавляют безводный ДМФА (4 мл, каталитическое количество). Затем медленно добавляют оксалилхлорид (1,3 мл, 15,0 ммоль) при поддержании температуры приблизительно при 15°С (водяная баня) и желтый раствор перемешивают в течение дополнительных 3 ч при комнатной температуре. Растворитель удаляют при пониженном давлении и остаток сушат в вакууме, получая при этом 2',4'-диметоксибифенил-3-карбонилхлорид (54) в виде желтого твердого вещества (3,2 г, количеств. выход). Дополнительную очистку не проводят.
(2',4'-Диметоксибифенил-3-ил)уксусная кислота (57)
Схема 20
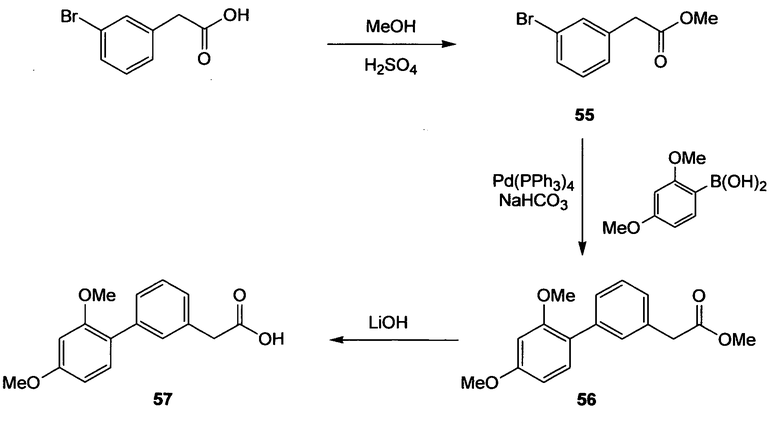
Стадия 1. (3-Бромфенил)уксусную кислоту (4,00 г, 18,6 ммоль) растворяют в МеОН (74 мл) и в раствор добавляют концентрированную серную кислоту (1,00 мл, 18,6 ммоль). Реакционную смесь перемешивают в течение 65 ч при 45°С. Смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и остаток распределяют между EtOAc и насыщенным водным раствором NaHCO3. Водный слой экстрагируют 3 раза EtOAc и объединенные органические слои промывают насыщенным раствором соли и сушат Na2SO4. Растворитель удаляют при пониженном давлении, получая при этом метиловый эфир (3-бромфенил)уксусной кислоты (55) в виде бесцветного масла (4,25 г, 99%). 1H ЯМР (400 МГц, CDCl3): 3,58 (с, 2H); 3,69 (с, 3H); 7,17 (т, 1H, J=7,6 Гц); 7,18-7,21 (м, 1H); 7,39 (дт, 1H, J1=6,8 Гц, J2=2,0 Гц); 7,41-7,43 (м, 1H).
Стадия 2. (Нижеследующую реакцию проводят в атмосфере N2). Метиловый эфир (3-бромфенил)уксусной кислоты (55) (2,00 г, 8,73 ммоль) и тетракис(трифенилфосфин)палладий(0) (303 мг, 0,26 ммоль) растворяют в DME (18 мл). Добавляют 2,4-диметоксифенилбороновую кислоту (1,84 г, 10,12 ммоль) и 1М водный раствор NaHCO3 (26 мл, 26 ммоль), реакционную смесь осторожно дегазируют (3 раза) и продувают струей N2. Смесь перемешивают на протяжении ночи при 100°С. Реакционный раствор охлаждают до комнатной температуры, распределяют между EtOAc и водой и отделенный водный слой несколько раз экстрагируют EtOAc. Объединенный органический слой промывают насыщенным раствором соли и сушат его Na2SO4. Сырой продукт очищают препаративной радиальной хроматографией (силикагель 60PF, CyH/EtOAc, 3+1), получая при этом метиловый эфир (2',4'-диметоксибифенил-3-ил)уксусной кислоты (56) в виде желтого масла (2,25 г, 90%). 1H ЯМР (400 МГц, CDCl3): 3,65 (с, 2H); 3,68 (с, 3H); 3,77 (с, 3H); 3,83 (с, 3H); 6,54 (с, 1H); 6,55 (дд, 1H, J1=7,0 Гц, J2=2,3 Гц); 7,18-7,21 (м, 1H); 7,22 (дд, 1H, J1=6,8 Гц, J2=2,3 Гц); 7,32 (т, 1H, J=8,0 Гц); 7,39 (д, 1H, J=1,5 Гц); 7,38-7,41 (м, 1H).
Стадия 3. Метиловый эфир (2',4'-диметоксибифенил-3-ил)уксусной кислоты (56) (2,25 г, 7,86 ммоль) растворяют в MeCN (79 мл) при комнатной температуре и в раствор добавляют 1М водный LiOH (40 мл, 40 ммоль). Реакционную смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь гасят (охлаждающая баня) 1М водным HCl (до достижения рН приблизительно 3) и MeCN удаляют при пониженном давлении. Водный остаток разбавляют EtOAc, слои разделяют и водный слой экстрагируют несколько раз EtOAc. Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4, получая при этом (2',4'-диметоксибифенил-3-ил)уксусную кислоту (57) в виде желтого масла (2,16 г, количеств. выход). 1H ЯМР (400 МГц, CDCl3): 3,67 (с, 2H); 3,76 (с, 3H); 3,83 (с, 3H); 6,53 (с, 1H); 6,52-6,56 (м, 1H); 7,18-7,22 (м, 1H); 7,22 (дд, 1H, J1=7,3 Гц, J2=1,5 Гц); 7,33 (т, 1H, J=7,8 Гц), 7,39-7,42 (м, 2H).
3',5'-Диметоксибифенил-3-карбонилхлорид (60)
Схема 21
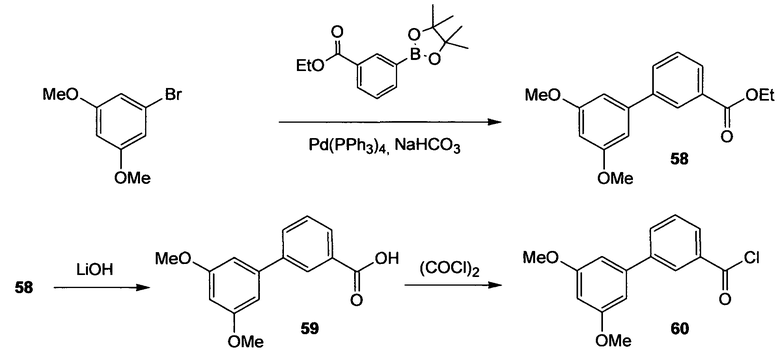
Стадия 1. (Нижеследующую реакцию проводят в атмосфере N2). Тетракис(трифенилфосфин)палладий(0) (410 мг, 0,35 ммоль) и 1-бром-3,5-диметоксибензол (1,80 г, 8,29 ммоль) растворяют в DME (17 мл). Добавляют этиловый эфир 3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензойной кислоты (2,66 г, 9,62 ммоль) и 1М водный раствор NaHCO3 (25 мл, 25 ммоль), реакционную смесь осторожно дегазируют (5 раз) и продувают струей N2. Смесь перемешивают на протяжении ночи при 100°С. Реакционный раствор охлаждают до комнатной температуры, распределяют между EtOAc и водой и отделенный водный слой несколько раз экстрагируют EtOAc. Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают препаративной радиальной хроматографией (силикагель 60PF, CyH/EtOAc, 10+1), получая при этом этиловый эфир 3',5'-диметоксибифенил-3-карбоновой кислоты (58) в виде желтого масла (2,04 г, 86%). 1H ЯМР (400 МГц, CDCl3): 1,37 (т, 3H, J=7,1 Гц); 3,84 (с, 6H); 4,39 (кв, 2H, J=7,1 Гц); 6,48 (т, 1H, J=2,3 Гц); 6,73 (д, 2H, J=2,3 Гц); 7,48 (т, 1H, J=7,6 Гц); 7,74 (д, 1H, J1=7,6 Гц); 8,01 (дт, 1H, J1=7,6 Гц, J2=1,5 Гц); 8,23 (т, 1H, J=1,5 Гц).
Стадия 2. Этиловый эфир 3',5'-диметоксибифенил-3-карбоновой кислоты (58) (2,04 г, 7,13 ммоль) растворяют в MeCN (71 мл) и добавляют 1М водный LiOH (36 мл, 36 ммоль). Реакционную смесь перемешивают при комнатной температуре и растворитель удаляют при пониженном давлении. Добавляют 1М водный HCl (до достижения рН приблизительно 3) и EtOAc, слои разделяют и водный слой экстрагируют EtOAc (несколько раз). Объединенный органический слой промывают насыщенным раствором соли и сушат его Na2SO4, получая при этом 3',5'-диметоксибифенил-3-карбоновую кислоту (59) в виде белого твердого вещества (1,73 г, 93%). 1H ЯМР (400 МГц, CDCl3): 3,85 (с, 6H); 6,49 (т, 1H, J=2,3 Гц); 6,74 (д, 2H, J=2,3 Гц); 7,52 (т, 1H, J=7,8 Гц); 7,80 (ддд, 1H, J1=7,8 Гц, J2=1,5 Гц, J3=1,3 Гц); 8,07 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 8,30 (т, 1H, J=1,5 Гц).
Стадия 3. (Нижеследующую реакцию проводят в безводной атмосфере N2). 3',5'-Диметоксибифенил-3-карбоновую кислоту (59) (950 мг, 3,68 ммоль) растворяют в безводном дихлорметане (25 мл) и добавляют безводный ДМФА (3 мл, до образования прозрачного раствора). Затем медленно добавляют оксалилхлорид (0,48 мл, 5,52 ммоль) при поддержании температуры приблизительно при 15°С (водяная баня) и смесь перемешивают в течение дополнительных 3 ч при комнатной температуре. Растворитель удаляют при пониженном давлении и остаток сушат в вакууме, получая при этом 3',5'-диметоксибифенил-3-карбонилхлорид (60) в виде желтого твердого вещества (1,22 г, количественный выход). Дополнительную очистку не проводят.
ПРИМЕР 8
Метиловый эфир (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (61) и (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусная кислота (62)
Схема 22
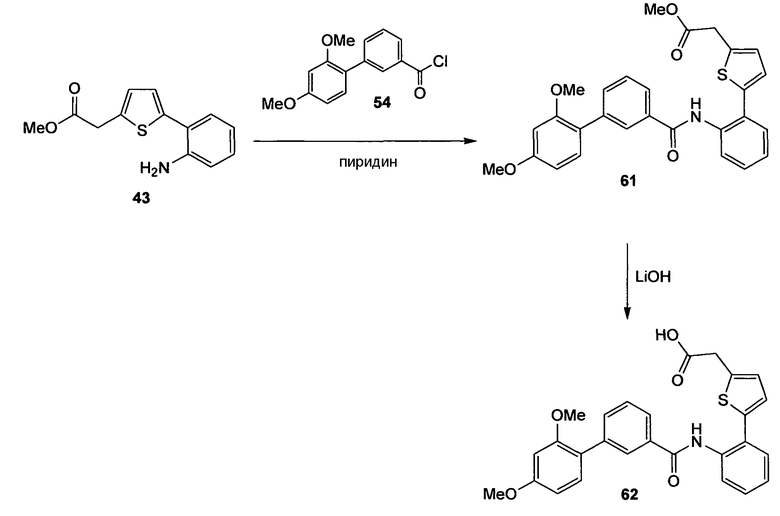
Стадия 1. (Нижеследующую реакцию проводят в атмосфере N2). Метиловый эфир [5-(2-аминофенил)тиофен-2-ил]уксусной кислоты (43) (62,0 мг, 0,25 ммоль) растворяют в безводном дихлорметане (3,7 мл) и безводном пиридине (1,1 мл) и реакционную смесь охлаждают до 0°С. Добавляют раствор 2',4'-диметоксибифенил-3-карбонилхлорида (54) (69 мг, 0,25 ммоль) в дихлорметане (1,5 мл) и реакционную смесь перемешивают в течение 1 ч при 0°С и на протяжении ночи при комнатной температуре. Реакционную смесь выливают в охлажденную льдом водную HCl, слои разделяют, водный слой экстрагируют дихлорметаном (3×), объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают препаративной радиальной хроматографией (силикагель 60PF, EtOAc/CyH, 3+1), получая при этом метиловый эфир (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (61) в виде желтого твердого вещества (4,2 мг, 37%). 1H ЯМР (400 МГц, CDCl3): 3,71 (с, 3H); 3,76 (с, 3H); 3,82 (с, 2H); 3,85 (с, 3H); 6,55 (д, 1H, J=2,3 Гц); 6,57 (дд, 1H, J1=8,0 Гц, J2=2,3 Гц); 6,95 (д, 1H, J=3,5 Гц); 7,02 (д, 1H, J=3,5 Гц); 7,15 (тд, 1H, J1=7,6 Гц, J2=1,0 Гц); 7,21 (д, 1H, J=8,0 Гц); 7,39 (д, 1H, J=7,6 Гц); 7,40 (д, 1H, J=7,6 Гц); 7,44 (т, 1H, J=7,6 Гц); 7,61-7,67 (м, 2H); 7,89 (т, 1H, J=1,5 Гц); 8,34 (ушир.с, 1H); 8,50 (д, 1H, J=8,0 Гц).
Стадия 2. Метиловый эфир (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (61) (45,0 мг, 0,09 ммоль) растворяют в MeCN (0,9 мл) и добавляют 1М водный LiOH (0,5 мл, 0,5 ммоль). Реакционную смесь перемешивают на протяжении ночи при комнатной температуре. Добавляют по каплям 1М водный HCl (до достижения рН приблизительно 3) и растворитель удаляют при пониженном давлении. Остаток растворяют в EtOAc и воде и отделенный водный слой несколько раз экстрагируют EtOAc. Объединенный органический слой промывают насыщенным раствором соли и сушат его Na2SO4, получая при этом (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусную кислоту (62) в виде желтого твердого вещества (48 мг, количественный выход). Дополнительную очистку не применяют. 1H ЯМР (400 МГц, CD3OD): 3,84 (ушир.с, 5H); 3,89 (с, 3H); 6,65-6,70 (м, 2H); 6,98 (д, 1H, J=3,5 Гц); 7,18 (д, 1H, J=3,5 Гц); 7,31 (д, 1H, J=8,0 Гц); 7,37 (тд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,43 (тд, 1H, J1=7,8 Гц, J2=1,5 Гц); 7,52 (т, 1H, J=7,8 Гц); 7,63 (дд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,70-7,76 (м, 2H); 7,83 (д, 1H, J=7,8 Гц); 8,01 (ушир.с, 1H).
ПРИМЕР 9
(5-{2-[(2',4'-Дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусная кислота (63) и метиловый эфир (5-{2-[(2',4'-дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (64)
Схема 23
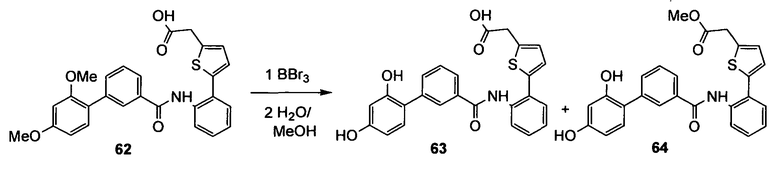
(Нижеследующую реакцию проводят в атмосфере N2). (5-{2-[(2',4'-Диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусную кислоту (62) (48,0 мг, 0,10 ммоль) растворяют в безводном дихлорметане (1,5 мл), раствор охлаждают до -78°С и по каплям добавляют 1М раствор BBr3 в дихлорметане (0,63 мл, 0,63 ммоль). Реакционную смесь перемешивают в течение 30 мин при -78°С и после медленного нагревания в течение дополнительных 2 ч при комнатной температуре. Смесь охлаждают до 0°С, добавляют по каплям воду с последующим добавлением при энергичном перемешивании МеОН. Образовавшуюся смесь концентрируют при пониженном давлении. Сырой продукт очищают препаративной ОФ-ВЭЖХ (градиент, вода/CH3CN, 95:5 - 5:95), получая при этом (5-{2-[(2',4'-дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусную кислоту (63) (3,7 мг, 8%) и метиловый эфир (5-{2-[(2',4'-дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (64) (7,1 мг, 15%), оба в виде желтых твердых веществ. 1H ЯМР соединения (63) (400 МГц, CD3OD): 3,85 (с, 2H); 6,42-6,47 (м, 2H); 6,98 (д, 1H, J=3,5 Гц); 7,18 (д, 1H, J=7,6 Гц); 7,19 (д, 1H, J=3,5 Гц); 7,36 (тд, 1H, J1=7,6 Гц, J2=1,3 Гц), 7,43 (тд, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,51 (т, 1H, J=7,8 Гц); 7,62 (дд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,75-7,81 (м, 3H); 8,08 (ушир.с, 1H), 1H ЯМР соединения (64) (400 МГц, CD3OD): 3,66 (с, 3H); 3,89 (с, 2H); 6,44 (дд, 1H, J1=7,0 Гц, J2=2,3 Гц); 6,45 (с, 1H); 6,97 (д, 1H, J=3,5 Гц); 7,18 (д, 1H, J=7,0 Гц); 7,19 (д, 1H, J=3,5 Гц); 7,37 (тд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,43 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,51 (т, 1H, J=7,8 Гц); 7,63 (дд, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,72 (д, 1H, J=7,8 Гц); 7,80 (д, 1H, J=8,0 Гц); 7,81 (т, 1H, J=7,6 Гц); 8,07 (с, 1H).
ПРИМЕР 10
Метиловый эфир (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновой кислоты (65)
Схема 24
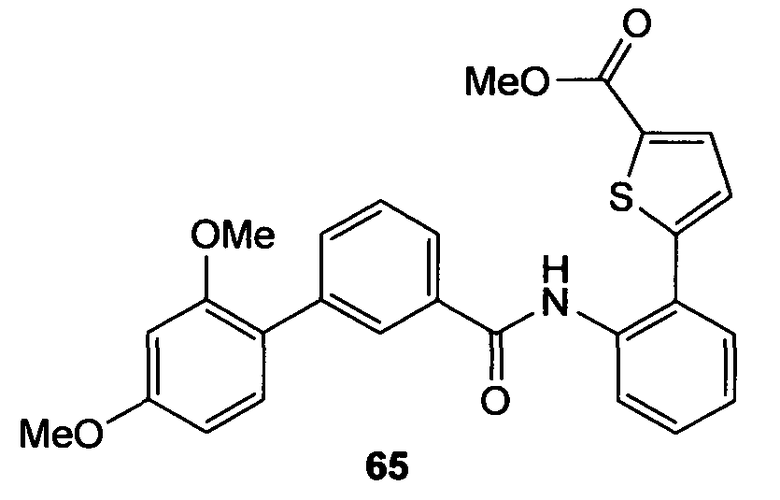
Метиловый эфир (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновой кислоты (65) синтезируют согласно методике, описанной в стадии 1 примера 8, исходя из анилина (45) и хлорангидрида карбоновой кислоты (54), и выделяют в виде желтого твердого вещества (147 мг, 62%). 1H ЯМР (400 МГц, CDCl3): 3,75 (с, 3H); 3,85 (с, 3H); 3,87 (с, 3H); 6,54 (с, 1H); 6,57 (дд, 1H, J1=8,6 Гц, J2=2,0 Гц); 7,17 (д, 1H, J=4,3 Гц); 7,19 (д, 1H, J=9,0 Гц); 7,20 (т, 1H, J=8,6 Гц); 7,41 (д, 1H, J=7,8 Гц); 7,44 (т, 1H, J=7,8 Гц); 7,46 (т, 1H, J=8,0 Гц); 7,64 (д, 1H, J=8,3 Гц); 7,66 (д, 1H, J=7,8 Гц); 7,80 (д, 1H, J=4,0 Гц); 7,83 (с, 1H); 8,19 (ушир.с, 1H); 8,47 (д, 1H, J=8,3 Гц).
ПРИМЕР 11
(5-{2-[(2',4'-Диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновая кислота (66)
Схема 25
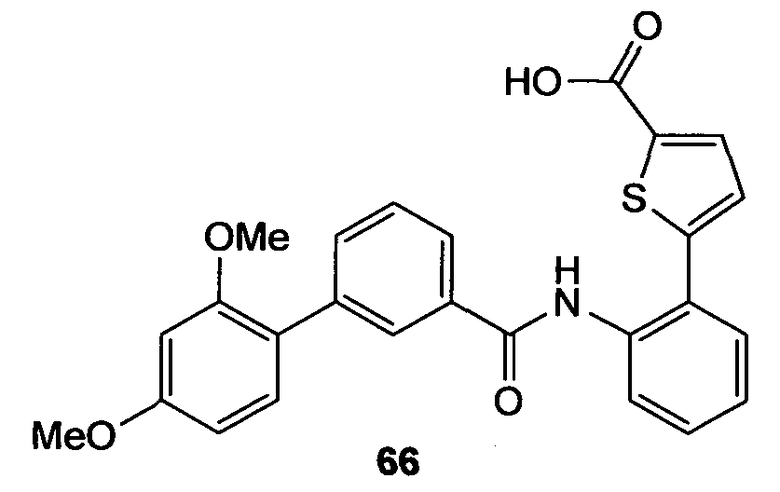
Омыление метилового эфира карбоновой кислоты (65) в смеси ТГФ и МеОН (3+2) согласно методике, описанной в стадии 2 примера 8, дает (5-{2-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновую кислоту (66) в виде желтого масла (130 мг, количеств. выход). 1H ЯМР (400 МГц, CD3OD): 3,83 (с, 3H); 3,88 (с, 3H); 6,66 (дд, 1H, J1=8,0 Гц, J2=2,3 Гц); 6,67 (с, 1H); 7,31 (д, 1H, J=8,0 Гц); 7,36 (д, 1H, J=4,0 Гц); 7,44 (тд, 1H, J1=7,8 Гц, J2=1,0 Гц); 7,48-7,53 (м, 1H); 7,52 (т, 1H, J=7,8 Гц); 7,65 (д, 1H, J=7,8 Гц); 7,71 (д, 1H, J=7,8 Гц); 7,73 (д, 1H, J=8,3 Гц); 7,76 (д, 1H, J=4,0 Гц); 7,84 (д, 1H, J=7,8 Гц); 8,01 (с, 1H).
ПРИМЕР 12
(5-{2-[(2',4'-Дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновая кислота (67)
Схема 26
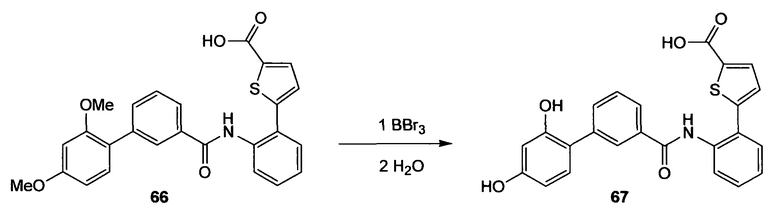
(Нижеследующую реакцию проводят в атмосфере N2). (5-{2-[(2',4'-Диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновую кислоту (66) (88,6 мг, 0,19 ммоль) суспендируют в безводном дихлорметане (4,0 мл), смесь охлаждают до -78°С и по каплям добавляют 1М раствор BBr3 в дихлорметане (0,80 мл, 0,80 ммоль). Реакционную смесь перемешивают в течение 30 мин при -78°С и после медленного нагревания в течение дополнительных 2 ч при комнатной температуре. Реакционную смесь охлаждают до 0°С, по каплям добавляют ледяную воду, слои разделяют и водный слой экстрагируют EtOAc (3 раза). Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают препаративной ОФ-ВЭЖХ (градиент, вода/CH3CN, 95:5 - 5:95), получая при этом (5-{2-[(2',4'-дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновую кислоту (67) в виде не совсем белого твердого вещества (23 мг, 26%). 1H ЯМР (400 МГц, CD3OD): 6,44 (дд, 1H, J1=7,8 Гц, J2=2,3 Гц); 6,45 (с, 1H); 7,19 (д, 1H, J=7,8 Гц); 7,35 (д, 1H, J=4,0 Гц); 7,42 (т, 1H, J=7,6 Гц); 7,50 (тд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,51 (т, 1H, J=7,8 Гц); 7,69 (д, 2H, J=7,6 Гц); 7,72 (д, 1H, J=3,8 Гц); 7,80 (д, 2H, J=7,8 Гц); 8,09 (с, 1H).
ПРИМЕР 13
Метиловый эфир (5-{2-[2-(2',4'-диметоксибифенил-3-ил)ацетиламино]фенил}тиофен-2-ил)уксусной кислоты (68)
Схема 27
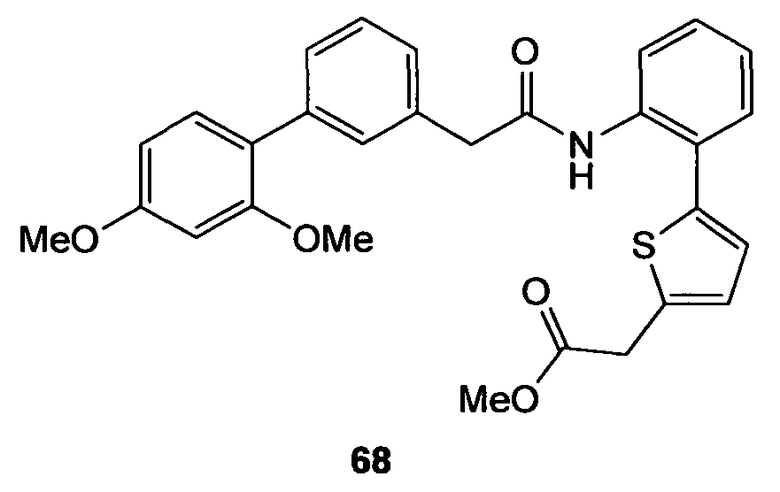
Метиловый эфир (5-{2-[2-(2',4'-диметоксибифенил-3-ил)ацетиламино]фенил}тиофен-2-ил)уксусной кислоты (68) синтезируют согласно методике, описанной в стадии 1 примера 4, исходя из анилина (43) и карбоновой кислоты (57), и выделяют в виде белого твердого вещества (117 мг, 57%). 1H ЯМР (400 МГц, CDCl3): 3,66 (с, 2H); 3,71 (с, 3H); 3,72 (с, 2H); 3,73 (с, 3H); 3,84 (с, 3H); 6,39 (д, 1H, J=3,0 Гц); 6,53 (с, 1H); 6,51-6,57 (м, 2H); 7,06 (т, 1H, J=8,3 Гц); 7,07 (д, 1H, J=8,0 Гц); 7,13 (д, 1H, J=8,6 Гц); 7,22-7,27 (м, 1H); 7,28 (т, 1H, J=7,8 Гц); 7,31 (т, 1H, J=7,8 Гц); 7,33 (с, 1H); 7,42 (д, 1H, J=7,8 Гц); 7,66 (с, 1H); 8,38 (д, 1H, J=8,3 Гц).
ПРИМЕР 14
(5-{2-[2-(2',4'-Диметоксибифенил-3-ил)ацетиламино]фенил}тиофен-2-ил)уксусная кислота (69)
Схема 28
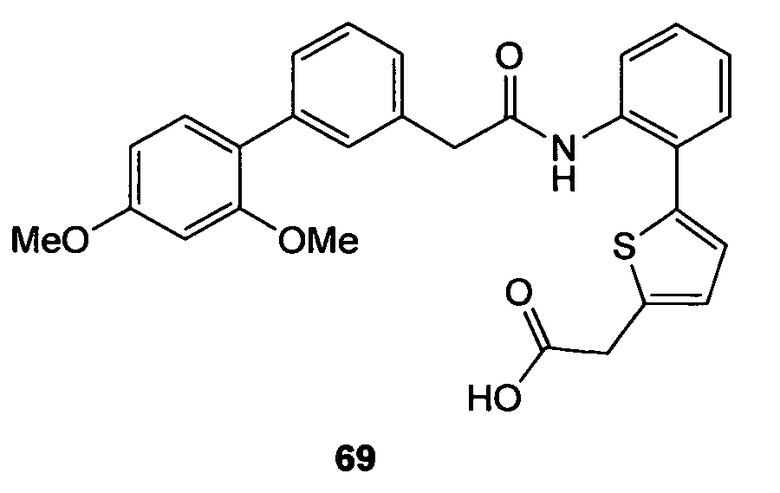
Омыление метилового эфира уксусной кислоты (68) в MeCN согласно методике, описанной в стадии 2 примера 8, дает (5-{2-[2-(2',4'-диметоксибифенил-3-ил)ацетиламино]фенил}тиофен-2-ил)уксусную кислоту (69) в виде желтого масла (117 мг, 96%). 1H ЯМР (400 МГц, CD3OD): 3,72 (с, 2H); 3,75 (с, 2H); 3,80 (с, 3H); 3,88 (с, 3H); 6,64 (дд, 1H, J1=8,6 Гц, J2=2,3 Гц); 6,66 (м, 1H); 6,70 (д, 1H, J=3,0 Гц); 6,78 (д, 1H, J=3,5 Гц); 7,22-7,27 (м, 1H); 7,25 (д, 1H, J=8,6 Гц); 7,26 (т, 1H, J=7,6 Гц); 7,36 (т, 2H, J=7,8 Гц); 7,42-7,49 (м, 3H); 7,74 (д, 1H, J=8,0 Гц).
ПРИМЕР 15
(5-{2-[2-(2',4'-Дигидроксибифенил-3-ил)ацетиламино]фенил}тиофен-2-ил)уксусная кислота (70)
Схема 29
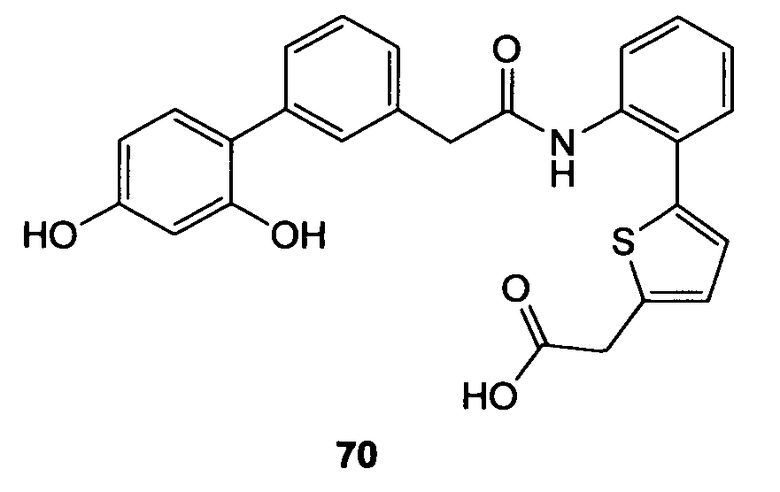
Согласно методике, описанной в примере 12, реакция карбоновой кислоты (69) с 1М раствором BBr3 дает (5-{2-[2-(2',4'-дигидроксибифенил-3-ил)ацетиламино]фенил}тиофен-2-ил)уксусную кислоту (70) в виде не совсем белого твердого вещества (61 мг, 55%). 1H ЯМР (400 МГц, CD3OD): 3,75 (с, 2H); 3,76 (с, 2H); 6,42 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,44 (д, 1H, J=2,3 Гц); 6,74 (д, 1H, J=3,5 Гц); 6,81 (д, 1H, J=3,5 Гц); 7,11 (д, 1H, J=8,3 Гц); 7,22 (д, 1H, J=7,6 Гц); 7,26 (т, 1H, J=7,6 Гц); 7,35 (т, 2H, J=7,8 Гц); 7,46 (д, 1H, J=7,8 Гц); 7,48-7,52 (м, 1H); 7,51 (с, 1H); 7,78 (д, 1H, J=8,1 Гц).
ПРИМЕР 16
[5-(2-{[5-(2,4-Дигидроксифенил)пиридин-3-карбонил]амино}фенил)тиофен-2-ил]уксусная кислота (73) и метиловый эфир [5-(2-{[5-(2,4-дигидроксифенил)пиридин-3-карбонил]амино}фенил)тиофен-2-ил]уксусной кислоты (74)
Схема 30
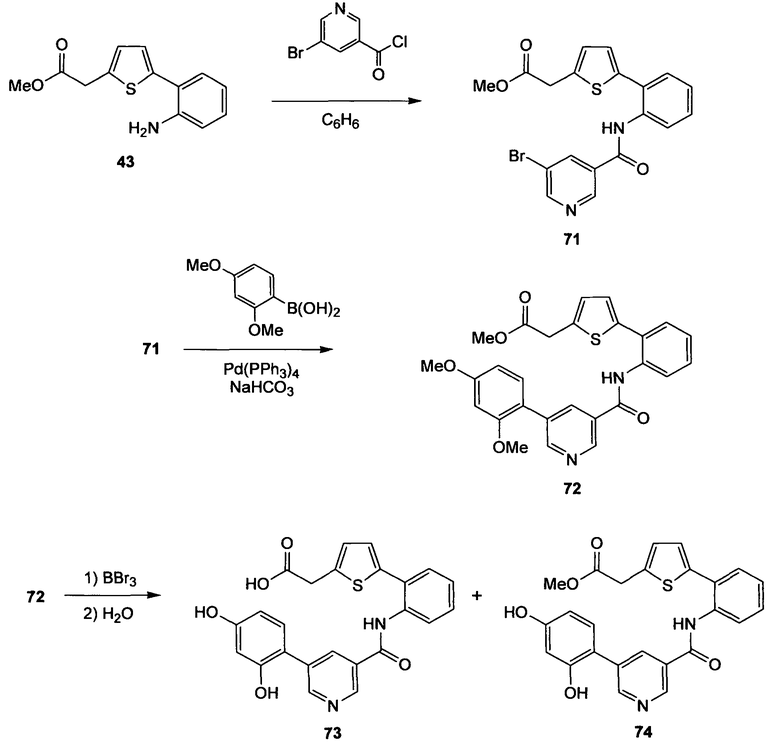
Стадия 1. (Нижеследующую реакцию проводят в атмосфере N2). Метиловый эфир [5-(2-аминофенил)тиофен-2-ил]уксусной кислоты (43) (250 мг, 1,01 ммоль) растворяют в безводном С6Н6 (4,0 мл). Добавляют раствор 5-бромникотиноилхлорида (223 мг, 1,01 ммоль) и образовавшуюся суспензию перемешивают на протяжении ночи при комнатной температуре. Растворитель удаляют при пониженном давлении. Сырой продукт очищают препаративной радиальной хроматографией (силикагель 60PF, CyH/EtOAc, 3+1, затем 1+1 и затем EtOAc и EtOAc/МеОН, 1+1), получая при этом метиловый эфир (5-{2-[(5-бромпиридин-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (71) в виде желтого твердого вещества (216 мг, 49%). 1H ЯМР (400 МГц, CD3OD): 3,71 (с, 3H); 3,90 (с, 2H); 6,97 (д, 1H, J=3,5 Гц); 7,18 (д, 1H, J=3,5 Гц); 7,41 (тд, 1H, J1=7,3 Гц, J2=1,8 Гц); 7,45 (тд, 1H, J1=7,3 Гц, J2=2,0 Гц); 7,59 (дд, 1H, J1=7,3 Гц, J2=2,0 Гц); 7,67 (дд, 1H, J1=7,1 Гц, J2=2,0 Гц); 8,52 (с, 1H); 8,88 (м, 1H); 9,05 (с, 1H).
Стадия 2. (Нижеследующую реакцию проводят в атмосфере N2). Тетракис(трифенилфосфин)палладий(0) (12 мг, 0,01 ммоль) и метиловый эфир (5-{2-[(5-бромпиридин-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (71) (150 мг, 0,35 ммоль) растворяют в DME (1,4 мл). Добавляют 2,4-диметоксифенилбороновую кислоту (95,0 мг, 0,52 ммоль) и 1М водный раствор NaHCO3 (1,0 мл, 1,0 ммоль), реакционную смесь осторожно дегазируют (5 раз) и продувают струей N2. Образовавшуюся смесь перемешивают в течение 1 ч при 90°С и снова охлаждают до комнатной температуры. Растворитель удаляют при пониженном давлении, остаток растворяют в МеОН и фильтрат пропускают через невысокий слой силикагеля. Фильтрат концентрируют при пониженном давлении и сырой продукт очищают препаративной радиальной хроматографией (силикагель 60PF, CyH/EtOAc, 1+1), получая при этом метиловый эфир [5-(2-{[5-(2,4-диметоксифенил)пиридин-3-карбонил]амино}фенил)тиофен-2-ил]уксусной кислоты (72) в виде желтого клейкого масла (121 мг, 71%). 1H ЯМР (400 МГц, CD3OD): 3,64 (с, 3H); 3,89 (ушир.с, 5H); 3,90 (с, 3H); 6,70-6,75 (м, 1H); 6,74 (с, 1H); 6,97 (д, 1H, J=3,3 Гц); 7,20 (д, 1H, J=3,5 Гц); 7,37-7,44 (м, 2H); 7,47 (тд, 1H, J1=7,3 Гц, J2=1,3 Гц); 7,61-7,72 (м, 3H); 8,44 (с, 1H); 8,87 (с, 1H); 8,97 (с, 1H).
Стадия 3. (Нижеследующую реакцию проводят в атмосфере N2). Метиловый эфир [5-(2-{[5-(2,4-диметоксифенил)пиридин-3-карбонил]амино}фенил)тиофен-2-ил]уксусной кислоты (72) (50 мг, 0,10 ммоль) растворяют в безводном дихлорметане (1,2 мл), раствор охлаждают до -78°С и по каплям добавляют 1М раствор BBr3 в дихлорметане (1,10 мл, 1,10 ммоль). Реакционную смесь перемешивают в течение 30 мин при -78°С и в течение дополнительного 1 ч при комнатной температуре. Смесь охлаждают до 0°С, добавляют по каплям воду и концентрируют при пониженном давлении. Сырой продукт очищают препаративной ОФ-ВЭЖХ (градиент, вода/CH3CN, 95:5 - 5:95), получая при этом [5-(2-{[5-(2,4-дигидроксифенил)пиридин-3-карбонил]амино}фенил)тиофен-2-ил]уксусную кислоту (73) в виде желтого твердого вещества (12,6 мг, 46%) и метиловый эфир [5-(2-{[5-(2,4-дигидроксифенил)пиридин-3-карбонил]амино}фенил)тиофен-2-ил]уксусной кислоты (74) в виде коричневого твердого вещества (21,9 мг, 47%). 1H ЯМР соединения (73) (400 МГц, CD3OD): 3,86 (с, 2H); 6,49 (дд, 1H, J1=9,1 Гц, J2=2,3 Гц); 6,49 (д, 1H, J=2,0 Гц); 6,98 (д, 1H, J=3,5 Гц); 7,20 (д, 1H, J=3,5 Гц); 7,26 (д, 1H, J=9,1 Гц); 7,40 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,45 (тд, 1H, J1=7,6 Гц, J2=1,8 Гц); 7,66 (дд, 1H, J1=7,6 Гц, J2=1,8 Гц); 7,66-7,70 (м, 1H); 8,50 (ушир.с, 1H); 8,92 (ушир.с, 1H); 8,95 (с, 1H). 1H ЯМР соединения (74) (400 МГц, CD3OD): 3,65 (с, 3H); 3,89 (с, 2H); 6,51 (с, 1H); 6,52 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,97 (д, 1H, J=3,5 Гц); 7,21 (д, 1H, J=3,5 Гц); 7,36 (д, 1H, J=8,3 Гц); 7,43 (тд, 1H, J1=7,3 Гц, J2=1,5 Гц); 7,46 (тд, 1H, J1=7,6 Гц, J2=1,8 Гц); 7,63-7,69 (м, 2H); 8,80 (ушир.с, 1H); 9,00 (ушир.с, 1H); 9,11 (с, 1H).
ПРИМЕР 17
Метиловый эфир 5-(4-{[5-(2,4-диметоксифенил)пиридин-3-карбонил]амино}фенил)-2-метилфуран-3-карбоновой кислоты (75)
Схема 31
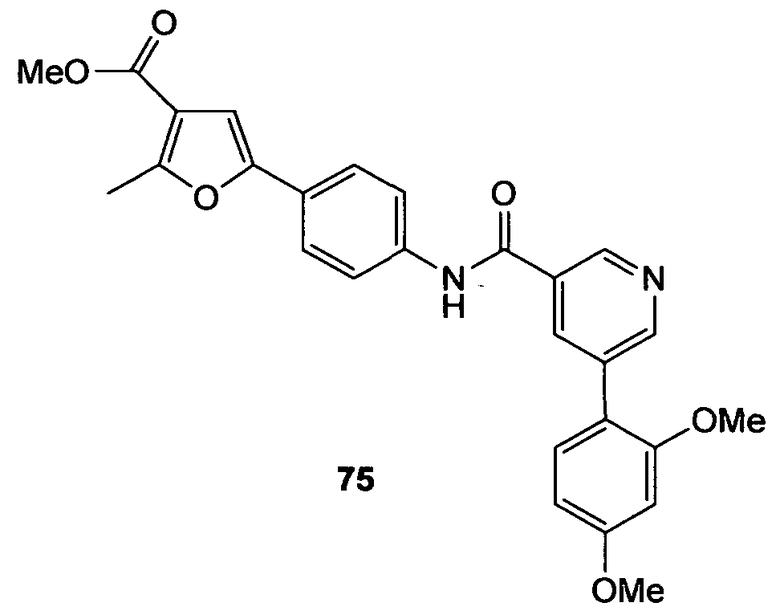
Метиловый эфир 5-(4-{[5-(2,4-диметоксифенил)пиридин-3-карбонил]амино}фенил)-2-метилфуран-3-карбоновой кислоты (75) синтезируют согласно методике, описанной в стадиях 1 и 2 примера 16, исходя из анилина (47) и 5-бромникотиноилхлорида, и выделяют в виде серого твердого вещества (103 мг, выход 32% после 2 стадий). 1H ЯМР (400 МГц, CD3OD): 2,68 (с, 3H); 3,89 (с, 3H); 3,90 (с, 3H); 3,91 (с, 3H); 6,71-6,76 (м, 2H); 6,99 (с, 1H); 7,42 (д, 1H, J=8,1 Гц); 7,74 (д, 2H, J=8,6 Гц); 7,84 (д, 2H, J=8,6 Гц); 8,47 (т, 1H, J=2,0 Гц); 8,87 (д, 1H, J=2,0 Гц); 9,00 (д, 1H, J=2,0 Гц).
ПРИМЕР 18
5-(4-{[5-(2,4-Дигидроксифенил)пиридин-3-карбонил]амино}фенил)-2-метилфуран-3-карбоновая кислота (76)
Схема 32
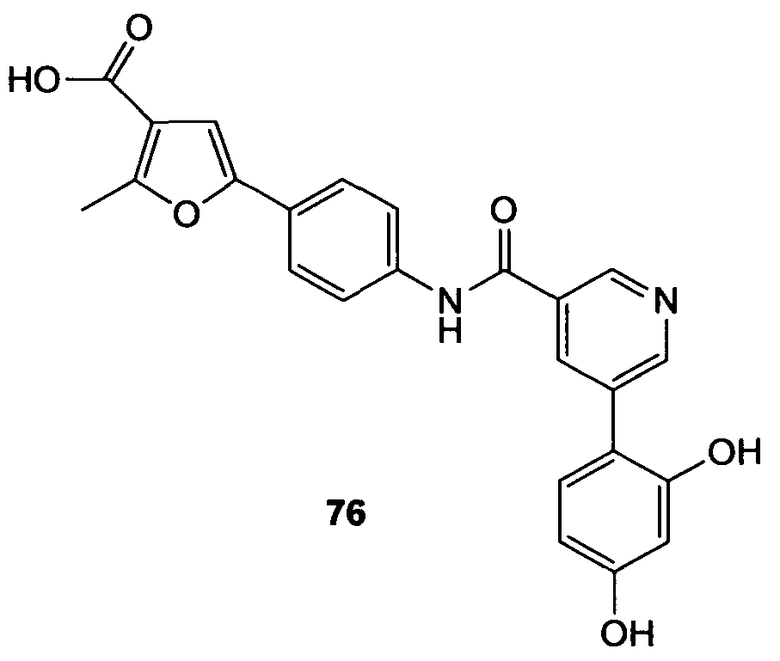
Согласно методике, описанной в стадии 3 примера 16, реакция амида (75) с 1М раствором BBr3 дает 5-(4-{[5-(2,4-дигидроксифенил)пиридин-3-карбонил]амино}фенил)-2-метилфуран-3-карбоновую кислоту (76) в виде коричневого твердого вещества (22 мг, 24%). 1H ЯМР (400 МГц, CD3OD): 2,69 (с, 3H); 3,39 (с, 1H); 6,51 (с, 1H); 6,52 (дд, 1H, J1=8,1 Гц, J2=2,3 Гц); 6,98 (с, 1H); 7,36 (д, 1H, J=8,1 Гц); 7,74 (ушир.д, 2H, J=8,6 Гц); 7,85 (ушир.д, 2H, J=8,6 Гц); 8,73 (с, 1H); 9,08 (ушир.с, 2H).
ПРИМЕР 19
Метиловый эфир 3-[(2',4'-диметоксибифенил-3-карбонил)амино]бензойной кислоты (77)
Схема 33
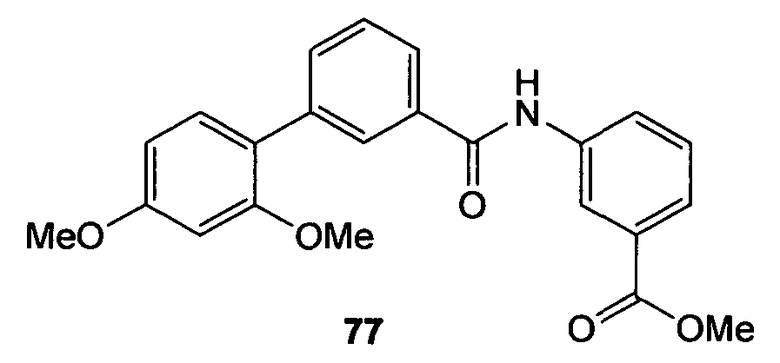
Метиловый эфир 3-[(2',4'-диметоксибифенил-3-карбонил)амино]бензойной кислоты (77) синтезируют согласно методике, описанной в стадии 1 примера 8, исходя из метилового эфира 3-аминобензойной кислоты и 2',4'-диметоксибифенил-3-карбонилхлорида (54), и выделяют в виде бесцветного масла (143 мг, 73%). 1H ЯМР (400 МГц, CDCl3): 3,80 (с, 3H); 3,85 (с, 3H); 3,91 (с, 3H); 6,57 (с, 1H); 6,58 (дд, 1H, J1=8,1 Гц, J2=2,3 Гц); 7,26 (д, 1H, J=8,1 Гц); 7,45 (т, 1H, J=7,8 Гц); 7,50 (т, 1H, J=7,8 Гц); 7,68 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,78 (ддд, 1H, J1=7,8 Гц, J2=1,8 Гц, J3=1,3H); 7,81 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,88 (ушир.с, 1H); 7,97 (т, 1H, J=1,8 Гц); 8,04 (ддд, 1H, J1=8,1 Гц, J2=2,3 Гц, J3=1,0 Гц); 8,13 (т, 1H, J=1,8 Гц).
ПРИМЕР 20
3-[(2',4'-Диметоксибифенил-3-карбонил)амино]бензойная кислота (78)
Схема 34
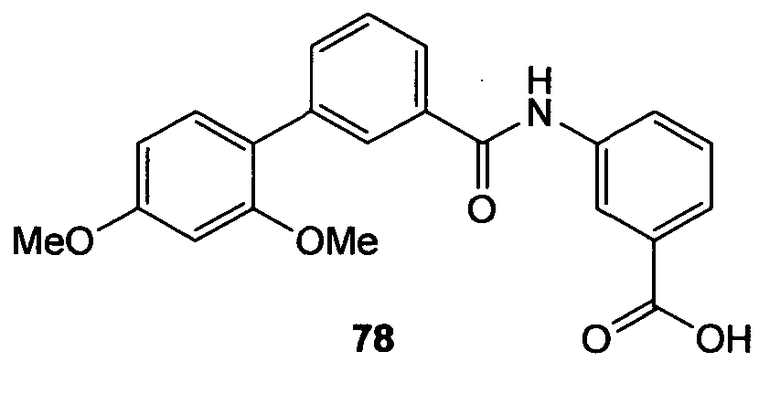
Омыление метилового эфира карбоновой кислоты (77) в MeCN согласно методике, описанной в стадии 2 примера 8, дает 3-[(2',4'-диметоксибифенил-3-карбонил)амино]бензойную кислоту (78) в виде белого твердого вещества (109 мг, 80%). 1H ЯМР (400 МГц, (CD3)2SO): 3,77 (с, 3H); 3,81 (с, 3H); 6,65 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,69 (д, 1H, J=2,3 Гц); 7,32 (д, 1H, J=8,3 Гц); 7,45 (т, 1H, J=7,8 Гц); 7,52 (т, 1H, J=7,8 Гц); 7,66 (ушир.д, 2H, J=7,6 Гц); 7,87 (дт, 1H, J1=7,8 Гц, J2=1,5 Гц); 8,00-8,05 (м, 1H); 8,01 (т, 1H, J=1,5 Гц); 8,38 (ушир.с, 1H); 10,39 (с, 1H).
ПРИМЕР 21
3-[(2',4'-Дигидроксибифенил-3-карбонил)амино]бензойная кислота (79)
Схема 35
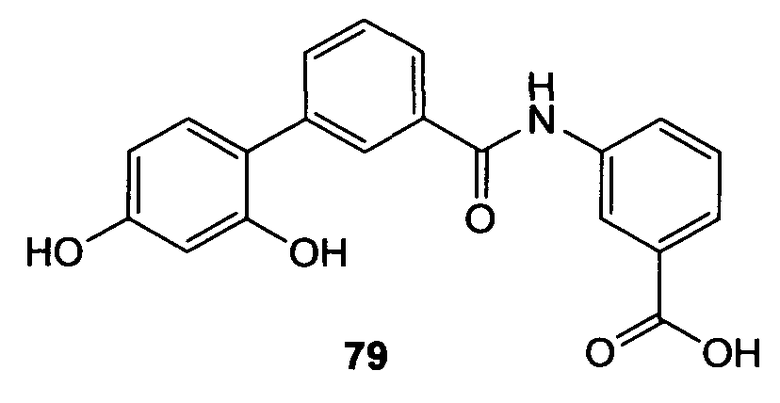
Согласно методике, описанной в примере 12, реакция карбоновой кислоты (78) с 1М раствором BBr3 дает 3-[(2',4'-дигидроксибифенил-3-карбонил)амино]бензойную кислоту (79) в виде не совсем белого твердого вещества (19 мг, 26%). 1H ЯМР (400 МГц, (CD3OD): 6,45 (дд, 1H, J1=8,1 Гц, J2=2,3 Гц); 6,46 (с, 1H); 7,22 (д, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,44 (т, 1H, J=7,8 Гц); 7,53 (т, 1H, J=7,8 Гц); 7,77-7,82 (м, 2H); 7,85 (д, 1H, J=7,8 Гц); 8,04 (д, 1H, J=8,1 Гц); 8,10-8,15 (м, 1H); 8,12 (т, 1H, J=1,8 Гц).
ПРИМЕР 22
Метиловый эфир (5-{2-[(3',5'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (80)
Схема 36
Метиловый эфир (5-{2-[(3',5'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (80) синтезируют согласно методике, описанной в стадии 1 примера 8, исходя из анилина (43) и 3',5'-диметоксибифенил-3-карбонилхлорида (60). В отличие от методики очистки, описанной здесь, сырой продукт (80) суспендируют в EtOAc, фильтруют и фильтровальный осадок промывают EtOAc (2 раза). Соединение (80) получают в виде желтого твердого вещества (187 мг, 68%). 1H ЯМР (400 МГц, CDCl3): 3,71 (с, 3H); 3,84 (с, 6H); 3,87 (с, 2H); 6,48 (т, 1H, J=2,3 Гц); 6,69 (д, 2H, J=2,3 Гц); 6,99-7,02 (м, 1H); 7,03 (д, 1H, J=3,5 Гц); 7,17 (дд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,39-7,44 (м, 2H); 7,50 (т, 1H, J=7,8 Гц); 7,68-7,73 (м, 2H); 7,90-7,94 (м, 1H); 8,43 (с, 1H); 8,53 (д, 1H, J=7,6 Гц).
ПРИМЕР 23
(5-{2-[(3',5'-Диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусная кислота (81)
Схема 37
Омыление метилового эфира карбоновой кислоты (80) в MeCN согласно методике, описанной выше в стадии 2 примера 8, дает (5-{2-[(3',5'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусную кислоту (81) в виде желтого твердого вещества (188 мг, количественный выход). 1H ЯМР (400 МГц, CD3OD): 3,83 (с, 2H); 3,89 (ушир.с, 6H); 6,56 (т, 1H, J=2,3 Гц); 6,86 (д, 2H, J=1,8 Гц); 6,97-7,00 (м, 1H); 7,19 (д, 1H, J=3,5 Гц); 7,38 (тд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,44 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,61 (т, 1H, J=7,8 Гц); 7,64 (дд, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,72-7,76 (м, 1H); 7,84-7,87 (м, 1H); 7,90-7,94 (м, 1H); 8,16 (ушир.с, 1H).
ПРИМЕР 24
(5-{2-[(3',5'-Дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусная кислота (82)
Схема 38
Согласно методике, описанной выше в примере 12, реакция карбоновой кислоты (81) с 1М раствором BBr3 дает (5-{2-[(3',5'-дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусную кислоту (82) в виде светло-желтого твердого вещества (33 мг, 35%). 1H ЯМР (400 МГц, CD3OD): 3,87 (с, 2H); 6,34 (т, 1H, J=2,0 Гц); 6,63 (д, 2H, J=2,0 Гц); 7,01 (д, 1H, J=3,5 Гц); 7,20 (д, 1H, J=3,5 Гц); 7,38 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,44 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,58 (т, 1H, J=7,8 Гц); 7,64 (дд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,74 (д, 1H, J=7,8 Гц); 7,79 (дд, 1H, J1=7,8 Гц, J2=1,0 Гц); 7,89 (д, 1H, J=7,6 Гц); 8,10 (с, 1H).
ПРИМЕР 25
Метиловый эфир 5-{2-[(3',5'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновой кислоты (83)
Схема 39
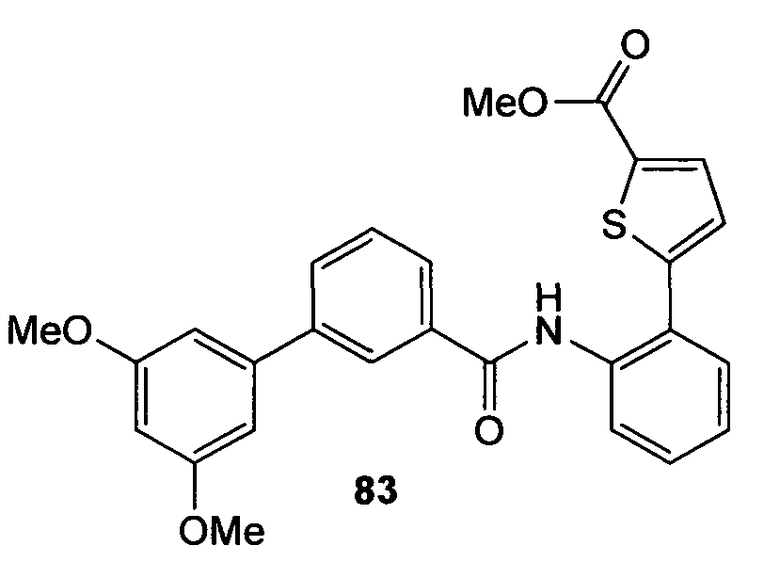
Метиловый эфир (5-{2-[(3',5'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновой кислоты (83) синтезируют согласно методике, описанной в стадии 1 примера 8, исходя из анилина (45) и хлорангидрида карбоновой кислоты (60). В отличие от методики очистки, описанной здесь, сырой продукт (80) суспендируют в EtOAc, фильтруют и фильтровальный осадок промывают EtOAc (2 раза). Соединение (83) получают в виде желтого твердого вещества (168 мг, 63%). 1H ЯМР (400 МГц, CDCl3): 3,84 (с, 6H); 3,87 (с, 3H); 6,48 (т, 1H, J=2,0 Гц); 6,89 (д, 2H, J=2,0 Гц); 7,20 (д, 1H, J=3,8 Гц); 7,21-7,25 (м, 1H); 7,43 (тд, 1H, J1=7,8 Гц, J2=1,5 Гц); 7,47 (т, 1H, J=7,8 Гц); 7,49 (т, 1H, J=7,8 Гц); 7,65 (д, 1H, J=7,8 Гц); 7,72 (дд, 1H, J1=7,8 Гц, J2=1,0 Гц); 7,84 (д, 1H, J=3,8 Гц); 7,97 (д, 1H, J=1,5 Гц); 8,22 (с, 1H); 8,46 (д, 1H, J=7,8 Гц).
ПРИМЕР 26
5-{2-[(3',5'-Диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновая кислота (84)
Схема 40
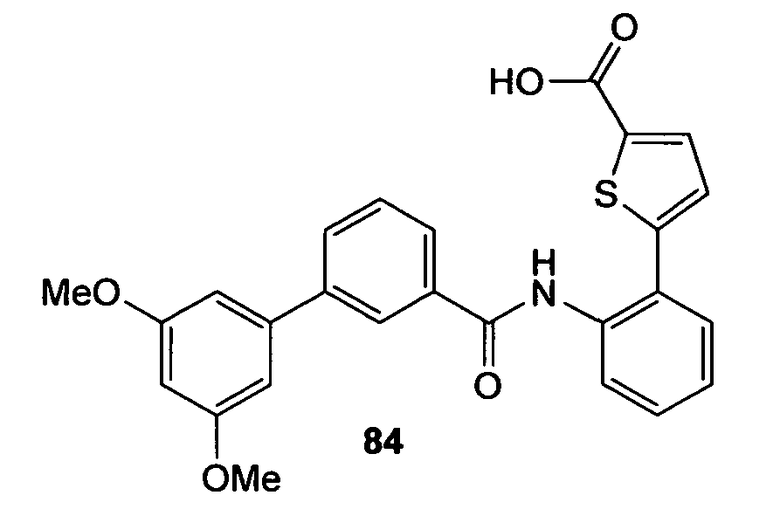
Омыление метилового эфира карбоновой кислоты (83) в MeCN согласно методике, описанной выше в стадии 2 примера 8, дает (5-{2-[(3',5'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновую кислоту (84) в виде белого твердого вещества (159 мг, 97%). 1H ЯМР (400 МГц, CD3OD): 3,88 (с, 6H); 6,55 (т, 1H, J=2,0 Гц); 6,86 (ушир.с, 2H); 7,38 (д, 1H, J=3,8 Гц); 7,46 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,52 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,58-7,65 (м, 2H); 7,71-7,74 (м, 1H); 7,75 (д, 1H, J=3,8 Гц); 7,87 (дд, 1H, J1=7,8 Гц, J2=1,0 Гц); 7,91-7,96 (м, 1H); 8,19 (с, 1H).
ПРИМЕР 27
5-{2-[(3',5'-Дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновая кислота (85)
Схема 41
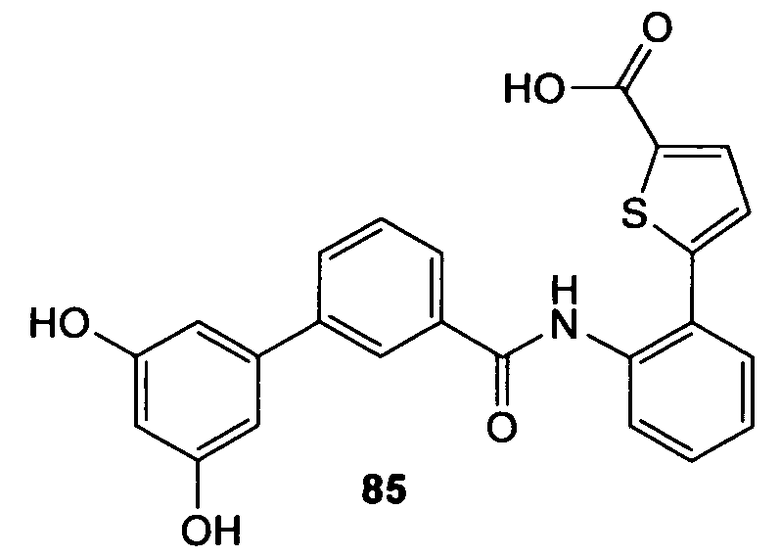
Согласно методике, описанной выше в примере 12, реакция карбоновой кислоты (84) с 1М раствором BBr3 дает (5-{2-[(3',5'-дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-карбоновую кислоту (85) в виде белого твердого вещества (24 мг, 50%). 1H ЯМР (400 МГц, CD3OD): 6,33 (т, 1H, J=2,0 Гц); 6,66 (д, 2H, J=2,0 Гц); 7,38 (д, 1H, J=4,0 Гц); 7,46 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,52 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,58 (т, 1H, J=7,6 Гц); 7,63 (д, 1H, J=7,6 Гц); 7,73 (дд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,75 (д, 1H, J=4,0); 7,80 (д, 1H, J=7,8 Гц); 7,87-7,91 (м, 1H); 8,16 (с, 1H).
ПРИМЕР 28
(2-Тиофен-2-илфенил)амид 2',4'-диметоксибифенил-3-карбоновой кислоты (86)
Схема 42
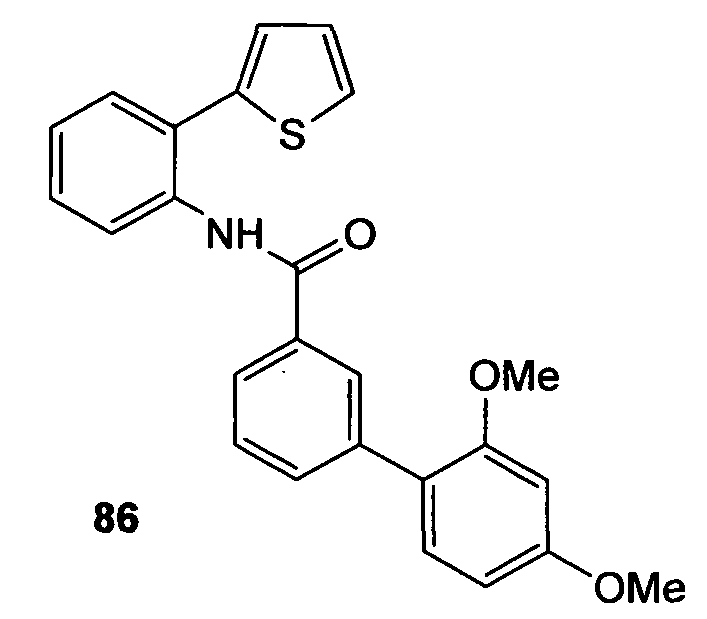
(2-Тиофен-2-илфенил)амид 2',4'-диметоксибифенил-3-карбоновой кислоты (86) синтезируют согласно методике, описанной выше в стадии 1 примера 8, исходя из анилина (48) и 2',4'-диметоксибифенил-3-карбонилхлорида (54), и выделяют в виде светло-желтого твердого вещества (159 мг, 58%). 1H ЯМР (400 МГц, C6D6): 3,27 (с, 3H); 3,50 (с, 3H); 6,52 (дд, 1H, J1=8,3 Гц, J2=2,5 Гц); 6,58 (д, 1H, J=2,5 Гц); 6,76 (дд, 1H, J1=5,0 Гц, J2=3,5 Гц); 6,87 (дд, 1H, J1=3,5 Гц, J2=1,3 Гц); 6,92 (дд, 1H, J1=5,0 Гц, J2=1,3 Гц); 6,98 (тд, 1H, J1=7,6 Гц, J2=1,3 Гц); 7,23 (т, 1H, J=7,6 Гц); 7,28-7,33 (м, 1H); 7,39 (дд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,71 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,77 (ддд, 1H, J1=7,8 Гц, J2=1,5 Гц, J3=1,3 Гц); 8,28 (т, 1H, J=1,5 Гц); 8,46 (ушир.с, 1H); 9,18 (д, 1H, J=8,3 Гц).
ПРИМЕР 29
(2-Тиофен-2-илфенил)амид 2',4'-дигидроксибифенил-3-карбоновой кислоты (87)
Схема 43
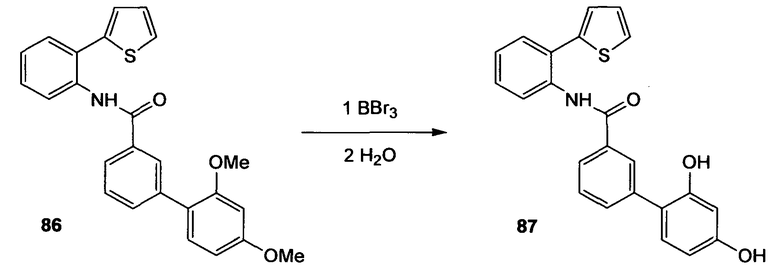
(Нижеследующую реакцию проводят в атмосфере N2). (2-Тиофен-2-илфенил)амид 2',4'-диметоксибифенил-3-карбоновой кислоты (86) (122 мг, 0,29 ммоль) суспендируют в безводном дихлорметане (9,7 мл), смесь охлаждают до -78°С и по каплям добавляют 1М раствор BBr3 в дихлорметане (1,17 мл, 1,17 ммоль). Реакционную смесь перемешивают в течение 30 мин при -78°С, медленно нагревают до 0°С (на протяжении периода 2 ч) и перемешивают дополнительно 30 мин при 0°С. Медленно добавляют ледяную воду, смесь перемешивают 1 ч при комнатной температуре для завершения реакции, слои разделяют и водный слой экстрагируют EtOAc (3 раза). Объединенный органический слой промывают насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают препаративной ОФ-ВЭЖХ (градиент, вода/CH3CN, 95:5 - 5:95), получая при этом (2-тиофен-2-илфенил)амид 2',4'-дигидроксибифенил-3-карбоновой кислоты (87) в виде не совсем белого твердого вещества (35 мг, 31%). 1H ЯМР (400 МГц, CD3OD): 6,41-6,46 (м, 2H); 7,14 (дд, 1H, J1=5,0 Гц, J2=3,5 Гц); 7,17 (д, 1H, J=8,1 Гц); 7,36 (дд, 1H, J1=3,5 Гц, J2=1,0 Гц); 7,39 (дд, 1H, J1=7,6 Гц, J2=1,0 Гц); 7,45 (тд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,47-7,49 (м, 1H); 7,50 (т, 1H, J=7,8 Гц); 7,65 (дд, 1H, J1=7,6 Гц, J2=1,5 Гц); 7,72 (д, 1H, J=7,8 Гц); 7,75-7,81 (м, 2H); 8,06 (с, 1H).
ПРИМЕР 30
Метиловый эфир (5-{3-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (88)
Схема 44
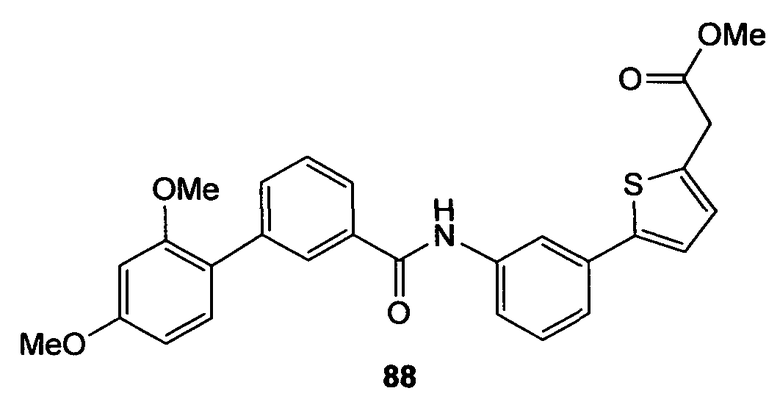
Метиловый эфир (5-{3-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (88) синтезируют согласно методике, описанной выше в стадии 1 примера 8, за время реакции 3 ч, исходя из анилина (50) и хлорангидрида карбоновой кислоты (54), и выделяют в виде желтого твердого вещества (213 мг, 87%). 1H ЯМР (400 МГц, CDCl3): 3,73 (с, 3H); 3,80 (с, 3H); 3,83 (с, 2H); 3,85 (с, 3H); 6,57 (с, 1H); 6,58 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,89 (д, 1H, J=3,5 Гц); 7,18 (д, 1H, J=3,5 Гц); 7,27 (д, 1H, J=8,3 Гц); 7,32-7,37 (м, 2H); 7,50 (т, 1H, J=7,6 Гц); 7,54-7,58 (м, 1H); 7,68 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,79 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,79-7,82 (м, 1H); 7,86 (т, 1H, J=1,3 Гц); 7,97 (т, 1H, J=1,5 Гц).
ПРИМЕР 31
(5-{3-[(2',4'-Диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусная кислота (89)
Схема 45
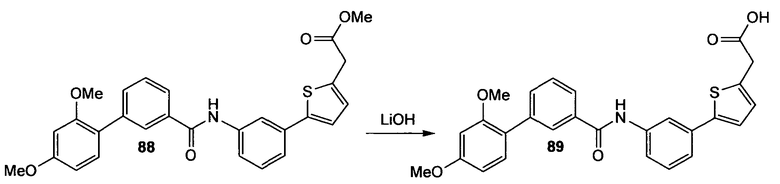
Метиловый эфир (5-{3-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусной кислоты (88) (190 мг, 0,39 ммоль) растворяют в MeCN (3,9 мл), добавляют 1М водный LiOH (1,9 мл, 1,9 ммоль) и смесь перемешивают 16 ч при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении и добавляют 1М водный HCl (приблизительно 2 мл, для достижения рН приблизительно 3). Добавляют EtOAc и воду и отделенный водный слой экстрагируют несколько раз EtOAc. Объединенный органический слой промывают насыщенным раствором соли и сушат его Na2SO4, получая при этом (5-{3-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусную кислоту (89) в виде оранжевого твердого вещества (185 мг, количественный выход). Дополнительную очистку не применяют. 1H ЯМР (400 МГц, CD3CN): 3,81 (с, 3H); 3,84 (с, 3H); 3,85 (с, 2H); 6,64 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,66 (д, 1H, J=2,3 Гц); 6,94 (д, 1H, J=3,5 Гц); 7,25 (д, 1H, J=3,5 Гц); 7,33 (д, 1H, J=8,3 Гц); 7,36-7,41 (м, 2H); 7,52 (т, 1H, J=7,8 Гц); 7,67-7,71 (м, 2H); 7,85 (д, 1H, J=7,8 Гц); 8,02 (ушир.с, 2H); 8,80 (с, 1H).
ПРИМЕР 32
(5-{3-[(2',4'-Дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусная кислота (90)
Схема 46
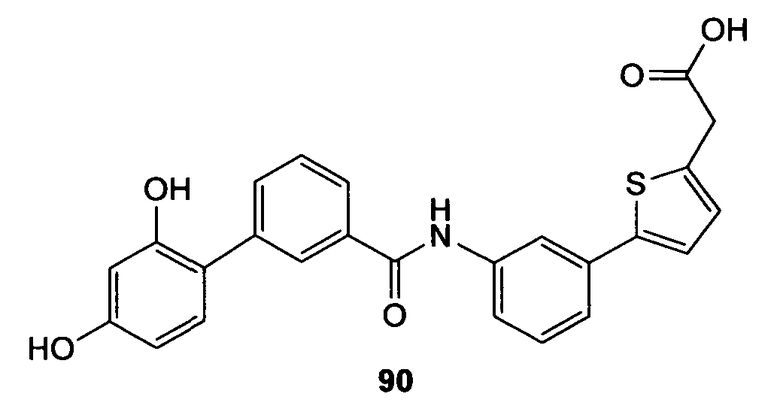
Согласно методике, описанной выше в примере 12, реакция карбоновой кислоты (89) с 1М раствором BBr3 дает (5-{3-[(2',4'-дигидроксибифенил-3-карбонил)амино]фенил}тиофен-2-ил)уксусную кислоту (90) в виде желто-коричневого твердого вещества (1,2 мг, 1,3%). 1H ЯМР (400 МГц, CD3OD): 3,89 (с, 2H); 6,45 (дд, 1H, J1=8,1 Гц, J2=2,3 Гц); 6,46 (с, 1H); 6,97 (д, 1H, J=3,5 Гц); 7,22 (д, 1H, J=8,1 Гц); 7,30 (д, 1H, J=3,5 Гц); 7,40 (т, 1H, J=7,6 Гц); 7,41-7,45 (м, 1H); 7,54 (т, 1H, J=7,6 Гц); 7,67 (д, 1H, J=7,3 Гц); 7,80 (д, 1H, J=7,8 Гц); 7,85 (д, 1H, J=7,8 Гц); 8,07 (с, 1H); 8,12 (с, 1H).
ПРИМЕР 33
Метиловый эфир 5-{6-[(2',4'-диметоксибифенил-3-карбонил)амино]пиридин-3-ил}-2-метилфуран-3-карбоновой кислоты (91) и 5-{6-[(2',4'-дигидроксибифенил-3-карбонил)амино]пиридин-3-ил}-2-метилфуран-3-карбоновая кислота (93)
Схема 47
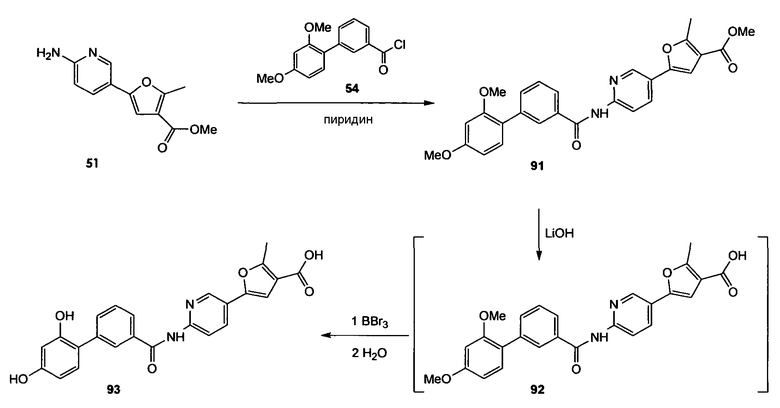
Стадия 1. (Нижеследующую реакцию проводят в атмосфере N2). Метиловый эфир 5-(6-аминопиридин-3-ил)-2-метилфуран-3-карбоновой кислоты (51) (80,0 мг, 0,34 ммоль) растворяют в безводном дихлорметане (5,4 мл) и безводном пиридине (1,2 мл) и реакционную смесь охлаждают до 0°С. Медленно добавляют суспензию 2',4'-диметоксибифенил-3-карбонилхлорида (54) (105 мг, 0,38 ммоль) в дихлорметане (3,0 мл) и реакционную смесь перемешивают в течение 1 ч при 0°С и 19 ч при комнатной температуре. Реакционную смесь разделяют между водой и EtOAc и водный слой экстрагируют EtOAc (3×). Объединенный органический слой промывают водой (6 раз) для удаления пиридина и насыщенным раствором соли и сушат Na2SO4. Сырой продукт очищают препаративной радиальной хроматографией (силикагель, 60PF, CyH/EtOAc, 2+1), получая при этом метиловый эфир 5-{6-[(2',4'-диметоксибифенил-3-карбонил)амино]пиридин-3-ил}-2-метилфуран-3-карбоновой кислоты (91) в виде не совсем белого твердого вещества (74 мг, 45%). 1H ЯМР (400 МГц, CDCl3): 2,65 (с, 3H); 3,80 (с, 3H); 3,84 (с, 3H); 3,85 (с, 3H); 6,57 (с, 1H); 6,58 (дд, 1H, J1=8,1 Гц, J2=2,5 Гц); 6,89 (с, 1H); 7,26 (д, 1H, J=8,1 Гц); 7,51 (т, 1H, J=7,6 Гц); 7,70 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,84 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,97 (дд, 1H, J1=8,8 Гц, J2=2,3 Гц); 8,03 (т, 1H, J=1,5 Гц); 8,45 (д, 1H, J=8,8 Гц); 8,57 (д, 1H, J=2,3 Гц); 8,70 (ушир.с, 1H).
Стадия 2. Метиловый эфир 5-{6-[(2',4'-диметоксибифенил-3-карбонил)амино]пиридин-3-ил}-2-метилфуран-3-карбоновой кислоты (91) (67,1 мг, 0,14 ммоль) растворяют в ТГФ (3 мл) и МеОН (0,5 мл) и добавляют 1М водный LiOH (0,71 мл, 0,71 ммоль). Реакционную смесь перемешивают 16 ч при комнатной температуре. Растворители удаляют при пониженном давлении и остаток растворяют в смеси ТГФ/ацетонитрил (2+1). Добавляют амберлит IRC86 и смесь перемешивают дополнительно 2 ч при комнатной температуре. Удаляют супернатант и оставшуюся смолу перемешивают несколько раз (10 мин каждый раз) с новыми порциями ТГФ и ацетонитрила. Собранные супернатанты концентрируют при пониженном давлении, получая при этом сырую 5-{6-[(2',4'-диметоксибифенил-3-карбонил)амино]пиридин-3-ил}-2-метилфуран-3-карбоновую кислоту (92) в виде светло-желтого твердого вещества (87 мг, количественный выход) без дополнительной очистки. 1H ЯМР (400 МГц, (CD3)2SO): 2,61 (с, 3H); 3,77 (с, 3H); 3,81 (с, 3H); 6,65 (дд, 1H, J1=8,6 Гц, J2=2,5 Гц); 6,68 (д, 1H, J=2,5 Гц); 7,19 (с, 1H); 7,38 (д, 1H, J=8,3 Гц); 7,50 (т, 1H, J=7,8 Гц); 7,68 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,91 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 8,05 (т, 1H, J=1,5 Гц); 8,13 (дд, 1H, J1=8,8 Гц, J2=2,3 Гц); 8,27 (д, 1H, J=8,8 Гц); 8,75 (д, 1H, J=1,3 Гц); 11,00 (с, 1H); 12,69 (ушир.с, 1H).
Стадия 3. (Нижеследующую реакцию проводят в атмосфере N2). Кислоту (92) (63,9 мг, 0,14 ммоль) растворяют в смеси безводного 1,2-дихлорэтана (4,0 мл) и безводного дихлорметана (1,0 мл), раствор охлаждают до -50°С и по каплям добавляют 1М раствор BBr3 в дихлорметане (0,70 мл, 0,70 ммоль). Реакционную смесь перемешивают в течение 30 мин при -78°С и после удаления охлаждающей бани в течение дополнительных 1,5 ч при комнатной температуре. Смесь охлаждают до 0°С, по каплям добавляют воду и образовавшуюся смесь перемешивают 30 мин при комнатной температуре. Смесь концентрируют при пониженном давлении и сырой продукт очищают препаративной ОФ-ВЭЖХ (градиент, вода/CH3CN, 95:5 - 5:95), получая при этом 5-{6-[(2',4'-дигидроксибифенил-3-карбонил)амино]пиридин-3-ил}-2-метилфуран-3-карбоновую кислоту (93) (18 мг, 30%) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, CD3OD): 2,70 (с, 3H); 6,45 (дд, 1H, J1=7,8 Гц, J2=2,3 Гц); 6,47 (с, 1H); 7,09 (ушир.с, 1H); 7,22 (дд, 1H, J1=7,8 Гц, J2=1,0 Гц); 7,56 (т, 1H, J=7,8 Гц); 7,82 (д, 1H, J=7,8 Гц); 7,88 (д, 1H, J=7,6 Гц); 8,15 (ушир.с, 2H); 8,36 (ушир.д, 1H, J=7,8 Гц); 8,72 (ушир.с, 1H).
ПРИМЕР 34
Этиловый эфир 5-{4-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}-2-метилфуран-3-карбоновой кислоты (94)
Схема 48
Этиловый эфир 5-{4-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}-2-метилфуран-3-карбоновой кислоты (94) синтезируют согласно методике, описанной выше в стадии 1 примера 8, исходя из анилина (25) и хлорангидрида карбоновой кислоты (54), и выделяют в виде желтого твердого вещества (190 мг, 64%). 1H ЯМР (400 МГц, C6D6): 1,17 (т, 3H, J=7,1 Гц); 2,59 (с, 3H); 3,32 (с, 3H); 3,50 (с, 3H); 4,24 (кв, 2H, J=7,1 Гц); 6,55 (дд, 1H, J1=8,3 Гц, J2=2,3 Гц); 6,62 (д, 1H, J=2,3 Гц); 7,05 (с, 1H); 7,32 (д, 1H, J=8,3 Гц); 7,25-7,34 (м, 2H); 7,61 (д, 2H, J=9,0 Гц); 7,65 (д, 2H, J=9,0 Гц); 7,71 (д, 1H, J=7,8 Гц); 7,77 (д, 1H, J=7,8 Гц); 8,82 (с, 1H).
ПРИМЕР 35
5-{4-[(2',4'-Диметоксибифенил-3-карбонил)амино]фенил}-2-метилфуран-3-карбоновая кислота (95)
Схема 49
Омыление метилового эфира карбоновой кислоты (94) в смеси ТГФ и МеОН (2+1) согласно методике, описанной выше в примере 31, дает 5-{4-[(2',4'-диметоксибифенил-3-карбонил)амино]фенил}-2-метилфуран-3-карбоновую кислоту (95) в виде не совсем белого твердого вещества (137 мг, количественный выход). 1H ЯМР (400 МГц, (CD3)2SO): 2,60 (с, 3H); 3,78 (с, 3H); 3,82 (с, 3H); 6,66 (дд, 1H, J1=8,3 Гц, J2=2,2 Гц); 6,70 (д, 1H, J=2,2 Гц); 7,00 (с, 1H); 7,32 (д, 1H, J=8,3 Гц); 7,53 (т, 1H, J=7,8 Гц); 7,66 (д, 1H, J=8,6 Гц); 7,69 (д, 2H, J=8,6 Гц); 7,86 (д, 3H, J=8,6 Гц); 7,99 (с, 1H); 7,99 (с, 1H); 10,34 (с, 1H).
ПРИМЕР 36
5-{4-[(2',4'-Дигидроксибифенил-3-карбонил)амино]фенил}-2-метилфуран-3-карбоновая кислота (96)
Схема 50
Согласно методике, описанной выше в примере 12, реакция карбоновой кислоты (95) с 1М раствором BBr3 дает 5-{4-[(2',4'-дигидроксибифенил-3-карбонил)амино]фенил}-2-метилфуран-3-карбоновую кислоту (96) в виде светло-желтого твердого вещества (24 мг, 32%). 1H ЯМР (400 МГц, CD3OD): 2,67 (с, 3H); 5,43-6,47 (м, 1H) 6,46 (с, 1H); 6,95 (с, 1H); 7,21 (д, 1H, J=8,6 Гц); 7,53 (т, 1H, J=7,7 Гц); 7,71 (д, 2H, J=8,8 Гц); 7,78-7,85 (м, 2H); 7,81 (д, 2H, J=8,8 Гц); 8,11 (с, 1H).
ПРИМЕР 37
(3-Трифторметилфенил)амид 2',4'-диметоксибифенил-3-карбоновой кислоты (97)
Схема 51
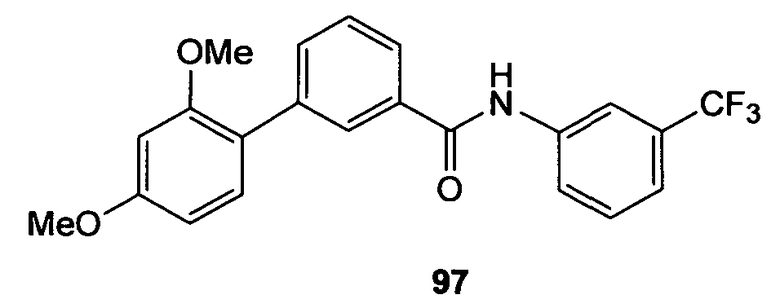
(3-Трифторметилфенил)амид 2',4'-диметоксибифенил-3-карбоновой кислоты (97) синтезируют согласно методике, описанной выше в стадии 1 примера 8, исходя из 3-трифторметилфениламина и хлорангидрида карбоновой кислоты (54), и выделяют в виде желтого масла (32 мг, 31%). 1H ЯМР (400 МГц, CDCl3): 3,80 (с, 3H); 3,85 (с, 3H); 6,56-6,60 (м, 1H); 6,57 (с, 1H); 7,26 (д, 1H, J=8,6 Гц); 7,39 (д, 1H, J=7,6 Гц); 7,47 (т, 1H, J=7,8 Гц); 7,50 (т, 1H, J=7,8 Гц); 7,69 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,77 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,84 (д, 1H, J=7,8 Гц); 7,88 (ушир.с, 1H); 7,94 (с, 1H); 7,96 (т, 1H, J=1,5 Гц).
ПРИМЕР 38
(3-Трифторметилфенил)амид 2',4'-дигидроксибифенил-3-карбоновой кислоты (98)
Схема 52
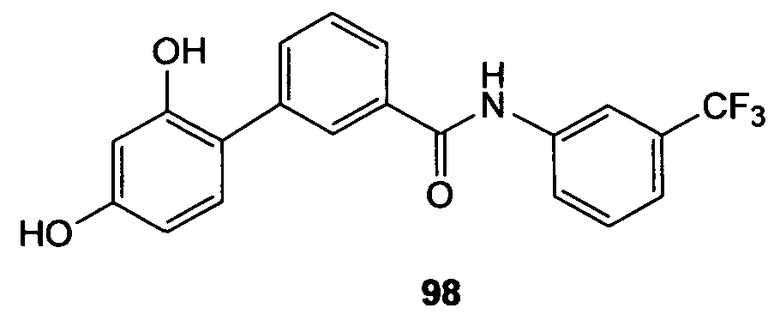
Согласно методике, описанной выше в примере 12, реакция (3-трифторметилфенил)амида 2',4'-диметоксибифенил-3-карбоновой кислоты (97) с 1М раствором BBr3 дает (3-трифторметилфенил)амид 2',4'-дигидроксибифенил-3-карбоновой кислоты (98) в виде коричневого твердого вещества (27 мг, 72%). 1H ЯМР (400 МГц, CD3OD): 6,45 (дд, 1H, J1=8,3 Гц, J2=2,5 Гц); 6,46 (с, 1H); 7,21 (дд, 1H, J1=8,6 Гц, J2=1,3 Гц); 7,47 (д, 1H, J=7,8 Гц); 7,54 (т, 1H, J=7,8 Гц); 7,59 (т, 1H, J=8,0 Гц); 7,81 (дт, 1H, J1=7,8 Гц, J2=1,3 Гц); 7,85 (ддд, 1H, J1=7,8 Гц, J2=1,7 Гц, J3=1,0 Гц); 7,99 (д, 1H, J=7,8 Гц); 8,12 (т, 1H, J=1,7 Гц); 8,21 (с, 1H).
Соединения, указываемые в нижеследующей схеме 12, являются соединениями, конкретно называемыми здесь предпочтительными соединениями.
Схема 12
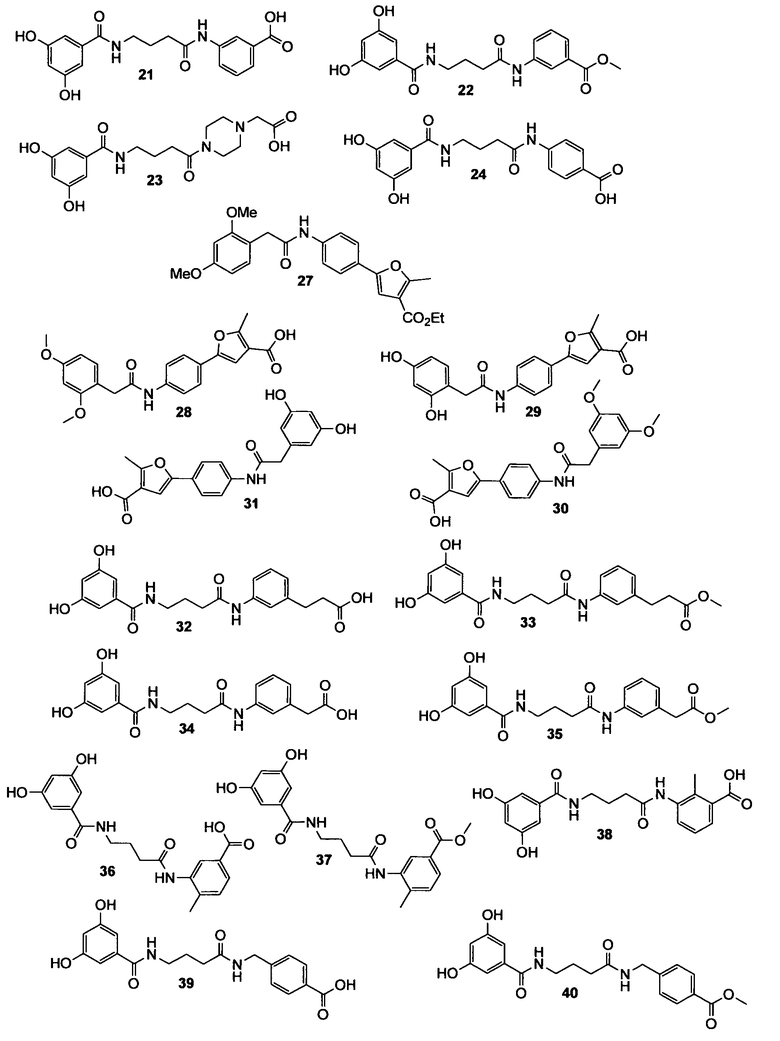
Анализ сиалил-Lewis X -тирозинсульфата (sLe X -TSA)
Соединения настоящего изобретения анализируют на молекулярном уровне на их способность ингибировать связывание химерных молекул Р-, L- или Е-селектина с sLeX и тирозинсульфатными остатками, связанными с полимерной матрицей как PSGL-1-замещение. Определяют выбранные величины IC50.
Титрационные микропланшеты выдерживают для покрытия на протяжении ночи в карбонатном буфере, рН 9,6, козьим антителом к Fc-mAB человека (10 мкг/мл). После промывания в буфере для анализа (25 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES), 150 мМ NaCl, 1 мМ CaCl2, рН 7,4) и блокирования (3% бычий сывороточный альбумин (BSA) в буфере для анализа) планшеты инкубируют в течение 2 ч при 37°С с химерами Р-селектин-IgG человека (0,61 нМ, соответственно 150 нг/мл), или химерами L-селектин-IgG человека (0,61 нМ, соответственно 89 нг/мл), или химерами Е-селектин-IgG человека (0,61 нМ, соответственно 131 нг/мл). Образуют комплекс 5 мкл sLeX-тирозинсульфат-полиакриламида (1 мг/мл), содержащего 15% sLex, 10% тирозинсульфата и 5% биотина, при помощи 20 мкл раствора стрептавидин-пероксидаза (1 мг/мл) и 25 мкл буфера для анализа без CaCl2. Для применения в анализе комплекс лиганда разводят как 1:10000 в буфере для анализа и далее разводят как 1:1 варьируемыми количествами соединений в буфере для анализа, включающем 2% ДМСО. Эту смесь добавляют к лункам, предварительно покрытым Е- или Р-селектином. После инкубации в течение 2 ч при 37°С лунки промывают шесть раз в буфере для анализа, включающем 0,005% монолаурата полиоксиэтиленсорбитана (твин 20), проявляют в течение 10-15 мин 20 мкл раствора субстрата 3,3',5,5'-тетраметилбензидин (ТМВ)/Н2О2 и реакцию останавливают 20 мкл 1М H2SO4. Связанный комплекс лиганда sLex-тирозинсульфат определяют измерением оптической плотности при 450 нм по сравнению с 620 нм в планшет-ридере Fusion alpha-FP (приобретен у Packard Bioscience, Dreieich, Germany).
[% ингиб.]
[% ингиб.]
[% ингиб.]
Анализ в проточной камере/адгезия и прокатывание клеток в условиях потока
Для определения способности соединений ингибировать связывание клеток в динамических условиях, похожих на кровоток в кровеносном сосуде, в проточной камере проводят анализы, адресованные связыванию/тестирующие связывание клеток HL-60/различных клеточных линий с химерными молекулами Р-селектина, L-селектина и Е-селектина.
Прикрепление клеток в условиях потока определяют с применением системы параллельных проточных камер. Полистирольную чашку для культивирования 35 мм покрывают на 1 час при комнатной температуре буфером для сенсибилизации поверхности (50 мМ трис(гидроксиметил)аминометановый буфер (трис), 150 мМ NaCl, 2 мМ CaCl2; рН 7,4), содержащим химеры Е- или Р-селектин-IgG человека при концентрациях 2,5 мкг/мл или 10 мкг/мл соответственно. После удаления раствора для покрытия сайты неспецифического связывания блокируют в течение дополнительного часа 1% BSA в буфере для сенсибилизации поверхности при комнатной температуре. После промывания буфером для анализа (“Roswell Park Memorial Institute 1640” (RPMI 1640) + 10 мМ HEPES) чашку вставляют в камеру с параллельными ламинарными потоками (приобретена у Glycotech, Rockville, MD) и устанавливают на инвертированный фазово-контрастный микроскоп (приобретен у Olympus, Hamburg, Germany), оснащенный камерой CCD (JVC), которая соединена с РС. С применением перистальтического насоса (приобретен у Ismatec, Wertheim-Mondfeld, Germany) рециркулирующую систему уравновешивают буфером для анализа, содержащим 125 мкМ соединение или наполнитель-контроль (ДМСО). В камеру добавляют клетки (1 миллион/мл) и позволяют им распределиться в течение 2 минут при высокой скорости течения. Скорость течения затем снижают, что приводит к рассчитанному сдвигу потока 1 дина/см2. Видеопоследовательности 10 низких силовых полей регистрируют цифровым образом после 5 минут непрерывного течения. Процент ингибирования вычисляют из среднего числа клеток на поле, которые прилипли к поверхности покрытой чашки в присутствии соединения в сравнении с отсутствием соединения в независимых экспериментах.
Данные анализа в проточной камере для Е- и Р-селектина
Величины даны как нормализованные отношения в виде % ингибирования соединения, деленного на % ингибирования бимосиамозы.
[Отношение]
[Отношение]
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ ФЛОРОГЛЮЦИНА, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ЛИГАНДА СЕЛЕКТИНА | 2006 |
|
RU2418584C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ НИТРОКАТЕХОЛА, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В КАЧЕСТВЕ ЛИГАНДОВ СЕЛЕКТИНА | 2006 |
|
RU2428979C2 |
| ИНДОЛЫ, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АНДРОГЕНОВЫМИ РЕЦЕПТОРАМИ | 2003 |
|
RU2328484C2 |
| ПРОИЗВОДНЫЕ ПИРАЗИНА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ ATR | 2009 |
|
RU2604066C2 |
| ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2429226C9 |
| ПРОИЗВОДНЫЕ ТАКСАНА, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПО 14-ПОЛОЖЕНИЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2320652C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА | 2004 |
|
RU2346943C2 |
| Пан-геномные ингибиторы белка NS5A вируса гепатита С, фармацевтические композиции, промежуточные продукты для синтеза ингибиторов и способы их получения и применения | 2016 |
|
RU2669919C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2681849C2 |
| ГАЛОГЕНЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2013 |
|
RU2649398C2 |
Фармацевтические композиции, включающие, по меньшей мере, одно соединение формулы (IIIa), или (IIIb), или (IVa), или (IVb), где -Х- и Y такие, как определено в формуле изобретения, или его фармацевтически приемлемые соли, сложные эфиры или амиды и фармацевтически приемлемый носитель, которые можно применять для процессов с модулированием экспрессии Е- и Р-селектина. Технический результат состоит в получении низкомолекулярных негликозидных и непептидных соединений, способных создавать антагонизм опосредуемым селектинами процессам. 8 н. и 3 з.п. ф-лы, 3 табл.




1. Фармацевтические композиции, модулирующие экспрессию Е- и Р-селектина, включающие, по меньшей мере, одно соединение формулы (IIIa), или (IIIb), или (IVa), или (IVb) в эффективном количестве и фармацевтически приемлемый носитель, который является пригодным в медицине,




где символы и заместители имеют нижеследующие значения:
X' представляет собой
(а)
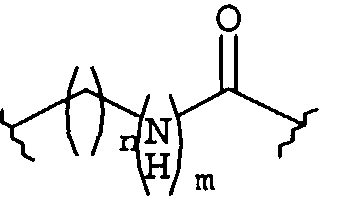
где m равно 0, 1; n равно 1;
(b)
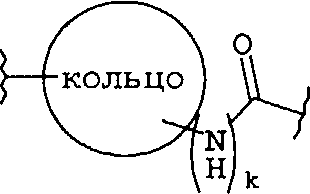
где «кольцо» представляет собой фенил или пиридин
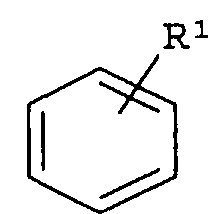
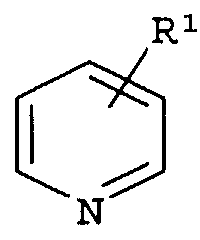
где R1 представляет собой Н, и k равно 0;
(с)

где «кольцо» представляет собой фенил или пиридин
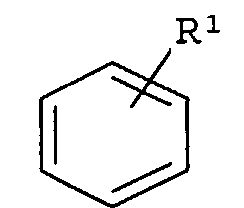

Т представляет собой О; р равно 1;
Y представляет собой
(а)
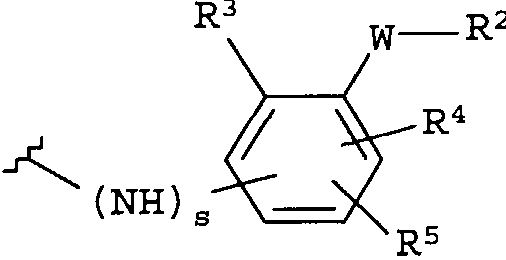
где s равно 1,
R2 представляет собой СО2Н, СО2-алкил, CF3;
где алкил представляет собой одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода,
R3 независимо от R2 представляет собой Н,
R4 независимо от R2 и R3 представляет собой Н,
R5 представляет собой Н,
и W представляет собой -(CH2-)v, где v равно 0, 1;
(е)
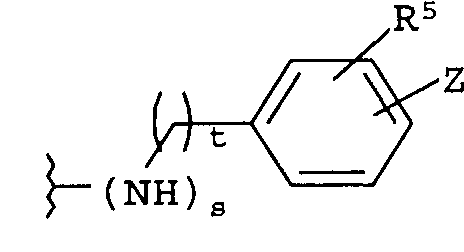
где t равно 0;
s равно 1,
R5 представляет собой Н,
(f)
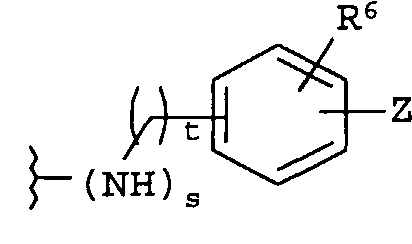
где t равно 0;
s равно 1,
R6 представляет собой Н,
Z представляет собой
(i)
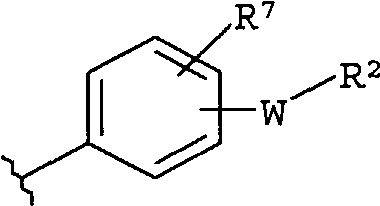
R7 независимо от R2 представляет собой Н, СН3, ОСН3,
W представляет собой -(СН2-)v, где v равно 0, 1,
R2 представляет собой CO2H, СО2-алкил, CF3;
где алкил представляет собой одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода,
(iv)
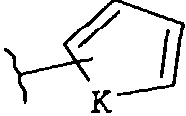
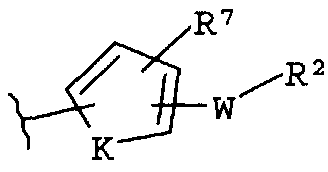
где К представляет собой О, S,
W представляет собой -(CH2-)v, где v равно 0, 1,
R2 представляет собой CO2H, СО2-алкил, CF3;
где алкил представляет собой одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода,
R7 независимо от R2 представляет собой Н, СН3, ОСН3,
или фармацевтически приемлемые соли, сложные эфиры или амиды вышеуказанных соединений формулы (IIIa), или (IIIb), или (IVa), или (IVb).
2. Фармацевтические композиции по п.1, где соединения имеют формулу (А1), или (А2), или (В1), или (В2), или (С1), или (С2), или (D1), или (D2)
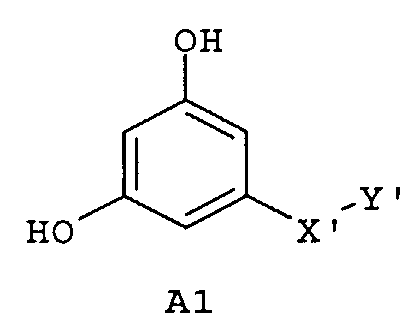
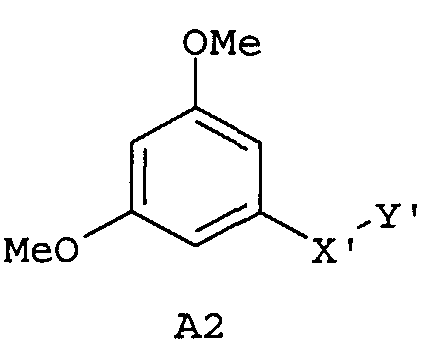
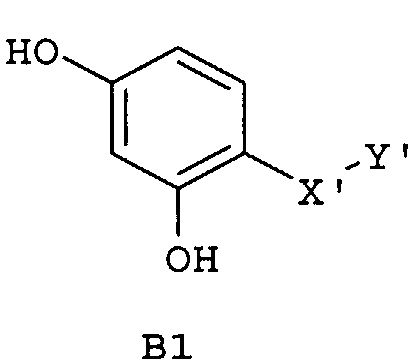
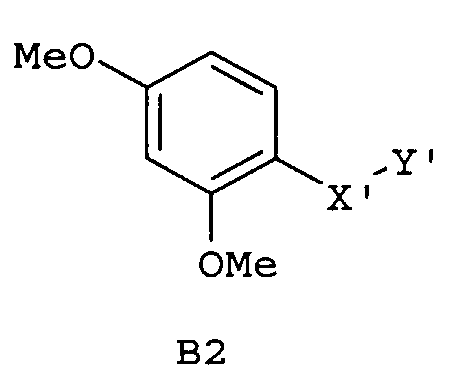
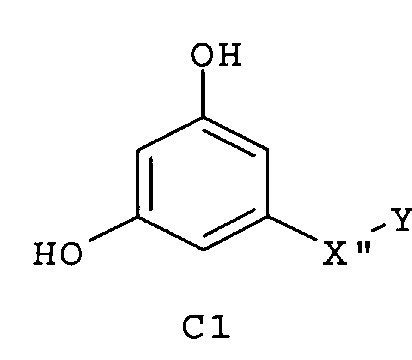
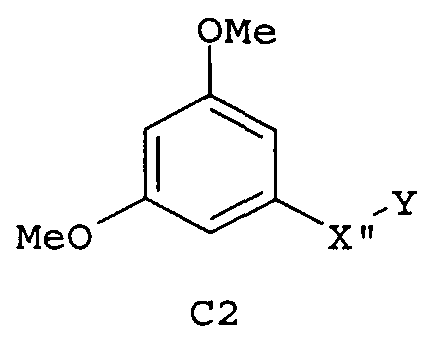
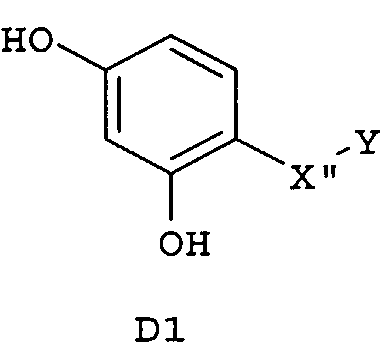
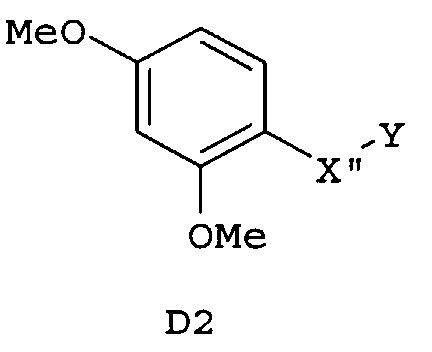
где X' и Y имеют значения, указанные в п.1, и где X" представляет собой
m=0,1,
и где Y' представляет собой
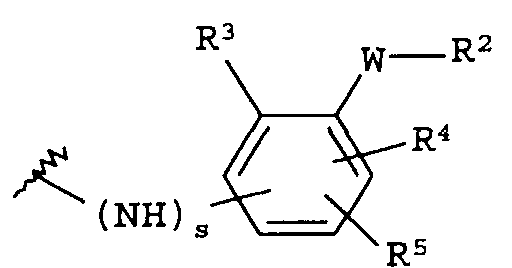
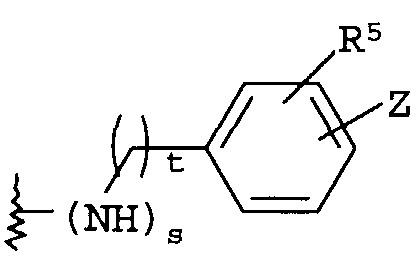
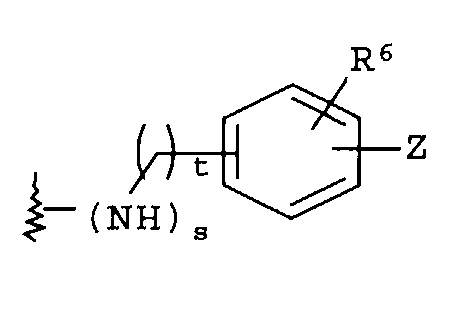
где все индексы, символы и заместители имеют значения, указанные в п.1.
3. Фармацевтические композиции по п.2, где соединения имеют формулу (Е1), или (Е2), или (F1), или (F2)
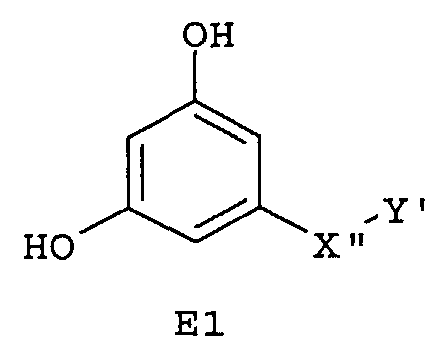
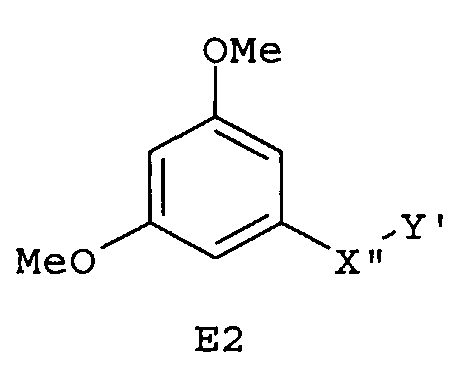
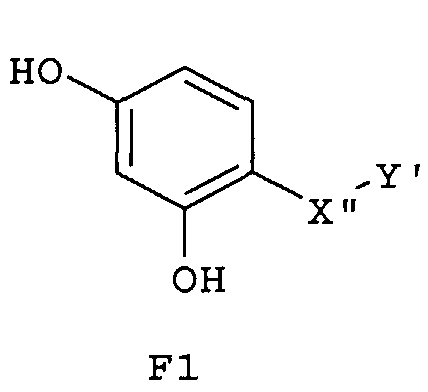
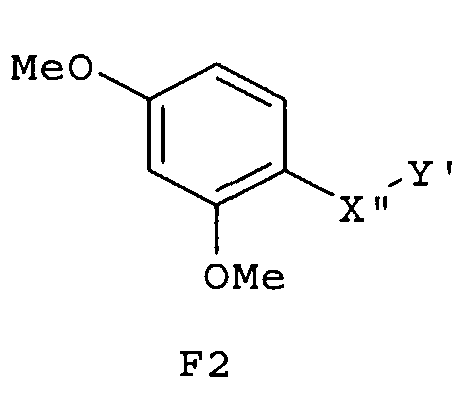
где X" и Y' имеют значения, указанные в п.2.
4. Фармацевтические композиции по п.1, где соединения имеют формулу (G1), или (G2), или (H1), или (Н2)
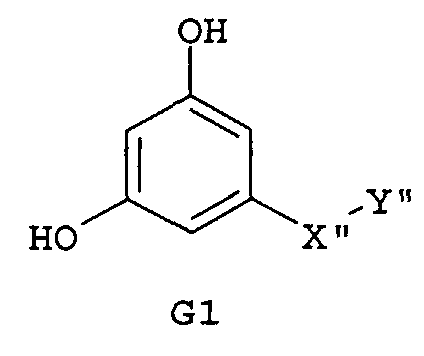
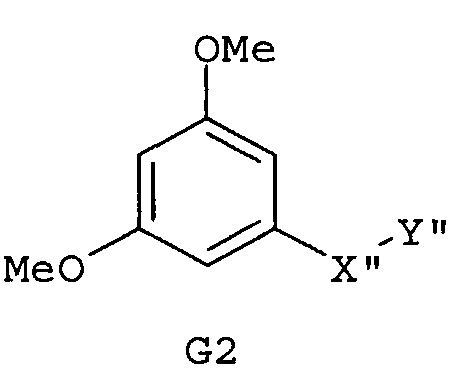
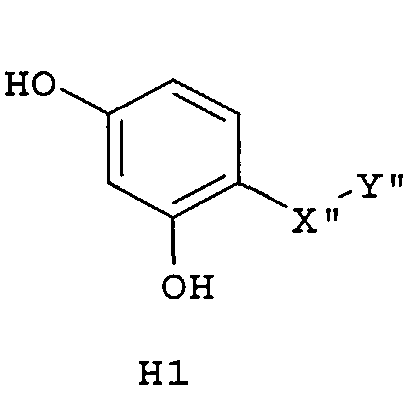
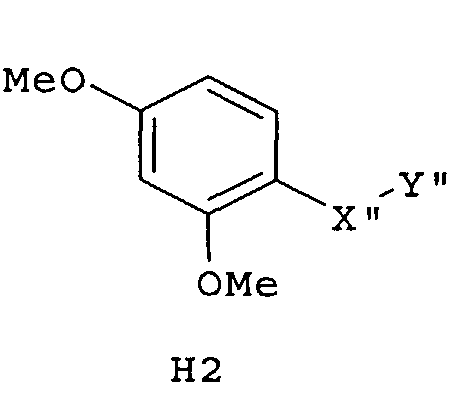
где X" имеет значения, указанные в п.2, и Y" представляет собой
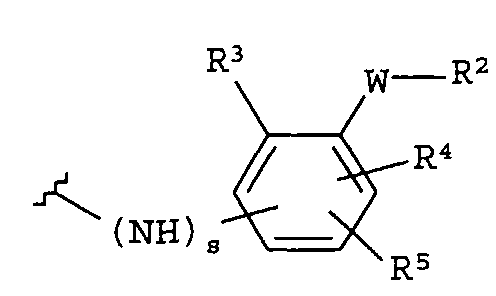
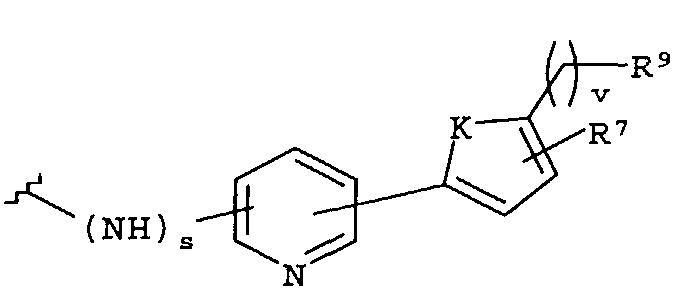
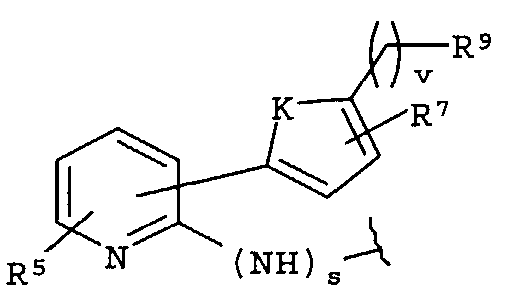
где R9 представляет собой CO2H, СO2алкил,
где алкил представляет собой одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода,
где все индексы, символы и заместители имеют значения, указанные в п.1.
5. Химические соединения, имеющие общую структуру формулы (Е1), (Е2), (F1), (F2), (G1), (G2), (H1) или (Н2)
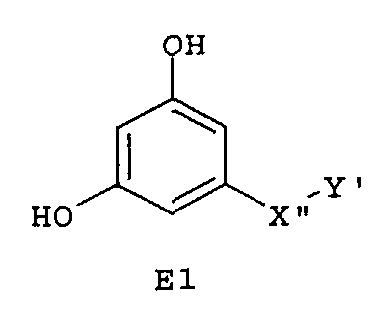
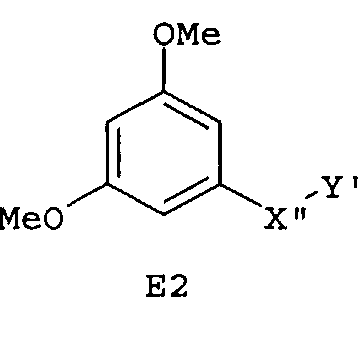
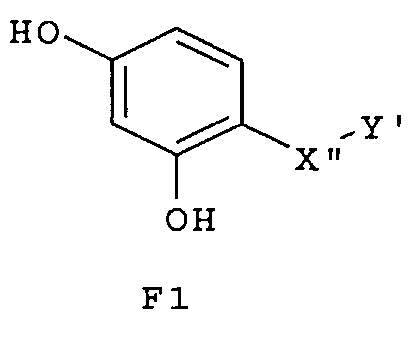
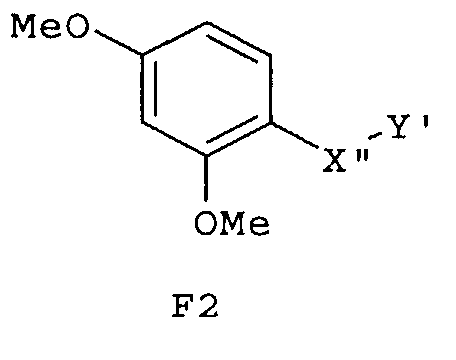




где символы и заместители имеют следующие значения:
X" представляет собой




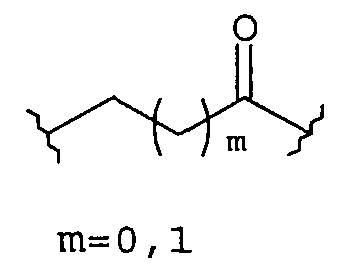
Y' представляет собой



Y" представляет собой



где s равно 1,
R2 представляет собой CO2H, CO2-алкил, CF3,
где алкил представляет собой одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода,
R3 независимо от R2 представляет собой Н и
R4 независимо от R2 и R3 представляет собой Н,
R5 представляет собой Н,
и W представляет собой -(CH2-)v, где v равно 0, 1;
где t равно 0;
где R6 представляет собой Н,
Z представляет собой
(i)
R7 независимо от R2 представляет собой Н, СН3, ОСН3,
W представляет собой -(CH2-)v, где v равно 0, 1,
R2 представляет собой CO2H, СО2-алкил, CF3,
где алкил представляет собой одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода,
(iv)
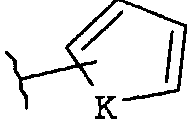
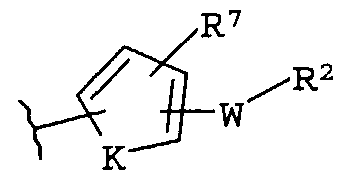
где К представляет собой О, S,
R7 независимо от R2 представляет собой Н, СН3, ОСН3,
W представляет собой -(CH2-)v, где v равно 0, 1,
R2 представляет собой CO2H, CO2-алкил, CF3,
где алкил представляет собой одновалентную группу с неразветвленной цепью или разветвленной цепью из 1, или 2, или 3, или 4, или 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12 атомов углерода.
6. Применение соединений, имеющих структуру формулы (IIIa), или (IIIb), или (IVa), или (IVb) по п.1, для получения лекарственного средства для лечения хронического обструктивного заболевания легких (COPD), острого повреждения легких (ALI), при экстракорпоральном кровообращении, для лечения острого респираторного дистресс-синдрома (ARDS), болезни Крона, септического шока, сепсиса, хронических воспалительных заболеваний, таких как псориаз, атопический дерматит и ревматоидный артрит, и реперфузионного повреждения, которое имеет место после сердечных приступов, мозговых кровоизлияний, атеросклероза и трансплантации органов, травматического шока, недостаточности деятельности многих органов, аутоиммунных заболеваний, подобных рассеянному склерозу, при подкожной внутрипросветной ангиопластике, для лечения астмы и воспалительного заболевания кишечника.
7. Применение соединений, имеющих структуру формулы (IIIa), или (IIIb), или (IVa), или (IVb) по п.1, для получения лекарственного средства, модулирующего экспрессию Е- и Р-селектина для лечения или профилактики воспалительных расстройств.
8. Применение соединений, имеющих структуру формулы (IIIa), или (IIIb), или (IVa), или (IVb) по п.1, в сочетании с одним или несколькими физиологически приемлемыми носителями, адъювантами или наполнителями, для парентеральной инъекции, для перорального введения в твердой или жидкой форме, для ректального или местного введения, для профилактики или лечения заболеваний, связанных с модулированием экспрессии Е- и Р-селектина.
9. Применение соединений, имеющих структуру формулы (IIIa), или (IIIb), или (IVa), или (IVb) по п.1, для получения косметических или дерматологических композиций, модулирующих экспрессию Е- и Р-селектина.
10. Косметические композиции, модулирующие экспрессию Е- и Р-селектина, включающие, по меньшей мере, одно соединение формулы (IIIa), или (IIIb), или (IVa), или (IVb) по п.1 и, по меньшей мере, один косметически переносимый компонент.
11. Дерматологические композиции, модулирующего экспрессию Е- и Р-селектина, включающие, по меньшей мере, одно соединение формулы (IIIa), или (IIIb), или (IVa), или (IVb) по п.1 и, по меньшей мере, один дерматологически переносимый компонент.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| US 5374772 A, 20.12.1994 | |||
| NOMOTO ET AL: "Preparation of hydroxybenzamide derivatives as prevention and treatment agents for bone diseases" CHEMICAL ABSTRACTS + INDEXES, AM | |||
| CHEM | |||
| SOC, 1996, v.13, №125, p.1122 | |||
| APPELDOORN С С M ET AL: "Rational Optimization of a Short Human P-selectin-binding Peptide Leads to | |||
Авторы
Даты
2011-11-20—Публикация
2006-09-20—Подача