Область техники, к которой относится изобретение
Настоящее изобретение относится к способу скрининга нетератогенного вещества, такого как лекарственное средство, фармацевтическая добавка, пищевой продукт, пищевая добавка и, в частности, нетератогенного производного талидомида, а также к способу скрининга антагониста талидомида с использованием цереблона (может быть обозначен аббревиатурой CRBN), являющегося мишенью для талидомида, или фрагмента CRBN. Настоящее изобретение также относится к мутированному CRBN, который почти не связывается с талидомидом, но сохраняет функцию компонента убихитинлигазного комплекса, к нуклеиновой кислоте, кодирующей мутированный CRBN, и к животному, отличному от человека, которому вводят указанную нуклеиновую кислоту с целью экспрессии.
Уровень техники
Талидомид, который в конце 1950-х годов и в начале 1960-х годов продавался в качестве седативного средства в более чем 40 странах, врачи часто прописывали беременным женщинам от утреннего недомогания. До того как было выявлено тератогенное действие данного средства и прекращено его применение, родились десятки тысяч или более детей с врожденными дефектами (пороками развития), включая мертворождение (приведенные литературные источники 1-3). У женщин, находившихся на третьей - восьмой неделе беременности, которые принимали талидомид, рождались дети с такими врожденными дефектами, как нарушение развития конечностей, ушей, сердца и желудочно-кишечного тракта, получившими название эмбриопатия, вызванная талидомидом (приведенные литературные источники 1-3). В частности, особенно часто встречаются дефекты развития конечностей и ушей. Дефект развития конечностей, известный как фокомелия, характеризуется укорачиванием ног и рук. Дефектом развития ушей является анотия, микротия и тугоухость. Несмотря на значительные усилия, направленные на установление причин данного явления, до сих пор мало известно о том, как возникают указанные дефекты развития. Ранее выполненные исследования позволили предположить, что возможной причиной тератогенного действия может быть вызываемый талидомидом окислительный стресс и его негативное воздействие на развитие кровеносных сосудов (приведенные литературные источники 4 и 5). Однако до сих пор не найдены ответы на некоторые важные вопросы, в частности, не известно, какие молекулы являются прямыми мишенями для талидомида и каким образом указанные мишени опосредуют вызываемое талидомидом тератогенное действие.
В настоящее время стало известно, что белок, именуемый CRBN, вызывает у людей легкую форму олигофрении (не являющийся патентом документ 1 и приведенный литературный источник 11). Хотя в научной литературе было отмечено, что указанный белок также связывается с белком, именуемым поврежденным ДНК-связывающим белком 1 (DDB1) (не являющийся патентом документ 2 и приведенный литературный источник 12), ранее не была выявлена его связь с талидомидом.
Список ссылок
Документ, не являющийся патентом
Не являющийся патентом документ 1: J.J. Higgins, J. Pucilowska, R.Q. Lombardi, J.P. Rooney, Neurology 63, 1927 (2004).
Не являющийся патентом документ 2: S. Angers et al., Nature 443, 590 (2006).
Сущность изобретения
Задачи, решаемые настоящим изобретением
В последнее время талидомид стал более широко применяться для лечения множественной миеломы и нодозной эритемы, которая является определенным типом лепры, сопровождающейся болью (приведенные литературные источники 2, 3, 6 и 7). Хотя детальный механизм такого воздействия остается неясным, известно, что талидомид оказывает благоприятное воздействие на указанные заболевания. Однако из-за серьезной проблемы, связанной с тератогенным действием, талидомид применяется только под строгим контролем (приведенный литературный источник 8), поэтому весьма желательно устранить тератогенное действие талидомида, что позволит расширить применение указанного лекарственного средства благодаря его благоприятному воздействию.
Настоящее изобретение было сделано с учетом вышеописанного уровня техники, и целью настоящего изобретения является создание нетератогенного лекарственного средства, являющегося альтернативой талидомиду, которое сохраняет благоприятное фармакологическое действие указанного лекарственного средства.
Способ решения поставленных задач
Авторы настоящего изобретения провели всестороннее исследование для достижения вышеуказанной цели. В результате выполненного исследования было установлено, что талидомид оказывает тератогенное действие в результате связывания с CRBN и ингибирования активности убихитин-лигазного комплекса, содержащего CRBN в качестве компонента. Как было описано ранее, известно, что CRBN является предполагаемой причиной возникновения у людей легкой формы олигофрении и что CRBN связывается с DDB1; однако до сих пор полностью не известна взаимосвязь между CRBN и талидомидом. В свете вышеизложенного, во время подачи настоящей заявки совершенно невероятным было открытие того, что CRBN является мишенью, опосредующей вызываемое талидомидом тератогенное действие.
На основании сделанного открытия можно прогнозировать тератогенное действие производного талидомида путем оценки сродства связывания данного соединения с CRBN.
В более широком понимании данное открытие позволяет прогнозировать тератогенное действие, подобное талидомиду, не только у производных талидомида, но также у всех испытуемых веществ путем исследования их способности связываться с CRBN.
Кроме того, авторы настоящего изобретения обнаружили, что аминокислотные остатки от положения 339 до положения 442 от N-конца CRBN человека представляют собой область связывания талидомида с CRBN человека, при этом замена тирозина в положении 384 и триптофана в положении 386 от N-конца аланином уменьшает способность CRBN связываться с талидомидом, но сохраняет его функцию в качестве компонента убихитин-лигазного комплекса.
В основе настоящего изобретения лежат вышеуказанные открытия.
То есть настоящее изобретение относится к нижеследующим объектам [1]-[11].
[1] Способ скрининга нетератогенного вещества, который включает приведение испытуемого вещества в контакт с цереблоном или фрагментом цереблона, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, не связывающегося с цереблоном или фрагментом цереблона, или испытуемого вещества, характеризующего более низкой способностью связываться с цереблоном или фрагментом цереблона по сравнению с талидомидом.
[2] Способ скрининга нетератогенного вещества по п.[1], в котором испытуемое вещество представляет собой лекарственное средство.
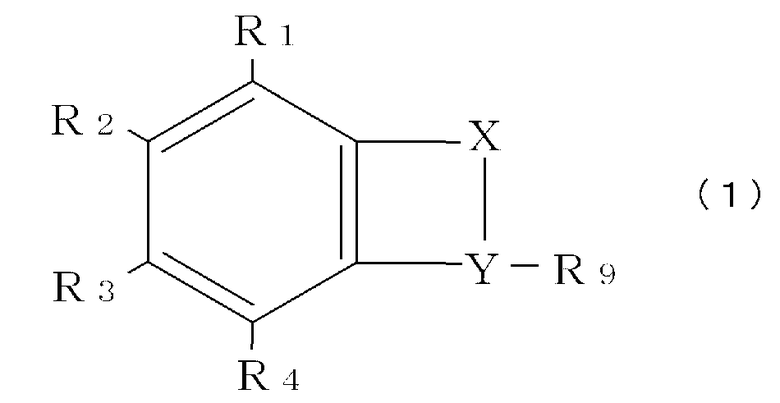
[3] Способ скрининга нетератогенного вещества по п.[1] или [2], в котором испытуемое вещество является производным талидомида, выраженным общей формулой (1):
Формула 1

где соединение, в котором Х означает R5-R7 и Y означает R6-R8, именуется соединением (А), соединение, в котором Х означает R5 и Y означает R6-R8, именуется соединением (В) и соединение, в котором Х означает R5 и Y означает R8, именуется соединением (С);
каждый элемент R1, R2, R3 и R4 может быть выбран из -Н; -ОН; =О; алкана, алкена и алкина с линейной или разветвленной цепью; циклического алкана, алкена и алкина; комбинации циклического и нециклического алкана, алкена и алкина; спирта, альдегида, кетона, карбоновой кислоты, сложного эфира или простого эфира, объединяющего кольцевую и некольцевую структуру, или комбинации циклических/ нециклических частей; аза; амино; -MOn или -O-MOn [где М=N и n=2; М=S и n=2 или 3; М=Р и n=1-3]; и галогена; и
каждый элемент R5, R6, R7 и R8 независимо выбирают из группы формулы (2):
Формула 2

и -О- (где Z является необязательным элементом и имеет такие же значения, что и вышеописанный элемент R1); и R10 имеет такие же значения, что и вышеописанный элемент R1, или (когда Z отсутствует) R10=О;
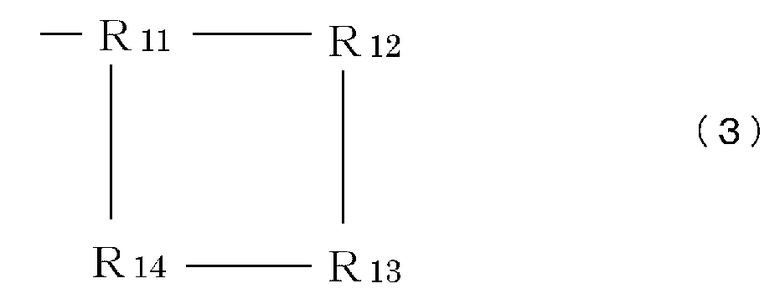
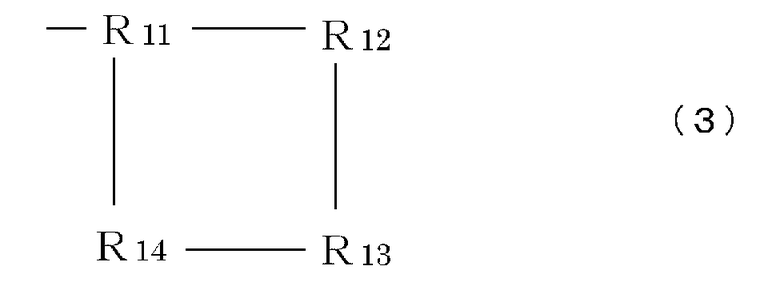
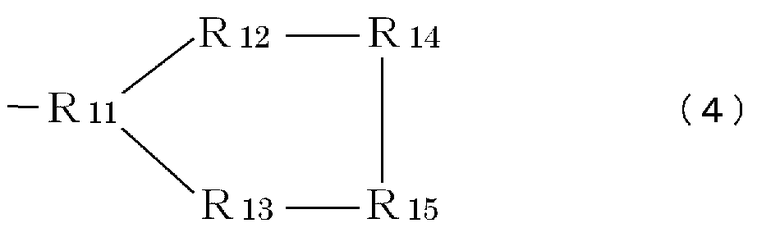
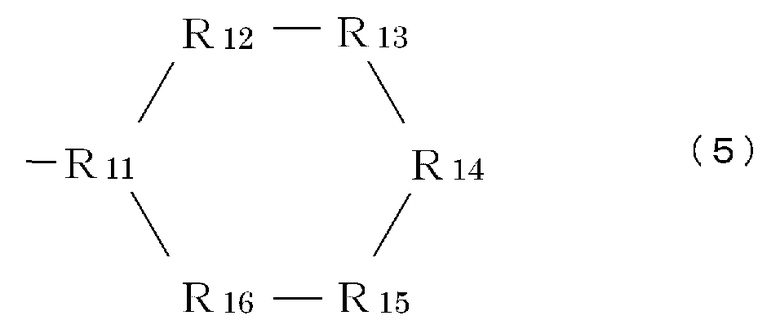
R9 означает часть, имеющую формулу (3), (4), (5), (6) или (7):
Формула 3
Формула 4

Формула 5

Формула 6
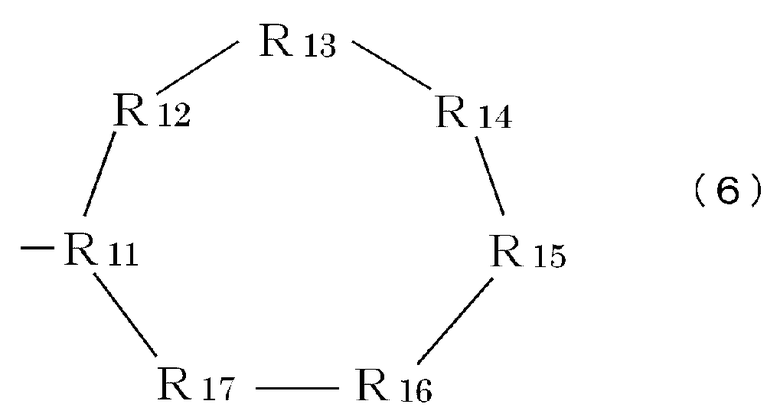
где каждый элемент R11-R17 (независимо) имеет такие же значения, что и вышеописанный элемент R5, или
Формула 7

где каждый элемент R18, R19 и R20 независимо выбирают из Н, -СН3, -СООН, -CONH2, -(CH2)n-COOH, -(CH2)n CONH2, где n=1-4.
[4] Способ скрининга нетератогенного вещества по любому из пп.[1]-[3], в котором фрагмент цереблона содержит аминокислотную последовательность от положения 339 до положения 442 от N-конца аминокислотной последовательности, показанной в SEQ ID NO:7, при этом в остальной части аминокислотной последовательности SEQ ID NO:7 заменяют, удаляют и/или добавляют один или более аминокислотных остатков.
[5] Способ скрининга нетератогенного вещества по любому из пп.[1]-[4], в котором цереблон или фрагмент цереблона иммобилизован на носителе.
[6] Способ скрининга нетератогенного вещества по п.[3], в котором производное талидомида обладает фармакологическим действием талидомида или известного производного талидомида.
[7] Способ скрининга антагониста тератогенного вещества, который включает стадию введения испытуемого вещества в соприкосновение с цереблоном или фрагментом цереблона, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, связывающегося с цереблоном или фрагментом цереблона, и стадию выбора из веществ, отобранных на вышеуказанной стадии, вещества, способного уменьшать i) тератогенное действие или ii) ингибирующее действие, оказываемое на активность убихитин-лигазного комплекса, содержащего цереблон.
[8] Способ скрининга антагониста тератогенного вещества по п.[7], в котором цереблон или фрагмент цереблона иммобилизован на носителе.
[9] Мутированный цереблон, включающий следующую замену аминокислотных остатков (а) и/или (b):
(а) замену тирозина в положении 384 от N-конца цереблона человека или эквивалентной аминокислоты аланином;
(b) замену триптофана в положении 386 от N-конца цереблона человека или эквивалентной аминокислоты аланином.
[10] Нуклеиновая кислота, кодирующая мутированный цереблон по п.[9].
[11] Животное, отличное от человека, устойчивое к вызываемому талидомидом тератогенному действию, которое содержит в качестве гена введенную нуклеиновую кислоту по п.[10] и экспрессирует указанный ген.
Преимущества изобретения
Нетератогенное вещество, полученное способом скрининга по настоящему изобретению, позволяет прогнозировать наличие или отсутствие тератогенного действия, подобного вызываемому талидомидом, при этом указанное нетератогенное производное талидомида может быть использовано в качестве лекарственного средства, являющегося альтернативой талидомиду. Кроме того, антагонист талидомида, полученный способом скрининга по настоящему изобретению, позволяет снизить риск возникновения тератогенного действия талидомида.
Животное, содержащее в качестве гена введенную нуклеиновую кислоту, кодирующую мутированный CRBN по настоящему изобретению, и экспрессирующее указанный ген, обладает устойчивостью к вызываемому талидомидом тератогенному действию и, таким образом, может быть использовано для оценки фармакологического действия талидомида и подобных веществ.
Краткое описание чертежей
[Фиг.1] На фиг.1 показана способность талидомида (thal) связываться с CRBN и DDB1. (А) Талидомид-связывающие белки были выделены из экстрактов клеток HeLa с использованием гранул, содержащих иммобилизованный талидомид (+), или контрольных гранул (-). Связанные белки элюировали, добавляя талидомид. Элюированные белки подвергали электрофорезу и окрашивали серебром (верхний блок). Звездочкой (*) отмечено неспецифическое связывание. Связанные белки были идентифицированы как CRBN и DDB1 методом тандемной масс-спектрометрии и вестерн-блоттинга. При добавлении к экстракту 0,3 мМ талидомида до инкубации с гранулами выход указанных белков уменьшался. (В) Чтобы определить, какой белок, CRBN или DDB1, связан с гранулами, содержащими иммобилизованный талидомид, очищенный рекомбинантный CRBN с FLAG-меченной антигенной детерминантой (CRBN-FLAG) и DDB1 с V5- и His-меченной антигенной детерминантой (DDB1-V5-His) смешивали с гранулами, содержащими иммобилизованный талидомид. Связанные белки обнаруживали методом вестерн-блоттинга. В результате выполненного эксперимента было установлено, что белок, связанный с гранулами, представляет собой CRBN. (С) CRBN-FLAG и DDB1-V5-His одновременно или независимо экспрессировали в клетках Sf9 и осаждали методом иммунопреципитации антителом против FLAG. Осажденный белок подвергали электрофорезу и окрашивали кумассии. В результате выполненного эксперимента был обнаружен DDB1.
[Фиг.2] На фиг.2 показано образование комплекса Е3 белками CRBN, DDB1 и куллином 4А (Cul4A). (А) FH-CRBN с FLAG- и гемагглютинин (НА)-меченной антигенной детерминантой и DDB1-V5-His коэкспрессировали в клетках HeLa и подвергали иммунному окрашиванию. DAPI означает 4'6-диамидино-2-фенилиндол. CRBN и DDB1 были локализованы главным образом в ядре, а также в цитоплазме. (В) Экстракты клеток 293Т, устойчиво экспрессирующих FH-CRBN, или контрольные клетки (псевдотрансфецированные клетки) осаждали методом иммунопреципитации антителом против FLAG и исследовали методом вестерн-блоттинга. В результате выполненного эксперимента DDB1, Cul4A и Roc1 были осаждены вместе с FH-CRBN. (С) Клетки 293Т котрансфецировали указанным количеством векторов экспрессии FH-CRBN и DDB2. Иммунопреципитаты исходного белка и FLAG-специфического белка обнаруживали методом вестерн-блоттинга (IB). Количество DDB1, осажденного вместе с CRBN, уменьшалось в присутствии возрастающих количеств коэкспрессированного DDB2. (D) Клетки 293Т, устойчиво экспрессирующие FH-CRBN, трансфецировали Cul4A или контрольной миРНК и обрабатывали MG132. Указанные клетки лизировали буфером RIPA. Клеточный лизат осаждали методом иммунопреципитации антителом против FLAG и исследовали методом вестерн-блоттинга с использованием антитела против убихитина (Ub). Аутоубихитинирование CRBN было обнаружено в присутствии MG132 и было аннулировано миРНК Cul4A. (Е) Клетки 293Т, устойчиво экспрессирующие FH-CRBN (WT, дикого типа) или мутант CRBN, не связывающийся с DDB1 (ΔMid, делеция аминокислот 187-260), обрабатывали MG132 и исследовали так же, как показано на фиг.(D). Убихитинирование ΔMid было меньше по сравнению с CRBN дикого типа.
[Фиг.3] На фиг.3 показано ингибирование талидомидом функции CRBN. (А) Схематическое изображение CRBN и его мутанта с делецией. Звездочками отмечены положения замен аланином. (В) GST-CRBN дикого типа или мутантный белок смешивали с гранулами, содержащими иммобилизованный талидомид, и связанные мутанты CRBN окрашивали серебром. Были связаны CRBN дикого типа и мутантный белок, экспрессирующий 104 С-концевых аминокислотных остатка CRBN. Положение непроцессированный GST-гибридизированных белков отмечено стрелками. (С) Экстракты, полученные из клеток 293Т, сверхэкспрессирующих FH-CRBN и его мутанты, смешивали с гранулами, содержащими иммобилизованный талидомид, и связанные мутанты CRBN обнаруживали методом вестерн-блоттинга. Мутанты CRBN с заменой в двух положениях, Y384A и W386A, не связывались с талидомидом. Кроме того, мутанты CRBN с двумя заменами YW/AA обладали чрезвычайно низкой активностью связывания с талидомидом. (D) CRBN-V5-His (дикого типа) и его мутант FH-CRBN YW/AA котрансфецировали в клетки HeLa и подвергали иммунному окрашиванию. DAPI означает 4'6-диамидино-2-фенилиндол. Субклеточная локализация мутанта не отличалась от CRBN дикого типа. (Е) Клетки 293Т, экспрессирующие FH-CRBN YW/AA осаждали методом иммунопреципитации антителом против FLAG и исследовали методом вестерн-блоттинга. CRBN YW/AA был осажден вместе с DDB1, Cul4A и Roc1. (F и G) Клетки 293Т, устойчиво экспрессирующие FH-CRBN (дикого типа) или FH-CRBN YW/AA исследовали так же, как показано на фиг.2Е. Как показано на фиг.(G), клетки обрабатывали талидомидом в указанной концентрации в течение 4 часов и затем собирали. Аутоубихитинирование CRBN под действием MG132 было подавлено в результате предварительной обработки талидомидом, в то время как талидомид не влиял на аутоубихитинирование CRBN YW/AA.
[Фиг.4] На фиг.4 показаны дефекты развития у рыбки данио-рерио и подавление комплекса CRBN в результате обработки талидомидом. (А и В) Эмбрионы данио-рерио развивались в среде, содержащей талидомид в указанной концентрации. В обработанных талидомидом эмбрионах было нарушено развитие грудного плавника и слуховых пузырьков. (C-F) В эмбрионы на одноклеточной стадии развития вводили антисмысловой морфолиноолигонуклеотид zcrbn (zcrbn AMO) с мРНК zcrbn или без мРНК zcrbn. Эмбрионы, в которые был введен zcrbn AMO, характеризовались специфическими дефектами развития грудного плавника и слуховых пузырьков, при этом в фенотипах, в которые была введена мРНК zcrbn, указанные дефекты отсутствовали. (G-I) Как указано, в эмбрионы на одноклеточной стадии развития вводили zcul4a AMO с мРНК zcul4a или без мРНК zcu14a. Введение zcul4a AMO вызывало аналогичные дефекты слуховых пузырьков и грудного плавника, при этом в фенотипах, в которые была введена мРНК zcul4a, указанные дефекты отсутствовали. (А и С) Эмбрионы фиксировали через 75 часов после оплодотворения (hpf) и окрашивали альциановым синим. В верхних блоках показан вид эмбрионов сверху и в нижних блоках показано увеличенное изображение грудных плавников. Грудные плавники указаны стрелками. (В, Е и Н). Увеличенное изображение слуховых пузырьков у эмбрионов через 30 часов после оплодотворения. (D и G) Эмбрионы через 48 часов после оплодотворения гибридизировали с антисмысловым зондом к фактору роста фибробластов 8а (fgf8a) и гену sonic hedgehog (shh). Увеличенное изображение почки плавника. Удаление zcrbn или zcul4a вызывало уменьшение экспресии fgf8a, при этом дефекты развития в указанных фенотипах были устранены при совместном введении мРНК zcrbn или zcul4a. Такое введение оказывало незначительное влияние на экспрессию shh. (F и I) Размер слуховых пузырьков через 30 часов после оплодотворения показан на графиках в сравнении с необработанным образцом (***р<0,001, uninj, введение или обработка не производились).
[Фиг.5] На фиг.5 показано уменьшение вызываемого талидомидом тератогенного действия в результате экспрессии мутированного CRBN. В эмбрионы на одноклеточной стадии развития вводили мРНК zcrbn (дикого типа) или мРНК zcrbn YW/AA. Эмбрионы развивались в присутствии или отсутствии талидомида. (А) Показано увеличенное изображение слуховых пузырьков через 27 часов после оплодотворения. (В) Размер слуховых пузырьков у эмбрионов через 30 часов после оплодотворения относительно размера эмбрионов. *p<0,05, **р<0,01. Обработка талидомидом эмбрионов, сверхэкспрессирующих zcrbn YW/AA, не влияла на размер слуховых пузырьков. (С и D) Эмбрионы через 48 часов после оплодотворения гибридизировали in situ с антисмысловыми зондами к fgf8 или shh. На фигурах показано увеличенное изображение почек плавников. uninj, введение не производилось. У эмбрионов, обработанных талидомидом, экспрессия fgf8a была значительно уменьшена, при этом экспрессия fgf8a была восстановлена в результате введения мРНК zcrbn YW/AA.
[Фиг.6] Схема иммобилизации талидомида на гранулах FG. (А и В) Структура талидомида и его производного FR259625. (С) Показана схема иммобилизации талидомида на гранулах FG.
[Фиг.7] На фиг.7 показана очистка талидомидсвязывающих факторов из клеток разных типов. Экстракты, полученные из указанных линий клеток, очищали при помощи аффинной хроматографии с использованием гранул, содержащих иммобилизованный талидомид. Элюированные фракции анализировали методом вестерн-блоттинга с использованием антитела против DDB1 и антитела против CRBN. К экстрактам добавляли 0,3 мМ талидомида до инкубации с гранулами. CRBN и DDB1 выделяли в виде талидомид-связывающих белков из клеток разных типов.
[Фиг.8] На фиг.8 оказана способность DDB1 связываться с CRBN. Экстракты из линии клеток 293Т, устойчиво экспрессирующих FH-CRBN, или контрольных клеток (псевдотрансфецированных клеток) осаждали методом иммунопреципитации антителом против FLAG, анализировали методом SDS-PAGE и окрашивали серебром. В результате выполненного эксперимента были осаждены DDB1 и CRBN. DDB1 был осажден вместе с CRBN.
[Фиг.9] На фиг.9 показано убихитинирование CRBN in vitro. Комплекс FH-CRBN, выделенный из клеток 293Т, устойчиво экспрессирующих FH-CRBN, инкубировали с GST-убихитином, Uba1 (соответствует Е1), UbcH5b (соответствует Е2) и АТР или без указанных веществ и аликвоты реакционных растворов исследовали методом вестерн-блоттинга с использованием указанных антител. Из контрольных клеток выделяли псевдокомплекс. Аутоубихитинирование имело место в присутствии комплекса CRBN.
[Фиг.10] На фиг.10 показана взаимосвязь между удалением DDB1 и уровнями белка CRBN. Клетки 293Т трансфецировали DDB1 или контрольной миРНК и полученные лизаты смешивали с гранулами, содержащими иммобилизованный талидомид. Исходные или связанные белки анализировали методом вестерн-блоттинга с использованием антитела против DDB1 или против CRBN. Удаление DDB1 вызывает значительное снижение уровней белка CRBN.
[Фиг.11] На фиг.11 показана взаимосвязь между мутантами CRBN с делецией и образованием комплекса убихитина. (А) Схематическое изображение CRBN и его мутанта с делецией. (В) FH-CRBN (дикого типа) и его мутанты экспрессировали в клетках 293Т и осаждали методом иммунопреципитации антителом против FLAG. CRBN и его мутант и связанный с ними эндогенный DDB1 обнаруживали методом вестерн-блоттинга. В результате выполненного экперимента было установлено, что делеция аминокислот от положения 187 до положения 260 CRBN (ΔMid) аннулировала взаимодействие с DDB1. (С) CRBN и ΔMid, мутант с отсутствием аминокислот от положения 187 до положения 260, экспрессировали в клетках 293Т. После иммунопреципитации антителом против FLAG белки DDB1 и Cul4A, связанные с CRBN или ΔMid, анализировали методом вестерн-блоттинга. ΔMid был неспособен образовывать комплекс с DDB1 и Cul4a.
[Фиг.12] На фиг.12 показано сохранение CRBN в процессе эволюции. Был произведен сравнительный анализ аминокислотных последовательностей ортологов CRBN из пяти видов. В рамках указаны аминокислоты, полностью сохранившиеся в указанных видах. Стрелкой показана талидомид-связывающая область, установленная в результате анализа мутанта с делецией, при этом звездочками обозначены аминокислоты, имеющие важное значение для связывания талидомида (Y384 и W386). См. фиг.3.
[Фиг.13] На фиг.13 показана экспрессия zcrbn и zcul4a в эмбрионах данио-рерио. Экспрессию zcrbn и zcu14a в эмбрионах через 48 часов после оплодотворения исследовали путем полной гибридизации in situ. (А) zcrbn высокоэкспрессирован в сосудистой сети головы, грудных плавниках и головном мозге. Вид сбоку. (В) Экспрессия zcrbn в слуховых пузырьках (OV, показаны стрелками) через 48 часов после оплодотворения. Вид сверху. (С) Увеличенное изображение экспрессии zcrbn в грудных плавниках эмбрионов через 48 часов после оплодотворения. Высокие уровни экспрессии имеют место в проксимальной мезенхиме (pm), и слабая экспрессия наблюдается в мигрирующей мезенхиме (mm). (D) zcul4a высокоэкспрессирован в переднем мозге, среднем мозге, заднем мозге и грудных плавниках через 48 часов после оплодотворения. (Е) Экспрессию fgf8 в эмбрионах через 48 часов после оплодотворения исследовали в качестве контрольного образца. fgf8 экспрессирован на границе между средним и задним мозгом и в заднем мозге. Масштаб 0,2 мм.
[Фиг.14] На фиг.14 представлены результаты биохимического анализа zcrbn. (А) Экстракт клеток 293Т, устойчиво экспрессирующих FH-zcrbn, смешивали и инкубировали с гранулами, содержащими талидомид. Связанные белки элюировали талидомидом и элюат анализировали методом вестерн-блоттинга. zcrbn был связан с талидомидом. (В) Лизат клеток 293Т, сверхэкспрессирующих FH-zcrbn, осаждали методом иммунопреципитации антителом против FLAG и обнаруживали DDB1 методом вестерн-блоттинга. Было установлено, что эндогенный DDB1 человека связывается с FH-zcrbn. (С) Лизат FLAG-zcrbn (дикого типа) или FLAG-zcrbn YW/AA, сверхэкспрессированного в клетках 293Т, смешивали с гранулами, содержащими талидомид. Для выполнения количественного анализа исходный белок и элюированную фракцию анализировали в разных количествах методом вестерн-блоттинга. Талидомид слабо связывался с zcrbn YW/AA.
[Фиг.15] На фиг.15 представлено схематическое изображение модели молекулярного механизма тератогенного действия талидомида. CRBN, являющийся компонентом убихитин-лигазного комплекса Е3, обычно выполняет функцию регулирования многочисленных процессов развития, таких как образование конечностей и слуховых пузырьков, в результате убихитинирования неизвестных субстратов (верхняя схема). Талидомид связывается с CRBN и ингибирует функцию, выполняемую комплексом Е3 (нижняя схема). Аберрантная аккумуляция его субстратов вызывает многочисленные дефекты развития, такие как короткие конечности и маленькие слуховые пузырьки, частично вследствие уменьшения экспрессии fgf8.
[Фиг.16] На фиг.16 показано связывание фталимида с CRBN и DDB1. Экстракты клеток 293Т смешивали с гранулами, содержащими иммобилизованный талидомид. Связанные белки элюировали талидомидом или равным количеством фталимида и элюированные фракции анализировали методом вестерн-блоттинга.
[Фиг.17] На фиг.17 представлены структурные формулы производных талидомида, у которых исследовали сродство связывания с CRBN.
[Фиг.18] На фиг.18 показано связывание производных талидомида с CRBN. Экстракты клеток 293Т смешивали с гранулами, содержащими иммобилизованный талидомид. Связанные белки элюировали производными талидомида. Связанные белки промывали и элюировали производными талидомида. Элюированную фракцию анализировали методом вестерн-блоттинга. Термин ”наполнитель”, использованный на данной фигуре, означает ДМСО. Термин ”фракция, подвергнутая кипячению в SDS” означает фракцию, в которой связанные белки были отсоединены путем нагревания гранул при 98,5°С в буфере, содержащем 2% SDS. CRBN был элюирован талидомидом и глутаримидом и не был элюирован фталимидом и 5-гидрокси(2,6-диизопропилфенил)-1Н-изоиндол-1,3-дионом (5НРР-33).
[Фиг.19] На фиг.19 показаны клетки множественной миеломы Kms12 после обработки талидомидом и 5НРР-33. Клетки KMS-12 инкубировали с талидомидом или 5НРР-33 (100 мкМ) в течение 48 часов при 37°С в 5% СО2. Для определения числа живых клеток в культуральную среду добавляли реагент для подсчета клеток SF (Nacalai Tesque, Inc.) и оставляли на 2 часа в конце инкубации, выполняемой в течение 48 часов. Измеряли оптическую плотность при 450 нм. Было установлено, что 5НРР-33 в значительной степени подавлял рост миеломных клеток.
Лучший вариант осуществления изобретения
Ниже представлено подробное описание настоящего изобретения.
(1) Способ скрининга нетератогенного вещества
Способ скрининга нетератогенного вещества по настоящему изобретению включает приведение испытуемого вещества в контакт с CRBN или фрагментом CRBN, оценку способности испытуемого вещества связываться с CRBN или фрагментом CRBN и отбор испытуемого вещества, не связывающегося с CRBN или фрагментом CRBN, или испытуемого вещества, проявляющего более низкую способность связываться с CRBN или фрагментом CRBN по сравнению с талидомидом.
Испытуемое вещество, характеризующееся более низкой способностью связываться с CRBN и его фрагментом по сравнению с талидомидом, можно отобрать, например, в результате выполнения контрольного эксперимента с использованием талидомида вместо испытуемого вещества и сравнения связывающей способности испытуемого вещества с аналогичным показателем талидомида.
CRBN считается молекулой-мишенью, опосредующей вызываемое талидомидом тератогенное действие. Поэтому можно предположить, что вещество, которое не связывается с CRBN, или вещество, характеризующееся более низкой связывающей способностью по сравнению с талидомидом, не оказывает тератогенного действия, присущего талидомиду, или оказывает более слабое тератогенное действие.
Хотя испытуемое вещество не имеет каких-либо конкретных ограничений, желательно, чтобы такое вещество было пригодно для введения человеку или других животным, и примеры таких веществ включают лекарственное средство, фармацевтическую добавку, пищевой продукт, пищевую добавку или химическое соединение, содержащееся в указанных веществах.
Производные талидомида имеют важное значение для получения лекарственных средств.
Примеры производного талидомида включают соединение, выраженное нижеследующей общей формулой (1):
Общая формула (1)
Формула 8
где соединение, в котором Х означает R5-R7 и Y означает R6-R8, именуется соединением (А), соединение, в котором Х означает R5 и Y означает R6-R8, именуется соединением (В) и соединение, в котором Х означает R5 и Y означает R8, именуется соединением (С);
каждый элемент R1, R2, R3 и R4 может быть выбран из -Н; -ОН; =О; алкана, алкена и алкина с линейной или разветвленной цепью; циклического алкана, алкена и алкина; комбинации циклического и нециклического алкана, алкена и алкина; спирта, альдегида, кетона, карбоновой кислоты, сложного эфира или простого эфира, объединяющего кольцевую и некольцевую структуру, или комбинации циклических/ нециклических частей; аза; амино; -MOn или -O-MOn [где М=N и n=2; М=S и n=2 или 3; М=Р и n=1-3]; и галогена;
каждый элемент R5, R6, R7 и R8 независимо выбирают из группы формулы (2):
Формула 9

и -О- (где Z является необязательным элементом и имеет такие же значения, что и вышеописанный элемент R1); и R10 имеет такие же значения, что и вышеописанный элемент R1, или (когда Z отсутствует) R10=О;
R9 означает часть, имеющую формулу (3), (4), (5), (6) или (7):
Формула 10
Формула 11
Формула 12
Формула 13

где каждый элемент R11-R17 (независимо) имеет такие же значения, что и вышеописанный элемент R5, или
Формула 14

где каждый элемент R18, R19 и R20 независимо выбирают из Н, -СН3, -СООН, -CONH2, -(CH2)n-COOH, -(CH2)nCONH2, где n=1-4.
Было установлено, что из производных талидомида 5-гидрокси(2,6-диизопропилфенил)-1Н-изоиндол-1,3-дион (5НРР-33) обладает чрезвычайно низкой способностью связываться с цереблоном при сохранении фармакологического действия, такого как ингибирование роста миеломных клеток человека.
Предпочтительным производным талидомида представляет собой производное, обладающее фармакологическим действием талидомида или известных производных талидомида.
В научной литературе были указаны следующие фармакологические действия талидомида: (i) подавление вызываемого bFGF развития кровеносных сосудов; (ii) подавление продуцирования TNF-α LPS-стимулированными моноцитами человека и продуцирования IL-6 при сокультивировании опухолевых клеток, таких как миеломные клетки человека, и стромальных клеток костного мозга человека; (iii) увеличение числа естественных клеток-киллеров в периферической крови больных множественной миеломой, усиление продуцирования IL-2 и INF-γ после стимуляции Т-клеточного рецептора и стимуляция IL-2-зависимой пролиферации Т-клеток; и (iv) индукция апоптоза и ингибирование роста опухолевых клеток, таких как миеломные клетки человека.
Кроме того, примеры профилактического или терапевтического действия талидомида включают седативный эффект, лепру (в частности, нодозную эритему), реакцию ”трансплантат против хозяина”, множественную миелому, солидный рак, системную красную волчанку, рассеянный склероз, болезнь Бехчета и воспалительное заболевание кишечника (болезнь Крона и неспецифический язвенный колит). Примеры фармакологического действия известных производных талидомида включают терапевтические воздействие леналидомида на множественную миелому и миелодисплазию (MDS) и терапевтическое воздействие помалидомида на множественную миелому и миелофиброз.
CRBN является известным белком, и в базе данных опубликована также последовательность оснований гена, кодирующего CRBN (ген CRBN). Например, последовательности оснований гена CRBN человека, мыши, крысы и данио-рерио зарегистрированы в Entrez Gene соответственно под идентификатором гена: 51185, идентификатором гена: 58799, идентификатором гена: 297498 и идентификатором гена: 445491. Могут быть использованы CRBN и ген CRBN, выделенные естественным путем, а также мутированный CRBN, состоящий из аминокислотной последовательности природного CRBN с делецией, заменой или добавлением одного или нескольких мутантов CRBN, способных образовывать активный убихитин-лигазный комплекс, и ген, кодирующий указанный мутированный CRBN.
Авторы настоящего изобретения выявили талидомид-связывающую область в CRBN человека. Поэтому даже при использовании вместо CRBN фрагмента CRBN, содержащего талидомид-связывающую область, все же необходимо определить связывающую способность такого фрагмента. Примеры талидомид-связывающей области включают область, состоящую из 104 С-концевых аминокислот CRBN человека. В CRBN, выделенном из организмов, отличных от человека, в качестве талидомид-связывающей области может быть использована область, соответствующая вышеуказанной области, состоящей из 104 С-концевых аминокислот (то есть область, совместимая с областью, состоящей из 104 С-концевых аминокислот CRBN человека, при выполнении сравнительного анализа на основании идентичности аминокислот).
Примеры фрагмента CRBN включают фрагмент CRBN, содержащий N-концевую аминокислотную последовательность от остатка 339 до остатка 442, показанную в SEQ ID NO:7, и остальную часть аминокислотной последовательности SEQ ID NO:7, в которой произведена замена, делеция и/или добавление одного или нескольких аминокислотных остатков, и фрагмент CRBN, выделенный из разных организмов, который соответствует вышеуказанному фрагменту CRBN человека. Кроме того, CRBN и фрагменты CRBN могут быть получены в виде гибридного белка путем добавления других белков.
Несмотря на то, что CRBN или фрагмент CRBN, использованные в настоящем изобретении, могут представлять собой любой вышеуказанный CRBN, выделенный из разных организмов, мутированный CRBN и фрагменты указанных CRBN, в соответствии с целью настоящего изобретения, включающей получение производных талидомида, не оказывающих тератогенного воздействия на человека, желательно использовать CRBN человека или фрагмент CRBN человека.
CRBN и фрагмент CRBN предпочтительно иммобилизуют на носителе. Хотя носитель не имеет каких-либо конкретных ограничений, если он позволяет иммобилизовать CRBN и фрагмент CRBN, желательно использовать материал в виде частиц, а также магнитный носитель. Примеры предпочтительного носителя включают магнитные наногранулы, покрытые органическим полимером. Хотя диаметр частиц магнитных наногранул, покрытых органическим полимером, не имеет каких-либо конкретных ограничений, желательно использовать частицы с диаметром 1-500 нм, более предпочтительно 20-300 нм. Примеры органического полимера включают GMA, сополимер GMA и стирола, полиметакриловую кислоту и полиакриловую кислоту. Конкретные примеры магнитных наногранул, покрытых органическим полимером, включают гранулы SG (Kawaguchi et al. Nucleic Acids Research 1989, 17: 6229 to 6240), гранулы FG (Nishio et al., Colloids and Surfaces B: Biointerfaces 2008, 64: 162 to 169), гранулы Dyna, гранулы Adem и гранулы Nanomag.
Способность производного талидомида связываться с CRBN можно определить стандартным методом, например, при помощи резонанса поверхностных плазмонов с использованием прибора BIAcore или изотермической титрационной калориметрии (ITC).
Хотя способ скрининга по настоящему изобретению не имеет каких-либо конкретных ограничений, если он позволяет определить способность испытуемого вещества связываться с CRBN или фрагментом CRBN, указанный способ скрининга может быть выполнен следующим образом.
(А) Способ скрининга с использованием гранул FG
Сначала получают гранулы FG, содержащие иммобилизованный талидомид. Гранулы, содержащие иммобилизованный талидомид, смешивают с экстрактами CRBN-экспрессирующих клеток или рекомбинантными белками и инкубируют в течение одного часа или более продолжительного времени в ротационном шейкере, вращающемся со скоростью 5 оборотов/мин, при 4°С. Затем гранулы промывают буфером, например, буфер, содержащий производное талидомида в качестве испытуемого вещества, пропускают через гранулы для элюирования CRBN. Примеры методов обнаружения элюированного CRBN включают вестерн-блоттинг, дот-блоттинг, окрашивание СВВ и окрашивание серебром. В качестве контрольных образцов используют талидомид и фталимид, который, как известно, не связывается с CRBN. Кроме того, для анализа большого количества образцов можно использовать прибор для скрининга гранул FG серии Target Angler компании Tamagawa Seiki Co.
(В) Скрининг с использованием прибора BIACore
CRBN, содержащий функциональную группу, такую как аминогруппа или карбоксильная группа, сначала иммобилизируют на сенсорном чипе BIACore. Затем через измерительный прибор BIACore (GE Healthcare), такой как BIACore 3000, в который помещают чип с иммобилизованным CRBN, пропускают разные производные и измеряют константу диссоциации. В качестве контрольных образцов используют талидомид и фталимид.
(С) Скрининг при помощи изотермической титрационной калориметрии
Раствор, содержащий производное талидомида, добавляют в виде капель несколько десятков раз (например, 18 раз) к раствору, содержащему CRBN, в ячейке для образца. Строят график количества калорий, образующихся при каждой концентрации, в зависимости от молярного отношения производного к CRBN в ячейке и определяют изотерму связывания для взаимодействия. Константу диссоциации вычисляют на основании полученной таким образом изотермы связывания. В качестве контрольных образцов используют талидомид и фталимид.
(2) Способ скрининга антагониста тератогенного вещества
Способ скрининга антагониста тератогенного вещества по настоящему изобретению включает стадию приведения испытуемого вещества в контакт с CRBN или фрагментом CRBN путем смешивания или подобным способом, оценку наличия или отсутствия связывания испытуемого вещества с CRBN или фрагментом CRBN и отбор испытуемого вещества, связывающегося с CRBN или фрагментом CRBN, и стадию выбора из веществ, отобранных на предыдущей стадии, вещества, способного уменьшать i) тератогенное действие или ii) ингибирующее действие на убихитин-лигазный комплекс, содержащий CRBN.
Антагонист тератогенного вещества, такого как талидомид, полученный вышеуказанным способом, ингибирует связывание тератогенного вещества с CRBN. Таким образом, риск тератогенного воздействия, которому подвергается субъект, принимающий тератогенное вещество, такое как талидомид и его производные, можно уменьшить благодаря одновременному использованию указанного антагониста.
Первая половина стадий, то есть стадия приведения испытуемого вещества в контакт с CRBN или фрагментом CRBN, оценки наличия или отсутствия связывания испытуемого вещества с CRBN или фрагментом CRBN и отбора испытуемого вещества, связывающегося с CRBN или фрагментом CRBN, может быть выполнена аналогично способу скрининга, описанному в пункте (1).
Если вещество, отобранное в результате выполнения первой половины стадий, является не агонистом, а антагонистом, такое вещество должно ослаблять действие, оказываемое тератогенным веществом, таким как талидомид. Таким образом, антагонист тератогенного вещества может быть отобран путем оценки наличия или отсутствия у вещества способности ослаблять тератогенное действие или ингибирующее действие, оказываемое на активность убихитин-лигазного комплекса, содержащего CRBN.
Примеры действия, оказываемого талидомидом, включают, помимо ранее известного тератогенного действия, ингибирующее действие, оказываемое на активность убихитин-лигазного комплекса, которое было обнаружено авторами настоящего изобретения.
Наличие или отсутствие у испытуемого вещества способности ослаблять действие, оказываемое талидомидом, можно проверить, сравнивая действие талидомида в присутствии и отсутствии испытуемого вещества.
Хотя способ скрининга антагониста тератогенного вещества по настоящему изобретению не имеет каких-либо конкретных ограничений, такой способ может быть выполнен следующим образом.
Сначала подтверждают способность антагониста-кандидата связываться с CRBN. Метод подтверждения связывающей способности аналогичен способу скрининга, описанному в пункте (1). Антагонисты-кандидаты, которые, как установлено на данной стадии, в значительной степени связываются с CRBN, затем исследуют следующими методами.
(А) Воздействие на убихитинирование in vitro
Антагонист-кандидат и талидомид добавляют к клеткам 293Т, экспрессирующим FH-CRBN. Затем методом вестерн-блоттинга определяют количество убихитинированного белка в экстрактах клеток. Если количество убихитинированного белка уменьшается в большей степени при добавлении антагониста-кандидата по сравнению с добавлением только талидомида, антагонист-кандидат признается антагонистом.
(В) Скрининг с использованием данио-рерио
Эмбрионы данио-рерио с удаленным хорионом оставляют развиваться в среде, содержащей талидомид и антагонист-кандидат. Если образование слуховых пузырьков и плавников оказывается менее аномальным, чем при добавлении только талидомида, антагонист-кандидат признается антагонистом.
(3) Мутированный CRBN
Мутированный CRBN по настоящему изобретению характеризуется наличием следующей замены аминокислоты (а) и/или (b).
(а) Замена тирозина в положении 384 от N-конца CRBN человека или эквивалентной аминокислоты ананином.
(b) Замена триптофана в положении 386 от N-конца CRBN человека или эквивалентной аминокислоты аланином.
В настоящем изобретении выражение ”аминокислотный эквивалент тирозина в положении 384 от N-конца CRBN человека” означает, как показано на фиг.12, аминокислоту, соответствующую тирозину в положении 384 от N-конца CRBN человека, при выполнении сравнительного анализа на основании идентичности аминокислот. Как показано на фиг.12, вышеуказанному аминокислотному эквиваленту соответствует тирозин в положении 361 от N-конца CRBN мыши; тирозин в положении 374 от N-конца CRBN данио-рерио; тирозин в положении 517 от N-конца CRBN дрозофилы фруктовой и тирозин в положении 504 CRBN арабидопсиса Таля. Аналогичным образом в настоящем изобретении выражение ”аминокислотный эквивалент триптофана в положении 386 от N-конца CRBN человека” означает аминокислоту, соответствующую триптофану в положении 386 от N-конца CRBN человека, при выполнении сравнительного анализа на основании идентичности аминокислот. Как показано на фиг.12, вышеуказанному аминокислотному эквиваленту соответствует триптофан в положении 363 от N-конца CRBN мыши; триптофан в положении 376 от N-конца CRBN данио-рерио; триптофан в положении 519 от N-конца CRBN дрозофилы фруктовой и триптофан в положении 506 CRBN арабидопсиса Таля.
Нуклеиновая кислота, кодирующая мутированный CRBN, может быть трансфецирована и экспрессирована в животных стандартным методом. Например, может быть создан экспрессирующий вектор, несущий ДНК, кодирующую мутированный CRBN, который трансфецируют в оплодотворенные яйца животных, и использованы подобные методы. Животное, которому трансфецируют указанную нуклеиновую кислоту, не имеет каких-либо конкретных ограничений, если такое животное не является человеком, при этом могут быть использованы, например, рыбки данио-рерио, цыплята, мыши и кролики.
Мутированный CRBN по настоящему изобретению сохраняет активность убихитин-лигазного комплекса, но не связывается с талидомидом. Поэтому животное, которому была введена нуклеиновая кислота, кодирующая указанный мутированный CRBN, и которое экспрессирует указанную нуклеиновую кислоту, приобретает устойчивость к вызываемому талидомидом тератогенному действию.
Животное, которому была введена нуклеиновая кислота, кодирующая мутированный CRBN, и которое экспрессирует указанную нуклеиновую кислоту, может быть использовано, например, для анализа других фармакологических действий помимо тератогенного действия. Кролики и цыплята, которым был трансфецирован мутированный CRBN, приобретают устойчивость к тератогенному дейтвию, поэтому фармакологическое действие, оказываемое талидомидом и его производными в организме указанных животных после введения, не зависит от тератогенного действия. Таким образом, животные, которым был трансфецирован мутированный CRBN, особенно пригодны для анализа воздействий, оказываемых талидомидом, которые не зависят от механизма тератогенного действия.
ПРИМЕРЫ
[Пример 1] Способность талидомида связываться с CRBN и DDB1
Талидомид-связывающие белки очищали при помощи аффинной хроматографии с использованием гранул FG, представляющих собой магнитные частицы (приведенный литературный источник 9). Производное талидомида FR259625, в которое была добавлена карбоксильная группа, иммобилизовали при помощи ковалентной связи на гранулах FG (фиг.6), смешивали и инкубировали с экстрактами клеток HeLa человека. Затем гранулы промывали, талидомид-связывающие белки избирательно элюировали свободным талидомидом и элюированные фракции анализировали при помощи SDS-PAGE и окрашивания серебром. В результате выполненного эксперимента были специфически элюированы два белка с молекулярной массой 127 кДа и 55 кДа (фиг.1А, блок 3). При добавлении свободного талидомида к экстрактам до смешивания с гранулами выход указанных белков, полученных в результате очистки при помощи аффинной хроматографии, значительно снижался (фиг.1А, блок 4), из чего следует, что указанные белки специфически связываются с талидомидом. Белки с молекулярной массой 127 и 55 кДа анализировали при помощи масс-спектрометрии, в результате чего указанные белки были соответственно идентифицированы как DDB1 и CRBN (таблица 1). Идентичность указанных белков была также подтверждена методом вестерн-блоттинга (иммуноблоттинга) (фиг.1А), после чего указанные белки были выделены таким же образом в виде талидомид-связывающих белков из экстрактов клеток разных типов (фиг.7). Чтобы определить, является ли такое взаимодействие с талидомидом результатом прямого связывания, очищали рекомбинантные белки. С гранулами, содержащими иммобилизованный талидомид, связывался CRBN-FLAG и не связывался DDB1-V5-His (фиг.1В). Можно предположить, что DDB1 связывается с талидомидом опосредованно через CRBN. Полученные результаты показывают, что талидомид связывается непосредственно с CRBN (фиг.1С), в то время как DDB1 связывается с талидомидом в результате его взаимодействия с CRBN.
[Таблица 1]

[Пример 2]
Образование комплекса Е3 белками CRBN, DDB1 и Cul4A
CRBN человека сначала был описан в научной литературе в качестве гена-кандидата, определяющего легкую форму аутосомной рецессивной олигофрении (приведенный литературный источник 11) и кодирующего белок, состоящий из 442 аминокислот. Указанный белок хорошо сохранился в процессе эволюции от растений до человека. Хотя в научной литературе сообщалось, что в недавно выполненном анализе белка CRBN связывался с DDB1 (приведенный литературный источник 12), функциональное взаимодействие указанных белков оставалось неясным и биологические функции CRBN в основном не известны.
Авторы настоящего изобретения выполнили биохимический анализ для исследования воздействия талидомида на функции CRBN. Были получены клетки 293Т, устойчиво экспрессирующие FH-CRBN, и экстракты указанных клеток очищали при помощи иммуноаффинной хроматографии с использованием антитела против FLAG для выявления CRBN-связывающих белков. Очищенный продукт окрашивали серебром, в результате чего было установлено, что CRBN связывается с DDB1 при молярном отношении, равном примерно 1:1 (фиг.8). Иммунное окрашивание (фиг.2А) показало, что CRBN и DDB1 локализованы главным образом в ядре. Полученный результат позволил предположить, что указанные белки выполняют важные функции в ядре. Как сообщалось в научной литературе, DDB1 является компонентом убихитин-лигазных комплексов Е3, содержащих Cul4 (Cul4A или Cul4B), регулятор куллина 1 (Roc1) и рецептор субстрата (приведенные литературные источники 13 и 14). Убихитин-лигазные комплексы Е3, в частности, регулируют полиубихитинирование белка субстрата благодаря специфическому взаимодействию с убихитин-конъюгирующим ферментом (Е2) (приведенные литературные источники 15 и 16). Cu14 является основным белком, в то время как Roc1 содержит кольцевую пальцеобразную область, ассоциированную с убихитин-конъюгирующим ферментом Е2. Рецепторы субстрата, такие как DDB2, CSA, SV5-V, CDT2 и AhR, связываются непосредственно со специфическими субстратами и опосредуют их убихитинирование (приведенные литературные источники 13 и 7-20).
Авторы настоящего изобретения исследовали способность CRBN взаимодействовать с другими компонентами комплекса Е3 и обнаружили, что DDB1, Cul4A и Roc1 образуют комплекс с FH-CRBN (фиг.2В). Если CRBN является новым рецептором субстрата, следует ожидать, что он будет конкурировать за связывание с DDB1 с другими рецепторами субстрата, такими как DDB2. Действительно количество DDB1, осажденного с CRBN, уменьшалось в присутствии возрастающих количеств коэкспрессированного DDB2 (фиг.2С). То есть полученные результаты показывают, что CRBN функционирует в качестве субстрат-связывающей субъединицы убихитин-лигазного комплекса DDB1-Cul4-Roc1 E3.
Авторы настоящего изобретения исследовали наличие у комплекса CRBN активности убихитин-лигазного комплекса Е3. Известно, что рецепторы субстрата и Cul4 подвергаются аутоубихитинированию in vitro. В результате выполнения анализа убихитинирования in vitro с использованием GST-меченного убихитина, Unal (E1), Ubal2 (E2) и комплекса CRBN действительно была обнаружена убихитинирующая активность в присутствии комплекса CRBN (фиг.9). Для исследования аутоубихитинирования CRBN в живых клетках клетки 293Т, экспрессирующие FH-CRBN, обрабатывали ингибитором протеосомы MG132. Аутоубихитинирование CRBN было обнаружено в присутствии MG132, причем убихитинирование указанного белка уменьшалось в результате миРНК-опосредованного подавления экспрессии Cul4A (фиг.2D). Удаление DDB1 вызывало значительное снижение уровня белка CRBN (фиг.10), поэтому было невозможно определить эффект подавления экспрессии DDB1 на аутоубихитинирование CRBN. Тем не менее, полученный результат позволяет предположить, что DDB1 и CRBN функционально связаны друг с другом.
Чтобы определить роль DDB1 в функции CRBN, был получен мутант CRBN, не способный связываться с DDB1. Анализ мутации с делецией показал, что делеция аминокислот 187-260 CRBN аннулирует его взаимодействие с DDB1 (фиг.11, ΔMid). Было установлено, что аутоубихитинирование в ΔMid-экспрессирующих клетках 293Т, обработанных MG132, значительно снижается по сравнению с клетками 293Т, экспрессирующих CRBN дикого типа. На основании вышеуказанных результатов был сделан вывод о том, что CRBN является субъединицей функционального убихитин-лигазного комплекса Е3 и подвергается аутоубихитинированию в зависимости от Cul4A и DDB1.
[Пример 3] Ингибирование функции CRBN талидомидом
Чтобы определить молекулярную основу взаимодействия CRBN с талидомидом и функциональное значение такого взаимодействия, авторы настоящего изобретения предприняли попытку получить точковый мутант CRBN, не связывающийся с талидомидом, но входящий в состав функционального комплекса Е3. Сначала была исследована талидомид-связывающая область с использованием N-концевых и С-концевых мутантов с делецией. В результате выполненного исследования было установлено, что талидомид-связывающая область состоит из 104 С-концевых аминокислот (фиг.3А и В). Анализ гомологии многочисленных гомологов CRBN от арабидопсиса Таля до человека показал, что С-концевая область является в высшей степени консервативной (фиг.12). С учетом того, что остаток, хорошо сохранившийся в процессе эволюции, может иметь важное значение для связывания талидомида, было создано несколько точковых мутантов, при этом было установлено, что два точковых мутанта, Y384A и W386A, не связывались с талидомидом (фиг.3С). Кроме того, было установлено, что мутант Y384A/W386A (мутант, именуемый CRBN YW/AA, в котором были одновременно заменены два остатка) обладает чрезвычайно низкой талидомид-связывающей активностью (фиг.3С). Авторы настоящего изобретения исследовали функциональную активность CRBN YW/AA в клетках. Субклеточная локализация указанного мутанта не отличалась от локализации CRBN дикого типа. Было установлено, что CRBN YW/AA осаждается с белками DDB1, Cul4A и Roc1 и подвергается аутоубихитинированию в присутствии MG132 (фиг.3Е и F). То есть CRBN YW/AA образует комплекс Е3 аналогично CRBN дикого типа и сохраняет указанную функцию.
Авторы настоящего изобретения исследовали ингибирование талидомидом убихитинирования CRBN-содержащего комплекса Е3. Клетки 293Т, устойчиво экспресссирующие FH-CRBN или FH-CRBN YW/AA, обрабатывали MG132 и талидомидом (10, 30 и 100 мкМ) в концентрации, соответствующей терапевтическим дозам, вводимым человеку. Талидомид сильно ингибировал аутоубихитинирование CRBN дикого типа и не влиял на аутоубихитинирование CRBN YW/AA (фиг.3G). Полученные результаты позволяют предположить, что табидомид ингибирует функцию Е3 в результате связывания с CRBN.
[Пример 4] CRBN в качестве мишени для талидомида in vivo
Затем авторы настоящего изобретения исследовали роль CRBN в вызываемом талидомидом тератогенном действии с использованием животной модели. Талидомид оказывает тератогенное действие в организме кроликов и цыплят и не является тератогенным для мышей (приведенные литературные источники 1-3). В данном исследовании в качестве модели была использована рыбка данио-рерио (Danio rerio) по следующим причинам: (i) быстрое развитие можно контролировать в реальном времени благодаря прозрачности эмбриона, (ii) может быть легко произведена генетическая супрессия (приведенный литературный источник 21) и (iii) рыбка данио-рерио пригодна для фармакотоксикологических исследований (приведенный литературный источник 22). Хотя не было известно о тератогенном действии талидомида в данио-рерио, ранее было установлено, что талидомид ингибирует развитие кровеносных сосудов у данио-рерио (приведенный литературный источник 23), поэтому авторы настоящего изобретения предположили, что талидомид также должен оказывать тератогенное действие в данио-рерио.
Для выявления возможного воздействия талидомида на развитие данио-рерио эмбрионы с удаленным хорионом переносили в среду, содержащую талидомид в разных концентрациях. Талидомид добавляли через два часа после оплодотворения (hpf) и следили за процессом развития в течение трех дней. Было установлено, что в эмбрионах, обработанных талидомидом, было нарушено развития грудных плавников и слуховых пузырьков (фиг.4А и В), при этом талидомид не влиял на другие аспекты развития. В частности, образование эндоскелетного диска грудного плавника было ингибировано через 75 часов после оплодотворения (фиг.4А) и размер слуховых пузырьков уменьшился через 30 часов после оплодотворения (фиг.4В). У эмбрионов через 48 часов после оплодотворения была также обнаружена задержка развития грудного плавника (фиг.5С и D). Недавно выполненные исследования показали, что развитие грудных плавников и слуховых пузырьков у костистых рыб (включая данио-рерио) происходит в соответствии с общими молекулярными механизмами развития конечностей и ушей у четвероногих животных (приведенные литературные источники 24-26). Таким образом, дефекты развития, вызываемые талидомидом, у данио-рерио аналогичны дефектам развития у женщин, принимавших талидомид на начальной стадии беременности, из чего следует, что вызываемое талидомидом тератогенное действие сохранилось у позвоночных в процессе эволюции.
Данио-рерио также имеет ортолог CRBN (гомологичный ген, обнаруженный в других видах), именуемый zcrbn. Генный продукт zcrbn примерно на 70% идентичен CRBN человека. Авторы настоящего изобретения исследовали паттерн экспрессии мРНК zcrbn и обнаружили, что данный ген экспрессирован в головном мозге, сосудистой сети головы, в ушах и грудных плавниках через 48 часов после оплодотворения (фиг.13). Было установлено, что zcrbn связывается как с талидомидом, так и с DDB1 человека (фир. 14), из чего следует, что результаты, полученные для линии клеток человека, действительны также для данио-рерио. Затем была исследована функция zcrbn на ранней стадии развития данио-рерио. Аналогично воздействию талидомида в эмбрионах, в которые вводили антисмысловой морфолиноолигонуклеотид (АМО) для zcrbn, возникали дефекты развития плавников и слуховых пузырьков (фиг.4С-F), относящиеся к таким же фенотипам, что и дефекты, возникающиеся в эмбрионах, обработанных талидомидом. Например, в эмбрионах, в которые вводили zcrbn-AMO, через 27 часов после оплодотворения размер слуховых пузырьков уменьшился на 40% по сравнению со слуховыми пузырьками дикого типа (фиг.4F). Указанные дефекты не возникали при совместном введении мРНК zcrbn (фиг.4С-F).
Вышеуказанные результаты позволяют предположить высокую вероятность того, что талидомид оказывает тератогенное действие, ингибируя функцию zcrbn. Если это так, то тератогенное действие должно быть ослаблено благодаря экспрессии функционально активного, но не связывающегося с талидомидом zcrbn. Для исследования данной гипотезы были получены мутанты, в которых остатки Y374 и W376 были заменены аланином (соответствующие YW/AA человека, а именно Y384A/W386A). zCrbn YW/AA обладает чрезвычайно низкой талидомид-связывающей активностью. При отсутствии талидомида сверхэкспрессия zcrbn дикого типа или zcrbn YW/AA не оказывает видимого воздействия на развитие плавников и слуховых пузырьков. Как показано на фиг.4В, обработка 400 мкМ талидомида существенно уменьшает размер слуховых пузырьков (на 64,5% по сравнению с контрольным размером, фиг.5А и В). Обработка талидомидом эмбрионов, сверхэкспрессирующих zcrbn дикого типа, также уменьшает размер слуховых пузырьков примерно на 66% по сравнению с контрольным размером. Однако важно отметить, что обработка талидомидом эмбрионов, сверхэкспрессирующих zcrbn YW/AA, не влияла на размер слуховых пузырьков (р=0,347). Нарушение развития плавников под воздействием талидомида также не возникало при сверхэкспрессии zcrbn YW/AA. Полученные результаты показывают, что талидомид оказывает тератогенное действие, связываясь с CRBN и ингибируя его функцию.
[Пример 5] Молекулярный механизм вызываемого талидомидом тератогенного действия
После обнаружения связи между талидомидом и CRBN авторы настоящего изобретения исследовали участие CRBN-содержащего убихитин-лигазного комплекса в вызываемом талидомидом тератогенном действии путем подавления экспрессии zCul4A. мРНК zcul4a высоко экспрессирована в головном мозге и плавниках (фиг.13). Как и предполагалось, zcul4a AMO вызывает дефекты слуховых пузырьков и плавников (фиг.4G-I). Размер слуховых пузырьков был заметно меньше в эмбрионах с удаленным zcul4a через 27 часов после оплодотворения (на 40% по сравнению с контрольным размером), причем указанный дефект был частично устранен в результате совместного введения мРНК zcul4a. Неполное устранение указанного дефекты может быть связано с избыточной активностью zcul4a AMO. Тем не менее, полученные результаты позволяют предположить, что убихитин-лигазный комплекс необходим для развития слуха и плавников и является мишенью для талидомида.
Вышеуказанные результаты показали, что убихитинирование определенных белков под воздействием CRBN-содержащего комплекса Е3 имеет важное значение для развития слуха и плавников, и позволили сделать вывод о том, что вызываемые талидомидом дефекты развития ассоциированы с нарушением функции CRBN-содержащего комплекса Е3. Чтобы определить сигнальные пути внизу от CRBN и талидомида, авторы настоящего изобретения анализировали хорошо известные основные молекулы, участвующие в развитии плавников. Ген Sonic hedgehog (Shh) экспрессирован в зоне поляризующей активности (ZPA) и отвечает за форму передних и задних конечностей и плавников (приведенный литературный источник 27), в то время как Fgf8 экспрессирован в апикальном эктодермальном гребне (AER) конечностей и плавников и необходим для отрастания конечностей и плавников вдоль проксимально-дистальной оси. В эмбрионах, обработанных талидомидом через 48 часов после оплодотворения, экспрессия fgf8a была снижена или отсутствовала (фиг.5С), при этом экспрессия shh не изменялась (фиг.5D). Кроме того, экспрессия fgf8a, сниженная под воздействием талидомида, была восстановлена в результате одновременного введения zcrbn YW/AA. Экспрессия fgf8a была также снижена в эмбрионах, в которые выводили zcrbn или zcul4a AMO, при этом экспрессия shh не изменялась. Таким образом, ингибитор продуцирования FGF8 является вероятной мишенью для талидомида и CRBN-содержащего комплекса Е3 в нижней области.
[Пример 6] Способность фталимида связываться с CRBN и DDB1
Способность фталимида, являющегося известным нетератогенным производным талидомида, связываться с CRBN и DDB1 была исследована следующим образом.
Гранулы, содержащие иммобилизованный талидомид, смешивали с экстрактами клеток 293Т и затем промывали. Факторы, связанные талидомидом, элюировали из гранул талидомидом или фталимидом. CRBN и DDB1 в элюированных фракциях анализировали методом вестерн-блоттинга. CRBN и DDB1 были обнаружены во фракции, элюированной талидомидом, и не были обнаружены во фракции, элюированной фталимидом (Phthal) (фиг.16).
[Пример 7]
Исследование связывания производных талидомида с CRBN
Экстракты клеток 293Т смешивали с гранулами, содержащими иммобилизованный талидомид, и инкубировали в течение двух часов. Затем гранулы трижды промывали лизирующим буфером c 0,5% NP-40 (трис-буфер с HCl, рН 8, 150 мМ NaCl, 0,5% NP-40) и смешивали с лизирующим буфером с 0,5% NP-40, содержащим 0,1-1 мМ талидомида, фталимида, глутаримида или 5НРР-33 (структурные формулы соответствующих соединений представлены на фиг.17) в течение одного часа для элюирования CRBN. Элюированные фракции анализировали методами SDS-PAGE и вестерн-блоттинга, используя антитело против CRBN. Результаты показаны на фиг.18.
Как показано на данной фигуре, очень мало CRBN было элюировано буфером, содержащим фталимид или 5НРР-33. На основании полученных результатов можно сделать вывод о том, что фталимид и 5НРР-33 обладают низкой способностью связываться с CRBN.
[Пример 8]
Ингибирование роста клеток множественной миеломы
Было исследовано ингибирующее действие талидомида и 5НРР-33 на пролиферацию клеток множественной миеломы Kms12.
Клетки множественной миеломы Kms12 культивировали в среде RPMI 1640, содержащей 10% FBS. Среду, предназначенную для обработки лекарственными средствами, доводили до 2×105 клеток Kms12/мл и вводили в 2 мл пробирки Eppendorf в виде 2 мл аликвот. Для получения исходного раствора талидомид или 5НРР-33 растворяли в диметилсульфоксиде (ДМСО) в концентрации, соответственно равной 100 мМ и 10 мМ. Исходный раствор добавляли к взвеси клеток в количестве 2 мкл/2 мл, после чего осторожно и тщательно перемешивали. Смесь клеток переносили на 96-луночный планшет в количестве 100 мкл/лунку и культивировали при 37°С и 5% СО2 в течение 48 часов. Для определения числа живых клеток в культуральную среду добавляли реагент для подсчета клеток SF (Nacalai Tesque, Inc.) и инкубировали в течение 2 часов. Оптическую плотность при 450 нм, которая соответствует числу живых клеток, измеряли при помощи детектирующей системы GloMax-Multi+ (Promega KK). Для построения калибровочной кривой использовали 1×106, 3×105 и 1×105 клеток Kms12/мл. Приняв число клеток, обработанных растворителем, равным 100, определяли относительные значения числа клеток, обработанных лекарственными средствами. Относительные значения числа клеток показаны на фиг.19.
Как показано на данной фигуре, 5НРР-33 оказывал сильное супрессорное действие на пролиферацию клеток множественной миеломы Kms12. Как показано в примере 7, 5НРР-33 обладает низкой способностью связываться с CRBN. Таким образом, ингибирующее рост клеток действие 5НРР-33 не зависит от связывания с CRBN.
Рассмотрение результатов
Гипотеза, состоящая в том, что CRBN функционирует в качестве субъединицы рецептора субстрата убихитин-лигазного комплекса DDB1-Cul4A-Roc1 E3, подтверждена следующими результатами. Во-первых, связывание CRBN с DDB1 происходит в конкурентной борьбе с DDB1, хорошо известным рецептором субстрата. Во-вторых, CRBN подвергается аутоубихитинированию аналогично другим рецепторам субстрата. Хотя многие рецепторы субстрата, в том числе DDB2, содержат фрагмент WDXR (приведенные литературные источники 11 и 19), известно, что у небольшого числа рецепторов субстрата указанный фрагмент отсутствует (приведенные литературные источники 13 и 18). Так как CRBN не содержит идентифицируемого фрагмента WDXR, указанный белок может относиться к рецепторам субстрата последнего типа. Дополнительно было установлено, что подавление экспрессии CRBN и Cul4a вызывает аналогичные дефекты развития у данио-рерио. Однако подавление экспрессии Cul4A вызывало образование более дефектного фенотипа по сравнению с подавлением экспрессии CRBN. Данное открытие не является удивительным, так как CRBN является лишь одним из нескольких рецепторов субстрата, ассоциированных с комплексом DDB1-Cul4-Roc1, и поэтому CRBN влияет только на указанные комплексы, в то время как подавление экспрессии Cul4A должно влиять на все убихитин-лигазные комплексы DDB1-Cul4.
Механизм действия талидомида является многосторонним и до сих пор полностью не изученным. Можно предположить, что причиной тератогенной активности талидомида, а также его терапевтического воздействия при лечении нодозной эритемы и множественной миеломы частично является иммуномодулирующую действие и действие, препятствующее развитию кровеносных сосудов (приведенные литературные источники 2 и 3). Кроме того, как было указано в научной литературе, талидомид подавляет продуцирование некоторых цитокинов, таких как TNF-альфа и VEGF (приведенные литературные источники 30 и 31). Талидомид также может вызывать апоптоз и продуцирование реакционно-способных разновидностей кислорода (ROS) (приведенные литературные источники 3, 4 и 32). Несмотря на наличие указанных данных, мишень, на которую непосредственно воздействует талидомид, оставалась неизвестной. Авторы настоящего изобретения получили несколько свидетельств того, что основной мишенью, опосредующей вызываемое талидомидом тератогенное действие, является CRBN. Во-первых, талидомид связывается непосредственно с CRBN для ингибирования аутоубихитинирования CRBN. Такое явление возникает в результате ингибирования образованного убихитин-лигазного комплекса, содержащего CRBN, и подобные явления были также обнаружены в других убихитин-лигазных комполексах (приведенный литературный источник 33). Во-вторых, вызываемые талидомидом дефекты развития у данио-рерио подобны дефектам, возникающим при удалении CRBN, причем такие дефекты могут быть уменьшены в результате сверхэкспрессии мутанта CRBN, не связывающегося с талидомидом. В-третьих, FGF8, который имеет важное значение для отрастания конечностей и плавников, является мишенью для талидомида и комплекса CRBN в нижней области (фиг.4D, 4G и 5С). Полученные результаты согласуются с ранее представленными научными отчетами, в которых подавление экспрессии fgf8 талидомидом было продемонстрировано при выполнении эксперимента с использованием кроликов (приведенный литературный источник 34). Кроме того, в научной литературе было отмечено, что в процессе развития почек конечностей у цыплят талидомид повышает экспрессию костного морфогенетического белка (ВМР) и вызывает апоптоз клеток (приведенный литературный источник 32). В научной литературе было также указано, что BMP мыши подавляет экспрессию FGF8 и вызывает апоптоз клеток в AER (приведенный литературный источник 35). То есть CRBN является недостающим звеном между талидомидом и указанными регуляторами развития.
Вышеуказанные результаты, приведенные в примерах, позволяют предположить, что талидомид оказывает тератогенное действие, связываясь с CRBN и ингибируя активность убихитин-лигазного комплекса (фиг.15). Авторы настоящего изобретения считают, что регулирование убихитин-зависимого протеолиза талидомидом и CRBN вызывает аномальное регулирование сигнальных путей BMP и FGF8 и программ развития, которые требуют нормального функционирования указанный сигнальных путей. Талоидомид также может влиять на другие факторы развития. Однако существует ряд вопросов, на которые не найдены ответы, в частности: каковы субстраты-мишени убихитин-лигазного комплекса Е3, содержащего CRBN; каким образом талидомид ингибирует убихитинирование CRBN? Указанные вопросы требуют дальнейшего исследования.
Экспериментальные методы и материалы
(1) Реагенты
Талидомид (Tocris Cookson) растворяли в диметилсульфоксиде (ДМСО) в конечной концентрации 400 мМ, нагревая при 65°С, и сразу же использовали. MG132 растворяли в ДМСО в конечной концентрации 10 мМ. ДМСО в таких же количествах использовали в качестве контрольных образцов при выполнении экспериментов.
(2) Получение гранул, содержащих иммобилизованный талидомид
Схема получения гранул, содержащих иммобилизованный талидомид, показана на фиг.6. Магнитные гранулы FG (5 мг, приведенный литературный источник 10) подвергали взаимодействию с 10 мМ 1-гидроксибензотриазола, 10 мМ гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 2 мМ FR259625 (производное карбоксилталидомида) в растворителе N,N-диметилформамиде (ДМФ) в течение четырех часов при комнатной температуре. Непрореагировавшие остатки в гранулах FG маскировали 20% угольного ангидрида в ДМФ и полученные гранулы хранили при 4°С.
(3) Очистка гранул, содержащих иммобилизованный талидомид, при помощи аффинной хроматографии
Гранулы, содержащие иммобилизованный талидомид, (0,5 мг) уравновешивали лизирующим буфером с 0,5% NP-40 (50 мМ трис-буфера с HCl, рН 8, 150 мМ NaCl, 0,5% NP-40). Экстракты клеток были получены из клеток HeLa, Джурката, ТНР-1, U266, HUVEC, LP101, SH-SY5Y и 293Т в соответствии с описанием, приведенным в научной литературе (приведенный литературный источник 36). Экстракты смешивали с гранулами и инкубировали в течение двух частов. Гранулы трижды промывали лизирующим буфером с 0,5% NP-40, после чего связанные белки элюировали 1 мМ талидомида. В некоторых экспериментах к экстрактам добавляли 0,3 мМ талидомида до смешивания с гранулами. Для исследования связывающей способности фталимида в процессе элюирования использовали 1 мМ фталимида вместо 1 мМ свободного талидомида.
(4) Плазмиды
кДНК CRBN и DDB2 была получена методом ПЦР с обратной транскрипцией из полной РНК клеток HeLa. Мутанты CRBN были созданы стандартными методами ПЦР. кДНК DDB1 была предоставлена д-ром Мацунага. кДНК zcrbn и zcul4a была получена методом ПЦР с обратной транскрипцией из полной РНК данио-рерио через 24 часа после оплодотворения. В данном исследовании были использованы следующие векторы: pcDNA3.1-FH-N, pcDNA6/V5-His (Invitrogen), pFastBac1 (Invitrogen), pLenti6 (Invitrogen), pCS2 (+) и pGEX6P-1 (GE Healthcare). Вектор pcDNA3.1-FH-N является производным pcDNA3.1, содержащим фрагмент, кодирующий последовательность FLAG-HA.
(5) Антитела
Антитело против CRBN было получено против CRBN кролика (65-76). Антитела против FLAG (M2, Sigma), HA (3F10, Roche), V5 (V5-10, Sigma), GST (Sigma), DDB1 (Abcam) и Roc1 (Zymed) были приобретены в коммерческих источниках. Антитела против Cul4A и против DDB2 были любезно предоставлены д-ром Райхаудхури и д-ром Мацунага.
(6) Анализ связывания, выполненный in vitro с использованием гранул, содержащих иммобилизованный талидомид
Рекомбинантные белки CRBN-FLAG и DDB1-V5-His были экспрессированы в клетках насекомых Sf9 с использованием экспрессирующей системы на основе бакуловируса Bac-to-bac (Invitrogen) и очищены при помощи агарозных гранул с антителом против FLAG M2 (Sigma) и агарозных гранул Ni-NTA (Qiagen). Очищенные рекомбинантные белки CRBN-FLAG и/или DDB1-V5-His смешивали с гранулами, содержащими иммобилизованный талидомид, и связанные белки элюировали буфером для образца с SDS. Для анализа мутанта с делецией CRBN белок CRBN, гибридизированный с GST, и его мутанты экспрессировали в E. coli BL21 и очищали с использованием глутатион-сефарозы (GE Healthcare). Мутанты CRBN были сверхэкспрессированы в клетках 293Т путем трансфекции с использованием липофектамина 2000 (Invitrogen). Последующие анализы связывания выполняли в соответствии с приведенным выше описанием.
(7) Коиммунопреципитация
Взаимодействие между CRBN и DDB1 анализировали, коэкспрессирую CRBN-FLAG и DDB1-V5-His в клетках Sf9. Экстракты клеток смешивали с агарозными гранулами, содержащими антитело против FLAG, после чего связанные белки избирательно элюировали пептидом FLAG. Для очистки комплекса CRBN получали клетки 293Т, экспрессирующие CRBN и его мутанты, и выполняли иммуносорбционную очистку в соответствии с приведенным выше описанием.
(8) Иммунное окрашивание
Клетки HeLa, сверхэкспрессирующие CRBN и DDB1, гибридизированные с метками HA или V5, фиксировали, смешивали с антителом против НА и против V5 и подвергали взаимодействию с вторичными антителами, конъюгированными соответственно с флуоресцентными красителями Alexa Fluor 594 или 488 (Invitrogen).
(9) Анализ убихитинирования in vitro
Анализы убихитинирования in vitro выполняли в соответствии с описанием, представленным в научной литературе (приведенный литературный источник 37). Комплекс FH-CRBN (200 нг) инкубировали при 30°С в течение двух часов в 15 мкл буфера, содержащего 500 нг Uba 1 (Biomol), 500 нг UbcH5b (Biomol), 4000 нг GST-убихитина (Calbiochem) и 4 мМ АТР. Взаимодействие прекращали, добавляя SDS и нагревая при 98°С в течение пяти минут.
(10) Аутоубихитинирование в живых клетках
Анализы выполняли в соответствии с описанием, представленным в научной литературе (приведенный литературный источник 38). Клетки 293Т, устойчиво экспрессирующие FH-CRBN или его мутант, обрабатывали 10 мкМ MG132 или ДМСО (наполнитель) в течение трех часов. Клеточные лизаты получали, используя буфер RIPA, содержащий 25 мкМ MG132 и 10 мМ N-этилмалеимида. FH-CEBN осаждали методом иммунопреципитации и анализировали в соответствии с приведенным выше описанием. За один час до обработки MG132 к клеткам добавляли талидомид в разных концентрациях.
(11) иРНК
Были использованы нижеследующие олигонуклеотиды иРНК Stealth (Invitrogen).
DDB1 №1: 5'-CAUACCUUGAUAAUGGUGUUGUGUU-3' (SEQ ID NO:1)
DDB1 №2: 5'-CAGUAAUGAACAAGGCUCCUAUGUA-3' (SEQ ID NO:2)
Cul4A №1: 5'-GCAAAGCAUGUGGAUUCAAAGUUAA-3' (SEQ ID NO:3)
Cul4A №2: 5'-GAAUCUCUGAUAGACAGAGACUAUA-3' (SEQ ID NO:4)
Показаны только смысловые цепи. В качестве образца использовали отрицательный контрольный образец иРНК с низким содержанием GC (Invitrogen). Клетки 293Т трансфецировали 40 нМ олигонуклеотида, используя липофектамин RNAiMAX, и собирали клетки через 72 часа.
(12) Данио-рерио
Рыбку данио-рерио содержали при 28,5°С с циклом чередования 14 часов света и 10 часов темноты.
Эмбрионы были получены в результате естественного спаривания (приведенный литературный источник 35). Ниже описаны методы окрашивания альциановым синим, микроинъецирования и гибридизации in situ. Гены CRBN и Cul4A данио-рерио (zcrbn и zcul4a) обозначены в соответствии с руководством по номенклатуре для данио-рерио, разработанным Комитетом по номенклатуре для данио-рерио.
(13) Обработка данио-рерио талидомидом
Талидомид растворяли в ДМСО и добавляли до конечной концентрации 400 мкМ в среду Е3, предварительно нагретую до 65°С. До введения в среду талидомида из эмбрионов данио-рерио удаляли хорион следующим образом: через 2 часа после оплодотворения эмбрионы инкубировали в среде Е3, содержащей 2 мг/мл протеазы типа XIV (Sigma), в течение трех минут и затем пять раз промывали указанной средой. После удаления хориона эмбрионы сразу же переносили в среду Е3, содержащую талидомид, и вели наблюдение в течение трех дней. Талидомидсодержащую среду заменяли через каждые 12 часов.
(14) Окрашивание альциановым синим
Внеклеточные матриксы, ассоциированные с хондроцитами, окрашивали альциановым синим (приведенный литературный источник 40). Эмбрионы данио-рерио фиксировали в 3,7% формальдегиде с нейтральным буфером в течение ночи. На следующий день эмбрионы промывали 100% этанолом и повторно гидратировали PBS. Затем эмбрионы инкубировали с раствором 0,05% трипсина в насыщенном растворе тетрабората натрия в течение одного-трех часов. Пигментацию рыбки удаляли раствором 3% пероксида водорода/1% гидроксида калия. Окрашенные эмбрионы хранили в растворе PBS, содержащем 70% глицерина.
(15) Микроинъекция антисмысловых морфолиноолигонуклеотидов и мРНК
Микроинъекцию в эмбрионы на одноклеточной стадии развития выполняли в соответствии с описанием, представленным в приведенном литературном источнике 39. Для инъекции был использован микроинъектор, действующий под давлением газообразного азота (IM 300, Narichige Co., Ltd.). Кэппированная мРНК была получена in vitro при помощи набора для транскрипции in vitro mMESSAGE mMACHINE (Ambion).
РНК растворяли в воде без нуклеазы в количестве 600 нг/мкл непосредственно перед использованием. Использованные антисмысловые олигонуклеотиды (Gene Tools) имеют следующие последовательности.
zCrbn AMO: 5'-AGAGCTGTAGCTGGTTCCCCATTTC-3' (SEQ ID NO:5)
zCul4A AMO: 5'-CTGGTGCTGAACATCTTCTGCCATC-3' (SEQ ID NO:6)
Указанные олигонуклеотиды растворяли в воде без нуклеазы в концентрации 700 мкМ.
(16) Полная гибридизация in situ
Данный анализ выполняли в соответствии с описанием, представленным в приведенном литературном источнике 41. Антисмысловой зонд к мРНК zcrbn был направлен против 5'-концевой кодирующей области длиной 513 п.о. Антисмысловой зонд к zcul4a был направлен против 3'-концевой нетранслированной области (3'-UTR) длиной 590 п.о. Зонды к shh и fgf7 были любезно предоставлены д-ром Крауссом и д-ром Тиссе. Для увеличения проникающей способности зондов фиксированные эмбрионы инкубировали с PBS, содержащим 0,1% твина-20 и 10 мг/мл протеиназы К, в течение двух минут при комнатной температуре.
(17) Измерение размера слуховых пузырьков
Эмбрионы данио-рерио через 48 часов после оплодотворения анестезировали 1% метилцеллюлозы и 0,003% этилового эфира 3-аминобензойной кислоты (Sigma) и помещали на предметное стекло. Затем фотографировали слуховые пузырьки десяти эмбрионов, произвольно отобранных из каждого образца. Размер слуховых пузырьков измеряли при помощи программного обеспечения NIH Image J и сравнивали с размером слуховых пузырьков контрольного образца. Вычисляли средние размеры и стандартные ошибки и определяли значения р при помощи U-критерия Манна-Уитнея.
Список приведенных литературных источников
Приведенный литературный источник 1: M.T. Miller, K. Stromland, Teratology 60, 306 (1999).
Приведенный литературный источник 2: M. Melchert, A. List, Int. J. Biochem. Cell Biol. 39, 1489 (2007).
Приведенный литературный источник 3: J. Knobloch, U. Ruther, Cell Cycle 7, 1121 (2008).
Приведенный литературный источник 4: T. Parman, M.J. Wiley, P.G. Wells, Nat. Med. 5, 582 (1999).
Приведенный литературный источник 5: R.J.D'Amato, M.S. Loughnan, E. Flynn, J. Folkman, Proc. Natl. Acad. Sci. U.S.A. 91, 4082 (1994).
Приведенный литературный источник 6: J. Sheskin, Clin. Pharmacol. Ther. 6, 303 (1965).
Приведенный литературный источник 7: S. Singhal et al., N. Engl. J. Med. 341, 1565 (1999).
Приведенный литературный источник 8: J.B. Zeldis, B.A. Williams, S.D. Thomas, M.E. Elsayed, Clin. Ther. 21, 319 (1999).
Приведенный литературный источник 9: S. Sakamoto, Y. Kabe, M. Hatakeyama, Y. Yamaguchi, H. Handa, Chem. Rec. 9, 66 (2009).
Приведенный литературный источник 10: S. Sakamoto, Y. Kabe, M. Hatakeyama, Y. Yamaguchi, H. Handa, Chem. Rec. 9, 66 (2009).
Приведенный литературный источник 11: J.J. Higgins, J. Pucilowska, R.Q. Lombardi, J.P. Rooney, Neurology 63, 1927 (2004).
Приведенный литературный источник 12: S. Angers et al., Nature 443, 590 (2006).
Приведенный литературный источник 13: R. Groisman et al., Cell 113, 357 (2003).
Приведенный литературный источник 14: F. Ohtake et al.,- Nature 446, 562 (2007).
Приведенный литературный источник 15: C.M. Pickart, Cell 116, 181 (2004).
Приведенный литературный источник 16: M.D. Petroski, R.J. Deshaies, Nat. Rev. Mol. Cell Biol. 6, 9 (2005).
Приведенный литературный источник 17: K. Sugasawa et al., Cell 121, 387 (2005).
Приведенный литературный источник 18: R. Groisman et al., Genes Dev. 20, 1429 (2006).
Приведенный литературный источник 19: O. Leupin, S. Bontron, M. Strubin, J. Virol. 77, 6274 (2003).
Приведенный литературный источник 20: J. Jin, E.E. Arias, J. Chen, J.W. Harper, J.C. Walter, Mol. Cell 23, 709 (2006).
Приведенный литературный источник 21: A. Nasevicius, S.C. Ekker, Nat. Genet. 26, 216 (2000).
Приведенный литературный источник 22: M.B. Veldman, S. Lin, Pediatr. Res. 64, 470 (2008).
Приведенный литературный источник 23: T. Yabu et al., Blood 106, 125 (2005).
Приведенный литературный источник 24: M. Tanaka et al., Nature 416, 527 (2002).
Приведенный литературный источник 25: M.C. Davis, R.D. Dahn, N.H. Shubin, Nature 447, 473 (2007).
Приведенный литературный источник 26: A. Streit, J. Anat. 199, 99 (2001).
Приведенный литературный источник 27: R.D. Riddle, R.L. Johnson, E. Laufer, C. Tabin, Cell 75, 1401 (1993).
Приведенный литературный источник 28: A.M. Moon, M.R. Capecchi, Nat. Genet. 26, 455 (2000).
Приведенный литературный источник 29: M. Lewandoski, X. Sun, G.R. Martin, Nat. Genet. 26, 460 (2000).
Приведенный литературный источник 30: A.L. Moreira et al., J. Exp. Med. 177, 1675 (1993).
Приведенный литературный источник 31: D. Gupta et al., Leukemia 15, 1950 (2001).
Приведенный литературный источник 32: J. Knobloch, J.D. Shaughnessy, Jr., U. Ruther, FASEB J. 21, 1410 (2007).
Приведенный литературный источник 33: T. Kamura, C.S. Brower, R.C. Conaway, J.W. Conaway, J. Biol. Chem. 277, 30388 (2002).
Приведенный литературный источник 34: J.M. Hansen, S.G. Gong, M. Philbert, C. Harris, Dev. Dyn. 225, 186 (2002).
Приведенный литературный источник 35: S. Pajni-Underwood, C.P. Wilson, C. Elder, Y. Mishina, M. Lewandoski, Development 134, 2359 (2007).
Приведенный литературный источник 36: H. Uga et al., Mol. Pharmacol. 70, 1832 (2006).
Приведенный литературный источник 37: R. Groisman et al., Cell 113, 357 (2003).
Приведенный литературный источник 38: F. Ohtake et al., Nature 446, 562 (2007).
Приведенный литературный источник 39: H. Ando, T. Furuta, H. Okamoto, Methods Cell Biol. 77, 159 (2004).
Приведенный литературный источник 40: W.L. Kelly, M.M. Bryden, Stain Technol. 58, 131 (1983).
Приведенный литературный источник 41: C. Thisse, B. Thisse, Nat. Protoc. 3, 59 (2008).
Промышленная применимость
Настоящее изобретение может быть использовано для определения наличия у испытуемого вещества тератогенного действия, подобного талидомиду, и, таким образом, данное изобретение может быть использовано для создания лекарственных средств, являющихся альтеративой талидомиду, и лекарственных средств, способных подавлять вызываемое талидомидом тератогенное действие.



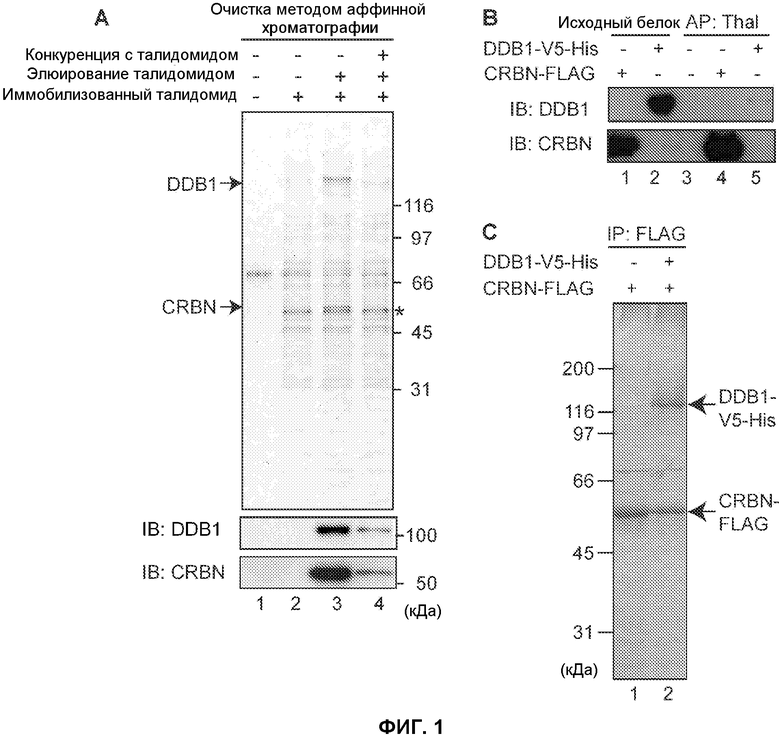
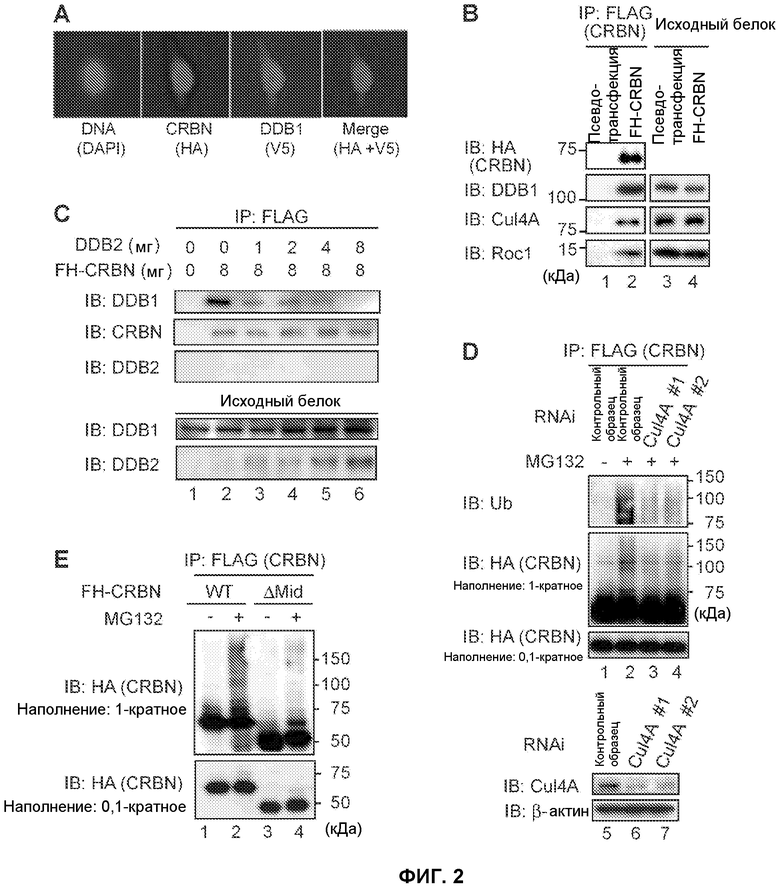
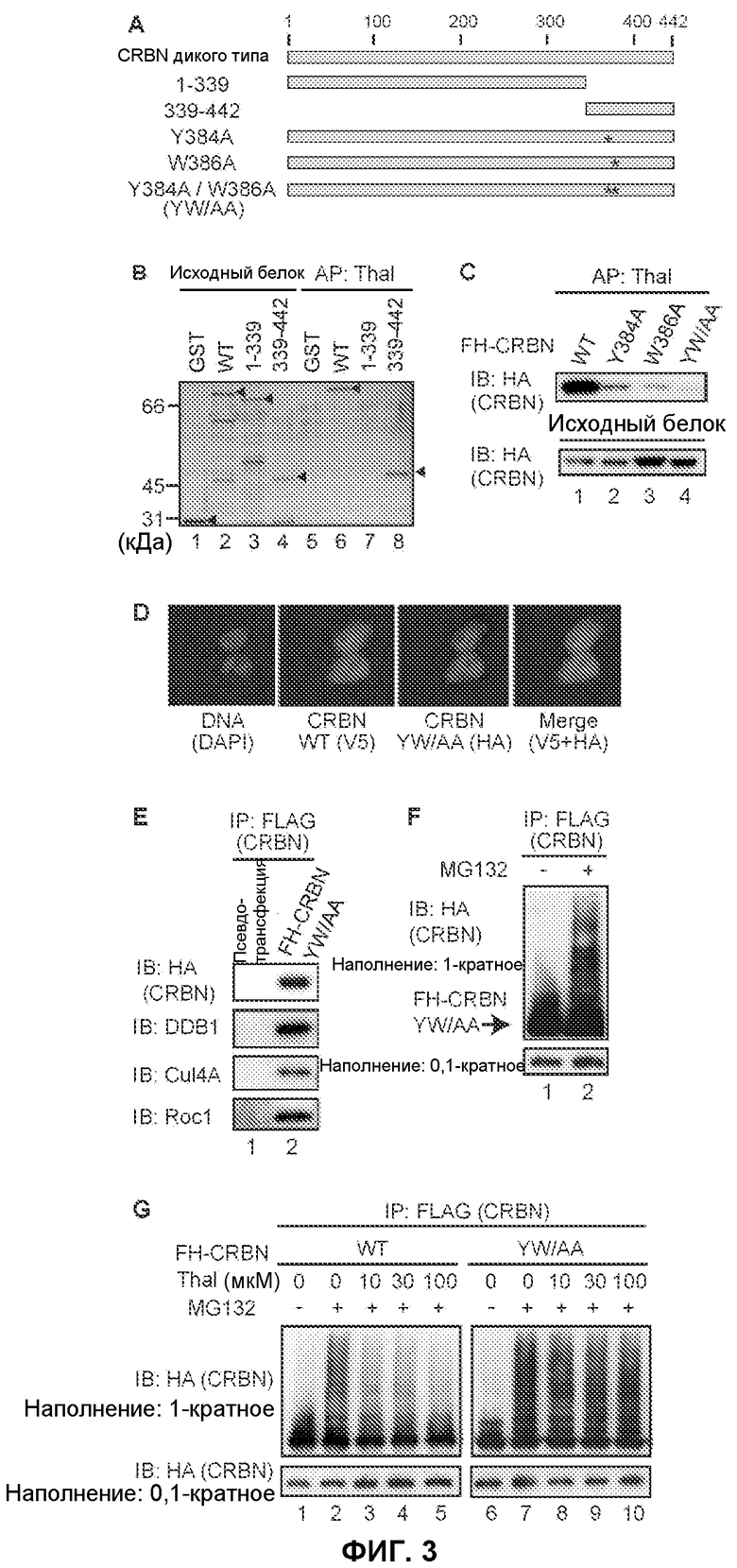




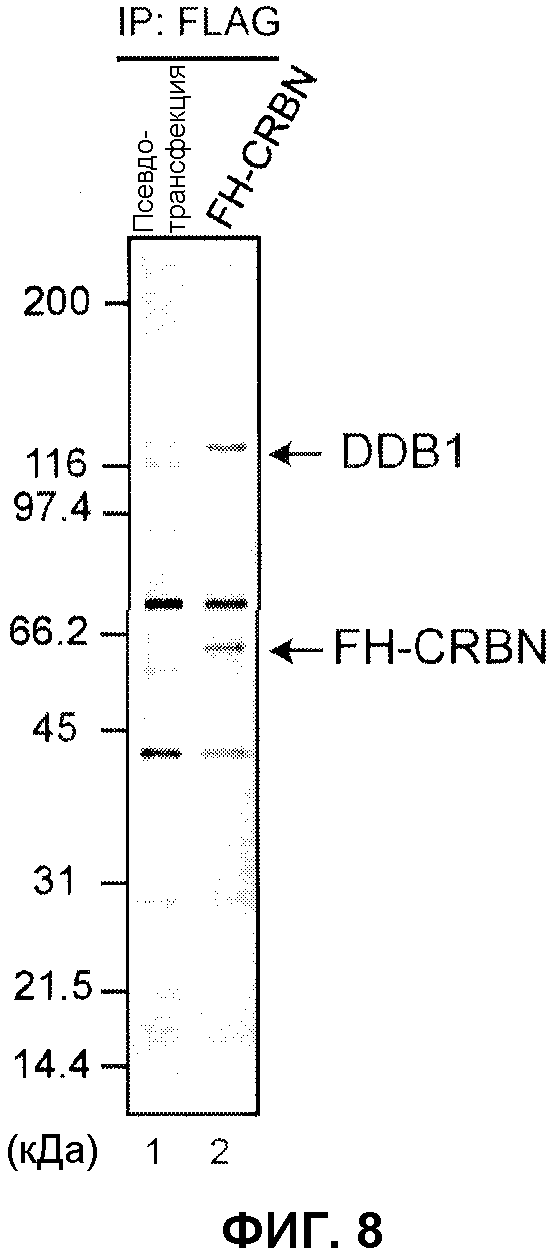

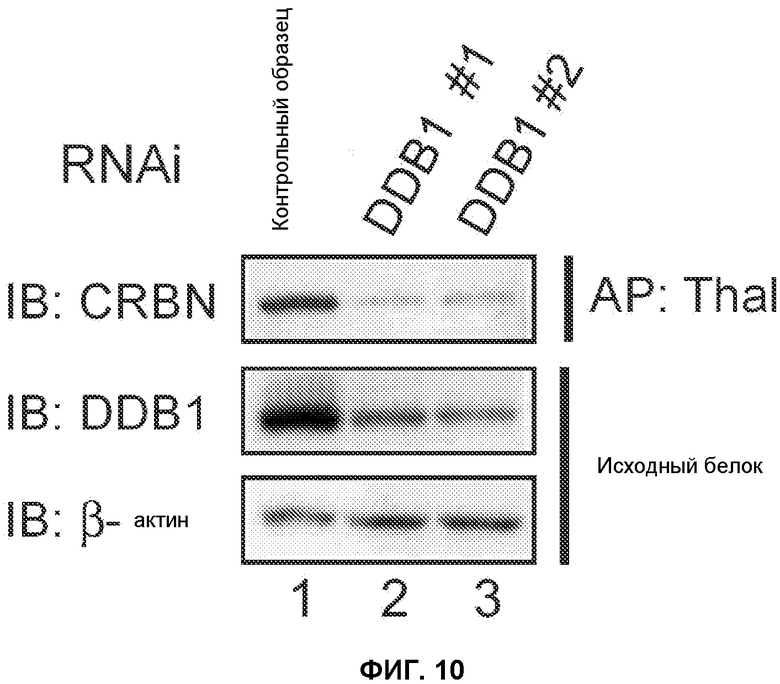

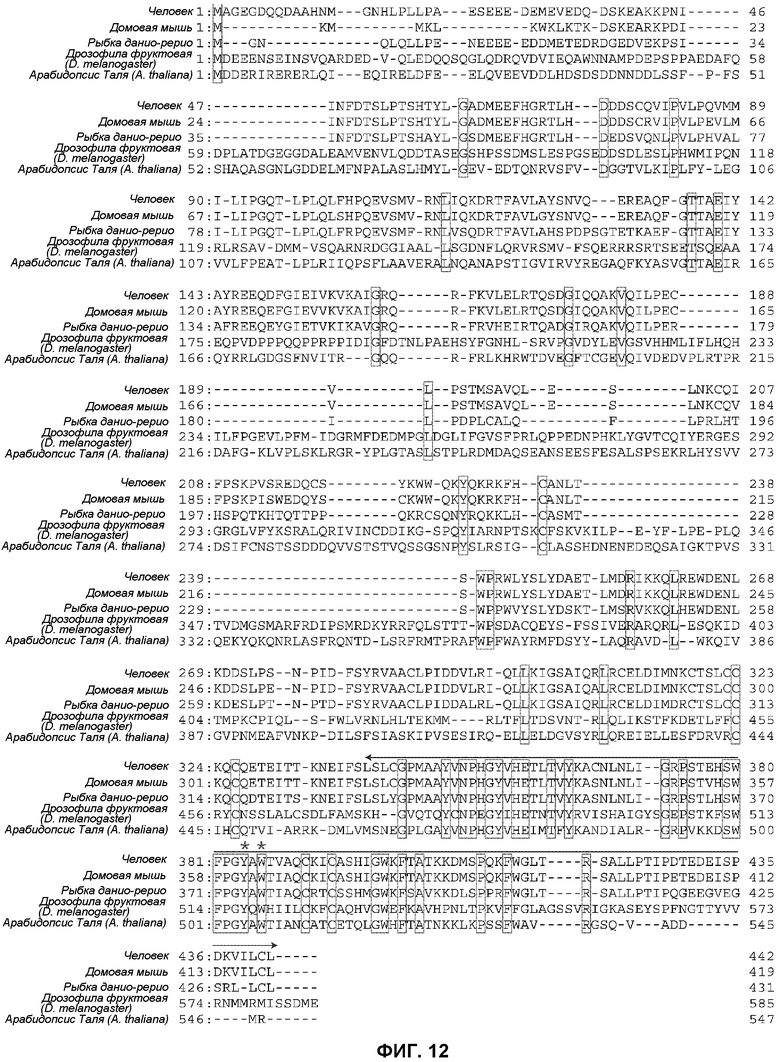
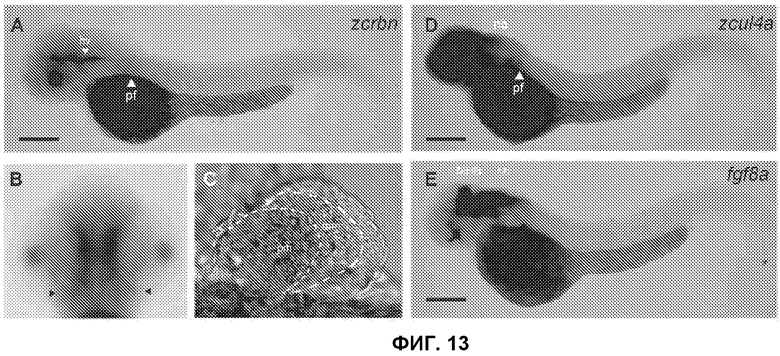

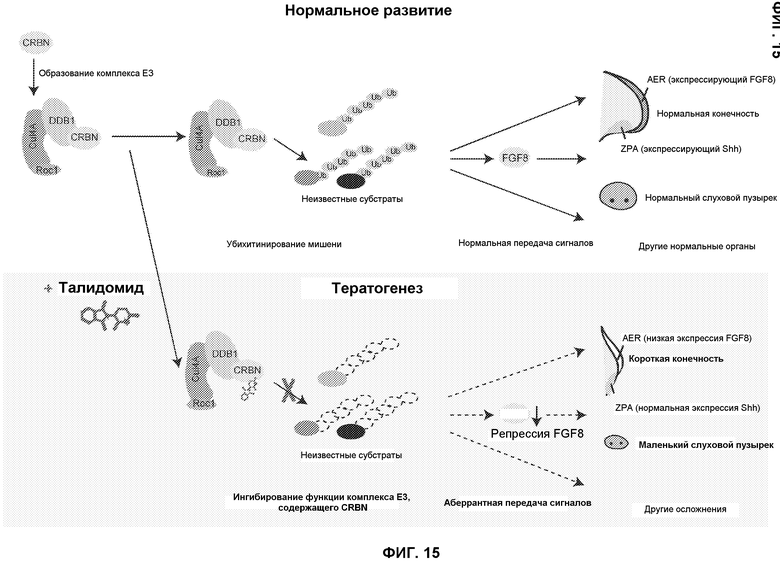

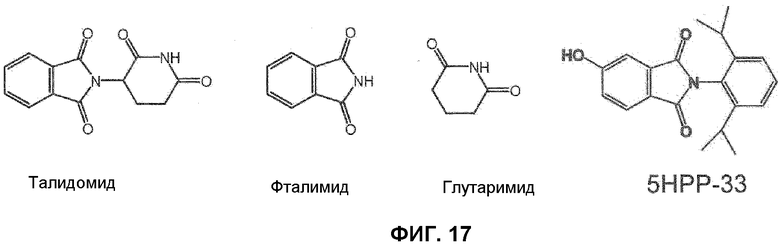
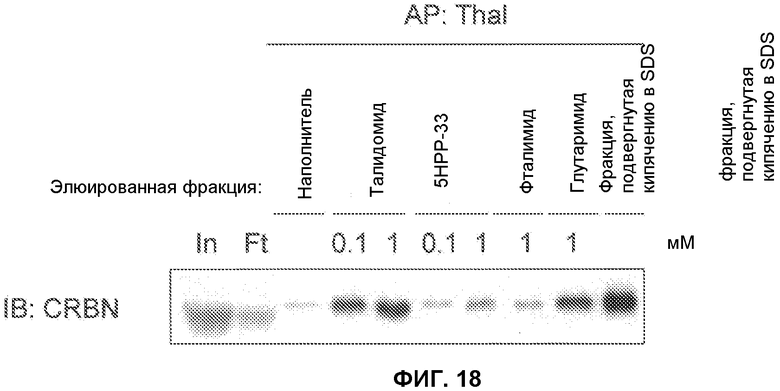

Изобретение относится к способу скрининга нетератогенного вещества, который включает приведение испытуемого вещества в контакт с цереблоном или фрагментом цереблона, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, не связывающегося с цереблоном или фрагментом цереблона, или испытуемого вещества, характеризующегося более низкой способностью связываться с цереблоном или фрагментом цереблона по сравнению с талидомидом. 2 н. и 6 з.п. ф-лы, 19 ил., 8 пр.
1. Способ скрининга нетератогенного вещества, который включает приведение испытуемого вещества в контакт с цереблоном или фрагментом цереблона, где указанные цереблон или фрагмент цереблона связывают талидомид, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, не связывающегося с цереблоном или фрагментом цереблона, или испытуемого вещества, проявляющего более низкую способность связываться с цереблоном или фрагментом цереблона по сравнению с талидомидом.
2. Способ скрининга нетератогенного вещества по п.1, где испытуемое вещество представляет собой лекарственное средство.
3. Способ скрининга нетератогенного вещества по п.1, где испытуемое вещество представляет собой производное талидомида, выраженное общей формулой (1):
Формула 1
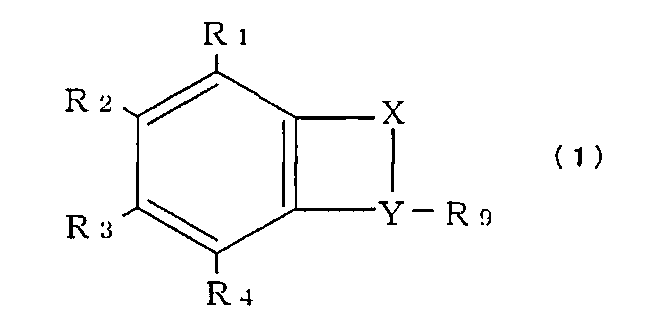
где соединение, в котором X означает R5-R7 и Y означает R6-R8, именуется соединением (A), соединение, в котором X означает R5 и Y означает R6-R8, именуется соединением (B) и соединение, в котором X означает R5 и Y означает R8, именуется соединением (C); и каждый элемент R1, R2, R3 и R4 выбран из -H; -OH; =O; алкана, алкена и алкина с линейной или разветвленной цепью; циклического алкана, алкена и алкина; комбинации циклического и нециклического алкана, алкена и алкина; спирта, альдегида, кетона, карбоновой кислоты, сложного эфира или простого эфира, объединяющих кольцевую и некольцевую структуру, или комбинацию циклических/нециклических частей; аза; амино; -MOn или -O-MOn [где M=N и n=2; M=S и n=2 или 3; M=P и n=1-3]; и галогена; и
каждый элемент R5, R6, R7 и R8 независимо выбирают из группы формулы (2):
Формула 2
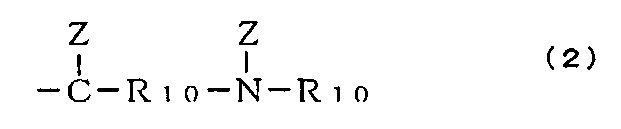
и -O- (где Z является необязательным элементом и имеет такие же значения, что и вышеописанный элемент R1); и R10 имеет такие же значения, что и вышеописанный элемент R1-, или (когда Z отсутствует) R10=O;
R9 означает часть, имеющую формулу (3), (4), (5), (6) или (7):
Формула 3
Формула 4

Формула 5

Формула 6
где каждый элемент R11-R17 (независимо) имеет такие же значения, что и вышеописанный элемент R5, или
Формула 7

где каждый элемент R18, R19 и R20 независимо выбирают из H, -CH3, -СООН, -CONH2, -(CH2)n-COOH и -(CH2)n CONH2, где n=1-4.
4. Способ скрининга нетератогенного вещества по любому из пп.1-3, где фрагмент цереблона содержит аминокислотную последовательность от положения 339 до положения 442 от N-конца аминокислотной последовательности, показанной в SEQ ID N0:7, а в остальной части аминокислотной последовательности SEQ ID N0:7 заменяют, удаляют и/или добавляют один или более аминокислотных остатков.
5. Способ скрининга нетератогенного вещества по любому из пп.1-3, где цереблон или фрагмент цереблона иммобилизованы на носителе.
6. Способ скрининга нетератогенного вещества по п.3, где производное талидомида обладает фармакологическим действием талидомида или известного производного талидомида.
7. Способ скрининга антагониста тератогенного вещества, который включает стадию приведения испытуемого вещества в контакт с цереблоном или фрагментом цереблона, где указанные цереблон или фрагмент цереблона связывают талидомид, оценку способности испытуемого вещества связываться с цереблоном или фрагментом цереблона и отбор испытуемого вещества, связывающегося с цереблоном или фрагментом цереблона, и стадию выбора из веществ, отобранных на вышеуказанной стадии, вещества, способного уменьшать i) тератогенное действие или ii) ингибирующее действие, оказываемое на активность убихитин-лигазного комплекса, содержащего цереблон.
8. Способ скрининга антагониста тератогенного вещества по п.7, где цереблон или фрагмент цереблона иммобилизован на носителе.
| HOHBERGER, B | |||
| ET AL.: 'Cereblon is expressed in the retina and binds to voltage-gated chloride channels' FEBS LETT | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Автоматический аппарат для тушения пожаров | 1912 |
|
SU583A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| 'Proceedings of the Guadeloupe Conf | |||
| "Methods Detect Environ Agents That Prod Congenital Defects"', 1975 deel ZIMMERMAN, E.F.: 'Chemical structure and teratogenic mechanism of action.', pages 79 | |||
Авторы
Даты
2014-09-20—Публикация
2010-10-18—Подача