Изобретение относится к медицине, в частности, области молекулярной медицины и клинической лабораторной диагностике с применением специализированных тест-систем для выявления дисфункции сосудистой системы у человека.
Термин «биомаркер», появившийся впервые в 1989 г.. первоначально рассматривался как потенциальный количественно детектируемый биологический параметр, являющийся индикатором напряженности физиологических и патологических процессов, в свою очередь характеризующих риск возникновения соматических и психических заболеваний, интенсивность влияния факторов внешней среды, уровень энергетического метаболизма организма человека/животного, состояние синдрома отмены/абстиненции, беременности, а также как диагностический инструмент для верификации диагноза заболевания. В качестве биомаркеров могут служить концентрации специфических энзимов, гормонов, пептидов, специфические распределения фенотипа в популяции, различные биологические интермедиаты, молекулы и т.п.(Joshi К. et.al. 2012, Hotchkiss JWet.al. 2012, Santamarina E. 2012).
В 2001 г. эксперты рабочей группы NIH (National Institute of Health) предложили унифицированное определение биомаркера как показателя. который, будучи непосредственно точно измерен, может служить в качестве индикатора физиологических и патологических биологических процессов, а также использоваться как критерий «ответа» на фармакологическое или терапевтическое вмешательство (Biomarkers Definitions Working Group, 2001). В настоящее время под биологическим маркером понимают потенциально детектируемый параметр, измерение которого отличается высокой точностью, надежностью и воспроизводимостью, что позволяет отражать состояние здоровья, напряженность физиологических процессов, величину риска или факт развития заболевания, стадию последнего (клиническая/доклиническая) и его прогрессирование/реверсию (Colburn W.A., 2000; De Gruttola V.G. et al., 2001; Manolio Т., 2003; Dowd J.В., Zajacova A., 2010).
В соответствии с рекомендациями и номенклатурой Biomarkers Definitions Working Group (2001) биомаркеры классифицируются на антецедентные (идентифицирующие риск возникновения заболевания), скрининговые (используемые для верификации субклинических стадий заболеваний на скрининге), диагностические (позволяющие установить наличие определенного заболевания), так называемые биомаркеры состояния (standing biomarkers), характеризующие тяжесть заболевания, и прогностические биомаркеры, отражающие эволюцию развития заболевания, в том числе позволяющие прогнозировать ожидаемый ответ на лечение, терапевтическое вмешательство и проводить мониторинг эффективности лечения. Необходимо однако отметить, что многие из биологических маркеров, использующихся в рутинной клинической/лабораторной практике в настоящее время, лишены исключительной принадлежности к каждой из указанных категорий, в связи с чем описанный классификационный подход носит несколько упрощенный характер (Colburn W.A., 2000).
Предпосылками создания настоящего изобретения является то, что в настоящее время кардиоваскулярные события оказывают серьезное влияние на клинические исходы и прогноз в различных популяциях пациентов, идентификация индивидуального риска рассматривается как один из основных компонентов в проведении стратегии профилактики и лечения возникновения сосудистых заболеваний. Биологические маркеры позволяют экономизировать расходы системы здравоохранения, затрачиваемые на оптимизацию процессов скринирования больных, выбора оптимальной стратегии лечения и оценки ее адекватности (De Gruttola V.G. et al.. 2003). С другой стороны, для того чтобы удовлетворять этим ожиданиям, биологические маркеры в идеале должны отличаться не только точностью, надежностью и воспроизводимостью при последовательных количественных измерениях, демонстрировать высокую чувствительность и специфичность, но и, желательно, не зависеть от возрастных, расовых и тендерных различий, а также способствовать возникновению однозначности мнений при интерпретации полученных данных (Wang J. et al., 2010). Далеко не все рекомендуемые к применению в рутинной клинической практике биологические маркеры васкулярных заболеваний удовлетворяют этим характеристикам. Все это создает необходимость в поиске новых перспективных суррогатных маркеров для оценки состояния сосудистой системы в норме и при развитии сосудистых заболеваний. Например, количество последних к настоящему времени уже перевалило за несколько сотен, а интерпретация их клиническою значения зачастую далека от идеальной.
В связи со сказанным совершенствование поиска новых биомаркеров является актуальной задачей, как и создание на их основе новых высокочувствительных тест-систем для иммуноферментного анализа (ИФА), который является одним из высокочувствительных методов лабораторной диагностики, используемых для качественного и количественного определении различных веществ в медицинских иммунобиологических препаратах.
В настоящее время известна иммуноферментная тест-система «VEGF-ИФА-БЕСТ» определения содержания фактора роста эндотелия сосудов (VEGF - vascular endotelialgrowth factor) в биологических жидкостях организма, в том числе и человека, производства фирмы ЗАО Вектор-Бест, Россия (hitp://www.http://vector-best.ru/publ/list/8784.pdf. предложена в качестве наиболее близкого аналога. Известный белок является ведущим фактором ангеогенеза, усиливает проницаемость сосудов и вазодилитацию. VEGF важен при формировании сосудистой системы, особенно в раннем периоде жизни. При патологических состояниях повышенные концентрации фактора в крови свидетельствуют о стимуляции роста новых сосудов, а в ряде случаев он является маркером злокачественных образований.
Известная иммуноферментная тест-система предусматривает применение следующих четырех этапов анализа:
- внесение исследуемого образца в лунки с сорбированными на них моноклональными к VEGF антителами с последующей инкубацией (2 ч, 37°C) и отмывкой буфером от несорбированного на антитела образца;
- внесение биотинилированных к VEGF антител с последующей инкубацией (2 ч., 37°C) и отмывкой буфером от несвязавшегося конъюгата антител:
- внесение стрептоведина, связанного с ферментом пероксидазой хрена и отмывкой буфером от несвязавшегося конъюгата;
- внесение субстратной смеси и выявление окрашенного продукта ферментативной реакции при 450 нм.
Несмотря на то, что данная тест-система является высокоспецифичной, она требует для применения в ней как составной части продукции дорогостоящих моноклональных антител к VEGF, а также этапа конъюгирования биотина с данными моноклональными антителами, что экономически удорожает тест-систему. Подобные недостатки известной тест-системы подвигли авторов к созданию принципиально иной иммуноферментной тест-системы, в которой в качестве биомаркера предложен фактор дифференцировки белка с дифференцирующей активностью HLDF (human leukemia differentiation factor) в сыворотке крови здоровых людей и пациентов с сосудистыми заболеваниями, в частности гипертонической болезнью.
Рассматривая возможность выбора подобного фактора, авторы руководствовались следующим. Первоначально белок HLDF - гликотизированный протеин молекулярной массой 8,2 кДа, состоящий из 54 аминокислотных остатков, был выделен из культуральной среды клеток промиелоцитарного лейкоза человека HL-60, обработанных полностью транс-ретиноевой кислотой, где он индуцировал дифференцировку активно пролиферирующих опухолевых клеток по гранулоцитарному пути (Kostanyan I.A. et al., 1994). Было известно, что наряду с дифференцирующей активностью белок HLDF в определенных условиях может проявлять ферментативные свойства неспецифической нуклеазы, гидролизующей молекулы нуклеиновых кислот по свободнорадикальному механизму (Драницина С.М. и др., 2000). В 2005 году он был обнаружен в мозгу млекопитающих (Sewell et.al. 2005), а также в крови человека и животных (Грудень и др., 2002, 2007). Было выявлено что фактор HLDF присутствует в крови (1.1±0.3 нг/мл) и нервной системе млекопитающих и человека. Высокие концентрации HLDF выявлены в гиппокампе (12.1±3.3 нг/мл), коре больших полушарий (5.9±1.7 нг/мл) и мозжечке (3.2±0.9 нг/мл), а также в гипоталамусе (1.0±0.2 нг/мл) и областях, задействованных в эмоциональной регуляции и функционировании сердечно-сосудистой системы (Sewell R., Gruden М. et al.. 2005).
Известно, что HLDF может реализовать ряд своих биологических свойств благодаря пептидным фрагментам, входящим в его состав. В частности, выявленные свойства фрагмента HLDF-6 определяются, как полагают, его способностью взаимодействовать с липидным компонентом клеточных мембран, что влияет на связывание с клеточной поверхностью цитокины, вовлеченных в процессы пролиферации, дифференцировки и программированной гибели клеток, например, интерлейкина IL-1β (Костанян И.А. и др., 2000; Ржевский Д.И., 2005).
Кроме того, известно, что белок HLDF наряду с уже известными вазоконстрикторами вовлечен в процессы регуляции артериального давления (АД) и/или в функционирование сердечно-сосудистой системы в целом. На нормотензивных крысах линий Wistar, WKY и спонтанно-гипертензивных, склонных к инсульту крысах линии SHR-SP продемонстрирована гемодинамическая активность пептидных фрагментов HLDF-24 и HLDF-8: при внутривенном введении они изменяют АД и частоту сердечных сокращений (ЧСС). При введении пептида HLDF-24 развивается дозозависимая гипотензия и рефлекторное повышение ЧСС. Интересно, что при увеличении дозы HLDF-24 появляется кратковременная гипертензивная фаза, предшествующая гипотензии. Похожее повышение АД наблюдалось при внутривенном введении пептида HLDF-8. Учитывая, что HLDF-8 является фрагментом пептида HLDF-24, можно предположить, что короткая гипертензивная фаза при введении HLDF-24 обусловлена входящим в его состав HLDF-8 (Ржевский Д.И. и др., 2006).
Сравнение эффектов пептидного фрагмента HLDF-24 на нормотензивных и гипертензивных животных выявило различия в изменении среднего АД и ЧСС. Так, у гипертензивных крыс была отмечена более глубокая гипотензия. В экспериментах по неселективной блокаде NO-синтазы установлено, что ингибирование фермента не изменяло гипотензивного эффекта пептида и незначительно снижало возникающую тахикардию. Это позволило предположить, что эффекты HLDF-24 обусловлены NO-независимыми механизмами. Сравнение эффектов пептида HLDF-8 на нормотензивных и гипертензивных линиях крыс показало следующее: реакция нормотензивных животных оказывается двухфазной - первоначальная кратковременная гипотензия сменяется более продолжительной гипертензией, в то время как гипертензивные животные реагируют только повышением АД (Ржевский Д.И., 2006).
В основе гемодинамической активности пептидных фрагментов фактора дифференцировки HLDF могут лежать несколько механизмов. Была обнаружена гомология аминокислотной последовательности молекулы HLDF с эндотелин-превращающим ферментом (ЭПФ) (Ржевский Д.И., 2005). Известно, что блокаторы ЭПФ вызывают гипотензивный эффект (Wada А., 2002; Mulder Р., 2004). Предположительно HLDF-24 может выступать в роли антагониста ЭПФ, тем самым уменьшая образование эндогенного ЕТ. Кроме этого, в результате ДНК/РНК-гидролизующей активности октапептида HLDF-8 в сосудистом русле образуются свободные радикалы (Драницына С.М. и др., 2000), которые способны инактивировать ряд ферментов, в том числе цинковых металлопротеиназ, в число которых входит ЭПФ (Lopez-Ongil et al., 2000).
Другим механизмом гемодинамической активности HLDF может являться его способность влиять на уровень половых стероидных гормонов. Известно, что уровень андрогенных гормонов ассоциирован с повышенным АД (Chen M.J. et al., 2007: Wu С.С.et al., 2011). В экспериментах на самцах мышей было показано, что пептид HLDF-6 стимулирует синтез тестостерона в семенниках и коре надпочечников, а также влияет на его метаболизм - ингибирует конверсию в дигидротестостерон путем снижения экспрессии мРНК 5-α-редуктазы как у кастрированных, так и у некастрированных животных. В результате этого белок HLDF оказывает влияние как на поведенческие, так и на физиологические процессы, опосредуемые половыми стероидами (сексуальная активность, болевая чувствительность, анаболический эффект, повышение АД) (Rzhevsky D.I. et al., 2005).
Продемонстрирована высокая иммуногенность белка HLDF. Получены данные, согласно которым при активной иммунизации синтетическим фактором дифференцировки HLDF и его пептидными фрагментами HLDF-6. HLDF-8 и HLDF-24 у кроликов развиваются симптомы, сходные с клинической картиной инсульта человека с тромбозом мелких сосудов мозга и разрушением эндотелиальных клеток. Показано, что выраженность и тяжесть сходных с инсультом признаков у животных коррелировала с уровнем антител к данному фактору дифференцировки в крови. Наибольшей иммуногенностью обладал пептид HLDF-24 и нативный фактор HLDF; пептиды HLDF-6 и HLDF-8 вызывали антителообразование только при конъюгировании с гемоцианином улитки (Гапон М.В. и др., 2006).
Описанная гемодинамическая активность FILDF, а также впервые показанная вовлеченность данного белка в патогенез острых и хронических нарушений мозгового кровообращения обосновывают участие фактора HLDF в механизмах цереброваскулярной патологии, ассоциированной с ГБ. Таким образом, представляется очевидной необходимость разработки диагностической тест-системы для использования в иммуноферментном анализе при определении концентрации белкового фактора дифференцировки HLDF - прогностического биомаркера состояния сосудистой системы у человека в норме и патологии, а также разработка и использование принципиально новой специализированной тест-системы для количественного иммуноферментного анализа содержания биомаркера состояния сосудистой системы как основы метода ранней диагностики развития гипертонической болезни и прогноза развития ее церебральных осложнений. Результат, полученный при решении поставленной задачи, состоит в возможности получения валидной специфичной и воспроизводимой иммуноферментной тест-системы, позволяющей детектировать биомаркер состояния сосудистой системы в сыворотке крови как здоровых, так и больных сосудистыми заболеваниями людей.
Для достижения поставленного результата предлагается способ количественного определения содержания фактора дифференцировки клеток HLDF (human leukemia differentiation factor) у пациента, страдающего заболеванием сердечно-сосудистой системы. включающий строго установленную качественно-количественную последовательность применяемых реагентов и их концентраций в виде следующих этапов:
внесение в лунки по 50-250 мкл раствора поликлональных моноспецифических антител млекопитающего к белку HLDF в буфере в соотношении 1:400, инкубацию, блокировку неспецифического связывания белков HLDF с покрытием лунки раствором бычьего сывороточного альбумина (БСА), с последующей инкубацией;
внесение в одну часть упомянутых лунок по 50-250 мкл образца сыворотки обследуемого пациента, разведенной буфером, с последующей инкубацией, в другую часть лунок - стандартных проб с концентрацией HLDF в диапазоне от 25 до 1000 нг/мл на основе концентрированного раствора белка HLDF;
внесение во все лунки по 50-250 мкл раствора поликлональных моноспецифических антител млекопитающего к белку HLDF в буфере в соотношении 1:4000 с последующей инкубацией;
внесение во все лунки по 50-250 мкл раствора антител козы против IgG кролика, конъюгированных с пероксидазой хрена в буфере, с последующей инкубацией,
внесение во все лунки субстратной смеси с последующим проведением ферментативной реакции в отсутствие освещения и принудительную остановку такой реакции,
при этом количественное определение содержания фактора дифференцировки клеток HLDF у пациента вели измерением оптической плотности содержимого лунки с образцами сыворотки пациента после остановки реакции и сравнением полученных по результатам измерения значений с калибровочными значениями, в качестве которых использовали содержимое лунок со стандартной концентрацией белка HLDF.
Возможность достижения поставленного результата применением заявленного способа обусловлена описанной последовательностью действий по принципу наслоения («сэндвича»), предусматривающего применение разновидных поликлональных антител к выявляемому веществу - белку HLDF.
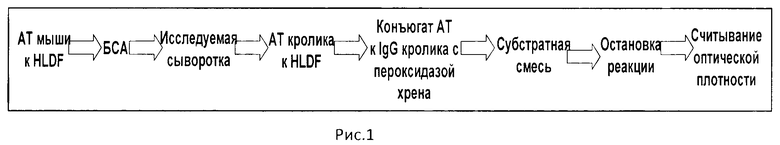
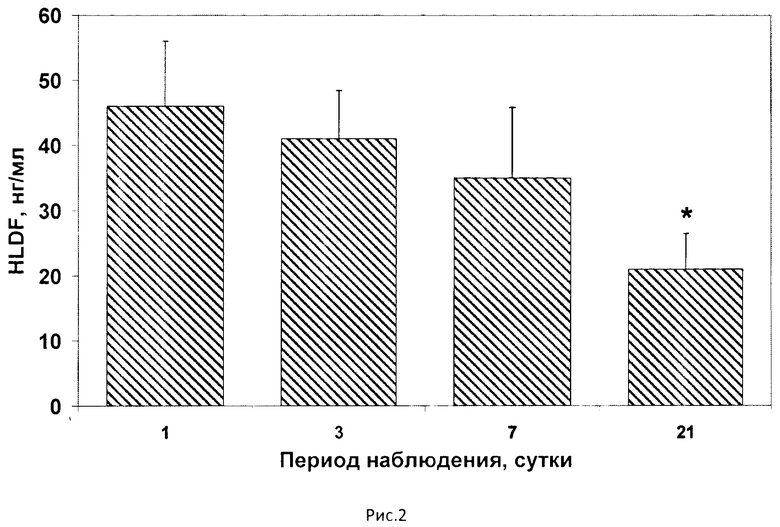
На рис.1 представлена принципиальная схема определения белка HLDF согласно заявленному решению, на рис.2 динамика сывороточной концентрации белка HLDF у пациентов с гипертоническим кризом в течение периода наблюдения.
В рамках поставленной задачи непосредственному созданию заявленной тест-системы предшествуют следующие этапы.
1. Получение крысиных и кроличьих моноспецифических антител против HLDF путем иммунизации по следующему протоколу:
День 1. Первая иммунизация высокоочищенным белком HLDF (1 мг/мл) с полным адъювантом Фрейнда внутрикожно в объеме 150 мкл для крыс линии Вистар (n=10) или 1000 мкл для кроликов - шиншилл (n=3).
День 28. Первая бустерная иммунизация белком HLDF (1 мг/мл) с неполным адъювантом Фрейнда внутрикожно в объеме 150 мкл и 500 мкл для крыс и кроликов соответственно.
День 42. Вторая бустерная иммунизация белком HLDF(1 мг/мл) с неполным адъювантом Фрейнда внутрикожно в объеме 150 мкл и 500 мкл для крыс и кроликов соответственно.
День 50. Первое взятие крови отдельно у каждого животного в объеме 1-3 мл. Третья бустерная иммунизация белком HLDF (1 мг/мл) с неполным адъювантом Фрейнда внутрикожно в объеме 150 мкл и 500 мкл для крыс и кроликов соответственно.
День 60. Второе взятие крови в объеме 50 мл, определение титра (ELISA), осаждение фракции иммуноглобулинов насыщенным раствором сульфата аммония до конечной концентрации сульфата - 33%.
2. Протокол выделения антител к HLDF. Сыворотка крови от каждого иммунизированного HLDF животного отделяется центрифугированием при 3500 об./мин помещается в стеклянный стакан. Добавляется насыщенный раствор сульфата аммония (pH 7.0) по каплям в течение 6 часов при +4°C до конечной концентрации сульфата 33%. Суспензию центрифугируют и осадок промывают дважды свежим раствором сульфата аммония с концентрацией 33%. Конечный осадок ресуспендируют и подвергают диализу против 0.01 М фосфатного буфера, pH 7.4, после чего проводят аффинную хроматографию на колонке с сорбентом, представляющим собой сефарозу-6В с иммобилизованным белком HLDF. Фракцию антител HLDF десорбируют с помощью 0.3 М раствора NaCl, диализуют и приготавливают препарат антител в концентрации 1 мг/мл с добавлением глицерина до 50% для хранения аликвот при -40°C. Минимальный титр определяется в эксперименте с применением метода прямой ELISA. Титр определен как разбавление раствора антител, достаточное для изменения оптической плотности на 1.0 при 450 нм в реакции превращения субстрата в течение 20 мин при 25°C. Лунки планшета покрываются антигеном с концентрацией 5 мкг/мл в 50 мМ бикарбонатом буфере, pH 9.6. Цветной реагент - 3,3',5,5'-тетраметилбензидин (ТМВ). Установлено, что титр крысиных/кроличьих моноспецифичных поликлональных антител к HLDF составил 1:1300 и 1:1000 соответственно.
Непосредственное измерение содержания белка HLDF в сыворотке крови человека согласно заявленному решению схематически отображено на рис.1 и включает следующую последовательность действий.
Для определения содержания белка HLD1 во все лунки полистиролового 96-луночного планшета вносили по, в среднем, от 50 до 250 мкл, предпочтительно 100 мкл раствора поликлональных моноспецифических антител млекопитающего первого вида, например, крысы к белку HLDF в концентрации 20 мкг/мл в бикарбонатном буфере (pH 8,7) в разведении 1:400. Проводили инкубацию в течение 16 часов при температуре +4°C, после чего планшет отмывали 3 раза Na-фосфатным буфером с твином-20 (pH 7.4) и 3 раза Na-фосфатным буфером (pH 7,4). Неспецифическое связывание белков с полистирольным покрытием блокировали добавлением в каждую лунку по 100 мкл 1%-ного раствора бычьего сывороточного альбумина (БСА) с последующей инкубацией в течение 2-х часов при комнатной температуре. Отмывали планшет 3 раза Na-фосфатным буфером с твином-20 (pH 7.4) и 3 раза Na-фосфатным буфером (pH 7,4). На следующем этапе в лунки вносили в 3-х повторностях по, в среднем, от 50 до 250 мкл, предпочтительно 100 мкл образцов сыворотки обследуемых пациентов, разведенных в 10 раз Na-фосфатным буфером с твином-20 (pH 7.4). В отдельные ряды лунок вносили стандартные пробы с известной концентрацией HLDF в диапазоне от 25 нг/мл до 1000 нг/мл, приготовленные на основе концентрированного раствора белка HLDF. Проводили инкубацию в течение 2-х часов при температуре 37°C. Отмывали 3 раза Na-фосфатным буфером с твином-20 (pH 7,4) и 3 раза Na-фосфатным буфером (pH 7,4). Вносили во все лунки по, в среднем, от 50 до 250 мкл, предпочтительно 100 мкл раствора поликлональных моноспецифических антител млекопитающего, в общем виде отличного от первого вида, например кролика к белку HLDF в Na-фосфатном буфере с твином-20 (pH 7,4) в разведении 1:4000 и инкубировали в течение 1,5 часов при температуре 37°C. Отмывали 3 раза Na-фосфатным буфером с твином-20 (pH 7,4) и 3 раза Na-фосфатным буфером (pH 7,4). Далее во все лунки вносили по, в среднем, от 50 до 250 мкл, предпочтительно 100 мкл раствора антител козы против IgG кролика, конъюгированных с пероксидазой хрена в Na-фосфатном буфере с твином-20 (pH 7,4) с рабочим титром 1:1000. Проводили инкубацию в течение 45 минут при температуре 37°C и отмывали 3 раза Na-фосфатным буфером с Твином-20 (pH 7,4) и 3 раза Na-фосфатным буфером (pH 7,4). Затем вносили во все лунки по 100 мкл раствора ТМБ в нитратном буфере, содержащего 0.01% перекись водорода (pH 6,0). Ферментативную реакцию проводили в отсутствие освещения при комнатной температуре в течение 30 минут. Останавливали реакцию добавлением в каждую лунку по 50 мкл 0,5N серной кислоты и измеряли оптическую плотность содержимого лунок при длине волны 450 нм на спектрофотометре «Униплан», Россия.
Содержание HLDE определяли по калибровочному графику, представляющему собой зависимость оптической плотности раствора субстрата после окончания ферментативной реакции от стандартных концентраций очищенного препарата белка HLDF в диапазоне от 25 нг/мл до 1000 нг/мл. Специфичность связывания полученных антител была подтверждена с помощью иммуноблоттинга с синтезированным HLDF, а также в иммуноферментном анализе с использованием реакции торможения белком взаимодействия выделенных антител к HLDF с антигеном. Селективность исследуемой тест-систем была проанализирована в иммуноферментном анализе с заменой первичных крысиных антител к HLDF на аналогичные антитела к ряду других белков, например инсулину.
Пример 1 - практическое использование разработанной тест-системы определения содержания белка HLDF в сыворотке крови здоровых людей.
В группу (n=40) были включены здоровые люди, проходившие профилактическое медицинское обследование в ЦВГ им. П.В.Мандрыка и в ГКБ №20, в результате которого у них не выявлено сердечно-сосудистых и неврологических заболеваний. Результаты измерений артериального давления (АД) у всех пациентов данной группы находилось в пределах нормы (≤139/89 мм рт.ст.). В анализе использовали сыворотку периферической крови, взятой из кубитальной вены по стандартной методике в условиях асептики. Образцы крови центрифугировали при 3000 об./мин сыворотку отбирали, аликвотировали и хранили при -80°C до проведения исследования. Определение концентрации HLDF проводилось методом гетерогенного твердофазного иммуноферментного анализа (ИФА; Ensyme-Linked Immunosorbent Assay, ELISA) (Самуилов В.Д., 1999; Rich R.R. et al., 2001) с применением разработанной тест-системы по протоколу, описанному выше. В результате проведения анализа установлено, что у пациентов контрольной группы средняя концентрация HLDF в сыворотке крови составила 435,8±21,2 нг/мл (рис.1).
Пример 2 - практическое определение содержания белка HLDF в сыворотке крови пациентов с гипертонической болезнью, церебральным гипертоническим кризом и острым ишемическим инсультом
Для понимания функциональной роли белка HLDF в молекулярных механизмах ГБ и ее церебральных осложнений проводили сравнительное изучение концентрации HLDF в сыворотке крови пациентов с диагностированными гипертонической болезнью (ГБ) (n=38), гипертоническим кризом (ГК) (n=36) и острым ишемическим инсультом (n=45). В результате проведенных экспериментов установлено, что у пациентов с ГБ и церебральными осложнениями ГБ концентрация HLDF была статистически значимо снижена более чем в 50 раз по сравнению с контрольной группой: 2,7±0,9 нг/мл (р<0,00()1) при неосложненной ГБ; 46,4±10,0 нг/мл (р<0,0001) при ГК; 51,4±8,4 нг/мл (р<0,0001) при ОИИ. Наименьшая концентрация HLDF, составляющая 0,6% от нормы, выявлена у пациентов с неосложненной ГБ, при этом она была статистически значимо ниже, чем у пациентов с осложненным течением ГБ: в 17 раз по сравнению с ГК (р=0,0003) и в 19 раз по сравнению с ОИИ (р<0,0001).
При определении концентрации белка HFDI в сыворотке крови пациентов с ГБ, ГК и ОИИ пониженная по сравнению с контрольной группой концентрация HLDF определялась у 100% больных всех групп, что свидетельствует о специфичности обнаруженного феномена снижения концентрации HLDF при ГБ и ее осложнениях.
Выявленное сниженное содержание фактора дифференцировки HLDF в сыворотке крови пациентов с ГБ и с церебральными осложнениями ГБ по сравнению с условно здоровыми лицами позволяет достоверно предположить вовлеченность HLDF в механизмы регуляции АД на молекулярном уровне. Возможно, данный фактор дифференцировки принимает участие в процессах, контролирующих нормальное функционирование эндотелия и/или других клеток сердечно-сосудистой системы, в частности, в процессах вазоконстрикции, так как при снижении его сывороточной концентрации в организме происходят гипертонические изменения, которые наблюдались у пациентов с ГБ, ГК и ОИИ.
Комментируя полученные в примере 2 результаты, необходимо отметить, что одним из механизмов гемодинамической активности белка HLDF и его пептидных фрагментов может являться его способность влиять на уровень половых стероидных гормонов. Так, в экспериментах на самцах мышей линии NMRI было установлено, что один из пептидных фрагментов белка HLDF - пептид HLDF-6 - стимулирует синтез тестостерона в семенниках и коре надпочечников, а также влияет на превращение тестостерона в дигидротестостерон через подавление экспрессии мРНК гена 5-α-редуктазы и как у кастрированных, так и у некастрированных животных, в результате чего белок HLDF может оказывать регулирующее влияние на физиологические процессы, опосредуемые половыми стероидами, в том числе на АД (Rzhevsky D.I. et al., 2005). В экспериментах на самках мышей линии NMRI выявлено, что пептидный фрагмент HLDF-6 блокирует метаболизм прогестерона в 5-α-дигидропрогестерон также за счет ингибирования экспрессии мРНК гена 5-α-редуктазы (неопубликованные данные). Учитывая тот факт, что в гуморальной регуляции АД человека значительная роль принадлежит ренин-ангиотензин-альдостероновой системе (РААС) (Atlas S.A., 2007; Carey R.M., 2011), активность которой зависит от режима кровоснабжения и функции почек, и, принимая во внимание данные о том, что женские половые стероиды являются функциональными антагонистами РААС, препятствующими развитию ГБ, а также ранее изложенные факты о влиянии пептидного фрагмента HLDF-6 на метаболизм половых гормонов, можно предположить взаимодействие РААС и фактора дифференцировки HLDF в процессах регуляции АД.
С целью изучения изменений концентрации белка HLDF в критические для развития заболевания временные периоды содержание HLDF в сыворотке крови обследованных пациентов с ГК и ОИИ было проанализировано в на 1-е, 3-е, 7-е и 21-е сутки госпитализации (см. рис.2, где по оси абсцисс отображен период наблюдения пациентов в сутках госпитализации, по оси ординат концентрация белка HLDF, нг/мл; *р<0,016 по сравнению с 1 сутками). Анализ выявленных особенностей в сывороточном содержании белка HLDF у пациентов, перенесших ГК, показал статистически значимое снижение концентрации HLDF в течение 21 дня наблюдения (χ2=6,83 р<0,016). Обнаружено, что у этих больных концентрация HLDF в сыворотке крови составила 46,0±10,0 нг/м на 1-е сутки, 40,9±7,4 нг/мл на 3-е сутки, 35,0±10,8 нг/мл на 7-е сутки и снижалась на 21-е сутки до 21,1±5,5 нг/мл, что на 50% ниже, чем в 1-е сутки наблюдения.
По-видимому, в острый период ГК повышение концентрации HLDF по сравнению с его уровнем при хронической бескризовой ГБ необходимо для осуществления некоторого защитного или репаративного воздействия на сосуды. Обнаруженный нами факт дальнейшего снижения концентрации HLDF в крови пациентов к 21-му дню от манифестации ГК позволяет предположить, что происходит процесс истощения белка в связи с его связыванием с ауто-АТ либо естественным катаболизмом с одновременным снижением его экспрессии. Поддерживаемый низкий уровень синтеза белкового фактора с дифференцирующей активностью позволяет также полагать его вовлеченность в молекулярные механизмы регуляции АД, описанные ранее. Снижение концентрации белка HLDF, сопровождающее ГК, приводит к ослаблению гемодинамического контроля с его участием и, вероятно, способствует ускорению развития цереброваскулярных нарушений. Показано, что влияние HLDF-6 препятствует гиперактивации NMDA-рецепторов нейронов CAl области гиппокампа и снижает центральную токсичность, вызываемую глутаматом (Костанян И.А. и др., 2009). Возможно, снижение содержания белка-предшественника - HLDF - снимает ограничения с активации глутаматных рецепторов, тем самым, стимулируя каскад ишемического повреждения ткани мозга.
Проведенные исследования сыворотки крови пациентов с ОИИ не выявили статистически значимой динамики концентрации белка FILDF за время обследования. Обнаружено, что с 1-го по 3-й и 7-й дни обследования наблюдалась тенденция к снижению концентрации белка HLDF: 51,4±8,4 нг/мл, 42,8±7,7 нг/мл, 32,6±5,2 нг/мл соответственно, в то время как на 21-е сутки от начала заболевания обнаружено возрастание содержания белка до уровня 54,9±1,4 нг/мл, что сопоставимо с концентрацией HLDF в момент госпитализации.
Подытоживая, результатом проведенных исследования явилась разработка параметров иммуноферментной тест-системы для количественного определения фактора дифференцировки клеток HLDF (human leukemia differentiation factor, фактор дифференцировки человеческой промиелоцитарной клеточной линии), а также проведена сравнительная оценка качества и специфичности данной системы в сыворотки крови здоровых лиц и пациентов с гипертонической болезнью и ее церебральными осложнениями в виде церебрального гипертонического криза и ишемического инсульта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОЛЕКУЛЯРНОЙ ДИАГНОСТИКИ СОСТОЯНИЯ ПСИХОСОМАТИЧЕСКИХ ФУНКЦИЙ У ПАЦИЕНТОВ С ДИСЦИРКУЛЯТОРНОЙ ЭНЦЕФАЛОПАТИЕЙ | 2012 |
|
RU2531922C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ УЛУЧШЕНИЯ КОГНИТИВНЫХ ФУНКЦИЙ ЧЕЛОВЕКА | 2012 |
|
RU2532379C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЗАБОЛЕВАНИЯ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ | 2012 |
|
RU2483306C1 |
| Скрининг-тест для определения функциональной активности системы комплемента крысы | 2022 |
|
RU2786208C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ СИСТЕМНОЙ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ В ОРГАНИЗМЕ ЧЕЛОВЕКА ПРИ ЗАБОЛЕВАНИЯХ | 2022 |
|
RU2808416C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛИТИЧЕСКОЙ АКТИВНОСТИ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2577719C1 |
| Способ определения активности классического и альтернативного путей системы комплемента мыши | 2022 |
|
RU2800363C1 |
| Способ определения комплемент-активирующей функции антител к SARS-CoV-2 для прогнозирования тяжести течения COVID-19 | 2023 |
|
RU2818351C1 |
| Способ определения ингибиторного потенциала крови для прогнозирования неконтролируемой активации системы комплемента при Ковид-19 | 2023 |
|
RU2814496C1 |
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФАКТОРА Н КОМПЛЕМЕНТА ЧЕЛОВЕКА | 2014 |
|
RU2565454C1 |
Изобретение относится к медицине. Способ включает последовательность этапов количественного определения содержания фактора дифференцировки клеток HLDF у пациента, страдающего заболеванием сердечно-сосудистой системы. Такая последовательность обеспечивает получение валидной специфичной и воспроизводимой иммуноферментной тест-системы, позволяющей детектировать биомаркер состояния сосудистой системы в сыворотке крови как здоровых, так и больных сосудистыми заболеваниями людей. 2 пр., 2 ил.
Способ количественного определения содержания фактора дифференцировки клеток HLDF (human leukemia differentiation factor) у пациента, страдающего заболеванием сердечно-сосудистой системы, включающий первоначальную последовательность следующих этапов:
внесение в лунки по 50-250 мкл раствора поликлональных моноспецифических антител млекопитающего к белку HLDF в буфере в соотношении 1:400, инкубацию, блокировку неспецифического связывания белков HLDF с покрытием лунки раствором бычьего сывороточного альбумина (БСА), с последующей инкубацией;
внесение в одну часть упомянутых лунок по 50-250 мкл образца сыворотки обследуемого пациента, разведенной буфером, с последующей инкубацией, в другую часть лунок - стандартных проб с концентрацией HLDF в диапазоне от 25 до 1000 нг/мл, приготовленных на основе концентрированного раствора белка HLDF;
внесение во все лунки по 50-250 мкл раствора поликлональных моноспецифических антител другого вида млекопитающего к белку HLDF в буфере в соотношении 1:4000 с последующей инкубацией;
внесение во все лунки по 50-250 мкл раствора антител козы против IgG кролика, конъюгированных с пероксидазой хрена в буфере, с последующей инкубацией;
внесение во все лунки субстратной смеси с последующим проведением ферментативной реакции в отсутствие освещения и принудительную остановку такой реакции;
при этом количественное определение содержания фактора дифференцировки клеток HLDF у пациента вели измерением оптической плотности содержимого лунки с образцами сыворотки пациента после остановки реакции и сравнением полученных по результатам измерения значений с калибровочными значениями, в качестве которых использовали содержимое лунок со стандартной концентрацией белка HLDF.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| BioVendor, VERSION 51 07.11.2009 | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
Авторы
Даты
2014-11-10—Публикация
2013-04-01—Подача