Область техники
Настоящее изобретение относится к новым полигетероциклическим соединениям, содержащим макроцикл и линейную структуру, особенно, содержащим три-гетероциклические функциональные группы, которые эффективно ингибируют репликацию протеазы NS3 вируса гепатита С (HCV), их комбинациям и способам использования в качестве ингибиторов HCV.
Предшествующий уровень техники Вирус гепатита С является основным патогеном большинства гепатитов не-А, не-В. Он представляет собой одноцепочечный RNA-содержащий вирус семейства желтых вирусов (Flaviviridae), который содержит белок нуклеокапсида (С) и конверт белков (Е1 и Е2), а также некоторые неструктурные белки (NS1, NS2, NS3, NS4a, NS5a и NS5b). Фермент разложения протеазы NS3 обладает сериновой протеазивной активностью и считается необходимым элементом механизма репликации вируса и заражения. О необходимости фермента разложения протеазы свидетельствует тот факт, что протеаза NS3 мутационной желтой лихорадки снижает вирусную инфекцию, необходимость ее для снижения вирусной инфекции следует из факта изменения желтой лихорадки протеазы NS3 и презумпции NS3 [Chamber et al, Proc. Natl. Acad. Sci. USA 87, 8898-8902 (1990)].
До сих пор инфекция вируса гепатита С вызывает хронические заболевания печени, такие, как цирроз и рак печени, уже стали одной из основных угроз для здоровья человека. Количество людей с инфекцией вируса гепатита С, по оценкам, составлялет 2-15% населения мира, но до сих пор нет эффективной вакцины или способа лечения [WO 89/04669; Lavanchy, J. Viral Hepatitis, 6, 35-47(1999); Alter, J. Hepatology, 3l (Suppl. 1), 88-91(1999); и Alberti et al, J. Hepatology, 3l (Suppl. 1), 17-24(1999)].
Было подтверждено, что в модели шимпанзе активная мутация протеазы NS3 HCV может полностью ингибировать инфекцию HCV [Rice et al, J. Virol. 74 (4) 2046-51 (2000)]. Кроме того, сериновые протеазы HCV NS3 оказываются полезными для протеолитического разложения NS3/NS4a, NS4a/NS4b, NS4b/NS5a, NS5a/NS5b и несут ответственность за формирование четырех вирусных белков в процессе репликации вирусов (US 2003/0207861). Таким образом, сериновые протеазы HCV NS3 стали самыми привлекательными и эффективными для развития нового ингибитора гепатита С.
До сих пор глобальные медицинские и исследовательские органы уже разработали многие виды эффективных ингибиторов протеазы NS3 HCV, такие как, WO 2010033466, WO 2010075127, US 20100003214, US 20100022578, US 20100029715, US 20100041889, WO 2009134624, WO 2009010804, US 20090269305, WO 2008057209, WO 2008057208, WO 2007015787, WO 2005037214, WO 200218369, WO 200009558, WO 200009543, WO 199964442, WO 199907733, WO 199907734, WO 199950230, WO 199846630, WO 199817679, US 5,990,276, Dunsdon et al, Biorg. Med. Chem. Lett. 10, 1571-1579 (2000); Llinas-Brunet et al, Biorg. Med. Chem. Lett. 10, 2267-2270 (2000); and S. LaPlante et al., Biorg. Med. Chem. Lett. 10, 2271-2274 (2000).
В последнее время, в связи с отсутствием иммунных или смягчающих способов, связанных с инфекцией вирусом гепатита С, инфекция вирусом гепатита С труднее поддается лечению, чем другие формы гепатита. В настоящее время доступна только анти - HCV терапия - интерферон (interferon), комбинация интерферона-альфа (interferon-alpha)/рибавирин (ribavirin), ПЭГ-интерферона-альфа (pegylated interferon-alpha). Тем не менее, процент непрерывной эффективности этих препаратов (интерферон (interferon), или компинация альфа-интерферона (interferon-alpha) / рибавирином (ribavirin) составляет лишь менее 50%, кроме того, пациенты страдают значительными побочными эффектами этих лечебных препаратов. [Walker, DDT, 4, 518-529 (1999); Weiland, FEMS Microbial. Rev., 14, 279-288 (1994); and WO 02/18369].
В связи с важностью контроля за HCV-инфекцией, задачей, стоящей перед настоящим изобретением, является разработка препаратов, ингибирующих репликацию протеазы HCV NS3, обладающих более высокой эффективностью и лучшей переносимостью.
Раскрытие изобретения
Настоящее изобретение относится к двум новым типам полигетероциклических соединений, как показано в следующих формулах, макроцикл Ia-Ib и линейная структура IIa-IIb, в частности, в них содержатся три-гетероциклические функциональные группы, которые эффективно ингибируют репликацию протеазы NS3 вируса гепатита С.Кроме того, настоящее изобретение также относится к комбинациям препаратов, содержащих одно или более новых соединений (чистые вещества или смешанные стереоизомеры, сольваты, гидраты, таутомеры, пролекарства или фармацевтически приемлемые соли) с другим действующим препаратом, известным для лечения HCV.
В первом аспекте настоящее изобретение предоставляет новый тип полигетероциклических соединений формулы Ia или It:

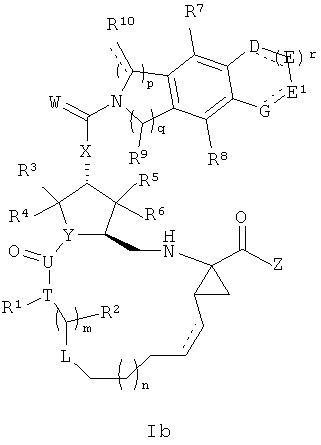
или стереоизомеры, сольваты, гидраты и таутомерные компоненты, этерификационные или амидированные пролекарства, фармацевтически приемлемые соли или их смеси, где:
m=0, 1 или 2;
n=0, 1 или 2;
p=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" ", одинарная связь или двойная связь;
", одинарная связь или двойная связь;
если " " является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, C1-C20-карбонил-аминокислот, С6-С20-арил, С6-С20-арилокси, С6-С20-арилокси-карбонил, или C2-C20- гетероциклические группы;
" является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, C1-C20-карбонил-аминокислот, С6-С20-арил, С6-С20-арилокси, С6-С20-арилокси-карбонил, или C2-C20- гетероциклические группы;
если " " является двойной связью, D, E, Е1 и G - независимые азоты или-С (Re) - функциональные группы; R10 - кислород или серы;
" является двойной связью, D, E, Е1 и G - независимые азоты или-С (Re) - функциональные группы; R10 - кислород или серы;
Ra, Rb и Re - независимые друг от друга водород, галоген, циано, нитро, С1-С20-алкил, С3-С20-циклоалкил, С6-С20-арил, C1-C20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил,
С6-С20-арилокси, С6-С20-арилокси-карбонил, С2-С20-гетероциклический алкоксикарбонил, С2-С20-гетероциклический арил, С1-С20-алкиламино, С2-С20-гетероциклическое амино, С6-С20-арил-амино, С1-С20-амино-карбонил, С1-С20-амидо, C1-С20-амидо-карбонил, С1-С20-карбонильное амино, С1-С20-алкил-сульфонил-амино, С2-С20-гетероциклический сульфонил-амино, С6-С20-арил-сульфонил-амидо, или С1-С20-амино-сульфониламидо.
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
L представляет собой кислород, серу, диметилсульфоксид (-SO), сульфон (-SO2-), карбонил, метилен (-CRbRc), C1-C20 алкенил, C1-C20 алкокси, С2-С20 гетероциклические группы, C2-C20 гетероциклические алкокси, C1-C20 амино, C1-C20 амино карбонил, C1-C20 алкоксикарбонил, С6-С20 арил, С6-С20 арилокси или С6-С20 арилокарбонильные группы;
Т - азот (N), кислорода (О) или СН;
U - углерод (С), сера (S), диметилсульфоксид (-СО-), фосфор (Р) или фосфат;
W - кислород или серы;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азота (N) или СН;
Z является гидрокси, С1-С20-алкил, С3-С20 циклоалкил, C1-C20 алкокси, С3-С20 циклалкокси, C1-C20 алкиламино, С3-С20 циклоалкил-амин, С2-С20 гетероциклическое амино, С6-С20 арил, С6-С20 ариламин, С4-С20 гетероариламино, C1-C20 алкил- сульфониламидо, С3-С20-циклоалкил-сульфониламидо, С6-С20-арил-сульфониламидо, С1-С20 алкокси-сульфонил-амидо, С3-С20-Циклалкокси-сульфониламидо, С1-С20-алкиламино-сульфониламидо, С3-С20 циклоариламино сульфониламидо, С6-С20 ариламино сульфониламидо, C1-C20 урамидо, C1-C20 тиомочевины, C1-C20 фосфат, или С1-С20 эфир борной кислоты.
R1 и R2 предствляют собой соответствующие независимые водород (Н), гидроксил (ОН), амины (-NH 2), C1-С20-алкил, С3-С20 циклоалкил, C1-C20 алкокси, С3-С20 циклалкокси, С1-С20алкоксикарбонил, C1-С20 алкиламино-, С3-С20 циклалкил амино, С2-С20 гетероциклическое амино, С6-С20 ариламино, C1-C20 алкоксикарбонил-амино, С6-С20 арилокси-карбониламино, C1-C20 алкил-сульфониламидо, С3-С20 циклосульфониламидо, С2-С20 гетероциклическое сульфониламидо, С6-С20 арил-сульфониламидо или С1-С20-аминосульфониламидо;
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, С1-С20-алкил, С3-С20 циклалкил, C1-C20 алкокси, C1-C20 алкиламин, С2-С20 гетероциклическое амино, С6-С20 арил, С6-С20 ариламин, C1-C20 алкил-сульфониламидо, C2-C20 гетероциклическое сульфониламидо и С6-С20 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С20-алкил, C1-C20 алкокси, C1-C20 алкилтио, C1-C20 алкоксил-карбонил, С1-С20-амино карбонил, C1-C20 карбониламино, С6-С20арил, С6-С20 арилокси, С6-С20 арилокси-карбонил, или С2-С20 гетероциклические группы.
Преимущественно, Ia-Ib:
m=0, 1 или 2;
n=0, 1 или 2;
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - динарная связь или двойная связь;
" - динарная связь или двойная связь;
если " " является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, C1-С15-алкилтио, С1-С15-алкоксикарбонил, С1-С15-амино-карбонил, С1-С15карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или С2-С15-гетероциклические группы.
" является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, C1-С15-алкилтио, С1-С15-алкоксикарбонил, С1-С15-амино-карбонил, С1-С15карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или С2-С15-гетероциклические группы.
если " " является двойной связью, D, E, E1 и G - независимые азоты или-С (Re) - функциональные группы; R10 - кислород или серы.
" является двойной связью, D, E, E1 и G - независимые азоты или-С (Re) - функциональные группы; R10 - кислород или серы.
Ra, Rb и Re - независимые друг от друга водород, галоген, циано, нитро, C1-C15-алкил, С3-С15-циклоалкил, С6-С15-арил, С1-С15-алкокси, С1-С15-алкилтио, С1-С15-алкоксикарбонил,
С6-С15-арилокси, С6-С15-арилокси-карбонил, С2-С15-гетероциклический алкоксикарбонил, С2-С15-гетероциклический арил, С1-С15-алкиламино, С2-С15-гетероциклическое амино, С6-С15-арил-амино, С1-С15-амино-карбонил, С1-С15-амидо, C1-C15-амидо-карбонил, С1-С15-карбонильное амино, C1-C15-алкил-сульфонил-амино, С2-С15-гетероциклический сульфонил-амино, С6-С15-арил-сульфонил-амидо, или С1-С15-амино- сульфониламидо.
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
L представляет собой кислород, серу, диметилсульфоксид (-SO), сульфон (-SO2-), карбонил, метилен (-CRbRc), С1-С15-алкенил, C1-C15 алкокси, С2-С15 гетероциклические группы, C2-C15 гетероциклические алкокси, C1-C15 амино, С1-С15 амино карбонил, C1-C15 алкоксикарбонил, C6-C15 арил, C6-C15 арилокси или C6-C15 арилокарбонильные группы;
Т - азот (N), кислорода (О) или СН;
U - углерод (С), сера (S), диметилсульфоксид (-СО-), фосфор (Р) или фосфат;
W - кислорода или серы;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1 и G;
У - азота (N) или СН;
Z является гидрокси, С1-С15-алкил, С3-С15 циклоалкил, C1-C15 алкокси, С3-С15-циклалкокси, С1-С15-алкиламино, С3-С15-циклоалкил-амин, C2-C15 гетероциклическое амино, C6-C15 арил, C6-C15 ариламин, C4-C15 гетероариламино, C1-C15 алкил- сульфониламидо, С3-С15 циклоалкил-сульфониламидо, C6-C15 арил-сульфониламидо, C1-C15 алкокси-сульфонил-амидо, С3-С15 циклалкокси-сульфониламидо, C1-C15 алкиламино-сульфониламидо, С3-С15 циклоариламиносульфониламидо, C6-C15 ариламино сульфониламидо, C1-C15 урамидо, C1-C15 тиомочевины, C1-C15 фосфат, или C1-C15 эфир борной кислоты.
R1 и R2 предствляют собой соответствующие независимые водород (Н), гидроксил (ОН), амины (-NH 2), С1-С15-алкил, С3-С15 циклоалкил, C1-C15 алкокси, С3-С15 циклалкокси, С1-С15 алкоксикарбонил, C1-C15 алкиламино, С3-С15циклалкил амино, C2-C15 гетероциклическое амино, С6-С15 ариламино, С1-С15алкоксикарбонил-амино, C6-C15 арилокси-карбониламино, C1-C15 алкил-сульфониламидо, С3-С15 циклосульфонил амидо, C2-C15 гетероциклическое сульфониламидо, C6-C15 арил-сульфониламидо или С1-С15-аминосульфониламидо;
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, С1-С15-алкил, С3-С15 циклалкил, С1-С15алкокси, C1-C15 алкиламин, C2-C15 гетероциклическое амино, C6-C15 арил, C6-C15 ариламин, C1-C15 алкил-сульфониламидо, С2-С15 гетероциклическое сульфониламидо и С6-С20 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С15-алкил, C1-C15 алкокси, С1-С15 алкилтио, C1-C15 алкоксил-карбонил, С1-С15-амино карбонил, С1-С15карбониламино, C6-C15 арил, C6-C15 арилокси, C6-C15 арилокси-карбонил, или C2-C15 гетероциклические группы.
R12 представляет собой водород, С1-С12-алкил, С3-С15 циклалкил, С6-С15 арил, C2-C15 гетероциклический арил, C1-C15 алкоксикарбонил, C6-C15 арилокси-карбонил, C1-C15 алкил амино-карбонил, С6-С15арилсульфонил, C1-C15 алкилсульфонил амино, С3-С15 циклоалкиламиносульфонил, C6-C15 ариламиносульфонил или С3-С15 гетероциклический аминосульфонил.
Предпочтительно, Ia-Ib:
m=0, 1 или 2;
n=0, 1 или 2;
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - одинарная связь или двойная связь;
" - одинарная связь или двойная связь;
если " " является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио,
" является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио,
С1-С8-алкоксикарбонил, С1-С8-амино-карбонил, С1-С8-карбонил-аминокислот, С6-С12-арил, С6-С12-арилокси, С6-С12-арилокси-карбонил, или C2-C12-гетероциклические группы;
если " " является двойной связью, D, E, Е1 и G - независимые азоты или -С (Rc) - функциональные группы; R10 - кислород или серы.
" является двойной связью, D, E, Е1 и G - независимые азоты или -С (Rc) - функциональные группы; R10 - кислород или серы.
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, C1-C8-алкил, С3-С8-циклоалкил, С6-С12-арил, C1-C8-алкокси, C1-C8-алкилтио, C1-C8-алкоксикарбонил, С6-С12-арилокси, С6-С12-арилокси-карбонил, С2-С8-гетероциклический алкоксикарбонил, С2-С8-гетероциклический арил, C1-C8-алкиламино, С2-С8-гетероциклическое амино, С6-С12-арил-амино, C1-C8-амино-карбонил, C1-C8-амидо, C1-C8-амидо-карбонил, C1-C8-карбонильное амино, C1-C8-алкил-сульфонил-амино, С2-С8-гетероциклический сульфонил-амино, С6-С12-арил-сульфонил-амидо, или C1-C8-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непросредственно связаны;
L представляет собой кислород, серу, диметилсульфоксид (-SO), сульфон (-SO2-), карбонил, метилен (-CRbRc), C1-C8 алкенил, C1-C8 алкокси, C2-C8 гетероциклические группы, C2-C8гетероциклические алкокси, C1-C8 амино, C1-C8 амино-карбонил, C1-C8 алкоксикарбонил, С6-С12 арил, С6-С12 арилокси или С6-С12 арилокарбонильные группы;
Т - азот (N), кислорода (О) или СН;
U - углерод (С), сера (S), диметилсульфоксид (-СО-), фосфор (Р) или фосфат;
W - кислород или серы;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азот (N) или СН;
Z является гидрокси, C1-C8-алкил, С3-C8 циклоалкил, C1-C8 алкокси, С3-С8-циклалкокси, C1-C8-алкиламино, С3-С8-циклоалкил-амин, C2-C8 гетероциклическое амино, С6-С12 арил, С6-С12 ариламин, C4-C12 гетероариламино, C1-C8 алкил- сульфониламидо, С3-С8циклоалкил-сульфониламидо, C6-C12 арил-сульфониламидо, C1-C8 алкокси-сульфонил-амидо, С3-C8 циклалкокси-сульфониламидо, C1-C8 алкиламино-сульфониламидо, С3-C8 циклоариламиносульфониламидо, C6-C12 ариламиносульфониламидо, C1-C8 урамидо, C1-C8 тиомочевины, C1-C8 фосфат, или C1-C8 эфир борной кислоты.
R1 и R2 предствляют собой соответствующие независимые водород (Н), гидроксил (ОН), амины (-NH2), C1-C8-алкил, С3-C8 циклоалкил, C1-C8 алкокси, С3-C8 циклалкокси, C1-C8 алкоксикарбонил, C1-C8 алкиламино-, С3-C8 циклалкиламино, C2-C8 гетероциклическое амино, С6-С12 ариламино, C1-C8 алкоксикарбонил-амино, C6-C12 арилокси-карбониламино, C1-C8 алкил-сульфониламидо, С3-С12 циклосульфониламидо, C2-C8 гетероциклическое сульфониламидо, C6-C12 арил-сульфониламидо или C1-C8-аминосульфониламидо;
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, C1-C8-алкил, С3-C8 циклалкил, C1-C8 алкокси, C1-C8 алкиламино, C2-C8 гетероциклическое амино, C6-C12 арил, C6-C12 ариламино, C1-C8 алкил-сульфониламидо, C2-C8 гетероциклическое сульфониламидо и C6-C12 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, C1-C8-алкил, C1-C8 алкокси, C1-C8 алкилтио, C1-C8 алкоксил-карбонил, С1-С8-амино карбонил, C1-C8 карбониламино, C6-C12 арил, C6-C12 арилокси, С6-С12 арилокси-карбонил, или C2-C8 гетероциклические группы.
R13 представляет собой водород, C1-C8-алкил, С3-C8 циклалкил, C6-C12 арил, C4-C12 гетероциклический арил, C1-C8 алкоксикарбонил, C1-C8 арилокси-карбонил, C1-C8 алкиламино-карбонил, C6-C12 арилсульфонил, C6-C12 ариламиносульфонил или C2-C8 гетероциклическая группа.
В наилучшей формуле Ia-Ib: m=1 или 2;
n=1 или 2;
p=1;
q=1;
r=0, 1 или 2;
" " - одинарная или двойная связь;
" - одинарная или двойная связь;
" " - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" " - одинарная связь в трехциклическом D, Е, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1 - независимые -СН2-.;
" - одинарная связь в трехциклическом D, Е, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1 - независимые -СН2-.;
если r=0, Е отсутствует, D и Е1 непосредственно связаны;
L--СН2-;
U - углерод (С), сера (S), диметилсульфоксид (-СО-), фосфор (Р) или фосфат;
W - кислород или сера;
Х является кислородом;
У - азот (N) или СН;
Z представляет собой гидроксил, C1-С6-алкокси, C1-С6-алкил-сульфониламидо, С3-С6 циклоалкил-сульфониламидо, или С6-С10 арил сульфониламидо;
R2, R3, R4, R5, и R6 - независимые друг от друга кислород;
R7, R8 и R9 - независимые друг от друга водород.
Во втором аспекте настоящее изобретение представляет новый тип полигетероциклических соединений формулы IIa или IIb:


или их стереоизомеры, сольваты, гидраты и таутомерные компоненты, этерификационные или амидировованные пролекарства, фармацевтически приемлемые соли или их смеси;
где:
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - одинарная связь или двойная связь;
" - одинарная связь или двойная связь;
если " " является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, С1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, С1-C20-карбонил-амино, С6-С20-арил, С6-С20-арилокси, С6-С20-арилокси-карбонил, или С2-С20-гетероциклические группы;
" является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, С1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, С1-C20-карбонил-амино, С6-С20-арил, С6-С20-арилокси, С6-С20-арилокси-карбонил, или С2-С20-гетероциклические группы;
если " " является двойной связью, D, E, Е1 и G - независимые азоты или-С (Re) - функциональные группы; R10- кислород или серы;
" является двойной связью, D, E, Е1 и G - независимые азоты или-С (Re) - функциональные группы; R10- кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, С1-С20-алкил, С3-С20-циклоалкил, С6-С20-арил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил,
С6-С20-арилокси, С6-С20-арилокси-карбонил, С2-С20-гетероциклический алкоксикарбонил, С2-С20-гетероциклический арил, С1-С20-алкиламино, С2-С20-гетероциклическое амино, С6-С20-арил-амино, С1-С20-амино-карбонил, С1-С20-амидо, C1-C20-амидо-карбонил, С1-С20-карбонильное амино, С1-С20-алкил-сульфонил-амино, С2-С20-гетероциклический сульфонил-амино, С6-С20-арил-сульфонил-амидо, или С1-С20-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непросредственно связаны;
W - кислород или сера;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азота (N) или СН;
Z является гидрокси, С1-С20-алкил, С3-С20 циклоалкил, C1-C20 алкокси, С3-С20 циклалкокси, C1-C20 алкиламино, С3-С20 циклоалкил-амин, С2-С20 гетероциклическое амино, С6-С20 арил, С6-С20 ариламин, C4-C20 гетероариламино, C1-C20 алкил- сульфониламидо, С3-С20циклоалкил-сульфониламидо, С6-С20-арил-сульфониламидо, C1-C20 алкокси-сульфонил-амидо, С3-С20-циклалкокси-сульфониламидо, С1-С20-алкиламино-сульфониламидо, С3-С20 циклоариламино сульфониламидо, С6-С20 ариламино сульфониламидо, C1-C20 урамидо, C1-С20 тиомочевины, C1-C20 фосфат, или С1-С20 эфир борной кислоты.
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, С1-С20-алкил, С3-С20 циклалкил, C1-C20 алкокси, С1-С20 алкиламин, С2-С20 гетероциклическое амино, С6-С20 арил, С6-С20 ариламин, C1-C20 алкил-сульфониламидо, С2-С20 гетероциклическое сульфониламидо и С6-С20 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С20-алкил, C1-C20 алкокси, C1-C20 алкилтио, C1-C20 алкоксил-карбонил, С1-С20-амино карбонил, C1-C20 карбониламино, С6-С20 арил, С6-С20 арилокси, С6-С20 арилокси-карбонил, или С2-С20 гетероциклические группы.
R11 представляет собой водород, С1-С20-алкил, С3-С20 цикл алкил, C6-C20 арил, С2-С20 гетероциклический арил, C1-C20-алкоксикарбонил, С6-С20 арилокси-карбонил, C1-C20 алкил амино-карбонил, С6-С20арилсульфонил, C1-C20 алкилсульфонил амино, С3-С20 циклоалкиламиносульфонил, С6-С20 ариламиносульфонил или
С3-С20 -гетероциклический аминосульфонил.
Предпочтительно, IIa или IIb
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " динарная связь или двойная связь;
" динарная связь или двойная связь;
если " " является одинарной связью, D, E, E1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, C1-С15-алкилтио, C1-С15-алкоксикарбонил, С1-С15-амино-карбонил, С1-С15-карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или C2-C15-гетероциклические группы,
" является одинарной связью, D, E, E1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, C1-С15-алкилтио, C1-С15-алкоксикарбонил, С1-С15-амино-карбонил, С1-С15-карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или C2-C15-гетероциклические группы,
если " " является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10- кислород или серы.
" является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10- кислород или серы.
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, С1-С15-алкил, С3-С15-циклоалкил, С6-С15-арил, С1-С15-алкокси, С1-С15-алкилтио, С1-С15-алкоксикарбонил,
С6-С15-арилокси, С6-С15-арилокси-карбонил, С2-С15-гетероциклический алкоксикарбонил, С2-С15-гетероциклический арил, С1-С15-алкиламино, С2-С15-гетероциклическое амино, С6-С15-арил-амино, С1-С15-амино-карбонил, С1-С15-амидо, C1-C15-амидо-карбонил, С1-С15-карбонильное амино, С1-С15-алкил-сульфонил-амино, С2-С15-гетероциклический сульфонил-амино, С6-С15-арил-сульфонил-амидо, или С1-С15-амино- сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
W - кислород или серы;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азота (N) или СН;
Z является гидрокси, С1-С15-алкил, С3-С15 циклоалкил, C1-C15 алкокси, С3-С15 циклалкокси, С1-С15алкиламино, С3-С15циклоалкил-амин, C2-C15 гетероциклическое амино, C6-C15 арил, C6-C15 ариламин, C4-C15 гетероариламино, C1-C15 алкил-сульфониламидо, С3-С15-циклоалкил-сульфониламидо, C6-C15-арил-сульфониламидо, C1-C15 алкокси-сульфонил-амидо, С3-С15 циклалкокси-сульфониламидо, C1-C15 алкиламино-сульфониламидо, С3-С15 циклоариламиносульфониламидо, C6-C15 ариламино сульфониламидо, C1-C15 урамидо, C1-C15 тиомочевины, C1-C15 фосфат, или C1-C15 эфир борной кислоты.
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, С1-С15-алкил, С3-С15 циклалкил, С1-С15алкокси, C1-C15 алкиламин, C2-C15 гетероциклическое амино, C6-C15 арил, C6-C15 ариламин, C1-C15 алкил-сульфониламидо, C2-C15 гетероциклическое сульфониламидо и C6-C15 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С15-алкил, C1-C15 алкокси, C1-C15 алкилтио, C1-C15 алкоксил-карбонил, С1-С15-амино карбонил, С1-С15карбониламино, C6-C15 арил, C6-C15 арилокси, C6-C15 арилокси-карбонил, или C2-C15 гетероциклические группы.
R11 представляет собой водород, С1-С15-алкил, С3-С15 цикл алкил, C6-C15 арил, C2-C15 гетероциклический арил, С1-С20алкоксикарбонил, С6-С20 арилокси-карбонил, C1-C15 алкил амино-карбонил, С6-С15арилсульфонил, C1-C15 алкилсульфонил амино, С3-С15 циклоалкиламиносульфонил, C6-C15 ариламиносульфонил или С3-С15 гетероциклический аминосульфонил.
В предпочтительном варианте настоящего изобретения IIa или IIb,
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - одинарная связь или двойная связь;
" - одинарная связь или двойная связь;
если " " является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио, С1-С8-алкоксикарбонил, С1-С8-амино-карбонил, C1-C8-карбонил-аминокислот, С6-С12-арил, С6-С12-арилокси, С6-С12-арилокси-карбонил, или C2-C12-гетероциклические группы;
" является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио, С1-С8-алкоксикарбонил, С1-С8-амино-карбонил, C1-C8-карбонил-аминокислот, С6-С12-арил, С6-С12-арилокси, С6-С12-арилокси-карбонил, или C2-C12-гетероциклические группы;
если " " является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10 - кислород или серы;
" является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10 - кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, C1-C8-алкил, С3-С8-циклоалкил, С6-С12-арил, C1-C8-алкокси, C1-C8-алкилтио, С1-C8-алкоксикарбонил,
С6-С12-арилокси, С6-С12-арилокси-карбонил, С2-С8-гетероциклический алкоксикарбонил, С2-C8-гетероциклический арил, C1-C8-алкиламино, С2-C8-гетероциклическое амино, С6-С12-арил-амино, C1-C8-амино-карбонил, C1-C8-амидо, C1-C8-амидо-карбонил, C1-C8-карбонильное амино, C1-C8-алкил-сульфонил-амино, С2-С8-гетероциклический сульфонил-амино, С6-С12-арил-сульфонил-амидо, или C1-C8-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
W - кислород или серы;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азота (N) или СН;
Z является гидрокси, C1-C8-алкил, С3-C8 циклоалкил, C1-C8 алкокси, С3-C8 циклалкокси, C1-C8 алкиламино, С3-С8 циклоалкил-амин, C2-C8 гетероциклическое амино, C6-C12 арил, C6-C12 ариламин, C4-C12 гетероариламино, C1-C8 алкил-сульфониламидо, С3-С8 циклоалкил-сульфониламидо, C6-C12 арил-сульфониламидо, C1-C8 алкокси-сульфонил-амидо, С3-C8 циклалкокси- сульфониламидо, C1-C8 алкиламино-сульфониламидо, С3-C8 циклоариламиносульфониламидо, C6-C12 ариламиносульфониламидо, C1-C8 урамидо, C1-C8 тиомочевины, C1-C8 фосфат, или С1-С8 эфир борной кислоты;
R1 и R2 предствляют собой соответствующие независимые водород (Н), гидроксил (ОН), амины (-NH2), C1-C8-алкил, С3-C8 циклоалкил, C1-C8 алкокси, С3-C8 циклалкокси, C1-C8 алкоксикарбонил, C1-C8 алкиламино-, С3-C8 циклалкил амино, C2-C8 гетероциклическое амино, C6-C12 ариламино, С1-C8алкоксикарбонил-амино, C6-C12 арилокси- карбониламино, C1-C8 алкил сульфониламидо, С3-С12 циклосульфонил амидо, C2-C8 гетероциклическое сульфониламидо, C6-C12 арил-сульфониламидо или C1-C8-аминосульфониламидо;
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, C1-C8-алкил, С3-C8 циклалкил, C1-C8 алкокси, C1-C8 алкиламин, C2-C8 гетероциклическое амино, C6-C12 арил, C6-C12 ариламин, C1-C8 алкил-сульфониламидо, С2-C8 гетероциклическое сульфониламидо и C6-C12 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, C1-C8-алкил, C1-C8 алкокси, C1-C8 алкилтио, C1-C8 алкоксил-карбонил, C1-C8-амино карбонил, C1-C8 карбониламино, C6-C12 арил, C6-C12 арилокси, C6-C12 арилокси-карбонил, или C2-C8 гетероциклические группы.
Предпочтительно, если R11 представляет собой водород, C1-C8-алкил, C1-C8-алкило-карбонил, C1-C8-алкокси-карбонил, С6-С12-арилокси-карбонил, или другие лучшие группы со следующими структурами SM-14a - SM-14v:
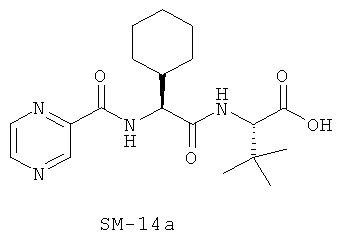
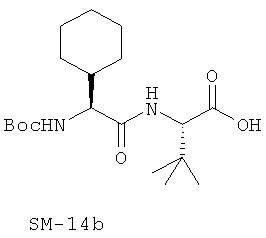
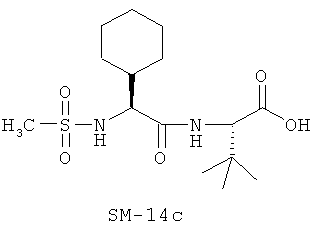


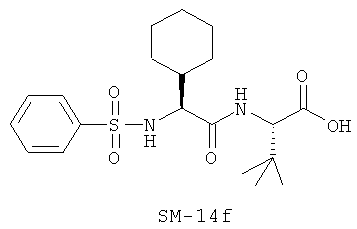
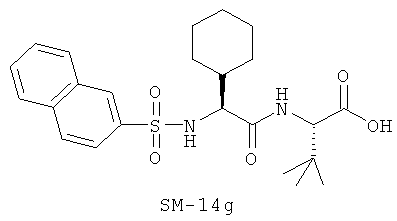



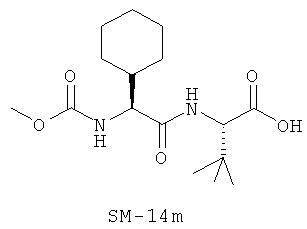

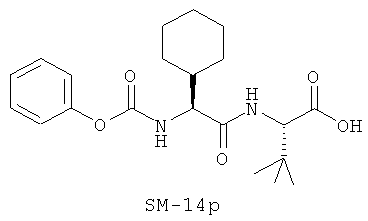





В предпочтительном варианте настоящего изобретения IIa-IIb,
p=1;
q=1;
r=0, 1 или 2;
" " - одинарная или двойная связь;
" - одинарная или двойная связь;
" " - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" " R10 - одинарная связь, R10 - водород;
" R10 - одинарная связь, R10 - водород;
" " - одинарная связь в трехциклическом D, E, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1- независимые -СН2-,
" - одинарная связь в трехциклическом D, E, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1- независимые -СН2-,
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
W - кислород или серы;
Х является кислородом;
У - азота (N) или СН;
Z представляет собой гидроксил, C1-С6-алкокси, C1-С6-алкил-сульфониламидо,
С3-С6 циклоалкил-сульфониламидо, или С6-С10 арил-сульфониламидо;
R2, R3, R4, R5, и R6- независимые друг от друга кислород;
R7, R8 и R9- независимые друг от друга водород;
R11 представляет собой водород, С1-С8-алкил, C1-C8 алкил-карбонил, C1-C8 алкоксикарбонил, C6-C12 арилокси-карбонил, или другие группы структур SM-14a-SM-14v в п.8.
В третьем аспекте настоящее изобретение предоставляет новый тип полициклических гетероциклических соединений формулы IIIa или IIIb:


где:
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - одинарная связь или двойная связь;
" - одинарная связь или двойная связь;
если " " является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, С1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, С1-С20-карбонил-амино, С6-С20-арил, С6-С20-арилокси, С6-С20-арилокси-карбонил, или С2-С20-гетероциклические группы;
" является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, С1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, С1-С20-карбонил-амино, С6-С20-арил, С6-С20-арилокси, С6-С20-арилокси-карбонил, или С2-С20-гетероциклические группы;
если " " является двойной связью, D, E, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10- кислород или серы;
" является двойной связью, D, E, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10- кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, С1-С20-алкил, С3-С20-циклоалкил, С6-С20-арил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил,
С6-С20-арилокси, С6-С20-арилокси-карбонил, С2-С20-гетероциклический алкоксикарбонил, С2-С20-гетероциклический арил, С1-С20-алкиламино, С2-С20-гетероциклическое амино, С6-С20-арил-амино, С1-С20-амино-карбонил, С1-С20-амидо, C1-C20-амидо-карбонил, С1-С20-карбонильное амино, С1-С20-алкил-сульфонил-амино, С2-С20-гетероциклическое сульфонил-амино, С6-С20-арил-сульфонил-амидо, или С1-С20-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
W - кислород или серы;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азота (N) или СН;
Z1 является гидрокси, C1-C20-алкил, С3-С20 циклоалкил, C1-C20 алкокси, С3-С20 циклалкокси, C1-C20 алкиламино, С3-С20 циклоалкил-амин, С2-С20 гетероциклическое амино, С6-С20 арил, C6-C20 ариламин, C4-C20 гетероариламино, C1-C20 алкил-сульфониламидо, С3-С20-циклоалкил-сульфониламидо, С6-С20 арил-сульфониламидо, C1-C20 алкокси-сульфонил-амидо, С3-С20 циклалкокси-сульфониламидо, C1-C20 алкиламино-сульфониламидо, С3-С20 циклоариламино сульфониламидо, C6-C20 ариламино сульфониламидо, C1-C20 урамидо, C1-C20 тиомочевины, C1-C20 фосфат, или С1-С20эфир борной кислоты;
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, C1-С20-алкил, С3-С20 циклалкил, C1-C20 алкокси, C1-C20 алкиламин, С2-С20 гетероциклическое амино, C6-C20 арил, C6-C20 ариламин, C1-C20 алкил-сульфониламидо, С2-С20 гетероциклическое сульфониламидо и С6-С20 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С20-алкил, C1-C20 алкокси, C1-С20 алкилтио, C1-C20 алкоксил-карбонил, С1-С20-амино карбонил, C1-C20 карбониламино, С6-С20 арил, С6-С20 арилокси, C6-C20 арилокси-карбонил, или С2-С20 гетероциклические группы;
R12 представляет собой водород, С1-С20-алкил, С3-С20 цикл алкил, С6-С20 арил, С2-С20 гетероциклический арил, C1-С20 алкоксикарбонил, С6-С20 арилокси-карбонил, C1-C20 алкил амино-карбонил, С6-С50 арилсульфонил, C1-C20 алкилсульфонил амино, С3-С20 циклоалкиламиносульфонил, С6-С20 ариламиносульфонил или С3-С20 гетероциклический аминосульфонил.
В предпочтительной формуле настоящего изобретения IIIa-IIIb,
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " динарная связь или двойная связь;
" динарная связь или двойная связь;
если " " является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, С1-С15-алкилтио, C1-С15-алкоксикарбонил, С1-С15-амино-карбонил, C1-C15 карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или C2-C15- гетероциклические группы;
" является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, С1-С15-алкилтио, C1-С15-алкоксикарбонил, С1-С15-амино-карбонил, C1-C15 карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или C2-C15- гетероциклические группы;
если " " является двойной связью, D, E, Е1 и G - независимые азоты или -С (Re) - функциональные группы; R10 - кислород или серы;
" является двойной связью, D, E, Е1 и G - независимые азоты или -С (Re) - функциональные группы; R10 - кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, С1-С15-алкил, С3-С15-циклоалкил, С6-С15-арил, С1-С15-алкокси, С1-С15-алкилтио, С1-С15-алкоксикарбонил,
С6-С15-арилокси, С6-С15-арилокси-карбонил, С2-С15-гетероциклический алкоксикарбонил, С2-С15-гетероциклический арил, С1-С15-алкиламино, С2-С15-гетероциклическое амино, С6-С15-арил-амино, С1-С15-амино-карбонил, С1-С15-амидо, C1-C15-амидо-карбонил, С1-С15-карбонильное амино, С1-С15-алкил-сульфонил-амино, С2-С15-гетероциклическое сульфонил-амино, С6-С15-арил-сульфонил-амидо, или С1-С15-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
W - кислород или серы;
Х является кислородом, серой, азотом, или амино (-NRa-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азота (N) или СН;
Z1 является гидрокси, С1-С15-алкил, С3-С15 циклоалкил, C1-C15 алкокси, С3-С15 циклалкокси, С1-С15алкиламино, С3-С15циклоалкил-амин, C2-C15 гетероциклическое амино, C6-C15 арил, C6-C15 ариламин, C4-C15 гетероариламино, C1-C15 алкил-сульфониламидо, С3-С15циклоалкил-сульфониламидо, C6-C15 арил-сульфониламидо, C1-C15 алкокси-сульфонил-амидо, С3-С15 циклалкокси-сульфониламидо, C1-C15 алкиламино-сульфониламидо, С3-С15 циклоариламиносульфониламидо, C6-C15 ариламиносульфониламидо, C1-C15 урамидо, C1-C15 тиомочевины, C1-C15 фосфат, или С1-С15эфир борной кислоты;
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, С1-С15-алкил, С3-С15 циклалкил, С1-С15алкокси, C1-C15 алкиламин, C2-C15 гетероциклическое амино, C6-C15 арил, C6-C15 ариламин, C1-C15 алкил-сульфониламидо, C2-C15 гетероциклическое сульфониламидо и С6-С20 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С15-алкил, C1-C15 алкокси, C1-C15 алкилтио, C1-C15 алкоксил-карбонил, С1-С15-амино карбонил, C1-C15 карбониламино, C6-C15 арил, C6-C15 арилокси, С6-С15 арилокси-карбонил, или C2-C15 гетероциклические группы;
R11 представляет собой водород, С1-С15-алкил, С3-С15 цикл алкил, C6-C15 арил, C2-C15 гетероциклический арил, С1-С20 алкоксикарбонил, С6-С20 арилокси-карбонил, C1-C15 алкиламино-карбонил, С6-С15 арилсульфонил, C1-C15 алкилсульфониламино, С3-С15 циклоалкиламиносульфонил, C6-C15 ариламиносульфонил или С3-С15 гетероциклический аминосульфонил.
В предпочтительной формуле настоящего изобретения IIIa-IIIb,
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - одинарная связь или двойная связь;
" - одинарная связь или двойная связь;
если " " является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио, С1-С8-алкоксикарбонил, С1-С8-амино-карбонил, C1-C8 карбонил-аминокислот, С6-С12-арил, С6-С12-арилокси, С6-С12-арилокси-карбонил, или C2-C12- гетероциклические группы;
" является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио, С1-С8-алкоксикарбонил, С1-С8-амино-карбонил, C1-C8 карбонил-аминокислот, С6-С12-арил, С6-С12-арилокси, С6-С12-арилокси-карбонил, или C2-C12- гетероциклические группы;
если " " является двойной связью, D, E, Е1 и G - независимые азоты или -С (Rc) - функциональные группы; R10 - кислород или серы;
" является двойной связью, D, E, Е1 и G - независимые азоты или -С (Rc) - функциональные группы; R10 - кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, C1-C8-алкил, С3-С8-циклоалкил, С6-С12-арил, C1-C8-алкокси, C1-C8-алкилтио, С1-С8-алкоксикарбонил, С6-С12-арилокси, С6-С12-арилокси-карбонил, C2-C8-гетероциклический алкоксикарбонил, С2-C8-гетероциклический арил, C1-C8-алкиламино, C2-C8-гетероциклическое амино, С6-С12-арил-амино, C1-C8-амино-карбонил, C1-C8-амидо, C1-C8-амидо-карбонил, C1-C8-карбонильное амино, C1-C8-алкил-сульфонил-амино, C2-C8-гетероциклическое сульфонил-амино, С6-С12-арил-сульфонил-амидо, или C1-C8-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
W - кислорода или серы;
Х является кислородом, серой, азотом, или амино (-НРО-); в особенности, определение Ra то же самое, как вышеуказанные Ra в D и Е, Е1, и G;
У - азота (N) или СН;
Z1 является гидрокси, C1-C8-алкил, С3-C8 циклоалкил, C1-C8 алкокси, С3-C8 циклалкокси, C1-C8 алкиламино, С3-С8 циклоалкил-амин, C2-C8 гетероциклическое амино, C6-C12 арил, С6-С12 ариламино, C4-C12 гетероариламино, C1-C8 алкил-сульфониламидо, С3-С8 циклоалкил-сульфониламидо, C6-C12 арил-сульфониламидо, C1-C8 алкокси-сульфонил-амидо, С3-C8 циклалкокси-сульфониламидо, C1-C8 алкиламино-сульфониламидо, С3-C8 циклоариламиносульфониламидо, C6-C12 ариламиносульфониламидо, C1-C8 урамидо, C1-C8 тиомочевины, C1-C8 фосфат, или C1-C8 эфир борной кислоты;
R1 и R2 предствляют собой соответствующие независимые водород (Н), гидроксил (ОН), амины (-NH2), C1-C8-алкил, С3-C8 циклоалкил, C1-C8 алкокси, С3-C8 циклалкокси, C1-C8 алкоксикарбонил, C1-C8 алкиламино-, С3-C8 циклалкил амино, C2-C8 гетероциклическое амино, C6-C12 ариламино, C1-C8 алкоксикарбонил-амино, C6-C12 арилокси-карбониламино, C1-C8 алкил-сульфониламидо, С3-С12 циклосульфониламидо, C2-C8 гетероциклическое сульфониламидо, C6-C12 арил-сульфониламидо или C1-C8-аминосульфониламидо;
R3, R4, R5, R6 - независимый водород, галоген, гидроксил, циано, нитро, C1-C8-алкил, С3-C8 циклалкил, C1-C8 алкокси, C1-C8 алкиламин, C2-C8 гетероциклическое амино, C6-C12 арил, C6-C12 ариламин, C1-C8 алкил-сульфониламидо, C2-C8 гетероциклическое сульфониламидо и C6-C12 арил-сульфонамидо, а также
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, C1-C8-алкил, C1-C8 алкокси, C1-C8 алкилтио, C1-C8 алкоксил-карбонил, C1-C8-амино карбонил, C1-C8 карбониламино, C6-C12 арил, C6-C12 арилокси, С6-С12арилокси-карбонил, или C2-C8 гетероциклические группы;
R12 представляет собой водород, C1-C8-алкил, С3-C8 цикл алкил, C6-C12 арил, C4-C12 гетероциклический арил, C1-C8 алкоксикарбонил, C6-C12 арилокси-карбонил, C1-C8 алкиламино-карбонил, С6-С12 арилсульфонил, C1-C8 алкилсульфониламино, С3-C8 циклоалкиламиносульфонил, C6-C12 ариламиносульфонил или С3-C8 гетероциклический аминосульфонил.
В предпочтительной формуле настоящего изобретения IIIa-IIIb:
p=1;
q=1;
r=0, 1 или 2;
" " - одинарная или двойная связь;
" - одинарная или двойная связь;
" " - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" " R10 - одинарная связь, R10 - водород;
" R10 - одинарная связь, R10 - водород;
" " - одинарная связь в трехциклическом D, Е, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1 - независимые -СН2-;
" - одинарная связь в трехциклическом D, Е, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1 - независимые -СН2-;
если r=0, Е отсутствует, D и Е1 непосредственно связаны;
W - кислород или серы;
Х является кислородом;
У - азот (N) или СН;
Z1 - гидрокси' C1-С6-алкокси, C1-С6 - алкисульфониламидо, С3-С6 циклоалкил-сульфонил амидо, С6-С10 арилсульфониламидо;
R3, R4, R5, и R6 независимые друг от друга водород;
R7, R8 и R9 независимые друг от друга водород;
R12 представляет собой водород, C1-С6-алкил, C1-С6 алкоксикарбонил, С6-С10 арилокси-карбонил, или С6-С10 арил сульфонил.
В четвертом аспекте настоящее изобретение предоставляет новый тип полигетероциклических соединений формулы Va или Vb:


где:
p=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - одинарная связь или двойная связь;
" - одинарная связь или двойная связь;
если " " является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, C1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, C1-С20
" является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 -водород, кислород, галоген, циано, трифторметил, C1-С20-алкил, С1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил, С1-С20-амино-карбонил, C1-С20
карбонил-амино, С6-С20-арил, С6-С20-арилокси, С6-С20-арилокси-карбонил, или С2-С20- гетероциклические группы;
если " " является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10 - кислород или серы;
" является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10 - кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, С1-С20-алкил, С3-С20-циклоалкил, С6-С20-арил, C1-С20-алкокси, С1-С20-алкилтио, С1-С20-алкоксикарбонил,
С6-С20-арилокси, С6-С20-арилокси-карбонил, С2-С20-гетероциклический алкоксикарбонил, С2-С20-гетероциклический арил, С1-С20-алкиламино, С2-С20-гетероциклическое амино, С6-С20-арил-амино, С1-С20-амино-карбонил, С1-С20-амидо, C1-С20-амидо-карбонил, С1-С20-карбонильное амино, С1-С20-алкил-сульфонил-амино, С2-С20-гетероциклический сульфонил-амино, С6-С20-арил-сульфонил-амидо, или С1-С20-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С20-алкил, C1-C20 алкокси, C1-C20 алкилтио, C1-C20 алкоксил-карбонил, С1-С20-амино карбонил, C1-C20 карбониламино, С6-С20 арил, С6-С20 арилокси, С6-С20 арилокси-карбонил, или С2-С20 гетероциклические группы;
R13 представляет собой водород, С1-С20-алкил, С3-С20 цикл алкил, С6-С20 арил, С4-С20 гетероциклический арил, C1-C20 алкоксикарбонил, C1-C20 арилокси-карбонил, С1-С20 алкил амино-карбонил, С6-С20 арилсульфонил, С6-С20-ариламиносульфонил или С2-С20 гетероциклическая группа.
В хорошей формуле настоящего изобретения Va-Vb:
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " динарная связь или двойная связь;
" динарная связь или двойная связь;
если " " является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, С1-С15-алкилтио, C1-С15-алкоксикарбонил, С1-С15-амино-карбонил, С1-С15-карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или C2-C15-гетероциклические группы;
" является одинарной связью, D, E, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, С1-С15-алкил, C1-С15-алкокси, С1-С15-алкилтио, C1-С15-алкоксикарбонил, С1-С15-амино-карбонил, С1-С15-карбонил-аминокислот, С6-С15-арил, С6-С15-арилокси, С6-С15-арилокси-карбонил, или C2-C15-гетероциклические группы;
если " " является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10- кислород или серы;
" является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Rc) - функциональные группы; R10- кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, С1-С15-алкил, С3-С15-циклоалкил, С6-С15-арил, С1-С15-алкокси, С1-С15-алкилтио, С1-С15-алкоксикарбонил,
С6-С15-арилокси, С6-С15-арилокси-карбонил, С2-С15-гетероциклический алкоксикарбонил, С2-С15-гетероциклический арил, С1-С15-алкиламино, С2-С15-гетероциклическое амино, С6-С15-арил-амино, С1-С15-амино-карбонил, С1-С15-амидо, C1-C15-амидо-карбонил, С1-С15-карбонильное амино, С1-С15-алкил-сульфонил-амино, С2-С15-гетероциклический сульфонил-амино, С6-С15-арил-сульфонил-амидо, или С1-С15-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны;
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, С1-С15-алкил, C1-C15 алкокси, C1-C15 алкилтио, C1-C15 алкоксил-карбонил, С1-С15-амино карбонил, С1-С15карбониламино, C6-C15 арил, C6-C15 арилокси, С6-С15арилокси-карбонил, или С2-С15 гетероциклические группы;
R13 представляет собой водород, С1-С15-алкил, С3-С15 цикл алкил, C6-C15 арил, C4-C15 гетероциклический арил, С1-С15 алкоксикарбонил, C1-C15 арилокси-карбонил, C1-C15 алкил амино-карбонил, С6-С15 арилсульфонил, C6-C15 ариламиносульфонил или С2-С15 гетероциклическая группа.
В преимущественной формуле настоящего изобретения Va-Vb;
р=0, 1 или 2;
q=0, 1 или 2;
r=0, 1, 2 или 3;
" " - одинарная связь или двойная связь;
" - одинарная связь или двойная связь;
если " " является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио, С1-С8-алкоксикарбонил, С1-С8-амино-карбонил, C1-C8 карбонил-аминокислот, С6-С12-арил, С6-С12-арилокси, С6-С12-арилокси-карбонил, или C2-C12- гетероциклические группы;
" является одинарной связью, D, Е, Е1 и G - независимые кислород, сера, аминокислота, или-С (Ra) (Rb) - функциональные группы; R10 - водород, кислород, галоген, циано, трифторметил, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкилтио, С1-С8-алкоксикарбонил, С1-С8-амино-карбонил, C1-C8 карбонил-аминокислот, С6-С12-арил, С6-С12-арилокси, С6-С12-арилокси-карбонил, или C2-C12- гетероциклические группы;
если " " является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Re) - функциональные группы; R10 - кислород или серы;
" является двойной связью, D, Е, Е1 и G - независимые азоты или-С (Re) - функциональные группы; R10 - кислород или серы;
Ra, Rb и Rc - независимые друг от друга водород, галоген, циано, нитро, C1-C8-алкил, С3-С8-циклоалкил, С6-С12-арил, C1-C8-алкокси, C1-C8-алкилтио, C1-C8-алкоксикарбонил,
С6-С12-арилокси, С6-С12-арилокси-карбонил, С2-С8-гетероциклический алкоксикарбонил, С2-C8-гетероциклический арил, C1-C8-алкиламино, С2-C8-гетероциклическое амино, С6-С12-арил-амино, С1-С8-амино-карбонил, C1-C8-амидо, C1-C8-амидо-карбонил, C1-C8-карбонильное амино, С1-C8-алкил-сульфонил-амино, С2-С8-гетероциклический сульфонил-амино, С6-С12-арил-сульфонил-амидо, или C1-C8-амино-сульфониламидо;
при r=0, Е отсутствует, D и Е1 непосредственно связаны
R7, R8 и R9 - независимые друг от друга водород, циано, нитро, трифторметана, C1-C8-алкил, C1-C8 алкокси, C1-C8 алкилтио, C1-C8 алкоксил-карбонил, C1-C8-амино карбонил, C1-C8 карбониламино, C6-C12 арил, С6-С12 арилокси, С6-С12 арилокси-карбонил, или С2-C8 гетероциклические группы;
R13 представляет собой водород, C1-C8-алкил, С3-С8циклалкил, C6-C8 арил, C4-C12 гетероциклический арил, C1-C8 алкоксикарбонил, C1-C8 арилокси-карбонил, C1-C8 алкил амино-карбонил, С6-C12 арилсульфонил, C6-C12 ариламиносульфонил или C2-C8 гетероциклические группы.
В наилучшей формуле настоящего изобретения Va-Vb:
p=1;
q=1;
r=0, 1 или 2;
" " - одинарная или двойная связь;
" - одинарная или двойная связь;
" " - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" - двойная связь в макроциклическом внутреннем объединении с циклопропил-формилом;
" " R10 - одинарная связь, R10-водород;
" R10 - одинарная связь, R10-водород;
" " - одинарная связь в трехциклическом D, Е, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1 независимые -CH2-;
" - одинарная связь в трехциклическом D, Е, Е1 и G и других циклических группах, D и G - независимые друг от друга кислород; Е и Е1 независимые -CH2-;
при r=0, Е отсутствует, D и Е1 непросредственно связаны;
R7, R8 и R9- независимые друг от друга водород;
R13 представляет собой водород, C1-C8 алкил, C1-C8 алкилкарбонил, C1-C8 алкоксикарбонил, или С6-С10 арилсульфонил;
Предпочтительно, если R13 представляет собой водород, Va или Vb имеет следующую структуру VIa-VIf:


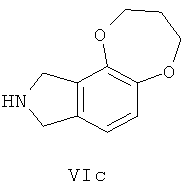


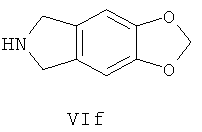
В пятом аспекте, настоящее изобретение предоставляет новый тип соединений и их стереоизомеры, сольваты, гидраты, таутомеры, пролекарства или фармацевтически приемлемые соли или их смеси.
В шестом аспекте предоставляется новая комбинация препаратов, включая одно или несколько соединений структуры Ia-Ib или IIa-IIb, и их стереоизомеры, таутомеры, сольваты, гидраты, таутомеры, этерификационные пролекарства или фармацевтически приемлемые соли или вспомогательные вещества.
В седьмом аспекте предоставляется способ ингибирования гепатита вируса С путем использования одного или более соединений по пп.1-16 в комбинации с одним или несколькими из следующих агентов: (1) иммуномодулирующие агенты, включая интерферон, ПЭГ-интерферон, производные интерферона, но не ограничиваясь ими; (2) ингибиторы протеазы вирусов гепатита С; (3) ингибиторы полимеразы вирусов гепатита С; (4) нуклеозиды и производные нуклеозидов, (5) ингибиторы циклофилина, (6) ингибиторы глюкозидазы, (7) IMPDH ингибиторы, (8) ингибиторы каспаз, (9) TLR-агонисты, (10) ингибиторы вируса иммунодефицита человека, (11) противовоспалительные препараты (12), лекарства от рака, или (13) другие соединения, не относящиеся к вышеуказанным (1)-(12).
Данное изобретение предоставляет два типа новых высокоэффективных полигетероциклических ингибиторов вируса гепатита С, которые могут эффективно ингибировать репликацию протеазы NS3 вируса гепатита С. Данное изобретение также проектирует приготовление и практическое использование ингибиторов HCV.
В последнее время данное изобретение получило заметное развитие:
1) Данное изобретение предоставляет эффективные методы приготовления, с помощью которых приготовлены многие новые полигетероциклические структуры, и различные новые полигетероциклические ингибиторы гепатита вируса С.
2) Данное изобретение предоставляет 2 класса высокоэффективных полигетероциклических соединений с макроциклической и линейной структурой, которые эффективно ингибируют гепатит вируса С в пробирке и в естественных условиях.
3) Данное изобретение исследует связь между структурами новых полигетероциклических соединений и эффективных ингибиторов гепатита вируса С, что обеспечивает развитие эффективных ингибиторов HCV.
Термины и понятия
Используемый здесь термин "алкил" относится ко всем алкилам на прямой цепи и разветвлениям, содержащим определенное количество атомов углерода и/или "алкилен" в пределах указанного диапазона, в котором один или несколько атомов водорода заменены на один или несколько заместителей галогена.
Термин "алкокси" означает алкил-O-группы.
Термин "циклоалкил" относится ко всем циклическим алканам или олефинам, содержащим определенное количество атомов углерода и/или "алкилен" в пределах указанного диапазона, в том числе, один или несколько атомов водорода заменены на один или несколько заместителей галогена.
Термин "галоген" означает атомы-фтор, хлор, бром, йод.
Термин "карбонил" означает "-С (О)-" - группы.
Термин "алкил-карбонил" означает "алкил-С(О) - группы.
Термин "алкоксикарбонил" означает"алкил-O-С (О) - группы.
Термин "алкиламино-карбонил" означает группы «алкил-NH-C (О)» - или группы «биалкил-NC (О)».
Термин "алкилосульфониламино" означает группу «алкил-S(O)2NH-» или группу «алкил- -S(O)2NH-», R представляет собой алкил или алкилокарбонил.
Термин "алкокси-сульфонил-амидо" означает группу «алкил-OS (О)2NH- " или группу "алкил-O-S (О)2N (R)», R представляет собой алкил или алкилокарбонил.
Термин "полициклическо-гетероциклический" означает трициклические или тетрациклические функциональные группы, в одной или более конденсированных кольцах существуют 1-5 гетероатома (например, кислород, азот, сера и фосфор).
Термин "сульфониламино" означает "-S(O)2NH-" или "-S(O)2N(R)-", и R представляет собой алкил или алкилокарбонил.
Термин "администрирование" означает пролекарство-соединения или соединения, предоставленные пациентам, приготовленные из соединений настоящего изобретения.
Термин «комбинация» означает продукт со специальными ингредиентами, а также прямой или косвенный продукт с этими смешанными специальными ингредиентами.
Термин "эффективная доза" означает дозу активных соединений или лекарственных препаратов, достаточную для вызова в организации, системе, животном или человеке биологического или медицинского реагирования, что наблюдается исследователем, ветеринаром, врачом и другим специалистом. Этот термин также включает в себя дозу активных соединений, достаточную для вызова видимого реагирования (то есть эффективная доза для ингибирования) для ингибирования протеазы ВГС NS3. Когда активным соединением (активным составом) служит соль, количество активного ингредиента означает количество соединения в форме свободной кислоты или в форме свободной щелочи.
Термин "фармацевтически приемлемый" означает, что компоненты комбинации препаратов должны быть совместимы друг с другом и безвредны для испытуемых.
Детальная часть настоящего изобретения описывает методы приготовления новых ингибиторов HCV Ia-Ib и IIa, Iib и испытания их биологической активности. Далее преимущества настоящего изобретения будут подробно описаны.
Подробные испытания и их результаты
Настоящее изобретение включает в себя два типа новых высокоэффективных полигетероциклических соединений Ia-Ib и IIa-IIb и их фармацевтически приемлемые соли и/или ингибиторы-гидраты протеазы NS3 вирусов гепатита С. Кроме того, исследования токсичности показывают, что эти соединения нетоксичны для большинства эффективных ингибиторов вируса гепатита С (токсичность LD50>10000).
В результате синтезирования новых полигетероциклических соединений Ia-Ib и IIa-IIb, в соответствии с ранее опубликованной литературой и оптимизированными методами синтезирования, подготовлены соединения различных структур Ia-Ib и IIa-IIb.
Аббревиатуры и комментарии химических реактивов и сольватов для синтезирования различных соединений и промежуточных продуктов перечислены перед практическими примерами в последней части.
Соединения настоящего изобретения VIA-VIF синтезированы реакцией по следующей иллюстрации.
Иллюстрация реакции 1:


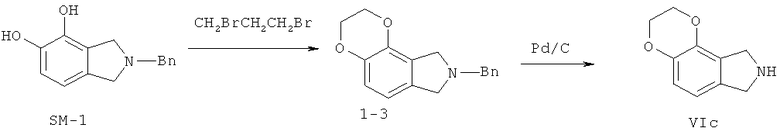
На иллюстрации реакции 1 под действием неорганических щелочей (например, гидроксид натрия, метоксид натрия или натрия), SM-1 растворяют в органических сольватах (метанол, тетрагидрофуран, N,N-диметилформамид или диметилсульфоксид), подогревают до 30-120°С, и реагируют с ClCH2Cl, ClCH2CH2Cl или BrCH2CH2CH2Br; получают пяти-, шести- или семи-членные гетероциклические продукты 1-1, 1-2 или 1-3, а затем в метаноле или этаноле-сольватах снимают защитные группы (бензил Bn) посредством каталитического освобождения водорода палладий / углерода, соответственно, получены ключевые продукты - трициклические гетероциклические Via-Vic.
Иллюстрация реакции 2:

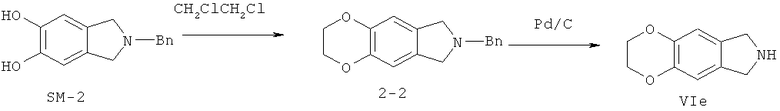
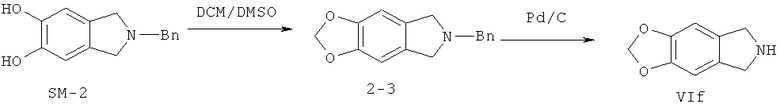
На иллюстрации реакции 2 SM-2 растворяют в органических сольватах (метанол, тетрагидрофуран, N,N-диметилформамид или диметилсульфоксид), подогревают до 30-120°С и реагируют с BrCH2CH2CH2Br, ClCH2CH2Cl или ClCH2Cl; получают семи-, шести- или пяти-членные гетероциклические продукты 2-1, 2-2 или 2-3, а затем в метаноле или этаноле-сольватах снимают защитные группы (бензил Bn) посредством каталитического освобождения водорода палладий / углерода, соответственно, получены ключевые продукты - трициклические гетероциклические VId-VIf.
На иллюстрации 3 показано, как приготовлены конкретные соединения IIIa-IIIb.
Иллюстрация реакции 3:

R11 выбрано в следующие группы SM-4a(Boc) или SM-4b:


В условиях связующего реагента CDI сырье SM-4 (например, SM-4a или SM-4b) реагирует с соединениями VIA-VIF отдельно путем связного амидирования, получают гетероциклические соединения 4a-4h и 6a-6d (IIIa-IIIb), как показано на иллюстрации структуры 1-1 и 1-2. Иллюстрация структуры 1:

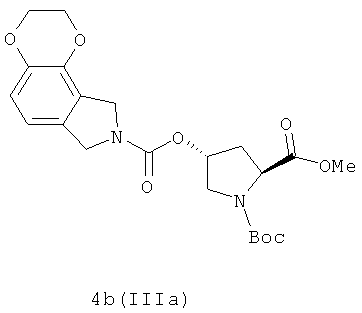




Иллюстрация структуры 1-1: структура соединения 4a-4f






Иллюстрация структуры 1-2: структура соединения 6a-6f
После того, как получены ключевые новые гетероциклические соединения 4a-4h и 6a-6d по методу на иллюстрации реакции 1-3, данное изобретение оптимизирует синтетический маршрут, как показано на иллюстрации реакций 4-11, чтобы приготовить различные новые ингибиторы гепатита С. Конкретные условия реакции и результаты анализа продукции в каждом шагу приведены в практических примерах.
Иллюстрация реакции 4:

Ha приведенной выше иллюстрации реакции 4 из синтезированных соединений на иллюстрации реакции 3 (например, 4а, 6а и 4f-6f) снята защитная группа Boc под действием HCl и получен промежуточный продукт реакции - карбонил (5), которая затем под воздействием связующего реагента HATU непосредственно реагирует с другим сырьем - аминокислотой SM-5 с защитной группой N-Boc 5 путем непосредственного амидирования; получен продукт 6. Соединение 6 реагирует в условиях LiOH-воды / метанола гидролизированное, получен продукт - карбонильная кислота (7). Продукт карбоновой кислоты (7) амидируется с другим аминометиловым эфиром или этиловым сырьем SM-6 под действием связующего реагента HATU; получен продукт 9 (например, соединения 9a-9f структуры 2-1). В безводных бескислородных органических сольватах (таких, как: дихлорметан, дихлорэтан или толуол) под воздействием катализатора метатезиса олефинов (например, изобретение, используемое в настоящем изобретении, катализатор Джейн-I или катализатор Джейн-IB) в 20-80°С диеновые соединения 9 выполняют полимеризацию метатезиса олефинов с закрытием циклов; получен продукт - макроциклические олефины 10, который затем гидрозируется метил/этиловым эфиром в водяном или метаноловом растворе щелочи LiOH; получен новый продукт - карбоновая кислота 11. В конце под воздействием связующего реагента (например: EDCI или HATU) карбонильный продукт 11 реагирует с различными веществами: сульфонамидом, циклоалкил сульфонамидом или фенил сульфонамидом (RdSO2NH2); получен ряд новых макроциклических полициклических соединений Ia-Ib (таких, как соединения 12а-12хх структуры, как показана на иллюстрации структуры 4).

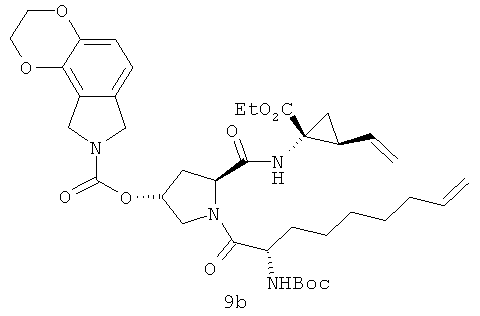

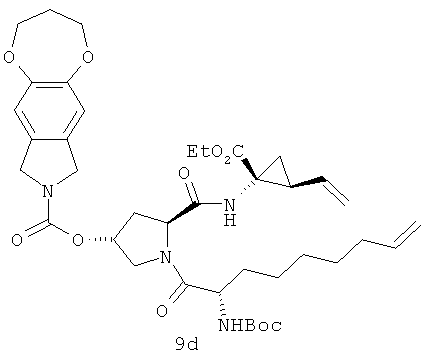
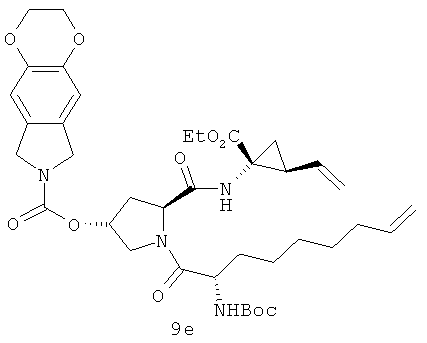

Иллюстрация структуры 2-1: структура соединений 9a-9f
Структура катализаторов Джейн, применяемых в циклизации олефинов промежуточного продукта - диеновых соединений на иллюстрации реакции 3 показана на следующей иллюстрации структуры 3:
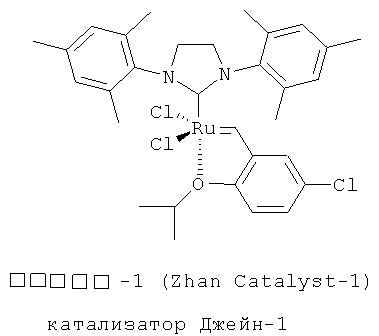
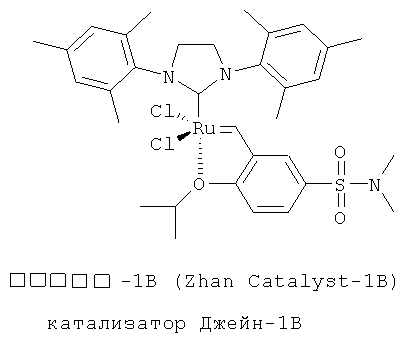
Иллюстрация структуры 3: структура катализатора Джейн-1 и Джейн-1В
Чтобы получить больше соединений для более эффективного выбора препаратов, мы оптимизировали другой синтетический маршрут, по которому можно синтезировать различные макроциклические полициклические соединения Ia-Ib более эффективно, как показано на иллюстрации реакции 5.
Иллюстрация реакции 5:
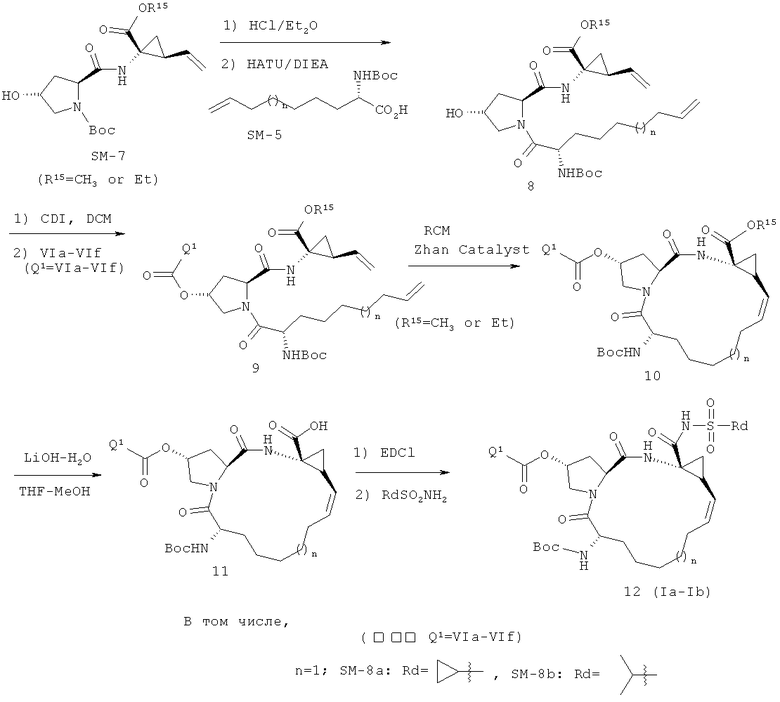
На приведенной выше иллюстрации реакции 5, из сырья SM-7 снята защитная группа Boc под воздействием HCl, а затем под воздействием связующего реагента HATU непосредственно реагирует с другим сырьем - аминокислотой SM-5 с защитной группой N-Boc 5 в безводном ограническом сольвате (например, DCM или DMF); получен продукт 8. Соединение 8 затем реагирует с соединениями VIa-VIf под воздействием связующего реагента CDI путем амидирования; получен продукт 9. В безводных бескислородных органических сольватах (таких, как: дихлорметан, дихлорэтан, или толуол) под воздействием катализатора метатезиса олефинов (например, изобретение, используемое в настоящем изобретении, катализатор Джейн-1 или катализатор Джейн-IB), в 20-80°С диеновые соединения 9 выполняют полимеризацию метатезиса олефинов с закрытием циклов; получен продукт - макроциклические олефины 10 с 14-16-тыми кольцами, а затем их гидрозируют метил/этиловым эфиром в водяном или метаноловом растворе щелочи LiOH; получен новый продукт - карбоновая кислота 11. В конце под воздействием связующего реагента (например: EDCI или HATU), карбонильный продукт 11 реагирует с различными веществами: сульфонамидом, циклоалкил сульфонамидом или фенил сульфонамидом (RdSO2NH2); получен ряд новых макроциклических полициклических соединений Ia -Ib.

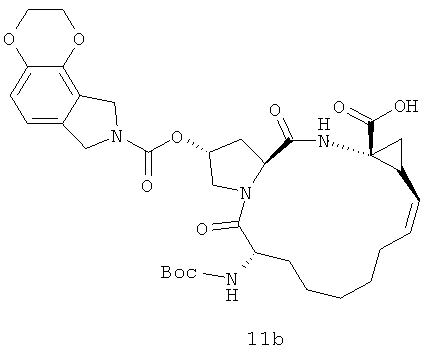

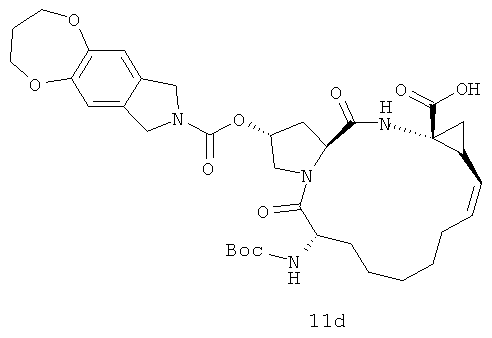


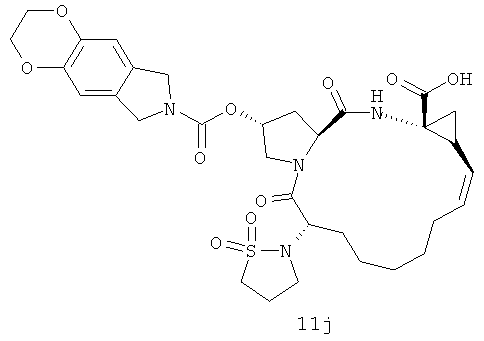

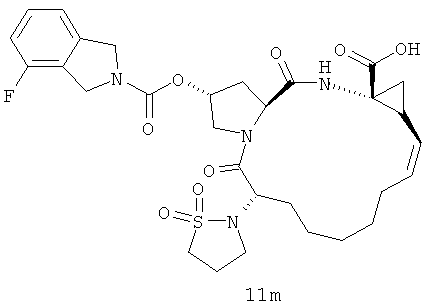
Иллюстрация структуры 4-1: структура соединения 11a-11m. Чтобы оптимизировать ингибиторский эффект и биологические характеристики нового ингибитора вируса гепатита С, на иллюстрации реакции 6-11 проектированы и синтезированы соединения с большими функциональными структурными группами. На иллюстрации реакции 6 приготовлены новые циклоалкил-сульфонамидовые соединения для сортировки лекарственного эффекта.
Иллюстрация реакции 6:
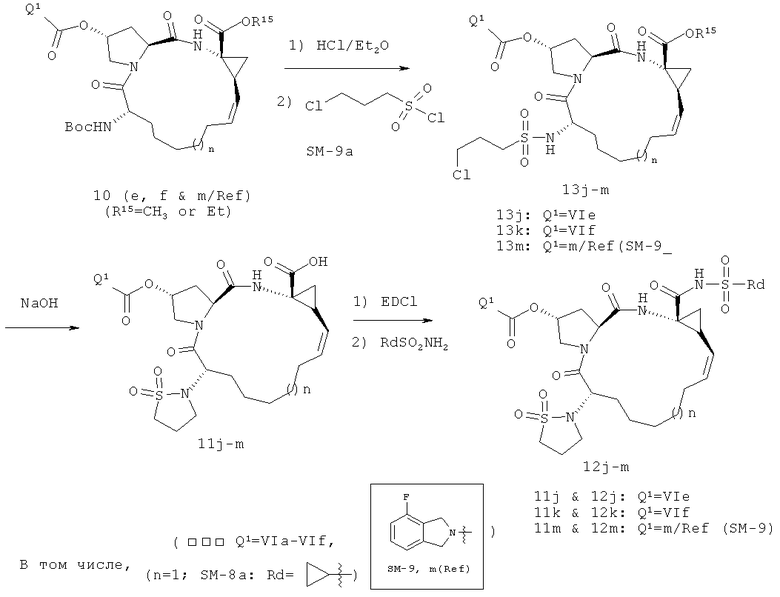
На вышеприведенной иллюстрации реакции 6 настоящее изобретение применяет в качестве промежуточных тел два конкретных соединения 10c-d продуктов цис-олефинов, полученных в иллюстрации реакции 4 и 5. Сначала снята защитная группа Boc с помощью HCl, потом реагируют с алкил-сульфонилхлоридом (RdSO2Cl или R17SO2Cl, SM-9); получено промежуточное тело алкилометиламидо 13, затем под воздействием сильной щелочи (например: NaOH или КОН) проводится внутримолекулярная циклизация; получены соединения циклосульфонамида 11; в конце под воздействием связующего реагента (например: EDCI или HATU) продукты карбоновой кислоты 11 реагируют с различными веществами: алкил-сульфонамидом, циклоалкил-сульфонамидом или фенилосульфонамидом (RdSO2NH2, SM8); получен ряд новых макро-полициклических соединений Ia-Ib (таких, как соединения 12J-12м структуры в иллюстрации структуры 5).
Кроме того, с данного соединения снимают защитную группу Boc с помощью HCl, и реагируют с алкил-сульфонилхлоридом (RdSO2Cl или R17SO2Cl, SM-9); получено промежуточное тело алкилометиламидо 13, затем под воздействием сильной щелочи (например: NaH) реагируют с реагентом R16-Cl (или R16-Br, SM-10); получены новые соединения циклосульфонамида Ia-Ib (12s-12u) в иллюстрации структуры 5, в том числе R16 - C1-С6-алкил, С3-С6 циклоалкил, C1-С6 алкокси-карбонил, С3-С6 циклалкоксикарбонил, С6-С10 арил, С6-С10 арил-карбонил, С6-С10 арилксикарбонил или С2-С10 гетероциклические группы.
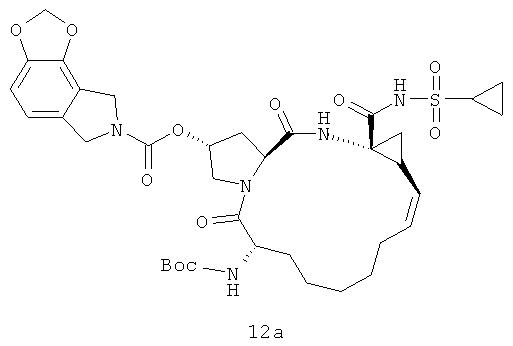

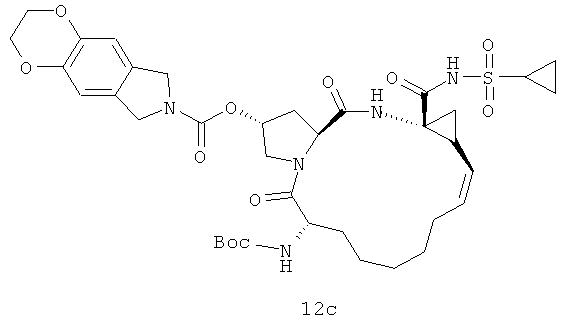

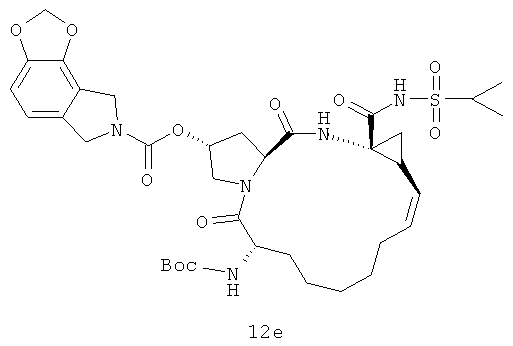
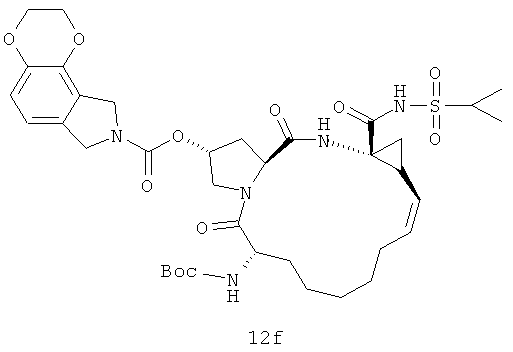

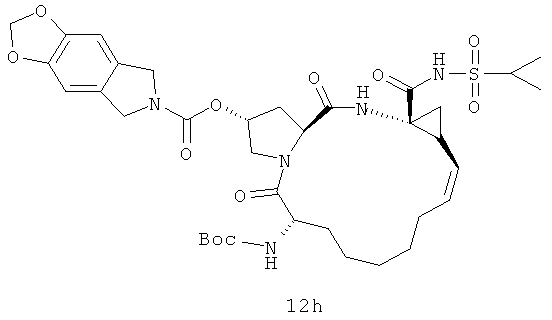
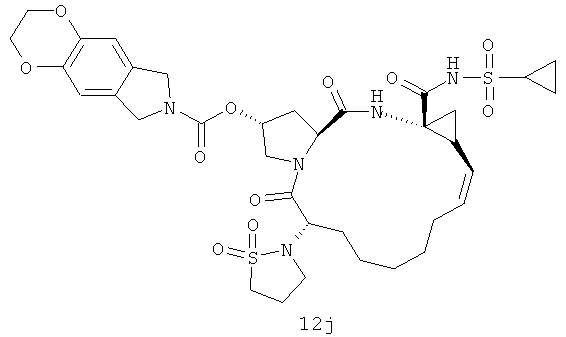
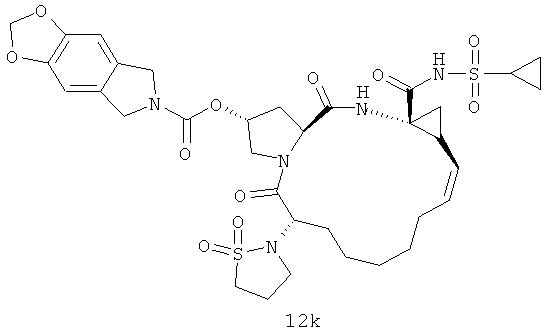
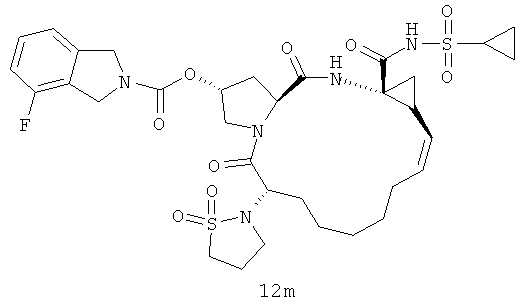

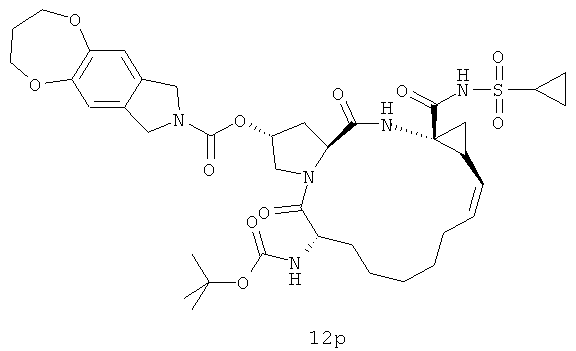
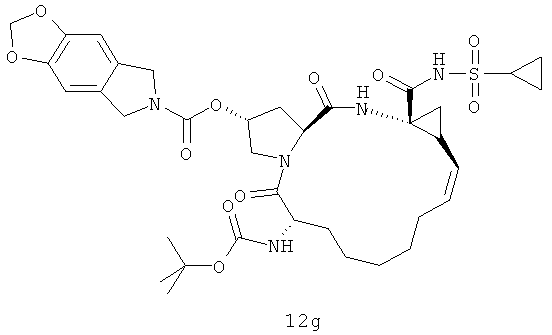
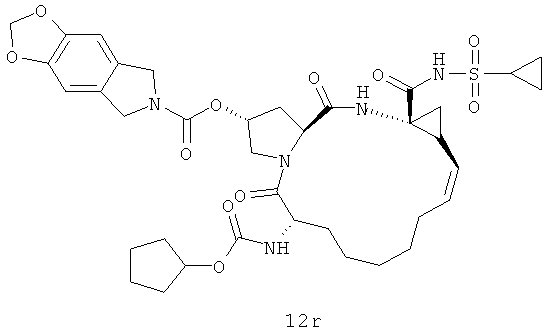
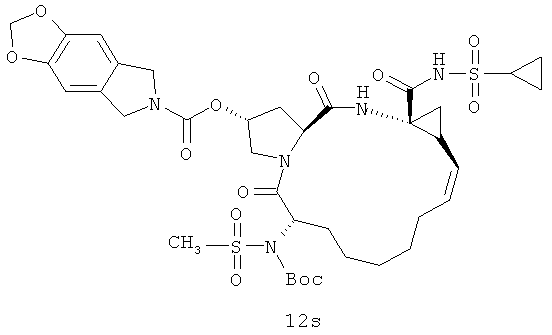
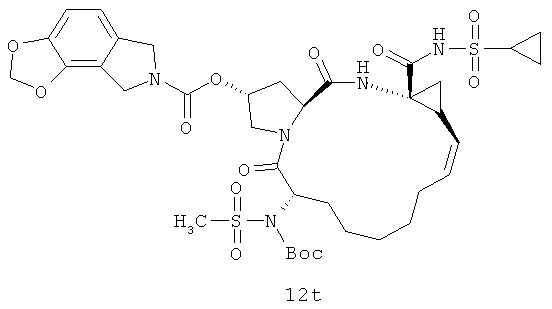

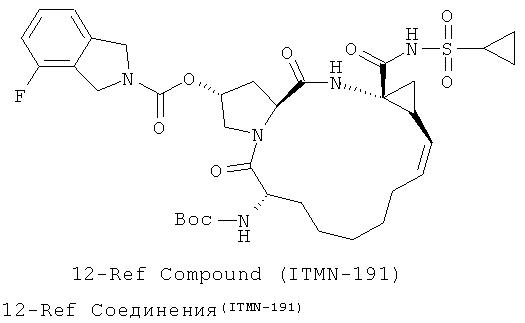
Иллюстрация структуры 5: структура соединений 12a-12u и 12-Ref
На следующей иллюстрации реакции 7, с продуктов 12 (таких как: 12а-12е и 12-Ref) сняты защитные группы Вос с помощью HCl, потом реагируют с хлорированным алкилом, бромидом или реагентами ароматических олефинов SM-10 (R16-Cl или R16-Br) путем алкилирования; получены N-алкилированные продукты 15, или реагируют с алкилхлоридом или реагентами арилохлоро-сульфонил SM-8 [R17S(O)2Cl)]; получены продукты 16 через реакцию амидирования, такие как соединения 15а-15б и 16а-16с на иллюстрации структуры 6. В том числе R16, R17, соответственно, C1-С6-алкил, С3-С6 циклоалкил, C1-С6- алкоксикарбонил, С3-С6 циклалкоксикарбонил, С6-С10 арил, С6-С10-арилокарбонил, С6-С10 арилокси-карбонил или С2-С10 гетероциклические группы.
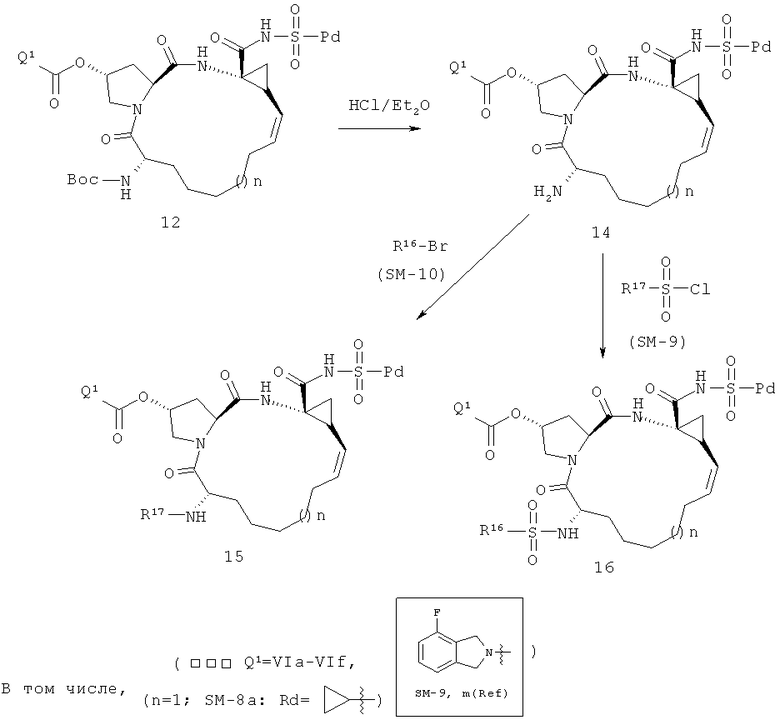
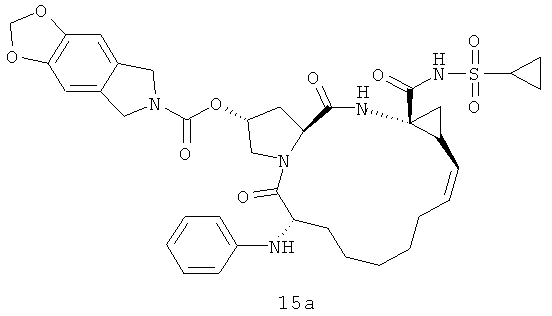

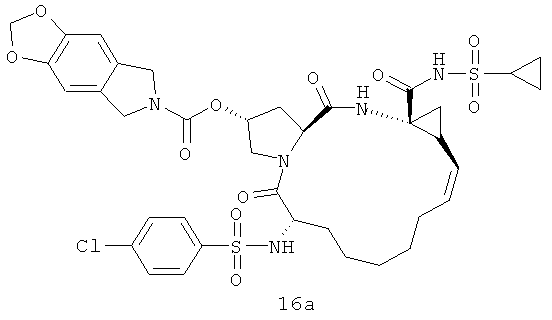

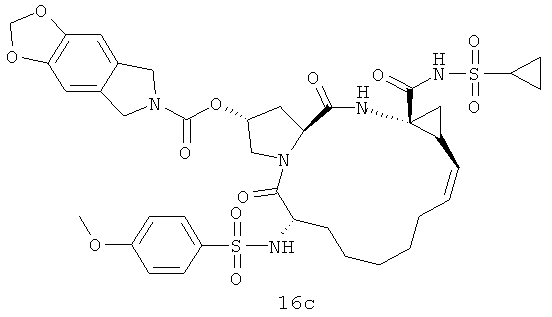
Иллюстрация структуры 6: структура соединений 15а-12b и 16а-16с
Чтобы оптимизировать эффект ингибирования ингибиторов вируса гепатита С - полициклических соединений с различных точек зрения, данное изобретение проектировало два различного маршрута синтезирования (иллюстрации реакции 8 и 9).
Иллюстрация реакции 8

На вышеуказанной иллюстрации реакции 8, карбоновое сырье SM-11 и аминовое сырье SM-11 реагируют под воздействием связующего реагента; получены амидированные продукты 17; с амидированными продуктами 17, содержащими диен, под воздействием катализатора Джейн-1В проводят метатезис олефинов циклизации; получены макроциклические продукты 18 с кольцами 14-16, затем циклоолефиновые продукты 18 с соединениями VIA-VIF под воздействием связующего реагента реагируют путем амидирования CDI; получено большинство макро-полициклических соединений 21a-21f; затем гидрируют их метило/этиловые эфиры в водяном или метаноловом растворе щелочи LiOH; получены новые карбоновые продукты 20. Наконец, под воздействием связующего реагента (например: EDCI или HATU) карбоновые продукты 20 реагируют с различными веществами: сульфонамидом, циклоалкил-сульфонамидом или фенил-сульфонамидом (RdSO2NH2); получен ряд новых макро-полициклических соединений Ia-Ib (например, соединения 21a-21j на иллюстрации структуры)).
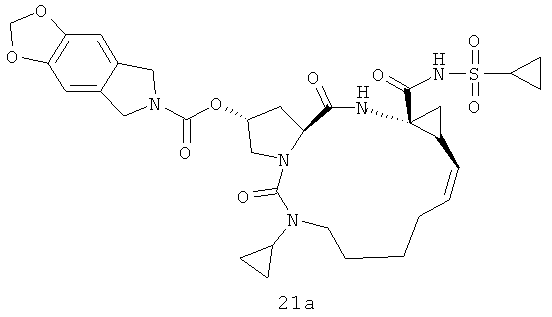
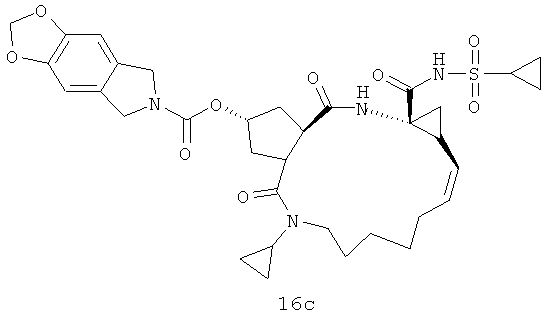



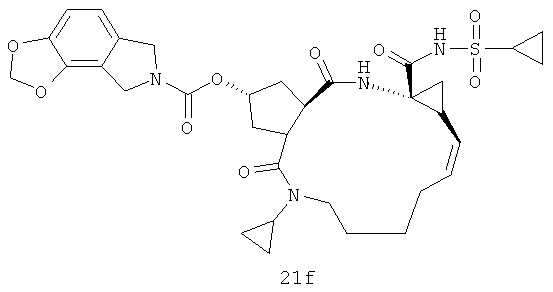
Иллюстрация структуры 7: структура соединения 21а-21j
Иллюстрация реакции 9:

На вышеуказанной иллюстрации реакции 9, сырье SM-7 и соединения VIa-VIf реагируют под воздействием CDI; получены макроциклические соединения 23a-23f; затем хлорформиат реагирует с алкиламиновым сырьем и SM-12 под воздействием реагентов нитробензола путем амидирования; получены диеновые продукты 24.
Диеновые аминовые соединения 24 выполняют полимеризацию метатезиса олефинов с закрытием циклов под воздействием катализатора Джейн-lB; получен продукт - цикло-цис-олефины 25 с 14-16-ми кольцами, а затем гидрозирует их метил/этиловый эфир в водяном или метаноловом растворе щелочи LiOH; получен новый продукт - карбоновые продукты 26. В конце под воздействием связующего реагента (например: EDCI или HATU), продукты карбоновой кислоты 20 реагируют с различными веществами: алкил-сульфонамидом, циклоалкил-сульфонамидом или фенилосульфонамидом (RdSO2NH2); получен ряд новых макро-полициклических соединений Ia-Ib (таких, как соединения 27а-27с и 27-Ref структуры в иллюстрации структуры 8).
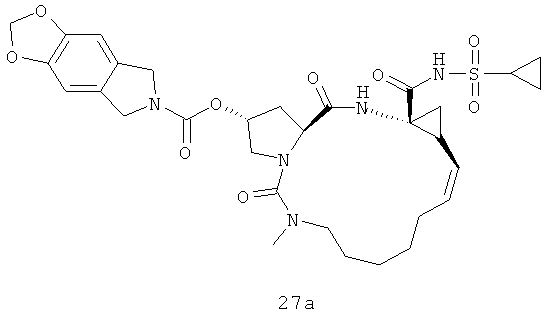

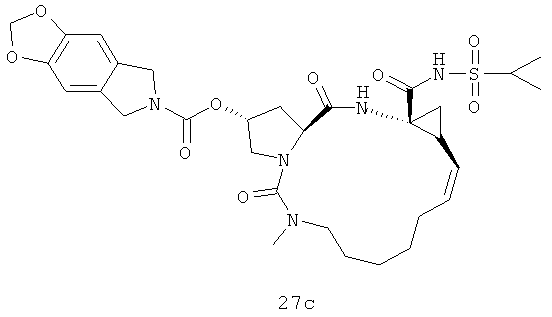


Иллюстрация структуры 8: структура соединений 27а-27с и 27-Ref
Для того, чтобы оценить разницу ингибиторских эффектов между новыми гетероциклическими ингибиторами вируса гепатита С и другой биологической активностью, данное изобретение синтезирует различные линейные соединения IIA-IIB (30 и 33) с макроциклической и структурой, (соответственно, см. Иллюстрации реакции 10 и 11).
Иллюстрация реакции 10:
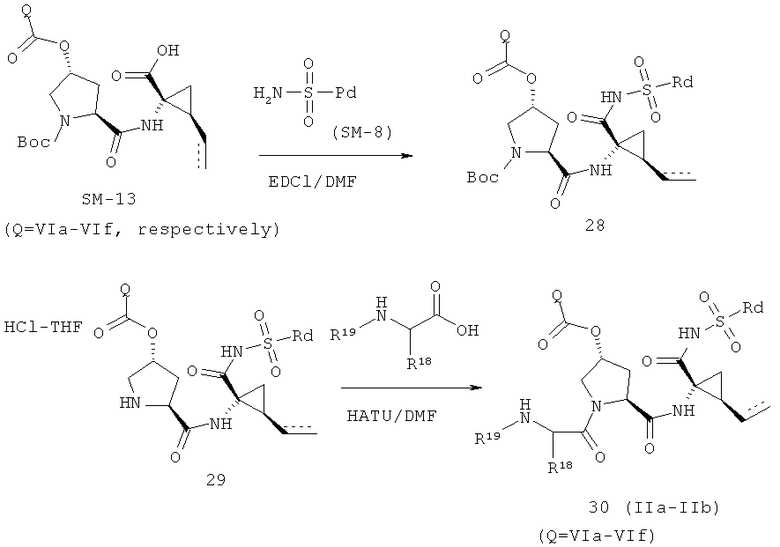
На вышеуказанной иллюстрации 10 реагируют аминовое сырье SM-13 и сульфонамидовые материалы SM-8 [RdS(O)2NH2]; получены продукты 28 реакции, а затем снимают защитные группы Boc для получения продукта 29. Наконец, под воздействием связующего реагента (например: EDCI или HATU) промежуточные амины 29 с различными производными аминокислот SM-14 (например, химические реагенты в иллюстрации структуры 9) реагируют; получены следующие различные типы продуктов IIa-IIb (30а-30ar), в том числе, Rd R18- С1-С6 алкил или С3-С6 циклоалкил, R19 - С1-С20-алкил, C1-C20 алкилокарбонил, C1-C20 алкоксикарбонил или C1-C20 алкил-сульфониламидо.
(

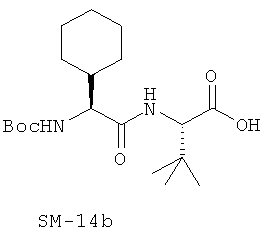
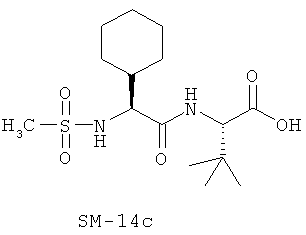




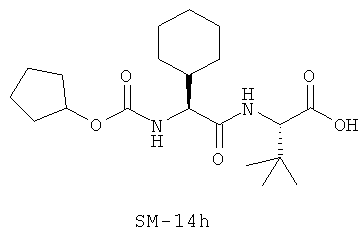

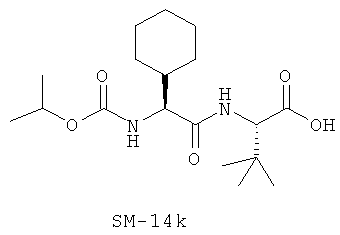


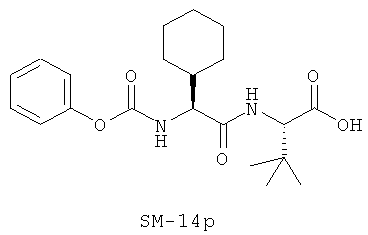


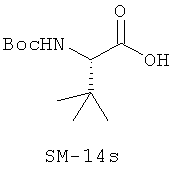

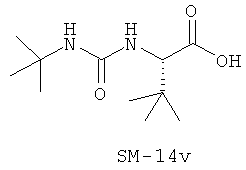
Иллюстрация структуры 9: соединения Аминокислоты (SM-14a-SM-14v)


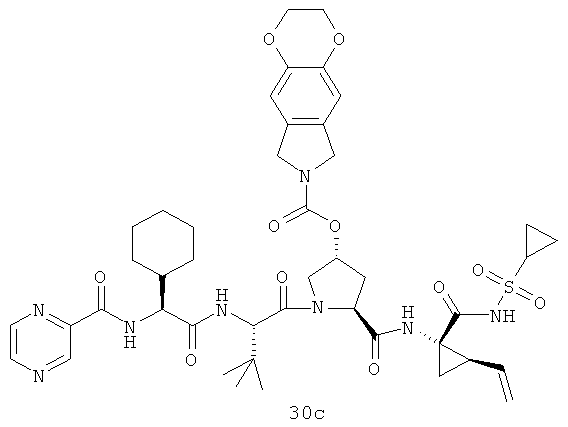


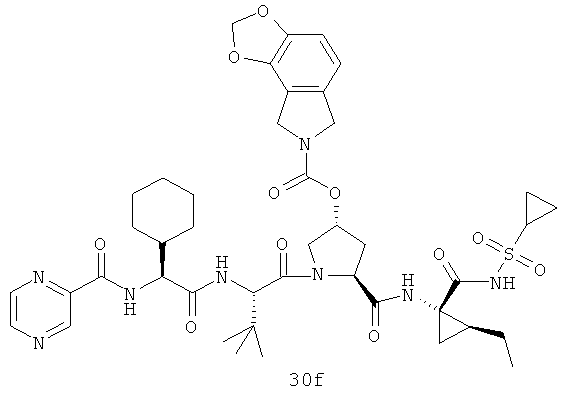



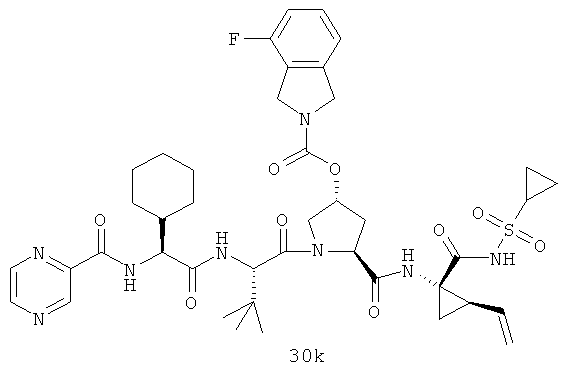

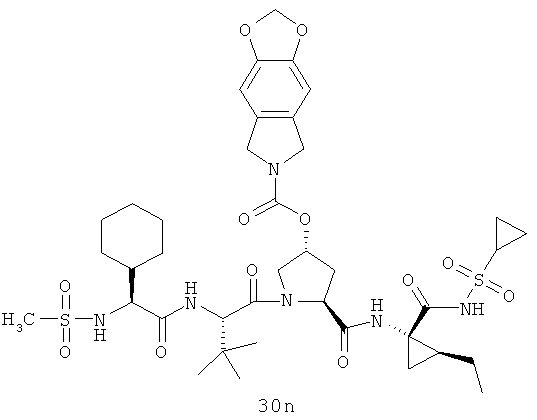

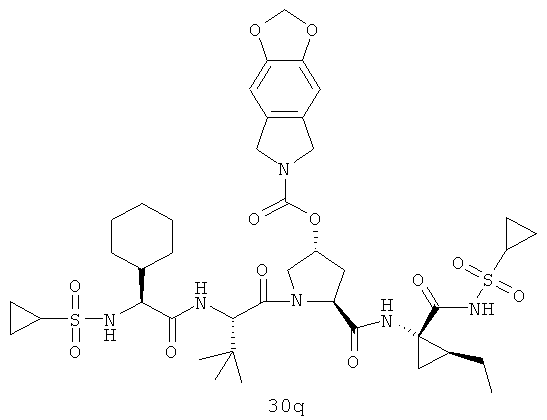


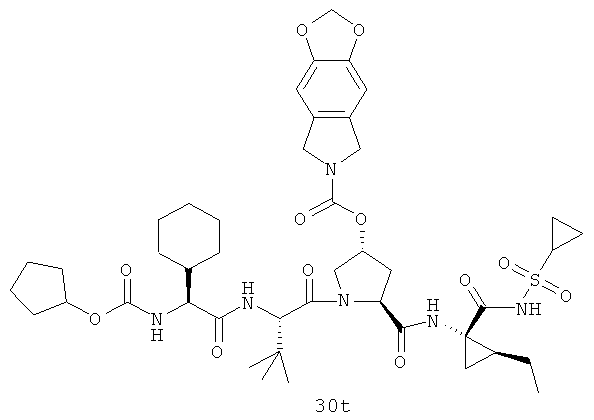




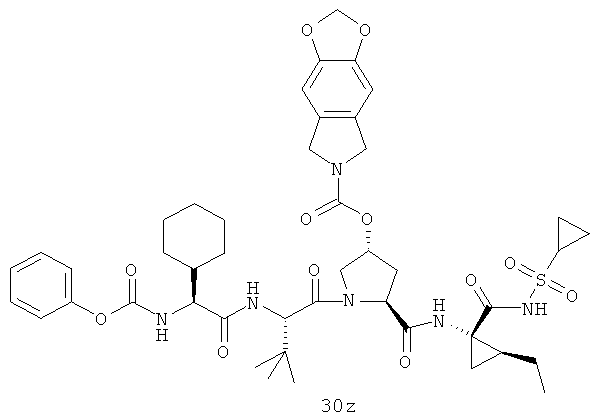
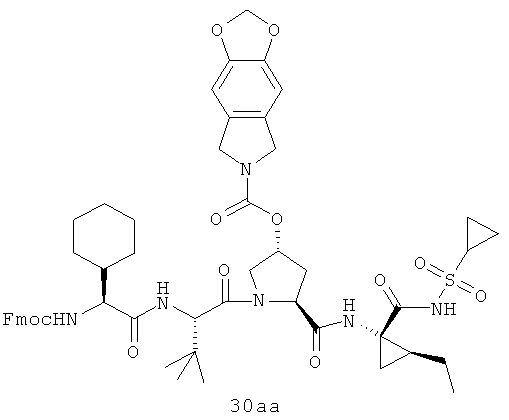
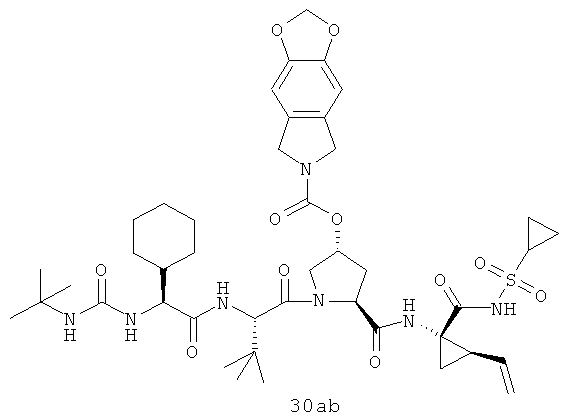

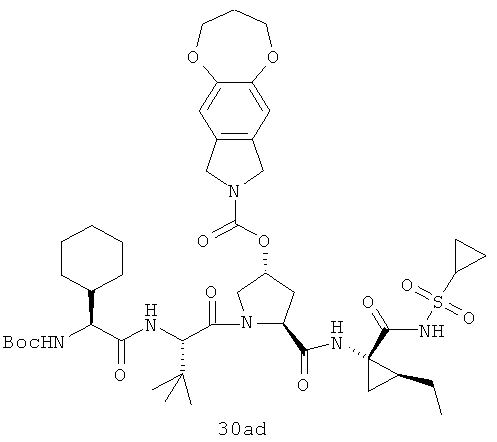


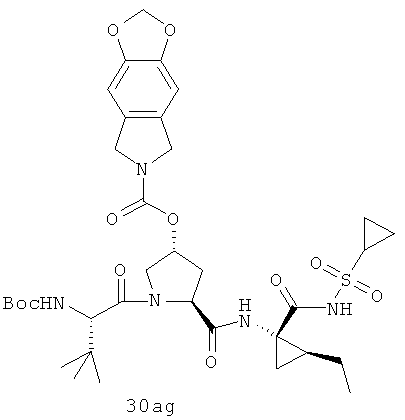

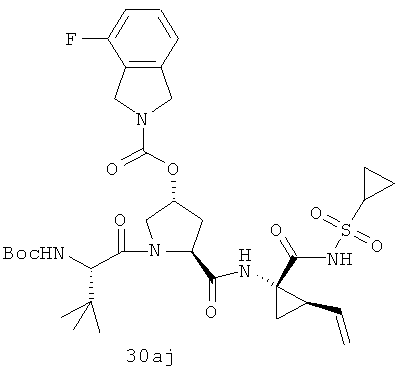


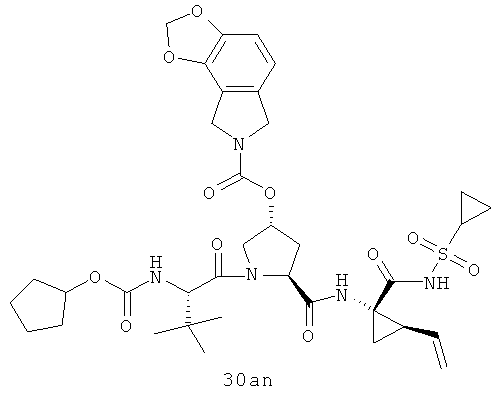
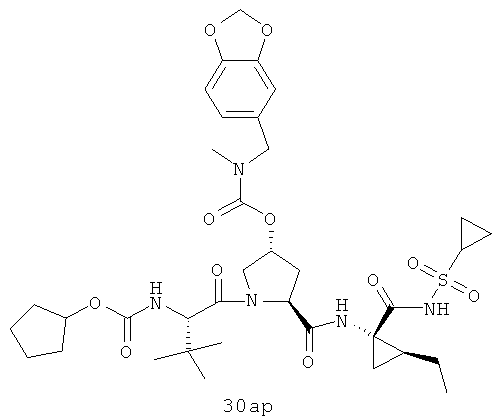
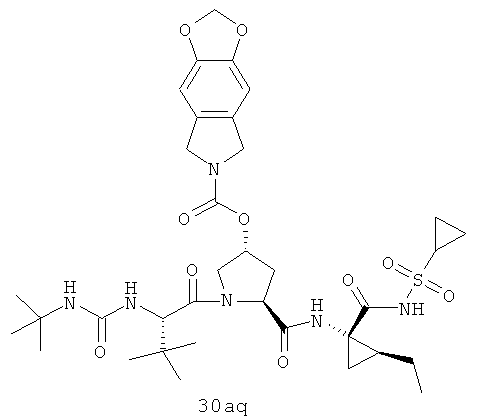


Иллюстрация структуры 10: структура соединений 30а-30ar и 30-Ref
Иллюстрация реакции 11:
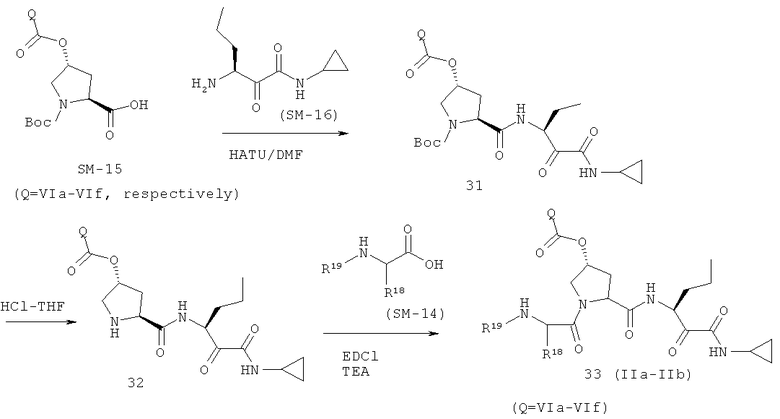
На вышеуказанной иллюстрации 11 реагируют аминовое сырье SM-13 и сульфонамидовые материалы SM-8 [RdS(O)2NH2]; получены продукты реакции 28, а затем снимают защитные группы Boc для получения продукта 29. Наконец, под воздействием связующего реагента (например: EDCI или HATU) промежуточные амины 29 с различными производными аминокислот SM-14 (например, химические реагенты в иллюстрации структуры 9) реагируют; получены следующие различные типы продуктов IIa-IIb (30а-30ar), в том числе, Rd и R18- С1-С6 алкил или С3-С6 циклоалкил, R19 - С1-С20-алкил, C1-C20 алкилокарбонил, C1-C20 алкоксикарбонил или C1-С20 алкил-сульфониламид.
На вышеуказанной иллюстрации 11 реагируют под воздействием связующего реагента HATU карбонильное сырье SM-15 и аминовое сырье SM-16 в сольвате DMF; получены амидированные продукты 31 реакции, а затем снимают защитные группы Boc в растворе HCl-THF для получения продукта 32. Наконец, под воздействием связующего реагента (например: EDCI или HATU), амидированные продукты 32 с различными производными карбонильной кислот SM-14 реагируют; получены следующие различные типы макро-циклических линейных продуктов IIa-IIb (соединения 33a-33d на иллюстрации структуры 11), в том числе, R20 и R21 представляет собой водород, C1-С6 алкил или С3-С6 циклоалкил, R22 - C1-С6-алкил, С3-С6 циклоалкил, C1-С6 алкил сульфонамид или С3-С6 циклоалкил сульфонамид.
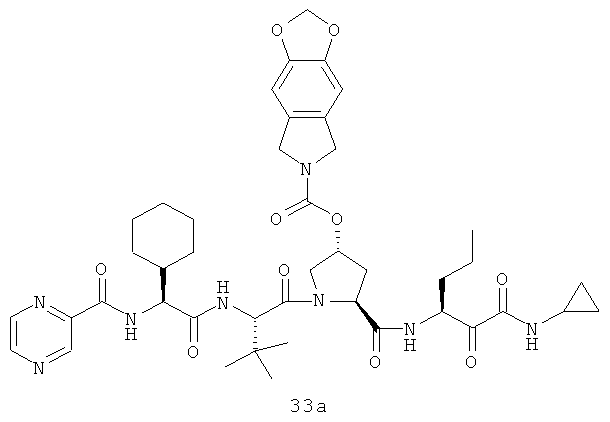


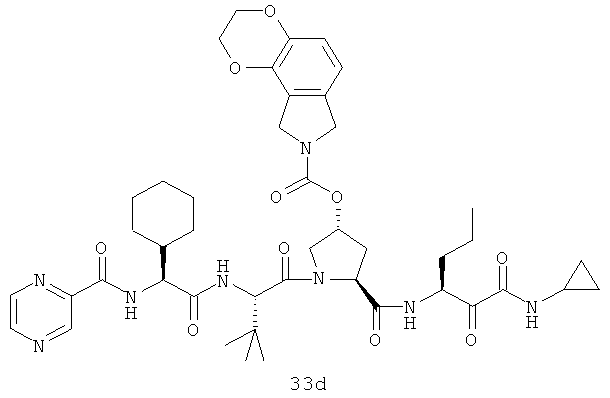
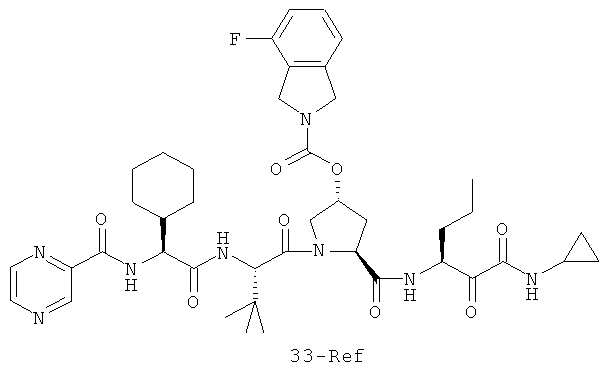
Иллюстрация структуры 11: структура соединений 33a-33d и 33-Ref
По вышеуказанным оптимизированным синтетическим маршрутам на иллюстрациях или в другой литературе, выбирая различные виды сырья, может быть синтезировано больше полициклических соединений. Методы приготовления на иллюстрациях синтезирования 1-11 могут быть дополнены конкретными шагами синтезирования, добавлением или удалением соответствующих защитных группа перед или за конкретными шагами синтезирования для того, что в конечном итоге позволит синтезировать продукты в рамках патента. Кроме того, путем изменения порядка синтетических шагов можно получать ожидаемые продукты.
В процессе синтезирования соединений, упомянутых в настоящем изобретении, преобразование химического синтезирования и методы разработки защитной группы (защита и снятия защиты) сыграли большую роль, что отражено в публикациях, в том числе, R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989)T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd Ed., John Wiley and Sons (1991) L. Fieser and M. Fieser, Fieser andFieser's Reagents for Organic Synthesis, John Wiley and Sons (1994) L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и последующие версии.
Указанные этим изобретением соединения могут содержать неароматические двойные связи, один или несколько асимметричных центров. Таким образом, они могут генерировать в рацемические и внешне-рацемические смеси, отдельные энантиомеры, отдельные изомеры, смесь асимметрических энантиомеров, энантиомер, цис- и транс-изомеры, гидрат и т.д. Все эти изомеры должны быть рассмотрены.
До сих пор нет достойной модели для оценки эффективности новых соединений, которые ученые синтезировали для ингибирования NS3 протеазы вируса гепатита С. Указанные в изобретении соединения после первоначальной проверки, в соответствии с экспериментальными результатами IC50/ЕС50 в лечении вирусного гепатита С в пробирке / в телах, использованы для оценки активности и эффективности. До клинических испытаний в процессе разработки новых лекарств нашли некоторые очень эффективные ингибиторы вируса гепатита С для исследования РК и токсичности. Ученые-фармацевты также применяют некоторые другие методы.
Эксперимент протеазы NS3-4A Hcv в пробирке: Эксперимент проводится в присутствии буферного раствора А из 30 mM NaCl, 5 mM CaCl2, 10 mM DTT, 50 mM Tris (pH 7.8), применяя Флуоресцентные пептиды Ac-Asp-Glu-Asp(EDANS)-Glu-Glu-Abu-ψ-[COO]-Ala-Ser-Lys (DABCYL)-NH2 (FRET-S)-Ala-Ser-Lys (DABCYL)-NH 2 (FRET-S) (AnaSpec, США) в качестве люминесцентных флуоресцентных пептидов.
Кратко, 140 µL буфер-раствора A, 20 µL соединений различных концентраций, подготовленных в буфер-растворах, и 20 µL протеазы NS3-4A вируса гепатита С, разбавленной буферным раствором, добавляли в 96 ячеек, хорошо перемешивали. Добавили 20 мкл FRET-S, и реакция началась. Использовав возбуждающий и излучающий фильтр 355 nm и 520 nm, проводился мониторинг реакции посредством BMG Polarstar Galaxy (MTX Lab Systems, Inc. USA) при 37°С. Расчет 50% ингибирующей концентрации (IC 50) проводился на основе метода Reed & Muench.
Противовирусный эксперимент: антивирусный эксперимент проводился в 96-ячеечном планшете с лученепроникающей стенкой и прозрачным днищем, плотность клетки люциферазы репликона Renil в 7×103 клеток/лунку в 100 мкл полной DMEM прививка культуры средних и антибиотиков. Восемь соединений, разбавленных в 2 раза в полной среде DMEM, были добавлены в соответствующие отверстия в конечной концентрации 200 мкл полной культуральной среды DMEM. Ответ получили через три дня, добавив в отверстие 100 мкл свежей среды (содержащей EnduRen™ живые подложки клетки, Promega производства) в конечной концентрации 60 мкм, при температуре в инкубаторе 37°С и концентрация углекислого газа тело культивировали в 5% от темной системы. Затем с помощью микропланшета En Vision (произведенный компанией Perkin Elmer) измеряли световое излучение, и контролировали по стандартизации проценты, проводили расчет 50% эффективной концентрации (ЕС50) с помощью метода Reed-Muench.
Исследование острой токсичности (MTD): Материалы и методы MTD включают: животные: 320 км мышей, номер сертификата: 2007000510144, самки и самцы - пополам, 40 крыс Wistar, номер сертификата: 2007000510555, самки и самцы - пополам. Животные были приобретены у ООО подопытных животных SLAC. Корма: излученные корма, особенно для крыс и мышей, приобретенных в ООО подопытных животных SLAC.
Экспериментальные группы: экспериментальные животные питаются более одной недели свободно для адаптации к системе. Здоровые крысы массой 170-190 г были случайным образом разделены на три группы, каждая группа из пяти самок и пяти самцов. Здоровые мыши массой 18-20 г были случайным образом разделены на 22 группы, каждая группа из пяти самок и пяти самцов.
Экспериментальный подход: в экспериментах крыс, количество дозирования - 21,00 грамма, серийный номер каждой группы - 1-3, соответственно, добавляли в препарат 30,00 г 0,7% раствора натриевой карбоксиметилцеллюлозы и смешивали высокоскоростным гомогенизатором 15000 rpm 10 минут. Во время кормления крыс каждый раз перорально вводили 10000 mg/кг. В экспериментах мышей, количество дозирования - 2,00 грамма, серийные номера каждой группы последовательности, соответственно, 4-25, в препараты добавляли 8,00 г 0,7% раствора натриевой карбоксиметилцеллюлозы и смешивали высокоскоростным гомогенизатором 15000 rpm 10 минут. Во время кормления мышей каждый раз вводили перорально 10000 mg/кг.
Клиническое наблюдение: в первый день после приема препарата животными наблюдают через каждый час, и в течение недели наблюдают за их поведением каждый день. Проводят осмор трупов умерших животных, наблюдают валовую патологию органов и ведут записи.
Оценка токсичности: оценку токсичности соединений определяют на основе коэффициента смертности животных, клинических проявлений и других признаков.
Конкретные полициклические соединения 11А-11Р, 12A-12u, 15A-15B, 16А-16С, 30A-30ar, 33A-33D и справочные соединение 12-Ref, 21-Ref, 27-Ref, результаты истытания ингибировочной активности вируса протеазы вируса гепатита С (протеаза NS3-4A вируса гепатита С) приведены в таблице 1, диапазон активности (IC50):≥200 нм с пометкой "А", активности в диапазоне 30-200 нм - "В", диапазон ≤30 нм - "С".
Результаты эксперимента активности новых макро-полициклических соединений, как ингибиторов NS3 протеазы вирусов гепатита С
Результаты в таблице 1 показывают, что: (1) в настоящем изобретении новые макро-полициклические соединения, содержащие циклопропил-сульфонамид и изопропиловый сульфонамид (например, 12a-12U), имеют лучшую активность для ингибирования вирусов гепатита С, чем карбонильные полициклические соединения, не содержащие циклопропил сульфонамид и изопропиловый метил-карбонамид (например, 11а-11м); (2) большинство макро-полициклических соединений Ia-Ib (например, 12a-12U) имеет более высокую эффективность и биологическую активность, чем линейные полициклические соединения IIa, IIb (например, 30а-30ar и 33a-33d); (3) новые типы сульфонамидовых макро-полициклических соединений Ia-Ib (например, 12a-12d, 12q-12U) являются ингибиторами вируса гепатиа C с хорошей активностью (ЕС50: 0.001-1.0 uM). Многие новые полициклические соединения обладают хорошей биологической активностью), ингибиторская активность вируса гепатита С уже достигла того же уровня во второй и третьей клинической фазе ингибиторов вируса гепатита С, как сообщили за рубежом, например, InterMune (ITMN-191, 12Ref)-Rocheu Merck МК-7009).
В целом, в данном патенте оценена активность и лечебная эффективность новых макро-полициклических соединений как в пробирке, так и в естественных условиях, и обнаружено высокое ингибирование вирусов гепатита С двумя новыми полициклическими соединениями; это предоставляет ценную зацепку для разработки ингибиторов вирусов гепатита С на основе действующих новых полициклических соединений Ia-Ib и IIa-IIb.
Далее приведены аббревиатуры и комментарии связанного химического сырья, реагентов и сольватов в практических примерах в рамках данного изобретения:
SM4: (Н-Вос-транс-4-гидрокси-L-пролина, метиловый эфир)
(N-Boc-trans-4-hydroxy-L-proline methyl ester)
SM5: Вос-L-2-амино-8-Азелаиновая кислота
(Boc-L-2-amino-8-azelaic acid)
SM6: ((1R,2S)-1-амино-2-метил-циклопропил- винил
((1R,2S)-1-amino-2-cyclopropyl methyl vinyl)
AIBN: азобисизобутиронитрила(azobisisobutyronitrile)
(Boc)2O: ди-трет-бутил-карбонат (di-tert-butyl carbonate)
CDI: Н,Н'-карбонилдиимидазол имидазол(N,N'-carbonyldiimidazole imidazole)
DBU: 1,8-Диазабицикло[5,4,0]ундец-7-ен)
(l,8-Diazabicyclo[5.4.0]undec-7-ene)
EDCI: Н-этил-N-(3-диметил-аминопропил) карбодиимида гидрохлорида
(N-ethyl-N-(3-dimethyl aminopropyi) carbodiimide hydrochloride)
HATU: (2-(7-бензотриазол азо)-N,N,N',N'-тетраметил мочевины фосфат гексафторида)
(2-(7-benzotriazole azo)-N,N,N',N'-tetramethyl urea phosphate hexafluoride)
NBS: N-бромсукцинимид(N-bromosuccinimide)
DMAP: 4-диметиламинопиридина(4-dimethylammopyridme)
DIEA: N,N-диизопропил этиламин(N,N-diisopropyl ethylamine)
SOCl2: тионил-хлорид (thionyl chloride)
Pd/C: Палладий углерода(Palladium carbon)
НМТА: гексаметилентетрамин(hexamethylene tetramine)
HOAc: уксусная кислота(acetic acid)
HBr: бромистоводородная кислота(Hydrobromic acid)
HCl: соляная кислота
TFA: трифторуксусная кислота(trifluoroacetic acid)
TsOH: Р-толуолсульфокислота
NaOH: едкий натрий
ACN: Ацетонитрил(acetonitrile)
DCM: дихлорметан(dichloromethane)
DCE: дихлорэтан(dichloroethane)
DMF: N,N-диметилформамид(N,N-dimethylformamide)
DMSO: иметилсульфоксид(dimethyl sulfoxide)
Et2O: диэтиловый эфир(diethyl ether)
EA: этилацетат(ethyl acetate)
РЕ: петролейный эфир(petroleum ether)
THF: тетрагидрофуран(tetrahydrofuran)
TBME: трет-бутиловый эфир(tert-butyl methyl ether)
Практический пример
Описание приборов и сырья:
Данные инфракрасного спектра получены при помощи анализирующего инфракрасного прибора Fourier Transform AVATAR™ 360 E.S.P™ ООО "Thermo Nicolet" (единица: см-1).
Спектр водорода ядерного магнитного резонанса получен при помощи ядерного магнитного анализатора с усиленением переменной ртути Varian Mercury Plus 400 (400 MHz). Химический сдвиг записан внутренней нормализацией тетраметилбензохинона. Единицей ррм показывают (CHCl3:δ=7.26 ppm). Записывают следующие данные: химический сдвиг, расщепление (s: моновершина; d: двойная вершина; t: тройная вершина; q: учетверенная вершина; br: широкая вершина; m: многочисленная вершина; константа связи (Hz), интеграл и распределение.
Спектр 19F и 31P ядерного магнитного резонанса получен при помощи анализаторов ядерного магнитного резонанса Varian Mercury Plus 400 (400 MHz) и Gemini-2000 (300 MHz). Химический сдвиг спектра 19F ядерного магнитного резонанса записан внутренней нормализацией трифторуксусной кислоты (CF3CO2H: 0.00 ppm). Химический сдвиг спектра 31Р ядерного магнитного резонанса записан внутренней маркировкой фосфокислоты (H3PO4:0.00 ppm).
Данные масс-спектров проанализированы с помощью прибора жидкофазного хроматографического спускного применения с масс-спектром Thermo Finnigan LCQ Advantage. Все реакции проведены при безводном и бескислородном условии под защитой сухого аргона. Тетрагидрофуран и эфир получены путем добавления натрия и дистиллированием. Дихлорметан, пентан и гексан получены путем добавления гидрида кальция и дистиллированием. Большинство соединений, связанных с настоящим изобретением, куплено или изготовлено под заказ в ООО "Цзаньнань", Шанхай. Обычные методы синтезирования различных гетероциклических промежуточных продуктов (Ia-Ib и IIa-IIb) подробно описаны в дальнейшем.
Пример 1. Синтезирование соединений VIa.
Сырье SM-1 (12.2 g, 0.5 mol) и 100 мл L DCM смешивали в реакционной колбе объемом 250 мл, затем добавляли NaOH (5g) и DMSO (50 mL) и подогревали до 100°С для реакции. После окончания реакции реакционный раствор наливали в ледовую воду и экстрагировали три раза с помощью DCM. Объединяли экстракцию и промывали насыщенной солевой водой, сушили и концентрировали, быстро очищали колоночной хроматографией; после реакции получен продукт - 1-1 (7.7g), коэффициент выхода - 61%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 253.1, фактически измеренное значение - 253.2.
Растворяли продукт 1-1 (5.0g, 0.2mol) в этаноле, добавляли катализатор Pd/C (0.5g) под давлением гидрирования (0.6 МРа). После окончания реакции профильтровали смесь, промывали этанолом, фильтровали, концентрировали до сырого продукта 3.0g, быстро очищали колоночной хроматографией; получен окончательный продукт Via (2.5g) с чистотой более 99%, коэффициент выхода - 76%. Общий выход двух реакции - 46%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.71 (s, 2H), 5.91 (s, 2Н), 4.20 (s, 2H), 4.15 (s, 2H), 2.22 (s, 1H, NH) продукта VIa показал, что теоретическое значение ESI-MS (M+H+): m/z - 164.1, фактически измеренное значение - 164.2.
Пример 2. Синтезирование соединений VIb.
Сырье SM-1 (12.2g, 0.5mol) и 100 мл LDCM смешивали в реакционной колбе объемом 250 мл, затем добавляли NaOH (5g) и DMSO (50 mL) и подогревали до 100°С для реакции. После окончания реакции наливали реакционный раствор в ледовую воду, перемешивали после добавления DCM для расслоения, экстрагировали два раза с помощью DCM. Объединяли органическую фазу и промывали насыщенной солевой водой, сушили и концентрировали, очищали колоночной хроматографией; после реакции получен продукт - 1-2 (9.4 g), коэффициент выхода - 71%. Масс-спектральный анализ продукта 1-2 показал, что теоретическое значение ESI-MS (M+H+): m/z - 268.1, фактически измеренное значение - 268.2.
Растворяли продукт 2-1 (5.0 g) в этаноле, добавляли катализатор Pd/C (0.5 g) под давлением гидрирования (0.6 МРа). После окончания реакции профильтровали смесь и промывали этанолом, фильтровали, концентрировали до 3.0 g, быстро очищали колоночной хроматографией; получен окончательный продукт VIb (2.9 g). Общий выход двух реакций - 61%.
После контроля масс-спектральный анализ 'H-NMR (CDCIs, 500MHz): S 6.77-6.75 (d, J=8.0 Hz, 1H), 6.72-6.70 (d, J=8.0 Hz, 1H), 4.29-4.28 (m, 2H), 4.27-4.26 (m, 2H), 4.19 (s, 2H), 4.17 (s, 2H), 2.27 (s, 1H, NH) продукта VIb показал, что
теоретическое значение ESI-MS (M+H4"): m/z - 178.1, фактически измеренное
значение- 178.2.
Пример 3. Синтезирование соединений Vie.
Добавляли сырье SM-1 (12.2 g, 0.5 mol) и 1,3-дибромпропан (20 мл) в реакционную колбу объемом 250 мл, затем добавляли NaOH (5 g) и DMSO (50 mL) и подогревали до 100°С для реакции. Условия реакции и приготовления такие же, как в примере 2. После реакции и ректификации получен продукт VIc, общий выход двух реакции - 47%.
После контроля масс-спектральный анализ 1H-NMR(CDCl3, 500 MHz): δ 10.09 (s, 2H), 6.96-6.94 (d, J=8.0 Hz, 1H), 6.92-6.90 (d, J=7.5 Hz, 1H), 4.40-4.39 (m, 4H), 4.20-4.17 (t, J=5.0 Hz, 2H), 4.13-4.11 (t, J=5.0 Hz, 2H), 2.19-2.09 (m, 2H) продукта VIc показал, что теоретическое значение ESI-MS (М+Н+): m/z - 192.1, фактически измеренное значение - 192.1.
Пример 4. Синтезирование соединений VId.
Добавляли сырье SM-2 (12.2 g, 0.5 mol) и 1,3-дибромпропан (20 мл) в реакционную колбу объемом 250 мл, затем добавляли NaOH (5 g) и DMSO (50 mL) и подогревали до 100°С для реакции. Условия реакции и приготовления такие же, как в примере 2. После реакции и ректификации получен продукт VId, общий выход двух реакции - 41%.
После контроля масс-спектральный анализ 'H-NMR (CDCl3, 500 MHz): δ 6.86 (s, 2Н), 4.30 (brs, 1H), 4.20 (s, 4H), 4.15-4.17 (t, J=5.8 Hz, 4H), 2.16-2.18 (m, 2H) продукта VId показал, что теоретическое значение ESI-MS (М+Н+): m/z - 192.1, фактически измеренное значение - 192.1.
Пример 5.Синтезирование соединений Vie.
Добавляли сырье SM-2 (12.2 g, 0.5 mol) и 30 mL DCE в реакционную колбу объемом 250 мл, затем добавляли NaOH (5 g) и DMSO (50 mL) и подогревали до 100°С для реакции. Условия реакции и приготовления такие же, как в примере 2. После реакции и ректификации получен продукт VIe, общий выход двух реакций - 56%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.74 (s, 2H), 4.23 (s, 4H), 4.13 (s, 4H) продукта VIe показал, что теоретическое значение ESI-MS (М+Н+): m/z - 178.1, фактически измеренное значение - 178.2.
Пример 6. Синтезирование соединений VIf.
Добавляли сырье SM-2 (12.2 g, 0.5 mol) и 100 mL DCE в реакционную колбу объемом 250 мл, затем добавляли NaOH (5 g) и DMSO (50 mL) и подогревали до 100°С для реакции. Условия реакции и приготовления такие же, как в примере 1. После реакции и ректификации получен продукт VIf, общий выход двух реакций - 51%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.69 (s, 2H), 5.95 (s, 2H), 4.14 (s, 4H) продукта VIf показал, что теоретическое значение ESI-MS (М+Н+): m/z - 164.1, фактически измеренное значение - 164.2.
Пример 7. Синтезирование соединений 4а.
Растворяли сырье SM-4 (5.37 g, 21.9 mmol) и CDI (14.2 g, 87.5 mmol, 4 eq.) в безводном дихлорметане 100 мл, и проводится реакция при комнатной температуре в течение суток. Добавляли другое соединение Via (43.7 mmol, 2 eq.), перемешивали при комнатной температуре, и полностью окончена реакция. После реакции и ректификации колоночной хроматографией получен продукт 4а (5.2 g), выход -71%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.78-6.80 (m, 1H), 6.69-6.75 (m, 1H), 6.00 (s, 2H), 5.34 (m, 1H), 4.67-4.70 (d, J=13.5 Hz, 2H), 4.60-4.63 (d, J=15 Hz, 2H), 4.40-4.48 (m, 1H), 3.66-3.78 (m, 5H), 2.48 (m, 1H), 2.24-2.26 (m, 1H), 1.48 (s, 4H), 1.45 (s, 5H) продукта 4а показал, что теоретическое значение ESI-MS (M+H+): m/z - 435.2, фактически измеренное значение - 435.3.
Пример 8. Синтезирование соединений 4b.
Растворяли сырье SM-4 (5.37 g, 21.9 mmol) и CDI (14.2 g, 87.5 mmol, 4 eq.) в безводном дихлорметане 100 мл, и проводится реакция при комнатной температуре сутки. Добавляли другое соединение VIb (43.7 mmol, 2 eq.), перемешивали при комнатной температуре, и полностью окончена рекация. После реакции и ректификации колоночной хроматографией получен продукт 4b (6.1 g), выход - 82%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.81-6.84 (m, 1H), 6.68-6.75 (m, 1H), 5.33 (m, 1H), 4.67 (s, 2H), 4.60 (s, 2H), 4.39-4.48 (m, 1H), 4.30 (m, 2H), 4.28 (m, 2H), 3.63-3.79 (m, 5H), 2.47-2.49 (m, 1H), 2.22-2.26 (m, 1H), 1.48 (s, 4H), 1.45 (s, 5H) продукта 4b показал, что теоретическое значение ESI-MS (M+H+): m/z - 449.2, фактически измеренное значение - 449.3.
Пример 9. Синтезирование соединений 4с.
Растворяли сырье SM-4 (5.37 g, 21.9 mmol) и CDI (14.2 g, 87.5 mmol, 4 eq.) в безводном дихлорметане 100 мл, и проводится реакция при комнатной температуре сутки. Добавляли другое соединение VIc (43.7 mmol, 2 eq.), перемешивали при комнатной температуре, и полностью окончена реакция. После реакции и ректификации колоночной хроматографией получен продукт 4с (6.1 g), выход - 82%.
После контроля масс-спектральный анализ продукта 4 с показал, что теоретическое значение ESI-MS (M+H+): m/z - 449.2, фактически измеренное значение - 449.3.
Пример 10. Синтезирование соединений 4d.
Растворяли сырье SM-4 (5.37 g, 21.9 mmol) и CDI (14.2 g, 87.5 mmol, 4 eq.) в безводном дихлорметане 100 мл, и проводится реакция при комнатной температуре сутки. HPLC-ELSD показал полностное завершение реакции, и добавляли другое соединение VId (43.7 mmol, 2 eq.), перемешивали при комнатной температуре, и полностью окончена реакция. После реакции и ректификации колоночной хроматографией получен продукт 4 d (6.1 g), выход - 82%.
После контроля масс-спектральный анализ продукта 4d показал, что теоретическое значение ESI-MS (M+H+): m/z - 449.2, фактически измеренное значение - 449.3.
Пример 11. Синтезирование соединений 4е.
Растворяли сырье SM-4 (5.37 g, 21.9 mmol) и CDI (14.2 g, 87.5 mmol, 4 eq.) в безводном дихлорметане 100 мл, и проводится реакция при комнатной температуре сутки. HPLC-ELSD показал полностное завершение реакции, и добавляли другое соединение Vie (43.7 mmol, 2 eq.), перемешивали при комнатной температуре, и полностью окончена рекация. После реакции и ректификации колоночной хроматографией получен продукт 4 е (5.7 g), выход - 75%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.77 (s, 1H), 6.73 (s, 1H), 5.32 (m, 1H), 4.63 (s, 2H), 4.56 (s, 2H), 4.37-4.48 (m, 1H), 4.26 (s, 4H), 3.64-3.79 (m, 5H), 2.47 (m, 1H), 2.21-2.26 (m, 1H), 1.48 (s, 4H), 1.44 (s, 5H) продукта 4е показал, что теоретическое значение ESI-MS (M+H+): m/z - 449.2, фактически измеренное значение - 449.3.
Пример 12. Синтезирование соединений 4f.
Растворяли сырье SM-4 (5.37 g, 21.9 mmol) и CDI (14.2 g, 87.5 mmol, 4 eq.) в безводном дихлорметане 100 мл, и проводится реакция при комнатной температуре сутки. HPLC-ELSD показал полностное завершение реакции, и добавляли продукт из примера 4 (43.7 mmol, 2 eq.), перемешивали при комнатной температуре, и полностью окончена рекация. После реакции и ректификации колоночной хроматографией получен продукт 4 f (5.9 g), выход - 74%.
После контроля масс-спектральный анализ 1H-NMR(CDCl3, 500 MHz): δ 6.71 (s, 1H), 6.67 (s, 1H), 5.97 (s, 2H), 5.32 (m, 1H), 4.63 (s, 2H), 4.57 (s, 2H), 4.38-4.47 (m, 1H), 3.64-3.76 (m, 5H), 2.47 (m, 1H), 2.23-2.25 (m, 1H), 1.47 (s, 4H), 1.44 (s, 5H) продукта 4f показал, что теоретическое значение ESI-MS (M+H+): m/z -435.2, фактически измеренное значение - 435.3.
Пример 13. Синтезирование соединения 6а.
Растворяли продукт 4а (2g, 4.9 mmol) в 40 mL HCl/Et2O (4N), и проводится реакция при 30°С, полностью снята защитная основа Во, получен продукт 5а.
Растворяли сгущенный 5а в 50 mL DMF, добавляли SM-5 (1.40 g, 5.14 mmol, 1.05 eq.) и HATU 2.05 g, 5.39 mmol, 1.1 eq.). После охлаждения в ледовой воде 15 мин добавляли каплями DIEA (2.53 g, 19.6 mmol, 4 eq.). Естественно восстанавливали до комнатной температуры, перемешивали и ждали сутки до полной реакции (мониторинг над реакцией HPLC-ELSD). После сгущения добавляли 100 мл воды и 200 мл этилацетата. Извлекалась органическая фаза, и экстрагировали водяной слой этилацетатом (100 mL×2). Объединяли органические фазы и промывали последовательно 1N соляной кислотой, водой, насыщенным бикарбонатом натрия, насыщенной солевой водой, сушили и концентрировали; после быстрого извлечения и ректификации колоночной хроматографией получен продукт 6а (2.5 g), выход - 87%. Масс-спектральный анализ продукта 6а показал, что теоретическое значение ESI-MS (M+H+): m/z - 588.3, фактически измеренное значение - 588.3.
Пример 14. Синтезирование соединения 7а.
Растворяли продукт 6а (2.3 g, 4.2 mmol) в смеси из 30 mL THF, и 15 mL метанола и 15 mL воды, добавляли моногидрат гидроксида лития (0.54 g, 12.8 mmol, 3 eq.), перемешивали и ждали сутки. После окончания реакции добавляли 50 mL воды в сгущенный раствор и промывали эфиром до полной реакции (мониторинг реакцией HPLC-ELSD). Регулировали Ph водяной фазы до 3 с помощью 1N-соляной кислоты, и экстрагировали этилацетатом (80 mL×2). Объединяли органические фазы и промывали насыщенной солевой водой, сушили и концентрировали; получен жесткий продукт 7а (2.1 g), выход >95%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 574.3, фактически измеренное значение - 574.4.
Пример 15. Синтезирование соединения 8а.
Растворяли сырье SM-7 (6.5 g, 18 mmol) в HCl/Et2O (4 M, 80 mL), и проводится реакция при 30°C, растворяли сгущенный вышеуказанный реакционный раствор в 50 mL DMF, дабавляли соединение (L)-N-Boc-2-амино-8-азелаиновую кислоту (SM-5, 5.2 g, 19 mmol, 1.05 eq.) и HATU (7.6 g, 20 mmol, 1.1 eq.). После охладждения в ледовой воде 15 мин. добавляли каплями DIEA (9.5 g, 76 mmol, 4 eq.). Естественно восстанавливали до комнатной температуры, перемешивали и ждали сутки до полной реакции. После быстрого извлечения и ректификации колоночной хроматографией получен продукт 8 (2.5 g) п, выход - 87%.
После контроля масс-спектральный анализ 1H-NMR(CDCl3, 500 MHz): δ 7.73 (s, 1H), 5.70-5.79 (m, 2H), 5.27-5.31 (d, J=17.0 Hz, 1H), 5.22-5.24 (d, J=8 Hz, 1H), 5.11-5.13 (m, 1H), 4.93-5.01 (m, 2H), 4.68-4.71 (t, J=7.5 Hz, 1H), 4.54 (br, 1H), 4.36-4.37 (m, 1H), 3.94-3.97 (d, J=11.5 Hz, 1H), 3.65 (s, 3H), 3.55-3.58 (m, 1H), 3.39 (br, 1H), 2.97 (s, 1H), 2.89 (s, 1H), 2.49-2.52 (m, 1H), 2.12-2.16 (m, 1H), 2.02-2.04 (m, 4H), 1.83-1.85 (m, 1H), 1.74-1.78 (m, 1H), 1.59-1.61 (m, 1H), 1.43 (s, 9H), 1.31-1.40 (m, 4H) продукта 8 показал, что теоретическое значение ESI-MS (M+H+): m/z - 508.3, фактически измеренное значение - 508.5.
Пример 16. Синтезирование соединения 9а.
Синтезирование соединения 9a-9d может проводиться двумя методами, как показано на рисунке синтезирующей реакции 4 и 5.
Метод I:
Растворяли продукт 7а (2.0 g, 4 mmol), циклопропило-амино-метиловый реагент с виниловыми заменителями SM-6 (1.3 g, 4.2 mmol, 1.05 eq.) и связующий реагент HATU (1.83 g, 4.82 mmol, 1.1 eq.) в 80 mL DMF. После охлаждения в ледовой воде 15 мин добавляли каплями DIEA (2.27 g, 17.5 mol, 4 eq.). Естественно восстанавливали до комнатной температуры, перемешивали и ждали сутки до полной реакции. После окончания реакции и обработки получен продукт 9а (2.4g) после быстрого извлечения и ректификации колоночной хроматографией, выход - 81%. Масс-спектральный анализ продукта 9а показал, что теоретическое значение ESI-MS (M+H+): m/z - 699.3, фактически измеренное значение - 699.4.
Метод II:
Растворяли продукт 8 из примера 9 (1.3 g, 2.56 mmol) и CDI (1.66 g, 10.2 mmol, 4 eq.) в 50 mL безводного дихлорметана, проводится реакция при комнатной температуре сутки. HPLC-ELSD показал полную реакцию, добавляли продукт VIa (5.12 mmol, 2 eq.) из примера 1, перемешивали при комнатной температуре до полной реакции. Получен продукт 9а (1.4 g) после обработки и быстрой колоночной хроматографии, выход - 86%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 699.3, фактически измеренное значение - 699.4.
Пример 17. Синтезирование соединения 9b.
Синтезирование соединения 9b может проводиться методом II, как показано на рисунке синтезирующей реакции 5.
Растворяли продукт 8 из примера 9 (1.3 g, 2.56 mmol) и CDI (1.66 g, 10.2 mmol, 4 eq.) в 50 mL безводного дихлорметана, проводится реакция при комнатной температуре сутки. Добавляли продукт VIb (5.12 mmol, 2 eq.) из примера 2, перемешивали при комнатной температуре до полной реакции. Получен продукт 9 b (1.6 g) после обработки и быстрой колоночной хроматографией, выход - 94%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 711.4, фактически измеренное значение - 711.5.
Пример 18. Синтезирование соединения 9с.
Синтезирование соединения 9с может проводиться методом II, как показано на рисунке синтезирующей реакции 5.
Растворяли продукт 8 (1.3 g, 2.56 mmol) и CDI (1.66 g, 10.2 mmol, 4 eq.) в 50 mL безводного дихлорметана, проводится реакция при комнатной температуре сутки. Добавляли продукт VIc (5.12 mmol, 2 eq.) из примера 2, перемешивали при комнатной температуре до полной реакции. Получен продукт 9с (1.3 g) после обработки и быстрой колоночной хроматографией, выход - 77%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 711.4, фактически измеренное значение - 711.5.
Пример 19. Синтезирование соединения 9d.
Синтезирование соединения 9d может проводиться методом II, как показано на рисунке синтезирующей реакции 5.
Растворяли вышеуказанный продукт 8 (1.3 g, 2.56 mmol) из примера 9 и CDI (1.66 g, 10.2 mmol, 4 eq.) в 50 mL безводного дихлорметана, проводится реакция при комнатной температуре сутки. Добавляли продукт VId (5.12 mmol, 2 eq.) из примера 2, перемешивали при комнатной температуре до полной реакции. Получен продукт 9d (1.3 g) после обработки и быстрой колоночной хроматографией, выход - 77%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 711.4, фактически измеренное значение - 711.5.
Пример 20. Синтезирование соединения 9е.
Синтезирование соединения 9е может проводиться методом II, как показано на рисунке синтезирующей реакции 5.
Растворяли продукт 8 (1.3 g, 2.56 mmol) из примера 9 и CDI (1.66 g, 10.2 mmol, 4 eq.) в 50 mL безводного дихлорметана, проводится реакция при комнатной температуре сутки. Добавляли продукт VIe (5.12 mmol, 2 eq.) из примера 2, перемешивали при комнатной температуре до полной реакции. Получен продукт 9е (1.4g) после обработки и быстрой колоночной хроматографией, выход - 83%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 711.4, фактически измеренное значение - 711.5.
Пример 21. Синтезирование соединения 9f.
Синтезирование соединения 9f может проводиться методом II, как показано на рисунке синтезирующей реакции 5.
Растворяли вышеуказанный продукт 8 (1.3 g, 2.56 mmol) из примера 9 и CDI (1.66 g, 10.2 mmol, 4 eq.) в 50 mL безводного дихлорметана, проводится реакция при комнатной температуре сутки. Добавляли продукт VI f (5.12 mmol, 2 eq.) из примера 2, перемешивали при комнатной температуре до полной реакции. Получен продукт 9 f (1.3 g) после обработки и быстрой колоночной хроматографией, выход - 78%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 697.3, фактически измеренное значение - 697.4.
Пример 22. Синтезирование соединения 9-Ref.
Синтезирование соединения 9-Ref может проводиться методом II, как показано на рисунке синтезирующей реакции 5.
Растворяли продукт 8 (1.3 g, 2.56 mmol) из примера 9 и CDI (1.66 g, 10.2 mmol, 4 eq.) в 50 mL безводного дихлорметана, проводится реакция при комнатной температуре сутки. Добавляли SM-8 (1.05 eq) в реакционный раствор, перемешивали при комнатной температуре до полной реакции. Получен продукт 9-Ref (1.4 g) после обработки и быстрой колоночной хроматографией, выход - 81%.
Масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 7.65-7.70 (d, J=9 Hz, 1H), 6.96-1.07 (m, 2H), 5.72-5.78 (m, 2H), 5.40 (br, 1H), 5.28-5.31 (d, J=16.5 Hz, 1H), 5.12-5.14 (d, J=10.5 Hz, 1H), 5.07-5.09 (d, J=7.5 Hz, 1H), 4.93-5.00 (m, 2H), 4.64-4.79 (m, 5H), 4.36-4.37 (m, 1H), 4.06 (m, 1H), 3.72-3.75 (m, 1H), 3.67 (s, 3H), 2.78 (m, 1H), 2.26 (m, 1H), 2.14-2.16 (m, 1H), 2.01-2.03 (m, 2H), 1.86-1.88 (m, 1H), 1.70-1.73 (m, 1H), 1.57-1.60 (m, 1H), 1.45-1.49 (m, 2H), 1.37-1.40 (m, 4H), 1.32 (s, 4H), 1.29 (s, 5H) продукта 9-Ref показал, что теоретическое значение ESI-MS (М+Н+): m/z - 691.3, фактически измеренное значение - 691.4.
Пример 23. Синтезирование соединения 10а.
Растворяли соединение 9а (2.25 mmol) в 450 mL безводного дихлорэтана под защитой аргона, добавляли Zhan Catalyst-1B (RC-303, 74.4 mg, 0.113 mmol, 0.05 eq.). Ставили реакционную колбу в масляную баню, подогретую до 80°С, проводится реакция сутки. Получен продукт 10а (1.2g) после обработки и быстрой колоночной хроматографией, выход - 64%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 669.3, фактически измеренное значение - 669.4.
Пример 24. Синтезирование соединения 10b.
Растворяли соединеине 9b (2.25 mmol) в 450 mL безводного дихлорэтана под защитой аргона, добавляли Zhan Catalyst-1B (RC-303, 74.4 mg, 0.113 mmol, 0.05 eq.). Ставили реакционную колбу в масляную баню, подогретую до 80°С, проводится реакция сутки. Получен продукт 10b (1.3g) после обработки и быстрой колоночной хроматографией, выход - 67%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 683.3, фактически измеренное значение - 683.5.
Пример 25. Синтезирование соединения 10 с.
Растворяли соединеине 9с (2.25 mmol) в 450 mL безводного дихлорэтана под защитой аргона, добавляли Zhan Catalyst-1B (RC-303, 74.4 mg, 0.113 mmol, 0.05 eq.). Ставили реакционную колбу в масляную баню, подогретую до 80°С, проводится реакция сутки. Получен продукт 10с (1.3 g) после обработки и быстрой колоночной хроматографией, выход - 56%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 683.3, фактически измеренное значение - 683.5.
Пример 26. Синтезирование соединения 10d.
Растворяли соединение 9d (2.25 mmol) в 450 mL безводного дихлорэтана под защитой аргона, добавляли Zhan Catalyst-lB (RC-303, 74.4 mg, 0.113 mmol, 0.05 eq.). Ставили реакционную колбу в масляную баню, подогретую до 80°С, проводится реакция сутки. Получен продукт 10 d (1.3g) после обработки и быстрой колоночной хроматографией, выход - 61%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 683.3, фактически измеренное значение - 683.5.
Пример 27. Синтезирование соединения 10е.
Растворяли соединение 9е (2.25 mmol) в 450 mL безводного дихлорэтана под защитой аргона, добавляли Zhan Catalyst-1B (RC-303, 74.4 mg, 0.113 mmol, 0.05 eq.). Ставили реакционную колбу в масляную баню, подогретую до 80°С, проводится реакция сутки. Получен продукт 10 е (1.1 g) после обработки и быстрой колоночной хроматографией, выход - 51%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 683.3, фактически измеренное значение - 683.5.
Пример 28. Синтезирование соединения 10f.
Растворяли соединение 9f (2.25 mmol) в 450 mL безводного дихлорэтана под защитой аргона, добавляли Zhan Catalyst-1 В (RC-303, 74.4 mg, 0.113 mmol, 0.05 eq.). Ставили реакционную колбу в масляную баню, подогретую до 80°С, проводится реакция сутки. Получен продукт 10f (0.9 g) после обработки и быстрой колоночной хроматографией, выход - 47%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 669.3, фактически измеренное значение - 669.4.
Пример 29. Синтезирование соединения 10-Ref.
Растворяли соединение 9-Ref (2.25 mmol) в 450 mL безводного дихлорэтана под защитой аргона, добавляли Zhan Catalyst-1B (RC-303, 74.4 mg, 0.113 mmol, 0.05 eq.). Ставили реакционную колбу в масляную баню, подогретую до 80°С, проводится реакция сутки. Получен продукт 10-Ref (1.4 g) после обработки и быстрой колоночной хроматографией, выход - 71%.
После контроля, масс-спектральный анализ +H-NMR (CDCl3, 500 MHz): δ 6.96-7.07 (m, 3Н), 5.53-5.55 (m, 1H), 5.39 (m, 1H), 5.23-5.28 (m, 2H), 4.69-4.84 (m, 5H), 4.49 (m, 1H), 4.05-4.07 (m, 1H), 3.86-3.89 (m, 1H), 3.67 (s, 3Н), 2.82-2.85 (m, 1H), 2.25-2.27 (m, 1H), 2.16-2.19 (m, 3Н), 1.85-1.88 (m, 2H), 1.56-1.73 (m, 3Н), 1.38-1.43 (m, 4H), 1.35 (s, 4H), 1.34 (s, 5H) продукта 10-Ref показал, что теоретическое значение ESI-MS (M+H+): m/z - 643.3, фактически измеренное значение - 643.5.
Пример 30. Синтезирование соединения 11а.
Растворяли продукт 10а (0.6 mmol) в смеси из 30 mL THF, и 15 mL метанола, и 15 mL воды, добавляли моногидрат гидроксида лития (122.9 mg, 2.93 mmol, 5 eq.), перемешивали и ждали сутки. Получен жесткий продукт 11а (466 mg) после обработки и быстрой колоночной хроматографией, выход >95%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z-655.3, фактически измеренное значение-655.3.
Пример 31. Синтезирование соединения 11b.
Растворяли продукт 10b (0.6 mmol) в смеси из 30 mL THF, 15 mL метанола и 15 mL воды, добавляли моногидрат гидроксида лития (122.9 mg, 2.93 mmol, 5 eq.), перемешивали и ждали сутки. Получен жесткий продукт 11b (439 mg) после обработки и быстрой колоночной хроматографией, выход >95%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 669.3, фактически измеренное значение - 669.3.
Пример 32. Синтезирование соединения 11с.
Растворяли продукт 10с (0.6 mmol) в смеси из 30 mL THF, 15 mL метанола и 15 mL воды, добавляли моногидрат гидроксида лития (122.9 mg, 2.93 mmol, 5 eq.), перемешивали и ждали сутки. Получен жесткий продукт 11с (453 mg) после обработки и быстрой колоночной хроматографией, выход >95%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 673.3, фактически измеренное значение - 673.3.
Пример 33. Синтезирование соединения 11d.
Растворяли продукт 10d (0.6 mmol) в смеси из 30 mL THF, 15 mL метанола и 15 mL воды, добавляли моногидрат гидроксида лития (122.9 mg, 2.93 mmol, 5 eq.), перемешивали и ждали сутки. Получен жесткий продукт 11d (457 mg) после обработки и быстрой колоночной хроматографией, выход >95%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+H+): m/z - 673.3, фактически измеренное значение - 673.3.
Пример 34. Синтезирование соединения 11е.
Растворяли продукт 10е (0.6 mmol) в смеси из 30 mL THF, 15 mL метанола и 15 mL воды, добавляли моногидрат гидроксида лития (122.9 mg, 2.93 mmol, 5 eq.), перемешивали и ждали сутки. Получен жесткий продукт 11е (418 mg) после обработки и быстрой колоночной хроматографией, выход >85%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+H+): m/z - 669.3, фактически измеренное значение - 669.3.
Пример 35. Синтезирование соединения 11f.
Растворяли продукт 10f (0.6 mmol) в смеси из 30 mL THF, 15 mL метанола и 15 mL воды, добавляли моногидрат гидроксида лития (122.9 mg, 2.93 mmol, 5 eq.), перемешивали и ждали сутки. Получен жесткий продукт 11f (453 mg) после обработки и быстрой колоночной хроматографией, выход >95%. Масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+H+): m/z - 655.3, фактически измеренное значение - 655.4.
Пример 36. Синтезирование соединения 11j.
Взвешивали соединение 10е (0.55 g, 0.81 mmol) в 10 mL 4N HCl/ -эфире, перемешивали два часа и концентрировали. Добавляли 10 mL DCM и триэтиламин (0.82 g, 8 mmol), затем охлаждали до 0-5°С, медленно добавляли сырье сульфохлорид 0.29 g (1.6 mmol), перемешивали при комнатной температуре и ждали сутки до полной реакции. Получен жесткий продукт 13j после обработки и быстрой колоночной хроматографией (0.43 g, выход: 73%).
Добавляли соединение 13j (0.4 g) в смеси из 10 mL ментола с NaOH (120 mg, 3 mmol) и 0,5 mL воды, подогревали до 60°С, перемешивали 5 часов до полной реакции. Получен жесткий продукт 11j (0.3 lg, выход: 80%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1Н-NMR (CDCl3, 500 MHz):. δ 7.30 (s, 1H), 6.76 (s, 1H), 6.68 (s, 1H), 5.69 (q, J=8.0 Hz, 1H), 5.48 (s, 1H), 5.15 (t, J=8.0 Hz, 1H), 4.63-4.48 (m, 5H), 4.24 (s, 4H), 4.23-4.14 (m, 2H), 3.86 (m, 1H), 3.71 (m, 1H), 3.39 (m, 1H), 3.07-2.91 (m, 2H), 2.57 (m, 1H), 2.44(m, 1H), 2.36-2.22 (br, 4H), 2.04 (m, 1H), 1.93 (m, 1H), 1.81 (m, 1H), 1.64-1.55 (br, 3H), 1.46-1.29 (br, 4H), 1.24-1.20 (br, 2H) 11j показал, что теоретическое значение ESI-MS (М+Н+): m/z - 673.2, фактически измеренное значение - 673.3.
Пример 37. Синтезирование соединения 11k.
Метод синтезирования соединения 11k такой же, как у соединения 11j.
Взвешивали соединение 10 f (0.55 g, 0.81 mmol) в 10 mL 4N HCl/ -эфире, перемешивали два часа и концентрировали. Добавляли 10 mL DCM и триэтиламин (0.82 g, 8 mmol), затем охлаждали до 0-5°С, медленно добавляли сырье сульфохлорид 0.29 g (1.6 mmol), перемешивали при комнатной температуре и ждали сутки до полной реакции. Получен жесткий продукт 13 k (0.48 g, выход: 91%) после обработки и быстрой колоночной хроматографией.
Добавляли соединение 13k (0.4g) в смеси из 10 mL ментола с NaOH (120 mg, 3 mmol) и 0, 5 mL воды, подогревали до 60°С, перемешивали 5 часов до полной реакции. Получен жесткий продукт 11k (0.30 g, выход: 78%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 7.32 (s, 1H), 6.71 (s, 1H), 6.63 (s, 1H), 5.96 (s, 2H), 5.69 (q, J=8.0 Hz, 1H), 5.48 (s, 1H), 5.15 (t, J=8.0 Hz, 1H), 4.64-4.49 (m, 5H), 4.23-4.15 (m, 2H), 3.89 (m, 1H), 3.72 (m, 1Н), 3.40 (m, 1H), 3.09-2.89 (m, 2H), 2.58 (m, 1H), 2.48 (m, 1H), 2.39-2.26 (br, 4H), 2.08 (m, 1H), 1.96 (m, 1H), 1.82 (m, 1H), 1.69-1.54 (br, 3H), 1.46-1.29 (br, 4H), 1.26-1.20 (br, 2H) 11k показал, что теоретическое значение ESI-MS (М+Н+): m/z - 659.2, фактически измеренное значение - 659.3.
Пример 38. Синтезирование соединения 11m.
Метод синтезирования соединения 11m такой же, как у соединения 11j.
Взвешивали соединение 10-Ref (0.55 g, 0.81 mmol) в 10 mL 4N HCl/-эфире, перемешивали два часа и концентрировали. Добавляли 10 mL DCM и триэтиламин (0.82 g, 8 mmol), затем охлаждали до 0-5°С, медленно добавляли сырье сульфохлорид 0.29 g (1.6 mmol), перемешивали при комнатной температуре и ждали сутки до полной реакции. Получен жесткий продукт 13 m (0.35 g, выход: 65%) после обработки и быстрой колоночной хроматографией.
Добавляли соединение 13 m (0.3g) в смеси из 10 mL ментола с NaOH (120 mg, 3 mmol) и 0,5 mL воды, подогревали до 60°С, перемешивали 5 часов до полной реакции. Получен жесткий продукт 11m (0.21 g, выход:76%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 7.25 (m, 1H), 7.06-6.95 (m, 2H), 5.71 (q, J=8.0 Hz, 1H), 5.49 (s, 1H), 5.32 (s, 1H), 5.14 (t, J=8.0 Hz, 1H), 4.80-4.4.61(m, 5H), 4.31 (m, 1H), 4.16(m, 1H), 3.86(m, 1H), 3.72(q, J=5.6 Hz, 1H), 3.40(q, J=5.6 Hz, 1H), 3.02 (m, 1H), 2.92 (m, 1H), 2.61 (br, 1H), 2.52-2.41 (br, 2H), 2.33-2.24 (br, 3H), 2.06 (br, 1H), 1.93 (br, 1H), 1.83 (br, 1H), 1.63-1.54 (br, 3H), 1.42-1.22 (br, 6H) 11m показал, что теоретическое значение ESI-MS (М+Н-+): m/z - 633.2, фактически измеренное значение - 633.3.
Пример 39. Синтезирование соединения 11-Ref.
Метод синтезирования соединения 11-Ref такой же, как у соединения 11а.
Растворяли продукт 10-Ref(0.6 mmol) в смеси из 30 mL THF, 15 mL метанола и 15 mL воды, добавляли моногидрат гидроксида лития (122.9 mg, 2.93 mmol, 5 eq.), перемешивали и ждали сутки. Получен жесткий продукт 11-Ref (438 mg) после обработки и быстрой колоночной хроматографией, выход >95%.
После контроля масс-спектральный анализ 11-Ref (CDCl3, 500 MHz): δ 7.16 (m, 1H), 6.96-7.07 (m, 2H), 5.63-5.64 (m, 1H), 5.32 (m, 1H), 5.20-5.28 (m, 2H), 4.68-4.78 (m, 5H), 4.34-4.40 (m, 1H), 4.19 (m, 1H), 3.89 (m, 1H), 2.68-2.78 (m, 1H), 2.32 (m, 2H), 2.21 (m, 1H), 2.10 (m, 1H), 1.84-1.87 (m, 2H), 1.59-1.62 (m, 2H), 1.40-1.45 (m, 5H), 1.32 (s, 4H), 1.30 (s, 5H) 1H-NMR показал, что теоретическое значение ESI-MS (М+Н+): m/z - 629.3, фактически измеренное значение - 629.4.
Пример 40. Синтезирование соединения 12а.
Растворяли соединение 11a (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12а (56 mg, выход: 58%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.29-10.30 (d, 1H), 6.97-7.02 (d, 2H), 6.60-6.78 (m, 2H), 5.98-5.99 (m, 2H), 5.70-5.73 (m, 1H), 5.47 (m, 1H), 4.98-5.08 (m, 2H), 4.56-4.70 (m, 5H), 4.37-4.40 (m, 1H), 4.21-4.23 (m, 1H), 3.84-3.86 (m, 1H), 2.90-2.93 (m, 1H), 2.50-2.56 (m, 2H), 2.46-2.48 (m, 1H), 2.25-2.28 (m, 1H), 1.89-1.95 (m, 2H), 1.74-1.79 (m, 2H), 1.46-1.58 (m, 6H), 1.36-1.39 (m, 2H), 1.29 (s, 4H), 1.25 (s, 5H), 1.08-1.16 (m, 2H), 0.90-0.95 (m, 1H) 12а показал, что теоретическое значение ESI-MS (M+H+): m/z - 758.3, фактически измеренное значение - 758.4.
Пример 41. Синтезирование соединения 12b.
Растворяли соединение 11b (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12 b (53 mg, выход: 51%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.25-10.25 (d, 1H), 6.88-6.91 (m, 1H), 6.77-6.80 (m, 1H), 6.58-6.60 (m, 1H), 5.68-5.74 (m, 1H), 5.45 (m, 1H), 4.98-5.06 (m, 2H), 4.64-4.68 (m, 2H), 4.52-4.60 (m, 3H), 4.35-4.39 (m, 1H), 4.22-4.29 (m, 5H), 3.82-3.84 (m, 1H), 2.88-2.91 (m, 1H), 2.45-2.56 (m, 2H), 2.41-2.45 (m, 1H), 2.23-2.29 (m, 1H), 1.82-1.93 (m, 1H), 1.60-1.79 (m, 3H), 1.36-1.56 (m, 8H), 1.23-1.29 (m, 9H), 0.93-1.06 (m, 2H), 0.89-0.93 (m, 1H) 12b показал, что теоретическое значение ESI-MS (М+Н+): m/z -772.3, фактически измеренное значение - 772.4.
Пример 42. Синтезирование соединения 12с.
Растворяли соединение 11c (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12 с (47 mg, выход:42%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.27 (s, 1H), 6.92 (s, 1H), 6.77 (s, 1H), 6.65 (s, 1H), 5.72-5.73 (m, 1H), 5.46 (m, 1H), 5.09 (m, 1H), 5.00 (m, 1H), 4.64 (m, 2H), 4.53-4.56 (m, 3H), 4.37-4.40 (m, 1H), 4.25 (m, 5H), 3.84-3.86 (m, 1H), 2.90 (m, 1H), 2.46-2.53 (m, 3H), 2.27-2.29 (m, 1H), 1.87-1.94 (m, 2H), 1.72 (m, 2H), 1.58 (m, 1H), 1.47 (m, 5H), 1.38 (m, 2H), 1.31 (s, 9H), 1.11 (m, 2H), 0.91 (m, 1H) 12с показал, что теоретическое значение ESI-MS (M+H+): m/z - 772.3, фактически измеренное значение - 772.4.
Пример 43. Синтезирование соединения 12d.
Растворяли соединение 11f (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12 d (65 mg, выход:67%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.24 (s, 1H), 6.80 (s, 1H), 6.72 (s, 1H), 6.59 (s, 1H), 5.98 (s, 2H), 5.70-5.76 (m, 1H), 5.47 (m, 1H), 5.03 (m, 2H), 4.65 (m, 2H), 4.53-4.57 (m, 3H), 4.38-4.41 (m, 1H), 4.23 (m, 1H), 3.85 (d, 1H), 2.92 (m, 1H), 2.51-2.57 (m, 2H), 2.45 (m, 1H), 2.28 (m, 1H), 1.95 (m, 2H), 1.59 (m, 1H), 1.59-1.65 (m, 2H), 1.48 (m, 5H), 1.38 (m, 2H), 1.30 (s, 9H), 1.12 (m, 2H), 0.92 (m, 1H) 12d показал, что теоретическое значение ESI-MS (M+H+): m/z -758.3, фактически измеренное значение - 758.5.
Пример 44. Синтезирование соединения 12е.
Растворяли соединение 11а (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=изопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12е (53 mg, выход:49%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.91-9.93 (d, 1H), 6.72-6.83 (m, 3Н), 5.95-5.99 (m, 2H), 5.72-5.73 (m, 1H), 5.47 (m, 1H), 4.99-5.05(m, 2H), 4.57-4.71(m, 5H), 4.40-4.42 (m, 1H), 4.22(m, 1H), 3.83-3.85 (d, 1H), 3.70-3.72(m, 1H), 2.55-2.57 (m, 2H), 2.46-2.48 (m, 1H), 2.27-2.30 (m, 1H), 1.97 (m, 1H), 1.76-1.86 (m, 3Н), 1.42-1.46 (m, 6H), 1.32-1.37 (m, 4H), 1.24-1.28 (d, 9H), 0.89-0.91 (m, 3Н) 12е показал, что теоретическое значение ESI-MS (М+Н+): m/z -760.3, фактически измеренное значение - 760.4.
Пример 45. Синтезирование соединения 12f.
Растворяли соединение 11b (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реационного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=изопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12f (50 mg, выход:46%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.94 (s, 1H), 6.73-6.78 (m, 2H), 6.59-6.73 (m, 1H), 5.69-5.75 (m, 1H), 5.47 (m, 1H), 4.99-5.05 (m, 2H), 4.63-4.67 (m, 2H), 4.42-4.53 (m, 3Н), 4.29-4.38 (m, 1H), 4.25-4.29 (m, 5H), 3.83-3.86 (m, 1H), 3.68-3.75 (m, 1H), 2.53-2.58 (m, 2H), 2.43-2.48 (m, 1H), 2.28-2.30 (m, 1H), 1.96-2.00 (m, 1H), 1.69-1.93 (m, 3Н), 1.42-1.47 (m, 6H), 1.32-1.44 (m, 4H), 1.24-1.29 (m, 9H), 0.86-0.93 (m, 3Н) 12f показал, что теоретическое значение ESI-MS (M+H+): m/z - 774.3, фактически измеренное значение - 774.4.
Пример 46. Синтезирование соединения 12g.
Растворяли соединение 11с (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтане, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=изопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12 g (45 mg, выход: 38%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1Н-NMR (CDCl3, 500 MHz): δ 9.91 (s, 1H), 6.77-6.78 (m, 2H), 6.65 (s, 1H), 5.69-5.75 (m, 1H,), 5.47 (m, 1H), 5.01-5.03 (m, 2H), 4.60-4.64 (m, 2H), 4.53-4.60 (m, 3H), 4.39-4.42 (m, 1H), 4.26 (m, 5H), 3.84-3.85 (m, 1H), 3.69-3.72 (m, 1H), 2.54-2.56 (m, 2H), 2.43-2.48 (m, 1H), 2.28-2.29 (m, 1H), 1.96 (m, 1H), 1.74-1.86 (m, 2H), 1.59 (m, 1H), 1.37-1.43 (m, 7H), 1.32-1.33 (m, 15H) 12g показал, что теоретическое значение ESI-MS (M+H+): m/z - 774.3, фактически измеренное значение - 774.4.
Пример 47. Синтезирование соединения 12h.
Растворяли соединение 11d (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=изопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12 h (53 mg, выход:48%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.95 (s, 1H), 6.90 (s, 1H), 6.71 (s, 1H), 6.59 (s, 1H), 5.98 (s, 2H), 5.73 (m, 1H), 5.47 (m, 1H), 5.04 (m, 2H), 4.65 (m, 2H), 4.53-4.57 (m, 3H), 4.39-4.41 (m, 1H), 4.23 (m, 1H), 3.84-3.85 (d, 1H), 3.70 (m, 1H), 2.53 (m, 2H), 2.48 (m, 1H), 2.28 (m, 1H), 1.95 (m, 1H), 1.76-1.86 (m, 3H), 1.57 (m, 1H), 1.41-1.46 (m, 7H), 1.30 (m, 15H) 12h показал, что теоретическое значение ESI-MS (M+H+): m/z - 760.3, фактически измеренное значение - 760.4.
Пример 48. Синтезирование соединения 12j.
Растворяли соединение 11j (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12j (73 mg, выход:61%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1Н-NMR (CDCl3, 500 MHz): δ 10.35 (s, 1H), 7.35 (s, 1H), 6.74 (s, 1H), 6.67 (s, 1H), 5.72-5.77 (q, J=8.5 Hz, 1H), 5.52 (m, 1H), 5.00-5.04 (t, J=9.5 Hz, 1H), 4.57-4.64 (m, 2H), 4.46-4.57 (m, 3H), 4.23-4.25 (m, 5H), 4.08-4.11 (d, 1H), 3.88-3.90 (m, 1H), 3.65-3.69 (m, 1H), 3.32-3.37 (m, 1H), 2.92-3.05 (m, 2H), 2.88-2.92 (m, 1H), 2.66-2.74 (m, 1H), 2.40-2.53 (m, 2H), 2.26-2.35 (m, 3H), 1.80-2.05 (m, 3H), 1.48-1.68 (m, 3H), 1.26-1.48 (m, 6H), 1.08-1.13 (m, 2H), 0.90-0.94 (m, 1H) 12j показал, что теоретическое значение ESI-MS (М+Н+): m/z - 776.3, фактически измеренное значение - 776.4.
Пример 49. Синтезирование соединения 12k.
Растворяли соединение 11k (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтане, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12k (54 mg, выход:38%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.36 (s, 1H), 7.39 (s, 1H), 6.70 (s, 1H), 6.64 (s, 1H), 5.97 (s, 2H), 5.74-5.76 (m, 2H), 5.53 (m, 1H), 5.01-5.05 (t, J=9.5 Hz, 1H), 4.46-4.64 (m, 5H), 4.24-4.26 (d, 1H), 4.10-4.13 (m, 1H), 3.88-3.91 (m, 1H), 3.66-3.68 (m, 1H), 3.33-3.38 (m, 1H), 2.90-3.03 (m, 3H), 2.71 (m, 1H), 2.49-2.51 (m, 1H), 2.42-2.45 (m, 1H), 2.28-2.34 (m, 3H), 1.81-2.02 (m, 4H), 1.62-1.69 (m, 4H), 1.44-1.49 (m, 4H), 1.08-1.14 (m, 2H), 0.86-0.96 (m, 1H) 12k показал, что теоретическое значение ESI-MS (М+Н+): m/z - 762.2, фактически измеренное значение - 762.3.
Пример 50. Синтезирование соединения 12m.
Растворяли соединение 11 m (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.363 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12m (61 mg, выход:52%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.38-10.41 (d, 1H), 7.51-7.55 (d, J=20.0 Hz, 1H), 6.94-7.05 (m, 2H), 5.73-5.79 (m, 2H), 5.54 (m, 1H), 5.02-5.06 (t, J=9.5 Hz, 1H), 4.75-4.85 (m, 2H), 4.54-4.64 (m, 3H), 4.29-4.33 (t, J=11 Hz, 1H), 4.08-4.10 (d, 1H), 3.85-3.89 (m, 1H), 3.65-3.68 (m, 1H), 3.31-3.36 (m, 3H), 2.73-2.74 (m, 1H), 2.51-2.52 (m, 2H), 2.27-2.36 (m, 3H), 1.72-2.02 (m, 4H), 1.27-1.66 (m, 9H), 1.09-1.13 (m, 2H), 0.91-0.95 (m, 1H) 12 m показал, что теоретическое значение ESI-MS (M+H+): m/z - 736.2, фактически измеренное значение - 736.4.
Пример 51. Синтезирование соединения 12n.
Растворяли соединение 11с (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.363 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12n (47 mg, выход: 42%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.27 (s, 1H), 6.89-6.92 (m, 2H), 6.67-6.79 (m, 1H), 5.72-5.74 (m, 1H), 5.46-5.47 (m, 1H), 4.99-5.07 (m, 2H), 4.55-4.69 (m, 5H), 4.39 (m, 1H), 4.21-4.25 (m, 5H), 3.84-3.86 (m, 1H), 2.90-2.93 (m, 1H), 2.45-2.56 (m, 3H), 2.19-2.29 (m, 3H), 1.89-1.95 (m, 2H), 1.71-1.79 (m, 2H), 1.58 (m, 1H), 1.34-1.50 (m, 7H), 1.29 (s, 5H), 1.25 (s, 4H), 1.08-1.16 (m, 2H), 0.92-0.94 (m, 1H) 12n показал, что теоретическое значение ESI-MS (М+Н+): m/z - 786.3, фактически измеренное значение - 786.4.
Пример 52. Синтезирование соединения 12р.
Растворяли соединение 11d (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.363 mmol, R=циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12р (65 mg, выход:67%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl2, 500 MHz): δ 10.28 (s, 1H), 7.00 (s, 1H), 6.87 (s, 1H), 6.75 (s, 1H), 5.70-5.72 (m, 1H), 5.45 (m, 1H), 4.97-5.09 (m, 2H), 4.52-4.63 (m, 5H), 4.35-4.38 (m, 1H), 4.14-4.22 (m, 5H), 3.83-3.84 (m, 1H), 2.88-2.91 (m, 1H), 2.44-2.53 (m, 3H), 2.17-2.27 (m, 3H), 1.76-1.91 (m, 4H), 1.57 (m, 1H), 1.37-1.51 (m, 7H), 1.28 (s, 9H), 1.06-1.13 (m, 2H), 0.89-0.93 (m, 1H) 12 p показал, что теоретическое значение ESI-MS (М+Н+): m/z -786.3, фактически измеренное значение - 786.4.
Пример 53. Синтезирование соединения 12q.
Растворяли соединение 12d (0.18 mmol) в 20 mL HCl-Et2O (2N), после полной реакции при 30°С получен продукт со снятой защитной основой Вое, проводится реакция с изопропиловым хлорформиатом (1.2 eq) и получен продукт 12q, выход: 72%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.27 (s, 1H), 6.97 (br, 1H), 6.70 (s, 1H), 6.59 (s, 1H), 5.95 (s, 2H), 5.70 (q, J=8.1 Hz, 1H), 5.44 (s, 1H), 5.14 (s, 1H), 4.99 (t, J=8.1 Hz, 1H), 4.65-4.47 (m, 5H), 4.35 (m, 2H), 4.24 (br, 1H), 3.82 (m, 1H), 2.91 (m, 1H), 2.45 (m, 3H), 2.23 (m, 1H), 1.92 (br, 2H), 1.74 (br, 2H), 1.59 (m, 1H), 1.47-1.27 (br, 8H), 1.11-1.06 (br, 5H), 1.01 (d, J=4.7 Hz, 3H), 0.96 (m, 1H) 12q показал, что теоретическое значение ESI-MS (М+Н+): m/z - 744.3, фактически измеренное значение - 744.3.
Пример 54. Синтезирование соединения 12r.
Растворяли соединение 12d (0.18 mmol) в 20 mL HCl-Et2O (2N), после полной реакции при 30°С получен продукт со снятой защитной основой Boc, проводится реакция с цилкопентуловым хлоридом (1.2 eq), и получен продукт 12 г, выход: 72%.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.35 (s, 1H), 7.26 (s, 1H), 6.68 (s, 1H), 6.57 (s, 1H), 5.92 (s, 2H), 5.67 (q, J=8.1 Hz, 1H), 5.42 (s, 1H), 4.95 (t, J=8.1 Hz, 1H), 4.58 (m, 5H), 4.29 (m, 2H), 3.81 (m, 1H), 2.86 (m, 1H), 2.42 (br, 3H), 2.24 (m, 1H), 1.77 (m, 4H), 1.58-1.25 (m, 18H), 1.07 (m, 2H), 0.90 (m, 1H) 12r показал, что теоретическое значение ESI-MS (М+Н+): m/z - 770.3, фактически измеренное значение - 770.4.
Пример 55. Синтезирование соединения 12s.
По методу приготовления соединений в примерах 48-50, на основе соединения 10f (0.3 mmol) в качестве начального сырья, получен продукт 12s (32 mg) после ряда реакций. После контроля масс-спектральный анализ 12s показал, что теоретическое значение ESI-MS (M+H+): m/z - 770.3, фактически измеренное значение - 770.4.
Пример 56. Синтезирование соединения 12t.
По методу приготовления соединений в примерах 48-50, на основе соединения 10f (0.3 mmol) в качестве начального сырья, получен продукт 12t (41 mg) после ряда реакций. После контроля масс-спектральный анализ 12t показал, что теоретическое значение ESI-MS (M+H+): m/z - 770.3, фактически измеренное значение - 770.4.
Пример 57. Синтезирование соединения 12u.
По методу приготовления соединений в примерах 48-50, на основе соединения 10-Ref (0.3 mmol) в качестве начального сырья, получен продукт 12 u (52 mg) после ряда реакций. После контроля масс-спектральный анализ 12u показал, что теоретическое значение ESI-MS (M+H+): m/z - 810.3, фактически измеренное значение - 810.4.
Пример 58. Синтезирование соединения 12-Ref.
Растворяли соединение 11-Ref (0.18 mmol) в 10 mL безводного дихлорметана, добавляли EDCI (69.8 mg, 0.36 mmol, 2 eq.), перемешивали при комнатной температуре до полной реакции. После обработки реакционного раствора растворяли полученный твердый продукт после сгущения в 10 mL безводного дихлорэтана, добавляли DBU (61.0 mg, 0.40 mmol), RSO2NH2 (0.36 mmol, R = циклопропил), перемешивали и ждали сутки до полной реакции. Получен жесткий продукт 12-Ref (62 mg, выход: 53%) после обработки и быстрой колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.28-10.29 (d, 1H), 6.87-7.07 (m, 3H), 5.72-5.74 (m, 1H), 5.48 (br, 1H), 4.99-5.03 (m, 2H), 4.58-4.79 (m, 5H), 4.42 (m, 1H), 4.21 (m, 1H), 3.83-3.85 (m, 1H), 2.90-2.93 (m, 1H), 2.48-2.57 (m, 3H), 2.27-2.30 (m, 1H), 1.88-1.97 (m, 2H), 1.67-1.79 (m, 2H), 1.45-1.58 (m, 6H), 1.34-1.40 (m, 2H), 1.27 (s, 4H), 1.24 (s, 5H), 1.08-1.15 (m, 2H), 0.91-0.94 (m, 1H) 12-Ref показал, что теоретическое значение ESI-MS (M+H+): m/z - 732.3, фактически измеренное значение - 732.5.
Пример 59. Синтезирование соединения 15а.
Снимали защитную основу Boc из соединения 11f (3.0 mmol) в 50 мл 4N HCl/эфире, а затем в DCE (30 мл) в условиях безводного ацетата меди - реакция с фенилбороновой кислотой, получен продукт 15а (выход: 62%). После контроля, масс-спектральный анализ 15а показал, что теоретическое значение ESI-MS (М+Н+): m/z - 734.3, фактически измеренное значение - 734.3.
Пример 60. Синтезирование соединения 15b.
Снимали защитную основу Boc из соединения 12d (3.0 mmol) в 50 мл 4N HCl/эфире, а затем в DCE (30 мл) в условиях безводного ацетата меди - реакция с фенилбороновой кислотой, получен продукт 15b (выход: 53%). После контроля, масс-спектральный анализ 15b показал, что теоретическое значение ESI-MS (M+H+): m/z - 752.3, фактически измеренное значение - 752.3.
Пример 61. Синтезирование соединения 16а.
Снимали защитную основу Boc из соединения 12d (3.0 mmol) в 50 мл 4N HCl/эфире, а затем в DCE (30 мл) - реакция с хлорбензол-сульфонилом, получен продукт 16 а (выход: 81%). После контроля масс-спектральный анализ 16 а показал, что теоретическое значение ESI-MS (М+Н+): m/z - 832.2, фактически измеренное значение - 832.3.
Пример 62. Синтезирование соединения 16b.
Снимали защитную основу Boc из соединения 12d (3.0 mmol) в 50 мл 4N HCl/эфире, а затем в DCE (30 мл) - реакция с бензол-сульфонилом, получен продукт 16b (выход: 74%). После контроля масс-спектральный анализ 16b показал, что теоретическое значение ESI-MS (M+H+): m/z - 798.2, фактически измеренное значение - 798.3.
Пример 63. Синтезирование соединения 16с.
Снимали защитную основу Boc из соединения 12d (3.0 mmol) в 50 мл 4N HCl/эфире, а затем в DCE (30 мл) - реакция с метокси-бензол-сульфонилом, получен продукт 16с (выход: 79%). После контроля масс-спектральный анализ 16с показал, что теоретическое значение ESI-MS (M+H+): m/z - 828.2, фактически измеренное значение - 828.3.
Пример 64. Синтезирование соединения 17.
Добавляли соединения SM-11 (35 g), DMF (350 mL) в реакционной колбе (125 mL), охлаждали в ледовой воде, добавляли SM-12 (17 g), HATU (10.4 g).
Перемешивали 10 мин, добавляли DIEA (125 mL), естественно поднимали температуру до комнатной, реакция проводилась сутки. Понижали давления и концентрацию, получен пенообразный твердый продукт 17 (18.6 g) после обработки и быстрой колоночной хроматографией. После контроля масс-спектральный анализ 17 показал, что теоретическое значение ESI-MS (M+H+): m/z - 407.3, фактически измеренное значение - 407.5.
Пример 65. Синтезирование соединения 21а.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 16-47, начиная с промежуточного продукта 17 (1.0 mmol), получен продукт 21a (59 mg) после многоступенчатой очистки. После контроля масс-спектральный анализ 21а показал, что теоретическое значение ESI-MS (M+H+): m/z - 669.3, фактически измеренное значение - 669.4.
Пример 66. Синтезирование соединения 21b.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 16-47, начиная с промежуточного продукта 17 (1.0 mmol), получен продукт 21b (46 mg) после многоступенчатой очистки. После контроля масс-спектральный анализ 21b показал, что теоретическое значение ESI-MS (М+Н+): m/z - 683.3, фактически измеренное значение - 683.4.
Пример 67. Синтезирование соединения 21с.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 16-47, начиная с промежуточного продукта 17 (1.0 mmol), получен продукт 21с (49 mg) после многоступенчатой очистки. После контроля масс-спектральный анализ 21с показал, что теоретическое значение ESI-MS (М+Н+): m/z - 643.3, фактически измеренное значение - 643.4.
Пример 68. Синтезирование соединения 21d.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 16-47, начиная с промежуточного продукта 17 (1.0 mmol), получен продукт 21d (63 mg) после многоступенчатой очистки. После контроля масс-спектральный анализ 21d показал, что теоретическое значение ESI-MS (М+Н+): m/z - 683.3, фактически измеренное значение - 683.4.
Пример 69. Синтезирование соединения 21е.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 16-47, начиная с промежуточного продукта 17 (1.0 mmol), получен продукт 21е (63 mg) после многоступенчатой очистки.
После контроля масс-спектральный анализ 1H-NMR( 500 MHz, CDCl3): δ 10.60 (s, 1H), 7.10 (s, 1H), 6.61-6.74 (m,3H), 5.95 (s, 2H), 5.65-5.69 (m, 1H), 5.26-5.29 (m, 1H), 4.98-5.09 (m, 1H), 4.65-4.68 (m, 1H), 4.41-4.56 (m, 4H), 3.88-3.91 (m, 1H), 3.47-3.53 (m, 2H), 3.19-3.26 (m, 1H), 3.07 (s, 1H), 2.96-3.01 (m, 1H), 2.90 (s, 3H), 2.50-2.64 (m, 1H), 2.24-2.28 (m, 1H), 2.04-2.16 (m, 3H), 1.67-1.99 (m, 4H), 1.08-1.49 (m, 8H), 0.86-0.96 (m, 2H) 21е показал, что теоретическое значение ESI-MS (М+Н+): m/z - 657.3, фактически измеренное значение - 657.4.
Пример 70. Синтезирование соединения 21f.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 16-47, начиная с промежуточного продукта 17 (1.0 mmol), получен продукт 21f (63 mg) после многоступенчатой очистки.
После контроля масс-спектральный анализ 21f показал, что теоретическое значение ESI-MS (М+Н+): m/z - 669.3,, фактически измеренное значение - 669.5.
Пример 71. Синтезирование соединения 27а.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 7-47, начиная с промежуточного продукта SM-7 (5.0 mmol), получен продукт 27а (69 mg) после многоступенчатой очистки.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.71 (s, 1H), 6.66 (s, 1H), 5.97-5.98 (s, 2H), 5.70-5.73 (m, 1H), 5.31-5.37 (m, 1H), 5.13-5.17 (m, 1H), 4.83-4.86 (m, 1H), 4.51-4.62 (m, 4H), 3.80-3.83 (m, 1H), 3.78-3.79 (m, 1H), 3.52-3.54 (m, 1H), 3.06-3.09 (m, 1H), 2.90 (s, 3H), 2.48-2.49 (m, 1H), 2.23-2.35 (m, 2H), 2.00-2.08 (m, 4H), 1.63-1.72 (m, 2H), 1.38-1.51 (m, 8H), 1.80-1.82 (m, 3H) 27а показал, что теоретическое значение ESI-MS (M+H+): m/z - 658.3, фактически измеренное значение - 658.4.
Пример 72. Синтезирование соединения 27b.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 7-47, начиная с промежудочного продукта SM-7 (5.0 mmol), получен продукт 27b (83 mg) после многоступенчатой очистки.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 6.72-6.76 (m, 2H), 5.71-5.72 (m, 1H), 5.36-5.37 (m, 1H), 5.15-5.17 (m, 1H), 4.84-4.85 (m, 1H), 4.53-4.61 (m, 4H), 4.25 (s, 4H), 3.79-3.82 (m, 2H), 3.51-3.53 (m, 1H), 2.93-3.04 (m, 2H), 2.89 (s, 3H), 2.48-2.49 (m, 1H), 2.24-2.35 (m, 2H), 1.93-2.03 (m, 3H), 1.69-1.73 (m, 1H), 1.49-1.51 (m, 2H), 1.27-1.38 (m, 3H), 1.06-1.14 (m, 2H), 0.80-0.88 (m, 3H) 27b показал, что теоретическое значение ESI-MS (М+Н+): m/z - 672.3, фактически измеренное значение - 672.4.
Пример 73. Синтезирование соединения 27с.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 7-47, начиная с промежудочного продукта SM-7 (5.0 mmol), получен продукт 27с (57 mg) после многоступенчатой очистки. После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 630.3, фактически измеренное значение - 630.5.
Пример 74. Синтезирование соединения 27-Ref.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 7-47, начиная с промежуточного продукта SM-7 (5.0 mmol), получен продукт 27-Ref (89 mg) после многоступенчатой очистки.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 7.41-7.43 (m, 1H), 6.96-7.07 (m, 2H), 5.71-5.73 (m, 1H), 5.38-5.39 (m, 1H), 5.13-5.18 (m, 1H), 4.84-4.88 (m, 1H), 4.73-4.77 (m, 2H), 4.67-4.70 (m, 2H), 3.80-3.84 (m, 1H), 3.65-3.68 (m, 1H), 3.52-3.56 (m, 1H), 3.06-3.09 (m, 1H), 2.93-2.96 (m, 1H), 2.89 (s, 3H), 2.49-2.52 (m, 2H), 2.24-2.36 (m, 2H), 2.00-2.10 (m, 2H), 1.68-1.69 (m, 2H), 1.48-1.51 (m, 2H), 1.27-1.38 (m, 5H), 1.07-1.31 (m, 2H) 27-Ref показал, что теоретическое значение ESI-MS (M+H+): m/z - 632.3, фактически измеренное значение - 632.4.
Пример 75. Синтезирование соединения 27-Ref-2.
По методу приготовления соединений 12a-12h в вышеуказанных примерах 7-47, начиная с промежуточного продукта SM-7 (5.0 mmol), получен продукт 27-Ref-2 (61 mg) после многоступенчатой очистки.
После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 658.3, фактически измеренное значение - 658.4.
Пример 76. Синтезирование соединения 30а.
Добавляли соединения SM-13a (5.4 g, 10 mmol), сульфамид SM-8a (1.1 eq) и DMF (80 mL) в реакционную колбу 250 mL, добавляли связующий реагент EDCI (1.3 eq), проводится полная реакция при температуре 55°С. Получен сырой продукт 28а после обработки, затем снимали Boc раствором HCl-THF, ипосле очистки перекристаллизованием из гексан-этилацетата получен продукт 29а (3.7 g, выход 83%), который может непосредственно быть использован для дальнейшей реакции. После контроля масс-спектральный анализ 27-Ref-2 1H-NMR показал, что теоретическое значение ESI-MS (М+Н+): m/z - 533.2, фактически измеренное значение - 533.2.
В DMF (1.0 mL) под связующий реагент HATU (1.3 eq) соединение 29а (60 mg, 0.1 mmol) реагирует с производными кислоты SM-14a, получен продукт 30а (39 mg) после быстрой очистки колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.98 (s, 1H), 9.39 (m, 1H), 8.77 (m, 1H), 8.56 (m, 1H), 8.19 (d, J=9.0 Hz, 1H), 7.32 (s, 1H), 6.89 (m, 1H), 6.71 (s, 1H), 6.67 (s, 1H), 5.95-5.96 (d, J=5.1 Hz, 2H), 5.72-5.81 (m, 1H), 5.26-5.30 (m, 1H), 5.13-5.16 (m, 1H), 5.40 (s, 1H), 4.63-4.70 (m, 2H), 4.52-4.60 (m, 3H), 4.43-4.48 (m, 2H), 4.20-4.22 (d, J=1.8 Hz, 1H), 3.88-3.91 (m, 1H), 2.81-2.86 (m, 1H), 2.35-2.38 (m, 1H), 2.06-2.13 (m, 1H), 2.04 (s, 1H), 1.95 (m, 2H), 1.87 (m, 1H), 1.61-1.73 (m, 6H), 1.46-1.50 (m, 1H), 1.24-1.31 (m, 4H), 0.99-1.06 (m, 12H) 30а показал, что теоретическое значение ESI-MS (M+H+): m/z - 891.4, фактически измеренное значение - 891.5.
Пример 77. Синтезирование соединения 30b.
Метод синтезирования 30b тот же, как в примере 76, получен 46 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.99 (s, 1H), 9.39 (m, 1H), 8.76 (m, 1H), 8.55 (m, 1H), 8.19 (d, J=9.0 Hz, 1H), 7.24 (s, 1H), 6.87-6.89 (d, J=8.6 Hz, 1H), 6.72 (s, 1H), 6.67 (s, 1H), 5.95-5.96 (d, J=5.1 Hz, 2H), 5.40 (s, 1H), 4.64-4.70 (m, 2H), 4.53-4.59 (m, 3H), 4.44-4.49 (m, 2H), 4.18-4.20 (d, J=1.8 Hz, 1H), 3.86-3.89 (m, 1H), 2.96 (s, 1H), 2.88 (m, 1H), 2.04 (s, 1H), 1.95 (m, 2H), 1.85 (m, 1H), 1.53-1.73 (m, 9H), 1.17-1.35 (m, 6H), 0.96-1.03 (m, 12H) 30b показал, что теоретическое значение ESI-MS (M+H+): m/z - 893.4, фактически измеренное значение - 893.4.
Пример 78. Синтезирование соединения 30с.
Метод синтезирования 30с тот же, как в примере 76, получен 41 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.37 (s, 1H), 9.26 (s, 1H), 8.74 (m, 1H), 8.57 (m, 1H), 8.34-8.36 (m, 1H), 7.31-7.32 (m, 1H), 6.76 (m, 1H), 6.79 (m, 1H), 5.92 (m, 1H), 5.39 (s, 1H), 5.30-5.33 (m, 1H), 5.13-5.15 (m, 2H), 4.72-4.74 (m, 1H), 4.61 (m, 2H), 4.49 (m, 2H), 4.40-4.43 (m, 2H), 4.25 (m, 4H), 2.87 (m, 1H), 2.47 (m, 1H), 2.25 (m, 2H), 1.89 (m, 4H), 1.78-1.80 (m, 4H), 1.65-1.67 (m, 1H), 1.44-1.48 (m, 2H), 1.13-1.21 (m, 8H), 1.02 (s, 9H) 30с показал, что теоретическое значение ESI-MS (М+Н+): m/z - 905.4, фактически измеренное значение - 905.4.
Пример 79. Синтезирование соединения 30d.
Метод синтезирования 30d тот же, как в примере 76, получен 38 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR( CDCl3, 500 MHz): δ 10.38 (s, 1H), 9.27 (s, 1H), 8.74 (m, 1H), 8.57 (m, 1H), 8.34-8.36 (m, 1H), 7.30-7.32 (m, 1H), 6.82 (m, 1H), 6.64-6.71 (m, 1H), 5.90 (m, 1H), 5.39 (s, 1H), 5.30-5.32 (m, 1H), 5.13-5.15 (m, 2H), 4.73-4.75 (m, 1H), 4.64 (m, 2H), 4.46-4.52 (m, 2H), 4.37-4.39 (m, 2H), 4.27-4.29 (m, 4H), 2.88 (m, 1H), 2.46 (m, 1H), 2.23 (m, 2H), 1.87-1.90 (m, 6H), 1.78-1.80 (m, 4H), 1.65-1.67 (m, 1H), 1.43-1.49 (m, 2H), 1.14-1.231 (m, 6H), 1.03 (s, 9H) 30d показал, что теоретическое значение ESI-MS (M+H+): m/z - 905.4, фактически измеренное значение - 905.4.
Пример 80. Синтезирование соединения 30е.
Метод синтезирования 30е тот же, как в примере 76, получен 43 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.39 (s, 1H), 9.27 (s, 1H), 8.74 (m, 1H), 8.57 (m, 1H), 8.38 (m, 1H), 7.30-7.32 (m, 1H), 6.78 (m, 1H), 6.69-6.74 (m, 1H), 5.99 (s, 2H), 5.87-5.95 (m, 1H), 5.40 (s, 1H), 5.31-5.34 (m, 1H), 5.12-5.14 (m, 2H), 4.73-4.76 (m, 1H), 4.65-4.66 (m, 2H), 4.47-4.58 (m, ЗН), 4.37-4.42 (m, 1H), 2.88 (m, 1H), 2.47 (m, 1H), 2.24 (m, 2H), 1.89 (m, ЗН), 1.78-1.80 (m, 4H), 1.65-1.67 (m, 1H), 1.42-1.47 (m, 2H), 1.14-1.23 (m, 6H), 1.03 (s, 9H), 0.84-0.88 (m, 3H) 30е показал, что теоретическое значение ESI-MS (М+Н+): m/z - 891.4, фактически измеренное значение - 891.4.
Пример 81. Синтезирование соединения 30f.
Метод синтезирования 30f тот же, как в примере 76, получен 43 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR( CDCl3, 500 MHz): δ 9.97-9.99 (m, 1H), 9.40 (s, 1H), 8.76 (m, 1H), 8.55 (m, 1H), 8.19 (m, 1H), 7.32-7.35 (m, 1H), 7.00 (m, 1H), 6.65-6.77 (m, 2H), 5.92-5.97 (m, 2H), 5.41 (s, 1H), 4.47-4.76 (m, 7H), 4.21-4.26 (m, 1H), 3.88-3.90 (m, 1H), 2.84-2.91 (m, 1H), 2.33-2.40 (m, 2H), 2.21 (m, 3H), 1.83 (m, 1H), 1.55-1.65 (m, 9H), 1.12-1.42 (m, 6H), 0.96-1.03 (m, 13H) 30f показал, что теоретическое значение ESI-MS (M+H+): m/z - 893.4, фактически измеренное значение - 893.5.
Пример 82. Синтезирование соединения 30g.
Метод синтезирования 30g тот же, как в примере 76, получен 26 mg после ректификации.
После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 919.4, фактически измеренное значение - 919.4.
Пример 83. Синтезирование соединения 30h.
Метод синтезирования 30h тот же, как в примере 76, получен 43 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.99 (s, 1H), 9.38 (m, 1H), 8.76 (m, 1H), 8.56 (m, 1H), 8.15-8.17 (m, 1H), 7.10 (s, 1H), 6.89 (s, 1H), 6.84 (s, 1H), 6.73-6.75 (m, 2H), 5.40 (s, 1H), 4.62-4.72 (m, 2H), 4.52-4.60 (m, 3H), 4.41-4.46 (m, 2H), 4.16-4.21 (m,5H), 3.85-3.88 (m, 1H), 2.84-2.91 (m, 1H), 2.36-2.45 (m, 1H), 2.32-2.36 (m, 1H), 2.16-2.21 (m, 2H), 1.87 (m, 1H), 1.72-1.75 (m, 6H), 1.65-1.68 (m, 3H), 1.57-1.59 (m, 2H), 1.49-1.5 (m, 2H), 1.31-1.33 (m, 2H), 1.27 (m, 1H), 1.21-1.23 (m, 2H), 1.08-1.09 (m, 3H), 1.01 (s, 9H), 0.97-0.99 (m, 3H) 30h показал, что теоретическое значение ESI-MS (M+H+): m/z - 921.4, фактически измеренное значение - 921.4.
Пример 84. Синтезирование соединения 30j.
Метод синтезирования 30j тот же, как в примере 76, получен 43 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.98-10.02 (m, 1H), 9.40-9.41 (m, 1H), 8.75 (m, 1H), 8.52-8.55 (m, 1H), 8.18-8.21 (m, 1H), 7.09 (s, 1H), 6.89-6.92 (m, 1H), 6.79-6.81 (d, J=8.0 Hz, 1H), 6.74-6.75 (d, J=8.0 Hz, 1H), 5.42 (s, 1H), 4.67-4.76 (m, 2H), 4.54-4.61 (m, 3H), 4.42-4.49 (m, 2H), 4.24-4.26 (t, J=5.5 Hz, 2H), 4.16-4.20 (m, 3H), 3.87-3.93 (m, 1H), 2.84-2.91 (m, 1H), 2.40- 2.46 (m, 1H), 2.30-2.36 (m, 1H), 2.18-2.23 (m, 2H), 1.88 (m, 1H), 1.80 (m, 3H), 1.63-1.71 (m, 5H), 1.57-1.61 (m, 3H), 1.36-1.41 (m, 1H), 1.30 (m, 2H), 1.18-1.26 (m, 2H), 1.08-1.10 (m, 2H), 1.02-1.04 (m, 2H), 0.99 (s, 9H), 0.96-0.98 (m, 3H) 30j показал, что теоретическое значение ESI-MS (M+H+): m/z - 921.4, фактически измеренное значение - 921.4.
Пример 85. Синтезирование соединения 30k.
Метод синтезирования 30k тот же, как в примере 76, получен 42 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.36 (s, 1H), 9.27 (m, 1H), 8.74 (m, 1H), 8.57 (m, 1H), 8.34-8.37 (m, 1H), 7.30 (m, 1H), 7.08 (m, 1H), 6.98 (m, 2H), 5.92 (m, 1H), 5.41 (s, 1H), 5.30-5.33 (m, 1H), 5.13-5.15 (m, 2H), 4.75 (m, 3H), 4.65-4.68 (m, 1H), 4.59 (m, 1H), 4.47-4.51 (m, 1H), 4.38-4.42 (m, 1H), 2.87 (m, 1H), 2.49 (m, 1H), 2.37 (m, 1H), 2.23-2.26 (m, 1H), 1.89 (m, 1H), 1.79 (m, 4H), 1.67 (m, 2H), 1.42-1.45 (m, 2H), 1.26-1.31 (m, 4H), 1.14-1.19 (m, 4H), 1.01-1.06 (m, 12H) 30k показал, что теоретическое значение ESI-MS (М+Н+): m/z - 865.4, фактически измеренное значение - 865.6.
Пример 86. Синтезирование соединения 30m.
Метод синтезирования 30m тот же, как в примере 76, получен 43 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.02 (m, 1H), 7.20 (s, 1H), 6.71 (s, 1H), 6.64 (m, 2H), 5.95-5.97 (m, 2H), 5.38 (s, 1H), 4.82-4.83 (m, 1H), 4.62-4.69 (m, 2H), 4.45-4.51 (m, 4H), 4.17-4.20 (m, 1H), 3.83-3.85 (m, 2H), 2.93 (m, 1H), 2.48 (m, 1H), 2.29 (m, 1H), 1.89 (m, 1H), 1.63-1.72 (m, 5H), 1.53-1.60 (m, 5H), 1.49 (s, 9H), 1.34-1.37 (m, 3H), 1.16-1.21 (m, 2H), 1.04-1.06 (m, 4H), 1.00 (s, 9H), 0.97-0.99 (m, 3H) 30m показал, что теоретическое значение ESI-MS (М+Н+): m/z - 887.4, фактически измеренное значение - 887.4.
Пример 87. Синтезирование соединения 30n.
Метод синтезирования 30n тот же, как в примере 76, получен 43 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.10 (s, 1H), 7.39 (s, 1H), 6.94 (m, 1H), 6.68 (s, 1H), 6.61 (m, 1H), 5.96 (s, 2H), 5.42 (s, 1H), 5.25 (br, 1H), 4.52-4.64 (m, 4H), 4.42-4.49 (m, 2H), 4.17-4.19 (m, 1H), 3.88-3.89 (m, 1H), 3.65 (m, 1H), 2.94 (m, 1H), 2.90 (s, 1H), 2.36-2.41 (m, 2H), 1.93 (m, 1H), 1.73 (m, 3H), 1.58-1.64 (m, 6H), 1.35 (m, 2H), 1.19-1.26 (m, 5H), 1.03-1.06 (m, 3H), 1.03 (s, 9H), 0.98-0.99 (m, 3H) 30n показал, что теоретическое значение ESI-MS (М+Н+): m/z - 865.3, фактически измеренное значение - 865.4.
Пример 88. Синтезирование соединения 30р.
Метод синтезирования 30р тот же, как в примере 76, получен 33 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.24 (s, 1H), 8.65 (m, 1H), 8.08 (m, 1H), 8.01 (m, 1H), 7.9 (m, 1H), 7.67 (m, 1H), 7.58 (m, 1H), 7.48 (m, 1H), 7.40 (m, 1H), 6.68 (m, 1H), 6.62 (s, 1H), 6.44 (s, 1H), 5.86-5.91 (m, 2H), 5.63 (s, 1H), 5.40 (s, 1H), 4.44-4.62 (m, 4H), 4.37-4.40 (m, 2H), 3.99-4.01 (m, 1H), 3.83 (m, 1H), 3.26 (m, 1H), 2.96 (m, 1H), 2.46 (m, 1H), 2.35 (m, 1H), 1.86 (m, 1H), 1.56-1.65 (m, 4H), 1.46-1.48 (m, 4H), 1.39-1.42 (m, 4H), 1.09 (m, 3H), 0.99-1.02 (m, 4H), 0.84 (s, 9H), 0.72 (m, 3H) 30р показал, что теоретическое значение ESI-MS (М+Н+): m/z - 977.4, фактически измеренное значение - 977.4.
Пример 89. Синтезирование соединения 30q
Метод синтезирования 30q тот же, как в примере 76, получен 39 mg после ректификации. После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 891.4, фактически измеренное значение - 891.5.
Пример 90. Синтезирование соединения 30r.
Метод синтезирования 30r тот же, как в примере 76, получен 44 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.51 (s, 1H), 7.65-7.67 (d, J=7.4 Hz, 2H), 7.47-7.51 (m, 2H), 7.34-7.37 (t, J=7.8 Hz, 2H),, 6.98-6.99 (m, 1H), 6.54 (s, 1H), 6.30 (s, 1H), 5.87 (s, 1H), 5.81 (s, 2H), 5.45 (s, 1H), 4.55-4.63 (m, 3H), 4.46-4.49 (m, 1H), 4.19-4.26 (m, 2H), 4.05-4.07 (m, 1H), 3.85-3.87 (m, 1H), 3.18 (m, 1H), 2.96 (m, 1H), 2.68 (m, 1H), 2.42 (m, 1H), 1.84 (m, 1H), 1.65-1.67 (m, 2H), 1.51-1.55 (m, 9H), 1.25-1.37 (m, 5H), 1.08-1.13 (m, 5H), 0.99 (s, 9H), 0.85 (m, 3H) 30r показал, что теоретическое значение ESI-MS (М+Н+): m/z - 927.4, фактически измеренное значение - 927.4.
Пример 91. Синтезирование соединения 30s.
Метод синтезирования 30s тот же, как в примере 76, получен 37 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.52 (s, 1H), 8.10 (m, 1H), 7.84-7.88 (t, J=9.0 Hz, 2H), 7.76-7.78 (m, 1H), 7.66-7.67 (m, 1H), 7.59-7.62 (m, 1H), 7.51-7.54 (m, 1H), 6.98 (m, 1H), 6.49 (s, 1H), 6.24 (s, 1H), 5.88-5.91 (m, 2H), 5.72 (s, 1H), 5.49 (s, 1H), 5.41 (s, 1H), 4.59-4.66 (m, 3H), 4.49-4.51 (m, 1H), 4.19-4.24 (m, 2H), 4.03-4.05 (m, 1H), 3.85-3.87 (m, 1H), 3.25 (m, 1H), 2.98 (m, 1H), 2.68 (m, 1H), 2.45 (m, 1H), 1.87 (m, 1H), 1.64-1.66 (m, 2H), 1.50-1.59 (m, 8H), 1.30-1.36 (m, 4H), 0.99-1.05 (m, 5H), 0.94 (s, 9H), 0.88 (m, 3H) 30s показал, что теоретическое значение ESI-MS (M+H+): m/z - 977.4, фактически измеренное значение - 977.4.
Пример 92. Синтезирование соединения 30t.
Метод синтезирования 30t тот же, как в примере 76, получен 21 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.05 (m, 1H), 7.32 (s, 1H), 6.71 (m, 1H), 6.63 (m, 1H), 6.59 (m, 1H), 5.96 (m, 2H), 5.39 (s, 1H), 4.91 (m, 1H), 4.43-4.66 (m, 7H), 4.19 (m, 1H), 3.87-3.95 (m, 1H), 3.68-3.77 (m, 1H), 2.93 (m, 1H), 2.49 (m, 1H), 2.33 (m, 1H), 1.96 (s, 1H), 1.81 (m, 1H), 1.71 (m, 3H), 1.57-1.63 (m, 6H), 1.36 (m, 3H), 1.25 (s, 3H), 1.15 (s, 2H), 1.11 (s, 3H), 0.99-1.04 (m, 18H) 30t показал, что теоретическое значение ESI-MS (M+H+): m/z - 899.4, фактически измеренное значение - 899.4.
Пример 93. Синтезирование соединения 30v.
Метод синтезирования 30v тот же, как в примере 76, получен 45 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.04 (s, 1H), 7.23 (s, 1H), 6.72 (s, 1H), 6.64 (m, 2H), 5.96-5.97 (m, 2H), 5.38 (s, 1H), 4.97-4.98 (m, 1H), 4.59-4.69 (m, 2H), 4.47-4.52 (m, 4H), 4.18-4.20 (m, 1H), 3.94 (m, 1H), 3.84 (m, 1H), 2.94 (m, 1H), 2.47 (m, 1H), 2.33 (m, 1H), 1.87 (m, 1H), 1.66-1.69 (m, 5H), 1.56-1.58 (m, 5H), 1.36 (m, 3H), 1.22-1.27 (m, 3H), 1.17-1.19 (m, 2H), 1.14-1.16 (m, 2H), 1.03-1.08 (m, 4H), 1.00 (s, 9H), 0.97-0.98 (m, 3H) 30v показал, что теоретическое значение ESI-MS (M+H+): m/z - 859.4, фактически измеренное значение - 859.4.
Пример 94. Синтезирование соединения 30w.
Метод синтезирования 30w тот же, как в примере 76, получен 40 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.02 (m, 1H), 7.19 (s, 1H), 6.72 (s, 1H), 6.65 (m, 2H), 5.96-5.97 (m, 2H), 5.38 (s, 1H), 4.89 (m, 2H), 4.60-4.69 (m, 2H), 4.47-4.51 (m, 4H), 4.20-4.22 (m, 1H), 3.83-3.90 (m, 2H), 2.94 (m, 1H), 2.48 (m, 1H), 2.33 (m, 1H), 1.88 (m, 1H), 1.64-1.69 (m, 5H), 1.56-1.58 (m, 5H), 1.36-1.37 (m, 3H), 1.25 (s, 3H), 1.24 (s, 3H), 1.14-1.19 (m, 3H), 0.97-1.05 (m, 12H), 0.82-0.91 (m, 3H) 30w показал, что теоретическое значение ESI-MS (М+Н+): m/z - 873.4, фактически измеренное значение - 873.5.
Пример 95. Синтезирование соединения 30х.
Метод синтезирования ЗОх тот же, как в примере 76, получен 41 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.09 (s, 1H), 7.34 (br, 1H), 6.71 (s, 1H), 6.65 (m, 2H), 5.96-5.97 (m, 2H), 5.38 (s, 1H), 5.05 (m, 1H), 4.59-4.69 (m, 2H), 4.49-4.52 (m, 4H), 4.17-4.19 (m, 1H), 3.96 (m, 1H), 3.88 (m, 1H), 3.68 (s, 3H), 2.92 (m, 1H), 2.43 (m, 1H), 2.34 (m, 1H), 1.88 (m, 1H), 1.64-1.69 (m, 5H), 1.56-1.57 (m, 5H), 1.35 (m, 3H), 1.26 (m, 4H), 1.17-1.20 (m, 2H), 1.01 (s, 9H), 0.88-0.89 (m, 3H) 30x показал, что теоретическое значение ESI-MS (М+Н+): m/z - 845.4, фактически измеренное значение - 845.4.
Пример 96. Синтезирование соединения 30у.
Метод синтезирования 30у тот же, как в примере 76, получен 43 mg после ректификации.
После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (М+Н+): m/z - 921.4, фактически измеренное значение - 921.4.
Пример 97. Синтезирование соединения 30z.
Метод синтезирования 30z тот же, как в примере 76, получен 31 mg после ректификации.
После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 907.4, фактически измеренное значение - 907.5.
Пример 98. Синтезирование соединения 30аа.
Метод синтезирования 30аа тот же, как в примере 76, получен 31 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.00 (s, 1H), 7.76-7.78 (d, J=7.3 Hz, 2H), 7.58-7.62 (d, J=7.4 Hz, 2H), 7.38-7.42 (m, 2H), 7.30-7.34 (m, 2H), 7.03 (s, 1H), 6.69 (m, 2H), 6.65 (s, 1H), 5.93-5.96 (m, 2H), 5.38(s, 1H), 5.13-5.15 (m, 1H), 4.59-4.69 (m, 2H), 4.52 (s, 2H), 4.39-4.48 (m, 4H), 4.17-4.20 (m, 1H), 3.95 (m, 1H), 3.83-3.87 (m, 1H), 2.91 (m, 1H), 2.43 (m, 1H), 2.30 (m, 1H), 1.86 (s, 1H), 1.68-1.73 (m, 2H), 1.61-1.64 (m, 3H), 1.53-1.58 (m, 3H), 1.33-1.36 (m, 2H), 1.26-1.30 (m, 2H), 1.15-1.20 (m, 3H), 0.97-1.03 (m, 15H) 30aa показал, что теоретическое значение ESI-MS (M+H+): m/z - 1009.4, фактически измеренное значение - 1009.4.
Пример 99. Синтезирование соединения 30ab.
Метод синтезирования 30ab тот же, как в примере 76, получен 46 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.49 (brs, 1H), 7.40 (brs, 1H), 6.68 (s, 1H), 6.64 (m, 2H), 5.92-5.95 (m, 2H), 5.81 (brs, 1H), 5.43 (m, 1H), 5.28-5.30 (m, 1H), 5.11-5.19 (m, 1H), 4.87 (m, 1H), 4.55-4.64 (m, 3H), 4.25-4.51 (m, 3H), 4.19 (m, 1H), 3.92-4.04 (m, 2H), 2.83 (m, 1H), 2.28-2.39 (m, 2H), 2.20 (m, 1H), 1.98 (m, 1H), 1.67-1.81 (m, 3H), 1.41-1.62 (m, 5H), 1.30 (s, 9H), 1.12-1.26 (m, 3H), 1.07-1.09 (m, 3H), 1.03 (s, 9H), 0.86-0.99 (m, 3H) 30ab показал, что теоретическое значение ESI-MS (M+H+): m/z - 884.4, фактически измеренное значение - 884.5.
Пример 100.Синтезирование соединения 30ac.
Метод синтезирования 30ac тот же, как в примере 76, получен 42 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 7.35 (brs, 1H), 6.63-6.68 (m, 2H), 5.93-5.95 (m, 2H), 5.39 (m, 1H), 4.89 (m, 1H), 4.33-4.59 (m, 6H), 4.16 (m, 1H), 3.92-4.00 (m, 2H), 2.85 (m, 1H), 2.32-2.39 (m, 3H), 1.67-1.80 (m, 5H), 1.52-1.62 (m, 5H), 1.40-1.48 (m, 3H), 1.30 (s, 9H), 1.13-1.26 (m, 4H), 1.05-1.10 (m, 3H), 1.04 (s, 9H), 0.89-0.99 (m, 3H) 30ас показал, что теоретическое значение ESI-MS (M+H+): m/z - 886.4, фактически измеренное значение - 886.5.
Пример 101. Синтезирование соединения 30ad.
Метод синтезирования 30ad тот же, как в примере 76, получен 31 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.03 (m, 1H), 7.20 (s, 1H), 6.88 (s, 1H), 6.81 (s, 1H), 6.72 (m, 1H), 5.38 (m, 1H), 4.85 (m, 1H), 4.59-4.68 (m, 2H), 4.43-4.51 (m, 4H), 4.18-4.20 (m, 5H), 3.85 (m, 2H), 2.86-2.96 (m, 2H), 2.42 (m, 1H), 2.34 (m, 1H), 2.19 (m, 2H), 1.60-1.70 (m, 5H), 1.51-1.58 (m, 5H), 1.44 (s, 9H), 1.36-1.39 (m, 3H), 1.13-1.21 (m, 2H), 1.04-1.07 (m, 4H), 1.01 (s, 9H), 0.97-0.99 (m, 3H) 30ad показал, что теоретическое значение ESI-MS (M+H+): m/z - 915.5, фактически измеренное значение - 915.6.
Пример 102. Синтезирование соединения 30ae.
Метод синтезирования 30ae тот же, как в примере 76, получен 31mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.03 (m, 1H), 7.19 (s, 1H), 6.88 (s, 1H), 6.80 (s, 1H), 6.64 (m, 1H), 5.38 (m, 1H), 5.07 (m, 1H), 4.89 (m, 1H), 4.60-4.69 (m, 2H), 4.45-4.54 (m, 4H), 4.20 (m, 5H), 3.86 (m, 2H), 2.91-2.96 (m, 1H), 2.44-2.49 (m, 1H), 2.32-2.34 (m, 1H), 2.17-2.21 (m, 2H), 1.81-1.90 (m, 4H), 1.64-1.71 (m, 8H), 1.52-1.57 (m, 7H), 1.33-1.36 (m, 2H), 1.05-1.28 (m, 7H), 1.01 (s, 9H), 0.93-0.99 (m, 3H) 30ae показал, что теоретическое значение ESI-MS (M+H+): m/z - 927.5, фактически измеренное значение - 927.6.
Пример 103. Синтезирование соединения 30af.
Метод синтезирования 30af тот же, как в примере 76, получен 31 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.03 (s, 1H), 7.20 (s, 1H), 6.70 (s, 1H), 6.58 (s, 1H), 5.97 (s, 2H), 5.74 (m, 1H), 5.40 (br, 1H), 5.21-5.28 (m, 2H), 5.14-5.16 (m, 1H), 4.66 (m, 2H), 4.44-4.55 (m, 3H), 4.21-4.23 (m, 2H), 3.87 (m, 1H), 2.89 (m, 1H), 2.37 (m, 2H), 2.08 (m, 1H), 1.94 (m, 1H), 1.78 (m, 1H), 1.40-1.48 (m, 2H), 1.34 (s, 9H), 1.07 (m, 2H), 1.02 (s, 9H) 30af показал, что теоретическое значение ESI-MS (М+Н+): m/z - 746.3, фактически измеренное значение - 746.4.
Пример 104. Синтезирование соединения 30ag.
Метод синтезирования 30ag тот же, как в примере 76, получен 31 mg после ректификации.
После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 748.3, фактически измеренное значение - 748.4.
Пример 105. Синтезирование соединения 30ah.
Метод синтезирования 30ah тот же, как в примере 76, получен 31 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.02 (s, 1H), 7.16-7.18 (m, 1H), 6.76 (m, 1H), 6.62-6.72 (m, 1H), 5.98 (s, 1H), 5.97 (m, 1H), 5.76 (m, 1H), 5.41 (s, 1H), 5.29 (m, 1H), 5.21 (m, 1H), 5.14-5.16 (m, 1H), 4.66-4.69 (m, 2H), 4.53-4.58 (m, 2H), 4.46 (m, 1H), 4.20-4.25 (m, 2H), 3.85 (m, 1H), 2.92 (m, 1H), 2.37-2.43 (m, 2H), 2.08 (m, 1H), 1.96 (m, 1H), 1.71 (m, 1H), 1.44-1.48 (m, 2H), 1.30-1.33 (m, 9H), 1.04-1.05 (m, 2H), 1.02 (s, 9H) 30ah показал, что теоретическое значение ESI-MS (M+H+): m/z - 746.3, фактически измеренное значение - 746.4.
Пример 106. Синтезирование соединения 30aj.
Метод синтезирования 30aj тот же, как в примере 76, получен 23 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR 30aj показал, что теоретическое значение ESI-MS (M+H+): m/z - 720.3, фактически измеренное значение - 720.4.
Пример 107. Синтезирование соединения 30ak.
Метод синтезирования 30ak тот же, как в примере 76, получен 39 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.01 (s, 1H), 7.21 (s, 1H), 6.71 (s, 1H), 6.68 (s, 1H), 5.96 (m, 2H), 5.76 (m, 1H), 5.40 (s, 1H), 5.26-5.30 (m, 2H), 5.15-5.17 (m, 1H), 4.73 (br, 1H), 4.60-4.69 (m, 2H), 4.47-4.52 (m, 2H), 4.23 (m, 2H), 3.83 (m, 1H), 2.93 (m, 1H), 2.42 (m, 1H), 2.36 (m, 1H), 2.09 (m, 1H), 1.98 (m, 1H), 1.63-1.68 (m, 7H), 1.44-1.47 (m, 4H), 1.36 (m, 3H), 1.02 (s, 9H) 30ak показал, что теоретическое значение ESI-MS (M+H+): m/z - 758.3, фактически измеренное значение - 758.4.
Пример 108. Синтезирование соединения 30am.
Метод синтезирования 30 am тот же, как в примере 76, получен 40 mg после ректификации.
После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 760.3, фактически измеренное значение - 760.3.
Пример 109. Синтезирование соединения 30an.
Метод синтезирования 30an тот же, как в примере 76, получен 31 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.98 (s, 1H), 7.25 (s, 1H), 6.77 (m, 1H), 6.62-6.75 (m, 1H), 5.95 (m, 2H), 5.75 (m, 1H), 5.40 (s, 1H), 5.25-5.32 (m, 2H), 5.14-5.16 (m, 1H), 4.65-4.75 (m, 3H), 4.47-4.62 (m, 3H), 4.22-4.27 (m, 2H), 3.85 (m, 1H), 2.90 (m, 1H), 2.42 (m, 1H), 2.37 (m, 1H), 2.08 (m, 1H), 1.96 (m, 1H), 1.73 (m, 1H), 1.54-1.62 (m, 6H), 1.44 (m, 3H), 1.34 (m, 2H), 1.01-1.05 (m, 11H) 30an показал, что теоретическое значение ESI-MS (M+H+): m/z - 758.3, фактически измеренное значение - 758.4.
Пример 110. Синтезирование соединения 30ap.
Метод синтезирования 30ap тот же, как в примере 76, получен 23 mg после ректификации.
После контроля масс-спектральный анализ показал, что теоретическое значение ESI-MS (M+H+): m/z - 762.3, фактически измеренное значение - 762.4.
Пример 111. Синтезирование соединения 30aq.
Метод синтезирования 30aq тот же, как в примере 76, получен 39 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 10.08 (s, 1H), 7.18 (brs, 1H), 6.69 (s, 1H), 6.58 (s, 1H), 5.96 (s, 2H), 5.40 (m, 1H), 4.47-4.64 (m, 4H), 4.3-4.44 (m, 2H), 4.29-4.31 (m, 1H), 3.89 (m, 1H), 2.92 (m, 1H), 2.34 (m, 2H), 1.58-1.68 (m, 3H), 1.36-1.43 (m, 2H), 1.28-1.33 (m, 1H), 1.26 (s, 9H), 1.05-1.07 (m, 3H), 1.01 (s, 9H), 0.95-0.98 (t, J=7.5 Hz, 1H) 30aq показал, что теоретическое значение ESI-MS (М+Н+): m/z - 747.4, фактически измеренное значение - 747.5.
Пример 112. Синтезирование соединения 30ar.
Метод синтезирования 30ar тот же, как в примере 76, получен 33 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR(CDCl3, 500 MHz): δ 10.18 (s, 1H), 7.11 (brs, 1H), 6.71 (s, 1H), 6.60 (s, 1H), 5.97 (s, 2H), 5.80-5.88 (m, 1H), 5.25-5.27 (d, J=9.5 Hz, 1H), 5.14-5.16 (d, J=10.5 Hz, 1H), 4.57-4.67 (m, 3H), 4.45-4.50 (m, 1H), 4.36-4.37 (m, 2H), 4.25-4.29 (m, 1H), 3.89 (m, 1H), 2.92 (m, 1H), 2.34-2.41 (m, 2H), 2.08-2.13 (m, 1H), 1.96-1.98 (m, 1H), 1.51-1.54 (m, 1H), 1.30-1.39 (m, 3H), 1.26 (s, 9H), 1.14-1.23 (m, 2H), 1.05 (m, 1H), 1.02 (s, 9H) 30ar показал, что теоретическое значение ESI-MS (M+H+): m/z - 745.4, фактически измеренное значение - 745.5.
Пример 113. Синтезирование соединения 30-Ref.
Метод синтезирования 30-Ref тот же, как в примере 76, получен 37 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.99 (s, 1H), 7.28 (s, 1H), 7.07 (m, 1H), 6.96 (m, 2H), 5.75 (m, 1H), 5.41 (s, 1H), 5.26-5.31 (m, 2H), 5.15-5.17 (m, 1H), 4.63-4.85 (m, 5H), 4.50-4.53 (m, 1H), 4.29-4.32 (m, 1H), 4.22-4.24 (m, 1H), 3.83 (m, 1H), 2.91 (m, 1H), 2.42 (m, 1H), 2.38 (m, 1H), 2.09 (m, 1H), 1.94 (m, 1H), 1.60 (m, 4H), 1.51 (m, 3H), 1.44 (m, 3H), 1.35 (m, 2H), 1.01-1.05 (m, 11H) 30-Ref показал, что теоретическое значение ESI-MS (М+Н+): m/z - 732.3.фактически измеренное значение - 732.4.
Пример 114. Синтезирование соединения 33а.
Добавляли соединения SM-15a (5.4 g, 10 mmol), SM-16 (1.1 eq) и DMF (80 mL) в реакционную колбу 250 mL, добавляли связующий реагент EDCI (1.3 eq), проводится полная реакция при температуре 55°С. Получен сырой продукт 31а после обработки, затем снимали Boc раствором HCl-THF, и после очистки перекристаллизованием из гексан - этилацетата получен продукт 32а (3.9 g, выход 86%), который может непосредственно быть использован для дальнейшей реакции. После контроля масс-спектральный анализ 27-Ref-2 1H-NMR показал, что теоретическое значение ESI-MS (M+H+): m/z - 487.2, фактически измеренное значение - 487.2.
В DMF (1.0 mL) под связующий реагент HATU (1.3 eq) соединение 32а (60 mg, 0.1 mmol) реагирует с производными кислоты SM-14a, получен продукт 33a (41 mg) после быстрой очистки колоночной хроматографией.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.40 (s, 1H), 8.77 (s, 1H), 8.55 (s, 1H), 8.16-8.17 (m, 1H), 7.32-7.33 (m, 1H), 7.04 (m, 1H), 6.72 (s, 1H), 6.68 (s, 1H), 5.94-5.95 (m, 2H), 5.36 (m, 1H), 4.77-4.80 (m, 1H), 4.69-4.72 (m, 1H), 4.59-4.64 (m, 2H), 4.51-4.53 (m, 2H), 4.44-4.47 (m, 2H), 4.18-4.20 (m, 1H), 3.80-3.83 (m, 1H), 2.78 (m, 1H), 2.64 (m, 1H), 2.26 (m, 1H), 1.88-1.92 (m, 1H), 1.77-1.79 (m, 1H), 1.66-1.69 (m, 3H), 1.59-1.61 (m, 4H), 1.38-1.42 (m, 2H), 1.10-1.19 (m, 3H), 1.00-1.07 (m, 3H), 0.97-0.99 (m, 9H), 0.89-0.93 (m, 3H), 0.85-0.86 (m, 2H), 0.61 (m, 2H) 33а показал, что теоретическое значение ESI-MS (M+H+): m/z - 845.4, фактически измеренное значение - 845.4.
Пример 115. Синтезирование соединения 33b.
Метод синтезирования 33b тот же, как в примере 114, получен 41 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.39 (m, 1H), 8.77 (m, 1H), 8.57 (m, 1H), 8.33 (m, 1H), 7.75 (m, 1H), 6.76 (s, 2H), 6.69 (s, 1H), 6.62 (m, 1H), 6.06 (br, 1H), 5.70 (br, 1H), 4.86 (m, 1H), 4.54-4.66 (m, 3H), 4.44-4.51 (m, 2H), 4.25-4.41 (m, 1H), 4.25 (m, 4H), 4.09 (m, 1H), 2.82 (m, 1H), 2.58 (m, 1H), 2.22 (m, 1H), 1.97 (m, 2H), 2.19 (m, 2H), 1.78 (m, 4H), 1.68 (m, 2H), 1.25-1.29 (m, 6H), 1.05-1.16 (m, 4H), 1.05 (s, 9H), 0.84-0.85 (m, 2H), 0.76-0.79 (m, 3H) 33b показал, что теоретическое значение ESI-MS (M+H+): m/z - 859.4, фактически измеренное значение - 859.5.
Пример 116. Синтезирование соединения 33с.
Метод синтезирования 33c тот же, как в примере 114, получен 21 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.28 (s, 1H), 8.75 (s, 1H), 8.56 (m, 2H), 7.72 (m, 1H), 6.76-6.78 (m, 1H), 6.65-6.67 (m, 1H), 6.68 (s, 1H), 5.99 (m, 2H), 5.32 (s, 1H), 4.86 (m, 1H), 4.44-4.67 (m, 6H), 4.09 (m, 2H), 2.82 (m, 1H), 2.61 (m, 1H), 2.24 (m, 1H), 2.03 (m, 2H), 1.84-1.87 (m, 2H), 1.65-1.78 (m, 5H), 1.21-1.34 (m, 5H), 1.09-1.25 (m, 4H), 1.05-1.09 (m, 9H), 0.84-0.85 (m, 2H), 0.76 (m, 4H) 33 с показал, что теоретическое значение ESI-MS (М+Н+): m/z - 845.4, фактически измеренное значение - 845.4.
Пример 117. Синтезирование соединения 33d.
Метод синтезирования 33d тот же, как в примере 114, получен 22mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.28 (m, 1H), 8.76 (m, 1H), 8.56 (m, 2H), 7.77 (m, 1H), 6.80 (m, 1H), 6.76 (m, 1H), 6.65 (m, 1H), 6.60 (br, 1H), 4.47-4.69 (m, 6H), 4.26 (m, 4H), 4.09 (m, 1H), 2.83 (m, 1H), 2.59 (m, 1H), 2.22 (m, 1H), 1.85-1.87 (m, 2H), 1.62-1.72 (m, 8H), 1.26 (m, 6H), 1.05-1.19 (m, 4H), 1.01-1.05 (m, 9H), 0.85-0.86 (m, 2H), 0.76-0.79 (m, 3H) 33d показал, что теоретическое значение ESI-MS (М+Н+): m/z - 859.4, фактически измеренное значение - 859.5.
Пример 118. Синтезирование соединения 33-Ref.
Метод синтезирования 33-Ref тот же, как в примере 114, получен 28 mg после ректификации.
После контроля масс-спектральный анализ 1H-NMR (CDCl3, 500 MHz): δ 9.28 (m, 1H), 8.75 (s, 1H), 8.57 (m, 2H), 7.71 (m, 1H), 7.07 (m, 1H), 6.97-7.00 (m, 2H), 6.63 (m, 1H), 5.92 (m, 1H), 5.41 (s, 1H), 5.30-5.33 (m, 1H), 5.13-5.15 (m, 2H), 4.75 (m, 3H), 4.65-4.68 (m, 1H), 4.59 (m, 1H), 4.47-4.51 (m, 1H), 4.38-4.42 (m, 1H), 2.87 (m, 1H), 2.49 (m, 1H), 2.37 (m, 1H), 2.23-2.26 (m, 1H), 2.03 (m, 2H), 1.84-1.87 (m, 2H), 1.65-1.78 (m, 5H), 1.21-1.34 (m, 5H), 1.09-1.25 (m, 4H), 1.05-1.09 (m, 9H), 0.84-0.85 (m, 2H), 0.76 (m, 4H) 33-Ref показал, что теоретическое значение ESI-MS (М+Н+): m/z - 819.4, фактически измеренное значение - 819.4.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫСОКОЭФФЕКТИВНЫЕ МЕТАТЕЗИСТИЧЕСКИЕ КАТАЛИЗАТОРЫ, ВЫБИРАЕМЫЕ В РЕАКЦИЯХ ROMP И RCM | 2010 |
|
RU2546656C2 |
| ИНГИБИРУЮЩИЕ HCV ХИМИЧЕСКИЕ СОЕДИНЕНИЯ, ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРИМЕНЕНИЯ | 2014 |
|
RU2671194C2 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО ЦИАНОЕНОНА КАК МОДУЛЯТОРЫ KEAP1 | 2021 |
|
RU2822828C1 |
| ПРОИЗВОДНЫЕ БЕНЗИЛФЕНИЛЦИКЛОГЕКСАНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2505521C2 |
| СОЕДИНЕНИЯ ТИЕНИЛ[3, 2-d]ПИРИМИДИН-4-ОН, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624021C2 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2007 |
|
RU2456278C2 |
| ИЗОКСАЗОЛИНЫ И ИЗОКСАЗОЛЫ, СПОСОБ ПОДАВЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОДАВЛЯЮЩАЯ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 1994 |
|
RU2149871C1 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | 2016 |
|
RU2766543C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ SGLT2 | 2009 |
|
RU2530494C2 |
Изобретение относится к новым полигетероциклическим соединениям формул Iа или Ib, приведенных ниже, стереоизомерам, фармацевтически приемлемым солям или их смеси, где m=0,1 или 2; n=0,1 или 2; р=0,1 или 2; q=0,1 или 2; r=0, 1, 2 или 3;  означает одинарную связь или двойную связь; причем
означает одинарную связь или двойную связь; причем  означает двойную связь в макроциклическом внутреннем объединении с циклопропильным формилом;
означает двойную связь в макроциклическом внутреннем объединении с циклопропильным формилом; означает одинарную связь в цикле D, Е, Е1 и G, где D и G независимо означают кислород, Е и Е1 независимо означают С(Ra)(Rb); R10 означает водород; Ra, Rb и Rc независимо друг от друга означают водород; при r=0 Е отсутствует, D и Е1 непосредственно связаны; L означает метилен (CRbRc); Т означает азот (N) или СН; U означает углерод (С); W означает кислород; Х означает кислород; У означает азот (N) или СН; Z означает ОН; С1-С20 алкил-сульфониламидо, С3-С20-циклоалкил-сульфониламидо; R1 и R2 независимо означают С1-С20-алкил, С3-С20 циклоалкил, С6-С12 ариламин, C1-C20 алкоксикарбонил-амино, С2-С20 гетероциклическое сульфониламидное кольцо; R3, R4, R5, R6 - независимо означают Н; R7, R8 и R9 независимо означают Н. Соединения ингибируют репликацию протеазы NS3 вируса гепатита С.4 н. и 3 з.п. ф-лы, 1 табл.,11 ил., 118 пр.
означает одинарную связь в цикле D, Е, Е1 и G, где D и G независимо означают кислород, Е и Е1 независимо означают С(Ra)(Rb); R10 означает водород; Ra, Rb и Rc независимо друг от друга означают водород; при r=0 Е отсутствует, D и Е1 непосредственно связаны; L означает метилен (CRbRc); Т означает азот (N) или СН; U означает углерод (С); W означает кислород; Х означает кислород; У означает азот (N) или СН; Z означает ОН; С1-С20 алкил-сульфониламидо, С3-С20-циклоалкил-сульфониламидо; R1 и R2 независимо означают С1-С20-алкил, С3-С20 циклоалкил, С6-С12 ариламин, C1-C20 алкоксикарбонил-амино, С2-С20 гетероциклическое сульфониламидное кольцо; R3, R4, R5, R6 - независимо означают Н; R7, R8 и R9 независимо означают Н. Соединения ингибируют репликацию протеазы NS3 вируса гепатита С.4 н. и 3 з.п. ф-лы, 1 табл.,11 ил., 118 пр.


1. Полигетероциклические соединения структуры Ia или Ib,
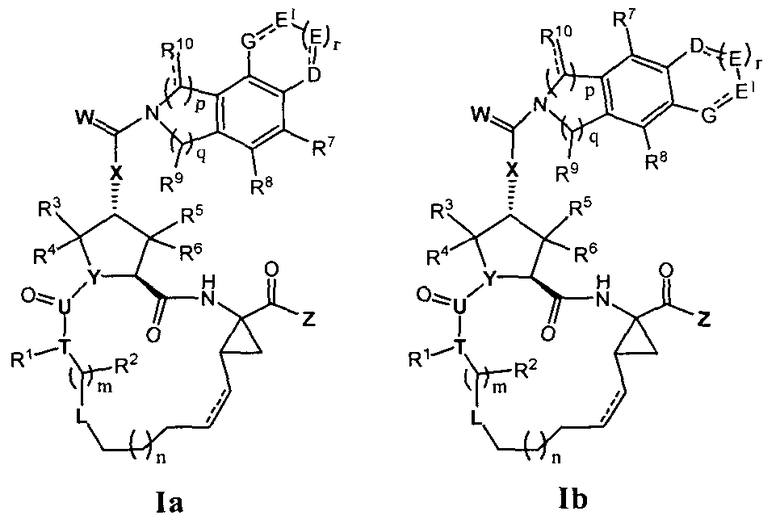
или стереоизомеры, фармацевтически приемлемые соли или их смеси, где: m=0,1 или 2; n=0,1 или 2; р=0,1 или 2; q=0,1 или 2; r=0, 1, 2 или 3;  означает одинарную связь или двойную связь;
означает одинарную связь или двойную связь;
причем  означает двойную связь в макроциклическом внутреннем объединении с циклопропильным формилом;
означает двойную связь в макроциклическом внутреннем объединении с циклопропильным формилом;
 означает одинарную связь в цикле D, Е, Е1 и G, где D и G независимо означают кислород, Е и Е1 независимо означают С(Ra)(Rb); R10 означает водород;
означает одинарную связь в цикле D, Е, Е1 и G, где D и G независимо означают кислород, Е и Е1 независимо означают С(Ra)(Rb); R10 означает водород;
Ra, Rb и Rc независимо друг от друга означают водород;
при r=0 Е отсутствует, D и Е1 непросредственно связаны;
L означает метилен (CRbRc);
Т - означает азот (N) или СН;
U - означает углерод (С);
W - означает кислород;
Х - означает кислород;
У - означает азот (N) или СН;
Z - означает гидрокси; С1-С20 алкил-сульфониламидо, С3-С20-циклоалкил-сульфониламидо;
R1 и R2 - независимо означают С1-С20-алкил, С3-С20 циклоалкил, С6-С12 ариламин, C1-C20 алкоксикарбонил-амино, С2-С20 гетероциклическое сульфониламидное кольцо;
R3, R4, R5, R6 - независимо означают водород и
R7, R8 и R9 - независимо означают водород.
2. Соединения по п.1, отличающиеся тем, что:
Z - означает гидрокси; C1-C20 алкил-сульфониламидо, С3-С20-циклоалкил-сульфониламидо;
R1 и R2 - независимо означают С1-С20-алкил, С3-С20 циклоалкил, С6-С12 ариламин, С1-С20 алкоксикарбонил-амино, С2-С20 гетероциклическое сульфониламидное кольцо.
3. Соединения по п.3, отличающиеся тем, что: m=1 или 2; n=1 или 2; p=1; q=1; r=0,1 или 2;  - означает одинарную или двойную связь;
- означает одинарную или двойную связь;  - означает двойную связь в макроциклическом внутреннем объединении с циклопропил-формилом;
- означает двойную связь в макроциклическом внутреннем объединении с циклопропил-формилом;  - означает одинарную связь в R10, и R10 означает водород (Н);
- означает одинарную связь в R10, и R10 означает водород (Н);  - означает одинарную связь в трехциклическом D, Е, Е1 и G и других циклических группах, где D и G - независимо означают кислород; Е и Е1 - независимо означают -СН2-;
- означает одинарную связь в трехциклическом D, Е, Е1 и G и других циклических группах, где D и G - независимо означают кислород; Е и Е1 - независимо означают -СН2-;
причем, при r=0, Е отсутствует, D и Е1 непосредственно связаны;
L - означает -СН2-;
Т - означает азот (N) или СН;
U - означает углерод (С);
W - означает кислород;
Х - означает кислород;
У - означает азот (N) или СН;
Z - означает гидрокси; C1-C20 алкил-сульфониламидо, С3-С20-циклоалкил-сульфониламидо;
R1 и R2 - независимо означают С1-С20-алкил, С3-С20 циклоалкил, C6-C12 ариламин, C1-С20 алкоксикарбонил-амино, С2-С20 гетероциклическое сульфониламидное кольцо;
R3, R4, R5 и R6 - независимо означают водород;
R7, R8 и R9 - независимо означают водород.
4. Соединения по п.1, отличающиеся тем, что соединения выбраны из группы, состоящей из:



5. Соединения, выбранные из группы, состоящей из 12r, 12s, 12t, 15b, 16a, 16с:
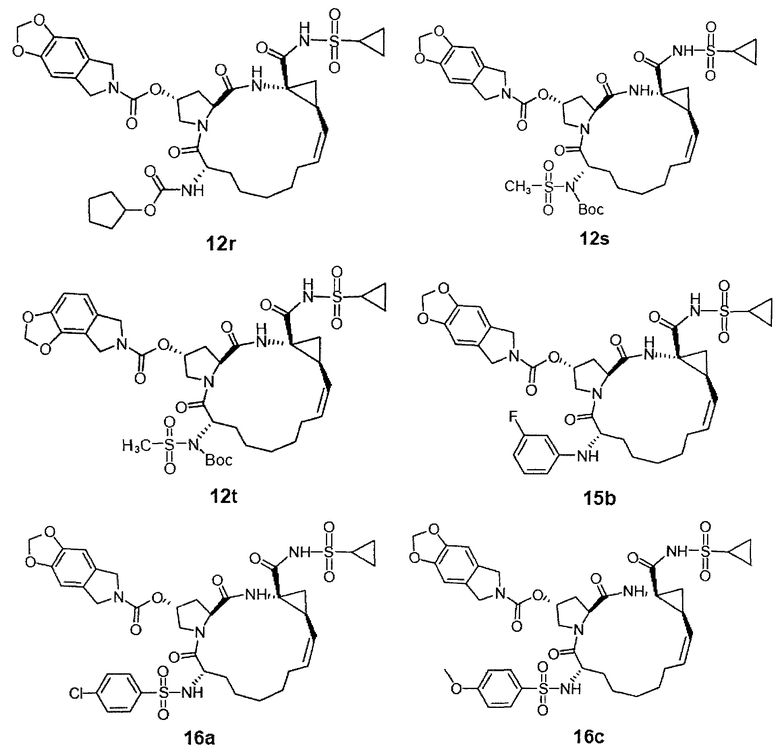
6. Фармацевтическая композиция, ингибирующая протеазу NS3 вируса гепатита С (HCV), включающая одно или несколько соединений по пп.1-6.
7. Способ ингибирования гепатита вируса С путем использования одного или более соединений по пп.1-5 в терапевтически эффективной дозе.
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2014-12-20—Публикация
2011-01-27—Подача