Изобретение относится к получению нанопорошков дисилицида церия и может быть использовано в получении функциональной керамики, обладающей рядом уникальных свойств, необходимых для изготовления токопроводящих и резистивных элементов интегральных схем.
Известен способ получения кристаллического силицида ниобия. Исходные порошки кремния 40-400 мкм и ниобия менее 63 мкм берут в соотношении 1,33-1,38:1 для получения однофазного продукта и 1,44-1,69:1 для получения многофазного продукта. Осуществляют механическую активацию в инертной среде в течение 0,5-2 минут. Отношение массы порошка к массе шаров равно 1:20. Полученный порошок прессуют и локально нагревают в атмосфере аргона, инициируя экзотермическую реакцию образования силицида ниобия в режиме самоподдерживающего горения. Техническим результатом является получение однофазного кристаллического силицида ниобия.
Известны способы получения силицидов редкоземельных металлов [Г.В. Самсонов Химия силицидов редкоземельных металлов. Успехи химии, 1982, Т.XXXI, Вып.12, стр.1478-1495]: а) непосредственное соединение редкоземельных металлов с кремнием [R. Vogel, Ztschr. anorg. Chem., 61, 46 (1909)]; б) восстановление оксидов редкоземельных металлов с кремнием [B.C. Нешпор, Г.В. Самсонов, ЖПХ, 33, 993 (1960)]; в) электролиз расплавленных сред, содержащих редкоземельные металлы и кремний [М. Dodero, C.r., 199, 566 (1934); Bull. Soc. Chim. France, 17, 545 (1950)].
Наиболее близким является высокотемпературный электрохимический синтез из расплавленных сред, содержащих редкоземельные металлы и кремний.
Недостатком вышеизложенного метода является высокая температура синтеза и загрязнение побочными продуктами, в частности силикатами, а также невозможность получения индивидуальной фазы дисилицида.
Задачей настоящего изобретения является получение наноразмерного порошка дисилицида церия, повышение скорости синтеза целевого продукта из расплавленного электролита.
Сущность изобретения заключается в том, что осуществляют совместное электровыделение церия и кремния из галогенидного расплава на катоде и последующее взаимодействие их на атомарном уровне с образованием наноразмерных порошков дисилицида церия. Процесс осуществляется в трехэлектродной кварцевой ячейке, где катодом служит вольфрамовый стержень; анодом и одновременно контейнером - стеклоуглеродный тигель; электродом сравнения - стеклоуглеродный стержень. Синтез дисилицида церия проводят посредством потенциостатического электролиза из эквимольного расплава KCl-NaCl, содержащего трихлорид церия и фторсиликат натрия в атмосфере очищенного и осушенного аргона. В качестве источника церия используют безводный трихлорид церия, в качестве источника кремния - фторсиликат натрия, в качестве растворителя - эквимольную смесь хлоридов калия и натрия при следующем соотношении компонентов, мас.%:
хлорид церия 1,0÷5,0;
фторсиликат натрия 1,0÷4,0;
остальное: эквимольная смесь хлоридов калия и натрия.
Потенциостатический электролиз проводят на вольфрамовом катоде при потенциалах от -2,2 до -2,6 B относительно стеклоуглеродного электрода сравнения при температуре 700°C. Оптимальная продолжительность ведения процесса электролиза составляет 60÷90 мин. Полученную катодно-солевую грушу, состоящую из дисилицида церия, отмывают от фторида церия фторидом калия.
Выбор компонентов электролитической ванны произведен на основании термодинамического анализа и кинетических измерений совместного электровыделения церия и кремния из галогенидных расплавов. Из соединений церия и кремния, не содержащих кислород, хлорид церия и фторсиликат натрия являются достаточно низкоплавкими и хорошо растворимыми в эквимольном расплаве KCl-NaCl. Растворитель (эквимольный расплав KCl-NaCl) выбран из следующих соображений: напряжение разложения расплавленной смеси KCl-NaCl больше такового для расплавов CeCl3 и Na2SiF6; хорошая растворимость в воде.
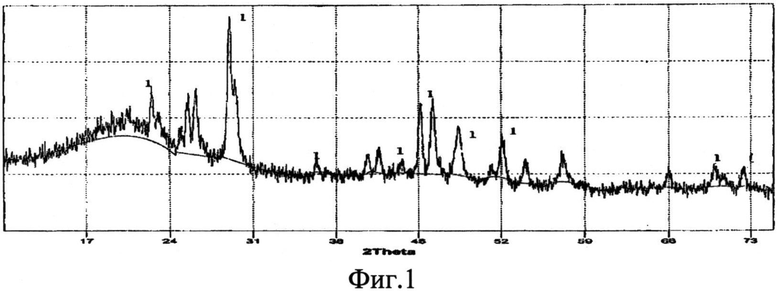
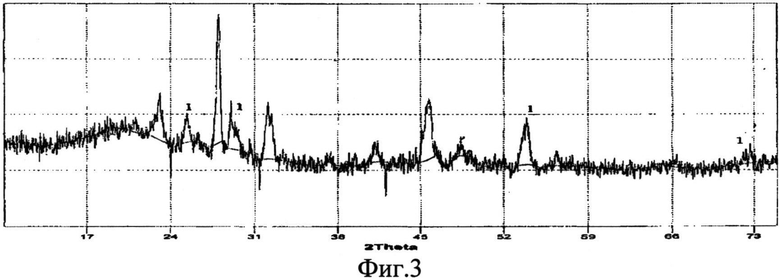
Фазовый состав идентифицирован методом рентгенофазового анализа на дифрактометре ДРОН-6, который показал наличие только фазы CeSi2. Изображения на фиг.1, 3, 5 соответствуют примерам 1, 2, 3.
Фиг.1 - Рентгенограмма порошка дисилицида церия CeSi2 (линия 1), полученного из расплава KCl-NaCl на вольфрамовом катоде при φ=-2,2 B.
Фиг.3 - Рентгенограмма порошка дисилицида церия CeSi2 (линия 1), полученного из расплава KCl-NaCl на вольфрамовом электроде при φ=-2,5 B.
Фиг.5 - Рентгенограмма порошка дисилицида церия CeSi2 (линия 1), полученного на вольфрамовом катоде при φ=-2,6 B.
Размер частиц определяли лазерным дифракционным анализатором Fritsch Analysette-22. Изображения на фиг.2, 4, 6 соответствуют примерам 1, 2, 3.
Фиг.2 - Диаграмма распределения по размерам частиц, полученных при 700°C электрохимическим синтезом при i=0,2 A/см2.
Фиг.4 - Диаграмма распределения по размерам частиц, полученных при 700°C электрохимическим синтезом при i=0,2 A/см2.
Фиг.6 - Диаграмма распределения по размерам частиц, полученных при 700°C электрохимическим синтезом при i=0,2 A/см2.
Пример 1
В стеклоуглеродный тигель объемом 40 мл помещают солевую смесь массой 32,66 г, содержащую 1,53 г CeCl3 (4,70 мас.%); 1,13 г Na2SiF6 (3,46 мас.%); 16,8 г KCl (51,44 мас.%); 13,2 г NaCl (40,42 мас.%). Тигель с солевой смесью помещают в кварцевую ячейку и в атмосфере сухого аргона выдерживают до температуры расплавления системы. По достижении рабочей температуры 700°C в расплав опускают вольфрамовый катод, электролиз проводят при потенциале -2,2 B относительно стеклоуглеродного электрода сравнения (плотность тока 0,2 А/см2). Катодно-солевую грушу, состоящую из дисилицида церия, отмывают от фторида церия фторидом калия. Размер частиц полученного порошка дисилицида церия до 100 нм.
Пример 2
В стеклоуглеродный тигель объемом 40 мл помещают солевую смесь массой 34,09 г, содержащую 1,53 г CeCl3 (4,49 мас.%); 2,56 г Na2SiF6 (7,51 мас.%); 16,8 г KCl (49,30 мас.%); 13,2 г NaCl (38,72 мас.%). Тигель с солевой смесью помещают в кварцевую ячейку и в атмосфере сухого аргона выдерживают до температуры расплавления системы. По достижении рабочей температуры 700°C в расплав опускают вольфрамовый катод, электролиз проводят при потенциале -2,5 B относительно стеклоуглеродного электрода сравнения (плотность тока 0,2 А/см2). Катодно-солевую грушу, состоящую из дисилицида церия, отмывают от фторида церия фторидом калия. Размер частиц полученного порошка дисилицида церия до 100 нм.
Пример 3
В стеклоуглеродный тигель объемом 40 мл помещают солевую смесь массой 42,83 г, содержащую 1,53 г CeCl3 (3,60 мас.%); 11,30 г Na2SiF6 (7,72 мас.%); 16,8 г KCl (49,79 мас.%); 13,2 г NaCl (26,39 мас.%). Тигель с солевой смесью помещают в кварцевую ячейку и в атмосфере сухого аргона выдерживают до температуры расплавления системы. По достижении рабочей температуры 700°C в расплав опускают вольфрамовый катод, электролиз проводят при потенциале -2,6 B относительно стеклоуглеродного электрода сравнения (плотность тока 0,2 А/см2). Катодно-солевую грушу, состоящую из дисилицида церия, отмывают от фторида церия фторидом калия. Размер частиц полученного порошка дисилицида церия до 100 нм.
Техническим результатом является:
- получение наноразмерных частиц дисилицида церия;
- получение целевого продукта в чистом виде за счет хорошей растворимости эквимольного расплава хлорида калия и хлорида натрия в воде, растворимости образующегося фторида церия фторидом калия.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО ПОРОШКА ГЕКСАБОРИДА ЦЕРИЯ | 2013 |
|
RU2540277C1 |
| Электролитический способ получения наноразмерных порошков силицидов лантана | 2015 |
|
RU2629184C2 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНЫХ ПОРОШКОВ ГЕКСАБОРИДА НЕОДИМА | 2008 |
|
RU2389684C2 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО ПОРОШКА ГЕКСАБОРИДА ГАДОЛИНИЯ | 2011 |
|
RU2466217C1 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО ПОРОШКА ГЕКСАБОРИДА ЛАНТАНА | 2011 |
|
RU2477340C2 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО ПОРОШКА ГЕКСАБОРИДА ДИСПРОЗИЯ | 2012 |
|
RU2510630C1 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО ПОРОШКА ГЕКСАБОРИДА ГАДОЛИНИЯ | 2012 |
|
RU2507314C1 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО ПОРОШКА ГЕКСАБОРИДА ЦЕРИЯ | 2011 |
|
RU2466090C1 |
| Электролитический способ получения наноразмерных порошков интерметаллидов лантана с кобальтом | 2015 |
|
RU2661481C2 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ГЕКСАБОРИДА ПРАЗЕОДИМА | 2008 |
|
RU2393115C2 |




Изобретение относится к получению нанопорошков дисилицида церия и может быть использовано для изготовления токопроводящих и резистивных элементов интегральных схем. Способ электролитического получения наноразмерного порошка дисилицида церия включает синтез дисилицида церия из расплавленных сред в атмосфере очищенного и осушенного аргона. Синтез проводят из галогенидного расплава. В качества источника церия используют безводный хлорид церия, в качестве источника кремния - фторсиликат натрия, а в качестве растворителя - эквимольную смесь хлоридов калия и натрия при следующем соотношении компонентов, мас.%: хлорид церия 1,0÷5,0, фторсиликат натрия 1,0÷4,0, остальное - эквимольная смесь хлоридов калия и натрия. Процесс ведут при температуре 700°С, плотности тока 0,2 А/см2 и потенциалах электролиза относительно стеклоуглеродного электрода сравнения от -2,2 до -2,6 B. Повышается скорость синтеза целевого продукта из расплавленного электролита. Получают целевой продукт в чистом виде за счет хорошей растворимости эквимольного расплава хлорида калия и хлорида натрия в воде и растворимости образующегося фторида церия фторидом калия. 6 ил., 1 пр.
Способ электролитического получения наноразмерного порошка дисилицида церия, включающий синтез дисилицида церия из расплавленных сред в атмосфере очищенного и осушенного аргона, отличающийся тем, что синтез проводят из галогенидного расплава, в качестве источника церия используют безводный хлорид церия, в качестве источника кремния - фторсиликат натрия, а в качестве растворителя - эквимольную смесь хлоридов калия и натрия при следующем соотношении компонентов, мас.%:
хлорид церия 1,0÷5,0;
фторсиликат натрия 1,0÷4,0;
остальное: эквимольная смесь хлоридов калия и натрия,
процесс ведут при температуре 700°С, плотности тока 0,2 А/см2 и потенциалах электролиза относительно стеклоуглеродного электрода сравнения от -2,2 до -2,6 B.
| DODERO M., Detail on the preparation of rare earth metal silicides by fused electrolysis, Bull.Soc.Chim, France, 1950, N17, с.545 | |||
| Способ получения дисперсного порошка ферросилиция | 1989 |
|
SU1740112A2 |
| US 20110303548 A1, 15.12.2011 | |||
| JP 48031198 A, 24.04.1973 | |||
Авторы
Даты
2015-01-20—Публикация
2013-09-27—Подача