Изобретение относится к области микробиологии и молекулярной генетики и может быть использовано в медицинской промышленности при производстве вакцин против Streptococcus agalactiae, т.е. стрептококков группы В (СГВ). В предлагаемом изобретении созданы рекомбинантная ДНК, рекомбинантная плазмидная ДНК, которые участвуют в получении нового штамма Escherichia coli - Е.coli M15 - продуцента рекомбинантного полипептида, вызывающего синтез антител, обладающих протективными свойствами против СГВ. Применение рекомбинантного полипептида в эксперименте в качестве вакцинного препарата дало положительный результат.
Борьба со стрептококковой инфекцией является актуальной проблемой. Стрептококки группы В представляют опасность, так как вызывают различные заболевания, особенно у новорожденных детей и у пожилых людей. Колонизация организма женщины штаммом СГВ может неблагоприятно повлиять на течение беременности, родов и развитие плода. СГВ представляют серьезную угрозу для новорожденных детей, обусловливая генерализованные формы инфекции с тяжелым клиническим течением болезни: менингит, сепсис и др.
В современной клинической практике широко используется лекарственная профилактика инфекций СГВ. В первую очередь это касается санирования беременных, являющихся носительницами инфекций, чтобы предотвратить возникновение инфекций у детей. Ввиду недостаточно отлаженной экспресс-диагностики возбудителей СГВ-инфекций существуют сложности в профилактике заболевания у беременных. Профилактика заболеваний у лиц пожилого возраста не проводится ни в России, ни за рубежом.
Одним из способов профилактики СГВ-инфекций является вакцинация населения. В настоящее время прошли клинические испытания конъюгированные полисахаридные вакцины. Серьезным недостатком вакцин на основе полисахаридов является то, что они относятся к Т-независимым антигенам, в результате чего иммунизация не вызывает формирования иммунологической памяти (Стрептококки группы B в патологии человека/ А.А.Тотолян, А.Н.Суворов, А.В.Дмитриев// Под общ. ред. А.А.Тотоляна. - СПб.: Человек, 2009. - 212 с.; ил.).
Известно, что идут разработки полипептидных рекомбинантных вакцин на основе различных поверхностных белков СГВ. Но данная группа вакцинных препаратов еще далека от стадии клинических испытаний (Стрептококки группы B в патологии человека/ А.А.Тотолян, А.Н.Суворов, А.В.Дмитриев// Под общ. ред. А.А.Тотоляна. - СПб.: Человек, 2009. - 212 с.; ил.).
В настоящее время не существует эффективной вакцины против стрептококков группы В, и создание белковой вакцины против стрептококков группы В является актуальной проблемой.
Прототипом изобретения является патент РФ №2378374, где в качестве антигена был выбран рекомбинантный полипептид С5а-пептидазы, но ген С5а-пептидазы встречается у всех штаммов стрептококков группы А и В, вне зависимости от степени их вирулентности, поэтому был произведен поиск другого полипептида, ген которого встречается только у наиболее вирулентных штаммов стрептококков группы В.
Задачей данного изобретения является получение иного по происхождению рекомбинантного полипептида, обладающего протективными свойствами против Streptococcus agalactiae, с целью использования его затем в качестве компонента противострептококковой вакцины. Создание штамма-продуцента такого рекомбинантного полипептида - необходимое условие в наработке вакцины.
Поиск белков, вероятных кандидатов в вакцинные, привел к идее использовать иной фактор вирулентности СГВ, нежели в аналогах.
При геномном анализе СГВ в штамме NEM316 был обнаружен ген gbs1356, sspB1, предположительно кодирующий поверхностный белок, относящийся к системе секреции V типа (Suvorov A.N., Ferretti J.J., J. Basic Microbiol, 2004, p.64-74). Система секреции V типа включает в себя группу белков, называемых автотранспортерами. Автотранспортеры выделяются (экспортируются) из цитоплазмы через Sec-систему с отщеплением сигнальной аминоконцевой последовательности. Некоторые из них могут оставаться заякоренными в клеточной стенке, другие же экспортируются непосредственно во внеклеточное пространство. Белок, кодируемый геном gbs1356, является потенциальным фактором вирулентности и встречается у вирулентных штаммов СГВ (Суворов А.Н., Савичева A.M. и др. Ж. акушерства и женских болезней, 2005, с.50-56).
Возможность использовать его в качестве компонента вакцины была опробована. Был получен рекомбинантный полипептид - результат заявляемого изобретения. Авторами он обозначен как StV.
Сущностью предлагаемого изобретения является создание уникальной рекомбинантной ДНК (обозначенной как stV), кодирующей рекомбинантный полипептид StV, обладающий свойствами, необходимыми для вакцины против СГВ. Рекомбинантная ДНК stV получена в результате полимеразной цепной реакции (ПЦР) с использованием хромосомной ДНК штамма 090R 1а серотипа СГВ и созданных уникальных праймеров for и rev с последующим клонированием с использованием экспрессионной плазмиды pQE-30 (The QIAexpress System, Qiagen, США). Также существенными признаками изобретения является создание рекомбинантной плазмидной ДНК PQE-stV, несущей рекомбинантную ДНК stV, и штамма-продуцента Escherichia coli M15-StV, позволяющего при определенных условиях экспрессировать рекомбинантный полипептид StV. Штамм внесен в коллекцию ФГБУ «НИИЭМ» СЗО РАМН под №242.
Для создания штамма-продуцента рекомбинантного полипептида StV был выбран штамм Е.coli M15 (The QIAexpress System, Qiagen, США). В результате его модификации с помощью плазмидной ДНК штамм приобрел новые свойства: способность экспрессировать рекомбинантный полипептид StV.
Фрагмент гена размером 3684 п.н., кодирующего полипептид StV штамма 090R Ia серотипа СГВ, обозначенный как stV, получен с помощью полимеразной цепной реакции с использованием праймеров for и rev и хромосомной ДНК штамма 090R Ia серотипа СГВ (фигура 1, таблица 1). Последовательность гена штамма 090R депонирована в GenBank NCBI с номером доступа JF436927.
Клонирование stV осуществлено с использованием экспрессионной плазмиды PQE-30 и последующей трансформацией полученной рекомбинантной плазмиды в гетерологическую систему E.coli M15. Созданный штамм-продуцент рекомбинантного полипептида StV обозначен как Е.coli M15 - StV. Клетки штамма Е.coli M15 - StV экспрессируют заданный рекомбинантный полипептид StV, который подвергают последующей одноступенчатой аффинной очистке с использованием 2 мл Ni-сефарозы (Amersham, США).
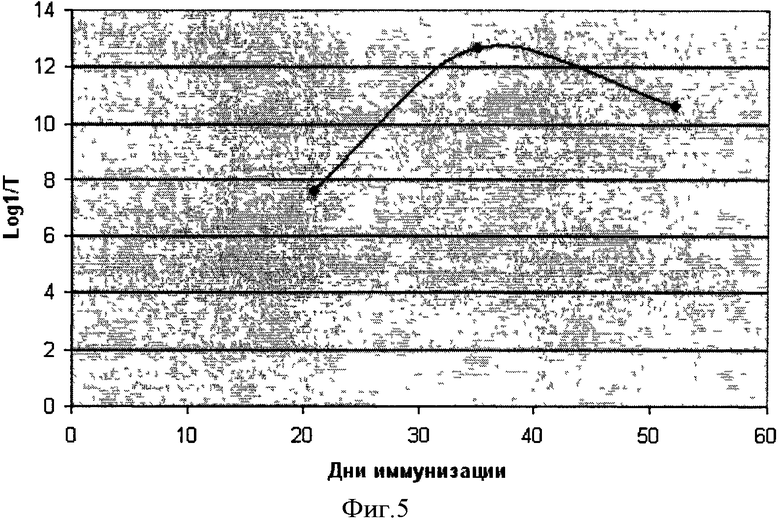
Исследуемый рекомбинантный StV-полипептид обладает выраженной иммуногенностью: при его подкожном введении млекопитающим (мышам и кроликам) развивается гуморальный иммунный ответ. На фигуре 5 представлена динамика изменения титра антител к рекомбинантному белку StV после иммунизации мышей. Максимальное значение титра антител к полипептиду StV наблюдалось на 40 день от начала иммунизации мышей и составляло 1,6·10-4, т.е. это достаточно высокий количественный показатель образования антител для элиминации стрептококков группы В.
Протективные свойства StV-специфических антител изучены в модельных экспериментах in vitro (опсонофагоцитарный тест) и in vivo (изучение динамики развития генерализованной СГВ инфекции у мышей, предварительно проиммунизированных рекомбинантным белком StV).
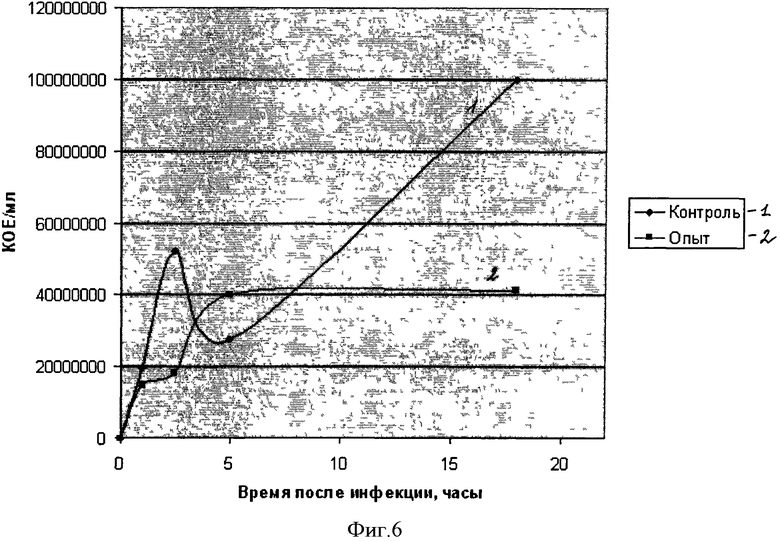
В опсонофагоцитарном тесте с использованием перитонеальных макрофагов мыши и СГВ показано, что предварительный контакт СГВ со специфической иммунной сывороткой усиливает процесс иммобилизации бактерий на поверхности макрофагов по сравнению с нормальной сывороткой. Результаты опсонофагоцитарного теста представлены в таблице 2. Кратность увеличения индекса инфицирования составила от 3,1 до 14,8 при обработке стрептококков иммунной кроличьей сывороткой по сравнению с индексом инфицирования при обработке стрептококков нормальной кроличьей сывороткой. Таким образом, установлено, что StV-специфические антитела способны опсонизировать стрептококки группы В, обеспечивая их ускоренную элиминацию, а следовательно, рекомбинантный полипептид StV как антиген выполняет роль вакцины. Был осуществлен контроль действия полипептида StV in vivo. На фигуре 6 «Динамика стрептококкового очага в селезенке мыши» показано содержание стрептококков в селезенке экспериментальных животных на различных этапах инфекционного процесса. Как видно из представленных данных, у неиммунизированных животных наблюдалось два пика максимального содержания стрептококков группы В: первый на 2.5 часов и второй к завершению эксперимента (18 часов). В случае иммунизированных белком StV животных наблюдалось плавное увеличение количества стрептококков к 5 часу эксперимента с последующей стабилизацией инфекционного процесса с тенденцией к постепенному снижению количества выявляемых стрептококков. Полученные данные указывают на то, что рекомбинантный полипептид StV способен стимулировать протективный гуморальный иммунный ответ.
Таким образом, в экспериментах по активной защите иммунных к StV мышей показано, что при внутрибрюшинном введении сублетальной дозы СГВ у иммунных мышей на ранних стадиях инфекции наблюдается ускоренное выведение инфекционного агента по сравнению с неиммунными животными.
Представленный новый рекомбинантный полипептид StV вызывает синтез StV-специфических антител, обладающих протективными свойствами против Streptococcus agalactiae. Рекомбинантный полипептид StV может быть полезен в качестве вакцинного компонента для профилактики и лечения бактериальной инфекции, вызванной Streptococcus agalactiae. Рекомбинантный полипептид StV может использоваться как в виде моновакцины, так и в качестве одной из составляющих частей многокомпонентной вакцины против Streptococcus agalactiae.
Пример 1. Клонирование
Для клонирования фрагмента гена stV использован метод ПЦР. Были сконструированы праймеры:
TCG GTA ССА AGG САА AGA CCG AAG GAA Т - for
AGG САА GCT ТСТ GAC ААА ТТТ ССС GTT CTG - rev
С помощью ПЦР, используя праймеры на матрице штамма 090R, был амплифицирован фрагмент ДНК.
Полимеразную цепную реакцию ставили по стандартной схеме, включающей общую денатурацию, отжиг праймеров и элонгацию фрагмента между праймерами.
Температурный профиль ПЦР был выбран следующий:
1) 94°С, 1 мин - общая денатурация ДНК
2) 94°С, 30 сек - денатурация ДНК
3) 60°С (610С), 1 мин - отжиг праймеров 30 циклов
4) 72°С, 1 мин - элонгация
5) 72°С, 1 мин - достройка
6) 4°С - хранение
Объем пробы для ПЦР составил 25 мкл. Состав смеси для ПЦР:
1) H2O - 16 мкл
2) Буфер с Mg2+ (5х) - 5 мкл
3) Прямой праймер - 0,5 мкл
4) Обратный праймер - 0,5 мкл
5) dNTP - 1 мкл
6) Taq-полимераза - 0,2 мкл
7) Исследуемая ДНК - 2 мкл.
Анализ ДНК в гель-электрофорезе показал, что размер амплификата составил 3684 н.п. Нуклеотидная последовательность представлена на фигуре 1. Амплифицированный фрагмент был выделен из геля набором «QIAquick Gel Extraction Kit» (Qiagen, США).
Для клонирования этого фрагмента был использован вектор PQE-30.
Вектор и амплифицированный фрагмент были рестрицированы ферментами KpnI и HindIII. Продукты рестрикции были разделены с помощью гель-электрофореза, а затем были выделены с помощью набора «QIAquick Gel Extraction Kit» (Qiagen, США). В ходе клонирования к 30 мкл фрагмента ДНК stV добавляли 2 мкл фрагмента ДНК PQE-30, полученных после очистки в соотношении концентраций 5:1, 5 мкл десятикратного лигазного буфера и 1 мкл лигазы фага Т4. Объем доводили дистиллированной водой до 50 мкл. Смесь инкубировали при 10°C в течение 12 часов. Затем провели кальциевую трансформацию культуры M15 E.coli:
В 20 мл BHI посеяли с чашки штамм E.coli M15, затем его инкубировали в течение ночи на шейкере при 37°С. На следующий день посеяли 1% E.coli на новую среду, прогретую при 37°С. Затем выращивали штамм при 37°С на шейкере до OD 0,2-0,4. Измерение проводили при длине волны 600 нм. Далее инкубировали во льду в течение 5 минут. Затем отцентрифугировали при 4°С в течение 10 минут на 5000 об/мин. Далее осадок растворили в 1/2 объема стерильного холодного 50 mM CaCl2, после чего инкубировали в течение 20 минут во льду. Затем отцентрифугировали при 4°С в течение 5 минут на 5000 об/мин. Осадок ресуспендировали в 50 mM CaCl2 в 1/10 объема к исходному объему среды.
Трансформацию проводили следующим образом:
- Опыт: 100 мкл клеток + 50 мкл лигазной смеси
- Положительный контроль: 100 мкл клеток + 2-3 мкл исходной плазмиды
- Отрицательный контроль: 100 мкл клеток
Затем инкубировали во льду в течение 40 минут. Далее инкубировали в термоблоке при 42°С в течение 2 минут. Затем инкубировали во льду в течение 5 минут. Добавили 1 мл стерильной среды. Инкубировали в течение часа при 37°С. Затем отцентрифугировали, отобрали 700-900 мкл, а осадок ресуспендировали. Посеяли по 100 мкл клеток на среду, содержащую ампициллин (Ар) (100 мкг/мл) и канамицин (Km) (25 мкг/мл).
Было получено 30 клонов, устойчивых к ампициллину и канамицину.
С целью выявления клонов, в которых плазмидная ДНК содержит вставочный фрагмент ДНК размером 3684 н.п., из 16 клонов были выделены плазмиды. Анализ в гель-электрофорезе (фигура 4) показал, что плазмиды 10 и 13 содержат вставку гена stV.
При проверке клонов на способность экспрессировать полипептид StV установлено, что такой способностью обладают клоны Е.coli M15 - StV.
Пример 2. Очистка рекомбинантного полипептида
Культуру штамма Е.coli M15 - StV культивировали в 800 мл жидкой среды BHI (Brain Heart Infusion Broth, Gibco, США) с добавлением антибиотиков (ампициллин (100 мкг/мл) и канамицин (25 мкг/мл)) до поздней логарифмической фазы роста (OD600=0,7-0,9). Экспрессия рекомбинантного полипептида была индуцирована добавлением изопропил-бета-D-тиогалактопиранозида (IPTG). Клетки культивировали в течение 4 часов. Затем клетки осаждали центрифугированием, отмывали лизирующим буфером А (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, 20 мМ имидазола, рН 8,0) и суспендировали в том же буфере в 4 мл, добавляя ингибитор протеаз, фенилметилсульфонилфторид (ФМСФ), до концентрации 1 мМ. Для лизирования клеток была использована трехкратная ультразвуковая обработка при 4°С в течение 20 сек с перерывом в 40 сек в ультразвуковом дезинтеграторе (УЗДН-1У4.2, Англия). Лизат клеток центрифугировали при 20000 об/мин и 4°С в течение 20 мин. Надосадочную жидкость пропускали через 0,45 мкм фильтр (Millipore, США) и затем ее наносили на колонку с 2 мл Ni-сефарозой (Qiagen, США), предварительно уравновешенную буфером А. Далее колонку промывали тем же буфером до тех пор, пока значения OD при длине волны 280 выходящего раствора не были больше, чем 0,01, т.е. пока не начал вымываться полипептид. Полипептид элюировали раствором буфера Б (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, 250 мМ имидазола, рН 8,0). Элюат собирали по фракциям по 500 мкл и измеряли в них значения OD280. Фракции с наибольшими значениями OD280 объединяли и диализовали против дистиллированной воды в течение 12 часов.
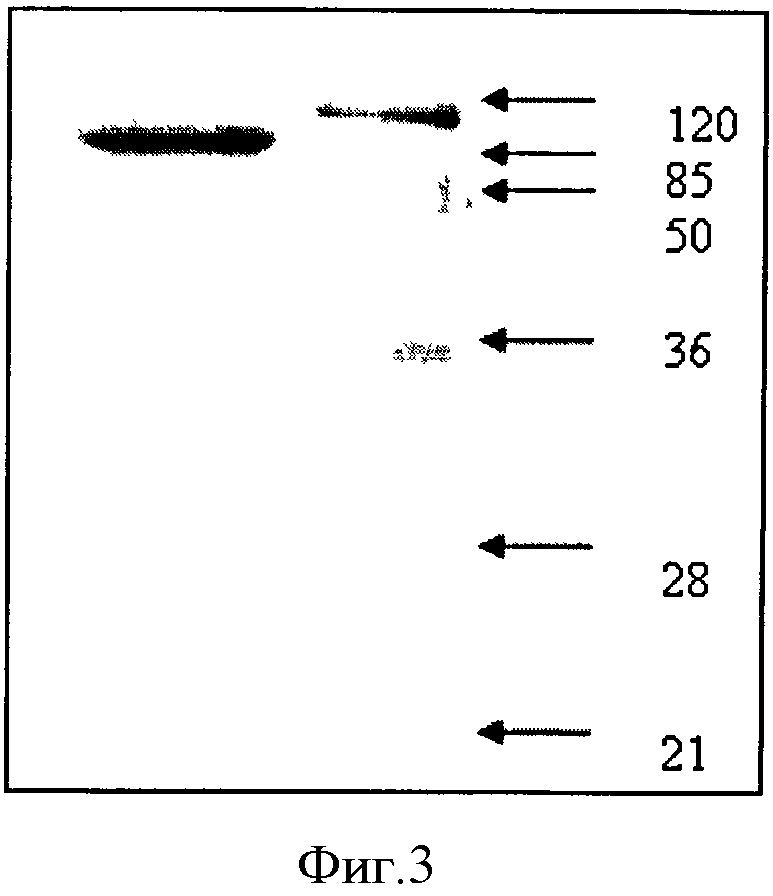
Молекулярную массу StV определяли с помощью 12% SDS-PAGE, сравнивая пробег полипептида StV с пробегом белков известной молекулярной массы. Молекулярная масса рекомбинантного полипептида StV оказалась примерно равной 130 кДа (фигура 3).
Таким образом, рекомбинантный полипептид StV содержит аминокислотную последовательность поверхностного полипептида, кодируемого геном штамма 090R Ia серотипа СГВ.
Полипептид с указанной последовательностью ковалентно связан с шестнадцатью аминокислотными остатками, кодируемыми PQE-30. Полученная аминокислотная последовательность StV полипептида состоит из 1228 аминокислотных остатков (фигура 2).
Пример 3. Динамика изменения уровня StV-специфических IgG в крови экспериментальных животных после иммунизации.
Гуморальный иммунный ответ к рекомбинантному белку StV изучали на беспородных белых мышах (самцах массой 16-18 г) и кроликах (самках массой 2,5 кг). Иммунизацию мышей проводили двукратно и подкожно с адъювантом гидроокиси алюминия. Мышам двукратно вводили 0,2 мл StV с адъювантом в соотношении объемов 1:1. Концентрация полипептида StV составляла 20 мкг на мышь.
Иммунизацию кроликов проводили двукратно и подкожно с полным адъювантом Фройнда. Кроликам дважды вводили подкожно по 0,5 мл StV с адъювантом в соотношении объемов 1:1. Концентрация полипептида составляла 100 мкг на кролика.
StV-специфические IgG определяли с помощью метода иммуноферментного анализа (ИФА). В лунки полистиролового планшета с высокой сорбционной емкостью (Costar, США) вносили по 100 мкл рекомбинантного полипептида StV в концентрации 2 мкг/мл. Сорбцию проводили в 100 мМ бикарбонатном буфере (рН=9,45) в течение 16-20 часов при 4°С. Затем из планшета удаляли содержимое и добавляли в лунки по 150 мкл забуференного физиологического раствора, рН=7,4 (PBS), содержащего 0,05% Твин-20 (PBST). Инкубацию проводили при 37°С в течение 30 мин. Содержимое планшета удаляли и трижды промывали PBST. Затем в лунки планшета вносили иммунную или нормальную (в качестве отрицательного контроля) сыворотку (с начальным разведением 1:100) с последующим шагом разведения, равным двум. Все разведения осуществляли в PBST и каждую пробу дублировали. Инкубацию проводили в течение 1 часа при 37°С. Далее содержимое планшета удаляли и дважды промывали планшет PBST. После этого в лунки добавляли по 100 мкл А-ПХ конъюгата (белок А стафилококка, ковалентно связанный с пероксидазой хрена) в концентрации 10-7 моль/л. После часовой инкубации при 37°С содержимое планшета удаляли и трижды отмывали планшет PBST и один раз PBS, чтобы избежать ингибирующего действия Твин-20 на ферментативную активность пероксидазы. Далее для визуализации реакции в лунки планшета вносили по 100 мкл субстратной смеси (0,5 мкг/мл о-фенилендиамин в 150 мМ фосфатно-цитратном буфере (рН=5,0), 10 мкл 30% перекиси водорода), которую готовили непосредственно перед применением. Планшет инкубировали в течение 30 мин в темноте при комнатной температуре и реакцию останавливали внесением в лунки по 30 мкл 50% концентрированной серной кислоты. Реакцию регистрировали при длине волны 492 нм с помощью прибора Titertek Multiskan (США).
Титр специфических антител определяли на разных сроках от начала иммунизации. Полученные результаты, представленные на фигуре 5 «Динамика изменения титра антител к рекомбинантному белку StV после иммунизации мышей», иллюстрируют развитие гуморального иммунного ответа на введение рекомбинантного полипептида StV. В представленном эксперименте видно, что образование иммуноглобулиов класса G начинается с 20 дня эксперимента, а максимальное значение титра антител к белку StV наблюдалось на 40 день от начала иммунизации мышей и составляло - 1,6·10-4. В последующем наблюдалось плавное снижение титра содержания антител к 60 дню. Общая продолжительность циркулирования антител в крови наблюдаемых животных достигала 6 месяцев.
Пример 4. Изучение протективных свойств StV-специфических антител на модели СГВ инфекции у мышей.
Протективная эффективность StV-специфических антител in vivo была изучена на «мышиной» модели генерализованной инфекции. Известно, что в этих условиях ведущим защитным механизмом является опсонофагоцитарная реакция.
В экспериментах in vivo лабораторным мышам вводили подкожно полипептид StV по схеме иммунизации, приведенной в примере 3. На пике иммунного ответа (40-й день от начала иммунизации) экспериментальной и контрольной группам мышей внутрибрюшинно вводили суспензию СГВ в сублетальной дозе (LD50=2,7×107 КОЕ/мл). Контроль развития инфекции осуществляли с помощью высева стрептококков из селезеночной суспензии мышей на среду с кровяным агаром на разных сроках после введения СГВ. На фигуре 6 «Динамика стрептококкового очага в селезенке мыши» показано содержание стрептококков в селезенке экспериментальных животных на различных этапах инфекционного процесса.
Пример 5. Изучение опсонизирующей эффективности кроличьих анти- StV антител.
Основной защитный механизм макроорганизма от бактериальной инфекции - это процесс фагоцитоза, опосредованного специфическими антителами (опсонофагоцитоз). Опсонизирующую активность кроличьих анти-StV антител в составе гипериммунной сыворотки изучали на монослое мышиных перитонеальных макрофагов. Макрофаги индуцировали за двое суток до получения перитонеального экссудата введением мышам 0,5 мл 10% пептона внутрибрюшинно. Перитонеальный экссудат от 4-5 мышей смывали питательной средой IMDM (Iscove's Modified Dulbecco's Media, БиолоТ, Россия), клетки отмывали, суспендировали в концентрации 1 млн/мл и высевали в объеме 0,2 мл на 96-луночные платы для культуры тканей, в объеме 1,0 мл на 24-луночные платы для культуры тканей, содержащие покровные стекла (Sarstedt, Германия). Через 1 час инкубации неприкрепившиеся клетки отмывали и макрофаги продолжали культивировать в среде IMDM с 10% ЭТС (эмбриональная телячья сыворотка, БиолоТ, Россия) в присутствии стрептомицина (100 мкг/мл) и пенициллина (100 ЕД/мл). Через сутки монослой отмывали от антибиотиков и вносили суспензию СГВ в среде IMDM, в концентрации 1×107 КОЕ/мл. Бактерии предварительно инкубировали в течение 30 минут с нормальной и иммунной кроличьей сывороткой, разведенной в 50 раз, в среде IMDM. Контакт бактерий с макрофагами продолжался 30 мин, после чего монослой тщательно отмывали от не прикрепившихся к поверхности клеток стрептококков. Все описанные выше этапы проводились при 37°С в атмосфере 5% CO2. Далее препараты фиксировали 30 мин абсолютным спиртом и последовательно окрашивали азидом и азуром в течение 30 мин. Монослой тщательно отмывали от остатков краски. При микроскопии на покровных стеклах исследовали не менее 100 клеток в трех параллельных пробах, подсчитывая процентную долю макрофагов, инфицированных стрептококками, и среднее число кокков на одну клетку. Степень инфицированности оценивали по фагоцитарному индексу (ФИ), который представляет собой произведение обоих показателей.
Результаты опсонофагоцитарного теста представлены в таблице 2. Кратность увеличения индекса инфицирования составила от 3,1 до 14,8 при обработке стрептококков иммунной кроличьей сывороткой по сравнению с индексом инфицирования при обработке стрептококков нормальной кроличьей сывороткой, что свидетельствует о протективности анти-StV антител в отношении СГВ. Штамм 7 содержит ген sspB1, а штаммы 60/59 и 5/70 - нет, что указывает на важность наличия гена sspB1 для процесса опсонизации стрептококков группы В. Представленные данные доказывают, что StV-специфические антитела способны опсонизировать стрептококки группы В, обеспечивая их ускоренную элиминацию.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ДНК, ОБЕСПЕЧИВАЮЩАЯ ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО БЕЛКА PB1, ОБЛАДАЮЩЕГО ПРОТЕКТИВНЫМИ СВОЙСТВАМИ В ОТНОШЕНИИ STREPTOCOCCUS PYOGENES И STREPTOCOCCUS AGALACTIAE | 2008 |
|
RU2378374C2 |
| КОМПЛЕКС РЕКОМБИНАНТНЫХ ПОЛИПЕПТИДОВ, ОБЛАДАЮЩИЙ ПРОТЕКТИВНЫМИ СВОЙСТВАМИ В ОТНОШЕНИИ STREPTOCOCCUS AGALACTIAE И STREPTOCOCCUS PYOGENES | 2014 |
|
RU2587627C2 |
| РЕКОМБИНАНТНЫЕ ДНК, ОБЕСПЕЧИВАЮЩИЕ ПОЛУЧЕНИЕ ПОЛИПЕПТИДОВ Р6, Р7, Р8, ОБЛАДАЮЩИХ ПРОТЕКТИВНЫМИ СВОЙСТВАМИ В ОТНОШЕНИИ STREPTOCOCCUS AGALACTIAE И СЕЛЕКТИВНО-СВЯЗЫВАЮЩИХ IgA | 2008 |
|
RU2387715C2 |
| СПОСОБ ВВЕДЕНИЯ ГЕНОВ ПАТОГЕННЫХ СТРЕПТОКОККОВ В ХРОМОСОМНУЮ ДНК ПРОБИОТИЧЕСКОГО ШТАММА ENTEROCOCCUS FAECIUM L3 ДЛЯ ЭКСПРЕССИИ В ПИЛЯХ | 2015 |
|
RU2640250C2 |
| Рекомбинантная ДНК, обеспечивающая получение рекомбинантного белка Cov1, обладающего иммуногенными свойствами в отношении вируса SARS-CoV-2 | 2021 |
|
RU2776484C1 |
| Химерный рекомбинантный белок, обладающий протективными свойствами в отношении Streptococcus pyogenes | 2016 |
|
RU2685957C2 |
| Рекомбинантные ДНК pG4223 и плазмидная ДНК pQE 30-pG4223, штамм Escherichia coli M 15-G4223, обеспечивающие получение полипептида G4223, селективно связывающего IgG, и его применение в аффинной хроматографии для выделения IgG | 2017 |
|
RU2715672C2 |
| Живая вакцина на основе штамма пробиотиков ENTEROCOCCUS FAECIUM L3 для профилактики инфекции, вызванной STREPTOCOCCUS PNEUMONIE | 2018 |
|
RU2701733C1 |
| РЕКОМБИНАНТНАЯ ВАКЦИНА ПРОТИВ ВИРУСА "СВИНОГО" ГРИППА H1N1 И СПСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2451027C2 |
| Способ создания рекомбинантного штамма энтерококка L3-SARSN1 на основе биологически активного штамма Enterococcus faecium L3 | 2022 |
|
RU2820058C1 |

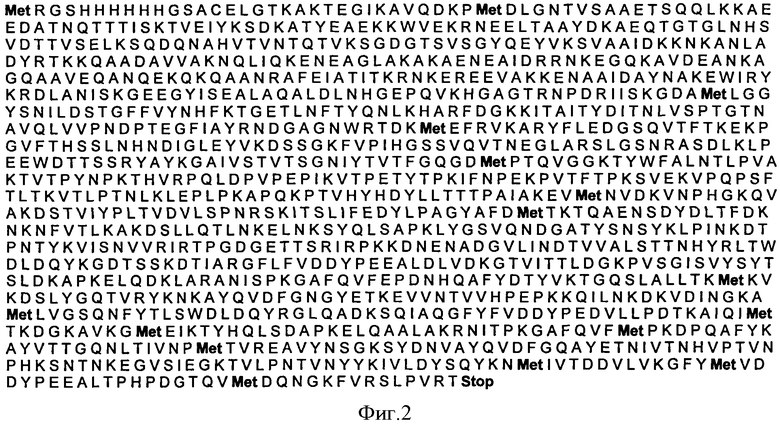

Изобретение относится к области микробиологии и молекулярной генетики и касается рекомбинантного полипептида StV, рекомбинантной ДНК stV, кодирующей указанный рекомбинантный полипептид StV, рекомбинантной плазмидной ДНК PQE-stV, представляющей собой плазмидную ДНК PQE-30, несущую указанную рекомбинантную ДНК stV, и штамма-продуцента Escherichia coli M15-StV, продуцирующего рекомбинантный полипептид StV. Представленные изобретения могут быть использованы в медицинской промышленности при производстве вакцин против Streptococcus agalactiae, т.е. стрептококков группы В (СГВ). 4 н.п. ф-лы, 6 ил., 2 табл., 5 пр.
1. Рекомбинантный полипептид StV с протективным эффектом против Streptococcus agalactiae, характеризующийся аминокислотной последовательностью, представленной на фиг.2, предназначенный для приготовления вакцины для иммунной защиты против стрептококков группы В.
2. Рекомбинантная ДНК stV, кодирующая рекомбинантный полипептид StV по п.1, нуклеотидная последовательность которой представлена на фиг.1.
3. Рекомбинантная плазмидная ДНК PQE-stV, представляющая собой плазмидную ДНК PQE-30, несущую рекомбинантную ДНК stV по п.2, обеспечивающая получение рекомбинантного полипептида StV по п.1.
4. Штамм-продуцент Escherichia coli M15-StV, продуцирующий рекомбинантный полипептид StV по п.1, полученный на основе Escherichia coli M15 и содержащий рекомбинантную плазмидную ДНК PQE-stV по п.3.
| РЕКОМБИНАНТНАЯ ДНК, ОБЕСПЕЧИВАЮЩАЯ ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО БЕЛКА PB1, ОБЛАДАЮЩЕГО ПРОТЕКТИВНЫМИ СВОЙСТВАМИ В ОТНОШЕНИИ STREPTOCOCCUS PYOGENES И STREPTOCOCCUS AGALACTIAE | 2008 |
|
RU2378374C2 |
| РЕКОМБИНАНТНЫЕ ДНК, ОБЕСПЕЧИВАЮЩИЕ ПОЛУЧЕНИЕ ПОЛИПЕПТИДОВ Р6, Р7, Р8, ОБЛАДАЮЩИХ ПРОТЕКТИВНЫМИ СВОЙСТВАМИ В ОТНОШЕНИИ STREPTOCOCCUS AGALACTIAE И СЕЛЕКТИВНО-СВЯЗЫВАЮЩИХ IgA | 2008 |
|
RU2387715C2 |
| Гидропривод грузоподъемного механизма | 1985 |
|
SU1320542A1 |
| US 0007098182 B2, 29.08.2006 | |||
| Устройство для управления асинхронным электродвигателем | 1990 |
|
SU1810978A1 |
Авторы
Даты
2015-02-20—Публикация
2012-05-17—Подача