Изобретение относится к медицине, биохимии и биоорганической химии и представляет собой улучшенный способ производства (печати) биочипов с улучшенной морфологией составляющих его элементов (спотов), что необходимо для проведения количественного иммунохимического и биохимического анализов. Биочипы, подготовленные по предлагаемому способу, могут найти применение в аналитической биохимии, иммунологии и медицине, в частности, для диагностики и прогностики злокачественных новообразований.
Уровень техники
В 2004 году группой авторов (Blixt О., et al.. Printed covalent glycan array for ligand profiling of diverse glycan binding proteins, Proc. Natl. Acad. Sci. USA, 2004, v.101 (49), p.17033-17038) [1] был создан гликочип (биочип, на который нанесены углеводные молекулы, также называемый printed glycan array - PGA) - инструмент изучения углеводсвязывающих белков, отличающийся миниатюрностью, возможностью проведения мультифакторного анализа и экономичностью в отношении иммобилизуемых лигандов. Однако, несмотря на его многообещающие аналитические свойства, до сих пор остается нерешенной проблема неоднозначности интерпретации сигналов от спотов - элементов биочипа, содержащих химически иммобилизованные лиганды (в данном примере - олигосахариды и полисахариды); эта неопределенность, обусловленная отсутствием единообразия их формы, делает проведение строго количественного анализа невозможным.
В настоящее время существует множество вариантов биочипов с химически иммобилизованными углеводными лигандами. Основной принцип их производства (печати) заключается в нанесении растворов предварительно модифицированных углеводов на активированную поверхность слайда с помощью печатающего устройства. Свободные восстанавливающие олигосахариды могут быть превращены в малеимид-, гидразид-, аминоокси-, тиол-производные, и напечатаны соответственно на тиол-, эпокси-, альдегид-, малеимид-активированную поверхность:
Park S., Lee M.R., Pyo S.J., Shin I., Carbohydrate chips for studying high-throughput carbohydrate-protein interactions, J. Am. Chem. Soc., 2004, v.126(15), p.4812-4819 [2].
Park S., Lee M.R., Shin I., Chemical microarrays constructed by selective attachment of hydrazide-conjugated substances to epoxide surfaces and their applications, Methods Mol. Biol., 2010, v. 669, p.195-208 [3].
Bohorov O., Andersson-Sand H., Hoffmann J., Blixt O., Arraying glycomics: a novel bifunctional spacer for one-step microscale derivatization of free reducing glycans, Glycobiol., 2006, v.l6(12),p.21C-27C [4].
Scurr D.J., Horlacher Т., Oberii M.A., Werz D.B., Kroeck L., Bufali S., Seeberger P.H., Shard A.G., Alexander M.R., Surface characterization of carbohydrate microarrays, Langmuir, 2010, v.26(22), p.17143-17155 [5].
Олигосахаридные лиганды можно печатать и без предварительной модификации на гидразид-, или аминоокси-активированную поверхность:
Zhi Z.L., Powell A.K., Tumbull J.E., Fabrication of carbohydrate microarrays on gold surfaces: direct attachment of nonderivatized oligosaccharides to hydrazide-modified self-assembled monolayers, Anal. Chem., 2006, v.78(14), p.4786-4793 [6].
Park S., Lee M.R., Shin I., Construction of carbohydrate microarrays by using one-step, direct immobilizations of diverse unmodified glycans on solid surfaces, Bioconjug. Chem., 2009, v.20(1), p.155-162 [7].
Полисахариды иммобилизуют на активированную поверхность как без предварительной модификации, так и после предварительного введения спейсера, например метил-N,O-гидроксилэтиламина:
Parthasarathy N., Saksena R., et al., Application of carbohydrate microarray technology for the detection of Burkholderia pseudomallei, Bacillus anthracis and Francisella tularensis antibodies, Carboh. Res., 2008, v.343, p.2783-2788 [8] и статья [4].
Однако только подход, описанный в статье [1], основанный на образовании амидной связи, получил широкое распространение (www.functionalglycomics.org). Именно он и является ближайшим аналогом данного изобретения.
Согласно цитированной статье [1] амино-спейсерированные олигосахариды (химически синтезированные и выделенные из природных источников гликаны, в которые предварительно был введен аминоспейсер) в виде раствора в водном буфере наносят на N-гидроксисукцинимид-активированную поверхность слайда с помощью печатающего устройства в условиях высокой влажности (~50%) в количестве около 100 фмоль на спот. Для проведения реакции иммобилизации напечатанные чипы выдерживают при повышенной влажности (~80%) и затем дезактивируют непрореагировавшие активные группы поверхности слайда. Готовый чип используют для анализа углеводной специфичности разнообразных молекул, в первую очередь лектинов и антител.
Несмотря на такие преимущества, как небольшие количества используемых лигандов и анализируемых белков, низкие фоновые значения аналитического сигнала, мультипараметричность и т.д., данный способ [1] обладает существенным недостатком, связанным с качеством составляющих его элементов - спотов, а именно гетерогенность размера, формы спотов и распределения сигнала внутри отдельного спота (фиг.1), возникающие предположительно из-за неравномерного высыхания капель растворов в процессе печати.
Раскрытие изобретения
Задачей изобретения является создание биочипов со спотами высокого качества.
Техническим результатом изобретения является повышение равномерности высыхания капель раствора на подложке при одновременном обеспечении защиты реакционных групп от преждевременного гидролиза и улучшение морфологии полученных спотов.
Технический результат достигается тем, что в способе печати биологических лигандов, представляющих собой олигосахариды, и/или полисахариды, и/или пептиды, и/или гликопептиды, и/или биотин, в процессе изготовления биочипов один биочип может одновременно содержать множество индивидуальных лигандов, включающем нанесение на подложку раствора биологических лигандов, согласно изобретению на подложку предварительно наносят слой гидрофобной нелетучей жидкости, не смешивающейся с растворителем биологических лигандов. Этот растворитель должен имеет большую удельную массу, чем наносимая на слайд жидкость; нанесение указанного раствора осуществляют бесконтактным методом.
Кроме того, в качестве гидрофобной нелетучей жидкости можно использовать вазелиновое, минеральное масло, высшие предельные углеводороды или их смесь. Кроме того, толщина слоя гидрофобной нелетучей жидкости предпочтительно составляет 50-200 мкм.
Настоящим изобретением предлагается способ печати биомолекул на активированную поверхность слайда через тонкий слой гидрофобной нелетучей жидкости («маску», 50-200 мкм), предварительно нанесенный перед стадией печати. Иммобилизуемые вещества растворяют в растворителе, который должен не смешиваться с жидкостью маски и обладать способностью проникать через нее за счет большей удельной массы.
Маска была впервые использована в работе (Liberski A., Zhang R., Bradley M., Inkjet fabrication of polymer microarrays and grids - solving the evaporation problem. Chem Commun (Camb), 2009, v.3, p.334-336) [9] при создании полимерных микроэрреев и сеток, чтобы избежать неравномерного высыхания наносимых растворов мономеров. Мономеры были растворены в 1-метил-2-пирролидоне, не смешивающемся с материалом маски - вазелиновым маслом. Капли, сформированные данной жидкостью, под собственным весом «проваливаливаются» через вазелиновый слой и после облучения вступают в фотоиндуцируемую реакцию полимеризации не высыхая. По окончании реакции гидрофобный слой легко удаляли раствором детергента.
В настоящем изобретении тот же принцип маски приложен для печати биомолекул (а не полимеров) и, соответственно, создания биочипов. Благодаря этому по сравнению с указанным выше способом [1] производства гликочипа процесс печати становится независим от влажности среды, так как склонная к гидролизу химически нестабильная активированная поверхность слайда защищена маской от прямых контактов с воздухом. Благодаря этому время контакта капли с поверхностью можно значительно увеличивать, проводя процесс столько времени, сколько это необходимо для полного завершения химической реакции между лигандами и подложкой. Таким образом, если в работе [9] маска только предотвращала высыхание микрокапли, то в нашем изобретении она играет дополнительную роль защиты активированных групп от преждевременного гидролиза. Необходимо отметить, что в способе [1] используется так называемый контактный принцип печати (и, соответственно, принтер для контактной печати). В случае использования маски этот способ применять не представляется возможным, так как жидкость маски может попадать в пины печатающей головки. В данном изобретении используется так называемый бесконтактный ("jet") способ печати и соответствующие бесконтактные принтеры, пины которых не входят в непосредственный контакт с поверхностью подложки, на которую производится печать. Необходимо также отметить, что замена контактного принтера на jet без применения маски не приводит к улучшению морфологии слотов.
Данный недостаток преодолен настоящим изобретением благодаря предварительно нанесенному перед стадией печати тонкому слою гидрофобной нелетучей жидкости («маске») на активированную поверхность подложки. Такая маска, предложенная авторами [9] для создания полимерных полимерных микрокапель и сеток, позволяет предотвратить высыхание наносимых на чип растворов биологических лигандов в процессе печати и тем самым избежать вышеупомянутых недостатков гликочипа, полученного способом [1] (фиг.2).
Далее, изобретение иллюстрируется ссылками на рисунки, а также примером, который приводится исключительно с целью иллюстрации и пояснения сущности заявленного изобретения, но который не предназначен для ограничения объема притязаний.
Список использованных сокращений
PGA - printed glycan array - гликочип или биочип, содержащий химически иммобилизованные олигосахариды или полисахариды;
RFU - относительные флуоресцентные единицы;
2D - гликочип - двухмерный гликочип;
GMDP-Lys - GlcNAcβ1-[НООС(СН3)СН]-3-O-GlcNAcβ-L-аланил-D-изоглутаминил-L-лизин;
GNa3'LN - GlcNAcα1-3Galβ1-4GlcNAcβ-sp;
Fs-2 - GalNAcαl-3GalNAcβ-sp;
GlcA3GN - GlcAα1-3GlcNAcβ-sp;
3'SiaLeC - Neu5Acα2-3Galβ1-3GlcNAcβ-sp;
a-LN - Galα1-4GlcNAcβ-sp;
Na3AN - GlcNAcα1-3GalNAcβ-sp;
GN2'TF - GlcNAcα1-3Galβ1-3GalNAcβ-sp;
KDN-LeC - KDNα2-3Galβ1-3GlcNAcβ-sp;
aLN3'LN - Galα1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp;
Gb5 - Galβ1-3GalNAcβ1-3Galα1-4Galβ1-4Glcβ-3Galβ1-4GlcNAcβ-sp;
Lac- Galβ1-4Glcβ-sp;
6-Su-Ch2 - GlcNAcβ1-4(6-Su)GlcNAcβ-sp;
b-Rha - Rhaβ-sp;
b-ManNAc - ManNAcβ-sp;
KDN - 3-дезокси-D-глицеро-D-галакто-нонулосониевая кислота;
CMG - диглицил-N-карбоксиметилглицин;
BovS10G - Ser-Ala-Pro-Asp-Thr-Arg-Pro-Ala-Pro-Gly-NH2;
ДМСО - диметилсульфоксид;
ИФБ - 0,1 М изотонический фосфатный буфер (0,01 М Na2HPO4, 0,01 М NaH2PO4, 0,138 М NaCl и 0,0027 М KCl, рН 7,4).
Краткое описание чертежей
Фиг.1 демонстрирует гетерогенность в морфологии спотов гликочипа, полученного известным способом [1]. Чипы инкубировали с пулом сывороток крови I(0)-IV(AB) групп (98 доноров), затем проявляли биотинилированными антителами козы против человеческих иммуноглобулинов Ig(G+M+A) с последующим прибавлением стрептавидина, меченного флуоресцентным красителем Alexa555.
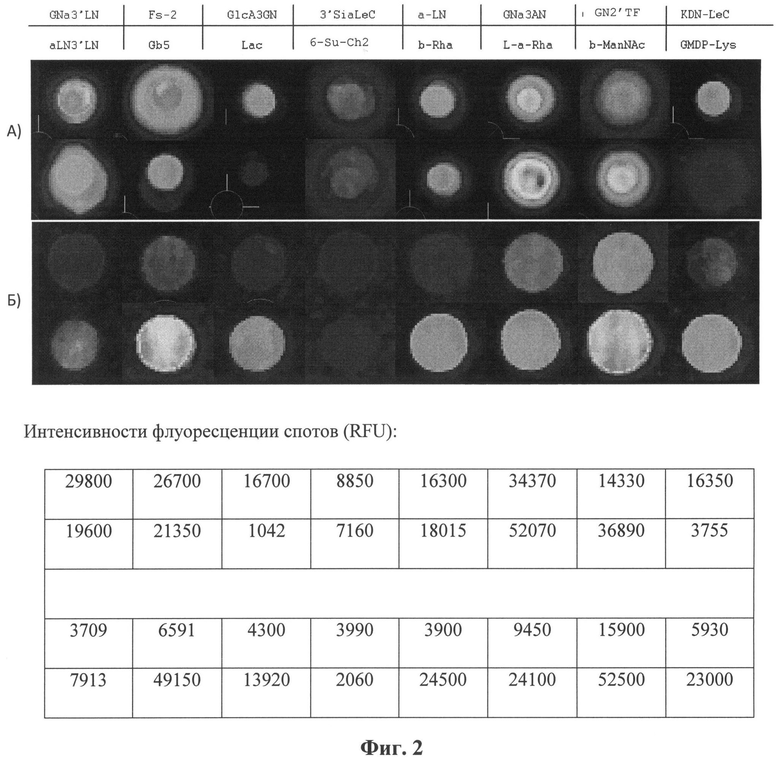
Фиг.2 демонстрирует морфологию спотов, полученных при печати различными способами: А) аминоспейсерированные гликаны, напечатанные контактным способом, без использования маски, как описано в статье [1]; Б) аминоспейсерированные гликаны, напечатанные предложенным способом с помощью бесконтактного принтера на слайд, покрытый смесью высших алканов (вазелиновое масло: додекан (2:1)). Схема расположения гликанов приведена в верхней таблице (GNa3'LN - GlcNAcα1-3Galβ1-4GlcNAcβ-sp, Fs-2 - GalNAcα1-3GalNAcβ-sp, GlcA3GN - GlcAα1-3GlcNAcβ-sp, 3'SiaLeC - Neu5Acα2-3Galβ1-3GlcNAcβ-sp, a-LN - Galα1-4GlcNAcβ-sp, GNa3AN - GlcNAcα1-3GalNAcβ-sp, GN2'TF - GlcNAcα1-3Galβ1-3GalNAcβ-sp, KDN-LeC - KDNα2-3Galβ1-3GlcNAcβ-sp, aLN3'LN - Galα1-4GlcNAcβ1-3Galβl-4GlcNAcβ-sp, Gb5 - Galβ1-3GalNAcβ1-3Galα1-4Galβ1-4Glcβ-3Galβ1-4GlcNAcβ-sp, Lac - Galβ1-4Glcβ-sp, 6-Su-Ch2 - GlcNAcβ1-4(6-Su)GlcNAcβ-sp, b-Rha - Rhaβ-sp, b-ManNAc - ManNAcβ-sp, GMDP-Lys - GlcNAcβ1-[НООС(СН3)СН]-3-O-GlcNAcβ-L-аланил-D-изоглутаминил-L-лизин; где sp - аминоэтиловый, аминопропиловый или глициновый спейсер), в нижней таблице указаны соответствующие интенсивности сигналов пятен (в виде относительных флуоресцентных единиц, RFU) после инкубации напечатанных слайдов с пулом сывороток крови I(0)-IV(AB) групп (98 доноров), которые затем проявляли биотинилированными антителами козы против человеческих иммуноглобулинов (IgG+M+A) с последующим прибавлением стрептавидина, меченного флуоресцентным красителем Alexa555.
Осуществление изобретения
Настоящее изобретение обеспечивает способ создания биочипа с улучшенной морфологией составляющих его элементов (спотов) для возможности проведения строго количественного иммунохимического и биохимического анализов.
Способ печати биомолекул по данному изобретению заключается в том, что в процессе изготовления биочипов присутствует стадия нанесения на подложку тонкого слоя гидрофобной нелетучей жидкости («маски») толщиной 50-200 мкм перед стадией печати биомолекул. В качестве гидрофобной нелетучей жидкости может использоваться вазелиновое или минеральное масло, или высшие предельные углеводороды, или их смесь. Биологические молекулы растворяют в растворителе, который не смешивается с жидкостью маски, которая обладает способностью проникать через нее за счет большей удельной массы. Далее, с помощью устройства для бесконтактной печати индивидуальные растворы биомолекул в виде капель наносят на подложку. За счет собственного веса капли раствора «проваливаются» через гидрофобный слой, где вступают в реакцию с активными группами поверхности, образуя споты.
В качестве биомолекул используются амино-спейсерированные олигосахариды, а также полисахариды (наличие спейсера у последних не обязательно), а также вещества не углеводной природы, такие как биотин и пептиды.
Морфологию формирующихся спотов оценивают по изображению, полученному при сканировании напечатанных слайдов, одновременно содержащих множество индивидуальных лигандов, после их инкубации с анализируемым образцом и проявленных соответствующими реагентами, имеющими в составе флуоресцентный краситель. Споты на чипах, полученных предлагаемым способом, были одинаковы по размеру и форме;
распределение сигнала внутри пятна было равномерным (фиг.2).
Как видно из приведенного ниже примера, при традиционном (без маски) способе [1] печати и печати предлагаемым способом наблюдается разное соотношение сигналов от гликанов между собой. Это видно из таблицы интенсивностей сигналов, приведенной на фиг.2, для получения которых слайды проявлялись в одинаковых условиях. Такое различие объясняется условиями иммобилизации биомолекул: в случае традиционного нанесения ([1] без маски) иммобилизуемому веществу необходимо успеть прореагировать с активной поверхностью слайда всего лишь за несколько секунд, так как микрокапля быстро испаряется. В случае микрокапли, находящейся под маской, иммобилизация проходит столько времени, сколько потребуется. Это позволяет прореагировать с подложкой даже наименее реакционно-способным биомолекулам, что в результате выравнивает свойства разных веществ и позволяет сделать степень их иммобилизации практически одинаковой.
В качестве маски могут выступать углеводороды различной природы и вязкости (Примеры 1, 2 и 3), на результат печати это не влияет, однако с точки зрения методического удобства оптимальной была смесь углеводородов (см. Пример 1).
В качестве растворителя опробовано несколько вариантов, среди которых следующие:
1) ДМСО, содержащий 1% диизопропилэтиламин,
2) 300 мМ фосфатный буферный раствор, рН 8.0, содержащий 0.001% Tween20,
3) смесь данных растворителей с триацетином.
Использование водных растворов осложняется тем, что наносимые капли при недостаточной удельной массе не достигают активированной поверхности. В случае растворов биологических лигандов в чистом ДМСО капли раствора достигают поверхности слайда, однако наблюдается некоторая зависимость от природы наносимого лиганда. В то же время добавление в качестве "утяжелителя" триацетина (до 50%), имеющего плотность 1,15 6 г/мл, полностью нивелировало эти различия, поэтому оптимальным для печати через углеводородную маску является раствор, состоящий из ДМСО и триацетина.
Приведенные примеры предназначены не для ограничения притязаний, а исключительно для иллюстрации отдельных воплощений настоящего изобретения.
Пример 1. Печать биомолекул через гидрофобный слой, состоящий из вазелинового масла и додекана
Для конструирования биочипа использовались следующие биомолекулы.
1. Олигосахариды: GlcNAcα1-3Galβ1-4GlcNAcβ-sp, GalNAcα1-3GalNAcβ-sp, GlcAα1-3GlcNAcβ-sp, Neu5Acα2-3Galβ1-3GlcNAcβ-sp, Galα1-4GlcNAcβ-sp, GlcNAcα1-3GalNAcβ-sp, GlcNAcα1-3Galβ1-3GalNAcβ-sp, KDNα2-3Galβ1-3GlcNAcβ-sp, Galα1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp, Galβ1-3GalNAcβ1-3Galα1-4Galβ1-4Glcβ-3Galβ1-4GlcNAcβ-sp, Galβ1-4Glcβ-sp, GlcNAcβ1-4(6-Su)GlcNAcβ-sp, Rhaβ-sp, ManNAcβ-sp, где sp - аминоэтиловый, аминопропиловый или глициновый спейсер.
2. Гликопептид GlcNAcβ1-[HOOC(CH3)CH]-3-O-GlcNAcβ-L-аланил-D-изоглутаминил-L-лизин.
3. Полисахариды: Escherichia coli O52, O58, O73.
4. Биотин в виде производного с диаминогексановым спейсером.
5. Пептиды BovS10G и CMG.
В качестве гидрофобной жидкости, формирующей маску, взята смесь вазелинового масла и додекана. В качестве растворителя биолигандов использовали смесь ДМСО с триацетином (1:1), содержащую 1% диизопропилэтиламина. Биомолекулы растворяли в этой смеси, в концентрация 50 мкМ. На N-гидроксисукцинимид-активированные слайды Н (Schott Nexterion, Германия) наносили 300 мкл смеси вазелинового масла (Татхимфармпрепараты, Россия) и додекана (Sigma-Aldrich, США) в соотношении 2:1 (по объему), давали жидкости равномерно растечься по слайду. Толщина образующейся маски составляла 150 мкм. Затем с помощью устройства для бесконтактной печати Nano-Plotter 2.1 (GeSim, Германия) на поверхность слайда, покрытого маской, наносили индивидуальные растворы перечисленных выше биомолекул в виде капель объемом 4 нл. После последовательного нанесения всех лигандов слайд выдерживали в течение 1 ч при комнатной температуре, смывали маску 0,1 М изотоническим фосфатным буфером (ИФБ) (0,01 М Na2HPO4, 0,01 М NaH2PO4, 0,138 М NaCl и 0,0027 М KCl, рН 7,4) (Sigma-Aldrich, США), содержащим 1% Tween20 (ICN, США). Затем блокировали оставшиеся непрореагировавшие активированные группы слайда 100 мМ раствором борной кислоты (Хеликон, Россия), содержащим 25 мМ этаноламин (Merck, США) и 0,2% Tween-20, pH8,5. Заблокированные слайды промывали бидистиллированной водой и высушивали центрифугированием.
Проявку слайда осуществляли следующим образом:
Выдерживали в течение 15 мин в ИФБ, содержащем 0,1% Tween-20 (ИФБ-0,1%), затем прибавляли 200 мкл пула сывороток крови I(0)-IV(AB) групп (98 доноров), разбавленный в 15 раз с помощью ИФБ-1%, содержащим 1% БСА, и выдерживали на шейкере при относительной влажности 80% в течение 1 ч при 37°С. Затем чип промывали ИФБ-0,05% и прибавляли 200 мкл раствора биотинилированных антител козы против человеческих иммуноглобулинов Ig(G+M+A) (ThermoSci, США), разведение 1:200 в ИФБ-0,1%, содержащем 1% БСА. После инкубации на шейкере при относительной влажности 80% в течение 1 ч при 37°С слайд промывали ИФБ-0,05% и прибавляли раствор стрептавидина, меченного флуоресцентным красителем Alexa555, разведение 1:1000 в ИФБ-0,1%. После инкубации слайда в течение 40 мин при комнатной температуре в отсутствие света его промывали сначала ИФБ-0,05%, затем бидистиллированной водой и высушивали центрифугированием. Изображения получали с помощью конфокального сканера ProScanArray Gx (PerkinElmer, США) с разрешением 5 мкм (мощность лазера 90%). Полученные файлы просматривали и обрабатывали с помощью программного обеспечения ScanArray Express 3.0 и Microsoft Excel.
Пример 2. Печать биомолекул через гидрофобный слой додекана
Для конструирования биочипа использовались следующие биомолекулы.
1. Олигосахариды: GlcNAcα1-3Galβ1-4GlcNAcβ-sp, GalNAcα1-3GalNAcβ-sp, GlcAα1-3GlcNAcβ-sp, Neu5Acα2-3Galβ1-3GlcNAcβ-sp, Galα1-4GlcNAcβ-sp, GlcNAcα1-3GalNAcβ-sp, GlcNAcα1-3Galβ1-3GalNAcβ-sp, KDNα2-3Galβ1-3GlcNAcβ-sp, Galα1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp, Galβ1-3GalNAcβ1-3Galα1-4Galβ1-4Glcβ-3Galβ1-4GlcNAcβ-sp, Galβ1-4Glcβ-sp, GlcNAcβ1-4(6-Su)GlcNAcβ-sp, Rhaβ-sp, ManNAcβ-sp, где sp - аминоэтиловый, аминопропиловый или глициновый спейсер.
2. Гликопептид GlcNAcβ1-[HOOC(CH3)CH]-3-O-GlcNAcβ-L-алани-D-изоглутаминил-L-лизин.
3. Полисахариды: Escherichia coli O52, O58, O73.
4. Биотин в виде производного с диаминогексановым спейсером.
5. Пептиды BovS10G и CMG.
Индивидуальный додекан, также как и минеральное масло, является более текучим, чем смесь (см. Пример 1). Поэтому, чтобы сформировать маску, стандартный слайд снабжали дополнительными съемными бортиками. Толщина слоя варьировалась от 100 до 200 мкм. В качестве растворителя использовали ту же смесь, что и в Примере 1. Биомолекулы растворяли в смеси ДМСО и триацетина в объемном соотношении 1:1, содержащей 1% диизопропилэтиламин в концентрации 50 мкМ. На N-гидроксисукцинимид-активированные слайды Н (Schott Nexterion, Германия) наносили 300 мкл додекана (Sigma-Aldrich, США), давали жидкости равномерно растечься по слайду. Толщина образующейся маски составляла ~150 мкм. Затем с помощью устройства для бесконтактной печати Nano-Plotter 2.1 (GeSim, Германия) на поверхность слайда, покрытого маской, наносили индивидуальные растворы перечисленных выше биомолекул в виде отдельных капель объемом 4 нл. После последовательного нанесения всех лигандов слайд выдерживали в течение 1 ч при комнатной температуре, смывали маску 0,1 М изотоническим фосфатным буфером (ИФБ) (0,01 М Na2HPO4, 0,01 М NaH2PO4, 0,138 М NaCl и 0,0027 М KCl, pH 7,4) (Sigma-Aldrich, США), содержащим 1% Tween20 (ICN, США). Затем блокировали оставшиеся непрореагировавшие активированные группы слайда 100 мМ раствором борной кислоты (Хеликон, Россия), содержащим 25 мМ этаноламин (Merck, США) и 0,2% Tween-20, pH8,5. Заблокированные слайды промывали бидистиллированной водой и высушивали центрифугированием. Проявку слайда осуществляли так же, как в Примере 1.
Пример 3. Печать биомолекул через слой вазелинового масла.
Для конструирования биочипа использовались следующие биомолекулы.
1. Олигосахариды: GlcNAcα1-3Galβ1-4GlcNAcβ-sp, GalNAcα1-3GalNAcβ-sp, GlcAα1-3GlcNAcβ-sp, Neu5Acα2-3Galβ1-3GlcNAcβ-sp, Galα1-4GlcNAcβ-sp, GlcNAcα1-3GalNAcβ-sp, GlcNAcα1-3Galβ1-3GalNAcβ-sp, KDNα2-3Galβ1-3GlcNAcβ-sp, Galα1-4GlcNAcβ1-3Galβ1-4GlcNAcβ-sp, Galβ1-3GalNAcβ1-3Galα1-4Galβ1-4Glcβ-3Galβ1-4GlcNAcβ-sp, Galβ1-4Glcβ-sp, GlcNAcβ1-4(6-Su)GlcNAcβ-sp, Rhaβ-sp, ManNAcβ-sp, где sp - аминоэтиловый, аминопропиловый или глициновый спейсер.
2. Гликопептид GlcNAcβ1-[HOOC(CH3)CH]-3-O-GlcNAcβ-L-аланил-D-изоглутаминил-L-лизин.
3. Полисахариды: Escherichia coli O52, O58, O73.
4. Биотин в виде производного с диаминогексановым спейсером.
5. Пептиды BovS10G и CMG.
В качестве гидрофобной маски бралось чистое неразбавленное вазелиновое масло. Нанесение маски и все последующие процедуры проводились так же, как описано в Примере 1. Отличия связаны только с более высокой вязкостью чистого вазелинового масла, из-за чего для формирования равномерной пленки требуется более длительное время и тщательный контроль равномерности распределения вазелина по поверхности слайда.
Перечень биомолекул, приведенный в примерах, может быть иным и гораздо шире. Для печати могут быть использованы любые олигосахариды, полисахариды, пептиды, гликопептиды, биотин. Для корректного сравнения примеров использовался одинаковый набор молекул.

Изобретение относится к биотехнологии. Предложен способ печати биологических лигандов, представляющих собой олигосахариды, и/или полисахариды, и/или пептиды, и/или гликопептиды, и/или биотин. Предварительно на подложку наносят слой гидрофобной нелетучей жидкости, не смешивающейся с растворителем биологических лигандов и имеющей удельную массу меньше, чем удельная масса раствора биологических лигандов. Затем бесконтактным методом осуществляют печать биологических лигандов. В качестве гидрофобной нелетучей жидкости используют вазелин, минеральное масло или высшие предельные углеводороды или их смесь. Толщина слоя гидрофобной нелетучей жидкости предпочтительно составляет 50-200 мкм. Техническим результатом изобретения является повышение равномерности высыхания капель раствора биологических лигандов на подложке при одновременном обеспечении защиты биологических лигандов от преждевременного гидролиза и улучшении морфологии спотов. 2 з.п. ф-лы, 2 ил., 3 пр.
1. Способ печати биологических лигандов, представляющих собой олигосахариды, и/или полисахариды, и/или пептиды, и/или гликопептиды, и/или биотин в процессе изготовления биочипов, включающий нанесение на подложку раствора биологических лигандов, отличающийся тем, что предварительно на подложку наносят слой гидрофобной нелетучей жидкости, не смешивающейся с растворителем раствора биологических лигандов и имеющей удельную массу меньше, чем удельная масса раствора, а нанесение раствора осуществляют бесконтактным методом.
2. Способ по п.1, отличающийся тем, что в качестве гидрофобной нелетучей жидкости используют, по меньшей мере, одно вещество, выбранное из ряда: вазелиновое масло, минеральное масло, высшие предельные углеводороды либо их смесь.
3. Способ по п.1, отличающийся тем, что толщина слоя гидрофобной нелетучей жидкости составляет 50-200 мкм.
| HOOK A | |||
| L | |||
| ET AL | |||
| "High throughput methods applied in biomaterial development and discovery", Biomaterials, 2010, v.31, pp.187-198 | |||
| BLIXT O | |||
| ET AL | |||
| "Printed covalent glycan array for ligand profiling of diverse glycan binding proteins", PNAS, 2004, v | |||
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
| LIBERSKI A | |||
| ET AL | |||
| "Inkjet fabrication of polymer microarrays and grids | |||
Авторы
Даты
2015-02-27—Публикация
2012-11-06—Подача