Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится к антигенсвязывающим молекулам (АСМ). В некоторых вариантах осуществления настоящее изобретение относится к рекомбинантным моноклональным антителам или их фрагментам, в том числе химерным, приматизированным или гуманизированным антителам или их фрагментам с измененной способностью опосредовать клеточную сигнальную активность антигеном-мишенью и/или измененной способностью опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней. Кроме того, настоящее изобретение относится к молекулам нуклеиновых кислот, кодирующих такие АСМ, а также к векторам и клеткам-хозяевам, включающих такие молекулы нуклеиновых кислот. Настоящее изобретение также относится к способам получения АСМ настоящего изобретения и способам применения АСМ для лечения заболеваний. Кроме того, настоящее изобретение относится к АСМ с модифицированным гликозилированием, обладающим улучшенными терапевтическими свойствами, в том числе к антителам с повышенным связыванием Fc-рецептора и повышенной эффекторной функцией.
Уровень техники
Антитела, также называемые иммуноглобулинами, имеют структуру, в основу которой входят четыре полипептидные цепи: две одинаковые тяжелые цепи (heavy - Н), спаренные с двумя одинаковыми легкими цепями (light - L). Каждая тяжелая и легкая цепь включает вариабельную область (variable region - VH и VL, соответственно) и постоянную область (constant region - СН и CL, соответственно). Область СН содержит 3 домена (СН1, СН2 и СН3), хотя меньшая область CL содержит только один домен (который просто обозначается «CL»). Каждая VH и VL область включает 3 комплементарно детерминированные области (complementarity determining region - CDR), фланкированные четырьмя каркасными участками в следующем порядке: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Комплементарно детерминированные области (CDR) являются наиболее вариабельной частью области V и определяют специфичность антитела. Вместе спаренные VH и VL формируют сайт связывания антигена, и бивалентные антитела имеют два таких антигенсвязываюших сайта. Следует отметить, что базисная структура антитела может быть модифицирована разными способами (например, генерацией фрагментов структуры), хотя она сохраняет или даже улучшает желаемые функции и/или антигенсвязывающую активность.
На границе между доменами VH и СН1 содержатся консервативные аминокислоты. Эта область контакта может быть описана под названием «молекулярного шаровидного сустава» или «шарнирного сочленения». Такое сочленение определяет «движение локтя» и поэтому называется «локтевым углом» областей VH и VL относительно областей СН1 и CL и предупреждает жесткий контакт между областями V и С (Lesk, Chothia, Nature 335, 1988, cc.188-190). «Углубление шаровидного сустава» формируется остатками аминокислот в каркасном участке VH, особенно в положениях 11, 110 и 112 (по системе нумерации Kabat и др. в кн. «Sequences of Proteins of Immunological Interest», 1987, 4-е изд., изд-во Public Health Services, NIH, Вашингтон, округ Колумбия). (См. Lesk, Chothia, Nature, 335, 1988, cc.188-190). «Шаровидный выступ» такого «шаровидного сустава» находится в составе домена СН1 и формируется преимущественно двумя аминокислотами в положениях 148 и 149 (см. Landolfi и др., J. Immunol. 166, 2001, cc.1748-1754, Lesk, Chothia, Nature 335, 1988, cc.188-190) (где остатки СН1, формирующие «шаровидный выступ», пронумерованы 149 и 150, соответственно). Различия в аминокислотах в этих положениях могут диктовать локтевой угол, который формируется между областями V и С, и, следовательно, ориентацию димера VH-VL (см. Lesk, Chothia, Nature 335, 1988, cc.188-190). Аминокислотные остатки, занимающие эти положения в VH, являются в высокой степени консервативными для последовательностей иммуноглобулина (см., например, Lesk, Chothia, Nature 335, 1988, cc.188-190). Все аминокислотные остатки, участвующие в этом сочленении (например, в положениях 11, 110, 112, 148 и 149), расположены в каркасных областях (например, остатки 11, 110 и 112) или в составе постоянного домена (например, 148 и 149 согласно Landolfi и др., или 149 и 150 согласно работе Lesk и Chothia), и, видимо, непосредственно не участвуют в связывании антигена. Landolfi и др., J. Immunol. 166, 2001, cc.1748-1754.
Помимо опосредования эффекторных функций, например, антитело зависимой клеточно-обусловленной цитотоксичности (antibody dependent cell-mediated cytotoxicity - ADCC) и комплементзависимой цитотоксичности (complement dependent cytotoxicity - CDC), моноклональные антитела могут модулировать клеточные функции индукцией или подавлением клеточных сигнальных метаболических путей. Например, установлено, что моноклональные антитела для опосредования антигенного перекрестного сшивания активируют рецепторы гибели (например, облегчая олигомеризацию рецепторов или мимикрируя связывание лиганда) и блокируют опосредованную лигандом передачу клеточного сигнала при росте и дифференциации клетки и/или метаболические пути пролиферации (см., например, Ludwig и др., Oncogene 22, 2003, cc.9097-9106).
Апоптоз, или запрограммированная гибель клеток, может быть индуцирован несколькими разными механизмами. Например, активация сигнальных метаболических путей через связанные с клеточной мембраной «рецепторы гибели», например, представители надсемейства рецептора фактора некроза опухолей (tumor necrosis factor receptor - TNFR), может привести к индукции апоптоза. Подобным образом димеризация или перекрестное сшивание поверхностного антигена может привести к индукции апоптоза. Так димеризация или перекрестное сшивание поверхностного антигена, например, антигена CD20, также может индуцировать апоптоз (см., например, Ludwig и др., Oncogene 22, 2003, cc.9097-9106).
По прежнему сохраняется потребность в совершенствовании терапевтических подходов к нацеливанию антигенов, связанных с передачей клеточного сигнала, включая, но, не ограничиваясь ею, индукцию апоптоза, для лечения заболевания у приматов, включая людей, но, не ограничиваясь ими.
Краткое описание изобретения
Распознавание огромного терапевтического потенциала модифицированных антигенсвязывающих молекул (АСМ), у которых изменена способность опосредовать клеточную сигнальную антигеном-мишенью и/или изменена способность опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней, в настоящем изобретении разработаны такие АСМ и способ получения таких АСМ. Кроме того, настоящий способ предусматривает получение рекомбинантных химерных антител или их химерных фрагментов. Эффективность таких модифицированных АСМ дополнительно повышается конструированием профиля гликозилирования области Fc антитела.
Таким образом, один из объектов настоящего изобретения представляет модифицированную антигенсвязывающую молекулу, включающую вариабельную область тяжелой или легкой цепи, включающую по меньшей мере одну замену остатка аминокислоты по меньшей мере в одном каркасном участке указанной вариабельной области тяжелой или легкой цепи, по сравнению с вариабельной областью тяжелой или легкой цепи исходной антигенсвязывающей молекулы, где указанные замены приводят к измененной клеточной сигнальной активности антигена-мишени, если указанная модифицированная антигенсвязывающая молекула объединяется с указанным антигеном-мишенью. В одном из вариантов осуществления настоящего изобретения измененная активность по передаче клеточного сигнала является апоптозом. В одном из вариантов осуществления настоящего изобретения модифицированная антигенсвязывающая молекула обладает повышенной способностью индуцировать апоптоз. В другом варианте осуществления настоящего изобретения модифицированная антигенсвязывающая молекула обладает пониженной способностью индуцировать апоптоз.
Другой объект настоящего изобретения относится к модифицированной антигенсвязывающей молекуле, включающей вариабельную область тяжелой или легкой цепи, в которой по меньшей мере одна аминокислота заменена по меньшей мере в одном каркасном участке указанной вариабельной области тяжелой или легкой цепи, по сравнению с вариабельной областью тяжелой или легкой цепи исходной антигенсвязывающей молекулы, причем указанная модифицированная антигенсвязывающая молекула обладает измененной способностью опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней в качестве результата указанной замены.
В одном из вариантов осуществления настоящего изобретения модифицированная антигенсвязывающая молекула настоящего изобретения включает замену в каркасном участке FR1 вариабельной области тяжелой цепи. В другом варианте осуществления настоящего изобретения замена представляет замену, выбранную из группы, состоящей по меньшей мере из 2 по меньшей мере 3 или по меньшей мере 4 аминокислот.
В еще одном из вариантов осуществления настоящего изобретения замена представляет полную замену каркасного участка FR1 вариабельной области тяжелой цепи. В другом варианте осуществления настоящего изобретения FR1 полностью замещается на VH FR1 клеток зародышевой линии. В еще одном варианте осуществления настоящего изобретения VH FR1 клеток зародышевой линии включает аминокислотную последовательность 8-13 по нумерации Kabat, выбранную из группы, состоящей из последовательностей SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78, SEQ ID NO:79, SEQ ID NO:101, SEQ ID NO:102, SEQ ID NO:103, SEQ ID NO:104 и SEQ ID NO:105.
В одном из вариантов осуществления настоящего изобретения модифицированная АСМ включает замену в каркасном участке FR1 вариабельной области тяжелой цепи в виде замены аминокислотного остатка в одном или нескольких положениях 8, 9, 10, 11, 12 или 13 по нумерации Kabat.
В одном из вариантов осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 8 по нумерации Kabat. В более конкретном варианте осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 8 по нумерации Kabat на остаток аминокислоты, выбранный из группы, состоящей из аргинина и глицина.
В другом конкретном варианте осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 9 по нумерации Kabat. В более конкретном варианте осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 9 по нумерации Kabat на остаток аминокислоты, выбранной из группы, состоящей из аланина, пролина, глицина, серина и гистидина.
В одном из конкретных вариантов осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 10 по нумерации Kabat. В более конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 10 по нумерации Kabat на остаток аминокислоты, выбранной из группы, состоящей из глутамата, треонина, глицина, аланина и валина.
В другом варианте осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 11 по нумерации Kabat. В более конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 11 по нумерации Kabat на остаток какой-либо аминокислоты за исключением лейцина. В еще одном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 11 по нумерации Kabat на неполярную аминокислоту. В другом варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 11 по нумерации Kabat на остаток аминокислоты, выбранной из группы, включающей валин, лейцин, изолейцин, серин и фенилаланин. В одном из вариантов осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 11 по нумерации Kabat на лейцин.
В другом варианте осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 12 по нумерации Kabat. В более конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 12 по нумерации Kabat на остаток какой-либо аминокислоты, выбранный из группы, включающей лизин, валин, лейцин и изолейцин.
В одном из вариантов осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положениях 11 и 12 по нумерации Kabat. В конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 11 по нумерации Kabat на валин и в положении 12 по нумерации Kabat на лизин; замену аминокислотного остатка в положении 11 по нумерации Kabat на лейцин и в положении 12 по нумерации Kabat на валин; замену аминокислотного остатка в положении 11 по нумерации Kabat на валин и в положении 12 по нумерации Kabat на изолейцин; или замену аминокислотного остатка в положении 11 по нумерации Kabat на валин и в положении 12 по нумерации Kabat на валин.
В другом варианте осуществления настоящего изобретения замена в FR1 вариабельной области тяжелой цепи представляет замену аминокислотного остатка в положении 13 по нумерации Kabat. В конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 13 по нумерации Kabat на остаток аминокислоты, выбранный из группы, включающей лизин, аргинин, глутамин и глутамат.
В еще одном варианте осуществления настоящего изобретения замена в АСМ представляет замену по меньшей мере одного аминокислотного остатка в FR4 вариабельной области тяжелой цепи. В конкретном варианте осуществления настоящего изобретения замена в FR4 вариабельной области тяжелой цепи представляет замену аминокислотного остатка по одному или обоим положениям 110 или 112 по нумерации Kabat.
В одном из конкретных вариантов осуществления настоящего изобретения замена аминокислотного остатка в положении 110 по нумерации Kabat на аминокислоту, выбранную из группы, включающей лейцин, изолейцин, треонин или серии. В более конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 110 по нумерации Kabat на изолейцин.
В другом варианте осуществления настоящего изобретения замена аминокислотного остатка в положении 112 по нумерации Kabat на аминокислоту, выбранную из группы, включающей валин, лейцин, изолейцин или треонин. В более конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 112 по нумерации Kabat на изолейцин.
Один из объектов настоящего изобретения связан с модифицированной антигенсвязывающей молекулой, включающей домен СН1, содержащий по меньшей мере одну замену остатка аминокислоты по сравнению с доменом СН1 исходного полипептида, причем замена приводит к измененной клеточной сигнальной активности антигена-мишени, если модифицированная антигенсвязывающая молекула объединяется с антигеном-мишенью.
Другой объект настоящего изобретения также связан с модифицированной антигенсвязывающей молекулой, включающей домен СН1, содержащий по меньшей мере одну замену остатка аминокислоты по сравнению с доменом СН1 исходного полипептида, причем антигенсвязывающая молекула в результате такой замены обладает измененной способностью опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней.
В одном из вариантов осуществления настоящего изобретения замена в СН1 представляет замену аминокислотного остатка по одному или нескольким положениям 148, 149 или 150. В конкретном варианте осуществления настоящего изобретения замена представляет замену аминокислотного остатка в положении 149 на лейцин. В другом варианте осуществления настоящего изобретения замена представляет замену целого домена СН1. В еще одном варианте осуществления настоящего изобретения замена представляет замену CH1-домена IgG на CH1-домен IgM.
Другой объект настоящего изобретения представляет модифицированную антигенсвязывающую молекулу, включающую по меньшей мере одну замену аминокислоты, в которой указанная замена представляет замену аминокислотного остатка в легкой цепи в пограничной области между вариабельной и постоянной областями, причем замена приводит к измененной активности по передаче клеточного сигнала антигена-мишени связывающей молекулы, если указанная модифицированная антигенсвязывающая молекула объединяется с указанным антигеном-мишенью.
Другой объект настоящего изобретения связан с модифицированной антигенсвязывающей молекулой, включающей по меньшей мере одну замену аминокислоты, в которой указанное замена представляет замену аминокислотного остатка в легкой цепи в пограничной области между вариабельной и постоянной областями, причем указанная модифицированная антигенсвязывающая молекула обладает измененной в результате указанной замены способностью опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней.
В одном из вариантов осуществления настоящего изобретения замена в вариабельной области легкой цепи АСМ представляет замену аминокислоты по одному или нескольким из положений 10, 12, 39, 40, 41, 80, 81, 83, 84, 103, 105, 106 и 108 по нумерации Kabat. В конкретном варианте осуществления настоящего изобретения замена в вариабельной области легкой цепи АСМ представляет замену аминокислотного остатка по одному или нескольким из положений 40, 80, 83, 105 или 106 по нумерации Kabat.
В другом варианте осуществления настоящего изобретения замена в легкой цепи АСМ представляет замену аминокислотного остатка по одному или нескольким из положений 40, 80, 83, 105 или 106 по нумерации Kabat на неполярную аминокислоту.
В другом конкретном варианте осуществления настоящего изобретения замена в легкой цепи АСМ представляет замену аминокислотного остатка в положении 40 по нумерации Kabat на аланин.
В другом конкретном варианте осуществления настоящего изобретения замена в легкой цепи АСМ представляет замену аминокислотного остатка в положении 80 по нумерации Kabat на пролин.
В другом конкретном варианте осуществления настоящего изобретения замена в легкой цепи АСМ представляет замену аминокислотного остатка в положении 83 по нумерации Kabat на фенилаланин.
В другом конкретном варианте осуществления настоящего изобретения замена в легкой цепи АСМ представляет замену аминокислотного остатка в положении 105 по нумерации Kabat на аланин.
В другом конкретном варианте осуществления настоящего изобретения замена в легкой цепи АСМ представляет замену аминокислотного остатка в положении 106 по нумерации Kabat на аланин. В другом конкретном варианте осуществления настоящего изобретения замена в легкой цепи АСМ представляет замену аминокислотного остатка в положении 106 по нумерации Kabat, причем у антигенсвязывающей молекулы снижается способность индуцировать апоптоз.
В некоторых вариантах осуществления настоящего изобретения замена согласно настоящему изобретению представляет комбинацию замен каких-либо аминокислотных остатков в вариабельной и/или постоянной областях тяжелой и/или легкой цепи согласно описанному в настоящем изобретении.
Одним из направлений исследования настоящего изобретения является аминокислотная замена (замены) в модифицированных АСМ настоящего изобретения, которая приводит к измененной клеточной сигнальной активности антигена-мишени, если модифицированная АСМ объединяется с антигеном-мишенью.
В одном из вариантов осуществления настоящего изобретения измененная клеточная сигнальная активность является повышенной агонистической активностью. В одном из конкретных вариантов осуществления настоящего изобретения повышенная агонистическая активность выбрана из группы, включающей индукцию апоптоза и индукцию клеточной дифференциации.
В одном из вариантов осуществления настоящего изобретения измененная клеточная сигнальная активность является повышенной антагонистической активностью. В конкретном варианте осуществления настоящего изобретения антагонистическая активность выбрана из группы, включающей выживание клеток, рост клеток, пролиферацию клеток и ангиогенез.
Другим объектом настоящего изобретения является модифицированная антигенсвязывающая молекула настоящего изобретения, которая специфически связывается с антигеном CD20 человека. Еще одним объектом настоящего изобретения является модифицированная антигенсвязывающая молекула, которая специфически связывается с представителем суперсемейства рецептора TNF человека. В одном из вариантов осуществления настоящего изобретения представитель суперсемейства рецептора TNF человека выбран из группы, включающей TNFR1, CD95, TRAILR1, TRAILR2, EDAR и p75NGFR.
Другим объектом настоящего изобретения является модифицированная антигенсвязывающая молекула, которая специфически связывается с рецепторной тирозинкиназой. В одном из конкретных вариантов осуществления настоящего изобретения рецепторная тирозинкиназа выбрана из группы, включающей HER1 (EGFR1), HER2/neu, HER3, HER4, IGF-1R, FGFR, PDGFR, VEGFR1, VEGFR2 и VEGFR3. В одном из конкретных вариантов осуществления настоящего изобретения рецепторной тирозинкиназой является HER1 (EGFR1).
Другим объектом настоящего изобретения также является модифицированная антигенсвязывающая молекула (АСМ), которая может быть выбрана из группы, включающей целое антитело, фрагмент Fab или его гибридный белок, фрагмент F(ab')2 или его гибридный белок, миниантитело, двойное антитело, тройное антитело и четырехкомпонентное антитело, но ими перечень не ограничивается. В одном из конкретных вариантов осуществления настоящего изобретения АСМ является химерной молекулой или молекулой, полностью полученной от человека. В еще одном более конкретном варианте осуществления настоящего изобретения модифицированная АСМ является гуманизированной. В другом варианте осуществления настоящего изобретения модифицированная АСМ является мультиспецифичной. В более конкретном варианте осуществления настоящего изобретения модифицированная АСМ является биспецифической.
Другим объектом настоящего изобретения является исходная антигенсвязывающая молекула, включающая вариабельную область тяжелой цепи, выбранную из группы, включающей SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61 и SEQ ID NO:62.
Другим объектом настоящего изобретения является исходная антигенсвязывающая молекула, включающая легкую цепь, выбранную из группы, включающей SEQ ID NO:48, SEQ ID NO:130, SEQ ID NO:131, SEQ ID NO:132, SEQ ID NO:133 и SEQ ID NO:134.
Другим объектом настоящего изобретения является модифицированная АСМ также включающая область Fc человека. Согласно одному из вариантов осуществления настоящего изобретения область Fc модифицированной АСМ модифицирована таким образом, что включает в себя измененные олигосахариды. В одном из конкретных вариантов осуществления настоящего изобретения область Fc была модифицирована для понижения пропорции остатков фукозы по сравнению с немодифицированной областью Fc. В другом конкретном варианте осуществления настоящего изобретения область Fc содержит повышенную пропорцию разветвленных олигосахаридов по сравнению с немодифицированной областью Fc. В еще одном конкретном варианте осуществления настоящего изобретения модифицированные олигосахариды являются разветвленным комплексом. В другом варианте осуществления настоящего изобретения модифицированные олигосахариды обладают повышенной пропорцией разветвленных нефукозилированных олигосахаридов в области Fc по сравнению с немодифицированной областью Fc. В одном из конкретных вариантов осуществления настоящего изобретения область Fc содержит повышенную пропорцию остатков N-ацетилглюкозамина (GlcNAc) по отношению к остаткам фукозы в модифицированной области Fc по сравнению с немодифицированной областью Fc. В конкретном варианте осуществления настоящего изобретения разветвленными нефукозилированными олигосахаридами являются гибридные олигосахариды. В другом конкретном варианте осуществления настоящего изобретения разветвленные нефукозилированные олигосахариды являются комплексными.
Другим объектом настоящего изобретения является рецептор на поверхности клеток, выбранный из группы, состоящей из мембранного транспортного рецептора, G-белок-связывающего рецептора и фермент-связывающего рецептора. В одном из конкретных вариантов осуществления настоящего изобретения мембранный транспортный рецептор является канал-сцепленным рецептором. В другом конкретном варианте осуществления настоящего изобретения ферментсвязанный рецептор выбран из группы, состоящей из рецепторных гуанилилциклаз, рецепторных тирозинкиназ, титрозинкиназа-связанных рецепторов, рецепторных тирозинфосфатаз и рецепторных серин/треонин киназ.
Другой объект настоящего изобретения связан с фармацевтической композицией, включающей модифицированную АСМ настоящего изобретения. Предполагается, что фармацевтическая композиция также может включать фармацевтически приемлемый носитель, адъювант или их комбинацию.
Настоящее изобретение также относится к способу лечения заболевания, которое поддается лечению за счет измененной клеточной сигнальной активности у пациента, заключающемуся во введении пациенту терапевтически эффективного количества фармацевтической композиции, включающей модифицированную АСМ согласно настоящему изобретению и фармацевтически приемлемый носитель.
Другой объект настоящего изобретения связан с выделенным полинуклеотидом, кодирующим полипептид, включающий вариабельную область тяжелой или легкой цепи, причем вариабельная область тяжелой или легкой цепи включает по меньшей мере одну замену аминокислотного остатка по меньшей мере в одном каркасном участке, по сравнению с исходной вариабельной областью тяжелой или легкой цепи, в результате которого происходит изменение клеточной сигнальной активности антигена-мишени, если полипептид объединяется с антигеном-мишенью.
Другой объект настоящего изобретения связан с выделенным полинуклеотидом, кодирующим полипептид, включающий вариабельную область тяжелой или легкой цепи, причем вариабельная область тяжелой или легкой цепи включает по меньшей мере одну замену аминокислотного остатка по меньшей мере в одном каркасном участке, по сравнению с исходной вариабельной областью тяжелой или легкой цепи, причем полипептид имеет измененную способность опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней в результате такой замены.
В одном из вариантов осуществления настоящего изобретения полинуклеотид по настоящему изобретению кодирует полипептид, включающий легкую или тяжелую цепь антитела. В другом варианте осуществления настоящего изобретения полинуклеотид настоящего изобретения кодирует полипептид, причем этот полипептид представляет гибридный белок. Настоящее изобретение также относится к полипептидам, кодируемым полинуклеотидами настоящего изобретения.
Настоящее изобретение также относится к вектору, включающему полинуклеотид согласно настоящему изобретению и клетку-хозяина, включающую этот вектор.
Настоящее изобретение также относится к полинуклеотиду, кодирующему полипептид, включающий вариабельную область тяжелой или легкой цепи, в котором содержится по меньшей мере один аминокислотный остаток по меньшей мере в одном каркасном участке вариабельной области тяжелой или легкой цепи, по сравнению с вариабельной областью тяжелой или легкой исходной антигенсвязывающей молекулы, причем полипептид является модифицированной АСМ согласно настоящему изобретению.
Настоящее изобретение также относится к клетке-хозяину, сконструированной таким образом, что она способна экспрессировать по меньшей мере одну нуклеиновую кислоту, кодирующую полипептид, проявляющий активность β(1,4)-N-ацетилглукозамилтрансферазы III, в количестве, достаточном для модификации олигосахаридов в области Fc полипептида, образуемого клеткой-хозяином, причем полипептид является модифицированной АСМ по настоящему изобретению. В одном из вариантов осуществления настоящего изобретения полипептид, обладающий активностью β(1,4)-N-ацетилглукозаминилтрансферазы III, является гибридным полипептидом. В одном из вариантов осуществления настоящего изобретения гибридный полипептид представляет каталитический домен β(1,4)-N-ацетилглукозаминилтрансферазы III. В другом варианте осуществления настоящего изобретения гибридный полипептид также включает домен локализации Гольджи гетерологического резидентного полипептида Гольджи. Домен локализации Гольджи может быть выбран из группы, включающей домен маннозидазы II, домен локализации β(1,2)-N- ацетилглюкозаминилтрансферазы I, домен локализации β(1,2)-N- ацетилглюкозаминилтрансферазы II, домен локализации маннозидазы I и домен локализации а 1-6 капсидной фукозилтрансферазы, но ими перечень не ограничивается.
В другом варианте осуществления настоящего изобретения АСМ включает область, эквивалентную области Fc в IgG человека.
В другом варианте осуществления настоящего изобретения АСМ, выделяемая клеткой-хозяином настоящего изобретения, проявляет повышенное связывающее сродство Fc и/или повышенную эффекторную функцию в связи с олигосахаридной модификацией. Согласно настоящему изобретению повышенная эффекторная функция выбрана из группы, включающей: повышенную Fc-опосредованную клеточную цитотоксичность, повышенное связывание с природными клетками-киллерами (ПКК), повышенное связывание с макрофагами, повышенное связывание с ПКК полиморфоядерными клетками, повышенное связывание с моноцитами, повышенный направленный сигнал-индуцируемый апоптоз, повышенное созревание дендровидных клеток и повышенное примирование Т-клеток. В одном из вариантов осуществления настоящего изобретения рецептор Fc является Fcγ-активирующим рецептором. В другом варианте осуществления настоящего изобретения рецептор Fc receptor является рецептором FcγRIIIA.
Согласно настоящему изобретению клетка-хозяин может быть выбрана из группы, которая включает клетки: СНО, HEK293-EBNA, BHK, NSO, SP2/0, клетки миеломы YO, клетки миеломы мыши Р3Х63, PER, PER.C6 или клетки гибридомы.
Другой вариант осуществления настоящего изобретения связан со способом получения модифицированной АСМ, включающей вариабельную область тяжелой или легкой цепи, включающую по меньшей мере одну замену аминокислотного остатка по меньшей мере в одном каркасном участке вариабельной области тяжелой или легкой цепи по сравнению с вариабельной областью тяжелой или легкой цепи исходной АСМ, причем замена приводит к изменению клеточной сигнальной активности антигена-мишени, если модифицированная АСМ объединяется с антигеном-мишенью; указанный способ включает: (i) культивирование клетки-хозяина настоящего изобретения в условиях, допускающих экспрессию полинуклеотида, и (ii) выделение модифицированной АСМ из культуральной среды.
Другой объект настоящего изобретения связан со способом получения модифицированной АСМ, включающей вариабельную область тяжелой или легкой цепи, включающей по меньшей мере одну замену аминокислотного остатка по меньшей мере в одном каркасном участке вариабельной области тяжелой или легкой цепи по сравнению с вариабельной областью тяжелой или легкой цепи исходной антигенсвязывающей молекулы, в которой модифицированная антигенсвязывающая молекула обладает измененной способностью опосредовать перекрестное сшивание в результате замены, который включает: (i) культивирование клетки-хозяина настоящего изобретения в условиях, допускающих экспрессию полинуклеотида, и (ii) выделение модифицированной АСМ из культуральной среды.
Другой объект настоящего изобретения связан со способом изменения способности АСМ облегчать формирование комплексов, включающих антиген-мишень антигенсвязывающей молекулы (АСМ), который содержит: замену по меньшей мере одного аминокислотного остатка по меньшей мере в одном каркасном участке вариабельной области тяжелой или легкой цепи исходной АСМ. В одном из вариантов осуществления настоящего изобретения АСМ повышает индукцию апоптоза в клетке, экспрессирующей антиген-мишень. В другом варианте осуществления настоящего изобретения АСМ повышает индукцию клеточной дифференциации в клетке, экспрессирующей антиген-мишень.
Настоящее изобретение также относится к способу индукции апоптоза в клетке, способу, включающему контактирование клетки с модифицированной АСМ, включающей вариабельную область тяжелой или легкой цепи, которая включает по меньшей мере одну замену аминокислотного остатка по меньшей мере в одном каркасном участке указанной вариабельной области тяжелой или легкой цепи по сравнению с вариабельной областью тяжелой или легкой цепи исходной АСМ, в которой модифицированная АСМ обладает повышенной способностью индуцировать апоптоз по сравнению с исходным полипептидом. В одном из конкретных вариантов осуществления настоящего изобретения клетка является опухолевой клеткой. В одном из вариантов осуществления настоящего изобретения контактирование происходит in vivo.
Другой объект настоящего изобретения также связан со способом лечения заболевания или расстройства, которое поддается лечению измененной клеточной сигнальной активностью антигена-мишени, со способом, представляющим введение субъекту, нуждающемуся в этом, терапевтически эффективного количества модифицированной АСМ, причем модифицированная АСМ включает вариабельную область тяжелой или легкой цепи, включающей по меньшей мере одну замену аминокислоты по меньшей мере в одном каркасном участке вариабельной области тяжелой или легкой цепи по сравнению с вариабельной областью тяжелой или легкой цепи исходной АСМ, причем замена приводит к измененной активности передачи клеточного сигнала антигена-мишени, если модифицированная АСМ объединена с антигеном-мишенью.
Другой объект настоящего изобретения также связан со способом лечения заболевания или расстройства, которое поддается лечению измененной способностью опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней, способом, включающим введение субъекту, нуждающемуся в этом, терапевтически эффективного количества модифицированной АСМ, в котором модифицированная АСМ включает вариабельную область тяжелой или легкой цепи, содержащей по меньшей мере одну замену аминокислоты по меньшей мере в одном каркасном участке вариабельной области тяжелой или легкой цепи по сравнению с вариабельной областью тяжелой или легкой цепи исходной АСМ, причем модифицированная АСМ обладает способностью опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней в качестве результата такой замены.
В одном из конкретных вариантов осуществления настоящего изобретения модифицированная АСМ, вводимая согласно настоящему изобретению, включает вариабельную область тяжелой цепи, выбранную из группы, включающей последовательности: SEQ ID NO:4, SEQ ID NO:36 и SEQ ID NO:38.
В одном из вариантов осуществления настоящего изобретения заболевание или расстройство, подвергаемое лечению модифицированной АСМ по настоящему изобретению, является расстройством, связанным с пролиферацией клеток. В другом варианте осуществления, настоящего изобретения расстройство, связанное с пролиферацией клеток, является раком. В еще одном варианте осуществления настоящего изобретения заболевание или расстройство, подвергаемое лечению модифицированной АСМ по настоящему изобретению, является расстройством В-клеток. В конкретном варианте осуществления настоящего изобретения расстройство В-клеток является В-клеточной лимфомой.
Настоящее изобретение также связано с применением модифицированной АСМ по настоящему изобретению для получения лекарственного средства для лечения или профилактики рака.
В одном из конкретных вариантов осуществления настоящее изобретение связано с применением модифицированной АСМ по настоящему изобретению для получения лекарственного средства для лечения или профилактики рака, выбранного из группы, включающей: В-клеточную лимфому, рак груди, рак мочевого пузыря, рак головы и шеи, рак кожи, рак поджелудочной железы, рак легких, рак яичника, рак толстой кишки, рак простаты, рак почек и рак мозга.
В другом конкретном варианте осуществления настоящее изобретение связано с применением модифицированной АСМ по настоящему изобретению для получения лекарственного средства для лечения или профилактики рака, в котором указанная антигенсвязывающая молекула используется в терапевтически эффективном количестве, составляющем примерно от 1,0 мг/кг до примерно 15 мг/кг. В другом варианте осуществления настоящего изобретения терапевтически эффективное количество составляет примерно от 1,5 мг/кг до примерно 12 мг/кг. В еще одном из вариантов осуществления настоящего изобретения терапевтически эффективное количество составляет примерно от 1,5 мг/кг до примерно 4,5 мг/кг. В другом варианте осуществления настоящего изобретения терапевтически эффективное количество составляет примерно от 4,5 мг/кг до примерно 12 мг/кг. В еще одном из вариантов осуществления настоящего изобретения терапевтически эффективное количество составляет примерно 1,5 мг/кг. В другом варианте осуществления настоящего изобретения терапевтически эффективное количество составляет примерно 4,5 мг/кг. В еще одном варианте осуществления настоящего изобретения терапевтически эффективное количество составляет примерно 12 мг/кг.
Настоящее изобретение также относится к способу лечения или профилактике рака, включающему введение терапевтически эффективного количество фармацевтической композиции настоящего изобретения пациенту, нуждающемуся в этом. В одном из конкретных вариантов осуществления настоящего изобретения рак выбран из группы, включающей: В-клеточную лимфому, рак груди, рак мочевого пузыря, рак головы и шеи, рак кожи, рак поджелудочной железы, рак легких, рак яичника, рак толстой кишки, рак простаты, рак почек и рак мозга.
Настоящее изобретение также относится к способу лечения или профилактики предракового состояния или нарушения, включающему введение терапевтически эффективного количества фармацевтической композиции по пункту 85 или 158 пациенту, нуждающемуся в этом. В одном из конкретных вариантов осуществления настоящего изобретения предраковое состояние или нарушение выбрано из группы, включающей лейкоплакию ротовой полости, актинический кератоз (старческие бородавки), предраковые полипы толстой или прямой кишки, желудочную эпителиальную дисплазию, аденоматозную дисплазию, синдром наследственного неполипозного рака толстой кишки (СННРТК), язву пищевода Баррета, дисплазию мочевого пузыря и предраковые цервикальные состояния.
Настоящее изобретение также относится к модифицированной антигенсвязывающей молекуле настоящего изобретения для лечения или профилактики рака. В одном из вариантов осуществления настоящего изобретения рак выбран из группы, включающей В-клеточную лимфому, рак груди, рак мочевого пузыря, рак головы и шеи, рак кожи, рак поджелудочной железы, рак легких, рак яичника, рак толстой кишки, рак простаты, рак почек и рак мозга.
Настоящее изобретение также относится к модифицированной антигенсвязывающей молекуле настоящего изобретения для применения в лечении или профилактике предракового состояния или нарушения. В одном из вариантов осуществления настоящего изобретения предраковое состояние или нарушение выбрано из группы, включающей лейкоплакию ротовой полости, актинический кератоз (старческие бородавки), предраковые полипы толстой или прямой кишки, желудочную эпителиальную дисплазию, аденоматозную дисплазию, синдром наследственного неполипозного рака толстой кишки (СННРТК), язву пищевода Баррета, дисплазию мочевого пузыря и предраковые цервикальные состояния.
Настоящее изобретение также относится к модифицированной антигенсвязывающей молекуле настоящего изобретения для применения в лечении расстройства, связанного с измененной сигнальной активностью и/или измененным сшиванием одного или нескольких антигенов-мишеней.
Краткое описание фигур
Фиг.1. Выверка аминокислотных последовательностей различных конструкций вариабельной области тяжелой цепи анти-CD20 антитела. Аминокислотную последовательность вариабельной области тяжелой цепи моноклонального антитела 1F5 используют в качестве контрольной последовательности. Отличия аминокислот при сопоставлении с 1F5 затенены.
Фиг.2. Связывание различных гуманизированных анти-CD20 антител с В-клетками Raji. Исходное (химерное) антитело В-ly1 сравнивают с двумя гуманизированными вариантами тяжелой цепи, для которых было установлено, что они индуцируют сильный апоптоз (ВНН2 и ВНН6), а также с теми производными (гуманизированного не вызывающего апоптоза) варианта B-HL8, которые предположительно восстанавливают данный эффект (варианты от В-HL11 до В-HL 17). Все гуманизированные варианты тяжелой цепи спаривают с одним и тем же гуманизированным вариантом легкой цепи BKV1.
Фиг.3. Связывание ритуксимаба (О) и chB-ly1 (Δ) с CD20 на В-клетках лимфомы Raji.
Фиг.4. Сравнение индукции антителозависимого апоптоза тремя анти-CD20 антителами. Антитело chB-ly1 wt представляет конструкцию химерного антитела В-ly1, включающую вариабельную область грызуна и константную область человека. Антитело BHH2-BKV1 представляет гуманизированный вариант, включающий CDR антитела грызуна В-ly1 и каркасные участки человека, полученные из класса VH1 генов V клеток зародышевой линии человека для тяжелой цепи, и спаренную с BKV1 легкую цепь гуманизированного антитела В-ly1. Антитело BHL8-BKV1wt представляет гуманизированный вариант, включающий CDR мышиного антитела В-ly1 и каркасные участки человека, полученные от генов V от клеток двух разных зародышевых линий человека, спаренное с легкой цепью BKV1 гуманизированного антитела В-ly1.
Фиг.5. Сравнение индукции антителозависимого апоптоза пятью гуманизированными вариантами анти-CD20 антитела В-ly1. Вариант антитела BHH2-BKV1 представляет гуманизированный вариант, включающий CDR антитела грызунов В-ly1 и каркасные участки человека, полученные из класса VH1 для тяжелой цепи (ВНН2) и спаренные с BKV1 легкой цепи гуманизированного антитела В-ly1. Вариант антитела BHL8-BKV1wt представляет гуманизированный вариант, включающий CDR антитела грызуна В-ly1 и каркасные участки человека, полученные от генов V клеток двух разных зародышевых линий человека и спаренные с BKV1 легкой цепи гуманизированного антитела В-ly1. Вариант антитела BHL14-BKV1 представляет производное BHL8 с заменой валина лизином по положению 12 по нумерации Kabat и с заменой валина метионином по положению 48 по нумерации Kabat в вариабельной области тяжелой цепи, спаренное с конструкцией BKV1 легкой цепи. Вариант антитела BHL15-BKV1 W1 также представляет производное BHL8 с заменой глицина серином в положении 16 по нумерации Kabat и валина метионином в положении 48 по нумерации Kabat в вариабельной области тяжелой цепи, спаренное с конструкцией BKV1 легкой цепи. Вариант антитела BHL16-BKV1 W1 является производным антитела BHL8 с заменой лейцина валином в положении 20 по нумерации Kabat и валина метионином в положении 48 по нумерации Kabat в вариабельной области тяжелой цепи, спаренным с конструкцией легкой цепи антитела BKV1. Вариант антитела BHL17-BKV1 W1 является производным антитела BHL8 с заменой валина метионином в положении 48 по нумерации Kabat в вариабельной области тяжелой цепи и спарено с конструкцией легкой цепи антитела BKV1.
Фиг.6. Сопоставление индукции апоптоза в клетках Z-138, вызываемой by С2В8 анти-CD20 моноклональным антителом и двумя гуманизированными вариантами антитела B-ly1, BHH2-BKV1 и BHL13-BKV1. Вариант антитела BHH2-BKV1 представляет гуманизированный вариант, включающий CDR антитела B-ly1 грызунов и каркасные участки человека, полученные из класса VH1 генов V зародышевой линии человека для тяжелой цепи, спаренный с BKV1 легкой цепи гуманизированного антитела B-ly1. Вариант антитела BHL13-BKV1 является производным антитела BHL8 (см. фиг.5 выше) с заменой лейцина на валин в положении 11 по нумерации Kabat и заменой валина на метионин в положении 48 по нумерации Kabat в вариабельной области тяжелой цепи и спарен с легкой цепью BKV1.
Фиг.7. Истощение В-клеток ритуксимабом (◇) и chB-ly1 (■) в цельной крови трех разных классов генотипа of FcγRIIIa-158V/F: (А) цельная кровь донора F/F, гомозиготного по рецептору с пониженным сродством, (Б) цельная кровь донора F/V, гетерозиготного по рецептору аффинности, и (В) цельная кровь донора V/V, гомозиготного по рецептору с повышенным сродством.
Фиг.8. Профиль MALDI-TOF гликоинженерного химерного антитела B-ly1. (А) Таблица, представляющая процентные содержания специфических пиков, (Б) Спектр гликоинженерного химерного антитела B-ly1, (В) Спектр гликоинженерного химерного антитела В-Ly1, обработанного Endo-H.
Фиг.9. Связывание различных гуманизированных анти-CD20 антител с В-клетками Raji. Отличия конструкции В-НН2 от конструкций B-HL8 и B-HL11 локализованы в каркасных участках 1 и 2 со всеми тремя CDR, которые являются идентичными. Конструкции B-HL8 и B-HL11 имеют последовательности каркасных участков, являющихся производными класса VH3 человека, хотя полный каркасный участок В-НН2 является производным VH1 человека. B-HL11 является производным B-HL8 с единичной мутацией Glu1Gln, причем Gln является остатком аминокислоты в конструкции В-НН2. Это означает, что замена Glu1Gln не изменяет связывающей аффинности или интенсивности. Другие отличия между В-НН2 и B-HL8 заключаются в остатках 14 FR, из которых один или несколько могут влиять на антигенсвязывающее свойство этого антитела.
Фиг.10. Связывание гуманизированного анти-CD20 антитела BHL4-BKV1 на клетках-мишенях Raji. Конструкция B-HL4 получена из антитела В-НН2 заменой каркасного участка FR1 в В-НН2 на каркасный участок последовательности IGHV1-45 (номер Х92209) зародышевой линии человека. Эта конструкция показывает уменьшенную антигенсвязывающую способность, несмотря на наличие разных аминокислот только по четырем положениям в каркасном участке FR1. Эти остатки локализованы в положениях 2, 14, 28 и 30 по нумерацииа Kabat. Предполагается, что среди них важное значение имеют положения 28 и 30, поскольку составляют часть CDR1 по нумерации Chothia.
Фиг.11. Сравнение способности к связыванию между В-НН1, В-НН2, В-НН3 (все спарены с BKV1 легкой цепи гуманизированноего антитела В-ly1) и исходным антителом В-ly1. Эти данные показывают, что все антитела показывают близкие величины ЕС50, но конструкция В-НН1 связывает с пониженной интенсивностью/ стехиометрией по сравнению с вариантами В-НН2 и В-НН3. В-НН1 можно отличить от В-НН2 и В-НН3 по частично гуманизированным областям CDR1 и CDR2 (по определению Kabat) и полиморфизму Ala/Thr в положении 28 (по нумерации Kabat). Это означает, что или положение 28, или целая область CDR1, и/или целая область CDR2 важны для взаимодействия антитела с антигеном.
Фиг.12. Сравнение связывающей активности между B-HL1, В-НН1 и исходным антителом В-ly1. Представленные данные показывают отсутствие какой-либо связывающей активности конструкции B-HL1 и примерно в два раза меньшую активность по интенсивности связывания/стехиометрии В-НН1 по сравнению с антителом В-ly1. И B-HL1, и В-НН1, сконструированы на основе акцепторных каркасных участков, производных от класса VH1 человека. Среди других отличий наиболее значительным является отличие по положению 71 (по нумерации Kabat) конструкции B-HL1, имеющее важное значение для связывания антигена.
Фиг.13. Сравнение связывания конструкций B-HL2 и B-HL3 тяжелой цепи анти-CD20 антитела с их антигеном. В обоих случаях последовательность VL грызунов объединена с гуманизированными тяжелыми цепями. Эти данные показывают, что конструкции B-HL2 и B-HL3 не проявляют связывающей активности с антигеном CD-20.
Фиг.14. Апоптическое действие анти-CD20 антител на клетки тучноклеточного лейкоза Z-138 MCL.
Фиг.15. Апоптоз, вызванный анти-CD20 антителами. Подробности исследования: 5×105 клеток/лунку засевают в 24-луночные планшеты (5×105 клеток/мл) в культуральную среду. В лунки добавляют до конечной концентрации 10 мкг/мл соответствующего антитела, ФСБ для отрицательного контроля или 5 мМ камптотецина для положительного контроля. Образцы инкубируют в течение ночи (16 ч), окрашивают AnnV-FITC и анализируют FACS. Исследования проводят в трех повторах. (*): Сигнал для одного ФСБ вычитают (один ФСБ дает 8% и 2% AnnV+ для клеток PR-1 и Z-138, соответственно. Используют антитела: С2 В8 (химерное, не подвергнутое гликоинженерии); BHH2-BKV1 (гуманизированное, не подвергнутое гликоинженерии). Примечание: настоящее исследование не включает какие-либо дополнительные эффекторные клетки, только мишени + антитело или контроли.
Фиг.16. Уничтожение клеток-мишеней анти-CD20 антителами с иммунными эффекторными клетками. Подробности исследования: истощение В-клеток в нормальной целой крови определяют инкубированием в течение ночи и анализируют методом FACS на CD19+/CD3+. ADCC определяют, используя в качестве эффекторов мононуклеарные клетки периферической крови (МКПК) при инкубировании в течение 4 ч и при соотношении 25:1 эффектора к мишени. Уничтожение клеток-мишеней измеряют по задержке кальцеина по сравнению с лизисом детергентом (100%) и лизисом без антител (0%). Используют следующие антитела: С2 В8 (химерное, не подвергнутое гликоинженерии), BHH2-BKV1-дт (гуманизированная, не подвергнутая гликоинженерии форма BHH2-BKV1), BHH2-BKV1-GE (гуманизированная, подвергнутая гликоинженерии форма BHH2-BKV1).
Фиг.17. Профиль MALDI/TOF-MS PNGaseF-высвобожденных Fc-олигосахаридов немодифицированного не подвергавшегося гликоинженирингу BHH2-BKV1 гуманизированного IgG1 B-ly1 антитела к человеческому CD20 антитела.
Фиг.18. Профиль MALDI/TOF-MS PNGaseF-высвобожденных Fc-олигосахаридов подвергшегося гликоинженирингу BHH2-BKV1 гуманизированного IgG1 B-ly1 антитело к человеческому CD20 антитела. Гликоинжениринг проводят совместной экспрессией в клетках-хозяевах генов антител и гена, кодирующего фермент с каталитической активностью β-1,4-N-ацетилглюкозаминилтрансферазы III (GnT-III).
Фиг.19. Профиль MALDI/TOF-MS PNGaseF-высвобожденных Fc-олигосахаридов гликоинженерного BHH2-BKV1g2 гуманизированного IgG1 В-ly1 анти-человеческого CD20 антитела. Гликоинжениринг проводят совместной экспрессией в клетках-хозяевах генов антител и генов, кодирующих фермент с каталитической активностью β-1,4-N-ацетилглюкозаминилтрансферазы III (GnT-III) и кодирующих фермент с каталитической активностью α-маннозидазы II Гольджи.
Фиг.20. Связывание антител, подвергнутых гликоинженерии и не подвергнутых ей (g2 версия; профили гликозилирования см. на фиг.17-19), с рецептором FcγRIIIa человека, проявляемых на поверхности клеток СНО, экспрессирующих рекомбинантный CD16.
Фиг.21. Апоптическое действие анти-CD20 антител, подвергнутых и не подвергнутых гликоинженерии в области Fc, на клетки тучноклеточного лейкоза Z-138. Подробности исследования: 5×105 клеток/лунку засевают в 24-луночные планшеты (5×105 клеток/мл) в культуральную среду. В лунки добавляют до конечной концентрации 10 мкг/мл соответствующего антитела или ФСБ для отрицательного контроля. Образцы инкубируют в течение ночи (16 ч), окрашивают AnnV-FITC и анализируют с помощью FACS. Исследования проводят в трех повторах. Используют антитела: С2В8=ритуксимаб (химерное, не подвергнутое гликоинженерии антитело), BHH2-BKV1 (гуманизированное, не подвергнутое гликоинженерии - профили гликозилирования см. на фиг.17-19), BHH2-BKV1g1 (гуманизированное, подвергнутое гликоинженерии), BHH2-BKV1g2 (гуманизированное, подвергнутое гликоинженерии). Примечание: данное исследование не включает какие-либо эффекторные клетки, только мишени + антитело или контроль. (*): Сигнал для ФСК вычитают.
Фиг.22. Связывание разных гуманизировапных анти-CD20 антител с В-клетками Raji. Конструкцию ВНН2 гуманизированной тяжелой цепи сравнивают с ее производными ВНН4 и ВНН7. Кроме того, показанные варианты являются вариантами, которые определяют влияние положений 28 и 30 по нумерации Kabat (BHH8 и ВНН9).
Фиг.23. Воздействие единственной замены аминокислоты на апоптоз анти-CD20 антителами клеток тучноклеточного лейкоза Z-138. Подробности исследования: 5×105 клеток/лунку засевают в 24-луночные планшеты (5×105 клеток/мл) в культуральную среду. В лунки добавляют до конечной концентрации 10 мкг/мл соответствующего антитела или ФСБ для отрицательного контроля (без антитела). Образцы инкубируют в течение ночи (16 ч), окрашивают AnnV-FITC и анализируют с помощью FACS. Исследования проводят в трех повторах. Используют антитела: С2 В8 (химерное, не подвергнутое гликоинженерии антитело), BHH2-BKV1 (гуманизированное, не подвергнутое гликоинженерии), ВНН2-А (производное ВНН2 с заменой валина лейцином в положении 11 по нумерации Kabat) и ВНН2-В (производное ВНН2 с заменой лизина валином в положении 12 по нумерации Kabat), три последних антитела спарены с легкой цепью BKV1. KD связывания антигена в результате замены остается без изменений. Примечание: данное исследование не включает какие-либо эффекторные клетки, только мишени + антитело или контроль. (*): Сигнал для ФСК вычитают.
Фиг.24. Воздействие одиночной аминокислотной замены на апоптоз прежде неактивных анти-CD20 антител на клетки тучноклеточного лейкоза Z-138 MCL. Подробности исследования: 5×105 клеток/лунку засевают в 24-луночные планшеты (5×105 клеток/мл) в культуральную среду. В лунки добавляют до конечной концентрации 10 мкг/мл соответствующего антитела или ФСБ для отрицательного контроля. Образцы инкубируют в течение ночи (16 ч), окрашивают AnnV-FITC и анализируют с помощью FACS. Исследования проводят в трех повторах. Используют антитела: С2В8 (химерное, не подвергнутое гликоинженерии антитело), BHL8 (гуманизированное, не подвергнутое гликоинженерии), BHL13 (производное BHL8 с заменой лейцина валином в положении 11 и валина метионином в положении 48 по нумерации Kabat) и BHL14 (производное BHL8 с заменой валина лизином в положении 12 и валина метионином в положении 48 по нумерации Kabat), три последних антитела спарены с легкой цепью BKV1. Примечание: данное исследование не включает какие-либо эффекторные клетки, только мишени + антитело или контроль.
Фиг.25. Влияние замены одной аминокислоты в легкой цепи на апоптоз, вызываемый анти-CD20 антителами в клетках Z-138 MCL. Проведение исследования: 5×105 клеток/лунку засевают в 24-луночные планшеты (5×105 клеток/мл) в культуральную среду. Конечная концентрация 10 мкг/мл соответствующего антитела, ФСБ в качестве отрицательного контроля (без антитела) или 5 мМ камптотецина для положительного контроля вносят в лунки. Образцы инкубируют в течение ночи (16 ч), окрашивают AnnV-FITC и анализируют FACS. Исследования проводят в трех повторах. Используют следующие антитела: антитело ВНН2-А (производное ВНН2 с заменой валина на лейцин в положении 11 по нумерации Kabat), спаренное с легкой цепью BKV1, антитело ВНН6 (производное ВНН2 с заменой метионина на изолейцин в положении 34 по нумерации Kabat), спаренное с легкой цепью BKV1, и антитело ВНН6, спаренное с легкой цепью BKV14 (производное BKV1 с заменой изолейцина аланином в положении 106 по нумерации Kabat).
Фиг.26. Трехмерное изображение молекулярного «шаровидного сустава» на границе доменов VH и СН1.
Подробное описание изобретения
Термины, используемые в настоящем изобретении, в основном являются общеупотребимыми, в противном случае ниже приводится их объяснение.
В контексте настоящего изобретения понятие «антигенсвязывающая молекула (АСМ)» относится в самом широком смысле к молекуле, которая специфически связывает антигенный детерминант. Понятие «специфически связывает» означает, что связывание является выборочным для антигена и может быть отличимо от нежелательных или неспецифических взаимоотношений. В контексте настоящего изобретения понятие «модифицированная антигенсвязывающая молекула (или модифицированная АСМ)» относится к АСМ, включающей замену по меньшей мере одного аминокислотного остатка в вариабельной области тяжелой цепи и/или области СН1, и/или замену по меньшей мере одного аминокислотного остатка в вариабельной области легкой цепи, и/или области CL.
Используемое в настоящем изобретении понятие «антитело» подразумевает целые молекулы антител, в том числе моноклональных, поликлональных и мультиспецифичных (например, биспецифичных) антител, а также фрагменты антител, обладающие областью Fc, сохраняющие специфичность связывания, и гибридные белки, которые включают область, эквивалентную области Fc иммуноглобулина, и сохраняют специфичность связывания. Настоящее понятие также относится к фрагментам антител, у которых сохранилась специфичность связывания, например, фрагменты VH, фрагменты VL, фрагменты Fab, фрагменты F(ab')2, фрагменты scFv, фрагменты Fv, миниантитела, двойные антитела, тройные антитела и четвертичные антитела, но ими перечень не ограничивается (см., например, Hudson и Souriau, Nature Med. 9, 2003, cc.129-134, сущность которого приведена в настоящем изобретении в виде ссылки). Настоящее понятие также относится к гуманизированным, приматизированным и химерным антителам. В контексте настоящего изобретения понятие целого антитела относится к молекуле иммуноглобулина, включающей две тяжелые цепи и две легкие цепи, каждая из которых включает вариабельную и постоянную область.
В контексте настоящего изобретения понятие «вариабельная область» относится к N-концевому домену тяжелой или легкой цепи иммуноглобулина. Согласно одному из вариантов осуществления настоящего изобретения модифицированная АСМ может включать функциональный фрагмент вариабельной области.
В контексте настоящего изобретения понятие «вариабельная область тяжелой цепи» относится к N-концевому домену тяжелой цепи иммуноглобулина. В одном примере вариабельная область тяжелой цепи выражается по Kabat положениями 1-113 (с возможными инсерциями по определенным остаткам по Kabat и др., в кн.: «Sequence of Proteins of Immunological Interest», 1983, изд-во Департамента здравоохранения и сферы услуг США). В одном из вариантов осуществления настоящего изобретения модифицированная АСМ может включать функциональный фрагмент вариабельной области тяжелой цепи.
В контексте настоящего изобретения понятие «постоянная область тяжелой цепи» относится к C-концевому домену тяжелой цепи иммуноглобулина. Существует пять природных классов постоянных областей тяжелой цепи: IgA, IgG, IgE, IgD и IgM. В одном из примеров постоянная область тяжелой цепи включает домены СН1, СН2 и СН3.
В контексте настоящего изобретения понятие «область СН1» означает домен тяжелой цепи иммуноглобулина, который является C-концевым по отношению к вариабельной области и N-концевым по отношению к шарнирной области. В иммуноглобулине типа IgG область СН1 по Kabat в норме выражена положениями 114-228.
В контексте настоящего изобретения понятие «апоптоз» относится к запрограммированной гибели клетки, которой свойственны определенные клеточные изменения, например, фрагментация ядра и/или формирование апоптических тел путем конденсации цитоплазмы, плазматических мембран и/или органелл.
В контексте настоящего изобретения понятие «агонистическая активность» относится к активности агента (например, антигенсвязывающей молекулы) при его взаимодействии (например, связывании) с молекулой, ассоциированной с поверхностью клетки, и инициации или индукции реакции.
В контексте настоящего изобретения понятие «антагонистическая активность» относится к активности агента (например, антигенсвязывающей молекулы) при его взаимодействии (например, связывании) с молекулой на поверхности клетки и в результате предупреждает инициацию или индукцию реакции или прекращает текущую реакцию.
В контексте настоящего изобретения понятия «гибридный» и «химерный» применительно к полипептидам, например, АСМ, относятся к полипептидам, включающим аминокислотные последовательности, производные от двух или нескольких гетерологичных пептидов, например, частей антител от разных видов. Для получения химерных АСМ компоненты, не обладающие антигенсвязывающим свойством, например, могут быть получены от разнообразных видов, в том числе от приматов, например, от шимпанзе и людей. Постоянная область химерной АСМ наиболее предпочтительно в основном идентична постоянной области природного антитела человека, а вариабельная область химерного антитела наиболее предпочтительно является производной антигенсвязывающей молекулы (полученной не от человека, а от другого донора), которая специфически связывает исследуемый антиген. Химерная АСМ может включать полную вариабельную область донора, в другом варианте химерное антитело может включать гуманизированное или приматизированное антитело. Гуманизированные антитела являются наиболее предпочтительными формами гибридного или химерного антитела.
В контексте настоящего изобретения понятие «гуманизированное» относится к антигенсвязывающей молекуле, являющейся производной антигенсвязывающей молекулы, полученной не от человека, например, мышиному антителу, которое сохраняет или в существенной степени сохраняет антигенсвязывающие свойства исходной молекулы, но которое в меньшей степени иммуногенно для людей. Это может быть достигнуто различными способами, включая (а) пересадку целых вариабельных доменов, полученных не от человека, в постоянные области человека для получения химерных антител, (б) пересадку только CDR, полученных не от человека, в каркасный участок и постоянные области человека, сохраняя или не сохраняя принципиально важные каркасные участки (например, те, которые важны для сохранения хорошего антигенсвязывающего сродства или функций антитела), или (в) пересадку целых вариабельных доменов, полученных не от человека, но «маскируя» их участком, подобным гуманизированному, путем замены поверхностных остатков. Такие способы описаны Jones и др., Morrison и др., Proc. Natl. Acad. Sci., 81, 1984, cc.6851-6855, Morrison и Oi, Adv. Immunol., 44, 1988, cc.65-92, Verhoeyen и др., Science, 239, 1988, cc.1534-1536, Padlan, Molec. Immun., 28, 1991, cc.489-498, Padlan, Molec. Immun., 31, 1994, cc.169-217; все эти работы включены в настоящее описание в виде ссылок на их сущность.
Обычно имеется три комплементарно детерминированные области (complementarity determining regions - CDR), CDR1, CDR2 и CDR3, в каждом из переменных доменов тяжелых и легких цепей антитела, которые фланкированы четырьмя каркасными субучастками (т.е., FR1, FR2, FR3 и FR4) в каждом из переменных доменов тяжелых и легких цепей антитела: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. С обсуждением гуманизированных антител наряду с другими работами можно ознакомиться в патенте US 6632927 и опубликованной заявке US No. 2003/0175269, сущность которых включена в настоящее описание в виде ссылок.
Схожим образом в контексте настоящего изобретения понятие «приматизированная» относится к антигенсвязывающей молекуле, являющейся производной антигенсвязывающей молекулы не из организма примата, например, антитела грызуна, которая сохраняет, или в значительной степени сохраняет, антигенсвязывающие свойства исходной молекулы, но которая в меньшей степени иммуногенна в организме приматов.
В том случае, когда понятие, применяемое и/или упоминаемое в данной области техники, может иметь два или более толкований, в контексте настоящего изобретения на него распространяются- все имеющиеся понятия, кроме тех, которые очевидно имеют иное значение. Конкретным примером в контексте настоящего изобретения является понятие «комплементарно детерминируемая область» («complementarity determining region - CDR»), используемое для описания несоприкасающихся антиген-объединяющих сайтов, наличие которых установлено в вариабельной области полипептидов и тяжелой, и легкой цепи. Эта область описана в работах Kabat и др. в кн.: «Sequences of Proteins of Immunological Interest», Департамент здравоохранения и сферы услуг США, 1983, а также Chothia и др. в J. Mol. Biol. 196, 1987, cc.901-917, причем обе работы упоминаются в настоящем изобретении и включены в него в виде ссылок, где определения включают перекрывание или подсовокупности аминокислотных остатков при сопоставлении друг с другом. Тем не менее, применение любого из определений к CDR антитела или его вариантов относится к данному понятию, применяемому в настоящем изобретении. Соответствующие аминокислотные остатки, которые входят в состав CDR согласно описаниям обеих цитируемых выше публикаций, приведены для сравнения ниже в табл.1, Номера остатков аминокислот, составляющих конкретную комплементарно детерминируемую область (CDR), могут варьировать в зависимости от последовательности и размера CDR. Специалист в данной области может легко определить, какие остатки содержит конкретная CDR, получая аминокислотную последовательность вариабельной области антитела.
Kabat и др. также описали систему нумерации для последовательностей вариабельного домена, которая применима для какого-либо антитела. Специалист в данной области может однозначно применить систему «нумерации Kabat» к какой-либо последовательности вариабельного домена вне зависимости от каких-либо экспериментальных данных за пределами самой последовательности. В контексте настоящего изобретения «нумерация Kabat» относится к системе исчисления, установленной Kabat и др. в кн.: «Sequences of Proteins of Immunological Interest», Департамент здравоохранения и сферы услуг США, 1983. Если не указано иначе, ссылки на определенные остатки аминокислот в составе АСМ соответствуют системе нумерации Kabat. Последовательности в перечне последовательностей пронумерованы не по системе Kabat.
В контексте настоящего изобретения относящееся к полипептиду понятие «активность GnTIII» означает полипептиды, которые могут катализировать добавление N-ацетилглюкозаминового остатка (GlcNAc) по β-1-4 связи к β-связанному маннозиду триманнозилового ядра N-связанных олигосахаридов. К ним относятся гибридные полипептиды, проявляющие ферментативную активность, схожую (но не идентичную) с активностью β(1,4)-N-ацетилглюкозаминилтрансферазы III, также известной под названием β-1,4-маннозил-гликопротеин 4-бета-М-ацетилглюкозаминилтрансферазы (ЕС 2.4.1.144) согласно нумерации Комитета по номенклатуре Международного союза биохимии и молекулярной биологии (Nomenclature Committee of the International Union of Biochemistry and Molecular Biology - NC-IUBMB), измеренную в конкретном биологическом исследовании и зависящую или независящую от дозы. В тех случаях, когда имеется доза-зависимость, она не должна быть идентичной доза-зависимости GnTIII, но предпочтительно в значительной степени сходна с доза-зависимостью данной активности по сравнению с GnTIII (т.е., исследуемый полипептид может проявлять повышенную активность, или активность, меньшую примерно в 25 раз, предпочтительно пониженную не более чем примерно в 10 раз, и, наиболее предпочтительно, пониженную не более чем примерно в 3 раза относительно активности GnTIII.)
В контексте настоящего изобретения понятие «вариант» или «аналог» относится к полипептиду, отличающемуся от определенного полипептида настоящего изобретения инсерциями, делениями или заменами аминокислот, произведенными с помощью, например, методов рекомбинации ДНК. Варианты АСМ настоящего изобретения включают химерные, приматизированные или гуманизированные антигенсвязывающие молекулы, в которых один или несколько аминокислотных остатков модифицированы путем замены, добавления и/или делении таким образом, что существенным образом не влияют на антигенсвязывающее сродство. Подход к определению того, какие аминокислотные остатки могут быть замещены, добавлены или делегированы без потери активностей, может быть установлен путем сравнения последовательности определенного полипептида с последовательностями гомологичных пептидов и минимизирования числа изменений в аминокислотной последовательности в высокой степени гомологичных (консервативных) областей или путем замены аминокислот на конценсусную последовательность.
С помощью другого подхода рекомбинантные варианты, кодирующие те же или близкие полипептиды, могут быть синтезированы или выбраны путем «избытка» в генетическом коде. Различные замены кодонов, например, молчащие изменения, которые вызывают формирование различных сайтов рестрикции, могут быть интродуцированы для оптимизации клонирования в плазмидном или вирусном векторе или экспрессии в определенной прокариотической или эукариотической системе. Мутации в полинуклеотидной последовательности могут быть отражены в полипептиде или доменах других пептидов, добавленных к полипептиду для модификации свойств какой-либо части полипептида, изменения свойств, например, лиганд-связывающего сродства, межцепочечного сродства или скорости разрушения/оборачиваемости.
В контексте настоящего изобретения понятие «замена» аминокислотного остатка» означает замену одной или нескольких аминокислот в контрольной последовательности (например, в исходной молекуле, например, антигенсвязывающей молекуле). В одном из вариантов осуществления настоящего изобретения замена аминокислотного остатка может быть, например, в виде точечной мутации в последовательности нуклеиновой кислоты, кодирующей полипептид, что отличает его от исходного пептида. В другом варианте осуществления настоящего изобретения замена аминокислотного остатка может быть достигнуто заменой целого каркасного участка исходного полипептида, например, на каркасный участок из последовательности VH зародышевой линии, которая включает требуемую аминокислоту в положении, по которому будет произведена замена относительно исходной последовательности.
В контексте настоящего изобретения понятие «консервативные аминокислотные последовательности» относится к последовательностям, которые могут быть получены заменой одной аминокислоты на другую, имеющую близкую структуру и/или химические свойства, т.е. получены в результате консервативных аминокислотных замен, и основой может быть схожесть в полярности, растворимости, гидрофобности, гидрофильности и/или амфипатической природе. Например, к неполярным (гидрофобным) аминокислотам относятся глицин, аланин, лейцин, изолейцин, валин, пролин, фенилалапин, триптофан и метионин, к полярным нейтральным аминокислотам относятся серии, треонин, цистеин, тирозин, аспарагин и глутамин, к положительно заряженным (основным) аминокислотам относятся аргинин, лизин и гистидин, и к отрицательно заряженным (кислым) аминокислотам относятся аспарагиновая кислота и глутаминовая кислота. Размер инсерций и делеций предпочтительно составляет 1-20 аминокислот, более предпочтительно 1-10 аминокислот. Допустимая вариация может быть определена экспериментально путем систематически производимых инсерций, делеций или замен аминокислот в молекуле полипептида, производимых методами рекомбинации ДНК и последующей оценки активности рекомбинантных вариантов.
В контексте настоящего изобретения понятие «исходная антигенсвязывающая молекула» или «исходная молекула» означает полипептид с определенной аминокислотной последовательностью, кодируемой полинуклеотидной последовательностью. Последовательность исходной молекулы (т.е. исходная последовательность) служит контрольной последовательностью при осуществлении замен аминокислотных остатков, в результате которых изменяется способность образуемой молекулы (например, модифицированной антигенсвязывающей молекулы) индуцировать или блокировать активность по передаче клеточного сигнала и/или по перекрестному связыванию антигена. Кроме того, действие исходной молекулы является контролем при определении того, обладает ли в результате замены антиген действием по передаче клеточного сигнала и/или по перекрестному связыванию антигена и, если это необходимо, степенью проявления этого действия. Последовательность, содержащая одно или несколько замен аминокислот по сравнению с исходной последовательностью (например, модифицированная АСМ) может в свою очередь служить исходной последовательностью для дальнейших замен.
В контексте настоящего изобретения понятие «измененная клеточная сигнальная активность» относится к повышению или понижению способности АСМ индуцировать или ингибировать клеточную сигнальную активность антигена-мишени.
В контексте настоящего изобретения понятие «измененное перекрестное связывание одного или нескольких антигенов-мишеней» означает повышение или понижение способности АСМ связываться в непосредственной близости друг к другу и/или в непосредственной близости с другими мембрано-ассоциированными молекулами, и/или в более благоприятной конформации для взаимодействующих антигенов-мишеней, которые способны формировать комплексы (например, за счет перекрестного сшивания белков или олигомеризации мембрано-ассоциированных рецепторов) для инициации клеточных сигнальных метаболических путей.
В контексте настоящего изобретения понятие «механизм передачи клеточного сигнала» или « клеточная сигнальная активность» относится к полному метаболическому пути передачи сигнала (т.е., сигнальной трансдукции), которая приводит к определенному изменению в клетке или к определенному биологическому действию, а также к каким-либо сигнальным стадиям на этом метаболическом пути.
В контексте настоящего изобретения, если указано, что нуклеиновая кислота или нуклеотидная последовательность, например по меньшей мере на 95% «идентична» контрольной нуклеотидной последовательности настоящего изобретения, это означает, что нуклеотидная последовательность полинуклеотида идентична контрольной последовательности за исключением того обстоятельства, что нуклеотидная последовательность может включать до пяти точечных мутаций на каждые 100 нуклеотидов контрольной нуклеотидной последовательности. Иначе говоря, для получения нуклеотидной последовательности по меньшей мере на 95% идентичной контрольной нуклеотидной последовательности, до 5% нуклеотидов в контрольной последовательности может быть делегировано или замещено другими нуклеотидами, или до 5% всех нуклеотидов в контрольной последовательности может быть инсертировано в контрольную последовательность.
На практике для того, чтобы определить, является ли какая-либо определенная молекула нуклеиновой кислоты или полипептида по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичной нуклеотидной последовательности или полипептидной последовательности настоящего изобретения, может быть применен обычный способ с использованием компьютерных программ. Предпочтительный способ определения наиболее общего совпадения между исследуемой последовательностью (последовательностью настоящего изобретения) и субъектной последовательностью, также называемый общей выверкой последовательности, может быть определено, используя компьютерную программу FASTDB, основанную на алгоритме Brutlag и др., Comp. Арр. Biosci. 6, 1990, cc.237-245. При выверке последовательностей изучаемой и субъектной обе являются последовательностями ДНК. Последовательность РНК может быть сопоставлена при конверсии У в Т. Результат выверки указанной общей последовательности заключается в идентичности, выраженной в процентах. Предпочтительными параметрами, применяемыми при выверки FASTDB последовательностей ДНК и подсчета процентов идентичности, являются: матрица = унитарная, k-кратность = 4, пенальти ошибочного спаривания оснований = 1, пенальти объединения = 30, протяженность рандомизированной группы = 0, граница отсечения = 1, пенальти гэпа = 5, пенальти размера гэпа = 0,05, размер окна = 500 или длина субъектной нуклеотидной последовательности, насколько бы она не была короче.
Если субъектная последовательность короче исследуемой последовательности из-за 5' или 3' делеций, а не из-за внутренних делеций, может быть произведена ручная коррекция результатов. Это связано с тем, что программа FASTDB не учитывает 5' и 3' усечения субъектной последовательности при подсчете процента идентичности. Для субъектных последовательностей, усеченных с 5'- или 3'-концов по сравнению с исследуемой последовательностью, процент идентичности корректируют подсчетом числа оснований исследуемой последовательности, которая представляет 5' и 3' субъектной последовательности, которая не совместима/не выровнена, в качестве процента от общего числа оснований в исследуемой последовательности. Является ли нуклеотид совместимым/выровненным, определяют по результатам выверки последовательности по результатам применения программы FASTDB. Этот процент затем вычитают из процента идентичности, подсчитанного с помощью указанной выше программы FASTDB, используя заданные параметры, для достижения итогового значения процента идентичности. Полученную скорректированную величину используют для целей настоящего изобретения. Только основания за пределами 5'- и 3'-оснований субъектной последовательности, что показано выверкой с применением программы FASTDB, которая не совместима/не выровнена с исследуемой последовательностью, подсчитывают для ручной корректировки процента идентичности.
Например, 90 пар оснований субъектной последовательности сравнивают со 100 основаниями исследуемой последовательности для определения процентной идентичности. Делеции расположены с 5'-конца субъектной последовательности и, следовательно, выверка методом FASTDB не показывает ошибку/совпадение первых 10 оснований с конца 5'. 10 неспаренных оснований составляют 10% последовательности (число оснований на 5'- и 3'-концах не соответствует общему числу оснований в исследуемой последовательности), поэтому 10% вычитают из оценки процента идентичности, подсчитанной с помощью программы FASTDB. Если оставшиеся 90 оснований полностью соответствуют, итоговый процент идентичности может составить 90%. В другом примере субъектная последовательность длиной 90 оснований сравнивается с исследуемой последовательностью длиной 100 оснований. На этот раз делеции являются внутренними делениями, поскольку нет оснований на 5'- или 3'-конце субъектной последовательности, которые не совместимы/не выравненны с контрольной последовательностью. В этом случае процент идентичности подсчитывают с помощью FASTDB и не корректируют вручную. Еще раз, только основания на 5'- и 3'-конце субъектной последовательности, которые не совместимы/не выравненны с исследуемой последовательностью, корректируют вручную. Для целей настоящего изобретения никакая другая ручная корректировка не производится.
С помощью полипептида, обладающего аминокислотной последовательностью по меньшей мере на 95% «идентичной» исследуемой аминокислотной последовательности настоящего изобретения, подразумевается, что аминокислотная последовательность субъектного полипептида идентична исследуемой последовательности за исключением того, что субъектная полипептидная последовательность может включать до пяти аминокислотных изменений на каждые 100 аминокислот исследуемой аминокислотной последовательности. Иначе говоря, для получения полипептида, имеющего аминокислотную последовательность по меньшей мере на 95% идентичную исследуемой аминокислотной последовательности, до 5% остатков аминокислот в субъектной последовательности может быть инсертировано, делегировано или замещено другими остатками аминокислот. Такие изменения контрольной последовательности могут быть с амино- или карбокси-конца контрольной аминокислотной последовательности или где-либо между этими концевыми позициями, распределенными либо пол-отдельности среди аминокислотных остатков в контрольной последовательности, либо в одной или нескольких соседних группах в контрольной последовательности.
Например, для того, чтобы определить, является ли определенный полипептид по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичным контрольному полипептиду, можно использовать известные контрольные компьютерные программы. Предпочтительный способ определения наибольшего общего совпадения между исследуемой последовательностью (последовательностью настоящего изобретения) и субъектной последовательностью, также называемый способом определения выверки рассматриваемой в целом последовательности, может быть определен с помощью компьютерной программы FASTDB, основанной на алгоритме Brutlag и др., Comp. Арр. Biosci. 6, 1990, cc.237-245. При выверке контрольной и субъектной последовательностей они могут быть или нуклеотидными, или аминокислотными последовательностями. Результат выверки рассматриваемой в целом последовательности является показателем процентной идентичностью. Предпочтительными параметрами, применяемыми при выверки аминокислот с применением программы FASTDB являются: матрица = РАМ 0, k-кратность = 2, пенальти ошибочного спаривания оснований = 1, пенальти объединения = 20, протяженность рандомизированной группы = 0, граница отсечения = 1, размер окна = длина последовательности, пенальти гэпа = 5, пенальти размера гэпа = 0,05, размер окна = 500 или длина субъектной аминокислотной последовательности, насколько бы она не была короче.
Предпочтительными параметрами, применяемыми при выверки FASTDB последовательностей ДНК и подсчета процентов идентичности, являются: матрица = унитарная, k-кратность = 4, пенальти ошибочного спаривания оснований = 1, пенальти объединения = 30, протяженность рандомизированной группы = 0, граница отсечения = 1, пенальти гэпа = 5, пенальти размера гэпа = 0,05, размер окна = 500 или длина субъектной нуклеотидной последовательности, насколько бы она не была короче.
Если субъектная последовательность короче, чем исследуемая последовательность из-за N- или C-концевых, а не внутренних, делеций, для получения результата должна быть произведена ручная коррекция. Это связано с тем, что программа ASTDB не учитывает N- и C-концевые усечения субъектной последовательности при расчете общей процентной идентичности. Для субъектных последовательностей, усеченных с N- и С-концов, при сопоставлении с исследуемой последовательностью процентную идентичность корректируют подсчетом числа остатков исследуемой последовательности, которые являются N- и C-концевыми остатками субъектной последовательности, которые не совпали/не выверены с соответствующим субъектным остатком в виде процента от общего числа оснований исследуемой последовательности. Является ли остаток совпавшим/выверенным определяют по результатам выверки последовательности с помощью программы FASTDB. Полученный процент затем вычитают из процента идентичности, подсчитанный с помощью указанной выше программы FASTDB, используя определенные параметры, для получения итоговой оценки процента идентичности. Итоговая оценка процента идентичности используется для целей настоящего изобретения. Только остатки по N- и С-концам субъектной последовательности, которые не совпали/не выверены с исследуемой последовательностью, учитывают при ручной корректировке процента идентичности. Это только положения исследуемых остатков за пределами N- и C-концевых остатков субъектной последовательности.
Например, 90 аминокислотных остатков субъектной последовательности выравнивают с исследуемой последовательностью из 100 остатков для определения процентной идентичности. Делеция находится с N-конца субъектной последовательности и, следовательно, применение программы FASTDB для выверки не показывает совпадения/выверки первых 10 остатков с N-конца. 10 неспаренных остатков представляют 10% последовательности (количество остатков с N- и С-конца не совпадает с общим числом остатков в исследуемой последовательности), поэтому 10% вычитают из величины оценки процентной идентичности, подсчитанной с помощью программы FASTDB. Если оставшиеся 90 остатков полностью совместимы, итоговая процентная идентичность может составлять 90%. В другом примере субъектная последовательность из 90 остатков сравнивается с исследуемой последовательностью из 100 остатков.
В данном случае делеции являются внутренними, поэтому нет остатков по N- или С-концам субъектной последовательности, которые не совпадают/не выверены с исследуемой последовательностью. В данном случае процент идентичности подсчитывают с помощью программы FASTDB без ручной коррекции. Таким образом, только остатки за пределами N- и С-концов субъектной последовательности, что было показано совмещением по программе FASTDB, не совпадают/не выверены с исследуемой последовательностью, и проводят коррекцию вручную. Другие коррекции для целей настоящего изобретения не проводятся.
В контексте настоящего изобретения нуклеиновая кислота, которую «гибридизируют в жестких условиях» с последовательностью нуклеиновой кислоты по настоящему изобретению, означает полинуклеотид, который гибридизируют в течение ночи при 42°С в растворе, включающем 50% формамида, 5х SSC (750 мМ NaCl, 75 мМ цитрата натрия), 50 мМ фосфата натрия (рН 7,6), 5х раствора Денхардта, 10% декстрансульфата и 20 мкг/мл денатурированной разрезанной ДНК спермы лосося с последующим промыванием фильтров в 0,1х SSC примерно при 65°С.
В контексте настоящего изобретения понятие «область Fc» относится к C-концевой области тяжелой цепи IgG. Хотя границы области Fc в тяжелой цепи IgG могут варьировать незначительно, область Fc тяжелой цепи IgG человека обычно определяют в виде протяженности от аминокислотного остатка в положении Cys226 до карбокси-конца последовательности.
В контексте настоящего изобретения понятие «область, эквивалентная области Fc иммуноглобулина» распространяется на природные аллельные варианты области Fc иммуноглобулина, а также варианты, имеющие изменения, которые вызывают замены, дополнения или делеции, но существенно не снижают способность иммуноглобулина опосредовать эффекторные функции (например, антителозависимую клеточную цитотоксичность). Например, может быть одна или несколько делеции аминокислот с N-конца или С-конца области Fc иммуноглобулина без существенной потери биологической функции. Такие варианты могут быть выбраны при соблюдении нескольких правил, известных в данной области, для выявления минимального воздействия на активность. (См., например, Bowie J. U. и др., Science 247, 1990, cc.1306-1310). В одном из вариантов осуществления настоящего изобретения «область, эквивалентная области Fc» также может формировать часть гетерологического гибридного белка. В некоторых вариантах осуществления настоящего изобретения «область, эквивалентная области Fc» также включает соответствующую область тяжелой цепи от другого класса иммуноглобулина (например, IgA, IgE, IgD и IgM).
В контексте настоящего изобретения понятие «домен локализации Гольджи» относится к аминокислотной последовательности резидентного полипептида Гольджи, который ответственен за заякоривание полипептида при локализации в комплексе Гольджи. Обычно домены локализации содержат амино-концевой «хвост» фермента.
В контексте настоящего изобретения понятие «эффекторная функция» относится к тем биологическим активностям, которые связаны с областью Fc (нативной последовательностью области Fc или аминокислотной последовательностью области варианта Fc) антитела. Примерами эффекторных функций антитела являются, но ими не ограничиваются, связывающее сродство Fc-рецептора, антителозависимая клеточная цитотоксичность (antibody-dependent cellular cytotoxicity - ADCC), антителозависимый клеточный фагоцитоз (antibody-dependent cellular phagocytosis - ADCP), секреция цитокина, опосредованное иммунным комплексом потребление антигена антиген-презентирующими клетками, понижение регуляции клеточных поверхностных рецепторов и т.д.
В контексте настоящего изобретения понятия «инженерный, инженерия, гликоинженерный, гликоинженерия и гликозилирование инженерией» включают какие-либо манипуляции с гликозилированным образцом природного или рекомбинантного полипептида, например, антигенсвязывающую молекулу (АСМ) или ее фрагмент. Гликозилирование включает метаболическую инженерию механизма гликозилирования клетки, включая генетические манипуляции метаболических путей синтеза олигосахаридов для достижения измененного гликозилирования экспрессируемых клетками гликопротеинов. В одном из вариантов осуществления настоящего изобретения направленная на гликозилирование инженерия является изменением активности гликозилтрансферазы. В одном из конкретных вариантов осуществления настоящего изобретения инженерия приводит к измененной активности глюкозаминилтрансферазы и/или активности фукозилтрансферазы.
В контексте настоящего изобретения понятие «клетка-хозяин» относится к какому-либо типу клеточной системы, который может быть сконструирован для получения полипептидов и антигенсвязывающих молекул настоящего изобретения. К клеткам-хозяевам относятся культивируемые клетки, например, культивируемые клетки млекопитающих, например, клетки СНО, BHK, HEK293-EBNA, NS0, SP2/0, клетки миеломы YO, клетки миеломы мыши Р3Х63, клетки PER, PER.C6, или клетки гибридомы, дрожжевые клетки, клетки насекомых и клетки растений, в том числе клетки трансгенных животных, трансгенных растений или культивируемых тканей растений или животных. В одном из вариантов осуществления настоящего изобретения конструируют клетку-хозяина, чтобы получить антигенсвязывающую молекулу с модифицированными гликоформами. В предпочтительном варианте осуществления настоящего изобретения антигенсвязывающая активность является антителом, фрагментом антитела или гибридным белком. В некоторых вариантах осуществления настоящего изобретения клетки-хозяева подвергаются дальнейшим манипуляциям для экспрессии повышенных уровней одного или нескольких полипептидов, обладающих активностью GnTIII. В других вариантах осуществления настоящего изобретения подвергаются инженерии клетки-хозяева для приобретения элиминированной, пониженной или подавленной активности коровой α1,6-флукозилтрансферазы. Понятие «активность коровой α1,6-фукозилтрансферазы» распространяется и на экспрессию гена капсидной α1,6-фукозилтрансферазы, и на взаимодействие корового фермента α1,6-фукозилтрансферазы и соответствующим субстратом.
В контексте настоящего изобретения понятие «Fc-опосредованная клеточная цитотоксичность» включает антителозависимую цитотоксичность и цитотоксичность, опосредованную растворимым Fc-гибридным белком, содержащим область Fc человека. Это иммунный механизм, приводящий к лизису «клеток-мишеней для антитела» с помощью «иммунных эффекторных клеток человека», причем:
В контексте настоящего изобретения понятие «иммунные эффекторные клетки человека» являются популяцией лейкоцитов, на поверхности которых проявляются рецепторы Fc на клеточной поверхности, через которые они связываются с областью Fc антител или Fc-гибридных белков и выполняют эфекторные функции. Такая популяция может включать, но ими она не ограничивается, мононуклеарные клетки периферической крови (МКПК) и/или природные клетки-киллеры (ПКК).
В контексте настоящего изобретения понятие «клетки-мишени антитела» означает клетки, связанные антителами или Fc-гибридными белками. Антитела или Fc-гибридные белки связывают клетки-мишени через белковую часть N-конца с областью Fc.
В контексте настоящего изобретения понятие «повышенная Fc-опосредованная клеточная цитотоксичность» означает либо повышение числа «клеток-мишеней антител», которые лизируются в данное время при данной концентрации антитела или концентрации Fc-гибридного белка, в среде, окружающей клетки-мишени, по механизму описанной выше Fc-опосредованной клеточной цитотоксичности, и/или снижение концентрации антитела или Fc-гибридного белка в среде, окружающей клетки-мишени, требуемой для достижения лизиса данного числа «клеток-мишеней антитела» в данное время по механизму Fc-опосредованной клеточной цитотоксичности. Повышение Fc-опосредованной клеточной цитотоксичности относительно клеточной цитотоксичности, опосредованной тем же антителом или Fc-гибридным белком, образуемым тем же типом клеток-хозяев, используя те же методы стандартного получения, очистки, переработки и хранения, известные специалистам в данной области, но не образуемые клетками-хозяевами, созданными для экспрессии гликозилтрансферазы GnTIII, методами, описанными в настоящем изобретении.
Под «антителом, обладающим повышенной антитело-зависимой клеточной цитотокичностью (ADCC)» в контексте настоящего изобретения подразумевается антитело, обладающее повышенной ADCC, которую определяют соответствующими методами, известными специалистам в данной области. Один из методов исследования ADCC описан ниже в примере. Другим приемлемым способом определения ADCC in vitro является следующий способ:
1) в данном исследовании используют клетки-мишени, о которых известно, что они экспрессируют антиген-мишень, распознаваемый антигенсвязывающей областью антитела,
2) в исследовании используют мононуклеарные клетки периферической крови (МКПК), выделенные из крови случайным образом выбранного донора, в качестве эффекторных клеток,
3) исследование проводят по следующему протоколу:
i) МКПК выделяют, используя центрифугирование в стандарте плотности, и суспендируют до плотности 5×106 клеток/мл культуральной среды RPMI,
ii) клетки-мишени выращивают с помощью стандартных методов для культур тканей, клетки собирают в экспоненциальной фазе роста при жизнеспособности более 90%, промывают в среде RPMI для культуры клеток, наносят метку в количестве 100 мкКюри 51Cr, дважды отмывают средой для культуры клеток и ресуспендируют в среде для культур клеток при плотности 105 клеток/мл,
iii) 100 мкл полученной выше суспензии клеток вносят в каждую лунку 96-луночного планшета для микротитрований,
iv) антитело разводят серийно с 4000 нг/мл до 0,04 нг/мл в среде для культуры клеток и по 50 мкл полученных растворов антитела вносят к клеткам-мишеням в 96-луночный планшет для микротитрований, тестируя в трех повторах каждую концентрацию антитела по всему диапазону концентраций, указанному выше,
v) для контролей максимального высвобождения (MB) в три дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят 50 мкл 2 об.% водного раствора неионного детергента (продукт Nonidet, фирма Sigma, Сэнт-Луис) вместо раствора антитела (пункт iv выше),
vi) для контролей спонтанного высвобождения (СВ) в три дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят 50 мкл культуральной среды RPMI вместо раствора антитела (пункт iv выше),
vii) затем 96-луночные планшеты для микротитрования центрифугируют в режиме 50 g в течение 1 мин и инкубируют в течение 1 ч при 4°С,
viii) по 50 мкл суспензии МКПК (пункт i выше) вносят в каждую лунку для получения соотношения эффектора: клеток-мишеней 25:1 и планшеты инкубируют в атмосфере 5% СО2 при 37°С в течение 4 ч,
ix) супернатант без клеток из каждой лунки собирают и количественно определяют высвободившуюся радиоактивность (ВР) с помощью счетчика гамма-лучей,
х) процент специфического лизиса подсчитывают для каждой концентрации антитела по формуле: (ВР-МВ)/(MB-СВ)×100, где ВР обозначает подсчитанную среднюю радиоактивность (см. пункт ix выше) для данной концентрации антитела, MB обозначает подсчитанную среднюю радиоактивность (см. пункт ix выше) для контролей MB (см. пункт v выше) и СВ обозначает среднюю радиоактивность (см. пункт ix выше) для контролей (см. пункт vi выше),
4) понятие «антитело-зависимая клеточная цитотоксичность - ADCC» означает или повышение максимального процента специфического лизиса клеток, наблюдаемого в диапазоне концентрации антитела, тестировавшегося выше, и/или снижение концентрации антитела, необходимой для достижения ½ максимального процента специфического лизиса, наблюдаемого в рамках приведенного выше тестируемого диапазона концентраций антитела. Повышение ADCC относительно величины ADCC, измеренной в указанном выше исследовании, выполненном с тем же антителом, вырабатываемым тем же типом клеток-хозяев, используя те же методы стандартной выработки, очистки, переработки и хранения, известные специалистам в данной области, но не вырабатываемым клетками-хозяевами, сконструированными для сверхэкспрессии GnTIII.
Антигенсвязывающие молекулы с заменами аминокислот в тяжелой и/или легкой цепи
Один из объектов настоящего изобретения связан с антигенсвязывающими молекулами (АСМ), включающими модифицированные V области и/или С области тяжелой и/или легкой цепи, а также с обнаружением того обстоятельства, что способность таких АСМ индуцировать клеточную сигнальную активность антигена-мишени и/или опосредовать перекрестное сшивание антигена-мишени может быть повышена (т.е. индуцирована или повышена) или понижена (т.е. подавлена или снижена) в результате таких модификаций. Таким образом, в настоящем изобретении предусмотрены полипептиды, в том числе АСМ, обладающие модифицированными V областями и/или С областями тяжелой и/или легкой цепи, последовательности нуклеиновых кислот (например, векторов), кодирующие такие полипептиды, способы получения полипептидов, обладающих модифицированными V и/или С областями тяжелой и/или легкой цепи, и способы их применения для лечения различных заболеваний и расстройств.
Известно несколько механизмов, вовлеченных в терапевтическую эффективность антител, в том числе антителозависимая цитотоксичность (ADCC), комплементзависимая цитотоксичность (complement-dependent cytotoxicity - CDC), индукция прекращения роста или апоптоза, блокирование или ингибирование роста клеток, клеточной пролиферации, выживаемости клеток и/или других клеточных процессов. Например, описаны случаи индукции клеточной гибели и других клеточных сигнальных явлений агонистическими моноклональными антителами. Cerisano и др. описали индукцию каспаз-независимой гибели клеток, отличающейся апоптозоподобными признаками (включая экспозицию фосфатидил-серином (ФС), морфологические изменения и/или потребление пропидия иодида (ПИ)), а также гомотипической агрегацией клеток саркомы Юинга, стимуляцией агонистическими антителами против трансмембранного гликопротеина, CD99 (например, анти-С099 013 MAb и O662 MAb) (Cerisano и др., Oncogene 23, 2003, cc.5664-5674). Кроме того. Likewise, Hahn и др. установили активирование MAPK-сигнальных метаболических путей за счет зацепления CD99 с анти-С099 моноклональными антителами (например, DN16 и YG32), что приводит к гомотипической агрегации клеток (Hahn и др., FEBS Letters 470, 2000, cc.350-354). Pettersen и др. идентифицировали новый функциональный домен CD99, который может быть активирован с помощью анти-С099 моноклонального антитела, Ad20, активация которого индуцирует апоптоз в трансформированных Т-клетках (Pettersen и др., J. Immunol. 166, 2001, cc.4931-4942). Моноклональные антитела против антигена CD47 (например, В6Н12) также могут индуцировать каспаз-зависимую гибель клеток, которая связана с сигнальными метаболическими путями реорганизации цитоскелета (Mateo и др., Blood 100, 2002, cc.2882-2890). Сущность каждой из цитируемых выше работ включена в настоящее описание в виде ссылки.
В других примерах показано, что некоторые антитела против антигенов CD20 (например, ритуксимаб и тоситумомаб) и CD52 (САМРАТН-1Н) непосредственно индуцируют апоптоз в раковых клетках. См. Ludwig и др., Oncogene 22, 2003, cc.9097-9106. Для ритуксимаба и некоторых других моноклональных антител с небольшой сигнальной активностью или без сигнальной активности (анти-CD19, CD21, CD22 и Нег2) способность индуцировать апоптоз или прекращать рост повышается за счет химической конверсии антител в гомодимеры IgG-IgG. Ghetie и др., Proc. Natl. Acad. Sci. 94, 1997, cc.7509-7514). Высказывались предположения, что повышение было из-за повышенной отрицательной передачи сигнала и/или повышенного перекрестного сшивания тетравалентными гомодимерами антител. Ghetie и др., Proc. Natl. Acad. Sci. 94, 1997, cc.7509-7514. Перекрестное сшивание и повышенный апоптоз также достигаются за счет применения вторичных антител или Fc-рецептор-несущих вспомогательных клеток. См. Jazhirehi и Bonavida, Oncogene 24, 2005, cc.2121-2143. Сущность каждой из цитируемых выше работ включена в настоящее описание в виде ссылки.
Не опираясь на теоретическое обоснование, в настоящем изобретении определяют, что модификации аминокислотных остатков в области шарнирного сустава антигенсвязывающей молекулы могут повлиять на способность АСМ индуцировать или ингибировать сигнальную активность и/или перекрестное сшивание антигена-мишени. Угол шарнирной области контролирует ориентацию области V относительно области С иммуноглобулина и за счет этого облегчает взаимодействия антител с антигеном и эффекторными белками. См. Lesk и Chothia, Nature 335, 1988, cc.188-190. Lesk и Chothia установили остатки, которые поддерживают «молекулярный шаровидный сустав» в области «локтевого угла» в антителах, а именно в положениях 11, 110 и 112 в области VH и в положениях 149 и 150 в области СН1 по нумерации Kabat, и установили, что существует высокая степень консервативности антител, а именно остатков аминокислот, поддерживающих это сочленение. Lesk и Chothia, Nature 335, 1988, cc.188-190 (сущность этой работы приведена в настоящем описании в виде ссылки). Однако они не получали модификаций остатков шаровидного сочленения или остатков, находящихся рядом. Landolfi и др. показали, что модификации в положениях 10-13 по нумерации Kabat в антителе AF2, которое нейтрализует ИФНγ человека, приводят к существенной утрате нейтрализующей активности антитела, но не влияют на связывание антитела с его антигеном-мишенью. Landolfi и др., J. Immunol. 166, 2001, cc.1748-1754 (сущность этой работы приведена в настоящем описании в виде ссылки). Однако Landolfi и др. не установили действия на способность антитела индуцировать клеточный сигнал или опосредовать перекрестное сшивание антигена.
У мультивалентной АСМ способность изменять ориентациюантигенсвязывающих сайтов позволяет изменять близость связанных антигенных единиц при объединении с множественными антигенсвязывающими сайтами. Близость антигенных единиц друг к другу облегчает повышенное или пониженное взаимодействие (например, перекрестное сшивание, димеризацию и т.д.) между антигенными единицами. Например, если угол изгиба каждой пары VH/VL-CH1/CL в АСМ ориентирован таким образом, что антигенсвязывающие сайты приводятся в более плотное соприкосновение друг с другом, единицы связывания антигена (например, клеточные поверхностные рецепторные молекулы) могут также соприкасаются плотнее друг с другом или приобретают такую конформацию, которая более благоприятна для взаимодействия. Такая близость или конформационное изменение могут опосредовать взаимодействия, например, перекрестное связывание или олигомеризацию, между связывающимися антигенами. С другой стороны ориентация антигенсвязывающих сайтов такова, что они расположены дальше друг от друга или имеют менее благоприятную конформацию, что может предотвратить их взаимодействие.
Остатки аминокислот на границе VL-CL также могут быть модифицированы для воздействия на ориентацию сайта связывания антигена. Например, остатки в положениях 40, 80, 83, 105 и 106 по нумерации Kabat в каркасных участках вариабельной области легкой цепи расположены на границе VL/CL.
Активность каких-либо клеточных сигнальных механизмов может быть изменена (т.е. индуцирована или подавлена) антигенсвязывающими молекулами (АСМ) настоящего изобретения. Настоящее изобретение также относится к клеточным сигнальным механизмам, в том числе к тем, которые инициируются через клеточные поверхностные рецепторные белки, включая связанные с ионными каналами, G-белком и ферментсвязанными клеточными поверхностными рецепторными белками. См. кн.: «Molecular Biology of the Cell», 1994, под ред. Alberts и др., 3-е изд., глава 5, включенную в настоящее изобретение в виде ссылки. Таким образом, например, по настоящему изобретению к клеточной сигнальной активности относятся, но ими не ограничиваются, те активности, которые вызывают апоптоз, клеточную дифференциацию, рост клеток, пролиферацию клеток и выживание клеток, а также какую-либо стадию передачи сигнала по метаболическому пути. В одном из вариантов осуществления настоящего изобретения клеточная сигнальная активность проявляется через ферментсвязанный рецептор; в одном из конкретных вариантов осуществления настоящего изобретения ферментсвязанный рецептор является рецепторной тирозинкиназой. В другом варианте осуществления настоящего изобретения клеточная сигнальная активность осуществляется через рецептор, связанный с ионным каналом.
Модифицированные V области и/или С области тяжелой или легкой цепей АСМ настоящего изобретения отличаются от соответствующих областей немодифицированного исходного полипептида (например, исходной антигенсвязывающей молекулы)по меньшей мере одной заменой аминокислоты. Понятия «исходный», «начальный» или «немодифицированный» полипептид предпочтительно включают по меньшей мере часть тяжелой или легкой цепи антитела и может быть приготовлен методами, известными в данной области для получения полипептидов, включающих область V тяжелой цепи, или область СН1 или ее часть, и/или область V легкой цепи или область С или ее часть. В одном из конкретных вариантов осуществления настоящего изобретения исходный полипептид является антигенсвязывающей молекулой и включает по меньшей мере часть области VH или VL. В некоторых вариантах осуществления настоящего изобретения модифицированная V область тяжелой и/или легкой цепи может быть получена (например, описанными в настоящем изобретении методами) и может быть гибридизирована с гетерологичным полипептидом выбора, например, антителом Fc. В одном из вариантов осуществления настоящего изобретения модифицированная АСМ или ее фрагмент включают гибридный белок, в котором модифицированная область V тяжелой цепи или ее фрагмент гибридизированы с постоянной областью тяжелой цепи, выбранной из группы, включающей IgA, IgG, IgE, IgD и IgM, их фрагмент или производное. В одном из конкретных вариантов осуществления настоящего изобретения константной областью тяжелой цепи является IgG. В другом варианте осуществления настоящего изобретения модифицированная АСМ или ее фрагмент включают гибридный белок, в котором модифицированная V область легкой цепи или ее фрагмент гибридизируют с постоянной областью легкой цепи, выбранной из группы, включающей IgA, IgG, IgE, IgD и IgM, или их фрагмент, или их производное. В одном из конкретных вариантов осуществления настоящего изобретения константной областью легкой цепи является IgG. В конкретных вариантах осуществления настоящего изобретения полипептиды настоящего изобретения включают целое антитело (например, IgG), содержащее легкие цепи и тяжелые цепи, имеющие модифицированную V область тяжелой и/или легкой цепи.
Полинуклеотиды, кодирующие полипептид, содержащий модифицированную V область или СН1 область тяжелой цепи или модифицированную V область или CL область легкой цепи, могут быть получены способами, известными в данной области, руководствуясь настоящим описанием для определенных последовательностей. К этим методам относятся, но ими не ограничиваются, приготовление способом сайт-направленного (или олигонуклеотид-опосредованного) мутагенеза, ПЦР мутагенеза и кассетного мутагенеза ранее полученной нуклеиновой кислоты, кодирующей полипептид. Сайт-направленный мутагенез является предпочтительным способом получения замещенных вариантов. Этот способ хорошо известен в данной области техники (см., например. Carter и др. Nucleic Acids Res. 13, 1985, cc.4431-4443 и Kunkel и др., Proc. Natl. Acad. Sci. USA 82, 1987, с.488, обе публикации включены в настоящее изобретение в виде ссылок). Вкратце, при выполнении сайт-направленного мутагенеза исходная ДНК изменяется сначала гибридизацией олигонуклеотида, кодирующего желаемую мутацию с одной цепью такой стартовой ДНК. После гибридизации ДНК-полимеразу используют для синтеза целой второй цепи, используя гибридизированный олигонуклеотид в качестве праймера и используя одну цепь начальной ДНК в качестве матрицы. Таким образом, олигонуклеотид, кодирующий желаемую мутацию, инкорпорируют в формируемую двунитевую ДНК.
ПЦР-мутагенез также пригоден для получения вариантов аминокислотной последовательности немодифицированного стартового полипептида (см., например, публикацию Vallette и др., Nuc. Acids Res. 17, 1989, cc.723-733, включенную в настоящее изобретение в виде ссылки). Вкратце, при использовании малых количеств матричной ДНК в качестве стартового материала при ПЦР праймеры, незначительно отличающиеся последовательностью от соответствующей области матричной ДНК, могут применяться для получения относительно больших количеств специфического фрагмента ДНК, который отличается от матричной последовательности только в положениях, в которых праймеры отличаются от матрицы.
Кассетный мутагенез - другой способ получения вариантов АСМ, основан на методе, описанном Wells и др. в публикации Gene 34, 1985, cc.315-323, включенной в настоящее изобретение в виде ссылки. Исходный материал является плазмидой (или другим вектором), включающим стартовую ДНК полипептида, который будет модифицироваться. Выявляют кодон (кодоны) в стартовой ДНК, в которой затем вызывают мутацию. Должен быть уникальный сайт эндонуклеазы рестрикции на каждой стороне идентифицированного сайта (сайтов) мутации. Если таких сайтов рестрикции нет, они могут быть получены, используя описанный выше метод олигонуклеотид-опосредованного мутагенеза для их интродукции согласно соответствующей локализации в стартовой полипептидной ДНК. Плазмидную ДНК разрезают по этим сайтам, в результате чего она становится линейной. Двунитевой олигонуклеотид, кодирующий последовательность ДНК между сайтами рестрикции, но содержащую желаемую мутацию (мутации) синтезируют, используя стандартные процедуры, причем две цепи олигонуклеотида синтезируют по отдельности и затем гибридизируют, используя стандартные методики. Этот двунитевой нуклеотид называется кассетным. Такая кассета создается для получения 5' и 3' концов, которые совместимы с концами линеаризованных плазмид, причем она может быть непосредственно лигирована в плазмиду. Эта плазмида теперь содержит мутантную последовательность ДНК.
В другом варианте или дополнительно желаемая аминокислотная последовательность, кодирующая полипептидный вариант, может быть определена, и последовательность нуклеиновой кислоты, кодирующей такой вариант аминокислотной последовательности, может быть получена синтетически.
Аминокислотная последовательность исходного полипептида может быть модифицирована для получения АСМ, имеющей модифицированную V область и/или модифицированную область СН1 тяжелой цепи, и/или модифицированную V область и/или модифицированную область CL легкой цепи, с измененной способностью индуцировать клеточную сигнальную активность антигена-мишени, если модифицированная АСМ объединяется (например, связывается) с антигеном-мишенью. Клеточная сигнальная активность может быть агонистической активностью или антагонистической активностью. Согласно одному из объектов настоящего изобретения агонистическая активность индуцируется модифицированной антигенсвязывающей молекулой, если она связывается с клеточным мембраноассоциированным рецептором и инициирует клеточный сигнальный метаболический путь. В одном из вариантов осуществления настоящего изобретения клеточный сигнальный метаболический путь является апоптическим метаболическим путем. В другом варианте осуществления настоящего изобретения клеточный сигнальный метаболический путь является метаболическим путем процесса дифференциации. Согласно другому объекту настоящего изобретения антагонистическая активность у модифицированной антигенсвязывающей молекулы проявляется, например, в том случае, когда АСМ связывает мембрано-ассоциированный рецептор и предотвращает индукцию клеточного сигнального метаболического пути или прерывает действующий сигнал. Антагонистическая активность может быть достигнута, например, блокированием связывания и последующей сигнальной трансдукции эндогенного лиганда и/или предупреждения перекрестного сшивания или олигомеризации рецепторов или других молекул, которые могут быть необходимы для индукции клеточного сигнального метаболического пути. В одном из вариантов осуществления настоящего изобретения клеточный сигнальный метаболический путь, который подавляется или прерывается, является метаболическим путем клеточного роста. В другом варианте осуществления настоящего изобретения клеточным сигнальным метаболическим путем, который подавляется или прерывается, является метаболический путь деления клетки. В еще одном из вариантов осуществления настоящего изобретения клеточным сигнальным метаболическим путем, который подавляется или прерывается, является метаболический путь выживания клетки.
Аминокислотная последовательность исходного полипептида также может быть модифицирована для получения АСМ, обладающей модифицированной областью V или модифицированной областью С тяжелой цепи (например, модифицированной областью СН1), и/или модифицированной областью V и/или модифицированной областью CL легкой цепи с измененной способностью опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней, если модифицированная АСМ объединяется (например, связывается) с антигеном-мишенью (антигенами-мишенями). В одном из вариантов осуществления настоящего изобретения связанные антигены-мишени (например, клеточные поверхностные рецепторные молекулы) приходят в более близкое соприкосновение друг с другом и/или в более благоприятную конформацию для взаимодействия по сравнению с соответствующей исходной немодифицированной АСМ, что в результате приводит к повышению перекрестного сшивания и олигомеризации между связанными антигенами. В другом варианте осуществления настоящего изобретения связанные антигены-мишени (например, клеточные поверхностные рецепторные молекулы) остаются удаленными друг от друга и/или пребывают в менее благоприятной конформации для взаимодействия по сравнению с соответствующей немодифицированной исходной АСМ, снижая или предупреждая перекрестное сшивание или олигомеризацию между связанными антигенами. В одном из конкретных вариантов осуществления настоящего изобретения повышенное перекрестное сшивание или олигомеризация приводят к повышенному апоптозу. В другом варианте осуществления настоящего изобретения повышенное перекрестное сшивание или олигомеризация приводят к повышенной клеточной дифференциации. В одном из вариантов осуществления настоящего изобретения пониженное перекрестное сшивание или олигомеризация приводят к пониженному клеточному росту, пониженному клеточному делению или пониженному клеточному выживанию.
Существенные модификации биологических свойств области V или области СН1 тяжелой цепи или области V или области CL легкой цепи могут быть достигнуты подбором замен, которые значительно отличаются по своему воздействию на получение (а) структуры полипептидной основы в области замен, например, плоской или спиральной конформации, (б) заряда или гидрофобности молекулы в целевом сайте или (в) величины боковой цепи. Естественным образом имеющиеся аминокислотные остатки делятся на классы на основании общих свойств боковой цепи:
(1) гиброфобные: met, ala, val, leu, ile,
(2) нейтральные гидрофобные: cys, ser, thr,
(3) кислотные: asp, glu,
(4) основные: asn, gln, his, lys, arg,
(5) остатки, влияющие на ориентацию цепи: gly, pro, и
(6) ароматические: trp, tyr, phe.
Замены, не являющиеся консервативными, могут вызывать замену представителя одного из этих классов на представителя другого класса. Консервативные замены могут вызывать замену представителя этих классов на другого представителя того же класса.
Примеры полипептидов. включающих модифицированные АСМ
Настоящее изобретение также относится к антигенсвязывающим молекулам с аминокислотными модификациями, которые изменяют способность АСМ индуцировать клеточную сигнальную активность и/или опостредовать перекрестное связывание антигенов. В одном из вариантов осуществления настоящего изобретения модификация АСМ включает замену по меньшей мере одного каркасного участка вариабельной области тяжелой или легкой цепи по сравнению с исходной молекулой. В конкретном варианте осуществления настоящего изобретения в результате замены происходит замена аминокислотного остатка в каркасном участке FR1 тяжелой цепи. В предпочтительном варианте осуществления настоящего изобретения модификация АСМ включает замену аминокислотного остатка в одном или нескольких положениях 8, 9, 10, 11, 12 или 13 по нумерации Kabat в вариабельной области тяжелой цепи. В другом варианте осуществления настоящего изобретения модификация АСМ представляет замену аминокислотного остатка в каркасном участке FR4 тяжелой цепи. В одном из конкретных вариантов осуществления настоящего изобретения модификация АСМ представляет замену аминокислотного остатка в одном или нескольких положениях 110 или 112 по нумерации Kabat в вариабельной области тяжелой цепи. В другом варианте осуществления настоящего изобретения модификация АСМ представляет замену по меньшей мере одного аминокислотного остатка в легкой цепи на границе областей V и С. В одном из конкретных вариантов осуществления настоящего изобретения модификация АСМ представляет замену аминокислотного остатка по одному или нескольким положениям 40, 80, 83, 105 или 106 по нумерации Kabat.
В одном из вариантов осуществления настоящего изобретения аминокислота может быть замещена точечной мутацией в исходной последовательности, что приводит к желаемой замене аминокислотного остатка (остатков). В другом варианте модификация АСМ может представлять замену целого каркасного участка в исходной молекуле на каркасный участок, который включает желаемый аминокислотный остаток в определенном положении. В одном из вариантов осуществления настоящего изобретения модификация АСМ представляет замену каркасного участка FR1 исходной молекулы на каркасный участок FR1, кодируемый вариабельной генной последовательностью зародышевой линии.
В другом варианте осуществления настоящего изобретения АСМ включает по меньшей мере область СН1, а модификация АСМ включает замену по меньшей мере одного аминокислотного остатка по сравнению с исходным полипептидом. В одном из конкретных вариантов осуществления настоящего изобретения модификация АСМ включает замену одного или нескольких аминокислотных остатков в положениях 148, 149 и/или 150 в постоянной области тяжелой цепи.
Настоящее изобретение также относится к модифицированным антигенсвязывающим молекулам, включающим одну или несколько комплемент-детерминируемую область (CDR) исходной антигенсвязывающей молекулы. Такие усеченные CDR могут содержать минимум аминокислотных остатков, определяющих специфичность данной CDR. Понятие «остаток, определяющий специфичность» означает те остатки, которые непосредственно участвуют во взаимодействии с антигеном. В общих чертах, примерно только от одной пятой до одной третьей части остатков в конкретной CDR участвует в связывании антигена. Определяющие специфичность остатки в определенной CDR могут быть идентифицированы, например, подсчетом межатомных контактов от трехмерного моделирования и определения вариабельности последовательности в данном положении остатка в соответствии с методами, описанными в работе Padlan и др., FASEB J. 9, 1995, cc.133-139, сущность которой включена в настоящее изобретение в виде ссылки.
Таким образом, настоящее изобретение также относится к выделенному полинуклеотиду, включающему по меньшей мере одну комплементарно детерминированную область исходной молекулы, или ее варианты или ее усеченные формы, содержащие по меньшей мере остатки, определяющие специфичность для указанной комплементарно детерминированной области, причем указанный выделенный полинуклеотид кодирует гибридный полипептид. Предпочтительно такие выделенные полинуклеотиды кодируют гибридный полипептид, являющийся модифицированной антигенсвязывающей молекулой. В одном из вариантов осуществления настоящего изобретения полинуклеотид включает три комплементарно детерминированные области исходной молекулы, или ее варианты или ее усеченные формы, содержащие по меньшей мере определяющие специфичность остатки для каждой из указанных трех комплементарно детерминированных областей. В другом варианте осуществления настоящего изобретения полинуклеотид кодирует целую вариабельную область легкой или тяжелой цепи химерного (например, гуманизированного) антитела. Настоящее изобретение также относится к полипептидам, кодирующим такие полинуклеотиды.
В другом варианте осуществления настоящее изобретение связано с модифицированной антигенсвязывающей молекулой, включающей по меньшей мере одну комплементарно детерминируемую область исходной молекулы, или ее варианта, или ее усеченной формы, содержащую по меньшей мере остатки, определяющие специфичность для указанной комплементарно-детерминируемой области, и включающую последовательность, полученную из гетерологического полипептида. В одном из вариантов осуществления настоящего изобретения модифицированная антигенсвязывающая молекула включает три комплементарно детерминируемые области исходной молекулы, или вариантов ее усеченных форм, содержащих по меньшей мере остатки, определяющие специфичность для каждой из трех комплементарно детерминируемых областей. Объектом настоящего изобретения также является модифицированная антигенсвязывающая молекула, включающая вариабельную область антитела легкой или тяжелой цепи. В одном особенно предпочтительном варианте осуществления настоящего изобретения антигенсвязывающая молекула является химерной, например, гуманизированным антителом. Настоящее изобретение также относится к способам получения таких модифицированных антигенсвязывающих молекул, а также к их применению для лечения заболеваний, в том числе связанных с пролиферацией клеток.
Известно, что некоторые механизмы связаны с терапевтической эффективностью антител, в том числе антителозависимая клеточная цитотоксичность (ADCC), комплемент-зависимая цитотоксичность (CDC), и индукция остановки роста, клеточная дифференциация или апоптоз.
Настоящее изобретение связано с модифицированными АСМ, которые обладают повышенной способностью индуцировать апоптоз по сравнению с соответствующей немодифицированной исходной АСМ. Например, исходная АСМ, которая слабо индуцирует апоптоз или не индуцирует его, может быть модифицирована согласно настоящему изобретению для выработки модифицированной АСМ, которая не обладает способностью индуцировать апоптоз или имеет повышенную способность индуцировать апоптоз. Настоящее изобретение также относится к модифицированным АСМ, обладающим повышенной способностью индуцировать остановку роста или клеточной дифференциации по сравнению с соответствующей немодифицированной исходной АСМ. Например, исходная АСМ, которая не вызывает прекращения роста или клеточной дифференциации или вызывает их незначительно, может быть модифицирована согласно настоящему изобретению для выработки модифицированной АСМ, которая не вызывает прекращения роста или дифференциации, или которая обладает повышенной способностью индуцировать прекращение роста или дифференциации.
В частности, например, относительно анти-CD20 антител, большое количество экспериментальных данных показывает, что ритуксимаб действует через обычные эффекторные механизмы, измеряемые путем исследования CDC и ADCC. Сходным образом было показано, что устойчивость разных клеток лимфомы к ритуксимабу in vivo является функцией их чувствительности к CDC in vitro. Напротив, тип действия in vivo другого анти-CD20 антитела, одобренного для медицинского применения, В1, не требует ни комплемента, ни природной киллерной клеточной активности. Точнее эффективность В1 in vivo связана с его способностью индуцировать сильный апоптоз. Обычно анти-CD20 моноклональные антитела делятся на две разные категории, основанные на их механизме действия по искоренению клеток лимфомы. Анти -CD20 антитела типа I главным образом утилизируют комплемент для уничтожения клеток-мишеней, хотя антитела типа II действуют по отличным механизмам, преимущественно по механизму апоптоза. Ритуксимаб и 1F5 являются примерами анти-CD20 антител типа I, a B1 является примером антитела типа II. См., например, Cragg, M.S., Glennie, M.J., Blood 103, 2004, cc.2738-2743, Teeling, J.L. и др.. Blood 104, 2004, cc.1793-1800, содержание которых включено в настоящее описание в виде ссылок.
В патентной заявке US 2005/0123546 (сущность которой включена в настоящее изобретение в виде ссылки) впервые сконструировано анти-CD20 антитело типа I для повышенных эффекторных функций, например, ADCC, и индукции мощной способности к апоптозу, эффективно изменяя анти-CD20 антитело типа I в анти-CD20 антитело типа II. В одном из вариантов осуществления настоящее изобретение связано с модифицированным анти-CD20 антителом, включающим замену в вариабельной области тяжелой или легкой цепи, по сравнению с исходным анти-CD20 антителом типа I приводит к повышенной индукции апоптоза модифицированным анти-CD20 антителом. В другом варианте осуществления настоящее изобретение связано с анти-CD20 антителами типа II, обладающими в результате инженерии повышенной эффекторной функцией, причем без потери выраженной способности индуцировать апоптоз. В одном из вариантов осуществления настоящего изобретения анти-CD20 антитела типа II включают замену одной или нескольких аминокислот в вариабельной области тяжелой цепи или легкой цепи по сравнению с исходной молекулой. В другом варианте осуществления настоящего изобретения сконструированы анти-CD20 антитела типа I и/или типа II для изменения структуры гликозилирования в области Fc. В одном из конкретных вариантов осуществления настоящего изобретения измененное гликозилирование модифицированной АСМ содержит повышенный уровень разветвленных комплексных остатков аминокислот в области Fc. В другом варианте осуществления настоящего изобретения измененное гликозилирование модифицированной АСМ приводит к пониженному уровню фукозных остатков в области Fc. См. патентную заявку US 2004 0093621, содержимое которой включено в настоящее изобретение в виде ссылки. В другом варианте осуществления настоящего изобретения анти-CD20 антитела типа I или типа II были подвергнуты полипептидной инженерии согласно способу, описанному в US 6737056, или патентной заявке US 2004 0185045 (фирма Macrogenics), или патентной заявке US 2004 0132101 (фирма Xencor), сущность которых включена в настоящее изобретение в виде ссылки. Настоящее изобретение также относится к способам получения таких конструируемых антител типа I или типа II и способам применения таких антител для лечения различных расстройств, связанных с В-клетками, в том числе В-клетками лимфомы. Химерные и гуманизированные модифицированные АСМ Известны химерные антитела мыши/человека. См., например, Morrison, S. L. и др., PNAS 1, 1984, cc.6851-6854, европейская публикация патента 173494, Boulianna G. L и др., Nature 312, 1984, с.642, Neubeiger M. S. и др., Nature 314, 1985, с.268, европейская публикация патента 125023; Tan и др., J. Immunol. 135, 1985, с.8564, Sun L. K и др., Hybridoma 5, 1986, с.517, Sahagan и др., J. Immunol. 137, 1986, с.1066-1074. См., например, публикации Muron, Nature 312, 1984, с.597, Dickson, Genetic Engineering News 5(3), 1985, Marx, Science 229, 1985, с.455, Morrison, Science 229, 1985, cc.1202-1207. Robinson и др. в РСТ WO/88104936 описали химерное антитело с постоянной областью человека и вариабельной областью грызуна, обладающее специфичностью к эпитопу CD20; часть химерного антитела, полученная от грызуна, по данным Robinson является производной моноклонального антитела мыши 2Н7 (гамма 2b, каппа). Хотя в указанной работе авторы отмечают, что описанное химерное антитело является «основным кандидатом» для лечения расстройств, связанных с В-клетками, специалисты в данной области могут рассматривать это утверждение применительно к указанному антителу только в качестве предположения, в основном потому, что в указанной ссылке отсутствуют данные, свидетельствующие о терапевтической эффективности, а также данные, полученные на высокоразвитых млекопитающих, например, приматах или людях.
Методические подходы для получения химерных антител известны специалистам в данной области. Например, легкие и тяжелые цепи могут экспрессироваться раздельно, используя, например, легкую цепь иммуноглобулина и тяжелые цепи иммуноглобулина в разных плазмидах или в одном векторе (например, полицистронном). Затем они могут быть очищены и собраны in vitro в состав полных антител, причем методические подходы для выполнения такой сборки описаны. См., например, Scharff M., Harvey Lectures 69) 1974, с.125. Также были описаны параметры формирования in vitro антител IgG от укороченных тяжелых и легких цепей. См., например. Sears и др., Biochem. 16, 1977, cc.2016-2025.
В одном из предпочтительных вариантов осуществления настоящего изобретения химерная АСМ настоящего изобретения является гуманизированным антителом. Способы гуманизирования антител, не принадлежащих человеку, известны в данной области техники. Например, гуманизированные АСМ настоящего изобретения могут быть приготовлены методами, описанными в US 5225539, US 6180370, US 6632927, US No. 2003/0039649, US No. 2004/0044187, US No. 2005/0033028, содержание которых включено в настоящее изобретение в виде ссылок. Предпочтительно гуманизированное антитело содержит один или несколько аминокислотных остатков, интродуцированных в его состав из источника, которым не является человек. Такие аминокислотные остатки, взятые не от человека, часто называют «импортными» остатками и обычно их берут из «импортного» вариабельного домена. Гуманизирование может быть произведено по методу Winter и др. (Jones и др., Nature, 321, 1986, cc.522-525, Riechmann и др., Nature, 332, 1988, cc.323-327, Verhoeyen и др., Science, 239, 1988, cc.1534-1536) путем замещения последовательностей гипервариабельных областей для соответствующих последовательностей антитела человека. Соответственно такие «гуманизированные» антитела являются химерными антителами (US 4816567), которые существенно меньше, чем интактный вариабельный домен человека замещенный соответствующей последовательностью от другого вида (не от человека). На практике гуманизированные антитела являются типичными антителами человека, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки каркасного участка замещены остатками от аналогичных сайтов антител грызунов. Гуманизированные анти-CD20 антитела субъекта могут включать постоянные области иммуноглобулина человека.
Выбор вариабельных доменов, и легкого, и тяжелого, используемых для получения гуманизированных антител, очень важен для снижения антигенности. С помощью метода, называемого «оптимальной подгонкой», проводят скрининг последовательности вариабельного домена антитела грызуна относительно целой библиотеки известных последовательностей человека с вариабельными доменами. Последовательность человека, которая наиболее близка к последовательности грызуна, затем рассматривается в качестве каркасного участка человека (FR) для гуманизированного антитела (Sims и др., J. Immunol., 151, 1993, с.2296, Chothia и др., J. Mol. Biol., 196, 1987, с.901). Другой метод выбора последовательности каркасного участка человека заключается в сопоставлении последовательности каждого отдельного субучастка полного каркасного участка грызуна (т.е., FR1, FR2, FR3 и FR4) или некоторой комбинации отдельных субучастков (например, FR1 и FR2) против библиотеки известных последовательностей вариабельной области человека, соответствующих каркасному субучастку (например, по нумерации Kabat), и в выборе последовательности человека для каждого субучастка или комбинации, наиболее близких к субучастку или комбинации человека (патентная заявка US No. 2003/0040606A1). В другом способе применяют определенный каркасный участок, производный от конценсусной последовательности всех антител человека определенной подгруппы легких или тяжелых цепей. Тот же каркасный участок может быть использован для нескольких разных гуманизированных антител (Carter и др., Proc. Natl. Acad. Sci. USA, 89, 1992, с.4285, Presta и др., J. Immunol., 151, 1993, с.2623, сущность которых включена в настоящее изобретение в виде ссылок).
Также важно, что антитела гуманизируют с сохранением высокой степени сродства к антигену и других ценных биологических свойств. Для достижения этой цели с помощью предпочтительного способа гуманизированные антитела получают путем анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с применением трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулина могут быть получены с помощью компьютерных программ, известных специалистам в данной области (например, InsightII, accelrys inc (ранее MSI), или на сайте http://swissmodel.expasy.org/, описанном Schwede и др. в Nucleic Acids Res. 13, 2003, cc.3381-3385). Анализ таких моделей позволяет выявить возможную роль остатков аминокислот в функционировании исследуемой последовательности иммуноглобулина, т.е. выявить остатки аминокислот, которые влияют на способность исследуемого иммуноглобулина связывать соответствующий антиген. Таким способом остатки FR могут быть выбраны и соединены от реципиента и ценных последовательностей таким образом, что достигаются желаемые свойства антитела, например, поддержание сродства с антигеном-мишенью (антигенами-мишенями). В общих чертах, остатки аминокислот гипервариабельной области непосредственно и наиболее существенным образом влияют на связывание антигена.
В другом варианте осуществления настоящего изобретения антигенсвязывающие молекулы настоящего изобретения конструируются для повышения связывающего сродства, например, по методам, описанным в патентной заявке US 2004/0132066, содержание которой приводится в настоящем изобретении в виде ссылки..
В предпочтительном варианте осуществления настоящего изобретения выделенный полинуклеотид включает последовательность, которая кодирует полипептид, содержащий аминокислотную последовательность, показанную ниже в табл.3 и/или 5. Настоящее изобретение также предусматривает выделенную нуклеиновую кислоту, включающую последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична нуклеотидной последовательности, представленной ниже в табл.2 и/или 4. В другом варианте осуществления настоящее изобретение направлено на выделенную нуклеиновую кислоту, включающую последовательность, которая кодирует полипептид с аминокислотной последовательностью, которая по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, представленной ниже в табл.3 и/или 5. Настоящее изобретение также включает выделенную нуклеиновую кислоту, включающую последовательность, которая кодирует полипептид, содержащий аминокислотную последовательность какой-либо из конструкций, представленных в табл.3 и/или 5, с консервативными аминокислотными заменами. В некоторых вариантах осуществления настоящего изобретения какие-либо полинуклеотиды или полипептиды из табл.2-5 могут быть отбракованы. В связи с этим, например, в некоторых вариантах осуществления настоящего изобретения модифицированная АСМ и/или полинуклеотид, кодирующий модифицированную АСМ, не содержит какую-либо или все из числа следующих последовательностей: SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37 или SEQ ID NO:38. В другом примере, в некоторых вариантах осуществления настоящего изобретения, модифицированная АСМ настоящего изобретения не содержит какую-либо или все из числа следующих последовательностей: SEQ ID NO:55-62.
В другом варианте осуществления настоящее изобретение направлено на выделенный полипептид, включающий аминокислотную последовательность, показанную ниже в табл.3 и/или 5. Настоящее изобретение также направлено на выделенный полипептид, включающий последовательность, кодируемую нуклеотидной последовательностью, представленной ниже в табл.2 и/или 4. В другом варианте осуществления настоящее изобретение направлено на выделенный полипептид, включающий аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, представленной ниже в табл.3 и/или 5. Настоящее изобретение также включает выделенный полипептид, содержащий аминокислотную последовательность какой-либо из конструкций, представленных в табл.3 и/или 5, с консервативными аминокислотными заменами. В определенных вариантах осуществления настоящего изобретения какие-либо из полинуклеотидов или полипептидов, представленных в табл.2-5, могут быть исключены. В связи с этим, например, в определенных вариантах осуществления настоящего изобретения полипептид не содержит аминокислотной последовательности, соответствующей или кодируемой какой-либо или всеми из следующих последовательностей: SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38. В другом примере для некоторых вариантов осуществления настоящего изобретения модифицированная АСМ настоящего изобретения не содержит какую-либо или все из следующих последовательностей: SEQ ID NO:55-62.
В другом варианте осуществления настоящего изобретения предусмотрен выделенный нуклеотид, включающий последовательность, которая кодирует полипептид с аминокислотной последовательностью, являющейся производной от исходной последовательности, представленной на фиг.1 и в табл.6, а также включающей по меньшей мере одну аминокислотную замену по меньшей мере в одном каркасном участке тяжелой цепи. В другом варианте осуществления настоящего изобретения предусматривается выделенный полипептид, включающий аминокислотную последовательность, производную от исходной последовательности, показанной на фиг.1 и в табл.6, а также включающую по меньшей мере одну аминокислотную замену по меньшей мере в одном каркасном участке тяжелой цепи.
В одном из вариантов осуществления настоящего изобретения модифицированные АСМ настоящего изобретения могут включать замену целого каркасного участка по сравнению с исходной АСМ. Например, настоящее изобретение также связано с выделенным полинуклеотидом, включающим последовательность, которая кодирует полипептид, содержащий по меньшей мере один каркасный участок тяжелой цепи, производный от последовательности VH зародышевой линии человека. В предпочтительном варианте осуществления настоящего изобретения последовательность VH зародышевой линии человека в каркасном участке FR1, или в положениях 8-13 по нумерации Kabat, получена от какой-либо из последовательностей, представленных ниже в табл.7. Эти последовательности могут быть получены из базы данных IMGT (http://mighf.cines.fro:8104/texts/IMGTrepertoire}. причем каждая последовательность, обладающая идентификационным номером, включена в настоящее изобретение в виде ссылки.
В другом варианте осуществления настоящее изобретение связано с выделенным полинуклеотидом, включающим последовательность, которая кодирует полипептид, включающий последовательность аминокислот в положениях 8-13 по нумерации Kabat вариабельной области тяжелой цепи или какую-либо ее подгруппу (например, положения 9-12, положения 10-12, и т.д.) по какой-либо из последовательностей, представленных ниже в табл.8. В одном из вариантов осуществления настоящее изобретение связано с выделенным полипептидом, включающим аминокислотную последовательность в положении 8-13 по нумерации Kabat или какую-либо ее подгруппу (например, положения 9-12, положения 10-12, и т.д.) по какой-либо из последовательностей, представленных ниже в табл.8.
В другом варианте осуществления настоящее изобретение направлено на выделенный полинуклеотид, включающий последовательность, которая кодирует полипептид, включающий аминокислоту в положении 108-113 по нумерации Kabat вариабельной области тяжелой цепи или какую-либо ее подгруппу (например, положения 110-112, положения 110 и 112 и т.д.). В одном из конкретных вариантов осуществления настоящего изобретения последовательность в положениях 108-113 показана в табл.9 ниже. В другом варианте осуществления настоящее изобретение относится к выделенному полипептиду, включающему аминокислотную последовательность в положениях 108-113 по нумерации Kabat или какую-либо ее подгруппу (например, положения 110-112, положения 110 и 112 и т.д.) по какой-либо из последовательностей, представленных ниже в табл.9.
В другом варианте осуществления настоящее изобретение относится к экспрессии вектора и/или клетки-хозяина, которая включает один или несколько выделенных полинуклеотидов настоящего изобретения.
Обычно для экспрессии АСМ по настоящему изобретению может быть использован какой-либо тип культивируемой линии клеток. В предпочтительном варианте осуществления настоящего изобретения клетки СНО, HEK293-EBNA, BHK, NSO, SP2/0, клетки миеломы YO, клетки миеломы мыши Р3Х63, клетки PER, клетки PER.C6 или клетки гибридомы, другие клетки млекопитающих, дрожжи, клетки насекомых и растительные клетки применяют в качестве исходной клеточной линии для получения сконструированных клеток-хозяев настоящего изобретения.
Модифицированные АСМ, дополнительно включающие области Fc и варианты областей Fc
В одном из вариантов осуществления настоящего изобретения АСМ настоящего изобретения, включающие одно или несколько аминокислотных замещений в V и/или СН1 областях тяжелой цепи и/или V и/или С областях легкой цепи, могут также включать область Fc человека. В одном из конкретных вариантов осуществления настоящего изобретения постоянная область человека является IgG1, что показано в SEQ ID NO 80 и 81 ниже:
Нуклеотидная последовательность IgG1 (SEQ ID NO:80)
ACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAAAGCAGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATGA
Аминокислотная последовательность IgG1 (SEQ ID NO:81)
TKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKAEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Варианты и изоформы области Fc человека также являются объектами настоящего изобретения. Например, варианты области Fc, применимые в настоящем изобретении, могут быть получены методами, описанными в US 6737056 (варианты области Fc с измененной эффекторной функцией из-за модификации одной или нескольких аминокислот), или в патентных заявках US 60/439498, 60/456041, 60/514549 или WO 2004/063351 (варианты области Fc с повышенным связывающим сродством из-за аминокислотной модификации), или в патентных заявках US 10/672280 и WO 2004/099249 (варианты Fc с измененной связываемостью с FcγR из-за аминокислотной модификации), сущность которых включена в настоящее изобретение в виде ссылок.
В другом варианте осуществления настоящего изобретения АСМ, включающие одно или несколько аминокислотных замен в V и/или СН1 областях тяжелой цепи и/или V и/или С областях легкой цепи, могут дополнительно включать вариант области Fc. Специалист может сконструировать область Fc для получения варианта с измененным связывающим сродством для одного или нескольких областей Fc. Например, может быть модифицирован один или несколько аминокислотных остатков в области Fc для изменения (например, повышения или понижения) связывания с FcR, согласно описанному в предварительной патентной заявке US 60/678,776, сущность которой включена в настоящее изобретение в виде ссылки. Обычно может быть произведена замена одной или нескольких аминокислот в области Fc, которые определяют связывание FcR, для получения такого варианта области Fc. В предпочтительных вариантах осуществления настоящего изобретения не более 1-10 остатков в области Fc может быть делегировано или замещено. В настоящем изобретении области Fc, включающие одну или несколько аминокислотных модификаций (например, замен), могут предпочтительно содержать по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, и наиболее предпочтительно по меньшей мере примерно 95%, последовательности исходной области Fc или нативной последовательности области Fc человека.
Также могут быть модифицированные области Fc с инсерциями аминокислот, чьи варианты имеют измененную эффекторную функцию. Например, можно интродуцировать по меньшей мере один аминокислотный остаток (например, 1-10 аминокислотных остатков и обычно не более 10 остатков), примыкающий к одному или нескольким положениям области Fc, который, согласно установленному в настоящем изобретении, воздействует на связывание FcR, В контексте настоящего изобретения под «примыканием» подразумевается присоединение одной или двух аминокислот в области Fc. Такие варианты области Fc могут проявлять повышенное или уменьшенное связывание с FcR и/или эффекторную функцию. Для получения таких вариантов с инсерциями можно оценить общую кристаллическую структуру полипептида, включающую область связывания FcR (например, внеклеточный домен исследуемого рецептора (FcR)) и область Fc, в которую инсертирован аминокислотный остаток (остатки) (см., например, статьи Sondermann и др. Nature 406, 2000, с.267, Deisenhofer, Biochemistry 20, 1981, cc.2361-2370, Burmeister и др., Nature 3442, 1994, cc.379-383, включенные в настоящее изобретение в виде ссылок) для рационального конструирования модифицированной области Fc, которая проявляет, например, улучшенную способность к связыванию с FcR.
Путем интродукции соответствующих модификаций последовательностей аминокислот в исходную область Fc может быть получен вариант области Fc, который (а) опосредует одну или несколько эффекторных функций в присутствии эффекторных клеток человека более или менее эффективно и/или (б) связывает рецептор Fcγ (FcγR) или неонатальный рецептор Fc (FcRn) с лучшей аффинностью по сравнению с исходным полипептидом. Такие модифицированные области Fc обычно могут включать по меньшей мере одну аминокислотную модификацию в области Fc.
В предпочтительных вариантах осуществления настоящего изобретения область Fc исходного полипептида является областью Fc человека, например, нативной областью Fc человека IgG1 человека (А и не-А аллотипы), IgG2, IgG3, IgG4 и все аллотипы, известные или описанные у каких-либо видов. Область Fc. Эти области обладают последовательностями, например, описанными во временной патентной заявке US No. 60/678776, которая включена в настоящее изобретение в виде ссылки на ее сущность.
В некоторых вариантах осуществления настоящего изобретения для получения АСМ, включающей одну или несколько аминокислотных замен в областях V и/или СН1 тяжелой цепи и/или областях V и/или С легкой цепи и дополнительно включающей модифицированную область Fc с улучшенной эффекторной функцией (например, ADCC), исходный полипептид предпочтительно обладает ранее существовавшей активностью ADCC (например, исходный полипептид включает IgG1 человека или Fc область IgG3 человека). В некоторых вариантах осуществления настоящего изобретения модифицированная область Fc с улучшенной ADCC опосредует ADCC значительно более эффективно, чем антитело с нативной последовательностью области Fc в IgG1 или IgG3.
В некоторых вариантах осуществления настоящего изобретения аминокислотная модификация (модификации) интродуцирована в домен СН2 исходной области Fc.
Полипептиды настоящего изобретения, обладающие модифицированными областями Fc, могут быть подвергнуты одной или нескольким дополнительным модификациям, в зависимости от желаемого или намеченного применения данного полипептида. Такие модификации могут включать, например, дополнительное изменение аминокислотной последовательности (замена, инсерцию и/или делецию аминокислотных остатков), гибридизацию с гетерологическим полипептидом (полипептидами) и/или ковалентными модификациями. Такие дополнительные модификации могут быть выполнены до, одновременно или после аминокислотной модификации (модификаций), описанной выше, что в результате приводит к изменению связывания Fc рецептора и/или эффекторной функции.
В другом варианте или дополнительно может быть полезно комбинировать аминокислотные модификации с одной или несколькими дополнительными аминокислотными модификациями, в результате изменяется Clq связывание и/или функция комплемент-зависимой цитотоксичности области Fc. Связанный с этим исходный полипептид особого интереса в настоящем изобретении является полипептидом, который связывается с Clq и проявляет комплементзависимую цитотоксичность (CDC). Аминокислотные замены, описанные в настоящем изобретении, могут приводить к изменению способности исходного полипептида связываться с Clq и/или модифицировать его функцию комплементзависимой цитотоксичности (например, уменьшить и предпочтительно ослабить эти эффекторные функции). Однако полипептиды, включающие замены по одному или нескольким описанным положениям с улучшенным Clq связыванием и/или функцией комплемент-зависимой цитотоксичности (complement dependent cytotoxicity - CDC), рассматриваются в настоящем изобретении. Например, может быть, что исходный полипептид неспособен связывать Clq и/или опосредовать CDC, и он может быть модифицирован с помощью описанных в настоящем изобретении способов таким образом, что он приобретает такие дополнительные эффекторные функции. Кроме того, полипептиды с имевшейся ранее Clq связывающей активностью, дополнительно необязательно включают способность опосредовать CDC, и могут быть модифицированы таким образом, что одна или обе эти активности повышаются. Аминокислотные модификации, которые изменяют Clq и/или модифицируют его функцию комплемент-зависимой цитотоксичности, описаны, например, в патентной заявке WO00/42072, включенный в настоящее изобретение в виде ссылки.
Согласно описанному выше, может быть сконструирована область Fc или ее часть с измененной эффекторной функцией, например, за счет модификации связывания Clq и/или связывания FcR, и за счет этого изменения активности CDC и/или активности ADCC. Например, может быть получена модифицированная область Fc с улучшенным связыванием Clq и улучшенным связыванием FcγRIII (например, и улучшенной активностью ADCC, и улучшенной активностью CDC). В другом варианте, если нужно, чтобы эффекторная функция была снижена или удалена, может быть сконструирована модифицированная область Fc со сниженной активностью CDC и/или пониженной активностью ADCC. В других вариантах осуществления настоящего изобретения можно повысить только одну из этих активностей и необязательно также понизить другую активность, например, получить модифицированную область Fc с повышенной активностью ADCC, но пониженной активностью CDC, и наоборот.
Другой тип аминокислотного замен изменяет тип гликозилирования полипептида. Это может быть достигнуто, например, путем делении одной или нескольких углеводных частей молекулы, выявленных в полипептиде, и/или добавлением одного или нескольких сайтов гликозилирования, которых нет в полипептиде. Гликозилирование полипептидов обычно либо N-связано, либо O-связано. N-связывание относится к присоединению углеводной части к боковой цепи остатка аспарагина. Пептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, в которых Х обозначает какую-либо аминокислоту кроме пролина, являются распознающими последовательностями для ферментного присоединения углеводной части к боковой цепи аспарагина. Таким образом, наличие одной из этих пептидных последовательностей в полипептиде создает мощный сайт гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, обычно серину или треонину, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
В некоторых вариантах осуществления настоящего изобретения предусмотрены композиции, включающие модификацию исходного полипептида, имеющего область Fc, причем модифицированная область Fc включает по меньшей мере одну модификацию остатка поверхностной аминокислоты (см., например, Deisenhofer, Biochemistry, 28, 1981, cc.2361-2370, и WO00/42072; оба источника включены в настоящее изобретение в виде ссылок). В других вариантах осуществления настоящего изобретения предусмотрены композиции, включающие модификацию исходного полипептида, имеющего область Fc, причем модифицированная область Fc включает по меньшей мере одну модификацию не связанной с поверхностью аминокислоты. В других вариантах осуществления настоящего изобретения описан вариант исходного полипептида, имеющего область Fc, причем вариант включает по меньшей мере одну модификацию поверхностной аминокислоты и по меньшей мере одну модификацию не связанной с поверхностью аминокислоты.
Терапевтическая эффективность модифицированных АСМ по настоящему изобретению может быть дополнительно повышена их получением в клетке-хозяине, которая была подвержена гликоинженерии, для приобретения измененной экспрессии по меньшей мере одной гликопротеинмодифицированной гликозилтрансферазы. В одном из вариантов осуществления настоящего изобретения подвергшаяся гликоинженерии клетка-хозяин дополнительно экспрессирует одну или несколько из следующих молекул: полинуклеотид, кодирующий полипептид, обладающий GnTIII активностью, полинуклеотид, кодирующий полипептид, обладающий ManII активностью, или полинуклеотид, кодирующий полипептид, обладающий GalT активностью. В одном из предпочтительных вариантов осуществления настоящего изобретения клетка-хозяин экспрессирует полинуклеотид, кодирующий полипептид, обладающий активностью GnTIII или ManII. В другом варианте осуществления настоящего изобретения клетка-хозяин экспрессирует полинуклеотид, кодирующий полипептид, обладающий активностью GnTIII, a также полинуклеотид, кодирующий полипептид, обладающий активностью ManII. В другом предпочтительном варианте осуществления настоящего изобретения полипептид, обладающий активностью GnTIII, является гибридным полипептидом, включающим домен локализации Гольджи резидентного полипептида Гольджи. В еще одном из предпочтительных вариантов осуществления настоящего изобретения экспрессия модифицированных АСМ настоящего изобретения в клетке-хозяине, которая экспрессирует полинуклеотид, кодирующий полипептид, обладающий активностью GnTIII, приводит к модификации АСМ с повышенным связывающим сродством с рецептором Fc и повышенной эффекторной функцией. Соответственно, в одном из вариантов осуществления настоящего изобретения оно направлено на клетку-хозяина, включающую (а) выделенную нуклеиновую кислоту, включающую последовательность, кодирующую полипептид, имеющий активность GnTIII, и (б) выделенный полинуклеотид, кодирующий АСМ настоящего изобретения, например, химерное, приматизированное или гуманизированное антитело, которое связывает антиген человека CD20. В предпочтительном варианте осуществления настоящего изобретения полипептид, обладающий активностью GnTIII, является гибридным полипептидом, включающим каталитический домен GnTIII и домен локализации Гольджи является доменом локализации маннозидазы II. Способы получения таких гибридных полипептидов и их применение для получения антител с повышенными эффекторными функциями описаны в предварительной заявке на патент US 60/495,142 и в заявке на патент US 2004/0241817, краткое содержание которых включено в настоящее изобретение в виде ссылок. В другом предпочтительном варианте осуществления настоящего изобретения химерная АСМ является химерным антителом или его фрагментом, способным специфически связываться с антителом В-Ly1 грызунов. В особенно предпочтительном варианте осуществления настоящего изобретения химерное антитело включает Fc человека. В другом предпочтительном варианте осуществления настоящего изобретения антитело является приматизированным или гуманизированным.
В одном из вариантов осуществления настоящего изобретения один или несколько полинуклеотидов, кодирующих АВМ настоящего изобретения, могут быть экспрессированы под контролем конститутивного промотора или, напротив, регулируемой системы экспрессии. К применимым регулируемым системам экспрессии относятся, но ими не ограничиваются, регулируемая тетрациклином система экспрессии, экдизон-индуцибельная система экспрессии, lac-индуцируемая система экспрессии, глюкокортикоид-индуцибельная система экспрессии, температура-индуцибельная промоторная система и металлотионеин метал-индуцибельная система экспрессии. Если несколько разных нуклеиновых кислот, кодирующих АСМ настоящего изобретения, содержатся в системе клетки-хозяина, некоторые из них могут экспрессироваться под контролем конститутивного промотора, хотя другие экспрессируются под контролем регулируемого промотора. Под максимальным уровнем экспрессии подразумевается наивысший возможный уровень стабильной экспрессии полипептида, который не оказывает существенного побочного действия на скорость роста клеток, и может быть определен с помощью традиционных экспериментов. Уровни экспрессии определяют методами, известными в данной области, в том числе методом вестерн блоттинга с применением антитела, специфического для АСМ, или антитела, специфического в отношении пептидной метки, гибридизированной с АСМ, и нозерн-блоттинга. В качестве еще одного варианта полинуклеотид может быть оперативно связан с репортерным геном; уровни экспрессии модифицированной АСМ, обладающей практически такой же связывающей специфичностью по отношению к исходному антителу, определяют измерением сигнала, коррелирующего с уровнем экспрессии репортерного гена. Репортерный ген может транскрибироваться вместе с нуклеиновой кислотой (кислотами), кодирующей указанный гибридный полипептид в виде одной молекулы иРНК; их соответствующие кодирующие последовательности могут быть связаны либо IRES-сайтом (внутренним сайтом связывания рибосомы), либо кэп-независимым трансляционным энхансером (cap-independent translation enhancer - CITE). Репортерный ген может транслироваться вместе по меньшей мере с одной нуклеиновой кислотой, кодирующей модифицированную АСМ, обладающую практически такой же связывающей специфичностью по отношению к исходному антителу таким образом, что формируется одна полипептидная цепочка. Нуклеиновые кислоты, кодирующие АСМ настоящего изобретения, могут быть оперативно связаны с репортерным геном под контролем одного промотора таким образом, что нуклеиновая кислота, кодирующая гибридный полипептид, и репортерный ген транскрибируются в молекулу РНК, которая в другом варианте сплайсирована в две отдельные молекулы информационной РНК (иРНК); одна из образующихся молекул иРНК транслируется в указанный репортерный белок, а другие транслируются в указанный гибридный полипептид.
Экспрессия модифицированных АСМ
Способы, хорошо известные специалистам в данной области, могут применяться для конструирования векторов экспрессии, содержащих кодирующую последовательность модифицированной АСМ, обладающей практически такой же связывающей специфичностью по отношению к исходному антителу наряду с соответствующими сигналами контроля транскрипции/трансляции. К этим способам относятся методики рекомбинации ДНК in vitro, методы синтеза и рекомбинации in vivo/генетической рекомбинации. См., например, способы, описанные Maniatis и др., в кн.: «Molecular cloning a laboratory manual», изд-во Cold Spring Harbor Laboratory, 1989, Нью-Йорк, и Ausubel и др., в кн.: «Current protocols in molecular biology», изд-во Greene Publishing Associates and Wiley Interscience, 1989, Нью-Йорк.
Различные векторные системы экспрессии в хозяина могут применяться для экспрессии кодирующей последовательности АСМ настоящего изобретения. Предпочтительно используют в качестве систем клеток-хозяев клетки млекопитающих, подвергнутые трансфекции векторами экспрессии плазмидной ДНК или космидной ДНК, содержащими кодирующую последовательность исследуемого белка и кодирующую последовательность гибридного полипептида. Наиболее предпочтительно используют в качестве систем клеток-хозяев клетки СНО, HEK293-EBNA, BHK, NSO, SP2/0, клетки миеломы YO, клетки миеломы мыши РЗХ63, клетки PER, PER.C6 или клетки гибридомы, другие клетки млекопитающих, дрожжевые клетки, клетки насекомых и клетки растений. Некоторые примеры систем экспрессии и методов селекции описаны в следующих работах: Borth и др., Biotechnol. Bioen. 71, 2000-2001, cc.266-273, Werner и др., Arzneimittelforschung/Drug Res. 48, 1998, cc.870-880 (1998), Andersen и Krummen, Curr. Op. Biotechnol. 13, 2002, cc.117-123, Chadd и Chamow, Curr. Op.Biotechnol. 12, 2001, cc.188-194, Giddings, Curr. Op. Biotechnol. 12, 2001, cc.450-454. В других вариантах осуществления настоящего изобретения могут рассматриваться другие системы эукариотических клеток-хозяев, включая клетки дрожжей, трансформированные рекомбинантными дрожжевыми векторами экспрессии, содержащими кодирующую последовательность АСМ настоящего изобретения, например, системы экспрессии, описанные в патентных заявках US 60/344169 и WO 03/056914 (способы получения гликопротеина типа гликопротеина человека в эукариотической клетке-хозяине, не являющейся клеткой человека) (сущность патентных заявок включена в настоящее изобретение в виде ссылок); системы клеток насекомых, инфицированные рекомбинантными вирусными векторами экспрессии (например, бакуловирусы), несущими кодирующую последовательность модифицированной АСМ, обладающей практически такой же связывающей специфичностью, что и исходное антитело; системы клеток растений, инфицированные рекомбинантными вирусными векторами экспрессии (например, вирусом мозаики цветной капусты, CaMV, вирусом мозаики табака, TMV), или трансформированные рекомбинантными плазмидными векторами экспрессии (например, плазмидой Ti), содержащей кодирующую последовательность АСМ настоящего изобретения, включая, но, не ограничиваясь ими, системы экспрессии, описанные в US 6815184 (способы экспрессии и секреции биологически активных полипептидов из генетически измененной ряски), WO 2004/057002 (образование гликозилированных белков клетками мхов в результате интродукции гена гликозилтрансферазы), WO 2004/024927 (способы генерации внеклеточных гетерологических нерастительных белков в протопластах мхов), заявках на патент US 60/365769, 60/368047 и WO 2003/078614 (процессинг гликопротеина в трансгенных растениях, включающих функциональный фермент GnTIII млекопитающих) (сущность каждой работы включена в настоящее изобретение в виде ссылки) или системы клеток животных, инфицированных рекомбинантными вирусными векторами экспрессии (например, аденовирусом, вирусом коровьей оспы), включая клеточные линии, сконструированные для содержания большого количества копий ДНК, кодирующей модифицированную АСМ, имеющую практически такую же специфичность связывания исходного антибиотика или стабильно амплифицированного (CHO/dhfr), или нестабильно амплифицированного в двойных микрохромосомах (например, линии клеток грызунов). В одном из вариантов осуществления настоящего изобретения вектор, включающий полинуклеотид (полинуклеотиды), кодирующий АСМ настоящего изобретения, является полицистронным. Кроме того, в одном из вариантов осуществления настоящего изобретения АСМ, обсуждавшаяся выше, является антителом или его фрагментом. В предпочтительном варианте осуществления настоящего изобретения АСМ является гуманизированным антителом.
Для способов настоящего изобретения стабильная экспрессия обычно предпочтительнее неустойчивой экспрессии, поскольку обычно дает более воспроизводимые результаты, а также подвержена в большей степени крупномасштабному продуцированию. До применения векторов экспрессии, содержащих механизм репликации вирусного происхождения, клетки-хозяева могут быть трансформированы соответствующими кодирующими нуклеиновыми кислотами, контролируемыми соответствующими элементами контроля экспрессии (например, промотором, энхансером, последовательностями, терминаторами транскрипции, сайтами полиаденилирования и т.д.) и селективным маркером. После интродукции чужеродной ДНК, сконструированные клетки могут быть оставлены для роста в течение 1-2 суток в обогащенной среде и затем их переносят в селективные среды. Селективный маркер в рекомбинантной плазмиде проявляет устойчивость к отбору и позволяет отбирать клетки, которые обладают стабильно интегрированной в хромосомы плазмидой и растут для образования очагов, которые в свою очередь могут быть клонированы и послужить началом клеточных линий.
Может быть применен ряд селективных систем, включая, но не ограничиваясь ими, тимидинкиназу вируса герпес симплекс (Wigler и др., Cell 11, 1977, с.223), гены гипоксантин-гуанин-фосфорибозилтрансферазы (Szybalska, Szybalski, Proc. Natl. Acad. Sci. USA 48, 1962, с.2026) и аденин-фосфорибозилтрансферазы (Lowy и др., Cell 22, 1980, с.817), которые могут быть применены в клетках tk-, hgprt- или aprt-, соответственно. Антиметаболитная устойчивость также может быть применена в качестве основы для отбора генов dhfr, который обусловливает устойчивость к метатрексату (Wigler и др., Natl. Acad. Sci. USA 77, 1989, с.3567, O'Hare и др., Proc. Natl. Acad. Sci. USA 78, 1981, с.1527), gpt, который обусловливает устойчивость к микофеноловой кислоте (Mulligan, Berg, Proc. Natl. Acad. Sci. USA 78, 1981, с.2072), пео, который обусловливает устойчивость к аминогликозиду G-418 (Colberre-Garapin и др., J. Mol. Biol. 150, 1981, с.1), и hygro, который обусловливает устойчивость к гигромицину (Santerre и др., Gene 30, 1984, с.147). Ранее были описаны селективные гены, а именно, trpB, который позволяет клеткам утилизировать индол вместо триптофана, hisD, который позволяет клеткам утилизировать гистинол вместо гистидина (Hartman, Mulligan, Proc. Natl. Acad. Sci. USA 85, 1988, с.8047), система глутаминсинтазы, и ODC (орнитиндекарбоксилаза), которая обусловливает устойчивость к ингибитору орнитиндекарбоксилазы, 2-(дифторметил)-DL-орнитин, DFMO (McConlogue в кн.: «Current Communications in Molecular Biology», 1987, изд-во Cold Spring Harbor Laboratory).
Экспрессия модифицированных антигенсвязывающих молекул (АСМ). включающих области Fc с измененным гликозилированием
Настоящее изобретение также относится к способу модификации профиля гликозилирования модифицированных АСМ, включающих по меньшей мере одну замену аминокислоты в области V или СН1, которая образуется клеткой-хозяином, включая экспрессирование в указанной клетке-хозяине нуклеиновой кислоты, кодирующей модифицированную АСМ настоящего изобретения, и нуклеиновой кислоты, колирующей полипептид с активностью GnTIII, или вектор, включающий такие нуклеиновые кислоты. Предпочтительно модифицированный полипептид является IgG или его фрагментом, включающим область Fc. В одном из особенно предпочтительных вариантов осуществления настоящего изобретения АСМ является гуманизированным антителом или его фрагментом. В другом варианте осуществления настоящего изобретения конструируют клетку-хозяина для совместной экспрессии АСМ настоящего изобретения, GnTIII и маннозидазы II (ManII).
Модифицированные АСМ, образуемые клетками-хозяевами настоящего изобретения, проявляют повышенное Fc-рецептор связывающее сродство и/или повышенную эффекторную функцию - результат модификации. В особенно предпочтительном варианте осуществления настоящего изобретения АСМ является гуманизированным антителом или его фрагментом, содержащим область Fc. Предпочтительно повышенное Fc-рецептор связывающее сродство является повышенным связыванием с Fcγ активирующим рецептором, например, FcγRIIIa рецептором. Повышенная эффекторная функция представляет предпочтительно повышение одной или нескольких из следующих функций: повышенной антитело-зависимой клеточной цитотоксичности, повышенного антитело-зависимого клеточного фагоцитоза (antibody-dependent cellular phagocytosis - ADCP), повышенной секреции цитокина, повышенным опосредованным иммунным комплексом потреблением антигена антиген-презентирующими клетками, повышенной Fc-опосредованной клеточной цитотоксичности, повышенным связыванием с клетками ПКК, повышенным связыванием с макрофагами, повышенным связыванием с полинуклеарными клетками, повышенным связыванием с моноцитами, повышенным перекрестным сшиванием связанных с мишенью антител, повышенным прямым сигнал-индуцируемым апоптозом, повышенным созреванием дендровидных клеток и повышенным примированием с Т-клетками.
Эффекторные функции могут быть измерены и/или определены разными методами, известными специалистам в данной области. Различные методы измерения эффекторных функций, включая Fc рецептор связывающее сродство и комплементзависимую цитотоксичность, описаны в патентной заявке US 2004/0241817А1, сущность которой включена в настоящее изобретение в виде ссылки. Секреция цитокина может быть измерена, например, с помощью метода сэндвич- ELISA, см., например, McRae и др., J. Immunol. 164, 2000, cc.23-28, и протокола сэндвич- ELISA, с которым можно ознакомиться на сайте www.bdbiosciences.com/pharmingen/protocols, или методами, описанными Takahashi и др., British J. Pharmacol. 137, 2002, cc.315-322, указанные публикации включены в настоящее изобретение в виде ссылок. Созревание дендровидных клеток, например, можно установить с помощью метода, описанного Kalergis, Ravetch, J. Exp.Med. 195, 2002, cc.1653-1659, сущность которого приведена в настоящем изобретении в виде ссылки. Примеры изучения фагоцитоза и потребления/презентации антигена предложены в работах Gresham и др., J. Exp. Med. 191, 2000, cc.515-528, Krauss и др., J. Immunol. 153, 1994, cc.1769-1777, Rafiq и др., J. Clin. Invest. 110, 2002, cc.71-79, Hamano и др., J. Immunol. 164, 2000, cc.6113-6119, каждая из которых включена в настоящее изобретение в виде ссылки. Сниженная регуляция клеточных поверхностных рецепторов может быть измерена, например, методами, описанными Liao и др., Blood 83, 1994, cc.2294-2304, сущность которых приводится в настоящем изобретении в виде ссылок. Основные методы, протоколы и методики содержатся в кн.: «Cell Biology: A Laboratory Handbook», 1998, под ред. Celis J.E., которая включена в настоящее изобретение в виде ссылки. Специалист в данной области может адаптировать указанные выше методы, протоколы и методики для использования в настоящем изобретении.
Настоящее изобретение также относится к способу получения АСМ настоящего изобретения, обладающей модифицированными олигосахаридами в клетке-хозяине, включающему (а) культивирование клетки-хозяина, сконструированной таким образом, чтобы экспрессировать по меньшей мере одну нуклеиновую кислоту, кодирующую полипептид, проявляющий активность GnTIII в условиях, позволяющих вырабатывать АСМ по настоящему изобретению, причем указанный полипептид, обладающий активностью GnTIII, экспрессируется в количестве, достаточном для модификации олигосахаридов в области Fc указанной АСМ, образуемой указанной клеткой-хозяином, и (б) выделение указанной АСМ. В предпочтительном варианте осуществления настоящего изобретения полипептид, обладающий активностью GnTIII, является гибридным полипептидом, содержащим каталитический домен GnTIII. В одном из особенно предпочтительных вариантов осуществления настоящего изобретения гибридный полипептид также включает домен локализации Гольджи резидентного полипептида Гольджи.
Предпочтительно домен локализации Гольджи является доменом локализации маннозидазы II или GnTI. В другом варианте домен локализации Гольджи выбран из группы, включающей: домен локализации маннозидазы I, домен локализации GnTII и домен локализации а 1-6 коровой фукозилтрансферазы. Полученные такими способами настоящего изобретения АСМ обладают повышенным Fc-рецептор связывающим сродством и/или повышенной эффекторной функцией. Предпочтительно повышенная эффекторная функция является одной или несколькими из следующих: повышенной Fc-опосредованной клеточной цитотоксичностью (включая повышенную антитело-зависимую цитотоксичность), повышенным антитело-зависимым клеточным фагоцитозом (ADCP), повышенной секрецией цитокина, повышенным потреблением антиген-презентирующими клетками опосредованного с иммунным комплексом антигена, повышенным связыванием с природными клетками-киллерами (ПКК), повышенным связыванием с макрофагами, повышенным связыванием с моноцитами, повышенным связыванием с макрофагами, повышенным связыванием с полиморфоядерными клетками, повышенным прямым сигнал-индуцируемым апоптозом, повышенным перекрестным сшиванием связанных с мишенью антител, повышенным созреванием дендровидных клеток и повышенным примированием Т-клеток. Повышенное Fc-рецептор связывающее сродство предпочтительно является повышенным связыванием с Fc активирующими рецепторами, например, рецептором FcγRIIIa. В особенно предпочтительном варианте осуществления настоящего изобретения АСМ является гуманизированным антителом или его фрагментом.
В другом варианте осуществления настоящее изобретение направлено на модифицированную АСМ, обладающую практически такой же связывающей специфичностью, что и исходное антитело, и получаемую с помощью способов настоящего изобретения, которая содержит в повышенной доле разветвленные олигосахариды в области Fc указанного полипептида. Предполагают, что такая АСМ включает антитела и их фрагменты, содержащие область Fc. В предпочтительном варианте осуществления настоящего изобретения АСМ является гуманизированным антителом. В одном из вариантов осуществления настоящего изобретения процентное содержание разветвленных олигосахаридов в области Fc АСМ составляет по меньшей мере 50%, более предпочтительно по меньшей мере 60% по меньшей мере 70% по меньшей мере 80%, или по меньшей мере 90%, и наиболее предпочтительно по меньшей мере 90-95% общего содержания олигосахаридов. В еще одном варианте осуществления настоящего изобретения АСМ, получаемая способами настоящего изобретения, обладает повышенным содержанием нефукозилированных олигосахаридов в области Fc из-за модификации ее олигосахаридов способами настоящего изобретения. В другом варианте осуществления настоящего изобретения процентное содержание нефукозилированных олигосахаридов составляет по меньшей мере 50%, предпочтительно по меньшей мере 60-70%, наиболее предпочтительно по меньшей мере 75%. Нефукозилированные олигосахариды могут быть гибридными или комплексными. В особенно предпочтительном варианте осуществления настоящего изобретения АСМ, вырабатываемая клетками-хозяевами по способам настоящего изобретения, содержит повышенную долю разветвленных нефукозилированных олигосахаридов в области Fc. Разветвленные нефукозилированные олигосахариды могут быть или гибридными, или комплексными. Конкретно способы настоящего изобретения могут быть применены для получения АСМ, у которых по меньшей мере 15%, более предпочтительно, по крайней мере, 20%, более предпочтительно по меньшей мере 25%, более предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 35% олигосахаридов в области Fc в АСМ являются разветвленными нефукозилированными. Способы настоящего изобретения также могут быть применены для получения полипептидов, у которых по меньшей мере 15%, более предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 25%, более предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 35% олигосахаридов в области Fc полипептида являются разветвленными гибридными нефукозилированными.
В другом варианте осуществления настоящее изобретение связано с модифицированной АСМ, обладающей практически такой же связывающей специфичностью, что и исходное антитело, которую конструируют для повышения эффекторной функции и/или повышения Fc рецептор связывающего сродства способами настоящего изобретения. Предпочтительно к повышенной эффекторной функции относится одна или несколько из следующих: повышенная Fc-опосредованная клеточная цитотоксичность (включая повышенную антителозависимую клеточную цитотоксичность), повышенный антителозависимый клеточный фагоцитоз (ADCP), повышенная секреция цитокина, повышенное потребление антиген-презентирующими клетками опосредованного с иммунным комплексом антигена, повышенное связывание с клетками ПКК; повышенное связывание с макрофагами, повышенное связывание с моноцитами, повышенное связывание с полиморфоядерными клетками, повышенный сигнал-индуцируемый апоптоз, повышенное перекрестное сшивание связанных с мишенью антител, повышенное созревание дендровидных клеток или повышенное примирование Т-клеток. В предпочтительном варианте осуществления настоящего изобретения повышенное Fc-рецептор связывающее сродство является повышенным связыванием с Fc активирующим рецептором, наиболее предпочтительно с рецептором FcγRIIIa В одном из вариантов осуществления настоящего изобретения модифицированная АСМ является антителом, фрагментом антитела, содержащим область Fc, или гибридным белком, который включает область, равноценную области Fc иммуноглобулина. В особенно предпочтительном варианте осуществления настоящего изобретения АСМ является гуманизированным антителом.
Фармацевтические композиции, включающие модифицированные антигенсвязывающие молекулы (АСМ)
Настоящее изобретение также относится к фармацевтическим композициям, включающим модифицированные АСМ настоящего изобретения и фармацевтически приемлемый носитель.
Могут применяться какие-либо традиционные носители. Материал носителя может быть органическим или неорганическим, пригодным для приема внутрь, подкожного или парентерального введения. К приемлемым носителям относятся вода, желатин, гуммиарабик, лактоза, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли, вазелин и другие. Кроме того, фармацевтические препараты могут содержать другие агенты фармацевтического действия. Дополнительные вспомогательные средства, например, ароматизирующие вещества, стабилизаторы, эмульгаторы, буферы и др. могут добавляться в соответствии с принятыми методами составления фармацевтических смесей.
Понятие «фармацевтически приемлемый» в контексте настоящего изобретения относится к тем соединениям, материалам, композициям и/или дозированным формам, которые с медицинской точки зрения пригодны для применения, предусматривающего контакт с тканями людей или животных, причем без выраженной токсичности, раздражения, аллергической реакции или других осложнений, соизмеряя пользу/допустимый риск.
Настоящее изобретение также направлено на такие фармацевтические композиции для лечения или профилактики рака. Настоящее изобретение также направлено на способ лечения или профилактики рака, заключающийся во введении терапевтически эффективного количества фармацевтической композиции настоящего изобретения.
Предпочтительно рак выбран из группы, состоящей из рака груди, рака мочевого пузыря, рака головы и шеи, рака кожи, рака поджелудочной железы, рака легких, рака яичника, рака толстой кишки, рака простаты, рака почки и рака мозга.
Настоящее изобретение также относится к таким фармацевтическим композициям для лечения или профилактики предракового состояния или повреждения. Настоящее изобретение также связано со способом лечения или профилактики предракового состояния или повреждения, заключающегося во введении терапевтически эффективного количества фармацевтической композиции настоящего изобретения.
Предпочтительно предраковое состояния или повреждение выбрано из группы, состоящей из оральной лейкоплакии, актинического кератоза (старческих бородавок), предраковых полипов толстой кишки или прямой кишки, эпителиальной дисплазии желудка, аденоматозной дисплазии, синдрома наследственного неполипозного рака толстой кишки, язвы пищевода Бэррета, дисплазии мочевого пузыря и предраковых цервикальных состояний.
Настоящее изобретение также связано со способами получения и применения систем клеток-хозяев для наработки гликоформ модифицированных АСМ настоящего изобретения, обладающих повышенным Fc-рецептор связывающим сродством, предпочтительно повышенным связыванием с Fc-активирующими рецепторами, и/или обладающих повышенными эффекторными функциями, включая антитело-зависимую клеточную цитотоксичность. Методология гликоинжениринга, применимого для модифицированных АСМ настоящего изобретения, подробно описана в патенте US 6602684, временной патентной заявке US 60/441307 и в WO 2004/065540, содержание которых включено в настоящее изобретение в виде ссылок. Модифицированные АСМ настоящего изобретения в другом варианте его осуществления могут быть подвергнуты гликоинженирингу для уменьшения содержания фукозных остатков в области Fc, выполненному методами, описанными в патенте ЕР 1 176 195 Al, содержание которого включено в настоящее изобретение в виде ссылки.
Получение клеточных линий для выработки модифицированных АСМ с измененным гликозилированием
Настоящее изобретение предусматривает системы экспрессии в клетках-хозяевах для выработки модифицированных АСМ настоящего изобретения, обладающих измененным гликозилированием. В частности, настоящее изобретение предусматривает систему клеток-хозяев для выработки гликоформ модифицированных АСМ настоящего изобретения, обладающих улучшенными терапевтическими свойствами. Таким образом, настоящее изобретение предусматривает систему экспрессии клеток-хозяев, отобранных или сконструированных для экспрессии полипептида, обладающего активностью GnTIII. В одном из вариантов осуществления настоящего изобретения полипептид, обладающий активностью GnTIII, является гибридный полипептид, включающий домен локализации Гольджи гетерологического резидентного полипептида Гольджи. Конкретно такие системы экспрессии в клетках-хозяевах могут быть сконструированы для включения молекулы рекомбинантной нуклеиновой кислоты, кодирующей полипептид, несущий GnTIII, оперативно связанный с конститутивной или регулируемой промоторной системой.
В одном из конкретных вариантов осуществления в настоящем изобретении предусмотрены клетки-хозяева, которые были сконструированы для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей гибридный полипептид, обладающий активностью GnTIII и включающий домен легализации Гольджи гетерологического резидентного полипептида Гольджи. В одном из вариантов осуществления настоящего изобретения в клетки-хозяева внедряют молекулу нуклеиновой кислоты, включающую по меньшей мере один ген, кодирующий гибридный полипептид, обладающий активностью GnTIII и включающий домен локализации Гольджи гетерологичного резидентного полипептида Гольджи.
Обычно какой-либо тип культивируемых линий клеток, в том числе описанных выше линий, может быть применен в качестве основы для инжениринга линий клеток-хозяев настоящего изобретения. В предпочтительном варианте осуществления настоящего изобретения клетки СНО, BHK, NS0, SP2/0, клетки миеломы YO, клетки миеломы мыши Р3Х63, клетки PER, PER.C6 или клетки гибридомы, другие клетки млекопитающих, дрожжевые клетки, клетки насекомых или клетки растений используют в качестве основы для создания сконструированных клеток-хозяев настоящего изобретения.
Настоящее изобретение также включает какие-либо сконструированные клетки-хозяева, экспрессирующие полипептид с активностью GnTIII, в том числе гибридный полипептид, включающий домен локализации Гольджи в гетерологичном резидентном полипептиде Гольджи согласно описанному выше.
Одна или несколько нуклеиновых кислот, кодирующих полипептид, обладающий активностью GnTIII, могут быть экспрессированы под контролем конститутивного промотора или, в другом варианте, регулируемой системой экспрессии. Такие системы хорошо известны в данной области, и к ним относятся описанные выше системы. Если несколько разных нуклеиновых кислот, которые кодируют гибридные полипептиды, обладающие активностью GnTIII и включающие домен локализации Гольджи гетерологического резидентного полипептида Гольджи, включены в систему клетки-хозяина, некоторые из них могут быть экспрессированы под контролем конститутивного промотора, а другие экспрессируются под контролем регулируемого промотора. Уровни экспрессии гибридных полипептидов, обладающих активностью GnTIII, определяют способами, обычно знакомыми специалистам в данной области, например, вестерн-блоттингом, нозерн-блоттингом, анализом экспрессии репортерного гена или измерением активности GnTIII. В другом варианте может быть использован лектин, который связывается с продуктами биосинтеза GnTIII, например, лектин Е4-РНА. Кроме того, может быть проведено функциональное исследование, позволяющее измерить повышенное связывание Fc-рецептора или повышенную эффекторную функцию, которые опосредованы антителами, вырабатываемыми клетками, сконструированными с нуклеиновой кислотой, кодирующей полипептид с активностью GnTIII.
Идентификация трансфектантов или трансформантов, которые экспрессируют белок, обладающий модифицированной формой гликозилирования
Клетки-хозяева, которые содержат кодирующую последовательность модифицированной АСМ настоящего изобретения и экспрессируют биологически активные генные продукты, могут быть идентифицированы с помощью по меньшей мере четырех основных подходов: (а) гибридизации ДНК-ДНК, (б) выяснения наличия или отсутствия функций «маркерного» гена, (в) оценки уровня транскрипции, измеряемого по экспрессии соответствующих транскриптов иРНК в клетке-хозяине и (г) выявления генного продукта, количество которого определяют иммуноанализом или по его биологической активности.
При первом подходе наличие кодирующей последовательности модифицированной АСМ настоящего изобретения и кодирующей последовательности полипептида, обладающего активностью GnTIII, может быть выявлено гибридизацией ДНК-ДНК или ДНК-РНК с применением зондов, включающих нуклеотидные последовательности, гомологичные соответствующим кодирующим последовательностям, или их части, или их производные.
При втором подходе рекомбинантный экспрессирующий вектор/система-хозяин могут быть идентифицированы и выбраны по наличию или отсутствию определенных функций «маркерного» гена (например, активности тимидинкиназы, устойчивости к антибиотикам, устойчивости к метатрексату, трансформационного фенотипа, формирования окклюзионных телец у бакуловирусов и т.д.). Например, если кодирующая последовательность модифицированной АСМ настоящего изобретения или ее фрагмент, и кодирующая последовательность полипептида, обладающего активностью GnTIII, инсертированы в последовательность маркерного гена вектора, рекомбинанты, содержащие соответствующие кодирующие последовательности, могут быть идентифицированы по отсутствию маркерной генной функции. В другом варианте маркерный ген может быть помещен в тандеме с кодирующими последовательностями под контролем того же, или другого промотора, применяемого для контроля экспрессии кодирующих последовательностей. Экспрессия маркера в ответ на индукцию или селекцию свидетельствует об экспрессии кодирующей последовательности модифицированной АСМ настоящего изобретения и кодирующей последовательности полипептида, обладающего активностью GnTIII.
При третьем подходе транскрипционная активность кодирующей области модифицированной АСМ настоящего изобретения или ее фрагмента и кодирующая последовательность полипептида, обладающего активностью GnTIII, может быть определена путем гибридизации. Например, РНК может быть выделена и проанализирована нозерн-блоттингом, используя зондовый гомолог кодирующих последовательностей модифицированной АСМ настоящего изобретения или ее фрагмента, и кодирующую последовательность полипептида, обладающего активностью GnTIII, или определенные ее части. В другом варианте сумма нуклеиновых кислот клетки-хозяина может быть проэкстрагирована и исследована для гибридизации такими зондами.
При четвертом подходе экспрессия белковых продуктов может быть оценена иммунологически, например, вестерн-блоттингом, иммуноанализами, например, радиоиммунопреципитацией, ферментсвязанными иммуноисследованиями и т.д. Эффективный анализ для определения успеха осуществления системы экспрессии, однако, включает выявление биологически активных генных продуктов.
Получение и применение модифицированных антигенсвязывающих молекул (АСМ), обладающих повышенной эффекторной функцией, включая антителозависимую клеточную цитотоксичность
В предпочтительным вариантах осуществления настоящего изобретения предусмотрены гликоформы химерных модифицированных АСМ, обладающих практически такой же специфичностью связывания антитела В-Ly1 грызунов и обладающих повышенной эффекторной функцией, включая антитело-зависимую клеточную цитотоксичность. Конструирование гликозилирования антител было описано ранее. См., например, патент US 6602684, сущность которого включена в настоящее изобретение в виде ссылки.
Клинические исследования применения неконъюгированных моноклональных антител (мАт) для лечения некоторых типов рака ранее дали обнадеживающие результаты. Dillman, Cancer Biother. & Radiopharm. 12, 1997, cc.223-225, Deo и др., Immunology Today 18, 1997, с.127. Подтверждено, что химерный неконъюгированный IgGI может быть применим для лечения слабо выраженной или фолликулярной В-клеточной неходжкинской лимфомы. Dillman, Cancer Biother. & Radiopharm. 12, 1997, cc.223-225, а другое неконъюгированное мАт, гуманизированный IgG1 против солидных опухолей груди, также показало обнадеживающие результаты на третьей фазе клинических исследований. Deo и др., Immunology Today 18, 1997, с.127. Антигены этих двух мАТ экспрессируются на высоком уровне в соответствующих опухолевых клетках и антитела опосредуют интенсивное разрушение опухоли эффекторными клетками in vitro и in vivo. Напротив, многие неконъюгированные мАт со строгой специфичностью в отношении опухоли не могут индуцировать эффекторные функции с интенсивностью, достаточной для клинического применения. Frost и др., Cancer 80, 1997, cc.317-333, Surfus и др., J. Immunother. 19, 1996, cc.184-191. В настоящее время исследуется вспомогательная терапия цитокином для некоторых из таких ослабленных мАт. Добавление цитокинов может стимулировать антителозависимую клеточную цитотоксичность (ADCC) повышением активности и количества циркулирующих лимфоцитов. Frost и др., Cancer 80, 1997, cc.317-333, Surfus и др., J. Immunother. 19, 1996, cc.184-191. ADCC, литическая атака на клетки-мишени антител, индуцируется связыванием рецепторов лейкоцитов с константной областью (Fc) антител. Deo и др., Immunology Today 18, 1997, с.127.
Различный, но комплементарный подход к повышению активности ADCC неконъюгированных IgG1 заключается в конструировании области Fc антитела. Исследования в области белковой инженерии установили, что FcγR взаимодействуют с нижней шарнирной областью домена СН2 в IgG. Lund и др., J. Immunol. 157, 1996, cc.4963-4969. Однако FcγR связывание также требует присутствия олигосахаридов, ковалентно связанных с консервативным аминокислотным остатком Asn 297 в области СН2. Lund и др., J. Immunol. 157, 1996, cc.4963-4969, Wright и Morrison, Trends Biotech. 15, 1997, cc.26-31 подтвердили, что или олигосахарид и полипептид оба непосредственно участвуют во взаимодействии с сайтом, или что олигосахарид необходим для поддержания активной конформации СН2 полипептида. Модификация структуры олигосахарида, следовательно, может производиться в качестве средства для повышения сродства этого взаимодействия.
Молекула IgG несет два N-связанных олигосахарида в области Fc, по одному на каждую тяжелую цепь. Подобно любому гликопротеину, антитело вырабатывается в виде популяции гликоформ, которые имеют общий полипептидный каркас молекулы, но с разными олигосахаридами, присоединенными к сайтам гликозилирования. Обычно олигосахариды, обнаруживаемые в области Fc сывороточного IgG, являются комплексным of complex bi-antennary type (Wormald и др., Biochemistry 36, 1997, cc.130-138) с низким уровнем концевой сиаловой кислоты и разветвленным N-ацетилглюкозамином (GlcNAc), и вариабельной степенью концевого галактозилирования и коревого фукозилирования. В ряде исследований подтверждено, что минимальная углеводная структура, необходимая для FcγR связывания, лежит в олигосахаридном ядре. Lund и др., J. Immunol. 157, 1996, cc.4963-4969.
Линии клеток, полученные от мышей и хомяков, используют в промышленности и науке для получения неконъюгированного мАт терапевтического назначения, обычно присоединяют требуемые олигосахаридные детерминанты к сайтам Fc. Формы IgG, экспрессируемые в этих клеточных линиях, однако, утратили разветвленный N-ацетил-D-глюкозамин (GlcNAc), обнаруженный в низких количествах в сывороточных иммуноглобулинах. Lifely и др., Glycobiology 318, 1995, cc.813-8. Напротив, ранее было установлено, что клетки миеломы крысы вырабатывают гуманизированный IgG1 (CAMPATH-1H), несущий разветвленный GlcNAc в некоторых его гликоформах. Lifely и др., Glycobiology 318, 1995, cc.813-822.
Антитела, образуемые клетками крысы, достигают сходной максимальной активности ADCC in vitro, подобно антителам САМРАТН-1Н, образуемым стандартными клеточными линиями, но при значительно меньших концентрациях антитела.
Антиген САМРАТН в норме присутствует в большом количестве на клетках лимфомы и его химерное мАт обладает высокой активностью ADCC при отсутствии разветвленного GlcNAc. Lifely и др., Glycobiology 318, 1995, cc.813-822. На метаболическом пути, связанном с N-связанным гликозилированием, разветвленный GlcNAc добавляют с помощью GnTIII. Schachter, Biochem. Cell Biol. 64, 1986, cc.163-181.
В предыдущих исследованиях использовали линию клеток СНО, вырабатывающих одно антитело, которое ранее было сконструировано для экспрессии, при регуляции извне, различных уровней фермента клонированного гена GnTIII (Umana, Р., и др.. Nature Biotechnol. 17, 1999, cc.176-180). Такой подход впервые установил строгую корреляцию между экспрессией GnTIII и активностью ADCC модифицированного антитела. Таким образом, настоящее изобретение предусматривает рекомбинантное химерное антитело или его фрагмент со связывающей специфичностью антитела В-Ly1 грызунов с измененным гликозилированием, приводящим к повышенной активности GnTIII. Повышенная активность GnTIII приводит к увеличению процентного содержания разветвленных олигосахаридов, а также к снижению процента фукозных остатков в области Fc модифицированного АСМ. Такое антитело или его фрагмент имеет повышенное Fc-рецептор связывающее сродство и повышенную эффекторную функцию. Кроме того, настоящее изобретение связано с фрагментом антитела и гибридными белками, содержащими область, которая эквивалентна области Fc иммуноглобулинов.
Медицинское применение модифицированных АСМ согласно способам настоящего изобретения
В самом широком значении модифицированные АСМ настоящего изобретения могут быть применены для клеток-мишеней in vivo или in vitro, которые экспрессируют антиген-мишень, в частности, где указанный антиген-мишень экспрессируется на поверхности клетки. Клетки, экспрессирующие антиген-мишень, могут быть применены для диагностических или терапевтических целей. В одном из вариантов осуществления настоящего изобретения модифицированные АСМ настоящего изобретения могут применяться для изменения клеточной сигнальной активности в клетках, экспрессирующих антиген-мишень. В другом варианте осуществления настоящего изобретения модифицированные АСМ настоящего изобретения могут применяться для изменения перекрестного сшивания и/или олигомеризации одного или нескольких антигенов-мишеней. Антигенами-мишенями для модифицированных АСМ настоящего изобретения могут быть клеточные поверхностные рецепторы, включая, но не ограничиваясь ими, рецепторы CD20, CD21, CD22, CD19, CD47, CD99, CD2, CD45, Her1 (EGFR), рецепторы Her2/neu, Her3, Her4, TRAIL (например, TRAILR1, TRAILR2), TNFR, FGF (например, FGFR1), рецепторы IGF, рецепторы PDGF, рецепторы VEGF и другие ассоциированные с клеточной поверхностью рецепторы. В одном из конкретных вариантов осуществления настоящего изобретения антигеном-мишенью является антиген CD20. Модифицированные АСМ настоящего изобретения также прерывают клеточный цикл, вызывают апоптоз клеток-мишеней (например, опухолевых клеток), ингибируют ангиогенез и/или вызывают дифференциацию клеток-мишеней.
Согласно другому объекту настоящего изобретения оно связано со способом лечения заболевания, которое поддается лечению с помощью измененной клеточной сигнальной активности антигена-мишени и/или измененной способности опосредовать перекрестное сшивание одного или нескольких антигенов-мишеней, включающим введение терапевтически эффективного количества модифицированной АСМ настоящего изобретения субъекту, который в этом нуждается. В одном из вариантов осуществления настоящего изобретения модифицированной АСМ является антитело. В одном из конкретных вариантов осуществления настоящего изобретения антитело является гуманизированным. Примерами заболеваний, для лечения которых могут вводиться АСМ, являются, но ими перечень не ограничивается, заболевания или расстройства с пролиферацией клеток, аутоиммунные заболевания или расстройства, а также заболевания или расстройства, связанные с бактериальными или вирусными инфекциями.
В одном из вариантов осуществления настоящего изобретения заболевание или расстройство связано с пролиферацией клеток. Примерами пролиферативных заболеваний, которые можно лечить с помощью АСМ настоящего изобретения, являются, но ими не ограничиваются, неоплазмы, рак, злокачественные заболевания и/или опухоли, локализованные в животе, костях, груди, пищеварительной системе, печени, поджелудочной железе, брюшине, эндокринных железах (надпочечниках, паращитовидных железах, гипофизе, семенниках, яичниках, тимусе, щитовидной железе), глазах, голове и шее, нервной системе (центральной и периферической), лимфатической системе, в области таза, в коже, мягких тканях, селезенке, грудной части трахеи и мочеполовой системе. Отдельные неоплазмы, формы рака, злокачественные заболевания и/или опухоли, которые можно лечить с помощью АСМ настоящего изобретения, включают, но ими не ограничиваются, эпидермальную и плоскоклеточную карциному, глиому, рак поджелудочной железы, рак яичника, рак простаты, рак груди, рак легких, рак мозга, злокачественную меланому, лейкоз, лимфому, Т-клеточную лимфому, множественную миелому, рак желудка, рак шейки матки, карциному эндометрия, рак пищевода, рак печени, рак кожи, карциному мочевыводящих путей, хориокарциному, рак глотки, рак гортани, гиперплазию стромы яичника, андробластому, гиперплазию эндометрия, эмбриому, фибросаркому, гемангиому, кавернозную гемангиому, ангиобластому, ретинобластому, астроцитому, нейрофиброму, олигодендроглиому, медуллобластому, ганглионевробластому, глиому, рабдомиосаркому, гамартобластому, остеобластосаркому, лейомиосаркома, саркому щитовидной железы, саркому Юинги и опухоль Вильмса.
Сходным образом другие пролиферативные заболевания также можно лечить модифицированными АСМ настоящего заболевания. Примерами таких пролиферативных заболеваний являются, но ими не ограничиваются, гипергаммаглобулинемия, лимфопролиферативные расстройства, парапротеинемия, пурпура, саркоидоз, синдром Сезари, макроглобулинемическая пурпура Вальденстрема, болезнь Гоше, гистиоцитоз и какие-либо другие пролиферативные заболевания помимо неоплазий, локализованные в системах органах, перечисленных выше.
Примерами аутоиммунных заболеваний или расстройств являются, но ими не ограничиваются, иммуноопосредованные тромбицитопении, например, острая идиопатическая тромбоцитопеническая пурпура и хроническая идиопатическая тромбоцитопеническая пурпура, дерматомиозит, хорея Сиденгама, волчаночный нефрит, ревматическая атака, плюригландулярные синдромы, пурпура Геноха-Шенлейна, пост-стрептококковый нефрит, узловатая эритема, артериит Такаясу, болезнь Аддисона, экссудативная многоформная эритема, узелковый периартериит, анкилозирующий спондилит, синдром Гудпасчера, облитерирующий тромбангиит, билиарный первичный цирроз печени, тиреоидит Хасимото, базедова болезнь, хронический активный гепатит, полимиозит/дерматомиозит, полихондрия, пузырчатка вульгарная (pemphigus vulgaris), гранулематоз Вегенера, мембранная нефропатия, амиотрофический латеральный склероз, спинномозговой табес, полимиалгия, пернициозная анемия, быстро прогрессирующий гломерулонефрит и фиброзирующий альвеолит, воспалительные реакции, например, воспалительные кожные заболевания, включая псориаз и дерматиты (например, атопический дерматит), системная склеродерма и склероз, ответные реакции, ассоциированные с воспалением кишечника (например, болезнь Крона и язвенный колит), синдром дыхательной недостаточности (включая синдром дыхательной недостаточности взрослых - СДНВ), дерматит, менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические состояния, например, экзема и астма, и другие состояния, включая инфильтрацию Т-клеток и хронические воспалительные реакции, атеросклероз, недостаточность адгезии лейкоцитов, ревматоидный артрит, системная красная волчанка (СКВ), сахарный диабет (например, сахарный диабет первого типа или инсулино-завивимый сахарный диабет), множественный склероз, феномен Рейно, аутоиммунный тиреоидит, аллергический энцефаломиелит, синдром Шегрена, ювенильный диабет, иммунные ответы, ассоциированные с острой и замедленной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, обычно проявляемые при туберкулезе, саркоидозе, полимиозите, грануломатозе и васкулите, пернициозная анемия (болезнь Аддисона), заболевания, включающие лейкоцитозный диапедез, воспалительное заболевание центральной нервной системы (ЦНС), синдром множественного поражения органов, гемолитическая анемия (включая, но не ограничиваясь ею, криоглобулинемию или позитивную анемию Кумбса), бульбоспинальный паралич, заболевания, опосредованные комплексом антиген-антитело, болезнь анти-клубочковой базальной мембраны, антифосфолипидный синдром, аллергический неврит, болезнь Грейвса, миастенический синдром Лэмберта-Итона, буллезный пемфигоид, пемфигус, аутоиммунные полиэндокринопатии, болезнь Рейтера, синдром негнущегося человека, синдром Бечета, артериит гигантоцитов, иммунокомплексный нефрит, IgA нефропатия, IgM полинейропатия, иммунная тромбоцитопеническая пурпура (ИТП) или аутоиммунная тромбоцитопения и т.д.
Модифицированные АСМ настоящего изобретения могут применяться по отдельности или в комбинации с другими способами лечения или с другими терапевтическими объектами для лечения расстройств, которые поддаются лечению за счет повышения или понижения клеточной сигнальной активности и/или перекрестного сшивания одного или нескольких антигенов-мишеней. В одном из вариантов осуществления настоящего изобретения АСМ настоящего изобретения обычно применяются отдельно для нацеливания на раковые клетки и их уничтожения in vivo. Модифицированные АСМ также могут использоваться в сочетании с соответствующим терапевтическим агентом для лечения карциномы человека. Например, модифицированные АСМ могут применяться в комбинации со стандартными или обычными способами лечения, например, химиотерапией, радиотерапией, или могут быть конъюгированы или связаны с терапевтическим лекарственным средством или токсином, а также с лимфокином или опухоль-ингибирующим фактором роста, для высвобождения агента в области карциномы. В других вариантах осуществления настоящего изобретения конъюгаты модифицированных АСМ настоящего изобретения (1) иммунотоксины (конъюгаты модифицированных АСМ и цитотоксической части молекулы) и (2) меченые (например, с радиометкой, связанные с ферментом или связанные с флуорохромом) модифицированные АСМ, в которых метка является средством идентификации иммунных комплексов, в составе которых содержится меченая АСМ. Модифицированные АСМ также могут применяться для индукции лизиса по природному пути комплемента и взаимодействуют с присутствующими в норме антителозависимыми цитотоксическими клетками.
Цитотоксическая часть молекулы иммунотоксина может быть цитотоксическим лекарственным средством, или ферментативно активным токсином бактериального или растительного происхождения, или ферментативно активным фрагментом («А цепью») такого токсина. Ферментативно активными токсинами и их фрагментами являются цепь А дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из бактерии Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модексина, альфа-сарцин, белки Aleurites fordii, белок диантин, белки фитолаккси американской (Phytolacca americana) (PAPI, PAPII и PAP-S), ингибитор дыни горькой (Momordica charantia), курцин, кротин, ингибитор мыльнянки лекарственной (Sapaonaria officinalis), гелонин, митогеллин, рестриктоцин, феномицин и эномицин. В другом варианте осуществления настоящего изобретения модифицированные АСМ конъюгированы с низкомолекулярными противоопухолевыми средствами. Конъюгаты модифицированных АСМ и такие цитотоксичные части молекул получают, используя различные бифункциональные белок-связывающие агенты. Примерами таких реагентов являются SPDP, IT, бифункциональные производные имидоэфиров, например, диметиладипимидата HCl, активные сложные эфиры, например, дисуксинимидил суберат, альдегиды, например, глутаральдегид, бис-азидо соединения, например, бис (р-азидобензоил)гексанедиамин, производные бис-диазония, например, бис-(р-диазонийбензоил)-этилендиамин, диизоцианаты, например, толилен-2,6-диизоцианат и соединения бис-активного фтора, например, 1,5-дифтор-2,4-динитробензол. Лизирующаяся часть токсина может быть соединена с фрагментом Fab модифицированных АСМ. Дополнительные токсины, которые также могут быть применимы, известны в данной области, что было установлено, например, в опубликованной патентной заявке US 2002/0128448, сущность которой приводится в настоящем изобретении в виде ссылки.
В одном из вариантов осуществления настоящего изобретения антигенсвязывающая молекула настоящего изобретения конъюгирована с дополнительной частью молекулы, например, радиометкой или токсином. Такие конъюгированные модифицированные АСМ могут быть получены разными методами, известными специалистам в данной области.
Различные радионуклиды могут быть применимы в настоящем изобретении, и специалисты в данной области могут определить, какой радионуклид наиболее подходит, учитывая конкретные различные обстоятельства. Например, радионуклид 131I используется для направленной иммунотерапии. Однако клиническое применение 131I может быть ограничено несколькими факторами, включая: период полувыведения длительностью 8 суток, дегалогенирование иодированного антитела и в крови, и в области опухоли, свойствами (например, большим гамма-компонентом), которые могут быть условно оптимальными для отложения в опухоли локализованной дозы. При поступлении высших хелатирующих агентов возможность присоединения металлических хелатирующих групп к белкам повышает возможность утилизировать другие радионуклиды, например, 111In и 90Y. Радионуклид 90Y предоставляет некоторые полезные свойства для применения в радиоиммунотерапии: период полураспада 90Y составляет 64 ч, что достаточно много для накопления в опухоли, и, напротив, в отличие, например, от 131I, радионуклид 90Y является источником излучения только бета-частиц высокой энергии без сопутствующего гамма-излучения при его распаде, с зоной облучения диаметром 100-1000 клеток. Кроме того, минимальное количество проникающей радиации можно вводить амбулаторным больным в виде антител, меченых 90Y. Кроме того, не требуется интернализации меченого антитела для уничтожения клеток, и локальная эмиссия ионизирующей радиации может быть летальной для примыкающих опухолевых клеток, теряющих антиген-мишень.
Эффективные дозы для однократного лечения (т.е. терапевтически эффективные количества) меченых радиоизотопом 90Y модифицированных АСМ настоящего изобретения находятся в диапазоне примерно от 5 и примерно до 75 мКюри, более предпочтительно примерно от 10 до примерно 40 мКюри. Эффективные дозы для однократного лечения не отторгающих костный мозг меченых 131I АСМ настоящего изобретения варьируют примерно от 5 до примерно 70 мКюри, более предпочтительно примерно от 5 до примерно 40 мКюри. Эффективные для однократного лечения и не вызывающие отторжения (т.е. не требующие аутологической пересадки костного мозга) дозы антител настоящего изобретения, меченых 131I, варьируют примерно от 30 до примерно 600 мКюри, более предпочтительно примерно от 50 и примерно до 500 мКюри. При конъюгировании с химерным антителом по настоящему изобретению вследствие более длительного срока полувыведения по сравнению с антителами грызунов эффективные дозы для однократного лечения не отторгающих костный мозг меченых 131I химерных антител настоящего изобретения варьируют примерно от 5 до примерно 40 мКюри, более предпочтительно составляют примерно менее 30 мКюри. Критерии для визуализации, например, метки 111In, обычно менее примерно 5 мКюри.
В настоящем изобретении терапия с применением меченых радионуклидами антител может быть в виде однократного лечения или многократного. Из-за радионуклидного компонента предпочтительно, чтобы перед лечением были «собраны» периферические стволовые клетки или клетки костного мозга у пациентов, которые могут быть подвержены фатальной для костного мозга токсичности, вызванной радиацией. Клетки костного мозга и/или периферические стволовые клетки собирают стандартными методами, затем очищают и замораживают для возможной реинфузии. Кроме того, наиболее предпочтительно, чтобы перед лечением пациента было произведено его диагностическое дозиметрическое исследование с помощью диагностических меченых антител (например, используя 111In), цель которого установить, что меченое антитело терапевтического назначения (например, с радионуклидом 90Y) не «сконцентрируется» неожиданно в каких-либо здоровых органах или тканях.
В одном из вариантов осуществления настоящего изобретения химерное модифицированное методом гликоинженерии АСМ настоящего изобретения конъюгировано с цепью рицина А. Наиболее выгодно цепь А рицина дегликозилируют и получают методами рекомбинации. Ценный способ получения иммунотоксина рицина описан в публикации Vitetta и др., Science 238, 1987, с.1098, включенной в настоящее изобретение в виде ссылки.
Если необходимо уничтожить раковые клетки человека in vitro для диагностических целей, конъюгаты обычно могут быть добавлены в среду для культуры клеток в концентрации, равной по меньшей мере примерно 10 нМ. Состав и способ введения при анализе in vitro не столь важны. Обычно используют водные составы, которые совместимы с культуральной или перфузионной средой. Цитотоксичность может быть определена обычными методами для обнаружения рака или степени его развития.
Выше обсуждалось, что цитотоксическое радиофармацевтическое средство для лечения рака может быть получено конъюгацией радиоактивного изотопа (например, I, Y, Pr) с химирным, подвергнутым гликоинженерии и/или модифицированным АСМ настоящего изобретения. Понятие «цитотоксическая часть молекулы» в контексте настоящего изобретения включает такие изотопы.
В другом варианте осуществления настоящего изобретения липосомы наполнены цитотоксическим лекарственным средством и покрыты АСМ настоящего изобретения. Поскольку многие молекулы-мишени для идентифицированных АСМ настоящего изобретения экспрессируются на поверхности клеток (например, большое количество молекул антигена CD20 на поверхности злокачественных В-клеток), настоящий способ позволяет высвобождать большие количества лекарственного средства для коррекции типа клеток.
Методики конъюгирования таких терапевтических агентов с антителами хорошо известны (см., например, Arnon и др. в кн.: «Monoclonal Antibodies and Cancer Therapy», под ред. Reisfeld и др., 1985, изд-во Alan R. Liss, Inc., cc.243-256, Hellstrom и др. в кн.: «Controlled Drug Delivery», 1987, 2-е изд., под ред. Robinson и др., изд-во Marcel Dekker, Inc., cc. 623-653, Thorpe в кн.: «Monoclonal Antibodies '84: Biological And Clinical Applications», 1985, под ред. Pinchera и др., cc.475-506, Thorpe и др., Immunol. Rev., 62, 1982, cc.119-158 (каждая из публикаций включена в настоящее изобретение в виде ссылки).
Также имеются другие терапевтические применения АСМ настоящего изобретения, в том числе конъюгация или связь, например, методами рекомбинации ДНК, с ферментом, способным конвертировать пролекарство в цитотоксическое лекарственное средство, и применение этого конъюгата антитела с ферментом в комбинации с пролекарством для конвенции пролекарства в цитотоксический агент у сайта опухоли (см., например, Senter и др., Proc. Natl. Acad. Sci. USA 85, 1988, cc.4842-4846 и Cancer Research 49, 1989, cc.5789-5792, Senter, FASEB J. 4, 1990, cc.188-193).
Еще одно применение АСМ настоящего изобретения заключается в использовании или неконъюгированного антитела (в присутствии комплемента), или части конъюгата антитела с лекарственным средством, или антитела с токсином, для удаления опухолевых клеток из костного мозга пациентов с раком. С помощью такого подхода аутологический костный мозг может быть очищен ex vivo с помощью обработки антителом, после чего костный мозг возвращают в организм пациента инфузией (см., например, Ramsay и др., J. Clin. Immunol., 8, 1988, cc.81-88).
Кроме того, настоящее изобретение предусматривает одноцепочечный иммунотоксин, включающий антиген связывающие домены, что обеспечивает практически ту же специфичность связывания, что и исходное антитело (например, полипептиды, включающие CDR исходного антитела), а также включает полипептидный токсин. Одноцепочечные иммунотоксины настоящего изобретения могут быть использованы для лечения карциномы in vivo.
Сходным образом гибридный белок, включающий по меньшей мере одну антигенсвязывающую область АСМ настоящего изобретения, соединено меньшей мере с функционально активной частью второго белка, обладающего противоопухолевой активностью, например, лимфокина или онкостатина, и может быть применен для лечения карциномы человека in vivo.
Настоящее изобретение предусматривает способ избирательного уничтожения опухолевых клеток, экспрессирующих клеточные поверхностные рецепторы, включая, но не ограничиваясь ими, рецепторы CD20, Her1 (EGFR), Her2/neu, Her3, Her4, TRAIL (например, TRAILR1, TRAILR2), TNFR, FGF (например, FGFR1), IGF, PDGF, VEGF и другие рецепторы, связанные с поверхностью клетки. Это способ представляет реагирование модифицированной АСМ настоящего изобретения (конъюгированной, например, иммунотоксина, или неконъюгированной) с указанными опухолевыми клетками. Эти опухолевые клетки могут быть получены из карциномы человека.
Кроме того, настоящее изобретение предусматривает способ лечения карциномы (например, карциномы человека) in vivo. Этот способ представляет введение субъекту фармацевтически эффективного количества композиции, содержащей по меньшей мере одну из модифицированных АСМ настоящего изобретения (конъюгированных, например, иммунотоксин, или неконъюгированных).
В еще одном варианте осуществления настоящее изобретение связано с улучшенным способом лечения В-клеточных пролиферативных заболеваний, в том числе В-клеточной лимфомы, а также аутоиммунного заболевания, вызванного полностью или частично патогенными антителами, основанным на истощении В-клеток и включающим введение терапевтически эффективного количества АСМ настоящего изобретения человеку, нуждающемуся в таком лечении. В предпочтительном варианте осуществления настоящего изобретения АСМ получено методом гликоинжениринга анти-CD20 антитела со связывающей специфичностью, практически такой же, что и у В-Ly1 антитела грызуна. В другом предпочтительном варианте осуществления настоящего изобретения антитело является гуманизированным. В таком варианте осуществления настоящего изобретения АСМ настоящего изобретения используют для уменьшения нормальных В-клеток в крови на длительный период.
В соответствии с практикой применения настоящего изобретения субъектом может быть человек, лошадь, свинья, корова, представители семейств грызунов, собачьих, кошачьих, а также птицы. Другие теплокровные животные также могут быть включены в настоящее изобретение.
Объект настоящего изобретения также предусматривает способы подавления роста раковых клеток, лечения рака у субъекта и лечение заболевания пролиферативного типа у субъекта. Способы включают введение субъекту эффективного количества композиции настоящего изобретения.
В одном из вариантов осуществления настоящее изобретение относится к АСМ по настоящему изобретению для применения для лечения или профилактики рака, предракового состояния или повреждения или аутоиммунного расстройства. В еще одном варианте осуществления настоящее изобретение относится к АСМ настоящего изобретения для применения в качества лекарственного средства для лечения или профилактики рака, предракового состояния или повреждения, или аутоиммунного заболевания. Раковым заболеванием может быть, например, В-клеточная лимфома, рак легких, немелкоклеточный рак легких, бронхо-альвеолярный рак легких, рак костей, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак груди, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидки, рак паращитовидных желез, рак надпочечников, саркома мягких тканей, рак уретры, рак пениса, рак простаты, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечных лоханок, мезотелиома, гепато-клеточный рак, рак желчного пузыря, хронический или острый лейкоз, лимфоцитарная лимфома, неоплазмы центральной нервной системы (ЦНС), опухоли позвоночника, глиома ствола головного мозга, мультиформная глиобластома, астроцитома, шваннома, эпендимома, медуллобластома, менингиома, плоскоклеточная карцинома, аденома гипофиза, включая невосприимчивые версии какого-либо из указанных форм рака или комбинацию одного или нескольких из указанных выше форм рака. Предраковые состояния или повреждения включают, например, лейкоплакию ротовой полости, актинический кератоз (старческие бородавки), предраковые полипы толстой или прямой кишки, желудочную эпителиальную дисплазию, аденоматозную дисплазию, синдром наследственного неполипозного рака толстой кишки, язву пищевода Баррета, дисплазию мочевого пузыря и предраковые цервикальные состояния.
Предпочтительно рак выбран из группы, включающей В-клеточную лимфому, рак груди, рак мочевого пузыря, рак головы и шеи, рак кожи, рак поджелудочной железы, рак легких, рак яичника, рак толстой кишки, рак простаты, рак почек и рак мозга. Примеры аутоиммунных заболеваний приведены выше.
В еще одном варианте осуществления настоящего изобретения описано применение АСМ согласно настоящему изобретению для получения лекарственного средства для лечения или профилактики предракового состояния или повреждения. Раковые заболевания и предраковые состояния описаны выше.
Таким образом, настоящее изобретение предусматривает фармацевтические композиции, комбинации, применения и способы лечения карцином человека. Например, настоящее изобретение предусматривает фармацевтические композиции для применения для лечения карцином человека, включая фармацевтически эффективное количество антитела настоящего изобретения и фармацевтически приемлемого носителя.
Композиции АСМ настоящего изобретения могут вводиться, используя обычные способы введения, включая, но не ограничиваясь ими: внутривенное, внутрибрюшинное, пероральное, внутрилимфатическое или непосредственно в опухоль. Внутривенное введение является предпочтительным.
В одном из вариантов осуществления настоящего изобретения терапевтические составы, включающие АСМ настоящего изобретения, приготавливают для хранения путем смешивания антитела, обладающего желаемой степенью чистоты, необязательно с фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (см. кн.: «Remington's Pharmaceutical Sciences», 1980, 16-е изд., под ред Osol А.) в форме лиофильно высушенных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях, и к ним относятся буферы, например, фосфатные, цитратные и с применением других органических кислот, антиоксиданты, включая аскорбиновую кислоту и метионин, консерванты (например, октадецилдиметилбензил аммония хлорид, гексаметония хлорид, бензалкония хлорид, бензетония хлорид, фенол, бутиловый или бензиловый спирт, алкилпарабены, например, метил- или пропилпарабен, катехол, резорцинол, циклогексанол, 3-пентанол и т-крезол), низкомолекулярные полипептиды (примерно менее 10 оснований), белки, например, сывороточный альбумин, желатин или иммуноглобулины, гидрофильные полимеры, например, поливинилпирролидон, аминокислоты, например, глицин, глутамин, аспарагин, гиститин, аргинин или лизин, моносахариды, дисахариды и другие углеводы, включая глюкозы, маннозу или декстрины, хелатирующие агенты, например, EDTA, сахара, например, сахароза, маннит, трегалоза или сорбит, соль-формирующие противоионы, например, натрий, комплексы металлов (например, комплексы Zn-белок) и/или неионные поверхностноактивные соединения, например, TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ).
Типичные составы анти-CD20 АСМ описаны в WO98/56418, включенной в настоящее изобретение в виде ссылки. В этой публикации описывают жидкие многодозовые составы, включающие 40 мг/мл ритуксимаба, 25 мМ ацетата, 150 мМ трегалозы, 0,9% бензилового спирта, 0,02% полисорбата 20 с величиной рН 5,0, срок годности которых составляет минимум два года при 2-8°С. Другой анти-CD20 исследуемый состав включает 10 мг/мл рутиксимаба в 9,0 мг/мл хлориде натрия, 7,35 мг/мл дигидрата цитрата натрия, 0,7 мг/мл полисорбата 80 и стерильной воде для инъекций, рН 6,5. В настоящем изобретении ритуксимаб может быть замещен модифицированным АСМ настоящего изобретения.
Лиофилизированные составы, адаптированные для подкожного введения, описаны в WO97/04801. Для применения такие лиофилизированные составы могут быть восстановлены путем соответствующего разведения, в результате которого получают раствор с высокой концентрацией белка, и восстановленный раствор может быть введен подкожно млекопитающему, подвергаемому лечению.
В настоящем изобретении состав также может содержать более одного действующего соединения, что необходимо при определенном показании, и предпочтительно, чтобы указанные соединения обладали дополнительными активностями, которые не оказывают друг на друга отрицательного воздействия. Например, может быть целесообразным применить дополнительно хемиотерапевтический агент, цитокин или иммуносупрессивный агент (например, агент, действующий на Т-клетки, например, циклоспорин или антитело, связывающее Т-клетки, например, связывающее LFA-1). Эффективное количество таких дополнительных агентов зависит от количества антагониста в составе, типа заболевания или типа расстройства, или от лечения, а также от других факторов, обсуждавшихся выше. Обычно их применяют в тех же дозировках и теми же способами введения, которые описаны выше, или в количестве, составляющем примерно 1-99% от ранее применявшихся дозировок.
Действующие ингредиенты также могут быть заключены в микрокапсулы, приготовленные, например, методиками с применением коацерватов или полимеризацией на границе сред, например, гидроксиметилцеллюлозных или желатиновых микрокапсул и поли(метилметакрилатных) микрокапсул, соответственно, в коллоидных системах высвобождения лекарственных средств (например, лизосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в микроэмульсиях. Такие методы описаны в кн.: «Remington's Pharmaceutical Sciences», 16-е изд., 1980, под ред. Osol A.
Могут быть приготовлены препараты устойчивого высвобождения. Примерами таких препаратов являются полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антагонист, причем матрицы имеют определенную форму, например, форму пленок или микрокапсул. Примерами матриц устойчивого высвобождения являются полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), поливиниловый спирт, полилактиды (US 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, не поддающийся разрушению этиленвинилацетат, разрушаемый сополимер молочной и гликолевой кислот, например, продукт LUPRON DEPOT™ (микросферы для инъекций, состоящие из сополимера молочной и гликолевой кислот и леупролида ацетата) и поли-D-(-)-3-гидроксимасляная кислота.
Составы для введения in vivo должны быть стерильными. Этого легко достичь стерилизацией путем фильтрации через мембрану.
Композиции настоящего изобретения могут быть в виде различных дозированных форм, в том числе включая, но не ограничиваясь ими, жидкие растворы или суспензии, таблетки, пилюли, порошки, суппозитории, полимерные микрокапсулы или микропузырьки, липосомы и инъекционные растворы или растворы для инфузии. Предпочтительные формы зависят от способа введения и терапевтического применения.
Композиции настоящего изобретения также предпочтительно включают обычные фармацевтически приемлемые носители и адъюванты, известные в данной области, например, сывороточный альбумин человека, ионообменники, окись алюминия, лецитин, буферные вещества, например, фосфаты, глицин, сорбиновая кислота, сорбат калия и соли или электролиты, например, сульфат протамина.
Наиболее эффективные способ введения и дозовый режим для фармацевтических композиций настоящего изобретения зависят от тяжести и течения заболевания, состояния здоровья пациента, ответа на лечение и заключение лечащего врача. В связи с этим дозы и композиции следует подбирать для пациентов индивидуально. Тем не менее, эффективная доза композиций настоящего изобретения обычно может быть в диапазоне примерно от 0,01 до примерно 2000 мг/кг.
Молекулы, описанные в настоящем изобретении, могут быть в различных дозированных формах, в том числе в форме растворов или суспензий, таблеток, пилюль, порошков, суппозиториев, полимерных микрокапсул или микропузырьков, липосом, растворов для инъекций или инфузий, однако ими перечень не ограничивается. Предпочтительная форма зависит от способа введения и терапевтического применения.
Дозировки настоящего изобретения в некоторых случаях могут быть определены в зависимости от биомаркеров. Биомаркеры или молекулярные маркеры, которые применяют для определения (т.е. качественного и/или количественного) типа экспрессии и/или активации связанных с опухолями генов или белков, или клеточных компонентов связанных с опухолями сигнальных метаболических путей. Оценка биологического действия целевых терапий на опухолевые ткани и корреляция этих эффектов с клиническим ответом позволяет выявить преимущественный рост и метаболические пути выживания, действующие в опухолях, тем самым, устанавливая профиль вероятных респондеров и, наоборот, обеспечивая рациональный подход для разработки стратегий преодоления устойчивости при терапии. Например, если модифицированная АСМ является антителом, специфичным в отношении рецептора EGFR, биомаркеры для анти-EGFR терапии могут включать одну или несколько молекул, которые в расположенном ниже сигнальном метаболическом пути EGFR, приводящему к клеточному пролиферативному заболеванию, включая, но не ограничиваясь ими, Akt, RAS, RAF, МАРК, ERK1, ERK2, РКС, STAT3, STAT5 (Mitchell, Nature Biotech. 22, 2004, cc.363-364, Becker, Nature Biotech 22, 2004, cc.15-18, Tsao, Herbst, в Signal 4, 2003, cc.4-9). Биомаркеры для анти-EGFR терапии также могут включать рецепторы фактора роста, например, EGFR, ErbB-2 (HER2/neu) и ErbB-3 (HER3), и могут быть положительными или отрицательными указателями ответа пациента на анти-EGFR терапию. Например, было установлено, что рецептор фактора роста ErbB-3 (HER3) является отрицательным биомаркером для анти-EGFR антитела АВХ-EGF (патентная заявка US 2004/0132097 A1).
Биомаркеры для прогнозирования эффективности лечения могут быть измерены методами анализа клеток, хорошо известными в данной области техники, включая, но не ограничиваясь ими, иммуногистохимию, жидкостную цитометрию, иммунофлуоресценцию, методы захвата и детекции и методы противофазы, и/или с помощью исследования, указанного ранее в патентной заявке US 2004/0132097 A1, содержание которой включено в настоящее изобретение в виде ссылки. Биомаркеры для прогнозирования эффективности анти-EGFR терапии могут быть идентифицированы с помощью методов, описанных ранее в патентной заявке US 2003/0190689 А1, содержание которой включено в настоящее изобретение в виде ссылки.
Таким образом, в настоящем изобретении предусмотрен способ лечения расстройства, связанного с измененной или нерегулируемой передачей клеточного сигнала антигеном-мишенью и/или с измененной способностью опосредовать перекрестное сшивание и/или олигомеризацию одного или нескольких антигенов-мишеней, включающий получение прогноза на лечение с применением модифицированной АСМ человека, нуждающегося в таком лечении, путем изучения образца, полученного от человека перед терапией, с применением одного или большого количества реагентов, которые выявляют экспрессию и/или активацию прогнозирующих биомаркеров для заболевания, связанного с измененной или нерегулируемой передачей клеточного сигнала антигеном-мишенью и/или с измененной способностью опосредовать перекрестное сшивание и/или олигомеризацию одного или нескольких антигенов-мишеней (например, рака); определение типа экспрессии и/или активации одного или нескольких прогнозирующих биомаркеров, на основании которого прогнозируют ответ человека на лечение модифицированной АСМ; и введение человеку, который согласно прогнозу положительно отвечает на лечение модифицированной АСМ, терапевтически эффективного количества композиции, включающей модифицированную АСМ настоящего изобретения. В контексте настоящего изобретения понятие «человек, который согласно прогнозу позитивно реагирует на лечение модифицированной АСМ» относится к субъекту, у которого модифицированная АСМ вызывает измеримое действие на заболевание или расстройство, связанное с измененной или нерегулируемой передачей клеточного сигнала антигеном-мишенью, и/или с измененной способностью опосредовать перекрестное сшивание и/или олигомеризацию одного или нескольких антигенов-мишеней (например, перекрестное сшивание/сморщивание опухоли), и которому польза от терапии модифицированной АСМ не перекрывается побочными эффектами (например, токсичностью). В контексте настоящего изобретения понятие «образец» означает какой-либо биологический образец, изъятый из организма, в частности из организма человека, включающий одну или несколько клеток, в том числе отдельных клеток какого-либо происхождения, из ткани или из образцов биопсии, который был изъят из органов, например, груди, легких, желудочнокишечного тракта, кожи, шейки матки, яичника, почек, мозга, головы и шеи или из каких-либо других органов или тканей организма, а также другие образцы, полученные от организма, к которым относятся, но ими не ограничиваются, мазки, мокрота, секреты, спинномозговая жидкость, желчь, кровь, лимфа, моча и кал.
Композиция, включающая модифицированную АСМ настоящего изобретения, может быть переработана, дозирована и введена способом, согласующимся с обычной медицинской практикой. В этом контексте к числу рассматриваемых факторов относятся: конкретное заболевание или расстройство, подвергаемое лечению, вид млекопитающего, подвергаемого лечению, клиническое состояние конкретного пациента, причина заболевания или расстройства, место высвобождения агента, способ введения, схемы введения и другие факторы, известные практикующим специалистам. Терапевтически эффективное количество антагониста для введения может быть установлено с учетом таких факторов.
Обычно терапевтически эффективное количество введенного парентерально антитела в дозе, находящейся в диапазоне примерно 0,1-20 мг/кг массы тела пациента в сутки, с обычным начальным диапазоном антагонистов, применяемым в диапазоне примерно 2-10 мг/кг.
Также предпочтительно модифицированную АСМ применяют в терапевтически эффективном количестве, составляющем примерно от 1,0 мг/кг до примерно 15 мг/кг.
Также более предпочтительно модифицированную АСМ применяют в терапевтически эффективном количестве, составляющем примерно от 1,5 мг/кг до примерно 12 мг/кг.
Также более предпочтительно модифицированную АСМ применяют в терапевтически эффективном количестве, составляющем примерно от 1,5 мг/кг до примерно 4,5 мг/кг.
Также более предпочтительно модифицированную АСМ применяют в терапевтически эффективном количестве, составляющем примерно от 4,5 мг/кг до примерно 12 мг/кг.
Более предпочтительно модифицированную АСМ применяют в терапевтически эффективном количестве, составляющем примерно 1,5 мг/кг.
Кроме того, наиболее предпочтительно модифицированную АСМ применяют в терапевтически эффективном количестве, составляющем примерно 4,5 мг/кг.
Кроме того, наиболее предпочтительно модифицированную АСМ применяют в терапевтически эффективном количестве, составляющем примерно 12 мг/кг.
В предпочтительном варианте осуществления настоящего изобретения модифицированным АСМ является антитело, предпочтительно гуманизированное антитело. Пригодные дозировки неконъюгированного антитела составляют, например, примерно от 20 мг/м2 до примерно 1000 мг/м2. В одном из вариантов осуществления настоящего изобретения дозировка антитела отличается от дозировки ритуксимаба, назначаемой в настоящее время. Например, при введении пациенту одной или нескольких доз, существенно меньших, чем доза антитела 375 мг/м2, например, в диапазоне примерно от 20 мг/м2 до примерно 250 мг/м2, например, примерно от 50 мг/м2 до примерно 200 мг/м2.
Кроме того, может быть введена одна или несколько начальных доз антитела с последующим введением одной или нескольких последовательных доз, причем доза в мг/м2 антитела в последующей дозе (дозах) превышает дозу в мг/м2 антитела в начальной дозе (дозах). Например, первоначальная доза может составлять примерно от 20 мг/м2 до примерно 250 мг/м2 (например, примерно от 50 мг/м2 до примерно 200 мг/м2), и последующая доза может быть в диапазоне примерно от 250 мг/м2 до примерно 1000 мг/м2.
Однако, согласно указанному выше, такие предлагаемые количества модифицированной АСМ подвергаются большому числу терапевтических ограничений. Ключевым фактором при отборе соответствующей дозы и схемы лечения является результат, полученный выше. Например, относительно более высокие дозы могут понадобиться первоначально для лечения заболеваний, в том числе протекающих в острой форме. Для получения более эффективных результатов, зависящих от заболевания или расстройства, антагонист вводят по возможности быстрее после проявления первых симптомов, постановки диагноза, проявления заболевания, или при возможности возникновения заболевания или расстройства, или в ходе ремиссий заболевания или расстройства.
Модифицированная АСМ настоящего изобретения вводится одним из подходящих способов, в том числе парентерально, подкожно, внутрибрюшинно, внутрилегочно и интраназально, а также, если требуется местное иммуносупрессивное лечение, введением в рану. К парентеральным инфузиям относятся внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, антагонист можно вводить пульсовой инфузией, например, при снижении доз антагониста. Предпочтительно дозирование проводят инъекциями, наиболее предпочтительно внутривенно или подкожно, частично в зависимости от того, является ли введение кратким или хроническим.
В настоящем изобретении также возможно введение других соединений, например, цитотоксических агентов, химиотерапевтических агентов, иммуносупрессивных агентов и/или цитокинов, также являющихся антагонистами. Комбинированное введение включает совместное введение, используя отдельные составы или один фармацевтический состав, и, в другом варианте, последовательно, причем предпочтительно, чтобы оба (или все) действующие агенты одновременно проявляли присущее им биологическое действие на протяжении одного периода времени.
Очевидно, что доза композиции настоящего изобретения, требуемая для достижения лечебного эффекта, может быть в дальнейшем снижена за счет оптимизации схемы лечения.
В соответствии с практикой настоящего изобретения фармацевтический носитель может быть липидным носителем. Липидный носитель может быть фосфолипидом. Кроме того, липидный носитель может быть жирной кислотой. Кроме того, липидный носитель может быть детергентом. В контексте настоящего изобретения понятие «детергент» означает какое-либо вещество, которое изменяет поверхностное натяжение жидкости, обычно понижая его.
В одном примере настоящего изобретения детергент может быть неионным детергентом. Примерами неионных детергентов могут быть, но ими перечень не ограничивается, полисорбат 80 (также называемый Tween 80 или полиоксиэтиленсорбитан моноолеат), Brij, Triton (например, Triton WR-1339 и Triton A-20).
В другом варианте детергент может быть ионным детергентом. Примером ионного детергента является алкилприметиламмонийбромид, но им перечень не ограничивается.
Кроме того, в соответствии с настоящим изобретением липидный носитель может быть липосомой. В контексте настоящего изобретения понятие «липосома» относится к окруженным мембраной пузырькам, которые содержат какие-либо молекулы настоящего изобретения или их комбинации.
Приведенные ниже примеры более подробно поясняют настоящее изобретение. Приведенные ниже препараты и примеры приводятся для более ясного понимания специалистами в данной области настоящего изобретения и его применения. Однако настоящее изобретение не ограничивается примерами его осуществления, которые приведены в качестве иллюстраций отдельных объектов настоящего изобретения, а функционально эквивалентные способы также применимы в настоящем изобретении. Несомненно, что различные модификации настоящего изобретения помимо описанных ясны специалистам в данной области благодаря приведенному выше описанию и фигурам. Такие модификации соответствуют приводимой формуле изобретения.
Примеры
Если не указано иначе, ссылки на положения аминокислотных остатков в приводимых ниже примерах соответствуют нумерации по системе Kabat.
Пример 1
Материалы и методы
Клонирование и экспрессия рекомбинантного антитела B-Ly1
Клетки гибридомы, экспрессирующие антитело В-Ly1 (см., например, Poppema S., и др. в кн.: «Proceedings of the 9th Biotest Symposium», 1987, под ред. Sonneborn H.H. и Tills D, изд-во Institute of Education, Лондон; Ling N.R. и др. в кн.: «Leucocyte Typing Conference III: White cell differentiation antigens», 1987, cc.302-355, под ред. A.J. McMichael, изд-во Oxford University Press, Оксфорд; Knapp W. в кн.: «Leukocyte Typing Conference IV Proceedings», 1990, изд-во Oxford University Press, Оксфорд), выращивают в среде RPMI, содержащей 10% ФСБ и 4 мМ L-глутамина. 6×106 клеток с выживаемостью >90% собирают и выделяют суммарную РНК, используя среднего размера набор Qiagen RNAeasy. Молекулы кДНК, кодирующие вариабельные тяжелую и легкую цепи В-Ly1, амплифицируют с помощью РВ-ПЦР. Реакцию РВ-ПЦР выполняют при следующих условиях: 30 мин при 50°С для синтеза первой цепи кДНК, 15 мин при 95°С начальная денатурация, 30 циклов длительностью 1 мин при 94°С, 1 мин при 45°С, 1,5 мин при 72°С и заключительная стадия элонгации в течение 10 мин при 72°С. Ожидаемый размер продуктов ПЦР подтверждают гель-электрофорезом. Продукты ПЦР клонируют в подходящих векторах Е.coli, сиквенс ДНК подтверждает, что выделены гены, кодирующие вариабельные легкую и тяжелую цепи генов.
Для конструирования химерных В-Ly1 экспрессирующих векторов синтетические сигнальные последовательности и соответствующие сайты рестрикции гибридизируют с вариабельными цепями с помощью дополнительных реакций ПЦР. После окончательного подтверждения соответствия последовательности ДНК вариабельных цепей, их комбинируют с соответствующими постоянными областями IgG1 человека. После конструирования генов их клонируют под контролем промотора MPSV и расположенного выше по цепи синтетического сайта полиА, используя два независимых вектора, по одному для каждой цепи, в результате формируются плазмиды pETR1808 (вектор экспрессии тяжелой цепи) и pETR1813 (вектор экспрессии легкой цепи). Каждый вектор несет последовательность EBV OriP.
Химерное антитело В-Ly1 получают совместной трансфекцией клеток HEK293-EBNA векторами pETR1808 и pETR1813, с помощью методики трансфекции с применением фосфата кальция. Экспоненциально растущие клетки HEK293-EBNA подвергают трансфекции способом с применением фосфата кальция. Клетки выращивают в виде прикрепленных монослоев в Т-флаконах на культуральной среде DMEM с добавлением 10% ФСТ и трансфецируют при слиянии клеток 50-80%. Для трансфекции во флакон Т75 засевают 8 миллионов клеток за 24 ч до трансфекции в 14 мл культуральной среды DMEM с добавлением ФСТ (10% от конечного объема), 250 мкг/мл неомицина, после чего клетки помещают в инкубатор с температурой 37°С в атмосферу 5% CO2 на ночь. Для каждого флакона Т75 при проведении трансфекции приготовляют раствор ДНК, CaCl2 и воды путем перемешивания 47 мкг суммарной плазмидной векторной ДНК, равно поделенной на два вектора экспрессии легкой и тяжелой цепи, 235 мкл 1М раствора CaCl2 и добавления воды до конечного объема 469 мкл. К этому раствору добавляют 469 мкл раствора 50 мМ HEPES, 280 мМ NaCl, 1,5 мМ Na2HPO4 pH 7,05, немедленно перемешивают в течение 10 сек и оставляют при комнатной температуре на 20 сек. Суспензии разводят в 12 мл DMEM с добавкой 2% ФСТ и вносят в Т75 вместо имеющейся среды. Клетки инкубируют при 37°С в атмосфере 5% СО2 в течение примерно 17-20 ч, затем среду заменяют! 2 мл DMEM 10% ФСТ. Для выработки немодифицированного антитела, обозначаемого «chB-Ly1», клетки трансфецируют только векторами, экспрессирующими антитела, pETR.1808 и pETR.1813 в соотношении 1:1. Для выработки антитела, обозначаемого «chB-Ly1-ge», подвергнутого гликоинженерии, клетки трансформируют совместно четырьмя плазмидами: две плазмиды - для экспрессии антитела (pETR.1808 and pETR.1813), одна - для экспрессии гибридного полипептида GnTIII (pETR1519) и еще одна - для экспрессии маннозидазы II (pCLF9), в соотношении 4:4:1:1, соответственно. Через 5 суток после трансфекции собирают супернатант, центрифугируют 5 мин при 1200 об/мин, затем центрифугируют еще раз в течение 10 мин при 4000 об/мин и хранят при 4°С.
Антитела chB-Ly1 и chB-Ly1-ge очищают от культурального супернатанта, используя три последовательные стадии хроматографирования: хроматографию белка А, катионообменную хроматографию и вытеснительную (по размеру) хроматографию па колонке Superdex 200 (фирма Amersham Pharmacia), заменяя буфер на фосфатно солевой буфер (ФСБ) и собирая мономерный пик антитела на этой заключительной стадии. Концентрацию антибиотика оценивают, используя спектрофотометр начиная с поглощения при 280 нм.
Анализ олигосахаридов
Олигосахариды высвобождают из антител ферментативно с помощью расщепления ферментом PNGaseF, при этом антитела находятся в растворе или иммобилизованы на мембране из поливинилиденфторида (ПВДФ).
Получаемый после расщепления раствор, который содержит высвободившиеся олигосахариды, либо используют непосредственно для иммуноферментного анализа MALDI/TOF-MS, либо еще раз подвергают расщеплению ферментом, EndoH гликозидазой, перед подготовкой образца для анализа MALDI/TOF-MS.
Способ высвобождения олигосахаридов из антител, иммобилизованных на мембране из поливинилиденфторида (ПВДФ)
Лунки 96-луночного планшета, оснащенные мембраной ПВДФ (продукт Immobilon Р, фирма Millipore, Бэдфорд, Массачусетс), смачивают 100 мкл метанола, и жидкость пропускают через мембрану ПВДФ, используя многозарядное вакуумное устройство Multiscreen vacuum manifold (фирма Millipore, Бэдфорд, Массачусетс). Мембраны ПВДФ трижды промывают 300 мкл воды. Затем лунки промывают в 50 мкл буфера RCM (8 М мочевины, 360 мМ Tris, 3,2 мМ EDTA, рН 8,6). Антитело в количестве 30-40 мкг загружают в лунку, содержащую 10 мкл буфера RCM. Жидкость из лунки вытягивают через мембрану с применением вакуума, и мембрану затем дважды промывают 50 мкл буфера RCM. Снижение дисульфидных мостиков осуществляют внесением 50 мкл 0,1 М дитиотреита в буфере RCM и инкубируют при 37°С в течение 1 ч.
При последующем восстановлении используют вакуум для удаления раствора дитиотреита из лунок. Лунки промывают трижды 300 мкл воды перед проведением карбоксиметилирования остатков цистеина внесением 50 мкл 0,1 М иодоуксусной кислоты в буфере RCM и инкубированием при комнатной температуре в темноте в течение 30 мин.
После карбоксиметилирования лунки высушивают вакуумом и затем трижды промывают 300 мкл воды. Затем мембрану из поливинилиденфторида (ПВДФ) блокируют для предупреждения абсорбции эндогликозидазы путем инкубирования 100 мкл 1% водного раствора поливинилпирролидона 360 при комнатной температуре в течение 1 ч. Блокирующий реагент затем удаляют слабым вакуумом с последующим трехкратным промыванием 300 мкл воды.
N-связанные олигосахариды высвобождают внесением 2,5 мЕ пептид-N-гликозидазы F (рекомбинантная N-Gгликаназа, фирма GLYKO, Новато, Калифорния) и 0,1 мЕ сиалидазы (фирма GLYKO, Новато, Калифорния) для удаления каких-либо потенциально заряженных моносахаридных остатков в конечном объеме 25 мкл 20 мМ NaHCO3, pH 7,0). Расщепление проводят в течение 3 ч при 37°С.
Способ высвобождения олигосахаридов для антител в растворе
Антитело в количестве 40-50 мкг перемешивают с 2,5 мЕ фермента PNGaseF (фирма Glyko, США) в 2 мМ Tris, pH 7,0 до конечного объема 25 мкл, после чего полученную смесь инкубируют в течение 3 ч при 37°С.
Расщепление ферментом эндогликозидазой Н олигосахаридов, высвобожденных в результате обработки ферментом PNGaseF, для распределения нейтральных пиков олигосахаридов MALDI/TOF-MS
Олигосахариды, высвобожденные в результате обработки ферментом PNGaseF, впоследствии расщепляют ферментом эндогликозидазой Н (EndoH, EC 3.2.1.96). Для расщепления 15 мЕ фермента EndoH (фирма Roche, Швейцария) добавляют к смеси после расщепления ферментом PNGaseF (выше описан раствор антитела) для получения конечного объема 30 мкл, и смесь инкубируют в течение 3 ч при 37°С. EndoH расщепляет между остатками N-ацетилглюкозамина хитобиозного ядра N-связанных олигосахаридов. Фермент может расщеплять только олигоманнозу и большинство гликанов гибридного типа, но не гидролизует олигосахариды комплексного типа.
Приготовление образца для MALDI/TOF-MS
После ферментативного расщепления высвобожденные олигосахариды инкубируют 3 ч при комнатной температуре после добавления уксусной кислоты до конечной концентрации 150 мМ и затем пропускают через 0,6 мл катион-обменной смолы (смола AG50W-X8, водородная форма, ячейки 100-200, фирма BioRad, Швейцария), которой заполнена хроматографическая колонка микро-био-спин (фирма BioRad, Швейцария) для удаления катионов и белков. Один микролитр получаемого образца наносят на чашку из нержавеющей стали и смешивают в чашке с 1 мкл матрицы sDHB. Матрицу sDHB приготовляют растворением 2 мг 2,5-дигидробензойной кислоты плюс 0,1 мг 5-метоксисалициловой кислоты в 1 мл этанола/10 мМ водного раствора хлорида натрия (соотношение объемов 1:1). Образцы подсушивают на воздухе, добавляют 0,2 мкл этанола и в заключении образцы подвергают перекристаллизации на воздухе.
MALDI/TOF-MS
Масс-спектрометр Voyager Elite (фирма Perspective Biosystems) используют для проведения MALDI-TOF для получения масс-спектра. Прибор используют в линейной конфигурации с ускорением 20 kB и задержкой 80 нсек. Проводят калибровку с помощью стандартов олигосахаридов для соотнесения масс ионов. Спектры 200 лазерных импульсов суммируют для получения итогового спектра.
Истощение В-клеток цельной крови
495 мкл гепаринизированной крови от здорового донора помещают в пробирки из полистерола объемом 5 мл, по 5 мкл 100-кратно концентрированных образцов антител (до конечной концентрации 1-1000 нг/мл) или ФСБ помещают в пробирки и инкубируют при 37°. Через 24 ч 50 мкл крови переносят в новую пробирку и окрашивают анти-CD3-FITC, анти-CD19-РЕ и анти-CD45-CyChrome (фирма Becton-Dickinson) в течение 15 мин при комнатной температуре в темноте. Перед проведением анализа 500 мкл буфера FACS (ФСБ, содержащий 2% ФСБ и 5 мМ EDTA) вносят в пробирки. Флуоресценцию CD3-FITC и CD19-PE образцов крови определяют жидкостной цитометрией по установке порога CD45-CyChrome. Истощение В-клеток определяют по соотношению CD19+ В-клеток к CD3+ Т-клеткам.
Связывание анти-CD20 антител клетками Raji
200000 клеток в 180 мкл буфера FACS (ФСБ с добавлением 2% ФСТ и 5 мМ EDTA) переносят в пробирки из полистерола объемом 5 мл. Затем вносят по 20 мкл 10-кратных концентрированных образцов анти-CD20 антитела (до конечной концентрации 1-5000 нг/мл) или ФСБ и пробирки инкубируют при 4°С в течение 30 мин. Затем образцы дважды промывают буфером FACS и осаждают при 300 g в течение 3 мин. Надосадочную жидкость отсасывают и выбрасывают, а клетки помещают в 100 мкл буфера FACS. Затем добавляют 1 мкл анти-Fc-специфических F(ab')2-FITC фрагментов (фирма Jackson Immuno Research Laboratories, США) и пробирки инкубируют при 4°С в течение 30 мин. Образцы дважды промывают буфером FACS и помещают в 500 мкл буфера FACS, 0,5 мкг/мл PI для анализа методом жидкостной цитометрии. Связывание определяют путем нанесения точек средних геометрических величин флуоресценции относительно концентрации антитела.
Пример 2
Подход с использованием высоко гомологичного акцептора
Исследование акцепторного каркасного участка высоко гомологичного антитела проводят путем сравнения белковой последовательности мышиного антитела В-ly1 с коллекцией последовательностей зародышевой линии человека и выбора той последовательности человека, которая показывает наивысшую идентичность последовательности. В данном случае последовательность VH1_10 (локус 1-е, принятый номер DP-88) из базы данных VBase выбирают в качестве акцепторной последовательности каркаса тяжелой цепи последовательности IGKV2-40 (принятый номер Х59314) из базы данных IMGT выбирают в качестве каркасного акцептора для легкой цепи. На эти два акцепторных каркасных участка пересаживают три комплементарно детерминированные области (CDR) тяжелых и легких вариабельных доменов мыши. Поскольку каркасный участок 4 не является частью вариабельной области гена V зародышевой линии, выверку по данной позиции проводят отдельно. Область JH4 выбирают для тяжелой цепи, а область JK4 выбирают для легкой цепи. Молекулярное моделирование конструируемого домена иммуноглобулина выявляет одну точку, потенциально требующую аминокислотные остатки грызуна вместо аминокислотных остатков последовательности человека вне пределов CDR. Повторное внедрение остатков аминокислот грызунов в каркас последовательности человека может генерировать так называемые обратные мутации. Например, акцепторный аминокислотный остаток в последовательности человека в положении 27 по нумерации Kabat представляет обратную мутацию и возврат к остатку тирозина. Варианты гуманизированных антител получены таким образом, что они или включают, или не включают какие-либо обратные мутации. Легкая цепь гуманизированного антитела не требует каких-либо обратных мутаций. После конструирования белковых последовательностей последовательности ДНК, кодирующие эти белки, получают способом, подробно описанным ниже. Подход с использованием смешанного каркасного участка Для того чтобы избежать интродукции обратных мутаций по положениям принципиально важных остатков аминокислот (принципиально важных для сохранения хорошего антигенсвязывающего сродства или функции антител) акцепторного каркаса человека, исследуют, может ли, или целый каркасный участок 1 (FR1), или каркасные участки 1 (FR1) и 2 (FR2) вместе, замещаться последовательностями антитела человека, уже несущими донорские остатки, или функционально эквивалентными последовательностями, по этим важным положениям в природной последовательности зародышевой линии человека. Для этого каркасные участки VH 1 и 2 последовательности антитела В-ly1 выравнивают по отдельности с последовательностями зародышевой линии человека. В настоящем изобретении наивысшая идентичность последовательностей не так важна и не используется для выбора акцепторных каркасных участков, и напротив, сопоставление нескольких принципиально важных остатков предположительно более важно. Такие принципиально важные остатки аминокислот в положениях 24, 71 и 94 (по нумерации Kabat), а также остатки аминокислот в положениях 27, 28 и 30 (по нумерации Kabat), которые локализованы за пределами CDR1 по нумерации Kabat, часто вовлечены в связывание антигена. Последовательность IMGT IGHV3-15 (принятый номер Х92216) выбирают в качестве такой последовательности. После конструирования белковых последовательностей синтезируют последовательности ДНК, кодирующие эти белки, способом, подробно описанным ниже. С помощью такого подхода не требуются обратные мутации ни для легкой, ни для тяжелой цепи, для того, чтобы сохранять высокие уровни связывания антигена.
Синтез генов антител
После конструирования аминокислотной последовательности области V гуманизированного антитела получают последовательность ДНК. Сведения о последовательностях ДНК отдельных каркасных участков почерпнуты в базах данных последовательностей зародышевых линий человека. Последовательность ДНК областей CDR получают из соответствующих баз данных кДНК грызунов. С помощью этих последовательностей фактически собирают полную последовательность ДНК. С помощью данных о последовательности такой ДНК сайты диагностической рестрикции внедряют в фактическую последовательность интродукцией молчащих мутаций, создавая сайты распознавания для эндонуклеаз рестрикции. Для получения цепи материальной ДНК проводят синтез гена (например, метод Wheeler и др. 1995). Согласно этому методу конструируют олигонуклеотиды с исследуемых генов таким образом, что с кодирующей цепи получают серии олигонуклеотидов, и другие серии - с некодирующей цепи. Концы 3' и 5' каждого олигонуклеотида (исключая самый первый и последний в ряду) всегда показывают комплементарные последовательности к двум праймерам, производным противоположной цепи. При помещении этих олигонуклеотидов в реакционный буфер для термоустойчивой полимеразы с добавлением Mg2+, динуклеозидтрифатов и ДНК-полимеразы каждый олигонуклеотид наращивается с 3'-конца. Вновь сформированный 3'-конец одного праймера затем отжигают со следующим праймером противоположной цепи и наращивают эту последовательность в условиях, пригодных для зависимой от матрицы элонгации цепи ДНК. Конечный продукт клонируют в обычном векторе для размножения в Е.coli.
Получение антител
Лидерные последовательности (для секреции) тяжелой и легкой цепи человека добавляют выше по цепи расположенных выше последовательностей вариабельной области и их соединяют выше по каппа-цепи последовательностей тяжелой и легкой цепи IgG1 человека, соответственно, используя стандартные методы молекулярной биологии. Образующиеся последовательности ДНК тяжелой и легкой цепи всего антитела пассируют в экспрессирующих векторах млекопитающих (один вектор для легкой цепи и один для тяжелой цепи) под контролем промотора MPSV выше синтетического сайта полиА каждого вектора, несущего последовательность EBV OriP согласно описанному выше в примере 1. Антитела получают согласно описанию в примере 1 выше, а именно, путем совместной трансфекции HEK293-EBNA векторами экспрессии тяжелой и легкой цепей антитела млекопитающего, получая определенную культуральную среду на 5-7 сутки после трансфекции, и очищая секретируемые антитела аффинной хроматографией белка А, затем катионообменной хроматографией и в заключение вытеснительной (по размеру) хроматографией для выделения чистых мономерных антител IgG1. Согласно рецептуре антитела разрабатывают в растворе 25 мМ фосфата калия, 125 мМ хлорида натрия, 100 мМ глицина при рН 6,7. Варианты гуманизированных антител, подвергавшиеся гликоинженерии, получают совместной трансфекцией векторов, экспрессирующих антитело, вместе с векторами экспрессии GnT-III гликозилтрансферазы или вместе с вектором экспрессии GnT-III плюс вектор экспрессии маннозидазы II Гольджи, согласно описанию для химерного антитела в примере 1, приведенном выше. Созданные гликоинженерией антитела очищают и перерабатывают согласно приведенному выше описанию для антител, не подвергавшихся гликоинженерии. Олигосахариды, присоединенные к области Fc антител анализируют иммуноферментным анализом MALDI/TOF-MS согласно описанному выше.
Анализ олигосахаров
Способ высвобождения олигосахаридов для антител, находящихся в растворе
Антитело в количестве 40-50 мкг смешивают с 2,5 мЕ фермента PNGaseF (фирма Glyko, США) в 2 мМ Tris, pH 7,0 в конечном объеме 25 мкл и смесь инкубируют в течение 3 ч при 37°С.
Приготовление образцов для MALDI/TOF-MS
После ферментативного расщепления высвобожденные олигосахариды инкубируют 3 ч при комнатной температуре после добавления уксусной кислоты до конечной концентрации 150 мМ и затем пропускают через 0,6 мл катион-обменной смолы (смола AG50W-X8, водородная форма, ячейки 100-200, фирма BioRad, Швейцария), которой заполнена хроматографическая колонка микро-био-спин (фирма BioRad, Швейцария) для удаления катионов и белков. Один микролитр получаемого образца наносят на чашку из нержавеющей стали и смешивают на чашке с 1 мкл матрицы sDHB. Матрицу sDHB приготовляют растворением 2 мг 2,5-дигидробензойной кислоты плюс 0,1 мг 5-метоксисалициловой кислоты в 1 мл этанола/10 мМ водного раствора хлорида натрия (соотношение объемов 1:1). Образцы подсушивают на воздухе, добавляют 0,2 мкл этанола и в заключении образцы подвергают перекристаллизации на воздухе.
MALDI/TOF-MS
Масс-спектрометр Voyager Elite (фирма Perspective Biosystems) используют для проведения MALDI-TOF для получения масс-спектра. Прибор используют в линейной конфигурации с ускорением 20 кВ и задержкой 80 нсек. Проводят калибровку с помощью стандартов олигосахаридов для соотнесения масс ионов. Спектры 200 лазерных импульсов суммируют для получения итогового спектра.
Изучение связывания антигенов
Очищенные варианты мономерного гуманизированного антитела тестируют для определения связывания с CD20 человека на клетках-мишенях лимфомы В-клеток Raji, используя метод на основе жидкостной цитометрии согласно описанному выше в примере 1 для химерного антитела В-ly1.
Связывание мономерных гликовариантов IgG1 с природными клетками-киллерами (ПКК) и клетками линии СНО, экспрессирующими FcγRIIIA
ПКК человека выделяют из свежевыделенных мононуклеарных клеток периферической крови (МКПК), применяя отрицательную селекцию для обогащения CD16- и CD56-позитивных клеток (система MACS, фирма Miltenyi Biotec GmbH, Bergisch Gladbach/Германия). Чистота, определенная экспрессией CD56, составляет 88-95%. Свежевыделенные ПКК инкубируют в ФСБ без ионов кальция и магния (3×105 клеток/мл) в течение 20 мин при 37°С для удаления ПКК-ассоциированного IgG. Клетки инкубируют в количестве 106 клеток/мл при разных концентрациях анти-CD20 антитела (0, 0,1, 0,3, 1,3, 10 мкг/мл) в ФСБ с 0,1% БСА. После нескольких промываний связывание антитела определяют путем инкубирования с 1:200 FITC-конъюгированным F(ab')2 козьим антителом к человеческому F(ab')2 специфическим IgG (фирма Jackson ImmunoReasearch, West Grove, Пенсильвания/США) и антителом к человеческом CD56-PE (фирма BD Biosciences, Allschwil/Швейцария). Анти-FcγRIIIA 3G8 F(ab')2 фрагменты (фирма Ancell, Bayport, Миннесота/США) добавляют в концентрации 10 мкг/мл до полного связывания гликовариантов антитела (3 мкг/мл). Интенсивность флуоресценции, соответствующую связанным вариантам антитела, определяют для CD56-позитивных клеток на приборе FACSCalibur (фирма BD Biosciences, Allschwil/Швейцария). Клетки линии СНО переносят электропортацией (280 В, 950 мкФ, 0,4 см) с вектором экспрессии, кодирующим FcγRIIIA-Val158 α-цепь и γ-цепь. Трансфектанты отбирают внесением 6 мкг/мл пуромицина и исследуют устойчивые клоны с помощью FACS, используя 10 мкл FITC-конъюгированного-анти-FcγRIII 3G8 моноклонального антитела (фирма BD Biosciences, Allschwil/Швейцария) для 106 клеток. Связывание IgG1 с FcγRIIIA-Val158-экспрессирующими клетками линии СНО осуществляют аналогично описанному выше связыванию ПКК.
Исследование антитело-зависимой клеточной цитотоксичности (ADCC)
Мононуклеарные клетки периферической крови (МКПК) человека используют в качестве эффекторных клеток и получают с помощью Histopaque-1077 (фирма Sigma Diagnostics Inc., Сэнт-Луис, MO63178 США), придерживаясь инструкций производителя. Вкратце, венозную кровь берут у добровольцев с помощью гепаринизированных шприцов. Кровь разбавляют ФСБ (без Са++ или Mg++) в соотношении 1:0,75-1,3 и наносят на Histopaque-1077. Градиент центрифугируют при 400 g в течение 30 мин при комнатной температуре (КТ) без перерывов. Интерфазу, содержащую МКПК, собирают, отмывают в ФСБ (50 мл для клеток двух градиентов) и собирают центрифугированием при 300 g в течение 10 мин при комнатной температуре. После ресуспендирования осадка в ФСБ подсчитывают МКПК и промывают второй раз центрифугированием при 200 g в течение 10 мин при комнатной температуре. Затем клетки ресуспендируют в соответствующей среде для последующих процедур.
Соотношение эффектора к мишени, применяемое для исследования ADCC, составляет 25:1 и 10:1 для клеток МКПК и ПКК, соответственно. Эффекторные клетки приготовляют в среде AIM-V в соответствующей концентрации для того, чтобы внести 50 мкл в круглодонные лунки 96-луночного планшета. Клетками-мишенями являются В-клетки лимфомы человека (например, клетки Raji), выращенные в среде DMEM, содержащей 10% ФСТ. Клетки-мишени промывают в ФСБ, подсчитывают и ресуспендируют в AIM-V в количестве 300000 в мл для того, чтобы внести 30000 клеток в 100 мкл в микролунку. Антитела разбавляют средой, добавляют 50 мкл предварительно выращенных клеток-мишеней и осуществляют связывание с мишенями в течение 10 мин при комнатной температуре. Затем добавляют Эффекторные клетки и планшетку инкубируют в течение 4 ч при 37°С во влажной атмосфере с 5% CO2. Уничтожение клеток-мишеней оценивают по высвобождению лактатдегидрогеназы (LDH) из поврежденных клеток, используя набор реактивов для определения цитотоксичности Cytotoxicity Detection kit (фирма Roche Diagnostics, Rotkreuz, Швейцария). После 4-часового инкубирования планшеты центрифугируют в режиме 800 g. Супернатант в количестве 100 мкл из каждой лунки переносят в прозрачные плоскодонные лунки 96-луночного планшета. По 100 мкл буфера для окраски субстрата из набора вносят в лунки. Величины Vmax цветной реакции определяют ридером ELISA при 490 нм в течение по меньшей мере 10 мин с применением программного обеспечения SOFTmax PRO (фирма Molecular Devices, Sunnyvale, CA94089, США). Спонтанное высвобождение LDH определяют в лунках, содержащих только клетки-мишени и Эффекторные клетки, но не содержащих антител. Максимальное высвобождение определяют в лунках, содержащих только клетки-мишени и 1% Triton X-100. Процент погибших клеток, опосредованных специфическими антителами, подсчитывают следующим образом: (x-SR)/(MR-SR)*100, где x обозначает среднюю величину Vmax при определенной концентрации антитела, SR обозначает среднюю величину Vmax спонтанного высвобождения и MR обозначает среднюю величину Vmax максимального высвобождения.
Исследование комплемент-зависимой цитотоксичности
Клетки-мишени подсчитывают, промывают ФСБ, ресуспендируют в среде AIM-V (фирма Invitrogen) в концентрации 1 миллион клеток в мл. 50 мкл клеток высевают в плоскодонные лунки 96-луночного планшета. Разведения антитела приготовляют в среде AIM-V и в объеме 50 мкл вносят к клеткам. Антитела связываются с клетками в течение 10 мин при комнатной температуре. Свежеразмороженный сывороточный комплемент человека (фирма Quidel) трехкратно разводят средой AIM-V и в объеме 50 мкл вносят в лунки. Комплемент кролика (фирма Cedarlane Laboratories) получают, опираясь на рекомендации производителя, разводят трехкратно средой AIM-V и в объеме 50 мкл добавляют в лунки. В качестве контроля перед исследованием источники комплемента нагревают в течение 30 мин при 56°С перед внесением. Планшеты инкубируют в течение 2 ч при 37°С. Уничтожение клеток определяют, измеряя высвобождение LDH. Вкратце, планшеты центрифугируют в режиме 300 g в течение 3 мин. По 50 мкл супернатанта из лунок переносят в новые 96-луночные планшеты и добавляют по 50 мкл реагента из набора Cytotoxicity Kit (фирма Roche). Кинетическое измерение с помощью ридера ELISA определяет величину Vmax, соответствующую концентрации в супернатанте. Максимальное высвобождение определяют инкубированием клеток в присутствии 1% Trition X-100.
Изучение истощения В-клеток в цельной крови
Истощение нормальных В-клеток в цельной крови анти-CD20 антителами осуществляют согласно описанному выше в примере 1.
Изучение апоптоза
Способность антител к апоптозу исследуют путем инкубирования антитела в концентрации 10 мкг/мл (в условиях насыщения для связывания антигена) с клетками-мишенями (нагрузка клеток-мишеней составляет 5×105 клеток/мл) в течение ночи (16-24 ч). Образцы окрашивают AnnV-FITC и анализируют с помощью FACS. Анализ проводят в трех повторах.
Выявление апоптоза осуществляют методом жидкостной цитометрии, отслеживая появление маркеров апоптоза, например, аннексина V и фосфатидилсерина. В отрицательном контроле (без индукции апоптоза) нет какого-либо антитела, присутствует только фосфатно-солевой буфер. В положительном контроле (максимальное проявление апоптоза) содержится 5 мкмоль камптотецина, интенсивно индуцирующего апоптоз.
Результаты и обсуждение
Сравнение связывания антигена человека CD20 с вариантами антитела В-НН1, В-НН2, В-НН3, объединенными с легкой цепью гуманизированного антитела B-ly1 (BKV1), и исходным химерным антителом chB-ly1 (описанным выше в примере 1) показывает, что все антитела имеют сходные значения ЕС50, но конструкция В-НН1 связывается с меньшей интенсивностью/стехиометрией по сравнению с вариантами В-НН2 и В-НН3 (фиг.11). Можно отличить В-НН1 от В-НН2 и В-НН3 по наличию части областей CDR1 и CDR2 человека (по нумерации Kabat), а также по Ala/Thr полиморфизму в положении 28 (по нумерации Kabat). Это свидетельствует о том, что или положение 28, или полная последовательность CDR1, и/или полная последовательность CDR2 важны для взаимодействия антитела/антигена.
Сравнение B-HL1, В-НН1 и химерного chB-ly1 исходного антитела показывает отсутствие какой-либо связывающей активности в конструкции В-HL1 и примерно половинное по интенсивности/стехиометрии связывание В-НН1 по сравнению с антителом B-ly1 (фиг.12). И B-HL1, и В-НН1 сконструированы на основе каркаса акцептора, полученного от класса VH1 человека. Среди других отличий важным является отличие по положению 71 (по нумерации Kabat) конструкции B-HL1, предположительно важное для связывания антигена. Аминокислотный остаток в положении 71 является одним из аминокислотных остатков, которые определяют каноническую петлю структуры CDR2 тяжелой цепи. Аланин или его функциональные эквиваленты, например, лейцин, валин или треонин (см., например, Morea и др., Methods 20, 2000, cc.267-279), предположительно важны для связывания антигена, а аргинин на связывание антигена влияет отрицательно.
При сопоставлении данных по связыванию антигена, представленных на фиг.2, 9-13, варианты BHH2-BKV1, BHL8-BKV1 и BHL11-BKV1 среди различных вариантов гуманизированного антитела показывают хорошее связывающее сродство с антигеном человека CD20 на поверхности клеток человека. Несмотря на близкие значения величины ЕС50 для связывания антигена, эти варианты существенно отличаются по способности индуцировать апоптоз в CD20-положительных клетках-мишенях (см. фиг.4-6, 14, 15). Поскольку исходное антитело В-ly1 индуцирует апоптоз на низком уровне, в настоящем изобретении выявляют различия между конструкцией исходного антитела В-ly1 и конструкциями B-HL8 и В-НН2. Выявлено семь остатков аминокислот в тяжелой цепи В-НН2, которые отсутствуют в B-HL8 или исходных тяжелых цепях антитела В-ly1: Gln1, Ala9, Val11, Lys12, Ser16, Val20 и Met48. Все эти семь аминокислотных остатков локализованы в каркасных участках домена VH. Вероятность прямого контакта с антигеном невозможна, исключение составляет Gln1. Для того чтобы определить, может ли один из этих аминокислотных остатков отвечать за вновь выработанное свойство индуцировать апоптоз, получают семь вариантов тяжелой цепи антитела B-HL8, которые потенциально могут восстановить апоптическое действие конструкции В-НН2: B-HL11 (несет мутацию E1Q), B-HL12(G9A, V48M), B-HL13(L11V, V48M), B-HL14(V12K, V48M), B-HL15(G16S, V48M), B-HL16(L20V, V48M) и В-HL17(V48M). См. следующие последовательности (SEQ ID NO):32, 34, 36, 38, 40, 42 и 44 (которые в перечне последовательностей пронумерованы не по нумерации Kabat, однако для специалиста не представляет сложности перевести их в систему нумерации Kabat). Антигенсвязывающие свойства этих вариантов существенно не отличаются по величине ЕС50 и стехиометрии (см. фиг.2). Однако выраженное отличие можно установить по присущей им способности индуцировать апоптоз (фиг.4-6, 14, 15 и 24). Конструкции с L11V, V48M модификациями, B-HL13 существенно повышают способность индуцировать апоптоз (см. фиг.24). Однако одна модификация V48M не имеет видимого эффекта (см. фиг.5). Следовательно, остатки аминокислот в положениях 11 и 12 по нумерации Kabat наиболее сильно влияют на апоптоз. Эти остатки непосредственно не влияют на связывание антигена, но в значительной степени воздействуют на границу между доменами VH и СН1 и таким образом действуют через модификацию «локтевого угла».
Конструкцию B-HL4 получают из антитела В-НН2 заменой каркасного участка FR1 антитела В-НН2 на каркасный участок последовательности IGHV1-45 зародышевой линии человека (установленный номер Х92209). Антигенсвязывающая способность этой конструкции существенно ослаблена, хотя отличаются только четыре аминокислоты по четырем положениям в каркасной области FR1. Эти остатки локализованы в положениях 2, 14, 28 и 30 (по нумерации Kabat). Из них положения 28 и 30 могут быть важными положениями, поскольку они составляют часть области CDR1 по определению Chothia. В вариантах В-НН8 и 9 (оба в BKV1 легкой цепи) положения 28 и 30 являются модифицированными по сравнению с последовательностью исходного антитела В-ly1. На фиг.22 показано, что способность к связыванию существенно не меняется, если в положении 28 присутствует треонин и в положении 30 также присутствует треонин (фиг.22). В гуманизированную легкую цепь, которая имеет CDR1, CDR2 и CDR3 по нумерации Kabat, не были интродуцированы обратные мутации. Наиболее сильно индуцирует апоптоз вариант BHH2-BKV1 гуманизированного антитела В-ly1 (даже сильнее, чем исходное антитело chB-ly1 и намного сильнее, чем антитело с последовательностью, идентичной ритуксимабу, С2В8; см. фиг.14, 15 и 21). Другие гуманизированные варианты, которые могут вызвать повышенный апоптоз, следующие: B-HL13 и B-HL14 (производные BHL8), ВНН8 («смешанный каркас»), ВНН9 («смешанный каркас» с одной обратной мутацией для оценки действия S30T) и В-НН6 (M34I производное В-НН2). Вариант ВНН4 является другим вариантом гуманизированного антитела В-ly1, в который не интродуцированы дополнительные последовательности, не принадлежащие человеку. Варианты В-НН5, В-НН6 и В-НН7 являются производными конструкции В-НН2 с частично гуманизированной областью CDR1 по нумерации Kabat.
Важные свойства гуманизированного антитела В-ly1 заключаются в том, что оно является антителом типа II анти-CD20 антитела согласно описанию Cragg M.S. и Glennie M.J. в Blood 103, 2004, cc.2738-2743. В связи с этим, оно не индуцирует при связывании с CD20 какой-либо существенной устойчивости к неионной экстракции детергентом антигена CD20 с поверхности CD20+ клеток человека, используя метод, описанный для этой цели Polyak M.J. и Deans J.P., Blood 99, 2002, cc.3256-3262. Оно индуцирует существенно меньшую устойчивость к неионной экстракции детергентом CD20, чем антителе С2 В8 (другое анти-CD20 антитело с последовательностью, идентичной ритуксимабу (см. US 2003 0003097)). Согласно ожидаемому свойству анти-CD20 антитела типа II, гуманизированное антитело В-ly1 не обладает какой-либо существенной комплемент-опосредованной литической активностью и проявляет намного меньшую комплемент-опосредованную литическую активность по сравнению с анти-CD20 антителом С2В8 (химерная последовательность IgG1 с последовательностью, идентичной ритуксимабу). Другое важное свойство гуманизированного антитела В-ly1 (вариант В-НН2 B-KV1) заключается в том, что оно очень активно для исследования гомотипической агрегации. При проведении этого исследования CD20-позитивные клетки человека, клетки Daudi, инкубируют в культуральной среде для клеток в течение 24 ч при 37°С в атмосфере 5% CO2 в инкубаторе клеток млекопитающих, согласно описанному методу Deans и др., с антителом в концентрации 1 мкг/мл и параллельно в концентрации 5 мкг/мл. Для сравнения проводят параллельное контрольное инкубирование клеток в идентичных условиях, используя анти-CD20 антитело, С2В8. В разное время, в том числе через 8 и 24 ч инкубации, клетки просматривают с помощью микроскопа. Установлено, что гуманизированное антитело В-ly1 приводит к жесткой гомотипической агрегации с формированием агрегатов, которые существенно больше тех, которые индуцируют внесением контрольного антитела С2В8. Кроме того, совместимость с антителом, относящимся к анти-CD20 типу II, вызывает повышенные уровни апоптоза, если CD20-позитивные клетки человека инкубируют с гуманизированным антителом В-ly1, относительно контроля при идентичных условиях, используя С2В8 химерное IgG1 антитело с последовательностью, идентичной последовательности ритуксимаба.
Гликоинженерные варианты гуманизированных антител получают совместной экспрессией GnTIII-гликозилтрансферазы вместе с генами антитела в клетках млекопитающих. Это приводит к повышению фракции нефукозилированных олигосахаридов, присоединенных к области Fc антител, включая разветвленные нефукозилированные олигосахариды, описанные в WO 2004/065540 (фиг.17-19). Гликоинженерные антитела имеют существенно более высокие уровни связывания с рецепторами FcγRIII человека (фиг.20), а также повышенную активность ADCC (фиг.16), по сравнению с не подвергавшимся гликоинженерии антителом и относительно антитела С2В8. Гуманизированное антитело В-ly1 также в большей степени индуцирует истощение В-клеток человека в цельной крови (фиг.16) по сравнению с контрольным антителом С2В8. Это относится и к не подвергавшемуся гликоинженерии антителу В-ly1, и к его гликоинженерной версии. Подвергшееся гликоинженерии антитело примерно в 1000 раз интенсивнее истощает В-клетки в цельной крови про сравнению с С2В8 контрольным анти-CD20 антителом. Такое сравнение важно и для не подвергавшейся гликоинженерии, и для гликоинженерной гуманизированной формы антитела В-ly1, поскольку было установлено, что такие комбинированные Fc-рецепторзависящие активности, например, ADCC, плюс комплемент-опосредованный лизис, плюс индукция апоптоза, у обеих форм В-ly1 существенно более активные по сравнению с С2В8, хотя обе формы В-ly1 проявляют существенно пониженную комплемент-опосредованную литическую активность. ADCC, Fc-рецептор-уничтожение клеток и индукция апоптоза представляют указанную активность гуманизированных вариантов антитела В-ly1. Кроме того, при исследовании апоптоза активность проявляли и подвергшиеся, и не подвергшиеся гликоинженирингу формы данного анти-CD20 антитела типа II с Fc-сконструированными вариантами с повышенным связывающим сродством к Fcγ-рецепторам, причем индукция апоптоза более эффективна, чем у не-Fc-сконструированного варианта, и со всеми вариантами, которые существенно более активны по сравнению с контрольным антителом С2В8. Четкий механизм повышения гомотипического агрегирования и индукции апоптоза, опосредованный анти-CD20 антителами типа II, неизвестен, и конкоминантное связывание с другими молекулами на поверхности CD20-позитивных клеток, например, с Fcγ-рецепторами, может влиять на это важное свойство. Поэтому важно показать, что анти-CD20 антитела типа II, которые были изменены в области Fc для повышенного связывающего сродства с рецепторами Fc гамма, включая FcγRIII, и с ассоциированным повышением активности ADCC, сохраняют способность индуцировать сильный апоптоз, даже в большей степени, чем при не подвергшейся конструированию области Fc, и гомотипическую агрегацию. Индукция апоптоза важна, поскольку in vivo в организме имеются места, в которых могут быть обнаружены CD20-позитивные клетки-мишени, но в которых доступ к FcγRIII-позитивным клеткам сложнее, чем доступ в крови (например, лимфоузлы). При таких локализациях индукция апоптоза анти-CD20 антителом, сама по себе, может быть решающей для хорошей эффективности терапии анти-CD20 антителом у людей и для лечения злокачественных гематологических заболеваний, например, неходжкинской лимфомы и В-клеточного хронического лимфоцитарного лейкоцитоза, а также для лечения аутоиммунных заболеваний, например, ревматоидного артрита и волчанки, путем истощения В-клеток. Повышенное связывающее сродство с FcγRIII и повышенная антителозависимая клеточная цитотокичность (ADCC) гуманизированного Fc-сконструированного анти-CD20 антитела типа II также может быть очень важным атрибутом для такой терапии. Таким образом, пониженная или незначительная комплемент-опосредованная литическая активность анти-CD20 антитела типа II, включая гуманизированные и Fc-сконструированные варианты, также может быть важной, поскольку повышенная активация комплемента анти-CD20 антителами коррелирует с повышенными нежелательными побочными эффектами.
Пример 3
Для дальнейшего изучения аминокислотных остатков, влияющих на апоптическую активность, получают шесть вариантов тяжелой цепи ВНН2: ВНН2-А (V11L) (SEQ ID NO:124), ВНН2-В (K12V) (SEQ ID NO:125), BHH2-C (A9G) (SEQ ID NO:126), BHH2-D (E10G) (SEQ ID NO:127), BHH2-E (T110I) (SEQ ID NO:128) и BHH2-F (S112I) (SEQ ID NO:129). Эти варианты конструкций исследуют на способность связываться с антигеном-мишенью (CD20) методами, описанными выше. Все шесть вариантов конструкций сохранили связывающую активность.
Варианты конструкций тяжелой цепи также исследуют на апоптическое действие описанными выше способами. Пять из этих конструкций, ВНН2-В, BHH2-C, BHH2-D, ВНН-2Е и BHH-2F, обладают апоптическим действием в той же степени, что и исходная конструкция ВНН2. Однако способность конструкции ВНН2-А (V11L) индуцировать апоптоз существенно ниже, чем у ВНН2 (см. фиг.23).
Также исследуют апоптическое действие единичных замен аминокислот в легкой цепи гуманизированного антитела B-ly1 (BKV1) путем получения пяти вариантов конструкции: BKV-10 (P40A) (SEQ ID NO:130), BKV-11 (A80P) (SEQ ID NO:131), BKV-12 (V83F) (SEQ ID NO:132), BKV-13 (E105A) (SEQ ID NO:133) и BKV-14 (I106A) (SEQ ID NO:134). Связывание конструкций BKV-11, BKV-12, BKV-13 и BKV-14 с антигеном-мишенью (CD20) исследовали описанными выше способами, и было установлено, что все четыре конструкции сохраняют связывающую активность. Эти четыре варианта конструкции легкой цепи также тестируют на апоптическое действие описанными выше способами. Способность к апоптозу конструкций BKV-11, BKV-12 и BKV-13 не изменилась в результате произведенных замен. Однако конструкция BKV-14 проявляет пониженную способность индуцировать апоптоз по сравнению с BKV1 (см., например, фиг.25).
Все публикации (пособия, журнальные статьи, базы данных, патентные заявки), упоминаемые в настоящем описании, приводятся в настоящем изобретении в виде ссылок в той степени, в которой конкретно каждую из них было необходимо упомянуть.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Роше Гликарт АГ
<120> МОДИФИЦИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ С ИЗМЕНЕННОЙ КЛЕТОЧНОЙ
СИГНАЛЬНОЙ АКТИВНОСТЬЮ
<130> 1975.056PC01
<150> US 60/711,454
<151> 2005-08-26
<160> 134
<170> PatentIn version 3.3
<210> 1
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH1 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 1
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctgggagttc agtgaaggtc 60
tcctgcaagg cttccggata caccttcagc tattcttgga tgagctgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
gcacagaaat tccaaggaag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 2
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH1 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Tyr Ser
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 3
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH2 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 3
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctgggagttc agtgaaggtc 60
tcctgcaagg cttccggata cgccttcagc tattcttgga tgaactgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 4
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH2 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 5
<211> 366
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH3 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 5
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctgggagttc agtgaaggtc 60
tcctgcaagg cttccggata cgccttcagc tattcttgga tgaactgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt atctgtgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctcagct 360
agcacc 366
<210> 6
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH3 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 6
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Leu Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 7
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH4 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 7
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctggagcttc agtgaaggtc 60
tcctgcaagg tctccggata cgcgttcagc tattcttgga tgaactgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 8
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH4 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 8
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 9
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH5 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 9
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctgggagttc agtgaaggtc 60
tcctgcaagg cttccggata cgcgttcagc tattcttgga tgagctgggt gcggcaggcg 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 10
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH5 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 10
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 11
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH6 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 11
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctgggagttc agtgaaggtc 60
tcctgcaagg cttccggata cgccttcagc tattcttgga tcaattgggt gcggcaggcg 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 12
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH6 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 12
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 13
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH7 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 13
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctgggagttc agtgaaggtc 60
tcctgcaagg cttccggata cgccttcagc tattcttgga tctcgtgggt gcggcaggcg 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 14
<211> 357
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH7 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 14
Cys Ala Gly Gly Thr Gly Cys Ala Ala Thr Thr Gly Gly Thr Gly Cys
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Cys Gly Cys Thr Gly Ala Ala Gly Thr
20 25 30
Thr Ala Ala Gly Ala Ala Gly Cys Cys Thr Gly Gly Gly Ala Gly Thr
35 40 45
Thr Cys Ala Gly Thr Gly Ala Ala Gly Gly Thr Cys Thr Cys Cys Thr
50 55 60
Gly Cys Ala Ala Gly Gly Cys Thr Thr Cys Cys Gly Gly Ala Thr Ala
65 70 75 80
Cys Gly Cys Cys Thr Thr Cys Ala Gly Cys Thr Ala Thr Thr Cys Thr
85 90 95
Thr Gly Gly Ala Thr Cys Thr Cys Gly Thr Gly Gly Gly Thr Gly Cys
100 105 110
Gly Gly Cys Ala Gly Gly Cys Gly Cys Cys Thr Gly Gly Ala Cys Ala
115 120 125
Ala Gly Gly Gly Cys Thr Cys Gly Ala Gly Thr Gly Gly Ala Thr Gly
130 135 140
Gly Gly Ala Cys Gly Gly Ala Thr Cys Thr Thr Thr Cys Cys Cys Gly
145 150 155 160
Gly Cys Gly Ala Thr Gly Gly Gly Gly Ala Thr Ala Cys Thr Gly Ala
165 170 175
Cys Thr Ala Cys Ala Ala Thr Gly Gly Gly Ala Ala Ala Thr Thr Cys
180 185 190
Ala Ala Gly Gly Gly Cys Ala Gly Ala Gly Thr Cys Ala Cys Ala Ala
195 200 205
Thr Thr Ala Cys Cys Gly Cys Cys Gly Ala Cys Ala Ala Ala Thr Cys
210 215 220
Cys Ala Cys Thr Ala Gly Cys Ala Cys Ala Gly Cys Cys Thr Ala Thr
225 230 235 240
Ala Thr Gly Gly Ala Gly Cys Thr Gly Ala Gly Cys Ala Gly Cys Cys
245 250 255
Thr Gly Ala Gly Ala Thr Cys Thr Gly Ala Gly Gly Ala Cys Ala Cys
260 265 270
Gly Gly Cys Cys Gly Thr Gly Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Cys Ala Ala Gly Ala Ala Ala Thr Gly Thr Cys Thr Thr Thr Gly
290 295 300
Ala Thr Gly Gly Thr Thr Ala Cys Thr Gly Gly Cys Thr Thr Gly Thr
305 310 315 320
Thr Thr Ala Cys Thr Gly Gly Gly Gly Cys Cys Ala Gly Gly Gly Ala
325 330 335
Ala Cys Cys Cys Thr Gly Gly Thr Cys Ala Cys Cys Gly Thr Cys Thr
340 345 350
Cys Cys Thr Cys Ala
355
<210> 15
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH8 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 15
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctggcgcctc agtgaaggtc 60
tcctgcaagg cttccggata caccttcaca tacagctgga tgaactgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 16
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH8 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 16
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 17
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HH9 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 17
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctggcgcctc agtgaaggtc 60
tcctgcaagg cttccggata caccttcagc tattcttgga tgaactgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 18
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH9 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 19
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL1 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 19
caggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttccggata caccttcacc tattcttgga tgcactgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
gcacagaaat tccaaggaag agtcacaatg acacgggaca cgtccacttc caccgtctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 20
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL1 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 20
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Tyr Ser
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 21
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL2 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 21
gaggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctggggccac cgtgaagatc 60
tcctgcaagg tgtccggata caccttcacc tattcttgga tgcactgggt gcagcaggcc 120
cctggaaagg ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
gcagagaaat tccaaggaag agtcacaatc acagccgaca cgtccactga caccgcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aaccaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 22
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL2 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 22
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Tyr Ser
20 25 30
Trp Met His Trp Val Gln Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Ala Glu Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 23
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL3 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 23
gaggtgcaat tggtgcagtc tggcgctgaa gttaagaagc ctggggccac cgtgaagatc 60
tcctgcaagg tgtccggata caccttcacc tattcttgga tgaactgggt gcagcaggcc 120
cctggaaagg ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggaag agtcacaatc acagccgaca cgtccactga caccgcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aaccaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 24
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL3 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 24
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Tyr Ser
20 25 30
Trp Met Asn Trp Val Gln Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 25
<211> 366
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL4 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 25
cagatgcaat tggtgcagtc tggcgctgaa gttaagaaga ccgggagttc agtgaaggtc 60
tcctgcaagg cttccggata caccttcacc tattcttgga tgagctgggt gcggcaggcc 120
cctggacaag ggctcgagtg gatgggacgg atctttcccg gcgatgggga tactgactac 180
gcacagaaat tccaaggaag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctcagct 360
agcacc 366
<210> 26
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL4 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 26
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Thr Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Tyr Ser
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 27
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL8 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 27
gaagtgcagc tggtggagtc tggaggaggc ttggtcaagc ctggcgggtc cctgcggctc 60
tcctgtgcag cctctggatt cacatttagc tattcttgga tgaactgggt gcggcaggct 120
cctggaaagg gcctcgagtg ggtgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 28
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL8 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 29
<211> 456
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL10 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 29
cggaattcgg cccaccggtg gccaccatgg actggacctg gaggatcctc ttcttggtgg 60
cagcagccac aggagcccac tccgaagtgc agctggtgga gtctggagga ggcttggtca 120
agcctggcgg gtccctgcgg ctctcctgtg cagcctctgg attcgcattc agctattctt 180
ggatgaactg ggtgcggcag gctcctggaa agggcctcga gtgggtggga cggatctttc 240
ccggcgatgg ggatactgac tacaatggga aattcaaggg cagagtcaca attaccgccg 300
acaaatccac tagcacagcc tatatggagc tgagcagcct gagatctgag gacacggccg 360
tgtattactg tgcaagaaat gtctttgatg gttactggct tgtttactgg ggccagggaa 420
ccctggtcac cgtctcctca gctagcgaat tctcga 456
<210> 30
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL10 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 31
<211> 357
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL11 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 31
caggtgcagc tggtggagtc tggaggaggc ttggtcaagc ctggcgggtc cctgcggctc 60
tcctgtgcag cctctggatt cacatttagc tattcttgga tgaactgggt gcggcaggct 120
cctggaaagg gcctcgagtg ggtgggacgg atctttcccg gcgatgggga tactgactac 180
aatgggaaat tcaagggcag agtcacaatt accgccgaca aatccactag cacagcctat 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc aagaaatgtc 300
tttgatggtt actggcttgt ttactggggc cagggaaccc tggtcaccgt ctcctca 357
<210> 32
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL11 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 32
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 33
<211> 456
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL12 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 33
cggaattcgg cccaccggtg gccaccatgg actggacctg gaggatcctc ttcttggtgg 60
cagcagccac aggagctcac tccgaagtgc agctcgtgga gtctggagca ggcttggtca 120
agcctggcgg gtccctgcgg ctctcctgcg cagcctctgg attcacattt agctattctt 180
ggatgaactg ggtgcggcag gctcctggaa agggcctcga gtgggtggga cggatctttc 240
ccggcgatgg ggatactgac tacaatggga aattcaaggg cagagtcaca attaccgccg 300
acaaatccac tagcacagcc tatatggagc tgagcagcct gagatctgag gacacggccg 360
tgtattactg tgcaagaaat gtctttgatg gttactggct tgtttactgg ggccagggaa 420
ccctggtcac cgtctcctca gctagcgaat tctcga 456
<210> 34
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL12 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 34
Glu Val Gln Leu Val Glu Ser Gly Ala Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 35
<211> 456
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 35
cggaattcgg cccaccggtg gccaccatgg actggacctg gaggatcctc ttcttggtgg 60
cagcagccac aggagctcac tccgaagtgc agctcgtcga gtctggagga ggcgtggtca 120
agcctggcgg gtccctgcgg ctctcctgcg cagcctctgg attcacattt agctattctt 180
ggatgaactg ggtgcggcag gctcctggaa agggcctcga gtgggtggga cggatctttc 240
ccggcgatgg ggatactgac tacaatggga aattcaaggg cagagtcaca attaccgccg 300
acaaatccac tagcacagcc tatatggagc tgagcagcct gagatctgag gacacggccg 360
tgtattactg tgcaagaaat gtctttgatg gttactggct tgtttactgg ggccagggaa 420
ccctggtcac cgtctcctca gctagcgaat tctcga 456
<210> 36
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 36
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 37
<211> 456
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL14 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 37
cggaattcgg cccaccggtg gccaccatgg actggacctg gaggatcctc ttcttggtgg 60
cagcagccac aggagctcac tccgaagtgc agctggtcga gtccggagga ggcttgaaga 120
agcctggcgg gtccctgcgg ctctcctgcg cagcctctgg attcacattt agctattctt 180
ggatgaactg ggtgcggcag gctcctggaa agggcctcga gtgggtggga cggatctttc 240
ccggcgatgg ggatactgac tacaatggga aattcaaggg cagagtcaca attaccgccg 300
acaaatccac tagcacagcc tatatggagc tgagcagcct gagatctgag gacacggccg 360
tgtattactg tgcaagaaat gtctttgatg gttactggct tgtttactgg ggccagggaa 420
ccctggtcac cgtctcctca gctagcgaat tctcga 456
<210> 38
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL14 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 38
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Lys Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 39
<211> 456
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL15 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 39
cggaattcgg cccaccggtg gccaccatgg actggacctg gaggatcctc ttcttggtgg 60
cagcagccac aggagcccac tccgaagtgc agctggtgga gtctggagga ggcttggtca 120
agcctggctc ttccctgcgg ctctcctgcg cagcctctgg attcacattt agctattctt 180
ggatgaactg ggtgcggcag gctcctggaa agggcctcga gtgggtggga cggatctttc 240
ccggcgatgg ggatactgac tacaatggga aattcaaggg cagagtcaca attaccgccg 300
acaaatccac tagcacagcc tatatggagc tgagcagcct gagatctgag gacacggccg 360
tgtattactg tgcaagaaat gtctttgatg gttactggct tgtttactgg ggccagggaa 420
ccctggtcac cgtctcctca gctagcgaat tctcga 456
<210> 40
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL15 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 40
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Ser
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 41
<211> 456
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL16 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 41
cggaattcgg cccaccggtg gccaccatgg actggacctg gaggatcctc ttcttggtgg 60
cagcagccac aggagcccac tccgaagtgc agctggtgga gtctggagga ggcttggtca 120
agcctggcgg gtccctgcgg gtcagctgcg cagcctctgg attcacattt agctattctt 180
ggatgaactg ggtgcggcag gctcctggaa agggcctcga gtgggtggga cggatctttc 240
ccggcgatgg ggatactgac tacaatggga aattcaaggg cagagtcaca attaccgccg 300
acaaatccac tagcacagcc tatatggagc tgagcagcct gagatctgag gacacggccg 360
tgtattactg tgcaagaaat gtctttgatg gttactggct tgtttactgg ggccagggaa 420
ccctggtcac cgtctcctca gctagcgaat tctcga 456
<210> 42
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL16 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 42
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Val Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 43
<211> 456
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция B-HL17 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 43
cggaattcgg cccaccggtg gccaccatgg actggacctg gaggatcctc ttcttggtgg 60
cagcagccac aggagcccac tccgaagtgc agctggtgga gtctggagga ggcttggtca 120
agcctggcgg gtccctgcgg ctctcctgcg cagcctctgg attcacattt agctattctt 180
ggatgaactg ggtgcggcag gctcctggaa agggcctcga gtgggtggga cggatctttc 240
ccggcgatgg ggatactgac tacaatggga aattcaaggg cagagtcaca attaccgccg 300
acaaatccac tagcacagcc tatatggagc tgagcagcct gagatctgag gacacggccg 360
tgtattactg tgcaagaaat gtctttgatg gttactggct tgtttactgg ggccagggaa 420
ccctggtcac cgtctcctca gctagcgaat tctcga 456
<210> 44
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HL17 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 44
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 45
<211> 57
<212> ДНК
<213> Homo sapiens
<400> 45
atggactgga cctggaggat cctcttcttg gtggcagcag ccacaggagc ccactcc 57
<210> 46
<211> 19
<212> БЕЛОК
<213> Homo sapiens
<400> 46
Met Asp Trp Thr Trp Arg Ile Leu Phe Leu Val Ala Ala Ala Thr Gly
1 5 10 15
Ala His Ser
<210> 47
<211> 345
<212> ДНК
<213> Искусственная
<220>
<223> B-KV1 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 47
gatatcgtga tgacccagac tccactctcc ctgcccgtca cccctggaga gcccgccagc 60
attagctgca ggtctagcaa gagcctcttg cacagcaatg gcatcactta tttgtattgg 120
tacctgcaaa agccagggca gtctccacag ctcctgattt atcaaatgtc caaccttgtc 180
tctggcgtcc ctgaccggtt ctccggatcc gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggagtt tattactgcg ctcagaatct agaacttcct 300
tacaccttcg gcggagggac caaggtggag atcaaacgta cggtg 345
<210> 48
<211> 114
<212> БЕЛОК
<213> Искусственная
<220>
<223> B-KV1 модифицированной антигенсвязывающей молекулы мыши/
<400> 48
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 49
<211> 66
<212> ДНК
<213> Homo sapiens
<400> 49
atggacatga gggtccccgc tcagctcctg ggcctcctgc tgctctggtt cccaggtgcc 60
aggtgt 66
<210> 50
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<400> 50
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Phe Pro Gly Ala Arg Cys
20
<210> 51
<211> 360
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция I-HHD модифицированной антигенсвязывающей молекулы мыши/человека
<400> 51
caggtgcagc tggtgcagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cctctggttt cacattcact gactacaaga tacactgggt gcgacaggcc 120
cctggacaag ggctcgagtg gatgggatat ttcaacccta acagcggtta tagtacctac 180
gcacagaagt tccagggcag ggtcaccatt accgcggaca aatccacgag cacagcctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gagactatcc 300
ccaggcggtt actatgttat ggatgcctgg ggccaaggga ccaccgtgac cgtctcctca 360
<210> 52
<211> 120
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция I-HHD модифицированной антигенсвязывающей молекулы мыши/человека
<400> 52
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Lys Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Phe Asn Pro Asn Ser Gly Tyr Ser Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ser Pro Gly Gly Tyr Tyr Val Met Asp Ala Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 53
<211> 366
<212> ДНК
<213> Искусственная
<220>
<223> Конструкция M-HHA модифицированной антигенсвязывающей молекулы мыши/человека
<400> 53
gaagtgcagc tggtggagtc tggaggaggc ttggtcaagc ctggcgggtc cctgcggctc 60
tcctgtgcag cctccggatt cacatttagc aactattgga tgaactgggt gcggcaggct 120
cctggaaagg gcctcgagtg ggtgggagag atcagattga aatccaataa cttcggaaga 180
tattacgctg caagcgtgaa gggccggttc accatcagca gagatgattc caagaacacg 240
ctgtacctgc agatgaacag cctgaagacc gaggatacgg ccgtgtatta ctgtaccaca 300
tacggcaact acgttgggca ctacttcgac cactggggcc aagggaccac cgtcaccgtc 360
tccagt 366
<210> 54
<211> 122
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция M-HHA модифицированной антигенсвязывающей молекулы мыши/человека
<400> 54
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Lys Ser Asn Asn Phe Gly Arg Tyr Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Tyr Gly Asn Tyr Val Gly His Tyr Phe Asp His Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 55
<211> 122
<212> БЕЛОК
<213> Искусственная
<220>
<223> IF5-VH - химерный полипептид мыши/человека
<400> 55
Gln Val Gln Leu Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser His Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Thr
115 120
<210> 56
<211> 120
<212> БЕЛОК
<213> Искусственная
<220>
<223> B9E9-VH - химерный полипептид мыши/человека
<400> 56
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gln Leu Arg Pro Asn Tyr Trp Tyr Phe Asp Val Trp Gly
100 105 110
Ala Gly Thr Thr Val Thr Val Ser
115 120
<210> 57
<211> 121
<212> БЕЛОК
<213> Искусственная
<220>
<223> C2B8-VH - химерный полипептид мыши/человека
<400> 57
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Arg Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Thr Tyr Tyr Gly Gly Asp Trp Tyr Phe Asn Val Trp Gly
100 105 110
Ala Gly Thr Thr Val Thr Val Ser Ala
115 120
<210> 58
<211> 121
<212> БЕЛОК
<213> Искусственная
<220>
<223> 2H7-VH - химерный полипептид мыши/человека
<400> 58
Gln Ala Tyr Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Arg Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Val Val Tyr Tyr Ser Asn Ser Tyr Trp Tyr Phe Asp Val Trp
100 105 110
Gly Thr Gly Thr Thr Val Thr Val Ser
115 120
<210> 59
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> B-lyl-VH - химерный полипептид мыши/человека
<400> 59
Glu Val Lys Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Lys Leu Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Thr Ser Leu Thr Ser Val Asp Ser Ala Val Tyr Leu Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 60
<211> 122
<212> БЕЛОК
<213> Искусственная
<220>
<223> 2F2-VH - химерный полипептид мыши/человека
<400> 60
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 61
<211> 122
<212> БЕЛОК
<213> Искусственная
<220>
<223> 7D8-VH - химерный полипептид мыши/человека
<400> 61
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Asp Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Trp Asn Ser Gly Thr Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 62
<211> 125
<212> БЕЛОК
<213> Искусственная
<220>
<223> 11B8-VH - химерный полипептид мыши/человека
<400> 62
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val His Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Gly Ser Gly Phe Thr Phe Ser Tyr His
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ile Ile Gly Thr Gly Gly Val Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Tyr Tyr Gly Ala Gly Ser Phe Tyr Asp Gly Leu Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 63
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 63
Gly Ala Glu Val Lys Lys
1 5
<210> 64
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 64
Gly Pro Thr Leu Val Lys
1 5
<210> 65
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность по нумерации Kabat модифицированной
<400> 65
Gly Pro Val Leu Val Lys
1 5
<210> 66
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 66
Gly Pro Ala Leu Val Lys
1 5
<210> 67
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 67
Gly Gly Gly Leu Val Gln
1 5
<210> 68
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 68
Gly Gly Gly Leu Val Lys
1 5
<210> 69
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 69
Gly Gly Gly Leu Val Glu
1 5
<210> 70
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 70
Gly Gly Gly Val Val Arg
1 5
<210> 71
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 71
Gly Gly Gly Val Val Gln
1 5
<210> 72
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 72
Gly Gly Val Val Val Gln
1 5
<210> 73
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 73
Gly Gly Gly Leu Ile Gln
1 5
<210> 74
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 74
Arg Gly Val Leu Val Gln
1 5
<210> 75
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 75
Gly Pro Gly Leu Val Lys
1 5
<210> 76
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 76
Gly Ser Gly Leu Val Lys
1 5
<210> 77
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 77
Gly Ala Gly Leu Leu Lys
1 5
<210> 78
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 78
Gly Ser Glu Leu Lys Lys
1 5
<210> 79
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 8-13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 79
Gly His Glu Val Lys Gln
1 5
<210> 80
<211> 987
<212> ДНК
<213> Homo sapiens
<400> 80
accaagggcc catcggtctt ccccctggca ccctcctcca agagcacctc tgggggcaca 60
gcggccctgg gctgcctggt caaggactac ttccccgaac cggtgacggt gtcgtggaac 120
tcaggcgccc tgaccagcgg cgtgcacacc ttcccggctg tcctacagtc ctcaggactc 180
tactccctca gcagcgtggt gaccgtgccc tccagcagct tgggcaccca gacctacatc 240
tgcaacgtga atcacaagcc cagcaacacc aaggtggaca agaaagcaga gcccaaatct 300
tgtgacaaaa ctcacacatg cccaccgtgc ccagcacctg aactcctggg gggaccgtca 360
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 420
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 480
gacggcgtgg aggtgcataa tgccaagaca aagccgcggg aggagcagta caacagcacg 540
taccgtgtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 600
aagtgcaagg tctccaacaa agccctccca gcccccatcg agaaaaccat ctccaaagcc 660
aaagggcagc cccgagaacc acaggtgtac accctgcccc catcccggga tgagctgacc 720
aagaaccagg tcagcctgac ctgcctggtc aaaggcttct atcccagcga catcgccgtg 780
gagtgggaga gcaatgggca gccggagaac aactacaaga ccacgcctcc cgtgctggac 840
tccgacggct ccttcttcct ctacagcaag ctcaccgtgg acaagagcag gtggcagcag 900
gggaacgtct tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacgcagaag 960
agcctctccc tgtctccggg taaatga 987
<210> 81
<211> 328
<212> БЕЛОК
<213> Homo sapiens
<400> 81
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
1 5 10 15
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
20 25 30
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
35 40 45
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
50 55 60
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
65 70 75 80
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Ala
85 90 95
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
100 105 110
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
115 120 125
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
130 135 140
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
145 150 155 160
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
165 170 175
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
180 185 190
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
195 200 205
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
210 215 220
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
225 230 235 240
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
245 250 255
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
260 265 270
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
275 280 285
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
290 295 300
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
305 310 315 320
Ser Leu Ser Leu Ser Pro Gly Lys
325
<210> 82
<211> 618
<212> ДНК
<213> Homo sapiens
<400> 82
ctcatgaata tgcaaataac ctgagattta ctgaagtaaa tacagatctg tcctgtgccc 60
tgagagcatc acccagcaac cacatctgtc ctctagagaa tcccctgaga gctccgttcc 120
tcaccatgga ctggacctgg aggatcctct tcttggtggc agcagccaca ggtaagaggc 180
tccctagtcc cagtgatgag aaagaggatt gagtccagtc cagggagatc tcatccactt 240
ctgtgttctc tccacaggag cccactccca ggtgcagctg gtgcagtctg gggctgaggt 300
gaagaagcct ggggcctcag tgaaggtctc ctgcaaggct tctggataca ccttcaccgg 360
ctactatatg cactgggtgc gacaggcccc tggacaaggg cttgagtgga tgggacggat 420
caaccctaac agtggtggca caaactatgc acagaagttt cagggcaggg tcaccagtac 480
cagggacacg tccatcagca cagcctacat ggagctgagc aggctgagat ctgacgacac 540
ggtcgtgtat tactgtgcga gagacacagt gtgaaaaccc acatcctgag ggtgtcagaa 600
accccaggga ggaggcag 618
<210> 83
<211> 613
<212> ДНК
<213> Homo sapiens
<400> 83
ccagctccac cctcctctgg gttgaaaaag ccgagcacag gtaccagctc agtgactcct 60
gtgcaccacc atggacacac tttgctccac gctcctgctg ctgaccatcc cttcatgtga 120
gtgctgtggt cagggactcc ttcacgggtg aaacatcagt tttcttgttt gtgggcttca 180
tcttcttatg ctttctccac aggggtcttg tcccagatca ccttgaagga gtctggtcct 240
acgctggtga aacccacaca gaccctcacg ctgacctgca ccttctctgg gttctcactc 300
agcactagtg gagtgggtgt gggctggatc cgtcagcccc caggaaaggc cctggagtgg 360
cttgcactca tttattggaa tgatgataag cgctacagcc catctctgaa gagcaggctc 420
accatcacca aggacacctc caaaaaccag gtggtcctta caatgaccaa catggaccct 480
gtggacacag ccacatatta ctgtgcacac agaccacaaa gacacagccc agggcacctc 540
ctgtacaaaa acccaggctg cttctcattg gtgctccctc cccacctctg cagaacagga 600
aagtctgtct gct 613
<210> 84
<211> 546
<212> ДНК
<213> Homo sapiens
<400> 84
agtgactcct gtgccccacc atggacacac tttgctacac actcctgctg ctgaccaccc 60
cttcctgtga gtgctgtggt cagggacttc ctcagaagtg aaacatcagt tgtctccttt 120
gtgggcttca tcttcttatg tcttctccac aggggtcttg tcccaggtca ccttgaagga 180
gtctggtcct gtgctggtga aacccacaga gaccctcacg ctgacctgca ccgtctctgg 240
gttctcactc agcaatgcta gaatgggtgt gagctggatc cgtcagcccc cagggaaggc 300
cctggagtgg cttgcacaca ttttttcgaa tgacgaaaaa tcctacagca catctctgaa 360
gagcaggctc accatctcca aggacacctc caaaagccag gtggtcctta ccatgaccaa 420
catggaccct gtggacacag ccacatatta ctgtgcacgg ataccacaga gacacagccc 480
aggatgcctc ctgtacaaga acctagctgc atctcagtgg tgctccctcc ctacctctgc 540
agaaca 546
<210> 85
<211> 460
<212> ДНК
<213> Homo sapiens
<400> 85
atggacatac tttgttccac gctcctgcta ctgactgtcc cgtcctgtga gtgctgtggt 60
caggtagtac ttcagaagca aaaaatctat tctctccttt gtgggcttca tcttcttatg 120
tcttctccac aggggtctta tcccaggtca ccttgaggga gtctggtcct gcgctggtga 180
aacccacaca gaccctcaca ctgacctgca ccttctctgg gttctcactc agcactagtg 240
gaatgtgtgt gagctggatc cgtcagcccc cagggaaggc cctggagtgg cttgcactca 300
ttgattggga tgatgataaa tactacagca catctctgaa gaccaggctc accatctcca 360
aggacacctc caaaaaccag gtggtcctta caatgaccaa catggaccct gtggacacag 420
ccacgtatta ctgtgcacgg ataccacaga gacacaccca 460
<210> 86
<211> 877
<212> ДНК
<213> Homo sapiens
<400> 86
acagcctatt cctccagcat cccactagag cttcttatat agtaggagac atgcaaatag 60
ggccctccct ctactgatga aaaccaaccc aaccctgacc ctgcaggtct cagagaggag 120
ccttagccct ggactccaag gcctttccac ttggtgatca gcactgagca cagaggactc 180
accatggaat tggggctgag ctgggttttc cttgttgcta ttttagaagg tgattcatgg 240
aaaactagga agattgagtg tgtgtggata tgagtgtgag aaacagtgga tttgtgtggc 300
agtttctgac cttggtgtct ctttgtttgc aggtgtccag tgtgaggtgc agctggtgga 360
gtctggggga ggcttggtcc agcctggggg gtccctgaga ctctcctgtg cagcctctgg 420
attcaccttt agtagctatt ggatgagctg ggtccgccag gctccaggga aggggctgga 480
gtgggtggcc aacataaagc aagatggaag tgagaaatac tatgtggact ctgtgaaggg 540
ccgattcacc atctccagag acaacgccaa gaactcactg tatctgcaaa tgaacagcct 600
gagagccgag gacacggctg tgtattactg tgcgagagac acagtgaggg gaagtcagtg 660
tgagcccaga cacaaacctc cctgcagggg tcccttggga ccaccagggg gcgacagggc 720
attgagcact gggctgtctc cagggcaggt gcaggtgctg ctgagggctg gcttcctgtc 780
gcggtctggg gctgcctcgt cgtcaaattt ccccaggaac ttctccagat ttacaattct 840
gtactgacat ttcatgtctc taaatgcaat acttttt 877
<210> 87
<211> 557
<212> ДНК
<213> Homo sapiens
<400> 87
ccaggagttt ccattcggtg atcagcactg aacacagagg actcaccatg gagtttgggc 60
tgagctgggt tttccttgtt gctataataa aaggtgattt atggagaact agagacattg 120
agtggacgtg agtgagataa gcagtgaata tatgtggcag tttctgacta ggttgtctct 180
gtgtttgcag gtgtccagtg tcaggtgcag ctggtggagt ctgggggagg cttggtcaag 240
cctggagggt ccctgagact ctcctgtgca gcctctggat tcaccttcag tgactactac 300
atgagctgga tccgccaggc tccagggaag gggctggagt gggtttcata cattagtagt 360
agtggtagta ccatatacta cgcagactct gtgaagggcc gattcaccat ctccagggac 420
aacgccaaga actcactgta tctgcaaatg aacagcctga gagccgagga cacggccgtg 480
tattactgtg cgagagacac agtgagggga agtcagtgtg agcccagaca caaacctccc 540
tgcagggggt cccttgg 557
<210> 88
<211> 727
<212> ДНК
<213> Homo sapiens
<400> 88
agatttaaga accttgcacc tggtacccgt tgctcttctt gtaaccattt gtcttttaag 60
ttgtttatca ctctgtaact attttgatta ttttgattct tgcatgtttt tacttctgta 120
aaattattac atttgagtcc ctctcccctt cctaaaccta ggtataaaat ttactcgagc 180
cccttcctcg tggccgagag aattttgagc atgagctgtc tctttggcag ccggcttaat 240
aaaggactct taattcgtct caaagtgtgg cgttttctta actcacctgg gtacaacagt 300
gcagctggtg gagtctgggg gaggcttggt agagcctggg gggtccctga gactctcctg 360
tgcagcctct ggattcacct tcagtaacag tgacatgaac tgggtccgcc aggctccagg 420
aaaggggctg gagtgggtat cgggtgttag ttggaatggc agtaggacgc actatgcaga 480
ctctgtgaag ggccgattca tcatctccag agacaattcc aggaacttcc tgtatcagca 540
aatgaacagc ctgaggcccg aggacatggc tgtgtattac tgtgtgagaa acactgtgag 600
aggacggaag tgtgagccca gacacaaacc tcctgcagga acgttggggg aaatcagctg 660
cagggggcgc tcaagaccca ctcatcagag tcaaccccag agcaggtgca catggaggct 720
gggtttt 727
<210> 89
<211> 514
<212> ДНК
<213> Homo sapiens
<400> 89
ggactcgcca tggagtttgg gctgagctgg gttttccttg ttgctatttt aaaaggtgat 60
tcatggatca atagagatgt tgagtgtgag tgaacacgag tgagagaaac agtggatttg 120
tgtggcagtt tctgaccagg gtgtctctgt gtttgcaggt gtccagtgtg aggtgcagct 180
ggtggagtct gggggaggtg tggtacggcc tggggggtcc ctgagactct cctgtgcagc 240
ctctggattc acctttgatg attatggcat gagctgggtc cgccaagctc cagggaaggg 300
gctggagtgg gtctctggta ttaattggaa tggtggtagc acaggttatg cagactctgt 360
gaagggccga ttcaccatct ccagagacaa cgccaagaac tccctgtatc tgcaaatgaa 420
cagtctgaga gccgaggaca cggccttgta tcactgtgcg agagacacag tgaggggaag 480
ccagtgagag cccagacaca aacgtccctg cagg 514
<210> 90
<211> 412
<212> ДНК
<213> Homo sapiens
<400> 90
tgattcatgg agaaatagag agactgagtg tgagtgaaca tgagtgagaa aaactggatt 60
tgtgtggcat tttctgataa cggtgtcctt ctgtttgcag gtgtccagtg tcaggtgcag 120
ctggtggagt ctgggggagg cgtggtccag cctgggaggt ccctgagact ctcctgtgca 180
gcgtctggat tcaccttcag tagctatggc atgcactggg tccgccaggc tccaggcaag 240
gggctggagt gggtggcagt tatatggtat gatggaagta ataaatacta tgcagactcc 300
gtgaagggcc gattcaccat ctccagagac aattccaaga acacgctgta tctgcaaatg 360
aacagcctga gagccgagga cacggctgtg tattactgtg cgagagacac ag 412
<210> 91
<211> 870
<212> ДНК
<213> Homo sapiens
<220>
<221> смешанные свойства
<222> (43)..(43)
<223> n обозначает a, c, g или t
<220>
<221> смешанные свойства
<222> (824)..(824)
<223> n обозначает a, c, g или t
<400> 91
catctgttac agaactcatt atatagtagg agacatccaa atngggtccc tccctctgct 60
gatgaaaacc agcccagccc tgaccctgca gctctgggag aggagcccca gccctgagat 120
tcccaggtgt ttccattcgg tgatcagcac tgaacacaga gaacgcacca tggagtttgg 180
actgagctgg gttttccttg ttgctatttt aaaaggtgat tcatggataa atagagatgt 240
tgagtgtgag tgaacatgag tgagagaaac agtggatatg tgtggcagtg tctgaccagg 300
gtgtctctgt gtttgcaggt gtccagtgtg aagtgcagct ggtggagtct gggggagtcg 360
tggtacagcc tggggggtcc ctgagactct cctgtgcagc ctctggattc acctttgatg 420
attataccat gcactgggtc cgtcaagctc cggggaaggg tctggagtgg gtctctctta 480
ttagttggga tggtggtagc acatactatg cagactctgt gaagggccga ttcaccatct 540
ccagagacaa cagcaaaaac tccctgtatc tgcaaatgaa cagtctgaga actgaggaca 600
ccgccttgta ttactgtgca aaagatacac agtgagggga agtcagcgag agcccagaca 660
aaaacctcgc tgcaggaaga caggaggggc ctgggctgca gaggccactc aagacacact 720
gagcataggg ttaactctgg gacaagttgc tcaggaaggt taagagctgg tttcctttca 780
gagtcttcac aaatttctcc atctaacagt ttccccagga accngtctag atctgtgatc 840
ttggatctgc tgaaactgcc tgtgtcacct 870
<210> 92
<211> 724
<212> ДНК
<213> Homo sapiens
<220>
<221> смешанные свойства
<222> (560)..(560)
<223> n обозначает a, c, g или t
<400> 92
ccattcggtg atcagcactg aacacagagg actcaccatg gagttttggc tgagctgggt 60
tttccttgtt gctattttaa aaggtgattc atggagaact agagatattg agtgtgagtg 120
aacacgagtg agagaaacag tggatatgtg tggcagtttc taaccaatgt ctctgtgttt 180
gcaggtgtcc agtgtgaggt gcagctggtg gagtctggag gaggcttgat ccagcctggg 240
gggtccctga gactctcctg tgcagcctct gggttcaccg tcagtagcaa ctacatgagc 300
tgggtccgcc aggctccagg gaaggggctg gagtgggtct cagttattta tagcggtggt 360
agcacatact acgcagactc cgtgaagggc cgattcacca tctccagaga caattccaag 420
aacacgctgt atcttcaaat gaacagcctg agagccgagg acacggccgt gtattactgt 480
gcgagagaca cagtgagggg aagtcattgt gcgcccagac acaaacctcc ctgcaggaac 540
gctgggggga aatcagcggn agggggcgct caggagccac tgatcagagt cagccccgga 600
ggcaggtgca gatggaggct gatttccttg tcaggatgtg gggacttttg tcttcttctg 660
acgggttccc caggggaacc tctctaagtt tagcattctg tgcctatgaa cgtcttctct 720
aagt 724
<210> 93
<211> 288
<212> ДНК
<213> Homo sapiens
<400> 93
gaggtgcagc tggtggagtc tcggggagtc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccgtcagt agcaatgaga tgagctgggt ccgccaggct 120
ccagggaagg gtctggagtg ggtctcatcc attagtggtg gtagcacata ctacgcagac 180
tccaggaagg gcagattcac catctccaga gacaattcca agaacacgct gcatcttcaa 240
atgaacagcc tgagagctga ggacacggct gtgtattact gtaagaaa 288
<210> 94
<211> 626
<212> ДНК
<213> Homo sapiens
<400> 94
catccctttt cacctcttta tacaaaggca ccacctacat gcaaatcctc acttaggcac 60
ccacaggaaa ccaccacaca tttccttaaa ttcagggtcc agctcacatg ggaaatactt 120
tctgagagct catgggcctc ctgcacaaga acatgaaaca cctgtggttc ttcctcctcc 180
tggtggcagc tcccagatgt gagtgtctca aggctgcaga catgggggta tgggaggtgc 240
ctctgatccc agggctcact gtgggtctct ctgttcacag gggtcctgtc tcaggtgcag 300
ctgcaggagt cgggcccagg actggtgaag cctccgggga ccctgtccct cacctgcgct 360
gtctctggtg gctccatcag cagtagtaac tggtggagtt gggtccgcca gcccccaggg 420
aaggggctgg agtggattgg ggaaatctat catagtggga gcaccaacta caacccgtcc 480
ctcaagagtc gagtcaccat atcagtagac aagtccaaga accagttctc cctgaagctg 540
agctctgtga ccgccgcgga cacggccgtg tattgctgtg cgagagacac agtgagggga 600
ggtgagtgtg agcccagaca caaacc 626
<210> 95
<211> 299
<212> ДНК
<213> Homo sapiens
<400> 95
cagctgcagc tgcaggagtc cggctcagga ctggtgaagc cttcacagac cctgtccctc 60
acctgcgctg tctctggtgg ctccatcagc agtggtggtt actcctggag ctggatccgg 120
cagccaccag ggaagggcct ggagtggatt gggtacatct atcatagtgg gagcacctac 180
tacaacccgt ccctcaagag tcgagtcacc atatcagtag acaggtccaa gaaccagttc 240
tccctgaagc tgagctctgt gaccgccgcg gacacggccg tgtattactg tgccagaga 299
<210> 96
<211> 410
<212> ДНК
<213> Homo sapiens
<400> 96
gggtcctgtc ccaggtgcag ctacagcagt ggggcgcagg actgttgaag ccttcggaga 60
ccctgtccct cacctgcgct gtctatggtg ggtccttcag tggttactac tggagctgga 120
tccgccagcc cccagggaag gggctggagt ggattgggga aatcaatcat agtggaagca 180
ccaactacaa cccgtccctc aagagtcgag tcaccatatc agtagacacg tccaagaacc 240
agttctccct gaagctgagc tctgtgaccg ccgcggacac ggctgtgtat tactgtgcga 300
gaggcacagt gaggggaggt gagtgtgagc ccagacaaaa acctccctgc aggtaggcag 360
agggggcggg cgcaggtact gctcaagacc agcaggtggc gcgcggcgcc 410
<210> 97
<211> 700
<212> ДНК
<213> Homo sapiens
<220>
<221> смешанные свойства
<222> (19)..(19)
<223> n обозначает a, c, g или t
<220>
<221> смешанные свойства
<222> (46)..(46)
<223> n обозначает a, c, g или t
<400> 97
aggttctggg ttataaacnc tgtagactcc tcccttcagg gcaggntgac caactatgca 60
aatgcaagtg ggggcctccc cacttaaacc cagggctccc ctccacagtg agtctccctc 120
actgcccagc tgggatctca gggcttcatt ttctgtcctc caccatcatg gggtcaaccg 180
ccatcctcgc cctcctcctg gctgttctcc aaggtcagtc ctgccgaggg cttgaggtca 240
cagaggagaa cgggtggaaa ggagcccctg attcaaattt tgtgtctccc ccacaggagt 300
ctgttccgag gtgcagctgg tgcagtctgg agcagaggtg aaaaagcccg gggagtctct 360
gaagatctcc tgtaagggtt ctggatacag ctttaccagc tactggatcg gctgggtgcg 420
ccagatgccc gggaaaggcc tggagtggat ggggatcatc tatcctggtg actctgatac 480
cagatacagc ccgtccttcc aaggccaggt caccatctca gccgacaagt ccatcagcac 540
cgcctacctg cagtggagca gcctgaaggc ctcggacacc gccatgtatt actgtgcgag 600
acacacagtg agagaaacca gccccgagcc cgtctaaaac cctccacacc gcaggtgcag 660
aatgagctgc tagagactca ctccccaggg gcctctctat 700
<210> 98
<211> 650
<212> ДНК
<213> Homo sapiens
<220>
<221> смешанные свойства
<222> (621)..(621)
<223> n обозначает a, c, g или t
<400> 98
agggcagtca ccagagctcc agacaatgtc tgtctccttc ctcatcttcc tgcccgtgct 60
gggcctccca tggggtcagt gtcagggaga tgccgtattc acagcagcat tcacagactg 120
aggggtgttt cactttgctg tttccttttg tctccaggtg tcctgtcaca ggtacagctg 180
cagcagtcag gtccaggact ggtgaagccc tcgcagaccc tctcactcac ctgtgccatc 240
tccggggaca gtgtctctag caacagtgct gcttggaact ggatcaggca gtccccatcg 300
agaggccttg agtggctggg aaggacatac tacaggtcca agtggtataa tgattatgca 360
gtatctgtga aaagtcgaat aaccatcaac ccagacacat ccaagaacca gttctccctg 420
cagctgaact ctgtgactcc cgaggacacg gctgtgtatt actgtgcaag agacacagtg 480
aggggaagtc agtgtgagcc cagacacaaa cctccctgca gggatgctca ggaccccaga 540
aggcacccag cactaccagc gcagggccca gaccaggagc aggtgtggag ttaagcaaaa 600
atggaacttc ttgctgtgtc ntaaactgtt gttgtttttt tttttttttt 650
<210> 99
<211> 388
<212> ДНК
<213> Homo sapiens
<400> 99
taaggggctc cccagtcact gggctgaggg agaaaccagc acagtcaagt gagacttcat 60
gcactcccat ctcctctcca caggtgccca ctcccaggtg cagctggtgc aatctgggtc 120
tgagttgaag aagcctgggg cctcagtgaa ggtttcctgc aaggcttctg gatacacctt 180
cactagctat gctatgaatt gggtgcgaca ggcccctgga caagggcttg agtggatggg 240
atggatcaac accaacactg ggaacccaac gtatgcccag ggcttcacag gacggtttgt 300
cttctccttg gacacctctg tcagcacggc atatctgcag atctgcagcc taaaggctga 360
ggacactgcc gtgtattact gtgcgaga 388
<210> 100
<211> 294
<212> ДНК
<213> Homo sapiens
<400> 100
caggtgcagc tggtgcagtc tggccatgag gtgaagcagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cagtttcacc acctatggta tgaattgggt gccacaggcc 120
cctggacaag ggcttgagtg gatgggatgg ttcaacacct acactgggaa cccaacatat 180
gcccagggct tcacaggacg gtttgtcttc tccatggaca cctctgccag cacagcatac 240
ctgcagatca gcagcctaaa ggctgaggac atggccatgt attactgtgc gaga 294
<210> 101
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 101
Gly Ala Glu Leu Lys Lys
1 5
<210> 102
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 102
Gly Ala Glu Val Val Lys
1 5
<210> 103
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 103
Gly Gly Glu Val Lys Lys
1 5
<210> 104
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Vh Sequence at Kabat positions 108-113 of mouse/human modified
antigen binding molecule
<400> 104
Gly Ala Gly Val Lys Lys
1 5
<210> 105
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 105
Gly Gly Gly Val Val Lys
1 5
<210> 106
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 106
Leu Val Thr Val Ser Ser
1 5
<210> 107
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 107
Leu Val Ile Val Ser Ser
1 5
<210> 108
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 108
Leu Val Thr Val Ile Ser
1 5
<210> 109
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 109
Leu Val Ile Val Ile Ser
1 5
<210> 110
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 110
Leu Val Gly Val Ser Ser
1 5
<210> 111
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 111
Leu Val Thr Val Gly Ser
1 5
<210> 112
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 112
Leu Val Gly Val Gly Ser
1 5
<210> 113
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 113
Leu Val Ala Val Ser Ser
1 5
<210> 114
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 114
Leu Val Thr Val Ala Ser
1 5
<210> 115
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 115
Leu Val Ala Val Ala Ser
1 5
<210> 116
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 116
Leu Val Val Val Ser Ser
1 5
<210> 117
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 117
Leu Val Thr Val Val Ser
1 5
<210> 118
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 118
Leu Val Val Val Val Ser
1 5
<210> 119
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 119
Leu Val Leu Val Ser Ser
1 5
<210> 120
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 120
Leu Val Thr Val Leu Ser
1 5
<210> 121
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 121
Leu Val Leu Val Leu Ser
1 5
<210> 122
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 122
Leu Val Ser Val Ser Ser
1 5
<210> 123
<211> 6
<212> БЕЛОК
<213> Искусственная
<220>
<223> Последовательность Vh по нумерации Kabat 108-113 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 123
Leu Val Thr Val Thr Ser
1 5
<210> 124
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH2A модифицированной антигенсвязывающей молекулы мыши/человека
<400> 124
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Leu Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 125
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH2B модифицированной антигенсвязывающей молекулы мыши/человека
<400> 125
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 126
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH2C модифицированной антигенсвязывающей молекулы мыши/человека
<400> 126
Gln Val Gln Leu Val Gln Ser Gly Gly Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 127
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH2D модифицированной антигенсвязывающей молекулы мыши/человека
<400> 127
Gln Val Gln Leu Val Gln Ser Gly Ala Gly Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 128
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH2E модифицированной антигенсвязывающей молекулы мыши/человека
<400> 128
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Ile Val Ser Ser
115
<210> 129
<211> 119
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-HH2F модифицированной антигенсвязывающей молекулы мыши/человека
<400> 129
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ile Ser
115
<210> 130
<211> 115
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-KV10 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 130
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Ala Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val
115
<210> 131
<211> 115
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-KV11 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 131
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Pro Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val
115
<210> 132
<211> 115
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-KV12 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 132
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Phe Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val
115
<210> 133
<211> 115
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-KV13 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 133
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Ala Ile Lys
100 105 110
Arg Thr Val
115
<210> 134
<211> 115
<212> БЕЛОК
<213> Искусственная
<220>
<223> Конструкция B-KV14 модифицированной антигенсвязывающей молекулы мыши/человека
<400> 134
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ala Lys
100 105 110
Arg Thr Val
115
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ЛЕЙКОТОКСИНОВ STAPHYLOCOCCUS AUREUS | 2019 |
|
RU2805969C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2019 |
|
RU2797268C2 |
| САЙТ-СПЕЦИФИЧЕСКАЯ КОНЪЮГАЦИЯ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПОСРЕДСТВОМ ГЛИКОИНЖЕНЕРИИ | 2014 |
|
RU2831409C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2810924C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2832669C2 |
| БИСПЕЦИФИЧЕСКИЕ 2+1 КОНТОРСТЕЛА | 2018 |
|
RU2797305C2 |
| АНТИТЕЛА К ENTPD2, ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ И СПОСОБЫ ПРИМЕНЕНИЯ АНТИТЕЛ И ВИДОВ КОМБИНИРОВАННОЙ ТЕРАПИИ | 2019 |
|
RU2790991C2 |
| Связывающие молекулы, специфичные в отношении CD73, и пути их применения | 2015 |
|
RU2730665C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2015 |
|
RU2723940C2 |



























































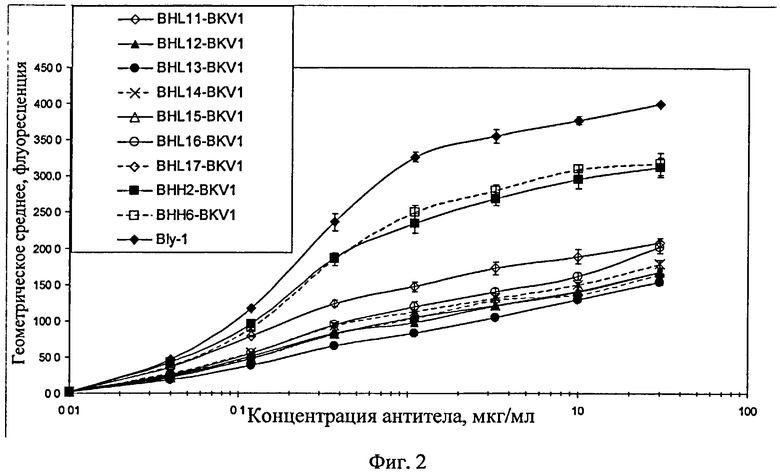



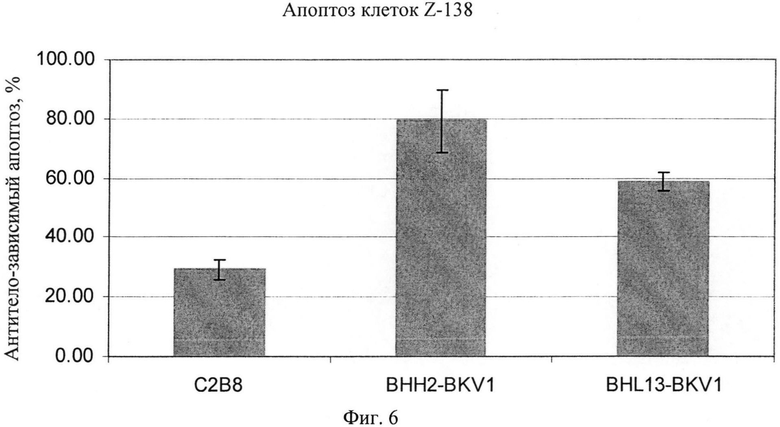
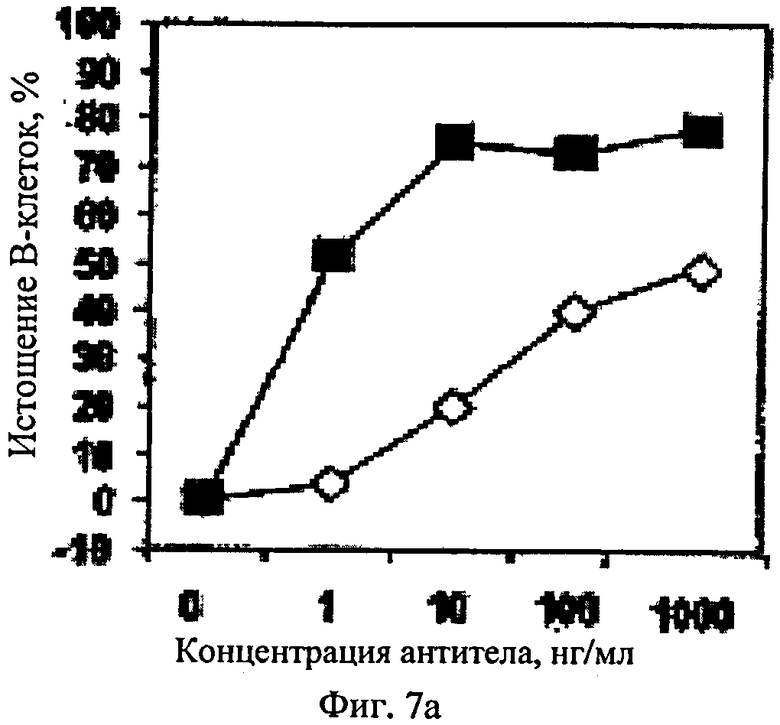

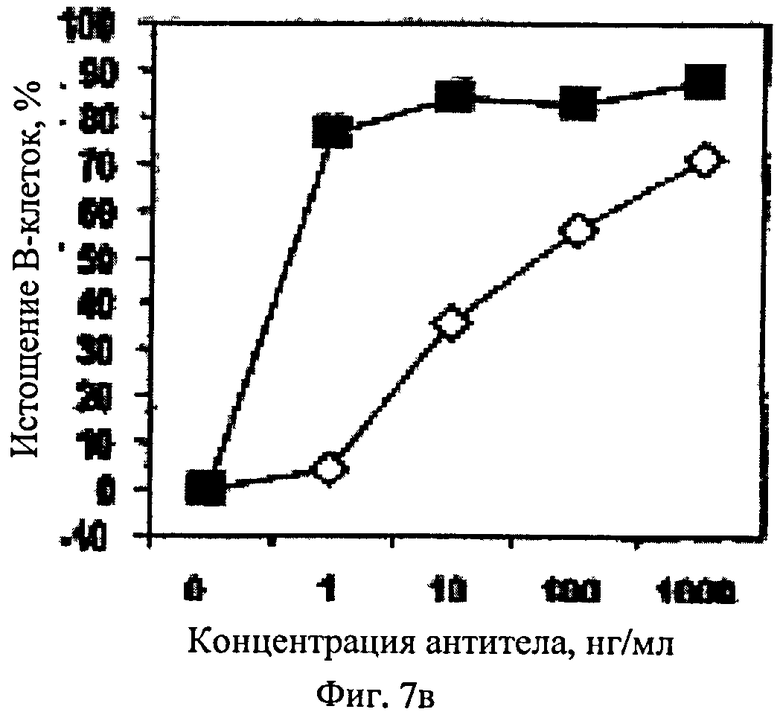

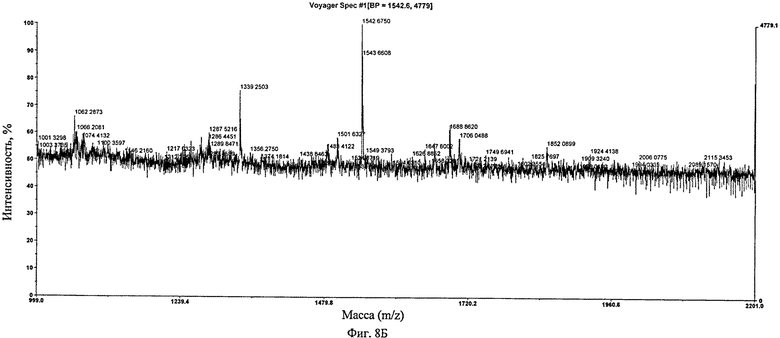
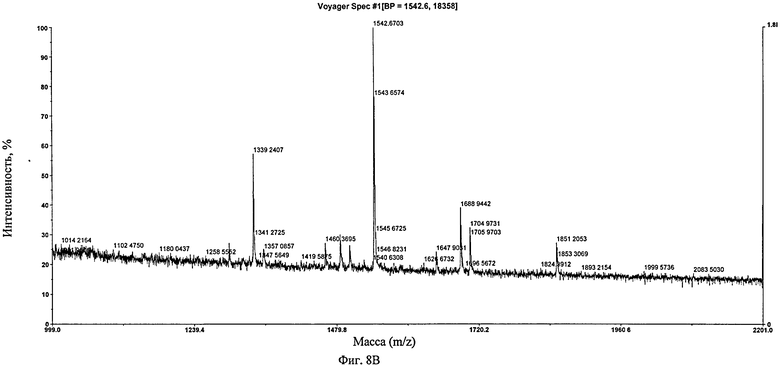
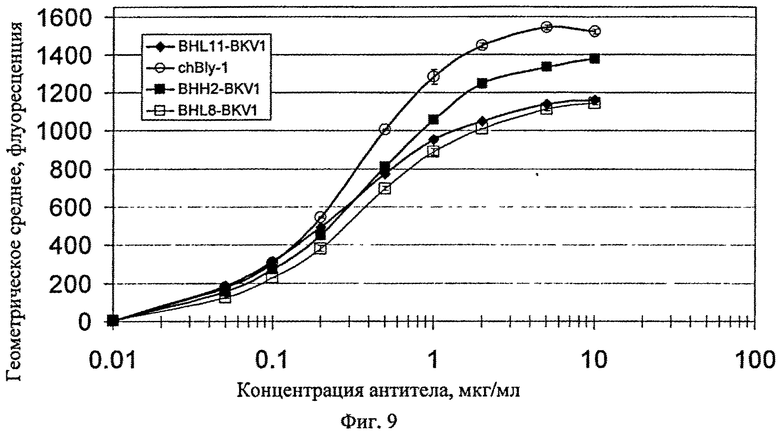
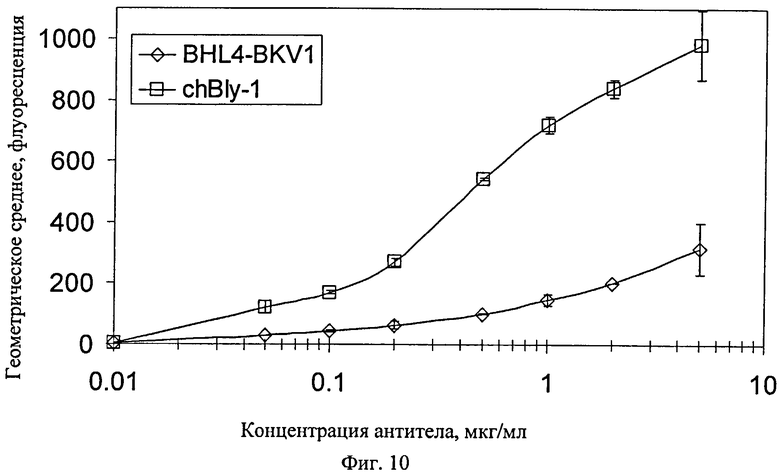
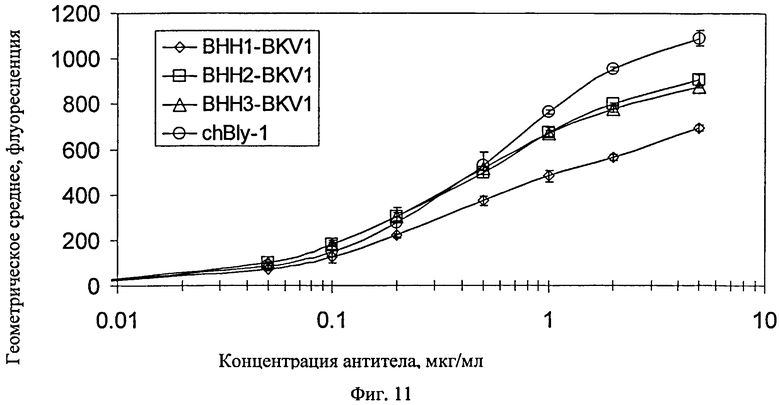
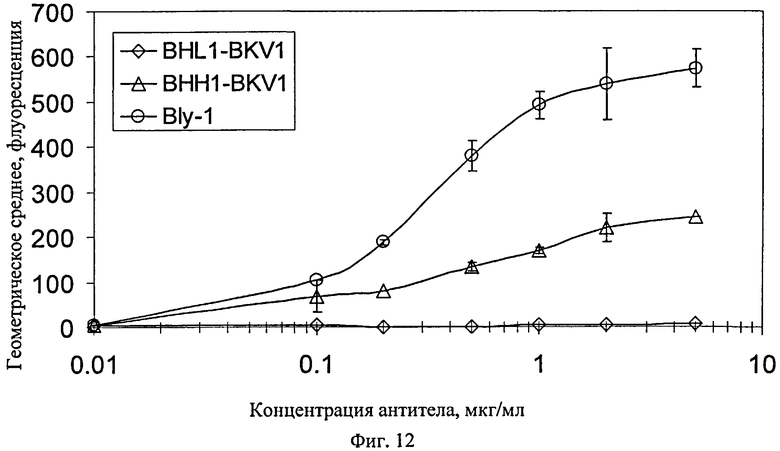
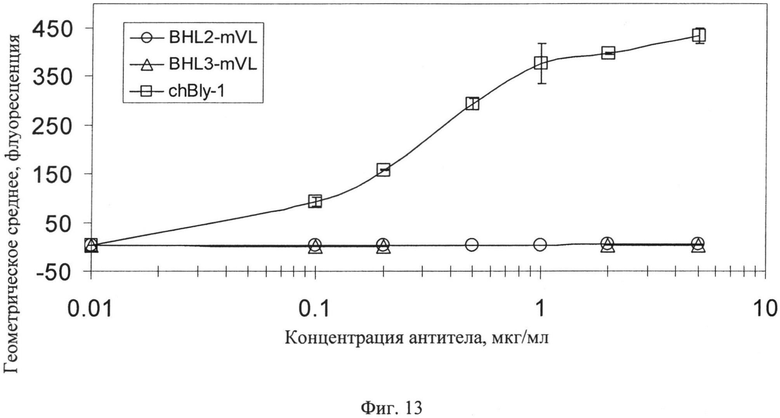
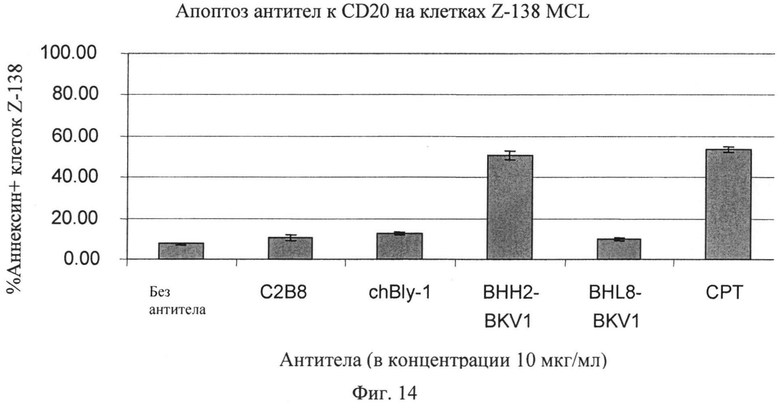
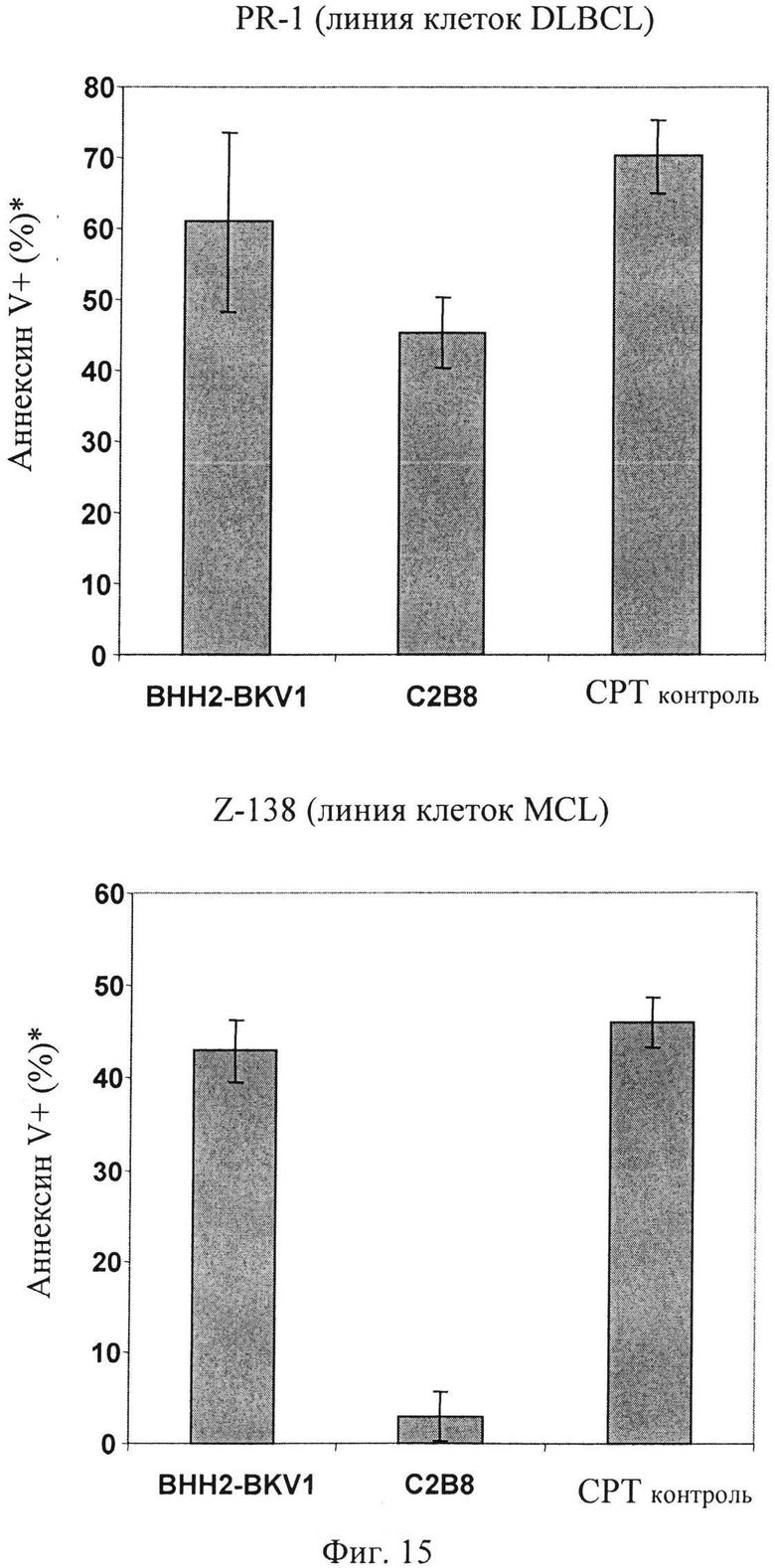
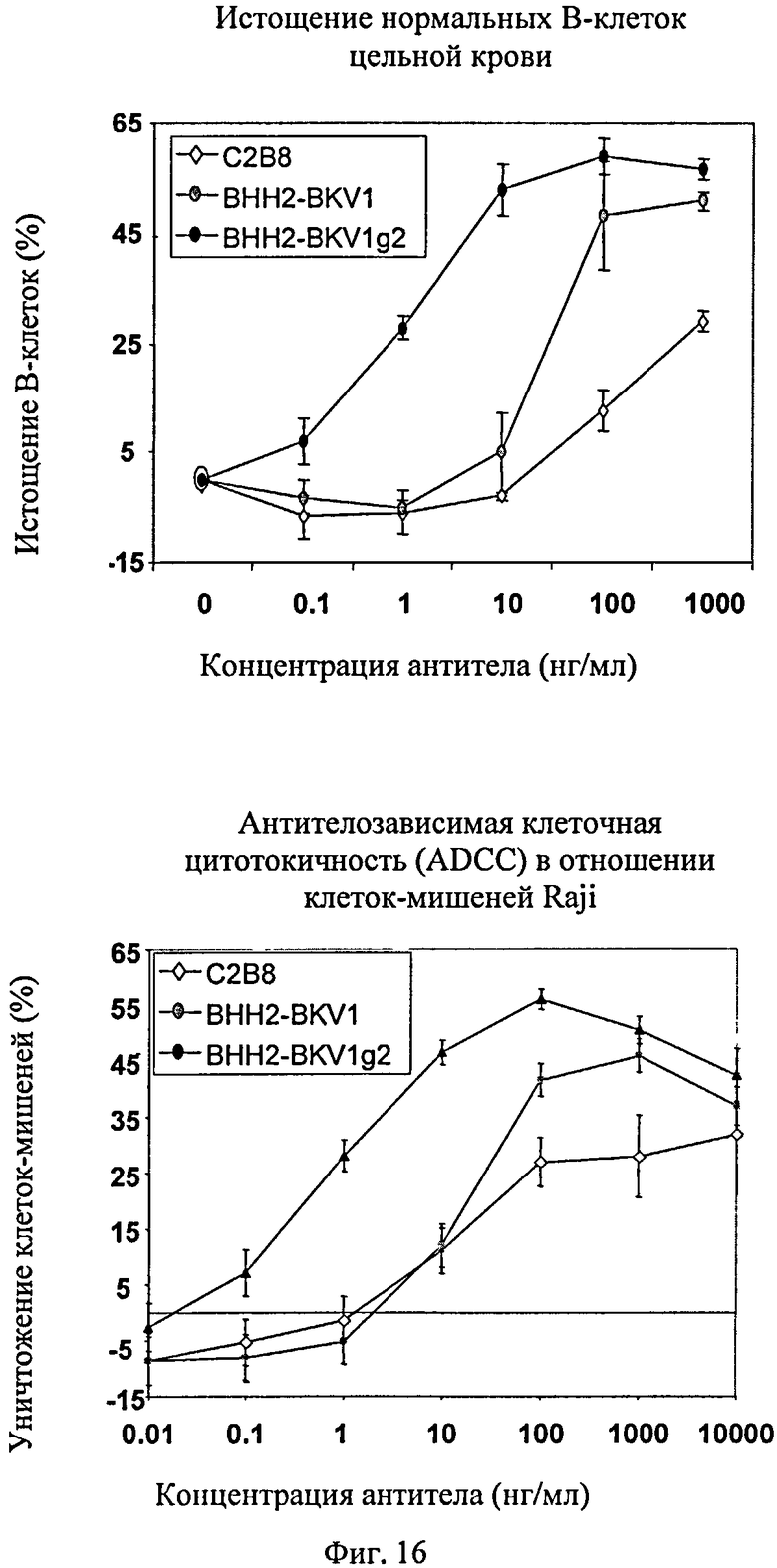
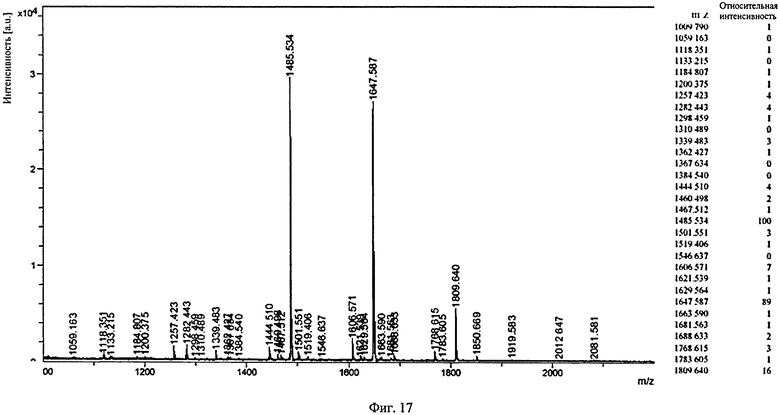
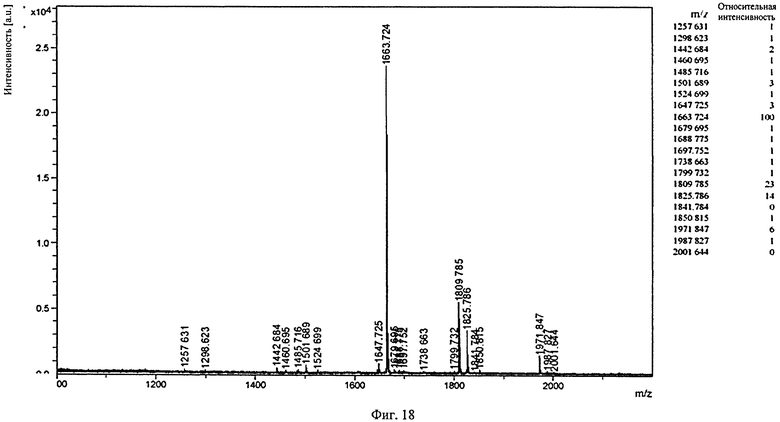
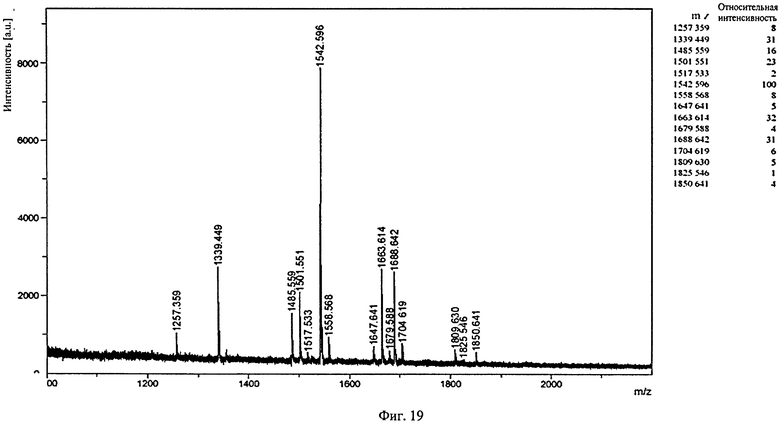
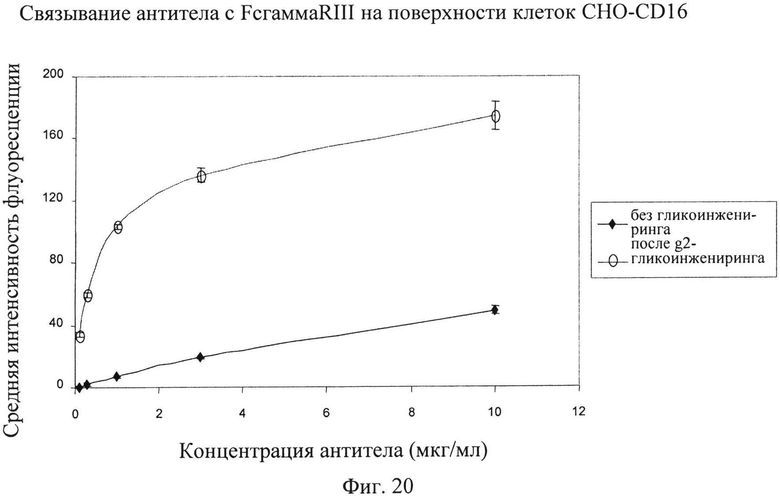
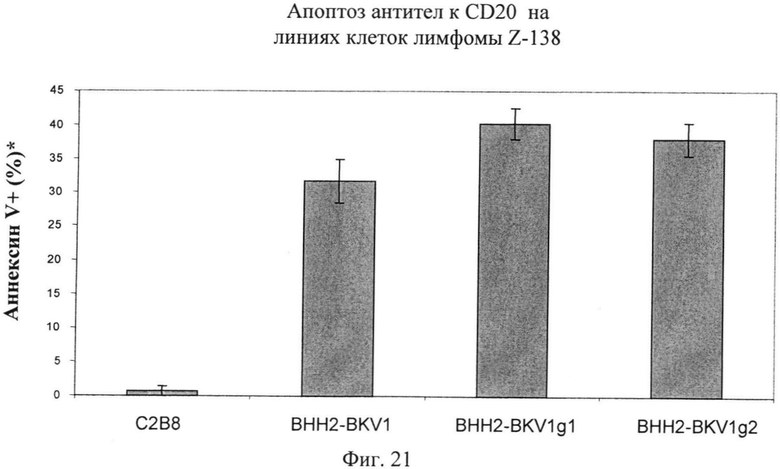
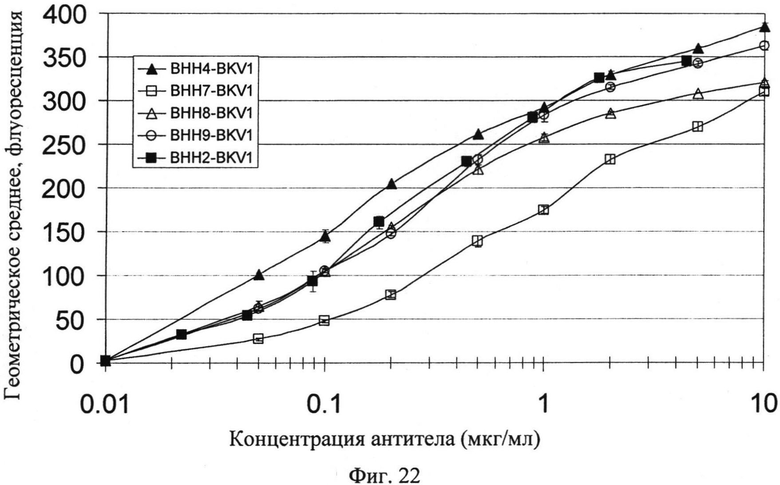
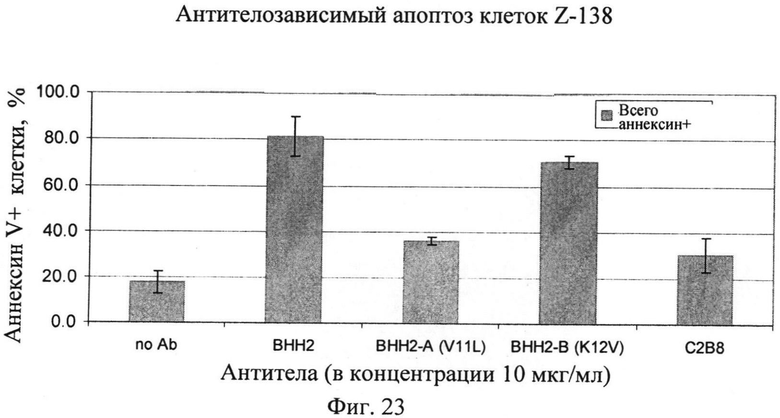
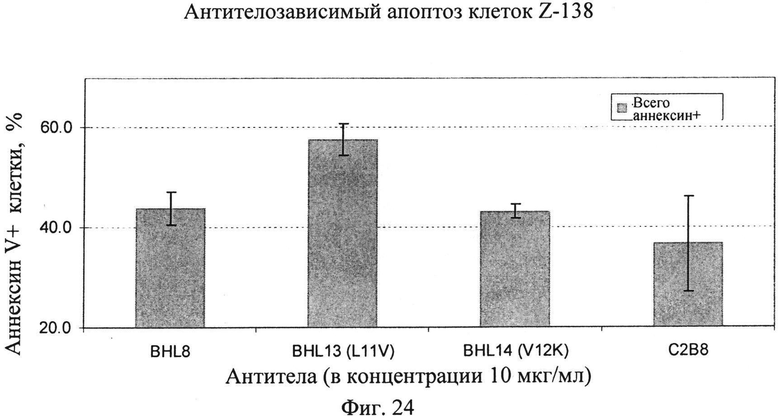
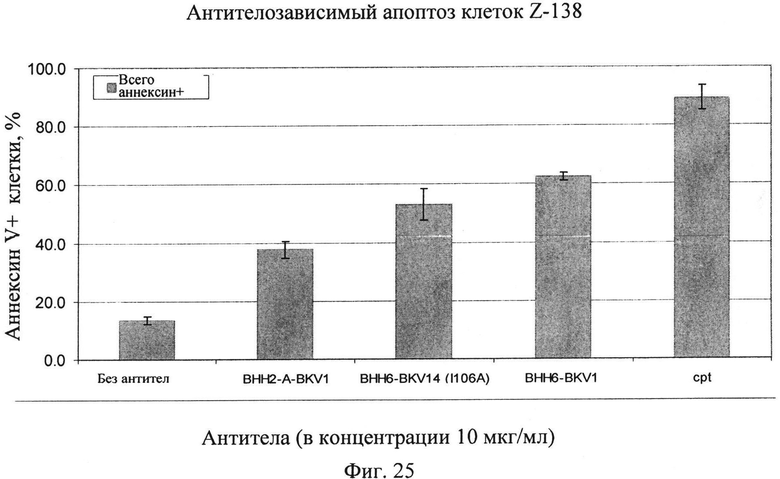
Изобретение относится к области иммунологии. Предложены варианты модифицированного антитела к CD20 или его антигенсвязывающего фрагмента. Каждый из вариантов характеризуется тем, что содержит вариабельную область лёгкой и тяжёлой цепи, и индуцирует более высокий уровень апоптоза, в сравнении с химерным B-Ly1 антителом. Предложены: смесь антител, в которой по меньшей мере 20% олигосахаридов в Fc области имеют разветвленную цепь и не фукозилированы, а также фармацевтическая композиция для производства лекарственного средства для лечения злокачественного гематологического или аутоиммунного заболевания на основе антител или смеси антител. Описаны: вектор экспрессии, клетка-хозяин на его основе, варианты кодирующих полинуклеотидов, а также способ получения антитела в клетке. Использование изобретений обеспечивает новые антитела с улучшенными терапевтическими свойствами, в том числе с повышенным связыванием рецептора Fc и с повышенной эффекторной функцией, что может найти применение для лечения злокачественного гематологического или аутоиммунного заболевания. 13 н. и 19 з.п. ф-лы, 3 пр., 9 табл., 26 ил.
1. Модифицированное анти-CD20 антитело или его антигенсвязывающий фрагмент, причем указанное антитело или его антигенсвязывающий фрагмент вызывают более высокие уровни апоптоза при образовании комплекса с CD20, в сравнении с химерным В-Ly1 антителом при образовании комплекса с CD20, и где указанное антитело или его антигенсвязывающий фрагмент включает: первый полипептид, содержащий вариабельную область тяжелой цепи с последовательностями SEQ ID NO: 125, SEQ ID NO: 126 или SEQ ID NO: 127; и второй полипептид, содержащий вариабельную область легкой цепи с последовательностью SEQ ID NO:48.
2. Антитело или его антигенсвязывающий фрагмент по п.1, причем указанное антитело или его антигенсвязывающий фрагмент включают первый полипептид, включающий вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 125, и второй полипептид, включающий вариабельную область легкой цепи с последовательностью SEQ ID NO: 48.
3. Антитело или его антигенсвязывающий фрагмент по п.1, причем указанное антитело или его антигенсвязывающий фрагмент включают первый полипептид, включающий вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 126, и второй полипептид, включающий вариабельную область легкой цепи с последовательностью SEQ ID NO: 48.
4. Антитело или его антигенсвязывающий фрагмент по п.1, причем указанное антитело или его антигенсвязывающий фрагмент включают первый полипептид, включающий вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 127, и второй полипептид, включающий вариабельную область легкой цепи с последовательностью SEQ ID NO: 48.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-4, причем указанное антитело или его антигенсвязывающий фрагмент включает Fc область, в которой была проведена глико-инженерная модификация для увеличения количества разветвленных нефукозилированных олигосахаридов.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-4, причем указанное антитело или его антигенсвязывающий фрагмент включает Fc область с N-связанными олигосахаридами, которая модифицирована для увеличения по меньшей мере одной эффекторной функции, увеличения аффинности связывания Fc рецептора, или увеличения по меньшей мере одной эффекторной функции и увеличения аффинности связывания Fc рецептора.
7. Смесь антител или его антигенсвязывающих фрагментов для усиления эффекторной функции и/или увеличения аффиности к Fc-рецептору, содержащая антитело или его антигенсвязывающий фрагмент по п.6, причем по меньшей мере 20% олигосахаридов в Fc области указанного антитела или его антигенсвязывающего фрагмента имеют разветвлённую цепь и не фуколизированы.
8. Смесь по п.7, причем по меньшей мере 50% олигосахаридов в Fc области не фуколизированы.
9. Клетка-хозяин для экспрессии антитела или его антигенсвязывающего фрагмента по любому из пп.5-6 или смеси по пп.7-8, причем указанная клетка-хозяин включает один или более полинуклеотид, кодирующий указанные тяжелые и легкие цепи, и по меньшей мере одну нуклеиновую кислоту, кодирующий полипептид, обладающий активностью β(1,4)-N-ацетилглюкозаминилтрансферазы III, которые экспрессируются в количествах, достаточных для глико-инженерной модификации Fc области.
10. Клетка-хозяин по п.9, причем указанная клетка-хозяин дополнительно экспрессирует нуклеиновую кислоту, кодирующую полипептид с активностью маннозидазы II.
11. Клетка-хозяин по п.9, причем указанное антитело или его антигенсвязывающий фрагмент, произведенный указанной клеткой-хозяином, демонстрирует увеличенную аффинность связывания Fc рецептора в результате указанной глико-инженерной модификации.
12. Клетка-хозяин по п.11, причем указанный Fc рецептор представляет собой рецептор FcγRIIIA.
13 Клетка-хозяин по п.9, причем указанное антитело или его антигенсвязывающий фрагмент, произведенный указанной клеткой-хозяином, демонстрирует усиленную эффекторную функцию в результате указанной глико-инженерной модификации.
14. Клетка-хозяин по п.12, причем усиленнная эффекторная функция представляет собой усиленную Fc клеточно-опосредованную цитотоксичность.
15. Клетка-хозяин по п.12, в которой указанная усиленная эффекторная функция представляет собой увеличенную антителозависимую клеточно-опосредованную цитотоксичность.
16. Клетка-хозяин по п.9, включающая по меньшей мере один трансфецированный полинуклеотид, кодирующий первый и второй полипептиды, которые представляют собой: первый полипептид, включающий вариабельную область тяжелой цепи с последовательностями SEQ ID NO: 125, SEQ ID NO: 126 или SEQ ID NO: 127; и второй полипептид, включающий вариабельную область легкой цепи с последовательностью SEQ ID NO: 48; причем указанный полинуклеотид включает последовательность, кодирующую область, эквивалентную Fc области человеческого иммуноглобулина.
17. Фармацевтическая композиция, включающая антитело или его антигенсвязывающий фрагмент по любому из пп.1-6 или их смесь по пп.7-8 в эффективном количестве, а также фармацевтически приемлемый носитель для производства лекарственного средства для лечения злокачественного гематологического заболевания или аутоиммунного заболевания.
18. Фармацевтическая композиция по п.17, причем указанное злокачественное гематологическое заболевание представляет собой В-клеточную лимфому, неходжкинскую лимфому или В-клеточную хроническую лимфоцитарную лейкемию.
19. Фармацевтическая композиция по п.17, причем указанное аутоиммунное заболевание представляет собой ревматоидный артрит или волчанку.
20. Фармацевтическая композиция по п.17, причем указанное злокачественное гематологическое заболевание представляет собой B-клеточную лимфому.
21. Выделенный полинуклеотид, кодирующий вариабельную область тяжелой цепи антитела или его антигенсвязывающего фрагмента по п.1, включающий последовательность SEQ ID NO: 125.
22. Выделенный полинуклеотид, кодирующий вариабельные области тяжелой и легкой цепи по п.1, включающий последовательность SEQ ID NO: 125 и SEQ ID NO: 48.
23. Выделенный полинуклеотид, кодирующий вариабельную область тяжелой цепи антитела или его антигенсвязывающего фрагмента по п.1, включающий последовательность SEQ ID NO: 126.
24. Выделенный полинуклеотид, кодирующий вариабельные области тяжелой и легкой цепи по п.1, включающий последовательность SEQ ID NO: 126 и SEQ ID NO: 48.
25. Выделенный полинуклеотид, кодирующий вариабельную область тяжелой цепи антитела или его антигенсвязывающего фрагмента по п.1, включающий последовательность SEQ ID NO: 127.
26. Выделенный полинуклеотид, кодирующий вариабельные области тяжелой и легкой цепи антитела или его антигенсвязывающего фрагмента по п.1, включающий последовательность SEQ ID NO: 127 и SEQ ID NO: 48.
27. Вектор экспрессии, включающий полинуклеотид по любому из пп.21-26.
28. Клетка-хозяин, включающая вектор экспрессии по п.27.
29. Способ производства в клетке-хозяине анти-CD20 антитела или его антигенсвязывающего фрагмента с Fc областью с модифицированными олигосахаридами и подвергнутой генно-инженерной модификации для усиления эффекторной функции, причем указанный способ включает: культивирование клетки-хозяина подвергнутой генно-инженерной модификации для экспрессии одной или более нуклеиновой кислоты, кодирующей указанное антитело или его антигенсвязывающий фрагмент и по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид обладающий активностью β(1,4)-N-ацетилглюкозаминилтрансферазы III; и выделение указанного антитела или его антигенсвязывающего фрагмента; причем указанное антитело или его антигенсвязывающий фрагмент представляют собой антитело или его антигенсвязывающий фрагмент по любому из пп.5-6 или смесь по пп.7-8.
30. Способ по п.29, в котором указанная клетка-хозяин подвергнута дополнительной генно-инженерной модификации для экспрессии нуклеиновой кислоты, кодирующей полипептид, обладающий активностью маннозидазы II.
31. Способ по п.29, в котором указанные модифицированные олигосахариды имеют меньшую степень фукозилирования по сравнению с немодифицированными олигосахаридами.
32. Способ по п.29, в котором указанное антитело или его антигенсвязывающий фрагмент, произведенные указанной клеткой-хозяином, включают увеличенную долю разветвлённых нефукозилированных олигосахаридов в Fc области.
| WO2005044859 A2, 19.05.2005 | |||
| PRESTA et al., "Antibody engineering for therapeutics", Current opinion in structural biology, 2003, 13 (4), с.519-525 | |||
| RU2003104016/15 A, 10.06.2004 | |||
| РОЙТ и др | |||
| "Иммунология", стр.110-113, 150-158. |
Авторы
Даты
2015-04-10—Публикация
2006-08-25—Подача