ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0001] Инфекции, вызываемые бактериальными патогенами, устойчивыми к противомикробным препаратам (AMR), представляют собой растущую угрозу для здоровья населения. Продолжающаяся эпидемия, вызванная AMR-патогенами, частично вызвана эмпирической терапией антибиотиками широкого спектра действия. Это привело к исследованию специфических в отношении патогенов способов, включая моноклональные антитела (mAb), для предотвращения или лечения серьезных бактериальных инфекций. В настоящее время разрабатываются некоторые моноклональные антитела для предотвращения или лечения устойчивых к антибиотикам бактериальных инфекций (см., например, DiGiandomenico, A., and B.R. Sellman, Curr. Opin. Microbiol., 27: 78-85, (2015)). Такие стратегии пассивной иммунизации обеспечивают немедленный и мощный иммуноглобулиновый ответ в отношении целевого патогена.
[0002] Staphylococcus aureus представляет собой бактериальный патоген, вызывающий широкий спектр заболеваний, включая инфекции кожи и мягких тканей, эндокардит, остеомиелит, пневмонию и бактериемию (Lowy, FD, N. Engl. J. Med., 339 (8): 520-32, (1998)). Доклинические исследования показывают, что подходы на основе моноклональных антител являются перспективными для профилактики и дополнительной терапии в отношении инфекций, вызванных S. aureus (см., например, Hazenbos et al., PLoS Pathog., 9(10):e1003653. doi: 10.1371/journal.ppat.10036532013 (2013); Rouha, H., MAbs, 7(1): 243-254 (2015); Foletti et al., J. Mol. Biol., 425(10): 1641-1654 (2013); Karauzum et al., J Biol Chem., 287(30): 25203-15 (2012); и Hua et al., Antimicrob Agents Chemother., 58(2): 1108-17, 2014). Однако остается потребность в антителах, полезных для лечения инфекций, вызываемых Staphylococcus aureus, в частности инфекций, устойчивых к доступным в настоящее время антибиотикам. В настоящем изобретении предусмотрены такие антитела.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0003] В данном документе предусмотрены антитела и их антигенсвязывающие фрагменты, которые связываются с лейкотоксином Staphylococcus aureus (S. aureus).
[0004] В определенных случаях антитело или его антигенсвязывающий фрагмент, которые специфически связываются c по меньшей мере одним лейкотоксином S. aureus, содержат определяющую комплементарность область (CDR) 1 вариабельной области тяжелой цепи (VH), CDR2 VH, CDR3 VH, CDR1 вариабельной области легкой цепи (VL), CDR2 VL и CDR3 VL, где CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL содержат последовательности, выбранные из группы, состоящей из: (а) SEQ ID NO:1, 2, 3, 12, 5 и 6 соответственно; (b) SEQ ID NO:1-6 соответственно; (c) SEQ ID NO:1, 2, 17, 4, 5 и 6 соответственно; (d) SEQ ID NO: 1, 2, 17, 12, 5 и 6 соответственно; и (e) SEQ ID NO: 1, 20, 3, 4, 5 и 6 соответственно.
[0005] В определенных случаях антитело или его антигенсвязывающий фрагмент, которые специфически связываются с по меньшей мере одним лейкотоксином S. aureus, содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL SAN481-SYT-YTE. В определенных случаях CDR представляют собой CDR, определенные по Kabat, CDR, определенные по Chothia, или CDR, определенные по AbM.
[0006] В определенных случаях антитело или его антигенсвязывающий фрагмент содержат VH и VL, где VH содержит аминокислотную последовательность под SEQ ID NO:7, 15, 18, 21 или 23. В определенных случаях антитело или его антигенсвязывающий фрагмент содержат VH и VL, где VL содержит аминокислотную последовательность под SEQ ID NO:8 или 13. В определенных случаях антитело или его антигенсвязывающий фрагмент содержат VH и VL, где VH и VL содержат последовательности, выбранные из группы, состоящей из: (а) SEQ ID NO:15 и 13 соответственно; (b) SEQ ID NO:7 и 8 соответственно; (c) SEQ ID NO:7 и 13 соответственно; (d) SEQ ID NO:15 и 8 соответственно; (e) SEQ ID NO:18 и 8 соответственно; (f) SEQ ID NO:18 и 13 соответственно; (g) SEQ ID NO:21 и 8 соответственно; и (h) SEQ ID NO:23 и 13 соответственно. В некоторых случаях антитело или его антигенсвязывающий фрагмент содержат VH, содержащую последовательность под SEQ ID NO:15, и VL, содержащую последовательность под SEQ ID NO:13. В определенных случаях антитело или антигенсвязывающий фрагмент содержат тяжелую цепь, содержащую последовательность под SEQ ID NO:16, 9, 11, 22 или 24. В определенных случаях антитело или антигенсвязывающий фрагмент содержат легкую цепь, содержащую последовательность под SEQ ID NO:14 или 10. В определенных случаях антитело содержит тяжелую цепь и легкую цепь, где тяжелая и легкая цепи содержат последовательности, выбранные из группы, состоящей из: (a) SEQ ID NO: 16 и 14 соответственно; (b) SEQ ID NO:9 и 10 соответственно; (c) SEQ ID NO:11 и 10 соответственно; (d) SEQ ID NO:11 и 14 соответственно; (e) SEQ ID NO:16 и 10 соответственно; (f) SEQ ID NO:19 и 10 соответственно; (g) SEQ ID NO:19 и 14 соответственно; (h) SEQ ID NO:22 и 10 соответственно; и (i) SEQ ID NO:24 и 14 соответственно. В некоторых случаях антитело содержит тяжелую цепь, содержащую последовательность под SEQ ID NO:16, и легкую цепь, содержащую последовательность под SEQ ID NO:14.
[0007] В некоторых случаях антитело или его антигенсвязывающий фрагмент, предусмотренные в данном документе, связываются с тем же эпитопом лейкотоксина S. aureus, что и антитело, содержащее VH, содержащую аминокислотную последовательность под SEQ ID NO:15, и VL, содержащую аминокислотную последовательность под SEQ ID NO:13.
[0008] В некоторых случаях антитело или его антигенсвязывающий фрагмент, предусмотренные в данном документе, конкурентно подавляют связывание антитела, содержащего VH, содержащую аминокислотную последовательность под SEQ ID NO:15, и VL, содержащую аминокислотную последовательность под SEQ ID NO:13, с лейкотоксином S. aureus.
[0009] В некоторых случаях антитело или антигенсвязывающий фрагмент связываются с LukF, LukD или HlgB, и/или антитело или антигенсвязывающий фрагмент нейтрализуют LukF, LukD или HlgB. В некоторых случаях антитело или антигенсвязывающий фрагмент (а) связываются с LukF, LukD и HlgB и/или (b) нейтрализуют LukF, LukD и HlgB.
[0010] В определенных случаях антитело или антигенсвязывающий фрагмент дополнительно содержат константную область тяжелой цепи. В определенных случаях константная область тяжелой цепи выбрана из группы, состоящей из константных областей тяжелой цепи человеческого иммуноглобулина IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. В определенных случаях константная область тяжелой цепи представляет собой константную область IgG1 человека.
[0011] В определенных случаях антитело или антигенсвязывающий фрагмент дополнительно содержат константную область легкой цепи. В определенных случаях константная область легкой цепи выбрана из группы, состоящей из константных областей легкой цепи человеческого иммуноглобулина IgGκ и IgGλ. В определенных случаях константная область легкой цепи представляет собой константную область легкой цепи человеческого IgGκ.
[0012] В определенных случаях антитело или его антигенсвязывающий фрагмент представляют собой антитело IgG или его антигенсвязывающий фрагмент.
[0013] В некоторых случаях антитело или антигенсвязывающий фрагмент содержат Fc-область, которая была сконструирована для увеличения периода полужизни. В определенных случаях антитело или его антигенсвязывающий фрагмент содержат Fc-область с мутацией YTE.
[0014] В определенных случаях антитело или антигенсвязывающий фрагмент представляют собой моноклональное антитело или антигенсвязывающий фрагмент.
[0015] В определенных случаях антитело или антигенсвязывающий фрагмент представляют собой полноразмерное антитело. В определенных случаях антитело или антигенсвязывающий фрагмент представляют собой антигенсвязывающий фрагмент. В определенных случаях антигенсвязывающий фрагмент включает Fab, Fab', F(ab')2, одноцепочечный Fv (scFv), связанный дисульфидной связью Fv, интратело, IgGΔCH2, миниантитело, F(ab')3, тетратело, триатело, диатело, DVD-Ig, Fcab, mAb2, (scFv)2 или scFv-Fc.
[0016] В определенных случаях антитело или его антигенсвязывающий фрагмент характеризуются аффинностью менее 75 пМ в отношении LukF, LukD и HlgB S. aureus. В определенных случаях антитело или его антигенсвязывающий фрагмент характеризуются сходной аффинностью связывания в отношении LukF, LukD и HIgB.
[0017] В определенных случаях антитело или его антигенсвязывающий фрагмент дополнительно содержат детектируемую метку.
[0018] В данном документе также предусмотрены композиции, содержащие антитело или его антигенсвязывающий фрагмент, предусмотренные в данном документе, и необязательно фармацевтически приемлемый носитель.
[0019] В данном документе также предусмотрены способы применения антитела, предусмотренного в данном документе. В определенных случаях способ лечения или предотвращения инфекции, вызываемой Staphylococcus aureus (S. aureus), у субъекта включает введение субъекту антитела или антигенсвязывающего фрагмента, предусмотренных в данном документе, или композиции, предусмотренной в данном документе. В определенных случаях инфекция, вызываемая S. aureus, представляет собой сепсис. В определенных случаях инфекция, вызываемая S. aureus, представляет собой бактериемию. В определенных случаях инфекция, вызываемая S. aureus, представляет собой пневмонию. В определенных случаях инфекция, вызываемая S. aureus, представляет собой пневмонию в ICU. В определенных случаях инфекция, вызываемая S. aureus, представляет собой инфекцию кожи или мягких тканей (SSTI). В определенных случаях инфекция, вызываемая S. aureus, представляет собой инфекцию нижних конечностей у больных диабетом. В определенных случаях инфекция, вызываемая S. aureus, представляет собой язву, обусловленную синдромом диабетической стопы (DFU). В определенных случаях DFU является неинфицированной. В определенных случаях DFU является инфицированной. В некоторых случаях DFU представляет собой DFU степени 1, 2 или 3. В определенных случаях инфекция, вызываемая S. aureus, представляет собой инфекцию костей или суставов. В определенных случаях инфекция, вызываемая S. aureus, представляет собой инфекцию суставов, инфекцию, ассоциированную с медицинским изделием в организме, раневую инфекцию, инфекцию области хирургического вмешательства или остеомиелит.
[0020] В некоторых случаях субъект представляет собой субъекта хирургического профиля.
[0021] В определенных случаях инфекция, вызываемая S. aureus, предусматривает инфекцию, вызванную устойчивым к антибиотикам S. aureus.
[0022] В определенных случаях у субъекта имеется диабет.
[0023] В определенных случаях субъектом является человек.
[0024] В определенных случаях лечение или предотвращение инфекции, вызываемой S. aureus, включает нейтрализацию токсина, подавление лизиса клеток, подавление полиорганной дисфункции, подавление сепсиса, ассоциированного с S. aureus, или любую комбинацию вышеперечисленного.
[0025] В данном документе также предусмотрены полинуклеотиды. В определенных случаях выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую VH или тяжелую цепь антитела или его антигенсвязывающий фрагмент, предусмотренные в данном документе. В определенных случаях выделенный полинуклеотид содержит молекулу нуклеиновой кислоты, кодирующую VL или легкую цепь антитела или его антигенсвязывающий фрагмент, предусмотренные в данном документе.
[0026] В данном документе также предусмотрены векторы. В определенных случаях в данном документе предусмотрен полинуклеотид.
[0027] В данном документе также предусмотрены клетки-хозяева. В определенных случаях клетка-хозяин содержит полинуклеотид, предусмотренный в данном документе, вектор, предусмотренный в данном документе, или первый вектор, полинуклеотид, предусмотренные в данном документе, и второй вектор, содержащий полинуклеотид, предусмотренный в данном документе. В определенных случаях клетка-хозяин выбрана из группы, состоящей из клеток CHO, NS0, PER-C6, HEK-293 и HeLa. В определенных случаях клетка-хозяин является изолированной.
[0028] В данном документе также предусмотрены способы получения антител или антигенсвязывающих фрагментов. В определенных случаях способ получения антитела или его антигенсвязывающего фрагмента включает культивирование клетки-хозяина, предусмотренной в данном документе, с обеспечением продуцирования антитела или его антигенсвязывающего фрагмента.
[0029] В данном документе также предусмотрены способы выявления S. aureus или лейкотоксина S. aureus. В определенных случаях способ выявления S. aureus или лейкотоксина S. aureus в образце включает приведение образца в контакт с антителом или его антигенсвязывающим фрагментом, предусмотренными в данном документе.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ИЗОБРАЖЕНИЙ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0030] На фигуре 1 представлены графики, показывающие активность множества вариантов SAN481 in vitro по сравнению с SAN481. QD1=SAN481-YTE; QD2=SAN481VL26S32Y-YTE; QD3=SAN481VH28T-YTE; QD4=SAN481-VH28T100F-YTE; QD5=SAN481-SY-T-YTE; QD6=SAN481-SY-TF-YTE; QD11=SAN481-EG-YTE; и QD12=SAN481-SY-QFS-YTE. (См. пример 2.)
[0031] На фигуре 2 представлен график, демонстрирующий, что SAN481-SYT-YTE характеризуется аналогичной SAN481 активностью нейтрализации лейкотоксина in vitro. (См. пример 3.)
[0032] На фигуре 3 представлено выравнивание последовательностей HIgB (SEQ ID NO:27), LukF (SEQ ID NO:25) и LukD (SEQ ID NO:26).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0033] Настоящее изобретение предусматривает антитела и их антигенсвязывающие фрагменты (например, моноклональные антитела и их антигенсвязывающие фрагменты), которые связываются с лейкотоксинами Staphylococcus aureus (S. aureus). Настоящее изобретение также предусматривает способы применения таких антител и антигенсвязывающих фрагментов, например, при выявлении лейкотоксинов Staphylococcus aureus (S. aureus) и при лечении или предотвращении инфекций, вызываемых S. aureus.
Определения
[0034] Используемый в данном документе термин "лейкотоксин" относится к полипептидам, представляющим собой бактериальный лейкотоксин, включая без ограничения природные полипептиды, представляющие собой лейкотоксин, и изоформы полипептидов, представляющих собой лейкотоксин. Термин "лейкотоксин" охватывает полноразмерные непроцессированные полипептиды, представляющие собой лейкотоксин, а также формы полипептидов, представляющих собой лейкотоксин, которые образуются в результате процессинга внутри клетки. Лейкотоксины включают LukSF, лейкотоксин ED (LukED ), HlgAB, HlgCB и лейкотоксин AB (LukAB, также известный как LukGH). Используемый в данном документе термин "LukF S. aureus" относится к полипептиду, содержащему аминокислотную последовательность под SEQ ID NO:25. Используемый в данном документе термин "LukD S. aureus" относится к полипептиду, содержащему аминокислотную последовательность под SEQ ID NO:26. Используемый в данном документе термин "HIgB S. aureus" относится к полипептиду, содержащему аминокислотную последовательность под SEQ ID NO:27. (См. фигуру 3). "Полинуклеотид лейкотоксина", "нуклеотид лейкотоксина" или "нуклеиновая кислота лейкотоксина" относятся к полинуклеотиду, кодирующему лейкотоксин.
[0035] Термин "антитело" означает молекулу иммуноглобулина, которая распознает мишень, такую как белок, полипептид, пептид, углевод, полинуклеотид, липид или комбинации вышеуказанного, и специфично связывается с ней посредством по меньшей мере одного антигенраспознающего центра в пределах вариабельного участка молекулы иммуноглобулина. Термин "антитело", используемый в данном документе, охватывает интактные поликлональные антитела, интактные моноклональные антитела, химерные антитела, гуманизированные антитела, человеческие антитела, слитые белки, содержащие антитело, а также любую другую модифицированную молекулу иммуноглобулина при условии, что антитела проявляют требуемую биологическую активность. Антитело может относиться к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM или их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) на основании особенностей их константных доменов тяжелой цепи, обозначаемых соответственно как альфа, дельта, эпсилон, гамма и мю. Разные классы иммуноглобулинов имеют различные и хорошо известные структуры субъединиц и трехмерные пространственные конфигурации. Антитела могут быть "голыми" или конъюгированными с другими молекулами, такими как токсины, радиоактивные изотопы и т. д.
[0036] Термин "моноклональные антитела", применяемый в данном документе, относится к антителам, которые продуцируются одним клоном B-клеток и связываются с одним и тем же эпитопом. Напротив, термин "поликлональные антитела" относится к популяции антител, которые продуцируются различными B-клетками и связываются с различными эпитопами одного и того же антигена.
[0037] Термин "фрагмент антитела" относится к части интактного антитела. "Антигенсвязывающий фрагмент", "антигенсвязывающий домен" или "антигенсвязывающая область" относится к части интактного антитела, которая связывается с антигеном. Антигенсвязывающий фрагмент может содержать области интактного антитела, распознающие антиген (например, определяющие комплементарность области (CDR)). Примеры антигенсвязывающих фрагментов антител включают без ограничения Fab-, Fab'-, F(ab')2- и Fv-фрагменты, линейные антитела и одноцепочечные антитела. Антигенсвязывающий фрагмент антитела может быть получен у любого вида животных, таких как грызуны (например, мышь, крыса или хомяк) и у людей, или может быть получен искусственно.
[0038] Целое антитело, как правило, состоит из четырех полипептидов: двух идентичных копий полипептида тяжелой (H) цепи и двух идентичных копий полипептида легкой (L) цепи. Каждая из тяжелых цепей содержит одну N-концевую вариабельную (VH) область и три C-концевых константных (CH1, CH2 и CH3) области, и каждая легкая цепь содержит одну N-концевую вариабельную (VL) область и одну C-концевую константную (CL) область. Вариабельные области каждой пары легкой и тяжелой цепей образуют антигенсвязывающий сайт антитела. Области VH и VL характеризуются одинаковой общей структурой, при этом каждая область содержит четыре каркасные области, последовательности которых являются относительно консервативными. Используемый в данном документе термин "каркасная область" относится к относительно консервативным аминокислотным последовательностям в вариабельной области, которые расположены между гипервариабельными или определяющими комплементарность областями (CDR). В каждом вариабельном домене присутствуют четыре каркасных области, которые обозначены FR1, FR2, FR3 и FR4. Каркасные области образуют β-складки, которые обеспечивают структурный каркас вариабельной области (см., например C.A. Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)). Три CDR, известные как CDR1, CDR2 и CDR3, образуют "гипервариабельную область" антитела, которая отвечает за связывание антигена.
[0039] Термины "VL" и "VL-домен" используются взаимозаменяемо для обозначения вариабельной области легкой цепи антитела.
[0040] Термины "VH" и "VH-домен" используются взаимозаменяемо для обозначения вариабельной области тяжелой цепи антитела.
[0041] Термин "нумерация по Kabat" и подобные термины известны в данной области техники и относятся к системе нумерации аминокислотных остатков в вариабельных областях тяжелой и легкой цепей антитела или его антигенсвязывающего фрагмента. В определенных случаях CDR могут быть определены в соответствии с системой нумерации по Kabat (см., например, Kabat EA & Wu TT (1971) Ann NY Acad Sci 190: 382-391 and Kabat EA et al., (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Используя систему нумерации по Kabat, CDR в молекуле тяжелой цепи антитела, как правило, присутствуют в положениях аминокислот с 31 по 35, которые необязательно могут включать одну или две дополнительные аминокислоты, следующие за 35 (обозначенные в схеме нумерации по Kabat как 35A и 35B) (CDR1), положениях аминокислот с 50 по 65 (CDR2) и положениях аминокислот с 95 по 102 (CDR3). Используя систему нумерации по Kabat, CDR в молекуле легкой цепи антитела как правило присутствуют в положениях аминокислот с 24 по 34 (CDR1), в положениях аминокислот с 50 по 56 (CDR2) и в положениях аминокислот с 89 по 97 (CDR3). В конкретном варианте осуществления CDR антител, описанных в данном документе, были определены в соответствии со схемой нумерации по Kabat.
[0042] В отличие от этого, Chothia ссылается на расположение структурных петель (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Конец петли CDR-H1 по Chothia при нумерации с использованием правил нумерации по Kabat варьирует от H32 до H34 в зависимости от длины петли (это обусловлено тем, что в соответствии со схемой нумерации по Kabat вставки расположены в H35A и H35B; при этом если не присутствуют ни 35A, ни 35B, то петля заканчивается на 32; если присутствует только 35A, то петля заканчивается на 33; если присутствуют как 35A, так и 35B, то петля заканчивается на 34). Определение гипервариабельных участков по AbM представляет собой компромисс между определением CDR по Kabat и структурных петель по Chothia и применяется в программном обеспечении для моделирования антител AbM от Oxford Molecular.
[0043] Используемые в данном документе термины "константная область" или "константный домен" являются взаимозаменяемыми и имеют общепринятое в данной области техники значение. Константная область представляет собой часть антитела, например карбокси-концевую часть легкой и/или тяжелой цепи, которая не участвует непосредственно в связывании антитела с антигеном, но может проявлять различные эффекторные функции, такие как взаимодействие с рецептором Fc. Константная область молекулы иммуноглобулина обычно имеет более консервативную аминокислотную последовательность по сравнению с вариабельным доменом иммуноглобулина.
[0044] Используемый в данном документе термин "тяжелая цепь" при использовании в отношении антитела может относиться к любому отдельному типу, например, альфа (α), дельта (δ), эпсилон (ε), гамма (γ) и мю (μ) на основе аминокислотной последовательности константного домена, которые дают начало классам антител IgA, IgD, IgE, IgG и IgM соответственно, включая подклассы IgG, например IgG1, IgG2, IgG3 и IgG4. Аминокислотные последовательности тяжелых цепей хорошо известны в данной области техники. В конкретных вариантах осуществления тяжелая цепь представляет собой тяжелую цепь человека.
[0045] Используемый в данном документе термин "легкая цепь" при использовании в отношении антитела может относиться к любому отдельному типу, например, каппа (κ) или лямбда (λ) на основе аминокислотной последовательности константных доменов. Аминокислотные последовательности легких цепей хорошо известны в данной области техники. В конкретных вариантах осуществления легкая цепь представляет собой легкую цепь человека.
[0046] "Химерное" антитело относится к антителу или его фрагменту, содержащему как человеческие области, так и области, отличные от человеческих. "Гуманизированное" антитело представляет собой антитело, содержащее каркас человеческого антитела и по меньшей мере одну CDR, полученную из антитела, отличного от человеческого, или произошедшую из него. Антитела, отличные от человеческих включают антитела, выделенные у любого животного, не являющегося человеком, такого как, например, грызун (например, мышь или крыса). Гуманизированное антитело может содержать одну, две или три CDR, полученных из антитела, отличного от человеческого, или произошедших из него. Полностью человеческое антитело не содержит аминокислотных остатков, полученных от животного, не являющегося человеком, или произошедших из него. Следует принимать во внимание, что полностью человеческие и гуманизированное антитела несут меньший риск индуцирования иммунных ответов у людей, чем мышиные или химерные антитела (см., например Harding et al., mAbs, 2(3): 256-26, 2010).
[0047] Используемый в данном документе термин "эпитоп" относится к локализованной области антигена, с которой может специфически связываться антитело или его антигенсвязывающий фрагмент. Эпитоп может представлять собой, например, смежные аминокислоты полипептида (линейный или смежный эпитоп), или эпитоп может, например, происходить из двух или более несмежных областей полипептида или полипептидов (конформационный, нелинейный, прерывистый или несмежный эпитоп). В определенных вариантах осуществления эпитоп, с которым связывается антитело или его антигенсвязывающий фрагмент, может быть определен, например, с помощью спектроскопии ЯМР, рентгеноструктурных кристаллографических исследований, анализов ELISA, анализа на основе водород-дейтериевого обмена в сочетании с масс-спектрометрией (например, жидкостной хроматографии в сочетании с масс-спектрометрией с электрораспылением), анализов сканирования олигопептидов на основе массивов и/или картирования мутагенеза (например, картирования сайт-направленного мутагенеза). Для рентгеновской кристаллографии кристаллизация может быть выполнена с использованием любого из известных в данной области техники способов (например, Giegé R et al., (1994) Acta Crystallogr D Biol Crystallogr 50(Pt 4): 339-350; McPherson A (1990) Eur J Biochem 189: 1-23; Chayen NE (1997) Structure 5: 1269-1274; McPherson A (1976) J Biol Chem 251: 6300-6303). Кристаллы антитело/его антигенсвязывающий фрагмент:антиген могут быть изучены с использованием хорошо известных методик рентгеноструктурного анализа и могут быть уточнены с использованием компьютерного программного обеспечения, такого как X-PLOR (Йельский университет, 1992, распространяемое Molecular Simulations, Inc; см., например, Meth Enzymol (1985) volumes 114 & 115, eds Wyckoff HW et al.,; U.S. 2004/0014194) и BUSTER (Bricogne G (1993) Acta Crystallogr D Biol Crystallogr 49(Pt 1): 37-60; Bricogne G (1997) Meth Enzymol 276A: 361-423, ed Carter CW; Roversi P et al., (2000) Acta Crystallogr D Biol Crystallogr 56(Pt 10): 1316-1323). Исследования картирования мутагенеза могут быть выполнены с использованием любого способа, известного специалисту в данной области техники. См., например, Champe M et al., (1995) J Biol Chem 270: 1388-1394 и Cunningham BC & Wells JA (1989) Science 244: 1081-1085 для описания методик мутагенеза, включая методики аланин-сканирующего мутагенеза.
[0048] Антитело, которое "связывается с тем же эпитопом", что и эталонное антитело, относится к антителу, которое связывается с теми же аминокислотными остатками, что и эталонное антитело. Способность антитела связываться с тем же эпитопом, что и эталонное антитело, можно определить с помощью анализа на основе водород-дейтериевого обмена (см. Coales et al. Rapid Commun. Mass Spectrom. 2009; 23: 639-647) или рентгеновской кристаллографии.
[0049] Используемые в данном документе термины "иммуноспецифически связывается", "иммуноспецифически распознает", "специфически связывает" и "специфически распознает" являются аналогичными терминами в контексте антител или их антигенсвязывающих фрагментов. Эти термины указывают на то, что антитело или его антигенсвязывающий фрагмент связываются с эпитопом посредством своего антиген-связывающего домена, и что связывание предполагает некоторую комплементарность между антиген-связывающим доменом и эпитопом. Соответственно, например, антитело, которое "специфически связывается" с первым лейкотоксином S. aureus, может также связываться с другими лейкотоксинами S. aureus, но степень связывания с неродственным белком, отличным от лейкотоксина, составляет менее чем приблизительно 10% от связывания антитела с первым лейкотоксином S. aureus при измерении, например, с помощью радиоиммуноанализа (RIA), твердофазного иммуноферментного анализа (ELISA), анализа связывания с помощью BiaCore или Octet.
[0050] Утверждается, что антитело "конкурентно подавляет" связывание эталонного антитела с данным эпитопом, если оно преимущественно связывается с этим эпитопом или перекрывающимся эпитопом в такой степени, что оно в некоторой степени блокирует связывание эталонного антитела с эпитопом. Конкурентное подавление можно определить с помощью любого способа, известного из уровня техники, например, с помощью конкурентных анализов ELISA. Может говориться, что антитело конкурентно подавляет связывание эталонного антитела с данным эпитопом по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60% или по меньшей мере на 50%.
[0051] Термин "последовательность нуклеиновой кислоты" предназначен для охвата полимера ДНК или РНК, т. е. полинуклеотида, который может быть одноцепочным или двухцепочным, и который может содержать неприродные или измененные нуклеотиды. Термины "нуклеиновая кислота" и "полинуклеотид", которые описаны в данном документе, относятся к полимерной форме нуклеотидов любой длины, будь то рибонуклеотиды (РНК) или дезоксирибонуклеотиды (ДНК). Эти термины относятся к первичной структуре молекулы и, таким образом, включают двух- и одноцепочную ДНК, а также двух- и одноцепочную РНК. В качестве эквивалентов термины включают аналоги РНК или ДНК, полученные из аналогов нуклеотидов и модифицированных полинуклеотидов, таких как без ограничения метилированные и/или кэпированные полинуклеотиды. Нуклеиновые кислоты, как правило, связаны через фосфатные связи с образованием последовательностей нуклеиновых кислот или полинуклеотидов, хотя известны многие другие связи в данной области техники (например, фосфоротиоаты, боранофосфаты и т. п.).
[0052] Инфекция, вызываемая S. aureus, может проявляться, например, в виде инфекции кожи или мягких тканей (SSTI) или бактериемии. Бактерии S. aureus могут перемещаться по кровотоку и инфицировать определенные участки тела, что приводит к пневмонии, пневмонии в ICU, инфекцию нижних конечностей у больных диабетом, язве, обусловленной синдромом диабетической стопы (DFU), инфекции костей или суставов, инфекции, ассоциированной с медицинским изделием в организме, раневой инфекции, инфекции области хирургического вмешательства или остеомиелиту.
[0053] Термины "трансфекция", "трансформация" или "трансдукция", используемые в данном документе, относятся к введению одного или нескольких экзогенных полинуклеотидов в клетку-хозяина с использованием физических или химических методов. Многие методы трансфекции известны в данной области техники и включают, например, совместное осаждение ДНК фосфатом кальция (см., например Murray E.J. (ed.), Methods in Molecular Biology, Vol. 7, Gene Transfer and Expression Protocols, Humana Press (1991)); DEAE-декстраном; электропорацию; катионную трансфекцию, опосредованную липосомами; бомбардировку микрочастицами с помощью частиц вольфрама (Johnston, Nature, 346: 776-777 (1990)); и совместное осаждение ДНК фосфатом стронция (Brash et al, Mol. Cell Biol., 7: 2031-2034 (1987)). Фаговые или вирусные векторы могут быть введены в клетки-хозяева после роста инфекционных частиц в подходящих упаковывающих клетках, многие из которых являются коммерчески доступными.
[0054] Применяемые в данном документе термины "лечение", "осуществление лечения" и т. п. относятся к получению необходимого фармакологического и/или физиологического эффекта. В одном варианте осуществления эффект является терапевтическим, т. е. эффект обеспечивает частичное или полное излечение заболевания и/или неблагоприятного симптома, относящегося к заболеванию.
[0055] "Терапевтически эффективное количество" относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения необходимого терапевтического результата (например, лечения инфекции, вызываемой S. aureus). Терапевтически эффективное количество может варьироваться в соответствии с такими факторами, как состояние заболевания, возраст, пол и вес индивидуума и способность антитела или антигенсвязывающего фрагмента вызывать необходимый ответ у индивидуума.
[0056] "Профилактически эффективное количество" относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения необходимого профилактического результата (например, предотвращения инфекции, вызываемой S. aureus, или начала заболевания).
[0057] Термины "вводить", "осуществление введения", "введение" и т. п., применяемые в данном документе, относятся к способам, которые можно применять для осуществления доставки лекарственного средства, например, лейкотксин-связывающего антитела или его антигенсвязывающего фрагмента, к требуемому месту биологического действия (например, к внутривенному введению). Методики введения, которые можно применять в отношении средств и способов, описанных в данном документе, можно найти, например, в Goodman and Gilman, The Pharmacological Basis of Therapeutics, текущее издание, Pergamon; and Remington's, Pharmaceutical Sciences, текущее издание, Mack Publishing Co., Easton, Pa.
[0058] Используемая в настоящем изобретении форма единственного числа предусматривает форму множественного числа, если из контекста явно не следует иное.
[0059] Если конкретно не указано или не очевидно из контекста, используемый в данном документе термин "или" понимают как включающий. Термин "и/или", используемый в данном документе во фразе, такой как "А и/или В", предназначен для включения и "А и В", и "А или В", и "А", и "В". Аналогичным образом, термин "и/или", используемый во фразе, такой как "A, B и/или C", предназначен для охвата каждого из следующих вариантов осуществления: А, В и С; А, В или С; А или С; А или В; В или С; А и С; А и В; В и С; А (отдельно); В (отдельно) и С (отдельно).
Антитела к лейкотоксину
[0060] В данном документе предусмотрены антитела и их антигенсвязывающие фрагменты, которые связываются по меньшей мере с одним лейкотоксином S. aureus.
[0061] Лейкотоксины являются фактором вирулентности S. aureus. Лейкотоксины нацелены на широкий спектр иммунных клеток и приводят к их разрушению. Лейкотоксины включают лейкоцидин Panton-Valentine (LukSF-PV, также известный как LukSF), лейкотоксин ED (LukED), гамма-гемолизин (который существует в виде двух токсинов: HlgAB и HlgCB) и лейкотоксин AB (LukAB, также известный как LukGH). В определенных случаях антитело или его антигенсвязывающий фрагмент, которые связываются по меньшей мере с одним лейкотоксином, связываются с LukF, LukD и/или HIgB. В определенных случаях антитело или его антигенсвязывающий фрагмент, которые связываются по меньшей мере с одним лейкотоксином, связываются с LukF, LukD и HIgB.
[0062] В одном случае антитело или антигенсвязывающий фрагмент (например, моноклональное антитело или фрагмент), которые специфически связываются по меньшей мере с одним лейкотоксином S. aureus, включают, состоят по существу из или состоят из (i) полипептида тяжелой цепи, содержащего аминокислотную последовательность CDR1 под SEQ ID NO:1, аминокислотную последовательность CDR2 под SEQ ID NO:2 и аминокислотную последовательность CDR3 под SEQ ID NO:3, и (ii) полипептида легкой цепи, содержащего аминокислотную последовательность CDR1 под SEQ ID NO:12, аминокислотную последовательность CDR2 под SEQ ID NO:5 и аминокислотную последовательность CDR3 под SEQ ID NO:6. В другом случае полипептид тяжелой цепи антитела или антигенсвязывающего фрагмента (например, моноклонального антитела или фрагмента), которые специфически связываются по меньшей мере с одним лейкотоксином S. aureus, включает, состоит по существу из или состоит из аминокислотной последовательности вариабельной области под SEQ ID NO:15. В другом случае полипептид тяжелой цепи антитела или антигенсвязывающего фрагмента (например, моноклонального антитела или фрагмента), которые специфически связываются по меньшей мере с одним лейкотоксином S. aureus, включает, состоит по существу из или состоит из аминокислотной последовательности вариабельной области под SEQ ID NO:13 В другом случае антитело или антигенсвязывающий фрагмент (например, моноклональное антитело или фрагмент), которые специфически связываются по меньшей мере с одним лейкотоксином S. aureus, включают, состоят под существу из или состоят из вариабельной области тяжелой цепи, включающей, состоящей по существу из или состоящей из аминокислотной последовательности под SEQ ID NO:15, и вариабельной области легкой цепи, включающей, состоящей по существу из или состоящей из аминокислотной последовательности под SEQ ID NO:13. В другом случае антитело или антигенсвязывающий фрагмент (например, моноклональное антитело или фрагмент), которые специфически связываются по меньшей мере с одним лейкотоксином S. aureus, включают, состоят под существу из или состоят из вариабельной области тяжелой цепи, включающей, состоящей по существу из или состоящей из аминокислотной последовательности под SEQ ID NO:16, и/или вариабельной области легкой цепи, включающей, состоящей по существу из или состоящей из аминокислотной последовательности под SEQ ID NO:14.
[0063] Последовательности иллюстративных антител к лейкотоксину представлены ниже. В определенных случаях описанные в данном документе антитело или его антигенсвязывающий фрагмент связываются по меньшей мере с одним лейкотоксином и содержат шесть CDR (т. е. CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL) из таблиц 1 и 2 ниже.
[0064] Антитело SAN481-SYT-YTE содержит CDR VH под SEQ ID NO:1-3 и CDR VL под SEQ ID NO:12, 5 и 6.
Таблица 1. Аминокислотные последовательности CDR VH
(SEQ ID NO:)
(SEQ ID NO:)
(SEQ ID NO:)
Таблица 2. Аминокислотные последовательности CDR VL
(SEQ ID NO:)
(SEQ ID NO:)
(SEQ ID NO:)
[0065] В определенных случаях описанное в данном документе антитело или его антигенсвязывающий фрагмент связываются по меньшей мере с одним лейкотоксином и содержат VH антитела, указанного в следующей таблице, например, в комбинации с VL.
Таблица 3. Аминокислотная последовательность вариабельной области тяжелой цепи (VH)
[0066] В определенных случаях описанное в данном документе антитело или его антигенсвязывающий фрагмент связываются по меньшей мере с одним лейкотоксином и содержат VL антитела, указанного в следующей таблице, например, в комбинации с VH, необязательно VH, указанной в предыдущей таблице.
Таблица 4. Аминокислотная последовательность вариабельной области легкой цепи (VL)
[0067] В определенных случаях описанное в данном документе антитело или его антигенсвязывающий фрагмент связываются по меньшей мере с одним лейкотоксином и содержат тяжелую цепь антитела, указанного в следующей таблице, например в комбинации с легкой цепью.
Таблица 5. Аминокислотные последовательности полноразмерной тяжелой цепи
[0068] В определенных случаях описанное в данном документе антитело или его антигенсвязывающий фрагмент связываются по меньшей мере с одним лейкотоксином и содержат легкую цепь антитела, указанного в следующей таблице, например в комбинации с тяжелой цепью, необязательно тяжелой цепью, указанной в предыдущей таблице.
Таблица 6. Аминокислотные последовательности полноразмерной легкой цепи
[0069] Последовательности антител, используемых в приведенных ниже примерах, обобщены в таблице 7.
Таблица 7. SEQ ID NO CDR, вариабельных областей, тяжелых и легких цепей антитела
[0070] В определенных аспектах CDR антитела или его антигенсвязывающего фрагмента могут быть определены в соответствии со схемой нумерации по Chothia, которая относится к местоположению структурных петель иммуноглобулина (см., например, Chothia C & Lesk AM, (1987), J Mol Biol 196: 901-917; Al-Lazikani B et al., (1997) J Mol Biol 273: 927-948; Chothia C et al., (1992) J Mol Biol 227: 799-817; Tramontano A et al., (1990) J Mol Biol 215(1): 175-82; и патент США № 7709226). Как правило, при использовании соглашения нумерации по Kabat петля по Chothia CDR-H1 присутствует на аминокислотах тяжелой цепи в положениях с 26 по 32, 33 или 34, петля по Chothia CDR-H2 присутствует на аминокислотах тяжелой цепи в положениях с 52 по 56, и петля по Chothia CDR-H3 присутствует на аминокислотах тяжелой цепи в положениях с 95 по 102, тогда как петля по Chothia CDR-L1 присутствует на аминокислотах легкой цепи в положениях с 24 по 34, петля по Chothia CDR-L2 присутствует на аминокислотах легкой цепи в положениях с 50 по 56 и петля по Chothia CDR-L3 присутствует на аминокислотах легкой цепи в положениях с 89 по 97. Конец петли CDR-H1 по Chothia при нумерации с использованием правил нумерации по Kabat варьирует от H32 до H34 в зависимости от длины петли (это обусловлено тем, что в соответствии со схемой нумерации по Kabat вставки расположены в H35A и H35B; при этом если не присутствуют ни 35A, ни 35B, то петля заканчивается на 32; если присутствует только 35A, то петля заканчивается на 33; если присутствуют как 35A, так и 35B, то петля заканчивается на 34).
[0071] В определенных аспектах в данном документе предусмотрены антитела и их антигенсвязывающие фрагменты, которые содержат CDR VH и VL по Chothia антитела SAN481 или SAN481-SYT. В определенных вариантах осуществления антитела или их антигенсвязывающие фрагменты содержат одну или несколько CDR, в которых CDR по Chothia и Kabat имеют одинаковую аминокислотную последовательность. В определенных вариантах осуществления, в данном документе предусмотрены антитела и их антигенсвязывающие фрагменты, которые содержат комбинации CDR по Kabat и CDR по Chothia.
[0072] В определенных случаях CDR антитела или его антигенсвязывающего фрагмента могут быть определены в соответствии с системой нумерации IMGT, как описано в Lefranc MP, (1999) The Immunologist 7: 132-136 and Lefranc M-P et al., (1999) Nucleic Acids Res 27: 209-212. В соответствии со схемой нумерации IMGT VH-CDR1 находится в положениях 26-35, VH-CDR2 находится в положениях 51-57, VH-CDR3 находится в положениях 93-102, VL-CDR1 находится в положениях 27-32, VL-CDR2 находится в положениях 50-52 и VL-CDR3 находится в положениях 89-97. В конкретном варианте осуществления в данном документе предусмотрены антитела и их антигенсвязывающие фрагменты, которые содержат CDR VH и VL согласно IMGT антитела SAN481 или SAN481-SYT-YTE, например, как описано в Lefranc M-P (1999) выше и Lefranc M-P et al., (1999) выше).
[0073] В определенных случаях CDR антитела или его антигенсвязывающего фрагмента могут быть определены согласно с MacCallum RM et al., (1996) J Mol Biol 262: 732-745. См. также, например, Martin A. "Protein Sequence and Structure Analysis of Antibody Variable Domains," in Antibody Engineering, Kontermann and Dübel, eds., Chapter 31, pp. 422-439, Springer-Verlag, Berlin (2001). В конкретном варианте осуществления в данном документе предусмотрены антитела или их антигенсвязывающие фрагменты, которые содержат CDR VH и VL антитела SAN481 или SAN481-SYT-YTE, определенные способом, описанным в MacCallum RM et al.
[0074] В определенных случаях CDR антитела или его антигенсвязывающего фрагмента могут быть определены в соответствии со схемой нумерации AbM, которая относится к гипервариабельным областям AbM, которые представляют собой компромисс между CDR по Kabat и структурными петлями по Chothia, и используются в программном обеспечении для моделирования антител AbM от Oxford Molecular (Oxford Molecular Group, Inc.). В конкретном варианте осуществления в данном документе предусмотрены антитела или антигенсвязывающие фрагменты, которые содержат CDR VH и VL антитела SAN481 или SAN481-SYT-YTE, как определено в соответствии со схемой нумерации AbM.
[0075] В другом аспекте антитело или его антигенсвязывающий фрагмент (например, моноклональное антитело или фрагмент), описанные в данном документе, могут содержать константную область (Fc) любого подходящего класса (например, IgG, IgA, IgD, IgM и IgE), которая была модифицирована для улучшения периода полужизни антитела или антигенсвязывающего фрагмента, (например, моноклонального антитела или фрагмента). Например, описанные в данном документе антитело или его антигенсвязывающий фрагмент (например, моноклональное антитело или фрагмент) могут содержать Fc, которая содержит мутацию, которая продлевает период полужизни по сравнению с тем же антителом без мутации.
[0076] Конструирование области Fc широко используется в данной области техники для увеличения времени полужизни терапевтических антител и защиты от разрушения in vivo. В некоторых вариантах осуществления Fc-область антитела IgG или антигенсвязывающего фрагмента может быть модифицирована для увеличения аффинности молекулы IgG в отношении неонатального рецептора Fc (FcRn), который опосредует катаболизм IgG и защищает молекулы IgG от разрушения. Подходящие аминокислотные замены или модификации Fc-области известны в данной области техники и включают, например, тройную замену M252Y/S254T/T256E (обозначаемую как "YTE") (см., например патент США 7658921; публикацию заявки на патент США 2014/0302058; и Yu et al., Antimicrob. Agents Chemother., 61(1): e01020-16 (2017)). В определенных аспектах антитело или антигенсвязывающий фрагмент (например, моноклональное антитело или фрагмент), которые связываются по меньшей мере с одним лейкотоксином S. aureus, содержат Fc-область, содержащую мутацию YTE.
[0077] Антитело или антигенсвязывающий фрагмент (например, моноклональное антитело или фрагмент), описанные в данном документе, могут представлять собой человеческое антитело, гуманизированное антитело, антитело, отличное от человеческого или химерное антитело или могут быть получены из них. В одном аспекте описанное в данном документе антитело или его антигенсвязывающий фрагмент являются полностью человеческим антителом.
[0078] Человеческое антитело, антитело, отличное от человеческого, химерное антитело или гуманизированное антитело можно получить любыми способами, в том числе с помощью источников in vitro (например, гибридомы или клеточной линии, продуцирующей антитело рекомбинантно) и источников in vivo (например, грызунов, миндалин человека). Способы получения антител известны в данной области техники и описаны, например, в Köhler and Milstein, Eur. J. Immunol., 5: 511-519 (1976); Harlow and Lane (eds.), Antibodies: A Laboratory Manual, CSH Press (1988); and Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, N.Y. (2001)). В определенных вариантах осуществления человеческое антитело или химерное антитело можно получить с использованием трансгенного животного (например, мыши), в котором один или несколько генов эндогенного иммуноглобулина заменены одним или несколькими генами человеческого иммуноглобулина. Примеры трансгенных мышей, у которых гены эндогенных антител эффективно заменены генами человеческих антител, включают без ограничения, Medarex HUMAB-MOUSE™, Kirin TC MOUSE™ и Kyowa Kirin KM-MOUSE™ (см., например Lonberg, Nat. Biotechnol., 23(9): 1117-25 (2005), and Lonberg, Handb. Exp. Pharmacol., 181: 69-97, 2008). Гуманизированное антитело может быть получено с использованием любого подходящего метода, известного в данной области техники (см., например An, Z. (ed.), Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley & Sons, Inc., Hoboken, N.J. (2009)), включая, например, пересадку CDR, отличных от человеческих, на каркас человеческого антитела (см., например Kashmiri et al., Methods, 36(1): 25-34 (2005); and Hou et al., J. Biochem., 144(1): 115-120 (2008)). В одном варианте осуществления гуманизированное антитело можно получить с использованием способов, описанных, например, в публикации заявки на патент США 2011/0287485 A1.
[0079] В определенных аспектах предусмотренные в данном документе антитело или антигенсвязывающий фрагмент характеризуются сходной аффинностью связывания в отношении LukF, LukD и HIgB.
Нуклеиновые кислоты, векторы и клетки-хозяева
[0080] Также в данном документе предусмотрены одна или несколько выделенных последовательностей нуклеиновых кислот, которые кодируют антитело или его антигенсвязывающий фрагмент, которые связываются по меньшей мере с одним лейкотоксином (необязательно где антитело или его антигенсвязывающий фрагмент представляют собой моноклональное антитело или фрагмент).
[0081] В настоящем изобретении также предусмотрены один или несколько векторов, содержащих одну или несколько последовательностей нуклеиновых кислот, кодирующих антитело или его антигенсвязывающий фрагмент, которые связываются по меньшей мере с одним лейкотоксином (необязательно где одно или несколько антител или их антигенсвязывающих фрагментов представляют собой моноклональное антитело или фрагмент). Вектор может быть, например, плазмидой, эписомой, космидой, вирусным вектором (например, ретровирусным или аденовирусным) или фагом. Подходящие векторы и способы получения векторов хорошо известны в данной области техники (см., например, Sambrook et al., Molecular Cloning, a Laboratory Manual, 3rd edition, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (2001), and Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, New York, N.Y. (1994)).
[0082] В дополнение к последовательности нуклеиновой кислоты, кодирующей антитело или его антигенсвязывающий фрагмент, которые связываются по меньшей мере с одним лейкотоксином (необязательно где антитело или его антигенсвязывающий фрагмент представляют собой моноклональное антитело или фрагмент), вектор желательно содержит последовательности контроля экспрессии, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы транскрипции, внутренние участки посадки рибосомы (IRES) и т. п., которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине. Примеры последовательностей контроля экспрессии известны в данной области техники и описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology, Vol. 185, Academic Press, San Diego, Calif. (1990).
[0083] Вектор(ы), содержащий(-ие) нуклеиновую(-ые) кислоту(-ы), кодирующую(-ие) антитело или его антигенсвязывающий фрагмент, которые связываются по меньшей мере с одним лейкотоксином (необязательно, где одно или несколько антител или их антигенсвязывающих фрагментов представляют собой моноклональное антитело или фрагмент), можно ввести в клетку-хозяина, которая способна экспрессировать кодируемые им (ими) полипептиды, включая любую подходящую прокариотическую или эукариотическую клетку. Таким образом, настоящее изобретение предусматривает изолированную клетку, содержащую вектор. Клетки-хозяева, которые можно использовать, включают клетки, которые можно легко и надежно выращивать, имеют достаточно высокие темпы роста, хорошо охарактеризованные системы экспрессии и могут быть легко и эффективно трансформированы или трансфицированы. Примеры подходящих прокариотических клеток включают без ограничения клетки из родов Bacillus (таких как Bacillus subtilis и Bacillus brevis), Escherichia (таких как E. coli), Pseudomonas, Streptomyces, Salmonella и Erwinia. Особенно полезные прокариотические клетки включают различные штаммы Escherichia coli (например, K12, HB101 (ATCC № 33694), DH5a, DH10, MC1061 (ATCC № 53338) и CC102). Подходящие эукариотические клетки известны в данной области техники и включают, например, дрожжевые клетки, клетки насекомых и клетки млекопитающих. В одном варианте осуществления вектор экспрессируется в клетках млекопитающих. Ряд подходящих клеток-хозяев млекопитающих известен в данной области техники, и многие из них доступны в Американской коллекции типовых культур (ATCC, Манассас, Виргиния). Примеры подходящих клеток млекопитающих включают без ограничения клетки яичника китайского хомячка (СНО) (АТСС № CCL61), СНО DHFR-клетки (Urlaub et al, Proc. Natl. Acad. Sci. USA, 97: 4216-4220 (1980)), эмбриональные клетки почки человека (HEK) 293 или 293T (ATCC № CRL1573) и клетки 3T3 (ATCC № CCL92). Другими подходящими клеточными линиями млекопитающих являются клеточные линии COS-1 обезьяны (ATCC № CRL1650) и COS-7 (ATCC № CRL1651), а также линия клеток CV-1 (ATCC № CCL70). Желательно, чтобы клетка млекопитающего была клеткой человека. Например, клетка млекопитающего может быть лимфоидной клеткой человека или лимфоидной клеткой, полученной из клеточной линии, такой как линия клеток пре-В-лимфоцитов, линия клеток PER.C6® (Crucell Holland BV, Нидерланды) или эмбриональные клетки почки человека (HEK) 293 или 293T (ATCC № CRL1573).
[0084] Последовательность нуклеиновой кислоты, кодирующая аминокислоты любого из антител или антигенсвязывающих фрагментов (необязательно моноклональных антител или фрагментов), описанных в данном документе, может быть введена в клетку посредством трансфекции, трансформации или трансдукции.
Фармацевтические композиции и способы применения антител к лейкотоксину Staphylococcus aureus
[0085] В настоящем изобретении предусмотрены композиции, содержащие антитело или его антигенсвязывающий фрагмент, описанные в данном документе, и фармацевтически приемлемый носитель.
[0086] В настоящем изобретении также предусмотрены композиции, содержащие одну или несколько последовательностей нуклеиновых кислот, кодирующих антитело или его антигенсвязывающий фрагмент, предусмотренные в данном документе, или один или несколько векторов, содержащих такие последовательности нуклеиновых кислот.
[0087] Предусмотренная в данном документе композиция (например, содержащая антитело или его антигенсвязывающий фрагмент, одну или несколько последовательностей нуклеиновых кислот или один или несколько векторов) может быть фармацевтически приемлемой (например, физиологически приемлемой) композицией, которая содержит носитель, такой как фармацевтически приемлемый (например, физиологически приемлемый) носитель и антитело или антигенсвязывающий фрагмент, последовательность(-и) нуклеиновой кислоты или вектор(ы).
[0088] В контексте изобретения можно использовать любой подходящий носитель, и такие носители хорошо известны в данной области техники. Выбор носителя будет частично определен конкретным местом, куда можно вводить композицию, и конкретным способом, применяемым для введения композиции. Композиция необязательно может быть стерильной. Композиция может быть заморожена или лиофилизована для хранения и восстановлена в подходящем стерильном носителе перед использованием. Композиции могут быть получены в соответствии с традиционными методиками, описанными, например, в Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins, Philadelphia, PA (2001).
[0089] Желательно, чтобы композиция содержала антитело или антигенсвязывающий фрагмент в количестве, которое является эффективным для лечения или предотвращения инфекции, вызываемой S. aureus. С этой целью, раскрытый способ предусматривает введение терапевтически эффективного количества или профилактически эффективного количества связывающих лейкотоксин антитела или его антигенсвязывающего фрагмента, или композиции, содержащей вышеуказанные антитело или его антигенсвязывающий фрагмент (включая моноклональные антитела или фрагменты).
[0090] Настоящее изобретение предусматривает способ лечения или предотвращения инфекции, вызываемой Staphylococcus aureus (S. aureus), у субъекта (например, человека), который включает введение связывающих лейкотоксин антитела или антигенсвязывающего фрагмента, описанных в данном документе нуждающемуся в этом субъекту, после чего осуществляется лечение или предотвращение инфекции, вызываемой S. aureus, у субъекта. В настоящем изобретении также предусмотрено применение связывающих лейкотоксин антитела или антигенсвязывающего фрагмента, описанных в данном документе, или композиции, содержащей антитела или их фрагменты, описанные в данном документе, в изготовлении лекарственного препарата для лечения или предотвращения инфекции, вызываемой S. aureus.
[0091] Как описано в данном документе, Staphylococcus aureus является основным патогеном человека, вызывающим широкий спектр клинических инфекций. S. aureus является основной причиной бактериемии и инфекционного эндокардита, а также костно-суставных, кожных инфекций и инфекций мягких тканей, плевропульмональных инфекций и инфекций, ассоциированной с медицинским изделием в организме. Примерно 30% человеческой популяции колонизированы S. aureus (Wertheim et al., Lancet Infect. Dis., 5: 751-762 (2005)). Симптомы кожных инфекций, вызванных S. aureus, включают, например, фурункулы, воспаление тканей и импетиго. S. aureus также может вызывать пищевое отравление, заражение крови (также известное как бактериемия), синдром токсического шока и септический артрит. Эпидемиология, патофизиология и клинические проявления инфекций, вызываемых S. aureus, подробно описаны, например, в Tong et al., Clin. Microbiol. Rev., 28(3): 603-661 (2015), и были секвенированы геномы нескольких различных штаммов S. aureus (см., например, в GenBank/EMBL под номерами доступа BX571856, BX571857, BX571858, FN433596, FN433597, FN433598, HE681097, FR821777, FR821778, FR821779 и FR821780). Как обсуждается в данном документе, субъект (например, человек) может иметь диабет.
[0092] В определенных случаях терапевтически эффективное количество связывающих лейкотоксин антитела или антигенсвязывающего фрагмента представляет собой количество, которое подавляет сепсис, ассоциированный с S. aureus, нейтрализует токсины, подавляет лизис клеток, подавляет полиорганную дисфункцию или включает любую комбинацию вышеперечисленного, например, у человека.
[0093] В качестве альтернативы, фармакологический и/или физиологический эффект может быть профилактическим, т. е. эффект обеспечивает полное или частичное предотвращение заболевания или его симптома. В этом отношении раскрытый способ включает введение "профилактически эффективного количества" связывающих лейкотоксин антитела или антигенсвязывающего фрагмента (включая моноклональные антитела или фрагменты).
[0094] Терапевтическую или профилактическую эффективность можно контролировать путем периодической оценки пациентов, получающих лечение. При повторных введениях в течение нескольких дней или дольше, в зависимости от состояния, лечение можно повторять до тех пор, пока не произойдет желаемое подавление симптомов заболевания. Однако могут быть полезны и другие схемы дозирования, которые входят в объем настоящего изобретения. Необходимая доза может быть доставлена посредством однократного болюсного введения композиции, многократного болюсного введения композиции или непрерывного инфузионного введения композиции.
[0095] Композиция(-и), содержащая(-ие) эффективное количество антитела или его антигенсвязывающего фрагмента, описанных в данном документе, последовательность(-и) нуклеиновой кислоты, кодирующей любое из вышеперечисленных, или вектор(ы), содержащий(-ие) последовательность нуклеиновой кислоты, может (могут) быть введена(-ы) субъекту, такому как человек, с использованием стандартных методик введения, включая внутривенный, внутрибрюшинный, подкожный и внутримышечный пути введения. Композиция может подходить для парентерального введения. Используемый в данном документе термин "парентеральный" включает внутривенное, внутримышечное, подкожное и внутрибрюшинное введение. В некоторых вариантах осуществления композицию вводят субъекту с использованием периферической системной доставки путем внутривенной, внутрибрюшинной или подкожной инъекции.
[0096] Связывающие лейкотоксин антитело или антигенсвязывающий фрагмент, или композицию, содержащую их, можно вводить отдельно или в комбинации с другими лекарственными средствами (например, в качестве адъюванта), обычно используемыми для лечения инфекции, вызываемой S. aureus. Композицию, содержащую связывающие лейкотоксин антитело или антигенсвязывающий фрагмент, можно использовать в комбинации, например, с одним или несколькими антибиотиками, такими как устойчивый к пенициллиназе β-лактамный антибиотик (например, оксациллин или флуклоксациллин). Гентамицин можно использовать для лечения серьезных инфекций, таких как эндокардит. Однако большинство штаммов S. aureus в настоящее время устойчивы к пенициллину, и двое из 100 человек являются носителями устойчивых к метициллину штаммов S. aureus (MRSA). Инфекции, вызываемые MRSA, как правило лечат ванкомицином, а незначительные кожные инфекции можно лечить мазью с тройным антибиотиком.
[0097] В дополнение к терапевтическим и профилактическим вариантам применения, любое антитело или его антигенсвязывающий фрагмент, описанные в данном документе, можно использовать в диагностических или исследовательских целях. В этом отношении связывающие лейкотоксин антитело или антигенсвязывающий фрагмент можно использовать в анализе для мониторинга инфекции, вызываемой S. aureus, у субъекта. Приложения для исследований включают, например, способы, в которых используются связывающие лейкотоксин антитело или антигенсвязывающий фрагмент и метка для обнаружения S. aureus в образце, например, в жидкости организма человека или в клеточном или тканевом экстракте. Связывающие лейкотоксин антитело или антигенсвязывающий фрагмент можно использовать с модификацией, такой как ковалентное или нековалентное мечение детектируемым фрагментом, или без модификации. Например, определяемый фрагмент может быть радиоизотопом (например, 3H, 14C, 32P, 35S, или 125I), флуоресцентным или хемилюминесцентным соединением (например, флуоресцеинизотиоцианат, родамин или люциферин), ферментом (например, щелочной фосфатазой, бета-галактозидазой или пероксидазой хрена) или простетическими группами. Любой известный в данной области техники способ для раздельного конъюгирования антитела или его антигенсвязывающего фрагмента с детектируемым фрагментом можно использовать в контексте настоящего изобретения (см., например, Hunter et al., Nature, 194: 495-496 (1962); David et al., Biochemistry, 13: 1014-1021 (1974); Pain et al., J. Immunol. Meth., 40: 219-230 (1981); and Nygren, J., Histochem. And Cytochem., 30: 407-412 (1982)).
[0098] Любое антитело или его антигенсвязывающий фрагмент, описанные в данном документе (например, моноклональные антитела или фрагменты), последовательность(-и) нуклеиновой кислоты, кодирующей любое из вышеперечисленных, вектор(ы), содержащий(-ие) последовательность(-и) нуклеиновой кислоты, или композиция(-ии), содержащая(-ие) любое из вышеперечисленных, могут быть предоставлены в виде набора, то есть упакованной комбинации реагентов в заранее определенных количествах с инструкциями по выполнению диагностического анализа. Если связывающие лейкотоксин антитело или антигенсвязывающий фрагмент мечены ферментом, желательно, чтобы набор содержал субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, который обеспечивает детектируемый хромофор или флуорофор). В дополнение, в набор могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или буфер для лизиса) и т. п. Относительные количества различных реагентов могут варьироваться для обеспечения концентраций реагентов в растворе, которые существенно оптимизируют чувствительность анализа. Реагенты могут быть представлены в виде сухих порошков (как правило лиофилизированных), включая вспомогательные вещества, которые при растворении будут предоставлять раствор реагента соответствующей концентрации.
[0099] Следующие примеры дополнительно иллюстрируют настоящее изобретение, но, разумеется, их не следует рассматривать как каким-либо образом ограничивающие его объем.
ПРИМЕР 1
[00100] Антитело SAN481 к лейкотоксину содержит тяжелую цепь с аминокислотной последовательностью под SEQ ID NO:9 и легкую цепь с аминокислотной последовательностью под SEQ ID NO:10. В этих последовательностях выявили несколько факторов неустойчивости. Например, наблюдали окисление тяжелой цепи W100a (в VH-CDR3) и M256 (в Fc-домене). Кроме того, сайт гликозилирования (NFS) в вариабельной области тяжелой цепи был гликозилирован на 70%. Идентифицировали два сайта дезамидирования NS в VL-CDR1, и идентифицировали сайт изомеризации DG/DS в VH-CDR2. Кроме того, светочувствительность привела к увеличению агрегации SAN481 на 3,5% после 1 недели воздействия CWL-2kLux.
[00101] Чтобы получить улучшенный вариант антитела SAN481, разработали и протестировали ряд вариантов последовательности. Варианты разработали для устранения этих факторов неустойчивости и для увеличения периода полужизни без влияния на активность антитела в отношении нейтрализации лейкотоксина. (Первоначальные попытки устранить факторы неустойчивости привели к потере активности связывания и нейтрализации LukSF. Эти первоначальные попытки включали мутацию W102 на F, Y, A, L, I, G и V в конструкции, содержащей мутацию N28T.) Мутацию YTE использовали для продления периода полужизни, и эта же мутация также способствует удалению сайта окисления метионина (остаток M256) в Fc-области.
[00102] Затем эти варианты тестировали на активность связывания и нейтрализации в отношении LukSF, на их фотостабильность и возможность разработки. Результаты сведены в таблицу 8 ниже, а дополнительную информацию можно найти в следующих примерах.
Таблица 8. SAN481 и варианты SAN481
(LukSF)
HL-60,
мкг/мл
(HIgAB)
HL-60,
мкг/мл
M
мг/л
Белка А
% изменения агр.
"мон." = мономер
"агр." = агрегация
[00103] SAN481-SYT-YTE выбрали в качестве особенно выгодного варианта ввиду того факта, что он характеризовался такими же значениями IC50 в отношении LukSF, LukED и HIgAB, что и SAN481, характеризовался минимальным увеличением агрегации под воздействием света, не характеризовался значительным дезамидированием и изомеризацией CDR (1,1%), не характеризовался проблемами со стабильностью, самоассоциацией и неспецифическим связыванием.
ПРИМЕР 2
[00104] Данный пример демонстрирует, что, в отличие от других вариантов SAN481, антитело SAN481-SYT-YTE поддерживает активность SAN481 in vitro.
[00105] Проводили анализы in vitro для оценки активности вариантов SAN481. В данных анализах дифференцированные моноцитарные клетки человека HL60 (2,5e4 лунка/25 мкл) инкубировали в течение 2 часов при 37°C с 50 мкл смеси LukSF (100 нг/мл каждая) или HIgAB (400 нг/мл каждая) и серийными разведениями каждого мутанта mAb (25 мкл), как показано на фигуре 1.
Процент жизнеспособности клеток измеряли с помощью анализа Cell Glo и рассчитывали следующим образом: 100*[(клетки OD450+токсин+mAb)/(клетки OD450 отдельно)]. Концентрацию mAb, необходимую для достижения 50% подавления жизнеспособности (IC50), рассчитывали и представили в таблице 9.
Таблица 9. Активность вариантов SAN481 в отношении LukSF и HIgAB
(мкг/мл)
[00106] Антитела SAN481-TF-YTE и SAN481-SYTF-YTE характеризовались потерей эффективности в отношении LukSF соответственно в 5,07 и 8,56 раз по сравнению с SAN481. Однако для антитела SAN481-SYT-YTE не отмечали такой эффект.
ПРИМЕР 3
[00107] Данный пример демонстрирует, что антитело SAN481-SYT-YTE характеризуется аналогичной антителу SAN481 нейтрализацией лейкотоксина in vitro.
[00108] Активность нейтрализации лейкотоксина in vitro тестировали с помощью анализа жизнеспособности клеток. Более конкретно, дифференцированные моноцитарные клетки человека HL60 (2,5e4 лунка/25 мкл) инкубировали в течение 2 часов при 37°C с 50 мкл смеси LukSF (100 нг/мл каждая), LukED (2000 нг/мл каждая), HlgCB (200 нг/мг каждая) или HIgAB (400 нг/мл каждая) и серийными разведениями SAN481 или SAN481_SYT-YTE (25 мкл), как показано на фигуре 2. Процент жизнеспособности клеток измеряли с помощью анализа Cell Glo и рассчитывали следующим образом: 100*[(клетки OD450+токсин+mAb)/(клетки OD450 отдельно)], и отображали в виде графика на фигуре 2.
[00109] Результаты, показанные на фигуре 2, демонстрируют, что SAN481-SYT-YTE и SAN481 обладают аналогичной активностью нейтрализации in vitro в отношении всех LukSF, HIgAB, HIgBC и LukED.
ПРИМЕР 4
[00110] Данный пример демонстрирует, что SAN481-SYT-YTE демонстрирует превосходную фотостабильность.
[00111] Тестировали фотостабильность вариантов SAN481. В данных анализах аффинность связывания вариантов mAb в отношении рекомбинантных антигенов измеряли с помощью бинтерферометрии биослоя на приборе Octet384 (ForteBio, Менло-Парк, Калифорния, США). Для определения внутренней аффинности связывания антитела в концентрации 2 мкг/мл в PBS pH 7,2, 3 мг/мл BSA, 0,05% (об./об.) tween 20 (1× Kinetics Buffer, ForteBio) захватывали биосенсорами, связывающими Fc IgG человека (ForteBio). После промывки измерения ассоциации и диссоциации проводили с использованием серийных разведений антигенного белка. Константу диссоциации (KD) рассчитывали как отношение двух констант скорости (koff/kon) из нелинейной аппроксимации данных с использованием программного обеспечения Octet384 v.7.2.
[00112] Результаты показаны в таблицах 10 и 11 ниже.
Таблица 10. Фотостабильность вариантов SAN481 после одной недели
Таблица 11. Активность связывания на Octet подвергнутых воздействию света SAN481, SAN481-YTE и SAN481-SYT-YTE
[00113] Результаты демонстрируют превосходную фотостабильность SAN481-SYT-YTE и отсутствие потери связывания для образцов SAN481-SYT-YTE при воздействии света.
[00114] Все ссылки, включая публикации, заявки на патенты и патенты, цитируемые в данном документе, включены в данный документ посредством ссылки в той же степени, как если бы каждый документ был конкретно и отдельно указан как включенный посредством ссылки и был представлен во всей своей полноте в данном документе.
[00115] Использование выражений и терминов в единственном числе и выражения "по меньшей мере один" и подобных определений в контексте описания настоящего изобретения (особенно в контексте нижеследующей формулы изобретения) должны толковаться как охватывающие как единственное число, так и множественное число, если в данном документе не указано иное или иное явно не противоречит контексту. Использование выражения "по меньшей мере один", после которого следует перечень из одного или нескольких элементов (например, "по меньшей мере один из A и B") подразумевает один элемент, выбранный из списка элементов (A или B), или любую комбинацию из двух или более из указанных элементов (A и B), если в данном документе не указано иное или иное явно не противоречит контексту. Выражения "состоящий", "имеющий", "включающий" и "содержащий" следует понимать, как открытые термины (т. е. означающие "включающий без ограничения"), если не указано иное. Предусматривается, что приведение диапазонов значений в данном документе служит исключительно в качестве способа сокращения индивидуального указания каждого отдельного значения, входящего в данный диапазон, если в данном документе не указано иное, и каждое отдельное значение включено в настоящее описание, как если бы оно было индивидуально упомянуто в данном документе. Все способы, описанные в данном документе, могут выполняться в любом подходящем порядке, если в данном документе не указано иное или иное явно не противоречит контексту. Применение всех возможных примеров или иллюстративных фраз (например, "такой как"), предусмотренных в данном документе, предназначено исключительно для лучшего освещения настоящего изобретения, а не для формулирования ограничения объема настоящего изобретения, если не заявлено иное. Никакая фраза в настоящем описании не должна толковаться как указание, что какой-либо незаявленный элемент является существенным для осуществления настоящего изобретения на практике.
[00116] Предпочтительные варианты осуществления данного изобретения описаны в данном документе, включая лучший вариант, известный авторам настоящего изобретения, для осуществления настоящего изобретения. Варианты этих предпочтительных вариантов осуществления могут стать очевидными для специалистов в данной области техники после ознакомления с вышеуказанным описанием. Авторы настоящего изобретения ожидают, что специалисты в данной области техники используют такие варианты как подходящие, и авторы настоящего изобретения предполагают, что настоящее изобретение будет реализовано на практике иначе, чем конкретно описано в данном документе. Соответственно, настоящее изобретение включает все модификации и эквиваленты объекта, упомянутого в прилагаемой формуле изобретения, как это разрешено действующим законодательством. Более того, любая комбинация вышеописанных элементов во всех возможных их вариантах охватывается настоящим изобретением, если в данном документе не указано иное или иное явно не противоречит контексту.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> МЕДИММЬЮН, ЭлЭлСи
ХУМАБС БИОМЕД СА
<120> Антитела, направленные против лейкотоксинов Staphylococcus aureus
<130> 2943.103PC02
<150> US 62/743,501
<151> 2018-10-09
<160> 28
<170> PatentIn версия 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481 VH CDR1
<400> 1
Thr Tyr Ala Met His
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481 VH CDR2
<400> 2
Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481 VH CDR3
<400> 3
Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr
1 5 10
<210> 4
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1 VL SAN 481
<400> 4
Ser Gly Asn Ser Tyr Asn Ile Gly Ser Asn Ser Val Tyr
1 5 10
<210> 5
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481 VL CDR2
<400> 5
Arg Ser Ile Gln Arg Pro Ser
1 5
<210> 6
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481 VL CDR3
<400> 6
Ala Ala Trp Asp Asp Ser Leu Arg Ala Trp Val
1 5 10
<210> 7
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481 VH
<400> 7
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asn Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481 VL
<400> 8
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Asn Ser Tyr Asn Ile Gly Ser Asn
20 25 30
Ser Val Tyr Trp Tyr Gln Gln Phe Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Ser Arg Ser Ile Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Val Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Arg Ala Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 9
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SAN481
<400> 9
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asn Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 10
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь SAN481
<400> 10
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Asn Ser Tyr Asn Ile Gly Ser Asn
20 25 30
Ser Val Tyr Trp Tyr Gln Gln Phe Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Ser Arg Ser Ile Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Val Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Arg Ala Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 11
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SAN481-YTE
<400> 11
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asn Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr
245 250 255
Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 12
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-SY VL CDR1
<400> 12
Ser Gly Ser Ser Tyr Asn Ile Gly Ser Asn Tyr Val Tyr
1 5 10
<210> 13
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-SY VL
<400> 13
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Tyr Asn Ile Gly Ser Asn
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Phe Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Ser Arg Ser Ile Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Val Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Arg Ala Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 14
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь SAN481-SY
<400> 14
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Tyr Asn Ile Gly Ser Asn
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Phe Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Ser Arg Ser Ile Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Val Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Arg Ala Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 15
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-T VH
<400> 15
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 16
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SAN481-T-YTE
<400> 16
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr
245 250 255
Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 17
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-TF VH CDR3
<400> 17
Asp Glu Tyr Thr Gly Gly Phe Tyr Ser Val Gly Tyr
1 5 10
<210> 18
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-TF VH
<400> 18
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Phe Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 19
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SAN481-TF-YTE
<400> 19
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Phe Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr
245 250 255
Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 20
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-EG VH CDR2
<400> 20
Val Thr Ser Phe Glu Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val Lys
1 5 10 15
Gly
<210> 21
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-EG VH
<400> 21
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asn Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Glu Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SAN481-EG-YTE
<400> 22
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asn Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Glu Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr
245 250 255
Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 23
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> SAN481-QFS VH
<400> 23
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Gln Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 24
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SAN481-QFS-YTE
<400> 24
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Gln Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr
245 250 255
Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 25
<211> 302
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> LukF
<400> 25
Gly Ala Gln His Ile Thr Pro Val Ser Glu Lys Lys Val Asp Asp Lys
1 5 10 15
Ile Thr Leu Tyr Lys Thr Thr Ala Thr Ser Asp Ser Asp Lys Leu Lys
20 25 30
Ile Ser Gln Ile Leu Thr Phe Asn Phe Ile Lys Asp Lys Ser Tyr Asp
35 40 45
Lys Asp Thr Leu Ile Leu Lys Ala Ala Gly Asn Ile Tyr Ser Gly Tyr
50 55 60
Thr Lys Pro Asn Pro Lys Asp Thr Ile Ser Ser Gln Phe Tyr Trp Gly
65 70 75 80
Ser Lys Tyr Asn Ile Ser Ile Asn Ser Asp Ser Asn Asp Ser Val Asn
85 90 95
Val Val Asp Tyr Ala Pro Lys Asn Gln Asn Glu Glu Phe Gln Val Gln
100 105 110
Gln Thr Val Gly Tyr Ser Tyr Gly Gly Asp Ile Asn Ile Ser Asn Gly
115 120 125
Leu Ser Gly Gly Gly Asn Gly Ser Lys Ser Phe Ser Glu Thr Ile Asn
130 135 140
Tyr Lys Gln Glu Ser Tyr Arg Thr Ser Leu Asp Lys Arg Thr Asn Phe
145 150 155 160
Lys Lys Ile Gly Trp Asp Val Glu Ala His Lys Ile Met Asn Asn Gly
165 170 175
Trp Gly Pro Tyr Gly Arg Asp Ser Tyr His Ser Thr Tyr Gly Asn Glu
180 185 190
Met Phe Leu Gly Ser Arg Gln Ser Asn Leu Asn Ala Gly Gln Asn Phe
195 200 205
Leu Glu Tyr His Lys Met Pro Val Leu Ser Arg Gly Asn Phe Asn Pro
210 215 220
Glu Phe Ile Gly Val Leu Ser Arg Lys Gln Asn Ala Ala Lys Lys Ser
225 230 235 240
Lys Ile Thr Val Thr Tyr Gln Arg Glu Met Asp Arg Tyr Thr Asn Phe
245 250 255
Trp Asn Gln Leu His Trp Ile Gly Asn Asn Tyr Lys Asp Glu Asn Arg
260 265 270
Ala Thr His Thr Ser Ile Tyr Glu Val Asp Trp Glu Asn His Thr Val
275 280 285
Lys Leu Ile Asp Thr Gln Ser Lys Glu Lys Asn Pro Met Ser
290 295 300
<210> 26
<211> 302
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> LukD
<400> 26
Gly Ala Gln His Ile Thr Pro Val Ser Glu Lys Lys Val Asp Asp Lys
1 5 10 15
Ile Thr Leu Tyr Lys Thr Thr Ala Thr Ser Asp Asn Asp Lys Leu Asn
20 25 30
Ile Ser Gln Ile Leu Thr Phe Asn Phe Ile Lys Asp Lys Ser Tyr Asp
35 40 45
Lys Asp Thr Leu Val Leu Lys Ala Ala Gly Asn Ile Asn Ser Gly Tyr
50 55 60
Lys Lys Pro Asn Pro Lys Asp Tyr Asn Tyr Ser Gln Phe Tyr Trp Gly
65 70 75 80
Gly Lys Tyr Asn Val Ser Val Ser Ser Glu Ser Asn Asp Ala Val Asn
85 90 95
Val Val Asp Tyr Ala Pro Lys Asn Gln Asn Glu Glu Phe Gln Val Gln
100 105 110
Gln Thr Leu Gly Tyr Ser Tyr Gly Gly Asp Ile Asn Ile Ser Asn Gly
115 120 125
Leu Ser Gly Gly Leu Asn Gly Ser Lys Ser Phe Ser Glu Thr Ile Asn
130 135 140
Tyr Lys Gln Glu Ser Tyr Arg Thr Thr Ile Asp Arg Lys Thr Asn His
145 150 155 160
Lys Ser Ile Gly Trp Gly Val Glu Ala His Lys Ile Met Asn Asn Gly
165 170 175
Trp Gly Pro Tyr Gly Arg Asp Ser Tyr Asp Pro Thr Tyr Gly Asn Glu
180 185 190
Leu Phe Leu Gly Gly Arg Gln Ser Ser Ser Asn Ala Gly Gln Asn Phe
195 200 205
Leu Pro Thr His Gln Met Pro Leu Leu Ala Arg Gly Asn Phe Asn Pro
210 215 220
Glu Phe Ile Ser Val Leu Ser His Lys Gln Asn Asp Thr Lys Lys Ser
225 230 235 240
Lys Ile Lys Val Thr Tyr Gln Arg Glu Met Asp Arg Tyr Thr Asn Gln
245 250 255
Trp Asn Arg Leu His Trp Val Gly Asn Asn Tyr Lys Asn Gln Asn Thr
260 265 270
Val Thr Phe Thr Ser Thr Tyr Glu Val Asp Trp Gln Asn His Thr Val
275 280 285
Lys Leu Ile Gly Thr Asp Ser Lys Glu Thr Asn Pro Gly Val
290 295 300
<210> 27
<211> 300
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HIgB
<400> 27
Gly Glu Gly Lys Ile Thr Pro Val Ser Val Lys Lys Val Asp Asp Lys
1 5 10 15
Val Thr Leu Tyr Lys Thr Thr Ala Thr Ala Asp Ser Asp Lys Phe Lys
20 25 30
Ile Ser Gln Ile Leu Thr Phe Asn Phe Ile Lys Asp Lys Ser Tyr Asp
35 40 45
Lys Asp Thr Leu Val Leu Lys Ala Thr Gly Asn Ile Asn Ser Gly Phe
50 55 60
Val Lys Pro Asn Pro Asn Asp Tyr Asp Phe Ser Lys Leu Tyr Trp Gly
65 70 75 80
Ala Lys Tyr Asn Val Ser Ile Ser Ser Gln Ser Asn Asp Ser Val Asn
85 90 95
Val Val Asp Tyr Ala Pro Lys Asn Gln Asn Glu Glu Phe Gln Val Gln
100 105 110
Asn Thr Leu Gly Tyr Thr Phe Gly Gly Asp Ile Ser Ile Ser Asn Gly
115 120 125
Leu Ser Gly Gly Leu Asn Gly Asn Thr Ala Phe Ser Glu Thr Ile Asn
130 135 140
Tyr Lys Gln Glu Ser Tyr Arg Thr Thr Leu Ser Arg Asn Thr Asn Tyr
145 150 155 160
Lys Asn Val Gly Trp Gly Val Glu Ala His Lys Ile Met Asn Asn Gly
165 170 175
Trp Gly Pro Tyr Gly Arg Asp Ser Phe His Pro Thr Tyr Gly Asn Glu
180 185 190
Leu Phe Leu Ala Gly Arg Gln Ser Ser Ala Tyr Ala Gly Gln Asn Phe
195 200 205
Ile Ala Gln His Gln Met Pro Leu Leu Ser Arg Ser Asn Phe Asn Pro
210 215 220
Glu Phe Leu Ser Val Leu Ser His Arg Gln Asp Gly Ala Lys Lys Ser
225 230 235 240
Lys Ile Thr Val Thr Tyr Gln Arg Glu Met Asp Leu Tyr Gln Ile Arg
245 250 255
Trp Asn Gly Phe Tyr Trp Ala Gly Ala Asn Tyr Lys Asn Phe Lys Thr
260 265 270
Arg Thr Phe Lys Ser Thr Tyr Glu Ile Asp Trp Glu Asn His Lys Val
275 280 285
Lys Leu Leu Asp Thr Lys Glu Thr Glu Asn Asn Lys
290 295 300
<210> 28
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SAN481-T
<400> 28
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Phe Asp Gly Ser Asn Glu Tyr Tyr Ile Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Gly Leu Arg Val Glu Asp Thr Ala Leu Tyr Phe Cys
85 90 95
Ala Arg Asp Glu Tyr Thr Gly Gly Trp Tyr Ser Val Gly Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ АНТИТЕЛ К STAPHYLOCOCCUS AUREUS | 2019 |
|
RU2804815C2 |
| АНТИ-PCSK9 АНТИТЕЛО, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2739208C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛА К PCSK-9, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2782792C2 |
| АНТИТЕЛО, НАПРАВЛЕННОЕ ПРОТИВ ФАКТОРА СЛИПАНИЯ А (ClfA) S. aureus | 2019 |
|
RU2818805C2 |
| АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2825304C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ХОЛЕСТЕРИНОМ | 2021 |
|
RU2832333C1 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| АНТИТЕЛО ПРОТИВ ФАКТОРА РОСТА СОЕДИНИТЕЛЬНОЙ ТКАНИ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2819228C2 |
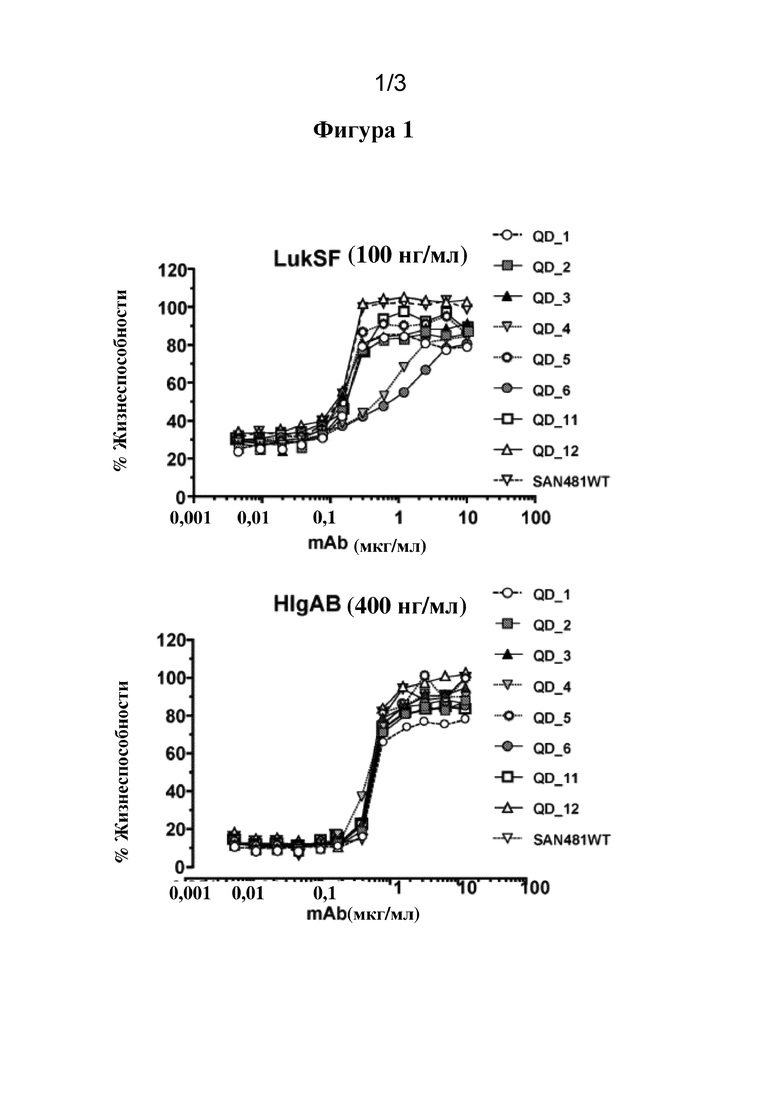
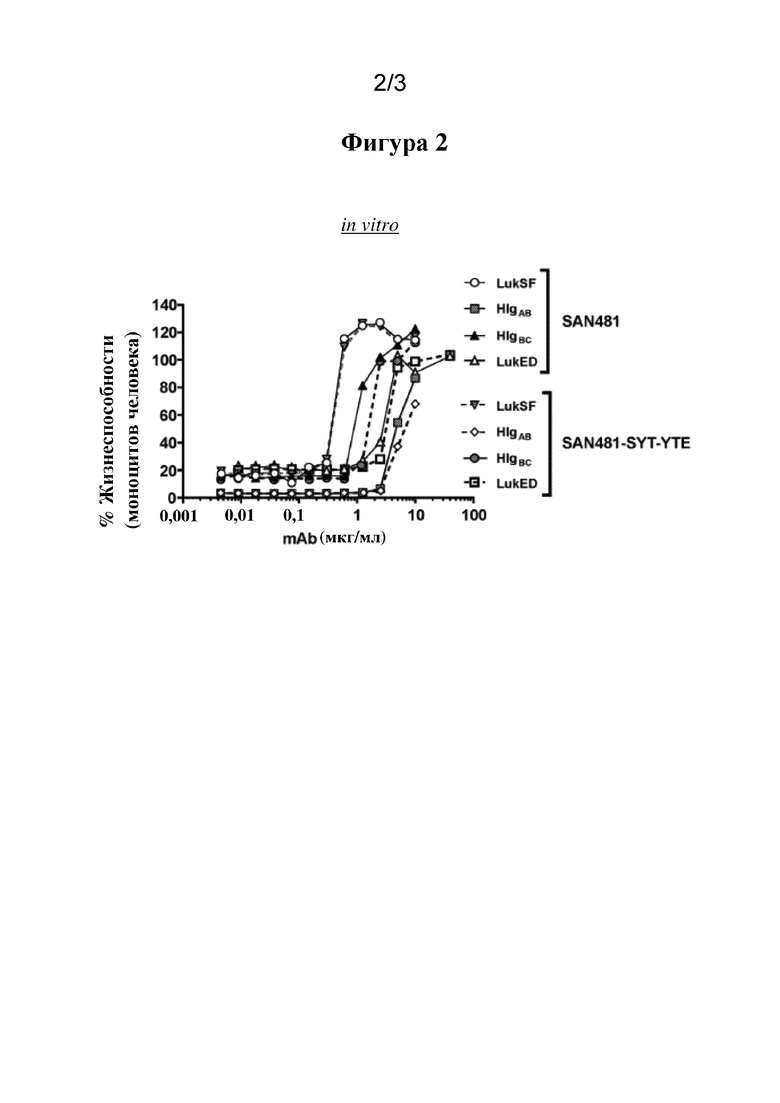

Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту, которые специфически связываются с LukD, LukF, и HIgB. Также раскрыты полинуклеотиды, кодирующие указанное антитело; вектор экспрессии, содержащий указанный полинуклеотид; клетка-хозяин, содержащая указанный вектор; фармацевтическая композиция, содержащий указанное антитело. Раскрыты способ получения указанного антитела; способ выявления S. aureus или лейкотоксина S. aureus в образце. Изобретение позволяет эффективно лечить инфекций, вызываемые Staphylococcus aureus. 9 н. и 43 з.п. ф-лы, 4 пр., 11 табл., 3 ил.
1. Антитело или его антигенсвязывающий фрагмент, которые специфически связываются с LukD, LukF, и HIgB, где антитело или антигенсвязывающий фрагмент содержат определяющую комплементарность область (CDR) 1 вариабельной области тяжелой цепи (VH), CDR2 VH, CDR3 VH, CDR1 вариабельной области легкой цепи (VL), CDR2 VL и CDR3 VL,
где CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL содержат последовательности, выбранные из группы, состоящей из:
(а) SEQ ID NO: 1, 2, 3, 12, 5 и 6 соответственно;
(b) SEQ ID NO: 1-6 соответственно;
(c) SEQ ID NO: 1, 2, 17, 4, 5 и 6 соответственно;
(d) SEQ ID NO: 1, 2, 17, 12, 5 и 6 соответственно; и
(e) SEQ ID NO: 1, 20, 3, 4, 5 и 6 соответственно.
2. Антитело или его антигенсвязывающий фрагмент по п.1, где антитело или его антигенсвязывающий фрагмент содержат VH и VL,
где VH содержит аминокислотную последовательность SEQ ID NO: 7, 15, 18, 21 или 23.
3. Антитело или его антигенсвязывающий фрагмент по п.1 или 2, где антитело или его антигенсвязывающий фрагмент содержат VH и VL,
где VL содержит аминокислотную последовательность SEQ ID NO: 8 или 13.
4. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-3, где антитело или его антигенсвязывающий фрагмент содержат VH и VL,
где VH и VL содержат последовательности, выбранные из группы, состоящей из:
(а) SEQ ID NO: 15 и 13 соответственно;
(b) SEQ ID NO: 7 и 8 соответственно;
(c) SEQ ID NO: 7 и 13 соответственно;
(d) SEQ ID NO: 15 и 8 соответственно;
(e) SEQ ID NO: 18 и 8 соответственно;
(f) SEQ ID NO: 18 и 13 соответственно;
(g) SEQ ID NO: 21 и 8 соответственно; и
(h) SEQ ID NO: 23 и 13 соответственно.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-3, где антитело или его антигенсвязывающий фрагмент содержат
VH, содержащую последовательность SEQ ID NO: 15, и
VL, содержащую последовательность SEQ ID NO: 13.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-5, где антитело или антигенсвязывающий фрагмент содержат тяжелую цепь, содержащую последовательность SEQ ID NO: 16, 9, 11, 22 или 24.
7. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-6, где антитело или его антигенсвязывающий фрагмент содержат легкую цепь, содержащую последовательность SEQ ID NO: 14 или 10.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-7, где антитело содержит тяжелую цепь и легкую цепь,
где тяжелая и легкая цепи содержат последовательности, выбранные из группы, состоящей из:
(a) SEQ ID NO: 16 и 14 соответственно;
(b) SEQ ID NO: 9 и 10 соответственно;
(c) SEQ ID NO: 11 и 10 соответственно;
(d) SEQ ID NO: 11 и 14 соответственно;
(e) SEQ ID NO: 16 и 10 соответственно;
(f) SEQ ID NO: 19 и 10 соответственно;
(g) SEQ ID NO:19 и 14, соответственно;
(h) SEQ ID NO: 22 и 10 соответственно; и
(i) SEQ ID NO: 24 и 14 соответственно.
9. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-7, где антитело содержит
тяжелую цепь, содержащую последовательность SEQ ID NO: 16, и
легкую цепь, содержащую последовательность SEQ ID NO: 14.
10. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-9, где антитело или антигенсвязывающий фрагмент нейтрализуют LukSF, LukED или HIgAB.
11. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, где антитело или антигенсвязывающий фрагмент дополнительно содержат константную область тяжелой цепи.
12. Антитело или его антигенсвязывающий фрагмент по п.11, где константная область тяжелой цепи выбрана из группы, состоящей из константных областей тяжелой цепи человеческого иммуноглобулина IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
13. Антитело или его антигенсвязывающий фрагмент по п.12, где константная область тяжелой цепи представляет собой константную область человеческого IgG1.
14. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-13, где антитело или антигенсвязывающий фрагмент дополнительно содержат константную область легкой цепи.
15. Антитело или его антигенсвязывающий фрагмент по п.14, где константная область легкой цепи выбрана из группы, состоящей из константных областей легкой цепи человеческого иммуноглобулина IgGκ и IgGλ.
16. Антитело или его антигенсвязывающий фрагмент по п.15, где константная область легкой цепи представляет собой константную область легкой цепи человеческого IgGκ.
17. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-16, где антитело или его антигенсвязывающий фрагмент представляют собой антитело IgG или его антигенсвязывающий фрагмент.
18. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-17, где антитело или его антигенсвязывающий фрагмент содержат Fc-область, которая была сконструирована для повышения периода полужизни.
19. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-18, где антитело или его антигенсвязывающий фрагмент содержат Fc-область с мутацией YTE.
20. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-19, где антитело или антигенсвязывающий фрагмент представляют собой моноклональное антитело или антигенсвязывающий фрагмент.
21. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-20, где антитело или антигенсвязывающий фрагмент представляют собой полноразмерное антитело.
22. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-21, где антитело или антигенсвязывающий фрагмент представляют собой антигенсвязывающий фрагмент.
23. Антигенсвязывающий фрагмент по п.22, где антигенсвязывающий фрагмент включает Fab, Fab', F(ab')2, одноцепочечный Fv (scFv), связанный дисульфидной связью Fv, интратело, IgGΔCH2, миниантитело, F(ab')3, тетратело, триатело, диатело, Fcab, mAb2, (scFv)2 или scFv-Fc.
24. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-23, где антитело или его антигенсвязывающий фрагмент характеризуются аффинностью менее 75 пМ в отношении LukF, LukD и HIgB S.aureus.
25. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-24, где антитело или его антигенсвязывающий фрагмент характеризуются сходной аффинностью связывания в отношении LukF, LukD и HIgB.
26. Композиция для лечения или профилактики инфекции, вызванной Staphylococcus aureus (S.aureus), содержащая эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-25 и, необязательно, фармацевтически приемлемый носитель.
27. Способ лечения или профилактики инфекции, вызыванной Staphylococcus aureus (S.aureus), у индивида, включающий введение индивиду антитела или антигенсвязывающего фрагмента по любому из пп.1-25 или композиции по п.26.
28. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой сепсис.
29. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой бактериемию.
30. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой пневмонию.
31. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой пневмонию в ICU.
32. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой инфекцию кожи или мягких тканей (SSTI).
33. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой инфекцию нижних конечностей у больного диабетом.
34. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой язву, обусловленную синдромом диабетической стопы (DFU).
35. Способ по п.34, где DFU является неинфицированной.
36. Способ по п.34, где DFU является инфицированной.
37. Способ по п.34, где DFU представляет собой DFU 1, 2 или 3 степени.
38. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой инфекцию костей или суставов.
39. Способ по п.27, где инфекция, вызываемая S.aureus, представляет собой инфекцию суставов, инфекцию, ассоциированную с медицинским изделием в организме, раневую инфекцию, инфекцию области хирургического вмешательства или остеомиелит.
40. Способ по любому из пп.27-39, где индивид является объектом хирургического вмешательства.
41. Способ по любому из пп.27-40, где инфекция, вызываемая S. aureus, включает устойчивый к антибиотикам S. aureus.
42. Способ по любому из пп.27-41, где у индивида имеется диабет.
43. Способ по любому из пп.27-42, где индивидом является человек.
44. Способ по любому из пп.27-43, где лечение или профилактика инфекции, вызываемой S. aureus, включает нейтрализацию токсина, подавление лизиса клеток, подавление полиорганной дисфункции, подавление сепсиса, ассоциированного с S. aureus, или любую комбинацию вышеперечисленного.
45. Выделенный полинуклеотид, содержащий молекулу нуклеиновой кислоты, кодирующую VH или тяжелую цепь антитела или его антигенсвязывающего фрагмента по любому из пп.1-25 для экспрессии VH или тяжелой цепи.
46. Выделенный полинуклеотид, содержащий молекулу нуклеиновой кислоты, кодирующую VL или легкую цепь антитела или его антигенсвязывающего фрагмента по любому из пп.1-25 для экспрессии VL или легкой цепи.
47. Выделенный вектор, содержащий полинуклеотид по пп.45 и/или 46, для экспрессии VH или тяжелой цепи и VL или легкой цепи.
48. Клетка-хозяин для экспрессии полинуклеотида по пп.45 и/или 46, вектора по п.47 или первого вектора, содержащего полинуклеотид по п.45, и второго вектора, содержащего полинуклеотид по п.46.
49. Клетка-хозяин по п.48, где клетка-хозяин выбрана из группы, состоящей из клеток CHO, NS0, PER-C6, HEK-293 и HeLa.
50. Клетка-хозяин по п.48 или 49, где клетка-хозяин является выделенной.
51. Способ получения антитела или его антигенсвязывающего фрагмента по любому из пп.1-25, включающий культивирование клетки-хозяина по любому из пп.48-50, таким образом обеспечивая получение антитела или его антигенсвязывающего фрагмента.
52. Способ детекции S. aureus или лейкотоксина S. aureus в образце, включающий приведение указанного образца в контакт с антителом или его антигенсвязывающим фрагментом по любому из пп.1-25.
| СПОСОБЫ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ИНФЕКЦИЙ СТАФИЛОКОККА ЗОЛОТИСТОГО И СВЯЗАННЫХ С НИМИ НАРУШЕНИЙ | 2012 |
|
RU2635462C2 |
| US 20170233461 A1, 17.08.2017 | |||
| WO 2015091935 A2, 25.06.2015. | |||
Авторы
Даты
2023-10-24—Публикация
2019-10-08—Подача