Изобретение относится к микробиологии и биотехнологии производства иммунопероксидазных конъюгатов (ИПК), используемых для выявления антигенов возбудителей инфекционных болезней в твердофазном иммуноферментном анализе (ТИФА).
Конъюгаты на основе иммуноглобулинов G (IgG) и пероксидазы хрена (ПХ) - это специфические белковые биополимеры, имеющие слабожесткую структуру, обладающие способностью связываться с антигенами и ускорять химические реакции. В процессе хранения при температуре 4°C они подвергаются отрицательному влиянию продуктов метаболизма микроорганизмов, буферных изменений, концентрации водородных ионов и других факторов, которые по нашим наблюдениям ограничивают срок их годности от нескольких дней до двух недель.
Известен способ консервации ИПК, заключающийся в том, что после приготовления его хранят при минус 20°C в присутствии бычьего сывороточного альбумина (БСА) концентрацией 10 мг/мл [1].
Недостатками данного способа являются необходимость хранения готового продукта отдельно от остальных ингредиентов для постановки ТИФА и создание особых условий при транспортировке по «холодовой цепи».
Наиболее близким к предлагаемому изобретению является способ консервации ИПК, включающий добавление к нему БСА из расчета 10 мг/мл и лиофилизацию с последующим хранением при 4°C [2].
Недостатком способа является то, что использование БСА в качестве стабилизирующей среды при лиофилизации препарата ограничивает срок годности иммуноферментного конъюгата 12 месяцами [3, 4].
Целью изобретения является разработка способа консервации ИПК путем подбора стабилизирующей среды высушивания, которая может служить альтернативой БСА при лиофилизации и после растворения препарата с сохранением стабильности физических и иммунохимических показателей на более продолжительный срок.
Технический результат изобретения достигается тем, что при консервации ИПК в качестве стабилизирующей среды высушивания используют белковый стабилизатор (БС), приготовленный на основе водной эмульсии белка куриного яйца, обладающий регулируемым составом белковых биополимеров с инертными поверхностными свойствами. Во время лиофильного высушивания молекулы ИПК оказываются между мономерами белков стабилизатора, благодаря чему активные центры фермента и иммуноглобулинов защищены от потери специфической активности под воздействием факторов окружающей среды во время высушивания и последующего хранения.
Стабилизирующая среда высушивания ИПК должна обладать рядом необходимых свойств: не препятствовать связыванию иммуноглобулинов с антигеном; обеспечивать возможность проникновения субстрата к активному центру ПХ; оставаться инертной по отношению к химическим характеристикам продукта, способствуя сохранению его биологической активности как в жидком, так и в высушенном состоянии; удерживать в процессе лиофилизации высушиваемый продукт внутри ампулы, предотвращая его улетучивание с сублимированными водяными парами; обеспечивать высокий уровень активности препарата в течение срока хранения [5].
Принимая во внимание выше перечисленные факторы, и учитывая свойства биополимеров водной эмульсии белка куриного яйца, очевиден вывод, что наиболее подходящей стабилизирующей средой высушивания для ИПК является БС, приготовленный из белка куриного яйца по ранее разработанному и запатентованному методу [6].
Иммунопероксидазные конъюгаты получали методом перйодатного окисления по методу P.K. Nacane, A. Kawaoi [1]. Для конъюгации IgG использовали фермент ПХ - тип VI-A, RZ-3 (Sigma, США). ПХ в количестве 5 мг растворяли в 1 мл свежеприготовленного 0,3 M раствора двухуглекислого натрия. Добавляли 0,025 мл 0,32%-ного раствора формалина, осторожно перемешивали на шуттель-аппарате в темном футляре 30 мин. Затем добавляли 1 мл 0,04 M раствора перйодата натрия и инкубировали на шуттель-аппарате в темном футляре в течение 30 мин, после чего раствор приобретал зеленовато-желтый оттенок, что является признаком образования активной формы ПХ. Далее вносили 1 мл 0,16 M раствора этиленгликоля и инкубировали в темноте при легком встряхивании в течение 1 ч. Все перечисленные операции проводили при комнатной температуре. Активированную пероксидазу хрена диализировали против 1 л 0,01 M карбонат-бикарбонатного буфера (КББ) pH 9,5 при 4°C в течение 18 ч на магнитной мешалке.
К активированной ПХ добавляли 5 мг IgG против возбудителя туляремии в 1 мл 0,01 M раствора КББ (специфическая активность в реакции иммунодиффузии (РИД) не менее 1:16-1:32). Инкубацию реакционной смеси проводили при перемешивании в течение 2 ч при комнатной температуре в темном футляре. По истечении времени добавляли 5 мг боргидрида натрия и оставляли в темном футляре без перемешивания в течение 2 ч при 4°C. Затем диализировали против 1 л 0,1 M фосфатно-солевого буфера (ФСБ) pH 7,4 в течение 18 ч при 4°C на магнитной мешалке.
БС готовили следующим образом: к 25 мл белка куриного яйца добавляли 75 мл дистиллированной воды и 1,25 г натрия двууглекислого, перемешивали в течение 10-15 мин на магнитной мешалке. Затем прогревали при температуре 56°C 40-60 мин, фильтровали через 8 слоев марли. БС использовали в различных разведениях (от нативного до 1:2) с 0,1 M раствором стерильного ФСБ и добавляли к готовому ИПК в объемном соотношении 1:1. Препарат разливали в ампулы по 0,2 мл, замораживали при температуре минус (45±5)°C не менее 18 ч и лиофилизировали до конечной температуры продукта 25°C. Ампулы с препаратом сразу же после высушивания запаивали в среде атмосферного воздуха. Готовый препарат хранили при 4-6°C.
Физические свойства (растворимость, цветность, прозрачность, потеря в массе при высушивании) и иммунохимические (специфическая активность, чувствительность) контролировали после лиофилизации ИПК в процессе хранения в течение 18 месяцев (срок наблюдения) и после разведения. Чувствительность и специфическую активность ИПК определяли в «сэндвич»-варианте ТИФА. Для постановки ТИФА использовали все компоненты из набора реагентов тест-системы диагностической для выявления возбудителя туляремии в иммуноферментном анализе «ИФА-Тул-СтавНИПЧИ», кроме иммунопероксидазного конъюгата [4]. Приготовленные серии препарата соответствовали основным требованиям нормативных документов.
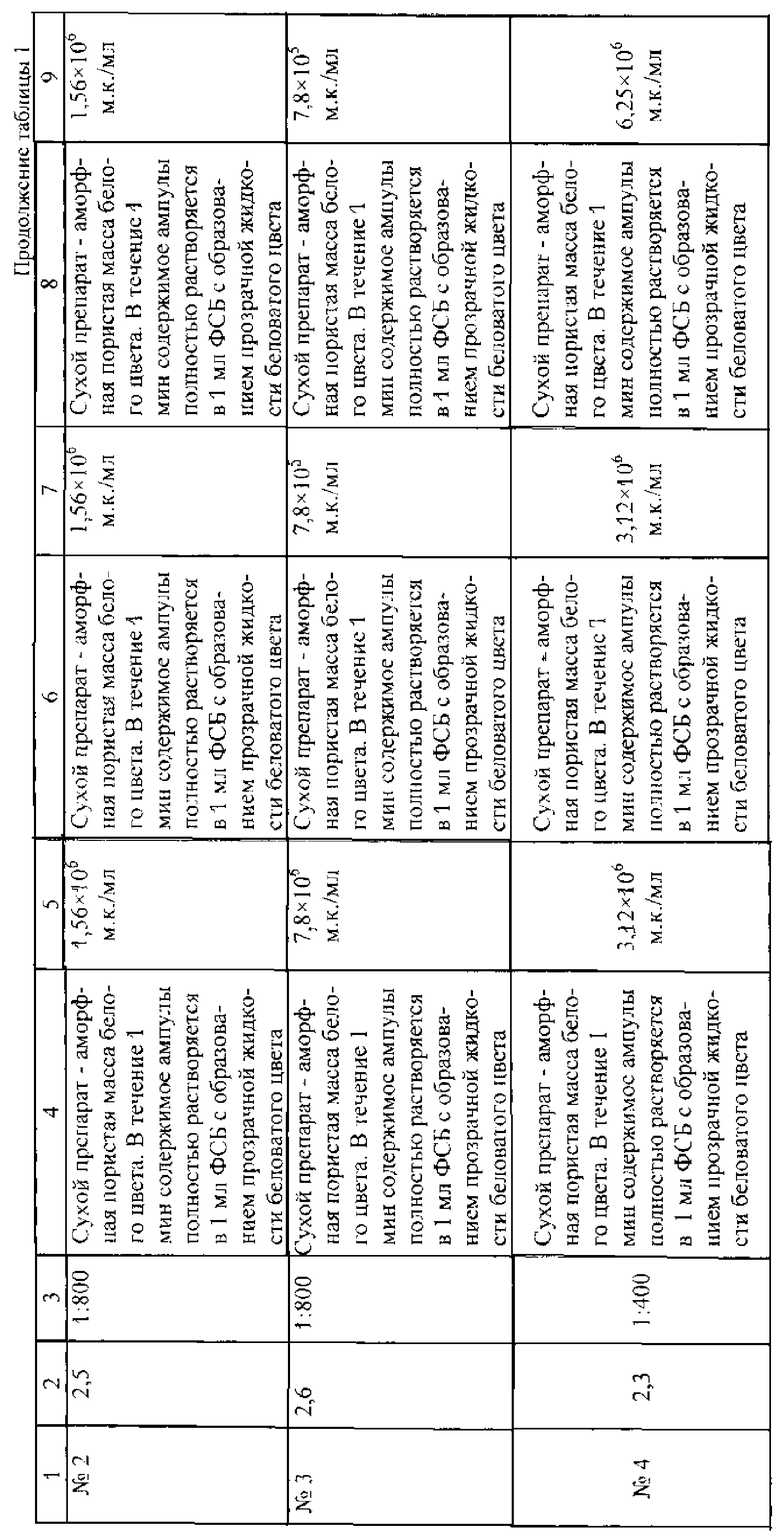
В таблице 1 представлены результаты изучения физических и иммунохимических свойств туляремийного ИПК, лиофильно высушенного в присутствии БС, подлежащего хранению в течение 18 месяцев (срок наблюдения).
При использовании в качестве стабилизирующей среды высушивания БС в различных разведениях с 0,1 M раствором стерильного ФСБ наилучшие результаты специфической активности ИПК и его чувствительности, а также стабильность характеристик в процессе хранения получены с разведением 1:1,5 (серия 3).
Таким образом, в результате проведенных исследований отработан способ консервации ИПК путем подбора стабилизирующей среды высушивания, обеспечивающей стабильность физических и иммунохимических показателей лиофилизированного и растворенного препарата.
Возможность практического применения изобретения иллюстрируется примерами его конкретного выполнения с использованием совокупности заявляемых признаков.

Пример 1. Получение туляремийного ИПК и его контроль после лиофильного высушивания в присутствии нативного БС.
Получение ИПК. ПХ в количестве 5 мг растворяли в 1 мл свежеприготовленного 0,3 M раствора двууглекислого натрия. Добавляли 0,025 мл 0,32%-ного раствора формалина, осторожно перемешивали на шуттель-аппарате в темном футляре 30 мин. Затем добавляли 1 мл 0,04 M раствора перйодата натрия, инкубировали на шуттель-аппарате в темном футляре 30 мин, после чего раствор приобретал зеленовато-желтый оттенок. Далее вносили 1 мл 0,16 M раствора этиленгликоля и инкубировали в темноте при легком встряхивании в течение 1 ч. Все перечисленные операции проводили при комнатной температуре. После диализировали против 1 л 0,01 M раствора КББ pH 9,5 при 4°C в течение 18 ч на магнитной мешалке.
Раствор активированной ПХ переносили из диализного мешка во флакон и добавляли IgG против возбудителя туляремии в концентрации 5 мг/мл в 1 мл 0,01 M КББ со специфической активностью в РИД не менее 1:16-1:32, содержимое перемешивали в течение 2 ч при комнатной температуре в темном футляре. Добавляли 5 мг боргидрида натрия, оставляли в темном футляре без перемешивания в течение 2 ч при 4°C. Затем диализировали против 1 л 0,1 M раствора ФСБ pH 7,4 в течение 18 ч при 4°C на магнитной мешалке.
БС готовили следующим образом: к 25 мл белка куриного яйца добавляли 75 мл дистиллированной воды и 1,25 г натрия двууглекислого, перемешивали в течение 10-15 мин на магнитной мешалке. Затем прогревали при температуре 56°C 40-60 мин, фильтровали через 8 слоев марли. К готовому ИПК добавляли БС в нативном состоянии в объемном соотношении 1:1. Препарат разливали в ампулы по 0,2 мл, замораживали при температуре минус (45±5)°C не менее 18 ч и лиофилизировали до конечной температуры продукта 25°C. Ампулы с препаратом сразу же после высушивания запаивали в среде атмосферного воздуха. Готовый препарат хранили при 4-6°C (серия 1).
Контролировали физические и иммунохимические свойства препарата после лиофилизации и в процессе хранения в течение 18 месяцев (срок наблюдения). Чувствительность и специфическую активность ИПК определяли в «сэндвич»-варианте ТИФА. Для постановки ТИФА использовали все компоненты из набора реагентов тест-системы диагностической для выявления возбудителя туляремии в иммуноферментном анализе «ИФА-Тул-СтавНИПЧИ», кроме иммунопероксидазного конъюгата [4]. Специфическая активность и чувствительность препарата не снижалась в течение 18 месяцев хранения (срок наблюдения). Внешний вид и растворимость препарата оставались без изменений в течение всего срока наблюдения.
Пример 2. Получение туляремийного ИПК и его контроль после лиофильного высушивания в присутствии БС, разведенного 1:1 в 0,1 M растворе ФСБ.
ИПК получали аналогично примеру 1.
БС готовили аналогично примеру 1.
БС разводили 1:1 0,1 M раствором стерильного ФСБ. Полученный раствор БС добавляли к готовому ИПК в объемном соотношении 1:1. Препарат разливали в ампулы по 0,2 мл, замораживали при температуре минус (45±5)°С не менее 18 ч и лиофилизировали до конечной температуры продукта 25°С. Ампулы с препаратом сразу же после высушивания запаивали в среде атмосферного воздуха. Готовый препарат хранили при 4-6°С (серия 2).
Контролировали физические и иммунохимические свойства препарата после лиофилизации и в процессе хранения в течение 18 месяцев (срок наблюдения) аналогично примеру 1. Специфическая активность и чувствительность ИПК не снижалась в течение 18 месяцев хранения (срок наблюдения). Внешний вид и растворимость препарата оставались без изменений в течение всего срока наблюдения.
Пример 3. Получение ИПК и его контроль после лиофильного высушивания в присутствии БС, разведенного в 1:1,5 в 0,1 M растворе ФСБ.
ИПК получали аналогично примеру 1.
БС готовили аналогично примеру 1.
БС разводили 1:1,5 0,1 M раствором стерильного ФСБ. Полученный раствор БС добавляли к готовому ИПК в объемном соотношении 1:1. Препарат разливали в ампулы по 0,2 мл, замораживали при температуре минус (45±5)°С не менее 18 ч и лиофилизировали до конечной температуры продукта 25°С. Ампулы с препаратом сразу же после высушивания запаивали в среде атмосферного воздуха. Готовый препарат хранили при 4-6°С (серия 3).
Контролировали физические и иммунохимические свойства препарата после лиофилизации и в процессе хранения в течение 18 месяцев (срок наблюдения) аналогично примеру 1. Специфическая активность и чувствительность - не снижалась в течение 18 месяцев хранения (срок наблюдения). Внешний вид и растворимость препарата оставались без изменений в течение всего срока наблюдения.
Пример 4. Получение туляремийного ИПК и его контроль после лиофильного высушивания в присутствии БС, разведенного 1:2 в 0,1 M растворе ФСБ.
ИПК получали аналогично примеру 1.
БС готовили аналогично примеру 1.
БС разводили 1:2 0,1 M раствором стерильного ФСБ. Полученный раствор БС добавляли к готовому ИПК в объемном соотношении 1:1. Препарат разливали в ампулы по 0,2 мл, замораживали при температуре минус (45±5)°С не менее 18 ч и лиофилизировали до конечной температуры продукта 25°С. Ампулы с препаратом сразу же после высушивания запаивали в среде атмосферного воздуха. Готовый препарат хранили при 4-6°С (серия 4).
Контролировали физические и иммунохимические свойства препарата после лиофилизации и в процессе хранения в течение 18 месяцев (срок наблюдения) аналогично примеру 1. Специфическая активность - не снижалась в течение 18 месяцев хранения (срок наблюдения). Чувствительность - снизилась в 2 раза после 18 месяцев хранения (срок наблюдения). Внешний вид и растворимость препарата оставались без изменений в течение всего срока наблюдения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНО-ИММУНОПЕРОКСИДАЗНОГО КОНЪЮГАТА | 2012 |
|
RU2500813C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК MUS MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К IGM СВИНЬИ | 1995 |
|
RU2093573C1 |
| СТАБИЛИЗИРУЮЩИЙ СОСТАВ ДЛЯ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННЫХ ПРЕПАРАТОВ НА ОСНОВЕ КОНЪЮГАТА АНТИИММУНОГЛОБУЛИНА G И ПЕРОКСИДАЗЫ ХРЕНА | 1996 |
|
RU2109290C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS. MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К CHLAMYDIA | 1998 |
|
RU2158760C2 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ИНФЕКЦИОННОГО БРОНХИТА КУР | 2001 |
|
RU2189042C1 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 КУР | 2000 |
|
RU2167673C1 |
| ДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ВИРУСА ГЕПАТИТА А | 1992 |
|
RU2065164C1 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВОЗБУДИТЕЛЮ РЕСПИРАТОРНОГО МИКОПЛАЗМОЗА ПТИЦ | 2001 |
|
RU2202797C2 |
| СПОСОБ ВИДОВОЙ ДИФФЕРЕНЦИАЦИИ ПАТОГЕННЫХ БУРКХОЛЬДЕРИЙ С ИСПОЛЬЗОВАНИЕМ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2018 |
|
RU2702723C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННОГО ПРЕПАРАТА КРОВЬ ГЕМОЛИЗИРОВАННАЯ | 2011 |
|
RU2455014C1 |
Изобретение относится к микробиологии и биотехнологии производства иммунопероксидазных конъюгатов, используемых для выявления антигенов возбудителей инфекционных болезней в твердофазном иммуноферментном анализе. Изобретение заключается в разработке способа консервации иммунопероксидазного конъюгата с применением в качестве стабилизирующей среды высушивания раствора белкового стабилизатора на основе водной эмульсии белка куриного яйца при лиофилизации и после растворения препарата с сохранением стабильности физических и иммунохимических показателей. Изобретение позволяет сохранять стабильность физических и иммунохимических показателей иммунопероксидазных конъюгатов в течение длительного срока. 1 табл., 3 пр.
Способ консервации иммунопероксидазного конъюгата, используемого для выявления антигенов возбудителей инфекционных болезней в твердофазном иммуноферментном анализе, отличающийся тем, что к иммунопероксидазному конъюгату добавляют раствор белкового стабилизатора на основе водной эмульсии белка куриного яйца в 0,1 M растворе фосфатно-солевого буфера (1:1,5) в объемном соотношении 1:1, после чего препарат разливают по 0,2 мл в ампулы, замораживают, лиофилизируют и хранят при температуре 4-6°C в течение 18 месяцев.
| XIAOQIANG WANG et al | |||
| Role of Ovalbumin in the Stabilization of Metastable Vaterite in Calcium Carbonate Biomineralization | |||
| J | |||
| Phys | |||
| Chem | |||
| B, 2009, 113 (26), PP | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПОВОРОТА СЕТЧАТОГО КОЛПАКА (ИСКРОУЛОВИТЕЛЯ) ПАРОВОЗНОЙ ТРУБЫ | 1927 |
|
SU8975A1 |
| WO2005118644 A2, 15.12.2005 | |||
| WO2010138522 A2, 02.12.2010 | |||
| ЖАРНИКОВА И | |||
| В | |||
| Методологические подходы и разработка биотехнологии иммунобиологических препаратов для диагностики | |||
Авторы
Даты
2015-05-10—Публикация
2014-07-01—Подача