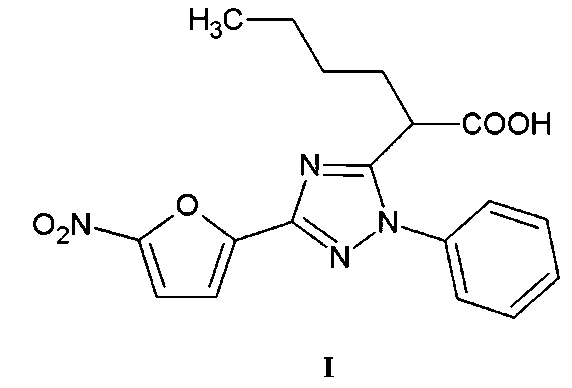
Группа изобретений относится к области органической и медицинской химии, а именно: к новому индивидуальному полифункциональному гетероциклическому соединению - 2-[3-(5-нитрофуран-2-ил)-1-фенил-1H-1,2,4-триазол-5-ил]гексановой кислоте формулы I и способу ее получения, которые могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального антимикробного средства.
Известны препараты нитрофуранового ряда - препараты широкого спектра действия, в основном используемые для лечения кишечных и урогенитальных инфекций. Данная группа соединений используется в терапии заболеваний, вызванных грамположительными и грамотрицательными бактериями, а также протозоями [Падейская Е.Н. Фурамаг в ряду антимикробных препаратов, производых 5-нитрофурана: значение для клинической практики / Ε.Н. Падейская // Инфекции и антимикробная терапия. - 2004. - Т.6, №1. - С. 24-30].
Действующие вещества зарегистрированных препаратов данной группы включают фурановый цикл, замещенный по 5-му положению нитрогруппой, а по 2-му - карбонилгидразиновой группировкой (формула II).

В последние годы для синтеза 3-арил(гетарил)-1H-1,2,4-триазол-5-илэтановых кислот был найден и развит метод синтеза из соответствующих 2-арил(гетарил)-4-гидрокси-6H-1,3-оксазин-6-онов действием гидразина в метаноле по схеме [Яковлев И.П. Пути образования, строение и свойства 1,3-оксазин-4,6-дионов и их производных: дис. … докт. хим. наук: 02.00.03 / И.П. Яковлев; СПХФА. - СПб., 1996. - 272 с.]:
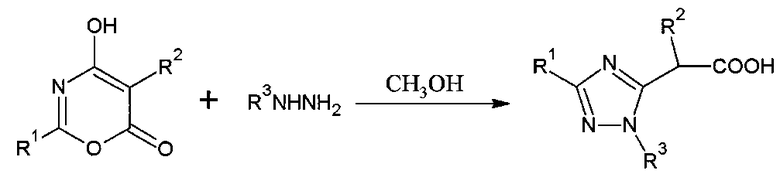
Выход данной реакции составляет 53-72%. Однако существующий метод имеет следующие недостатки:
- возможность побочной реакции расщепления оксазинового цикла метанолом, что снижает выход продукта;
- большая длительность реакции (12 часов), что обуславливается необходимостью проведения синтеза при температуре 15-20°С для уменьшения скорости побочного процесса.
Из патентной и научно-технической литературы не выявлены ни способ получения нового, заявляемого авторами соединения, ни сама структура.
Задачей предлагаемой группы изобретений является создание нового, неописанного в литературе соединения - 2-[3-(5-нитрофуран-2-ил)-1-фенил-1H-1,2,4-триазол-5-ил]гексановой кислоты (I), что позволит расширить ассортимент потенциальных антимикробных средств.
Техническими результатами, на достижение которых направлена группа изобретений, являются получение нового полифункционального гетероциклического соединения формулы I, которое потенциально может быть использовано в медицине в качестве антимикробного средства; разработка простого способа его синтеза путем совершенствования уже существующего общего метода получения 3-арил(гетарил)-1H-1,2,4-триазол-5-илэтановых кислот.
Поставленная задача осуществляется путем взаимодействия 5-бутил-4-гидрокси-2-(5-нитрофуран-2-ил)-6H-1,3-оксазин-6-она с фенилгидразином в соотношении 1:1 в среде ледяной уксусной кислоты при температуре 60°С в течение 1 часа с последующим выделением целевого продукта по схеме

Способ получения 2-[3-(5-нитрофуран-2-ил)-1-фенил-1H-1,2,4-триазол-5-ил]гексановой кислоты изучен и проведен в лабораторных условиях на стандартном товарном сырье. По сравнению с известным методом получения данной триазольной системы в метаноле при температуре 15-20°С предложенный способ позволяет избежать побочной реакции расщепления оксазинового цикла другими нуклеофилами ввиду того, что нуклеофильность уксусной кислоты значительно слабее нуклеофильности метанола. Отсутствие возможности побочных процессов позволяет повысить температуру процесса и таким образом сократить время реакции получения данной триазольной системы с 12 часов до 1 часа.
Данные элементного анализа, выход продукта реакции, температура плавления и величина Rf приведены в таблице 1, спектральные характеристики полученного соединения приведены в таблице 2.
Предполагаемая группа изобретений проиллюстрирована схемами и примерами практического осуществления.
Пример 1. Получение 2-[3-(5-нитрофуран-2-ил)-1-фенил-1Н-1,2,4-триазол-5-ил]гексановой кислоты (I). В круглодонную колбу емкостью 100 мл, снабженную обратным холодильником и термометром, загружают 20 мл ледяной уксусной кислоты, 4,2 г (15 ммоль) 5-бутил-4-гидрокси-2-(5-нитрофуран-2-ил)-6H-1,3-оксазин-6-она и 1,6 г (15 ммоль) фенилгидразина. Реакционную смесь нагревают и выдерживают 1 час при 60°С, при этом субстрат растворяется. После охлаждения полученного раствора выпадает кристаллический продукт, который отфильтровывают, промывают уксусной кислотой и водой, сушат на воздухе при температуре 15-20°С.
Масса продукта желтого цвета составляет 3,9 г, 70% от теоретического расчета на исходный оксазин. Температура плавления 184-186°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в ацетоне в системе этилацетат: уксусная кислота =9:1. Rf=0,64. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C18H18N4O5. Найдено, %: С - 58,42, Η - 4,91, Ν - 15,09, О - 21,58. Вычислено %: С - 58,38, Η - 4,90, Ν - 15,12, O - 21,60.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1H и 13С, ИК-спектроскопией.
В спектре ЯМР 1Н раствора исследуемого соединения в ДМСО-d6 в слабом поле присутствуют уширенный синглет протона карбоксильной группы в области 13,1 м.д., мультиплет протонов фенильного заместителя в области 7,60-7,70 м.д. и дублеты протонов фуранового цикла 7,40 и 7,85 м.д. В сильном поле спектра находятся сигналы протонов бутильной группы: 2,00 м.д. (м, 2Н), 1,20 м.д. (м, 4Н), 0,80 м.д. (т, 3Н), а также триплет протона α-углеродного атома в области 3,88 м.д.
В спектре ЯМР 13С в слабом поле присутствуют сигналы карбонильного атома углерода 171,3 м.д. и атомов С3, С5 триазольного цикла в области 152,6 и 156,4 м.д. Сигналы с химическими сдвигами 113,1, 115,1, 126,2, 130,3, 130,5, 136,6, 158,2, 152,2 м.д. принадлежат атомам углерода фенильного и фурильного заместителей. Сигналы атомов углерода бутильной группы имеют химические сдвиги 14,1, 22,2, 29,1, 30,2 м.д., а сигнал α-углеродного атома 43,0 м.д.
В ИК-спектре кристаллического вещества (I) в таблетках бромида калия были обнаружены полосы поглощения в области 3270-3320, 3140-3250 и 2840-2960 см-1, которые соответствуют валентным колебаниям связи О-Н карбонильной группы, связей Csp2-Ни Csp3-Η соответственно. Также на спектре присутствуют полосы поглощения групп С=O 1730 см-1 и C=N (2 полосы) 1640 и 1670 см-1 соответственно. Группа полос поглощения в области 1490-1580 см-1 относится к колебаниям С=С связей в ароматических фрагментах. Нитрогруппа в фурильном заместителе дает две полосы поглощения 1350 и 1540 см-1.
Пример 2. Соединение I обладает антимикробной активностью. Определение минимальных подавляющих концентраций (МПК) проводили методом серийных разведений в мясопептонном бульоне в отношении тест-культур Staphylococcus aureus АТСС 6538-Р и Escherichia coli АТСС и в жидкой среде Сабуро в отношении тест-культуры Candida albicans NCTC 885-653, рекомендованных Государственной Фармакопеей [Государственная фармакопея. - 12-е изд. - М., 2007. - Ч.1. - 312 с.]. Исследуемые соединения ограниченно растворяются в воде, поэтому в качестве растворителя использовали 50% раствор ДМСО, не подавляющий роста ни одной из использованных тест-культур в условиях эксперимента. Минимальная подавляющая концентрация соединения I на Е. coli и С.albicans составляет 62,5 и 125 мкг/мл соответственно. Величина МПК в отношении St. aureus составляет 4 мкг/мл, что находится на уровне широко используемых на практике нитрофуранов (эрсефурил - 10-20 мкг/мл, фуразидин - 2-10 мкг/мл) и антибиотиков (ванкомицин и тейкопланин - 0,3-12,5 мкг/мл).
Получено новое соединение - 2-[3-(5-нитрофуран-2-ил)-1-фенил-1H-1,2,4-триазол-5-ил]гексановая кислота I, которая может быть использована для синтеза новых гетероциклических соединений и в медицине в качестве потенциального антимикробного средства; разработан простой способ его синтеза.


| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЁННЫЕ 2-(1,3-БЕНЗОТИАЗОЛ-2-ИЛ)-3-ФЕНИЛ-1Н-1,2,4-ТРИАЗОЛ-5-ИЛ) ПРОПАНОВЫЕ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2603958C1 |
| Замещённые 2-(1-(3-оксо-3,4-дигидрохиноксалин-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил)пропановые кислоты и способ их получения | 2017 |
|
RU2645683C1 |
| Замещённые 2,2'-[(6-метилпиримидин-2,4-диил)бис(3-фенил-1Н-1,2,4-триазол-1,5-диил)]дипропановые кислоты и способ их получения | 2016 |
|
RU2631325C1 |
| 2-((3-(4-Бромбензоил)-4-гидрокси-1-(2-гидроксиэтил)-5-оксо-2,5-дигидро-1H-пиррол-2-ил)тио)уксусная кислота, обладающая анальгетической активностью | 2021 |
|
RU2763737C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-(1,2,4-ТРИАЗОЛ-1-ИЛ)ТРИПТАМИНОВЫХ СОЕДИНЕНИЙ И 2-[5-(1,2,4-ТРИАЗОЛ-1-ИЛ- МЕТИЛ)-1Н-ИНДОЛ-3-ИЛ/ЭТИЛОВЫЙ СПИРТ | 1995 |
|
RU2138496C1 |
| Анальгезирующее и противовирусное средство на основе замещенной 2-[1-(1Н-бензимидазол-2-ил)-3-фенил-1Н-1,2,4-триазол-5-ил]пропановой кислоты | 2018 |
|
RU2684781C1 |
| Анальгезирующее средство на основе замещённой 2-[1-(1Н-бензимидазол-2-ил)-3-фенил-1Н-1,2,4-триазол-5-ил]пропановой кислоты | 2017 |
|
RU2661603C1 |
| 3-(2-Арил-2,4-дигидрокси-1(2-гидроксиэтил)-5-оксо-2,5-дигидро-1Н-пиррол-3-ил)хиноксалин-2(1Н)-оны, обладающие анальгетической активностью и способ их получения | 2019 |
|
RU2707196C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(АЗОЛ-1-ИЛ)ЭТАНАМИНОВ | 2006 |
|
RU2317984C2 |
| Способ получения замещенных хлоридов 2-[(1Z)-1-(3,5-диарил-1,3,4-тиадиазол-2(3Н)-илиден)метил]-3,5-диарил-1,3,4-тиадиазол-3-ия | 2017 |
|
RU2637926C1 |
Изобретение относится к 2-[3-(5-нитрофуран-2-ил)-1-фенил-1H-1,2,4-триазол-5-ил]гексановой кислоте формулы I и способу её получения.
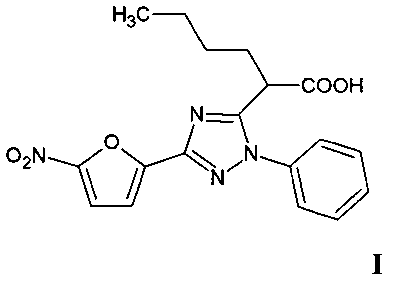
Технический результат: получено новое гетероциклическое соединение формулы I, которое может быть использовано в медицине в качестве антимикробного средства. 2 н.п. ф-лы, 2 пр., 2 табл.
1. 2-[3-(5-Нитрофуран-2-ил)-1-фенил-1H-1,2,4-триазол-5-ил]гексановая кислота формулы I
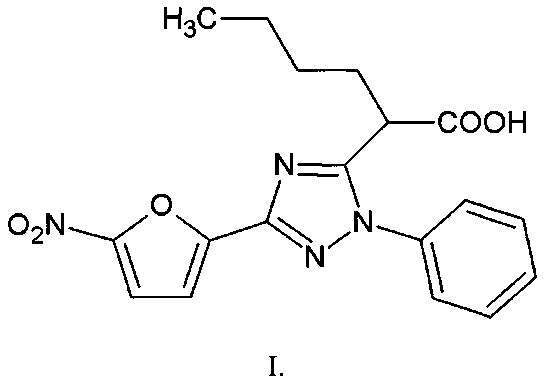
2. Способ получения 2-[3-(5-нитрофуран-2-ил)-1-фенил-1H-1,2,4-триазол-5-ил]гексановой кислоты формулы
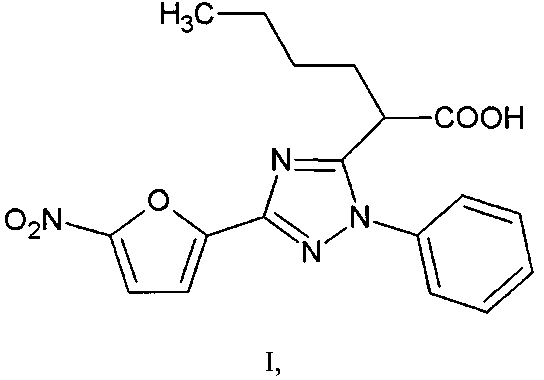
заключающийся в том, что 5-бутил-4-гидрокси-2-(5-нитрофуран-2-ил)-6H-1,3-оксазин-6-он подвергают взаимодействию с фенилгидразином в соотношении 1:1 в среде ледяной уксусной кислоты при температуре 60°C в течение 1 часа с последующим выделением целевого продукта.
| Способ получения производных 3-/1-триазолил/-фурана | 1984 |
|
SU1243624A3 |
Авторы
Даты
2015-11-10—Публикация
2014-09-18—Подача