Область техники, к которой относится изобретение
Настоящее изобретение касается соединений, представленных общей формулой (I)
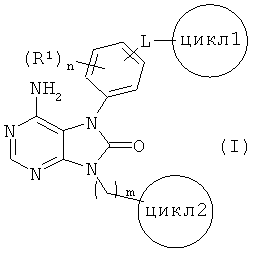
(все символы в данной формуле соответствуют приведенным ниже определениям), их оптических изомеров или их смеси, их солей, сольватов, N-оксидов и пролекарств (далее именуются "соединениями по настоящему изобретению").
Уровень техники
Тирозинкиназа Брутона (далее обозначаемая "Btk") относится к Тес-семейству киназ, представляющему собой нерецепторные тирозинкиназы, и селективно экспрессируется в линиях В-клеток и миелоцитов. Btk играет важную роль в сигнальной трансдукции в В-клетках и является фактором, влияющим на выживание, дифференцировку, пролиферацию и активацию В-клеток. Передача сигнала в В-клетках посредством антигенного рецептора В-клеток (BCR) вызывает большое количество биологических реакций, и ненормальная передача сигнала в этом случае вызывает ненормальную активацию В-клеток и образование патогенных аутоантител. Считается, что Btk является звеном в BCR-опосредованном пути передачи сигнала в В-клетки. Так, известно, что сцепленная с Х-хромосомой агаммаглобулинемия (XLA) вызвана дефектом в Btk гене человека, который приводит к началу ненормальной дифференцировки В-клеток и кардинальному снижению выработки иммуноглобулина (см. Непатентный документ 1). Симптомы данного заболевания включают значительное уменьшение количества В-клеток в периферической крови и повышенную восприимчивость к бактериальным инфекциям. Также известно, что Btk участвует в активации тучных клеток (мастоцитов) и в физиологических функциях тромбоцитов. Ввиду вышесказанного, соединения, обладающие Btk-ингибирующей активностью, эффективны при лечении заболеваний, в которых задействованы В-клетки или мастоциты, например аллергических заболеваний, аутоиммунных заболеваний, воспалительных заболеваний, тромбоэмболических заболеваний и рака (см. Непатентный документ 2).
Следующие соединения известны в качестве уровня техники для соединений по настоящему изобретению.
Соединения, представленные общей формулой (А), известны как соединения, обладающие Btk-ингибирующей активностью
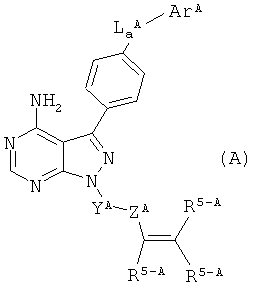
(в данной формуле, 
С другой стороны, например соединения, представленные общей формулой (В)
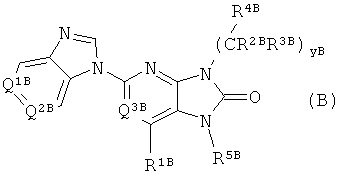
(в данной формуле, Q1B и Q2B независимо выбраны из CX1B, CX2B и азота; Q3B представляет собой N или CH; X1B и X2B независимо выбраны из группы, состоящей из атома водорода, (C1-C6) алкила, циано-группы, атома галогена и т.д.; R1B выбран из группы, состоящей из атома водорода и (C1-C6) алкила; yB равно 0 или целому числу от 1 до 3; R2B и R3B независимо выбраны из атома водорода и (C1-C6) алкила; R4B выбран из группы, состоящей из алкила, гетероциклила, арила, гетероарила и т.д.; и R5B выбран из группы, состоящей из алкила, гетероциклила и замещенного гетероциклила (определения данных групп были приведены)) (см. Патентный документ 4) известны как соединения, имеющие пуриноновый скелет.
Также известны соединения, представленные общей формулой (С),
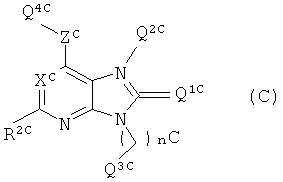
(в данной формуле, XC выбран из группы, состоящей из атома азота и CR8C; R8C выбран из группы, состоящей из атома водорода, галогена, замещенного или незамещенного алкила, и т.д.; Q1C выбран из группы, состоящей из O, S и т.д.; ZC выбран из группы, состоящей из атома кислорода, атома серы и NY5C; Y5C выбран из группы, состоящей из атома водорода, замещенного или незамещенного алкила и т.д.; Q2C, Q3C и Q4C независимо выбраны из группы, состоящей из атома водорода, замещенного или незамещенного алкила, замещенного или незамещенного арила и т.д.; R2C выбран из группы, состоящей из атома водорода и замещенного или незамещенного алкила; и nC равно 0, 1, 2, 3 или 4 (определения данных групп были приведены)) (см. Патентный документ 5).
Соединения, имеющие пуриноновый скелет, описаны также как формула 20 (в параграфе номер 0028) в Патентном Документе 6.
Также известны соединения, представленные общей формулой (D)
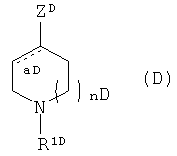
(в данной формуле, R1D представляет собой группу, выбранную из атома водорода, замещенного или незамещенного алкила,
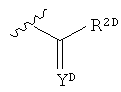
и т.д.; R2D представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил; YD представляет собой группу, выбранную из O, C-NO2 и S; ZD представляет собой группу, выбранную из
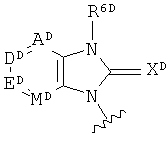
и т.д.; в данном случае каждый из AD, DD, ED и MD независимо представляет собой CR12D, N и N-оксид; R представляет собой группу, выбранную из атома водорода, атома галогена, амино-, гидрокси- и циано-групп; XD представляет собой группу, выбранную из О, C-NO2 и S; R6D представляет собой группу, выбранную из замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероалкила и замещенного или незамещенного арила; обозначение aD, изображенное пунктирной линией, представляет собой простую связь или двойную связь; и nD представляет собой целое число, выбранное из 0,1 и 2) (см. Патентный документ 7).
Соединения по настоящему изобретению представляют собой соединения, которые, наряду с Btk-селективной ингибирующей активностью, демонстрируют отличную метаболическую устойчивость и не проявляют CYP ингибирующую активность и не вызывают патологических реакций, таких как, например, гепатотоксичность; однако в документах предшествующего уровня техники отсутствует сведения или предположения, касающиеся таких отличительных признаков.
Патентный Документ 1: Перевод на японский язык РСТ Заявки No. 2010-504324
Патентный Документ 2: WO 2008/121742
Патентный Документ 3: WO 2010/009342
Патентный Документ 4: WO 2008/060301
Патентный Документ 5: WO 2007/142755
Патентный Документ 6: Перевод на японский язык РСТ Заявки No. 2003-509427
Патентный Документ 7: WO 2003/037890
Непатентный Документ 1: Nature, Volume 361, pp.226-233, 1993 Непатентный Документ 2: Anticancer Agents in Medicinal Chemistry, Volume 7, Number 6, pp.624-632, 2007
Раскрытие изобретения
В целях разработки очень безопасного терапевтического средства для лечения заболеваний, в которых задействованы В-клетки и/или мастоциты, задача настоящего изобретения заключается в разработке соединения, которое наряду с Btk-селективной ингибирующей активностью демонстрирует отличную метаболическую устойчивость и не обладает гепатотоксичностью и т.п.
Для достижения поставленной задачи авторами настоящего изобретения было проведено глубокое исследование, направленное на обнаружение соединений, обладающих Btk-селективной ингибирующей активностью, в результате которого были обнаружены соединения по настоящему изобретению. Более того, также было обнаружено, что данные соединения представляют собой соединения, которые характеризуются отличной метаболической активностью и не обладают гепатотоксичностью и т.п. Таким образом было осуществлено настоящее изобретение.
То есть настоящее изобретение касается:
[1] соединения, представленного общей формулой (I)
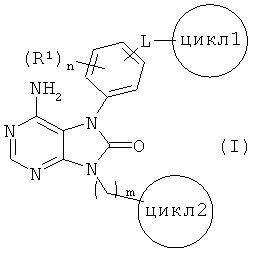
(в данной формуле
L представляет собой (1) -O-, (2) -S-, (3) -SO-, (4) -SO2-(5) -NH-, (6) -С(О)-, (7) -CH2-O-, (8) -O-CH2-, (9) -CH2- или (10) -CH(OH)-;
R1 представляет собой (1) атом галогена, (2) C1-4 алкильную группу, (3) C1-4 алкокси группу, (4) C1-4 галогеналкильную группу или (5) C1-4 галогеналкокси группу;
цикл1 представляет собой 4-7-членную циклическую группу, которая может быть замещена 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) атомов галогена, (2) C1-4 алкильных групп, (3) C1-4 алкокси групп, (4) нитрильной группы, (5) C1-4 галогеналкильных групп и (6) C1-4 галогеналкокси групп, где в случае наличия двух или нескольких заместителей в цикле 1 эти заместители могут вместе с атомами в цикле 1, с которыми эти заместители связаны, образовывать 4-7-членную циклическую группу;
цикл2 представляет собой 4-7-членный насыщенный гетероцикл, который может иметь один-три заместителя -K-R2;
К представляет собой (1) связь, (2) C1-4 алкилен, (3) -C(O)-, (4) -C(O)-CH2-, (5) -CH2-C(O)-, (6) -C(O)O- или (7) -SO2- (где левая связь присоединена к циклу 2);
R2 представляет собой (1) C1-4 алкильную, (2) C2-4 алкенильную или (3) C2-4 алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7, и (5) OR8;
каждый из R3 и R4 независимо представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена OR9 или CONR10R11; R3 и R4 вместе с атомом азота, с которым они связаны, могут образовывать 4-7-членный азотсодержащий насыщенный гетероцикл, который может быть замещен оксо-группой или гидроксильной группой;
каждый из R5 и R6 независимо представляет собой (1) атом водорода, (2) C1-4 алкильную группу или (3) фенильную группу;
R7 представляет собой (1) атом водорода или (2) C1-4 алкильную группу;
R8 представляет собой (1) атом водорода, (2) C1-4 алкильную группу, (3) фенильную группу или (4) бензотриазолиловую группу;
R9 представляет собой (1) атом водорода или (2) C1-4 алкильную группу;
каждый из R10 и R11 независимо представляет собой (1) атом водорода или (2) C1-4 алкильную группу;
n представляет собой целое число от 0 до 4;
m представляет собой целое число от 0 до 2; и
когда n равно двум или более, заместители R1 могут быть одинаковыми или разными), его оптический изомер или их смесь, его соль, сольват, N-оксид или пролекарство;
[2] соединение по приведенному выше п.[1], в котором R2 представляет собой C2-4 алкенильную группу или C2-4 алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8;
[3] соединение по приведенному выше п.[1], в котором цикл1 представляет собой бензольный, циклогексановый или пиридиновый цикл, каждый из которых может быть замещен 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) атомов галогена, (2) C1-4 алкильньгх групп, (3) C1-4 алкокси групп, (4) нитрильной группы и (5) CF3;
[4] соединение по приведенному выше п.[1], в котором цикл2 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, который может иметь один-три заместителя -K-R2;
[5] соединение по приведенному выше п.[4], в котором 4-7-членный азотсодержащий насыщенный гетероцикл представляет собой азетидиновый, пирролидиновый или пиперидиновый цикл;
[6] соединение по приведенному выше п.[1], представленное общей формулой (I-1)
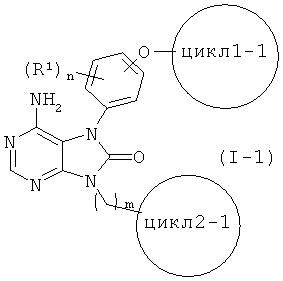
(в данной формуле, цикл 1-1 представляет собой бензольный, циклогексановый или пиридиновый цикл, каждый из которых может быть замещен 1 -5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) атомов галогена, (2) C1-4 алкильных групп, (3) C1-4 алкокси групп, (4) нитрильной группы и (5) CF3, и цикл2-1 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, который может иметь один-три заместителя -K-R2, где другие символы соответствуют приведенным выше определениям);
[7] соединение по приведенному выше п.[6], в котором R2 представляет собой C2-4 алкенильную группу или С2-4 алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8;
[8] соединение по приведенному выше п.[1], которое представляет собой (1) 9-(1-акрилоил-3-азетидинил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (2) 6-амино-9-{(3R)-1-[(2E)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (4) 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (5) 6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (6) 6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-он, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, или его оптический изомер или их смесь;
[9]фармацевтическая композиция, содержащая соединение, представленное общей формулой (I) по приведенному выше п.[1], его оптический изомер или их смесь, его соль, сольват, N-оксид или пролекарство;
[10] фармацевтическая композиция по приведенному выше п.[9], которая представляет собой Btk ингибитор;
[11] фармацевтическая композиция по приведенному выше п.[9], которая представляет собой профилактическое средство и/или терапевтическое средство для лечения заболевания, связанного с Btk;
[12] фармацевтическая композиция по приведенному выше п.[11], в которой заболевание, связанное с Btk, представляет собой аллергическое заболевание, аутоиммунное заболевание, воспалительное заболевание, тромбоэмболическое заболевание или рак;
[13] фармацевтическая композиция по приведенному выше п.[12], в которой рак представляет собой не-ходжкинскую лимфому;
[14] фармацевтическая композиция по приведенному выше п.[9], которая представляет собой ингибитор активации В-клеток;
[15] способ профилактики и/или лечения заболевания, связанного с Btk, включающий введение млекопитающему эффективного количества соединения, представленного общей формулой (I) по приведенному выше п.[1], его оптического изомера или их смеси, его соли, сольвата, N-оксида или пролекарства;
[16] соединение, представленное общей формулой (I) по приведенному выше п.[1], его оптический изомер или их смесь, его соль, сольват, N-оксид или пролекарство для профилактики и/или лечения заболевания, связанного с Btk; и
[17] использование соединения, представленного общей формулой (I) по приведенному выше п.[1], его оптического изомера или их смеси, его соли, сольвата, N-оксида или пролекарства для получения средства для профилактики и/или лечения заболевания, связанного с Btk.
Соединения по настоящему изобретению наряду с Btk-селективной ингибирующей активностью демонстрируют отличную метаболическую устойчивость и не обладают гепатотоксичностью и т.п., и, следовательно, пригодны в качестве очень безопасных терапевтических средств для лечения заболеваний, в которых задействованы В-клетки и/или мастоциты, таких как не-ходжкинская лимфома.
Осуществление настоящего изобретения
Настоящее изобретение подробно описано ниже.
В настоящем изобретении термин "обладающий Btk-селективной ингибирующей активностью" означает Btk-селективную ингибирующую активность относительно не-Btk тирозинкиназ и особенно лимфоидно-специфической протеин-тирозанкиназы (Lck), протеин-тирозинкиназы fyn (Fyn) и изоформы А связанного с вирусом саркомы Ямагучи гомолога онкогена v-yes-1 (LynA). Данное свойство позволяет избегать непредсказуемых побочных реакций, вызванных ингибированием другой тирозинкиназы. Например, известно появление нарушений сетчатки у Lck-дефицитных мышей (Oncogene, Volume 16, pp.2351-2356, 1998), что увеличивает вероятность возникновения побочных реакций в глазу при ингибировании Lck.
В настоящем изобретении атом галогена означает атомы фтора, хлора, брома и йода.
В настоящем изобретении C1-4 алкильная группа означает C1-4 алкильные группы с линейной или разветвленной цепью, например метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
В настоящем изобретении C1-4 алкиленовая группа означает метилен, этилен, пропилен, бутилен и их изомеры.
В настоящем изобретении C1-4 алкокси группа означает С1-4 алкокси группы с линейной или разветвленной цепью, например метокси, этокси, пропокси, изопропокси, бутокси, изобутилокси и трет-бутокси группы.
В настоящем изобретении С2-4 алкенильная группа означает С2-4 алкенильные группы с линейной или разветвленной цепью, например этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил и 1,3-бутадиенил.
В настоящем изобретении С2-4 алкинильная группа означает С2-4 алкинильные группы с линейной или разветвленной цепью, например этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил и 1,3-бутадиинил.
В настоящем изобретении C1-4 галогеналкильная группа означает группу, полученную введением в качестве заместителей одного, двух или более атомов галогена в С1-4 алкильную группу и может быть проиллюстрирована фторметильной группой, хлорметильной группой, бромметильной группой, йодметильной группой, дифторметильной группой, трифторметильной группой, 1-фторэтильной группой, 2-фторэтильной группой, 2-хлорэтильной группой, пентафторэтильной группой, 1-фторпропильной группой, 2-хлорпропильной группой, 3-фторпропильной группой, 3-хлорпропильной группой, 4,4,4-трифторбутильной группой и 4-бромбутильной группой.
В настоящем изобретении С1-4 галогеналкокси группа означает группу, полученную введением в качестве заместителей одного, двух или более атомов галогена в C1-4 алкокси группу и может быть проиллюстрирована трифторметокси группой, трихлорметокси группой, хлорметокси группой, бромметокси группой, фторметокси группой, йодметокси группой, дифторметокси группой, дибромметокси группой, 2-хлорэтокси группой, 2,2,2-трифторэтокси группой, 2,2,2-трихлорэтокси группой, 3-бромпропокси группой, 3-хлорпропокси группой, 2,3-дихлорпропокси группой, 1-фторбутокси группой, 4-фторбутокси группой и 1-хлорбутокси группой.
В настоящем изобретении 4-7-членная циклическая группа означает С4-7 карбоциклическое кольцо или 4-7-членный гетероцикл.
В настоящем изобретении С4-7 карбоциклическое кольцо означает С4-7 моноциклическое алифатическое или ароматическое карбоциклическое кольцо. Алифатическая система может быть частично или полностью насыщенной. В данном случае примерами являются циклобутан, циклопентан, циклогексан, циклогептан, циклопентен, циклогексен, циклогептен, циклобутадиен, циклопентадиен, циклогексадиен, циклогептадиен и бензол.
В настоящем изобретении С5-6 карбоциклическое кольцо означает С5-6 моноциклическое алифатическое или ароматическое карбоциклическое кольцо. Алифатическая система может быть частично или полностью насыщенной. В данном случае примерами являются циклопентан, циклогексан, циклопентен, циклогексен, циклопентадиен, циклогексадиен и бензол.
В настоящем изобретении 4-7-членный гетероцикл означает 4-7-членный ненасыщенный гетероцикл или 4-7-членный насыщенный гетероцикл.
В настоящем изобретении 4-7-членный ненасыщенный гетероцикл означает ненасыщенный 4-7-членный моноциклический гетероцикл, который содержит от одного до пяти гетероатомов, выбранных из атома кислорода, атома азота и атома серы, и в качестве примеров можно привести пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, пиридазин, азепин, диазепин, фуран, пиран, океепин, тиофен, тиопиран, тиепин, оксазол, изоксазол, тиазол, изотиазол, фуразан, оксадиазол, оксазин, оксадиазин, оксазепин, оксадиазепин, тиадиазол, тиазин, тиадиазин, тиазепин и тиадиазепин.
В настоящем изобретении 4-7-членный насыщенный гетероцикл означает частично или полностью насыщенный 4-7-членный моноциклический гетероцикл, который содержит от одного до пяти гетероатомов, каждый из которых независимо выбран из атома кислорода, атома азота и атома серы, и в качестве примеров можно привести азетидин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидроазепин, тетрагидроазепин, пергидроазепин, дигидродиазепин, тетрагидродиазепин, пергидродиазепин, оксетан, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, дигидрооксепин, тетрагидрооксепин, пергидрооксепин, тиетан, дигидротиофен, тетрагидротиофен, дигидротиопиран, тетрагидротиопиран, дигидротиепин, тетрагидротиепин, пергидротиепин, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизоксазол, тетрагидроизоксазол (изоксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидрооксазепин, тетрагидрооксазепин, пергидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, пергидрооксадиазепин,
дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, дигидротиазепин, тетрагидротиазепин, пергидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, пергидротиадиазепин, морфолин, тиоморфолин, оксатиан, диоксолан, диоксан, дитиолан и дитиан.
В настоящем изобретении 4-7-членный азотсодержащий насыщенный гетероцикл означает такие 4-7-членные насыщенные гетероциклы, которые обязательно содержат по меньшей мере один атом азота. Примеры представляют собой азетидин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин,
тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидроазепин, тетрагидроазепин, пергидроазепин, дигидродиазепин, тетрагидродиазепин, пергидродиазепин, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизоксазол, тетрагидроизоксазол (изоксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидрооксазепин, тетрагидрооксазепин, пергидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, пергидрооксадиазепин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, дигидротиазепин, тетрагидротиазепин, пергидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, пергидротиадиазепин, морфолин и тиоморфолин.
В качестве примеров 4-6-членных азотсодержащих насыщенных гетероциклов по настоящему изобретению можно привести азетидин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизоксазол, тетрагидроизоксазол (изоксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, морфолин и тиоморфолин.
L в настоящем изобретении предпочтительно представляет собой -O-, -CH2-O-, -O-CH2-, -NH-, -C(O)-, -CH2- или -CH(OH)-.
R1 в настоящем изобретении предпочтительно представляет собой атом галогена или C1-4 алкокси группу.
4-7-членная циклическая группа в случае цикла 1 в настоящем изобретении предпочтительно представляет собой C5-6 карбоциклическое кольцо или 4-7-членный ненасыщенный гетероцикл, и более предпочтительно представляет собой бензольный, циклогексановый или пиридиновый цикл.
4-7-членный насыщенный гетероцикл в случае цикла2 в настоящем изобретении предпочтительно представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, более предпочтительно 4-6-членный азотсодержащий насыщенный гетероцикл, еще более предпочтительно азетидиновый, пирролидиновый или пиперидиновый цикл, и особенно предпочтительно азетидиновый или пирролидиновый цикл.
К в настоящем изобретении предпочтительно представляет собой связь или -C(O)-.
R2 в настоящем изобретении предпочтительно представляет собой C2-4 алкенильную группу или C2-4 алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8.
m в настоящем изобретении предпочтительно равно 0 или 1, и более предпочтительно равно 0.
Любая комбинация отдельных предпочтительных групп, приведенных выше в качестве примеров и выбранных из L, R1, цикла, цикла2, K, R и m, также является предпочтительной в настоящем изобретении.
Соединения, представленные общей формулой (I-1)
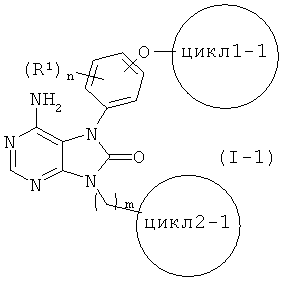
(все символы в данной формуле соответствуют приведенным выше определениям) являются предпочтительными в настоящем изобретении среди соединений общей формулы (I).
R1 в общей формуле (1-1) предпочтительно представляет собой атом галогена или С1-4 алкокси группу.
Циклы в общей формуле (1-1) предпочтительно представляет собой бензольный цикл.
4-7-членный азотсодержащий насыщенный гетероцикл в случае цикла2-1 в общей формуле (1-1) предпочтительно представляет собой азетидиновый, пирролидиновый или пиперидиновый цикл, и более предпочтительно представляет собой азетидиновый или пирролидиновый цикл.
Что касается заместителя -K-R2- в цикле2-1 в общей формуле (1-1), то K предпочтительно представляет собой связь или -C(O)-, a R2 предпочтительно представляет собой C2-4 алкенильную группу или С2-4 алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7, и (5) OR8.
m в общей формуле (1-1) предпочтительно равно 0 или 1, и более предпочтительно равно 0.
Любая комбинация отдельных предпочтительных групп, приведенных выше в качестве примеров, также является предпочтительной для общей формулы (I-1).
Изомеры
Настоящее изобретение охватывает все изомеры, если специально не указано иное. Например, термин «алкильные группы» охватывает как линейные алкильные группы, так и алкильные группы с разветвленной цепью. Кроме того, в настоящее изобретение включены все перечисленные далее варианты: геометрические изомеры (Е-конфигурация, Z-конфигурация, цис-конфигурация, транс-конфигурация) для двойных связей, циклов и конденсированных циклов; оптические изомеры, возникающие вследствие, например, наличия асимметрического атома углерода (R и S конфигурации, α и β положения, энантиомеры, диастереомеры); оптически активные формы, обладающие оптическим вращением (D, L, d и 1 конфигурации); полярные формы, получаемые хроматографическим разделением (высокополярные формы, низкополярные формы); соединения, находящиеся в равновесии; ротамеры; смеси перечисленных выше изомеров в любых соотношениях и рацемические смеси. Настоящее изобретение охватывает также все изомеры, возникающие вследствие таутомерии.
Кроме того, «оптический изомер» по настоящему изобретению представляет собой не только 100% чистый оптический изомер, но может также включать другой оптический изомер в количестве меньше 50%.
В настоящем изобретении, если особо не указано иное, и как понятно квалифицированному специалисту в данной области, символ

означает связь, направленную назад от плоскости бумаги (то есть, α-положение); символ

означает связь, направленную вперед от плоскости бумаги (то есть, β-положение); и символ

означает α-положение, β-положение или их смесь в любом соотношении.
Соединения, представленные общей формулой (I), превращают в соответствующие соли известными способами. Соль предпочтительно представляет собой растворимые в воде соли. В качестве примеров подходящих солей можно привести соли щелочных металлов (калий, натрий и т.д.), соли щелочноземельных металлов (кальций, магний и т.д.), соль аммония, соли фармацевтически приемлемых органический аминов (тетраметиламмоний, триэтиламин, метиламин, диметиламин, циклопентиламин, бензиламин, фенэтиламин, пиперидин, моноэтаноламин, диэтаноламин, трис(гидроксиметил)аминометан, лизин, аргинин, N-метил-О-глюкамин и т.д.), и кислотно-аддитивные соли (соли неорганических кислот (гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, нитрат и т.д.) и соли органических кислот (ацетат, трифторацетат, лактат, тартрат, оксалат, фумарат, малеат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, изетионат, глюкуронат, глюконат и т.д.)).
Соединения, представленные общей формулой (I), и их соли можно также превращать в сольваты. Такой сольват предпочтительно является растворимым в воде и имеет низкую токсичность. В качестве примеров подходящих сольватов можно привести сольваты, например с водным или спиртовым растворителем (например с этанолом).
Пролекарство соединения, представленного общей формулой (I), означает соединение, которое посредством реакции in vivo, например с ферментом или с кислотой в желудке, превращается в соединение, представленное общей формулой (I). Пролекарства соединений общей формулы (I) могут быть проиллюстрированы соединениями, в которых - когда соединение, представленное общей формулой (I), содержит гидроксильную группу - данная гидроксильная группа является ацилированной, алкилированной, фосфатированной или борированной (например соединения, полученные ацетилированием, пальмитоилированием, пропаноилированием, пивалоилированием, сукцинилированием, фумарилированием, аланилированием или
диметиламинометилкарбонилированием гидроксильной группы в соединениях по настоящему изобретению); другие примеры представляют собой соединения, полученные этерификацией или амидированием карбоксильной группы в соединении, представленном общей формулой (I) (например соединения, полученные этерификацией с получением этилового эфира, изопропилового эфира, фенилового эфира, карбоксиметилового эфира, диметиламинометилового эфира, пивалоилоксиметилового эфира,
этоксикарбонилоксиэтилового эфира, фталидилового эфира, (5-метил-2-оксо-1,3-диоксолен-4-ил)метилового эфира, циклогексилоксикарбонилэтилового эфира, или метиламинированием карбоксильной группы в соединении, представленном общей формулой (I)). Перечисленные соединения можно получать известными способами. Кроме того, пролекарство соединения, представленного общей формулой (I), может представлять собой гидрат или быть безводным. Пролекарство соединения, представленного общей формулой (I), превращается при физиологических условиях в соединение, представленное общей формулой (I), как описано в следующем источнике: стр.163-198, Molecular Design в Development of Medicines, Volume 7 (Hirokawa Shoten Co., 1990). Кроме того, соединения, представленные общей формулой (I), можно метить изотопами (например 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 35S, 18F, 36Cl, 123I и 125I).
Способы получения соединений по настоящему изобретению
Соединения по настоящему изобретению можно получать посредством соответствующего модифицирования и комбинирования известных способов, например способов, описанных в Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition (Richard C. Larock, John Wiley &.Sons Inc., 1999), или способов, приведенных в примерах.
Среди соединений, представленных общей формулой (I), соединения, в которых цикл2 представляет собой незамещенный 4-7-членный азотсодержащий насыщенный гетероцикл, т.е., соединения, представленные общей формулой (I-A) [С 14]
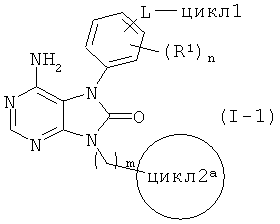
(в данной формуле, цикл2а представляет собой незамещенный 4-7-членный азотсодержащий насыщенный гетероцикл, в то время как другие символы соответствуют приведенным выше определениям), можно получать по следующей реакционной схеме 1.
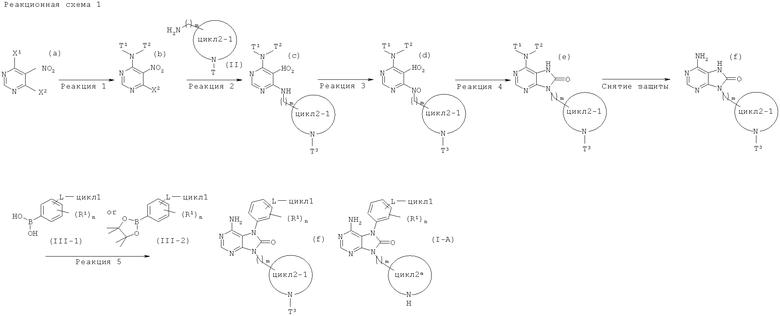
(В данных формулах каждый из T1 и T2 независимо представляет собой защитную группу для аминогруппы (например бензильную (Bn) группу, 4-метоксибензильную группу и 3,4-диметоксибензильную группу); каждый из X1 и X2 независимо представляет собой атом галогена; цикл2-1 представляет собой цикл2а, защищенный защитной группой Т3 (например трет-бутоксикарбонильная (Boc) группа и бензилоксикарбонильная(Cdz) группа); и другие символы соответствуют приведенным выше определениям.)
Реакция 1 в реакционной схеме 1 известна и осуществляется с использованием соединения общей формулы (а) и защищенного производного амина, т.е., соединения, представленного формулой T1T2-NH (Т1 и Т2 в данной формуле соответствуют приведенным выше определениям). Реакцию проводят в органическом растворителе (например дихлорметане, тетрагидрофуране, диоксане, диметилформамиде, диметилацетамиде и 1-метил-2-пирролидоне) в присутствии основания (например триэтиламина, N,N-диизопропилэтиламина, пиридина, 4-диметиламинопиридина и N-метилморфолина) при температуре от -20°C до комнатной.
Реакция 2 в реакционной схеме 1 известна и осуществляется с использованием соединения общей формулы (b) и соединения, представленного общей формулой (II). Реакцию проводят в органическом растворителе (например диоксане, ацетонитриле, тетрагидрофуране, диметилформамиде, диметилацетамиде и 1-метил-2-пирролидоне) в присутствии основания (например триэтиламина, N,N-диизопропилэтиламина, пиридина, 4-диметиламинопиридина и N-метилморфолина) при температуре от -20°C до 70°C.
Реакция 3 в реакционной схеме 1 известна и осуществляется с использованием соединения общей формулы (с) и металлического реагента (например цинка, железа, олова, хлорида олова, хлорида железа, самария, индия и боргидрида натрия/хлорида никеля) в смешивающемся с водой растворителе (например этаноле, метаноле, тетрагидрофуране и этилацетате) в присутствии кислоты (например соляная кислота, бромистоводородная кислота, хлорид аммония, уксусная кислота и формиат аммония) или без кислоты при температуре от 0°C до 150°C.
Реакция 4 в реакционной схеме 1 известна и осуществляется с использованием соединения, представленного общей формулой (d), и реагента (например 1,1'-карбонилдиимидазола (CDI) и трифосгена) в органическом растворителе (например тетрагидрофуране, диметилформамиде и диметилацетамиде) в присутствии основания (например триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин и N-метилморфолин) или без основания, в диапазоне температур от ледяной бани до кипячения.
Реакции снятия защитных групп в реакционной схеме 1 известны и могут осуществляться описанными ниже способами. В данном случае примеры представляют собой (1) реакции снятия защиты, имеющие в основе щелочной гидролиз, (2) реакции снятия защиты в кислых условиях, (3) реакции снятия защиты, имеющие в основе гидрогенолиз, (4) реакции снятия защиты для силильной группы, (5) реакции снятия защиты с использованием металла, и (6) реакции снятия защиты с использованием комплекса металла.
Эти способы подробно описаны ниже.
(1) Реакции снятия защиты, имеющие в основе щелочной гидролиз, можно проводить, например, в органическом растворителе (например метаноле,-тетрагидрофуране и диоксане) при температуре от 0°С до 40°С с использованием гидроксида щелочного металла (например гидроксида натрия, гидроксида калия и гидроксида лития), гидроксида щелочноземельного металла (например гидроксида бария и гидроксида кальция), или карбоната (например карбоната натрия и карбоната калия), или их водного раствора или их смеси.
(2) Реакции снятия защиты в кислых условиях можно проводить, например, при температуре от 0°C до 100°C в присутствии 2,2,2-трифторэтанола или без него в органическом растворителе (например дихлорметане, хлороформе, диоксане, этилацетате, метаноле, изопропиловом спирте, тетрагидрофуране и анизоле) и в органической кислоте (например уксусная кислота, трифторуксусная кислота, метансульфоновая кислота и п-тозилат) или в неорганической кислоте (например соляная кислота и серная кислота) или в их смеси (например бромоводород/уксусная кислота).
(3) Реакции снятия защиты, имеющие в основе гидрогенолиз, можно проводить, например, при температуре от 0°C до 200°C в растворителе (например в простом эфире (например тетрагидрофуран, диоксан, диметоксиэтан и диэтиловый эфир), спирте (например метанол и этанол), бензольном растворителе (например бензол и толуол), кетоне (например ацетон и метилэтилкетон), нитриле (например ацетонитрил), амиде (например N,N-диметилформамид), воде, этилацетате, уксусной кислоте, или в смешанном растворителе, состоящем из двух или более вышеуказанных растворителей) в присутствии катализатора (например палладий на угле, палладиевая чернь, гидроксид палладия на угле, оксид платины и никель Ренея) в атмосфере водорода при нормальном или повышенном давлении или в присутствии формиата аммония.
(4) Реакции снятия защиты для силильной группы можно проводить, например, при температуре от 0°C до 40°C в смешивающемся с водой органическом растворителе (например тетрагидрофуран и ацетонитрил) с использованием фторида тетрабутиламмония. Данную реакцию также можно проводить, например, при температуре от -10°C до 100°C в органической кислоте (например уксусная кислота, трифторуксусная кислота, метансульфоновая кислота и п-тозилат) или в неорганической кислоте (например соляная кислота и серная кислота) или в их смеси (например бромоводород/уксусная кислота).
(5) Реакции снятия защиты с использованием металла можно проводить, например, при температуре от 0°C до 40°C в кислотном растворителе (например уксусная кислота, буфер с pH от 4.2 до 7.2, или в смеси растворителей, содержащей вышеуказанные растворы и органический растворитель, такой как тетрагидрофуран) в присутствии порошка цинка и, при необходимости, с применением ультразвука.
(6) Реакции снятия защиты с использованием комплекса металла можно проводить, например, при температуре от 0°C до 40°C в органическом растворителе (например в дихлорметане, N,N-диметилформамиде, тетрагидрофуране, этилацетате, ацетонитриле, диоксане и этаноле), в воде или в их смеси с использованием комплекса металла (например тетракис(трифенилфосфин)палладий(II), бис(трифенилфосфин)палладия(II) дихлорид, палладия(П) ацетат и трис(трифенилфосфин)родия(I) хлорид) в присутствии улавливающего реагента (например трибутилолово гидрид, триэтилсилан, димедон, морфолин, диэтиламин и пирролидон) органической кислоты (например уксусная кислота, муравьиная кислота и 2-этилгексановая кислота) и/или соли органической кислоты (например 2-этилгексаноат натрия и 2-этилгексаноат калия) и в присутствии фосфинового реагента (например трифенилфосфина) или без него.
Помимо вышеуказанного реакцию снятия защиты можно также осуществлять с использованием способов, описанных, например, в книге Т. W. Greene, Protective Groups in Organic Synthesis, Wiley, New York, 1999.
В качестве примеров защитной группы для аминогруппы можно привести бензилоксикарбонильную группу, трет-бутоксикарбонильную группу, аллилоксикарбонильную (Alloc) группу, 1-метил-1-(4-бифенил)этоксикарбонильную (Врос) группу, трифторацетильную группу, 9-флуоренилметоксикарбонильную группу, бензильную (Bn) группу, п-метоксибензильную группу, бензилоксиметильную (ВОМ) группу и 2-(триметилсилил)этоксиметильную (SEM) группу.
Помимо вышеуказанного защитная группа для аминогруппы может представлять собой любую группу, которая поддается легкому и селективному удалению, и их список не ограничивается каким-либо специальным образом. Например, можно использовать группы, описанные в книге Т. W. Greene, Protective Groups in Organic Synthesis, Wiley, New York, 1999.
Реакция 5 в реакционной схеме 1 известна и может проводиться с использованием соединения общей формулы (f) и соединения, представленного общей формулой (III-1) или общей формулой (III-2), и данную реакцию проводят при температуре от комнатной до 120°C в органическом растворителе (например в дихлорметане и ацетонитриле) в присутствии основания (например пиридин, триэтиламин и N,N-дишопропилэтиламин), соли меди (например ацетата меди(II)) и осушителя (например молекулярных сит).
Среди соединений общей формулы (I) соединения, в которых цикл2 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, имеющий по меньшей мере один заместитель -K-R2, где K представляет собой C(O) и R2 представляет собой C1-4 алкиленовую или C2-4 алкениленовую группу, которая может иметь заместитель в виде атома галогена, т.е. соединения, представленные общей формулой (I-B)
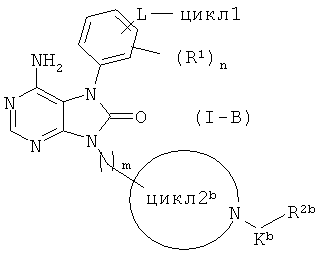
(в данной формуле, цикл2b представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, имеющий заместитель -Kb-R2b; Kb представляет собой -С(О)-; R2b представляет собой C1-4 алкиленовую или C2-4 алкениленовую группу, которая может иметь заместитель в виде атома галогена; и другие символы соответствуют приведенным выше определениям), можно получать с использованием соединения общей формулы (I-А), которое можно получать по реакционной схеме 1, и соединения, представленного общей формулой (I-B-1)
Xb-C(O)-R2b (I-B-1)
(в данной формуле Xb представляет собой атом галогена, a R2b соответствует приведенному выше определению), и реакцию проводят при температуре от 0°C до комнатной в органическом растворителе (например, в дихлорметане, хлороформе, диметилформамиде, диметилацетамиде, диэтиловом эфире и тетрагидрофуране), в присутствии основания (например триэтиламин, пиридин, N,N-диизопропилэтиламин, 4-диметиламинопиридин и N-метилморфолин).
Среди соединений общей формулы (I) соединения, в которых цикл2 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, имеющий по меньшей мере один заместитель -K-R2, где К представляет собой С(О) и R2 представляет собой C2-4 алкиленовую или C2-4 алкениленовую группу, которая может иметь заместитель NR3R4, т.е. соединения общей формулы (I-C)
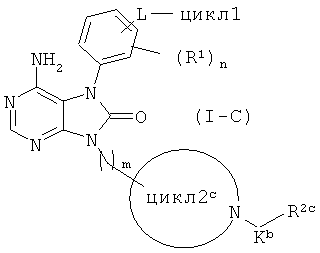
(в данной формуле, цикл2с представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, имеющий заместитель -Kb-R2c; R2c представляет собой C2-4 алкиленовую или C2-4 алкениленовую группу, которая может иметь заместитель NR3R4; а остальные символы соответствуют приведенным выше определениям), можно получать взаимодействием соединения, представленного общей формулой (I-C-2)
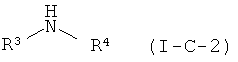
(все символы в данной формуле соответствуют приведенным выше определениям) при температуре от комнатной до 120°C в органическом растворителе (например в тетрагидрофуране, диоксане, ацетонитриле, диметилформамиде, диметилацетамиде и 1-метил-2-пирролидоне), с соединением, полученным реакцией соединения, представленного общей формулой (I-A), с соединением, представленным общей формулой (I-C-1)
Xc-1-C(O)-R2c-1-Xc-2 (I-C-1)
(в данной формуле, каждый из Xc-1 и Xc-2 независимо представляет собой атом галогена, а R2c-1 представляет собой C1-4 алкиленовую или C2-4 алкениленовую группу) при температуре 0°C или ниже в органическом растворителе (например в дихлорметане, хлороформе, диметилформамиде, диметилацетамиде, диэтиловом эфире и тетрагидрофуране) в присутствии основания (например триэтиламин, пиридин, N,N-диизопропилэтиламин, 4-диметиламинопиридин и N-метилморфолин).
Среди соединений общей формулы (I) соединения, в которых цикл2 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, имеющий по меньшей мере один заместитель -K-R2, где K представляет собой C(O) и R2 представляет собой C1-4 алкиленовую, C2-4 алкениленовую или C2-4 алкиниленовую группу, которая может иметь заместитель CONR5R5, CO2R7 или OR8, т.е., соединения общей формулы (I-D)
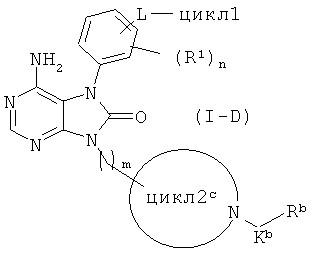
(в данной формуле цккп2й представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, имеющий по меньшей мере один заместитель -Kb-R2d; R2d представляет собой C1-4 алкиленовую, C2-4 алкениленовую или C2-4 алкиниленовую группу, которая может иметь заместитель CONR5R6, CO2R7 или OR8; а остальные символы соответствуют приведенным выше определениям), можно получать с использованием соединения, представленного общей формулой (I-A), и соединения, представленного общей формулой (I-D-1)
R2d-CO2H (I-D-1)
(R2d в данной формуле соответствует приведенному выше определению). Реакцию проводят при температуре от 0°C до комнатной с использованием конденсирующего агента (например 1,3-дициклогексилкарбодиимид (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимид (EDC), 1,1'-карбонилдиимидазол (CDI), 2-хлор-1-метилпиридиния иодид и циклический ангидрид 1-пропанфосфоновой кислоты (РРА)) в органическом растворителе (например в хлороформе, дихлорметане, диметилформамиде, диметилацетамиде, диэтиловом эфире и тетрагидрофуране) или без растворителя, в присутствии основания (например триэтиламина, пиридина, N,N-диизопропилэтиламина, 4-диметиламинопиридина и N-метилморфолина) или без основания, и с использованием 1-гидроксибензтриазола (HOBt) или без него.
Соединения, используемые в качестве исходных веществ в каждой из реакций из данного описания, например соединения общей формулы (а), (II), (III-1), (III-2), (I-B-1), (I-С-1), (I-C-2) и (I-D-1), являются известными или могут быть легко получены известными способами.
Для каждой из реакций из данного описания, реакции, осуществляемые с использованием тепла, можно проводить с помощью водяной бани, масляной бани, песчаной бани или микроволновой печи, что очевидно для квалифицированного специалиста в данной области техники.
В реакциях по настоящему описанию при необходимости можно использовать твердофазный реагент, включая реагент, нанесенный на полимер с высоким молекулярным весом (например на полистирол, полиакриламид, полипропилен и полиэтиленгликоль).
Продукт реакции в каждой из реакций по настоящему описанию можно очищать обычными способами очистки, например с применением таких способов как перегонка при нормальном давлении или при пониженном давлении, высокоэффективная жидкостная хроматография с использованием силикагеля или силиката магния, тонкослойная хроматография, ионообменные смолы, поглотительные смолы, колоночная хроматография, промывка, перекристаллизация и т.д. Очистку можно проводить после каждой реакции или после завершения нескольких реакций. Токсичность
Соединения по настоящему изобретению обладают приемлемо низкой токсичностью, например, они почти не обладают CYP-ингибирующей активностью и почти не обладают гепатотоксичностью, и, таким образом, их можно безопасно использовать в качестве действующего фармацевтического вещества.
Применение в фармацевтических препаратах
Соединения по настоящему изобретению обладают селективной Btk-ингибирующей активностью и, как следствие, пригодны для использования в качестве средств профилактики и/или лечения заболеваний, связанных с Btk, т.е. заболеваний, в которых задействованы В-клетки и/или мастоциты, например аллергических заболеваний, аутоиммунных заболеваний, воспалительных заболеваний, тромбоэмболических заболеваний, рака и заболеваний типа «трансплантат против хозяина». Соединения по настоящему изобретению также демонстрируют селективное ингибирующее действие на активацию В-клеток и, как следствие, также эффективны в качестве ингибиторов активации В-клеток.
В качестве примеров аллергических заболеваний по настоящему изобретению можно привести аллергии, анафилаксию, аллергический конъюнктивит, аллергический ринит и аллергический дерматит.
В качестве примеров аутоиммунных заболеваний по настоящему изобретению можно привести воспалительное заболевание кишечника, артрит, волчанку, ревматоидный артрит, псориатический артрит, остеоартрит, болезнь Стилла, хронический полиартрит у детей, диабет I типа, миастению гравис, тиреоидит Хашимото, тиреоидит Орда, базедову болезнь, синдром Сегрена, рассеянный склероз, синдром Гийена-Барре, острый рассеянный энцефаломиелит, болезнь Аддисона, опсоклонус-миоклонус, анкилозирующий спондилит, анти-фосфолипидный синдром, апластическую анемию, аутоиммунный гепатит, глютеиновую болезнь, синдром Гудпасчера, идиопатическую тромбоцитопеническую пурпуру, неврит зрительного нерва, склеродермию, билиарный первичный цирроз печени, болезнь Рейтера, синдром Такая су, височный артериит, аутоиммунную гемолитическую анемию с синдромом тепловых агглютининов, гранулематоз Вегенера, псориаз, общую алопецию, болезнь Бехчета, синдром хронической усталости, вегетативную дистонию, эндометриоз, интерстициальный цистит, миотонию, вульводинию и системную красную волчанку.
В качестве примеров воспалительных заболеваний по настоящему изобретению можно привести астму, аппендицит, блефарит, бронхиолит, бронхит, бурсит, цервитит, холангит, холецистит, колит, конъюнктивит, цистит, дакриоаденит, дерматит, дерматомиозит, энцефалит, эндокардит, эндометрит, энтерит, эпикондилит, эпидидимит, фасцит, фиброзит, гастрит, гастроэнтерит, гепатит, гнойный гидраденит, ларингит, мастит, менингтит, миелит, миокардит, миозит, нефрит, оофорит, орхит, остит, панкреатит, паротит, перикардит, перитонит, фарингит, плеврит, флебит, пневмонию, проктит, простатит, пиелонефрит, ринит, сальпингит, синусит, стоматит, синовит, тендинит, тонзиллит, увеит, вагинит, васкулит и вульвит.
В качестве примеров тромбоэмболических заболеваний по настоящему изобретению можно привести инфаркт миокарда, стенокардию, реокклюзию после ангиопластики, рестеноз после ангиопластики, реокклюзию после аортокоронарного шунтирования, рестеноз после аортокоронарного шунтирования, инсульт, преходящую ишемию, окклюзивные нарушения периферических артерий, эмболию легких и тромбоз глубоких вен.
В настоящем изобретении виды рака включают неходжкинские лимфомы, из которых особенно подходят В-клеточные неходжкинские лимфомы, например лимфома Беркитта, СПИД-обусловленная лимфома, В-клеточная лимфома из клеток маргинальной зоны (В-клеточная лимфома клеток маргинальной зоны лимфоузлов, экстранодальная В-клеточная лимфома клеток маргинальной зоны, и В-клеточная лимфома клеток маргинальной зоны селезенки), диффузная В-крупноклеточная лимфома, первичная выпотная лимфома, лимфогранулематоз, фолликулярная лимфома, В-клеточный хронический лимфолекоз, В-клеточный пролимфоцитарный лейкоз, лимфоплазмоцитарный лейкоз/макроглобулинемия Вальденстрема, плазмоцитома, лимфома из клеток мантийной зоны, медиастинальная В-крупноклеточная лимфома, интраваскулярная В-крупноклеточная лимфома и лейкоз ворсистых клеток. Помимо неходжкинской лимфомы виды рака в настоящем изобретении включают опухоли поджелудочной железы, например инсулиному, гастриному, глюкагоному, соматостатиному, ВИПому, опухоль из РР-клеток и GRF-му.
Соединение по настоящему изобретению можно вводить индивидуально или в виде комбинированного препарата совместно с другим лекарственным средством в целях
1) дополнения и/или усиления профилактического и/или терапевтического воздействия соединения,
2) улучшения фармакокинетических свойств и абсорбции, а также снижения дозировки соединения, и/или
3) уменьшения побочных эффектов соединения.
Комбинированный препарат соединения по настоящему изобретению с другим лекарственным средством можно вводить в форме сложного средства, в котором оба компонента объединены в одной лекарственной форме, или можно вводить в виде отдельных лекарственных форм. Введение в виде отдельных лекарственных форм включает одновременное введение или введение в разные моменты времени. В случае введения в разное время соединение по настоящему изобретению можно вводить первым с последующим введением другого лекарственного средства, или же другое лекарственное средство можно вводить первым с последующим введением соединения по настоящему изобретению. Для каждого лекарственного средства можно применять одинаковые или разные способы введения.
Список заболеваний, для которых может проводиться профилактика и/или лечение описанным выше комбинированным препаратом, ничем не ограничивается, и данный комбинированный препарат можно использовать при любом заболевании, при котором профилактическое и/или лечебное воздействие соединения по настоящему изобретению дополняется и/или усиливается.
В качестве примеров вышеупомянутого другого лекарственного средства, дополняющего и/или усиливающего профилактическое и/или лечебное воздействие соединения по настоящему изобретению в отношении аллергических заболеваний, можно привести антигистамины, антагонисты лейкотриена, противоаллергические средства, антагонисты рецептора тромбоксана А2, ингибиторы тромбоксансинтазы и стероиды.
В качестве примеров вышеупомянутого другого лекарственного средства, дополняющего и/или усиливающего профилактиктическое и/или лечебное воздействие соединения по настоящему изобретению в отношении аутоиммунных заболеваний, можно привести иммунодепрессанты; стероиды; модифицирующие заболевание противоревматические лекарственные средства; ингибиторы эластазы; агонисты рецептора каннабиноида-2; простагландины; ингибиторы простагландинсинтазы; ингибиторы фосфодиэстеразы; ингибиторы металлопротеазы; ингибиторы адгезивных молекул; белковые антицитокины, такие как анти-TNF-α средства, анти-IL-1 средства и анти-IL-6 средства; ингибиторы цитокина; нестероидные противовоспалительные средства; и анти-СБ20 антитела.
В качестве примеров вышеупомянутого другого лекарственного средства, дополняющего и/или усиливающего профилактиктическое и/или лечебное воздействие соединения по настоящему изобретению в отношении воспалительных заболеваний, можно привести стероиды, ингибиторы эластазы, агонисты рецептора каннабиноида-2, простагландины, ингибиторы простагландинсинтазы, ингибиторы фосфодиэстеразы, ингибиторы металлопротеазы, ингибиторы адгезивных молекул, анти-лейкотриены, анти-холинэргические средства, антагонисты рецептора тромбоксана А2, ингибиторы тромбоксансинтазы, производные ксантина, отхаркивающие средства, антибактериальные средства, антигистамины, белковые антицитокины, ингибиторы цитокинов, форсколиновые средства, ингибиторы высвобождения медиаторов и нестероидные противовоспалительные средства.
В качестве примеров вышеупомянутого другого лекарственного средства, дополняющего и/или усиливающего профилактическое и/или лечебное воздействие соединения по настоящему изобретению в отношении тромбоэмболических заболеваний, можно привести тромболитические средства, гепарин, гепариноиды, низкомолекулярные гепарины, варфарин, ингибиторы тромбина, ингибиторы фактора Xa, антагонисты рецептора ADP и ингибиторы циклооксигеназы.
В качестве примеров вышеупомянутого другого лекарственного средства, дополняющего и/или усиливающего профилактическое и/или лечебное воздействие соединения по настоящему изобретению в отношении неходжкинских лимфом, можно привести алкилирующие агенты, антиметаболиты, противораковые антибиотики, растительные алкалоиды, гормоны, соединения платины, анти-СБ20 антитела и другие противораковые средства.
В качестве примеров антигистаминов можно привести азеластина гидрохлорид, эбастин, эпинастина гидрохлорид, эмедастина фумарат, ауранофин, оксатомид, олопатадина гидрохлорид, d1-хлорфенирамина малеат, клемастина фумарат, кетотифена фумарат, циметидин, дименгидринат, дифенгидрамина гидрохлорид, ципрогептадина гидрохлорид, цетиризина гидрохлорид, дезлоратадин, терфенадин, фамотидин, фексофенадина гидрохлорид, бепотастин, бепотастина безилат, мизоластин, мехитазин, мометазона фуроат, ранитидин, ранитидина гидрохлорид, лоратадин, прометазина гидрохлорид и гомохлорциклизина гидрохлорид.
В качестве примеров антагонистов лейкотриена можно привести пранлукаст гидрат, монтелукаст натрия, зафирлукаст, аблукаст, побилукаст, сулукаст, иралукаст натрия, верлукаст, ритолукаст, циналукаст, пиродомаст, томелукаст и докваласт.
В качестве примеров противоаллергических лекарственных средств можно привести амексанокс, азеластина гидрохлорид, исрапафант, ибудиласт, имитродаст натрия, эбастин, эпинастина гидрохлорид, эмедастина фумарат, оксатомид, озагрела гидрохлорид, олопатадина гидрохлорид, кромоглициевую кислоту, натрия кромогликат, кетотифена фумарат, сератродаст, цетиризина гидрохлорид, суплатаста тозилат, тазаноласт, терфенадин, домитробан кальция гидрат, траниласт, недокромил, фексофенадин, фексофенадина гидрохлорид, пемироласт калия, мехитазин, раматробан, репиринаст и лоратадин.
В качестве примеров антагонистов рецептора тромбоксана А2 можно привести сератродаст, домитробан кальция гидрат и раматробан.
В качестве примеров ингибиторов тромбоксансинтазы можно привести имитродаст натрия и озагрела гидрохлорид.
В качестве примеров стероидов можно привести амцинонид, гидрокортизона натрия сукцинат, преднизолона натрия сукцинат, метилпреднизолона натрия сукцинат, циклезонид, дифлупреднат, бетаметазона пропионат, дексаметазон, дефлазакорт, триамцинолон, триамцинолона ацетонид, галцинонид, дексаметазона пальмитат, гидрокортизон, флуметазона пивалат, преднизолона бутилацетат, будезонид, прастерона сульфат, мометазона фуроат, флуоцинонид, флуоцинолона ацетонид, флудроксикортид, флунизолид, преднизолон, алклометазона пропионат, клобетазола пропионат, дексаметазона пропионат, депродона пропионат, флутиказона пропионат, беклометазона пропионат, бетаметазон, метилпреднизолон, метилпреднизолона сулептанат, метилпреднизолона натрия сукцинат, дексаметазона натрия фосфат, гидрокортизона натрия фосфат, преднизолона натрия фосфат, дифлукортолона валерат, дексаметазона валерат, бетаметазона валерат, преднизолона валерат ацетат, кортизона ацетат, дифлоразона ацетат, дексаметазона ацетат, триамцинолона ацетат, параметазона ацетат, галопредона ацетат, флудрокортизона ацетат, преднизолона ацетат, метилпреднизолона ацетат, клобетазона бутират, гидрокортизона бутират, гидрокортизона бутират пропионат и бетаметазона бутират пропионат.
В качестве примеров иммунодепрессантов можно привести азатиоприн, аскомицин, эверолимус, салазосульфапиридин, циклоспорин, циклофосфамид, сиролимус, такролимус, буцилламин, метотрексат и лефлуномид.
В качестве примеров модифицирующих заболевание противоревматических лекарственных средств можно привести D-пеницилламин, актарит, ауранофин, салазосульфапиридин, гидроксихлорохин, буцилламин, метотрексат, лефлуномид, лобензарит натрия, ауротиоглюкозу и натрия ауротиомалат.
В качестве примеров ингибиторов эластазы можно привести ONO-5046, ONO-6818, MR-889, РВЫ 101, EPI-HNE-4, R-665, ZD-0892, ZD-8321, GW-311616, DMP-777, L-659286, L-680833, L-683845 и АЕ-3763.
В качестве примеров простагландинов (обозначаемых далее как "PG") можно привести PGE1 лекарственные средства (примеры: алпростадил алфадекс, алпростадил), PGI2 лекарственные средства (пример: берапрост натрия), агонисты PG рецептора и антагонисты PG рецептора. В качестве примеров PG рецептора можно привести PGE рецепторы (ЕР1, ЕР2, ЕРЗ и ЕР4), PGD рецепторы (DP, CRTH2), PGF рецепторы (FP), PGI2 рецепторы (IP) и ТХ рецепторы (TP).
В качестве примеров ингибиторов простагландинсинтазы можно привести салазосульфапиридин, месалазин, олсалазин, 4-аминосалициловую кислоту, JTE-522, ауранофин, карпрофен, дифенпирамид, флуноксапрофен, флурбипрофен, индометацин, кетопрофен, лорноксикам, локсопрофен, мелоксикам, оксапрозин, парсалмид, пипроксен, пироксикам, пироксикам циннамат, залтопрофен и пранопрофен.
В качестве примеров ингибиторов фосфодиэстеразы можно привести ролипрам, циломиласт, Вау19-8004, NIK-616, рофлумиласт (BY-217), ципамфиллин (BRL-61063), атизорам (СР-80633), ONO-6126, SCH-351591, YM-976, V-11294A, PD-168787, D-4396 и IC-485.
В качестве примеров ингибиторов адгезивных молекул можно привести антагонист α4 интегрина.
В качестве примеров анти-TNF-α средств можно привести анти-TNF-α антитела, рецептор растворимого TNF-α, антитела анти-TNF-α рецептора и белок, связывающий растворимый TNF-α, и особенно инфликсимаб и этанерцепт.
В качестве примеров анти-IL-1 средств можно привести анти-IL-1 антитела, рецептор растворимого IL-1, анти-IL-1Ra антитела и/или антитела анти-IL-1 рецептора, и особенно анакинру.
В качестве примеров aHTH-IL-6 средств можно привести анти-IL-6 антитела, рецептор растворимого IL-6 и антитела анти-IL-6 рецептора, и особенно тоцилизумаб.
В качестве примеров ингибиторов цитокина можно привести суплатаст тозилат, Т-614, SR-31747 и сонатимод.
В качестве примеров анти-холинэргических средств можно привести тригексифенидил, тригексифенидила гидрохлорид, бипериден и биперидена гидрохлорид.
В качестве примеров производных ксантина можно привести аминофиллин, теофиллин, доксофиллин, сипамфиллин и дипрофиллин.
В качестве примеров отхаркивающих средств можно привести нашатырный спирт, бикарбонат натрия, бромгексина гидрохлорид, карбоцистеин, амброксола гидрохлорид, метилцистеина гидрохлорид, ацетилцистеин, этил-Е-цистеина гидрохлорид и тилоксапол.
В качестве примеров антибактериальных средств можно привести натрия цефуроксим, меропенема тригидрат, нетилмицина сульфат, сизомицина сульфат, цефтибутен, РА-1806, IB-367, тобрамицин, РА-1420, доксорубицин, астромицина сульфат и цефетамета пивоксил гидрохлорид.
В качестве примеров ингибиторов высвобождения медиаторов можно привести траниласт, натрия кромогликат, амлексанокс, репиринаст, ибудиласт, дазаноласт и пемироласт калия.
В качестве примеров тромболитических средств можно привести альтеплазу, урокиназу, тизокиназу, назаруплазу, натерплазу, t-PA, памитеплазу, монтеплазу, проурокиназу и стрептокиназу.
В качестве примеров гепариноидов можно привести фондапаринукс.
В качестве примеров низкомолекулярных гепаринов можно привести данапароид натрия, эноксапарин (натрия), надропарин кальция, бемипарин (натрия), ревипарин (натрия) и тинзапарин (натрия).
В качестве примеров ингибиторов тромбина можно привести аргатробан, ксимелагатран, мелагатран, дабигатран, бивалирудин, лепирудин, гирудин и дезирудин.
В качестве примеров антагонистов ADP рецептора можно привести тиклопидина гидрохлорид и клопидогрела сульфат.
В качестве примеров ингибиторов циклооксигеназы можно привести аспирин.
В качестве примеров алкилирующих средств можно привести N-оксид гидрохлорид азотистого иприта, циклофосфамид, ифосфамид, мелфалан, тиотепу, карбоквон, бусульфан, нимустина гидрохлорид, дакарбазин и ранимустин.
В качестве примеров антиметаболитов можно привести метотрексат, меркаптопурин, 6-меркаптопурина рибозид, фторурацил, тегафур, тегафур урацил, кармофур, доксифлуридин, цитарабин, эноцитабин, тегафур гиместат отастат калия, гемцитабина гидрохлорид, цитарабина окфосфат, прокарбазина гидрохлорид и гидроксикарбамид.
В качестве примеров противораковых антибиотиков можно привести актиномицин D, митомицин С, даунорубицина гидрохлорид, доксорубицина гидрохлорид, акларубицина гидрохлорид, неокарзиностатин, пирарубицина гидрохлорид, эпирубицин (гидрохлорид), идарубицина гидрохлорид, хромомицин A3, блеомицин (гидрохлорид), пепломицина сульфат, терарубицин и зиностатин стималамер.
В качестве примеров растительных алкалоидов можно привести винбластина сульфат, винкристина сульфат, виндезина сульфат, иринотекана гидрохлорид, этопозид, флутамид, винорелбина тартрат, доцетаксела гидрат и паклитаксел.
В качестве примеров гормонов можно привести эстрамустина фосфат натрия, мепитиостан, эпитиостанол, госерелина ацетат, фосфестрол (диэтилстилбестрола фосфат), тамоксифена цитрат, торемифена цитрат, фадрозола гидрохлорид гидрат, медроксипрогестерона ацетат, бикалутамид, лейпролелина ацетат, анастрозол и эксеместан.
В качестве примеров соединений платины можно привести карбоплатин, цисплатин и недаплатин.
В качестве примеров анти-СБ-20 антител можно привести ритуксимаб, ибритумомаб и окрелизумаб.
В качестве примеров других противораковых средств можно привести L-аспарагиназу, октреотида ацетат, порфимер натрия и митоксантрона ацетат.
Комбинированный препарат, содержащий комбинацию соединения по настоящему изобретению, включает не только комбинированные препараты, открытые к настоящему времени, но также включает комбинированные препараты, которые могут быть открыты в будущем.
Соединения по настоящему изобретению обычно вводят системно или локально в качестве фармацевтически приемлемого компонента в готовой форме для перорального или парентерального введения. В качестве примеров готовых форм для перорального введения можно привести жидкости для перорального введения (например, эликсиры, сиропы, фармацевтически приемлемые препараты на водной основе, суспензии и эмульсии) и твердые препараты для перорального введения (например, таблетки (включая сублингвальные таблетки и таблетки для рассасывания во рту), пилюли, капсулы (включая твердые капсулы, мягкие капсулы, желатиновые капсулы и микрокапсулы), порошки, гранулы и пастилки). В качестве примеров готовых форм для парентерального введения можно привести растворы (например, для инъекций (например, для подкожных инъекций, внутривенных инъекций, внутримышечных инъекций, интраперитонеальных инъекций и препараты для капельниц), глазные капли (например, глазные капли на водной основе (например, глазные капли на водной основе, глазные суспензии на водной основе, вязкие глазные капли и солюбилизированные глазные капли) и неводные глазные капли (например, неводные глазные капли и неводные глазные суспензии)), готовые формы для местного применения (например, мази (например, офтальмологические мази)) и ушные капли). Перечисленные препараты могут представлять собой препараты с контролируемым высвобождением, такие как препараты с быстрым высвобождением, препараты с замедленным высвобождением и т.д. Перечисленные препараты можно готовить известными способами, например способами, описанными в The Japanese Pharmacopoeia.
Жидкости для перорального введения из группы готовых форм для перорального введения можно получать, например, растворением, суспендированием или эмульгированием действующего вещества в обычно используемом растворителе (например, очищенная вода, этанол или их смесь). Эти жидкие готовые формы также могут содержать, например, смачивающее средство, суспендирующее средство, эмульгирующее средство, подсластитель, отдушку, ароматизатор, консервант, буферную добавку и т.д.
Твердые препараты для перорального введения из группы готовых форм для перорального введения можно получать смешиванием действующего вещества, например, с носителем (например, лактоза, маннит, глюкоза, микрокристаллическая целлюлоза и крахмал), связующим средством (например, гидроксипропил целлюлоза, поливинилпирролидон и магния метасиликат алюминат), разрыхлителем (например, кальций гликолят целлюлозы), смазывающим средством (например, стеарат магния), стабилизатором, вспомогательным веществом для растворения (например, глютаминовая кислота и аспарагиновая кислота) и т.д., и изготовлением готового препарата в соответствии со стандартными методиками. При необходимости можно нанести покрытие с помощью соответствующего средства (например, сахар, желатин, гидроксипропил целлюлоза и гидроксипропил метил целлюлозы фталат), при этом можно наносить два или более слоев.
В области препаратов для парентерального введения средство для местного нанесения можно готовить известным способом или получая общеупотребимый тип препарата. Например, мазь можно получать введением действующего вещества в основу или плавлением действующего вещества в основе. Основу для мази выбирают из известных основ для мазей или она представляет собой общеупотребимую основу для мази. Например, можно использовать одно средство из перечисленных далее или смесь двух или более отдельных средств: высшие жирные кислоты и сложные эфиры высших жирных кислот (например, адипиновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота, сложные эфиры адипиновой кислоты, миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты и олеиновой кислоты), воски (например, пчелиный воск, спермацет и церезин), поверхностно-активные средства (например фосфатные эфиры полиоксиэтилен-алкиловьгх простых эфиров), высшие спирты (например, цетанол, стеариловый спирт и цетостеариловый спирт), силиконовые масла (например, диметилпо лисил океан), углеводороды (например, гидрофильный вазелин, белый вазелин, очищенный ланолин и жидкий парафин), гликоли (например, этиленгликоль, диэтиленгликоль, пропиленгликоль, полиэтиленгликоль и макрогол), растительные масла (например, касторовое масло, оливковое масло, кунжутное масло и скипидарное масло), животные масла (например, норковый жир, масло из яичного желтка, сквалан и сквален), вода, стимуляторы абсорбции и анти-раздражители. Также можно добавлять увлажняющее средство, консервант, стабилизатор, антиоксидант, отдушку и т.д.
Инъекционные препараты из группы готовых форм для парэнтерального введения включают растворы, суспензии и эмульсии, а также твердые препараты для инъекций, используемые после растворения или суспендирования в растворителе непосредственно перед применением. Например, можно применять инъекционный препарат, действующее вещество в котором растворено, суспендировано или эмульгировано в растворителе. Например, в качестве растворителя можно использовать дистиллированную воду для инъекций, физиологический раствор, растительное масло, пропиленгликоль, полиэтиленгликоль, спирт, такой как этанол, или комбинацию перечисленных растворителей. Инъекционный препарат также может содержать стабилизатор, вспомогательное вещество для растворения (например, глютаминовая кислота, аспарагиновая кислота и Полисорбат 80 (зарегистрированный товарный знак)), суспендирующее средство, эмульгирующее средство, успокаивающее средство, буферную добавку, консервант и т.д. Инъекционный препарат можно стерилизовать на финальной стадии или можно производить с применением асептической обработки. Инъекционный препарат также можно производить в виде стерильного твердого вещества, например сублимированного продукта, и можно применять после растворения в дистиллированной воде для инъекции или в другом растворителе, который является стерильным или который стерилизуют перед применением.
Дозировку при использовании соединения по настоящему изобретению в виде действующего вещества в лекарственном средстве можно выбирать сообразно обстоятельствам в зависимости, например, от симптомов, возраста, типа готовой формы и т.д. В случае готовой формы для перорального введения предпочтительно от 1 мг до 100 мг и более предпочтительно от 5 мг до 30 мг можно вводить от одного до нескольких раз в день (например, от одного до трех раз). В случае глазных капель за один раз можно вводить от одной до нескольких капель раствора для закапывания в глаза с концентрацией предпочтительно от 0.000001% до 5% (вес./об.) и более предпочтительно от 0.00001% до 0.05% (вес./об.), от одного до нескольких раз в день (например от одного до восьми раз). В случае офтальмологической мази можно применять офтальмологическую мазь с концентрацией предпочтительно от 0.000001% до 5% (вес./вес.) и более предпочтительно от 0.00001%) до 0.05% (вес./вес.) от одного до нескольких раз в день (например от одного до четырех раз).
Разумеется, как описано выше, дозировка зависит от различных условий и, следовательно, возможны случаи, в которых будет достаточным количество ниже указанных уровней дозировок, или случаи, в которых указанные пределы необходимо превысить.
Примеры
Настоящее изобретение описано ниже с помощью примеров, но настоящее изобретение этими примерами не ограничивается.
Растворители, указанные в скобках для ТСХ и в разделе, посвященном хроматографическому разделению, означают растворители, которые применялись для элюирования или проявления, а указанные соотношения представляют собой соотношения по объему.
Если особо не указано иное, данные ЯМР представляют собой данные 1Н-ЯМР.
Использованные при регистрации спектров растворители указаны в скобках в разделе, посвященном ЯМР.
Названия соединений, используемые в настоящем описании, в целом представляют собой названия, сгенерированные на основе правил ИЮПАК или сгенерированные с использованием ACD/Name (зарегистрированный товарный знак), компьютерной программы от Advanced Chemistry Development, Inc., которая генерирует названия на основе правил ИЮПАК
Пример 1
N,N[-дибензил-6-хлор-5-нитропиримидин-4-амйн
Дибензиламин (10.2 г) в растворе дихлорметана (30 мл) прикапывали при охлаждении на ледяной бане к дихлорметановому (70 мл) раствору 4,6-дихлор-5-нитропиримидина (10 г). После этого добавляли триэтиламин (14.4 мл) и перемешивали полученную смесь 1 час.Затем в реакционную смесь добавляли воду, органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении, получая указанное в заголовке соединение (19.2 г), имеющее приведенные ниже физические характеристики. ТСХ: Rf 0.50 (гексан: этил ацетат=7:1).
Пример 2
Трет-бутил 3-{[6-(дибензиламино)-5-нитропиримидин-4-ил]амино}азетидин-1-карбоксилат
Соединение (10.3 г), полученное в Примере 1, и трет-бутил 3-аминоазетидин-1-карбоксилат (5.0 г) растворяли в диоксане (58 мл); добавляли триэтиламин (8.1 мл) и перемешивали в течение 5 часов при 50°C. Реакционную смесь охлаждали до комнатной температуры; затем растворитель упаривали; добавляли воду и проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (10.8 г), имеющее приведенные ниже физические характеристики. ТСХ: Rf 0.40 (гексан: этилацетат=4: 1).
Пример 3
Трет-бутил 3-{[5-амино-6-(дибензиламино)пиримидин-4-ил] амино} азетидин-1-карбоксилат
Этилацетатный (360 мл) раствор соединения (17.5 г), полученного в Примере 2, добавляли по каплям к смеси цинка (23.3 г) и 3.0 М водного раствора хлорида аммония (11.4 г) на ледяной бане, и температуру немедленно поднимали до комнатной температуры. После перемешивания в течение 2 часов реакционную смесь фильтровали через целит (торговое название) и затем растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (12.4 г), имеющее приведенные ниже физические характеристики. ТСХ: Rf 0.69 (гексан: этилацетат=1:1).
Пример 4
Трет-бутил 3-[6-(дибензиламино)-8-оксо-7,8-дигидро-9Н-пурин-9-ил]азетидин-1-карбоксилат
Соединение (8.4 г), полученное в Примере 3, и 1,1 '-карбонилдиимидазол (5.9 г) растворяли в тетрагидрофуране (120 мл) после чего перемешивали в течение 15 часов при 60°С. После отгонки растворителя из реакционной смеси добавляли воду и проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (7.8 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.28 (гексан: этилацетат=2:1).
Пример 5
Трет-бутил 3-(6-амино-8-оксо-7,8-дигидро-9Н-пурин-9-ил)азетидин-1-карбоксилат
Соединение (7.8 г), полученное в Примере 4, растворяли в метаноле (240 мл) и этилацетате (50 мл); добавляли 20%-ный катализатор Перлмана (Pd(OH)2/C) (8.0 г, 100 вес.%); заполняли реакционный сосуд водородом и перемешивали 7.5 часов при 60°C. Реакционную смесь фильтровали через целит (торговое название) и отгоняли растворитель, получая указанное в заголовке соединение (5.0 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.50 (этилацетат).
Пример 6
Трет-бутил 3-[6-амино-8-оксо-7-(4-феноксифенил)-7,8-дигидро-9Н-пурин-9-ил] азетидин-1 -карбоксилат
Пара-феноксифенилбороновую кислоту (2.1 г), ацетат меди(И) (1.48 г), молекулярные сита 4А (2.5 г) и пиридин (0.82 мл) добавляли при комнатной температуре в дихлорметановую (200 мл) суспензию соединения (2.5 г), полученного в Примере 5, после чего перемешивали 21 час. Реакционный раствор фильтровали через целит (торговое название), и остаток очищали колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (1.3 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.18 (гексан: этилацетат=1:1).
Пример 7
6-амино-9-азетидин-3-ил-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он дигидрохлорид
4н. раствор хлороводорода в диоксане (13 мл) добавляли при комнатной температуре к суспензии в метаноле (13 мл) соединения (1.3 г, 2.76 ммоль, 1.0 экв.), полученного в Примере 6, и перемешивали в течение 1 часа. Растворитель затем упаривали, получая указанное в заголовке соединение (1.5 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.50 (дихлорметан: метанол: 28% водный аммиак=9: 1: 0.1).
Пример 8
9-(1-акрилоил-3-азетидинил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
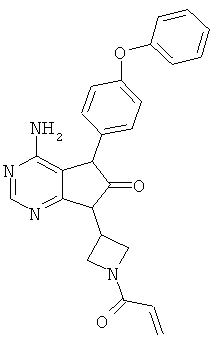
Триэтиламин (1.1 мл) добавляли к суспензии в дихлорметане (16 мл) соединения (1.5 г), полученного в Примере 7, и затем прикапывали дихлорметановый (10 мл) раствор акрилоилхлорида (0.32 мл) при -10°C. Растворитель отгоняли из реакционной смеси, после чего добавляли воду и экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (0.8 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.43 (этилацетат);
1Н-ЯМР (CDCl3): δ 4.47-4.61, 4.83-4.88, 5.06-5.11, 5.37-5.47, 5.70-5.74, 6.21-6.30, 6.36-6.43, 7.07-7.23, 7.35-7.44, 8.24.
Пример 8(1) - Пример 8(22)
Описанные ниже иллюстративные соединения были получены по той же схеме, как в цепочке Пример 1 → Пример 2 → Пример 3 → Пример 4 → Пример 5 → Пример 6 → Пример 7 → Пример 8, с использованием 4,6-дихлор-5-нитропиримидина, с использованием трет-бутил 3-аминоазетидин-1-карбоксилата или соответствующего аминного производного вместо него, с использованием акрилоилхлорида или соответствующего ацилхлорида вместо него, и с использованием п-феноксифенилбороновой кислоты или соответствующей бороновой кислоты вместо нее.
Пример 8(1)
9-[(3R)-1-акрилоил-3-пиперидинил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8H-пурин-8-он
ТСХ: Rf 0.33 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.64-1.78, 1.90-2.12, 2.55-2.80, 3.10-3.22, 3.63-3.74, 3.99-4.12, 4.40-4.55, 4.73-4.82, 5.66-5.72, 6.26-6.31, 6.53-6.65, 7.07-7.22, 7.36-7.44, 8.23.
Пример 8(2)
9-(1-акрилоил-3-азетидинил)-6-амино-7-[4-(3-хлорфенокси)-3-метоксифенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.25 (этилацетат);
1Н-ЯМР (CDCl3): δ 3.88, 4.47-4.62, 4.83-4.89, 5.07-5.12, 5.39-5.48, 5.70-5.74, 6.21-6.30, 6.37-6.43, 6.87-6.91, 6.95-7.00, 7.08-7.13, 7.24-7.29, 8.27.
Пример 8(3)
9-(1-акрилоил-4-пиперидинил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.38 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.88-1.96, 2.59-2.80, 3.15-3.27, 4.13-4.22, 4.48, 4.58-4.69, 4.85-4.95, 5.69-5.73, 6.27-6.34, 6.59-6.68, 7.07-7.15, 7.17-7.22, 7.34-7.44, 8.21.
Пример 8(4)
9-[(3R)-l-акрилоил-3-пирролидинил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8H-пурин-8-он
ТСХ: Rf 0.60 (хлороформ: метанол: водный аммиак=80:10:1);
1Н-ЯМР (CDCl3): δ 2.21-2.46, 2.82-3.08, 3.53-3.76, 3.89-4.36, 4.40-4.59, 5.11-5.32, 5.64-5.77, 6.34-6.58, 7.04-7.24, 7.34-7.49, 8.18-8.26.
Пример 8(5)
9-[(3S)-1-акрилоил-3-пиперидинил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.71 (хлороформ: метанол: водный аммиак=80: 10: 1);
1Н-ЯМР (CDCl3): δ 1.52-1.80, 1.88-2.17, 2.51-2.84, 3.07-3.26, 3.59-3.76, 3.94-4.16, 4.38-4.63, 4.66-4.90, 5.61-5.80, 6.21-6.40, 6.48-6.72, 7.03-7.25, 7.33-7.50, 8.23.
Пример 8(6)
9-[(3S)-1-акрилоил-3-пирролидинил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.50 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 2.23-2.43, 2.84-3.04, 3.55-3.73, 3.91-4.08, 4.12-4.19, 4.26-4.32, 4.47-4.49, 5.13-5.27, 5.66-5.73, 6.35-6.54, 7.03-7.28, 7.33-7.43, 8.20-8.22.
Пример 8(7)
9-(1-акрилоил-3-азетидинил)-6-амино-7-[4-(3-хлорфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.53 (хлороформ: метанол: водный аммиак=9:1: 0.01);
1Н-ЯМР (CDCl3): δ 4.46-4.61, 4.85, 5.08, 5.42, 5.71, 6.24, 6.38, 6.96, 7.08, 7.13-7.18, 7.32, 7.42, 8.24.
Пример 8(8)
9-(1-акрилоил-3-азетидинил)-6-амино-7-(3-метокси-4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.18 (этилацетат);
1Н-ЯМР (CDCl3): δ 3.90, 4.45-4.65, 4.80-4.90, 5.05-5.15, 5.35-5.45, 5.72, 6.26, 6.39, 6.90-7.40, 8.25.
Пример 8(9)
9-(1-акрилоил-3-азетидинил)-6-амино-7-(3-фтор-4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.27 (этилацетат);
1Н-ЯМР (CDCl3): δ 4.45-4.65, 4.80-4.90, 5.05-5.15, 5.35-5.45, 5.72, 6.25, 6.40, 7.05-7.42, 8.26.
Пример 8(10)
9-(1 -акрилоил-3 -азетидинил)-6-амино-7-[4-(3,4-дихлорфенокси)-3-метоксифенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.20 (этилацетат);
1Н-ЯМР (CD3OD): δ 3.82, 4.47, 4.59, 4.72, 4.77-4.95, 5.00-5.09, 5.40-5.53, 5.77, 6.28, 6.41, 6.91,7.09,7.28,7.43,8.17.
Пример 8(11)
9-(1-акрилоил-3-азетидинил)-6-амино-7-[4-(3-фторфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.73 (этилацетат: метанол: триэтиламин=9:1:0.1);
1H-ЯМР (CDCl3): δ 4.50, 4.59, 4.85, 5.08, 5.42, 5.72, 6.25, 6.40, 6.78-6.93, 7.17, 7.33, 7.43, 8.26.
Пример 8(12)
9-(1-акрилоил-3-азетидинил)-6-амино-7-[4-(3,5-дифторфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.78 (этилацетат: метанол: триэтиламин=9:1:0.1);
1Н-ЯМР (CDCl3): δ 4.50, 4.59, 4.85, 5.08, 5.42, 5.71, 6.25, 6.39, 6.57-6.62, 7.19, 7.45, 8.26.
Пример 8(13)
9-(1 -акрилоил-3-азетидинил)-6-амино-7-(2-фтор-4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.47 (метанол: этилацетат=1:19);
1Н-ЯМР (CDC1): δ 4.40-4.60, 4.80-4.90, 5.00-5.10, 5.35-5.45, 5.72, 6.25, 6.39, 6.80-7.50, 8.24.
Пример 8 ("14)
9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.50 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl): δ 1.27-1.44, 1.72-1.86, 2.18-2.37, 2.66, 3.04, 3.90, 4.00, 4.51, 4.67, 5.66, 6.24, 6.56, 7.03-7.24, 7.32-7.46, 8.25.
Пример 8(15)
6-амино-9-[1-(хлорацетил)-3-азетидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.41 (этилацетат: метанол=19: 1);
1H-ЯМР (CDCl3): δ 3.96-4.05, 4.44-4.53, 4.62-4.72, 4.80-4.87, 5.08-5.16, 5.38-5.48, 7.05-7.24, 7.35-7.43, 8.24.
Пример 8(16)
6-амино-9-[(3R)-1-(хлорацетил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.49 (этилацетат: метанол=19:1);
1H-ЯМР (CDCl3): δ 2.20-2.48, 2.78-3.01, 3.50-3.63, 3.64-3.81, 3.90-4.19, 4.26-4.36, 4.51, 5.14-5.32,7.02-7.26,7.27-7.46,8.21.
Пример 8(17)
6-амино-9-{(3R)-l-[(2E)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.41 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 1.88, 2.19-2.43, 2.82-3.05, 3.50-3.74, 3.88-4.18, 4.20-4.30, 4.48, 5.08-5.16, 6.13, 6.95, 7.05-7.23, 7.34-7.46, 8.22.
Пример 8(18)
6-амино-9-{[1-(хлорацетил)-4-пиперидинил]метил} -7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.54 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): 5 1.14-1.59, 1.70-1.87, 2.19-2.37, 2.65, 3.10, 3.81-3.95, 3.91, 4.06, 4.50, 4.51-4.63, 7.05-7.23, 7.34-7.46, 8.25.
Пример 8(19)
9-[(1-акрилоил-4-метил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.55 (этилацетат: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.15, 1.37-1.85, 3.21-3.50, 3.70-3.99, 4.03-4.23, 4.52-4.73, 5.64, 6.24, 6.56, 6.97-7.23, 7.31-7.50, 8.21.
Пример 8(20)
6-амино-9-{1-[(2Е)-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.63 (этилацетат: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.89, 4.46, 4.51, 4.79, 5.03, 5.20, 5.39, 5.94, 6.93, 7.07-7.10, 7.19, 7.36-7.43, 8.23.
Пример 8(21)
9-{[(3R)-1-акрилоил-3-пирролидинил]метил}-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-8-он
ТСХ: Rf 0.49 (дихлорметан: метанол: водный аммиак=9: 1: 0.1);
1Н-ЯМР (CDCl3): δ 1.77-1.97, 2.02-2.19, 2.83-3.01, 3.38-3.62, 3.66-3.83, 3.98-4.11, 4.42-4.54, 5.61-5.70, 6.30-6.45, 7.04-7.23, 7.36-7.43, 8.23.
Пример 8(22)
9-{[(28)-1-акрилоил-2-пирролидинил]метил}-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.44 (дихлорметан: метанол: водный аммиак=9:1:
1Н-ЯМР (CDCl3): δ 1.87-2.28, 3.46-3.78, 3.86-3.96, 3.99-4.10, 4.15-4.23, 4.40, 4.45-4.60, 4.81-4.91, 5.54-5.72, 6.16-6.44, 6.86-6.97, 7.04-7.22, 7.36-7.45, 8.21-8.26.
Пример 9
трет-бутил (3R)-3-{[6-(дибензиламино)-5-нитропиримидин-4-ил]амино}пиперидин-1-карбоксилат
Указанное в заголовке соединение (1.44 г), имеющее приведенные ниже физические характеристики, получали по той же общей методике, как описано в. Примере 2, с использованием соединения (1.5 г), полученного в Примере 1 и с использованием трет-бутил (3R)-3-аминопиперидин-1-карбоксилата (0.85 г) вместо трет-бутил 3-аминоазетидин-1-карбоксилата.
ТСХ: Rf 0.23 (гексан: этилацетат=9:1).
Пример 10
6-амино-7-(4-феноксифенил)-9-[(3R)-пиперидин-3-ил]-7,9-дигидро-8H-пурин-8-он дигидрохлорид
Указанное в заголовке соединение (155 мг), имеющее приведенные ниже физические характеристики, получали по той же общей методике, которая описана в цепочке Пример 3 → Пример 4 → Пример 5 → Пример 6 → Пример 7, с использованием соединения, полученного в Примере 9 и с использованием п-феноксифенилбороновой кислоты (154 мг).
ТСХ: Rf 0.68 (метанол: дихлорметан: водный аммиак=80:20:4).
Пример 11
6-амино-9--{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пиперидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
Триэтиламин (1.40 мл) добавляли в дихлорметановый (6 мл) раствор соединения (1.20 г), полученного в Примере 10. Добавляли при охлаждении на ледяной бане 4-бромкротонил хлорид (0.5 М раствор в дихлорэтане, 5.04 мл), и перемешивали реакционную смесь 30 минут на ледяной бане. После концентрирования добавляли насыщенный водный раствор бикарбоната натрия и проводили экстракцию этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Добавляли к остатку тетрагидрофуран (6 мл) и диметиламин (2.0 М раствор в тетрагидрофуране, 6.3 мл) и нагревали 2 часа при 50°C. Затем раствор фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат=1:1 → этилацетат → этилацетат: метанол: триэтиламин=18:2:1), получая указанное в заголовке соединение (0.66 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.40 (этилацетат: метанол: триэтиламин=18:2:1);
1H-ЯМР (CDCl3): δ 1.52-1.77, 1.87-2.00, 2.00-2.12, 2.18-2.35, 2.53-2.85, 2.93-3.22, 3.57-3.74, 3.97-4.17, 4.36-4.60, 4.66-4.89, 6.35-6.55, 6.76-6.94, 7.03-7.30, 7.32-7.48, 8.21.
Примеры 11(1)-11(26)
Описанные ниже иллюстративные соединения были получены по той же схеме, что в цепочке Пример 9 → Пример 10 → Пример 11, с использованием соединения, полученного в Примере 1, с использованием трет-бутил (3R)-3-аминопиперидин-1-карбоксилата или соответствующего, аминного производного вместо него, с использованием п-феноксифенилбороновой кислоты или соответствующей бороновой кислоты вместо нее, и с использованием диметиламина или соответствующего аминного производного вместо него.
Пример 11(1)
6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.21 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1Н-ЯМР (CDCl3): δ 2.27, 3.08-3.10, 4.45-4.60, 4.80-4.86, 5.05-5.10, 5.36-5.44, 6.06-6.12, 6.87-6.96, 7.07-7.15, 7.17-7.23, 7.35-7.44, 8.24.
Пример 11(2)
6-амино-9-{1-[(2Е)-4-(4-морфолинил)-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.48 (этилацетат: метанол: триэтиламин=9:1:0.5);
1Н-ЯМР (CDCl3): δ 2.48, 3.14-3.16, 3.71-3.73, 4.44-4.59, 4.80-4.86, 5.04-5.09, 5.36-5.46, 6.08-6.13, 6.86-6.95, 7.07-7.15, 7.17-7.22, 7.34-7.42, 8.23.
Пример 11(3)
6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
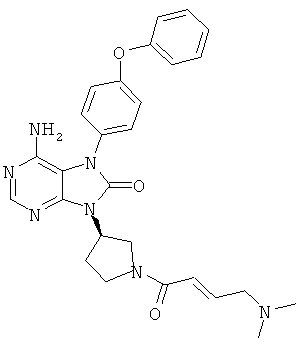
ТСХ: Rf 0.21 (дихлорметан: метанол=17:3);
1Н-ЯМР (CDCl3): δ 2.20-2.42, 2.84-3.14, 3.52-3.76, 3.90-4.20, 4.22-4.34, 4.42-4.51, 5.10-5.29, 6.20-6.38, 6.86-7.01, 7.03-7.24, 7.37-7.46, 8.20-8.23.
Пример 11(4)
6-амино-7-(4-феноксифенил)-9-{1-[(2Е)-4-(1-пиперидинил)-2-бутеноил]-3-азетидинил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.48 (этилацетат: метанол: триэтиламин=9:1:0.5);
1H-ЯМ? (CDCl3): δ 1.32-1.47, 1.57-1.64, 2.38-2.44, 3.13-3.14, 4.44-4.60, 4.80-4.86, 5.04-5.09, 5.35-5.46, 6.05-6.11, 6.89-6.99, 7.07-7.15, 7.17-7.23, 7.35-7.44, 8.24.
Пример 11(5)
6-амино-7-(4-феноксифенил)-9-{1-[(2Е)-4-(4-тиоморфолинил)-2-бутеноил]-3-азетидинил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.58 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1Н-ЯМР (CDCl3): 5 2.66-2.75, 3.15-3.17, 4.44-4.59, 4.80-4.86, 5.04-5.09, 5.36-5.44, 6.05-6.11, 6.85-6.94, 7.07-7.15, 7.17-7.23, 7.35-7.44, 8.24.
Пример 11(6)
6-амино-9-{1-[(2Е)-4-(3-оксо-1-пиперазинил)-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.16 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1Н-ЯМР (CDCl3): δ 2.67-2.71, 3.19, 3.22-3.24, 3.36-3.40, 4.45-4.59, 4.81-4.87, 5.05-5.10, 5.37-5.47, 6.05, 6.10-6.16, 6.84-6.93, 7.07-7.15, 7.17-7.23, 7.36-7.44, 8.24.
Пример 11 (7)
6-амино-7-(4-феноксифенил)-9-{1-[(2Е)-4-(1-пирролидинил)-2-бутеноил]-3-азетидинил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.39 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1H-ЯМР (CDCl3): δ 1.79-1.83, 2.50-2.65, 3.28-3.31, 4.44-4.60, 4.80-4.85, 5.04-5.09, 5.35-5.45, 6.10-6.15, 6.90-6.99, 7.06-7.14, 7.16-7.22, 7.35-7.43, 8.23.
Пример 11 (8)
6-амино-9-(1-{(2Е)-4-[(2-гидроксиэтил)(метил)амино]-2-бутеноил}-3-азетидинил)-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.40 (дихлорметан: метанол: водный аммиак=9: 1: 0.1);
1Н-ЯМР (CDCl3): δ 2.29, 2.57-2.61, 3.23-3.26, 3.59-3.63, 4.44-4.59, 4.80-4.86, 5.04-5.09, 5.36-5.46, 6.06-6.13, 6.86-6.95, 7.07-7.15, 7.16-7.26, 7.35-7.42, 8.24.
Пример 11(9)
6-амино-7-(4-феноксифенил)-9-{^)-1-[(2Е)-4-(1-пирролидинил)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.42 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.74-1.92, 2.15-2.43, 2.54-2.70, 2.82-3.06, 3.32, 3.49-3.77, 3.91-4.20, 4.23-4.36, 4.51, 5.10-5.28, 6.36, 6.91-7.04, 7.06-7.24, 7.37-7.45, 8.21.
Пример 11(10)
6-амино-7-(4-феноксифенил)-9-{(3R)-1-[(2E)-4-(1-пиперидинил)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.39 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.35-1.50, 1.51-1.65, 2.20-2.48, 2.82-3.06, 3.12, 3.52-3.75, 3.88-4.19, 4.21-4.33, 4.51, 5.09-5.28, 6.27, 6.88-7.04, 7.05-7.23, 7.34-7.44, 8.22.
Пример 11(11)
6-амино-9-{(3R)-1-[(2Е)-4-(4-морфолинил)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.51 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 2.19-2.54, 2.83-3.05, 3.14, 3.51-3.77, 3.89-4.19, 4.21-4.32, 4.57, 5.10-5.28, 6.31, 6.87-6.99, 7.04-7.23, 7.34-7.46, 8.21.
Пример 11(12)
6-амино-7-(4-феноксифенил)-9-{(3R)-1-[(2E)-4-(4-тиоморфолинил)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.54 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): 5 2.10-2.43, 2.50-2.78, 2.82-3.06, 3.15, 3.51-3.74, 3.89-4.19, 4.22-4.33, 4.51, 5.09-5.28, 6.29, 6.86-6.99, 7.04-7.23, 7.35-7.47, 8.22.
Пример 11(13)
6-амино-9-[(3R)-1-{(2E)-4-[этил(метил)амино]-2-бутеноил}-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.34 (этилацетат: метанол: триэтиламин=9: 1: 0.5);
1H-ЯМР (CDCl3): δ 1.05-1.19, 2.20-2.43, 2.35, 2.59, 2.82-3.08, 3.31, 3.50-3.77, 3.90-4.20, 4.23-4.33, 4.50, 5.10-5.28, 6.38, 6.88-6.99, 7.04-7.23, 7.35-7.46, 8.21.
Пример 11(14)
6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
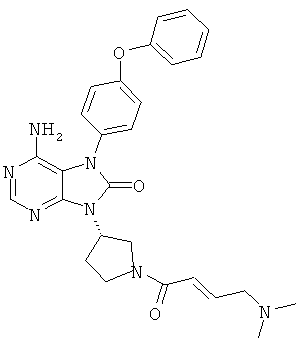
ТСХ: Rf 0.38 (дихлорметан: метанол: водный аммиак=9:1:0.1);
1H-ЯМР (CDCl3) δ 2.20-2.42, 2.83-3.14, 3.52-3.74, 3.92-4.20, 4.24-4.32, 4.42-4.51, 5.13-5.25, 6.20-6.38, 6.87-7.00, 7.05-7.24, 7.35-7.43, 8.20-8.23.
Пример 11(15)
6-амино-9-{1-[(2Е)-4-(диэтиламино)-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.47 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1Н-ЯМР (CDCl3): δ 1.01-1.06, 2.51-2.58, 3.25-3.27, 4.44-4.59, 4.81-4.86, 5.04-5.09, 5.36-5.46, 6.07-6.13, 6.91-7.00, 7.07-7.15, 7.17-7.23, 7.36-7.44, 8.24.
Пример 11(16)
6-амино-9-(1-{(2Е)-4-[этил(метил)амино]-2-бутеноил}-3-азетидинил)-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.50 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1Н-ЯМР (CDCl3): δ 1.05-1.09, 2.24, 2.41-2.48, 3.15-3.18, 4.44-4.59, 4.80-4.86, 5.04-5.09, 5.36-5.46, 6.05-6.12, 6.89-6.98, 7.07-7.15, 7.17-7.23, 7.36-7.44, 8.24.
Пример 11(17)
2-{[(2Е)-4-{3-[6-амино-8-оксо-7-(4-феноксифенил)-7,8-дигидро-9Н-пурин-9-ил]-1-азетидинил} -4-оксо-2-бутен-1 -ил] (метил)амино} ацетамид
ТСХ: Rf 0.30 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1H-ЯМР (CDCl3): δ 2.35, 3.04, 3.23-3.25, 4.45-4.60, 4.81-4.87, 5.04-5.09, 5.37-5.47, 5.61, 6.05-6.11, 6.84-6.94, 6.99, 7.07-7.15, 7.17-7.23, 7.35-7.44, 8.24.
Пример 11(18)
6-амино-9-{(3R)-l-[(2E)-4-(диэтиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.52 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 0.96-1.11, 2.21-2.43, 2.45-2.63, 2.83-3.05, 3.29, 3.52-3.78, 3.90-4.20, 4.22-4.33, 4.49, 5.10-5.28, 6.33, 6.90-7.04, 7.05-7.23, 7.34-7.47, 8.21.
Пример 11(19)
6-амино-9-[(3R)-l-{(2E)-4-[(2-гидроксиэтил)(метил)амино]-2-бутеноил}-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.18 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1Н-ЯМР (CDCl3): δ 2.21-2.62, 2.85-3.08, 3.21-3.28, 3.52-3.74, 3.92-4.17, 4.25-4.33, 4.61-4.63, 5.13-5.30, 6.24-6.37, 6.87-6.98, 7.07-7.23, 7.35-7.44, 8.19-8.22.
Пример 11(20)
6-амино-9-{1-[(2Е)-4-(4-гидрокси-1 -пиперидинил)-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.30 (дихлорметан: метанол: триэтиламин=9: 1: 0.1);
1Н-ЯМР (CDCl3): δ 1.30-1.75, 1.82-1.97, 2.10-2.24, 2.65-2.82, 3.05-3.20, 3.61-3.78, 4.40-4.60, 4.78-4.86, 5.00-5.11, 5.33-5.46, 6.02-6.12, 6.84-6.98, 7.05-7.24, 7.35-7.43, 8.23.
Пример 11(21)
6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-он
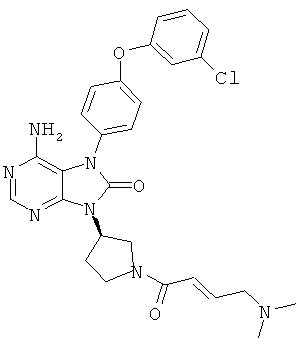
ТСХ: Rf 0.28 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 2.17-2.43, 2.25, 2.83-3.05, 3.08, 3.51-3.76, 3.91-4.20, 4.22-4.33, 4.50, 5.10-5.18, 6.29, 6.88-7.01, 7.09, 7.10-7.20, 7.33, 7.42, 8.23.
Пример 11(22)
6-амино-9-[(3S)-1-{(2Е)-4-[этил(метил)амино] -2-бутеноил}-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.44 (этилацетат: метанол: триэтиламин=18:2:1);
1Н-ЯМР (CDCl3): δ 1.00-1.14, 2.18-2.32, 2.32-2.53, 2.82-3.06, 3.10-3.23, 3.50-3.77, 3.86-4.09, 4.09-4.35, 4.37-4.58, 5.06-5.32, 6.20-6.41, 6.87-7.03, 7.03-7.25, 7.31-7.50, 8.14-8.30.
Пример 11(23)
6-амино-9-{(3S)-1-[(2Е)-4-(диэтиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он ТСХ: Rf 0.44 (этилацетат: метанол: триэтиламин=18:2:1);
1Н-ЯМР (CDCl3): δ 0.97-1.11, 2.19-2.46, 2.47-2.65, 2.85-3.05, 3.21-3.35, 3.50-3.76, 3.89-4.09, 4.09-4.33, 4.40-4.55, 5.10-5.28, 6.21-6.43, 6.88-7.05, 7.05-7.24, 7.34-7.48, 8.17-8.27.
Пример 11(24)
6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил} -7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
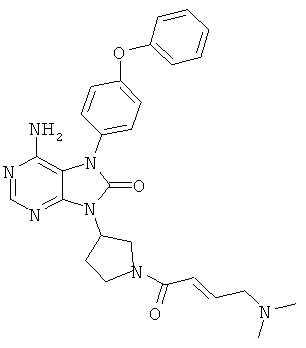
ТСХ: Rf 0.38 (дихлорметан: метанол: водный аммиак=9: 1: 0.1);
1Н-ЯМР (CDCl3): δ 2.20-2.42, 2.83-3.14, 3.52-3.74, 3.92-4.20, 4.24-4.32, 4.42-4.51, 5.13-5.25, 6.20-6.38, 6.87-7.00, 7.05-7.24, 7.35-7.43, 8.20-8.23.
Пример 11(25)
6-амино-9-({(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}метил)-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.28 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.75-1.97, 2.00-2.16, 2.20-2.26, 2.83-3.00, 3.02-3.10, 3.38-3.62, 3.69-3.82, 3.98-4.08, 4.50-4.60, 6.19-6.31, 6.82-6.96, 7.04-7.22, 7.35-7.43, 8.23.
Пример 11(26)
6-амино-9-({(2S)-1-[(2Е)-4-(диметиламино)-2-бутеноил] -2-пирролидинил} метил)-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.30 (этилацетат: метанол: триэтиламин=9:1: 0.5);
1Н-ЯМР (CDCl3): δ 1.86-2.27, 2.98-3.02, 3.03-3.17, 3.45-3.76, 3.88-3.95, 3.98-4.08, 4.15-4.23, 4.39-4.42,4.47-4.57,4.80-4.91, 6.09-6.19, 6.66-6.83, 6.94-7.03, 7.04-7.23, 7.35-7.46, 8.20-8.27.
Пример 12
Диметиламиноацетальдегида дисульфит
Воду (1 мл) и концентрированную соляную кислоту (2.4 мл) добавляли к диэтилацеталю диметиламиноацетальдегида (2.00 г) и нагревали 3 часа при 40°С.Дисульфит натрия (3.0 М раствор в воде, 3.6 мл) и этанол (10 мл) добавляли на ледяной бане и перемешивали 1.5 часа при комнатной температуре. Раствор фильтровали и концентрировали. Полученный остаток упаривали досуха при пониженном давлении при 60°C, получая указанное в заголовке соединение (1.29 г).
Пример 13
Трет-бутил (3R)-3-{[6-(дибензиламино)-5-нитропиримидин-4-ил] амино} пирролидин-1 -карбоксил ат
Указанное в заголовке соединение (27.0 г), имеющее приведенные ниже физические характеристики, получали по той же общей методике, что и в Примере 2, с использованием соединения (19 г), полученного в Примере 1, и с использованием трет-бутил (3R)-3-aMHHonnpponHflHH-l-Kap6oKCHnaTa (10.5 г) вместо трет-бутил 3-аминоазетидин-1 -карбоксилата.
ТСХ: Rf 0.29 (гексан: этилацетат=4:1).
Пример 14
6-амино-7-(4-феноксифенил)-9-[(3R)-пирролидин-3-ил]-7,9-дигидро-8H-пурин-8-он дигидрохлорид
Указанное в заголовке соединение (945 мг), имеющее приведенные ниже физические характеристики, получали по той же общей методике, что и в Примере 10, с использованием соединения (9.0 г), полученного в Примере 13, и с использованием п-феноксифенилбороновой кислоты (2.1 г).
ТСХ: Rf 0.43 (дихлорметан: метанол: водный аммиак=8:1:0.1).
Пример 15
Диэтил (2-{[(3R)-3-[6-амино-8-оксо-7-(4-феноксифенил)-7,8-дигидро-9H-пурин-9-ил]пирролидин-1 -ил} -2-оксоэтил)фосфонат
1,1'-карбонилдиимидазол (0.827 г) добавляли в тетрагидрофуран (5 мл) и нагревали до 40°C. В полученный раствор добавляли диэтилфосфоноуксусную кислоту (1.00 г), растворенную в тетрагидрофуране (5 мл). Перемешивали 30 минут при 40°C. Полученный раствор (0.28 мл), соединение (50 мг), полученное в Примере 14, и триэтиламин (0.03 мл) добавляли в тетрагидрофуран (0.5 мл) и перемешивали 1 день при комнатной температуре. Добавляли воду и проводили экстракцию этилацетатом. Полученный органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, затем фильтровали и концентрировали. Полученный остаток упаривали досуха при пониженном давлении, получая указанное в заголовке соединение (53 мг), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.46 (хлороформ: метанол: 28% водный аммиак=80:10:1).
Пример 16
6-амино-9-{(3R)-1-[(2 г)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
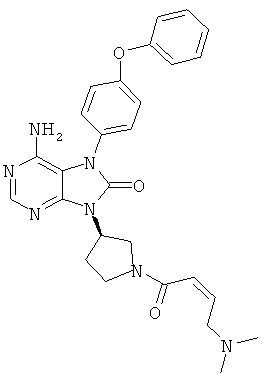
Соединение (53 мг), полученное в Примере 12, добавляли в этанол (0.9 мл) и добавляли хлорид лития (4.2 мг). При охлаждении на ледяной бане добавляли гидроксид калия (45%-ный водный раствор, 0.056 мл) и соединение (25 мг), полученное в Примере 15, растворенное в воде (0.25 мл). Перемешивали 30 минут на ледяной бане. Добавляли еще порцию соединения (7.5 мг), полученного в Примере 15, растворенного в воде (0.25 мл). Перемешивали 2 часа на ледяной бане, затем перемешивали 1 день при комнатной температуре. Проводили экстракцию этилацетатом, органический слой промывали насыщенным водным раствором хлорида натрия и концентрировали при пониженном давлении. Полученный остаток очищали методом тонкослойной хроматографии (дихлорметан: метанол: 28% водный аммиак=80: 10: 1), получая указанное в заголовке соединение (7.7 мг), имеющее приведенные ниже физические характеристики. ТСХ: Rf 0.43 (хлороформ: метанол: водный аммиак=80:10:1);
1Н-ЯМР (CDCl3): δ 2.14-2.45, 2.81-3.03, 3.43-3.68, 3.80-4.06, 4.06-4.28, 4.42-4.62, 5.11-5.29, 5.97-6.24, 7.03-7.25,8.17-8.28.
Пример 17
Трет-бутил 4-({[6-(дибензиламино)-5-нитропиримидин-4-ил] амино} метил)пиперидин-1 -карбоксилат
Указанное в заголовке соединение (68.3 г), имеющее приведенные ниже физические характеристики, получали по той же общей методике, как описано в Примере 2, с использованием соединения (45.5 г), полученного в Примере 1, и с использованием трет-бутил 4-(аминометил)пиперидин-1-карбоксилата (27.5 г) вместо трет-бутил 3-аминоазетидин-1-карбоксилата.
ТСХ: Rf 0.56 (гексан: этилацетат=2:1).
Пример 18
6-амино-7-(4-феноксифенил)-9-(пиперидин-4-илметил)-7,9-дигидро-8Н-пурин-8-он дигидрохлорид
Указанное в заголовке соединение (1.66 г), имеющее приведенные ниже физические характеристики, получали по той же общей методике, что и в Примере 10, с использованием соединения, полученного в Примере 17, и с использованием п-феноксифенилбороновой кислоты (19 г).
ТСХ: Rf 0.10 (этилацетат: метанол: триэтиламин -18:2:1).
Пример 19
6-амино-9-{[1-(2-бутиноил)-4-пиперидинил]метил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
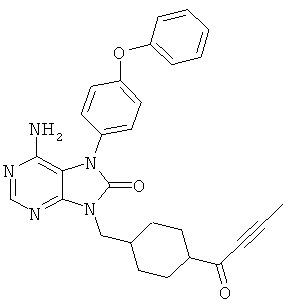
2-бутиновуто кислоту (34 мг), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (EDC) (78 мг), 1-гидроксибензотриазол (HOBt) (62 мг) и триэтиламин (114 мкл) добавляли в диметилформамидный (3 мл) раствор соединения (100 мг), полученного в Примере 18, после чего перемешивали в течение 3 часов при комнатной температуре. В реакционную смесь добавляли воду и проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, после чего сушили над безводным сульфатом натрия и отгоняли растворитель. Остаток очищали методом тонкослойной хроматографии (дихлорметан: метанол: 28% водный аммиак=90: 10: 1), получая указанное в заголовке соединение (75 мг), имеющее приведенные ниже физические характеристики. ТСХ: Rf 0.43 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.21-1.45, 1.71-1.83, 1.99, 2.18-2.36, 2.59-2.72, 2.99-3.94, 4.34-4.61, 7.05-7.24, 7.36-7.43, 8.24.
Примеры 19(1)-19(49)
Описанные ниже иллюстративные соединения были получены по той же схеме, что и в цепочке Пример 9 → Пример 10 → Пример 19, с использованием соединения, полученного в Примере 1, с использованием трет-бутил (3R)-3-аминопиперидин-1-карбоксилата или соответствующего аминного производного вместо него, и с использованием п-феноксифенилбороновой кислоты или соответствующей бороновой кислоты вместо нее.
Пример 19(1)
6-амино-9-[1-(2-бутиноил)-3-азетидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.38 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 1.99, 4.39-4.57, 4.75-4.83, 4.97-5.05, 5.32-5.43, 7.05-7.24, 7.35-7.43, 8.24.
Пример 19(2)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
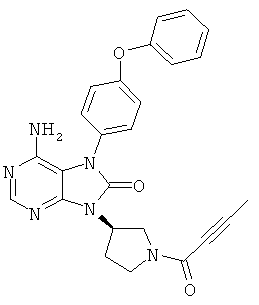
ТСХ: Rf 0.68 (этилацетат: метанол=9:1);
1Н-ЯМР (CDCL3): δ 1.94-2.03, 2.23-2.39, 2.80-3.01, 3.50-3.63, 3.67-3.80, 3.86-4.02, 4.03-4.18, 4.23-4.33, 4.42-4.51, 5.11-5.25, 7.04-7.23, 7.34-7.45, 8.20-8.23.
Пример 19(3)
6-амино-9-[(3S)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.27 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.89-4.00, 4.03-4.18, 4.23-4.34,4.42-4.51, 5.13-5.25, 7.05-7.24, 7.35-7.43, 8.20-8.23.
Пример 19(4)
6-амино-7-(4-феноксйфенил)-9-[(3R)-l-пропиолоил-3-пирролидинил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.51 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 2.25-2.43, 2.82-3.01, 3.05, 3.52-3.66, 3.73-3.85, 3.92-4.04, 4.07-4.23, 4.31-4.40, 4.48, 5.17-5.27, 7.06-7.23, 7.34-7.47, 8.23.
Пример 19(5)
(2Е)-4-{3-[6-амино-8-оксо-7-(4-феноксифенил)-7,8-дигидро-9Н-пурин-9-ил]-1-азетидинил}-4-оксо-N-фенил-2-бутенамид ТСХ: Rf 0.56 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 4.43-4.72, 4.87-4.96, 5.10-5.20, 5.40-5.52, 6.20, 6.36, 7.04-7.43, 7.72, 8.22, 12.49.
Пример 19(6)
(2Е)-4-{3-[6-амино-8-оксо-7-(4-феноксифенил)-7,8-дигидро-9Н-пурин-9-ил]-1-азетидинил}-4-оксо-2-бутенамид
ТСХ: Rf 0.50 (этилацетат: метанол: триэтиламин=9:1:0.5);
1Н-ЯМР (CDCl3): δ 4.29-4.35, 4.57-4.70, 4.86-4.91, 5.28-5.37, 5.82, 6.77-6.88, 7.10-7.20, 7.39-7.46, 7.86, 8.14.
Пример 19(7)
6-амино-7-(4-феноксифенил)-9-[(1-пропиолоил-4-пиперидинил)метил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.38 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.26-1.50, 1.74-1.88, 2.19-2.38, 2.69, 3.09, 3.10, 3.91, 4.41, 4.49, 4.56, 7.05-7.23, 7.35-7.44, 8.25.
Пример 19(8)
(2E)-4-{(3R)-3-[6-амино-8-оксо-7-(4-феноксифенил)-7,8-дигидро-9H-пурин-9-ил]-l-пирролидинил}-4-оксо-2-бутенамид
ТСХ: Rf 0.41 (дихлорметан: метанол: водный аммиак=9:1:0.1);
1Н-ЯМР (CDCl3): δ 2.23-2.47, 2.81-3.02, 3.45-3.82, 3.99-4.23, 4.35-4.53, 5.16-5.31, 5.50-5.65, 5.84-6.00, 6.97-7.30, 7.34-7.43, 8.19-8.22.
Пример 19(9)
6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
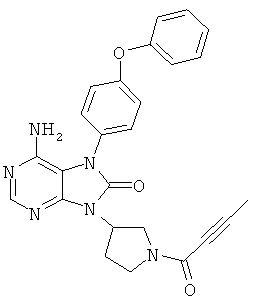
ТСХ: Rf 0.27 (этилацетат: метанол=19: 1);
1H-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.89-4.00, 4.03-4.18, 4.23-4.34,4.42-4.51, 5.13-5.25, 7.05-7.24, 7.35-7.43, 8.20-8.23.
Пример 19(10)
Этил (2Е)-4- {3 - [6-амино-8 -оксо-7-(4-феноксифенил)-7,8 -дигидро-9Н-пурин-9-ил] -1-азетидинил}-4-оксо-2-бутеноат
ТСХ: Rf 0.35 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.30-1.35, 4.22-4.30, 4.48-4.68, 4.84-4.90, 5.12-5.17, 5.40-5.50, 6.86-7.06, 7.07-7.16, 7.18-7.23, 7.35-7.44, 8.24.
Пример 19(11)
6-амино-9-{1-[(2Е)-4-фенокси-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.55 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 4.38-4.60, 4.68-4.79, 4.80-4.89, 4.99-5.11, 5.32-5.46, 6.24-6.34, 6.87-7.43, 8.22.
Пример 19(12)
6-амино-9-{1-[(2Е)-4-гидрокси-2-бутеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.21 (этилацетат: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.82-1.90, 4.35-4.41, 4.43-4.62, 4.79-4.87, 5.03-5.12, 5.36-5.47, 6.19-6.26, 6.98-7.23,7.35-7.44,8.23.
Пример 19(13)
6-амино-9-{1-[(2Е)-2,4-пентадиеноил]-3-азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.47 (этилацетат: метанол=9:1);
1Н-ЯМР (CDCl3): δ 4.42-4.67, 4.80-4.90, 5.02-5.13, 5.33-5.50, 5.61, 6.02, 6.39-6.55, 7.04-7.27, 7.32-7.48, 8.24.
Пример 19(14)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(циклогексилокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.44 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.22-2.46, 1.48-1.70, 1.72-1.88, 1.94-2.05, 2.22-2.40, 2.80-3.01, 3.51-3.62, 3.68-3.80, 3.87-4.00,4.02-4.18, 4.22-4.37, 4.42-4.55, 5.11-5.24, 6.98-7.05, 7.29-7.36, 8.19-8.23.
Пример 19(15)
6-амино-9-({(3R)-1-[(2E)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}метил)-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.28 (хлороформ: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.75-1.97, 2.00-2.16, 2.20-2.26, 2.83-3.00, 3.02-3.10, 3.38-3.62, 3.69-3.82, 3.98-4.08, 4.50-4.60, 6.19-6.31, 6.82-6.96, 7.04-7.22, 7.35-7.43, 8.23.
Пример 19(16)
6-амино-9-{[(2S)-1-(2-бутеноил)-2-пирролидинил]метил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.48 (этилацетат: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.75, 3.80-2.27, 3.58-3.73, 3.94-4.04, 4.06-4.19, 4.39-4.55, 4.66-4.82, 7.03-7.22, 7.35-7.46, 8.22-8.24.
Пример 19(17)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3-хлорфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.45 (дихлорметан: метанол: водный аммиак=9: 1: 0.1);
1Н-ЯМР (CDCl3): 8 1.94-2.03, 2.24-2.40, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.42-4.51, 5.13-5.25, 6.93-7.00, 7.05-7.09, 7.10-7.20, 7.26-7.35, 7.38-7.44, 8.20-8.24.
Пример 19(18)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3-фторфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.52 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.51-3.62, 3.68-3.80, 3.88-4.00, 4.03-4.19, 4.23-4.34, 4.40-4.55, 5.13-5.25, 6.77-6.93, 7.12-7.20, 7.28-7.44, 8.20-8.25.
Пример 19(19)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3,5-дифторфенокси)фенил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.48 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.52-3.63, 3.68-3.80, 3.88-4.00, 4.03-4.19, 4.23-4.34, 4.42-4.54, 5.13-5.25, 6.53-6.66, 7.17-7.27, 7.41-7.48, 8.21-8.26.
Пример 19(20)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пиррождинил]-7-(3-фтор-4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.41 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.80-3.00, 3.52-3.63, 3.68-3.80, 3.88-4.00, 4.03-4.19, 4.23-4.34, 4.46-4.57, 5.13-5.25, 7.02-7.21, 7.29-7.42, 8.21-8.26.
Пример 19(21)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-фторфенокси)фенил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.26 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34,4.42-4.54, 5.12-5.25, 6.99-7.16, 7.35-7.41, 8.20-8.24.
Пример 19(22)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-хлорфенокси)фенил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.28 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.02, 3.47-3.62, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.42-4.54, 5.12-5.25, 7.00-7.06, 7.09-7.17, 7.30-7.43, 8.20-8.24.
Пример 19(23)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3-метилфенокси)фенил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.35 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.42-4.51, 5.13-5.25, 6.84-6.92, 6.99-7.03, 7.07-7.15, 7.24-7.31, 7.36-7.41, 8.20-8.24.
Пример 19(24)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-метилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.33 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.22-2.42, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.42-4.55, 5.13-5.25, 6.95-7.02, 7.04-7.16, 7.17-7.23, 7.33-7.41, 8.20-8.24.
Пример 19(25)
6-шино-9-[3R)-1-(2-бутиноил)-3-пирролидинил]-7-{4-[3-(трифторметил)фенокси]фенил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.33 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.22-2.42, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.42-4.55, 5.13-5.25, 7.12-7.20, 7.22-7.28, 7.35-7.38, 7.40-7.57, 8.20-8.24.
Пример 19(26)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-метоксифенокси)фенил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.23 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.83, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.41-4.55, 5.13-5.25, 6.89-6.97, 7.00-7.08, 7.30-7.38, 8.19-8.23.
Пример 19(27)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3-метоксифенокси)фенил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.28 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.47-3.62, 3.69-3.83, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.41-4.55, 5.13-5.25, 6.62-6.69, 6.71-6.78, 7.10-7.19, 7.24-7.35, 7.36-7.42, 6.89-6.97, 7.00-7.08, 7.30-7.38, 8.20-8.24.
Пример 19(28)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-изопропилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.31 (этилацетат);
1Н-ЯМР (CDCI3): δ 1.20-1.34, 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.47-3.63, 3.69-3.79, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.46-4.57, 5.13-5.25, 6.98-7.03, 7.06-7.15, 7.21-7.30, 7.33-7.41, 8.20-8.24.
Пример 19(29)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3-изопропилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.40 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.20-1.28, 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.47-3.63, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.46-4.57, 5.13-5.25, 6.84-6.90, 6.98, 7.04-7.16, 7.27-7.41, 8.20-8.24.
Пример 19(30)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(2-изопропилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.37 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.20-1.27, 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.16-3.30, 3.47-3.63, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.46-4.56, 5.13-5.25, 6.93-7.00, 7.01-7.08, 7.17-7.24, 7.32-7.41, 8.20-8.24.
Пример 19(31)
6-амино-9-[(3R)-l-(2-бутиноил)-3-пирролидинил]-7-[4-(2-метилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.64 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24, 2.24-2.40, 2.81-3.01, 3.47-3.63, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.44-4.55, 5.13-5.25, 6.98-7.05, 7.10-7.18, 7.20-7.40, 8.20-8.24.
Пример 19(32)
6-амино-9-[(3R)-1-(2-бутиноил)-3 -пирролидинил]-7-[4-(3-хлорфенокси)-3-метоксифенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.33 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.82-3.01, 3.47-3.63, 3.69-3.81, 3.87-4.00, 4.03-4.19, 4.23-4.34,4.48-4.60, 5.14-5.26, 6.85-6.92, 6.95-7.01, 7.05-7.14, 7.22-7.29, 8.23-8.27.
Пример 19(33)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3,4-дихлорфенокси)-3-метоксифенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.33 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.82-3.01, 3.47-3.63, 3.69-3.81, 3.87, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.48-4.60, 5.14-5.27, 6.81-6.86, 6.97-7.01, 7.06-7.16, 7.37-7.40, 8.23-8.27.
Пример 19(34)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(3-метокси-4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.31 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.82-3.01, 3.47-3.63, 3.69-3.81, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.48-4.60, 5.14-5.27, 6.90-6.97, 7.00-7.04, 7.05-7.18, 7.32-7.41, 8.23-8.26.
Пример 19(35)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3,4-дихлорфенокси)фенил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.37 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.50-3.63, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.44-4.55, 5.14-5.27, 6.92-6.98, 7.12-7.22, 7.40-7.49, 8.21-8.26.
Пример 19(36)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пиперидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.59 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.55-1.80, 1.84-2.11, 2.55-2.76, 3.07-3.21, 3.63-3.74, 4.06-4.17, 4.38-4.59, 4.60-4.74, 7.04-7.23, 7.33-7.44, 8.20-8.24.
Пример 19(37)
6-амино-7- [4-(бензилокси)фенил] -9- [(3 R)-1 -(2-бутиноил)-3 -пирролидинил] -7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.22 (этилацетат);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.50-3.62, 3.68-3.79, 3.87-4.00, 4.03-4.19, 4.23-4.34,4.40-4.50, 5.08-5.27, 7.07-7.16, 7.32-7.46, 8.18-8.25.
Пример 19(38)
6-амино-7-[4-(1,3 -бензодиоксол-5-илокси)фенил]-9-[1-(2-бутиноил)-3-пирролидинил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.69 (этилацетат: метанол: водный аммиак=9: 1: 0.1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.80-3.01, 3.47-3.62, 3.69-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34, 4.40-4.51, 5.12-5.25, 6.01, 6.53-6.59, 6.60-6.63, 6.79-6.83, 7.04-7.13, 7.32-7.40, 8.20-8.23.
Пример 19(39)
6-амино-7-(4-анилинофенил)-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.66 (этилацетат: метанол=9: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.23-2.40, 2.80-3.01, 3.50-3.62, 3.68-3.80, 3.87-4.00, 4.02-4.19, 4.23-4.34,4.46-4.60, 5.12-5.25, 6.02, 7.00-7.18, 7.22-7.40, 8.18-8.22.
Пример 19(40)
6-амино-7-(4-бензоилфенил)-9-[(ЗR)-l-(2-бутиноил)-3-пирролидинил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.62 (этилацетат: метанол=8:1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.41, 2.81-3.01, 3.52-3.63, 3.68-3.81, 3.88-4.01, 4.03-4.20, 4.25-4.36, 4.55-4.65, 5.17-5.29, 7.49-7.68, 7.81-7.86, 7.97-8.03, 8.25-8.29.
Пример 19(41)
6-амино-7-(4-бензилфенил)-9-[(3R)-l-(2-бутиноил)-3-пирролидинил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.53 (этилацетат: метанол=9: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.02, 2.23-2.39, 2.80-3,00, 3.50-3.61, 3.67-3.79, 3.87-4.00, 4.02-4.18, 4.23-4.32, 4.44-4.52, 5.12-5.24, 7.18-7.42, 8.19-8.23.
Пример 19(42)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(феноксиметил)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.50 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.25-2.40, 2.82-3.01, 3.51-3.63, 3.69-3.80, 3.88-4.01, 4.05-4.19, 4.25-4.34, 4.45-4.54, 5.11-5.27, 6.95-7.05, 7.28-7.37, 7.43-7.51, 7.60-7.66, 8.22-8.27.
Пример 19(43)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-{4-[(6-метил-2-пиридинил)окси] фенил}-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.48 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.46, 2.81-3.01, 3.50-3.62, 3.68-3.80, 3.87-4.01, 4.03-4.19, 4.23-4.34, 4.52-4.62, 5.14-5.27, 6.73-6.78, 6.93-6.98, 7.23-7.32, 7.40-7.46, 7.60-7.67, 8.21-8.25.
Пример 19(44)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-фтор-3-метилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.51 (этилацетат: метанол=19:1);
1H-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.52-3.63, 3.68-3.80, 3.87-4.01, 4.03-4.19, 4.23-4.34,4.42-4.54, 5.14-5.27, 6.84-6.95, 6.99-7.12, 7.34-7.41, 8.20-8.24.
Пример 19(45)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-метокси-3 -метилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.51 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.23, 2.24-2.39, 2.81-3.01, 3.52-3.62, 3.68-3.80, 3.85, 3.87-4.01, 4.03-4.19, 4.23-4.34, 4.42-4.54, 5.14-5.26, 6.80-6.84, 6.85-6.93, 7.01-7.09, 7.31-7.39, 8.20-8.24.
Пример 19(46)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-фтор-3 -метоксифенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.48 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.48-3.63, 3.68-3.80, 3.87-4.01, 4.03-4.19, 4.23-4.34, 4.44-4.56, 5.14-5.26, 6.57-6.63, 6.70-6.78, 7.03-7.14, 7.37-7.43, 8.20-8.24.
Пример 19(47)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(3,4-диметилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.53 (этилацетат: метанол=19: 1);
1Н-ЯМР (CDCb): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.48-3.62, 3.68-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34,4.48-4.59, 5.14-5.25, 6.80-6.84, 6.89, 7.04-7.17, 7.32-7.40, 8.20-8.24.
Пример 19(48)
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-[4-(4-хлор-3 -метилфенокси)фенил]-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.64 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.24-2.40, 2.81-3.01, 3.52-3.64, 3.70-3.80, 3.87-4.00, 4.03-4.19, 4.23-4.34,4.48-4.59, 5.14-5.25, 6.82-6.88, 6.98, 7.06-7.15, 7.33-7.42, 8.20-8.24.
Пример 19(49)
6-амино-9-{(3R)-1-[(2Е)-3-хлор-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
ТСХ: Rf 0.64 (этилацетат: метанол=19:1);
1Н-ЯМР (CDCl3): δ 2.23-2.31, 2.32-2.40, 2.54-2.60, 2.86-2.97, 3.47-3.65, 2.81-3.01, 3.52-3.64, 3.84-3.88, 3.93-4.01, 4.08-4.14, 4.20-4.25, 4.40-4.54, 5.15-5.24, 6.20-6.31, 7.07-7.17, 7.18-7.22, 7.35-7.44, 8.20-8.24.
Пример 20
6-амино-9-{1-[(2Е)-4-(1 Н-бензотриазол-1-илокси)-2-бутеноил]-3 -азетидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он
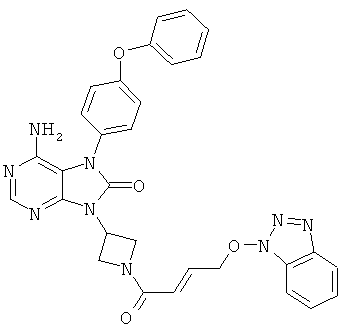
4-бромкротоновую кислоту (0.44 г), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (0.86 г), HOBt (0.68 г) и триэтиламин (1.3 мл) добавляли в диметилформамидный (22 мл) раствор соединения (1.0 г), полученного в Примере 7, после чего перемешивали в течение 1 часа при комнатной температуре. В реакционную смесь добавляли воду и проводили экстракцию этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и отгоняли растворитель. Остаток очищали колоночной хроматографией на силикагеле, получая указанное в заголовке соединение (0.43 г), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.56 (дихлорметан: метанол: 28% водный аммиак=9: 1: 0.1);
1Н-ЯМР (CDCl3): δ 4.43-4.63, 4.79-4.88, 4.99-5.05, 5.22-5.24, 5.35-5.45, 6.26-6.34, 7.01-7.23, 7.36-7.44,7.51-7.62, 8.22.
Пример 21
6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-{4-[гидрокси(фенил)метил]фенил}-7,9-дигидро-8Н-пурин-8-он
Метанольный (1 мл) раствор соединения (30 мг), полученного в Примере 19(40), охлаждали до 0°C; добавляли боргидрид натрия (2.4 мг) и перемешивали в течение 30 минут. Реакционную смесь разбавляли этилацетатом и затем промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом натрия, затем концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат → этилацетат: метанол=10: 1), получая указанное в заголовке соединение (28 мг), имеющее приведенные ниже физические характеристики.
ТСХ: Rf 0.58 (этилацетат: метанол=9:1);
1Н-ЯМР (CDCl3): δ 1.94-2.03, 2.23-2.39, 2.57, 2.80-3.00, 3.50-3.61, 3.67-3.79, 3.87-4.00, 4.02-4.18, 4.23-4.32, 4.45-4.54, 5.12-5.24, 5.91, 7.27-7.43, 7.56-7.62, 8.20-8.23.
Фармакологические экспериментальные примеры
Биологический пример 1
Определение Btk-ингибирующей активности и селективности (тесты in vitro) в отношении Btk
Ингибирующую активность в отношении Btk-фермента определяли на основе предоставленного производителем протокола, используя Btk (Invitrogen Corporation) и набор Z'-LYTE™ Kinase Assay Kit-Tyrl peptide (Invitrogen Corporation), который содержал следующие реагенты: Tyr-1 пептид, Thy-1 фосфопептид, 5× киназный буфер, АТФ, проявляющий реагент В, буфер для проявления и стоп-реагент.
В 96-луночный микропланшет помещали по 5 мкл/лунку раствора испытуемого соединения, разбавленного диметилсульфоксидом (ДМСО), или ДМСО, а также по 10 мкл/лунку раствора смеси субстрат/фермент, и проводили реакцию 20 минут при 30°C. Раствор смеси субстрат/фермент готовили путем разбавления киназным буфером (DL-дитиотреитол (DTT, 2.7 мМ), 1.33× киназный буфер), получая конечную концентрацию Tyr-1 пептида 4 мкМ и конечную концентрацию Btk 5 нМ. Затем добавляли по 5 мкл/лунку аденозин трифосфата (АТФ, конечная концентрация=36 мкМ), и проводили реакцию 1 час при 30°C. По окончании реакции добавляли 10 мкл проявляющего раствора, полученного разбавлением проявляющего реагента В в 128 раз буфером для проявления, и реакцию оставляли еще на 1 час при 30°C. Затем ферментативную реакцию останавливали добавлением 10 мкл стоп-реагента. Интенсивность флуоресценции при 445 нм и 520 нм в каждой лунке измеряли на спектрофотометре для чтения планшетов для визуализации флуоресценции Fusion Universal Microplate Analyzer (PerkinElmer Inc.). Процент фосфорилирования определяли по соотношению излучения при 445 нм (излучение кумарина) к излучению при 520 нм (излучение флуоресцеина) по методике, прилагавшейся к набору.
Процент ингибирования (%) испытуемым соединением вычисляли по следующему уравнению.
процент ингибирования (%) фосфорилирования=1-{(AC-AX)/(AC-AB)}×100
AX: % фосфорилирования при добавлении испытуемого соединения
AB: % фосфорилирования без добавления АТФ (пустой опыт)
AC: % фосфорилирования при добавлении только ДМСО (контроль)
Концентрацию, обеспечивающую 50%-ное ингибирование (значение IC50), для испытуемого соединения определяли по кривой ингибирования, построенной по величинам % ингибирования для каждой концентрации испытуемого соединения.
Ингибирующую активность для других киназ (например Lck, Fyn и LynA (все производства Invitrogen Corporation)) определяли так же, как описано выше, применяя соответствующую киназу вместо Btk.
Согласно полученным результатам, значения IC50 для соединений по настоящему изобретению составляли, например, 0.004 мкМ для соединения из Примера 8, 0.014 мкМ для соединения из Примера 11(3), 0.004 мкМ для соединения из Примера 8(14), 0.007 мкМ для соединения из Примера 19(2) и 0.011 мкМ для соединения из Примера 19(40).
Кроме того, Btk-селективную ингибирующую активность для соединений по настоящему изобретению по сравнению с другими киназами, в частности с Lck, Fyn и LynA, вычисляли как соотношение значений IC50 для индивидуальных киназ, и полученные значения приведены ниже в Таблице 1.
Полученные результаты показывают, что соединения по настоящему изобретению не только обладают Btk-ингибирующей активностью, но также имеют Btk-селективную ингибирующую активность в сравнении с другими киназами.
Биологический пример 2
Определение активации В-клеток или Т-клеток с использованием мононуклеарных клеток периферической крови (МКПК) человека.
Раствор испытуемого соединения в ДМСО (10 ммоль/л) помещали в 96-луночный микропланшет (Nunc) и готовили серии 5х разбавления в ДМСО. Концентрацию 100х разбавления испытуемого соединения готовили дополнительным 10х разбавлением средой RPMI1640 (содержит 10% HI-FBS, 1% пенициллин). Мононуклеарные клетки периферической крови (МКПК) человека разбавляли средой до плотности 2×106 клеток/мл. 396 мкл полученной суспензии клеток добавляли в 96-луночный планшет, куда заранее помещали 4 мкл 100× разбавленного раствора испытуемого соединения или растворителя (10% ДМСО), и инкубировали 10 минут при 37°C и 5% CO2.10 мкл раствора анти-IgM антител (Southern Biotech)/IL-4 (R&D Systems) или суспензии шариков с анти-CD3/CD28 антителами (Invitrogen Corporation) добавляли в 96-луночный планшет, после чего добавляли 90 мкл суспензии клеток, приготовленной как описано выше (конечные концентрации: анти-IgM антитела=1 мкг/мл, IL-4=3 нг/мл, и шарики с анти-CD3/CD28 антителами=2×106 шариков/мл). В лунки с нестимулированными образцами добавляли 10 мкл среды вместо стимулирующих веществ и снова оставляли при 37°C и 5% CO2. Инкубацию проводили в течение 16 часов в случае определения активации Т-клеток и в течение 22 часов в случае определения активации В-клеток. Добавляли 100 мкл буфера Cytofix Buffer (BD Biosciences); выдерживали 15 минут при 37°C; центрифугировали 10 минут при 1500 об/мин; и удаляли надосадочный раствор. Добавляли 200 мкл буфера Perm buffer II (BD Biosciences) при -20°C; выдерживали 30 минут на льду; центрифугировали 10 минут при 1500 об/мин; и удаляли надосадочный раствор. Добавляли 0.5 мл буфера Stain buffer (BD Biosciences) и центрифугировали 10 минут при 1500 об/мин. Добавляли 100 мкл раствора смешанных антител и инкубировали 30 минут на льду в темноте. Смесь антител представляла собой 10× разбавление буфером Stain Buffer смеси 1:1:1 PerCP-меченых анти-CD3 антител (BD Biosciences), АЕ488-меченых анти-CD20 антител (BD Biosciences) и РЕ-меченых анти-CD69 антител (BD Biosciences). Добавляли 0.4 мл буфера Stain Buffer и удаляли надосадочный раствор. Добавляли 0.3 мл буфера Stain Buffer и суспендировали осадок клеток, получая образец для анализа методом сортировки флуоресцентно-активированных клеток (FACS). Для FACS-анализа применяли программы анализа данных BD FACSCalibur (BD Biosciences) и CELLQuest Version 3.3 (BD Biosciences). Измеряли CD69-положительньш сигнал (средняя интенсивность флуоресценции) для CD20-положительных CD3-отрицательных клеток (В-клетки) или CD3-положительных СО20-отрицательных клеток (Т-клетки). После вычета значения, полученного для нестимулированного образца, определяли % ингибирования относительно значения для стимулированного контрольного образца. Строили диаграмму % ингибирования с помощью программы Prism (ver. 5.01J, GraphPad Software) и вычисляли значение IC50.
Согласно полученным результатам значения IC50 у соединений по настоящему изобретению для СБ69-положительного сигнала для В-клеток составляли, например, 0.021 мкМ для соединения из Примера 8, 0.032 мкМ для соединения из Примера 11(3), 0.023 мкМ для соединения из Примера 8(14) и 0.061 мкМ для соединения из Примера 19(2). С другой стороны, значения IC50 у соединений по настоящему изобретению для СБ69-положительного сигнала для Т-клеток составляли >10 мкМ для всех перечисленных соединений. Соответственно, было показано, что соединения по настоящему изобретению оказывают селективное ингибирующее действие на активацию В-клеток.
Биологический пример 3
Определение стабильности в микросомах печени крыс и человека.
(1) Приготовление раствора испытуемого соединения
Раствор с концентрацией 0.25 ммоль/л готовили разбавлением испытуемого соединения (10 ммоль/л раствор в ДМСО, 5 мкл) 50%-ным водным раствором ацетонитрила (195 мкл).
(2) Приготовление реакционного образца, соответствующего 0-минуте
245 мкл фосфатного буфера с концентрацией 0.1 моль/л (pH 7.4), содержащего 0.5 мг/мл микросом печени крыс и человека (XenoTech) и НАДФ-кофактор (BD Biosciences) добавляли в заранее нагретый до 37°C реактор; в течение 5 минут проводили пре-инкубирование; добавляли описанный ранее раствор испытуемого соединения (5 мкл), и реакция начиналась. 20 мкл отбирали сразу после начала, и останавливали реакцию добавлением 180 мкл ацетонитрила, содержащего внутренний стандарт (варфарин). 20 мкл данного раствора перемешивали с 180 мкл 50%-ного водного раствора ацетонитрила на планшете для фильтрования для выработки белка, после чего фильтровали под вакуумом и использовали фильтрат в качестве стандартного образца.
(3) Приготовление реакционного образца, соответствующего 15-минуте Описанный выше реакционный раствор инкубировали в течение 15 минут при 37°C, и затем 20 мкл добавляли в 180 мкл холодного ацетонитрила (содержащего внутренний стандарт варфарин) для остановки реакции. 20 мкл полученного раствора перемешивали с 180 мкл 50%-ного водного раствора ацетонитрила на планшете для фильтрования для выработки белка, после чего фильтровали под вакуумом и использовали фильтрат в качестве стандартного образца.
(4) Методика оценки и результаты
Процент сохранения (%) вычисляли путем введения 1 мкл раствора образца в прибор LC-MS/MS; делили соотношение площадей пиков для реакционного образца (площадь пика испытуемого соединения/площадь пика внутреннего стандарта) на соотношение площадей пиков для стандартного образца; и умножали полученное значение на 100.
В качестве испытуемых соединений применяли следующие: соединения по настоящему изобретению и 1-{(3R)-3-[4-амино-3-(4-феноксифенил)-1Н-пиразоло[3,4-d]пиримидин-1-ил]-1-пиперидинил}-2-пропен-1-он (сравнительное соединение А) и 1-{3-[4-амино-3-(4-феноксифенил)-1Н-пиразоло [3,4-а]пиримидин-1-ил]-1-пирролидинил}-2-пропин-1-он (сравнительное соединение В), которые являются иллюстративными примерами соединений, описанных в Патентном Документе 1, имеющих пиразолопиримидиновый скелет. Процент сохранения (%) испытуемого соединения в микросомах печени крыс и человека приведен ниже в Таблице 2.
Результаты показывают, что соединения по настоящему изобретению намного более устойчивы в микросомах печени крыс и человека, чем сравнительные соединения.
Биологический пример 4
Измерение ингибирующей активности в отношении ферментов, метаболизирующих лекарства (ингибирующее действие на человеческий CYP2C8 и человеческий CYP2C19)
Экспериментальный метод
Реакцию проводили в 96-луночном планшете. Вещества, являющиеся положительным контролем (CYP2C8: кетоконазол, CYP2C19: транилципромин), доводили с помощью ДМСО (CYP2C8: 0.6 и 6 ммоль/л, CYP2C19: 0.9 и 9 ммоль/л) до концентраций, в 300 раз превышающих окончательную концентрацию, и готовили растворы (CYP2C8: 8 и 80 мкмоль/л, CYP2C19: 12 и 120 мкмоль/л) 75-кратным разбавлением очищенной водой, содержащей 2.7% ацетонитрила. Концентрацию испытуемых соединений доводили до 0.3 и 3 моль/л с помощью ДМСО, и доводили до концентрации 4 и 40 мкмоль/л 75-кратным разбавлением очищенной водой, содержащей 2.7% ацетонитрила. Затем готовили реакционную смесь (цифровые значения означают конечные концентрации) добавлением буферного раствора фосфата калия (pH 7.4), хлорида магния (5 моль/л), субстрата (CYP2C8: дибензилфлуоресцеин 1 мкмоль/л, CYP2C19: 3-циано-7-этоксикумарин 25 мкмоль/л) и экспрессированых в Е. coli микросом печени CYP2C8 (Сурех, 10 пкмоль/л) и CYP2C19 (Сурех, 3 пкмоль/л). 100 мкл реакционной смеси и 50 мкл испытуемого соединения, полученного, как описано выше, и описанный выше раствор положительного контроля диспергировали в каждой лунке и проводили пре-инкубирование в течение 10 минут при 37°C. Реакцию начинали добавлением 50 мкл раствора НАДФ-Н (конечная концентрация=1 ммоль/л) и проводили инкубацию в течение 30 минут при 37°C. Измеряли интенсивность флуоресценции (CYP2C8: длина волны облучения=485 нм, длина волны флуоресценции=538 нм; CYP2C19: длина волны облучения=409 нм, длина волны флуоресценции=460 нм) сразу после добавления НАДФ-Н и после инкубирования в течение 30 минут. За % ингибирования принимали % снижения (% ингибирования) интенсивности флуоресценции в сравнении с контрольным образцом, в который вместо раствора испытуемого соединения добавляли ДМСО и проводили реакцию, и вычисляли по следующей формуле.
ингибирование (%)=100-{(интенсивность флуоресценции после реакции с испытуемым соединением - интенсивность флуоресценции до реакции с испытуемым соединением)/(интенсивность флуоресценции после контрольной реакции интенсивность флуоресценции до контрольной реакции)×100}
Считали, что значение IC50<1 мкМ, когда % ингибирования при концентрации 1 мкмоль/л составлял по меньшей мере 50%; значение IC50>10 мкмоль/л, когда % ингибирования при 10 мкмоль/л составлял не более 50%; и значение IC50 между этими значениями (не более 50% при 1 мкмоль/л и по меньшей мере 50% при 10 мкмоль/л) вычисляли по следующей формуле
IC50=(50-b)/а
где а и b представляют собой угол наклона и отсекаемый на оси отрезок для графика линейной регрессии y=ax+b, который проходит через следующие две точки: концентрация 1 мкмоль/л, % ингибирования и концентрация 10 мкмоль/л, % ингибирования.
Значения IC50 для сравнительных соединений и соединений по настоящему изобретению вычисляли по методу, описанному выше.
Были получены следующие результаты: для сравнительного соединения А и сравнительного соединения В значения IC50 для CYP2C8 составили 4.7 мкМ и 6.9 мкМ, соответственно, и значения IC50 для CYP2C19 составили 5.6 мкМ и 8.1 мкМ, соответственно. С другой стороны, для соединений по настоящему изобретению, например соединения из Примера 8, Примера 11(3), Примера 8(14) и Примера 19(2), все значения IC50 для CYP2C8 и CYP2C19 были>10 мкМ. Соответственно, было показано, что соединения по настоящему, изобретению оказывают меньшее CYP-ингибирующее действие, чем сравнительные соединения.
Биологический пример 5
Измерение цитотоксичности и способности уменьшать мембранный потенциал митохондрий у культуры клеток гепатомы человека.
Известно, что ткань, поддерживающая аэробное равновесие, например почки и сердце, и ткань, подвергающаяся воздействию высоких концентраций лекарств и осуществляющая метаболизм лекарств, например печень, чувствительны к дисфункции митохондрий (Drug Discovery Today, 12 (17-18), 777-785, 2007). Уменьшение или ослабление потенциала митохондриальной мембраны лекарственным средством вызывается прямым подавлением электрон-транспортной системы, подавлением переноса электронов с АТФ-синтазы или открытием проницаемых пор в митохондриальной мембране. Как следствие, измерение потенциала митохондриальной мембраны в клетках печени может служить параметром гепатотоксичности.
Клетки печени человека высевали в покрытый коллагеном 96-луночный планшет с плотностью 30000 клеток/лунку и проводили инкубацию в течение ночи в инкубаторе при 37°C в атмосфере 5% CO2-95% воздух. Культуру клеток окрашивали в течение 1 часа 5, 5', 6, 6'-тетрагидро - 1, 1', 3, 3'-тетраметил-бензамидазолокарбоцианин иодидом (JC-1), после чего обрабатывали испытуемым соединением. Испытуемое соединение растворяли в ДМСО, затем разбавляли жидкой клеточной средой Hepatocyte Culture Medium (НСМ) и добавляли к клеткам. Концентрации раствора испытуемого соединения составляли 0, 6.25, 12.5, 25, 50, 100, 200 и 400 мкмоль/л. После обработки испытуемым соединением в течение 24 -часов проводили измерения на планшет-ридере SpectraMax (Molecular Devices, LLC) при длине волны облучения 485 нм и длине волны флуоресценции 538 нм, а также при длине волны облучения 544 нм и длине волны флуоресценции 590 нм. Мембранный потенциал определяли по соотношению между измеренным значением 544 нм/590 нм и измеренным значением 485 нм/538 нм. После этого измеряли концентрацию АТФ в клетках с помощью набора для люминисцентного анализа Celltiter Glo (Promega Corporation), чтобы оценить клеточную токсичность испытуемого соединения. Клетки лизировали буферным раствором для анализа, поставляемым с набором для проведения анализа, и измеряли концентрацию высвобождаемого из клеток АТФ, используя в качестве индекса активность фермента люциферин-люциферазы. Излучение измеряли с помощью планшет-ридера SpectraMax. Способность испытуемого соединения понижать потенциал митохондриальной мембраны и цитотоксичность испытуемого соединения выражаются концентрацией (значение IC50), которая вызывает 50%-ное снижение потенциала митохондриальной мембраны и концентрации АТФ, соответственно. Способность испытуемых соединений понижать потенциал митохондриальной мембраны и цитотоксичность испытуемых соединений приведены ниже в Таблице 3.
Полученные результаты показали, что в обоих случаях значения IC50 для всех соединений по настоящему изобретению были ниже, чем для сравнительных соединений.
Примеры препаратов
Пример препарата 1
Перечисленные ниже компоненты смешивали стандартным способом, фильтровали через пылеулавливающий фильтр, помещали в ампулы объемом 5 мл и термически стерилизовали в автоклаве, получая 10000 ампул, содержащих 20 мг действующего компонента в каждой ампуле.
Пример препарата 2
Перечисленные ниже компоненты смешивали стандартным способом и затем таблетировали, получая 10000 таблеток, содержащие 10 мг действующего компонента в каждой таблетке.
Промышленная применимость
Соединения по настоящему изобретению представляют собой соединения, которые, наряду с Btk-селективной ингибирующей активностью, демонстрируют отличную метаболическую устойчивость и не обладают гепатотоксичностью и т.п., и, как следствие, пригодны в качестве абсолютно безопасных терапевтических средств для лечения заболеваний, в которых задействованы В-клетки или мастоциты.
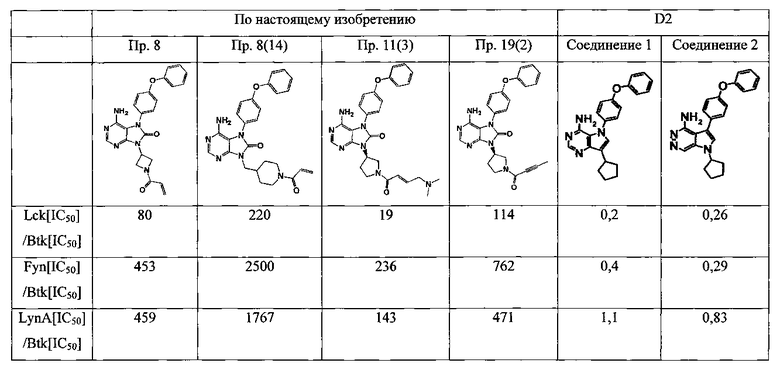
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОХЛОРИД ПРОИЗВОДНОГО ПУРИНОНА | 2012 |
|
RU2615999C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АНТИТЕЛА К CD20 И ИНГИБИТОРА ВТК | 2014 |
|
RU2727650C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АНТИТЕЛА К CD20 И ИНГИБИТОРА BTK | 2021 |
|
RU2815679C2 |
| ГИДРОХЛОРИД ПРОИЗВОДНОГО ПУРИНОНА | 2012 |
|
RU2750538C2 |
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |
| АГОНИСТЫ TLR7 | 2019 |
|
RU2817014C2 |
| ПИРИМИДО[5,4-b]ИНДОЛИЗИНОВОЕ ИЛИ ПИРИМИДО[5,4-b]ПИРРОЛИЗИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2721774C1 |
| 6,7-ДИГИДРО-5H-ПИРИДО[2,3-C]ПИРИДАЗИНОВЫЕ ПРОИЗВОДНЫЕ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛКОВ BCLXL И ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2832191C2 |
| Ингибиторы BTK | 2020 |
|
RU2830171C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ АМИНА | 1990 |
|
RU2015964C1 |
Изобретение относится к новым соединениям общей формулы (I), которые обладают Btk-селективной ингибирующей активностью (ингибиторы тирозинкиназы Брутона). При этом соединения проявляют метаболическую устойчивость и не обладают гепатотоксичностью, то есть являются безопасными терапевтическими средствами для лечения заболеваний, в которых задействованы В-клетки или мастоциты. Соединения могут быть использованы при лечении аллергического заболевания, аутоиммунного заболевания, воспалительного заболевания, тромбоэмболического заболевания или рака, в частности при лечении не-ходжкинской лимфомы. В общей формуле (I)
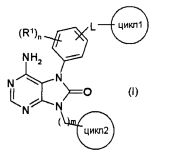
L представляет собой (1) -О-, (5) -NH-, (6) -С(О)-, (7) -СН2-O-, (8) -O-СН2- или (9) -СН2-; R1 представляет собой (1) атом галогена, (2) С1-4алкильную группу, (3) С1-4алкокси группу, или (4) С1-4галогеналкильную группу; цикл 1 представляет собой циклическую группу, выбранную из фенила, С4-7циклоалкила и пиридинила, которая может быть замещена 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) атомов галогена, (2) С1-4алкильных групп, (3) С1-4алкоксигрупп и (5) С1-4галогеналкильных групп, где в случае наличия двух заместителей в цикле 1 эти заместители могут образовывать 4-7-членную циклическую группу вместе с атомами в цикле 1, с которыми связаны данные заместители, содержащую в циклической группе 2 атома кислорода; цикл 2 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, который имеет от одного до двух заместителей -K-R2; К представляет собой -С(О)- (где левая связь связана с циклом 2); R2 представляет собой (2) С2-4алкенильную или (3) С2-4алкинильную группу, каждая из которых может быть замещена 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8; каждый из R3 и R4 независимо представляет собой (1) атом водорода или (2) С1-4алкильную группу, которая может иметь заместитель OR9 или CONR10R11; R3 и R4 вместе с атомом азота, с которым они связаны, могут образовывать 4-7-членный азотсодержащий насыщенный гетероцикл, содержащий атом азота и, необязательно, еще один гетероатом, выбранный из азота, серы и кислорода, который может быть замещен оксогруппой или гидроксильной группой; каждый из R5 и R6 независимо представляет собой (1) атом водорода; R7 представляет собой (1) атом водорода или (2) С1-4алкильную группу; R8 представляет собой (1) атом водорода, (2) С1-4алкильную группу или (4) бензотриазолильную группу; R9 представляет собой (1) атом водорода или (2) С1-4алкильную группу; каждый из R10 и R11 независимо представляет собой (1) атом водорода; n представляет собой 0 или 1; m представляет собой целое число от 0 до 2. 6 н. и 9 з.п. ф-лы, 3 табл., 27 пр.,
1. Соединение, представленное общей формулой (I)

(в данной формуле
L представляет собой (1) -О-, (5) -NH-, (6) -С(О)-, (7) -СН2-O-, (8) -O-СН2- или (9) -СН2-;
R1 представляет собой (1) атом галогена, (2) С1-4алкильную группу, (3) С1-4алкокси группу или (4) С1-4галогеналкильную группу;
цикл 1 представляет собой циклическую группу, выбранную из фенила, С4-7циклоалкила и пиридинила, которая может быть замещена 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) атомов галогена, (2) С1-4алкильных групп, (3) С1-4алкоксигрупп и (5) С1-4галогеналкильных групп, где в случае наличия двух заместителей в цикле 1 эти заместители могут образовывать 4-7-членную циклическую группу вместе с атомами в цикле 1, с которыми связаны данные заместители, содержащую в циклической группе 2 атома кислорода;
цикл 2 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, который имеет от одного до двух заместителей -K-R2;
К представляет собой -С(О)- (где левая связь связана с циклом 2);
R2 представляет собой (2) С2-4алкенильную или (3) С2-4алкинильную группу, каждая из которых может быть замещена 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8;
каждый из R3 и R4 независимо представляет собой (1) атом водорода или
(2) С1-4алкильную группу, которая может иметь заместитель OR9 или CONR10R11;
R3 и R4 вместе с атомом азота, с которым они связаны, могут образовывать 4-7-членный азотсодержащий насыщенный гетероцикл, содержащий атом азота и, необязательно, еще один гетероатом, выбранный из азота, серы и кислорода, который может быть замещен оксогруппой или гидроксильной группой;
каждый из R5 и R6 независимо представляет собой (1) атом водорода;
R7 представляет собой (1) атом водорода или (2) С1-4алкильную группу;
R8 представляет собой (1) атом водорода, (2) С1-4алкильную группу или (4) бензотриазолильную группу;
R9 представляет собой (1) атом водорода или (2) С1-4алкильную группу;
каждый из R10 и R11 независимо представляет собой (1) атом водорода;
n представляет собой 0 или 1;
m представляет собой целое число от 0 до 2,
его оптический изомер или их смесь, или его соль, выбранную из солей щелочных металлов, солей щелочноземельных металлов, соли аммония, солей фармацевтически приемлемых органическиx аминов и кислотно-аддитивных солей.
2. Соединение по п. 1, в котором цикл 1 представляет собой бензольный, циклогексановый или пиридиновый цикл, каждый из которых может быть замещен 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) атомов галогена, (2) C1-4алкильных групп, (3) С1-4алкокси групп и (5) CF3.
3. Соединение по п. 1, в котором 4-7-членный азотсодержащий насыщенный гетероцикл представляет собой азетидиновый, пирролидиновый или пиперидиновый цикл.
4. Соединение по п. 1, представленное общей формулой (I-1)
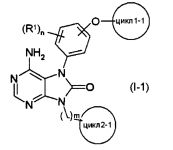
(в данной формуле цикл 1-1 представляет собой бензольный, циклогексановый или пиридиновый цикл, каждый из которых может быть замещен 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из (1) атомов галогена, (2) С1-4алкильных групп, (3) С1-4алкокси групп и (5) CF3, и цикл 2-1 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, имеющий от одного до двух заместителей -K-R2, где остальные символы соответствуют вышеприведенным определениям).
5. Соединение по п. 1, которое представляет собой (1) 9-(1-акрилоил-3-азетидинил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (2) 6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (4) 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (5) 6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (6) 6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2E)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-он, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, или его оптический изомер, или их смесь.
6. Фармацевтическая композиция, обладающая свойствами ингибитора Btk (тирозинкиназы Брутона) и содержащая эффективное количество соединения, представленного общей формулой (I) по п. 1, его оптического изомера, или их смеси, или его соли, выбранной из солей щелочных металлов, солей щелочноземельных металлов, соли аммония, солей фармацевтически приемлемых органическиx аминов и кислотно-аддитивных солей.
7. Фармацевтическая композиция по п. 6, предназначенная для получения средства для профилактики и/или средства для лечения заболевания, связанного с Btk.
8. Фармацевтическая композиция по п. 7, где заболевание, связанное с Btk, представляет собой аллергическое заболевание, аутоиммунное заболевание, воспалительное заболевание, тромбоэмболическое заболевание или рак.
9. Фармацевтическая композиция по п. 8, где рак представляет собой не-ходжкинскую лимфому.
10. Фармацевтическая композиция по п. 6, которая представляет собой ингибитор В-клеточной активации.
11. Способ профилактики и/или лечения заболевания, связанного с Btk, включающий введение млекопитающему эффективного количества соединения, представленного общей формулой (I) по п. 1, его оптического изомера, или их смеси, или его соли, выбранной из солей щелочных металлов, солей щелочноземельных металлов, соли аммония, солей фармацевтически приемлемых органическиx аминов и кислотно-аддитивных солей.
12. Соединение, представленное общей формулой (I) по п. 1, его оптический изомер, или их смесь, или его соль, выбранная из солей щелочных металлов, солей щелочноземельных металлов, соли аммония, солей фармацевтически приемлемых органическиx аминов и кислотно-аддитивных солей, для профилактики и/или лечения заболевания, связанного с Btk.
13. Применение соединения, представленного общей формулой (I) по п. 1, его оптического изомера, или их смеси, или его соли, выбранной из солей щелочных металлов, солей щелочноземельных металлов, соли аммония, солей фармацевтически приемлемых органических аминов и кислотно-аддитивных солей, для получения средства для профилактики и/или лечения заболевания, связанного с Btk.
14. 6-Амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль, выбранная из солей щелочных металлов, солей щелочноземельных металлов, соли аммония, солей фармацевтически приемлемых органическиx аминов и кислотно-аддитивных солей.
15. 6-Амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он.
| WO 03037890 A2,08 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| US 7071199 B1, 04.07.2006 & JP 2003509427 | |||
| WO 2008039218 A2,03.04.2008 & EA 018573 D1 | |||
| WO2008121742 A2,09.10.2008 & EA 017865 B1 | |||
| СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМ 1,3-ДИГИДРОИМИДАЗОЛЬНЫМ ЦИКЛОМ | 2003 |
|
RU2328498C9 |
Авторы
Даты
2016-02-20—Публикация
2011-05-30—Подача