В настоящем изобретении предложена комбинированная терапия на основе антитела к CD20 и ингибитора BTK для лечения рака. Предпосылки создания изобретения Афукозилированные антитела
Опосредованные клеткой эффекторные функции моноклональных антител можно усиливать путем конструирования их олигосахаридного компонента согласно методу, описанному у Umana Р. и др., Nature Biotechnol. 17, 1999, сс.176-180 и в US 6602684. Антитела IgG1-типа, представляющие собой антитела, наиболее часто используемые в иммунотерапии рака, являются гликопротеинами, которые имеют консервативный N-связанный сайт гликозилирования в положении Asn297 в каждом СН2-домене. Два сложных биантенных олигосахарида, которые присоединены к Asn297, размещаются между СН2-доменами, образуя обширные контакты с каркасом полипептида, и их наличие является существенным для способности антитела опосредовать эффекторные функции, такие как антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) (Lifely M.R. и др., Glycobiology, 5, 1995, сс.813-822; Jefferis R. и др., Immunol. Rev., 163, 1998, сс.59-76; Wright А. и Morrison S.L., Trends Biotechnol., 15, 1997, сс. 26-32).У  Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180 и в WO 1999/54342 продемонстрировано, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), т.е. гликозилтрансферазы, которая катализирует образование бисекционных олигосахаридов, существенно повышает ADCC-активность антител in vitro. Изменение состава N297-углевода или его элиминация оказывают также воздействие на связывание Fc с FcγR и C1q (Umana Р. и др., Nature Biotechnol. 17,1999, сс.176-180; Davies J. и др., Biotechnol. Bioeng. 74, 2001, сс.288-294; Mimura Y. и др., J. Biol. Chem. 276, 2001, cc. 45539-45547; Radaev S. и др., J. Biol. Chem. 276, 2001, cc. 16478-16483; Shields R.L. и др., J. Biol. Chem. 276, 2001, cc. 6591-6604; Shields R.L. и др., J. Biol. Chem. 277, 2002, cc. 26733-26740; Simmons L.C. и др., J. Immunol. Methods 263, 2002, cc. 133-147).
Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180 и в WO 1999/54342 продемонстрировано, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), т.е. гликозилтрансферазы, которая катализирует образование бисекционных олигосахаридов, существенно повышает ADCC-активность антител in vitro. Изменение состава N297-углевода или его элиминация оказывают также воздействие на связывание Fc с FcγR и C1q (Umana Р. и др., Nature Biotechnol. 17,1999, сс.176-180; Davies J. и др., Biotechnol. Bioeng. 74, 2001, сс.288-294; Mimura Y. и др., J. Biol. Chem. 276, 2001, cc. 45539-45547; Radaev S. и др., J. Biol. Chem. 276, 2001, cc. 16478-16483; Shields R.L. и др., J. Biol. Chem. 276, 2001, cc. 6591-6604; Shields R.L. и др., J. Biol. Chem. 277, 2002, cc. 26733-26740; Simmons L.C. и др., J. Immunol. Methods 263, 2002, cc. 133-147).
Опубликованы исследования, в которых обсуждается активность афукозилированных и фукозилированных антител, включая антитела к CD20 (см., например, Iida S. и др., Clin. Cancer Res. 12, 2006, сс.2879-2887; Natsume А. и др., J. Immunol. Methods 306, 2005, сс.93-103; Satoh М. и др., Expert Opin. Biol. Ther. 6, 2006, cc. 1161-1173; Kanda Y., и др., Biotechnol. Bioeng. 94, 2006, cc. 680-688; Davies J. и др., Biotechnol. Bioeng. 74, 2001, cc. 288-294).
CD20 и антитела к CD20
Молекула CD20 (которую называют также эволюционно консервативным дифференцировочным антигеном человеческих В-лимфоцитов или Вр35) представляет собой широко известный гидрофобный трансмембранный белок, локализованный на пре-В и зрелых В-лимфоцитах (Valentine М.А. и др., J. Biol. Chem. 264, 1989, сс.11282-11287; и Einfeld D.A. и др., EMBO J. 7, 1988, 711-717; Tedder T.F. и др., Proc. Natl. Acad. Sci. U.S.A. 85, 1988, cc. 208-212; Stamenkovic I. и др., J. Exp.Med. 167, 1988, cc. 1975-1980; Tedder T.F. и др., J. Immunol. 142, 1989, cc. 2560-2568). При неходжкинских лимфомах (НХЛ) CD20 экспрессируется на поверхности более 90% В-клеток (Anderson K.С. и др., Blood 63, 1984, сс. 1424-1433), но он не выявлен на гемопоэтических стволовых клетках, про-В-клетках, здоровых плазматических клетках или в других здоровых тканях (Tedder T.F. и др., J. Immunol. 135, 1985, сс. 973-979).
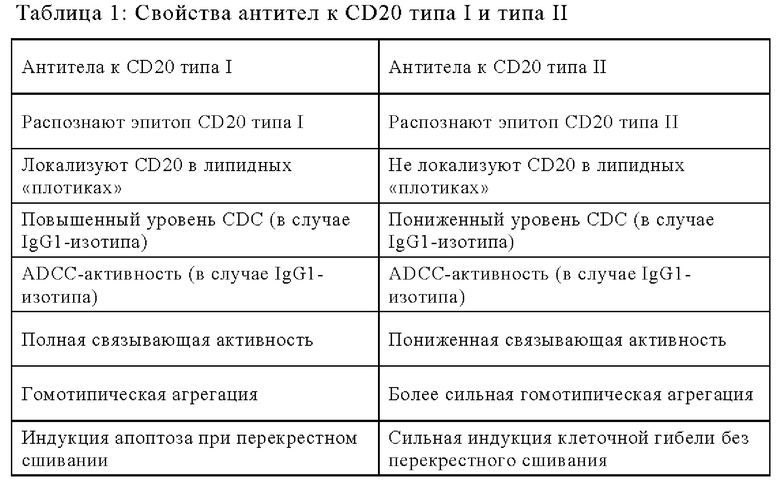
Существуют два различных типа антител к CD20, которые существенно отличаются механизмом связывания CD20 и биологической активностью (Cragg M.S. и др., Blood 103, 2004, сс.2738-2743; и Cragg M.S. и др., Blood, 101, 2003, сс.1045-1052). Антитела типа I, такие, например, как ритуксимаб (не афукозилированное антитело с содержанием фукозы 85% или более), офатумумаб, велтузумаб, окрелизумаб, обладают сильной опосредуемой комплементом цитотоксичностью.
Антитела типа II, такие, например, как тозитумомаб (B1), 11 В8, АТ80 или гуманизированные антитела B-Ly1, эффективно инициируют гибель клеток-мишеней посредством независимого от каспазы апоптоза при сопутствующем воздействии фосфатидилсерина.
BTK и ингибиторы BTK
Тирозинкиназа Брутона или тирозинкиназа, с мутацией которой связана агаммаглобулинемия Брутона (сокращенно Btk или BTK), является представителем ТЕС-семейства киназ. BTK связана с агаммаглобулинемией, заболеванием, ассоциированном с Х-сцепленным первичным иммунодефицитом (агаммаглобулинемия Брутона). Точный механизм ее действия не известен. Ген BTK кодирует белок BTK, который имеет решающее значение для развития и созревания В-клеток, например, активации тучных клеток посредством высокоаффинного IgE-рецептора. Пациенты с Х-сцепленной агаммаглобулинемией имеют обычные популяции пре-В-клеток в костном мозге, однако эти популяции не могут созревать и проникать в кровоток. Ген BTK локализован на Х-хромосоме. В гене BTK идентифицировано более 400 мутаций.
BTK активируется в обратном направлении киназами Src-семейства, такими как Blk, Lyn и Fyn, и приводит к активации в прямом направлении имеющих решающее значение для выживания путей, таких как NF-κВ и МАР-киназа. BTK содержит гомологичный плекстрину (РН) домен, который связывается с фосфатидилинозит-(3,4,5)-трифосфатом (РI(3,4,5)Р3). Связывание РI(3,4,5)Р3 индуцирует фосфорилирование Btk фосфолипазы Сγ (PLCγ), которая в свою очередь гидролизует РI(4,5)Р2, фосфатидилинозит, с образованием двух вторичных мессенджеров, инозиттрифосфата (IP3) и диацилглицреина (DAG), которые затем продолжают модулировать активность расположенных в прямом направлении белков в процессе передачи В-клеточных сигналов. Затем
происходит мобилизация Са2+ и активируются пути NF-κВ и МАР-киназы.
Примером известного в данной области ингибитора BTK является ибрутиниб (PCI-32765; Advani и др., J Clin Oncol. 31(1), 1 января 2013 г., сс. 88-94), представляющий собой низкомолекулярный обратимый ингибитор BTK.
Краткое изложение сущности изобретения
При создании изобретения было установлено, что комбинация антитела к CD20 типа I или афукозилированного антитела к CD20 типа II с ингибитором BTK обладала значительно повышенными антипролиферативными действиями, При создании изобретения неожиданного было установлено, что комбинация обладала действием, превышающим аддитивное, т.е. высоко синергетическим действием.
Одним из объектов изобретении является афукозилированное антитело к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для лечения рака в комбинации с ингибитором BTK.
Другим объектом изобретении является применение афукозилированного антитела к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для приготовления лекарственного средства для лечения рака в комбинации с ингибитором BTK.
Другим объектом изобретении является способ лечения пациента, страдающего раком, заключающийся в том, что вводят афукозилированное антитело к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, в комбинации с ингибитором BTK пациенту, который нуждается в таком лечении.
Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297. Согласно другому варианту осуществления изобретения содержание фукозы составляет 0% от общего количества олигосахаридов (сахаров) на Asn297.
В одном из вариантов осуществления изобретения антитело к CD20 типа I представляет собой ритуксимаб. В одном из вариантов осуществления изобретения афукозилированное антитело к CD20 представляет собой антитело изотипа IgG1. В другом варианте осуществления изобретения указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз. В одном из вариантов осуществления изобретения афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1. В другом варианте осуществления изобретения указанное афукозилированное антитело к CD20 представляет собой антитело к CD20 типа П.
В одном из вариантов осуществления изобретения указанный ингибитор BTK представляет собой соединение, выбранное из соединений, которые описаны в WO 2011/152351 и WO 2013/081016. Указанный ингибитор BTK предпочтительно представляет собой соединение формулы I или формулы I-1, указанное в настоящем описании. Предпочтительно ингибитор BTK представляет собой 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль.
В одном из вариантов осуществления изобретения указанное антитело к CD20 типа I представляет собой ритуксимаб, указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1 и указанный ингибитор BTK выбирают из группы, состоящей из соединений, которые описаны в WO 2011/152351 и WO 2013/081016. Указанный ингибитор BTK предпочтительно представляет собой соединение формулы I или формулы I-1, указанное в настоящем описании. Предпочтительно ингибитор BTK представляет собой 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль, и указанный рак представляет собой рак, при котором происходит экспрессия CD20, в одном из вариантов осуществления изобретения лимфому или лимфоцитарный лейкоз.
Согласно одному из вариантов осуществления изобретения связывание афукозилированного антитела к CD20 с CD20 характеризуется величиной KD, составляющей от 10-8 М до 10-13 М.
Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая комбинацию антитела к CD20 типа I (в одном из вариантов осуществления изобретения ритуксимаба) или афукозилированного антитела к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (в одном из вариантов осуществления изобретения афукозированное гуманизированное антитело B-Ly1) и ингибитора BTK (в одном из вариантов осуществления изобретения указанный ингибитор BTK выбирают из группы, состоящей из соединений, которые описаны в WO 2011/152351 и WO 2013/081016). Указанный ингибитор BTK предпочтительно представляет собой соединение формулы I или формулы I-1, указанное в настоящем описании. Предпочтительно ингибитор BTK представляет собой 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль), предназначенная для лечения рака.
Описание чертежей
На чертежах показано:
на фиг. 1 - результаты исследования противоопухолевой активности на мышах, несущих подкожные TMD8-клетки: кривые, на которых представлены средние объемы опухолей (а), и кривые, на которых представлены медианы объема опухолей (б).
Мышей подвергали ксенотрансплантации в D0. Рандомизацию осуществляли в D14 (обозначен как день 0 на фиг. 1). Мышам вводили пероральным путем (РО) один наполнитель и соединение А в дозе 10 мг/кг дважды каждый день (Q0,5D × 24) индивидуально или в комбинации с одной IV-инъекцией GA101 в дозе 1 и 3 мг/кг один раз в неделю (Q7D х 4). Мышам вводили путем внутривенной (IV)-инъекции один ритуксимаб (3 мг/кг) или путем IV-инъекции один GA101 (1 и 3 мг/кг) один раз в неделю (D14 (день 0), 21 (день 7), 28 (день 14) и D35 (день 21): Q7D × 4). Осуществляли мониторинг объемов опухолей и регистрировали дважды в неделю;
на фиг. 2 - результаты исследования противоопухолевой активности на мышах, несущих подкожные ТМD8-клетки: кривые, на которых представлены средние объемы опухолей (а), и кривые, на которых представлены медианы объема опухолей (б), в отношении мышей.
Мышей подвергали ксенотрансплантации в D0. Рандомизацию осуществляли в D14 (400-450 мм3: обозначен как день 0 на фиг. 2). Мышам вводили РО-путем один наполнитель и соединение А в дозе 10 мг/кг дважды каждый день (Q0,5D × 24) индивидуально или в комбинации с одной IV-инъекцией GA101/RTX в дозе 3 мг/кг один раз в неделю (Q7D × 4). Мыши получали одну IV-инъекцию ритуксимаба (3 мг/кг) или одну IV-инъекцию GA101 (3 мг/кг) один раз в неделю (D14 (день 0), 21 (день 7), 28 (день 14) и 35 (день 21): Q7D × 4). Осуществляли мониторинг объемов опухолей и регистрировали дважды в неделю;
на фиг. 3 результаты исследования противоопухолевой активности на мышах, несущих подкожные TMD8-клетки: кривые, на которых представлены средние объемы опухолей, в отношении мышей.
Мышей подвергали ксенотрансплантации в D0. Рандомизацию осуществляли в D14 (примерно 450 мм3: обозначен как день 0 на фиг. 3). Мышам давали корм, содержащий соединение А в концентрации 0,0037% (соответствует дозе 6 мг/кг/день) или соединение Б в концентрации 0,012% (соответствует дозе 20 мг/кг/день), индивидуально или в комбинации с одной IV-инъекцией RTX в дозе 3 мг/кг один раз в неделю (Q7D × 3). Мыши получали одну IV-инъекцию ритуксимаба (3 мг/кг) один раз в неделю (D14 (день 0), 21 (день 7) и 28 (день 14): Q7D × 3). Осуществляли мониторинг объемов опухолей и регистрировали в день 3, день 7, день 11, день 14, день 18 и день 21.
Подробное описание изобретения
В изобретении предложено антитело к CD20 типа I или афукозилированное антитело к CD20 IgG1- или IgG3-изотипа, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для лечения рака в комбинации с ингибитором BTK.
В изобретении предложено применение антитела к CD20 типа I или афукозилированного антитела к CD20 IgG1- или IgG3-изотипа, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для приготовления лекарственного средства, предназначенного для лечения рака в комбинации с ингибитором BTK.
Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
Понятие «антитело» относится к различным формам антител, включая (но, не ограничиваясь только ими) полные антитела, человеческие антитела, гуманизированные антитела и созданные с помощью генной инженерии антитела, такие как моноклональные антитела, химерные антитела или рекомбинантные антитела, а также фрагменты указанных антител, если они сохраняют отличительные признаки антител, предлагаемых в изобретении. Понятия «моноклональное антитело» или «композиция моноклонального антитела» в контексте настоящего описания относятся к препарату, содержащему молекулы антитела, которые имеют одинаковый аминокислотный состав. Соответственно понятие «человеческое моноклональное антитело» относится к антителам, обладающим одинаковой специфичностью связывания, которые имеют вариабельную и константную области, полученные из последовательностей иммуноглобулина человеческой зародышевой линии. Согласно одному из вариантов осуществления изобретения человеческие моноклональные антитела получают с помощью гибридомы, которая включает В-клетку, полученную из трансгенного животного кроме человека, например, трансгенной мыши, имеющей геном, который содержит трансген человеческой тяжелой цепи и трансген человеческой легкой цепи, слитые с иммортализованной клеткой.
Понятие «химерное антитело» относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, происхлдящую из одного источника или вида, и по меньшей мере часть константной области, выведенную из другого источника или вида, которое, как правило, получают методами рекомбинантной ДНК. Наиболее предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Такие мышиные/человеческие химерные антитела являются продуктом экспрессируемых генов иммуноглобулина, содержащих сегменты ДНК, которые кодируют мышиные вариабельные области иммуноглобулина, и сегменты ДНК, которые кодируют человеческие константные области иммуноглобулина. Другими формами «химерных антител», подпадающих под объем настоящего изобретения, являются антитела, в которых класс или подкласс модифицирован или изменен по сравнению с исходным антителом. Такие «химерные» антитела называют также «антителами переключенного класса». Методы получения химерных антител основаны на общепринятых методиках рекомбинантной ДНК и методиках генной трансфекции, и в настоящее время являются хорошо известными в данной области (см., например, Morrison S.L. и др., Proc. Natl. Acad Sci. USA 81, 1984, cc. 6851-6855; US 5202238 и US 5204244).
Понятие «гуманизированное антитело» относится к антителам, в которых каркасный участок или «гипервариабельные участки» (CDR) модифицированы таким образом, что они содержат CDR иммуноглобулина другой специфичности по сравнению с родительским иммуноглобулином. В предпочтительном варианте осуществления изобретения мышиный CDR трансплантируют в каркасный участок человеческого антитела, в результате чего образуется «гуманизированное антитело» (см., например, Riechmann L. и др., Nature 332, 1988, сс.323-327; и Neuberger M.S. и др., Nature 314, 1985, сс. 268-270). Наиболее предпочтительные CDR соответствуют участкам, которые представлены последовательностями, которые распознают антигены, указанные выше для химерных и би- или мультиспецифических антител.
Подразумевается, что в контексте настоящего описания понятие «человеческое антитело» включает антитела, имеющие вариабельную и константную области, происходящие из последовательностей иммуноглобулина человеческой зародышевой линии. Человеческие антитела хорошо известны в данной области (van Dijk М.А. и van de Winkel J.G., Curr. Opin. Chem. Biol. 5, 2001, cc. 368-374). На основе указанной технологии можно получать человеческие антитела к широкому разнообразию мишеней. Примеры человеческих антител описаны у Kellermann S.A. и др., Curr Opin Biotechnol. 13, 2002, сс. 593-597.
Подразумевается, что понятие «рекомбинантное человеческое антитело» в контексте настоящего описания включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют методами рекомбинации, такие как антитела, выделенные из клетки-хозяина, такой как NS0- или СНО-клетка, или из животного (например, из мыши), которое является трансгенным по генам человеческого иммуноглобулина, или антитела, экспрессируемые с помощью рекомбинантного экспрессионного вектора, которым трансфектируют клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, происходящие из последовательностей иммуноглобулина человеческой зародышевой линии, в преобразованной форме. Рекомбинантные человеческие антитела, предлагаемые в изобретении, подвергали in vivo соматической гипермутации. Так, аминокислотные последовательности VH- и VL-областей рекомбинантного антитела представляют собой последовательности, которые, хотя и происходят из последовательностей VH- и VL-областей человеческой зародышевой линии и являются родственными им, но могут не встречаться в существующем в естественных условиях in vivo спектре зародышевых линий человеческого антитела.
В контексте настоящего описания понятие «би- или мультиспецифическое антитело» относится к моноклональным антителам, которые имеют специфичности, связывающиеся по меньшей мере с двумя различными сайтами. В некоторых вариантах осуществления изобретения одна специфичность связывается с CD20, а другая с любым другим антигеном. В некоторых вариантах осуществления изобретения биспецифические антитела могут связываться с двумя различными эпитопами CD20. Биспецифические антитела можно применять также для локализации цитотоксических агентов в клетках, которые экспрессируют CD20. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
В контексте настоящего описания понятие «связывается (связывание)» или «специфически связывается (специфическое связывание)» относится к антителу, специфически связывающемуся с эпитопом опухолевого антигена по данным анализа in vitro, предпочтительно по данным анализа методом (поверхностного) плазмонного резонанса (BIAcore, фирма GE-Healthcare, Уппсала, Швеция) при использовании очищенного антигена дикого типа. Аффинность связывания определяют в понятиях kа (константа скорости ассоциации антитела при образовании комплекса антитело/антиген), kD (константа диссоциации) и KD (kD/ka). Считается, что имеет место связывание или специфическое связывание, если аффинность связывания (KD) составляет 10-8 М или менее, предпочтительно от 10-8 М до 10-13 М (в одном из вариантов осуществления изобретения от 10-9М до 10-13 М). Таким образом, афукозилированное антитело, предлагаемое в изобретении, специфически связывается с опухолевым антигеном, что характеризуется аффинностью связывания (KD), составляющей 10-8 моля/л, предпочтительно от 10-8 М до 10-13 М (в одном из вариантов осуществления изобретения от 10-9 М до 10-13 М).
Подразумевается, что понятие «молекула нуклеиновой кислоты» в контексте настоящего описания относится к молекулам ДНК и молекулам РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно она представляет собой двухцепочечную ДНК.
«Константные домены» не участвуют непосредственно в связывании антитела с антигеном, но они участвуют в эффекторных функциях (таких как ADCC, связывание комплемента и CDC).
Понятия «вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) в контексте настоящего описания обозначают области каждой из пары легких и тяжелых цепей, которые принимают непосредственное участие в связывании антитела с антигеном. Вариабельные домены человеческих легкой и тяжелой цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасных участка (FR), последовательности которых в значительной степени являются консервативными, соединенные тремя «гипервариабельными участками» (или определяющими комплементарность участками, CDR). Каркасные участки адоптированы к β-складчатой конформации, и CDR могут образовывать петли, соединяющие β-складчатую структуру. CDR в каждой цепи поддерживают свою трехмерную структуру с помощью каркасных участков и образуют вместе с CDR из другой цепи антигенсвязывающий центр.
Понятие «гипервариабельный участок» в контексте настоящего описания относятся к аминокислотным остаткам антитела, которые ответственны за связывание с антигеном. Гипервариабельный участок содержит аминокислотные остатки из «определяющих комплементарность участков» или «CDR». «Каркасные» или «FR»-участки представляют собой участки вариабельной области, отличные от остатков гипервариабельного участка, как он определен в настоящем описании. Таким образом, легкая и тяжелая цепи антитела содержат в направлении от N- к С-концу следующие участки: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR3 тяжелой цепи представляет собой участок, который вносит основной вклад в связывание с антигеном. CDR- и FR-участки определяют согласно стандартной номенклатуре Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991) и/или как участки из «гипервариабельной петли».
Понятие «афукозилированное антитело» относится к антителу изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1) с измененной схемой гликозилирования в Fc-области в положении Asn297, которое имеет пониженное количество остатков фукозы. Гликозилирование человеческих IgG1 или IgG3 имеет место в положении Asn297, оно обусловлено присутствием корового фукозилированного биантенного сложного олигосахарида в сайте гликозилирования, имеющего на конце вплоть до 2 остатков Gal. Эти структуры обозначают как G0-, G1- (α1,6 или α1,3) или G2-гликановые остатки в зависимости от количества концевых остатков Gal (Raju T.S., BioProcess Int. 1, 2003, cc. 44-53). СНО-тип гликозилирования Fc-областей антител описан, например, у Routier F.H., Glycoconjugate J. 14, 1997, сс.201-207. Антитела, полученные в результате рекомбинантной экспрессии в клетках-хозяевах СНО, не имеющих модификации гликозилирования (гликомодификация), как правило, имеют уровень фукозилирования в положении Asn297, составляющий по меньшей мере 85%. Очевидно, что в контексте настоящего описания понятие афукозилированное антитело включает также и антитела, у которых в их схеме гликозилирования фукоза отсутствует. Хорошо известно, что обычное положение гликозилированного остатка в антителе соответствует аспарагину в положении 297 согласно системе нумерации EU («Asn297»).
«Систему нумерации EU» или «EU-индекс», как правило, применяют для обозначения положения остатка в константной области тяжелой цепи иммуноглобулина (например, EU-индекс описан у Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991, публикация полностью включена в настоящее описание в качестве ссылки).
Таким образом, афукозилированное антитело, предлагаемое в настоящем изобретении, представляет собой антитело изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (это означает, что по меньшей мере 40% или более олигосахаридов на Asn297 в Fc-области являются афукозилированными). В одном из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от количества олигосахаридов на Asn297 в Fc-области. В другом варианте осуществления изобретения содержание фукозы составляет 50% или менее, а в следующем варианте осуществления изобретения содержание фукозы составляет 30% или менее от количества олигосахаридов на Asn297 в Fc-области. Согласно изобретению «доля (количество) фукозы» означает количество указанного олигосахарида (фукозы) в олигосахаридной (сахарной) цепи на Asn297 относительно суммы всех олигосахаридов (сахаров), присоединенных к Asn297 (например, сложных, гибридных и имеющих высокое содержание маннозы структур) по данным MALDI-TOF-масс-спектрометрии и рассчитанное в виде среднего значения (подробный метод определения количества фукозы описан, например, в WO 2008/077546). Согласно еще одному варианту осуществления изобретения олигосахариды Fc-области являются бисекционными. Афукозилированное антитело, предлагаемое в изобретении, можно экспрессировать в гликомодифицированной клетке-хозяине, сконструированной с целью экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, который обладает GnTIII-активностью, в количестве, достаточном для частичного фукозилирования олигосахаридов в Fc-области. Согласно одному из вариантов осуществления изобретения, полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид. В альтернативном варианте α1,6-фукозилтрансферазную активность клетки-хозяина можно снижать или элиминировать согласно методу, описанному в US 6946292, с получением гликомодифицированных клеток-хозяев. Уровень фукозилирования антитела можно предопределять, например, либо путем изменения условий ферментации (например, продолжительности ферментации), либо путем объединения по меньшей мере двух антител с различным уровнем фукозилирования. Указанные афукозилированные антитела и соответствующие методы гликоконструирования (конструирование схемы гликозилирования, гликоинженерия) описаны в WO 2005/044859, WO 2004/065540, WO 2007/031875, Umana Р. и др., Nature Biotechnol. 17, 1999, сс.176-180, WO 99/154342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739. Указанные антитела, полученные с помощью методов гликоинженерии, обладают повышенной ADCC. Другие методы гликоинженерии, которые позволяют получать афукозилированные антитела, предлагаемые в изобретении, описаны, например, у Niwa R. и др., J. Immunol. Methods 306, 2005, сс. 151-160; Shinkawa Т. и др., J. Biol. Chem. 278, 2003, сс. 3466-3473; WO 03/055993 или US 2005/0249722.
Таким образом, одним из объектов изобретения является антитело к CD20 типа I или афукозилированное антитело к CD20 IgG1- или IgG3-изотипа (предпочтительно IgG1-изотипа), специфически связывающееся с CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для лечения рака в комбинации с ингибитором BTK. Другим объектом изобретения является применение афукозилированного антитела к CD20 IgG1- или IgG3-изотипа (предпочтительно IgG1-изотипа), специфически связывающегося с CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для приготовления лекарственного средства, предназначенного для лечения рака в комбинации с ингибитором BTK. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 60% до 20% от общего количества олигосахаридов (сахаров) на Asn297. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 60% до 40% от общего количества олигосахаридов (сахаров) на Asn297. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет 0% от общего количества олигосахаридов (сахаров) на Asn297.
CD20 (который называют также В-лимфоцитарным антигеном CD20, В-лимфоцитарным поверхностным антигеном B1, Leu-16, Вр35, ВМ5 и LF5; последовательность представлена в базе данных SwissProt под номером Р11836) представляет собой гидрофобный трансмембранный белок с молекулярной массой примерно 35 кДа, локализованный на пре-В и зрелых В-лимфоцитах (Valentine М.А. и др., J. Biol. Chem. 264, 1989, сс. 11282-11287; Tedder T.F. и др., Proc. Natl. Acad. Sci. U.S.A. 85, 1988, cc. 208-212; Stamenkovic I. и др., J. Exp.Med. 167, 1988, cc. 1975-1980; Einfeld D.A. и др., EMBO J. 7, 1988, cc. 711-717; Tedder T.F. и др., J. Immunol. 142, 1989, cc. 2560-2568). Соответствующий человеческий ген представляет собой имеющий 4 трансмембранных домена представитель 1 подсемейства А, известный также как MS4A1. Этот ген кодирует представителя семейства трансмембранных генов 4А. Представители этого нового семейства белков отличаются общими структурными особенностями и сходными интрон/экзонными сочленениями (границы сплайсинга) и отличаются уникальными схемами экспрессии для гематопоэтических клеток и нелимфоидных тканей. Этот ген кодирует поверхностную молекулу В-лимфоцитов, которая играет роль в развитии и дифференцировке В-клеток в плазматические клетки. Этот представитель семейства локализован на 11q12 в кластере представителей семейства. Альтернативный сплайсинг этого гена приводит к образованию двух транскрипционных вариантов, которые кодируют один и тот же белок.
Понятия «CD20» и «антиген CD20» в контексте настоящего описания используют взаимозаменяемо, и они включают любые варианты, изоформы и видовые гомологи человеческого CD20, которые в естественных условиях экспрессируются клетками или экспрессируются на клетках, трансфектированных геном CD20. Связывание антитела, предлагаемого в изобретении, с антигеном CD20 опосредует уничтожение клеток, экспрессирующих CD20 (например, опухолевой клетки), путем инактивации CD20. Уничтожение клеток, экспрессирующих CD20, может происходить посредством одного или нескольких из следующих механизмов: индукция клеточной гибели/апоптоза, ADCC и CDC.
Синонимами CD20, принятыми в данной области, являются антиген CD20 В-лимфоцитов, поверхностный антиген В-лимфоцитов B1, Leu-16, Вр35, ВМ5 и LF5.
Понятие «антитело к CD20», предлагаемое в изобретении, относится к антителу, которое специфически связывается с антигеном CD20. В зависимости от характеристик связывания и биологической активности антитела к CD20 в отношении антигена CD20 можно различать два типа антител к CD20 (антитела к CD20 типа I и типа II) согласно Cragg M.S. и др., Blood 103, 2004, сс. 2738-2743; и Cragg M.S. и др., Blood 101, 2003, сс. 1045-1052 (см. таблицу 1).
Примерами антител к CD20 типа II являются, например, гуманизированное антитело B-Ly1 изотипа IgG1 (химерное гуманизированное антитело изотипа IgG1, описанное в WO 2005/044859), 11 В8 IgG1 (описанное в WO 2004/035607) и АТ80 IgG1. Как правило, антитела к CD20 типа II изотипа IgG1 обладают характерными CDC-свойствами. Антитела к CD20 типа II обладают пониженной CDC (если они относятся к изотипу IgG1) по сравнению с антителами типа I изотипа IgG1.
Примерами антител к CD20 типа I являются, например, ритуксимаб, HI47 IgG3 (ЕСАСС, гибридома), 2С6 IgG1 (описанное в WO 2005/103081), 2F2 IgG1 (описанное в WO 2004/035607 и WO 2005/103081) и 2Н7 IgG1 (описанное в WO 2004/056312).
Согласно одному из вариантов осуществления изобретения афукозилированные антитела к CD20, предлагаемые в изобретении, представляют собой антитело к CD20 типа II, а согласно другому варианту осуществления изобретения представляет собой афукозилированное гуманизированное антитело B-Ly1.
Афукозилированные антитела к CD20, предлагаемые в изобретении, обладают повышенной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC) по сравнению с антителами к CD20, у которых не снижено содержание фукозы.
К «афукозилированному антителу к CD20 с повышенной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC)» относится афукозилированное антитело к CD20, как оно определено в настоящем описании, обладающее повышенной ADCC, для определения которой используют любой приемлемый метод, известный в данной области. Один из приемлемых методов анализа in vitro ADCC предусматривает, что:
1) в анализе используют клетки-мишени, для которых известно, что они экспрессируют антиген-мишень, распознаваемый антигенсвязывающей областью антитела;
2) в качестве эффекторных клеток в анализе используют мононуклеарные клетки периферической крови человека (РВМС), выделенные из крови произвольно выбранного здорового донора;
3) анализ осуществляют согласно следующему протоколу:
I) выделяют РВМС с помощью стандартных процессов центрифугирования в градиенте плотности и суспендируют из расчета 5 × 106 клеток/мл в RPMI-среде для культивирования клеток;
II) выращивают клетки-мишени с помощью стандартных методов культивирования тканей, собирают клетки на экспоненциальной фазе роста, жизнеспособность которых превышает 90%, промывают в RPMI-среде для культивирования клеток, метят 51Cr (100 мкКи), промывают дважды в среде для культивирования клеток и ресуспендируют в среде для культивирования клеток с плотностью 105 клеток/мл;
III) осуществляют трансфекцию, используя по 100 мкл указанной выше конечной суспензии клеток-мишеней на каждую лунку 96-луночного титрационного микропланшета;
IV) осуществляют серийное разведение антитела от 4000 до 0,04 нг/мл в среде для культивирования клеток и добавляют по 50 мкл образовавшихся растворов антитела к клеткам-мишеням в 96-луночном титрационном микропланшете, оценивают в трех повторностях антитело в различных концентрациях, охватывающих весь диапазон указанных выше концентраций;
V) для контроля максимального высвобождения (MR) в 3 дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят по 50 мкл 2%-ного (VN) водного раствора неионогенного поверхностно-активного вещества (Nonidet, фирма Sigma, Сент-Луис) вместо раствора антитела (пункт IV, выше);
VI) для контроля спонтанного высвобождения (SR) в 3 дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят по 50 мкл RPMI-среды для культивирования клеток вместо раствора антитела (пункт IV, выше);
VII) затем 96-луночный титрационный микропланшет центрифугируют при 50 × g в течение 1 мин и инкубируют в течение 1 ч при 4°С;
VIII) добавляют по 50 мкл суспензии РВМС (пункт I, выше) в каждую лунку для обеспечения соотношения эффекторная клетка:клетка-мишень 25:1, и планшеты помещают в инкубатор в атмосферу, содержащую 5% СО2, на 4 ч при 37°С;
IX) собирают бесклеточный супернатант из каждой лунки и количественно оценивают высвободившуюся в эксперименте радиоактивность (ER) с помощью гамма-счетчика;
X) рассчитывают процент удельного лизиса для каждой концентрации антитела с помощью формулы (ER-MR)/(MR-SR) × 100, где ER представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для указанной концентрации антитела, MR представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для MR-контролей (см. пункт V, выше), a SR представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для SR-контролей (см. пункт VI, выше);
4) считают, что имеет место «повышенный уровень ADCC», если установлено: или повышение максимального процента удельного лизиса, обнаруженного в указанном выше диапазоне концентраций антитела, и/или снижение концентрации антитела, требуемой для достижения половины от максимального процента специфического лизиса, обнаруженного в указанном выше диапазоне концентраций антитела. Повышение уровня ADCC определяют относительно уровня ADCC, измеренного с помощью описанного выше анализа, опосредуемого таким же антителом, полученным с использованием такого же типа клеток-хозяев, с использованием таких же стандартных методов очистки, приготовления форм и хранения, которые хорошо известны специалистам в данной области, но которое не получено с использованием клеток-хозяев, сконструированных так, что они сверхэкспрессируют GnTIII.
Указанную «повышенную (повышенный уровень) ADCC» можно получать с помощью модификации указанных антител методами гликоинженерии, что означает повышение встречающихся в естественных условиях опосредуемых клеткой эффекторных функций моноклональных антител путем конструирования их олигосахаридного компонента согласно методу, описанному у Umana, Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180 и в US 6602684.
Понятие «комплементзависимая цитотоксичность (CDC)» относится к лизису человеческих опухолевых клеток-мишеней антителом, предлагаемым в изобретении, в присутствии комплемента. CDC предпочтительно оценивают путем обработки препарата экспрессирующих CD20 клеток антителом к CD20, предлагаемым в изобретении, в присутствии комплемента. Считается, что имеет место CDC, если антитело при его использовании в концентрации 100нМ индуцирует лизис (гибель клеток) 20% или большего количества опухолевых клеток в течение 4 ч. Анализ предпочтительно осуществляют с помощью меченных 51 Сr или Еu опухолевых клеток и оценивают высвобождение 51Сr или Еu. В качестве контроля опухолевые клетки-мишени инкубируют с комплементом без антитела.
Антитело «ритуксимаб» (являющееся примером антитела к CD20 типа I) представляет собой созданное с помощью генетической инженерии химерное человеческое/мышиное содержащее человеческую гамма-1 константную область моноклональное антитело к человеческому антигену CD20.
Антитело «ритуксимаб» (являющееся примером антитела к CD20 типа I) представляет собой созданное с помощью генетической инженерии химерное человеческое/мышиное содержащее человеческую гамма-1 константную область моноклональное антитело к человеческому антигену CD20. Указанное химерное антитело содержит человеческие гамма-1 константные области и идентифицировано под названием «С2 В8» в US 5736137 (Anderson K.C. и др.), выданном 17 апреля 1998 г. на имя фирмы IDEC Pharmaceuticals Corporation.
Ритуксимаб разрешен для лечения пациентов, страдающих рецидивирующей или рефрактерной, низкой степени злокачественности или фолликулярной, CD20-позитивной, В-клеточной неходжкинской лимфомой. Изучение механизма действия в опытах in vitro продемонстрировало, что ритуксимаб обладает зависимой от человеческого комплемента цитотоксичностью (CDC) (Reff М.Е. и др., Blood 83(2), 1994, сс. 435-445). Кроме того, он обладает выраженной активностью в анализах по оценке антитело-обусловленной клеточнозависимой цитотоксичности (ADCC). Ритуксимаб является неафукозилированным.

Понятие «гуманизированное антитело В-Ly1» относится к гуманизированному антителу B-Ly1, описанному в WO 2005/044859 и WO 2007/031875, которое получали из мышиного моноклонального антитела к CD20 B-Ly1 (вариабельная область мышиной тяжелой цепи (VH): SEQ ID NO: 1; вариабельная область мышиной легкой цепи (VL): SEQ ID NO: 2 - см. Poppema S. и Visser L., Biotest Bulletin 3, 1987, cc. 131-139) путем химеризации с использованием человеческой константной области из IgG1 и последующей гуманизации (см. WO 2005/044859 и WO 2007/031875). Эти «гуманизированные антитела В-Ly1» описаны подробно в WO 2005/044859 и WO 2007/031875.
Согласно одному из вариантов осуществления изобретения «гуманизированное антитело В-Ly1» имеет вариабельную область тяжелой цепи (VH), выбранную из SEQ ID NO: 3 - SEQ ID NO: 20 (B-HH2 - B-HH9 и B-HL8 -B-HL17, которые описаны в WO 2005/044859 и WO 2007/031875). В одном из конкретных вариантов осуществления изобретения такой вариабельный домен выбирают из группы, состоящей из SEQ ID NO: 3, 4, 7, 9, 11, 13 и 15 (В-НН2, В-НН3, В-НН6, В-НН8, B-HL8, B-HL11 и B-HL13, которые описаны в WO 2005/044859 и WO 2007/031875). В одном из конкретных вариантов осуществления изобретения «гуманизированное антитело В-Ly1» имеет вариабельную область легкой (VL), которая представлена в SEQ ID NO: 20 (В-KV1 в WO 2005/044859 и WO 2007/031875). В одном из конкретных вариантов осуществления изобретения «гуманизированное антитело В-Ly1» имеет вариабельную область тяжелой цепи (VH), которая представлена в SEQ ID NO: 7 (В-НН6 в WO 2005/044859 и WO 2007/031875), и имеет вариабельную область легкой цепи (VL), которая представлена в SEQ ID NO: 20 (B-KV1 в WO 2005/044859 и WO 2007/031875). Кроме того, гуманизированное антитело B-Ly1 предпочтительно представляет собой антитело изотипа IgG1. Указанные афукозилированные гуманизированные антитела B-Ly1, предлагаемые в изобретении, созданы с помощью гликоинженерии (GE) в Fc-области согласно методам, описанным в WO 2005/044859, WO 2004/065540, WO 2007/031875, у Umana Р. и др., Nature Biotechnol. 17, 1999, сс.176-180 и WO 99/154342. Согласно одному из вариантов осуществления изобретения афукозилированное созданное с помощью гликоинженерии гуманизированное антитело B-Ly1 представляет собой B-HH6-B-KV1 GE. В одном из вариантов осуществления изобретения антитело к CD20 представляет собой обинутузумаб (рекомендованное международное непатентованное название (INN), WHO Drug Information, т.26, №4, 2012, с. 453). В контексте настоящего описания обинутузумаб является синонимом GA101. Торговое название - GAZYVA. Информационный документ ВОЗ, касающийся лекарственных средств (WHO Drug Information document) заменяет все предыдущие версии (например, т.25, №. 1, 2011, сс.75-76), и его ранее известное название афутузумаб (рекомендованное INN, WHO Drug Information, т.23, №2, 2009, с. 176; т.22, №2, 2008, с. 124).
BTK в контексте настоящего описания означает «тирозинкиназу Брутона» или «тирозинкиназу, с мутацией которой связана агаммаглобулинемия Брутона» (сокращенно Btk или BTK), которая является представителем ТЕС-семейства киназ. Ген BTK кодирует белок BTK, который имеет решающее значение для развития и созревания В-клеток, например, активации тучных клеток посредством высокоаффинного IgE-рецептора. Ген BTK локализован на X-хромосоме. В гене BTK идентифицировано более 400 мутаций.
Понятие «ингибитор BTK» согласно изобретению относится к агентам, которые препятствуют проявлению киназной активности BTK, для которых характерна величина IC50, составляющая от 0,001 мкМ до примерно 2 мкМ, в одном из вариантов осуществления изобретения от 0,002 мкМ до примерно 2 мкМ. В одном из вариантов осуществления изобретения ингибиторы BTK представляют собой антитела, антисмысловые олигонуклеотиды, пептиды.
В другом варианте осуществления изобретения ингибиторы BTK представляют собой низкомолекулярные соединения с молекулярной массой (ММ) менее 1500 Дальтон (Да).
В одном из вариантов осуществления изобретения указанные низкомолекулярные ингибиторы BTK представляют собой соединения, описанные в WO 2011/152351 и WO 2013/081016.
В одном из вариантов осуществления изобретения низкомолекулярный ингибитор BTK, предлагаемый в изобретении, отличается общей формулой (I)
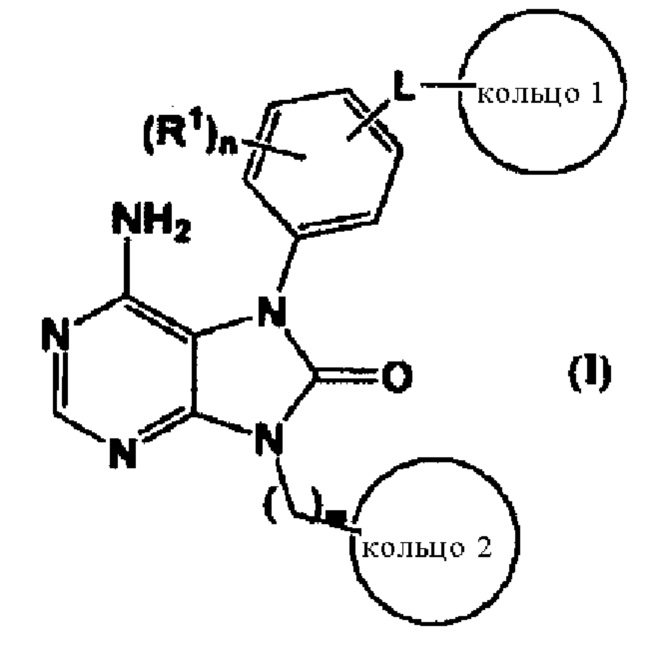
В формуле L обозначает (1) -О-, (2) -S-, (3) -SO-, (4) -SO2- (5) -NH-, (6) -С(О)- (7) -СН2-O- (8) -O-СН2- (9) -СН2- или (10) -СН(ОН)-;
R1 обозначает (1) атом галогена, (2) С1-С4алкильную группу, (3) C1-С4алкоксигруппу, (4) С1-С4галоалкильную группу или (5) C1-С4 ггалоалкоксигруппу;
кольцо 1 обозначает 4-7-членную циклическую группу, которая может быть замещена 1-5 заместителями, независимо друг от друга выбранными из группы, состоящей из (1) атомов галогена, (2) С1-С4алкильных групп, (3) C1-С4алкоксигрупп, (4) нитрила, (5) С1-С4галоалкильных групп и (6) C1-С4галоалкоксигрупп, при этом, когда два или большее количество заместителей присутствуют в кольце 1, то эти заместители могут образовывать 4-7-членную циклическую группу в сочетании с атомами в кольце 1, с которыми эти заместители связаны;
кольцо 2 обозначает 4-7-членный насыщенный гетероцикл, который может быть замещен 1-3 группами -K-R2;
К обозначает (1) связь, (2) С1-С4алкилен, (3) -С(О)-, (4) -С(O)-СН2-, (5) -СН2-С(O)-, (6) -С(O)O- или (7) -SO2- (в которых обозначенная слева связь связана с кольцом 2);
R2 обозначает (1) С1-С4алкильную, (2) С2-С4алкенильную или (3) С2-С4алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо друг от друга выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8;
R3 и R4 каждый независимо друг от друга обозначает (1) атом водорода или (2) С1-С4алкильную группа, которая может быть замещена OR9 или CONR10R11;
R3 и R4 вместе с атомом азота, с которым они связаны, могут образовывать 4-7-членный азотсодержащий насыщенный гетероцикл, который может быть замещен оксогруппой или гидроксильной группой;
R5 и R6 каждый независимо друг от друга обозначает (1) атом водорода, (2) С1-С4алкильну группу или (3) фенильную группу;
R7 обозначает (1) атом водорода или (2) С1-С4алкильную группу;
R8 обозначает (1) атом водорода, (2) С1-С4алкильную группу (3) фенильную группу или (4) бензотриазолильную группу;
R9 обозначает (1) атом водорода или (2) С1-С4алкильную группу; R10 и R11 каждый независимо друг от друга обозначает (1) атом водорода или (2) С1-С4алкильну группу;
n обозначает целое число от 0 до 4; m обозначает целое число от 0 до 2 и, когда n обозначает 2 или более, то R1' могут быть одинаковыми или могут отличаться друг от друга, оптический изомер соединения или их смесь, его соль, сольват, N-оксид или пролекарство;
[2] соединение, подпадающее под описанное в пункте [1], в котором R2 обозначает С2-С4алкенильную группу или С2-С4алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо друг от друга выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8;
[3] соединение, подпадающее под описанное в пункте [1], в котором кольцо 1 представляет собой бензольное, циклогексановое или пиридиновое кольцо, каждое из которых может быть замещено 1-5 заместителями, каждый из которых независимо друг от друга выбран из группы, состоящей из (1) атомов галогена, (2) С1-С4алкильных группами, (3) С1-С4алкоксигрупп, (4) нитрила и (5) CF3;
[4] соединение, подпадающее под описанное в пункте [1], в котором кольцо 2 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, который может быть замещен 1-3 группами K-R2;
[5] соединение, подпадающее под описанное в пункте [4], в котором 4-7-членный азотсодержащий насыщенный гетероцикл представляет собой азетидиновое, пирролидиновое или пиперидиновое кольцо;
[6] соединение, подпадающее под описанное в пункте [1], представленное общей формулой (I-1)
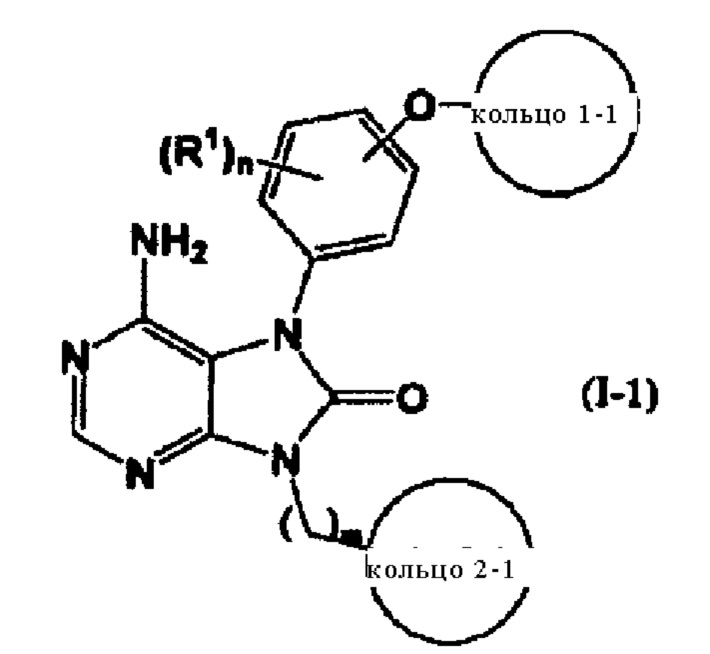
В формуле кольцо 1-1 представляет собой бензольное, циклогексановое или пиридиновое кольцо, каждое из которых может быть замещено 1-5 заместителя, каждый из которых независимо друг от друга выбран из группы, состоящей из (1) атомов галогена, (2) С1-С4алкильных групп, (3) С1-С4алкоксигрупп, (4) нитрила и (5) CF3, и кольцо 2-1 представляет собой 4-7-членный азотсодержащий насыщенный гетероцикл, который может быть замещен 1-3 группами -K-R2, где другие символы имеют указанные выше значения;
[7] соединение, подпадающее под описанное в пункте [6], в котором R2 обозначает С2-С4алкенильную группу или С2-С4алкинильную группу, каждая из которых может быть замещена 1-5 заместителями, каждый из которых независимо друг от друга выбран из группы, состоящей из (1) NR3R4, (2) атомов галогена, (3) CONR5R6, (4) CO2R7 и (5) OR8;
[8] соединение, подпадающее под описанное в пункте [1], которое представляет собой (1) 9-(1-акрилоил-3-азетидил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (2) 6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (4) 6-aминo-9-[(3R)-1-(2-бyтинoил)-3-пиppoлидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (5) 6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, (6) 6-aминo-7-[4-(3-xлopфeнoкcи)фeнил]-9-{(3R)-1-[(2E)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-он, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он, или его изомер или их смеси.
Предпочтительно ингибитор BTK, предлагаемый в изобретении, представляет собой 6-aминo-9-[(3R)-1-(2-бyтинoил)-3-пиppoлидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль.
Получение ингибитора BTK, предлагаемого в изобретении, осуществляет согласно методу, описанному в WO 2011/152351.
Понятие «соль» относится к солям соединений в виде фармацевтически приемлемой соли. Примерами указанных солей могут являться соли со щелочными металлами (калий, натрий и т.п.), соли щелочноземельных металлов (кальций, магний и т.п.), аммониевая соль, соли с фармацевтически приемлемыми органическими аминами (тетраметиламмоний, триэтиламин, метиламин, диметиламин, циклопентиламин, бензиламин, фенэтиламин, пиперидин, моноэтаноламин, диэтаноламин, трис(гидроксиметил)аминометан, лизин, аргинин, N-метил-D-глюкамин и т.п.), и кислотно-аддитивные соли (соли неорганических кислот (гидрохлорид, гидробромид, гидройодид, сульфат, фосфат, нитрат и т.п.) и соли органических кислот (ацетат, трифторацетат, лактат, тартрат, оксалат, фумарат, малеат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфанат, изетионат, глюкуронат, глюконат и т.п.)).
Понятие «IC50» относится к концентрации конкретного соединения, требуемой для ингибирования на 50% конкретной измеряемой активности. IC50 ингибиторов BTK, которые ингибируют активность киназы BTK, можно измерять, среди прочего, согласно описанному ниже методу.
Анализ активности in vitro для определения IC50 ингибитора BTK, предлагаемого в изобретении:
Ингибирующую активность в отношении фермента Btk измеряли, основываясь на протоколе, предоставленном производителем, используя Btk (фирма Invitrogen Corporation) и набор для анализа киназной активности Z'-LYTE™ -Туr1-пептид (фирма Invitrogen Corporation), который содержал следующие реагенты: Туr-1-пептид, Thy-1-фосфопептид, 5-кратный киназный буфер, АТФ, проявляющий реагент В, проявляющий буфер и реагент, прекращающий реакцию (стоп-реагент). По 5 мкл/лунку раствора ингибитора BTK, разведенного диметилсульфоксидом (ДМСО), или только ДМСО, и по 10 мкл/лунку раствора смеси субстрата/фермента вносили в 96-луночный планшет для анализа и реакцию осуществляли в течение 20 мин при 30°С. Раствор смеси субстрат/фермент получали путем разведения киназным буфером (DL-дитиотреитол (DTT, 2,7 мМ), 1,33-кратный киназный буфер) до получения конечной концентрации Tyr-1-пептида 4 мкМ и конечной концентрации Btk 5нМ. Затем добавляли по 5 мкл/лунку аденозинтрифосфата (АТФ, конечная концентрация 36 мкМ) и реакцию осуществляли в течение 1 ч при 30°С. После завершения реакции добавляли 10 мкл проявляющего раствора, который получали путем разведения проявляющего реагента В в 128 раз, используя проявляющий буфер, и реакцию осуществляли в течение еще 1 ч при 30°С. Затем ферментативную реакцию прекращали, добавляя 10 мкл стоп-раствора. Измеряли интенсивность флуоресценции при 445 нм и 520 нм в каждой лунке с помощью универсального анализатора для микропланшетов Fusion (фирма PerkinElmer Inc.), такого как флуоресцентный планшет-ридер. Процент фосфорилирования определяли, используя отношение испускания при 445 нм (испускание кумарина) и испускания при 520 нм (испускание флуоресцеина), согласно протоколу, приложенному к набору.
Процент ингибирования (%) ингибитором BTK рассчитывали с помощью следующего уравнения:
Процент (%) ингибирования фосфорилирования =1 - {(АС - АХ)/(АС - АВ)} × 100, где АХ обозначает % фосфорилирования при добавлении ингибитора BTK, АВ обозначает % фосфорилирования без добавления АТФ (пустой контроль), АС обозначает % фосфорилирования при добавлении только ДМСО (контроль).
Величину 50%-ного ингибирования (величина IC50) для ингибитора BTK определяли из кривой ингибирования на основе % ингибирования при каждой концентрации ингибитора BTK.
Олигосахаридный компонент может оказывать существенное влияние на свойства, имеющие отношение к эффективности терапевтического гликопротеина, включая его физическую стабильность, устойчивость к воздействию протеаз, взаимодействия с иммунной системой, фармакокинетические параметры и специфическую биологическую активность. Указанные свойства могут зависеть не только от присутствия или отсутствия олигосахаридов, но также от их специфических структур. Можно сделать определенные обобщения, касающиеся зависимости структуры олигосахарида и функции гликопротеина. Например, некоторые структуры олигосахарида опосредуют быстрый клиренс гликопротеина из кровотока в результате взаимодействий со специфическими связывающими углеводы белками, а другие могут связываться антителами и запускать нежелательные иммунные реакции (Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981).
Клетки млекопитающих являются предпочтительными хозяевами для производства терапевтических гликопротеинов благодаря их способности гликозилировать белки с образованием наиболее приемлемой для применения на человеке формы (Cumming D.A. и др., Glycobiology 1, 1991, сс. 115-130; Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981). Бактерии очень редко гликозилируют белки, и подобно другим типам обычных хозяев, таких как клетки дрожжей, нитчатых грибов, насекомых и растений, обеспечивают схемы гликозилирования, ассоциированные с быстрым клиренсом из кровотока, нежелательными иммунными взаимодействиями и в некоторых конкретных случаях пониженной биологической активностью. Среди клеток млекопитающих клетки яичника китайского хомячка (СНО) нашли наиболее широкое применение в течение двух последних десятилетий. Помимо обеспечения приемлемых схем гликозилирования эти клетки позволяют устойчиво получать генетически стабильные, высокопродуктивные клональные клеточные линии. Их можно культивировать, достигая высокой плотности, в простых биореакторах с использованием бессывороточных сред, и на их основе можно разрабатывать безопасные и воспроизводимые биопроцессы. Другими обычно применяемыми клетками животных являются клетки почки детеныша хомяка (BHK), клетки мышиной миеломы NS0 и SP2/0. В последние годы изучали также возможность их производства в организме трансгенных животных (Jenkins N. и др., Nature Biotechnol. 14, 1996, сс.975-981).
Все антитела содержат углеводные структуры в консервативных положениях в константных областях тяжелой цепи, при этом каждый изотип характеризуется различной организацией N-связанных углеводных структур, которые оказывают различное действие на сборку, секрецию и функциональную активность белка (Wright А. и Monison S.L., Trends Biotech. 15, 1997, сс. 26-32). Структура присоединенного N-связанного углевода значительно варьируется в зависимости от степени процессирования и может включать имеющие высокое содержание маннозы, множество разветвлений, а также биантенные сложные олигосахариды (Wright А. и Morrison S.L., Trends Biotech. 15, 1997, сс. 26-32). Как правило, имеет место гетерогенный процессинг коровых олигосахаридных структур, присоединенных в конкретном сайте гликозилирования, в результате чего даже моноклональные антитела существует в виде нескольких гликоформ. Было установлено также, что имеют место большие различия в гликозилировании антител между клеточными линиями, и даже при выращивании данной клеточной линии в других условиях культивирования имеют место небольшие различия (Lifely M.R. и др., Glycobiology 5(8), 1995, сс. 813-822).
Одним из путей достижения значительного повышения эффективности при сохранении простого процесса производства и возможности избежать значительных нежелательных побочных действий является усиление природных опосредуемых клеткой эффекторных функций моноклональных антител путем конструирования олигосахаридного компонента согласно методу, описанному у Umana Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180 и в US 6602684. Антитела IgG1-типа, представляющие собой антитела, наиболее часто используемые в иммунотерапии рака, являются гликопротеинами, которые имеют консервативный N-связанный сайт гликозилирования в положении Asn297 в каждом СН2-домене. Два сложных биантенных олигосахарида, которые присоединены к Asn297, размещаются между СН2-доменами, образуя обширные контакты с каркасом полипептида, и их наличие является существенным для способности антитела опосредовать эффекторные функции, такие как антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) (Lifely M.R. и др., Glycobiology, 5, 1995, сс. 813-822; Jefferis R. и др., Immunol. Rev., 163, 1998, сс.59-76; Wright А. и Morrison S.L., Trends Biotechnol., 15, 1997, cc. 26-32).
Ранее было установлено, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), гликозилтрансферазы, катализирующей образование бисекционных олигосахаридов, существенно повышает ADCC-активность in vitro антинейробластомного химерного моноклонального антитела (chCE7), продуцируемого сконструированными клетками СНО (см. Umafia Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180; и WO 1999/54342, полное содержание указанных документов включено в настоящее описание в качестве ссылки). Антитело chCE7 относится к большому классу неконъюгированных моноклональных антител, которые обладают высокой аффинностью и специфичностью в отношении опухолей, но имеют слишком низкую эффективность для клинического применения при их получении в стандартных применяемых в промышленности клеточных линиях, в которых отсутствует фермент GnTIII (Umana Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180). Это исследование было первым, в котором установлено, что существенных повышений ADCC-активности можно достигать путем конструирования продуцирующих антитело клеток, экспрессирующих GnTIII, что приводит также к повышению относительного содержания ассоциированных с константной областью (Fc) бисекционных олигосахаридов, включая бисекционные нефукозилированные олигосахариды, по сравнению с уровнями, характерными для встречающихся в естественных условиях антител.
Понятие «рак» в контексте настоящего описания относится к таким видам рака, как лимфомы, лимфолейкозы, рак легкого, немелкоклеточный рак легкого (NSCL), бронхоальвеолярно-клеточный рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичника, ректальный рак, рак анальной области, рак желудка, гастральный рак, рак ободочной кишки, рак молочной железы, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягкой ткани, рак мочеиспускательного канала, рак пениса, рак предстательной железы, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечных лоханок, мезотелиома, печеночно-клеточный рак, билиарный рак, неоплазмы центральной нервной системы (ЦНС), опухоль позвоночника, глиома ствола головного мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза, в том числе устойчивые варианты любого из указанных выше видов рака или комбинации одного или нескольких из указанных выше видов рака. Согласно одному из вариантов осуществления изобретения понятие рак относится к раку, при котором происходит экспрессия CD20.
Подразумевается, что понятие «экспрессия антигена CD20» относится к значительному уровню экспрессии антигена CD20 в клетке, предпочтительно на клеточной поверхности Т- или В-клетки, более предпочтительно В-клетки, входящей в опухоль или рак соответственно, предпочтительно опухоль, которая не относится к солидным опухолям. Пациентов, которые имеют «рак, при котором происходит экспрессия CD20», можно выявлять с помощью стандартных анализов, известных в данной области. Например, экспрессию антигена CD20 можно оценивать иммуногистохимическим (ИГХ) методом, FACS или путем выявления с помощью ПЦР соответствующей мРНК.
Понятие «рак, при котором происходит экспрессия CD20» в контексте настоящего описания относится ко всем видам рака, при которых раковые клетки экспрессируют антигена CD20. В контексте настоящего описания рак, при котором происходит экспрессия CD20, предпочтительно относится к лимфомам (предпочтительно В-клеточным неходжкинским лимфомам (НХЛ)) и лимфолейкозам. Указанные лимфомы и лимфолейкозы включают, например, а) фолликулярные лимфомы, б) мелкоклеточные с нерасщепленными ядрами лимфомы/лимфому Беркитта (включая эндемическую лимфому Беркитта, спорадическую лимфому Беркитта и не-беркиттовскую лимфому), в) лимфомы маргинальной зоны (включая экстранодальную В-клеточную лимфому маргинальной зоны (лимфомы лимфоидной ткани слизистых оболочек, MALT), нодальную В-клеточную лимфому марганальной зоны и лимфому маргинальной зоны селезенки), г) лимфому из клеток зоны мантии (MCL), д) крупноклеточную лимфому (включая В-клеточную диффузную крупноклеточную лимфому (DLCL), диффузную смешанно-клеточную лимфому, иммунобластную лимфому, первичную медиастинальную В-клеточную лимфому, ангиоцентрическую лимфому-легочную В-клеточную лимфому), е) волосковоклеточный лейкоз, ж) лимфоцитарную лимфому, макроглобулинемию Вальденстрема, з) острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (СLL)/мелкоклеточный лимфолейкоз (SLL), В-клеточный пролимфоцитарный лейкоз, и) неоплазмы из плазматических клеток, миеломы из плазматических клеток, множественную миелому, плазмацитому, к) болезнь Ходжкина.
Согласно одному из вариантов осуществления изобретения рак, при котором происходит экспрессия CD20, представляет собой В-клеточные неходжкинские лимфомы (НХЛ)). Согласно другому варианту осуществления изобретения рак, при котором происходит экспрессия CD20, представляет собой лимфому из клеток зоны мантии (MCL), острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (CLL), В-клеточную диффузную крупноклеточную лимфому (DLCL), лимфому Беркитта, волосковоклеточный лейкоз, фолликулярную лимфому, множественную миелому, лимфому маргинальной зоны, пост-трансплантационное лимфопролиферативное нарушение (PTLD), ассоциированную с ВИЧ лимфому, Вальденстрема макроглобулинемию или первичную лимфому ЦНС.
Понятие «метод лечения», «метод обработки» или его эквивалент применительно, например, к раку, относится к процедуре или курсу лечения, которую/который разрабатывают с целью снижения или устранения некоторого количества раковых клеток в организме пациента или для облегчения симптомов рака. «Метод лечения» рака или другого пролиферативного нарушения не обязательно подразумевает, что раковые клетки или другие нарушения должны быть фактически элиминированы, что количество клеток или уровень нарушения фактически должны быть снижены, или что другие симптомы рака или другого нарушения фактически должны быть облегчены. Часто метод лечения рака можно осуществлять даже с небольшой вероятностью успеха, но если с учетом истории болезни пациента и оцененной перспективы хирургического вмешательства предполагается, что он, тем не менее, может оказывать общее благоприятное воздействие.
Понятия «комбинация», «совместное введение» или «совместное применение» относится к применению указанного антитела к CD20 типа I или указанного афукозилированного антитела к CD20 и указанного ингибитора BTK в виде двух различных препаративных форм (или в виде одной препаративной формы). Совместное применение может быть одновременным или последовательным в любом порядке, при этом предпочтительно существует период времени, в течение которого два действующих вещества (или все действующие вещества) одновременно проявляют свое биологическое действие. Указанное антитело к CD20 типа I или указанное афукозилированное антитело к CD20 и указанный ингибитор BTK применяют совместно либо одновременно, либо последовательно (например, внутривенно (i.v.) посредством непрерывной инфузии (одна для антитела к CD20 и затем одна для указанного ингибитора BTK; или например, антитело к CD20 вводят внутривенно (i.v.) посредством непрерывной инфузии, а указанный ингибитор BTK вводят орально). Когда оба терапевтических агента совместно вводят последовательно, то вводимую дозу применяют либо в один и тот же день в виде двух различных введений, либо один из агентов вводят в день 1, а второй совместно применяемый агент вводят в день 2-7, предпочтительно день 2-4. Таким образом, понятие «последовательно» означает в пределах 7 дней после введения дозы первого компонента (антитела к CD20 или ингибитора BTK), предпочтительно в пределах 4 дней после введения дозы первого компонента; а понятие «одновременно» означает в одно и тоже время. Понятие «совместное применение» касательно поддерживающих доз указанного антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора BTK означает, что поддерживающие дозы можно совместно вводить одновременно, если цикл лечения обоих лекарственных средств пригоден для этого, например, каждую неделю. Или ингибитор BTK вводят, например, каждый первый-третий день, а указанное афукозилированное антитело вводят каждую неделю. Или поддерживающие дозы применяют совместно последовательно либо в один день, либо в пределах нескольких дней.
Очевидно, что антитела вводят пациенту в «терапевтически эффективном количестве» (или просто в «эффективном количестве»), которое представляет собой количество соответствующего соединения или комбинации, вызывающее биологический или медицинский ответ ткани, системы, животного или человека, ожидаемый исследователем, ветеринаром, лечащим врачом или другим клиницистом.
Количество, применяемое для совместного введения указанного антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора BTK, и время совместного введения должны зависеть от типа (вид, пол, возраст, вес и т.д.) и состояния подлежащего лечению пациента и серьезности заболевания или состояния, подлежащего лечению. Указанное антитело к CD20 типа I или афукозилированное антитело к CD20 и указанный ингибитор BTK можно применять для совместного введения пациенту одновременно или в виде серий обработок, например, в один и тот же день или на следующий день.
Если введение является внутривенным, то продолжительность начальной инфузии указанного антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора BTK может быть длиннее, чем продолжительность последующих инфузий, например, составлять примерно 90 мин для начальной инфузии и примерно 30 мин для последующих инфузий (если начальная инфузия хорошо переносилась).
В зависимости от типа и серьезности заболевания начальная возможная доза при совместном введении обоих лекарственных средств пациенту может составлять примерно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) для указанного антитела к CD20 типа I или афукозилированного антитела к CD20; и от 1 мкг /кг до 50 мг/кг (например, 0,1-20 мг/кг) для указанного ингибитора BTK. Согласно одному из вариантов осуществления изобретения предпочтительная доза указанного афукозилированного антитела к CD20 (предпочтительно афукозилированного гуманизированного антитела B-Ly1, более предпочтительно обинутузумаба) должна составлять от примерно 0,05 до примерно 30 мг/кг.Так, для совместного введения пациенту можно использовать одну или несколько из следующих доз: примерно 0,5, 2,0, 4,0, 10 или 30 мг/кг (или любую их комбинацию). Согласно одному из вариантов осуществления изобретения доза указанного ингибитора BTK (предпочтительно 6-амино-9-[(3R)- 1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она или его соли) должна составлять от примерно 0,05 до примерно 30 мг/кг. Так, для совместного введения пациенту можно использовать одну или несколько из следующих доз: примерно 0,5, 2,0, 4,0, 10 или 30 мг/кг (или любую их комбинацию).
В зависимости от типа (вид, пол, возраст, вес и т.д.) и состояния пациента и от антитела к CD20 типа I, предпочтительно ритуксимаба, или типа афукозилированного антитела к CD20 дозу и схему введения указанного афукозилированного антитела, предпочтительно афукозилированного гуманизированного антитела B-Ly1, более предпочтительно обинутузумаба, доза и схема введения указанного антитела к CD20 типа I или указанного афукозилированного антитела к CD20 можно отличаться от применяемых для указанного ингибитора BTK. Например, антитело к CD20 типа I или указанное афукозилированное антитело к CD20 можно вводить, например, каждую 1-3 недели, а указанный ингибитор BTK можно вводить ежедневно или каждые 2-10 дней. Можно применять также начальную более высокую ударную дозу, после которой можно вводить одну или несколько более низких доз.
Согласно одному из вариантов осуществления изобретения предпочтительная доза антитела к CD20 типа I (предпочтительно ритуксимаба) может составлять от примерно 100 до примерно 1000 мг/м2 в день 1, 8, 15, 22, 29, 36, 43, 50, 57 при осуществлении 8-недельного цикла дозирования.
Согласно одному из вариантов осуществления изобретения предпочтительная доза указанного афукозилированного антитела к CD20 (предпочтительно афукозилированного гуманизированного антитела B-Ly1, более предпочтительно обинутузумаба) может составлять от 800 до 1600 мг (в одном из вариантов осуществления от 800 до 1200 мг) в день 1, 8, 15 при осуществлении 3-6-недельного цикла дозирования, а затем доза может составлять от 400 до 1200 (в одном из вариантов осуществления от 800 до 1200 мг) в день 1 при осуществлении вплоть до девяти 3-4-недельных циклов дозирования.
В одном из вариантов осуществления изобретения доза указанного ингибитора BTK, выбранного из группы, состоящей из: (1) 9-(1-акрилоил-3-азетидил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (2) 6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (4) 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (5) 6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (6) 6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-она, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она и (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, соответствует указанной ниже. Доза указанного ингибитора BTK, выбранного из группы оптических изомеров указанных соединений (1)-(8) и их смесей, соответствует указанной ниже. Доза ингибитора BTK 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она или его соли соответствует указанной ниже. Указанная доза, предлагаемая в изобретении, составляет от 10 до 70 мг/кг, предпочтительно от 20 до 55 мг/кг, которую применяют ежедневно или через день путем орального введения.
Рекомендованная доза может варьироваться в зависимости от дополнительного совместного введения химиотерапевтического средства и в зависимости от типа химиотерапевтического средства.
В одном из вариантов осуществления указанное изобретение можно применять для предупреждения или снижения метастазов или дальнейшего их распространения у пациента, страдающего раком, предпочтительно раком, при котором происходит экспрессия CD20. Указанное изобретение можно применять для удлинения продолжительности жизни указанного пациента, удлинения продолжительности жизни без прогрессирования заболевания у указанного пациента, удлинения продолжительности ответа, что приводит к статистически значимому и клинически заметному улучшению состояния подвергнутого лечению пациента при оценке по продолжительности жизни, продолжительности жизни без прогрессирования заболевания, уровню ответа или продолжительности ответа. В предпочтительном варианте осуществления изобретения указанное изобретение можно применять для повышения уровня ответа у группы пациентов.
В контексте настоящего описания для лечения рака можно применять дополнительные другие цитотоксические, химиотерапевтические или противораковые средства, или соединения или ионизирующее излучение, что повышает эффективность указанных средств (например, цитокины), в комбинации с антителом к CD20 типа I или афукозилированным антителом к CD20 и указанным ингибитором BTK для лечения рака. Указанные молекулы должны присутствовать в комбинации в количествах, эффективных для поставленных целей. Согласно одному из вариантов осуществления изобретения комбинированное лечение с использованием указанного антитела к CD20 типа I, предпочтительно ритуксимаба, или указанного афукозилированного антитела к CD20, предпочтительно афукозилированного гуманизированного антитела В-Ly1, более предпочтительно обинутузумаба, и указанного ингибитора BTK применяют без указанных дополнительных цитотоксических, химиотерапевтических или противораковых средств или соединений, повышающих эффективность указанных дополнительных средств.
Указанные дополнительные средства представляют собой, например, алкилирующие агенты или агенты, обладающие алкилирующей активностью, такие как циклофосфамид (СТХ; например, Cytoxan®), хлорамбуцил (CHL; например, leukeran®), цисплатин (CisP; например, platinol®), бусульфан (например, myleran®), мелфалан, кармустин (BCNU), стрептозотоцин, триэтиленмеламин (ТЕМ), митомицин С, и т.п.; антиметаболиты, такие как метотрексат (МТХ), этопозид (VP16; например, vepesid®), 6-меркаптопурин (6МР), 6-тиогуанин (6TG), цитарабин (Ara-С), 5-фторурацил (5-FU), капецитабин (например, Xeloda®), дакарбазин (DTIC) и т.п.; антибиотики, такие как актиномицин D, доксорубицин (DXR; например, adriamycin®), даунорубицин (дауномицин), блеомицин, митрамицин и т.п.; алкалоиды, такие как алкалоиды барвинка, такие как винкристин (VCR), винбластин и т.п.; и другие противоопухолевые агенты, такие как паклитаксел (например, taxol®) и производные паклитаксела, цитостатические агенты, глюкокортикоиды, такие как дексаметазон (DEX; например decadron®) и кортикостероиды, такие как преднизон, ингибиторы нуклеозидных ферментов, такие как гидроксимочевина, истощающие аминокислоты ферменты, такие как аспарагиназа, лейковорин и другие производные фолиевой кислоты, и аналогичные другие противоопухолевые агенты. В качестве дополнительных средств можно применять также следующие агенты: арнифостин (например, ethyol®), дактиномицин, мехлоретамин (азотный аналог горчичного газа), стрептозоцин, циклофосфамид, ломустин (CCNU), доксорубицин липо (например, doxil®), гемцитабин (например, gemzar®), даунорубицин липо (например, daunoxome®), прокарбазин, митомицин, доцетаксел (например, taxotere®), альдеслейкин, карбоплатин, оксалиплатин, кладрибин, камптотецин, СРТ 11 (иринотекан), 10-гидрокси-7-этилкамптотецин (SN38), флоксуридин, флударабин, ифосфамид, идарубицин, месну, интерферон бета, интерферон альфа, митоксантрон, топотекан, леупролид, мегестрол, мелфалан, меркаптопурин, пликамицин, митотан, пэгаспаргазу, пентостатин, пипоброман, пликамицин, тамоксифен, тенипозид, тестолактон, тиогуанин, тиотепу, урациловый аналог горчичного газа, винорелбин, хлорамбуцил. В одном из варрантов осуществления изобретения комбинированную терапию на основе афукозилированного антитела к CD20 и указанного ингибитора BTK применяют без указанных дополнительных средств.
Применение цитотоксических и противораковых средств, описанных выше, а также антипролиферативных мишеньспецифических противораковых лекарственных средств типа ингибиторов протеинкиназ, в химиотерапевтических схемах, как правило, хорошо охарактеризовано в области лечения рака, и предусмотрено в контексте настоящего описания и при их применении следует учитывать аналогичные положения касательно мониторинга толерантности и эффективности и контроля путей введения и доз с определенными корректировками. Например, фактические дозы цитотоксических агентов можно изменять в зависимости от ответа культивируемых клеток пациента, определенного с использованием методов на основе гистокультур. Как правило, дозы должны быть ниже по сравнению с количеством средства, в котором его применяют в отсутствии других дополнительных агентов.
Типичные дозы эффективного цитотоксического средства могут находиться в диапазонах, рекомендованных производителем, и с учетом ответов in vitro или ответов, полученных на созданных на животных моделях, их концентрацию или количество можно снижать на величину, составляющую примерно вплоть до одного порядка. Так, фактическая доза должна зависеть от рекомендаций лечащего врача, состояния пациента и эффективности терапевтического метода, определенного на основе чувствительности in vitro первичных культур злокачественных клеток или образца ткани из гистокультуры, или ответов, обнаруженных на соответствующих созданных на животных моделях.
В контексте настоящего изобретения в дополнение к комбинированному лечению рака, при котором происходит экспрессия CD20, на основе антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора BTK можно применять в эффективном количестве (дозе) ионизирующее излучение и/или радиофармацевтические средства. Источник излучения может быть внутренним или внешним относительно пациента, подлежащего лечению. Когда источник является внешним относительно пациента, то терапию называют наружной лучевой терапией (EBRT). Когда источник излучения является внутренним относительно пациента, то лечение обозначают как брахитерапия (ВТ). Радиоактивные атомы, которые можно применять согласно настоящему изобретению, можно выбирать из группы, включающей (но, не ограничиваясь только ими) радий, цезий-137, иридий-192, америций-241, золото-198, кобальт-57, медь-67, технеций-99, йод-123, йод-131 и индий-111. Можно также метить антитело соответствующими радиоактивными изотопами. В одном из вариантов осуществления изобретения комбинированную терапию на основе антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора BTK применяют без ионизирующего излучения.
Лучевая терапия является стандартным средством лечения для контроля нерезектабельных или неоперабельных опухолей и/или метастазов опухолей. Улучшенные результаты были получены, когда лучевую терапию объединяли с химиотерапией. Лучевая терапия основана на принципе, что высокая доза излучения, поставляемая к области-мишени, может приводить к гибели репродуктивных клеток как в опухоли, так и в здоровых тканях. Схему введения излучения, как правило, определяют в понятиях абсорбированной дозы излучения (Гр), времени и фракционирования, и ее должен тщательно подбирать онколог. Количество излучения, полученное пациентом, должно зависеть от различных обстоятельств, но двумя наиболее важными являются локализация опухоли относительно других имеющих решающее значение структур или органов в организме и степень распространения опухоли. Типичный курс лечения пациента, подвергающегося лучевой терапии, представляет собой схему лечения в течение периода времени, составляющего от 1 до 6 недель, при этом общую дозу от 10 до 80 Гр вводят пациенту в виде однократной суточной фракционированной дозы, составляющей от 1,8 до 2,0 Гр, 5 дней в неделю. В предпочтительном варианте осуществления настоящего изобретения имеет место синергизм, когда опухоли у больных людей подвергают комбинированной терапии, предлагаемой в изобретении, и излучению. Другими словами, ингибирование роста опухолей с помощью агентов, входящих в комбинацию, предлагаемую в изобретении, повышается при объединении с излучением, необязательно в сочетании с дополнительными химиотерапевтическими или противораковыми средствами. Параметры вспомогательной лучевой терапии описаны, например, в WO 99/60023.
Антитело к CD20 типа I или афукозилированные антитела к CD20 вводят пациенту с помощью известных методов с использованием внутривенного введения в виде болюса или длительной инфузии в течение определенного периода времени, с помощью внутримышечного, внутрибрюшинного, спинномозгового, подкожного, внутрисуставного, интрасиновиального или подоболочечного пути введения. В одном из вариантов осуществления изобретения антитело вводят внутривенно или подкожно.
Ингибитор BTK вводят пациенту с помощью известных методов с использованием внутривенного введения в виде болюса или длительной инфузии в течение определенного периода времени, с помощью орального, внутримышечного, внутрибрюшинного, спинномозгового, подкожного, внутрисуставного, интрасиновиального или подоболочечного пути введения. В одном из вариантов осуществления изобретения ингибитор BTK вводят внутривенно или орально.
В контексте настоящего описания понятие «фармацевтически приемлемый носитель» включает любой и все материалы, пригодные для фармацевтического введения, включая растворители, дисперсионные среды, покрытия, антибактериальные и противогрибные агенты, придающие изотоничность и замедляющие абсорбцию агенты и другие материалы и соединения, которые являются пригодными для фармацевтического введения. За исключением случая, когда они являются несовместимыми с действующим веществом, в композициях, предлагаемых в изобретении, можно применять любые общепринятые среды или агенты. В композиции можно включать также дополнительные действующие вещества.
Фармацевтические композиции:
Фармацевтические композиции можно получать обработкой предлагаемого в изобретении антитела к CD20 и/или ингибитора BTK с фармацевтически приемлемыми неорганическими или органическими носителями. В качестве носителей, например, для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул, можно применять лактозу, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Однако в зависимости от природы действующего вещества, как правило, для мягких желатиновых капсул носители не требуются. Приемлемыми носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и т.п. Приемлемыми носителями для суппозиториев являются, например, встречающиеся в естественных условиях или гидрогенизированные масла, воски, жиры, полутвердые или жидкие полиолы и т.п.
Кроме того, в состав фармацевтических композиций могут входить консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для изменения осмотического давления, буферы, маскирующие вещества или антиоксиданты. Они могут содержать также другие терапевтически эффективные субстанции.
Одним из вариантов осуществления изобретения является композиция, содержащая как указанное антитело к CD20 типа I (предпочтительно ритуксимаб) или указанное афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело B-Ly1, более предпочтительно обинутузумаб), так и указанный ингибитор BTK, для применения при лечении рака, в частности рака, при котором происходит экспрессия CD20 (предпочтительно лимфомы или лимфоцитарного лейкоза, более предпочтительно В-клеточной неходжкинской лимфомы (НХЛ)), лимфомы из клеток зоны мантии (MCL), острого лимфобластного лейкоза (ALL), хронического лимфолейкоза (CLL), В-клеточной диффузной крупноклеточной лимфомы (DLCL), лимфомы Беркитта, волосковоклеточного лейкоза, фолликулярной лимфомы, множественной миеломы, лимфомы маргинальной зоны, пост-трансплантационного лимфопролиферативного нарушения (PTLD), ассоциированной с ВИЧ лимфомы, Вальденстрема макроглобулинемии или первичной лимфомы ЦНС).
Указанная фармацевтическая композиция может содержать также один или несколько фармацевтически приемлемых носителей.
Настоящее изобретение относится также к фармацевтической композиции, которую применяют, в частности, при раке, содержащей (I) в качестве первого агента антитело к CD20 типа I (предпочтительно ритуксимаб) или афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело В-Ly1), в эффективном количестве и (II) ингибитор BTK в эффективном количестве Указанная композиция необязательно содержит фармацевтически приемлемые носители и/или эксципиенты.
Фармацевтические композиции, содержащие только антитело к CD20 типа I или афукозилированное антитело к CD20, которые применяют согласно настоящему изобретению, приготавливают для хранения путем смешения антитела, имеющего требуемую степень чистоты, необязательно в сочетании с фармацевтически приемлемыми носителями, экципиентами или стабилизаторами (Remington's Pharmaceutical Sciences, под ред. Osol А.Е., 16-е изд., 1980), в форме лиофилизированных препаративных форм или водных растворов. Пригодные носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный и буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и мета-крезол); низкомолекулярные (состоящие менее чем примерно из 10 остатков) полипептиды; белки, такие сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соли противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ).
Фармацевтические композиции ингибиторов BTK могут быть сходными с описанными для антитела к CD20 типа I или афукозилированного антитела к CD20.
Фармацевтические композиции низкомолекулярного ингибитора BTK включают композиции, пригодные для орального, назального, местного (включая трансбуккальное и подъязычное), ректального, вагинального и/или парентерального введения. Удобно, когда композиции представляют собой стандартные дозы лекарственного средства и их можно получать методами, хорошо известными в области фармации. Количество действующего вещества, которое можно объединять с носителем для получения единицы лекарственной формы, может варьироваться в зависимости от хозяина, подлежащего лечению, а также от конкретного пути введения. Количество действующего вещества, которое можно объединять с носителем для получения единицы лекарственной формы, должно, как правило, представлять собой количество ингибитора BTK, которое обеспечивает терапевтическое действие. Как правило, в случае, когда оно не составляет 100%, это количество должно составлять от примерно 1% до примерно 99% действующего вещества, предпочтительно от примерно 5% до примерено 70%, наиболее предпочтительно от примерно 10% до примерно 30%. Методы получения указанных композиций включают стадию, на которой приводят в контакт ингибитор BTK с носителем и необязательно одним или несколькими вспомогательными ингредиентами. Как правило, фармацевтические композиции ингибитора BTK получают путем однородного и тесного контакта ингибитора BTK с жидким носителем или тонкоизмельченными твердыми носителями, или с обоими типа носителей, а затем при необходимости придания формы продукту. Фармацевтические композиции, пригодные для орального введения, могут иметь форму капсул, крахмальных облаток, саше, пилюль, таблеток, лепешек (полученных с применением корригентной основы, как правило, сахарозы, гуммиарабика или трагаканта), порошков, гранул или находиться в виде раствора или суспензии в водной или неводной жидкости, или находиться в виде жидкой эмульсии типа масло-в-воде или вода-в-масле, или находиться в виде эликсира или сиропа или пастилок (полученных с использованием инертной основы, такой как желатин и глицерин, или сахарозы и гуммиарабика), и/или жидкости для полоскания рта и т.п., при этом каждая форма содержит в качестве действующего вещества ингибитор BTK в предварительно определенном количестве. Ингибитор BTK можно применять так и в виде болюса, электуария или пасты.
В одном из дополнительных вариантов осуществления изобретения антитело к CD20 типа I или афукозилированное антитело к CD20 и ингибитор BTK приготавливают в виде двух различных фармацевтических композиций.
Действующие вещества можно включать в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или в желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы для введения лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Указанные методы описаны в Remington's Pharmaceutical Sciences, под ред. Osol А.Е., 16-е изд., 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобные полимеров, содержащих антитело, указанные матрицы имеют форму изделий определенной конфигурации, например, пленок или микрокапсул. Примерами матриц с замедленным высвобождением являются сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (US 3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразложимый этиленвинилацетат, разложимые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и леупролидацетата), и поли-D-(-)-3-гидроксимасляная кислота.
Препаративные формы, предназначенные для введения in vivo, должны быть стерильными. Для этой цели можно применять фильтрацию через стерильные фильтрующие мембраны.
Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая комбинацию антитела к CD20 типа I или гуманизированного антитела B-Ly1, которое является афукозилированным с содержанием фукозы, составляющим 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, и 6-aминo-9-[(3R)-1-(2-бyтинoил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она или его соли, предназначенная для лечения рака.
Настоящее изобретение относится также в способу лечения рака, заключающемуся в том, что вводят пациенту, который нуждается в таком лечении, (I) в качестве первого агента антитело к CD20 типа I или афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело В-Ly1), в эффективном количестве, и (II) в качестве второго агента ингибитор BTK в эффективном количестве.
В одном из вариантов осуществления изобретение фукоза присутствует в количестве от 40% до 60%.
Предпочтительно рак представляет собой рак, при котором происходит экспрессия CD20.
Предпочтительно рак, при котором происходит экспрессия CD20, представляет собой лимфому или лимфоцитарный лейкоз.
Предпочтительно антитело к CD20 типа I представляет собой ритуксимаб.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой антитело к CD20 типа II.
Предпочтительно указанное антитело представляет собой гуманизированное антитело B-Ly1, представленное в настоящем описании.
Предпочтительно указанное антитело представляет собой обинутузумаб.
Предпочтительно указанный ингибитор BTK выбирают из группы, состоящей из: (1) 9-(1-акрилоил-3-азетидил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (2) 6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (4) 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (5) 6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (6) 6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-она, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она и (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она. Предпочтительно также указанный ингибитор BTK выбирают из группы оптических изомеров указанных соединений (1)-(8) и их смеси.
Предпочтительно указанный ингибитор BTK представляет собой 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль.
Предпочтительно указанная соль представляет собой гидрохлорид.
Предпочтительное указанное антитело к CD20 типа I представляет собой ритуксимаб или указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1 и указанный ингибитор BTK выбирают из группы, состоящей из: (1) 9-(1-акрилоил-3-азетидил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (2) 6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (4) 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (5) 6-амино-9-{(3S)- 1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (6) 6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-она, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она и (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она. Предпочтительно также указанный ингибитор BTK выбирают из группы оптических изомеров указанных соединений (1)-(8) и их смесей. Предпочтительно указанный ингибитор BTK представляет собой 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль, и указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
В контексте настоящего описания понятие «пациент» предпочтительно относится к человеку, который нуждается в лечении с использованием антитела к CD20 типа I или афукозилированного антитела к CD20 (например, к пациенту, страдающему раком, при котором происходит экспрессия CD20), для любой цели, и наиболее предпочтительно к человеку, который нуждается в указанном лечении рака или предракового состояния или повреждения. Однако понятие «пациент» можно относить также к животным кроме человека, предпочтительно млекопитающим, среди прочего, таким как собаки, кошки, лошади, коровы, свиньи, овцы и приматы кроме человека.
Настоящее изобретение относится также к антителу к CD20 типа I или афукозилированному антителу к CD20 с содержанием фукозы, составляющим 60% или менее, и ингибитору BTK для применения для лечения рака.
Предпочтительно указанное антитело к CD20 типа I представляет собой ритуксимаб.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1.
Предпочтительно указанное афукозилированное гуманизированное антитело B-Ly1 представляет собой обинутузумаб.
Предпочтительно указанный ингибитор BTK выбирают из группы, состоящей из: (1) 9-(1-акрилоил-3-азетидил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (2) 6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (4) 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (5) 6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (6) 6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-она, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она и (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она. Предпочтительно также указанный ингибитор BTK выбирают из группы оптических изомеров указанных соединений (1)-(8) и их смесей.
Предпочтительно указанный ингибитор BTK представляет собой 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль. Указанное соединение представлено также в виде следующей структуры:
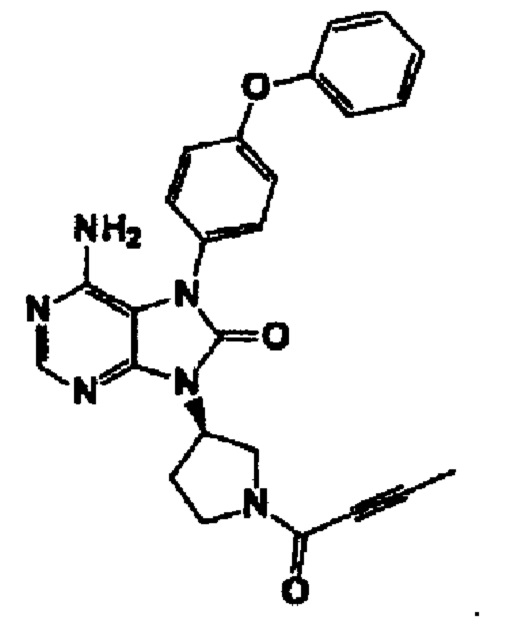
Предпочтительно указанная соль представляет собой гидрохлорид.
Предпочтительно указанное антитело к CD20 типа I представляет собой ритуксимаб или указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1, более предпочтительно обинутузумаб, и указанный ингибитор BTK выбирают из группы, состоящей из: (1) 9-(1-акрилоил-3-азетидил)-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (2) 6-амино-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (3) 9-[(1-акрилоил-4-пиперидинил)метил]-6-амино-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (4) 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (5) 6-амино-9-{(3S)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она, (6) 6-амино-7-[4-(3-хлорфенокси)фенил]-9-{(3R)-1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7,9-дигидро-8Н-пурин-8-она, (7) 6-амино-9-[1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она и (8) 6-амино-9-{1-[(2Е)-4-(диметиламино)-2-бутеноил]-3-пирролидинил}-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она. Предпочтительно также указанный ингибитор BTK выбирают из группы оптических изомеров указанных соединений (1)-(8) и их смесей. Предпочтительно указанный ингибитор BTK представляет собой 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соль, и указанный рак представляет собой рак, при котором происходит экспрессии CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
Приведенные ниже примеры, перечень последовательностей и чертежи представлены с целью пояснения настоящего изобретения, истинный объем которого представлен в прилагаемой формуле изобретения. Очевидно, что в представленные процедуры можно вносить модификации без отклонения от сущности изобретения.
Описание перечня последовательностей:
SEQ ID NO: 1 - аминокислотная последовательность вариабельной области тяжелой цепи (VH) мышиного моноклонального антитела к CD20 B-Ly1.
SEQ ID NO: 2 - аминокислотная последовательность вариабельной области легкой цепи (VL) мышиного моноклонального антитела к CD20 B-Ly1.
SEQ ID NO: 3-19 - аминокислотные последовательности вариабельной области тяжелой цепи (VH) гуманизированных антител B-Ly1 (В-НН2 - В-НН9, B-HL8 и B-HL10 - B-HL17).
SEQ ID NO: 20 - аминокислотные последовательности вариабельной области легкой цепи (VL) гуманизированного антитела B-Ly1 B-KV1.
Экспериментальные процедуры
Пример 1:
Изучение противоопухолевой эффективности ингибитора BTK в комбинации с Ат к CD20 на SCID-мышах с подкожными ксенотрансплантатами клеток линии TMD8 (ABC-DLBCL)
1. Материалы и методы
1.1. Тестируемые субстанции
Тестируемую субстанцию, гидрохлорид 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она (обозначена ниже в контексте настоящего описание как «соединение А»), хранили в запечатанных контейнерах при температуре окружающей среды, защищая от света.
GA101 (обинутузумаб, поступает в продажу под товарным знаком Gazyva® или Gazyvaro®), 500 мг, ритуксимаб (RTX, поступает в продажу под товарными знаками Rituxan® и MabThera®), 200 мг, получали о фирмы Roche Glycart AG и хранили при 4°С.
1.2. Наполнитель для субстанций
Взвешивали соединение А и суспендировали в растворе 0,5% (маc./об.) растворе метилцеллюлозы с вязкостью 400 сП (фирма Wako Pure Chemical Industries, Ltd., обозначена ниже в контексте настоящего описания как «0,5% МС»), используя ступку и пестик, с получением суспензии с концентрацией 1 мг/мл. Суспензию применяли в течение 7 дней после приготовления. Подтверждали, что суспензия была стабильной и однородной в течение 7 дней при хранении в холодильнике, в защищенном от света месте и еще в течение 24 ч при температуре окружающей среды при воздействии освещения внутри помещения.
Маточные растворы и GA101 (25 мг/мл), и ритуксимаба (10 мг/мл) выдерживали при 4°С. Перед введением мышам маточные растворы разводили 0,9% NaCl с получением концентрации 0,3, 1 и 3 мг/мл, которые применяли в опыте по оценке доз, и 0,1 и 0,3 мг/мл, которые применяли для изучения комбинаций.
1.3. Путь введения лекарственных средств
СоединениеА вводили мышам per os (РО) дважды в день посредством орального лаважа, используя одноразовую иглу для кормления через рот (фирма Fuchigami Kikai Co.), в дозе 10 мл/кг. Смесь GA101/ритуксимаб инъецировали внутривенно (IV) в дозе 10 мл/кг в каудальную вену мышей. При осуществлении всех обработок применяемые для введения объемы адаптировали с учетом веса тела каждой мыши, измеренного в максимально близкий к моменту введения момент времени. Группу, которая получала b.i.d. соединение А, и группа, которая получала наполнитель для соединения А и 0,5% МС соответственно, обрабатывали утром и днем с интервалом 8 ч или более.
2. Животные
Использовали самок мышей линии С. В- 17/1cr-SCID/SCIDJcl (фирма Clea Japan Inc., возраст которых в начале эксперименты составлял 6 недель; далее в контексте настоящего описания обозначены как «Scid-мыши»). Мышей содержали в металлических клетках по 3-5 особей на клетку и давали им акклиматизироваться в течение периода времени, составляющего примерно 1 неделю, до включения в эксперимент. Находясь в виварии заявителей, животные имели свободный доступ к твердому корму CRF-1 (фирма Oriental Yeast Co., Ltd.) и водопроводной воде (из автоматического диспенсера). Экскременты обрабатывали с помощью автоматической системы очистки. Общее состояние животных обследовали при их получении и при завершении периода акклиматизации. В эксперимент включали животных, которые не имели проблем с общим состоянием. Животных выдерживали в комнатах с контролируемой температурой: 24±2°С, влажностью: 55±15%, вентиляцией: 15±5 циклов/ч с 100% свежим наружным воздухом, в условиях освещения: циклы 12 ч темноты/света с освещением флуоресцентными лампами (свет: с 08:00 до 20:00).
3. Линии раковых клеток и условия культивирования
Линию TMD8 создавали из клеток пациента с В-клеточной диффузной крупноклеточной лимфомой (Tohda S. и др., Leuk Res., 30, 2006, сс.1385-1390). Приготавливали среду RPMI 1640 (фирма Invitrogen Corporation, далее в контексте настоящего описания обозначена как «RPMI»), содержащую 10 об.% инактивированной FBS и 1 об.% жидкости, содержащей пенициллин-стрептомицин (фирма Invitrogen Corporation), и применяли в качестве среды. Среду хранили при 5°С (допустимый диапазон от 1°С до 9°С). Клеточной суспензией инокулировали 150-миллиметровые чашки, содержащие среду, из расчета от 4 × 106 до 2,0 × 107 клеток на чашку. Планшеты инкубировали при 37°С, 5% СO2, 95% воздуха. Количество клеток подсчитывали с помощью гемоцитометра, и их жизнеспособность составляла по меньшей мере 90% в день инъекции клеток.
4. Инокуляция клеток
В день 0 клеточный дебрис суспендировали в RPMI, предварительно охлажденной на льду, с получением клеточной суспензии, содержащей 2×108 клеток/мл. Объединяли клеточную суспензию в RPMI и равный объем BD-матригеля GFR (фирма BD Biosciences) с получением клеточной суспензии, содержащей 1 × 108 клеток/мл. Ее применяли в качестве клеточной суспензии для имплантации. Затем 0,1 мл клеточной суспензии подкожно инъецировали в правую боковую область мышей под анестезией пентобарбиталом, используя иглу 25-размера (фирма Terumo Corporation).
5. Схема обработки
Когда средний размер опухолей достигал 100-200 мм3 и 300-400 мм3, мышей произвольно разделяли на группы по 8-10 особей на основе индивидуальных размеров опухолей и начинали обработку. Средний объем опухолей в каждой группе не отличался от объема опухолей в других группах (анализ средних отклонений).
6. Наблюдение за состоянием несущих ксенотрансплантаты животных
После имплантации TMD8 общее состояние всех животных регистрировали каждый день, измеряя объем опухолей.
7. Измерение диаметров опухолей
Длинную ось и короткую ось опухолей измеряли с помощью электронного кронциркуля (фирма Mitutoyo Corporation) через каждые 2 или 4 дня после имплантации TMD8 вплоть до дня конечной оценки.
8. Конечные точки и методы оценки
Первичная конечная точка представляла собой объем опухоли в день конечной оценки. Кроме того, рассчитывали степень ингибирования роста опухоли (TGI, %) в обработанных лекарственным средством группах по сравнению с группой, обработанной наполнителем. Изменение в зависимости от времени объема опухоли и веса тела относительно дня 0 использовали в качестве вторичных конечных точек. Объем опухоли рассчитывали с помощью следующей формулы.
Объем опухоли=длинная ось опухоли х (короткая ось опухоли)2 × 0,5. Объемы индивидуальных опухолей рассчитывали до первого десятичного знака.
В конце мышей умерщвляли и осуществляли аутопсию, когда опухоли достигали максимум 3000 мм3.
9. Форма представления и обработка данных
9.1. Форма представления данных
Объем опухолей и вес тела в каждой группе выражали в виде среднего значения ± квадратичная ошибка (S.E.). TGI(%) в обработанных группах рассчитывали до первого десятичного знака.
9.2. Статистический анализ
Применяли программу Microsoft Office Excel 2007 SP-1 для расчета средних значений и квадратичных ошибок и включали в таблицы и графики. Для оценки статистических критериев использовали систему EXSUS, версия 7.7.1 (фирма САС Corporation), основанную на SAS 9.2 TS2M3 (фирма SAS Institute Japan). Для сравнения объемов опухолей при монотерапии GA101 и комбинированной терапии GA101 и соединением А применяли t-критерий Стьюдента. Все статистические критерии были 2-сторонними, уровень значимости составлял 5%.
10. Результаты
Описание экспериментальных групп.
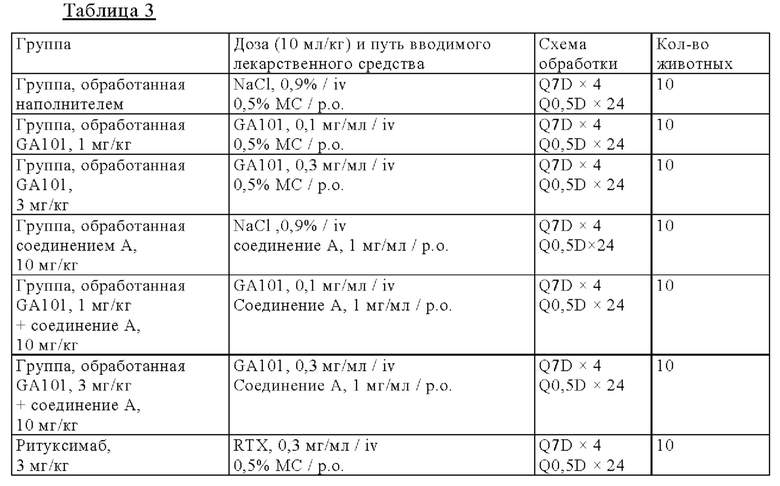
На фиг.1 продемонстрированы результаты опыта по оценке противоопухолевой активности соединения А в комбинации с GA101 на модели, полученной путем ксенотрансплантации TMD8. В D14, когда средний объем опухолей достигал 400-450 мм3, осуществляли произвольное распределение мышей на 7 групп по 10 мышей в каждой в зависимости от объема опухолей. Как продемонстрировано на фиг. 1, монотерапия GA101 обладала противоопухолевым действием. Однако в группах, подвергаемых комбинированной терапии, действие было более выраженным по сравнению с соответствующей монотерапией. Статистически значимые различия обнаружены в дни 14, 17, 21 и 24. В D35 (день 21) 4 мышей из обработанной наполнителем группы умерщвляли, поскольку объем их опухолей превышал 3000 мм3. Всех мышей умерщвляли в D38 (день 24).
В этом опыте установлено, что комбинация GA101-соединение А значимо превышала активность указанной монотерапии (статистический анализ представлен ниже).
При создании изобретения неожиданно был обнаружен регресс объемов опухолей у части особей b D 14 и 21 в группах, обработанных GA101 в дозе 3 мг/кг в комбинации с соединением А в дозе 10 мг/кг, в то время как в группе, которую подвергали монотерапии, не обнаружено полной ремиссии опухолей. Эти результаты четко демонстрируют, что комбинированная терапия может обладать более высокой эффективностью на модели запущенной опухоли.
Пример 2:
Эксперимент, описанный в примере 2, осуществляли согласно методу, описанному в примере 1, за исключением указанного для «наполнителя для субстанций» и «схемы обработки».
1. 1. Наполнитель для субстанций
Взвешивали соединение А и суспендировали в растворе 0,5% (мас./об.) растворе метилцеллюлозы с вязкостью 400 сП (фирма Wako Pure Chemical Industries, Ltd., обозначена ниже в контексте настоящего описания как «0,5% МС»), используя ступку и пестик, с получением суспензии с концентрацией 1 мг/мл (10 мг/кг). Суспензию применяли в течение 7 дней после приготовления. Подтверждали, что суспензия была стабильной и однородной в течение 7 дней при хранении в холодильнике, в защищенном от света месте и еще в течение 24 ч при температуре окружающей среды при воздействии освещения внутри помещения.
Маточные растворы и GA101 (25 мг/мл) и ритуксимаба (10 мг/мл) выдерживали при 4°С. Перед введением мышам маточные растворы разводили 0,9% NaCl с получением концентрации 0,3 мг/мл (3 мг/кг), которую применяли в этом опыте.
1.2. Схема обработки
Когда средний размер опухолей достигал 400-450 мм3, мышей произвольно разделяли на 6 групп на основе индивидуальных размеров опухолей и начинали обработку. Средний объем опухолей в каждой группе отличался от объема опухолей в других группах (анализ средних отклонений).
2. Результаты
Описание экспериментальных групп.
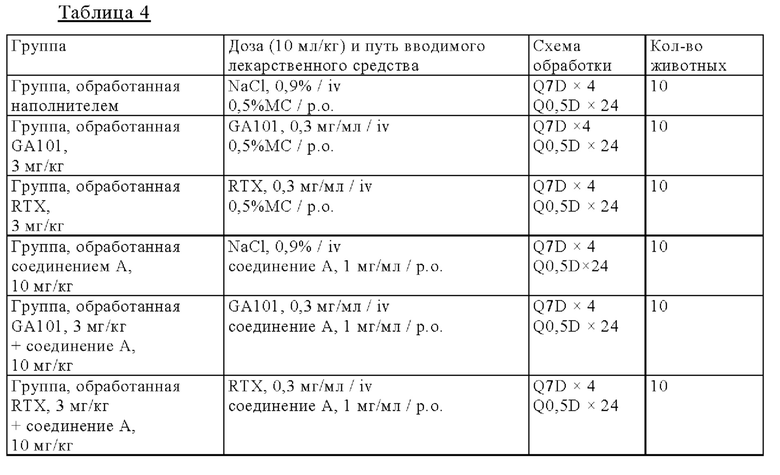
На фиг. 2 продемонстрированы результаты опыта по оценке противоопухолевой активности соединения А в комбинации с GA101/RTX на модели, полученной путем ксенотрансплантации TMD8. В D14 (день 0), когда средний объем опухолей достигал 400-450 мм3, осуществляли произвольное распределение мышей на 6 групп по 10 мышей в каждой в зависимости от объема опухолей. Как продемонстрировано на фиг. 2, каждая монотерапия обладала противоопухолевым действием. Статистически значимые различия обнаружены после дня 4 для GA101 и RTX и после дня 11 для соединения А. Кроме того, обработка соединением А в комбинации с GA101 или RTX в субоптимальной дозе, составляющей 3 мг/кг один раз в неделю, приводила к значимому ингибированию роста опухолей на модели, полученной с помощью ксенотрансплантата TMD8. Статистически значимые различия обнаружены также между группами, подвергнутыми монотерапии и комбинированной терапии с использованием соединения А, что свидетельствовало о том, что комбинация соединения А с GA101 или RTX при применении в субоптимальной дозе, обладала значимо более высокой активностью, чем соответствующие Ат или соединение А при их применении в качестве монотерапии. В D35 (день 21), 3 мышей из обработанной наполнителем группы умерщвляли, поскольку объем их опухолей превышал 3000 мм3. Всех мышей умерщвляли в D39 (день 25).
Данные об ингибировании роста опухолей (TGI) в день 0, 4, 7, 11, 14, 18 и 21 в каждой группе представлены ниже. Монотерапия на основе GA101 обладала более высокой противоопухолевой активностью по сравнению с монотерапией на основе RTX в понятиях ингибирования роста опухолей (TGI, 77,9% ср. 54,3% в день 21).
Ингибирование роста опухолей (TGI).
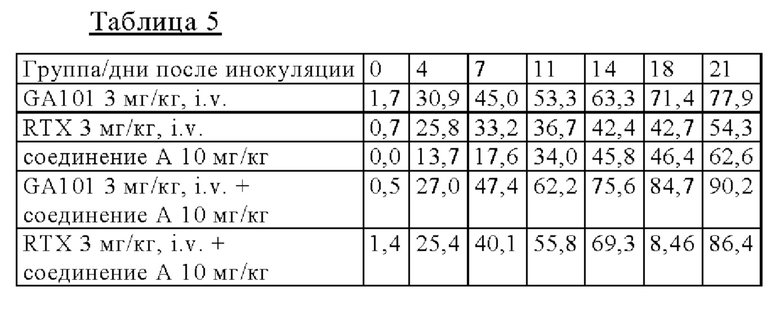
Измеряли диаметр опухолей и объем опухолей рассчитывали через каждые 3 или 4 дня после оценки группы. Данные о ингибировании роста опухолей (TGI, %) в указанной подвергнутой обработке лекарственными средствами группе, полученные с сравнении с объемом опухолей в обработанной наполнителем группе в каждый день, когда осуществляли измерения, рассчитывали и выражали до первого десятичного знака.
Пример 3:
Эксперимент, описанный в примере 3, осуществляли согласно методу, описанному в примере 1, за исключением указанных «тестируемой субстанции», «пути введения» и «схемы обработки».
1.1 Тестируемая субстанция
Применяемую для сравнения субстанцию, ибрутиниб (далее в контексте настоящего описания обозначен как «соединение Б»), хранили в запечатанных контейнерах при температуре окружающей среды, защищая от света.
1.2 Путь введения лекарственных средств
Мышей содержали на поступающем в продажу корме (CRF1, фирма Oriental Yeast Co., Ltd.), дополненным либо 0,0037 мас. % (включено в пеллеты) соединения А, либо 0,012 мас. % (включено в пеллеты) соединения Б соответственно. Доза соединения А или соединения Б соответствовала суточному потреблению, составляющему 6 или 20 мг/кг веса тела. Указанных расчет основывался на том, что среднее суточное потребление корма составляло от 160 до 180 мг/г веса тела. 1.3 Схема обработки
Две группы (наполнитель и RTX): мышей содержали на обычном корме (CRF1). Группы, обрабатываемые лекарственными средствами: мышей содержали на таком же корме, содержащем соединение А или соединение Б, после рандомизации. Ритуксимаб вводили внутривенно в дозе 3 мг/кг один раз в неделю.
2. Результаты
Описание экспериментальных групп.
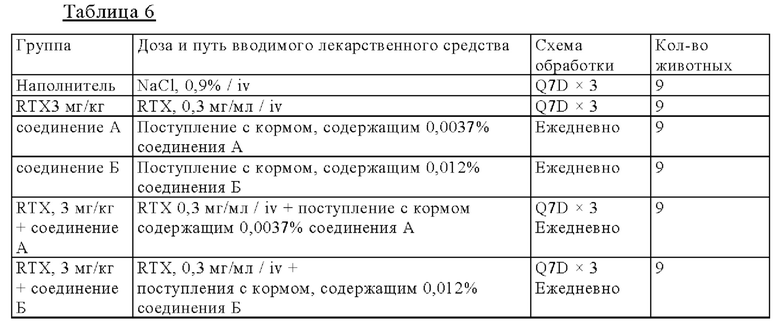
На фиг. 3 продемонстрированы результаты опыта по оценке противоопухолевой активности соединения А или соединения Б в комбинации с RTX на модели, полученной путем ксенотрансплантации TMD8. В D14 (день 0), когда средний объем опухолей достигал 450 мм3, осуществляли произвольное распределение мышей на 6 групп по 9 мышей в каждой в зависимости от объема опухолей. Как продемонстрировано на фиг. 3, каждая монотерапия обладала противоопухолевым действием. Статистически значимые различия обнаружены после дня 7 для RTX и соединения А и после дня 11 для соединения Б. Между каждым из них не обнаружено статистически значимых различий. Таким образом, противоопухолевая активность соединения А (0,0037%) оказалась сопоставимой с активностью соединения Б (0,012%). Важно отметить, что соединение А в комбинации с RTX оказалось более эффективным, чем соответствующие монотерапии на модели, полученной с помощью ксенотрансплантата TMD8. Статистически значимые различия обнаружены также между монотерапией и комбинированной терапией. Однако статистически значимые различия не обнаружены при применении соединения Б с RTX и соответствующей монотерапией, что свидетельствует о том, что соединение А в сочетании с RTX обладает синергетическим действием.
Данные о ингибировании роста опухолей (TGI) в день 0, 3, 7, 11, 14, 18 и 21 в каждой группе представлены ниже. Монотерапия на основе соединения А обладала более высокой противоопухолевой активностью по сравнению с монотерапией на основе RTX в понятиях ингибирования роста опухолей (TGI, 91,1% ср. 64,2% в день 21, р<0,001).
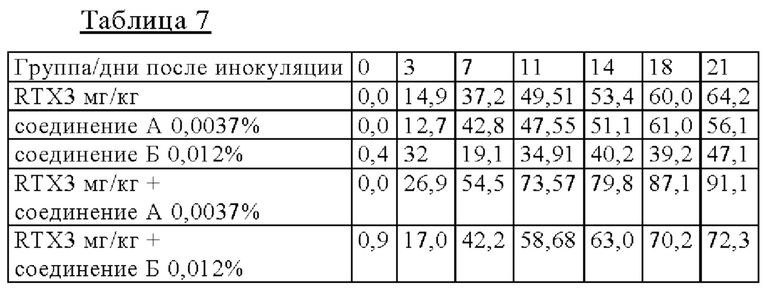
Измеряли диаметр опухолей и объем опухолей рассчитывали каждые 3 или 4 дня после оценки группы. Данные о ингибировании роста опухолей (TGI, %) в указанной подвергнутой обработке лекарственными средствами группе, полученные с сравнении с объемом опухолей в обработанной наполнителем группе в каждый день, когда осуществляли измерения, рассчитывали и выражали до первого десятичного знака.
Заключение
На основе результатов, изложенных в примере 1, примере 2 и примере 3, очевидно, что применение комбинации соединения А с GA101 или RTX может представлять собой эффективное лечение ABC-DLBCL. Продемонстрировано, что соединение Б оказывает антагонистическое действие на RTX-зависимую опосредуемую NK-клетками цитотоксичность (см. Kohrt Н.Е. и др., Blood, т. 123, 2014, сс. 1957-1960). При этом, следует отметить, что соединение А в комбинации с RTX или GA101 является более эффективным, чем соединение Б в комбинации с RTX на указанной модели, полученной с помощью ксенотрансплантации DLBCL, что позволяет предположить возможность применения указанной комбинации (соединение А+RTX или GA101) в клинической практике.
Указанные в настоящем описании, а также в прилагаемом перечне последовательностей указанные ниже последовательности являются частью настоящего изобретения:
Последовательности
SEQ ID NO: 1
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) мышиного моноклонального антитела к CD20 B-Ly1
Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys
Ala Ser Gly Tyr Ala Phe Ser Tyr Ser Trp Met Asn Trp Val Lys Leu
Arg Pro Gly Gln Gly Leu Glu Trp ILe Gly Arg Ile Phe Pro Gly Asp
Gly Asp Thr Asp Tyr Asn Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr
Ala Asp Lys Ser Ser Asn Thr Ala Tyr Met Gln Leu Thr Ser Leu Thr
Ser Val Asp Ser Ala Val Tyr Leu Cys Ala Arg Asn Val Phe Asp Gly
Tyr Trp Leu Val Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
SEQ ID NO: 2
Аминокислотная последовательность вариабельной области легкой цепи (VL) мышиного моноклонального антитела к CD20 B-Ly1
Asn Pro Val Thr Leu Gly Thr Ser Ala Ser Ile Ser Cys Arg Ser Ser
Lys Ser Leu Leu His Ser Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu
Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn
Leu Val Ser Gly Val Pro Asp Arg Phe Ser Ser Ser Gly Ser Gly Thr
Asp Phe Thr Leu Arg Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
Tyr Tyr Cys Ala Gln Asn Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly
Thr Lys Leu Glu Ile Lys Arg
SEQ ID NO: 3
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН2)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NP: 4
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН3)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Leu Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NP: 5
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН4)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
Ser Val Lys Val Ser Cys Lys Val Ser Gly Tyr Ala Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Il Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 6
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН5)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 7
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН6)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 8
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН7)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
Trp Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 9
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН8)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 10
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН9)
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NP: 11
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL8)
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NP: 12
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL10)
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 13
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL11)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 14
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL12)
Glu Val Gln Leu Val Glu Ser Gly Ala Gly Leu Val Lys Pro Gly Gly
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 15
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL13)
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Lys Pro Gly Gly
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 16
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL14)
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Lys Lys Pro Gly Gly
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 17
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL15)
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Ser
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 18
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL16)
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
Ser Leu Arg Val Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gin Ala Pro Gly Lys Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NP: 19
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL17)
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Ser
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
Thr Leu Val Thr Val Ser Ser
SEQ ID NO: 20
Аминокислотная последовательность вариабельной области легкой цепи (VL) гуманизированного антитела B-Ly1 B-KV1
Asp Ilе Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gin Ser
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
Arg Thr Val
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ С ИЗМЕНЕННОЙ КЛЕТОЧНОЙ СИГНАЛЬНОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2547931C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745707C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2834309C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2826270C2 |
| СТРАТЕГИЯ ДОЗИРОВАНИЯ, УМЕНЬШАЮЩАЯ СИНДРОМ ВЫСВОБОЖДЕНИЯ ЦИТОКИНОВ ДЛЯ БИСПЕЦИФИЧНЫХ АНТИТЕЛ К CD3/C20 | 2019 |
|
RU2799529C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ ДЛЯ АКТИВАЦИИ КЛЕТОК-НАТУРАЛЬНЫХ КИЛЛЕРОВ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2809125C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2826991C2 |
| ИНГИБИТОР ИММУНОСУПРЕССИИ, СВЯЗАННЫЙ С РАКОМ | 2018 |
|
RU2805232C2 |
| Комбинация антитела к CD19 и ингибитора тирозинкиназы брутона и их применение | 2016 |
|
RU2756010C2 |



















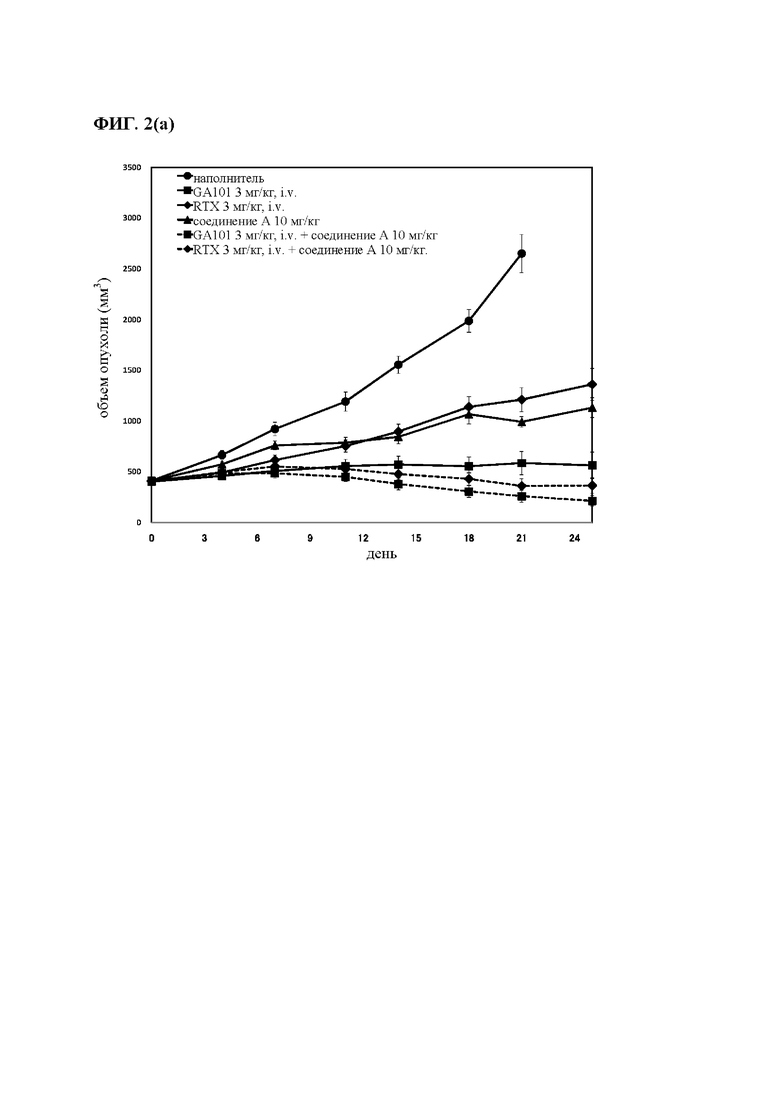
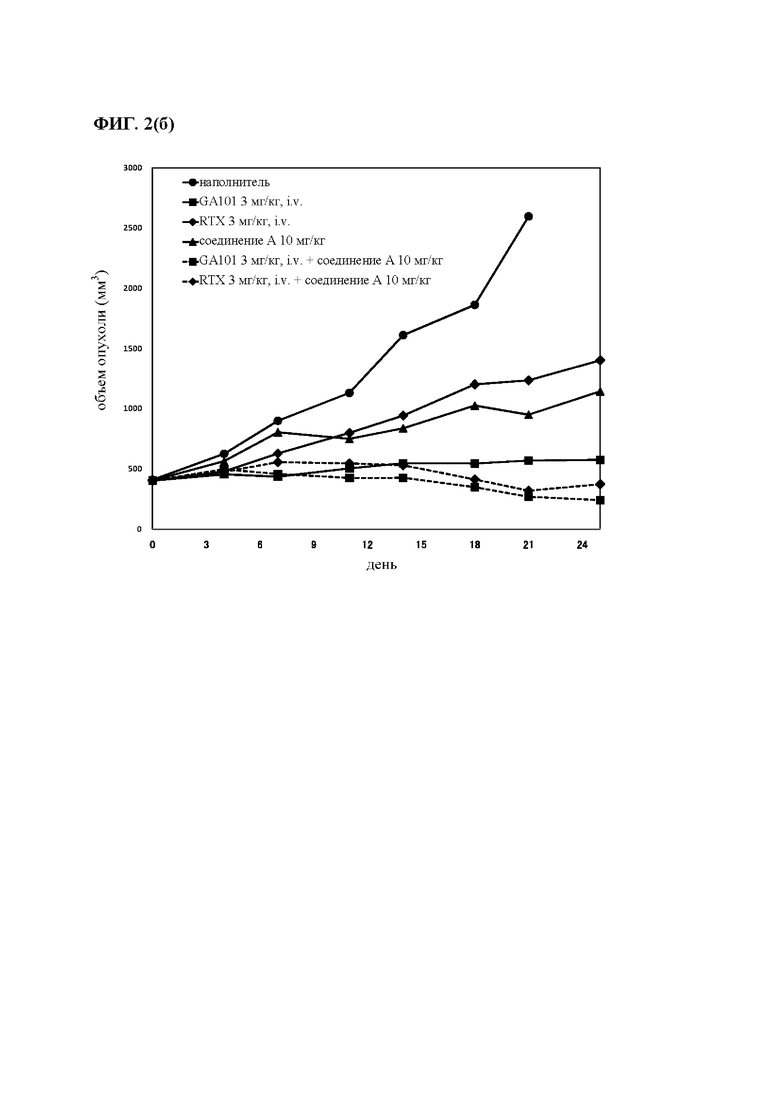
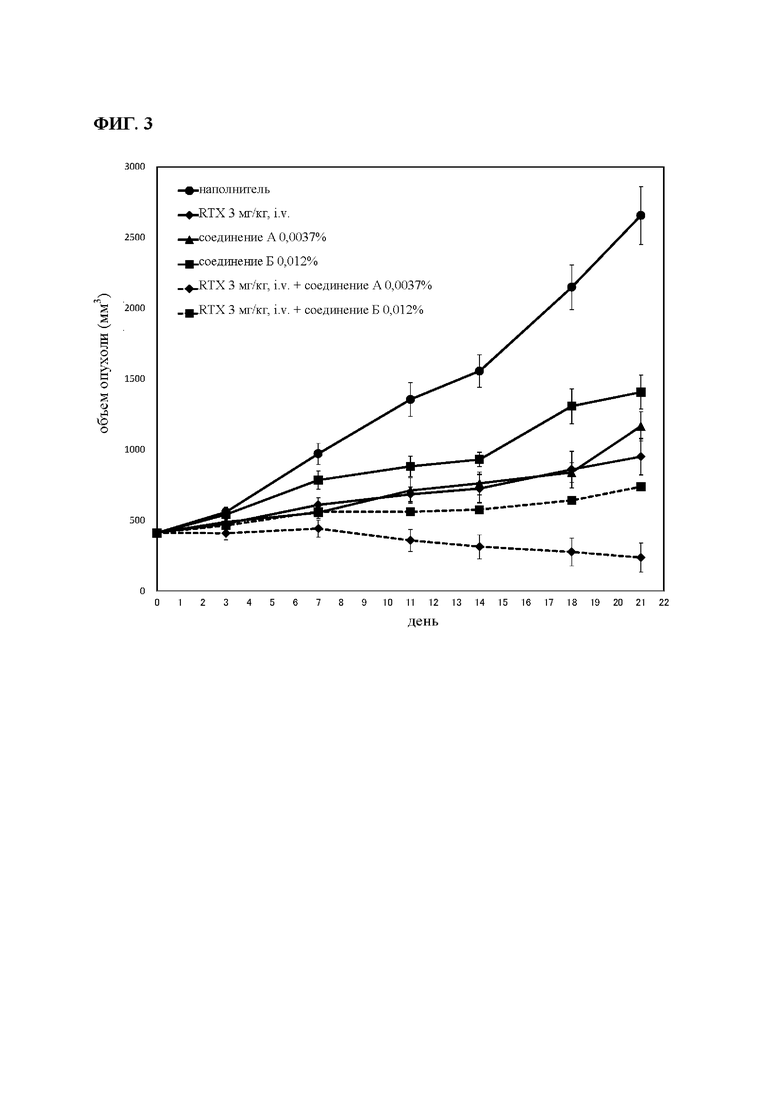
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая фармацевтическую комбинацию для лечения рака, при котором происходит экспрессия CD20 и применение фармацевтической комбинации для приготовления лекарственного средства, предназначенного для лечения рака, при котором происходит экспрессия CD20. Фармацевтическая комбинация состоит из ритуксимаба и ингибитора BTK, которым является 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соли, в синергетически эффективном количестве, где количество ритуксимаба составляет от 0,1 до 50 мг/кг, а количество 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она или его соли составляет от 1 мкг/кг до 50 мг/кг. Изобретение расширяет арсенал средств для лечения рака, при котором происходит экспрессия CD20. 2 н. и 3 з.п. ф-лы, 5 ил., 7 табл., 3 пр.
1. Фармацевтическая комбинация для лечения рака, при котором происходит экспрессия CD20, состоящая из ритуксимаба и ингибитора BTK, которым является 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-он или его соли, в синергетически эффективном количестве, где количество ритуксимаба составляет от 0,1 до 50 мг/кг, а количество 6-амино-9-[(3R)-1-(2-бутиноил)-3-пирролидинил]-7-(4-феноксифенил)-7,9-дигидро-8Н-пурин-8-она или его соли составляет от 1 мкг/кг до 50 мг/кг.
2. Фармацевтическая комбинация по п. 1, отличающаяся тем, что указанный рак, при котором происходит экспрессия CD20, представляет собой лимфому или лимфоцитарный лейкоз.
3. Применение фармацевтической комбинации по п. 1 для приготовления лекарственного средства, предназначенного для лечения рака, при котором происходит экспрессия CD20.
4. Применение по п. 3, отличающееся тем, что указанный рак, при котором происходит экспрессия CD20, представляет собой лимфому или лимфоцитарный лейкоз.
5. Применение по п. 3, отличающееся тем, что применяют одно или несколько дополнительных других цитотоксических, химиотерапевтических, или противораковых средств, или соединений, или ионизирующее излучение, что повышает действие указанных средств.
| ИНСТРУМЕНТ ДЛЯ ПРИВОДИМОГО ДВИГАТЕЛЕМ КУХОННОГО ПРИБОРА | 2012 |
|
RU2578585C2 |
| Тарантул В.З | |||
| Толковый биотехнологический словарь | |||
| Русско-английский.- М.: Языки славянских культур, 2009 | |||
| Паровозная паровая машина с изменяемым ходом поршня | 1924 |
|
SU936A1 |
| WO 2013076183 A1, 30.05.2013 | |||
| АНТИТЕЛА ЧЕЛОВЕКА К CD20 ЧЕЛОВЕКА И СПОСОБ ИХ ИСПОЛЬЗОВАНИЯ | 2008 |
|
RU2486205C2 |
| Burger J | |||
| A | |||
| et al | |||
| Тепломер | 1932 |
|
SU32765A1 |
Авторы
Даты
2024-03-20—Публикация
2021-12-01—Подача