Данная заявка претендует на приоритет предварительной заявки на патент США № 61/289083, поданной 22 декабря 2009 г., содержание которой включено в данный документ в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее раскрытие относится к композиции вакцин, в частности, ГЛУ-пептидным конъюгатам и способам создания таких композиций. Настоящее раскрытие относится также к способам снижения аномального роста клеток с использованием композиций, описанных здесь.
УРОВЕНЬ ТЕХНИКИ
В настоящее время разрабатывается лекарственное средство CDX-110 для лечения пациентов, страдающих от мультиформной глиобластомы, типа рака мозга. Значительная часть пациентов с этим заболеванием экспрессирует на поверхности раковых клеток вариант рецептора эпидермального фактора роста (EGFR, РЭФР). Этот вариант, известный как EGFRvIII, образуется из соединения мутаций, ведущих к уникальной пептидной последовательности (как правило, из 13 аминокислот) на поверхности раковых клеток. Так как этот вариант не экспрессируется на нормальных клетках, последовательность EGFRvIII является хорошей мишенью для противоракового лечения.
EGFR представляет собой белок, который был хорошо проверен в качестве мишени для терапии раковых заболеваний. В отличие от EGFR, тем не менее, EGFRvIII не присутствует в нормальных тканях, выдвигая в качестве предположения, что эта мишень будет способствовать развитию опухоль-специфической терапии для больных раком. Более того, EGFRvIII является трансформирующим онкогеном, который может прямо способствовать росту раковых клеток. Хотя экспрессия EGFRvIII первоначально была обнаружена при мультиформной глиобластоме (МГБ), наиболее распространенной и агрессивной форме рака мозга, она наблюдается также при различных других видах раковых заболеваний, таких как рак молочной железы, рак яичников, метастатический рак предстательной железы, колоректальный рак и рак головы и шеи.
CDX-110 является конъюгатом вакцины, образованным при помощи ковалентной связи EGFRvIII пептида, к которому был добавлен С-концевой цистеин с белком-носителем гемоцианином лимфы улитки (ГЛУ) (см., например, патенты США под номерами 5401828, 6224868 и WO 2007/056061). ГЛУ также действует как иммунный стимулятор для повышения иммунных ответов против EGFRvIII пептида. Химическая связь пептида EGFRvIII и ГЛУ достигается за счет использования бифункционального линкера, сульфосукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилата (сульфо-СМЦК).
Предыдущие процессы по производству CDX-110 и технология приготовления лекарственного средства имели несколько препятствий для использования в коммерческих условиях. Например, такие недостатки включали отсутствие полной растворимости линкера (СМЦК), что приводило в результате к реакции, которую трудно контролировать; неприемлемые уровни примесей внутри процесса; методологию процесса, которая не поддается масштабированию; отсутствие достаточного контроля основных биофизических характеристик, таких как соотношение пептид:ГЛУ-носитель, неоднородность размера, образование геля и частиц, и нестабильность продуктов. ГЛУ представляет собой очень большой белок-носитель, который ранее продемонстрировал большие трудности в конъюгации и составлении рецептуры в соответствии с высокими фармацевтическими стандартами. Соответственно, существует необходимость совершенствования способов производства и технологии приготовления лекарственного средства, которые обеспечивают композиции ГЛУ-пептидных конъюгатов, которые направлены на устранение этих недостатков.
СУЩНОСТИ ИЗОБРЕТЕНИЯ
Другие особенности и преимущества настоящего раскрытия будут видны из последующего подробного описания и примеров, которые не должны рассматриваться как ограничивающие. Содержание всех ссылок, фигур, записей GenBank, патентов и опубликованных патентных заявок, цитированных напротяжении всего текста настоящего описания, в точности введено в настоящее изобретение с помощью ссылки во всей их полноте.
В одном аспекте раскрытие обеспечивает композицию, включающую ГЛУ-пептидный конъюгат, калий-фосфатный буфер, дисахарид, а также поверхностно-активное вещество. В одном из вариантов воплощения калий-фосфатный буфер присутствует в концентрации в диапазоне от 5 мМ до 30 мМ, например, от 5 мМ до 20 мМ, от 5 мМ до 15 мМ, от 7 мМ до 13 мМ, от 8 мМ до 12 мМ, от 9 мМ до 11 мМ или от 9,5 мМ до 10,5 мМ. В другом варианте воплощения калий-фосфатный буфер присутствует в концентрации, равной 10 мМ. В дополнительном варианте воплощения калий-фосфатный буфер присутствует в такой концентрации, как после хранения в течение 12 недель при температуре 40°C, концентрация ГЛУ-пептидного конъюгата в указанной композиции, измеренная в мг/мл, изменилась менее чем на 15% по сравнению с исходной концентрацией.
В дополнительном варианте воплощения дисахарид в композиции представляет собой трегалозу. В одном варианте воплощения трегалоза присутствует в концентрации в диапазоне от 45 мг/мл до 150 мг/мл, от 70 мг/мл до 120 мг/мл, от 80 мг/мл до 100 мг/мл или от 85 мг/мл до 95 мг/мл. В другом варианте воплощения трегалоза присутствует в концентрации, равной 90 мг/мл. В другом варианте воплощения трегалоза присутствует в такой концентрации, как после хранения в течение 12 недель при температуре 40°C, концентрация ГЛУ-пептидного конъюгата в указанной композиции, измеренная в мг/мл, изменилась менее чем на 15% по сравнению с исходной концентрацией.
В дополнительном варианте воплощения поверхностно-активное вещество в композиции представляет собой полисорбат 80. Например, в одном варианте воплощения полисорбат 80 присутствует в концентрации в диапазоне от 0,01 мг/мл до 0,3 мг/мл, от 0,05 мг/мл до 0,25 мг/мл, от 0,1 мг/мл до 0,25 мг/мл или от 0,15 мг/мл до 0,25 мг/мл. В одном варианте воплощения полисорбат 80 присутствует в концентрации, равной 0,2 мг/мл. В дополнительном варианте воплощения полисорбат 80 присутствует в такой концентрации, как после хранения в течение 12 недель при температуре 40°C, концентрация ГЛУ-пептидного конъюгата в указанной композиции, измеренная в мг/мл, изменилась менее чем на 15% по сравнению с исходной концентрацией.
В одном аспекте настоящее раскрытие обеспечивает любые композиции, как описано выше, в которых пептид, конъюгированный с ГЛУ в ГЛУ-пептидном конъюгате, включает, состоит в основном из или состоит из SEQ ID №:1. В дополнительном варианте воплощения пептид, конъюгированный с ГЛУ в ГЛУ-пептидном конъюгате, включает, состоит в основном из или состоит из SEQ ID №:2. В одном варианте воплощения пептид, конъюгирован с ГЛУ сульфо-СМЦК линкером.
В одном аспекте настоящее раскрытие обеспечивает любую из ГЛУ-пептидных композиций, описанных здесь, в которой плотность эпитопа находится в диапазоне от 20 до 80. Например, в одном варианте воплощения плотность эпитопа находится в диапазоне от 25 до 75, от 25 до 70, от 25 до 65, от 30 до 60, от 30 до 55, от 35 до 50, от 40 до 50. В дополнительном варианте воплощения плотность эпитопа составляет 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60.
В дополнительном аспекте настоящее раскрытие обеспечивает любую из композиций, описанных здесь, в которой количество ГЛУ-пептидного конъюгата, присутствующего в форме димера находится в диапазоне от 45 масс.% до 65 масс.% от общей массы композиции, как определено посредством гель-фильтрационной хроматографии. Например, в одном варианте воплощения количество в форме димера находится в диапазоне от 50 масс.% до 60 масс.%, от 51 масс.% до 59 масс.%, от 52 масс.% до 58 масс.%, от 53 масс.% до 57 масс.% или от 54 масс.% до 56 масс.%. В дополнительном варианте воплощения количество ГЛУ-пептидного конъюгата в форме димера составляет 50 масс.%, 51 масс.%, 52 масс.%, 53 масс.%, 54 масс.%, 55 масс.%, 56 масс.%, 57 масс.%, 58 масс.%, 59 масс.% или 60 масс.% от общей массы композиции, как определено посредством гель-фильтрационной хроматографии. В дополнительном варианте воплощения количество ГЛУ-пептидного конъюгата в форме димера составляет более чем 80 масс.% по массе от общей массы композиции, как определено посредством гель-фильтрационной хроматографии. Например, в одном варианте воплощения количество в форме димера составляет более чем 85 масс.%, более чем 90 масс.%, более чем 95 масс.%, более чем 96 масс.%, более чем 97 масс.%, более чем 98 масс.% или более чем 99 масс.%.
В дополнительном аспекте настоящее раскрытие обеспечивает любую из композиций, описанных в настоящем документе, в которой, когда она подвергается гель-фильтрационной хроматографии с определением УФ-поглощения, пик, соответствующий форме димера в ГЛУ-пептидном конъюгате, составляет от 45% до 65% от общей площади под кривой. Например, в одном варианте воплощения пик, соответствующий форме димера, составляет от 50% до 60%, от 51% до 59%, от 52% до 58%, от 53% до 57% или от 54% до 56% от общей площади под кривой. В дополнительном варианте воплощения пик, соответствующий форме димера, составляет 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59% или 60% от общей площади под кривой. В дополнительном варианте воплощения пик, соответствующий форме димера, составляет более чем 80% от общей площади под кривой. Например, в одном варианте воплощения пик, соответствующий форме димера, составляет более чем 85%, более чем 90%, более чем 95%, более чем 96%, более чем 97%, более чем 98% или более чем 99% от общей площади под кривой.
В дополнительном аспекте настоящее раскрытие обеспечивает любую из композиций, описанных здесь, в которой количество ГЛУ-пептидного конъюгата, присутствующего в форме мономера, находится в диапазоне от 15 масс.% до 40 масс.% от общей массы композиции, как определено посредством гель-фильтрационной хроматографии. Например, в одном варианте воплощения форма димера находится в диапазоне от 20 масс.% до 35 масс.%, от 21 масс.% до 34 масс.%, от 22 масс.% до 33 масс.%, от 23 масс.% до 32 масс.%, от 24 масс.% до 31 масс.% или от 25 масс.% до 30 масс.%. В дополнительном варианте воплощения количество ГЛУ-пептидного конъюгата в форме мономера составляет18 масс.%, 19 масс.%, 20 масс.%, 21 масс.%, 22 масс.%, 23 масс.%, 24 масс.%, 25 масс.%, 26 масс.%, 27 масс.%, 28 масс.%, 29 масс.% или 30 масс.% от общей массы композиции, как определено посредством гель-фильтрационной хроматографии. В дополнительном варианте воплощения количество ГЛУ-пептидного конъюгата в форме мономера составляет более чем 80 масс.% от общей массы композиции, как определено посредством гель-фильтрационной хроматографии. Например, в одном варианте воплощения количество формы мономера составляет более чем 85 масс.%, более чем 90 масс.%, более чем 95 масс.%, более чем 96 масс.%, более чем 97 масс.%, более чем 98 масс.% или более чем 99 масс.%.
В дополнительном аспекте настоящее раскрытие обеспечивает любую из композиций, описанных здесь, в которой, когда она подвергается гель-фильтрационной хроматографии с определением УФ-поглощения, пик, соответствующий форме мономера ГЛУ-пептидного конъюгата, составляет от 15% до 40% от общей площади под кривой. Например, в одном варианте воплощения пик, соответствующий форме мономера, составляет от 20% до 35%, от 21% до 34%, от 22% до 33%, от 23% до 32%, от 24% до 31% или от 25% до 30% от общей площади под кривой. В дополнительном варианте воплощения пик, соответствующий форме мономера, составляет 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29% или 30% от общей площади под кривой. В дополнительном варианте воплощения пик, соответствующий форме мономера, составляет более чем 80% от общей площади под кривой. Например, в одном варианте воплощения пик, соответствующий форме мономера, составляет более чем 85%, более чем 90%, более чем 95%, более чем 96%, более чем 97%, более чем 98% или более чем 99% от общей площади под кривой.
Настоящее раскрытие дополнительно обеспечивает любую из композиций ГЛУ-пептидного конъюгата, описанную здесь, где композиция представляет собой водную фармацевтическую композицию. В одном варианте воплощения уровень pH вышеупомянутой композиции находится в диапазоне от 6 до 8. В дополнительном варианте воплощения уровень pH композиции находится в диапазоне от 6,5 до 7,5. В дополнительном варианте воплощения уровень pH композиции составляет 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4 или 7,5. В дополнительном варианте воплощения уровень pH представляет собой такое значение, как после хранения в течение 12 недель при температуре 40°C, концентрация ГЛУ-пептидного конъюгата в указанной композиции, измеренная в мг/мл, изменилась менее чем на 15% по сравнению с исходной концентрацией.
В дополнительном аспекте настоящее раскрытие обеспечивает жидкую композицию, содержащую ГЛУ-пептидный конъюгат, калий-фосфатный буфер, трегалозу и полисорбат 80, где: пептид, конъюгированный с ГЛУ, включает, состоит в основном из или состоит из SEQ ID №:1 или SEQ ID №:2; ГЛУ-пептидный конъюгат имеет плотность эпитопа в диапазоне от 30 до 65; буфер присутствует в концентрации в диапазоне от 9 мМ до 11 мМ; уровень pH композиции находится в диапазоне от 7,3 до 7,5; трегалоза присутствует в концентрации в диапазоне от 85 мг/мл до 95 мг/мл; полисорбат 80 присутствует в концентрации в диапазоне от 0,1 мг/мл до 0,3 мг/мл; и где дополнительно количество ГЛУ-пептидного конъюгата, присутствующего в форме мономера, находится в диапазоне от 18 масс.% до 35 масс.% от общей массы композиции, а количество ГЛУ-пептидного конъюгата, присутствующего в форме димера, находится в диапазоне от 50 масс.% до 65 масс.% от общей массы композиции, как определено посредством гель-фильтрационной хроматографии. Например, в одном варианте воплощения буфер присутствует в концентрации, равной 10 мМ, уровень pH композиции составляет 7,4, трегалоза присутствует в концентрации, равной 90 мг/мл, и полисорбат 80 присутствует в концентрации, равной 0,2 мг/мл. Более того, например, вышеупомянутая жидкая композиция была подготовлена путем восстановления лиофилизированной композиции при помощи воды.
Настоящее раскрытие дополнительно обеспечивает лиофилизированную композицию, включающую, состоящую в основном из или состоящую из ГЛУ-пептидного конъюгата, калий-фосфатного буфера, дисахарида и поверхностно-активного вещества. В одном варианте воплощения вышеупомянутая лиофилизированная композиция, при восстановлении при помощи воды, имеет уровень pH в диапазоне от 6 до 9. В одном варианте воплощения дисахарид представляет собой трегалозу, а поверхностно-активное вещество представляет собой полисорбат 80. В дополнительном варианте воплощения трегалоза присутствует в количестве в диапазоне от 80 мг до 110 мг на мг ГЛУ-пептидного конъюгата; и полисорбат 80 присутствует в количестве в диапазоне от 0,01 до 0,3 мг на мг ГЛУ-пептидного конъюгата. В дополнительном варианте воплощения трегалоза присутствует в количестве, равном 90 мг на мг ГЛУ-пептидного конъюгата; а полисорбат 80 присутствует в количестве, равном 0,2 мг на мг ГЛУ-пептидного конъюгата.
В одном аспекте раскрытие обеспечивает жидкую композицию, содержащую ГЛУ-EGFRvIII конъюгат, где после хранения в течение 12 недель при температуре 40°C концентрация вышеназванного конъюгата в указанной жидкой композиции, измеренная в мг/мл, изменилась менее чем на 15%, менее чем на 13%, менее чем на 11%, менее чем на 10%, менее чем на 8% или менее чем на 5% по сравнению с исходной концентрацией.
В дополнительном аспекте раскрытие обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие этап введения указанному млекопитающему любой композиции, описанной здесь. В одном варианте воплощения аномальный рост клеток является раковым. В дополнительном варианте воплощения рак представляет собой глиобластому.
В дополнительном аспекте раскрытие обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие этапы: a) смешивание любой композиции, описанной здесь, с адъювантом и b) введение указанному млекопитающему полученной в результате смеси. В дополнительном аспекте раскрытие обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие введение любой композиции, описанной здесь, в комбинации по меньшей мере с одним адъювантом. В одном варианте воплощения адъювант представляет собой гранулоцитарно-макрофагальный колониестимулирующий фактор.
Настоящее раскрытие дополнительно обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие: a) предоставление любой из лиофилизированных композиций, описанных здесь, b) добавление воды в лиофилизированную композицию для того, чтобы обеспечить восстановленную композицию и c) введение указанному млекопитающему восстановленной композиции.
Настоящее раскрытие дополнительно обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие: a) предоставление любой из лиофилизированных композиций, описанных здесь, b) добавление воды в лиофилизированную композицию для того, чтобы обеспечить восстановленную композицию, c) смешивание восстановленной композиции с адъювантной композицией и d) введение указанному млекопитающему полученной в результате смеси. В одном варианте воплощения указанный адъювант представляет собой гранулоцитарно-макрофагальный колониестимулирующий фактор.
Настоящее раскрытие дополнительно обеспечивает использование любой из композиций, описанных здесь, в производстве лекарственного средства для лечения аномального роста клеток у млекопитающих.
Настоящее раскрытие дополнительно обеспечивает способы получения лиофилизированной композиции, включающей ГЛУ-пептидный конъюгат, включающий подвергание любой из жидких композиций, описанных здесь, воздействию температуры равной -20°C или ниже, -30°C или ниже, -40°C или ниже, -50°C или ниже или-60°C или ниже, и воздействию условий вакуума.
Настоящее раскрытие дополнительно обеспечивает способы получения жидких композиций, включающие добавление воды к любой из лиофилизированных композиций, описанных здесь.
Настоящее раскрытие дополнительно обеспечивает способы приготовления ГЛУ-EGFRvIII конъюгата, включающие: a) объединение ГЛУ с линкером и предоставление возможности ГЛУ и линкеру взаимодействовать на протяжении периода времени в диапазоне от 30 до 60 минут, от 35 до 55 минут, от 40 до 50 минут или 45 минут; и b) добавление пептида, включающего, состоящего в основном из или состоящего из SEQ ID №:1 или SEQ ID №:2, к активированному продукту ГЛУ, полученному в результате этапа a), чтобы предоставить ГЛУ-EGFRvIII конъюгат. В одном варианте воплощения этап b) осуществляется в системе фильтрации в тангенциальном потоке. В дополнительном варианте воплощения скорость течения ретентата находится в диапазоне от 10 мл/мин до 1000 мл/мин, например, от 50 мл/мин до 500 мл/мин, например, от 100 мл/мин до 500 мл/мин, и далее, например, 50 мл/мин, 100 мл/мин, 150 мл/мин, 200 мл/мин, 250 мл/мин, 300 мл/мин, 350 мл/мин, 400 мл/мин, 450 мл/мин или 500 мл/мин.
В одном варианте воплощения линкер объединяют с ГЛУ в молярном соотношении линкер:ГЛУ, которое находится в диапазоне от 75:1 до 325:1. Например, в одном варианте воплощения вышеупомянутое молярное соотношение линкер:ГЛУ находится в диапазоне от 100:1 до 300:1, от 150:1 до 250:1 или от 175:1 до 225:1. Например, в одном варианте воплощения вышеупомянутое молярное соотношение линкер:ГЛУ составляет 175:1, 180:1, 185:1, 190:1, 195:1, 200:1, 205:1, 210:1, 215:1, 220:1 или 225:1.
Настоящее раскрытие дополнительно обеспечивает жидкую композицию, содержащую ГЛУ-EGFRvIII-конъюгат, где после хранения в течение 26 недель при температуре 5°C число частиц по размеру больше или равных 10 мкм, как измерено согласно USP <788>, увеличилось менее чем на1000%, менее чем на 750%, менее чем на 500%, менее чем на 400%, менее чем на 300%, менее чем на 200% или менее чем на 100%.
Настоящее раскрытие дополнительно обеспечивает жидкую композицию, содержащую ГЛУ-EGFRvIII-конъюгат, где после хранения в течение 26 недель при температуре 5°C число частиц по размеру больше или равных 25 мкм, как измерено согласно USP <788>, увеличилось менее чем на 1000%, менее чем на 750%, менее чем на 500%, менее чем на 400%, менее чем на 300%, менее чем на 200% или менее чем на 100%.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 демонстрирует общую схему процесса одного из примеров проведения реакции конъюгации ГЛУ-пептида.
Фигура 2A демонстрирует краткое изложение ключевых рабочих параметров, используемых в ходе реакции активации в различных экспериментах поперечного потока.
Фигура 2B демонстрирует краткое изложение ключевых рабочих параметров, используемых в ходе этапа начальной диафильтрации в различных экспериментах поперечного потока.
Фигура 2C демонстрирует краткое изложение ключевых рабочих параметров, используемых в ходе этапа конъюгации в различных экспериментах поперечного потока.
Фигуры 3A, 3B, 3C и 3D демонстрируют краткое изложение аналитических результатов для экспериментов фильтрации в поперечном потоке.
Фигуры 4A, 4B и 4C демонстрируют краткое изложение реакционных параметров, которые использовались в различных экспериментах.
Фигура 5 демонстрирует репрезентативную ГФХ ВЭЖХ хроматограмму для конъюгата CDX-110 ГЛУ-EGFRvIII, показывающую примерное время удержания пяти пиков.
Фигура 6 демонстрирует график, показывающий влияние соотношения сульфо-СМЦК на плотность эпитопа.
Фигура 7 демонстрирует график, показывающий влияние времени активации на плотность эпитопа.
Фигуры 8A (димер) и 8B (мономер) демонстрируют графики, показывающие влияние соотношения сульфо-СМЦК на гетерогенность ГФХ.
Фигуры 9A (димер) и 9B (мономер) демонстрируют графики, показывающие влияние времени активации на гетерогенность ГФХ.
Фигура 10 демонстрирует сравнение плотности эпитопа при использовании суспензии линкера и растворенного в ДМСО линкера.
Фигуры 11A (димер) и 11B (мономер) демонстрируют графики, показывающие влияние ДМСО на профиль ГФХ реакции активации.
Фигуры 12A и 12B демонстрируют статистический анализ результатов плотности эпитопа, показывающий взаимодействие соотношения сульфо-СМЦК:ГЛУ и концентрации белка.
Фигуры 13A и 13B демонстрируют статистический анализ результатов димера, показывающий взаимодействие соотношения сульфо-СМЦК:ГЛУ и концентрации белка.
Фигура 14 демонстрирует краткое изложение реакционных параметров, используемых для оригинального и оптимизированного процесса приготовления CDX-110.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее раскрытие основывается на открытии новых композиций ГЛУ-пептидных конъюгатов, которые обеспечивают полезные свойства, такие как снижение образования частиц и геля и повышение стабильности конъюгата. Композиции, описанные здесь, могут быть лиофилизированы и восстановлены, обеспечивая дополнительные преимущества для транспортировки и длительного хранения. Такие полезные свойства и другие, которые будут очевидны специалистам в данной области техники, описаны здесь более подробно. Более того, в соответствии с настоящим раскрытием было разработано улучшение процессов для производства вакцин ГЛУ-EGFRvIII-пептидного конъюгата. Новые процессы, описанные здесь, обеспечивают оптимальные условия реакции, которые подчиняются крупномасштабным производственным протоколам и которые в результате приводят к улучшению профиля чистоты и контроля основных биофизических характеристик, таких как соотношение пептидов/ГЛУ и гетерогенность размера.
Для того, чтобы настоящее раскрытие могло быть более понятным, некоторые термины вначале определены. Дополнительные определения приведены на протяжении всего текста подробного описания изобретения.
Если здесь не оговорено иначе, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понимаются обычными специалистами в данной области. Кроме того, если по контексту не требуется иначе, термины в единственном числе должны включать формы во множественном числе, а термины во множественном числе должны включать формы единственного числа. Как правило, использованная номенклатура и описанные здесь технические приемы, касающиеся выращивания клеток и ткани, молекулярной биологии, иммунологии, микробиологии, генетики и химии, и гибридизации белков и нуклеиновых кислот, являются общеизвестными и обычно используемыми в данной области техники.
Способы и технические приемы, согласно настоящему изобретению, обычно выполняются в соответствии со стандартными способами, общеизвестными в данной области и как описано в различных общих и более специфических ссылках, которые цитируются и рассматриваются в настоящем описании, если не указано иначе. Такие ссылки включают, например, Sambrook and Russell, Molecular Cloning, A Laboratory Approach, Cold Spring Harbor Press, Cold Spring Harbor, NY (2001), Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, NY (2002), and Harlow and Lane Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1990). Ферментативные реакции и технические приемы по очистке проводят согласно инструкциям производителя, как обычно выполняется в данной области или как описано здесь. Использованная номенклатура, лабораторные методики и технические приемы, касающиеся аналитической химии, синтетической органической химии и медицинской, и фармацевтической химии, описанные здесь, являются общеизвестными и обычно используемыми в данной области техники. Стандартные способы применяются для химического синтеза, химического анализа, фармацевтического изготовления, разработки состава и доставки, и лечения пациентов.
Как используется здесь, каждый из следующих терминов имеет значение, связанное с ним в этом разделе.
Неопределенные артикли и формы единственного числа используются в документе для обозначения одного или нескольких (то есть по меньшей мере одного) грамматического объекта статьи. К примеру, "элемент" означает один элемент или более одного элемента.
Используемые здесь двадцать главных аминокислот и их аббревиатуры имеют общепринятое использование. См. публикацию Immunology - A Synthesis (2nd Edition, E.S. Golub and D.R Gren, Eds., Sinauer Associates, Sunderland, Mass. (1991)).
Используемый в данном описании термин "ГЛУ" относится к белку гемоцианину лимфы улитки, состоящему из множества субъединиц, переносящему кислород металлопротеину, обнаруженному в гемолимфе улиток (Megathura crenulata), или к его фрагменту или субъединице.
Используемый здесь термин "ГЛУ-пептидный конъюгат" относится к ГЛУ белку или к его фрагменту или субъединице, который ковалентно связан с полипептидом, не имеющим отношения к ГЛУ. Такая ковалентная связь, как правило, достигается за счет использования соответствующего химического линкера.
Используемый здесь термин "плотность эпитопа", со ссылкой на ГЛУ-пептидный конъюгат, относится к среднему число пептидов, которые связаны с каждой субъединицей ГЛУ. Плотность эпитопа можно определить с помощью анализа аминокислотной композиции, как описано здесь.
Термин "дисахарид", используемый здесь, относится к соединению, которое после гидролиза дает две моносахаридные молекулы (например, глюкозы, фруктозы, маннозы и др.). Подходящие дисахариды включают, не ограничиваясь этим, сахарозу, лактозу и трегалозу.
Используемый здесь термин "поверхностно-активное вещество" относится к вспомогательному веществу, которое может изменять поверхностное натяжение жидкой композиции ГЛУ-пептидного конъюгата. Как указывается далее здесь, примеры поверхностно-активных веществ включают, не ограничиваясь этим, полисорбатные поверхностно-активные вещества, полоксамеры (например, полоксамер 18 и 407), тритонные поверхностно-активные вещества, такие как Тритон Х-100®, а также полисорбатные поверхностно-активные вещества, такие как Твин 20® и Твин 80®, среди многих других, которые известны специалистам в данной области техники.
Термины "лиофилизация", "лиофилизированный" и "сублимированный" относятся к процессу, при помощи которого материал, который должен быть высушен, сначала замораживают, а затем удаляют лед или замороженный растворитель при помощи сублимации в вакуумной среде.
Используемый здесь термин "EGFRvIII" относится к пептиду, который является представителем варианта мутанта III, который присутствует в рецепторе эпидермального фактора роста РЭФР, и обычно включает в себя или состоит из аминокислотной последовательности, изложенной как SEQ ID №:1 или 2 или по меньшей мере включает аминокислотную последовательность "Lys-Lys-Gly-Asn-Tyr".
Термин "аномальный рост клеток", используемый в данном описании, если не указано иное, относится к росту клеток, который является независимым от нормальных регуляторных механизмов (например, потеря контактного ингибирования), в том числе к аномальному росту нормальных клеток и росту аномальных клеток. Этот термин включает, не ограничиваясь этим, аномальный рост: опухолевых клеток (опухолей), например, мезотелиомы, гепатобилиарной опухоли (печеночной и желчевыводящих протоков), первичных или вторичных опухолей ЦНС (центральной нервной системы), первичных или вторичных опухолей головного мозга, рака легких (немелкоклеточного рака легких (НМРЛ) и мелкоклеточного рака легких (МРЛ)), рака костей, рака поджелудочной железы, рака кожи, рака головы и шеи, кожной или внутриглазной меланомы, рака яичников, рака толстой кишки, рака прямой кишки, рака анальной области, рака желудка, желудочно-кишечного тракта (желудка, толстой кишки, и двенадцатиперстной кишки), рака молочной железы, рака матки, рака фаллопиевых труб, рака эндометрия, рака шейки матки, рака влагалища, рака вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, рака эндокринной системы, рака щитовидной железы, рака паращитовидных желез, рака надпочечников, саркомы мягких тканей, рака уретры, рака полового члена, рака предстательной железы, тестикулярного рака, хронического или острого лейкоза, хронического миелоидного лейкоза, лимфоцитарной лимфомы, рака мочевого пузыря, рака почек или мочеточников, почечно-клеточной карциномы, рака почечной лоханки, опухолей центральной нервной системы (ЦНС), первичной лимфомы ЦНС, неходжкинской лимфомы, опухолей спинальной оси, глиомы ствола головного мозга, аденомы гипофиза, рака коры надпочечников, рака желчного пузыря, множественной миеломы, холангиокарциномы, фибросаркомы, нейробластомы, ретинобластомы или комбинации из одного или более вышеназванных видов рака.
Используемый здесь термин "лечебный" или "лечение" относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам, где есть объект для предотвращения или замедления (уменьшения) целевого патологического состояния или состояний. Те, кто нуждаются в лечении, включают тех, у кого уже существует указанное состояние, а также тех, которые предрасположены иметь это состояние, или тех, у кого такое состояние должно быть предотвращено.
Термин "терапевтически эффективное количество" композиции относится к количеству, которое является эффективным в дозировках и в течение периодов времени, необходимых для достижения желаемого терапевтического результата, который включает лечение или профилактическое предупреждение аномального роста клеток. Следует отметить, что значения дозы могут изменяться в зависимости от тяжести состояния, которое должно быть облегчено. В дальнейшем необходимо понимать, что для любого конкретного субъекта, конкретные схемы дозирования должны быть скорректированы с течением времени, в зависимости от индивидуальных потребностей и профессиональной оценки лица, которое вводит или осуществляет контроль за введением композиций, и что диапазоны доз, изложенные здесь, являются только иллюстративными и не предназначены для ограничения объема или осуществления заявленной композиции. Аналогично терапевтически эффективное количество композиции может варьироваться в зависимости от таких факторов как состояние заболевания, возраст, пол и масса индивидуума, способности терапевтической композиции вызвать желаемый ответ у индивидуума и желаемого пути введения. Терапевтически эффективное количество также является таким, в котором терапевтически благоприятное воздействие превосходит любые токсичные или нежелательные эффекты композиции.
Термин "фармацевтическая композиция" относится к лекарственным средствам, которые находятся в такой форме, которая позволяет биологической активности действующих веществ быть эффективной.
"Фармацевтически приемлемыми вспомогательными веществами" (транспортными средствами, добавками) являются те, которые могут быть введены разумно (т.е. безопасно) субъекту, чтобы обеспечить эффективную дозу применяемого активного ингредиента. Термин "вспомогательное вещество" или "носитель", используемый здесь, относится к инертному веществу, которое обычно используется в качестве растворителя, транспортного средства, консерванта, связующего вещества или стабилизирующего вещества для лекарственных средств. Используемый здесь термин "разбавитель" относится к фармацевтически приемлемому (безопасному и нетоксичному при введении человеку) растворителю и является пригодным для приготовления жидких лекарственных форм, описанных здесь. Примерные растворители включают, не ограничиваясь этим, стерильную воду и бактериостатическую воду для инъекций (БВДИ).
Если не указано иное, концентрации и значения рН различных компонентов композиции, описанные здесь, представляют собой концентрации в условиях окружающей среды (т. е. при температуре 25°С и атмосферном давлении). Когда концентрации и значения рН находятся в диапазонах, перечисленных здесь, такие диапазоны, которые занимают промежуточное положение в подробно процитированных диапазонах, также предназначены для того, чтобы быть частью настоящего раскрытия. Например, диапазоны значений, использующие комбинацию любого из значений как верхнего, так и/или нижнего пределов предназначены для включения.
В соответствии с настоящим раскрытием было обнаружено, что для ГЛУ-пептидного конъюгата формирование частиц и/или геля может быть уменьшено, и стабильность конъюгата может быть улучшена путем объединения конъюгата с калий-фосфатным буфером, дисахаридом, таким как трегалоза, и поверхностно-активным веществом, таким как Твин 80. Более того, было обнаружено, что когда эти компоненты используются в определенных количествах, становится возможной лиофилизация (с последующим восстановлением в виде водного раствора) и одновременная минимизация формирования частиц и геля, и поддержание стабильности и биофизических характеристик конъюгата.
Не желая быть связанными какой-либо конкретной теорией, предполагается, что композиции настоящего раскрытия способствуют повышению стабильности и уменьшению формирования твердых частиц и/или геля ГЛУ-пептидных конъюгатов путем уменьшения частоты одного или нескольких из перечисленного: ГЛУ-пептидной агрегации, фрагментации, окисления, нестабильности замораживания/оттаивания, нестабильности, связанной с доставкой или транспортировкой из одного места в другое, изменения цвета и/или деамидирования. Таким образом, настоящее раскрытие обеспечивает композиции ГЛУ-пептидного конъюгата, обладающие улучшенной химической и/или физической стабильностью по сравнению с ранее раскрытыми композициями.
Таким образом, в некоторых аспектах настоящее раскрытие обеспечивает композицию, включающую ГЛУ-пептидный конъюгат, калий-фосфатный буфер, дисахарид, а также поверхностно-активное вещество. В других аспектах вышеупомянутая композиция может включать в себя дополнительные фармацевтически приемлемые вспомогательные вещества, в том числе, но не ограничиваясь этим, буферы, соли, антиоксиданты, вещества для тоничности, поверхностно-активные вещества и их смеси. Таким образом, данное раскрытие предлагает новые композиции для ГЛУ-пептидных конъюгатов.
ГЛУ-пептидные конъюгаты
ГЛУ представляет собой комплексный мультимерный белок, который может быть использован в качестве носителя для антигенных пептидов. Такие пептиды могут быть конъюгированными с ГЛУ, а полученный в результате ГЛУ-пептидный конъюгат может быть использован в качестве вакцины для стимулирования иммунного ответа, направленного на антигенный пептид.
В одном аспекте раскрытия антигенный пептид конъюгирован с ГЛУ путем химического поперечного сшивания, обычно с использованием гетеробифункционального поперечносшивающего линкера. Несколько гетеро-бифункциональных поперечно сшивающих линкеров известны в данной области техники. В некоторых вариантах воплощения гетеро-бифункциональный поперечно сшивающий линкер содержит функциональную группу, которая может реагировать с первыми сайтами прикрепления, то есть с боковой цепью аминогруппы остатков лизина ГЛУ, и дополнительные функциональные группы, которые могут реагировать с предпочтительным вторым сайтом присоединения, т. е. остатком цистеина, сплавленным с антигенным пептидом и, необязательно, также подготовленным доступным для реакции посредством преобразования. Первый шаг процедуры, как правило, называемый дериватизация, является реакцией ГЛУ с поперечносшивающим линкером. Продуктом этой реакции является активированный ГЛУ, также называемый активированным носителем. На втором этапе непрореагировавший поперечносшивающий линкер удаляется с помощью стандартных методов, таких как гель-фильтрация или диализ. На третьем этапе антигенный пептид взаимодействует с активированным ГЛУ, и этот этап, как правило, называют соединяющим этапом. Непрореагировавший антигенный пептид может быть дополнительно удален на четвертом этапе, например, путем диализа. Несколько гетеро-бифункциональных поперечносшивающих линкеров известны в данной области техники. Они включают поперечносшивающие линкеры, такие как СМПГ, сульфо-МБС, сульфо-ЕМКС, сульфо-ГММС, сульфо-СИАБ, сульфо-СМФБ, сульфо-СМЦК, СВСБ, СИА и другие кросс-линкеры, коммерчески доступные, например, в компании Pierce Chemical Company (Rockford, IL, USA) и обладающие одной функциональной группой, реагирующей с аминогруппами и одной функциональной группой, реагирующей с остатками цистеина. Все вышеупомянутые перекрестносшивающие линкеры приводят к образованию тиоэфирной связи.
Один из примеров ГЛУ-пептидного конъюгата включает пептид, известный как EGFRvIII (SEQ ID №:1), который является химически конъюгированным с поверхностью ГЛУ-белка. Этот пептид EGFRvIII содержит тринадцать аминокислот типа III-вариантной формы рецептора эпидермального фактора роста (EGFRvIII) (см., например, патент США № 5401828). Пептид EGFRvIII может быть связан с первичными аминогруппами (например, на боковых цепях Lys) на поверхности ГЛУ путем включения Cys-остатка на N- или С-конец пептида (см., например, SEQ ID №№:2 или 3), а затем с помощью сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (сульфо-СМЦК) в качестве линкера. Таким образом, типичная реакция связывания может осуществляться так, как показано ниже на схеме 1.
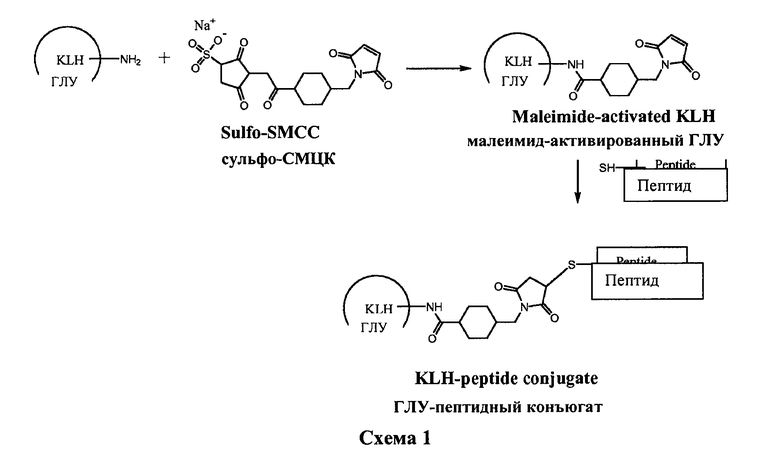
Специалисты в данной области техники распознают соответствующие условия реакции для достижения конъюгации согласно схемы 1. Например, первым этапом на вышеприведенной схеме 1 (реакция активации) является тот, где ГЛУ, буфер, вода и линкер смешиваются вместе. Этой реакции активации может быть затем предоставлена возможность продолжаться в течение приблизительно 45±5 минут. В конце времени реакции смесь реакции активации может быть разбавлена и перенесена в соответствующую систему фильтрации для того, чтобы удалить излишки линкера и связанные с линкером примеси. Затем вводят пептиды, предварительно растворенные в соответствующем буфере и предоставляют возможность реакции конъюгации продолжаться на протяжении периода времени от 2 до 3 часов. По окончании времени процесса конъюгации может быть выполнена вторая операция фильтрации для того, чтобы удалить излишки пептида и связанных с пептидом примесей и буферизировать обмен в соответствующем окончательном буфере. Дальнейшая технология может включать в себя регулирование концентрации путем разбавления, добавления вспомогательных веществ, окончательной фильтрации и упаковки. Фигура 1 представляет общую схему одного примера того, как этот процесс может быть осуществлен.
Число пептидов на субъединицу ГЛУ (также называемая здесь "плотность эпитопа") будет зависеть от конкретных условий реакции, но обычно находится в диапазоне от приблизительно 30 пептидов до приблизительно 100 пептидов на молекулу ГЛУ. Эта плотность эпитопа может быть измерена путем сравнения общей аминокислотной композиции между конъюгированным и неконъюгированным ГЛУ, как описано здесь. Профиль распределения по размерам для ГЛУ-пептидных конъюгатов, таких как ГЛУ-EGFRvIII конъюгаты, может включать мономеры, а также многомерные формы, такие как димеры, тримеры и т. д. В зависимости от условий проведения реакции, этот профиль размеров может варьировать и может быть измерен при помощи аналитических способов, таких как гель-фильтрационная хроматография (ГФХ).
Там, где пептид, используемый в приведенной выше схеме конъюгации, представляет собой EGFRvIII-пептид (как указано в SEQ ID №№:2 или 3), полученный в результате ГЛУ-конъюгат называют ГЛУ-EGFRvIII-конъюгатом. Оптимизированный процесс получения ГЛУ-EGFRvIII-конъюгата был разработан в целях устранения недостатков исходного процесса, сохраняя при этом значительную сопоставимость с партиями лекарственных веществ, которые уже были в клинике. Ключевыми аналитическими признаками, которые использовали для технологического развития, были беспримесность, определяемая при помощи анионообменной (АО) и обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ), распределение молекулярного размера, как измерено при помощи ГФХ ВЭЖХ, и плотность эпитопа. Критерии для оптимизации процесса включают сохранение или улучшение беспримесности лекарственного вещества и получение профиля распределения по размерам и плотности эпитопа в пределах желаемого диапазона.
Антигенные пептиды
Полипептиды, которые используются для конъюгации с ГЛУ, могут быть получены из природных источников и выделены от млекопитающих, таких как, например, человек, примат, кошка, собака, лошадь, мышь или крыса. Полипептиды раскрытия, таким образом, могут быть выделены из клеточных или тканевых источников с использованием стандартных способов очистки белков.
Альтернативно полипептиды могут быть синтезированы химическим путем или могут производиться с использованием техник рекомбинантной ДНК. Например, полипептид раскрытия (например, те, которые показаны, как SEQ ID №№: 1-3) может быть синтезирован при помощи твердофазных процедур, хорошо известных в данной области техники. Подходящий синтез может осуществляться за счет использования "T-boc" или "F-moc" процедур. Циклические пептиды могут быть синтезированы твердофазными способами, использующими хорошо известную "F-moc" процедуру и полиамидную смолу в полностью автоматизированном аппарате. Альтернативно специалисты в данной области техники будут знать необходимые лабораторные процедуры для выполнения процесса вручную. Способы и процедуры для твердофазного синтеза описаны в работах Solid Phase Peptide Synthesis: A Practical Approach by E. Atherton and R. C. Sheppard, published by IRL at Oxford University Press (1989) и Methods in Molecular Biology, Vol. 35: Peptide Synthesis Protocols (ed. M. W. Pennington and B. M. Dunn), chapter 7, pp. 91-171 by D. Andreau et al.
Как вариант, полинуклеотид, кодирующий полипептид раскрытия, может быть введен в вектор экспрессии, который может быть экспрессирован в подходящей системе экспрессии с помощью способов, хорошо известных в данной области техники, с последующим выделением или очисткой экспрессированного полипептида, представляющего интерес. Различные системы экспрессии - бактериальные, дрожжевые, растительные, млекопитающих и насекомых - доступны в данной области техники, и любая такая система экспрессии может быть использована. Необязательно полинуклеотид, кодирующий полипептид раскрытия, может быть транслирован в бесклеточную систему трансляции.
Гемоцианин лимфы улитки
Специалисты в этой области техники распознают ГЛУ как благотворный носитель антигенных пептидов, благодаря его способности повышать иммунный ответ из-за своего большого размера и различных эпитопов (см., например. Harris et al., Micron 30(6):597-623 (1999)). ГЛУ, как правило, получают непосредственно путем очистки из лимфы улиток и он коммерчески доступен из нескольких источников (например, от компании Thermo Scientific, Biosyn).
Приготовление композиций ГЛУ-пептидного конъюгата
ГЛУ-пептидные конъюгаты настоящего раскрытия, как правило, составлены как фармацевтические композиции для парентерального введения субъекту. В одном варианте воплощения композиция представляет собой жидкую композицию. В другом варианте воплощения композиция представляет собой лиофилизированную композицию. Композиции настоящего раскрытия включают ГЛУ-пептидный конъюгат, такой как ГЛУ-EGFRvIII-конъюгат, в сочетании с калий-фосфатным буфером, дисахаридом, а также поверхностно-активным веществом. Количество ГЛУ-пептидного конъюгата, такого как ГЛУ-EGFRvIII-конъюгат, может присутствовать в композициях настоящего раскрытия в диапазоне от 0,01 мг/мл до 20,0 мг/мл, например, от 0,1 мг/мл до 10 мг/мл или от 0,5 мг/мл до 5 мг/мл. Например, в отдельных вариантах воплощения ГЛУ-пептидный конъюгат, такой как ГЛУ-EGFRvIII-конъюгат, присутствует в жидкой композиции в количестве от 0,5 мг/мл до 1,5 мг/мл, например, 1,0 мг/мл.
Такие композиции могут быть водными жидкими композициями с уровнем рН в диапазоне от 7 до 8. В конкретном варианте воплощения уровень рН составляет от 7,3 до 7,5, например, 7,4. Специалистам в данной области техники будет понятно, что будет существовать некоторая межаппаратная вариабельность в измерении значений рН того или иного отдельного раствора, как правило, составляющая 0,1 единицы рН. Таким образом, там, где по ходу всего настоящего раскрытия приведены значения рН, специалисту в данной области техники будет понятно, что такие значения предназначены и для охвата такой межаппаратной вариабельности.
Композиции настоящего раскрытия также включают лиофилизированные композиции, которые впоследствии были восстановлены путем добавления растворителей, таких как вода.
Композиции настоящего раскрытия могут включать в себя калий-фосфатный буфер, который обычно используется для регулировки рН до желаемого уровня. Однако, настоящее раскрытие не предназначено для ограничения каким-либо конкретным механизмом, при помощи которого калий-фосфатный буфер действует в композиции, описанной здесь, и калий-фосфатные буферы, используемые в композициях, раскрытых здесь, могут достигать своих свойств с помощью механизмов, которые вообще не связаны с их способностью регулировать рН до желаемого уровня. Используемый здесь термин "буфер" относится к дополнительной композиции, которая позволяет жидкой композиции противостоять изменениям уровня рН. В некоторых вариантах воплощения добавленный буфер позволяет жидкой композиции ГЛУ-пептидного конъюгата противостоять изменению уровня рН за счет действия кислотно-щелочных компонентов конъюгата. Когда идет ссылка на концентрацию буфера, предполагается, что приведенная концентрация представляет молярную концентрацию формы свободной кислоты или свободного основания буфера.
Хотя специалистам в данной области техники будет понятно, что фосфатные буферы, как правило, не используются в парентеральных композициях, особенно в лиофилизированных продуктах, так как фосфатные соли имеют тенденцию к кристаллизации при замораживании, настоящее раскрытие неожиданно демонстрирует, что калий-фосфатный буфер пригоден в композиции ГЛУ-пептидного конъюгата без какой-либо подобной кристаллизации. В частности, калий-фосфатный буфер может быть использован в концентрации, которая находится в диапазоне от 5 мМ до 15 мМ, например, от 7 мМ до 12 мМ, от 8 до 11 мМ или от 9,5 мМ до 10,5 мМ. Специалистам в данной области техники будет понятно, что калий-фосфатный буфер, как правило, получают в виде смеси одноосновного дигидрофосфата и двухосновного моногидрофосфата (например, KH2PO4, K2HPO4) в достаточных соответствующих концентрациях, чтобы достичь заданного уровня рН. Такие буферы являются коммерчески доступными, или специалистам в данной области техники будет понятно, как приготовить и использовать такие буферы в контексте настоящего раскрытия.
Композиции настоящего раскрытия могут также содержать дисахарид, такой как трегалоза, для использования в качестве криопротектора во время замораживания и в качестве лиопротектора во время лиофилизирования. Однако настоящее раскрытие не предназначено для ограничений каким-либо конкретным механизмом, посредством которого дисахарид действует в композициях, описанных здесь, и дисахариды, используемые в композициях, раскрытых здесь, могут достигать своих свойств с помощью механизмов, которые вообще не связаны с их способностью выступать в качестве криопротектора во время замораживания и в качестве лиопротектора во время лиофилизирования. В настоящем раскрытии такой дисахарид может быть использован в количестве от 70 мг/мл до 110 мг/мл. Специалистам в данной области техники будет понятно, что дисахариды, такие как трегалоза, декстран и сахароза (среди прочих), можно легко получить через коммерческие источники.
Композиция настоящего раскрытия может также содержать поверхностно-активное вещество, такое как полисорбат 80, чтобы помочь уменьшить формирование частиц за счет уменьшения взаимодействия ГЛУ-пептидных конъюгатов с воздушно-водными или ледяно-водными границами раздела. Однако настоящее раскрытие не предназначено для ограничений каким-либо конкретным механизмом, посредством которого поверхностно-активное вещество действует в композициях, раскрытых здесь, и поверхностно-активные вещества, используемые в композициях, раскрытых здесь, могут достигать своих свойств с помощью механизмов, которые вообще не связаны с их способностью снижать взаимодействие ГЛУ-пептидных конъюгатов с воздушно-водными или ледяно-водными границами раздела. Используемый здесь термин "поверхностно-активное вещество" относится к вспомогательному веществу, которое может изменить поверхностное натяжение жидкой композиции ГЛУ-пептидного конъюгата. В некоторых вариантах воплощения поверхностно-активное вещество уменьшает поверхностное натяжение жидкой композиции ГЛУ-пептидного конъюгата. В других вариантах воплощения "поверхностно-активное вещество" может способствовать повышению стабильности ГЛУ-пептидного конъюгата, такого как ГЛУ-EGFRvIII-конъюгат. Например, поверхностно-активное вещество может снижать агрегацию ГЛУ-пептидного конъюгата и/или минимизировать образование твердых частиц в композиции, и/или уменьшать адсорбцию. Поверхностно-активное вещество может также улучшить стабильность ГЛУ-пептидного конъюгата во время и после цикла замораживания/оттаивания.
Подходящие поверхностно-активные вещества включают полисорбатные поверхностно-активные вещества, полоксамеры (например, полоксамер 18 и полоксамер 407), тритонные поверхностно-активное вещества, например, Тритон Х-100®, полисорбатные поверхностно-активные вещества, такие как Твин 20® и Твин 80®, додецилсульфат натрия, лаурилсульфат натрия, натрия октил гликозид, лаурил-сульфобетаин, миристил-сульфобетаин, линолеил-сульфобетаин, стеарил-сульфобетаин, лаурил-саркозин, миристил-саркозин, линолеил-саркозин, стеарил-саркозин, линолеил-бетаин, миристил-бетаин, цетил-бетаин, лауроамидопропил-бетаин, кокамидопропил-бетаин, линоламидопропил-бетаин, миристамидопропил-бетаин, палмидопропил-бетаин, изостеарамидопропил-бетаин, миристамидопропил-диметиламин, палмидопропил-диметиламин, изостеарамидопропил-диметиламин, натрий метил кокоил таурат, динатрия метил олеил-таурат, дигидроксипропил пэг 5 линоламмония хлорид, полиэтиленгликоль, полипропиленгликоль и их смеси.
В одном варианте воплощения поверхностно-активное вещество представляет собой полисорбатное поверхностно-активное вещество содержащее по меньшей мере одно вспомогательное вещество, выбранное из группы, состоящей из полисорбата 20, полисорбата 21, полисорбата 40, полисорбата 60, полисорбата 61, полисорбата 65, полисорбата 80, полисорбата 81, полисорбата 85 и их смесей.
Концентрация поверхностно-активного вещества, когда оно присутствует в композиции, как правило, находится в диапазоне от 0,01 мг/мл до 10 мг/мл, от 0,05 мг/мл до 5,0 мг/мл, от 0,1 мг/мл до 1,0 мг/мл или от 0,2 мг/мл до 0,7 мг/мл. В другом варианте воплощения поверхностно-активное вещество присутствует в количестве, которое составляет 0,2 мг/мл. В другом варианте воплощения поверхностно-активное вещество присутствует в количестве, которое составляет 0,5 мг/мл. В другом варианте воплощения поверхностно-активное вещество представляет собой полисорбат 80 (например, Твин 80®) и присутствует в количестве от 0,1 мг/мл до 0,3 мг/мл, например, 0,2 мг/мл. Промежуточные диапазоны вышеприведенных концентраций поверхностно-активного вещества также предназначены для того, чтобы быть частью этого раскрытия. Например, диапазоны значений, использующие комбинацию любого из вышеприведенных значений, как верхних, так и/или нижних пределов, предназначены для включения. Специалистам в данной области техники будет понятно, что поверхностно-активные вещества, такие как Твин 80®, можно легко получить через коммерческие источники.
После того, как ГЛУ-пептидный конъюгат, такой как ГЛУ-EGFRvIII-конъюгат, изготовлен, он может быть сформулирован с компонентами, как описано выше, используя способы, которые хорошо известные специалистам в этой области техники. Например, ГЛУ-EGFRvIII-конъюгат может быть введен в подходящий сосуд компаундирования и осторожно перемешан до достижения гомогенности. Конъюгат может быть разбавлен приблизительно до 1,0 мг/мл буфером композиции (например, фосфатом калия). Из раствора затем может быть отобрана проба, чтобы подтвердить соответствующий уровень рН и концентрацию. Раствор затем может быть пропущен через два стерилизационных фильтра (0,22 мкм) в сериях.
Пути введения и дозы
Композиции настоящего раскрытия могут быть в виде жидких растворов (например, в виде растворов для инъекций и инфузий). Предпочтительная форма может зависеть от предполагаемого способа введения и терапевтического применения. Типичными предпочтительными композициями являются композиции в форме растворов для инъекций или инфузий, такие как композиции, похожие на те, которые используются для пассивной иммунизации людей. Предпочтительным способом введения является парентеральный (например, внутривенный, внутрикожный, внутриартериальный, подкожный, внутрикостный, внутрибрюшинный, внутримышечный и внутригрудинный) или при помощи инфузии, в форме стерильных инъекционных жидких или масляных суспензий. Как будет понятно специалисту в данной области техники, путь и/или режим введения будет варьироваться в зависимости от желаемых результатов.
В одном варианте воплощения композицию ГЛУ-пептидного конъюгата вводят путем внутривенной инфузии или инъекции. В другом варианте воплощения композицию вводят путем внутримышечной или подкожной инъекции. Терапевтические композиции, как правило, являются стерильными и стабильными в условиях производства и хранения. Композиция может быть приготовлена в виде раствора, микроэмульсии, дисперсии или липосомы. Стерильные растворы для инъекций могут быть получены путем включения необходимого количества композиции ГЛУ-пептидного конъюгата в соответствующий растворитель с одним или несколькими из перечисленных выше компонентов, как это требуется, с последующей стерилизацией (например, стерилизация фильтрованием). Как правило, дисперсии готовят путем включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше.
Стерильное лекарственное средство для инъекций может находиться в форме стерильного инъекционного раствора или суспензии в нетоксичном парентерально приемлемом растворителе или носителе, таком как, например, раствор 1,3-бутандиола. Среди приемлемых носителей и растворителей, которые могут быть использованы, находятся вода, раствор Рингера, изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используются стерильные нелетучие масла. Для этой цели может быть использовано любое обычное жирное масло, в том числе синтетические моноглицериды или диглицериды. Кроме того, n-3 полиненасыщенные жирные кислоты могут найти применение при приготовлении инъекционных лекарственных средств. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами приготовления являются вакуумная сушка, сушка распылением и лиофилизирование, что дает выход порошка активного ингредиента плюс любые дополнительные желаемые ингредиенты из их раствора, предварительно простерилизованного фильтрацией. Надлежащая текучесть раствора может быть обеспечена, например, с помощью использования покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии, и с помощью использования поверхностно-активных веществ.
Продолжительная абсорбция инъекционных композиций может быть осуществлена путем включения в композицию вещества, задерживающего абсорбцию, например, моностеаратных солей и желатина, или путем составления рецептуры композиция в виде форм с пролонгированной абсорбцией, таких как депо, липосомы, полимерные микросферы, полимерные гели, а также имплантаты.
Другие способы введения композиций, описанных здесь, включают кожные патчи, которые высвобождают лекарственные средства непосредственно в кожу субъекта. Такие патчи могут содержать композиции настоящего раскрытия, необязательно, в буферизированном, жидком растворе, растворенном и/или диспергированном в адгезионном веществе, или диспергированном в полимере. Другие способы введения композиций, описанных здесь, включают жидкие офтальмологические капли для глаз.
Композицию ГЛУ-пептидного конъюгата можно вводить один раз или несколько раз. Например, композиция может быть введена от одного раза в сутки до одного раза каждые шесть месяцев или дольше. Введение может осуществляться по схеме: например, три раза в сутки, два раза в сутки, один раз в сутки, один раз в два дня, один раз в три дня, один раз в неделю, один раз в две недели, один раз в месяц, один раз в два месяца, один раз в три месяца и один раз в шесть месяцев.
Композиция может также вводиться непрерывно через мини-насос. Композиция может быть введена в место опухоли или воспаленной части тела, в опухоль или в воспаленную часть тела или в место, отдаленное от места опухоли или воспаленной части тела. Композиция может быть введена один раз, по меньшей мере два раза или по меньшей мере в течение периода времени, до тех пор, пока состояние не будет вылечено, облегчено или исцелено. Композицию ГЛУ-пептидного конъюгата, как правило, можно вводить до тех пор, пока присутствует опухоль, при условии, что композиция приводит в результате к желаемому терапевтическому эффекту. Композицию обычно будут вводить как часть фармацевтической композиции, как описано здесь. Композиции раскрытия могут включать терапевтически эффективное количество ГЛУ-пептидного конъюгата, как раскрыто здесь. При подготовке композиции может быть определено терапевтически эффективное количество ГЛУ-пептидного конъюгата, присутствующего в композиции, например, с учетом желаемого объема дозы и схем (ы) введения, характера и тяжести состояния, которое подлежит лечению, а также с учетом возраста и размера субъекта.
Примерными не ограничивающими диапазонами дозы для введения композиций настоящего раскрытия субъекту являются от 0,01 мг/кг до 200 мг/кг (выражены в миллиграммах (мг) ГЛУ-пептидного конъюгата, введенного на килограмм (кг) массы тела субъекта), от 0,1 мг/кг до 100 мг/кг, от 1,0 мг/кг до 50 мг/кг, от 5,0 мг/кг до 20 мг/кг или 15 мг/кг. Для целей настоящего раскрытия масса тела среднего субъекта человека составляет около 70 кг. Промежуточные диапазоны любых из вышеприведенных доз, например, 0,01 мг/кг-199 мг/кг, также предназначены для того, чтобы быть частью этого раскрытия. Например, диапазоны значений, использующие комбинацию любого из выше приведенных значений, как верхних, так и/или нижних пределов, предназначены для включения.
Схемы дозирования также могут быть скорректированы, чтобы обеспечить оптимальный желаемый ответ (например, терапевтический или профилактический ответ) путем введения нескольких разделенных доз субъекту с течением времени, или доза может быть пропорционально уменьшена или увеличена, как это показано необходимостью конкретной терапевтической ситуации. Это особенно полезно для разработки парентеральных композиций в форме единичной дозы для облегчения введения и единообразия дозы. Форма единичной дозы, используемая здесь, относится к физически дискретным единицам, подходящим в качестве стандартных доз для субъектов млекопитающих, подлежащих лечению, и каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация для формы единичной дозы изобретения продиктована и напрямую зависит от (а) уникальных характеристик ГЛУ-пептидного конъюгата и конкретных терапевтических или профилактических эффектов, которые должны быть достигнуты, и (b) ограничений, присущих области техники компаундирования, такой как ГЛУ-пептидный конъюгат, для лечения чувствительности у индивидуумов.
Жидкие композиции настоящего раскрытия могут быть изготовлены в форме единичной дозы. Например, единичная доза в одном флаконе может содержать от 1 до 1000 миллилитров (мл) различных концентраций ГЛУ-пептидного конъюгата. В других вариантах воплощения единичная доза в одном флаконе может содержать 0,2 мл, 0,4 мл, 0,6 мл, 0,8 мл, 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл, 20 мл, 30 мл, 40 мл, 50 мл или 100 мл различных концентраций ГЛУ-пептидного конъюгата. При необходимости эти препараты могут быть скорректированы до нужной концентрации путем добавления стерильного растворителя к каждому флакону. Жидкие композиции настоящего раскрытия также могут быть изготовлены в форме единичной дозы в стерильных пакетах, контейнерах, предварительно заполненных шприцах, ручках или микроиглах, которые могут быть использованы для прямого введения и/или являются подходящими для подключения к системе или катетеру для внутривенного введения.
ГЛУ-пептидные конъюгаты, такие как ГЛУ-EGFRvIII-конъюгаты, могут быть объединены с другими иммуностимулирующими веществами, такими как гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), например, сарграмостим или молграмостим. Например, ГМ-КСФ может быть объединен непосредственно с ГЛУ-EGFRvIII-конъюгатом и затем введен субъекту. В одном примере 0,35 мл ГМ-КСФ, концентрация которого составляет 0,5 мг/мл, может быть объединен с 0,6 мл композиции ГЛУ-EGFRvIII-конъюгата, концентрация которого составляет 1 мг/мл, чтобы предоставить 0,95 мл комбинированного раствора, содержащего 0,5 мг ГЛУ-EGFRvIII-конъюгата и 0,15 мг ГМ-КСФ. Эта комбинированная композиция затем может быть введена непосредственно субъекту. Специалистам в данной области техники будет понятно, что для обеспечения соответствующего количества дозы субъекту, нуждающемуся в этом, могут быть использованы различные количества и концентрации.
Оценка стабильности
Настоящее раскрытие обеспечивает стабильные жидкие и лиофилизированные композиции, содержащие ГЛУ-пептидный конъюгат, как описано здесь. Стабильная композиция желательно должна поддерживать или противостоять изменениям, например, внешнего вида продукта и целостности (в том числе физическому или химическому разложению, которое потенциально ведет к снижению биологической активности). Различные аналитические способы и показатели для измерения стабильности белка сообщаются в литературе, и некоторые из этих способов и показателей рассматриваются в работах Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) and Jones, A., Adv. Drug Delivery Rev. 10: 29-90 (1993).
В общем композиции настоящего раскрытия демонстрируют улучшенную стабильность при воздействии низких температур хранения в течение определенного периода времени и/или при воздействии одного или нескольких циклов замораживания/оттаивания. Стабильность ГЛУ-пептидных конъюгатов может быть измерена с помощью различных аналитических способов, которые хорошо известны специалистам в этой области техники. Например, аналитические тесты, такие как внешний вид (по данным визуального осмотра и/или УФ-рассеяния света), микроскопия, исследование способом светотени, гель-фильтрационная хроматография, анионообменная (АО) хроматография и обращенно-фазовая высокоэффективная жидкостная хроматография. Такие анализы могут предоставить данные о стабильности для нескольких путей деградации, таких как изменение содержания соотношения мономер/димер, формирования примесей пептид-линкер, изменения в соотношении A280/A340, АО время задержки пика ГЛУ-пептидного конъюгата, обусловленное формированием кислотообразующих элементов. Такие аналитические тесты могут быть использованы для контроля стабильности конъюгата, в зависимости от времени и температуры.
Белковую фрагментацию в жидкой фармацевтической композиции можно измерить различными способами, известными в этой области техники. Такие способы включают, например, гель-фильтрационную хроматографию, ультрафиолетовую детекцию (например, при длине волны 214 нм), НДС-ПАГЭ (анализ методом электрофореза в полиакриламидном геле с додецилсульфатом натрия) и/или матрично-активированную лазерную десорбцию/ионизацию времяпролетную масс-спектрометрию (МАЛДИ/ВП МС). Белковую фрагментацию, в результате которой происходит изменение заряда (например, возникающее в результате деамидирования), можно оценить, например, при помощи ионно-обменной хроматографии или изоэлектрической фокусировки (ИЭФ). Изменение цвета композиции, как правило, можно измерить с помощью визуального осмотра самой композиции. Композиции, описанные здесь, как правило, уменьшают изменение цвета композиции (например, розовый или желтый) и/или поддерживают прозрачность композиции (например, мутность, непрозрачность и/или образование частиц). Для целей настоящего раскрытия термин "изменение цвета" относится как к изменениям в цвете (например, от прозрачного и бесцветного до розового или желтого), а также к изменениям прозрачности (например, от прозрачного и бесцветного до мутного, непрозрачного и/или имеющего твердые частицы). Изменение цвета композиции, как правило, можно измерить с помощью дополнительных способов, таких как ультрафиолетовая детекция при длине волны 214 нм и/или при помощи визуального сравнения со стандартной цветовой шкалой сравниваемых композиций.
Используемый здесь термин "замораживание/оттаивание" относится к способам использования жидкого образца после хранения в замороженном виде, в которых температура образца понижается до температуры 0°C или ниже для того, чтобы заморозить жидкий образец, а затем образец подвергают воздействию температуры, которая восстанавливает его жидкое состояние на период времени, достаточный для того, чтобы разрешить использование образца, а затем вернуться к хранению в замороженном виде, предпочтительно при температуре 0°C или ниже. Используемый здесь термин "хранение в замороженном виде" относится к замораживанию и поддержанию ранее жидкого образца при температуре 0°С или ниже, а предпочтительно -20°C или ниже.
Способы лечения
Любая из ГЛУ-пептидных композиций, описанных здесь, может быть использована в терапевтических целях. В одном варианте воплощения ГЛУ-пептидный конъюгат является ГЛУ-EGFRvIII-конъюгатом, как описано здесь, и используется для лечения субъекта-человека. Кроме того, субъект может быть млекопитающим, которое экспрессирует вариант EGFRvIII. Таким образом, композиции ГЛУ-EGFRvIII-конъюгата, описанные здесь, могут быть введены млекопитающему, не являющемуся человеком, экспрессирующему вариант EGFRvIII для ветеринарных целей или в качестве животной модели заболеваний человека. Такие модели на животных могут быть использованы для оценки терапевтической эффективности композиций настоящего раскрытия.
Настоящее раскрытие обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие этап введения указанному млекопитающему любой из композиций, описанных здесь, в частности, тех, у которых ГЛУ-пептидный конъюгат представляет собой ГЛУ-EGFRvIII-конъюгат. В одном варианте воплощения аномальный рост клеток является раковым. В дополнительном варианте воплощения рак представляет собой глиобластому. Настоящее раскрытие обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие этапы: a) смешивание любой композиции, описанной здесь, с адъювантом и b) введение указанному млекопитающему полученной в результате смеси. В одном варианте воплощения ГЛУ-пептидный конъюгат представляет собой ГЛУ-EGFRvIII-конъюгат, а адъювант представляет собой гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), например, сарграмостим или молграмостим.
Настоящее раскрытие дополнительно обеспечивает способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие: a) предоставление любой из лиофилизированных композиций, описанных здесь, добавление воды в лиофилизированную композицию для того, чтобы обеспечить восстановленную композицию, и введение указанному млекопитающему восстановленной композиции. Также здесь обеспечены способы уменьшения аномального роста клеток у млекопитающих, нуждающихся в этом, включающие предоставление любой из лиофилизированных композиций, описанных здесь, добавление воды в лиофилизированную композицию для того, чтобы обеспечить восстановленную композицию, смешивание восстановленной композиции с адъювантной композицией и введение указанному млекопитающему полученной в результате смеси. В отдельных вариантах воплощения млекопитающее является человеком, а ГЛУ-пептидный конъюгат представляет собой ГЛУ-EGFRvIII-конъюгат.
Терапевтические способы включают введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества или "эффективного количества" композиции, содержащей ГЛУ-пептидный конъюгат, такой как ГЛУ-EGFRvIII-конъюгат, как это предусмотрено в настоящем раскрытии. Используемые здесь термины "терапевтически эффективное" или "эффективное" количество относятся к количеству ГЛУ-пептидного конъюгата композиции, который присутствует в достаточном количестве, чтобы привести к уменьшению выраженности симптомов заболевания, увеличению частоты и продолжительности бессимптомных периодов заболевания или предотвращению ухудшений или инвалидности в результате страдания от заболевания, или в виде разовой дозы, или в соответствии со схемой многократных доз, в качестве монотерапии или в комбинации с другими веществами. Обычный специалист в данной области техники сможет определить такие количества на основе таких факторов, как размер субъекта, тяжесть симптомов субъекта, а также конкретной композиции или выбранного пути введения. Субъектом может быть человек или животное, не являющееся человеком (например, кролик, крыса, мышь, обезьяна или другие низшие приматы). Композиция по настоящему раскрытию может также быть введена одновременно с известными лекарственными средствами.
Композиции ГЛУ-EGFRvIII-конъюгата, описанные здесь, могут быть использованы в качестве терапевтического продукта в различных ситуациях, когда нежелательно экспрессируется или обнаружен вариант EGFRvIII. Учитывая экспрессию варианта EGFRvIII при различных раковых заболеваниях, таких как глиобластома, расстройства и состояния, особенно подходящие для лечения композицией ГЛУ-EGFRvIII-конъюгата настоящего раскрытия, включают аномальный рост клеток, например, мезотелиомы, гепатобилиарной опухоли (печеночной и желчевыводящих протоков), первичных или вторичных опухолей ЦНС (центральной нервной системы), первичных или вторичных опухолей головного мозга, рака легкого (НМРЛ и МРЛ), рака костей, рака поджелудочной железы, рака кожи, рака головы и шеи, кожной или внутриглазной меланомы, рака яичников, рака толстой кишки, рака прямой кишки, рака анальной области, рака желудка, желудочно-кишечного тракта (желудка, толстой кишки и двенадцатиперстной кишки), рака молочной железы, рака матки, рака фаллопиевых труб, рака эндометрия, рака шейки матки, рака влагалища, рака вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, рака эндокринной системы, рака щитовидной железы, рака паращитовидных желез, рака надпочечников, саркомы мягких тканей, рака уретры, рака полового члена, рака предстательной железы, тестикулярного рака, хронического или острого лейкоза, хронического миелоидного лейкоза, лимфоцитарной лимфомы, рака мочевого пузыря, рака почек или мочеточников, почечно-клеточной карциномы, рака почечной лоханки, опухолей центральной нервной системы (ЦНС), первичной лимфомы ЦНС, неходжкинской лимфомы, опухолей спинальной оси, глиомы ствола головного мозга, аденомы гипофиза, рака коры надпочечников, рака желчного пузыря, множественной миеломы, холангиокарциномы, фибросаркомы, нейробластомы, ретинобластомы или комбинации из одного или более вышеназванных видов рака.
Композиции, описанные здесь, могут быть введены любым подходящим способом, который может изменяться в зависимости от типа расстройства, подлежащего лечению. Возможные пути введения включают парентеральные (например, внутривенный, внутрикожный, внутриартериальный, подкожный, внутрикостный, внутрибрюшинный, внутримышечный и внутригрудинный), внутрилегочной и интраназальный, и, если это необходимо для местного иммуносупрессивного лечения, введение внутрь патологического повреждения. Кроме того, композиции раскрытия могут быть введены путем импульсных инфузий, например, со снижением дозы ГЛУ-пептидного конъюгата.
Предпочтительно дозу лекарственного средства вводят в виде инъекций, наиболее предпочтительно внутрикожных или внутримышечных инъекций, в частности, в зависимости от того, является ли введение недолгим или хроническим.
Количество для введения будет зависеть от целого ряда факторов, таких как клинические симптомы, масса тела индивидуума, вводятся ли другие лекарственные средства. Специалисту в данной области техники будет понятно, что способ введения будет варьироваться в зависимости от расстройства или заболевания, подлежащего лечению. Например, определение терапевтически эффективного количества композиции, содержащей ГЛУ-пептидный конъюгат (например, ГЛУ-EGFRvIII-конъюгат), по настоящему раскрытию во многом будет зависеть от особенностей конкретного пациента, способа введения и характера заболевания, подлежащего лечению. Общие рекомендации могут быть найдены, например, в публикации Международной конференции по гармонизации и в работе Remington's Pharmaceutical Sciences, главы 27 и 28, стр. 484-528 (18th ed., Alfonso R. Gennaro, Ed., Easton, Pa.: Mack Pub. Co., 1990). В частности, определение терапевтически эффективного количества будет зависеть от таких факторов, как токсичность и эффективность лекарственного средства. Токсичность можно определить с помощью способов, хорошо известных в данной области техники, и найти в вышеупомянутых ссылках. Эффективность может быть определена с использованием тех же рекомендаций.
Адъюванты
В некоторых вариантах воплощения композицию ГЛУ-пептидного конъюгата настоящего раскрытия (например, ГЛУ-EGFRvIII-конъюгата) можно комбинировать или вводить одновременно по меньшей мере с одним адъювантом. Подходящие адъюванты включают пригодные для использования у млекопитающих, преимущественно у людей. Примеры известных подходящих адъювантов, которые могут использоваться у человека, включают, но необязательно ограничиваются ими, квасцы, фосфат алюминия, гидроокись алюминия, MF59™ (4,3% массы/объем сквалена, 0,5% массы/объем полисорбата 80 (Твин 80), 0,5% массы/объем сорбитантриолеата (Спан 85)), CpG-содержащие нуклеиновые кислоты (где цитозин является неметилированным), QS21 (адъювант сапонин), МФЛ (монофосфориллипид А), 3ДМФЛ (3-O-деацилированный МФЛ), экстракты от Aquilla, ISCOMS (см., например, Sjolander et al., J. Leukocyte Biol. 64:713 (1998); публикации PCT №№ WO 90/03184, WO 96/11711, WO 00/48630, WO 98/36772, WO 00/41720, WO 06/134423 и WO 07/026190), LT/CT мутанты, микрочастицы поли (D, L-лактид-со-гликолид) (ПЛГ), Квил-А, интерлейкины и тому подобное. Для ветеринарного применения, включая, но не ограничиваясь экспериментами на животных, можно использовать адъювант Фрейнда, N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-МДФ), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (CGP 11637, именуемый нор-МДФ), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (CGP 19835A, называемый МТФ-ФЭ) и RIBI, который содержит три компонента, извлечённые из бактерий, монофосфориллипид А, трегалозы димиколат и каркас клеточной стенки (МФЛ+ТДМ+ККС) в 2% эмульсии сквален/Твин 80.
Дополнительные типичные адъюванты для повышения эффективности композиции включают, не ограничиваясь этим: (1) композиции масло-в-воде (с другими специальными иммуностимулирующими веществами или без них, такими как мурамиловые пептиды (см. ниже) или компоненты бактериальной клеточной стенки), такие как, например: (a) MF59™ (публикация PCT №. WO 90/14837; глава 10 Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995), содержащий 5% сквалена, 0,5% Твин 80 (полиоксиэтилен сорбитан моно-олеат) и 0,5% Спан 85 (сорбитан триолеат) (необязательно содержащий мурамил трипептид, ковалентно связанный с мурамил три-дипальмитоил фосфатидилэтаноламином (MTФ-ФЭ)), сформулированый в субмикронных частицах с помощью микрофлюидизатора, (b) SAF, содержащий 10% сквалена, 0,4% Твин 80, 5% плуроник-блок-полимера L121 и thr-МДФ, микрофлюидизированный в субмикронную эмульсию или перемешанный в вихревой мешалке для создания эмульсии с частицами большего размера, и (c) RIBI™ адъювантная система (РАС) (Ribi Immunochem, Hamilton, MT), содержащая 2% сквалена, 0,2% Твин 80 и один или несколько компонентов стенок бактериальных клеток, таких как монофосфориллипид А (МФЛ), трегалозы димиколат (ТДМ), каркас клеточной стенки (ККС), предпочтительно МФЛ + ККС (DETOX™); (2) могут быть использованы адъюванты сапонина, такие как QS21, STIMULON™ (Cambridge Bioscience, Worcester, MA), Abisco® (Isconova, Sweden) или Iscomatrix® (Commonwealth Serum Laboratories, Australia), или же частицы, образующиеся из них, такие как ISCOMs (иммуностимулирующие комплексы), где ISCOMs могут быть лишены дополнительного детергента, см, например, публикацию PCT № WO 00/07621; (3) полный адъювант Фрейнда (ПАФ) и неполный адъювант Фрейнда (НАФ); (4) цитокины, такие как интерлейкины (например,. IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (публикация PCT №. WO 99/44636) и т.д.), интерфероны (например, гамма-интерферон), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ, такой как молграмостим или сарграмостим), фактор некроза опухоли (ФНО) и т.д.; (5) монофосфориллипид А (МФЛ) или 3-О-деацилированный МФЛ (3ДМФЛ), см., например, патент Великобритании № GB-2220221 и европейский патент № EP-A-0689454, необязательно при практическом отсутствии алюминия во время использовании пневмококковых сахаридов см., например, публикацию PCT № WO 00/56358; (6) комбинации 3ДМФЛ, например, с QS21 и/или эмульсиями масло-в-воде, см., например, EP-A-0835318, EP-A-0735898, EP-A-0761231; (7) олигонуклеотиды, содержащие мотивы CpG [Krieg, Vaccine (2000) 19:618-622; Krieg, Curr Opin Mol Ther (2001) 3:15-24; Roman et al., Nat. Med. (1997) 3:849-854; Weiner et al., PNAS USA (1997) 94:10833-10837; Davis et al, J. Immunol (1998) 160:870-876; Chu et al., J. Exp.Med (1997) 186:1623-1631; Lipford et al, Ear. J. Immunol. (1997) 27:2340-2344; Moldoveami el al., Vaccine (1988) 16:1216-1224, Krieg et al., Nature (1995) 374:546-549; Klinman et al., PNAS USA (1996) 93:2879-2883; Ballas et al, J. Immunol, (1996) 157:1840-1845; Cowdery et al, J. Immunol (1996) 156:4570-4575; Halpern et al, Cell Immunol. (1996) 167:72-78; Yamamoto et al, Jpn. J. Cancer Res., (1988) 79:866-873; Stacey et al, J. Immunol., (1996) 157:2116-2122; Messina et al, J. Immunol, (1991) 147:1759-1764; Yi et al, J. Immunol (1996) 157:4918-4925; Yi et al, J. Immunol (1996) 157:5394-5402; Yi et al, J. Immunol, (1998) 160:4755-4761; и Yi et al, J. Immunol, (1998) 160:5898-5906; публикации PCT №№ WO 96/02555, WO 98/16247, WO 98/18810, WO 98/40100, WO 98/55495, WO 98/37919 и WO 98/52581], т.е. содержащие по меньшей мере один динуклеотид CG, где цитозин является неметилированным; (8) простой полиоксиэтиленовый эфир или сложный полиоксиэтиленовый эфир, см., например, публикацию PCT № WO 99/52549; (9) поверхностно-активный сложный полиоксиэтиленовый эфир сорбитана в комбинации с октоксинолом (публикация PCT № WO 01/21207) или поверхностно-активный простой или сложный полиоксиэтиленалкиловый эфир в комбинации по меньшей мере с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (публикация PCT №. WO 01/21152); (10) сапонин и иммуностимулирующий олигонуклеотид (например, олигонуклеотид CpG) (публикация PCT № WO 00/62800); (11) иммуностимулятор и частицу соли металла, см., например, публикацию PCT № WO 00/23105; (12) сапонин и эмульсию масло-в-воде, см., например, публикацию PCT № WO 99/11241; (13) сапонин (например, QS21)+3ДМФЛ+IM2 (необязательно+стерол), см., например, публикацию PCT № WO 98/57659; (14) другие вещества, которые действуют как иммуностимулирующие вещества для повышения эффективности композиции, такие как мурамиловые пептиды, включая N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-МДФ), N-25 ацетил-нор-мурамил-L-аланил-D-изоглутамин (нор-МДФ), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин МТФ-ФЭ), (15) лиганды для толл-подобных рецепторов (ТПР), природные или синтезированные (например, как описано в работе Kanzler et al., Nature Med. 13:1552-1559 (2007)), включая ТПР3 лиганды, такие как polyl:C и схожие соединения, такие как Hiltonol и Ampligen.
В одном варианте воплощения композицию настоящего раскрытия вводят одновременно или комбинируют до введения по меньшей мере с одним адъювантом. В конкретном варианте воплощения указанный адъювант представляет собой цитокин, в частности, ГМ-КСФ (например, молграмостим или сарграмостим).
Промышленные изделия
В другом варианте воплощения раскрытия обеспечивается промышленное изделие, включающее контейнер, который содержит жидкую композицию, включающую ГЛУ-пептидный конъюгат, как описано здесь, и, необязательно, предоставляются инструкции по его использованию. Подходящие контейнеры включают, например, бутылки, флаконы, пакеты и шприцы. Контейнер может быть образован из различных материалов, таких как стекло или пластик. Типичный контейнер представляет собой одноразовый стеклянный флакон объемом 3-20 мл. Кроме того, для многодозовых композиций, контейнер может быть стеклянным флаконом объемом 3-100 мл. Контейнер содержит композицию и этикетку на нем или связанную с ним, контейнер может указывать инструкции по применению. Изделие может дополнительно включать другие материалы, желательные с коммерческой и пользовательской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы, шприцы и листки-вкладыши с инструкцией по применению, противопоказания и/или перечни потенциальных побочных эффектов.
Настоящее раскрытие также предоставляет набор для приготовления жидкой композиции ГЛУ-пептидного конъюгата, включающий первый контейнер, содержащий ГЛУ-пептидный конъюгат, такой как ГЛУ-EGFRvIII-конъюгат в растворе, и второй контейнер, содержащий достаточное количество адъюванта, такого как, например, ГМ-КСФ, отдельно или в комбинации с другими вспомогательными веществами.
Настоящее раскрытие далее иллюстрируется следующими примерами, которые не должны рассматриваться как дальнейшее ограничение. Содержание всех фигур и всех ссылок, патентов и опубликованных патентных заявок, процитированных на протяжении всего этого раскрытия, прямо включены в настоящее описание в качестве ссылки во всей их полноте.
ПРИМЕРЫ
В приведенных ниже примерах "плотность эпитопа" определяют с помощью аминокислотного анализа следующим образом. Связь пептида EGFRvIII с ГЛУ через бифункциональный линкер приводит к распределению пептидов, конъюгированных с белком-носителем ГЛУ. Число пептидов, конъюгированных с ГЛУ, измеряют с помощью анализа аминокислотной композиции. Существует несколько аминокислот, происхождение которых идет исключительно из белков-носителей ГЛУ, а не из пептида. Сравнивая эти аминокислоты с теми, которые происходят как из пептида, так и из ГЛУ, может быть вычислен молярный избыток. Молярный избыток этих аминокислот может быть отнесен к EGFRvIII-пептиду и используется для расчета количества пептидов на субъединицу ГЛУ. Перед аминокислотным анализом образцы подвергают буферному обмену, чтобы удалить остатки примесей переработки, такие как пептидный димер или конъюгат пептид:линкер. Эти примеси обладают потенциалом влиять на уровни аминокислот и искажать результаты. Образцы затем гидролизуют с использованием 6N HCl, метят флуоресцентными метками, разделяют и определяют количественно, используя ВЭЖХ.
Пример 1: Влияние уровня рН/буфера
Целью исследования было изучение влияния уровня рН и видов буфера на стабильность хранения CDX-110 при различных температурах (5°C, 25°C и 40°C) как для жидких, так и для лиофилизированных композиций (таблица 1А). Проанализированный диапазон значений рН составил от 4,5 до 7,4, а различными видами буферизации были фосфат калия, фосфат натрия, сукцинат и гистидин. Данные, представленные здесь, представляют собой данные в конце 12 недель для всех композиций, кроме сукцината (J), исследование которого было прекращено в конце 8 недели. Концентрация белка, уровень рН и содержание полисорбата поддерживались постоянными, как показано в таблице 1А. Сокращение "жидк" означает жидкую композицию, тогда как "лио" означает лиофилизированную композицию. Диапазоны значений рН были выбраны для внутрикожного введения. Все сравнения сделаны относительно текущей композиции F (как жидкой, так и лиофилизированной в ФСБ, состав композиций представлен в таблице 1В).
Состав композиции для исследования pH/буфера
(жидк)
(лио)
(жидк)
(лио)
(жидк)
(лио)
(жидк)
(лио)
(жидк)
(лио)
(жидк)
(лио)
жидк)
Композиции C и D отличаются только по содержанию трегалозы на 6 мг/мл. Все лиофилизированные композиции были восстановлены с помощью ВДИ таким образом, что окончательная концентрация CDX-110 составила ~ 1,0 мг/мл.
Текущий состав композиции CDX-110 в ФСБ (F)
0,12 мг KH2PO4
Приготовление буферных растворов
Пять буферных растворов готовят, как описано ниже в таблице 1С. Каждый раствор готовят сначала посредством растворения количества видов буфера (перечисленных в таблице 1С) в воде для инъекций (ВДИ). Уровень рН каждого буферного раствора измеряют. Буферный раствор затем фильтруют через стерилизационный фильтр (с размером пор 0,22 микрон) в простерилизованную емкость для последующего использования.
Буферные растворы
L-Гистидин HCl моногидрат
Натрия сукцинат
(Фосфатно-солевой буфер)
Калия фосфат одноосновный
Натрия хлорид
Калия хлорид
Калия фосфат одноосновный
Натрия фосфат двухосновный безводный
Приготовление композиции CDX-110
Композиции, которые были оценены, приведены в таблице 1А. Для приготовления каждой композиции, материал CDX-110 получают в концентрации 1,0 мг/мл в 10 мМ ФСБ с уровнем рН 7,4. Буферный обмен материала CDX-110 в вышеуказанные растворы композиций проводят при помощи оборудования Amicon Ultra15 ПДММ 50, центрифужную концентрацию проводят на центрифуге Beckman Coulter Allegra 21R, которая работает при режиме 4500 об./мин при температуре 5°C. Проводят приблизительно восемь обменов объема, и раствор концентрируют в диапазоне между 1,4 мг/мл и 1,8 мг/мл. Получают приблизительно от 70 мл до 99 мл всех композиций. Концентрацию CDX-110 определяют при помощи ультрафиолетовой видимой спектрометрии (УФ-Вид) с использованием коэффициента экстинкции 1,38 (мг/мл)-1 см-1 при длине волны 280 нм.
Дисахаридный раствор в концентрации 400 мг/мл готовят путем разбавления и растворения трегалозы/сахарозы соответствующей буферной композицией, как указано в таблице 1А. Кроме того, раствор полисорбата 80 (ПС 80) в концентрации 10 мг/мл готовят путем растворения ПС 80 в соответствующей композиции буфера. Соответствующие объемы исходного раствора дисахарида и исходного раствора ПС 80 затем добавляют в исходный раствор CDX-110 для получения конечной концентрации 1,0 мг/мл в составе композиции, перечисленном в таблице 1А.
Затем композицию фильтруют через стерилизационный фильтр с диаметром пор 0,2 мкм и разливают во флаконы. Объемом наполнения, равным 0,6 мл, наполняют стеклянные флаконы типа І емкостью 2 мл. Флаконы с жидкой композицией закрывают сывороточными пробками Daikyo 777-1 с покрытием Flurotec®, заворачивают крышками на резьбе и опечатывают. Флаконы с лиофилизированной композицией частично закрывают пробкой Daikyo 777-1 с покрытием Flurotec® B2-TR, затем лиофилизируют в соответствии с параметрами цикла лиофилизирования, указанными в таблице 1D, закрывают пробкой, заворачивают крышками на резьбе и опечатывают. Жидкие и лиофилизированные композиции помещают в камеры стабильности и хранят при температуре 5°С, 25°С и 40°С в течение 2, 4, 8, 13, 26, 52 и 104 недель. Флаконы промывают и автоклавируют, как и 13 мм Daikyo 777-1 сывороточные и лио-пробки. Лио-пробки сушат при температуре 100°С в течение 6 часов. Образцы анализируют по внешнему виду, уровню рН и концентрации белка при помощи УФ-Вид-абсорбции, гель-фильтрационной ВЭЖХ, анионообменной ВЭЖХ, обращенно-фазовой ВЭЖХ. Исследование продолжается, и значения представляют собой такие, которые зарегистрированы в промежуточных точках времени или через 12 недель.
Параметры цикла лиофилизирования
Исследования
Внешний вид
Каждую композицию оценивают визуально после 0 (начальной) и определенных точек времени относительно образования частиц, изменения цвета и изменения прозрачности. Образец держат напротив светлого и темного фона при правильном освещении. Образец не может быть окрашен более интенсивно, чем уровень 6 цветового диапазона, и не может быть более опалесцирующим, чем эталонная суспензия III. Видимые частицы также регистрируют.
pH
Образцы подвергают потенциометрическому измерению уровней рН. Калибровку рН-метра проводят с использованием стандартных коммерческих буферов в диапазоне уровней рН от 4 до 10.
Измерение концентрации белка при помощи определения УФ-Вид оптической плотности
Измерение концентрации белка проводят с помощью подходящего спектрофотометра. Образец сканируют при длине волны 280 нм и оптическую плотность при 280 нм используют для определения концентрации белка. Экспериментально полученный коэффициент экстинкции, равный 1,19 (мг/мл)-1 см-1 и 1,38 (мг/мл)-1см-1 (для D жидк и D лио) при длине волны 280 нм, используют для определения концентрации белка.
Гель-фильтрационная ВЭЖХ
Наличие мономеров, димеров и видов с высокой молекулярной массой (ВВММ) контролируется с помощью гель-фильтрационной хроматографии (ГФХ). Гель-фильтрационную хроматографию проводят с использованием ГФХ-колонки Waters Biosuite 450, подвижная фаза 50 мМ фосфата натрия, 75 мМ NaCl, 0,01% азида натрия, уровень рН 7,4, скорость потока 0,3 мл/мин, а также УФ-детекции при длине волны 214 нм. Уровни мономеров, димеров и ВВММ рассчитывают путем интеграции площадей под пиками хроматограмм для каждой композиции и описания пиков интегрированных областей мономера, димера и видов с высокой молекулярной массой в процентах от общей площади пика.
Анионообменная ВЭЖХ
Анионообменную хроматографию проводят с использованием колонки TSKgel DEAE-5PW с подвижной фазой 10 мМ Трис, рН 7,3 и 10 мМ Трис, 0,5 М NaCl, рН 7,3, градиентным элюированием, скоростью потока 1 мл/мин и УФ-детекцией при длине волны 280 нм. Анионообменная хроматография разделяет CDX-110 с ГЛУ, пептидом, линкером и родственными соединениями, в зависимости от их распределения между заряженной стационарной фазой и подвижной фазой различной ионной силы. Виды, представляющие интерес, обнаруживают при помощи ультрафиолетового поглощения и определяют количественно по относительной площади.
Обращенно-фазовая ВЭЖХ
Обращенно-фазовую хроматографию проводят с использованием колонки Waters symmetry 300 C4 с подвижной фазой 0,1% ТФА воды и градиентным элюированием 0,1% ТФА в ацетонитриле, скоростью потока 1 мл/мин и УФ-детекцией при длине волны 215 нм. Обращенно-фазовая хроматография разделяет CDX-110 с примесями, связанными с пептидами или линкером на основе их распределения между неполярной стационарной фазой и полярной подвижной фазой. Пики обнаружены с применением ультрафиолетового детектора света при фиксированной длине волны, при которой примеси на основе пептида и линкера обладают абсорбцией.
Результаты
Внешний вид
Из анализа внешнего вида можно сделать вывод, что все композиции в фосфате натрия (B), фосфате калия (A, C и D) и гистидине (E) ведут себя одинаково, как в жидкой, так и в лиофилизированной композициях. Композиции J (жидк, сукцинат) и F (лио, ФСБ) ведут себя наихудшим образом. Для более подробной информации см. жидкие и лиофилизированные композиции, изложенные в таблицах 1А, 1В и 1С.
Жидкие композиции (Таблица 1E)
Все Т0 (нулевое время) композиции были зарегистрированы бесцветными и НБО ЭСI. С точки зрения частиц, 1 белая хлопьевидная частица наблюдалась в композиции D (жидк, KPi, Тре), тогда как композиция C (жидк, KPi, Тре), которая отличается только содержанием трегалозы на 6 мг/мл, является СБВЧ по существу, без видимых частиц (СБВЧ). Текущая композиция F (жидк, ФСБ) также является бесцветной и СБВЧ.
При температуре 5°C (T=12 недель) все композиции были бесцветными и НБО ЭСI. Одна частица наблюдалась в композициях B (жидк) и C (жидк), в то время как текущая композиция F (в ФСБ) осталась СБВЧ и НБО ЭСI.
При температуре 25°C (T=12 недель) было зарегистрировано, что композиции J (жидк, сукцинат - НБО ЭСII) и D (жидк, KPi, Тре - НБО ЭСI) являлись очень светло-коричневыми. Было зарегистрировано, что композиция F (жидк, ФСБ) имела ряд различных типов частиц, тогда как композиция D (жидк, KPi, Тре) имела 1 частицу.
При температуре 40°C (T=12 недель) все композиции изменили цвет на желтый или коричневый (кроме ФСБ, то есть F), при этом композиция J (жидк, сукцинат) являлась худшей с точки зрения опалесценции (НБО ЭСIV). Было зарегистрировано, что калий-фосфатные жидкие композиции C (жидк, KPi, Тре) и D (жидк, KPi, Тре) являлись очень светло-коричневыми с одной твердой частицей или без частиц. Композиция F (жидк, ФСБ) была бесцветная с двумя белыми хлопьевидными частицами. Композиция F (жидк, ФСБ) была единственной композицией без ПС 80.
Лиофилизированные композиции (Таблица1E)
Все композиции в T=0 были бесцветными, за исключением композиции F (лио, ФСБ) (светло-коричневого цвета при восстановлении), которая также имела много коричневых/жёлто-коричневых частиц, напоминающих картонную упаковку. Композиция A (лио, KPi, Сукц) также имела одну твердую частицу при восстановлении.
При температуре 5°C (T=12 недель) все композиции были бесцветными и СБВЧ, за исключением композиции F (лио, ФСБ), которая имела много частиц и была опалесцирующей. При температуре 25°C (T=12 недель) все композиции, кроме композиции F (лио, ФСБ), были бесцветными и НБО ЭСI. Две маленькие белые частицы также были зарегистрированы для композиции C (лио, KPi, Тре). При температуре 40°C (T=12 недель) все композиции были бесцветными и НБО ЭСI, за исключением композиции F (лио, ФСБ) при восстановлении. Одна и две частицы наблюдались в композициях B (лио, NaPi, Сукц) и D (лио, KPi, Тре), соответственно, тогда как F (лио, ФСБ) имела множественные частицы.
Концентрация
Жидкие композиции (Таблица 1F)
При температуре 5°C (T=12 недель) никаких существенных изменений не наблюдалось. При температуре 25°C (T=12 недель) увеличение концентрации наблюдалось в композиции E (жидк, Гис, Тре). Все остальные композиции не продемонстрировали существенных изменений. При температуре 40°C композиции C (жидк, KPi, Тре), D (жидк, KPi, Тре) и F (жидк, ФСБ) не продемонстрировали существенных изменений, в то время как композиции A (жидк, KPi, Сукц), B (жидк, NaPi, Сукц) и E (жидк, Гис, Тре) продемонстрировали заметное увеличение концентрации.
Лиофилизированные композиции (Таблица 1F)
При температуре 5°C (T=12 недель) никаких существенных изменений не наблюдалось, за исключением композиции F (лио, ФСБ), которая продемонстрировала небольшое снижение концентрации. При температуре 25°C (T=12 недель) никаких существенных изменений не наблюдалось, за исключением незначительного снижения концентрации в композициях E (лио, Гис, Тре) и F (лио, ФСБ). При температуре 40°C (T=12недель) никаких существенных изменений не наблюдалось, за исключением F (лио, ФСБ). Незначительное увеличение концентрации наблюдалось в композиции A (лио, KPi, Сукц).
Соотношение A280/A340
Соотношение абсорбции при длине волны 280 нм к абсорбции при длине волны 340 нм играет важную роль в связи с наличием связанной меди в CDX-110, которая дает характерный голубой цвет. Абсорбция при длине волны 340 нм обусловлена наличием меди и, следовательно, снижение абсорбции при этой длине волны свидетельствует о потере меди или изменении состояния окисления меди.
Жидкие композиции (Таблица 1G)
При температуре 5°C (T=12 недель) не наблюдалось никаких существенных изменений в соотношении, за исключением композиции A (жидк, KPi, Сукц), в которой наблюдалось увеличение соотношения. При температуре 25°C (T=12 недель) все жидкие композиции демонстрируют увеличение соотношения, что указывает на потери/изменения в молекуле меди, за исключением композиции J (жидк, сукцинат). Композиция J (жидк, сукцинат) продемонстрировала снижение соотношения в отличие от других жидких композиций. Некоторые композиции продемонстрировали более значительное изменение в соотношении по сравнению с другими, например, композиции C (жидк, KPi, Тре), D (жидк, KPi, Тре) и F (жидк, ФСБ) имели более значительное увеличение, чем композиции A (жидк, KPi, Сукц) и B (жидк, NaPi, Сукц). Композиция E (жидк, Гис, Тре) имела умеренное увеличение соотношения.
При температуре 40°C композиция J (жидк, сукцинат) демонстрирует значительное снижение в соотношении (Таблица 1B). Композиции C, D и E демонстрируют значительное увеличение как и композиция F, демонстрирующая самое высокое увеличение. Соотношение для содержащих сахарозу композиций A (жидк, KPi, Сукц) и B (жидк, NaPi, Сукц) кажется постоянным. Более пристальный взгляд на данные открыл, что композиции, содержащие сахарозу, демонстрируют увеличение абсорбции при длине волны 280 нм так же, как и увеличение абсорбции при длине волны 340 нм, с повышением времени и температуры, таким образом, позволяя соотношению A280 к A340 казаться постоянным. Для композиций, содержащих трегалозу и ФСБ, увеличение этого соотношения наблюдается в связи с уменьшением абсорбции при длине волны 340 нм.
Лиофилизированные композиции (Таблица 1G)
При температуре 5°C (T=12 недель) наблюдается отсутствие изменений/минимальные изменения, кроме композиции F (лио, ФСБ). При температуре 25°C наблюдается отсутствие изменений/минимальные изменения, кроме композиции F (лио, ФСБ). При температуре 40°C не наблюдаются значительные изменения в соотношении для всех композиций, кроме композиции F (лио, ФСБ).
Димер/Мономер/ВВММ
Жидкие композиции (Таблицы 1H, 1I и 1J)
Содержание димера (Таблица 1H) уменьшилось во всех композициях с повышением температуры. Наименьшее снижение было отмечено в композициях C (жидк, KPi, Тре) и D (жидк, KPi, Тре). Содержание мономера увеличилось для всех композиций, содержащих сахар, в то время как композиции с гистидином (E) и ФСБ (F) продемонстрировали снижение содержания мономера. Композиция с гистидином продемонстрировала заметное снижение в содержании мономера (Таблица 1H) при температуре 25°C и 40°C с одновременным увеличением содержания ВВММ (Таблица 1I). Совершенно противоположная тенденция наблюдалась для композиций, содержащих натрия фосфат, калия фосфат, где при более высоких температурах происходило повышенное образование мономеров из ВВММ.
Лиофилизированные композиции (Таблица 1H, 1I и 1J)
Все лиофилизированные композиции продемонстрировали отсутствие изменений/минимальные изменения при температуре 5°C, 25°C и 40°C к концу 12 недель, за исключением лиофилизированной ФСБ композиции (F лио, ФСБ).
Изменение процента примесей и времени удержания CDX-110, определенное посредством АО
Жидкие композиции (Таблица 1K и 1L)
При температуре 5°C (T=12 недель) процент примесей для всех композиции составил менее чем или был равным 1%, за исключением композиции с сукцинатом (I). Время удержания для пика CDX-110 переместилось примерно на одну минуту для всех композиций, за исключением композиции с сукцинатом. Смещение времени удержания указывает на образование кислотообразующих элементов, которое может быть объяснено комбинацией гидролиза линкера и деамидирования. При температуре 25°C и 40°C (T=12 недель) процент примесей увеличился значительно для всех композиций. Изменение времени удержания также следует аналогичной тенденции, что свидетельствует о повышении образования кислотообразующих элементов.
Лиофилизированные композиции (Таблица 1K и 1L)
Для всех лиофилизированных композиций изменение процента примесей и смещение во времени удержания при всех температурах не были существенными, за исключением композиции F (лио, ФСБ).
Изменение процента примесей, определенное посредством ОФ ВЭЖХ
Жидкая композиция (Таблица 1M)
Увеличенное образование примесей, связанных с пептидом и линкером, наблюдалось в композициях при повышении температуры, при этом композиция с гистидином (E) демонстрировала наименьший уровень образования примесей.
Лиофилизированные композиции (Таблица 1M)
Не наблюдалось никаких существенных изменений в какой-либо из композиций, за исключением лиофилизированной композиции ФСБ (F).
Эффективность у мышей
Спецификация эффективности лекарственного средства установлена на ≥75% сероконверсии у мышей.
Протестировали следующие композиции: калия фосфат (A, C, D), гистидин (E) и ФСБ (F). Тестируемые образцы хранили при температуре 5°C в течение 8 и 12 недель. Все образцы продемонстрировали >75% сероконверсии (Таблица 1K) и, следовательно, отвечают спецификациям лекарственного средства.
Данные внешнего вида для исследования рН/буфер
Сукцинат, ПС 80,
pH 4,5, жидк*
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Видимая СI коричневая (<B7)
СБВЧ
Коричневая (<B6)
2 хлопьевидные частицы (белые сферические частицы)
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная
(<B9)
СБВЧ
1 маленькая белая круглая частица
KPO4, Сук-80 мг/мл, ПС 80, pH
7,4, лио
Бесцветная
(<B9)
1 короткая белая
серебристая частица
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9) 1 белая, 1 желтовато-коричневая короткая волокнистая частица
Бесцветная (<B9)
СБВЧ
СI Коричнево-желтая
(≤BY6)
СБВЧ
NaPO4, Сук-80
мг/мл, ПС 80, pH 7,4, лио
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
1 короткая белая волокнистая частица
KPO4, Тре-84 мг/мл, ПС 80, pH
7,4, жидк
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
1 короткая белая
волокнистая частица и 3 маленьких белых круглых частицы
Бесцветная (<B9)
СБВЧ
СI коричнево-желтая
(<BY7)
1 маленькая белая круглая частица
KPO4, Тре-84
мг/мл, П С80, pH
7,4,
лио
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
2 маленькие белые круглые
частицы
Бесцветная (<B9)
СБВЧ
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
Бесцветная (<B9)
1 белая хлопьевидная частица
Бесцветная (<B9) СБВЧ
Видимая незначительно коричневая (<B7)
1 маленькая белая круглая частица
Видимая незначительно коричневая
(<B7)
СБВЧ
KPO4, Тре-90
мг/мл, ПС 80, pH
7,4,
лио
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
2 маленькие белые
круглые частицы
Гис, Тре-84
мг/мл, ПС 80, pH 6,5, жидк
Бесцветная
(<B9) СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Коричнево-желтая
(<B6) СБВЧ
Гис, Тре-84
мг/мл, ПС 80, pH
6,5, лио
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
ФСБ, pH 7,4, жидк
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
~5 коротких белых волокнистоподобных
частиц;
~5 маленьких белых сферических частиц;
~6 маленьких белых хлопьевидных частиц
Бесцветная (<B9)
2 белые хлопьевидные
частицы
ФСБ, pH 7,4, лио
Слегка коричневая (<B6)
Много (~15) коротких
коричневых/желтовато-коричневых волокон. Напоминают картонную упаковку.
2 короткие белые серебристые частицы
Очень незначительно коричневая (≤B7)
~10 желтовато-коричневых коротких волокнистых
и 3 белые сферические частицы (хлопьевидные)
Очень незначительно коричневая (≤B7)
2 короткие белые волокнистые и 4 белые
сферические частицы (хлопьевидные)
Очень незначительно коричневая (≤B7)
3 желтовато-коричневые короткие
волокнистые, 2 маленькие белые круглые, 5 белых сферических частиц (хлопьевидных)
Изменения концентрации
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH
6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH
6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения в соотношении A280/A340
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4,
жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения в процентном содержании димера
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4,
жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения в процентном содержании мономера
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4,
жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения в процентном содержании ВВММ
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4,
жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения в процентном содержании примесей, определенные посредством АО
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4,
жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения во времени удержания, определенном посредством АО
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4,
жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения в процентном содержании примесей, определенные посредством обращенно-фазовой ВЭЖХ
Сукцинат, ПС 80, pH 4,5, жидк*
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4,
жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, лио
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, жидк
Гис, Тре-84 мг/мл, ПС 80, pH 6,5, лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Результаты эффективности на мышах
Пример 2: Влияние дисахаридов
Было проведено исследование, в котором были приготовлены различные жидкие и лиофилизированные композиции, чтобы изучить влияние дисахаридов при уровне рН 7,4. Для исследования были использованы трегалоза и сахароза. Композиции C и D имели две различные концентрации трегалозы, а остальные компоненты оставались теми же. Концентрацию белка и уровень рН поддерживали постоянными, как показано в Таблице 2A. Для этих композиций использовали буферные виды калия фосфата и натрия фосфата. Все сравнения проводили относительно текущей композиции (композиция F - как жидкая, так и лиофилизированная) в ФСБ (см. Таблицу 1B).
Состав композиций для влияния дисахаридов
(жидк)
(лио)
(жидк)
(лио)
(жидк)
(лио)
(жидк)
(лио)
(жидк)
(лио)
Фосфат мМ
(мл)
Аналитические тесты, выполненные для оценки стабильности, были следующими: внешний вид, УФ, pH, ГФХ, АО и ОФ ВЭЖХ. Таблицы 2B-2K демонстрируют данные о стабильности для нескольких путей деградации, включая изменения в содержании мономеров/димеров/видов с высокий молекулярной массой, образование пептид-линкер связанных примесей, изменения в соотношении A280/A340, определенном посредством АО времени удержания пика CDX-110 в результате образования кислотообразующих элементов и эффективность в исследованиях на мышах.
Приготовление буферных растворов
Пять буферных растворов получают, как описано ниже в Таблице 2В. Сначала каждый раствор готовят посредством растворения количества видов буферов (перечислены в Таблице 2В) в воде для инъекций (ВДИ). Измеряют уровень рН каждого буферного раствора. Затем буферный раствор фильтруют через стерилизационный фильтр (с размером пор 0,22 микрон) в простерилизованную емкость для последующего использования.
Буферные растворы
L-Гистидин HCl моногидрат
Натрия сукцинат
(Фосфатно-солевой буфер)
Калия фосфат одноосновный
Натрия хлорид
Калия хлорид
Калия фосфат одноосновный
Натрия фосфат, двухосновный, безводный
Приготовление композиции CDX-110
Композиции, которые были оценены, приведены в таблице 2А. Для приготовления каждой композиции материал CDX-110 получают в концентрации 1,0 мг/мл в 10 мМ ФСБ с уровнем рН 7,4. Буферный обмен материала CDX-110 в вышеуказанные растворы композиций проводят при помощи оборудования Amicon Ultra15 ПДММ 50, центрифужную концентрацию проводят на центрифуге Beckman Coulter Allegra 21R, которая работает при режиме 4500 об./мин при температуре 5°C. Проводят приблизительно восемь обменов объема, и раствор концентрируют в диапазоне между 1,4 мг/мл и 1,8 мг/мл. Получают приблизительно от 70 мл до 99 мл всех композиций. Концентрацию CDX-110 определяют при помощи ультрафиолетовой видимой спектрометрии (УФ-Вид) с использованием коэффициента экстинкции 1,38 (мг/мл)-1 см-1 при длине волны 280 нм.
Дисахаридный раствор в концентрации 400 мг/мл готовят путем разбавления и растворения трегалозы/сахарозы соответствующей буферной композицией, как указано в таблице 2А. Кроме того, раствор полисорбата 80 (ПС 80) в концентрации 10 мг/мл готовят путем растворения ПС 80 в соответствующей композиции буфера, как описано выше. Соответствующие объемы исходного раствора дисахарида и исходного раствора ПС 80 затем добавляют в исходный раствор CDX-110 для получения конечной концентрации 1,0 мг/мл в составе композиции, перечисленном в таблице 2А.
Затем композиции фильтруют через стерилизационный фильтр с диаметром пор 0,2 мкм и разливают во флаконы. Объемом наполнения, равным 0,6 мл, наполняют стеклянные флаконы типа І объемом 2 мл. Флаконы с жидкой композицией закрывают сывороточными пробками Daikyo 777-1 с покрытием Flurotec®, заворачивают крышками на резьбе и опечатывают. Флаконы с лиофилизированной композицией частично закрывают пробкой Daikyo 777-1 с покрытием Flurotec ® B2-TR, затем лиофилизируют в соответствии с параметрами цикла лиофилизирования, указанными в таблице 2C, закрывают пробкой, заворачивают крышками на резьбе и опечатывают. Жидкие и лиофилизированные композиции помещают в камеры стабильности и хранят при температуре 5°С, 25°С и 40°С в течение 2, 4, 8, 13, 26, 52 и 104 недель. Флаконы промывают и автоклавируют, как и 13 мм Daikyo 777-1 сывороточные и лио-пробки. Лио-пробки сушат при температуре 100°С в течение шести часов. Образцы анализируют по внешнему виду, уровню рН и концентрации белка при помощи УФ-Вид-абсорбции, гель-фильтрационной ВЭЖХ, анионообменной ВЭЖХ, обращенно-фазовой ВЭЖХ. Исследование продолжается, и значения представляют собой такие, которые зарегистрированы в промежуточных точках времени или через 12 недель.
Параметры цикла лиофилизирования
Исследования
Внешний вид
Каждую композицию оценивают визуально после 0 (начальной) и определенных точек времени относительно образования частиц, изменения цвета и изменения прозрачности. Образец держат напротив светлого и темного фона при правильном освещении. Образец не может быть окрашен более интенсивно, чем уровень 6 цветового диапазона, и не может быть более опалесцирующим, чем эталонная суспензия III. Видимые частицы также регистрируют.
pH
Образцы подвергают потенциометрическому измерению уровней рН. Калибровку рН-метра проводят с использованием стандартных коммерческих буферов в диапазоне уровней рН от 4 до 10.
Измерение концентрации белка при помощи определения УФ-Вид оптической плотности
Измерение концентрации белка проводят с помощью подходящего спектрофотометра. Образец сканируют при длине волны 280 нм и используют оптическую плотность при 280 нм для определения концентрации белка. Экспериментально полученный коэффициент экстинкции, равный 1,19 (мг/мл)-1см-1 и 1,38 (мг/мл)-1см-1 (для D жидк и D лио) при длине волны 280 нм, используют для определения концентрации белка.
Гель-фильтрационная ВЭЖХ
Наличие мономеров, димеров и видов с высокой молекулярной массой (ВВММ) контролируется с помощью гель-фильтрационной хроматографии (ГФХ). Гель-фильтрационную хроматографию проводят с использованием ГФХ колонки Waters Biosuite 450, подвижная фаза 50 мМ фосфата натрия, 75 мМ NaCl, 0,01% азида натрия, уровень рН 7,4, скорость потока 0,3 мл/мин, а также УФ-детекция при длине волны 214 нм. Уровни мономеров, димеров и ВВММ рассчитывают путем интеграции площадей под пиками хроматограмм для каждой композиции и описания пиков интегрированных областей мономера, димера и видов с высокой молекулярной массой в процентах от общей площади пика.
Анионообменная ВЭЖХ
Анионообменную хроматографию проводят с использованием колонки TSKgel DEAE-5PW с подвижной фазой 10 мМ Трис, рН 7,3 и 10 мМ Трис, 0,5 М NaCl, рН 7,3, градиентным элюированием, скоростью потока 1 мл/мин и УФ-детекцией при длине волны 280 нм. Анионообменная хроматография разделяет CDX-110 с ГЛУ, пептидом, линкером и родственными соединениями, в зависимости от их распределения между заряженной стационарной фазой и подвижной фазой различной ионной силы. Виды, представляющие интерес, обнаруживают при помощи ультрафиолетового поглощения и определяют количественно по относительной площади.
Обращенно-фазовая ВЭЖХ
Обращенно-фазовую хроматографию проводят с использованием колонки Waters symmetry 300 C4 с подвижной фазой 0,1% ТФА воды и градиентным элюированием 0,1% ТФА в ацетонитриле, скоростью потока 1 мл/мин и УФ-детекцией при длине волны 215 нм. Обращенно-фазовая хроматография разделяет CDX-110 с примесями, связанными с пептидами или линкером, на основе их распределения между неполярной стационарной фазой и полярной подвижной фазой. Пики обнаружены с применением ультрафиолетового детектора света с фиксированной длиной волны, где примеси на основе пептида и линкера имеют абсорбцию.
Результаты
Внешний вид
Из анализа внешнего вида можно сделать вывод, что композиции с сахарозой и трегалозой ведут себя одинаково как в жидкой, так и в лиофилизированной композициях. Композиция F (лио, ФСБ) ведет себя наихудшим образом. Более подробная информация приводится ниже.
Жидкие композиции (Таблица 2D)
Все Т 0 композиции были зарегистрированы бесцветными. Одна белая хлопьевидная частица наблюдалась в композиции D (жидк, KPi, Тре), тогда как композиция C (жидк, KPi, Тре), которая отличается только содержанием трегалозы на 6 мг/мл, является СБВЧ. Текущая композиция F (жидк, ФСБ) также является бесцветной и СБВЧ. При температуре 5°C (T=12 недель) все композиции были бесцветными и НБО ЭСI. Одна частица наблюдалась в композициях B (жидк, NaPi, Сукц) и C (жидк, KPi, Тре), в то время как текущая композиция F (жидк, ФСБ) осталась СБВЧ.
При температуре 25°C (T=12 недель) было зарегистрировано, что композиция D (жидк, KPi, Тре-НБО ЭСI) являлась очень светло-коричневой. Было зарегистрировано, что композиция F (жидк, ФСБ) имела ряд различных типов частиц, тогда как композиция D (жидк, KPi, Тре) имела 1 частицу. При температуре 40°C (T=12 недель) все композиции изменили цвет на желтый или коричневый, кроме композиции F (жидк, ФСБ). Было зарегистрировано, что композиции с трегалозой C и D являлись очень светло-коричневыми с одной твердой частицей или без частиц. Композиция F (жидк, ФСБ) была бесцветная с двумя белыми хлопьевидными частицами. Композиция F (жидк, ФСБ) была единственной композицией без ПС 80.
Лиофолизированные композиции (Таблица 2D)
Все композиции в T=0 были бесцветными. Композиция A (лио, KPi, Сукц) также имела одну твердую частицу. При температуре 5°C (T=12 недель) все композиции были бесцветными и СБВЧ. При температуре 25°C (T=12 недель) все композиции были бесцветными и НБО ЭСI. Две маленькие белые частицы были зарегистрированы для композиции C (лио, KPi, Тре). При температуре 40°C (T=12 недель) все композиции были бесцветными и НБО ЭСI. Одна и две частицы наблюдались в композициях B (лио, NaPi, Сукц) и D (лио, KPi, Тре), соответственно.
Концентрация
Жидкие композиции (Таблица 2E)
При температуре 5°C (T=12 недель) никаких существенных изменений не наблюдалось. При температуре 25°C (T=12 недель) все композиции не продемонстрировали никаких существенных изменений. При температуре 40°C композиции C (жидк, KPi, Тре), D (жидк, KPi, Тре) и F (жидк, ФСБ) не продемонстрировали никаких существенных изменений, в то время как композиции A (жидк, KPi, Сукц) и B (жидк, NaPi, Сукц) продемонстрировали заметное увеличение концентрации. Это показывает, что композиция с трегалозой вела себя лучше, чем композиция с сахарозой.
Лиофилизированные композиции (Таблица 2E)
При температуре 5°C (T=12 недель) никаких существенных изменений не наблюдалось. При температуре 25°C (T=12 недель) никаких существенных изменений не наблюдалось, за исключением композиции F (лио, ФСБ). При температуре 40°C (T=12 недель) никаких существенных изменений не наблюдалось, за исключением композиции F (лио, ФСБ). Незначительное увеличение наблюдалось в композиции A (лио, KPi, Сукц).
Соотношение A280/A340
Жидкие композиции (Таблица 2F)
При температуре 5°C (T=12 недель) не наблюдалось никаких существенных изменений в соотношении, за исключением композиций с сахарозой (A и B), в которых наблюдалось увеличение соотношения. При температуре 25°C (T=12 недель) все жидкие композиции демонстрируют увеличение соотношения, что указывает на потери/изменения в молекуле меди. Некоторые композиции продемонстрировали более значительное изменение в соотношении по сравнению с другими, например, композиции C (жидк, KPi, Тре), D (жидк, KPi, Тре) и F (жидк, ФСБ) имели более значительный эффект, чем композиции A (жидк, KPi, Сукц) и B (жидк, NaPi, Тре). При температуре 40°C соотношение в композициях, содержащих сахарозу, A (жидк, KPi, Сукц) и B (жидк, NaPi, Сукц), похоже, пострадало меньше (Таблица 2F) по сравнению с другими композициями. Данные концентрации (Таблица 2E) демонстрируют, что композиции A (жидк, KPi, Сукц) и B (жидк, NaPi, Сукц) имели значительно более высокие значения концентрации (или высокие значения абсорбции при длине волны 280 нм) при температуре 40°C. Кроме того, абсорбция при длине волны 340 нм также увеличивается с течением времени для композиций, содержащих сахарозу, приводя в результате к незначительным изменениям в соотношении A280/A340. Для композиций, содержащих трегалозу, C (жидк, KPi, Тре), D (жидк, KPi, Тре) и текущей ФСБ композиции F (жидк, ФСБ), этот феномен (т.е. отсутствие повышения A280 с течением времени) не наблюдается, что приводит к увеличению соотношения A280/A340, в основном за счет уменьшения абсорбции при длине волны 340 нм.
Лиофилизированные композиции (Таблица 2F)
Никаких существенных изменений не наблюдалось ни в одной из лиофилизированных композиций, кроме композиции F (лио, ФСБ).
Содержание Димера/Мономера/ВВММ
Жидкие композиции (Таблица 2G, 2H, и 2I)
Содержание димера (Таблица 2G) уменьшилось во всех композициях с повышением температуры. Наименьшее снижение было отмечено в содержащих трегалозу композициях C (жидк, KPi, Тре) и D (жидк, KPi, Тре). Содержание мономера увеличилось для всех содержащих дисахариды композициях, в то время как текущая композиция F (жидк., ФСБ) продемонстрировала снижение содержания мономера. Композиция с ФСБ продемонстрировала заметное снижение в содержании мономера (Таблица 2H) при температуре 25°C и 40°C с одновременным увеличением содержания ВВММ (Таблица 2I). Совершенно противоположная тенденция наблюдалась для композиций, содержащих сахарозу (A и B) и трегалозу (C и D), где увеличенное образование мономера при одновременном уменьшении содержания ВВММ и димера наблюдалось при более высоких температурах. При температуре 25°C как композиции, содержащие сахарозу (A и B), так и композиции, содержащие трегалозу (C и D) вели себя аналогичным образом. При температуре 40°C композиции с трегалозой (C и D) продемонстрировали значительно меньшие изменения в содержании димера, мономера и ВВММ по сравнению с композициями с сахарозой (A и B) при температуре 40°C. Это продемонстрировало, что при температуре 40°C композиции с трегалозой являются относительно более стабильными, чем композиции, содержащие сахарозу.
Лиофилизированные композиции (Таблица 2G, 2H и 2I)
Все лиофилизированные композиции продемонстрировали отсутствие изменений/минимальные изменения при температуре 5°C, 25°C и 40°C к концу 12 недель, за исключением лиофилизированной ФСБ (F) композиции.
Изменение процента примесей и сдвиг времени удержания, определенные посредством АО
Жидкие композиции (Таблица 2J и 2K)
При температуре 5°C (T=12 недель) процент примесей для композиций с сахарозой и трегалозой составил менее чем или был равным 1%. Время удержания для CDX-110 пика сместилось примерно на одну минуту для всех композиций. Смещение времени удержания указывает на образование кислотообразующих элементов, которые могут быть объяснены комбинацией гидролиза линкера и деамидирования. При температуре 25°C и 40°C (T=12 недель) процент примесей увеличился значительно для всех композиций. Изменение времени удержания также следует аналогичной тенденции, что свидетельствует о повышении образования кислотообразующих элементов. Сдвиг времени удержания для композиции, содержащей трегалозу, был меньшим в сравнении с композицией, содержащей сахарозу, что указывает на меньшее образование кислотообразующих элементов в композиции с трегалозой.
Лиофилизированные композиции (Таблица 2J и K))
Для всех лиофилизированных композиций изменение процента примесей при всех температурах не было существенным. Схожая тенденция наблюдалась для времени удержания (<1минуты) для всех композиций.
Изменение процента примесей, определенное посредством ОФ ВЭЖХ
Жидкая композиция (Таблица 2L)
Увеличенное образование примесей, связанных с пептидом и линкером, наблюдалось в композиции при повышении температуры, как для композиций, содержащих сахарозу, так и для композиций, содержащих трегалозу. Композиция с трегалозой продемонстрировала меньший уровень образования примесей по сравнению с композицией, содержащей сахарозу.
Лиофилизированные композиции (Таблица 2L)
Не наблюдалось никаких существенных изменений в какой-либо из композиций, за исключением лиофилизированной композиции ФСБ (F).
Эффективность у мышей
Все протестированные жидкие и лиофилизированные композиции (образцы 5°C) отвечают спецификациям лекарственного средства ≥75% сероконверсии у мышей (Таблица 2M).
Данные внешнего вида
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная
(<B9)
СБВЧ
1 маленькая белая круглая частица
KPO4, Сук-80 мг/мл, ПС 80, pH
7,4, лио
Бесцветная
(<B9)
1 короткая белая
серебристая частица
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
1 белая, 1 желтовато-коричневая короткая волокнистая частица
Бесцветная (<B9) СБВЧ
(≤BY6)
СБВЧ
NaPO4, Сук-80
мг/мл, ПС 80, pH 7,4, лио
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
1 короткая белая волокнистая частица
KPO4, Тре-84 мг/мл, ПС 80, pH
7,4, жидк
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
1 короткая белая
волокнистая частица и 3 маленьких белых круглых частицы
Бесцветная (<B9)
СБВЧ
(<BY7)
1 маленькая белая круглая частица
KPO4, Тре-84
мг/мл, ПС 80, pH
7,4,
лио
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
2 маленькие белые круглые
частицы
Бесцветная (<B9)
СБВЧ
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
Бесцветная (<B9)
1 белая хлопьевидная частица
Бесцветная (<B9) СБВЧ
Видимая незначительно коричневая (<B7) 1 маленькая белая круглая частица
Видимая незначительно коричневая
(<B7)
СБВЧ
KPO4, Тре-90
мг/мл, ПС 80, pH
7,4,
лио
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
2 маленькие белые
круглые частицы
ФСБ, pH 7,4, жидк
Бесцветная
(<B9)
СБВЧ
Бесцветная (<B9)
СБВЧ
Бесцветная (<B9)
~5 коротких белых волокнистых
частиц;
~5 маленьких белых сферических частиц;
~6 маленьких белых хлопьевидных частиц
Бесцветная (<B9)
2 белые хлопьевидные
частицы
ФСБ, pH 7,4, лио
Слегка коричневая (<B6)
Много (~15) коротких
коричневых/желтовато-коричневых волокон. Напоминают картонную упаковку.
2 короткие белые серебристые частицы
Очень незначительно коричневая (≤B7)
~10 желтовато-коричневых коротких волокнистых
и 3 белые сферические частицы (хлопьевидные)
Очень незначительно коричневая (≤B7)
2 короткие белые волокнистые и 4 белые
сферические частицы (хлопьевидные)
Очень незначительно коричневая (≤B7)
3 желтовато-коричневые короткие
волокнистые, 2 маленькие белые круглые, 5 белых сферических частиц (хлопьевидных)
Данные изменения концентрации
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH
7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
NaPO4, Сук-80
мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH
7,4, жидк
KPO4, Тре-84
мг/мл, ПС 80, pH
7,4,
лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90
мг/мл, ПС 80, pH
7,4,
лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Изменения в соотношении A280/A340
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH
7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
NaPO4, Сук-80
мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH
7,4, жидк
KPO4, Тре-84
мг/мл, ПС 80, pH
7,4,
лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90
мг/мл, ПС 80, pH
7,4,
лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Данные изменения в процентном содержании димера
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH
7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
NaPO4, Сук-80
мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH
7,4, жидк
KPO4, Тре-84
мг/мл, ПС 80, pH
7,4,
лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90
мг/мл, ПС 80, pH
7,4,
лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Данные изменения в процентном содержании мономера
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH
7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
NaPO4, Сук-80
мг/мл, ПС 80, pH 7, 4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH
7,4, жидк
KPO4, Тре-84
мг/мл, ПС 80, pH
7,4,
лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90
мг/мл, ПС 80, pH
7,4,
лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Данные изменения в процентном содержании ВВММ
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH
7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
NaPO4, Сук-80
мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH
7,4, жидк
KPO4, Тре-84
мг/мл, ПС 80, pH
7,4,
лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90
мг/мл, ПС 80, pH
7,4,
лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Данные изменения в процентном содержании примесей, определенные посредством АО
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, жидк
NaPO4, Сук-80 мг/мл, ПС 80, pH 7,4, лио
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-84 мг/мл, ПС 80, pH 7,4,
лио
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4, жидк
KPO4, Тре-90 мг/мл, ПС 80, pH 7,4,
лио
ФСБ, pH 7,4, жидк
ФСБ, pH 7,4, лио
Пример 3: Развитие процесса фильтрации
3.1 Материалы и оборудование
Следующие материалы процесса и оборудование были использованы в ходе данного исследования: AKTA устройство фильтрации в тангенциальном потоке от компании GE Healthcare; 30 K и 100 K кассеты для микрофильтрации Hydrosart с площадью мембраны 200 см2 (Sartorius № 308144590 2E-SG; 308144680 2E-SG); 30 K кассеты для микрофильтрации Hydrosart с площадью мембраны 0,1 м2 (Sartorius № 308144590 2E-SG); гемоцианин лимфы улитки (ГЛУ), коммерчески доступный как Vacmune® (Biosyn Corporation, серии 739690V1, R625258, 817873V1 и 817873V2); EGFRvIII-пептид (Ambiopharm Inc., серия APi 080616); EGFRvIII-пептид (Chinese Peptide Corporation (CPC), серия № CH-0600453); сульфосукцинимидил 4-[N-малеимидометил]циклогексан-1-карбоксилат (сульфо-СМЦК) (Thermo, различные серии, № по каталогу 22322); диметил сульфоксид (ДМСО) безводный 99,9% (Sigma Catalog № 276855); NaPh буфер = 100 мM натрия фосфата, pH 7,2; ФСБ = OmniPur 10x фосфатный солевой буфер, разведенный до 1x (VWR Catalog № EM6506); KPh буфер = 10 мМ калия фосфата, pH 7,4; ПЭТГ (полиэтилентерефталата сополиэфир) флаконы (различных размеров от компании Nalgene).
3.2. Способы
В целом процесс включал: (1) реакцию активации между ГЛУ и линкером; (2) начальный этап ФТП (фильтрации в тангенциальном потоке) для того, чтобы удалить избыток линкера и примесей, связанных с линкером; (3) этап реакции конъюгации между активированным ГЛУ и пептидом; с последующим (4) вторым этапом ФТП для того, чтобы удалить избыток пептида и примесей, связанных с пептидом, и чтобы заменить буфер. Коэффициент экстинкции, равный 1,38 для CDX-110, был использован в настоящем исследовании. Более подробное описание каждого этапа следует ниже.
3.2.1 Этап реакции активации
Для большинства серий ФТП ГЛУ (100-160 мг) добавляют в виде аликвоты в пластиковую пробирку объемом 15 мл или 50 мл, разбавляют NaPh буфером и водой для инъекций (ВДИ) и смешивают перевертыванием пробирки несколько раз. Линкерный раствор (предварительно растворенный либо в воде, либо в ДМСО) добавляют в смесь ГЛУ, осторожно перемешивают путем перевертывания пробирки несколько раз, а затем держат неподвижно оставшиеся 45±5 минут. Для серий экспериментов 121161-165 и 121161-172 в качестве реакционных емкостей используют ПЭТГ флаконы, и раствор энергично смешивают мешалкой во время добавления линкера и более осторожно перемешивают в течение оставшегося времени прохождения реакции. Исследуют различные параметры реакции активации, такие как молярное соотношение линкер:ГЛУ, концентрация буфера, концентрация исходного раствора линкера и время реакции, поскольку различные процессы входят в ФТП систему. Полная информация представлена на Фигуре 2А.
Первая операция ФТП
В конце реакции активации раствор активированного ГЛУ разбавляют буфером NaPh до концентрации белка 1,5-2,0 мг/мл, перед тем, как переместить через перекачивающий насос в систему тангенциального потока. Мембраны перед использованием предварительно дезинфицируют. При разработке и оптимизации ФТП операции исследуют различные параметры, такие как концентрация белка во время диафильтрации, буфер диафильтрации, мембрана для предельно-допустимой молекулярной массы (ПДММ), трансмембранное давление (ТМД), скорость течения ретентата и число оборотов объемов диафильтрации (ООД). Полная информация представлена на Фигуре 2B.
Этап конъюгации
Диафильтрованный активированный раствор ГЛУ, переработанный в ФТП системе, рециркулируют при скорости 10 мл/мин и либо держат в общей сложности 255 минут (от начала активации реакции до добавления пептида), либо конъюгируют немедленно с раствором пептида. Перед этапом конъюгации белковый раствор в резервуаре концентрируют до 2 мг/мл для достижения целевой концентрации для этапа реакции конъюгации. Для всех реакций конъюгации целевая концентрация как для ГЛУ, так и для пептида составляет 1,5 мг/мл. Исходный раствор пептида предварительно растворяют в буфере NaPh и добавляют в виде единственного болюса непосредственно в резервуар с ФТП при помощи пипетки. Соотношение ГЛУ:пептид поддерживают постоянным как 1:1 (соотношение по массе). Исследуют такие параметры, как концентрация исходного раствора пептида и время реакции конъюгации. Во время реакции систему ФТП устанавливают рециркулировать на уровне 0,5 л/мин/м2 с закрытой линией пермеата и широко открытой линией ретентата. Полная информация представлена на Фигуре 2C.
3.2.4 Вторая операция ФТП
После завершения реакции конъюгации проводят вторую диафильтрацию для буферного обмена конъюгированного ГЛУ и удаления излишков пептида и примесей, связанных с пептидом. Для этого второго этапа диафильтрации используют те же мембраны и те же операционные условия, что и для первой диафильтрации. После завершения второй диафильтрации ретентат удаляют с системы ФТП и фильтруют с помощью фильтра с размером пор 0,2 мкм. Промывание буфера выполняют через мембрану и собирают отдельно.
3.2.5 Краткое изложение экспериментов фильтрации в тангенциальном потоке
Фигуры 2A-2C резюмируют ключевые параметры работы для десяти серий экспериментов развития ФТП, полностью проведенных для того, чтобы разработать оптимизированный процесс. Эксперименты 121161-090, 121161-093, 121161-096, 121161-100 представляют собой набор серии начальных экспериментов для оценки соотношения линкер:ГЛУ, концентрации исходного раствора линкера и растворителя, концентрации исходного пептида. Кроме того, оценивают ПДММ мембраны (30 кДа по сравнению со 100 кДа).
Основной целью экспериментов 121161-120, 121161-125 и 121161-130 было определить рабочие параметры ФТП, такие как ТМД, скорость течения ретентата и поток. Эксперимент 121161-147 являлся повторением эксперимента 121161-125. Причины повторения эксперимента 121161-125 обсуждаются ниже. Эксперименты 121161-165 и 121161-172 представляли собой демонстрационные опыты процесса, который должен был быть передан на опытный завод. Эксперимент 121161-165 проводили с использованием загрузки 160 мг ГЛУ, а эксперимент 121161-172 проводили с помощью использования загрузки 1 г ГЛУ, чтобы оценить масштабируемость оптимизированного процесса.
Пример 4: Результаты и обсуждение разработки фильтрационного процесса
Ключевые аналитические результаты для всех экспериментов разработки процесса приведены на Фигурах 3A-3D. Окончательное лекарственное вещество использовали для всех тестов, за исключением определения плотности эпитопа, для которого использовали ретентат, восстановленный из системы ФТП перед добавлением наполнителей. Было неясно, будет ли ПС 80, который является одним из добавляемых наполнителей, влиять на анализ плотности эпитопа. Целевые диапазоны были основаны на результатах предыдущих клинических серий (например, серий 06-044-001 и 07-044-001, как продемонстрировано ниже в Таблице 3А) с учетом нормальных колебаний в анализах. Почти все эксперименты производили материал, который являлся целевым для всех анализов или по меньшей мере был близким к целевым диапазонам. Единственным исключением был % линкера, определенный при помощи АО-анализа, который был значительно выше в некоторых сериях по сравнению с другими.
чистота
ВЭЖХ
чистота
(димер)
(мономер)
Эксперименты 121161-090, -093, -096 и-100
Из экспериментов 121161-090, -093, -096 и -100 могут быть приняты некоторые решения в отношении реакции активации. Во-первых, после эксперимента 121161-090 было принято решение перейти от 100 кДа мембраны к мембране 30 кДа. Это решение было основано на возможных потерях активированного ГЛУ через мембрану. ОФ-ВЭЖХ-анализ пермеата, казалось, демонстрировал некоторую утечку активированного ГЛУ, однако, более поздняя работа установила, что анализ был склонен к переносу остатка при определенных условиях. Активированный ГЛУ, который видели в пермеате, был, скорее всего, за счет переноса остатков на колонку из предыдущих экспериментов, а не в результате утечки через мембрану.
Во-вторых, было принято решение включить ДМСО в процесс для того, чтобы обеспечить полное растворение линкера, таким образом, иметь больше контроля над соотношением линкер:ГЛУ. Из этих экспериментов было установлено, что ДМСО не обладает отрицательным влиянием на качество продукта. Поддерживался соответствующий профиль ГФХ, и плотность эпитопа была близка к целевому диапазону; однако, первоначальное соотношение 357:1 линкер:ГЛУ (121161-090 и 121161-100) приводило в результате к плотности эпитопа, которая была чуть выше желаемого диапазона, а соотношение 100:1 приводило в результате к слишком низкой плотности эпитопа (121161-093). Данные этих экспериментов и дополнительные данные из небольших экспериментов активации привели к решению установить соотношение линкер:ГЛУ на уровне 200:1.
Также было принято решение установить концентрацию исходного раствора линкера на уровне 100 мг/мл. Желаемым было сохранить концентрацию высокой, чтобы минимизировать количество ДМСО, которое добавляли во время реакции, но на уровне такой концентрации, при которой линкер растворяется быстро и легко. В эксперименте 121161-100 был использован исходный раствор линкера в концентрации 180 мг/мл, но растворение линкера было не таким быстрым, как при концентрации 100 мг/мл.
Концентрация пептидного исходного раствора была установлена на уровне 6 мг/мл. Эта исходная концентрация обеспечивала соответствующий объем раствора пептида, добавляемый в реакцию конъюгации, который приводил в результате к желаемым концентрациям пептида и активированного ГЛУ 1,5-2,0 мг/мл без дальнейшего добавления буфера. Окончательным решением на основе этих четырех экспериментов было установить значения NaPh буфера в реакции активации на 40 мМ.
Эксперименты 121161-120, -125, -130 и-147
Целью следующей серии экспериментов было определение оптимальных значений для параметров ФТП, таких как ТМД, скорость течения ретентата и поток. К этому времени произошла номинация композиции и, как следствие, второй буфер диафильтрации был изменен для всех предстоящих экспериментов на KPh буфер. Соотношение линкер:ГЛУ было установлено на уровне 200:1, и линкер был растворен в 100 мг/мл ДМСО. Эксперимент 121161-120 был поставлен для изучения нижнего уровня диапазона ТМД и скорости течения ретентата. Результаты анализа показали, что произведенный материал выполнил все целевые характеристики, за исключением того, что % линкера, измеренный с помощью АО, был значительно выше, чем наблюдаемый раньше. Это увеличение линкера первоначально считалось связанным со снижением скорости течения ретентата (50 мл/мин в сравнении со 100 мл/мин) между начальной серией из четырех экспериментов и экпериментом 121161-120.
Эксперимент 121161-125 был поставлен для решения гипотезы о том, что уменьшение скорости течения ретентата стало причиной снижения клиренса линкера. Профиль ГФХ продемонстрировал, что % димера был немного за пределами целевого диапазона, а плотность эпитопа, на уровне 36 пептидов/ГЛУ, была близкой к нижней границе целевого диапазона (30-64 пептидов/ГЛУ), однако, клиренс линкера значительно улучшился (0,3% относительно 3,0% по сравнению с экспериментом 121161-120).
Для эксперимента 121161-130 было принято решение попробовать большее значение пор ПДММ мембраны (100 кДа), чтобы попытаться улучшить клиренс примесей. В то же время соотношение линкер:ГЛУ было увеличено до 250:1, чтобы увеличить плотность эпитопа, приводящую в результате к значению пептид/ГЛУ ближе к середине целевого диапазона. Полученный в результате материал выполняет все аналитические цели, за исключением % линкера, который увеличился до 3,4%. Поскольку для этого эксперимента было изменено два параметра (размер пор мембраны ПДММ и соотношение линкер:ГЛУ), было неясно, что вызвало увеличение % линкера по сравнению с экспериментом 121161-125. Было принято решение вернуться к использованию пор ПДММ мембраны 30 кДа, поскольку эксперимент 121161-130 не продемонстрировал никаких преимуществ в использовании мембраны с размером пор100 кДа.
Для решения вопросов относительно нормального уровня % линкера в разбросе характеристик от серии к серии было принято решение повторить эксперимент 121161-125 как можно точнее, чтобы определить, может ли низкий уровень % линкера быть достигнут вновь. Результаты этого эксперимента продемонстрировали, что хотя уровень линкера снизился до 1,9%, он все еще не был столь низким, как в более ранних экспериментах (<1%). Чтобы оценить истинное влияние этих уровней примесей линкера, были выполнены расчеты, чтобы определить корреляцию между % по площади и фактическим количеством частей на миллион. Было определено, что уровни % линкера по площади, наблюдаемые в процессе разработки экспериментов, соответствовали <3 частей на миллион, таким образом, фактическое количество примесей линкера по массе является достаточно маленьким и находится на приемлемом уровне.
Эксперименты 121161-165 и-172
Эксперимент 121161-165 представлял собой демонстрационный эксперимент в лабораторном масштабе с использованием загрузки 160 мг ГЛУ для проверки приемлемости материала, изготовленного при помощи оптимизированных параметров, определенных во время разработки процесса. Эти параметры приведены на Фигурах 2A-2C, и аналитические результаты продемонстрированы на Фигурах 3A-3D. Чтобы создать дополнительную уверенность в оптимизированном процессе, был проведен более крупномасштабный лабораторный эксперимент. Этот эксперимент (121161-172) использовал загрузку 1 г ГЛУ. Параметры ФТП приведены на Фигурах 2A-2C, а аналитические результаты - на Фигурах 3A-3D. Параметры для расширения процесса до 1 г были основаны на сохранении потока постоянным (см. Таблицу 3В ниже). Кроме того, в Таблице 3B представлены параметры масштабируемого увеличения, которые могут быть использованы для запуска процесса при масштабе 10 г.
эксперимент
Пример 5: Процесс разработки реакционных параметров
5.1 Материалы и способы
Следующие материалы процесса и оборудование были использованы в ходе данного исследования: гемоцианин лимфы улитки (ГЛУ), коммерчески доступный как Vacmune® (Biosyn Corporation, серии 739690V1, R625258, 817873V1 и 817873V2); EGFRvIII-пептид (Ambiopharm Inc., серия APi 080616); EGFRvIII-пептид (Chinese Peptide Corporation (CPC), серия № CH-0600453); сульфосукцинимидил 4-[N-малеимидометил]циклогексан-1-карбоксилат (сульфо-СМЦК) (Thermo, различные серии, № по каталогу 22322); диметил сульфоксид (ДМСО) безводный 99,9% (Sigma Catalog № 276855 или эквивалент); NaPh буфер = 100 мM натрия фосфата, pH 7,2; ФСБ = Gibco 1x ФСБ, pH 7,2 (Gibco, № по каталогу 20012) или Dulbeccos 1x ФСБ (Gibco, № по каталогу 14190), или OmniPur 10x фосфатный солевой буфер, разведенный до 1x (VWR, № по каталогу EM6506); стеклянные ВЭЖХ флаконы объемом 2 мл для реакций <2мл (Agilent, номер по каталогу 5182-0715 или эквивалент); конусообразные полипропиленовые пробирки объёмом 15 мл для реакций ≥2 мл; центрифужные фильтры Amicon 50K и 100K (Millipore, номера по каталогу UFC805906 и UFC810096) или эквивалент; хроматографическая колонка Zeba Desalt Spin Columns, 0,5 мл (Thermo, номер по каталогу 89883); настольная центрифуга.
5.2 Способы
Оптимизированный процесс производства включает в себя: 1) реакцию активации, которая ковалентно связывает аминогруппы белка ГЛУ с NHS-эфирными группами сульфо-СМЦК линкера, чтобы сформировать активированный ГЛУ, 2) начальный этап ФТП, чтобы удалить излишки линкера и связанных с линкером примесей, 3) реакцию конъюгации, которая ковалентно присоединяет C-концевой цистеин синтетического пептида EGFRvIII к малеимидной группе сульфо-СМЦК линкера, который является частью активированной ГЛУ-молекулы, образующей конъюгированный CDX-110, а затем 4) второй этап ФТП, чтобы удалить излишки пептида и связанных с пептидом примесей и для замены буфера. В настоящем отчете описывается оптимизация условий реакции с использованием уменьшенной системы, называемой реакцией в одном сосуде. В этом исследовании использовали коэффициент экстинкции, равный 1,30 для ГЛУ и активированного ГЛУ, и 1,38 для CDX-110.
Реакция в одном сосуде
ГЛУ вносят в виде аликвоты в стеклянный флакон ВЭЖХ объемом 2 мл или полипропиленовую пробирку объемом 15 мл, разбавляют буфером NaPh и, аккуратно переворачивая, смешивают. Раствор линкера (предварительно растворенный либо в воде, либо в ДМСО) добавляют в смесь ГЛУ, кратко встряхивая (15-30 с), а затем держат в течение 45±5 минут в орбитальном смесителе. Через 45 минут начинают конъюгацию тушением реакции раствором пептида в соотношении пептид:линкер 4:1 и кратко встряхивают (15-30 секунд). Реакции конъюгации позволяют реагировать в течение ~ от 2 до 3 часов в орбитальном смесителе и затем держат в течение ночи в смесителе или в холодильнике до замены буфера. Пептиды и связанные с пептидами примеси удаляют при помощи диафильтрации с применением центробежного фильтра Millipore Amicon, до того, как проводят анализ плотности эпитопа. Реакционные параметры корректируют по мере необходимости, чтобы собрать сведения о желаемых переменных, таких как соотношение линкер:белок, время активации, концентрация белка, а также процент ДМСО. Каждый эксперимент кратко описан в следующем разделе. Фигуры 4A-4C содержат краткую информацию о параметрах реакции, которые использовались для каждого эксперимента.
Эксперимент № 122123-065
ГЛУ активируют с сульфо-СМЦК при молярных соотношениях линкер:ГЛУ, варьирующих в диапазоне между 100:1 и 357:1, в течение ~45 минут. Сульфо-СМЦК линкер перед добавлением растворяют ДМСО до концентрации 8 мг/мл. Пептид при молярном соотношении 242:1 (пептид:ГЛУ) сразу же добавляют в реакцию в конце активации. Соотношение пептид:ГЛУ удерживается на уровне 242:1 и не может быть в избытке в экспериментах с более высоким соотношением линкера. Увеличенное соотношение пептид:линкер использовали в экспериментах позже.
Эксперименты под номерами 122123-097, 122123-109, 122123-112
ГЛУ активируют с сульфо-СМЦК при молярных соотношениях линкер:белок, варьирующих в диапазоне между 100:1 и 440:1, в течение ~45 минут. Сульфо-СМЦК линкер перед добавлением растворяют в воде до концентрации 8 мг/мл или в ДМСО до 30 мг/мл. ДМСО не присутствует в эксперименте 122123-097. Концентрация ДМСО колеблется от 3,5% до 15,6% для эксперимента 122123-109 и поддерживается постоянной на уровне 15,6% для эксперимента 122123-112. Пептид в молярном соотношении пептид:линкер 2,42:1 немедленно добавляют в реакцию в конце активации для эксперимента 122123-097. Хотя результаты были приемлемыми, молярное соотношение пептид:линкер для последующих экспериментов увеличивали до 4:1 для обеспечения наличия пептида в избытке.
Эксперимент № 122123-115
Эксперимент 122123-115 изучал процент ДМСО, молярное соотношение сульфо-СМЦК:ГЛУ и концентрацию белка, используя полный факториальный дизайн экспериментов (ДЭ), показанный на Фигуре 4C. Сульфо-СМЦК линкер перед добавлением растворяют в ДМСО до концентрации 121,8 мг/мл. Пептид в молярном соотношении пептид:линкер 4:1 немедленно добавляют в реакцию в конце активации.
Эксперимент № 122123-190
ГЛУ активируют с сульфо-СМЦК при молярных соотношениях линкер:белок, варьирующих в диапазоне между 25:1 и 350:1, в течение различных промежутков времени активации в соответствии с Фигурой 4A. Сульфо-СМЦК линкер перед введением растворяют в ДМСО до 100 мг/мл. Пептид в молярном соотношении пептид:линкер 4:1 немедленно добавляют в реакцию в конце активации.
Пример 6: Результаты процесса разработки реакционных параметров
Основное внимание в процессе разработки параметров реакции было уделено оптимизации параметров реакции с использованием уменьшенной системы. Реакционные объемы составляют менее 2 мл, и клиренс пептида достигают за счет использования центробежного фильтра Amicon. Клиренс пептида необходим для того, чтобы иметь точный анализ плотности эпитопа. Тенденции, сгенерированные с использованием уменьшенной реакции, могут быть использованы для понимания влияния и взаимодействий параметров процесса, но клиренс пептида не является эквивалентным непрерывной операции ФТП. Аналитические отличительные черты, значительные для реакции оптимизации, представляют собой плотность эпитопа и профиль распределения по размерам. Чистоту конъюгатов, полученную при помощи АО и/или ОФ-ВЭЖХ, используемую для гарантии того, что пептид был удален до анализа аминокислотного состава, не включен в настоящий документ. Цели для оптимизированного процесса перечислены ниже в Таблице 4.
Цели для качества лекарственного вещества CDX-110 <2%
<2%
Пик 2 8-17%
8-17%
Пик 3 50-60%
50-60%
Пик 4 20-30%
20-30%
Пик 5 1-5%
1-5%
ОФ-ВЭЖХ
Линкер или связанные с линкером примеси ≤1% Общие пептидно-линкерные примеси ≤10%
Фигура 5 содержит типичные ГФХ ВЭЖХ хроматограммы для CDX-110, демонстрирующие приблизительное время удержания пяти пиков. Пики 1 и 2 считаются видами высокой молекулярной массы, пик 3 считается димером, пик 4 считается мономером, и пик 5 считается видом низкой молекулярной массы.
6.1 Реакция в одном сосуде
Уменьшенная модель реакции включает тестирование множества параметров одновременно и использует реакционные объемы менее 2 мл. Хотя некоторые эксперименты удаляют линкер из активации путем медленной диафильтрации фильтрами Amicon, большинство экспериментов используют модель реакции в одном сосуде. Система в одном сосуде гасит реакцию активации и любые примеси линкера с увеличением молярного соотношения пептида (молярное соотношение пептид:линкер 4:1) вместо очищения реакции от линкера. Способы удаления линкера при этом небольшом масштабе были либо не эффективны для удаления примесей, либо могли изменить распределение ГФХ во время переработки.
Реакция в одном сосуде не смешивает операционное время с протестированными переменными и может демонстрировать истинные тенденции параметров активации. Однако, результаты распределения ГФХ из реакции в одном сосуде, как правило, не всегда находятся в целевом диапазоне для процессов лекарственного вещества из-за отсутствия ФТП во время операции. Распределение ГФХ и плотность эпитопа продолжают меняться с течением времени, как показано на активированном ГЛУ после клиренса линкера и для времени активации (см. раздел 6.2). Влияние времени на распределение ГФХ и плотность эпитопа было учтено при выборе параметров для оптимизированного процесса.
6.2 Молярное соотношение сульфо-СМЦК:ГЛУ и время активации
Плотность эпитопа
Увеличение плотности эпитопа, связанное с увеличением соотношения линкера в эксперименте 122123-190, соответствует полиному второго порядка, показанному на Фигуре 6. Кривая второго порядка была использована в предварительных оценках кинетической модели. Эта соответствующая кривая может быть использована для прогнозирования плотности эпитопа в данном соотношении линкер:белок с использованием тех же условий активации. Результаты эксперимента 122123-065, также показанные на Фигуре 6, сравнимы с экспериментом 122123-190.
Соотношение линкер:белок 200:1, выбранное для оптимизированного процесса, приводит в результате к плотности эпитопа, равной ~45 пептидов/ГЛУ при использовании схемы реакции в одном сосуде. Соотношение 200:1 обеспечивает средний диапазон плотности эпитопа, и весь целевой диапазон 30-64 пептидов/ГЛУ может быть достигнут путем молярного соотношения линкера 200±125 со временем активации 45 минут. Ожидаемая для процесса производства плотность эпитопа будет меньше, чем плотность эпитопа с учетом времени на обработку для удаления линкера путем диафильтрации.
Время активации ~150 минут приводит в результате к максимальной плотности эпитопа ~80 пептидов/ГЛУ для реакции с использованием молярного соотношения 350:1 сульфо-СМЦК: ГЛУ и максимальной плотности эпитопа ~60 пептидов/ГЛУ для реакции с использованием соотношения сульфо-СМЦК:ГЛУ 200:1 (Фигура 7). После 150 минут плотность эпитопа, достигнутая для каждого соотношения линкера, начинает уменьшаться. Снижение плотности эпитопа со временем может быть связано с гидролизом активного малеимида или с деградацией линкера.
Подобные кривые плотности эпитопа получены в результате активации как в течение 45 минут, так и в течение 4 часов (см. Фигуру 6). Сходство кривых связано с результатами времени активации, продемонстрированными на Фигуре 7, где 45 минут и 250 минут (4 часа) имеют одинаковые плотности эпитопов. Высшая плотность эпитопа может быть достигнута в аналогичных условиях, если такая же кривая соотношения линкера была создана на максимуме (150 мин).
Распределение ГФХ
Хотя для определения формы кривой необходимо больше точек данных, результаты ГФХ из эксперимента 122123-190, продемонстрированные на Фигурах 8А и 8B, соответствовали линейной кривой, демонстрируя общую тенденцию. Виды мономера (пик 4), как было показано, увеличиваются, в то время как было показано, что виды высокой молекулярной массы (пик 2) и виды димера (пик 3) уменьшаются с увеличением соотношения линкер:белок. В оптимизированных условиях процесса, при соотношении линкер:белок 200:1 и со временем активации 45 минут, распределение ГФХ не соответствует процессу получения лекарственного вещества, потому что реакции проводили с использованием модели реакции в одном сосуде без дополнительного времени удержания или времени обработки.
Виды высокой молекулярной массы (пики 1, 2 и 3) формируются с течением времени при реакции активации. Это наблюдение является постоянным, независимо от соотношения линкер:белок. ГФХ-результаты для времени активации (Фигуры 9А и 9B) также соответствуют линейной кривой, демонстрируя общую тенденцию, хотя фактические отношения могут не быть линейными.
Результаты для пиков 1 и 5 не представлены, но в целом следуют аналогичным тенденциям видов с более высокой молекулярной массой со сниженным соотношением линкер:белок и увеличенным временем активации, однако, процент каждого вида или изменения значений является очень маленьким.
Прямые отношения между плотностью эпитопа и гетерогенностью ГФХ не обнаружены. Каждый находится под влиянием одних и тех же параметров, но не обязательно таким же образом. Параметры для оптимизированного процесса были выбраны с учётом того, как все эти параметры взаимодействуют. Если операционное время для ФТП процесса объединить с изменениями в распределении ГФХ с течением времени, все пики ГФХ и плотность эпитопа будут находиться в пределах целевого диапазона.
6.3 Растворение линкера
Сульфо-СМЦК линкер в предыдущем процессе был суспендирован в фосфатном буфере перед началом активации. Линкер не растворяется в водном буфере при этой концентрации, что приводит в результате к образованию суспензии линкера. Сульфо-СМЦК является полностью растворимым в ДМСО в концентрации более чем 100 мг/мл и обладает рядом преимуществ, которые сделают весь процесс более надежным. Эти преимущества включают: 1) уменьшение гидролиза линкера - линкер начнет деградировать и подвергаться гидролизу, как только он входит в контакт с водным раствором, но должен оставаться стабильным в безводном ДМСО, который будет обеспечивать большую гибкость для производства; и 2) лучший контроль соотношения линкер:белок - перенос и растворение суспензии труднее контролировать по сравнению с водным раствором. Небольшие изменения в соотношении линкера могут существенно повлиять на плотность эпитопа и распределение ГФХ.
Суспензия линкера в сравнении с растворением в ДМСО
Плотность эпитопа была схожей для соотношений линкер:белок 100:1 и 440:1 при сравнении с тем, когда линкер добавляют в виде суспензии (без ДМСО) и когда линкер растворяют в ДМСО (Фигура 10). Это наблюдение согласуется с результатами, приведенными на Фигуре 6, на которой сравниваются эксперименты 122123-065 (без ДМСО) и 122123-190 (ДМСО <3,4%), которые также имели подобные плотности эпитопа для реакций с ДМСО и без него.
Было зарегистрировано, что ДМСО, добавленный к реакции активации, уменьшает количество видов с высокой молекулярной массой (Фигуры 11А и 11В). Димер (пик 3) и мономер (пик 4) изменились на 10-15% по мере того как ДМСО увеличилась от 0% до ~15,6%. Пики 1, 2 и 5, как правило, следуют той же тенденции, хотя процент каждого вида или изменения значения является очень маленьким.
6.4 ДЭ для установления влияния ДМСО, концентрации белка и соотношения сульфо-СМЦК
Первые эксперименты, рассматривающие суспензию линкера, продемонстрировали практически отсутствие изменений плотности эпитопа и существенное влияние ДМСО на распределение ГФХ. Дополнительный эксперимент 122123-115 был разработан для дальнейшего изучения влияния ДМСО с использованием полного факториального дизайна эксперимента (ДЭ). Эксперимент был разработан, чтобы протестировать ДМСО (4,7%-15,6%), молярное соотношение линкер:белок (200:1-357:1) и концентрацию белка (5-15 мг/мл).
Плотность эпитопа
Результаты анализа вариаций (ANOVA) плотности эпитопа с 95% доверительным интервалом показывают, что соотношение линкер:белок является статистически значимым фактором. Плотность эпитопа увеличивается тогда, когда присутствует больше сульфо-СМЦК, что согласуется с результатами, которые обсуждаются в разделе 6.2. Хотя это и не является статистическим взаимодействием, окончательная плотность эпитопа, полученная для данного соотношения сульфо-СМЦК, находится под влиянием концентрации белка и ДМСО. При низких концентрациях ДМСО (4,7%) влияние на плотность эпитопа является незначительным (Фигура 12А), в то время как при высоких концентрациях ДМСО (15,6%) плотность эпитопа компенсируется посредством около 10 пептидов/ГЛУ, в зависимости от концентрации белка (Фигура 12B).
Если доверительный интервал сокращается до 90%, концентрация белка и взаимодействие между концентрацией белка и ДМСО также становятся значительными параметрами, влияющими на плотность эпитопа. При концентрации ДМСО, равной 4,7%, наблюдаются незначительные изменения в плотности эпитопа. При концентрации белка от 5 мг/мл до 7,5 мг/мл плотность эпитопа начинает увеличиваться с увеличением процента ДМСО в реакции. При концентрации белка от 12 мг/мл до 15 мг/мл плотность эпитопа начинает уменьшаться с увеличением процента ДМСО в реакции.
ГФХ распределение
Результаты ANOVA-анализа димера (пик 3) с 95% доверительным интервалом означают, что соотношение линкер:белок, процент ДМСО, концентрация белка, а также взаимодействие между процентом ДМСО и концентрацией белка являются статистически значимыми факторами. Димер (пик 3) уменьшается при присутствии большего количества сульфо-СМЦК, что согласуется с результатами, которые обсуждаются в разделе 6.2. Хотя это и не является статистическим взаимодействием, процентное содержание димера, полученное для данного соотношения сульфо-СМЦК, находится под влиянием концентрации белка и ДМСО. При высоких концентрациях ДМСО (15,6%) влияние на плотность эпитопа является незначительным (Фигура 13B), а при низких концентрациях ДМСО (4,7%) плотность эпитопа компенсируется до 15%, в зависимости от концентрации белка (Фигура 13A).
Влияние взаимодействия между концентрацией белка и ДМСО на димер (пик 3) можно резюмировать следующим образом. При концентрации ДМСО, равной 15,6%, наблюдаются незначительные изменения плотности эпитопа. При концентрации белка от 5 мг/мл до 11,5 мг/мл димер (пик 3) начинает увеличиваться со снижением процента ДМСО в реакции.
Концентрация белка для оптимизированного процесса (10 мг/мл) не изменилась по сравнению с исходным процессом. При этой концентрации димер (пик 3) изменяется незначительно по мере повышения процента ДМСО от 4,7% до 15,6%. Результаты анализа ANOVA мономера (пик 4) с 95% доверительным интервалом означают, что оба фактора, соотношение сульфо-СМЦК и процент ДМСО, являются статистически значимыми. Мономер увеличивается, когда присутствует больше сульфо-СМЦК и больше ДМСО, что согласуется с результатами, которые обсуждаются в разделе 6.2.
6.5 Оптимизированный процесс
Фигура 14 обобщает реакционные параметры, используемые как для исходных, так и для оптимизированных процессов. Изменения в условиях реакции (выделены жирным шрифтом) представляют собой такие: 1) растворение сульфо-СМЦК в безводном ДМСО - снижение гидролиза линкера и предоставление лучшего контроля соотношения сульфо-СМЦК линкера, 2) снижение молярного соотношения сульфо-СМЦК до 200x - это изменение было проведено для того, чтобы компенсировать растворение линкера в ДМСО, 3) температура снижена до 15°C, 4) концентрация исходного раствора пептида увеличена с учетом концентрации ГЛУ после операции ФТП. Поскольку пептид является растворимым при >20 мг/мл, и димеризация является медленной, это также должно оказывать незначительное влияние на реакцию.
Пример 7: Подсчет частиц
Фармакопея США <788> (USP <788> вещества твердых частиц в инъекциях) устанавливает определенные критерии и протоколы, касающиеся измерения количества частиц в одном флаконе. Как указано в USP <788>, для определения твердых частиц могут быть использованы две процедуры: способ подсчета частиц по затуханию света, а также микроскопический способ подсчета частиц. Критерии, изложенные в USP <788>, представляют собой следующие: частиц размером ≥10 мкм - не более 6000/контейнер, а частиц размером ≥25 мкм - не более 600/контейнер. Для CDX-110 было проведено исследование, сравнивающее две композиции в момент времени = 0 и в конце 26 недель при температуре 5°C, чтобы определить влияние компонентов композиции на подсчет частиц с помощью стандартных протоколов, приведенных в USP <788>. Первая композиция (композиция А) содержит 1,0 мг/мл ГЛУ-EGFRvIII-конъюгата CDX-110 1,0 мг/мл, 10 мМ фосфатного буфера (Na2HPO4/KH2PO4), 137 мМ NaCl и 2,7 мМ KCl. Вторая композиция (Композиция B) содержит 1,0 мг/мл ГЛУ-EGFRvIII-конъюгата CDX-110, 10 мМ калий-фосфатного буфера, 90 мг/мл трегалозы и 0,2 мг/мл полисорбата 80.
В таблице 5 и в таблице 6 перечислен подсчет частиц для Композиции A в момент времени = 0 и в конце 26 недель при температуре 5°C, соответственно. В таблице 7 и таблице 8 перечислен подсчет частиц для Композиции B в момент времени = 0 и в конце 26 недель при температуре 5°C, соответственно. Данные демонстрируют незначительное увеличение содержания частиц в конце 26 недель для Композиции B. Значительное увеличение суб-видимых частиц размером более 10 мкм и 25 мкм, однако, наблюдается через 26 недель для Композиции А по сравнению с Композицией B.
Подсчет частиц для Композиции A в момент времени = 0
Подсчет частиц для Композиции A в момент времени = 26 недель, 5°C
Подсчет частиц для Композиции A в момент времени = 0
Подсчет частиц для Композиции В в момент времени = 26 недель, 5°C
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕТИЧЕСКИЙ ПЕПТИД ДЛЯ ПОЛУЧЕНИЯ МОНОСПЕЦИФИЧНЫХ АНТИТЕЛ ПРОТИВ ИЗОФОРМЫ 2 ЭУКАРИОТИЧЕСКОГО ФАКТОРА ЭЛОНГАЦИИ ТРАНСЛЯЦИИ 1А | 2013 |
|
RU2562880C2 |
| ЖИДКАЯ КОМПОЗИЦИЯ ДЛИТЕЛЬНО ДЕЙСТВУЮЩИХ ИНСУЛИНА И ИНСУЛИНОТРОПНОГО ПЕПТИДА | 2013 |
|
RU2643766C2 |
| ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЬЮГАТ ГИАЛУРОНОВОЙ КИСЛОТЫ, ЛИНКЕРА И ДВОЙНОГО АГОНИСТА GLP-1/ГЛЮКАГОНА | 2016 |
|
RU2719482C2 |
| КОНЪЮГАТЫ АНАЛОГОВ ЭКСЕНАТИДА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2017 |
|
RU2764547C2 |
| ЛИПОСОМЫ, СОДЕРЖАЩИЕ ПРОНИКАЮЩИЕ В КЛЕТКИ ПЕПТИДЫ И ТЕТРАЭФИРНЫЕ ЛИПИДЫ, ДЛЯ ПЕРОРАЛЬНОЙ ДОСТАВКИ МАКРОМОЛЕКУЛ | 2016 |
|
RU2743431C2 |
| Жидкая композиция конъюгата инсулинотропного пептида длительного действия | 2013 |
|
RU2671576C2 |
| СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЯ, АССОЦИИРОВАННОГО С ОТЛОЖЕНИЕМ АМИЛОИДНЫХ БЕЛКОВ (ВАРИАНТЫ) | 2010 |
|
RU2533806C2 |
| ГЛИЦЕРИН-СВЯЗАННЫЕ ПЭГИЛИРОВАННЫЕ САХАРА И ГЛИКОПЕПТИДЫ | 2007 |
|
RU2460543C2 |
| СОСТАВЫ АНАЛОГОВ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-2 (GLP-2) | 2019 |
|
RU2833459C2 |
| Вакцинная композиция и ее применения | 2016 |
|
RU2726411C2 |

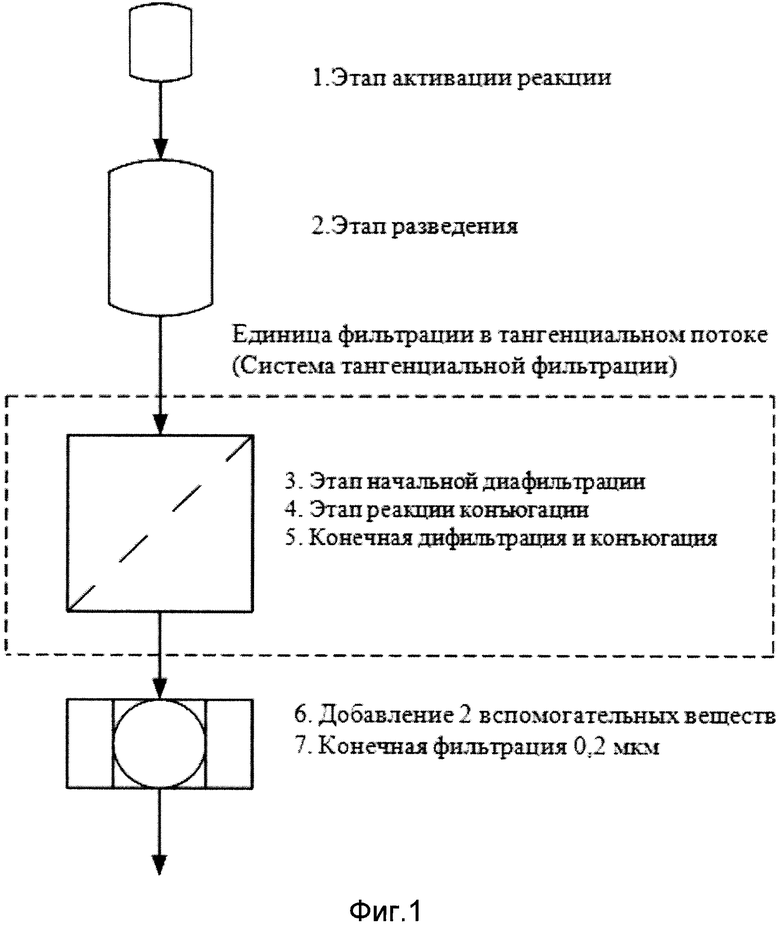
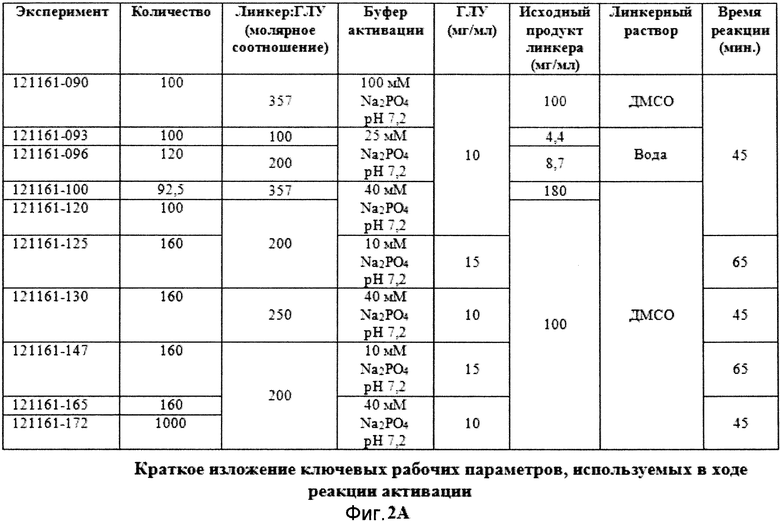
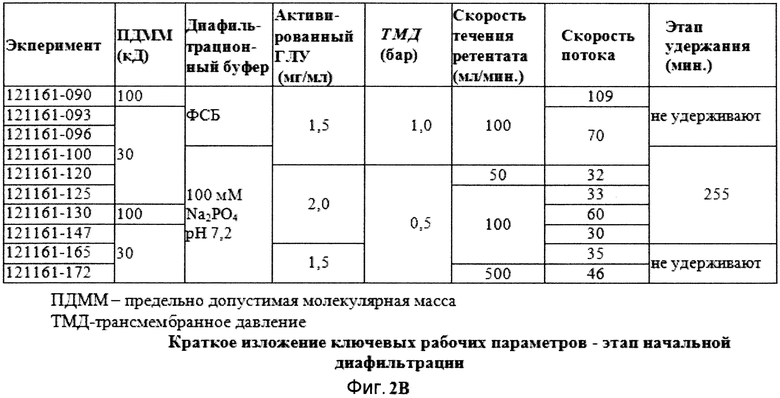

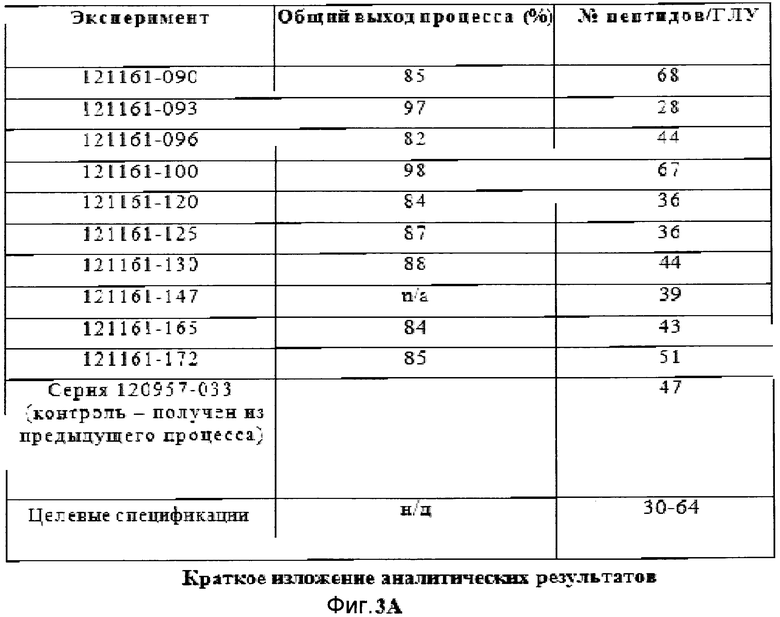
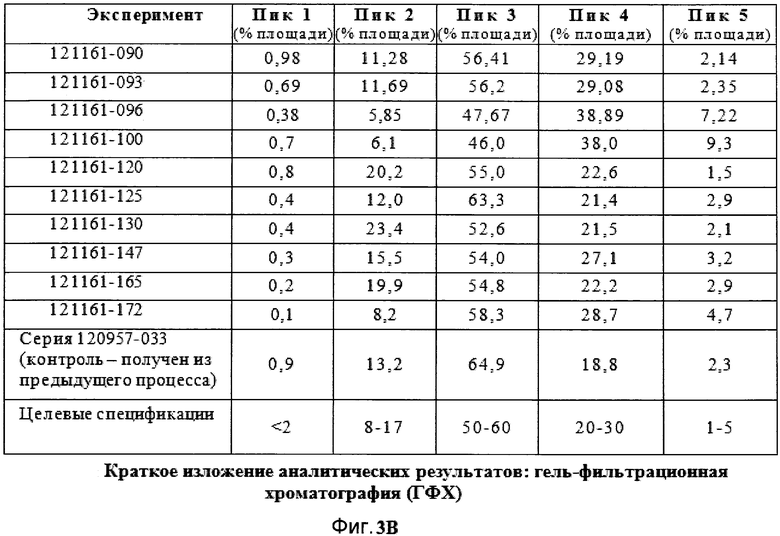
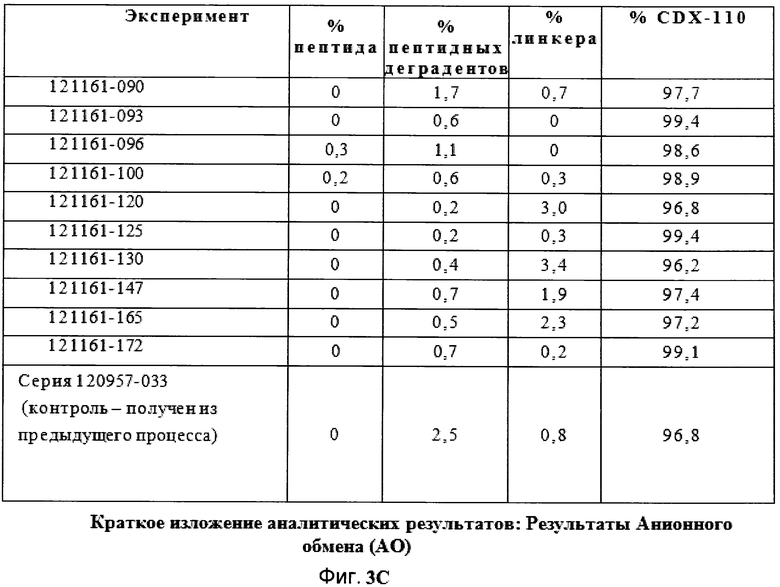
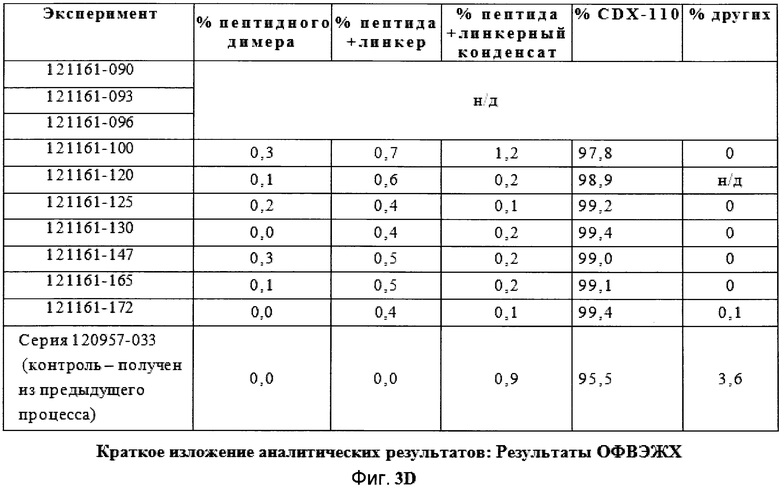
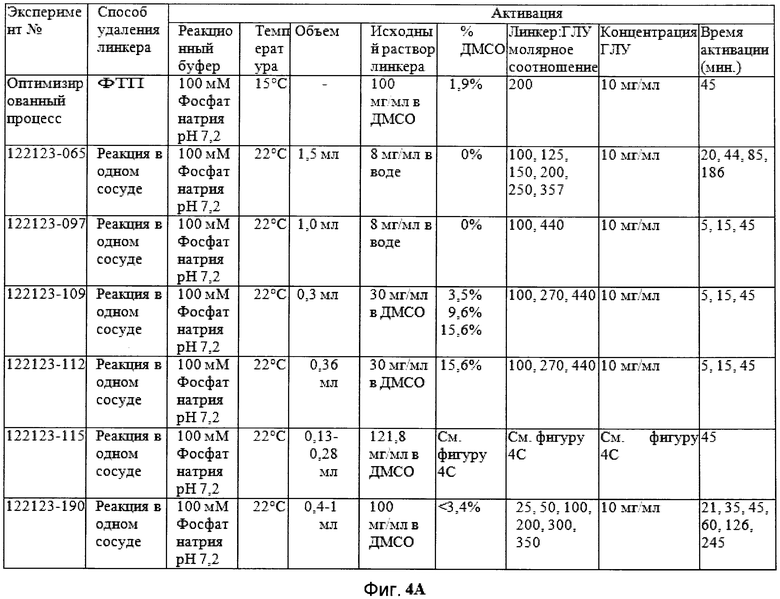
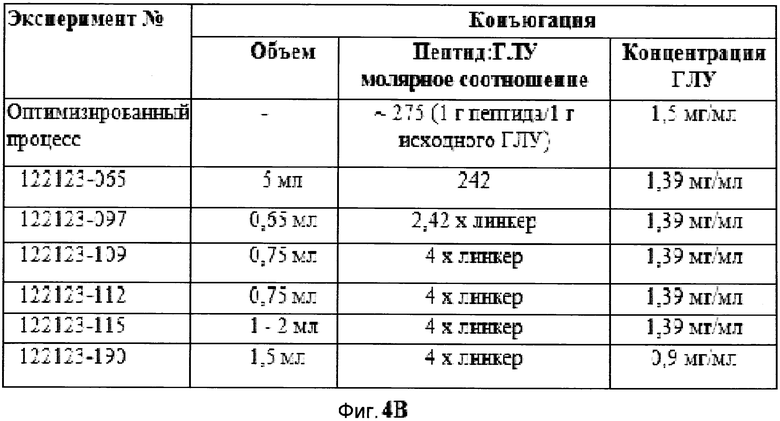
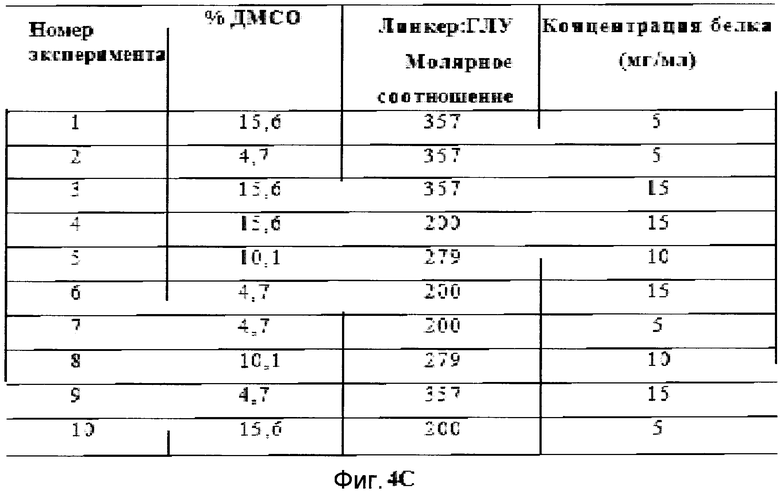
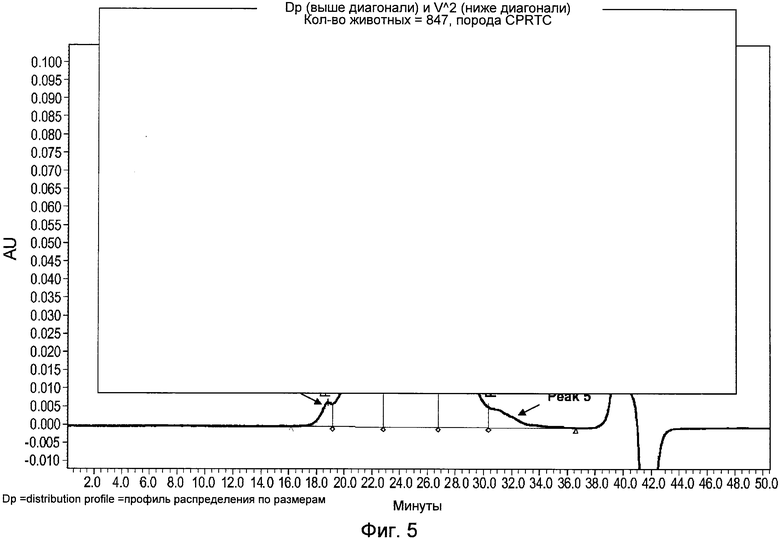
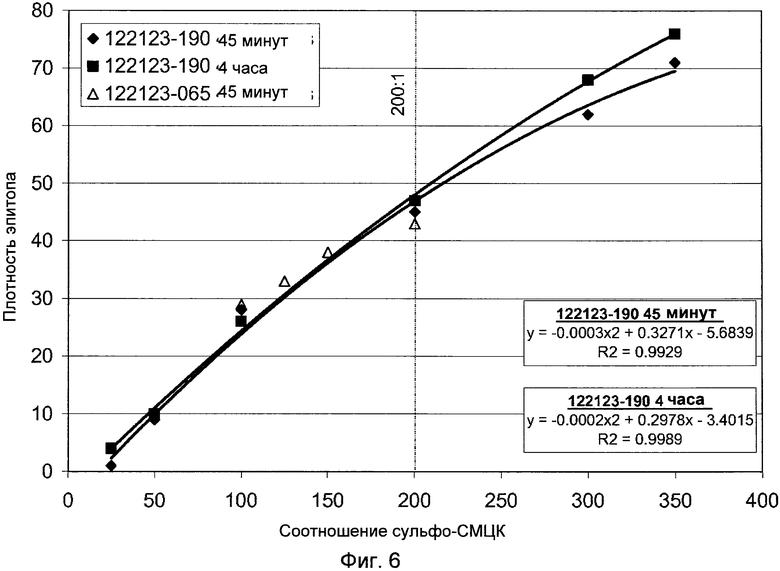
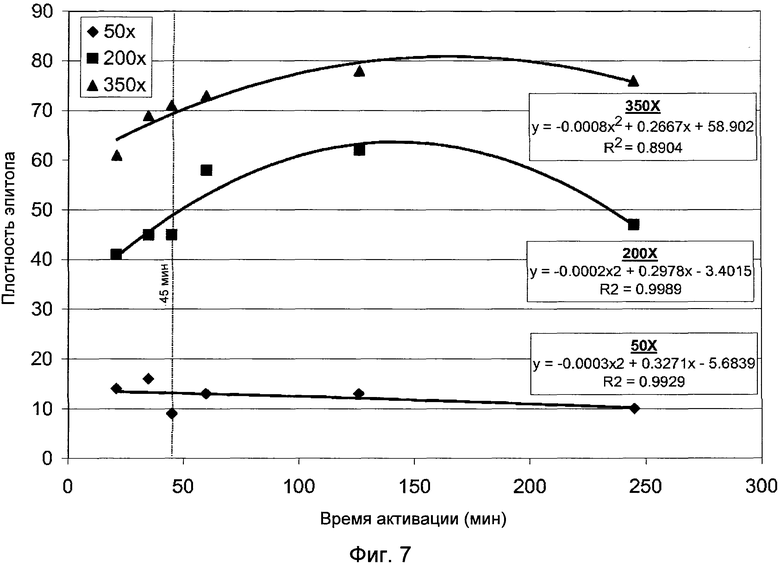
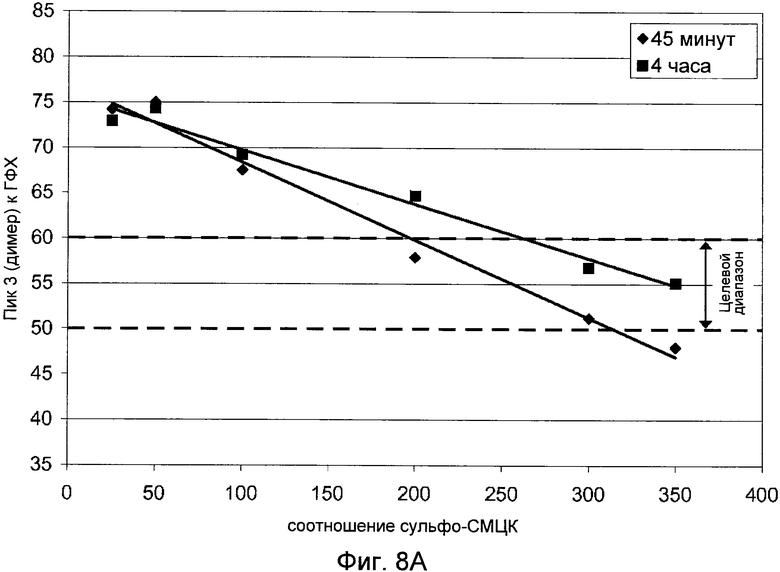
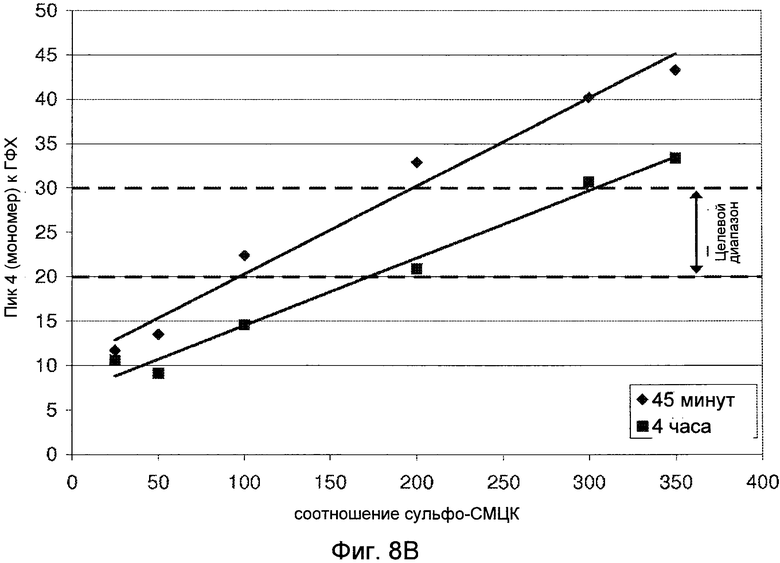
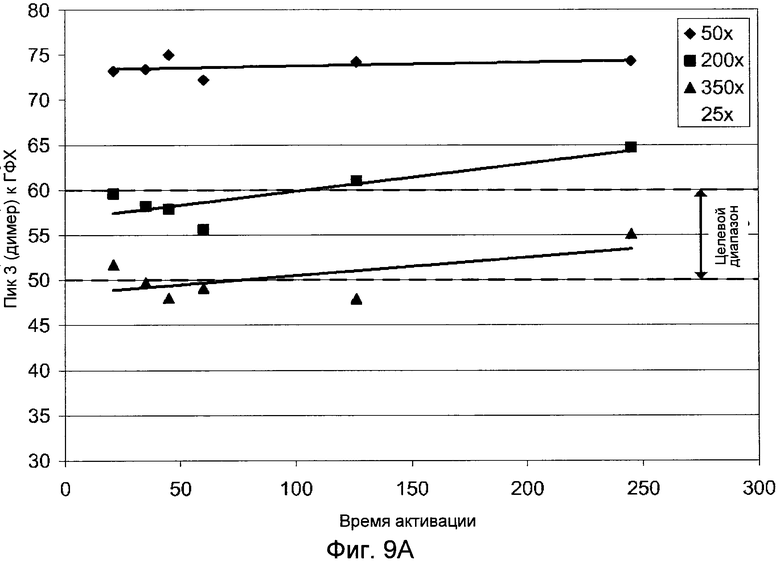
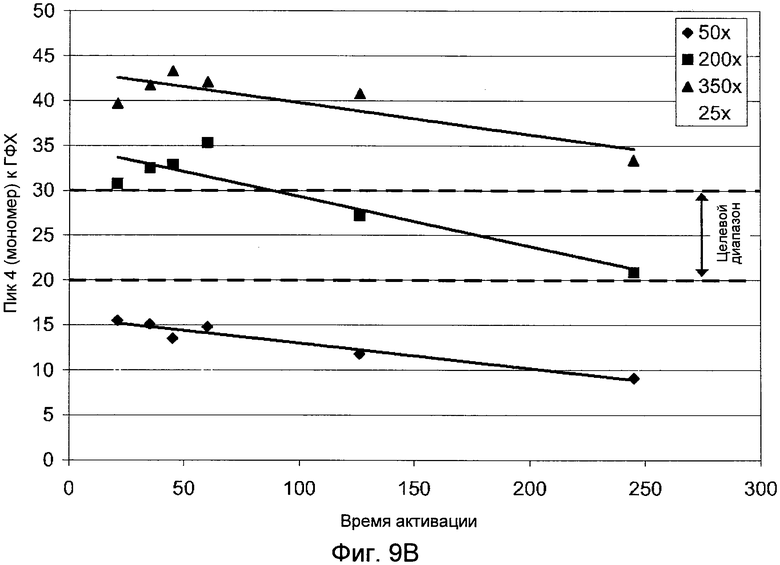
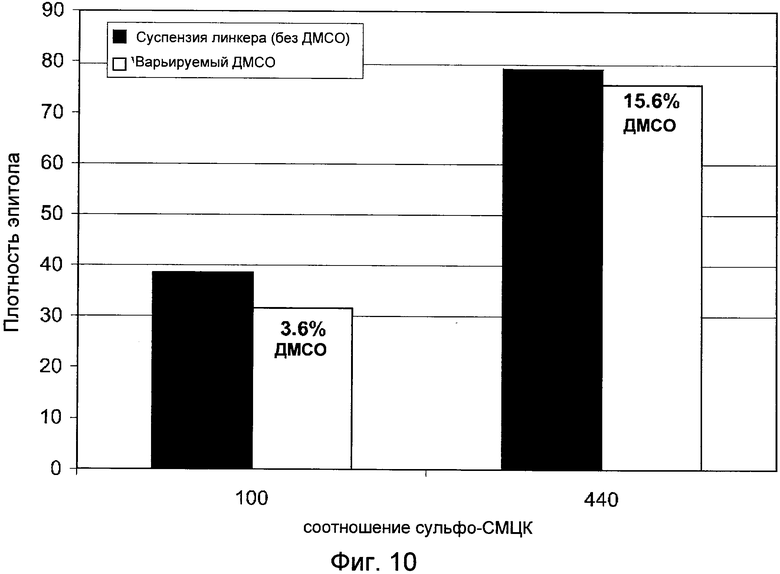
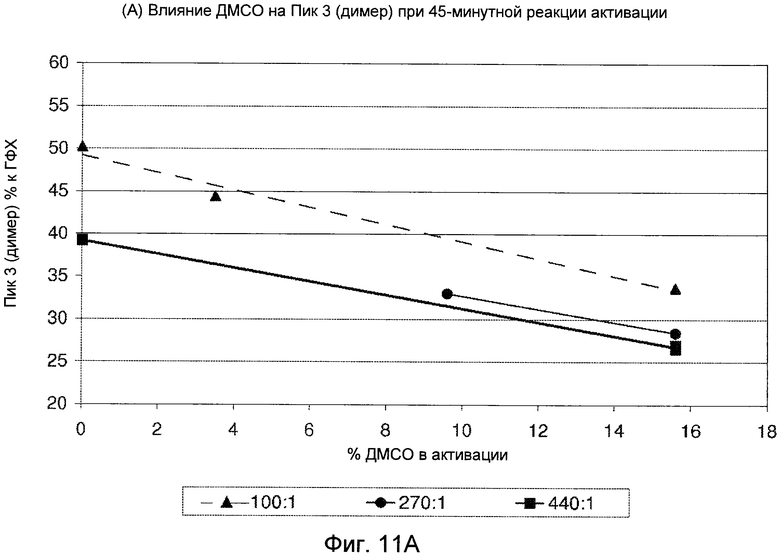
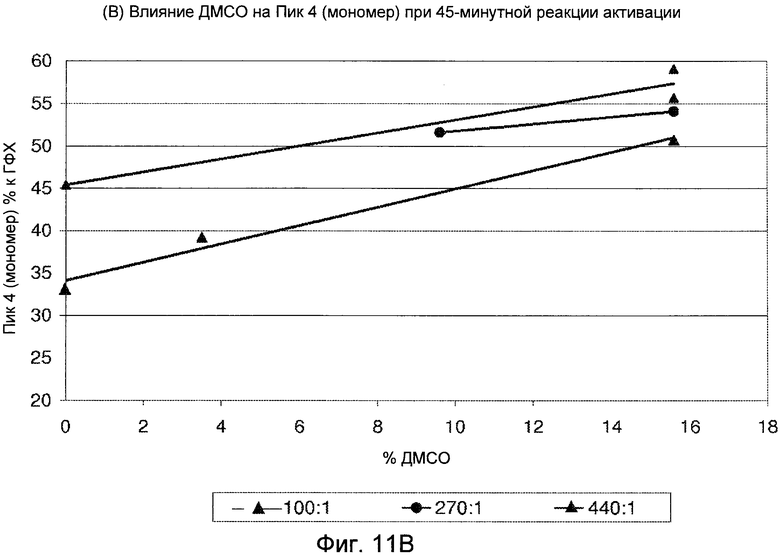
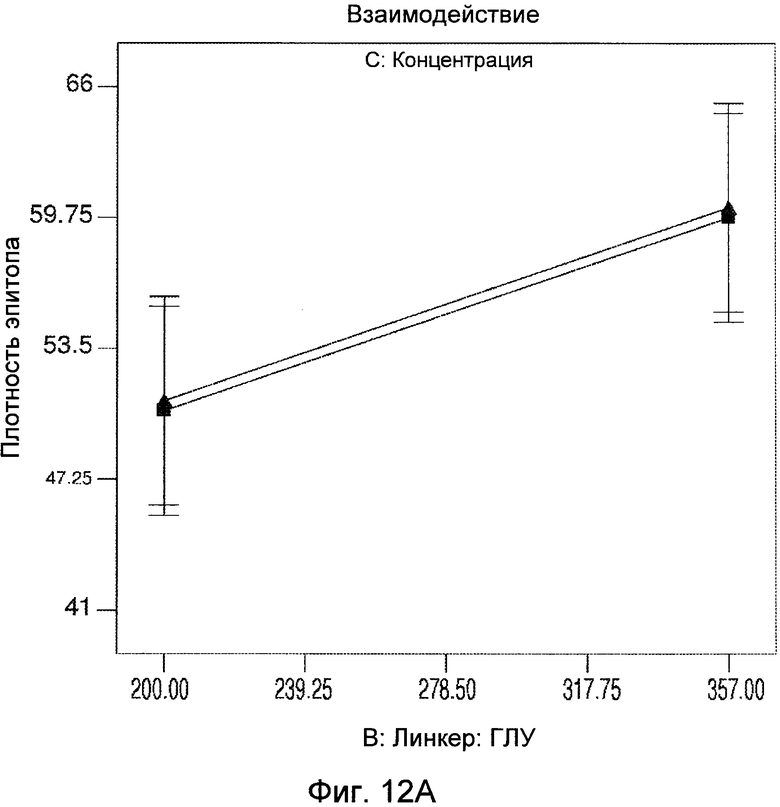
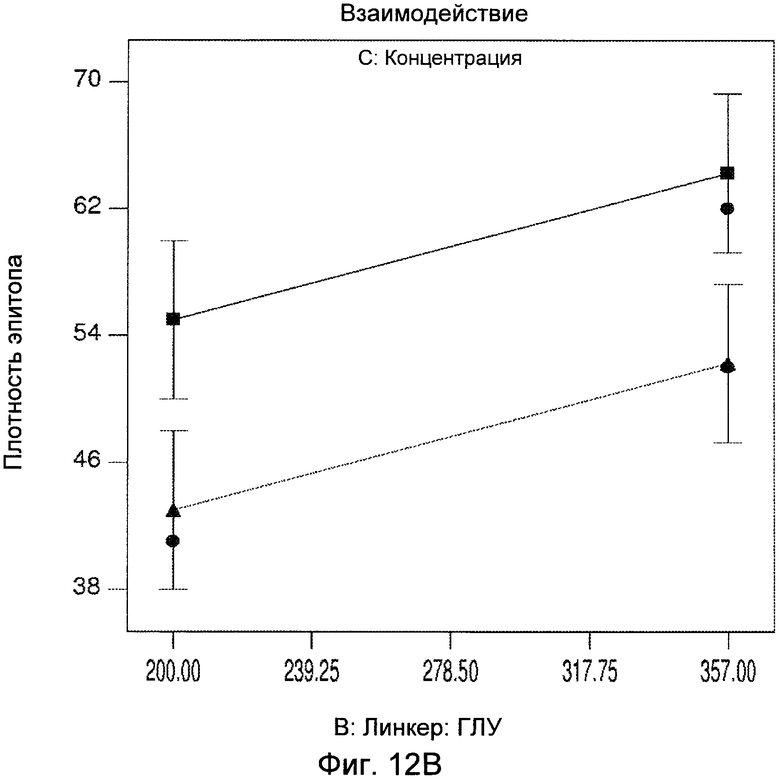
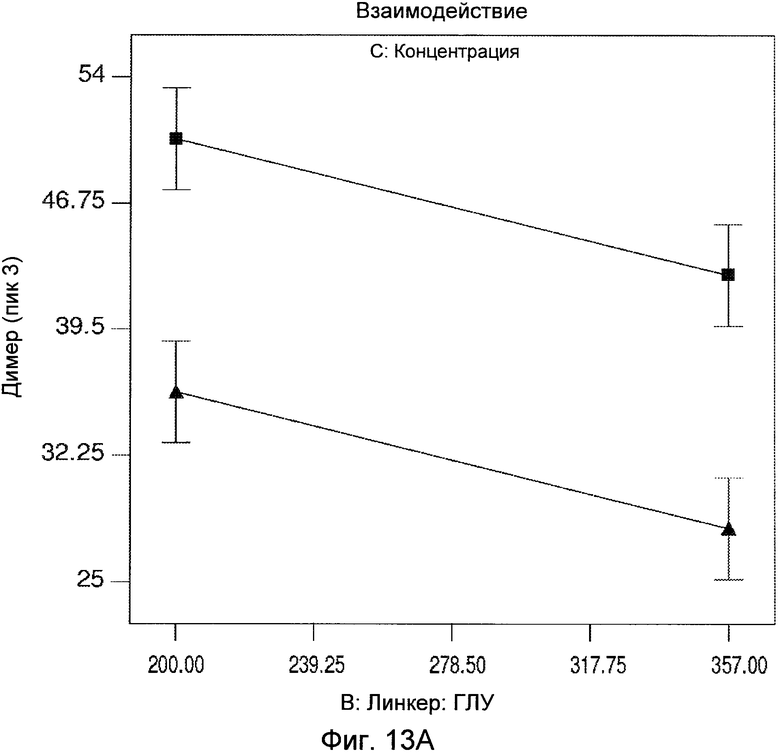
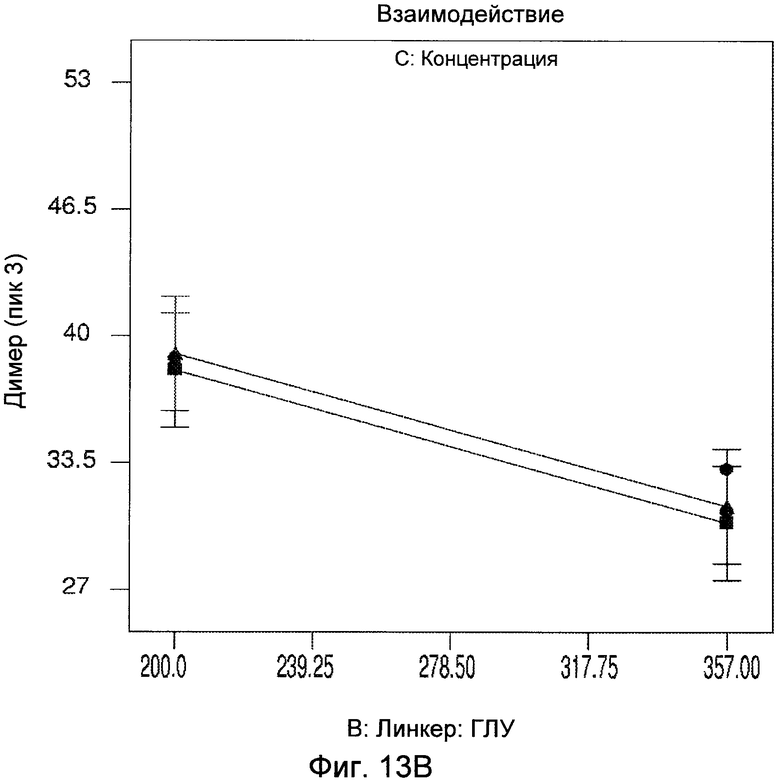
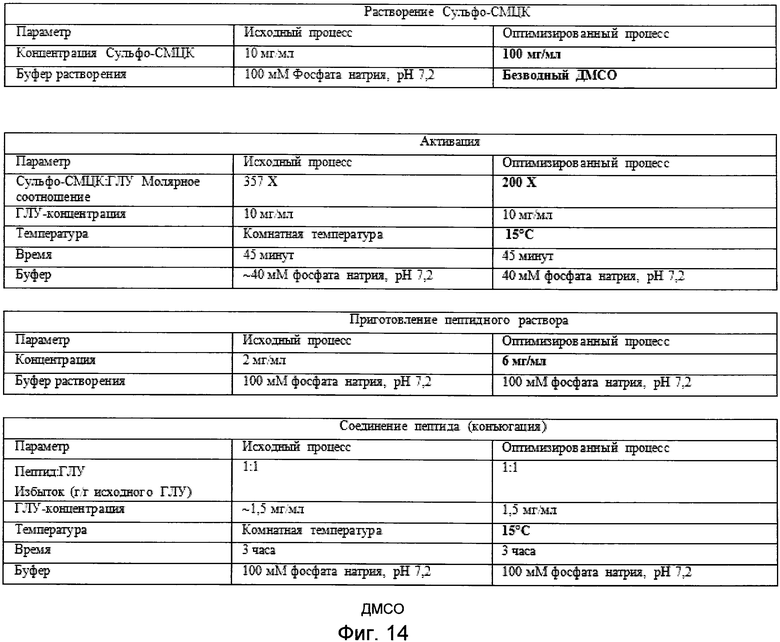
Настоящая группа изобретений относится к способу получения конъюгата ГЛУ-EGFRvIII, включающему объединение ГЛУ с линкером и предоставление возможности ГЛУ и линкеру взаимодействовать на протяжении периода времени в диапазоне от 30 до 60 минут; добавление пептида, включающего SEQ ID NO:1, к активированному продукту ГЛУ, полученному на предыдущей стадии с получением конъюгата ГЛУ-EGFRvIII, причем молярное соотношение линкер:ГЛУ находится в диапазоне от 75:1 до 325:1, а также конъюгату ГЛУ-EGFRvIII, полученному данным способом. Группа изобретений раскрывает эффективные способы производства и технологии приготовления лекарственного средства. 2 н. и 5 з.п. ф-лы, 26 ил., 8 табл., 7 пр.
1. Способ получения конъюгата ГЛУ-EGFRvIII, включающий: а) объединение ГЛУ с линкером и предоставление возможности ГЛУ и линкеру взаимодействовать на протяжении периода времени в диапазоне от 30 до 60 минут; и b) добавление пептида, включающего SEQ ID NO:1, к активированному продукту ГЛУ, полученному на стадии а), с получением конъюгата ГЛУ-EGFRvIII, причем молярное соотношение линкер:ГЛУ находится в диапазоне от 75:1 до 325:1.
2. Способ по п. 1, в котором линкер объединяют с ГЛУ в молярном соотношении линкер:ГЛУ от 150:1 до 250:1.
3. Способ по п. 1, в котором линкер объединяют с ГЛУ в молярном соотношении линкер:ГЛУ 200:1.
4. Способ по п. 1, в котором линкер является сульфо-СМЦК линкером, добавляемым в безводный растворитель.
5. Способ по п. 4, в котором безводный растворитель содержит ДМСО.
6. Способ по любому из пп. 1-5, дополнительно включающий стадию лиофилизации конъюгата.
7. Конъюгат ГЛУ-EGFRvIII, полученный способом по любому из пп. 1-6.
| WO1999006840 А1, 11.02.1999 | |||
| WO2007056061 A2, 18.05.2007 | |||
| УПРАВЛЯЕМЫЙ ПРОТИВОСЛЕПЯЩИЙ ФИЛЬТР (УПФ) | 2013 |
|
RU2530172C1 |
| R | |||
| J | |||
| SCHMITTLING et al | |||
| Detection of humoral response in patients with glioblastoma receiving EGFRvIII-KLH vaccines | |||
| Journal of Immunological Methods, 339, 2008, PP | |||
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
| AMY B | |||
| HEIMBERGER et al | |||
| Epidermal Growth Factor Receptor VIII Peptide Vaccination Is | |||
Авторы
Даты
2016-04-10—Публикация
2010-12-08—Подача