Изобретение относится к области биотехнологий, в частности к генетической и клеточной инженерии, и может быть использовано в медицине.
Множественная миелома (ММ) - злокачественная опухоль системы В-лимфоцитов в костном мозге, приводящая к дифференцировке пре-В-клеток в плазматические клетки. Трансформированные клетки-плазмоциты, помимо замещения нормальных клеток костного мозга, также производят миеломный белок, представляющий собой моноклональное антитело, которое заменяет нормальные антитела в крови, что приводит к увеличению восприимчивости организма к инфекции и проблемам в работе почек. Этиология этого заболевания до конца не изучена. Известно, что на белковом уровне миеломные клетки характеризуются повышенной экспрессией ДНК-зависимой киназы, казеин-киназы СК2, Akt и других киназ, отвечающих за передачу сигнала пролиферации.
На сегодняшний день одним из наиболее перспективных препаратов против этого неизлечимого заболевания является бортезомиб (Velcade). Бортезомиб представляет собой дипептид - производное борной кислоты и является мощным специфическим ингибитором протеолитических активностей протеасомы (Adams J. and Kauffman M. 2004. Cancer Investigation 22:304-311; Jagannath S. et al., 2004. British Journal of Haematology. 127:165-172.). Протеасома осуществляет основной нелизосомальный протеолитический путь в клетке через узнавание и специфическое разрушение белков, ковалентно модифицированных с помощью белка убиквитина. Важно отметить, что миеломные клетки гораздо более чувствительны к воздействию бортезомиба по сравнению с нормальными клетками плазмы крови, или В-клетками. На сегодняшний день механизм этого феномена не известен.
Недавно было показано, что обработка клеток ММ бортезомибом повышала их чувствительность к препаратам, вызывающим генотоксический стресс, в частности, к доксорубицину. Выживаемость больных с устойчивостью к монотерапии бортезомибом при сочетанной химиотерапии с доксорубицином повышалась почти в 2 раза (Orlowski R.Z. 2004. J. Natl. Compr. Cane. Netw. 2 Suppl 4:S16-20). Доксорубицин является генотоксическим агентом, который, блокируя активность фермента топоизомеразы II, вызывает двухцепочечные разрывы ДНК. Доксорубицин, при низких дозах, усиливает активность протеасом, а при высоких - ингибирует ее.
Молекулярные механизмы синергизма между бортезомибом и доксорубицином в миеломных клетках остаются еще совершенно неизученными и являются насущной проблемой как для фундаментальной, так и для прикладной медицины. Можно лишь предполагать, что этот эффект может быть обусловлен накоплением сигнальных короткоживущих убиквитинированных белков (в нормальных условиях разрушаемых протеасомой), которые индуцируют остановку клеточного цикла и апоптоз в ответ на повреждения ДНК. Протеомный подход должен ускорить идентификацию соответствующих убиквитинированных белков, что позволило бы начать изучение их роли в остановке клеточного цикла и апоптозе миеломных клеток в ответ на химиотерапию. В связи с этим, проблема изучения белков «убиквитома», взаимодействующих с протеасомой и накапливающихся в клетках в результате действия бортезомиба и доксорубицина, приобретает чрезвычайную актуальность.
Проблема идентификации убиквитинированных белков состоит в том, что они быстро деградируются протеасомой, и процент их содержания в клетке очень невелик. Соответственно, встает методический вопрос очистки и обогащения доли убиквитинированных белков для их дальнейшей идентификации методом масс-спектрометрического анализа.
Другим важным моментом является тот факт, что помимо убиквитин-зависимой деградации, протеасомы также способны разрушать белки и по убиквитин-независимому пути, через белок-белковые взаимодействия с альфа 7 (PSMA3) субъединицей 20S протеасомы (Fedorova O.A., Moiseeva T.N., Nikiforov A.A., Tsimokha A.S., Livinskaya V.A., Hodson M., Bottrill A., Evteeva I.N., Ermolayeva J.B., Kuznetzova I.M., Turoverov K.K., Eperon I., Barlev N.A. 2011. Biochem. Biophys. Res. Commun. 416(3-4):258-265). Например, важнейший онкосупрессор человека р53, вызывающий апоптоз миеломных клеток в ответ на генотоксический стресс, подвергается деградации протеасомами как по убиквитин-зависимому, так и по убиквитин-независимому пути (Tsvetkov P., Reuven N.. Shaul Y. 2010. Cell Death Differentiation. 17:103-108; Mittenberg A.G., Moiseeva T.N., Barlev N.A. 2008. Front. Biosci. 13:7184-7192). В этом случае, чтобы иметь полное представление о белках, разрушаемых протеасомами в клетках ММ, необходимо также идентифицировать белки протеома человека, которые взаимодействуют с коровым комплексом протеасомы независимо от убиквитинилирования.
Известно, что 26S протеасома представляет собой комплекс АТФ-зависимых протеаз и состоит из 20S каталитической коровой частицы и ассоциированных с ней регуляторных комплексов. Протеасома осуществляет основной нелизосомальный протеолитический путь в клетке через узнавание и специфическое разрушение белков, ковалентно модифицированных с помощью белка убиквитина. 20S протеасома (700кДа) представляет собой полый цилиндр, состоящий из четырех колец, каждое из которых соответственно образовано семью альфа- или бета-субъединицами. Альфа-субъединицы играют структурную роль, а бета-субъединицы непосредственно осуществляют протеолитическое разрушение белков. 19S регуляторный комплекс состоит из шести АТФазных и не менее одиннадцати неАТФазных субъединиц, которые помогают узнавать, денатурировать и деубиквитинировать субстратный белок для его последующего разрушения в 20S комплексе (Konstantinova I.M., Tsimokha A.S., Mittenberg A.G. 2008. Int. Rev. Cell Mol. Biol. 267:59-124). Нужно учитывать еще тот момент, что сами протеасомы могут подвергаться убиквитинилированию, что может модулировать ее связи с другими белками и протеолитические активности. Результаты исследований последних лет указывают на то, что новыми мишенями в терапии рака могут выступать ферменты, деубиквитинилирующие протеасому (D'Arcy P., Under S. 2012. Int. J. Biochem. Cell Biol. 44(11):1729-1738).
Одним из наиболее перспективных и в то же время достаточно простых подходов к решению данной проблемы нам представляется создание белков слияния, несущих последовательность глутатион-S-трансферазы (Smith D.B., Johnson K.S. 1988. Gene. 67:31-40), а также интересующий нас полипептид (последовательность убиквитин-связывающего домена (УСД) HDAC6 или фрагмента субъединицы 20S протеасомы альфа7 (PSMA3)).
Убиквитин-связывающий домен (УСД) HDAC6 (Bertos N.R., Gilquin В., Chan G.K., Yen T.J., Khochbin S., Yang X.J. 2004. J. Biol. Chem. 279:48246-48254), в основном, связывает полиубиквитины, а не моноубиквитины, и поэтому, вероятнее всего, будет играть важную роль in vivo в регуляции времени жизни белков (Hook S.S., Orian A., Cowley S.M., Eisenman R.N. 2002. PNAS USA 99(21):13425-13430).
Соответственно, предлагаемый нами протеомный подход для идентификации совокупности убиквитинилированных и неубиквитинилированных белков, ассоциированных с протеасомой и являющихся ее субстратами, в клетках ММ представляется весьма актуальным и научно-значимым.
В качестве прототипа нами выбран способ, описанный в патенте US20090220470, наиболее релевантном по отношению к исследуемому объекту. В нем предложен способ обогащения препаратов из тотальных клеточных лизатов убиквитинилированными белками с использованием убиквитин-связывающих доменов различных генов. Суть метода заключается в создании генно-инженерной конструкции - молекулы дезоскирибонуклеиновой кислоты, несущей в экспрессирующем векторе последовательность ДНК глутатион-S-трансферазы, за которой следуют участки специфического связывания убиквитина; с последующей экспрессией данного химерного белка в клетках E.coli. Авторы предлагают использовать химерные белки, несущие два тандемно расположенных различных убиквитин-связывающих домена, тем самым повышая эффективность связывания убиквитинилированных белков. Обогащенная таким образом популяция белков в дальнейшем используется для различных исследований убиквитома клетки.
К настоящему времени биохимические механизмы, определяющие судьбу убиквитинилированных белков, изучены недостаточно. Недавно было установлено, что распознавание специфических убиквитинилированных белков-мишеней происходит с помощью убиквитин-связывающих белков, которые также известны как убиквитиновые рецепторы. Убиквитин-связывающие белки обычно имеют в своем составе убиквитин-связывающие домены (УСД). Они представляют собой небольшие (20-150 аминокислот) домены модулярной природы, которые могут нековалентно взаимодействовать как с моно-, так и с полиубиквитинилированными цепочками. УСД найдены как в ферментах, которые непосредственно катализируют реакции убиквитинилирования и деубиквитинилирования, так и в убиквитиновых рецепторах, которые распознают и интерпретируют сигналы этой пост-трансляционной модификации, конъюгированной с белками-субстратами, для контроля разнообразных клеточных событий. УСД разнообразны по своей структуре и обнаруживаются в белках, выполняющих различные биологические функции. Для ряда УСД известны детальные молекулярные структуры, но чтобы понять механизм их действия, необходимо знать, каким образом определяется специфичность их связывания с убиквитином, как регулируется это связывание и как функционируют УСД в контексте полноразмерных белков.
На сегодняшний день идентифицировано пять модулей УСД. Короткая и простая последовательность Rpn10 у дрожжей (S5a или PSMD4 у человека), которая необходима и достаточна для взаимодействий с убиквитином, была использована в качестве стартовой точки в нескольких биоинформационных поисках, чтобы выявить сходные последовательности в других белках. Оказалось, что подобно исходному S5a убиквитин-взаимодействующие мотивы (УВМ) в целом ряде разнообразных белков являются непосредственными аутентичными убиквитин-связывающими мотивами (УСМ). Другой мотив, убиквитин-ассоциированный домен (У АД), впервые был идентифицирован с использованием биоинформационной техники как паттерн последовательностей, общий у ряда белков, подвергающихся убиквитинилированию и (или) деубиквитинилированию. Примерно в то же самое время, когда были открыты УВМ, независимые исследования показали, что УАД может непосредственно взаимодействовать с убиквитином. Открытие УВМ и УАД дало толчок активным исследованиям в этой области. Одним из наиболее впечатляющих открытий стало то, что УВМ и УАД обнаруживаются во множестве белков с разнообразными функциями и локализацией.
В связи с этим весьма перспективным представляется УСД, обнаруженный в составе белка HDAC6, гистондеацетилазы 6. Домен (УСД-6) расположен на С-конце и имеет структуру типа «цинковых пальцев». Интересно отметить, что мутации в цистеинах, которые участвуют в координации атомов цинка, существенно снижали способность УСД-6 связывать убиквитин. Таким образом, можно сказать, что структура типа «цинковых пальцев» важна для активного связывания молекул убиквитина. Этот домен способен связывать как моно-, так и полиубиквитиновые субстраты с высокой константой аффинности (около 60 нМ). Также было показано, что УСД-6 специфически узнает С-концевую последовательность убиквитина - RLRGG. В узнавании этой последовательности ключевыми являются пара глицинов (GG), поскольку их удаление или мутация полностью разрушает взаимодействие соответствующих пептидомиметиков с УСД-6 (Hard R.L., Liu J., Shen J., Zhou P., Pei D. 2010. Biochemistry 49:10737-10746). Соответственно было показано, что на клеточном уровне белок HDAC6 за счет УСД способен аккумулировать убиквитинилированные белки, тем самым вызывая образование белковых агрегатов (аггресом) и нерастворимых инклюзионных телец (Boyault С., Gilquin В., Zhang Y., Rybin V., Garman E., Meyer-Klaucke W., Matthias P., Milller C.W., Khochbin S. 2006. EMBO J. 25:3357-3366). Таким образом, убиквитин-связывающий домен белка HDAC6 представляет собой универсальный УСД и может быть использован в целях обогащения фракции короткоживущих убиквитинилированных белков. Следует отметить, что использованный нами убиквитин-связывающий домен гистондеацетилазы 6 (см. Фиг.1.), в основном, связывает полиубиквитины, а не моноубиквитины (как в патенте US20090220470), что более актуально для изучения короткоживущих регуляторных белков.
Аналогов второго химерного белка (GST-PSMA3, см. Фиг.2.), используемого в нашей работе для обогащения клеточного экстракта белками-мишенями для убиквитин-независимого протеасомного протеолиза, в ходе патентного поиска обнаружено не было.
Целью настоящего изобретения является быстрая и эффективная идентификация регуляторных короткоживущих белков в протеоме человека, которые могут участвовать в специфической модуляции цитотоксического эффекта сочетанной химиотерапии бортезомибом (ингибитор протеасом) и доксорубицином (индуктор генотоксического стресса) на опухолевые клетки множественной миеломы (ММ). Достигается это в настоящей заявке путем одностадийной аффинной хроматографии с белками слияния (GST-UBD_HDAC6 и GST-PSMA3), позволяющей очистить из клеточных экстрактов как полиубиквитинилированные белки, так и белки-мишени для убиквитин-независимого протеолиза протеасомами. Белки слияния включают в себя фрагмент гена HDAC6, соответствующий убиквитин-связывающему домену (УСД6), либо кДНК гена субъединицы протеасом альфа 7, слитый с фрагментом гена, кодирующего субстрат-связывающий домен фермента глутатион-S-трансферазы (GST). Обе конструкции экспрессируются в бактериальном штамме BL21 Е.соli. Полученные клеточные экстракты осветвляют центрифугированием и связывают с глутатион-сефарозой. Химерные белки, слитые с GST, инкубируют с белковыми экстрактами, приготовленными из клеток множественной миеломы, для специфической преципитации аффинного носителя и ассоциированных с ними убиквитинилированных или PSMA3-ассоциированных белков. Полученные таким образом клеточные белки дополнительно очищают от избытка солей, разделяют в системе двумерного белкового электрофореза и анализируют методами прямой и тандемной времяпролетной масс-спектрометрии.
Положительный эффект от применения предлагаемого изобретения заключается в быстром и эффективном выявлении потенциальных онкомаркеров среди короткоживущих регуляторных белков: 1) в сокращении, благодаря одноступенчатой аффинной очистке, времени получения искомых белковых молекул, 2) в повышении эффективности связывания полиубиквитинилированных белков с помощью носителя с UBD HDAC6, 3) в возможности охвата наиболее широкого спектра регуляторных белков, за счет использования белка слияния GST-PSMA3, связывающегося с мишенями для убиквитин-независимого протеасомного протеолиза.
Изобретение иллюстрируется следующими графическими материалами:
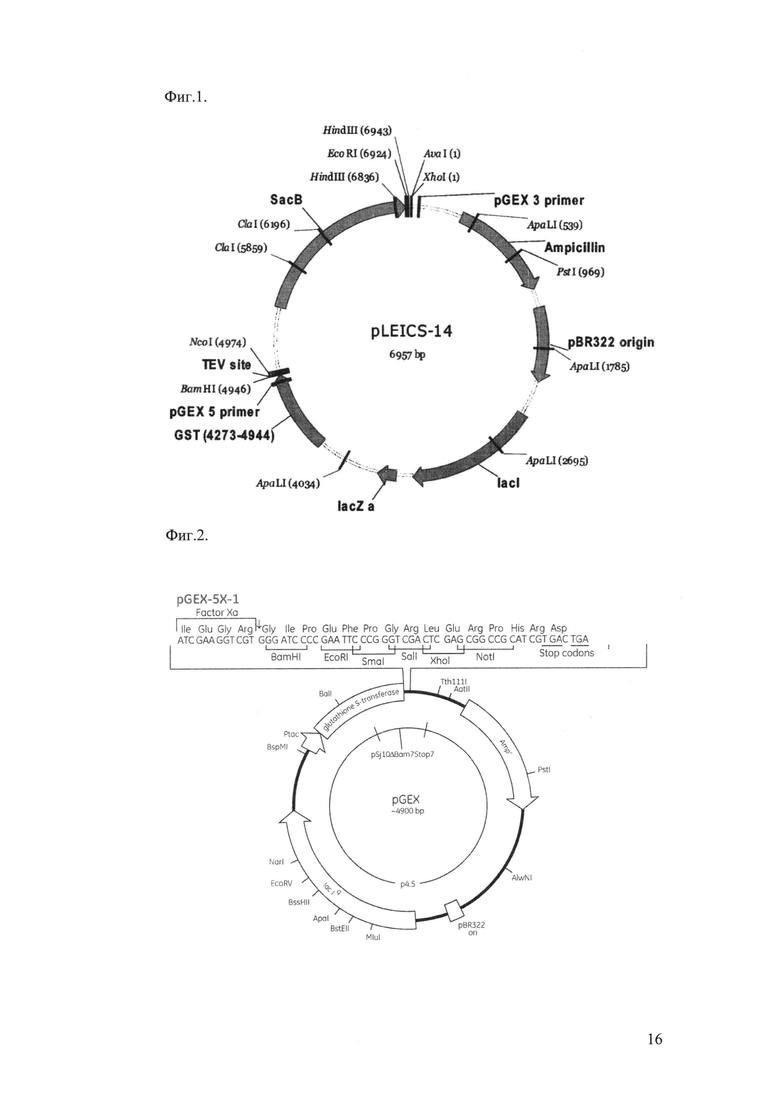
На Фиг.1 изображена карта вектора pLEICS-14, в который лигирован УСД HDAC6. Последовательность HDAC6 была взята в качестве матрицы для полимеразной цепной реакции, с целью амплифицировать фрагмент (3135-3648), связывающий полиубиквитин, соответствующий а.а. 1045-1216. Были использованы следующие праймеры:
N-ter: GTATTTTCAGGGCGCCCCCAGTACACTGAT…,
C-ter: GTCGACTGCAGAATTTTAGTGTGGGTtca
для клонирования в вектор pLEICS-14, содержащий последовательность фермента глутатион-3-трансферазы (GST). Последовательность вставки в полученной конструкции проверяют секвенированием ДНК. После трансформации в бактериальный штамм BL21, проводят индукцию белка с помощью 0.2 мМ IPTG в течение ночи при 16°С, чтобы избежать формирования нерастворимых белковых агрегатов. Затем белок очищают из клеток E.coli, предварительно разрушенных ультразвуком, на глутатион-содержащей смоле (Glutathione-sepharose 4 В, GE Healthcare) согласно рекомендациям производителя.
Последовательность нуклеотидов кДНК гистондеацетилазы 6 (HDAC6). Вставка (убиквитин-связывающий домен) выделена курсивом:

На Фиг.2 изображена карта вектора pGEX-5X-l, в который лигирована последовательность кДНК PSMA3.
Создание химерного белка α7-GST потребовало получить последовательность кДНК протеасомной субъединицы α7 (PSMA3) методом ПЦР, сопряженной с обратной транскрипцией. В качестве РНК-матрицы использовали суммарную РНК клеток человека линии К562. Последовательности праймеров:
N-ter: 5'-ATGCGGATCCGCATGAGCTCAATCGGC-3'
C-ter: 5' -CGGAGGATCCGTTACATATTATCATC-3'.
Полученный ПЦР-продукт клонируют в экспрессионный вектор pGEX-5Х-1, который несет в себе фрагмент гена GST, для последующей аффинной очистки химерного белка на глутатион-сефарозе. После трансформации бактерий позитивные колонии, содержащие вектор со вставкой, сначала определяют методом ПЦР со специфическими праймерами, а затем, после выделения плазмидной ДНК, последовательность вставки в полученной конструкции проверяют секвенированием ДНК. После трансформации в бактериальный штамм BL21 проводят индукцию белка с помощью 0.2 мМ IPTG в течение ночи при 16°С, чтобы избежать формирования нерастворимых белковых агрегатов. Затем белок очищают из клеток E.coli, предварительно разрушенных ультразвуком, на глутатион-содержащей смоле (Glutathione-sepharose 4 В, GE Healthcare) согласно рекомендациям производителя.
Способ осуществляется следующим образом: полученные генно-инженерные конструкции вводят в клетки E.coli с целью экспрессии в них интересующих нас белков слияния (GST-PSMA3 и GST-UBD_HDAC6). Очистку белков из клеток E.coli осуществляют с помощью аффинной хроматографии на глутатион-сефарозе (GE Healthcare).
Следующий этап представляет собой реакцию связывания белков из экстракта клеток множественной миеломы (до или после сочетанной химиотерапии бортезомибом и доксорубицином): полиубиквитинилированных (в случае использования белка слияния GST-UBD_HDAC6), либо белков-мишеней для убиквитин-независимого протеасомного протеолиза (GST-PSMA3). Связавшиеся белки смывают с хроматографического носителя глутатион-содержащим буферным раствором, после чего обессаливают и концентрируют на микроконцентраторах Amicon (Millipore Inc.). Полученные препараты белков разделяют в системе двумерного электрофореза (I направление - изоэлектрическое фокусирование белков на приборе Ettan IPG Phor 3 (GE Healthcare), II направление - разделение белков по молекулярным массам в денатурирующем электрофорезе по Лэммли).
Пятна, соответствующие отдельным белкам, вырезают из полиакриламидного геля и анализируют их состав с помощью времяпролетной тандемной масс-спектрометрии на приборе АВ Sciex 5800 MALDI TOF/TOF (AB Sciex).
Новизна настоящего изобретения заключается в том, что в нем предложен метод одноступенчатой аффинной очистки из клеток человека совокупности короткоживущих регуляторных белков, включающих как полиубиквитинилированные (т.е. потенциальные мишени убиквитин-зависимого протеасомного пути), так и ассоциированные с субъединицей протеасом альфа7 (т.е. мишени убиквитин-независимого протеасомного протеолиза) белки. Для очистки полиубиквитинилированных белков используется последовательность убиквитин-связывающего домена гистондеацетилазы 6: данный полипептид обладает значительно более высоким сродством к полиубиквитинилированным субстратам, нежели его аналоги из других белков. Аналогов второго химерного белка (GST-PSMA3), используемого в нашей работе для обогащения клеточного экстракта белками-мишенями для убиквитин-независимого протеасомного протеолиза, в мировой практике не обнаружено. Удобство метода состоит в возможности манипулировать непосредственно с клеточными экстрактами, минуя стадии дополнительной очистки белков.
Изобретение может найти важное применение:
- для разработки диагностических подходов, основанных на методах высокопроизводительного анализа белковых взаимодействий между протеасомами и их субстратами;
- выявления механизмов цитотоксического действия вышеуказанных лекарств в опухолевых клетках ММ, а также определения новых белковых маркеров, специфических для этого заболевания.
Полученные знания могут иметь важные приложения в клинической практике при отработке методов противораковой терапии.
Список литературы
Adams J and Kauffman M. 2004. Development of the proteasome inhibitor Velcade (Bortezomib). Cancer Investigation 22:304-311.
Bertos N.R, Gilquin В., Chan O.K., Yen T.J., Khochbin S., Yang X.J. 2004. Role of the tetradecapeptide repeat domain of human histone deacetylase 6 in cytoplasmic retention. J. Biol Chem 279(46):48246-48254.
Boyault C., Gilquin В., Zhang Y., Rybin V., Garman E., Meyer-Klaucke W., Matthias P, Muller C.W., Khochbin S. HDAC6-p97/VCP controlled polyubiquitin chain turnover. 2006. EMBO J. 25:3357-3366.
D'Arcy P., Linder S. 2012. Proteasome deubiquitinases as novel targets for cancer therapy. Int. J. Biochem. Cell Biol. 44(11):1729-1738.
Fedorova O.A., Moiseeva T.N., Nikiforov A.A., Tsimokha A.S., Livinskaya V.A., Hodson M., Bottrill A., Evteeva I.N., Ermolayeva J.B., Kuznetzova I.M., Turoverov K.K., Eperon I., Barlev N.A. 2011. Proteomic analysis of the 20S proteasome (PSMA3)-interacting proteins reveals a functional link between the proteasome and mRNA metabolism. Biochem. Biophys. Res. Commun. 416(3-4):258-265.
Hard R.L., Liu J., Shen J., Zhou P., Pei D. 2010. HDAC6 and Ubp-M BUZ domains recognize specific C-terminal sequences of proteins. Biochemistry. 49:10737-10746.
Hook S.S., Orian A., Cowley S.M., Eisenman R.N. 2002. Histone deacetylase 6 binds polyubiquitin through its zinc finger (PAZ domain) and copurifies with deubiquitinating enzymes. PNAS USA 99(21):13425-13430.
Jagannath S., Barlogie В., Berenson J., Siegel D., Irwin D., Richardson P.G., Niesvizky R., Alexanian R., Limentani S.A., Alsina M., Adams J., Kauflman M., Esseltine D.L., Schenkein D.P, Anderson K.C. 2004. A phase 2 study of two doses ofbortezomib in relapsed or refractory myeloma. British Journal ofHaematology. 127(2):165-172.
Konstantinova I.M., Tsimokha A.S., Mittenberg A.G. 2008. Role ofProteasomes in Cellular Regulation. International Review of Cellular and Molecular Biology, 267:59-124.
Mittenberg A.G., Moiseeva T.N., Barlev N.A. 2008. Role ofproteasomes in transcription and their regulation by covalent modifications. Front. Biosci. 13:7184-7192.
Orlowski R.Z. 2004. Bortezomib in combination with other therapies for the treatment of multiple myeloma. J. Natl. Compr. Cane. Netw. 2 Suppi 4:S16-20.
Smith D.B., Johnson K.S. 1988. Single-step purification ofpolypeptides expressed in Escherichia coli as fusions with glutathione S-transferase. Gene. 67(1):31-40.
Tsvetkov P., Reuven N., Shaul Y. 2010. Ubiquitin-independent p53 proteasomal degradation Cell Death Differ. 17(1):103-108.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОГИДРОЛИЗОВАННОЙ ПЕПТИДНОЙ КОМПОЗИЦИИ ИЗ БЕЛКОВ МОЛОЧНОЙ СЫВОРОТКИ | 2013 |
|
RU2531164C1 |
| КОМБИНАЦИИ СПЕЦИФИЧНЫХ ИНГИБИТОРОВ ГИСТОНОВЫХ ДЕАЦЕТИЛАЗ КЛАССА I С ИНГИБИТОРАМИ ПРОТЕАСОМ | 2007 |
|
RU2456990C2 |
| Лекарственный препарат для лечения нарушений мозгового кровообращения и восстановления утраченных функций мозга | 2018 |
|
RU2713655C2 |
| Лекарственный препарат для лечения нарушений мозгового кровообращения и восстановления утраченных функций мозга | 2020 |
|
RU2751331C1 |
| ВЕКТОР ЭКСПРЕССИИ ДЛЯ ТРАНСГЕННОГО ВВЕДЕНИЯ В КЛЕТКИ И ТКАНИ МЛЕКОПИТАЮЩИХ С РЕГУЛИРУЕМЫМ НЕВИРУСНЫМ ПРОМОТОРОМ | 2011 |
|
RU2495128C2 |
| СПОСОБ УСИЛЕНИЯ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОВ ПАНОБИНОСТАТА НА ОПУХОЛЕВЫЕ КЛЕТКИ | 2023 |
|
RU2806371C2 |
| РЕКОМБИНАНТНАЯ ДНК, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА СЛИТОГО ПОСЛЕДОВАТЕЛЬНОСТЬЮ ГЛУТАТИОН-S-ТРАНСФЕРАЗЫ (GST-hEGF) И РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAS007, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ GST-hEGF В КЛЕТКАХ Escherichia coli | 2011 |
|
RU2521515C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕБЛАГОПРИЯТНОГО ИСХОДА ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО | 2019 |
|
RU2696872C1 |
| Применение пирролилазинов в качестве активаторов синтеза белков теплового шока | 2020 |
|
RU2809487C2 |
| Генетическая конструкция для экспрессии функционально-активного человеческого стресс-белка (БТШ70) с мутированными сайтами гликозилирования для наработки в эукариотических экспрессионных системах | 2016 |
|
RU2647570C1 |
Изобретение относится к биохимии. Получают химерные белки слияния: GST УСД HDAC6 и GST-PSMA3, путем их экспрессии в клетки E. coli за счет введения в них соответствующих векторов и последующей очистки с помощью аффинной хроматографии на глутатион-сефарозе. Проводят реакции связывания белков из экстракта клеток множественной миеломы до или после сочетанной химиотерапии бортезомибом и доксорубицином с GST-UBD_HDAC6 и GST-PSMA3. Осуществляют смыв связавшихся белков с хроматографического носителя глутатион-содержащим буферным раствором. Обессаливают и концентрируют на микроконцентраторах. Разделяют полученные препараты белков в системе двумерного электрофореза: I направление - изоэлектрическое фокусирование белков на приборе Ettan IPG Phor3 (GE Healthcare), II направление - разделение белков по молекулярным массам в денатурирующем электрофорезе по Лэммли. Пятна, соответствующие отдельным белкам, вырезают из полиакриламидного геля и анализируют их состав. Изобретение обеспечивает повышение эффективности очистки регуляторных короткоживущих белков (как полиубиквитинилированных (GST-UBD_HDAC6), так и подвергающихся убиквитин-независимому протеолизу GST-PSMA3)). Удобство метода состоит еще и в том, что он позволяет манипулировать непосредственно с клеточными экстрактами, минуя стадии дополнительной очистки белков. Изобретение позволяет облегчить диагностику множественной миеломы путем выявления среди короткоживущих регуляторных белков специфических онкомаркеров, характерных для данного заболевания. 2 ил., 1 табл.
Способ идентификации регуляторных короткоживущих белков в протеоме человека, участвующих в специфической модуляции цитотоксического эффекта, включающий получение химерных белков слияния: GST УСД HDAC6 и GST-PSMA3, путем их экспрессии в клетки E. coli за счет введения в них соответствующих векторов и последующей очистки с помощью аффинной хроматографии на глутатион-сефарозе, проведение реакции связывания белков из экстракта клеток множественной миеломы до или после сочетанной химиотерапии бортезомибом и доксорубицином с GST-UBD_HDAC6 и GST-PSMA3, смыв связавшихся белков с хроматографического носителя глутатион-содержащим буферным раствором, обессаливание и концентрирование на микроконцентраторах, разделение полученных препаратов белков в системе двумерного электрофореза: I направление - изоэлектрическое фокусирование белков на приборе Ettan IPG Phor3 (GE Healthcare), II направление - разделение белков по молекулярным массам в денатурирующем электрофорезе по Лэммли, пятна, соответствующие отдельным белкам, вырезают из полиакриламидного геля и анализируют их состав с помощью времяпролетной тандемной масс-спектрометрии на приборе АВ Sciex 5800 MALDI TOF/TOF (АВ Sciex).
| НАБОР ДЛЯ СКРИНИНГОВОГО АНАЛИЗА ОНКОМАРКЕРА В СЫВОРОТКЕ И ЦЕЛЬНОЙ КРОВИ | 1995 |
|
RU2119167C1 |
| RU 2008137432 A1, 27.03.2010 | |||
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ОНКОМАРКЕРА MUC1 В СЫВОРОТКЕ КРОВИ ЧЕЛОВЕКА | 2007 |
|
RU2338200C1 |
| WO 2012006589 А2, 12.01.2012. | |||
Авторы
Даты
2016-07-10—Публикация
2012-10-12—Подача