Изобретение относится к биохимии и может быть использовано в лабораторной практике для определения содержания белка в биологических жидкостях (моче, спинномозговой жидкости, ликворе, сыворотке, плазме крови и т.д.).
На сегодняшний день самым распространенным и широко применяемым в клинической биохимии методом определения общего белка в биологических жидкостях является спектрофотометрический метод.
Известен и широко применим в клинико-биохимических исследованиях способ определения концентрации белка в биологическом материале, в основе которого лежит реакция взаимодействия ионов меди с пептидными связями в молекуле белка в присутствии сильного основания (биуретовый метод). [Dilena В.А., Penberthy L.A., Fraser C.G. Clin. Chem. 1983. V. 29. P. 553-557], [Marshall Т., Williams K.M. Clin. Chem. 2000. V. 46. P. 392-398]. Интенсивность окраски образующегося комплекса зависит от концентрации белка и может быть оценена как с помощью анализаторов (автоматических и полуавтоматических), так и обычных фотометров. Метод характеризуется высокой аналитической надежностью, специфичностью и позволяет определять белок в широком диапазоне концентраций. Однако способ не обладает чувствительностью при определении минимальных количеств белка.
Известен метод Лоури [Альтшулер Б.Ю., Раков С.С., Ткачев Г.А. Вопросы медицинской химии. 2001. №4. С. 426-438], сочетающий биуретовую реакцию и реакцию Фолина на аминокислоты, тирозин и триптофан в составе белковой молекулы. Он обладает более высокой чувствительностью по сравнению с биуретовым методом, однако возможно неспецифическое взаимодействие реактива Фолина с небелковыми компонентами (чаще всего со свободными ароматическими аминокислотами и многими другими соединениями, содержащими фенольную группу), способными оказывать влияние на данную реакцию и искажать результаты исследования.
Известны спектрофотометрические способы определения белка в биологических жидкостях, основанные на связывании протеина с органическими красителями, обеспечивающими лучшую воспроизводимость результатов. В качестве красителей могут использоваться: кумасси бриллиантовый синий (Coumassie Brilliant Blue) [Bradford M.M. Anal. Biochem. 1976. V. 72. P. 248-254], бромфеноловый синий [патент РФ №2250465, МПК7 G01N 33/52, опубл. 20.04.2005], бромкрезоловый зеленый [Инструкция по применению набора реагентов для определения содержания альбумина в сыворотке и плазме крови человека. АЛЬБУМИН ФС. Утверждена Приказом Росздравнадзора от 15 апреля 2009 г. №3004 - Пр/09 РУ № ФСР 2009/04712 от 06.02.2009 г.], пирогаллоловый красный [Инструкция по применению набора реагентов для количественного определения общего белка в моче и СМЖ с пирогаллоловым красным. ОБЩИЙ БЕЛОК ПГК ФС. «Диакон-ДС». Утверждена приказом Росздравнадзора от 20.06.2010 г. №6830-Пр/10 РУ № ФСР 2007/01435 от 07.05.2010]. В результате реакции молекул белка с органическим красителем образуется окрашенное соединение, интенсивность окраски которого пропорциональна концентрации белка в пробе.
Недостатками этих методов является неодинаковая чувствительность каждого из красителей к различным белкам, что приводит к заметному искажению результатов при использовании калибраторов различного состава и появлению дополнительных ошибок при определении общего белка в биологических жидкостях. Наличие лекарственных препаратов в исследуемых биологических жидкостях оказывает влияние на оптическую плотность растворов, кроме того, сорбция красителей на стенках кювет ограничивает применение методов в лабораторной практике для рутинных анализов.
Наиболее близким к заявляемому техническому решению является способ количественного определения белка в биологических жидкостях [патент РФ №2268476, МПК7 G01N 33/68, опубл. 20.01.2006]. Для определения концентрации белка в биологической жидкости указанным способом осуществляют:
- смешивание образца биологической жидкости с реактивом-комплексообразователем,
- инкубацию пробы в течение 10 мин при комнатной температуре,
- измерение оптической плотности пробы фотометрически при длинах волн в диапазоне 600-700 нм,
- определение концентрации белка стандартным образом.
При этом используют реактив-комплексообразователь, содержащий в качестве органического красителя пирогаллоловый красный, молибдат натрия, янтарную кислоту, ацетат натрия, низкоатомный спирт и стабилизатор, воду при следующих соотношениях компонентов (в масс. %): молибдат натрия - (0.6-1.6)×10-3; пирогаллоловый красный - (1.0-2.0)×10-3; янтарная кислота - 0.4-0.7; ацетат натрия - 0.04-0.10; низкоатомный спирт - 8.0-16.0; стабилизатор - 0.03-1.0; вода - остальное.
Реактив-комплексообразователь в качестве низкоатомного спирта может содержать этанол, метанол или другой, а в качестве стабилизатора - любой неионогенный ПАВ.
Смешивание биологической жидкости с реактивом-комплексообразователем ведут в соотношении 1:(10-50).
Недостатком прототипа является различие в чувствительности пирогаллолового красного к альбумину и белкам глобулинового ряда, что приводит к ошибкам в случае определения общего белка в биологических жидкостях при использовании калибраторов разного состава, а также возможность использования указанного способа для определения содержания общего белка только в моче и спинномозговой жидкости.
Техническим результатом заявляемого технического решения является минимизация погрешности в определении общего белка в биологических жидкостях разного вида.
Для достижения технического результата предлагается смешивать образец биологической жидкости с раствором реагента, содержащим следующие компоненты: бромпирогаллоловый красный, молибдат натрия оксалат натрия, янтарную кислоту и воду. Концентрации компонентов в растворе реагента (масс. %):
бромпирогаллоловый красный - (1.5-4.0)×10-3;
молибдат натрия - (0.5-1.5)×10-3;
оксалат натрия - 0.01-0.03;
янтарная кислота - 0.4-0.7;
вода - остальное.
Смешивают образец биологической жидкости и раствор реагента в соотношении 1:(5-200) соответственно и измеряют оптическую плотность пробы при длине волны в диапазоне 580-620 нм относительно холостой пробы, а затем определяют концентрацию белка методом градуировочного графика или методом одного эталона.
Если проводят анализ биологических жидкостей с высоким содержанием белка, например плазма или сыворотка крови, ее следует разбавлять физиологическим раствором.
Предлагаемое техническое решение имеет с прототипом следующие общие признаки:
- смешивание биологической жидкости с реактивом - комплексообразователем ведут в соотношении 1:(10-50) соответственно;
- выдерживание при комнатной температуре;
- измерение оптической плотности пробы проводят фотометрически при длинах волн в более узком диапазоне;
- раствор реагента содержит органический краситель, молибдат натрия, янтарную кислоту, ацетат натрия, взятых в концентрациях (масс. %):
органический краситель - (1.0-2.0)×10-3;
молибдат натрия - (0.6-1.6)×10-3;
ацетат натрия 0.04-0.10;
янтарная кислота 0.4-0.7;
вода - остальное.
Оксалат натрия и ацетат натрия предназначены для создания постоянного значения рН раствора реагента и поддержания буферной емкости, т.е. являются эквивалентами.
Отличительными признаками являются:
- в состав раствора реагента входит в качестве органического красителя бромпирогаллоловый красный с содержанием (1.5-4.0)×10-3 масс. %;
- в состав раствора реагента входит оксалат натрия с содержанием 0.01-0.03 масс. %, взятый в меньшем количестве;
- инкубирование можно не проводить;
- смешивание образца биологической жидкости и раствора реагента проводят в соотношении 1:(5-200), т.е. в более широком диапазоне.
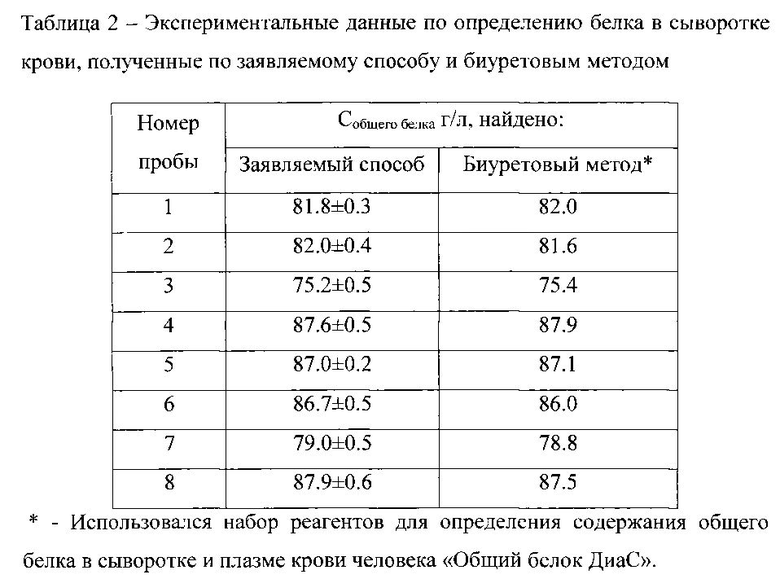
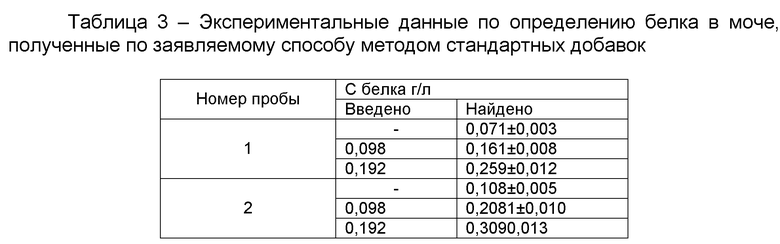
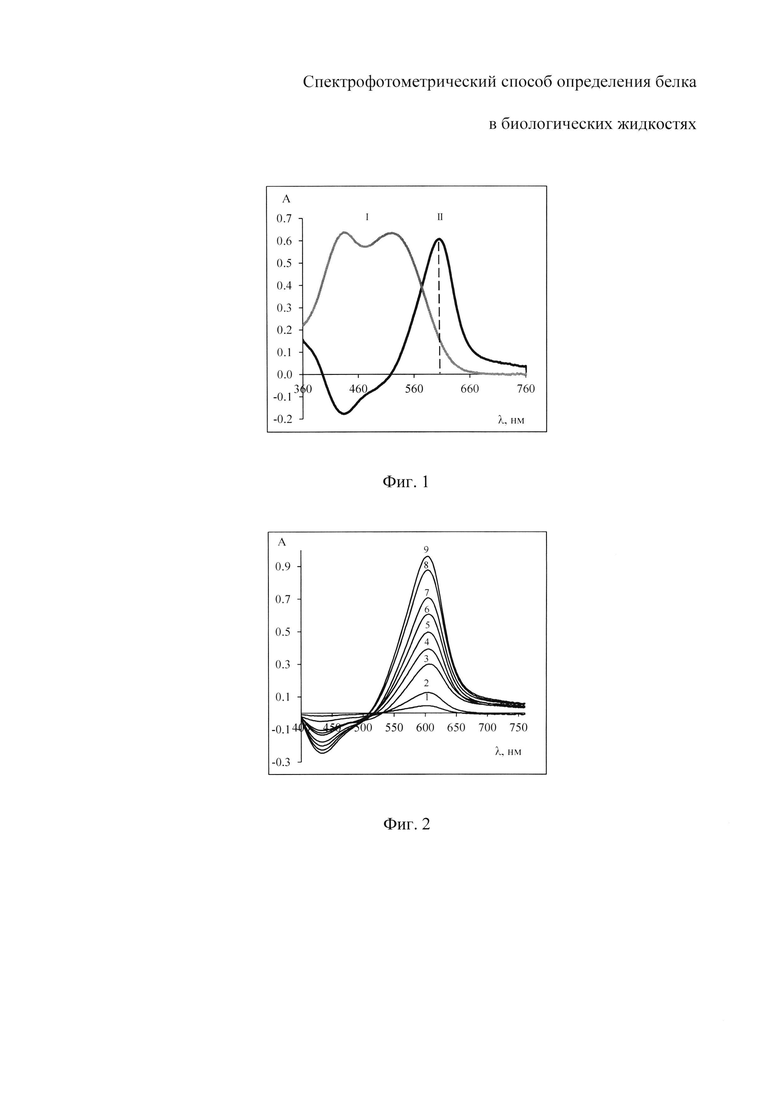
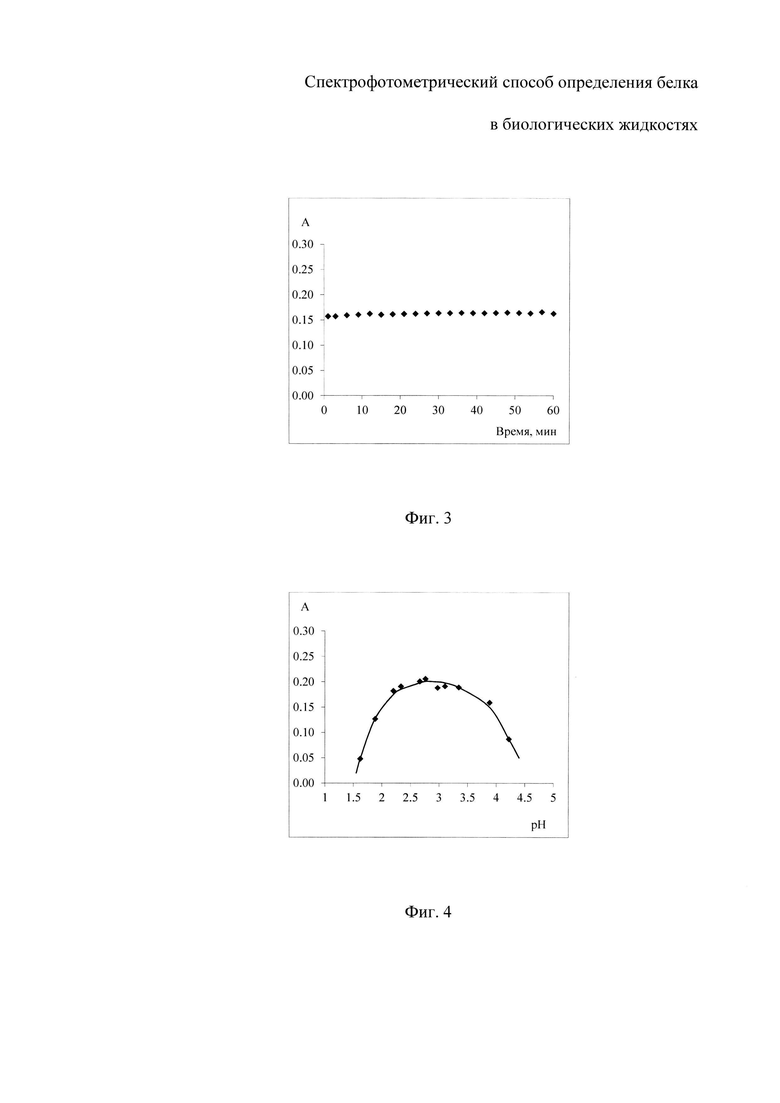
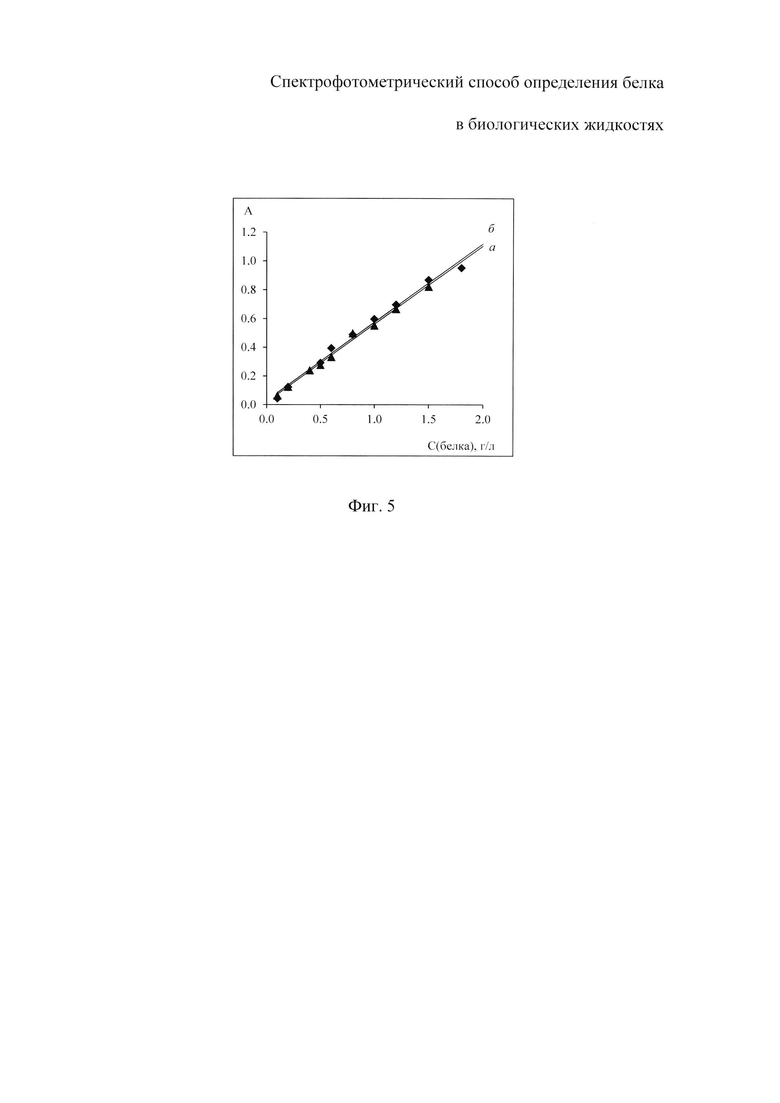
На фиг. 1 изображены спектры поглощения растворов комплекса бромпирогаллолового красного с молибденом (VI) (БПГК - Mo(VI)) - I и комплекса бромпирогаллолового красного с молибденом (VI) в присутствии белка - II с максимумом поглощения при длине волны 600 нм; на фиг. 2 - спектры поглощения растворов реагента с разной концентрацией общего белка: при 0.003 г/л - график 1; при 0.006 г/л - график 2; при 0.012 г/л - график 3; при 0.015 г/л - график 4; при 0.018 г/л - график 5; при 0.021 г/л - график 6; при 0.024 г/л - график 7; при 0.030 г/л - график 8; при 0.036 г/л - график 9; на фиг. 3 - графики зависимости оптической плотности раствора, содержащего БПГК - Mo(VI) и альбумин с концентрацией 0.002 г/л, при фиксированном значении рН и температуре 25°C от времени инкубации; на фиг. 4 - зависимость оптической плотности растворов с постоянной концентрацией альбумина 0.002 г/л от кислотности среды; на фиг. 5 - представлены градуировочные зависимости оптической плотности растворов от концентрации белка: общий белок - график а; альбумин - график б.
При осуществлении способа в результате смешения раствора реагента с раствором белка образуется трехкомпонентный комплекс БПГК - Mo(VI) - белок (фигура 1). Спектр поглощения раствора реагента имеет характерный вид с двумя максимумами поглощения - I (фиг. 1). При введении в систему молекул белка происходит образование трехкомпонентного соединения, и спектр поглощения сдвигается в область 580-620 нм - II (фиг. 1), максимум поглощения трехкомпонентного комплекса БПГК - Mo(VI) - белок наблюдается при длине волны 600 нм. При увеличении концентрации молекул белка в растворе происходит пропорциональное увеличение оптической плотности при длине волны 600 нм (фигура 2). Поскольку раствор реагента также поглощает при длине волны 600 нм, то в качестве холостой пробы следует использовать раствор, приготовленный смешиванием соответствующего объема раствора реагента и объема физиологического раствора, равного объему пробы (см. графики 1-9).
Концентрация БПГК и молибдата натрия в растворе реагента не должна быть меньше 1.5×10-3 и 0.6×10-3 масс. % соответственно, т.к. при меньших концентрациях этих компонентов сокращается диапазон линейности градуировочного графика. Использование концентраций, больших 4.0×10-3 и 1.6×10-3 масс. % соответственно, приводит к излишнему расходу реактивов.
Исследование времени формирования аналитического сигнала проводили путем измерения оптической плотности раствора, содержащего комплекс БПГК - Mo(VI) и альбумин с концентрацией 0.002 г/л, при фиксированном значении рН 2.5 и температуре 25°C через равные промежутки времени на спектрофотометре (UV-1800 «Shimadzu», Япония) в режиме «Кинетика». Полученные результаты, представленные на фигуре 3, показывают, что оптическая плотность растворов в пределах погрешности ее измерения остается постоянной в течение не менее 60 минут, что позволяет исключить обязательное инкубирование проб.
Для выбора оптимальной кислотности среды для проведения реакции между молекулами белка и реагентом готовили серию растворов с постоянной концентрацией альбумина и различной кислотностью среды и измеряли оптические плотности полученных растворов. Значение кислотности среды определяли с помощью рН-метра-иономера «Эксперт - 001». Кислотность варьировали в диапазоне значений 1.5-4.5 ед. рН добавлением разных количеств едкого натра или хлороводородной кислоты к исходному раствору в присутствии сукцинатного буфера. Эксперимент проводили для растворов с постоянной концентрацией альбумина 0.002 г/л при длине волны 600 нм. В соответствии с полученными данными был построен график зависимости оптической плотности растворов от кислотности (фигура 4) для раствора реагента с составом (масс. %): бромпирогаллоловый красный 3.5×10-3, молибдат натрия 1.0×10-3; янтарная кислота 0.6; оксалат натрия 0.01. Оптимальное значение кислотности среды для проведения реакции между комплексом БПГК-Mo(VI) и раствором белка предлагаем создавать введением янтарной кислоты с концентрацией 0.4-0.7 масс. %; и оксалатом натрия 0.01-0.03 масс. %. Введение оксалат ионов в состав раствора реагента способствует устранению их влияния при анализе белка в биологических жидкостях. Совместное присутствие оксалата натрия и янтарной кислоты способствует созданию требуемой буферной емкости раствора реагента, позволяющей сохранять оптимальное значение кислотности среды в пределах от 2.2 до 3.5 ед. рН даже при добавлении большого объема пробы. Меньшее содержание компонентов не обеспечивает достаточную буферную емкость реагента, а большее содержание приводит к неоправданно завышенному расходу реактивов.
С целью оптимизации состава раствора реагента к буферному раствору, содержащему БПГК - Mo(VI), янтарную кислоту и оксалат натрия, добавляли этиловый спирт 8.0-16.0 масс. % и поверхностно-активные вещества 0.03-1.00 масс. %. Как указано в прототипе, добавление этилового спирта в указанных количествах позволяет стабилизировать раствор реактива во времени, а добавление детергентов позволяет предотвратить выпадение осадка. Экспериментально установлено, что добавление детергентов в раствор реагента приводит к уменьшению срока хранения раствора, а добавление этилового спирта не влияет на устойчивость раствора реагента.
Исследовали диапазон линейности зависимости оптической плотности растворов от концентрации и предел обнаружения белка при использовании растворов реагента различного состава. Результаты эксперимента представлены в таблице 1.
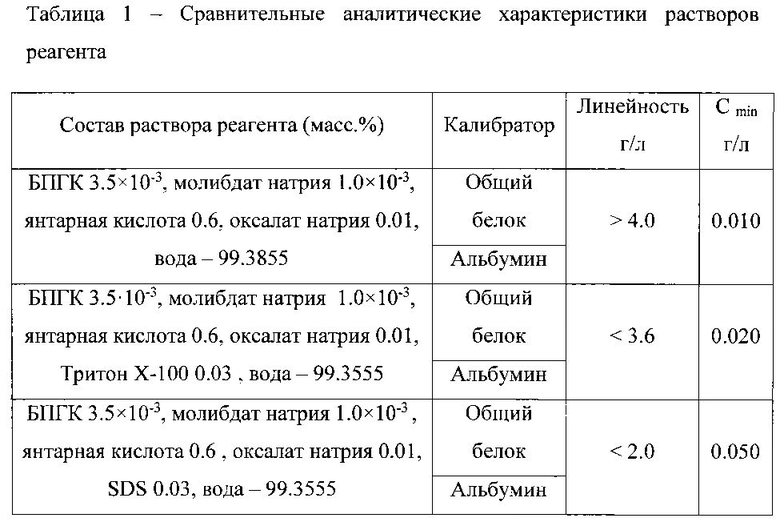
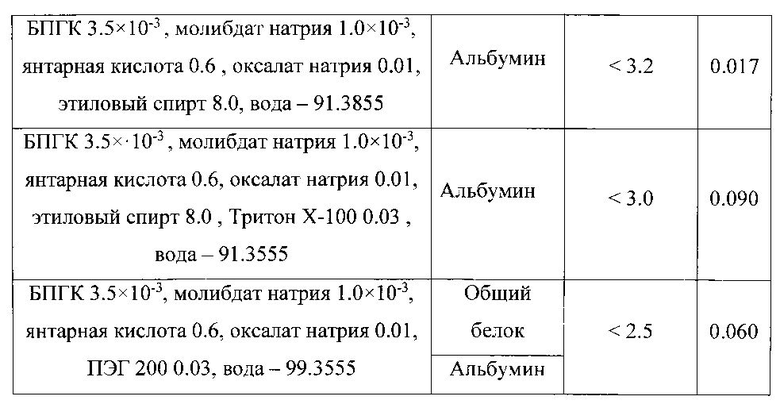
Полученные данные свидетельствуют о том, что введение в состав раствора реагента этанола и (или) детергентов не приводит к увеличению чувствительности и расширению диапазона определяемых содержаний белка. Применение более простого по составу раствора реагента, включающего только БПГК - Mo(VI), янтарную кислоту, оксалат натрия и воду, позволяет расширить диапазон линейности градуировочного графика, диапазон определяемых содержаний общего белка, а также уменьшить предел его обнаружения и экономить реактивы.
Для построения градуировочного графика в пробирки вносят раствор реагента и соответствующий объем стандартного раствора белка. Растворы перемешивают и измеряют оптическую плотность в кювете с толщиной слоя 1 см относительно холостой пробы на спектрофотометре при длине волны 600 нм. Холостая проба готовится добавлением к реагенту соответствующего объема физиологического раствора.
Градуировочные зависимости оптической плотности от концентрации альбумина и общего белка при их содержании в растворе до 2 г/л представлены на фигуре 5.
Предел обнаружения рассчитывали по общепринятой формуле:
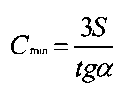
где S - стандартное отклонение фонового значения,
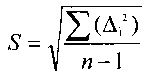
tgα - тангенс угла наклона градуировочной кривой.
Как видно из фигуры 5, градуировочные зависимости оптической плотности растворов от концентрации белка, построенные при использовании разных калибраторов - стандартного раствора альбумина и стандартного раствора общего белка - имеют одинаковый тангенс угла наклона. Значение предела обнаружения в обоих случаях составило 0.01 г/л, что говорит о практически одинаковой чувствительности реагента к белкам различной природы.
Таким образом, введение в состав раствора реагента бромпирогаллолового красного позволяет минимизировать или исключить ошибку, которая возникает в обычной практике при определении общего белка в случае использования в качестве калибратора стандартного раствора альбумина.
Проверку правильности определения общего белка в реальных объектах - образцах сыворотки крови и мочи. В первом случае результаты анализа сравнивали с данными, полученными независимым биуретовым методом. Для проб мочи использовали метод стандартных добавок. Содержание общего белка определяли по градуировочному графику и методом одного эталона. Данные эксперимента представлены в таблицах 2-3.
Таким образом, по сравнению с используемыми на практике способами определения общего белка в биологических жидкостях, предлагаемый способ характеризуется более широким диапазоном определяемых концентраций и большей чувствительностью.
Возможность варьирования кратности разведения анализируемых проб, а также высокая чувствительность предлагаемого способа и больший диапазон линейности позволяет проводить анализ как объектов с заведомо низким содержанием белка (моча, спинномозговая жидкость, ликвор), так и объектов, где содержание общего белка высоко (сыворотка и плазма крови). Отсутствие необходимости инкубирования проб позволяет сократить время анализа.
Одинаковая чувствительность бромпирогаллолового красного в составе предлагаемого реагента к белкам различной природы позволяет минимизировать погрешности в определении общего белка в биологических жидкостях, так как природа и состав калибратора при использовании указанного красителя не оказывает влияние на результаты определения общего белка.
Получаемый технический результат обеспечивается отличительными признаками заявляемого способа, т.е. он обладает изобретательским уровнем, новизной и может найти широкое практическое применение для количественного определения общего белка в биологических жидкостях при массовых клинико-диагностических исследованиях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ БЕЛКА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 2004 |
|
RU2268476C2 |
| Способ количественной и электрофоретической оценки содержания белков в моче | 2022 |
|
RU2812894C2 |
| 5-[4'-(1'',3''-БЕНЗОКСАЗОЛ-2''-ИЛ)ФЕНИЛ]-10,15,20-ТРИС(4'-СУЛЬФОФЕНИЛ)ПОРФИН В КАЧЕСТВЕ ФЛУОРЕСЦЕНТНОГО СЕНСОРА ДЛЯ ОБНАРУЖЕНИЯ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ АЛЬБУМИНА | 2022 |
|
RU2807912C1 |
| Способ определения хинина | 1990 |
|
SU1735748A1 |
| СОРБЦИОННО-СПЕКТРОФОТОМЕТРИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ СВИНЦА (II) | 2013 |
|
RU2529660C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МЕТОКЛОПРАМИДА | 2015 |
|
RU2605316C2 |
| 2,6-ДИФЕНИЛ-4- (4-ДИМЕТИЛАМИНОСТИРИЛ)ПИРИЛИЯ-ХЛОРИД В КАЧЕСТВЕ АНАЛИТИЧЕСКОГО РЕАГЕНТА ДЛЯ КОЛИЧЕСТВЕННОГО ФОТОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ АНИОННЫХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ | 1992 |
|
RU2030414C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ БЕЛКОВЫХ СОЕДИНЕНИЙ В ПОЧЕЧНЫХ КАМНЯХ | 2003 |
|
RU2239195C1 |
| Способ определения папаверина | 1990 |
|
SU1735749A1 |
| СПОСОБ ФОТОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ТИТАНА | 1992 |
|
RU2024850C1 |
Изобретение относится к биохимии и описывает спектрофотометрический способ определения общего белка в биологических жидкостях. Способ включает смешивание образца биологической жидкости с раствором реагента, содержащим следующие компоненты: бромпирогаллоловый красный, молибдат натрия оксалат натрия, янтарную кислоту и воду. Концентрации компонентов в растворе реагента (мас.%): бромпирогаллоловый красный - (1.5-4.0)×10-3; молибдат натрия - (0.5-1.5)×10-3; оксалат натрия - 0.01-0.03; янтарная кислота - 0.4-0.7; вода - остальное. Смешивают образец биологической жидкости и раствор реагента в соотношении 1:(5-200) соответственно и измеряют оптическую плотность пробы при длине волны в диапазоне 580-620 нм относительно холостой пробы, а затем определяют концентрацию белка методом градуировочного графика или методом одного эталона. Изобретение обеспечивает минимизацию погрешности в определении общего белка в биологических жидкостях и может быть использовано в лабораторной практике для определения содержания белка в моче, спинномозговой жидкости, ликворе, сыворотке, плазме крови. 2 з.п. ф-лы, 3 табл., 5 ил.
1. Спектрофотометрический способ определения общего белка в биологических жидкостях, включающий смешивание образца биологической жидкости с раствором реагента, взятых в определенном соотношении, выдерживание при комнатной температуре, измерение оптической плотности пробы при длинах волн в определенном диапазоне, определение концентрации общего белка, при этом раствор реагента содержит органический краситель, молибдат натрия, соль натрия, янтарную кислоту и воду, отличающийся тем, что в растворе реагента в качестве органического красителя взят бромпирогаллоловый красный, а в качестве соли натрия оксалат натрия, при этом компоненты взяты в концентрациях (мас.%):
бромпирогаллоловый красный - (1.5-4.0)×10-3,
молибдат натрия - (0.5-1.5)×10-3,
оксалат натрия - 0.01-0.03,
янтарная кислота - 0.4-0.7,
вода - остальное,
соотношение образца биологической жидкости с раствором реагента берут 1:(5-200) соответственно, измеряют оптическую плотность пробы при длине волны в диапазоне 580-620 нм относительно холостой пробы, приготовленной путем добавления к реагенту соответствующего объема физиологического раствора, определение концентрации общего белка осуществляют методом градуировочного графика или методом одного эталона.
2. Способ по п. 1, отличающийся тем, что для построения градуировочного графика используют стандартные растворы альбумина или общего белка.
3. Способ по п. 1, отличающийся тем, что оптическую плотность растворов измеряют при длине волны 600 нм.
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ БЕЛКА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 2004 |
|
RU2268476C2 |
| Ларичева Е | |||
| С., Андреев Ю | |||
| Н., Ребякова Е | |||
| Н., Козлов А | |||
| В | |||
| Способен ли метод определения белка в моче пирогаллоловым красным претендовать на роль основного? "Лабораторная диагностика", 2009, с | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| Мамедова А.М | |||
| Аналитические аспекты использования цветометрических характеристик пирогаллолового красного и | |||
Авторы
Даты
2016-08-10—Публикация
2015-02-24—Подача