Область изобретения
Данное изобретение относится к области молекулярной биологии и иммунологии, в частности к технологии идентификации пар фрагментов молекул ДНК или РНК, которые присутствуют в одних и тех же клетках, например, нативных пар фрагментов генов тяжелых и легких цепей антител или нативных пар фрагментов генов альфа- и бета-цепей Т-клеточных рецепторов.
Предшествующий уровень техники
Антитела и Т-клеточные рецепторы (ТКР) - оружие адаптивного иммунитета, способное избирательно узнавать специфические антигены - представляют собой бесценный источник средств для биологических исследований и медицинского применения (Leavy О., 2010, Nat Rev Immunol, 10, 297; Schumacher T.N., 2002, Nat Rev Immunol, 2, 512-519).
Антитело состоит из двух пар полипептидных цепей: тяжелых Н (Heavy) с молекулярным весом около 50000 и легких L (Light) - около 25000, соединенных друг с другом дисульфидными связями.
Т-клеточный рецептор также представляет собой гетеродимер, состоящий из пары различных полипептидных цепей - α и β (либо γ и δ для γδ Т клеток) - с молекулярным весом около 50000. α- и β-цепи соединены между собой дисульфидной связью.
Н-, L-, α- и β-цепи имеют сходный план строения и относятся к одному суперсемейству белков - иммуноглобулинов. Каждая цепь имеет константный (С) и вариабельный (V) районы. Вариабельные участки Н- и L-цепей (для антител) либо α- и β-цепей (для ТКР) выполняют функцию специфического распознавания и связывания антигенов и образуют активные центры. Благодаря симметричной структуре иммуноглобулина, каждая молекула антитела имеет два центра связывания с антигеном: в V-доменах тяжелых и легких цепей каждой пары. Таким образом, функциональной единицей антитела или ТКР, то есть частью, определяющей специфичность и обеспечивающей связывание антигена, является в случае антитела пара Н- и L-цепей, а в случае ТКР - пара α- и β-цепей.
Гены, кодирующие структуру одной полипептидной цепи антитела или ТКР, разделены на 2 или 3 сегмента (V/J или V/D/J) и расположены в одном участке хромосомы в определенном порядке. Согласно структуре каждого из сегментов гены, кодирующие синтез Н- и L-цепей антител и α- и β-цепей ТКР, объединены в семейства. Число таких семейств может насчитывать несколько десятков. Так, например, для вида homo sapiens, количество семейств генов β-цепи ТКР - более 50, количество семейств генов тяжелой цепи антител - более 60.
В процессе созревания лимфоцита фрагменты случайным образом рекомбинируют в один ген. Для различных цепей антител или ТКР число вариантов комбинаций достигает значений от тысяч до десятков тысяч. Кроме того, в процессе сборки происходит относительно случайная достройка и укорачивание соединяемых сегментов, что резко увеличивает число возможных комбинаций. Дальнейшее разнообразие активных центров возникает за счет объединения вариабельных районов пар цепей, составляющих эти центры. Таким образом, благодаря сборке V-гена из сегментов и формированию активных центров из разных цепей, может создаваться более 1015 теоретических вариантов уникальных по своей структуре участков молекул антител и ТКР, формирующих впоследствии репертуар антител и ТКР (Arstila, Т.P. et al. Science 2000, 288, 1135).
Анализ репертуара ТКР и антител важен для фундаментальных исследований адаптивного иммунитета в норме и патологии (Miles J.J., et al., 2011, Immunol Cell Biol, 89, 375-387).
В течение десятилетий велся поиск эффективного способа идентификации их функциональных единиц - нативных пар тяжелых и легких цепей антител или альфа- и бета-цепей ТКР.
С этой целью были разработаны различные подходы. Одним из них стало получение гибридом (Schwaber J., et al., 1973, Nature, 244, 444-447): клеточная линия, секретирующая антитела, образуется путем слияния антителообразующей клетки лимфоидной ткани иммунизированного животного и клетки плазмацитомы, находящейся на сходной стадии дифференцировки. Полученная в результате гибридома наследует от одной родительской клетки способность к секреции антител определенной специфичности, а от другой (клетки плазмацитомы) способность к неограниченному росту in vitro. Отобранные по специфичности гибридомы могут быть использованы как для идентификации ативных пар тяжелых и легких цепей антител, так и для продукции моноклональных антител.
Другой технологией является ПЦР с одиночных клеток (Lagerkvist А.С., et al. 1995 Biotechniques, 18, 862-869; Babcook J.S., 1996, Proc Natl Acad Sci USA, 93, 7843-7848; Meijer P.J., et al., 2006, J Mol Biol, 358, 764-772). Метод основан на молекулярном клонировании участков ДНК либо кДНК вариабельных участков иммуноглобулинов, полученных из одного единственного лимфоцита, например из отсортированных клеток кролика или мыши, продуцирующих специфические антитела.
Также применяется спаривание молекул на основе частоты их встречаемости (Reddy S.T., et al., 2010, Nat Biotechnol, 28, 965-969). Данный метод, как и в предыдущем случае, включает иммунизацию с последующей изоляцией клеток, продуцирующих специфические антитела, и получением кДНК вариабельных участков иммуноглобулиновых цепей. Далее для определения репертуара вариабельных участков цепей антител используются высокопроизводительные методы секвенирования и биоинформатический анализ. В данном методе выявление пар α- и β-цепей производится на основе простого анализа относительной частоты встречаемости наиболее представленных молекул, что может быть применимо лишь для нескольких наиболее представленных пар в образце.
Кроме того, нативные пары цепей ТКР или антител могут быть найдены после культивирования клонов лимфоцитов (Lagerkvist А.С., et al., 1995, Biotechniques, 18, 862-869), а также с помощью сортировки антиген-специфичных популяций Т-клеток (Trautmann L., et al., 2005, J Immunol, 175, 6123-6132) или В-клеток (Franz В., et al., 2011, Blood, 118, 348-357).
Все перечисленные методы позволяют выявлять нативные пары тяжелых и легких цепей антител или альфа- и бета-цепей ТКР, однако только для ограниченного числа клонов и по одной или несколько пар за один трудоемкий эксперимент.
Идентификация нативных пар цепей ТКР или антител для сложной смеси лимфоцитов с высокой точностью и высокой производительностью долгое время оставалась невыполнимой задачей.
Одним из высокопроизводительных решений является использование так называемых дисплейных технологий. При использовании метода фагового дисплея (Smith, G.P., 1985, Science, 228,1315-1317) в геном бактериофагов встраивают ген гибридного белка, представляющего собой продукт объединения фрагментов тяжелой и легкой цепей антитела и поверхностного белка фаговой частицы. Фрагменты тяжелой и легкой цепей антитела оказываются экспонированными на поверхности вирусных частиц. Отбор фаговых частиц производится на основе сродства фрагментов антител к антигену. Как правило, для получения фагового дисплея используется фаг М13, и фрагменты антител экспрессируют в виде гибридных белков с белками оболочки фага pIII, pIV и pVIII (Benhar, I., Pastan, I., 1994, Protein Eng., 7, 1509-1515). Из отобранных фаговых частиц затем выделяют фаговую кДНК и определяют нуклеотидную последовательность фрагментов антител. На основе этой последовательности в дальнейшем создают полноразмерные рекомбинантные антитела (Luginbuhl, B.,et al., 2006, J. Mol. Biol., 363, 75-97; Krebber, A., et al., 1997, J. Immunol. Methods, 201, 35-55; Maynard, J., Georgiou, G., 2000, Annu. Rev. Biomed. Eng. 2, 339-376.9; Winter, G. et al., 1994, Annu. Rev. Immunol., 12, 433-455). Одним из видов дисплея в эукариотах является дрожжевой дисплей. Для экспонирования рекомбинантных фрагментов антител на поверхности дрожжевых клеток создают гибридные белки, состоящие из антитела или его фрагментов и субъединицы агглютинина Aga2p, которая ковалентно соединена при помощи двух дисульфидных связей с агглютинином Aga1, заякоренным в клеточной стенке дрожжевой клетки (Boder, Е.Т. et al., 2000, Proc. Natl. Acad. Sci, 97, 10701-10705; Boder, E.T., Wittrup, K.D. 1998, Biotechnol. Prog., 14, 55-62; Boder, E.T., Wittrup, K.D. 1997, Nat. Biotechnol., 15, 553-557; Siegel R.W. 2009, Methods Mol. Biol., 504, 351-383). Фаговые и дрожжевые дисплейные технологии, хотя и эффективны для выделения антиген-специфичных антител (Hoogenboom H.R. et al., 1991, Nucleic Acids Res, 19, 4133-4137; Marks J.D. et al., 1991, J Mol Biol, 222, 581-597; Bowley D.R. et al., 2009, Proc Natl Acad Sci USA, 106, 1380-1385), но основываются на случайных спариваниях молекул и не предоставляют информацию о нативности найденных пар.
Еще один потенциально высокопроизводительный подход основан на амплификации и сборке фрагментов генов тяжелых и легких цепей антител в фиксированных клетках (Embleton M.J., 1992, Nucleic Acids Res, 20, 3831-3837; Chapal N., 1997, Biotechniques, 23, 518-524). При этом подходе клетки предварительно фиксируются, после чего в них проводится ОТ-ПЦР с использованием набора праймеров, с последующим объединением посредством лигирования или достраивания удлинением, также в пределах фиксированных клеток. Однако применение данного подхода на практике оказалось малопригодным для анализа. Подход не позволяет детектировать нативные пары цепей антител или ТКР для сложных смесей клеток, вероятно по причинам низкой эффективности реакций в фиксированных клетках, а также высокого фона от соединяемых фрагментов генов цепей из разных клеток.
Недавно была опубликована технология для идентификации нативных пар цепей антител (DeKosky B.J. et al., Nature Biotechnology, 2013). В этой технологии B-лимфоциты исходно распределяют по многолуночной плашке, содержащей микробусины, несущие поли-Т олигонуклеотиды. Затем клетки лизируют, и содержащаяся в них мРНК, в том числе мРНК, кодирующая легкие и тяжелые цепи иммуноглобулинов, гибридизуется на бусины. Затем бусины извлекают из плашки и помещают в эмульсию «вода в масле», в которой проводится обратная транскрипция, ПЦР и слияние фрагментов по методу «перекрывания-удлинения» (overlap extension) (Но S.N., et al., 1989, Gene, 77, 51-59). Выход реакции представляет собой сложную смесь продуктов ПЦР, в которой присутствуют как спаренные в ходе эмульсионной ОТ-ПЦР молекулы А-Б, так и неспаренные одиночные молекулы А и Б, амплифицированные с генетического материала разных клеток.
Авторами настоящего изобретения показано, что дальнейшая ПЦР амплификация, необходимая для подготовки образца для секвенирования по предложенной технологии, приводит к неспецифическому спариванию одиночных молекул А и Б из разных клеток, и таким образом исходная информация о нативных парах цепей теряется.
Таким образом, идентификация нативных пар цепей ТКР или антител для сложной смеси лимфоцитов с высокой точностью и высокой производительностью остается нерешенной задачей. Создание таких технологий востребовано для и диагностики и терапии заболеваний, а также фундаментальных исследований.
Настоящим изобретением предлагается оригинальный способ подавления неспецифического спаривания одиночных молекул А и Б из разных клеток с использованием нового метода ПЦР-блокировки.
Краткое описание изобретения
Настоящее изобретение относится к способу идентификации нативных пар фрагментов нуклеиновых кислот (ДНК или РНК), присутствующих в одних и тех же живых клетках.
Способ настоящего изобретения включает:
(1) амплификацию и физическое спаривание целевых фрагментов А и Б, проводимое в эмульсии;
(2) внеэмульсионную ПЦР-амплификацию спаренных целевых фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии на стадии (1).
Стадия (1) метода состоит из следующих шагов: (а) получение эмульсии «вода в масле», в которой клетки заключены в каплях водной фазы; (б) амплификации целевых фрагментов А и Б, проводимую в эмульсии; (в) физическое спаривание целевых амплифицированных фрагментов А с целевыми амплифицированными фрагментами Б, находящимися в одной капле. В преимущественных воплощениях шаги (б) и (в) происходят одновременно в ходе амплификации в эмульсии.
Стадия (2) метода состоит из следующих шагов: (г) выделение фракции нуклеиновых кислот, содержащих спаренные фрагменты, из эмульсии; (д) амплификация целевых спаренных фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии в ходе шага (в);
В преимущественных воплощениях метод также включает стадию (3) секвенирование полученных ПЦР-ампликонов.
В одном из воплощений указанный способ относится к идентификации двух различных фрагментов ДНК (фрагменты А и Б), находящихся в одной клетке. Например, указанный способ относится к идентификации фрагментов молекул ДНК, кодирующих альфа-цепь (фрагмент А) и бета-цепь (фрагмент Б) Т-клеточного рецептора, присутствующих в геноме одной клетки и представляющих функциональную единицу Т-клеточного рецептора. Указанный способ также относится к идентификации фрагментов молекул ДНК, кодирующих тяжелую цепь (фрагмент А) и легкую цепь (фрагмент Б) антитела, присутствующих в геноме одной клетки и представляющих функциональную единицу антитела.
В другом воплощении указанный способ относится к идентификации двух фрагментов различных молекул РНК (фрагменты А и Б), синтезирующихся в одной клетке. Например, указанный способ относится к идентификации фрагментов молекул мРНК, кодирующих альфа-цепь (фрагмент А) и бета-цепь (фрагмент Б) Т-клеточного рецептора, коэкспрессирующихся в одной клетке и представляющих функциональную единицу Т-клеточного рецептора. Указанный способ также относится к идентификации фрагментов молекул мРНК, кодирующих тяжелую цепь (фрагмент А) и легкую цепь (фрагмент Б) антитела, коэкспрессирующиеся в одной клетке и представляющих функциональную единицу антитела.
Способ настоящего изобретения позволяет проводить массовую идентификацию пар фрагментов А и Б в популяции живых или фиксированных клеток.
В некоторых воплощениях, стадия (б) способа настоящего изобретения (амплификация целевых фрагментов А и Б, проводимая в эмульсии) осуществляется с помощью эмульсионной ПЦР, где матрицей служат целевые фрагменты ДНК.
В других воплощениях, стадия (б) способа настоящего изобретения осуществляется с помощью эмульсионной обратной-транскрипции-ПЦР (ОТ-ПЦР), где матрицей служат целевые фрагменты РНК.
В некоторых воплощениях, стадия (в) способа настоящего изобретения (физическое спаривание целевых амплифицированных фрагментов А с целевыми амплифицированными фрагментами Б, находящимися в одной капле) осуществляется с помощью технологии «перекрывания-удлинения» (overlap extension). В других воплощениях эта стадия осуществляется с помощью лигирования, амплификации на бусинах или рекомбинации.
В преимущественных воплощениях стадия (д) настоящего изобретения осуществляется в ходе одной или нескольких последовательных ПЦР. Настоящее изобретение отличается тем, что на этой стадии используется оригинальный способ селективного подавления амплификации неспаренных целевых амплифицированных фрагментов А и неспаренных целевых амплифицированных фрагментов Б, полученных на стадии (а) и присутствующих в смеси нуклеиновых кислот. Подавление неспецифической амплификации неспаренных фрагментов А и Б является неотъемлемой и принципиальной составляющей этой стадии.
Селективное подавление амплификации неспаренных целевых фрагментов достигается за счет добавления в реакционную смесь блокирующего олигонуклеотида. Блокирующий олигонуклеотид содержит:
(а′) 3′-концевую последовательность, комплементарную последовательности 3′-концевого участка фрагмента ДНК, амплификация которого должна быть подавлена;
(б′) 5′-концевую последовательность, служащую матрицей для достройки нового 3′-конца для указанного фрагмента ДНК, где новая 3′-концевая последовательность не имеет комплементарности с предполагаемыми матрицами и исключает дальнейшее участие этого фрагмента в амплификации в качестве затравки.
Изобретенный новый тип ПЦР-блокировки позволяет, после проведения эмульсионных реакций, селективно амплифицировать библиотеку спаренных в эмульсии фрагментов генов. Суть изобретения состоит в том, что селективное подавление участия в ПЦР неспаренных фрагментов позволяет преимущественно амплифицировать целевые пары фрагментов, ранее успешно спаренные в пределах капель в эмульсии, по сравнению с амплификацией пар фрагментов, способных к нецелевому спариванию уже после выделения смеси нуклеиновых кислот из эмульсии.
Краткое описание фигур
Фиг. 1 показывает поэтапную схему получения спаренных альфа- и бета-цепей ТКР. Эмульгированные белые клетки крови разрушаются при кратковременном нагревании до 62°C; вышедшая из клеток мРНК альфа- и бета-цепей ТКР подвергается обратной транскрипции при 50°C со специфичными праймерами, после чего в каждой капле осуществляется реакция амплификации с последующем спариванием методом перекрывания-удлинения. Продукты реакции извлекаются из эмульсии, и представляющие интерес спаренные молекулы селективно амплифицируются, в то время как аплификация неспаренных молекул блокируется.
Фиг. 2 показывает схему получения спаренных альфа- и бета-цепей ТКР в пределах эмульсионной капли. Вышедшая из клеток мРНК альфа- и бета-цепей ТКР подвергается обратной транскрипции при 50°C со специфичными праймерами, после чего в каждой капле осуществляется реакция амплификации с последующем спариванием методом перекрывания-удлинения.
Фиг. 3 показывает схему ПЦР-блокировки. Представляющие интерес спаренные молекулы селективно амплифицируются, в то время как амплификация неспаренных молекул блокируется.
Фиг. 4. Пост-эмульсионная реакция амплификации спаренных молекул ТКР, полученных в одной эмульсии, содержащей все праймеры (αβ), либо объединенных после получения в двух отдельных эмульсиях, одна из которых содержит праймеры для амплификации альфа-цепей ТКР, а другая - бета-цепей ТКР (α+β после ОТ-ПЦР, то есть контроль случайных реакций перекрывания-удлинения после высвобождения из эмульсии), либо полученных в двух отдельных эмульсиях, одна из которых содержит праймеры для амплификации альфа-цепей ТКР, а другая - бета-цепей ТКР и объединенных после обратной транскрипции (α+β после ОТ, то есть контроль случайных реакций перекрывания-удлинения за счет слияния капель эмульсии). Все реакции проводили с или без использования ПЦР-блокировки.
Фиг. 5 показанывает результаты эксперимента по подбору концентрации блокирующих олигонуклеотидов в эмульсионных реакциях с живых клеток. Показаны результаты второй пост-эмульсионной амплификации спаренных альфа- и бета-цепей ТКР. Предшествующая первая пост-эмульсионная амплификация проводилась в присутствии 0, 0.2, 0.4, 0.8, 1.6, 3.2, 6.4 или 12.8 мкМ каждого блокирующего олигонуклеотида; указанная амплификация проводилась, в одном случае, с продукта полной эмульсионной реакции, проводившейся в присутствии праймеров для амплификации и реакции перекрывания-удлинения и альфа, и бета-цепей ТКР (а); в другом случае указанная амплификация проводилась со смеси продуктов, полученной после объединения двух отдельных эмульсий, каждая из которых содержала праймеры для амплификации и перекрывания-удлинения либо альфа-, либо бета-цепей (б).
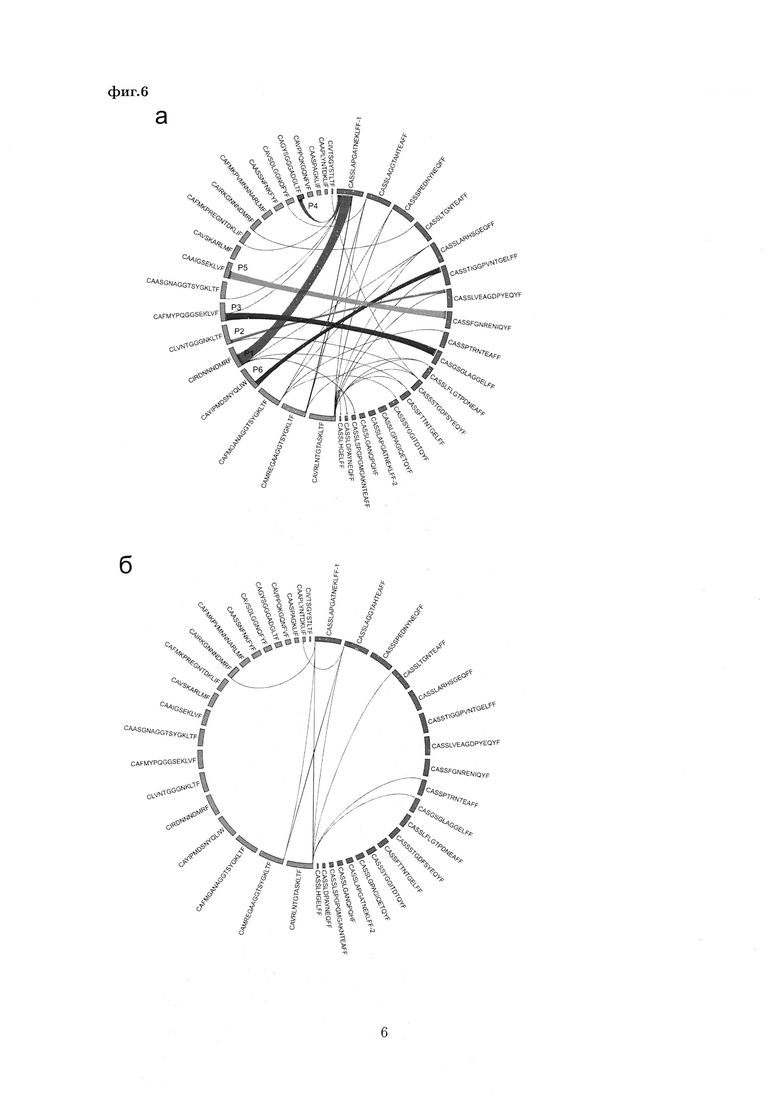
На Фиг. 6 представлена иллюстрация образования 400 теоретически наиболее вероятных пар из 20 альфа-цепей CDR3 и 20 бета-цепей CDR3, которые были преимущественно представлены в контрольной реакции. Показан процент каждой из наблюдаемых пар среди всех обнаруженных пар в эмульсии (а) и контрольной безэмульсионной реакции (б). Вычтены случайные спаривания, ожидаемые исходя из частоты встречаемости. Показаны круговые диаграммы спаривания альфа- и бета-цепей ТКР, созданные с помощью Circos (Krzywinski М., et al., 2009, Genome Res., 19, 1639-1645). Размеры сегментов указывают на представленность варианта цепи в контроле, ширина лент соотносится с числом прочтений данной пары в указанной эмульсии. Идентифицированные нативные пары обозначены номерами (P1-P6) (см. Пример 1, Табл. 3).
Фиг. 7 показавает результат проточного флуоресцентного сортинга (FACS - Fluorescence-activated cell sorting) CD8+ HLA-A*02-CMV (NLV пептид)-специфичных Т-клеток. Показана популяция клеток CD8+. Из 20 млн мононуклеарных клеток периферической крови было отсортировано более 100000 Т-клеток интересующей субпопуляции (область R1). Область R1 содержит 3,8% из CD8+ Т-клеток и 1,7% всех клеток. Чистота отсортированной популяции более 97%.
Подробное описание изобретения
Настоящее изобретение относится к способу идентификации двух различных фрагментов нуклеиновых кислот, присутствующих в одних и тех же живых клетках. Схематическое изображение способа отображено на Фиг. 1-3.
Способ настоящего изобретения включает:
Стадию (1): амплификацию и физическое спаривание целевых фрагментов А и Б, проводимое в эмульсии;
Стадию (2) внеэмульсионную ПЦР-амплификацию спаренных целевых фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии на стадии (1).
В преимущественных воплощениях метод также включает стадию (3) секвенирование полученных ПЦР-ампликонов.
В одном из воплощений указанный способ относится к идентификации двух различных фрагментов ДНК (фрагменты А и Б), находящихся в одной клетке. В другом воплощении указанный способ относится к идентификации двух фрагментов различных молекул РНК (фрагменты А и Б), синтезирующихся в одной клетке. Например, указанный способ относится к идентификации фрагментов молекул ДНК и мРНК, кодирующих альфа-цепь (фрагмент А) и бета-цепь (фрагмент Б) Т-клеточного рецептора, присутствующих в одной клетке и представляющих функциональную единицу Т-клеточного рецептора. Указанный способ также относится к идентификации фрагментов молекул мРНК, кодирующих тяжелую цепь (фрагмент А) и легкую цепь (фрагмент Б) антитела, присутствующих в одной клетке и представляющих функциональную единицу антитела.
Способ настоящего изобретения позволяет проводить массовую идентификацию пар фрагментов А и Б в популяции живых или фиксированных клеток. В частности, способ настоящего изобретения позволяет идентифицировать нативные пары альфа- и бета-цепей Т-клеточных рецепторов и тяжелых и легких цепей антител, представляющие собой функциональные единицы, в образцах крови. Способ востребован в исследованиях адаптивного иммунитета и созданий функциональных моноклональных антител и ТКР для клинических и научных приложений.
Как здесь используется термин «нативная пара» означает пару альфа- и бета-цепей Т-клеточного рецептора, либо пару тяжелых и легких цепей антитела, экспрессируемых в одном и том же лимфоците живого организма и составляющих соответственно функциональную единицу - Т-клеточный рецептор либо антитело, соответственно.
Как здесь используется термин «функциональная единица» означает пару Н- и L-цепей антител или альфа и бета-цепей ТКР, которые определяют специфичность и обеспечивают связывание антигена с антителом или ТКР, соответственно.
Стадия 1. Амплификация и физическое спаривание целевых фрагментов А и Б, проводимое в эмульсии
А) Получение эмульсии клеток
Ключевым требованием для успешного применения указанного способа является получение репрезентативной библиотеки ДНК или кДНК фрагментов А и Б, спаренных в процессе эмульсионной реакции, полученной из клеток, каждая из которых изолирована в отдельной капле минимального объема, достаточного для проведения ПЦР (Фиг. 1).
Важными качествами, позволяющими успешно применить эмульсию для нужд данного изобретения, являются ее стабильность (в т.ч. и при изменении температуры в ходе ПЦР), интактность по отношению к клеткам, заключенным в капли, и способность формировать капли эффективного объема. Под термином «эффективный объем» подразумевается объем капли, достаточный для того, чтобы вместить клетку, и объем реакционной смеси, по крайней мере, сравнимый с объемом клетки. В предпочтительных воплощениях, «эффективный объем» достаточен для того, чтобы вместить клетку и объем реакционной смеси, который больше объема клетки по крайней мере в 2 раза, предпочтительно по крайней мере в 5 раз, например в 10 и более раз, чаще всего в 20 и более раз.
Существуют различные технические решения для получения эмульсии клеток «вода в масле», отвечающей указанным требованиям и пригодной для дальнейшего проведения ПЦР (ОТ-ПЦР).
Предпочтительным вариантом получения эмульсии клеток является приготовление эмульсии типа «вода в масле», в которой клетки и все реагенты для ПЦР (или ОТ-ПЦР) заключены в капли воды. Критическим компонентом в этой композиции является сурфактант (эмульгатор), необходимый для стабилизации водных капель в масляной фазе.
Одним из подходов является приготовление эмульсии типа «агароза в масле». В этом случае компоненты водной фазы (клетки и все реагенты для ПЦР либо ОТ-ПЦР) заключены в капли из легкоплавкой агарозы, которая способна сохранять жидкое агрегатное состояние при температуре выше 16°C, тем самым обеспечивая эффективное протекание реакции в эмульсии (Zhang Н et al, Anal Chem. 2012 Apr 17; 84(8):3599-606; Leng X, Yang CJ., Methods Mol Biol. 2013; 949:413-22; Zhi Zhu et al., Lab Chip, 2012, 12, 3907-3913).
В некоторых вариантах реализации данного изобретения в качестве масляной дисперсионной среды при приготовлении эмульсии может использоваться фторуглеродное масло. Предпочтительными эмульгаторами, применяющимися для стабилизации водных капель в фторуглеродном масле являются сурфактанты - производные перфторполиэфира (ПФПЭ):
Krytox (DuPont) (С. Holtze, А.С. Rowat, J.J. Agresti, J.В. Hutchison, F.E. Angile, C.H.J. Schmitz, S. Koster, H. Duan, K.J. Humphry, R.A. Scanga, J.S. Johnson, D. Pisignano, D.A. Weitz, Lab Chip 2008, 8, 1632-1639.),
полиэтиленгликоль-ПФПЭ (J. Clausell-Tormos, D. Lieber, J.C. Baret, A. El-Harrak, O.J. Miller, L. Frenz, J. Blouwolff, K.J. Humphry, S. Koster, H. Duan, C. Holtze, D.A. Weitz, A.D. Griffiths, C.A. Merten, Chem. Biol. 2008, 15, 427-437.),
гексаэтиленгликоль-ПФПЭ (D.J. Holt, R.J. Payne, W.Y. Chow, C. Abell, J. Colloid Interface Sci. 2010, 350, 205-211).
В других вариантах реализации настоящего изобретения в качестве масляной дисперсионной среды при приготовлении эмульсии может использоваться углеводородное (минеральное) масло. Известны следующие системы сурфактантов, применяемые для стабилизации водных капель в минеральном масле:
- 4.5% Span-80, 0.4% Tween 80, 0.05% Triton Х-100 (Williams et al., Nat Methods, vol. 3 no. 7, 545-550);
- 73% Tegosoft DEC, 7% ABIL WE (Schutze et al., Anal. Biochem. 2011 March 1; 410(1):155-7);
- 3% ABIL-EM90 (Schaerli Y et al, 2009 Anal Chem 81:302-306);
- 2% ABIL-EM90, 0.05% Triton X-100 (Hatch AC et al., 2011, Lab Chip 11:3838-3845).
В некоторых вариантах реализации данного изобретения (амплификация ДНК) в качестве водного компонента эмульсии используется реакционная смесь для ПЦР, в которую помещают клетки.
В других вариантах реализации данного изобретения (амплификация РНК) в качестве водного компонента эмульсии используется смесь для ОТ-ПЦР, в которую помещают клетки.
Составы реакционных смесей и ферменты для ПЦР и ОТ-ПЦР хорошо известны из уровня техники и доступны в виде коммерческих наборов реактивов. Особенности реакционных смесей, используемых для реализации данного изобретения описаны подробно в разделе «Б» Эульсионная ПЦР либо ОТ-ПЦР», ниже. Примеры конкретных смесей приведены в разделе «Примеры».
В некоторых вариантах реализации изобретения для приготовления эмульсии клеток могут использоваться живые клетки непосредственно сразу после выделения из биологического материала. Например, для осуществления предлагаемого способа идентификации нативных пар тяжелых и легких цепей антител или пар альфа- и бета-цепей Т-клеточных рецепторов могут быть использованы мононуклеарные клетки периферической крови (МКПК), полученные при центрифугировании цельной крови в градиенте плотности фиколл-урографин.
В других вариантах реализации изобретения для приготовления эмульсии клеток могут использоваться клетки, подвергшиеся процедуре заморозки. В предпочтительном варианте для заморозки клеток используется среда с добавлением сыворотки и DMSO. Перед приготовлением эмульсии клетки необходимо разморозить и отмыть от криоконсервационной среды. Соответствующие протоколы хорошо известны и описаны например, в (Kreher et al. (2003) Journal of Immunological Methods 278:79-93, Reimann, et al. (2000) Clin. Diagn. Lab. Immunol. 7:352-359, and Romeu et al. (1992) J. Immunol. Methods 154:7-10.) В других вариантах реализации изобретения для приготовления эмульсии клеток могут использоваться клетки, подвергшиеся процедуре фиксации.
Предпочтительным вариантом фиксации клеток является фиксация формальдегидом. Перед приготовлением эмульсии клетки необходимо отмыть от фиксирующего реагента.
Важным параметром, влияющим на качество приготовляемой эмульсии, является количество клеток, добавляемое в реакцию. При добавлении в реакцию слишком малого числа клеток становится невозможным получить детектируемое количество целевых спаренных фрагментов А-Б. При добавлении в реакцию избыточного числа клеток увеличивается вероятность попадания нескольких клеток в одну каплю эмульсии. Тем не менее, концентрация клеток при различных вариантах реализации изобретения может варьировать в широких пределах и составлять от 100 штук до 100 миллионов штук и более на 100 мкл водной фазы приготовляемой эмульсии. В предпочтительном варианте реализации изобретения, концентрация клеток составляет от 10 тысяч до 1 миллиона штук на 100 мкл водной фазы приготовляемой эмульсии.
Эмульсия готовится путем перемешивания масляного компонента и водного компонента, например, в соотношении 9:1. Перемешивание происходит, например, при температуре 25°C. Варианты приготовления эмульсии хорошо известны из уровня техники. В некоторых воплощениях заявленного способа для перемешивания масляного (смесь масла и эмульгаторов) и водного (смесь реагентов для ПЦР/ОТ-ПЦР и клеток) компонентов эмульсии используются микрофлюидные чипы, представляющие собой организованную систему микроканалов в объеме тонкой твердой подложки из стекла, кремния или полимеров (Eric Brouzes et al., 2009, PNAS, vol. 106, no. 34, 14195-14200; Zeng et al., Anal. Chem. 2010, 82, 3183-3190; Zhang et al., Anal. Chem. 2012, 84, 3599-3606). В других воплощениях заявленного способа для достижения этой цели используется механическое перемешивание компонентов эмульсии с помощью магнитной мешалки и магнитного якоря (Williams et al., Nat Methods, vol. 3 no. 7, 545-550; Dekosky BJ et al., Nat Biotechnol. 2013 Jan 20; 31(2):166-9; Shao et al., PLoS One. 2011; 6(9):e24910).
После перемешивания масляного и водного компонентов, подготовленная эмульсия распределяется по пробиркам для ПЦР-амплификации, количество которых зависит от объема реакционной смеси.
Б) Эмульсионная ПЦР либо ОТ-ПЦР
В некоторых воплощениях, стадия амплификации целевых фрагментов А и Б, проводимая в эмульсии клеток, способа настоящего изобретения осуществляется с помощью эмульсионной ПЦР, где матрицей служат целевые фрагменты ДНК. В других воплощениях стадия амплификации целевых фрагментов А и Б, проводимая в эмульсии клеток, осуществляется с помощью эмульсионной обратной-транскрипции-ПЦР (ОТ-ПЦР), где матрицей служат целевые фрагменты РНК.
Для выделения из клеток, изолированных в каплях эмульсии, фракции нуклеиновых кислот (ДНК/РНК) могут применяться различные технические решения. В некоторых вариантах реализации способа изобретения возможно использование технологии лазерного фотолизиса клеток (М. Не, J.S. Edgar, G.D.М. Jeffries, R.М. Lorenz, J.P. Shelby, D.Т. Chiu, Anal. Chem. 2005, 77, 1539-1544). В других вариантах реализации способа предлагаемого изобретения возможно использование технологии температурного лизиса клеток. Авторами изобретения показано, что при нагревании эмульсии, содержащей живые мононуклеарные клетки периферической крови, до температуры 65°C и инкубации при такой температуре в течение более 30 секунд, например, в течение 2 минут, происходит разрушение клеток внутри капель эмульсии и выход нуклеиновых кислот (ДНК/РНК) в реакционную среду.
Во варианте реализации предлагаемого изобретения, в котором в качестве матрицы для синтеза целевых фрагментов используется РНК, стадия (б) настоящего способа начинается с процесса обратной транскрипции. Обратная транскрипция представляет собой синтез одноцепочечной кДНК на матрице РНК и обеспечивает переход от нестабильных молекул РНК к более стабильным молекулам кДНК.
В этом случае, в преимущественном варианте воплощения предлагаемого изобретения, в составе реакционной смеси на стадии (б) настоящего способа должен присутствовать ингибитор РНКаз, например ингибитор RNAsin плацентарного или рекомбинантного происхождения или ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Синтез первой цепи кДНК на матрице РНК происходит при участии фермента РНК-зависимой ДНК-полимеразы (обратной транскриптазы). Для проведения реакции обратной транскрипции могут использоваться различные коммерчески доступные препараты термостабильных обратных транскриптаз, способных сохранять свою активность после инкубации реакционной смеси при 65°C в течение 2 минут, например, обратная транскриптаза MMLV (Евроген) или SuperScript III (Invitrogen).
Амплификация целевых фрагментов А и Б на матрице ДНК или кДНК происходит при участии фермента - ДНК-зависимой ДНК-полимеразы. Для проведения амплификации могут использоваться различные коммерчески доступные препараты термостабильных ДНК-полимераз, например полимераза Encyclo (Евроген). Для амплификации кДНК, ключевым свойством используемой ДНК-полимеразы является способность работать в одном и том же буфере с обратной транскриптазой, так как реакция происходит в пределах эмульсии, не оставляя возможности для замены реакционного буфера.
Для проведения амплификации целевых фрагментов А и Б на матрице ДНК или кДНК на стадии (б) настоящего способа необходимо присутствие в составе реакционной смеси по крайней мере двух пар специфических праймеров (прямого и обратного) - для амплификации фрагмента «А» (праймеры «а») и для амплификации фрагмента «Б» (праймеры «б»).
Праймеры - синтетические олигонуклеотиды, комплементарные последовательностям ДНК на левой и правой границах амплифицируемого фрагмента и ориентированные таким образом, что достраивание новой цепи ДНК проходит только между ними. В результате ПЦР происходит многократное увеличение числа копий (амплификация) специфического фрагмента ДНК или кДНК.
Один из пары праймеров обозначается термином «прямой», а второй - «обратный». Для нужд настоящего изобретения термином «прямой праймер» обозначен праймер, который повторяет последовательность кодирующей цепи ДНК, а термином «обратный праймер» - праймер, который комплементарен кодирующей цепи. Как здесь используется «кодирующая цепь ДНК» обозначает цепь идентичную мРНК, а комплементарная ей цепь используется как матрица при транскрипции.
В варианте реализации предлагаемого изобретения, в котором в качестве матрицы для синтеза целевых фрагментов используется РНК, два обратных праймера, кроме того, служат для затравки синтеза первой цепи кДНК на матрице РНК. Два прямых праймера служат для ПЦР-амплификации целевых фрагментов А и Б.
Оптимальные концентрации праймеров в реакционной смеси варьируют в пределах 0.1-1 мкМ, как правило, в пределах 0.2-0.5 мкМ.
В вариантах осуществления настоящего изобретения, в которых проводится идентификация нескольких пар фрагментов нуклеиновых кислот, присутствующих в одних и тех же живых клетках, на стадии (б) предлагаемого способа используются смеси прямых и обратных праймеров, специфичных к парам исследуемых целевых фрагментов.
Помимо нуклеиновых кислот (ДНК/РНК) - матриц для синтеза целевых фрагментов А и Б, ферментов, осуществляющих этот синтез (обратной транскриптазы, ДНК-полимеразы) и праймеров в состав реакционной смеси заявленного способа вводят следующие компоненты:
- смесь дезоксирибонуклеотидтрифосфатов четырех типов (dATP, dTTP, dGTP, dCTP). Концентрация dNTP может варьировать от 0.2 мМ до 0.6 мМ для каждого dNTP, причем все четыре dNTPs должны использоваться в эквивалентных концентрациях для минимизации ошибок присоединения. В предпочтительном варианте реализации изобретения используется концентрация dNTP 0.6 мМ.
- реакционный буферный раствор, в котором используемые ферменты сохраняют функциональность. Состав буферного раствора зависит от того, какие именно ферменты используются для ПЦР или ОТ-ПЦР.
Как здесь используется, термин "функциональный" означает, что фермент может функционировать для указанного испытания или задачи. Например, термин "функциональный", используемый для описания ДНК полимеразы означает, что она способна осуществлять синтез на подходящей ДНК или РНК-матрице.
Реакция амплификации целевых фрагментов А и Б проводится с использованием специализированного оборудования - амплификаторов, согласно температурному режиму, показанному в таблице 1.
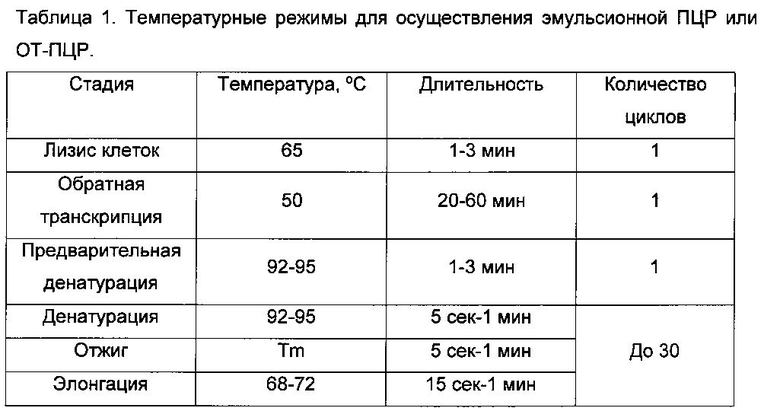
Стадия обратной транскрипции присутствует в программе амплификации только в тех вариантах реализации способа, в которых в качестве матрицы для синтеза целевых фрагментов А и Б служит РНК.
Температура Tm стадии отжига зависит от структуры праймеров и обычно варьирует в пределах от 50°C до 72°C.
Для амплификации целевых фрагментов А и Б в эмульсии, как правило, необходимо не менее 15 циклов, однако в некоторых приложениях настоящего изобретения их число может быть и меньше.
Для амплификации целевых фрагментов А и Б в эмульсии не рекомендуется проводить более 30 циклов, так как многократный нагрев и охлаждение эмульсии снижают ее стабильность.
Оптимальные условия амплификации (температура, время инкубации и количество циклов ПЦР) могут варьировать в зависимости от характеристик амплификатора, объема амплифицируемой реакционной смеси, структуры праймеров.
В) Физическое спаривание целевых амплифицированных фрагментов А с целевыми амплифицированными фрагментами Б, находящимися в одной капле.
Указанный в настоящем изобретении способ идентификации производится с помощью физического спаривания амплифицированных на стадии (б) фрагментов ДНК или РНК. В предпочтительном варианте реализации способа спаривание производится с помощью технологии перекрывания-удлинения (Но S.N., et al., 1989, Gene, 77, 51-59) в пределах каждой капли эмульсии.
В данном варианте осуществления спаривания обеспечивается спаривание лишь тех продуктов амплификации фрагментов ДНК или РНК, которые присутствуют в одной и той же капле.
В данном варианте осуществления спаривания процесс амплификации целевых фрагментов ДНК или РНК и процесс перекрывания-удлинения амплифицированных целевых фрагментов происходят одновременно и в одном и том же объеме.
В данном варианте осуществления спаривания путем перекрывания-удлинения амплифицированных целевых фрагментов используются те же праймеры, что и для процесса амплификации целевых фрагментов ДНК или РНК.
Для обеспечения перекрывания в последовательности праймеров вводят дополнительные последовательности, так называемые «перекрывающиеся хвосты», как показано на схеме (Фиг. 2).
В одном из вариантов способа настоящего изобретения «перекрывающиеся хвосты» для реакции перекрывания-удлинения вводят в прямые праймеры, специфические для фрагментов «А» и «Б». 5′-концевые участки двух прямых праймеров, предназначенных для спаривания целевых фрагментов А и Б, представляют собой взаимокомплементарные последовательности. В этом случае два обратных праймера (один, специфический для фрагмента «А», а второй - для фрагмента «Б») используются для ПЦР-амплификации фрагментов А и Б и последующей ПЦР-амплификации спаренных цепей А-Б. При старте с кДНК, те же два обратных праймера могут служить для затравки синтеза кДНК.
В другом варианте реализации способа изобретения «перекрывающиеся хвосты» вводят в обратные праймеры. Обратные праймеры также могут использоваться для амплификации фрагментов. Обратные праймеры также могут выполнять функцию затравки синтеза кДНК. В этом варианте реализации способа изобретения, два прямых праймера (один, специфический для фрагмента «А», а второй - для фрагмента «Б») используются только для ПЦР-амплификации фрагментов А и Б и последующей ПЦР-амплификации спаренных цепей А-Б.
В третьем варианте реализации способа изобретения «перекрывающиеся хвосты» вводят в прямой праймер «а» и обратный праймер «б». В этом случае для ПЦР-амплификации фрагментов А и Б и последующей ПЦР-амплификации спаренных цепей А-Б используют обратный праймер «а» и прямой праймер «б».
В четвертом варианте реализации способа изобретения «перекрывающиеся хвосты» вводят в адаптер, на который обратная транскриптаза переходит после синтеза кДНК по технологии синтеза кДНК со сменой матрицы (Template switching cDNA synthesis approach, Matz, M., et al., Nucleic Acids Res. 1999. 27:1558-1560.).
Длина последовательности для перекрывания-удлинения может варьировать от 8 до 75 нуклеотидов, однако в предпочтительном варианте реализации способа изобретения составляет 15-28 нуклеотидов. Использование более длинных 5′-концевых последовательностей для перекрывания с одной стороны может повысить эффективность спаривания целевых фрагментов, с другой стороны - снизить эффективность связывания с целевыми фрагментами 3′-концевого участка праймера. Использование слишком коротких 5′-концевых последовательностей для перекрывания может привести к преобладанию процесса амплификации целевых фрагментов над процессом их спаривания. При разработке структуры последовательности для перекрывания следует учитывать способность Taq-полимеразы нематрично добавлять дополнительный аденозин (dATP) к 3′-концу вновь синтезированной молекулы ДНК. Кроме того, необходимо принимать во внимание общие правила создания праймеров для ПЦР: праймеры с последовательностью для перекрывания не должны образовывать шпилек, димеров, иметь сайтов для неспецифического отжига.
В предпочтительном варианте реализации изобретения концентрация праймеров с участком для перекрывания-удлинения должна быть ниже концентрации праймеров, использующихся только для ПЦР-амплификации целевых фрагментов А и Б. Суммарная концентрация олигонуклеотидов в реакции перекрывания-удлинения может достигать 1-2 мкМ и более. В случае, когда целевой фрагмент А амплифицируется с меньшей эффективностью, чем целевой фрагмент Б, выровнять эффективности амплификации можно, увеличив концентрацию прямого и обратного праймеров «а» или снизив концентрацию прямого и обратного праймеров «б». Например, концентрация праймера может быть повышена до 5 мкМ или снижена до 0.03 мкМ. Оптимальные концентрации каждого праймера находятся в диапазоне 0.1-0.5 мкМ.
В другом варианте указанное спаривание может быть осуществлено с помощью лигирования. В другом варианте настоящего изобретения спаренные молекулы могут быть получены посредством амплификации на бусинах. В еще одном варианте изобретения пары молекул могут быть получены рекомбинацией.
Стадия 2. Внеэмульсионная ПЦР-амплификацию спаренных целевых фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии на стадии.
(Г) Выделение фракции нуклеиновых кислот, содержащих спаренные фрагменты, из эмульсии
Для осуществления предлагаемого способа изобретения после окончания эмульсионной ПЦР/ОТ-ПЦР и физического спаривания фрагментов А и Б необходимо провести выделение из эмульсии продукта реакции, содержащего спаренные целевые молекулы А-Б.
Это может быть осуществлено многими способами разбиения эмульсии «вода в масле», включая использование коагулирующих агентов. Одним из подходов является использование в качестве коагулирующих агентов неорганических соединений - KCl, NaCl, AlCl3, FeCl3, Al2(SO4)3, Fe2(SO4)3 (Japanese Unexamined Patent Publication No. 54-156268, No. 50-116369, No. 46-49899, No. 46-33131).
Другим подходом является использование в качестве коагулирующих агентов органических растворителей - водонасыщенного диэтилового эфира, этилацетата (Williams R., et al., 2006, Nat Methods, 3, 545-550).
В еще одном варианте разбиение эмульсии может осуществляться механически путем фильтрации (Japanese Unexamined Patent Publication No. 53-91462).
В предпочтительном варианте реализации способа изобретения на стадии выделения нуклеиновых кислот из эмульсии для блокировки активности полимеразы в реакцию добавляется хелатирующий агент, например, ЭДТА в концентрации не менее 0.5 мМ, предпочтительно в концентрации 1 мМ и более.
В предпочтительном варианте реализации способа изобретения продукт эмульсионной ПЦР/ОТ-ПЦР после выделения из эмульсии очищают с использованием любого коммерчески доступного набора для очистки ПЦР-продуктов, например набора PCR CleanUp Kit (Qiagen, США).
В одном из вариантов реализации способа изобретения очистке и дальнейшей амплификации подвергается суммарная фракция нуклеиновых кислот, выделенная из эмульсии.
В другом варианте реализации способа изобретения суммарная фракция нуклеиновых кислот, выделенная из эмульсии, разделяется с помощью агарозного гель-электрофореза согласно размеру ампликонов. Очистке и дальнейшей амплификации подвергается лишь та часть суммарного послеэмульсионного ПЦР-продукта, которая соответствует по размеру спаренному ПЦР-продукту А-Б.
Д) ПЦР-амплификация целевых спаренных фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии в ходе шага (в)
Непосредственный результат эмульсионной ПЦР/ОТ-ПЦР на базе живых клеток представляет собой сложную смесь продуктов ПЦР, в которой присутствуют, но не обязательно доминируют целевые продукты, то есть спаренные в эмульсии продукты перекрывания-удлинения А-Б.
Для наработки детектируемого количества целевых продуктов перекрывания-удлинения А-Б предлагаемый способ реализации изобретения подразумевает применение вложенной (nested) ПЦР-амплификации (ПЦР с заглубленными праймерами) (Porter-Jordan К., et al. 1990, J Med Virol, 30, 85-91).
В ходе вложенной ПЦР используют праймеры, амплифицирующие спаренный фрагмент, но расположенные чуть ближе к центру спаренного фрагмента относительно праймеров, фланкировавших спаренный фрагмент в ходе эмульсионной ПЦР. Оптимальные концентрации праймеров, использующихся в ходе вложенной ПЦР, как правило, варьируют от 0.2 до 0.5 мкМ.
Кроме продукта эмульсионной ПЦР, выступающего в качестве матрицы для вложенной ПЦР, и праймеров в состав реакционной смеси на стадии (д) вводят смесь дезоксирибонуклеотидтрифосфатов четырех типов (dATP, dTTP, dGTP, dCTP) в концентрации 0.2 мМ каждого из dNTP, фермент, осуществляющий синтез ДНК на матрице ДНК (ДНК-зависимая ДНК-полимераза) и реакционный буферный раствор.
Реакция амплификации проводится с использованием специализированного оборудования - амплификаторов, согласно температурному режиму, указанному в таблице 2.

После разрушения эмульсии на стадии (г) настоящего способа спаренные в ходе эмульсионной ПЦР/ОТ-ПЦР молекулы А-Б, а также неспаренные одиночные молекулы А и Б, амплифицированные с генетического материала разных клеток, объединяются в одном и том же реакционном объеме. Авторами настоящего изобретения показано, что амплификация спаренных молекул А-Б, образовавшихся в результате перекрывания-удлинения фрагментов А и Б внутри эмульсии (целевой продукт), происходит с той же эффективностью, что и амплификация молекул А-Б, спаривание которых происходит в результате случайного постэмульсионного перекрывания-удлинения фрагментов А и Б в ходе ПЦР на стадии «Д».
Для селективной блокировки такого случайного перекрывания-удлинения, а также для селективной блокировки мега-праймирования (то есть затравки амплификации спаренного фрагмента с продукта ПЦР неспаренного фрагмента, выступающего в роли праймера) одиночных неспаренных продуктов ПЦР А и Б, амплификация целевых спаренных фрагментов А-Б, выделенных из эмульсии, проводится в присутствии олигонуклеотидов, блокирующих эти процессы. Авторами изобретения показана возможность подавления нежелательной амплификации при добавлении блокирующих олигонуклеотидов в концентрации более 1.6 мкМ более чем в 100 раз (фиг. 5).
5′-концы блокирующих олигонуклеотидов представлены последовательностями, комплементарными 3′-концам неспаренных одиночных молекул А и Б, и обеспечивают гибридизацию блокирующих олигонуклеотидов с неспаренными фрагментами А и Б, потенциально способными вступить в реакцию случайного перекрывания-удлинения.
Длина комплементарной последовательности зависит от ее GC состава и должна обеспечивать эффективную гибридизацию блокирующих нуклеотидов на неспаренные фрагменты А и Б при температуре отжига праймера, используемого для ПЦР. Как правило, длина комплементарной последовательности блокирующего олигонуклеотида составляет не менее 12 нуклеотидов, например 18 или 22 нуклеотида или более.
3′-концы блокирующих олигонуклеотидов представляют собой некодирующие последовательности и служат матрицей для удлинения неспаренных фрагментов А и Б на несколько несмысловых нуклеотидов. Удлиненные продукты теряют сайт отжига на 3′-конце с парной молекулой (фрагмент А с фрагментом Б и/или фрагмент Б с фрагментом А) и, следовательно, способность вступать в реакцию перекрывания-удлинения. Предлагаемый в данном изобретении способ ПЦР-блокировки проиллюстрирован на фиг. 3.
В предлагаемом варианте реализации указанного способа блокировки 3′-концы блокирующих олигонуклеотидов защищены от простраивания терминальным нуклеотидом. В некоторых вариантах реализации способа изобретения в качестве терминального нуклеотида может использоваться дидекзинуклеотидтрифосфат (ddNTP′s). В других вариантах для блокирования простраивания 3′-концов может использоваться фосфатная группа (PO4-). Наличие терминального нуклеотида предотвращает возможность достраивания блокирующих нуклеотидов в ходе ПЦР.
В некоторых воплощениях настоящего изобретения длина блокирующей части может быть 1 и более нуклеотидов, преимущественно 2 и более нуклеотидов, или 3 и более нуклеотидов. В преимущественных воплощениях длина блокирующей части составляет не менее 7 нуклеотидов, например 7-25 нуклеотидов.
Блокирующие олигонуклеотиды добавляют в реакцию в избытке концентрации по сравнению с концентрацией праймеров. Оптимальная концентрация блокирующих олигонуклеотидов в каждом конкретном случае подбирается экспериментально путем титрования. Слишком низкая концентрация не обеспечивает эффективной блокировки нежелательной амплификации. Слишком высокая концентрация дополнительных олигонуклеотидов в реакции приводит к подавлению амплификации целевых фрагментов.
В некоторых воплощениях настоящего изобретения, концентрация блокирующего нуклеотида в реакционной смеси превышает концентрацию праймеров по крайней мере в 2 раза. Однако предпочтительным является использование максимальной возможной концентрации блокирующих олигонуклеотидов, не вызывающей ингибирования амплификации целевых фрагментов. В случае, проиллюстрированном в «Примере 1», такой концентрацией блокирующих олигонуклеотидов является концентрация, превышающая концентрацию праймеров в 32 раза, и составившая 3.2 мкМ.
В предпочтительном варианте реализации указанного способа амплификации целевых спаренных фрагментов в присутствии олигонуклеотидов, блокирующих амплификацию неспаренных фрагментов, используют ДНК-зависимую ДНК-полимеразу, лишенную корректирующей активности, например Taq-полимеразу.
Продукт ПЦР, полученный в результате вложенной ПЦР-амплификации с добавлением блокирующих олигонуклеотидов, представляет собой продукт преимущественной амплификации спаренных во время эмульсии целевых фрагментов А-Б.
Таким образом, новый тип ПЦР-блокировки позволяет устранить фоновую амплификацию, производимую из-за случайных реакций перекрывания-удлинения после эмульсионной ПЦР или эмульсионной ОТ-ПЦР.
Стадия 3. Секвенирование полученных ПЦР-апликонов
Секвенирование полученных ПЦР-апликонов может проводиться любым известными методами и технологиям секвенирования. Предпочтительным вариантом секвенирования является высокопроизводительное секвенирование, например двустороннее секвенирования по технологии Illumina, позволяющее получать сотни тысяч и миллионы парных прочтений для анализируемой библиотеки ПЦР-фрагментов. Секвенирование может проводиться по стандартным протоколам производителя.
Способы применения
Метод настоящего изобретения востребован при идентификации уникальных нуклеиновых кислот, присутствующих в одной клетке, в частности для идентификации нативных пар Т клеточных рецепторов и нативных пар тяжелых и легких цепей также антител.
Идентификация нативных пар Т клеточных рецепторов необходима для рационального анализа Т клеточных репертуаров при исследовании иммунной системы, а также для непосредственной идентификации специфичных ТКР, в том числе ТКР, специфичных к вирусным и бактериальным пептидам, аутологичным пептидам, пептидам, экспонированным на тех или иных опухолевых клетках. Соответственно, идентификация нативных пар альфа- и бета-цепей Т-клеточных рецепторов может быть эффективно использована при разработке методов точной диагностики, а также методов высокоспецифичной индивидуальной терапии инфекционных, аутоиммунных, и онкологических заболеваний.
Идентификация нативных пар тяжелых и легких цепей антител необходима для рационального исследования адаптивного иммунитета в норме и патологии. Кроме того, идентификация нативных пар тяжелых и легких цепей антител необходима при разработке моноклональных терапевтических антител высокой специфичности, которые с каждым годом все активнее используются для лечения самых различных заболеваний.
Следующий пример предлагается в качестве иллюстративного, но не ограничивающего.
Примеры
Пример 1. Выявление нативных пар альфа- и бета-цепей ТКР для мононуклеарных клеток периферической крови (МКПК) из образца человеческой донорской крови.
Данный пример иллюстрирует применение предлагаемого способа для выявления нативных пар ТКР, для спектра 16 вариантов V-сегментов альфа-цепей (TRAV4, 8, 12, 13, 14, 21, 22, 24, 25, 26-1, 26-2, 27, 29, 38, 39, 41) и 1 семейства бета-цепей (TRBV7) ТКР для МКПК образца человеческой донорской крови.
Эксперимент включал следующие этапы:
- выделение клеток МКПК и помещение их эмульсию,
- эмульсионная ОТ-ПЦР,
- пост-эмульсионная ПЦР с вложенными праймерами, с эффектом ПЦР-блокировки неспаренных фрагментов,
- массированное секвенирование полученной библиотеки спаренных фрагментов и анализ полученных данных,
- подтверждение верности идентифицированных пар с использованием сортировки антиген-специфичных клеток и секвенирования полученных библиотек альфа- и бета-цепей генов ТКР.
Выделение МКПК и помещение их эмульсию
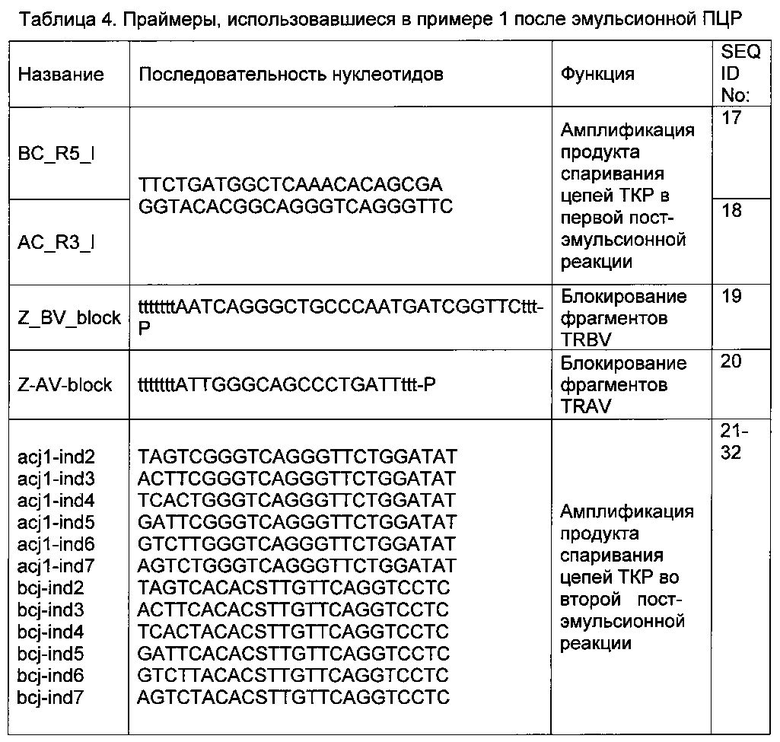
МКПК были выделены из образца периферической крови 45-летнего мужчины (с информированного согласия) с помощью центрифугирования в градиенте плотности фиколл-урографин (Paneco). 1×106 живых МКПК предварительно инкубировали в течение ночи с 10 Ед/мл IL2 (Roche) и использовали для каждой из 8 эмульсионных и 2 контрольных реакций. Эмульсии были получены согласно описанию (Williams R., et al., 2006, Nat Methods, 3, 545-550) при температуре 25, из 900 мкл смеси масло-сурфактант (2% ABIL EM 90 и 0,05% Тритон Х-100 в минеральном масле) и 100 мкл водной фазы, содержавшей МКПК в 10 мкл 150 мМ NaCl, 7,5 UE полимеразы Encyclo (Евроген, Россия), 5 мкл 10х буфера для полимеразы Encyclo, 5 UE обратной транскриптазы MMLV (Евроген), 3,5 мМ MgCl2, 1,4 мМ DTT, 0,5 г/л BSA, 30 UE RNAsin (Promega, США), 2,4 мМ смесь dNTP, и олигонуклеотиды: BC_R4_s (0,2 мкм), AC_R2_s (0,2 мкм), Z_BV7 (0,2 мкм), смесь из 12 праймеров TRBA: Z_AV14_BV_s, Z_AV26-1/4_BV_s, Z_AV26-2/4_BV_s, Z_AV39/24_BV_s, AV38_2_Z, AV13_2_Z, AV25_2_Z, Z_AV41/22_BV, Z_AV8_BV, Z_AV29/23_BV, Z_AV12S3_BV, AV27_BV_l (0,02 мкМ каждого), и Z_BV_CompRev (0,2 мкм). Все олигонуклеотиды, использованные на этом этапе исследования, а также их функции приведены в Таблице 3.
Эмульсионная ОТ-ПЦР
Содержащая клетки эмульсия была прогрета в течение 2 мин при температуре 65°C для разрушения МКПК и высвобождения РНК в реакционный объем.
Для проведения дальнейших реакций, показанных на Фиг. 2, был использован следующий температурный режим: 30 мин инкубации при 50°C для специфичного отжига праймеров на РНК и синтеза кДНК, 27 циклов для ПЦР-амплификации и перекрывания-удлинения: 94°C 10 сек, 53°C 10 сек, 72°C 20 сек.
Для блокировки активности полимеразы, сразу после амплификации в эмульсии в реакцию был добавлен ЭДТА до конечной концентрации 1 мМ. Продукт реакции был экстрагирован из эмульсии согласно описанию с помощью диэтилового эфира/этилацетата/диэтилового эфира (Williams R., et al., 2006, Nat Methods, 3, 545-550) и очищен с использованием набора для очистки ПЦР-продуктов (Qiagen).
Пост-эмульсионная ПЦР со вложенными праймерами, с эффектом ПЦР-блокировки неспаренных фрагментов
Вся полученная в эмульсии ДНК амплифицировалась с помощью двух последовательных вложенных ПЦР с углубленными праймерами, специфичными для константных участков генов альфа- и бета-цепей ТКР (Таблица 4) с использованием метода ПЦР-блокировки, предусмотренного в данном изобретении, чтобы блокировать амплификацию неспаренных во время эмульсии фрагментов генов альфа- и бета-цепей ТКР, как показано на Фиг. 3.
Состав первой постэмульсионной ПЦР: 5 UE Taq полимеразы (Евроген), 2.5 мкл 10х буфера для Taq полимеразы (Евроген), 2,4 мМ смесь dNTP, и олигонуклеотиды: BC_R5_l (0,2 мкм), AC_R3_l (0,2 мкм), Z_BV_block (3,2 мкм), Z-AV-block (3,2 мкм). Объем реакции составлял 25 мкл. Амплификация проводилась при следующем температурном режиме:
- предварительная денатурация ДНК 95С - 1 мин 30 сек,
- 15 циклов (денатурация 95С - 10 сек, отжиг 62С - 10 сек, элонгация 72С - 20 сек).
Продукт первой постэмульсионной ПЦР разводили в 25 раз и проводили вторую постэмульсионную амплификацию. Состав второй постэмульсионной ПЦР: 5 UE Taq полимеразы (Евроген), 2.5 мкл 10х буфера для Taq полимеразы (Евроген), 2,4 мМ смесь dNTP, и олигонуклеотиды: acj1-indN (0,2 мкм), bcj1-indN (0,2 мкм), bcj2-indN (0,2 мкм). Объем реакции составлял 25 мкл. Амплификация проводилась при следующем температурном режиме:
- предварительная денатурация ДНК 95С - 1 мин 30 сек,
- 15 циклов (денатурация 95С - 10 сек, отжиг 62С - 10 сек, элонгация 72С - 20 сек).
Последовательности олигонуклеотидов, использованных на данном этапе исследования представлены в Таблице 4.
Массированное секвенирование полученной библиотеки спаренных фрагментов и анализ полученных данных
Полученная библиотека ДНК-фрагментов была просеквенирована на секвенаторе нового поколения MiSeq, длина чтения 150 нуклеотидов с каждой стороны.
Чтобы извлечь сиквенсы фрагментов альфа- и бета-цепей ТКР и исправить ошибки ПЦР, которые приводят к большему разнообразию последовательностей и к искусственному увеличению вариантов прочтений, сырые данные секвенирования Ilumina были проанализированы согласно описанию (Bolotin D.A., et al., 2012 Eur J Immunol. 42(11), 3073-83).
Чтобы свести к минимуму шум от случайных событий, таких как выход из-под ПЦР-блокировки, перекрывание-удлинение недостроенных продуктов ПЦР в процессе амплификации библиотеки, и амплификации между группами клонов на чипе ("cross-bridge" амплификация на уровне секвенирования Illumina), мы отбросили пары с незначительным количеством прочтений последовательности (менее 0,05% от общего числа прочтений в каждой выборке). В целом после такой обработки осталось 664 пары.
Дальнейший анализ показал, что в эмульсионной реакции было выборочно увеличено некоторое количество пар CDR3 за счет специфичного спаривания, в отличие от контрольной реакции, где встречаемость пар почти равнялась ожидаемому количеству случайных спариваний в соответствии с частотой встречаемости.
Альфа-бета пары ТКР CDR3, которыми были наиболее значительно и селективно обогащена каждая эмульсионная реакция, были идентифицированы на основании количества их прочтений.
425 (64%) из наблюдаемых пар были значительно (p-значение менее 0,01) и селективно амплифицированы в эмульсии по сравнению с контрольной реакцией и были получены для последующего анализа.
Для того чтобы исключить случайные события, которые могут произойти в результате попадания во время эмульгирования в одну каплю двух различных Т-клеток или, в редких случаях, в результате слияния капель, содержащих клетки, мы считали достоверными только пары, идентифицированные, по крайней мере, в двух различных эмульсиях. Этот строгий критерий отсеял наивные Т-клетки и мало представленные клоны Т-клеток и, следовательно, большинство выявленных пар (большей частью, вероятно, правильных) были потеряны на данном этапе. Тем не менее, мы считаем этот отсев необходимым для получения однозначной информации, так как он обеспечивает независимое подтверждение для каждой идентифицированной пары.
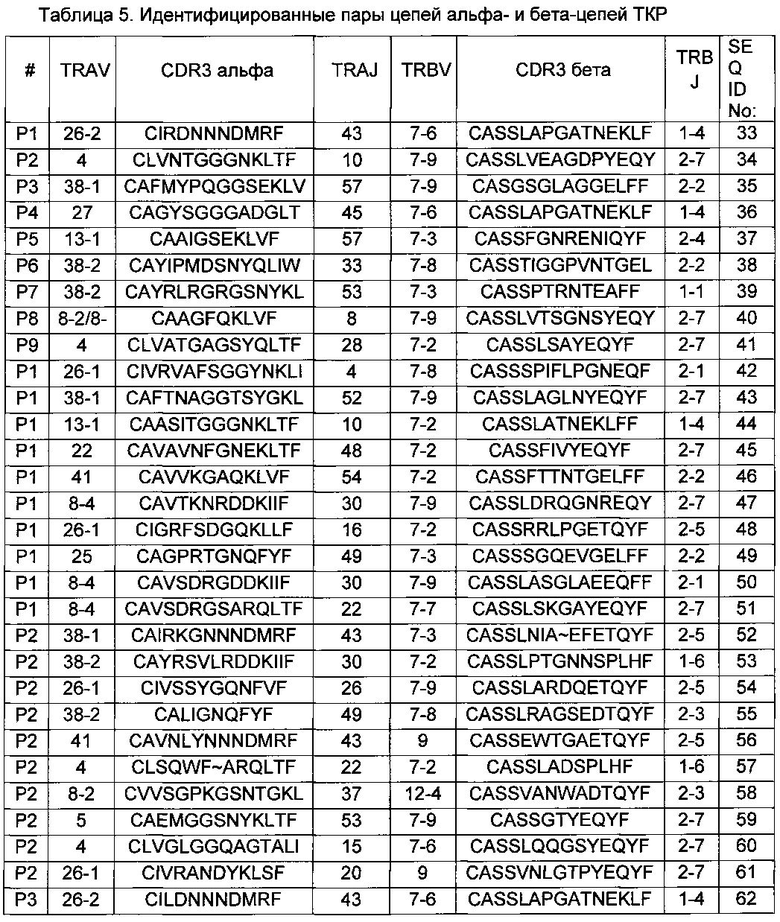
В результате всем критериям соответствовали 30 альфа/бета пар ТКР (Фиг. 6, Табл. 5).
Подтверждение верности идентифицированных пар с использованием сортировки антиген-специфичных клеток и секвенирования полученных библиотек альфа- и бета-цепей генов ТКР.
Для подтверждения правильности спаривания цепей ТКР, мы отсортировали субпопуляцию клонов CD8+ Т-клеток того же пациента, специфичных к NLV-пептиду цитомегаловируса, с помощью метода проточной сортировки клеток. С этой целью МКПК выделяли из образцов периферической крови с помощью центрифугирования в градиенте плотности фиколл-урографин (Paneco), инкубировали с CD8-специфичными антителами (клон ЕТК 182,20, Abcam), CD4-специфичными антителами (клон S3.5, Invitrogen), и мультимером HLA-A*02-CMV (NLV) pelimer (Sanquin) в течение 20 мин при комнатной температуре, дважды промывали PBS и сортировавали на клеточном сортере MoFlo (DakoCytomation). Было отсортировано более 100,000 клеток с 97% чистотой (Фиг. 7).
РНК экстрагировали с использованием реагента TRIZOL (Invitrogen). Библиотеки альфа- и бета-цепей ТКР получали с использованием технологии смены матрицы, согласно описанию (Mamedov I.Z., et al., 2011, EMBO Mol Med, 3, 201-207). Библиотеки генов альфа- и бета-цепей были проанализированы с помощью секвенирования Illumina MiSeq со спаренными концами с единовременным прочтением фрагментов размером до 150 нуклеотидов. Для каждой из двух библиотек было получено и проанализировано более 20,000 CDR3-содержащих последовательностей.
Глубокое профилирование показало основные альфа- и бета-цепи ТКР CDR3 специфичные к HLA-A*02-CMV (NLV), а также предоставило статистику о вероятности спаривания на основе частоты встречаемости (Reddy S.T., et al., 2010, Nat Biotechnol, 28, 965-969). Вариант CDR3 бета CASSLAPGATNEKLFF-1 составил примерно 90% всех NLV-специфичных бета-цепей ТКР, что примерно равно общему количеству вариантов альфа-цепей ТКР CDR3 CIRDNNNDMRF и CAGYSGGGADGLTF.
Таким образом, анализ сортированных клеток установил 2 пары цепей ТКР, специфичных к HLA-A*02-CMV (NLV): пара CDR3-альфа CIRDNNNDMRF/CDR3-бета CASSLAPGATNEKLFF, подтвержденной существованием практически идентичного NLV-специфичного Т-клеточного клона, идентифицированного в независимом исследовании (Trautmann L., et al., 2005, J Immunol, 175, 6123-6132), а также пара CDR3-альфа CAGYSGGGADGLTF/CDR3-бета CASSLAPGATNEKLFF. Алгоритм созревания Т-клеток подразумевает, что одна и та же бета-цепь ТКР может быть сопряжена с несколькими альфа-цепями ТКР альфа, в результате чего образуется несколько Т-клеточных клонов с похожей специфичностью (Arstila Т.Р., et al., 2000, Science, 288, 1135). Соответственно, наличие двух Т-клеточных клонов с одинаковыми бета-цепями ТКР не было неожиданностью.
Обе пары, идентифицированные по данным секвенирования библиотек, полученных для сортированных Т-клеток, были также успешно идентифицированы методом эмульсионной ОТ-ПЦР (пары P1 и P4, Фиг 6, Табл. 5). Таким образом, эмульсионный подход позволяет однозначно идентифицировать функциональные пары альфа- и бета-цепей ТКР, по крайней мере, для относительно крупных клонов Т-клеток.
Принимая во внимание, что с помощью нашего набора праймеров был проанализирован относительно узкий пул фрагментов генов семейства TRBV7, этот результат можно экстраполировать на сотни функциональных пар цепей ТКР, которые могут быть однозначно определены для данного образца крови с использованием того же метода, но различных наборов праймеров. Кроме того, глубина указанного анализа может быть увеличена за счет большего числа и объема эмульсионных реакций, а следовательно, большего числа, независимо выявленных в двух реакциях.


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИДЕНТИФИКАЦИИ НАТИВНЫХ ПАР ФРАГМЕНТОВ ДНК ИЛИ РНК, ПРИСУТСТВУЮЩИХ В ОДНИХ И ТЕХ ЖЕ ЖИВЫХ КЛЕТКАХ | 2013 |
|
RU2578009C2 |
| КОНЪЮГАТЫ АФФИННАЯ ЧАСТЬ-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2778754C2 |
| КОНЪЮГАТЫ АФФИННАЯ МОЛЕКУЛА-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2763554C2 |
| СЕКВЕНИРОВАНИЕ ПОЛИНУКЛЕОТИДНЫХ БИБЛИОТЕК С ВЫСОКОЙ ПРОПУСКНОЙ СПОСОБНОСТЬЮ И АНАЛИЗ ТРАНСКРИПТОМОВ | 2018 |
|
RU2790291C2 |
| Способ амплификации нуклеиновых кислот тяжелой и легкой цепи человеческих иммуноглобулинов для создания рекомбинантных антител, композиции праймеров (варианты) | 2020 |
|
RU2775914C2 |
| ГЕН MTS, МУТАЦИИ ДАННОГО ГЕНА И СПОСОБЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА MTS | 1995 |
|
RU2164419C2 |
| МУТАЦИИ ГЕНА МТS В ЗАРОДЫШЕВОЙ ЛИНИИ И СПОСОБ ВЫЯВЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ К ЗЛОКАЧЕСТВЕННЫМ ОПУХОЛЯМ В ГЕНЕ МТS | 1995 |
|
RU2161309C2 |
| МУТАГЕНЕЗ ДНК ЗА СЧЕТ НЕУПОРЯДОЧЕННОЙ ФРАГМЕНТАЦИИ И ВТОРИЧНОЙ СБОРКИ | 1995 |
|
RU2157851C2 |
| ВЫДЕЛЕНИЕ И ИДЕНТИФИКАЦИЯ Т-КЛЕТОК | 2003 |
|
RU2327487C2 |
| СПОСОБЫ ДИСКРЕТНОЙ АМПЛИФИКАЦИИ ПОЛНОГО ГЕНОМА | 2016 |
|
RU2736351C2 |






Изобретение относится к области биотехнологии. В изобретении описан способ идентификации пар фрагментов ДНК или РНК, исходно присутствующих в одних и тех же живых или фиксированных клетках, в частности, способ идентификации нативных пар генов легких и тяжелых цепей антител, а также нативных пар генов альфа- и бета-цепей Т-клеточных рецепторов (ТКР). Метод основан на эмульсионной ПЦР либо ОТ-ПЦР, проводимой с живых или фиксированных клеток, в ходе которой происходит ПЦР-амплификация пар фрагментов ДНК либо РНК, с последующим физическим спариванием продуктов ПЦР-амплификации. Все перечисленные реакции осуществляются в пределах эмульсии с разделенными клетками, каждая из которых находится в отдельной эмульсионной капле. Отличительной чертой метода является новый тип ПЦР-блокировки, который позволяет, после проведения эмульсионных реакций, селективно амплифицировать библиотеку спаренных в эмульсии фрагментов генов. Селективное подавление участия в ПЦР неспаренных фрагментов позволяет преимущественно амплифицировать целевые пары фрагментов, ранее успешно спаренные в пределах капель в эмульсии, по сравнению с амплификацией пар фрагментов, способных к нецелевому спариванию уже после выделения смеси нуклеиновых кислот из эмульсии. 8 з.п. ф-лы, 7 ил., 5 табл., 1 пр.
1. Способ идентификации пар фрагментов нуклеиновых кислот, присутствующих в одних и тех же клетках, включающий:
(1) амплификацию и физическое спаривание целевых фрагментов А и Б, проводимое в эмульсии;
(2) внеэмульсионную ПЦР-амплификацию спаренных целевых фрагментов в присутствии олигонуклеотидов, блокирующих спаривание фрагментов, ранее не спаренных в одной капле в эмульсии на стадии (1).
2. Способ по п. 1, также включающий стадию (3) секвенирования полученных ПЦР-ампликонов.
3. Способ по п. 1, где нуклеиновые кислоты - это молекулы ДНК.
4. Способ по п. 2, где нуклеиновые кислоты - это молекулы РНК.
5. Способ по п. 1, где физическое спаривание в эмульсии проводят с помощью технологии перекрывания-удлинения.
6. Способ по п. 4, где пары фрагментов РНК представляют собой нативные пары фрагментов мРНК альфа- и бета-цепей Т-клеточных рецепторов.
7. Способ по п. 4, где пары фрагментов РНК представляют собой нативные пары фрагментов мРНК тяжелых и легких цепей антител.
8. Способ по п. 3, где пары фрагментов ДНК представляют собой нативные пары фрагментов ДНК альфа- и бета-цепей Т-клеточных рецепторов.
9. Способ по п. 3, где пары фрагментов ДНК представляют собой нативные пары фрагментов ДНК тяжелых и легких цепей антител.
| Brandon J DeKosky et al., High-throughput sequencing of the paired human immunoglobulin heavy and light chain repertoire, Nat Biotechnol | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Published in final edited form as: Nat Biotechnol | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| СПОСОБ ОБНАРУЖЕНИЯ ЦЕЛЕВОЙ НУКЛЕИНОВОЙ КИСЛОТЫ, НАБОР (ВАРИАНТЫ), ДНК ДУПЛЕКС И КОМПОЗИЦИЯ ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА | 1994 |
|
RU2158765C2 |
| US 5210015 A 11.05.1993. | |||
Авторы
Даты
2016-10-27—Публикация
2015-06-24—Подача