Родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/324602, поданной 15 апреля 2010 г., которая включена в настоящее описание изобретения в качестве ссылки в полном объеме.
Ссылка на список последовательностей, предоставленный в виде текстового файла по EFS-WEB
Список последовательностей предоставлен одновременно с описанием изобретения в виде текстового файла в формате ASCII по EFS-WEB под именем ”P4410R1_Sequence_Listing.TXT”, дата создания 13 апреля 2011 г., размер 39,9 килобайт. Список последовательностей, поданный по EFS-WEB, является частью описания изобретения и включен в настоящее описание изобретения в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам против полиубиквитина и, в частности, к антителам против полиубиквитина, которые специфически не связываются с моноубиквитином и являются специфичными к определенным формам лизиновых связей полиубиквитина, и к способам применения указанных антител.
Уровень техники
Убиквитин представляет собой мелкий белок, который является важным регулятором целого ряда сигнальных путей клетки. Установлено, что убиквитиновые цепи, связанные лизином в положении 11 (К11), являются важными регуляторами деления клеток (Jin et al., 2008; Kirkpatrick et al., 2006) и участвуют в деградации передачи сигнала убиквитин-лигазных субстратов анафазастимулирующего комплекса (АРС/С), важной стадии деления эукариотических клеток (Jin et al., 2008; Williamson et al., 2009). АРС/C рекрутирует два фермента Е2: UbcH10, инициирующий образование убиквитиновой цепи, и Ube2S, удлиняющий убиквитиновую цепь, которые собирают К11-связанные цепи с высокой специфичностью (Garnett et al., 2009; Williamson et al., 2009; Wu et al., 2010). Утрата указанного АРС/С-специфичного модуля Е2 вызывает нарушение митоза (Williamson et al., 2009; Song and Rape, Molecular Cell in press). Хотя полученные результаты позволяют предположить, что К11-связанные цепи вызывают разрушение белка протеасомой в процессе митоза, исследование убиквитиновых цепей, собранных АРС/С, UbcH10 и Ube2S, основано главным образом на экспериментах, выполненных in vitro. Прямое исследование К11-связанных полиубиквитиновых цепей, регулирующих разрушение белка в клетках, было невозможно из-за отсутствия инструментальных средств, позволяющих обнаруживать такие цепи.
Сущность изобретения
Настоящее изобретение относится к антителам против К11-связанного полиубиквитина и способам их применения. Один вариант осуществления изобретения относится к выделенному антителу, которое специфически связывается с первым полиубиквитином, содержащим связь, образованную лизином К11, при этом антитело специфически не связывается со вторым полиубиквитином, содержащим связь, образованную вторым лизином, которая отличается от связи, образованной лизином К11. Другой вариант осуществления изобретения относится к выделенному антителу, которое специфически связывается с первым полиубиквитином, содержащим связь, образованную лизином К11, и со вторым полиубиквитином, содержащим связь, образованную вторым лизином, которая отличается от связи, образованной лизином К11, при этом антитело специфически не связывается с моноубиквитином и связывается со вторым полиубиквитином с гораздо меньшим сродством связывания по сравнению со сродством связывания к первому полиубиквитину.
Другой вариант осуществления изобретения относится к выделенному антителу, которое специфически связывается с полиубиквитином, связанным лизином-11, при этом указанное антитело специфически не связывается с моноубиквитином. В одном из аспектов настоящего изобретения антитело содержит по меньшей мере одну последовательность гипервариабельного участка (HVR), выбираемую, соответственно, из любых последовательностей HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3 SEQ ID NO:2 и 57-60; SEQ ID NO:3 и 61; SEQ ID NO:4; SEQ ID NO:6-11; SEQ ID NO:12-17 и 67 и SEQ ID NO:18-23, 68 и 69. В другом аспекте антитело содержит по меньшей мере одну последовательность, выбираемую из HVR-H1, HVR-H2 и HVR-H3, из которых HVR-H1 содержит аминокислотную последовательность Х1 Х2 Х3 Х4 Ile X5 (SEQ ID NO:24), где аминокислоту Х1 выбирают из серина и треонина, аминокислоту Х2 выбирают из аспарагина, аспарагиновой кислоты, серина и глицина, аминокислоту Х3 выбирают из тирозина, серина и треонина, аминокислоту Х4 выбирают из триптофана, аспарагиновой кислоты, глицина и тирозина и аминокислоту Х5 выбирают из серина и гистидина; HVR-H2 содержит аминокислотную последовательность Х6 Х7 Ile X8 Pro X9 Gly X10 Thr X11 (SEQ ID NO:25), где аминокислоту Х6 выбирают из глицина и аланина, аминокислоту Х7 выбирают из аспарагиновой кислоты, триптофана, глицина, глутаминовой кислоты и валина, аминокислоту Х8 выбирают из серина, тирозина и аспарагина, аминокислоту Х9 выбирают из аспарагиновой кислоты, аланина, гистидина и аспарагина, аминокислоту Х10 выбирают из тирозина и серина и аминокислоту Х11 выбирают из тирозина, аспарагиновой кислоты и аспарагина; и HVR-H3 содержит аминокислотную последовательность Х12 Х13 X14 Х15 Х16 Х17 Х18 Х19 Х20 Х21 Asp (SEQ ID NO:26), где аминокислоту Х12 выбирают из аргинина и лизина, аминокислоту Х13 выбирают из глутаминовой кислоты, глицина, аспарагиновой кислоты и пролина, аминокислоту Х14 выбирают из серина, изолейцина, валина и триптофана, аминокислоту Х15 выбирают из триптофана, глицина, тирозина и фенилаланина, аминокислоту Х16 выбирают из триптофана, тирозина, лейцина, глицина и фенилаланина, аминокислоту Х17 выбирают из серина, тирозина, фенилаланина и глицина, аминокислоту Х18 выбирают из аланина, фенилаланина, тирозина и глицина или данная аминокислота отсутствует, аминокислоту Х19 выбирают из триптофана, глицина, аланина и тирозина или данная аминокислота отсутствует, аминокислота Х20 является валином или отсутствует и аминокислоту Х21 выбирают из метионина и фенилаланина.
В другом аспекте настоящего изобретения антитело содержит по меньшей мере одну последовательность, выбираемую из HVR-L1, HVR-L2, из которых HVR-L1 содержит аминокислотную последовательность Х22 Х23 Ser X24 X25 X26 X27 X28 X29 X30 X31 (SEQ ID NO:73), где аминокислоту Х22 выбирают из аргинина и глицина, аминокислоту Х23 выбирают из аланина и валина, аминокислоту Х24 выбирают из глутамина и гистидина, аминокислоту Х25 выбирают из аспарагиновой кислоты, аспарагина и изолейцина, аминокислоту Х26 выбирают из лейцина и валина, аминокислоту Х27 выбирают из серина, аспарагиновой кислоты, глицина и глутаминовой кислоты, аминокислоту Х28 выбирают из треонина и серина, аминокислоту Х29 выбирают из аланина, валина и фенилаланина, аминокислоту Х30 выбирают из валина и изолейцина и аминокислоту Х31 выбирают из аланина и серина; и HVR-L2 содержит аминокислотную последовательность X32 X33 X34 Phe X35 Tyr Ser (SEQ ID NO:74), где аминокислоту Х32 выбирают из серина и аспарагина, аминокислоту Х33 выбирают из глутамина и аланина, аминокислоту Х34 выбирают из глутаминовой кислоты и серина и аминокислоту Х35 выбирают из лейцина и валина. Другим аспектом настоящего изобретения является антитело, содержащее по меньшей мере одну последовательность, выбираемую из HVR-H2 и HVR-H3, из которых HVR-H2 содержит аминокислотную последовательность X36 Ile Asn Pro X37 Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val Lys Gly (SEQ ID NO:75), где аминокислоту Х36 выбирают из аланина и глицина и аминокислоту Х37 выбирают из аланина и аспарагина; и HVR-H3 содержит аминокислотную последовательность Glu Trp Tyr X38 X39 Gly Tyr Val Met Asp Tyr (SEQ ID NO:76), где аминокислоту Х38 выбирают из фенилаланина и тирозина и аминокислоту Х39 выбирают из глицина и аспарагиновой кислоты.
В другом аспекте настоящего изобретения антитело содержит, соответственно, последовательность HVR-L1 SEQ ID NO:2, последовательность HVR-L2 SEQ ID NO:3 и последовательность HVR-L3 SEQ ID NO:4. В другом аспекте настоящее изобретение относится к антителу, содержащему последовательности HVR-H1, HVR-H2 и HVR-H3, соответствующие последовательностям, представленным для клонов А3, А6, А9, В5, F5 и G3 на фигуре 1В. В другом аспекте настоящего изобретения антитело содержит последовательности HVR-L1, HVR-L2 и HVR-L3, соответствующие последовательностям, представленным для клонов 1А11, 1С12, 1F12, 2A3, 2A6, 2D7, 2E6 или 2G4 на фигуре 4А. В другом аспекте настоящего изобретения антитело содержит последовательности HVR-H1, HVR-H2 и HVR-H3, соответствующие последовательностям, представленным для клонов 1А11, 1С12, 1F12, 2A3, 2A6, 2E6 или 2G4 на фигуре 4В.
В другом аспекте настоящее изобретение относится к антителу, содержащему последовательность HVR-L1 SEQ ID NO:2, последовательность HVR-L2 SEQ ID NO:3, последовательность HVR-L3 SEQ ID NO:4, последовательность HVR-H1 SEQ ID NO:11, последовательность HVR-H2 SEQ ID NO:17 и последовательность HVR-H3 SEQ ID NO:23. В другом аспекте настоящее изобретение относится к антителу, содержащему последовательность HVR-L1 SEQ ID NO:58, последовательность HVR-L2 SEQ ID NO:3, последовательность HVR-L3 SEQ ID NO:4, последовательность HVR-H1 SEQ ID NO:11, последовательность HVR-H2 SEQ ID NO:17 и последовательность HVR-H3 SEQ ID NO:23. В другом аспекте настоящее изобретение относится к антителу, содержащему последовательность HVR-L1 SEQ ID NO:59, последовательность HVR-L2 SEQ ID NO:3, последовательность HVR-L3 SEQ ID NO:4, последовательность HVR-H1 SEQ ID NO:11, последовательность HVR-H2 SEQ ID NO:17 и последовательность HVR-H3 SEQ ID NO:23. В другом аспекте настоящее изобретение относится к антителу, содержащему последовательность HVR-L1 SEQ ID NO:2, последовательность HVR-L2 SEQ ID NO:3, последовательность HVR-L3 SEQ ID NO:4, последовательность HVR-H1 SEQ ID NO:11, последовательность HVR-H2 SEQ ID NO:67 и последовательность HVR-H3 SEQ ID NO:23. В другом аспекте настоящее изобретение относится к антителу, содержащему последовательность HVR-L1 SEQ ID NO:58, последовательность HVR-L2 SEQ ID NO:3, последовательность HVR-L3 SEQ ID NO:4, последовательность HVR-H1 SEQ ID NO:11, последовательность HVR-H2 SEQ ID NO:67 и последовательность HVR-H3 SEQ ID NO:23. В другом аспекте настоящее изобретение относится к антителу, содержащему последовательность HVR-L1 SEQ ID NO:59, последовательность HVR-L2 SEQ ID NO:3, последовательность HVR-L3 SEQ ID NO:4, последовательность HVR-H1 SEQ ID NO:11, последовательность HVR-H2 SEQ ID NO:67 и последовательность HVR-L3 SEQ ID NO:23.
В другом аспекте настоящее изобретение относится к антителу, содержащему аминокислотную последовательность легкой цепи, выбираемую из SEQ ID NO:5 и 62-66. В другом аспекте настоящее изобретение относится к антителу, содержащему аминокислотную последовательность тяжелой цепи, выбираемую из SEQ ID NO:27-32 и 70-72.
В другом аспекте настоящее изобретение относится к антителу, содержащему аминокислотные последовательности легкой цепи и тяжелой цепи, которые по меньшей мере на 95% идентичны аминокислотным последовательностям одной из нижеследующих комбинаций последовательностей: SEQ ID NO:5 и 32; SEQ ID NO:63 и 32; SEQ ID NO:65 и 32; SEQ ID NO:5 и 72; SEQ ID NO:63 и 72; SEQ ID NO:65 и 72.
Другой вариант осуществления изобретения относится к выделенному антителу, которое связывается с той же антигенной детерминантой К-11 связанного полиубиквитина, что и любое из вышеуказанных антител, при этом данное антитело специфически не связывается с моноубиквитином. Другой вариант осуществления изобретения относится к выделенному антителу, конкурирующему с любым из вышеуказанных антител за связывание с полиубиквитином, при этом данное антитело специфически не связывается с моноубиквитином. Другой вариант осуществления изобретения относится к любому из вышеуказанных выделенных антител, которое специфически связывается с К11-связанным полиубиквитинированным белком. Другой вариант осуществления изобретения относится к любому из вышеуказанных выделенных антител, которое модулирует по меньшей мере один сигнальный путь, опосредуемый полиубиквитином.
Одним общим аспектом настоящего изобретения является любое из вышеуказанных антител, которое представляет собой моноклональное антитело. Другим общим аспектом настоящего изобретения является любое из вышеуказанных антител, которое представляет собой антитело человека. Другим общим аспектом настоящего изобретения является любое из вышеуказанных антител, которое представляет собой гуманизированное антитело. Другим общим аспектом настоящего изобретения является любое из вышеуказанных антител, которое представляет собой химерное антитело. Другим общим аспектом настоящего изобретения является любое из вышеуказанных антител, которое представляет собой фрагмент антитела, связывающийся с К11-связанным полиубиквитином.
Другой вариант осуществления изобретения относится к выделенной нуклеиновой кислоте, кодирующей любое из вышеуказанных антител. Другой вариант осуществления изобретения относится к вектору, содержащему выделенную нуклеиновую кислоту, кодирующую любое из вышеуказанных антител. Другой вариант осуществления изобретения относится к клетке-хозяину, содержащей выделенную нуклеиновую кислоту, кодирующую любое из вышеуказанных антител. Другой вариант осуществления изобретения относится к клетке-хозяину, содержащей вектор, содержащий выделенную нуклеиновую кислоту, кодирующую любое из вышеуказанных антител.
Другой вариант осуществления изобретения относится к способу получения любого из вышеуказанных антител, который включает культивирование вышеуказанной клетки-хозяина в условиях, обеспечивающих продуцирование антитела. Одним из аспектов настоящего изобретения является способ, который далее включает выделение антитела из клетки-хозяина. Другим объектом настоящего изобретения является способ, который далее включает очистку антитела.
Другой вариант осуществления изобретения относится к иммуноконъюгату, содержащему любое из вышеуказанных антител и цитотоксический агент. Другой вариант осуществления изобретения относится к фармацевтическому препарату, содержащему любое из вышеуказанных антител и фармацевтически приемлемый носитель. Одним из аспектов настоящего изобретения является фармацевтический препарат, который далее содержит дополнительное терапевтическое средство. Одним из аспектов настоящего изобретения является дополнительное терапевтическое средство, которое представляет собой химиотерапевтическое средство.
Другой вариант осуществления изобретения относится к любому из вышеуказанных антител, предназначенному для применения в качестве лекарственного средства. Другой вариант осуществления изобретения относится к любому из вышеуказанных антител, предназначенному для применения при лечении заболевания или нарушения, относящегося к клеточному циклу. Одним объектом настоящего изобретения является заболевание или нарушение, относящееся к клеточному циклу, выбираемое из заболевания или нарушения, связанного с аберрантно быстрым развитием клеточного цикла, и заболевания или нарушения, связанного с аберрантно медленным развитием клеточного цикла. Одним объектом настоящего изобретения является заболевание или нарушение, связанное с аберрантно быстрым развитием клеточного цикла, представляющее собой рак. Другим объектом настоящего изобретения является заболевание или нарушение, связанное с аберрантно медленным развитием клеточного цикла, выбираемое из дегенеративного мышечного нарушения или дегенеративного нервного нарушения.
Другой вариант осуществления изобретения относится к применению любого из вышеуказанных антител для приготовления лекарственного средства. Одним из аспектов настоящего изобретения является лекарственное средство, предназначенное для лечения заболевания или нарушения, выбираемого из рака, дегенеративного мышечного нарушения и дегенеративного нервного нарушения. Другой вариант осуществления изобретения относится к способу лечения индивида, страдающего заболеванием или нарушением, выбираемым из рака, дегенеративного мышечного нарушения и дегенеративного нервного нарушения, который включает введение указанному индивиду эффективного количества любого из вышеуказанных антител.
Другой вариант осуществления изобретения относится к способу определения присутствия полиубиквитина или полиубиквитинированного белка в образце, в котором предполагается наличие полиубиквитина или полиубиквитинированного белка, который включает обработку указанного образца по меньшей мере одним из вышеуказанных антител и определение связывания по меньшей мере одного антитела с полиубиквитином или полиубиквитинированным белком в образце. Другой вариант осуществления изобретения относится к способу отделения К11-связанного полиубиквитинированного белка от К11-несвязанного полиубиквитированного белка в образце, который включает приведение в контакт образца по меньшей мере с одним из вышеуказанных антител. Другой вариант осуществления изобретения относится к способу определения функции и/или активности К11-связанного полиубиквитина в клетке или образце, который включает приведение в контакт клетки или образца по меньшей мере с одним из вышеуказанных антител и оценку эффекта, производимого указанным контактированием на клетку или образец.
Краткое описание чертежей
На фигурах 1А и 1В показаны аминокислотные последовательности легкой и тяжелой цепей Fab-фрагментов, полученных в примере 1. На фигуре 1А показана последовательность легкой цепи клонов, выделенных из непроцессированной библиотеки VH. Благодаря структуре библиотеки последовательности легких цепей были идентичны для всех полученных клонов. На фигуре 1В показан сравнительный анализ последовательностей тяжелых цепей клонов, выделенных из непроцессированной библиотеки VH. Для каждого клона указано число сиблинговых клонов, идентифицированных в результате третьего и четвертого циклов сортировки. На фигурах 1А и 1В последовательности HVR каждого клона указаны в рамках, при этом в первой рамке представлена последовательность HVR-L1 (фигура 1А) или HVR-H1 (фигура 1В), во второй рамке представлена последовательность HVR-L2 (фигура 1А) или HVR-H2 (фигура 1В) и в третьей рамке представлена последовательность HVR-L3 (фигура 1А) или HVR-Н3 (фигура 1В).
На фигуре 2 показан анализ ELISA фаговых пятен, демонстрирующий относительные сигналы связывания с панелью убиквитиновых белков при длине волны 450 нм для каждого полученного клона по примеру 1. Клоны библиотеки Fab-фрагментов содержали gD метку, и отображение Fab-фрагментов на фаге оценивали путем связывания с антителом против gD. Несенсибилизированные лунки были использованы в качестве отрицательного контрольного образца.
На фигурах 3А-3С показаны свойства связывания очищенного Fab-фрагмента G3, рассмотренного в примере 1. На фигуре 3А показаны результаты экспериментов по оценке способности очищенного Fab-фрагмента G3 в разных концентрациях связываться с панелью убиквитиновых белков при выполнении анализа ELISA. На фигуре 3В показаны результаты IC50 конкурентного анализа ELISA по измерению сродства очищенного Fab-фрагмента G3 к К11-связанному диубиквитину. На фигуре 3С показаны результаты анализа методом вестерн-блоттинга по определению способности Fab-фрагмента G3 специфически распознавать панель убиквитиновых белков в иммобилизированном виде. Гель, окрашенный кумассии, демонстрирует подвижность каждого образца.
На фигурах 4А и 4В показаны аминокислотные последовательности легких и тяжелых цепей клонов с созревшей аффинностью, полученных в примере 2. На фигуре 4 показаны последовательности легких цепей клонов с созревшей аффинностью. На фигуре 4В показан сравнительный анализ последовательностей тяжелых цепей клонов с созревшей аффинностью. Для каждого клона указано число сиблинговых клонов, идентифицированных в результате выполнения четвертого цикла сортировки. На фигурах 4А и 4В последовательности HVR для каждого клона указаны в рамках, при этом в первой рамке представлена последовательность HVR-L1 (фигура 4А) или HVR-H1 (фигура 4В), во второй рамке представлена последовательность HVR-L2 (фигура 4А) или HVR-H2 (фигура 4В) и в третьей рамке представлена последовательность HVR-L3 (фигура 4А) или HVR-H3 (фигура 4В). Замены аминокислот по сравнению с исходной последовательностью G3 выделены серым цветом.
На фигурах 5А-5В показаны результаты анализов ELISA, выполненных для оценки связывания родительского клона G3 и восьми вариантов с созревшей аффинностью, отображенных на фаге для связывания с панелью убиквитиновых белков, рассмотренных в примере 2Е.
На фигурах 6А и 6В показаны аминокислотные последовательности легких и тяжелых цепей гибридных клонов, полученных в примере 2. На фигуре 6А показаны последовательности легких цепей гибридных клонов. На фигуре 6В показан сравнительный анализ последовательностей тяжелых цепей гибридных клонов. На фигурах 6А и 6В последовательности HVR для каждого клона указаны в рамках, при этом в первой рамке представлена последовательность HVR-L1 (фигура 6А) или HVR-H1 (фигура 6В), во второй рамке представлена последовательность HVR-L2 (фигура 6А) или HVR-H2 (фигура 6В) и в третьей рамке представлена последовательность HVR-L3 (фигура 6А) или HVR-H3 (фигура 6В). Замены аминокислот по сравнению с исходной последовательностью G3 выделены серым цветом.
На фигурах 7А-7D показаны результаты исследований по оценке характеристик связывания гибридных IgG по сравнению с родительским клоном G3 и контрольными образцами, рассмотренные в примере 3. На фигуре 7А представлены результаты анализа ELISA, показывающие связывание IgG клонов G3, 1C12/2E6 и 2A3/2E6 в 4 М мочевины с панелью убиквитиновых белков. На фигуре 7В показаны результаты анализов методом вестерн-блоттинга связывания IgG клонов G3, 1C12/2E6 и 2A3/2E6 с двукратными серийными разведениями К11-связанного диубиквитина (1000, 500, 250, 125, 63, 31 и 16 нг/полосу с указанием градиента) или моноубиквитина, линейного диубиквитина, К48-связанного диубиквитина и К63-связанного диубиквитина (1 мкг/полосу). Гель, окрашенный кумассии, (верхний левый блок) показывает, где каждый из исследованных убиквитинов мигрирует в гели. На фигуре 7С показаны результаты экспериментов, в которых моноубиквитин, К48-связанный полиубиквитин 2-7 (длиной от двух до семи субъединиц убиквитина), К63-связанный полиубиквитин 2-7 (длиной от двух до семи субъединиц убиквитина) и К11-связанный полиубиквитин (1 мкг/полосу) исследовали методом иммуноблоттинга с использованием пан-убиквитинового антитела P4D1 (средний блок) или IgG 2A3/2E6 (правый блок). Окрашивание кумассии позволило выявить состав образцов (левый блок). На фигуре 7D показаны результаты экспериментов, в которых К11-связанный диубиквитин (50 нг/полосу), К48-связанный диубиквитин (1 мкг/полосу), К63-связанный диубиквитин (1 мкг/полосу), лизат цельных клеток, полученный из клеток 293Т человека, (100 мкг/полосу) и S. cerevisiae исследовали методом иммуноблоттинга с использованием IgG 2A3/2E6 (правый блок). Окрашивание кумассии позволило выявить состав образцов (левый блок).
На фигурах 8А-8Е показаны результаты экспериментов по исследованию способности гибридного антитела 2А3/2Е6 специфически распознавать и/или вызывать иммунопреципитацию К11-связанных полиубиквитинированных белков в результате выполнения реакций убиквитинирования in vitro. На фигуре 8А показаны результаты анализа методом вестерн-блоттинга, выполненного с использованием пан-убиквитинового антитела P4D1 после автоубиквитинирования MuRF1. Добавление ферментов Е1 (Ube1), E2 (UbcH5c) и Е3 (MuRF1) привело к превращению моноубиквитина в полиубиквитиновые цепи на MuRF1 (MuRF1-Ub(n)). На фигуре 8В показаны результаты анализа методом иммунопреципитации, в котором продукт, полученный в результате выполнения анализа автоубиквитинирования MuRF1 с убиквитином дикого типа, использовали в качестве субстрата для иммунопреципитации при помощи IgG 2A3/2E6 в присутствии мочевины в разных концентрациях. Исходную реакционную смесь и вещество, осажденное методом иммунопреципитации, обнаруживали при помощи вестерн-блоттинга с использованием пан-убиквитинового антитела (P4D1). На фигуре 8С показаны результаты эксперимента, выполненного методом иммуноблоттинга аналогично эксперименту, показанному на фигуре 8В, за исключением того, что вместо убиквитина дикого типа был использован K11R убиквитин. На фигуре 8D показаны результаты вестерн-блоттинга, выполненного после реакций автоубиквитинирования MuRF1 in vitro с использованием убиквитина дикого типа, K11R, K48R и K63R убиквитина, которые были осаждены методом иммунопреципитации антителом 2A3/2E6 (К11) или изотипически сходным контрольным антителом и подвергнуты анализу методом вестерн-блоттинга. Числа в скобках указывают соответствующие полосы в геле и столбцы на (Е). Продукты реакций автоубиквитинирования (исходные смеси в полосах 1, 4, 7 и 10) и иммунопреципитации (полосы 2, 3, 5, 6, 8, 9, 11 и 12) анализировали методом иммуноблоттинга с использованием пан-убиквитинового антитела. Белыми линиями обозначена область геля, окрашенного кумасси, которая была вырезана для масс-спектрометрического анализа AQUA, контролируемого вестерн-блоттингом. На фигуре 8Е представлены результаты масс-спектрометрических анализов AQUA областей геля, показанных на фигуре 8D. Указано число К11, К48 и К63 связей, измеренных в каждом образце. Во всех случаях было обнаружено пренебрежимо малое число убиквитиновых связей в продуктах иммунопреципитации при использовании изотипически сходного контрольного антитела.
На фигурах 9А-9D показаны результаты экспериментов по исследованию способности гибридного антитела 2А3/2Е6 специфически распознавать и/или вызывать иммунопреципитацию К11-связанных полиубиквитинированных белков из клеточных лизатов. На фигуре 9А показана схема эксперимента и представлены результаты иммунопреципитации, полученные методом вестерн-блоттинга с использованием клеточных лизатов из клеток НЕК293Т, псевдотрансфицированных клеток или клеток, содержащих плазмиду, сверхэкспрессирующую убиквитин дикого типа или К0 убиквитин, которые были осаждены методом иммунопреципитации антителом 2А3/2Е6 (К11) или изотипически сходным контрольным антителом. Числа в скобках указывают соответствующие полосы в геле и столбцы на фигуре 9В. Лизаты цельных клеток (исходные смеси, полосы 1, 4 и 7) и продукты иммунопреципитации (полосы 2, 3, 5, 6, 8 и 9) исследовали методом иммуноблоттинга с использованием пан-убиквитинового антитела. Белыми линиями обозначены области геля, окрашенного кумассии, которые были вырезаны для масс-спектрометрического анализа AQUA, контролируемого вестерн-блоттингом. На фигуре 9В показаны окрашенные кумассии гели для вестерн-блоттинга, аналогичные изображенным на фигуре 9А. Области А и В геля, окрашенного кумассии, были вырезаны для исследования исходных смесей и продуктов иммунопреципитации. Нумерация соответствует показанной на фигуре 9А. На фигуре 9С показаны результаты масс-спектрометрических анализов, выполненных в областях геля, изображенных на фигурах 9А и 9В. Указано число К11, К48 и К63 связей, измеренных в каждом образце. Во всех случаях было обнаружено пренебрежимо малое число убиквитиновых связей в продуктах иммунопреципитации при использовании изотипически сходного контрольного антитела. На фигуре 9D изображены графики, позволяющие сравнить процентное значение К11-связей от общего числа убиквитиновых связей, измеренных в исходных смесях и продуктах иммунопреципитации (антитело против К11), которые демонстрируют увеличение К11-связей при использовании гибридного антитела, специфичного к К11-связям.
Подробное описание вариантов осуществления изобретения
I. Определения терминов
“Акцепторная остовная область человека” в соответствии с целями настоящего изобретения означает остовную область, содержащую аминокислотную последовательность остовной области вариабельного домена легкой цепи (VL) или остовной области вариабельного домена тяжелой цепи (VH), выделенную из остовной области иммуноглобулина человека или консенсусной остовной области человека, указанной ниже. Акцепторная остовная область человека, ”выделенная из” остовной области иммуноглобулина человека или консенсусной остовной области человека, может содержать такую же аминокислотную последовательность или может содержать замены в аминокислотной последовательности. В некоторых вариантах осуществления изобретения число замен аминокислот равно 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше либо 2 или меньше. В некоторых вариантах осуществления изобретения акцепторная остовная область VL человека идентична последовательности остовной области VL иммуноглобулина человека или консенсусной остовной области человека.
Термин “сродство” означает силу суммарных общих нековалентных взаимодействий между одним связывающим сайтом молекулы (например, антитела) и его партнером связывания (например, антигеном). За исключением особо оговоренных случаев в значении, использованном в настоящем изобретении, термин ”сродство связывания” означает собственное сродство связывания, которое отражает взаимодействие с отношением 1:1 между членами связывающейся пары (например, антитела и антигена). Сродство молекулы Х к партнеру Y обычно может быть представлено константой диссоциации (Kd). Сродство можно измерить обычными методами, известными в данной области, включая методы, рассмотренные в настоящем описании изобретения. Ниже представлены специальные иллюстративные и типичные варианты осуществления изобретения, относящиеся к измерению сродства связывания.
Антитело ”с созревшей аффинностью” означает антитело, включающее одно или несколько изменений в одном или нескольких гипервариабельных участках (HVR), по сравнению с исходным антителом, которое не содержит таких изменений, улучшающих сродство антитела к антигену.
Термин “антитело-агонист”, как используется в настоящем описании, означает антитело, которое имитирует по меньшей мере одну из функциональных активностей представляющего интерес полипептида.
“Антитело-антагонист” или ”блокирующее антитело” является антителом, которое ингибирует или уменьшает биологическую активность антигена, с которым оно специфически связывается. Определенные блокирующие антитела или антитела-антагонисты в основном или полностью ингибируют биологическую активность антигена.
Термин ”антитело” использовано в настоящем описании изобретения в самом широком значении и означает разные структуры антител, которые включают, не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, если они обладают требуемой антиген-связывающей активностью.
Термин “фрагмент антитела” означает молекулу, отличную от интактного антитела, которая содержит часть интактного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают, не ограничиваясь ими, Fv, Fab, Fab', Fab'-SH, F(ab')2, диатела, линейные антитела, одноцепочечные антитела (например, scFv) и мультиспецифические антитела, образованные фрагментами антител.
“Антитело, связывающееся с тем же эпитопом”, что и эталонное антитело, означает антитело, которое блокирует связывание эталонного антитела с антигеном на 50% или больше при выполнении конкурентного анализа, и наоборот эталонное антитело блокирует связывание указанного антитела с антигеном на 50% или больше при выполнении конкурентного анализа. В настоящем описании изобретения представлен типичный конкурентный анализ.
Термины ”антитело против К11-связанного полиубиквитина” и “антитело, связывающееся с К11-связанным полиубиквитином” означают антитело, способное связываться с К11-связанным полиубиквитином с достаточным сродством для того, чтобы указанное антитело можно было использовать в качестве диагностического и/или терапевтического агента для направленного воздействия на К11-связанный полиубиквитин. В одном из вариантов осуществления изобретения степень связывания антитела против К11-связанного полиубиквитина с неродственным белком, не являющимся К11-связанным полубиквитином, составляет менее примерно 10% связывания антитела с К11-связанным полиубиквитином при измерении, например, с помощью радиоиммуноанализа (RIA). В определенных вариантах осуществления изобретения антитело, связывающееся с К11-связанным полиубиквитином, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или меньше, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В определенных вариантах осуществления изобретения антитело против К11-связанного полиубиквитина связывается с эпитопом К11-связанного полиубиквитина, который является консервативным для К11-связанного полиубиквитина разных видов.
Как используется в настоящем описании термин ”антитело против полиубиквитина” означает антитело, способное специфически связываться с молекулой полиубиквитина.
Как используется в настоящем описании термины ”антитело против убиквитина” и “антитело против моноубиквитина” имеют взаимозаменяемые значения и означают антитело, способное специфически связываться с молекулой убиквитина.
Термин ”химерное” антитело означает антитело, в котором часть тяжелой и/или легкой цепи выделена из одного определенного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи выделена из другого источника или вида.
Термин “класс” антитела означает тип константного домена или константной области, находящейся в тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, при этом некоторые из указанных классов могут быть далее подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие разным классам иммуноглобулинов, именуются, соответственно, α, β, ε, γ и µ.
Термин ”цитотоксический агент”, как используется в настоящем описании, означает вещество, которое ингибирует или препятствует выполнению функции клетки и/или вызывает гибель или разрушение клетки. Цитотоксические агенты включают, не ограничиваясь ими, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические и лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин и другие интеркалирующие средства); ингибиторы роста; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, в том числе их фрагменты и/или варианты; и разные противоопухолевые или противораковые средства, описанные ниже.
“Нарушение” представляет собой любое состояние, которое может быть улучшено в результате лечения антителом по настоящему изобретению. В определение данного термина входят хронические и острые нарушения или заболевания, в том числе патологические состояния, провоцирующие возникновение у млекопитающего данного нарушения. Неограничивающими примерами нарушений, подлежащих лечению способом по настоящему изобретению, являются рак и гипотрофические нарушения, которые включают, не ограничиваясь ими, дегенеративные мышечные нарушения и дегенеративные нервные нарушения.
Термин ”эффекторные функции” означает биологические активности, обусловленные Fc-областью антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; уменьшение числа рецепторов на поверхности клетки (например, В-клеточных рецепторов) и активацию В-клеток.
“Эффективное количество” агента, например, фармацевтического препарата, означает количество, которое при вводимых дозах и в течение необходимых периодов времени обеспечивает достижение требуемого терапевтического или профилактического результата.
Термин ”Fc-область” использован в настоящем описании изобретения для определения С-концевой области тяжелой цепи иммуноглобулина, содержащей по меньшей мере часть константной области. В определение данного термина входят Fc-области нативной последовательности и вариантные Fc-области. В одном варианте осуществления изобретения Fc-область тяжелой цепи IgG человека расположена от остатка Cys226 или Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. За исключением особо оговоренных случаев нумерация аминокислотных остатков в Fc-области или константной области произведена в соответствии с системой нумерации EU, именуемой также индексом EU, которая описана в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Термин “остовная область” или “FR” означает остатки вариабельного домена, отличные от остатков гиперварибельного участка (HVR). Остовная область вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Последовательности HVR и FR обычно встречаются в следующей последовательности VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины ”полноразмерное антитело”, “интактное антитело” и “полное антитело” имеют взаимозаменяемые значения и означают антитело, структура которого по существу подобна структуре нативного антитела или тяжелые цепи которого содержат Fc-область, рассмотренную в настоящем описании изобретения.
Термины ”клетка-хозяин”, “линия клеток-хозяев” и “культура клеток-хозяев” имеют взаимозаменяемые значения и означают клетки, в которые была введена экзогенная нуклеиновая кислота, и потомство таких клеток. Клетки-хозяева включают ”трансформанты” и “трансформированные клетки”, в том числе первично трансформированную клетку и ее потомство независимо от числа пассажей. Нуклеиновые кислоты в потомстве могут не полностью соответствовать материнской клетке и могут включать мутации. В объем настоящего изобретения входит мутантное потомство, которое выполняет такую же функцию или обладает биологической активностью, присущей первоначально трансформированной клетке.
“Антитело человека” представляет собой антитело, которое содержит аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцированного человеком или клеткой человека либо выделенное из источника, отличного от человека, для которого характерен спектр антител человека или других кодирующих антитело последовательностей человека. В данное определение антитела человека не входит гуманизированное антитело, содержащее антигенсвязывающие остатки, отличные от человеческих.
Термин ”консенсусная остовная область человека” означает остовную область, содержащую наиболее часто встречающиеся аминокислотные остатки при выборе последовательностей остовной области VL или VH иммуноглобулина человека. Последовательности VL или VH иммуноглобулина человека обычно выбирают из подгруппы последовательностей вариабельных доменов. Указанная подгруппа последовательностей обычно является подгруппой, описанной в публикации Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном из вариантов осуществления изобретения подгруппа для VL является подгруппой каппа I, описанной в приведенной выше публикации Kabat et al. В одном из вариантов осуществления изобретения подгруппа для VH является подгруппой III, описанной в приведенной выше публикации Kabat et al.
Термин ”гуманизированное” антитело означает химерное антитело, содержащее аминокислотные остатки, выделенные из гипервариабельных участков, отличных от человеческих, и аминокислотные остатки из остовных областей человека. В определенных вариантах осуществления изобретения гуманизированное антитело содержит по существу все за исключением по меньшей мере одного и обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные участки (например, CDR) соответствуют гипервариабельным участкам антитела, отличного от антитела человека, и все или по существу все остовные области соответствуют остовным областям антитела человека. Гуманизированное антитело может необязательно содержать по меньшей мере часть константной области антитела, выделенной из антитела человека. Термин ”гуманизированная форма” антитела, например, антитела, отличного от антитела человека, означает антитело, подвергнутое гуманизации.
Термин ”гипервариабельный участок” или “HVR”, как используется в настоящем описании, означает любые области вариабельного домена антитела, содержащие гипервариабельную последовательность и/или образующие структурно определенные петли (”гипервариабельные петли”). Нативные четырехцепочечные антитела обычно содержат шесть гипервариабельных участков: три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3). Гипервариабельные участки обычно включают аминокислотные остатки из гипервариабельных петель и/или из ”областей, определяющих комплементарность” (CDR), причем указанные последние области характеризуются наибольшей вариабельностью последовательностей и/или участвуют в распознавании антигена. Типичные гипервариабельные петли находятся в положении аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) и 96-101 (Н3). (Chotia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Типичные CDR-области (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) находятся в положении аминокислотных остатков 24-34 L1, 50-56 L2, 89-97 L3, 31-35B Н1, 50-65 Н2 и 95-102 Н3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). За исключением CDR1 в VH, области, определяющие комплементарность, обычно содержат аминокислотные остатки, образующие гипервариабельные петли. Области, определяющие комплементарность, также содержат ”остатки, определяющие специфичность” или ”SDR”, которые являются остатками, контактирующими с антигеном. SDR находятся в областях CDR, именуемых укороченными CDR или а-CDR. Типичные а-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) находятся в положении аминокислотных остатков 31-34 L1, 50-55 L2, 89-96 L3, 31-35B H1, 50-58 H2 и 95-102 Н3. (См. публикацию Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)). За исключением особо оговоренных случаев нумерация остатков гипервариабельного участка и других остатков в вариабельном домене (например, остатков остовной области) выполнена в соответствии с приведенной выше публикацией Kabat et al.
Термин ”иммуноконъюгат” означает антитело, конъюгированное с одной или несколькими гетерологичными молекулами, которые включают, не ограничиваясь им, цитотоксический агент.
”Индивидум” или “индивид” является млекопитающим. Млекопитающие включают, не ограничиваясь ими, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов кроме человека, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В определенных вариантах осуществления изобретения индивидум или субъект является человеком.
“Выделенное” антитело является антителом, отделенным от компонентов естественного окружения. В некоторых вариантах осуществления изобретения антитело очищено до более чем 95% или 99% чистоты, определяемой электрофоретическими методами (например, SDS-PAGE, изоэлектрическое фокусирование (IEF), капиллярный электрофорез) или хроматографическими методами (например, ионообменная хроматография или ВЭЖХ с обращенной фазой). Для ознакомления с методами оценки чистоты антитела см., например, публикацию Flatman et al., J. Chromatogr. B 848:79-87 (2007).
Термин ”выделенная” нуклеиновая кислота означает молекулу нуклеиновой кислоты, которая была отделена от компонентов естественного окружения. Выделенная нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, находящуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но указанная молекула нуклеиновой кислоты не находится в хромосоме или занимает положение в хромосоме, отличное от естественного положения в хромосоме.
Термин ”выделенная нуклеиновая кислота, кодирующая антитело против К11-связанного полиубиквитина” означает одну или несколько молекул нуклеиновой кислоты, кодирующих тяжелые и легкие цепи антитела (или его фрагментов), в том числе молекулы нуклеиновой кислоты, находящиеся в одном векторе или разных векторах и присутствующие в одном или нескольких положениях в клетке-хозяине.
Как используется в настоящем описании термины ”К*-связанный полиубиквитин” и “L*-связанный полиубиквитин” имеют взаимозаменяемые значения и означают молекулу полиубиквитина, содержащую по меньшей мере одну изопептидную связь между С-концом одной части убиквитина и лизином в положении * другой части убиквитина. Например, термин ”К11-связанный полиубиквитин” может быть использован взаимозаменяемо с термином ”Lys11-связанный полиубиквитин”, и оба термина означают молекулу полиубиквитина, содержащую изопептидную связь между С-концом одной части убиквитина в молекуле и лизином в положении 11 другой части убиквитина в молекуле.
Как используется в настоящем описании, заявление о том, что первая лизиновая связь ”отличается” от второй лизиновой связи, означает, что первая лизиновая связь между одной частью убиквитина и другой частью убиквитина содержит остаток лизина (например, К6, К11, К27, К29, К33, К48 и/или К63), отличающийся от второй лизиновой связи между одной частью убиквитина и другой частью убиквитина.
Термин ”моноклональное антитело”, как используется в настоящем описании, означает антитело, полученное из популяции по существу гомогенных антител, то есть отдельные антитела, образующие данную популяцию, являются идентичными и/или связываются с одним и тем же эпитопом, за исключением возможных вариантных антител, например, содержащих природные мутации или появившихся в процессе создания препарата моноклональных антител, причем такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела против разных антигенных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против одной антигенной детерминанты. Таким образом, определение ”моноклональный” указывает на характер антитела, полученного из по существу гомогенной популяции антител, и не должно быть истолковано как требование получения такого антитела каким-либо конкретным методом. Например, моноклональные антитела по настоящему изобретению могут быть получены разными методами, которые включают, нке ограничиваясь ими, метод гибридом, методы рекомбинантных ДНК, методы отображения на фаге и методы с использованием трансгенных животных, содержащих все или часть локусов иммуноглобулина человека; такие методы и другие типичные методы получения моноклональных антител рассмотрены в настоящем описании изобретения.
Термин ”голое антитело” означает антитело, не конъюгированное с гетерологичной частью (например, цитотоксической частью) или радиоактивным изотопом. Голое антитело может присутствовать в фармацевтическом препарате.
Термин ”нативные антитела” означает молекулы природного иммуноглобулина с изменяющейся структурой. Например, нативные антитела IgG являются гетеротетрамерными гликопротеинами с молекулярной массой около 150000 Дальтон, состоящими из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидной связью. В направлении от N-конца к С-концу каждая тяжелая цепь содержит вариабельную область (VH), также именуемую вариабельным доменом тяжелой цепи, за которым следуют три константных домена (СН1, СН2 и СН3). Аналогичным образом в направлении от N-конца к С-концу каждая легкая цепь содержит вариабельную область (VL), также именуемую вариабельным доменом легкой цепи, за которым следует константный домен легкой цепи (CL). Легкая цепь антитела может относиться к одному из двух типов, именуемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности константного домена.
Термин ”вкладыш в упаковке” означает инструкции, вложенные в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях к применению, использовании, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждения, касающиеся использования таких терапевтических продуктов.
Термин ”процентное значение (%) идентичности аминокислотной последовательности” относительно эталонной полипептидной последовательности означает процентное значение аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в эталонной полипептидной последовательности, после выполнения сравнительного анализа последовательностей и при необходимости введение разрывов для достижения максимального процентного значения идентичности последовательностей, при этом любые консервативные замены не учитываются при определении идентичности последовательности. Сравнительный анализ последовательностей с целью определения процентного значения идентичности аминокислотной последовательности может быть выполнен разными способами, известными в данной области, например, при помощи общедоступных компьютерных программ, таких как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для сравнительного анализа последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального совмещения сравниваемых последовательностей по всей длине. Однако в соответствии с целями настоящего изобретения процентные значения идентичности аминокислотных последовательностей определяют при помощи компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2 была создана в компании Genentech, Inc., и исходный код был направлен вместе с документацией пользователя в Бюро регистрации авторских прав США, Вашингтон, округ Колумбия, 20559, где указанная программа зарегистрирована под регистрационным номером TXU510087. Программа ALIGN-2 может быть предоставлена компанией Genentech, Inc., South San Francisco, California, или может быть компилирована из исходного кода. Программа ALIGN-2 должна быть компилирована для использования в операционной системе UNIX, в том числе в цифровой системе UNIX V4.0D. В программе ALIGN-2 заданы все параметры сравнения последовательностей и не могут быть изменены.
При использовании программы ALIGN-2 для сравнения аминокислотных последовательностей процентное значение идентичности данной аминокислотной последовательности А относительно данной аминокислотной последовательности В (другими словами данной аминокислотной последовательности А, которая обладает определенным процентным значением идентичности относительно данной аминокислотной последовательности В) вычисляют следующим образом:
100 × результат деления Х/Y
где Х означает число аминокислотных остатков, являющихся идентичными парами по результатам сравнительного анализа последовательностей А и В, выполненного программой сравнения последовательностей ALIGN-2, и Y означает общее число аминокислотных остатков в В. Следует отметить, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то процентное значение идентичности аминокислотной последовательности А по отношению к В не будет равно процентному значению идентичности аминокислотной последовательности В по отношению к А. За исключением особо оговоренных случаев все процентные значения идентичности аминокислотных последовательностей, использованные в настоящем описании изобретения, получены в соответствии с описанием, приведенным в предшествующем абзаце, при помощи компьютерной программы ALIGN-2.
Термин “Фармацевтический препарат” означает препарат, форма которого делает эффективной биологическое действие содержащегося в нем активного ингредиента и который не содержит дополнительных компонентов, неприемлемо токсичных для индивида, принимающего данный препарат.
Термин ”фармацевтически приемлемый носитель” означает ингредиент в фармацевтическом препарате, не являющийся активным ингредиентом, который не токсичен для индивида. Фармацевтически приемлемый носитель включает, не ограничиваясь ими, буфер, наполнитель, стабилизатор или консервант.
Как используется в настоящем описании термин ”полиубиквитин” означает все виды нативных человеческих и синтетических полимерных цепей убиквитина, которые попадают под определение человеческих и синтетических классов разных полимерных связей убиквитина, которые включают, не ограничиваясь ими, К6-связанный полиубиквитин, К11-связанный полиубиквитин, К27-связанный полиубиквитин, К29-связанный полиубиквитин, К33-связанный полиубиквитин, К48-связанный полиубиквитин и К63-связанный полиубиквитин. Полиубиквитин может иметь любую длину и включает по меньшей мере две убиквитиновые части. Полиубиквитин отличается от тандемных повторов убиквитина, которые первоначально экспрессированы в виде единичного белка.
Как используется в настоящем описании термин ”лечение” (и грамматические варианты данного термина, такие как ”лечить”) означает клиническое вмешательство в попытке изменить естественное развитие заболевания у подвергаемого лечению индивида и может проводиться для профилактики или в процессе клинической патологии. Желаемые эффекты лечения включают, не ограничиваясь ими, предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, предотвращение возникновения метастазов, уменьшение интенсивности развития заболевания, улучшение или временное ослабление проявления болезни и ремиссию или лучший прогноз. В некоторых вариантах осуществления изобретения антитела по настоящему изобретению используют для задержки или замедления развития заболевания.
Как используются в настоящем описании термины “убиквитин” и “моноубиквитин” имеют взаимозаменяемые значения и означают любой нативный убиквитин, полученный у любого позвоночного, включая млекопитающих, таких как приматы (например, человек) и грызуны (например, мыши и крысы) за исключением особо оговоренных случаев. В определение данного термина входит полноразмерный убиквитин, а также любая укороченная или модифицированная после трансляции форма убиквитина, образующаяся в результате процессинга в клетке, за исключением молекул, состоящих из нескольких частей убиквитина. В определение данного термина также входят природные варианты убиквитина, например, сплайсированные варианты или аллельные варианты. Аминокислотная последовательность типичного убиквитина человека показана в SEQ ID NO:1: MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFA GKQLEDGRTLSDYNIQKESTLHLVLRLRGG (SEQ ID NO:1). Убиквитин содержит по меньшей мере один остаток лизина в положении аминокислоты 6, аминокислоты 11, аминокислоты 27, аминокислоты 29, аминокислоты 33, аминокислоты 48 и/или аминокислоты 63 (отмечены жирным шрифтом в приведенной выше SEQ ID NO:1).
Как используется в настоящем описании термин ”сигнальный путь убиквитина” означает биохимический путь в клетке или реконструированный in vitro, который включает убиквитин и/или полиубиквитин.
Термин ”вариабельная область” или “вариабельный домен” означает домен тяжелой или легкой цепи антитела, участвующий в связывании антитела с антигеном. Вариабельные домены тяжелой и легкой цепей (соответственно VH и VL) нативного антитела обычно имеют одинаковую структуру, при этом каждый домен содержит четыре консервативные остовные области (FR) и три гипервариабельных участка (HVR). (См., например, публикацию Kindt et al., Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)). Для сообщения антигенсвязывающей специфичности может быть достаточно одного VH или VL домена. Кроме того, антитела, связывающиеся с конкретным антигеном, могут быть выделены с использованием VH или VL домена из антитела, связывающегося с данным антигеном, путем скрининга библиотеки комплементарных VL или VH доменов. См., например, публикации Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
Термин ”вектор”, как используется в настоящем описании, означает молекулу нуклеиновой кислоты, способную культивировать другую нуклеиновую кислоту, с которой она связывается. В определение данного термина входит вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор в составе генома клетки-хозяина, в которую он был введен. Определенные векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы определяются в настоящем описании изобретения как ”векторы экспрессии”.
II. Композиции и методы
Одним из аспектов настоящего изобретения частично является создание антител, способных специфически распознавать первую молекулу полиубиквитина, содержащую первую полиубиквитиновую связь, и специфически не связывающихся со второй молекулой полиубиквитина, содержащей вторую полиубиквитиновую связь. Определенные варианты осуществления изобретения относятся к антителам, которые специфически связываются с К11-связанным полиубиквитином. Антитела по настоящему изобретению могут быть использованы в научно-исследовательской работе, например, для диагностики или лечения, например, заболеваний и нарушений, обусловленных аберрантным развитием клеточного цикла.
Уникальные свойства антител против К11-связанного полиубиквитина по настоящему изобретению делают их особенно полезными для выявления разных форм связанного лизином полиубиквитина в системе клеток, не прибегая к сложным и дорогостоящим генетическим манипуляциям и биофизическим методам, таким как масс-спектрометрия. Антитела против К11-связанного полиубиквитина по настоящему изобретению могут быть использованы для исследования функций и активности специфических К11-связанных полиубиквитинов как in vitro, так и in vivo. Антитела против К11-связанного полиубиквитина по настоящему изобретению могут быть также использованы для определения роли специфических К11-связанных полиубиквитинов в развитии и патогенезе заболевания. Антитела против К11-связанного полиубиквитина по настоящему изобретению могут быть далее использованы для лечения заболеваний, обусловленных аберрантной регуляцией или аберрантным функционированием одного или нескольких связанных лизином полиубиквитинов, без нарушения нормальной активности полиубиквитинов, для которых антитела против полиубиквитина по настоящему изобретению не являются специфическими.
Известно, что анафаза-стимулирующий комплекс АРС/C действует в качестве убиквитинирующей лигазы Е3, отвечающей за большинство цепей К11-связанного полиубиквитина, синтезированных в процессе митоза. В частности, АРС/С-опосредованное К11-связанное полиубиквитинирование митотических белков, таких как циклины, геминин и Plk1, вызывает последующее разрушение указанных меченых белков протеасомой. Когда эндогенный убиквитин мутирует с заменой лизина в положении 11 аргинином и поэтому не может быть использован для образования лизиновой связи, в образующихся мутантных клетках отсутствует аберрантное разрушение важных митотических белков и происходит прекращение клеточного цикла. В виде Xenopus указанная мутация вызывает гибель эмбриона до гаструляции. Таким образом, наличие и доступность метки К11-связанного полиубиквитина играет важную роль в нормальном развитии клеточного цикла, поэтому антитела и Fab-фрагменты по настоящему изобретению являются важным терапевтическим средством модуляции нарушений и заболеваний, опосредованных аберрантной регуляцией клеточного цикла. В одном из вариантов осуществления изобретения антитела против К11-связанного полиубиквитина по настоящему изобретению использованы для лечения заболеваний и нарушений с аберрантно ускоренным развитием клеточного цикла, в результате чего происходит слишком много делений клетки, как это имеет место в случае рака. В другом варианте осуществления изобретения антитела против К11-связанного полиубиквитина по настоящему изобретению использованы для лечения заболеваний и нарушений с аберрантно замедленным развитием клеточного цикла, в результате чего происходит слишком мало делений клетки, что вызывает утрату или разрушение ткани. Примеры таких заболеваний включают, не ограничиваясь ими, дегенеративные мышечные нарушения и дегенеративные нервные нарушения (которые включают, не ограничиваясь ими, болезнь Шарко-Мари-Тута, полиомиелит, боковой амиотрофический склероз и болезнь Гийена-Барре).
Как используются в настоящем описании, термины ”клеточнопролиферативное нарушение” и “пролиферативное нарушение” означают нарушения, связанные с некоторой степенью аномальной пролиферации клеток. В одном из вариантов осуществления изобретения клеточнопролиферативным нарушением является рак.
Термины ”рак” и “раковый” означают или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом/пролиферацией клеток. Примеры рака включают, не ограничиваясь ими, карциному, лимфому (например, лимфому Ходжкина и неходжкинскую лимфому), бластому, саркому и лейкоз. Более конкретные примеры таких раков включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, рак брюшины, печеночно-клеточный рак, желудочно-кишечный рак, рак червеобразного отростка, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, рак эндометрия или матки, рак слюнной железы, рак почки, рак печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, карциному печени, лейкоз и другие лифопролиферативные нарушения и разные типы рака головы и шеи.
Термин ”опухоль”, как используется в настоящем описании, означает все неопластические нарушения роста и пролиферации клетки, как злокачественные, так и доброкачественные, и все предраковые и раковые клетки и ткани. Термины ”рак”, “раковый”, “клеточнопролиферативное нарушение”, “пролиферативное нарушение” и “опухоль” не являются взаимоисключающими, как указано в настоящем описании изобретения.
Термин ”дегенеративное мышечное нарушение” означает или описывает физиологическое состояние у животных, имеющих мышцы, которое обычно характеризуется разрушением или ослаблением скелетных и/или гладких мышц, в результате чего ухудшается нормальное функционирование мышц. Примеры дегенеративных мышечных нарушений включают, не ограничиваясь ими, мышечную дистрофию, миотоническую дистрофию, врожденную миотонию, кахексию, саркопению, рассеянный склероз, боковой амиотрофический склероз, болезнь Исаака, тугоподвижность, семейный периодический паралич, миопатию, миотонию, острый некроз скелетных мышц, мышечную атрофию и разные типы мышечной слабости и мышечной ригидности.
Термин ”дегенеративное нервное нарушение” означает или описывает физиологическое состояние у животных, имеющих нервы, которое обычно характеризуется разрушением нервной ткани или нарушением связи между клетками в нервной ткани. Примеры дегенеративных нервных нарушений включают, не ограничиваясь ими, нейродегенеративные заболевания, которые включают, не ограничиваясь ими, болезнь тельцев Леви, постполиомиелитный синдром, болезнь Шая-Драгера, оливопонтоцеребеллярную атрофию, болезнь Паркинсона, множественную системную атрофию, боковой амиотрофический склероз, болезнь Гийена-Барре, болезнь Шарко-Мари-Тута, дегенерацию полосатого тела и разрушение нервных клеток/ткани, вызванное или обусловленное таутопатией, болезни, вызванные прионом, бульбарный паралич, заболевание двигательных нейронов, слабоумие и гетеродегенеративные нарушения нервной системы (которые включают, не ограничиваясь ими, болезнь Канавана, болезнь Хантингтона, цероидлипофусциноз нейронов, болезнь Александера, болезнь Туретте, синдром Менкеса, синдром Коккейна, синдром Халервордена-Спарца, болезнь Лафора, синдром Ретта, гепатоцеребральную дистрофию, синдром Леша-Найхана и миоклоническую эпилепсию).
В другом аспекте настоящее изобретение относится к антителам против К11-связанного полиубиквитина по настоящему изобретению, которые могут быть использованы в качестве реагентов для обнаружения и выделения К11-связанного полиубиквитина, например, с целью обнаружения полиубиквитина в разных типах клеток и тканях, включая определение плотности и распределения полиубиквитина в популяциях клеток и в данной клетке и сортировку клеток на основании наличия или количества полиубиквитина. Другим аспектом настоящего изобретения являются антитела против К11-связанного полиубиквитина по настоящему изобретения, используемые для создания антагонистов полиубиквитина, обладающих блокирующей активностью подобно антителам по настоящему изобретению. В качестве дополнительного примера можно отметить, что антитела против К11-связанного полиубиквитина по настоящему изобретению могут быть использованы для идентификации других антител против полиубиквитина, которые связываются в основном с теми же антигенными детерминантами полиубиквитина, что и антитела по настоящему изобретению, включая линейные и конформационные эпитопы.
Антитела против К11-связанного полиубиквитина по настоящему изобретению могут быть использованы при выполнении анализов физиологических путей с участием полиубиквитина с целью скрининга низкомолекулярных антагонистов функции К11-связанного полиубиквитина. Например, поскольку известно, что цепи К11-связанного полиубиквитина необходимы для нормального развития клеточного цикла при участии анафазы (CITE), способность антител против К11-связанного полиубиквитина модулировать (ускорять или замедлять) развитие клеточного цикла в обработанных клетках или тканях можно сравнить с аналогичной способностью одного или нескольких потенциальных низкомолекулярных антагонистов К11-связанного полиубиквитина.
А. Типичные антитела против К11-связанного полиубиквитина
В одном из аспектов настоящее изобретение относится к выделенным антителам, связывающимся с К11-связанным полиубиквитином. В определенных вариантах осуществления изобретения антитело против К11-связанного полиубиквитина специфически связывается с К11-связанным полиубиквитином и специфически не связывается с моноубиквитином. В определенных вариантах осуществления изобретения антитело против К11-связанного полиубиквитина специфически связывается с К11-связанным полиубиквитином и специфически не связывается с полиубиквитином, имеющим связь, образованную любым другим лизином (то есть К6-, К27-, К29-, К33-, К48- и/или К63-связи).
В другом аспекте настоящее изобретение относится к антителу против К11-связанного полиубиквитина, содержащему HVR-H1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:6-11 и 24. В другом аспекте настоящее изобретение относится к антителу, содержащему HVR-H2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:12-17, 25, 67 и 75. В другом аспекте настоящее изобретение относится к антителу, содержащему HVR-H3 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:18-23, 26, 68, 69 и 76.
В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-H1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:6-11 и 24, и HVR-H2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:12-17, 25, 67 и 75. В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-H1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:6-11 и 24, и HVR-H3 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:18-23, 26, 68, 69 и 76. В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-H2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:12-17, 25, 67 и 75, и HVR-H3 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:18-23, 26, 68, 69 и 76.
В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-L1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:2, 57-60 и 73. В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-L2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:3, 61 и 74. В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-L3 область, содержащую последовательность SEQ ID NO:4.
В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-L1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:2, 57-60 и 73, и HVR-L2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:3, 61 и 74. В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-L1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:2, 57-60 и 73, и HVR-L3 область, содержащую последовательность SEQ ID NO:4. В одном из аспектов настоящее изобретение относится к антителу, содержащему HVR-L2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:3, 61 и 74, и HVR-L3 область, содержащую последовательность SEQ ID NO:4.
В одном из аспектов настоящее изобретение относится к антителу, содержащему по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или все шесть нижеследующих областей:
(i) HVR-H1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:6-11 и 24;
(ii) HVR-H2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:12-17, 25, 67 и 75;
(iii) HVR-H3 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:18-23, 26, 68, 69 и 76;
(iv) HVR-L1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:2, 57-60 и 73;
(v) HVR-L2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:3, 61 и 74; и
(vi) HVR-L3 область, содержащую последовательность SEQ ID NO:4.
В одном из аспектов настоящее изобретение относится к антителу, которое специфически связывается с высокой степенью сродства с К11-связанным полиубиквитином и с гораздо меньшей степенью сродства связывается с полиубиквитином, имеющим связь, образованную каким-либо другим лизином, и которое содержит по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или все шесть нижеследующих областей:
(i) HVR-H1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:6-11 и 24;
(ii) HVR-H2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:12-17, 25, 67 и 75;
(iii) HVR-H3 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:18-23, 26, 68, 69 и 76;
(iv) HVR-L1 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:2, 57-60 и 73;
(v) HVR-L2 область, содержащую по меньшей мере одну последовательность из SEQ ID NO:3, 61 и 74; и
(vi) HVR-L3 область, содержащую последовательность SEQ ID NO:4.
В одном из аспектов настоящее изобретение относится к антителу, содержащему последовательности HVR тяжелой цепи, показанные на фигурах 1В, 4В или 6В. В одном из вариантов осуществления изобретения антитела содержат последовательности HVR легкой цепи, показанные на фигурах 1А, 4А или 6А. В одном из вариантов осуществления изобретения антитела содержат последовательности HVR тяжелой цепи, показанные на фигурах 1В, 4В или 6В, и последовательности HVR легкой цепи, показанные на фигурах 1А, 4А или 6А.
Некоторые варианты антител по настоящему изобретению содержат вариабельный домен легкой цепи гуманизированного антитела 4D5 (huMAb4D5-8) (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также см. патент США № 6407213 и публикации Lee et al., J. Mol. Biol. (2004), 340(5):1073-93), содержащий последовательность, показанную в приведенной ниже SEQ ID NO:79.
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID NO:79) (Остатки HVR подчеркнуты)
В одном из вариантов осуществления изобретения последовательность вариабельного домена легкой цепи huMAb4D5-8 модифицирована в одном или нескольких положениях 28, 30, 31, 53, 66 и 91 (Asp, Asn, Thr, Phe, Arg и His, отмеченные в приведенной выше последовательности жирным шрифтом/курсивом). В одном из вариантов осуществления изобретения модифицированная последовательность huMAb4D5-8 содержит Ser в положении 28, Ser в положении 30, Ser в положении 31, Ser в положении 53, Gly в положении 66 и/или Ser в положении 91. Таким образом, в одном из вариантов осуществления изобретения антитело по настоящему изобретению содержит вариабельный домен легкой цепи, содержащий последовательность, показанную в приведенной ниже SEQ ID NO:80:
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Ser Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID NO: 80) (Остатки HVR подчеркнуты)
Замененные остатки в huMAb4D5-8 отмечены в приведенной выше последовательности жирным шрифтом/курсивом.
Антитела по настоящему изобретению могут содержать любую приемлемую последовательность вариабельного домена остовной области при условии сохранения активности связывания с К11-связанным полиубиквитином. Например, в некоторых вариантах осуществления изобретения антитела по настоящему изобретению содержат консенсусную последовательность остовной области тяжелой цепи из подгруппы III человека. В одном из вариантов указанных антител консенсусная последовательность остовной области содержит замены в положениях 71, 73 и/или 78. В некоторых вариантах указанных антител в положении 71 находится А, в положении 73 находится Т и/или в положении 78 находится А. В одном варианте осуществления изобретения указанные антитела содержат последовательности вариабельного домена тяжелой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также см. патенты США № 6407213 и 5821337 и публикации Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93). В одном из вариантов осуществления изобретения указанные антитела далее содержат консенсусную последовательность остовной области легкой κI-цепи человека. В одном варианте осуществления изобретения указанные антитела включают по меньшей мере одну, две или все последовательности HVR легкой цепи SEQ ID NO:2-4, 57-61, 73 и 74. В одном из вариантов осуществления изобретения указанные антитела содержат последовательности HVR легкой цепи huMAb4D5-8, описанные в патентах США № 6407213 и 5821337). В одном варианте осуществления изобретения указанные антитела содержат последовательности вариабельного домена легкой цепи huMAb4D5-87 (SEQ ID NO:783 и 784) (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (см. также в патентах США № 6407213 и 5821337 и в публикации Lee et al., J. Mol. Biol. (2004), 340(5):1073-93).
В одном из вариантов осуществления изобретения антитело по настоящему изобретению является антителом с созревшей аффинностью, используемым для получения желаемого целенаправленного сродства связывания. В одном примере антитело с созревшей аффинностью по настоящему изобретению, специфически связывающееся с высоким сродством с К11-связанным полиубиквитином и с гораздо меньшим сродством связывающееся с полиубиквитином, у которого связи образованы другим лизином (не К11), содержит замену в положениях аминокислот 60 и 63 HVR-H2. В другом примере антитело с созревшей аффинностью по настоящему изобретению, специфически связывающееся с высоким сродством с К11-связанным полиубиквитином и с гораздо меньшим сродством связывающееся с полиубиквитином, у которого связи образованы другим лизином (не К11), содержит замену в положениях аминокислот 98 и 99 HVR-H3. В другом примере антитело с созревшей аффинностью по настоящему изобретению, специфически связывающееся с высоким сродством с К11-связанным полиубиквитином и с гораздо меньшим сродством связывающееся с полиубиквитином, у которого связи образованы другим лизином (не К11), содержит замену в положениях аминокислот 24, 25, 27 и 28-34 HVR-L1. В другом примере антитело с созревшей аффинностью по настоящему изобретению, специфически связывающееся с высоким сродством с К11-связанным полиубиквитином и с гораздо меньшим сродством связывающееся с полиубиквитином, у которого связи образованы другим лизином (не К11), содержит замену в положениях аминокислот 50-52 и 54 HVR-L2.
В одном из вариантов осуществления изобретения антитело по настоящему изобретению содержит по меньшей мере одну последовательность вариабельного домена тяжелой цепи из SEQ ID NO:27-32 и 70-72. В одном из вариантов осуществления изобретения антитело по настоящему изобретению содержит по меньшей мере одну последовательность вариабельного домена легкой цепи из SEQ ID NO:5 и 62-66. В одном из вариантов осуществления изобретения антитело по настоящему изобретению содержит по меньшей мере одну последовательность вариабельного домена тяжелой цепи из SEQ ID NO:27-32 и 70-72, а также по меньшей мере одну последовательность вариабельного домена легкой цепи из SEQ ID NO:5 и 62-66. В других вариантах осуществления изобретения антитело по настоящему изобретению, соответствующее определенному номеру клона, содержит вариабельный домен тяжелой цепи, содержащий последовательность HVR-H1, HVR-H2 и HVR-H3, показанную на фигурах 1В, 4В или 6В для данного номера клона. В других вариантах осуществления изобретения антитело по настоящему изобретению, соответствующее определенному номеру клона, содержит вариабельный домен легкой цепи, содержащий последовательность HVR-L1, HVR-L2 и HVR-L3, показанную на фигурах 1А, 4А и 6А для данного номера клона. В других вариантах осуществления изобретения антитело по настоящему изобретению, соответствующее определенному номеру клона, содержит вариабельный домен тяжелой цепи, содержащий последовательность HVR-H1, HVR-H2 и HVR-H3, показанную на фигурах 1В, 4В или 6В для данного номера клона, а также вариабельный домен легкой цепи, содержащий последовательность HVR-L1, HVR-L2 и HVR-L3, показанную на фигурах 1А, 4А и 6А для данного номера клона.
В одном из аспектов настоящее изобретение относится к антителу, конкурирующему с любым из вышеуказанных антител за связывание с К11-связанным полиубиквитином. В одном из аспектов настоящее изобретение относится к антителу, которое связывается с той же антигенной детерминантой К11-связанного полиубиквитина, что и любое из вышеуказанных антител.
Как показано в настоящем описании изобретения, антитела по настоящему изобретению специфически связываются с выделенным полиубиквитином, имеющим связь, образованную конкретным лизином. Как показано в настоящем описании изобретения, антитела по настоящему изобретению также специфически связываются с полиубиквитином, имеющим связь, образованную конкретным лизином, при присоединении данного полиубиквитина к гетерологичному белку.
В любом из вышеописанных вариантов осуществления изобретения антитело против К11-связанного полиубиквитина является гуманизированным антителом. В одном варианте осуществления изобретения антитело против К11-связанного полиубиквитина содержит гипервариабельные участки (HVR), рассмотренные в любом из вышеуказанных вариантов осуществления изобретения, и далее содержит акцепторную остовную область человека, например, остовную область иммуноглобулина человека или консенсусную остовную область человека. В другом варианте осуществления изобретения антитело против К11-связанного полиубиквитина содержит гипервариабельные участки, рассмотренные в любом из вышеуказанных вариантов осуществления изобретения, и далее включает VH домен, содержащий любую последовательность FR1, FR2, FR3 или FR4 из SEQ ID NO:27-32 и 70-72. В другом варианте осуществления изобретения антитело против К11-связанного полиубиквитина содержит гипервариабельные участки, рассмотренные в любом из вышеуказанных вариантов осуществления изобретения, и далее содержит VL домен, содержащий любую последовательность FR1, FR2, FR3 или FR4 из SEQ ID NO:5 и 62-66.
В другом аспекте настоящее изобретение относится к антителу против К11-связанного полиубиквитина, содержащему последовательность вариабельного домена (VH) тяжелой цепи, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична любой аминокислотной последовательности из SEQ ID NO: 27-32 и 70-72. В определенных вариантах осуществления изобретения последовательность VH домена, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), инсерции или делеции по сравнению с эталонной последовательностью, при этом антитело против К11-связанного полиубиквитина, содержащее указанную последовательность, сохраняет способность связываться с К11-связанным полиубиквитином. В определенных вариантах осуществления изобретения любая последовательность из SEQ ID NO:27-32 и 70-72 включает замены, инсерции и/или делеции в общей сложности от 1 до 10 аминокислот. В определенных вариантах осуществления изобретения замены, инсерции или делеции находятся в областях за пределами гипервариабельных участков (то есть в остовных областях). Антитело против К11-связанного полиубиквитина необязательно включает любую последовательность VH домена из SEQ ID NO:27-32 и 70-72, содержащую посттрансляционные модификации.
В другом аспекте настоящее изобретение относится к антителу против К11-связанного полиубиквитина, содержащему вариабельный домен (VL) легкой цепи, в котором последовательность по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична любой аминокислотной последовательности из SEQ ID NO:5 и 62-66. В определенных вариантах осуществления изобретения последовательность VL домена, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), инсерции или делеции по сравнению с эталонной последовательностью, при этом антитело против К11-связанного полиубиквитина, включающее указанную последовательность, сохраняет способность связываться с К11-связанным полиубиквитином. В определенных вариантах осуществления изобретения любая последовательность из SEQ ID NO:5 и 62-66 включает замены, инсерции и/или делеции в общей сложности от 1 до 10 аминокислот. В определенных вариантах осуществления изобретения замены, инсерции или делеции находятся в областях за пределами гипервариабельных участков (то есть в остовных областях). Антитело против К11-связанного полиубиквитина необязательно содержит любую последовательность VL домена из SEQ ID NO:5 и 62-66, в том числе посттрансляционные модификации указанной последовательности.
В другом аспекте настоящее изобретение относится к антителу против К11-связанного полиубиквитина, которое содержит VH домен, рассмотренный в любом из вышеуказанных ввариантов осуществления изобретения, и VL домен, рассмотренный в любом из вышеуказанных вариантов осуществления изобретения. В одном из вариантов осуществления изобретения антитело содержит любые последовательности VH и VL доменов из SEQ ID NO:27-32 и 70-72 и SEQ ID NO:5 и 62-66, в том числе посттрансляционные модификации указанных последовательностей.
В одном из аспектов настоящее изобретение относится к антителу против К11-связанного полиубиквитина по любому из вышеуказанных вариантов осуществления изобретения, которое представляет собой моноклональное антитело, включая химерное, гуманизированное или антитело человека. В одном варианте осуществления изобретения антитело против К11-связанного полиубиквитина представляет собой фрагмент антитела, например, Fv, Fab, Fab', scFv, диатело или F(ab')2 фрагмент. В другом вариантке осуществления изобретения антитело является полноразмерным антителом, например, интактным антителом IgG1 или антителом другого класса или изотипа, рассмотренным в настоящем описании изобретения.
В объем настоящего изобретения входят композиции, содержащие по меньшей мере одно антитело против К11-связанного полиубиквитина или по меньшей мере один полинуклеотид, содержащий последовательности, кодирующие антитело против К11-связанного полиубиквитина. В определенных вариантах осуществления изобретения композиция может быть фармацевтической композицией. Композиции по настоящему изобретению включают одно или несколько антител, которые связываются с одним или несколькими полиубиквитинами, и/или один или несколько полинуклеотидов, содержащих последовательности, кодирующие одно или несколько антител, связывающихся с одним или несколькими полиубиквитинами. Указанные композиции могут далее содержать приемлемые носители, такие как фармацевтически приемлемые наполнители, включающие буферы, хорошо известные в данной области.
В другом аспекте настоящее изобретение относится к антителу против К11-связанного полиубиквитина по любому из вышеуказанных вариантов осуществления изобретения, которое может обладать любыми признаками, отдельно или в комбинации, рассмотренными в нижеследующих разделах 1-7.
1. Сродство антитела
В определенных вариантах осуществления изобретения антитело по настоящему изобретению имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или меньше, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В одном из вариантов осуществления изобретения Kd измеряют при помощи анализа связывания антигена, меченного радиоактивным изотопом (RIA), выполняемого при использовании Fab-фрагмента представляющего интерес антитела и его антигена в соответствии с нижеследующим описанием. Сродство связывания Fab-фрагментов с антигеном в растворе измеряют, уравновешивая Fab-фрагмент с (125I)-меченным антигеном в минимальной концентрации в присутствии серии титров немеченного антигена и улавливая связанный антиген на планшете, сенсибилизированном антителом против Fab-фрагмента (см., например, публикацию Chen et al., J. Mol. Biol. 293:865-881 (1999)). С целью создания условий для выполнения данного анализа многолуночные планшеты MICROTITER® (Thermo Scientific) сенсибилизируют в течение ночи 5 мкг/мл улавливающего антитела против Fab-фрагмента (Cappel Labs) в 50 мМ карбоната натрия (рН 9,6) и затем блокируют 2% (мас./об.) бычьего сывороточного альбумина в PBS в течение двух-пяти часов при комнатной температуре (примерно 23°С). На неадсорбирующем планшете (Nunc № 269620) 100 пМ или 26 пМ [125I]-меченного антигена смешивают с серийно разведенным представляющим интерес Fab-фрагментом (например, в соответствии с оценкой антитела против VEGF, Fab-12, представленной в публикации Presta et al., Cancer Res. 57:4593-4599 (1997)). Представляющий интерес Fab-фрагмент затем инкубируют в течение ночи; однако инкубация может быть произведена в течение более продолжительного времени (например, в течение примерно 65 часов) для гарантии достижения равновесия. Затем смесь переносят на улавливающий планшет для инкубации при комнатной температуре (например, в течение одного часа). Раствор удаляют и планшет восемь раз промывают 0,1% полисорбата 20 (твин-20®) в PBS. После высыхания планшетов добавляют 150 мкл/лунку сцинтиллятора (MICROSCINT-20™, Packard) и производят подсчет на планшетах счетчиком гамма-излучения (Packard) в течение десяти минут. В конкурентно-связывающих анализах используют концентрации Fab-фрагментов, которые обеспечивают менее 20% или соответствуют 20% максимального связывания.
В соответствии с другим вариантом осуществления изобретения Kd измеряют при помощи анализов резонанса поверхностных плазмонов в устройстве BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С на чипах с иммобилизованным антигеном СМ5 при ~10 единицах ответной реакции (RU). Биосенсорные чипы с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разводят 10 мМ ацетата натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) и вводят со скоростью потока 5 мкл/минуту до достижения примерно 10 единиц ответной реакции (RU) связанного белка. После введения антигена вводят 1 М этаноламина для блокирования непрореагировавших групп. Для измерений кинетики вводят Fab-фрагмент в виде двукратных серийных разведений (от 0,78 нМ до 500 нМ) в PBS с 0,05% полисорбата 20 (твин-20™), являющегося поверхностно-активным веществом (PBST) при 25°С со скоростью потока примерно 25 мкл/мин. Степень ассоциации (kon) и степени диссоциации (koff) вычисляют при помощи простой модели связывания 1:1 Лангмюра (программа оценки BIACORE®, версия 3.2) путем одновременно совмещения сенсограмм ассоциации и диссоциации. Константу равновесной диссоциации (Kd) вычисляют в виде отношения koff/kon. См., например, публикацию Chen et al., J. Mol. Biol. 293:865-881 (1999). Если степень ассоциации превышает 106 М-1 s-1 при выполнении анализа резонанса поверхностных плазмонов, тогда степень ассоциации может определить методом гашения флуоресценции, позволяющим измерить увеличение или уменьшение интенсивности флуоресценции (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С с использованием 20 нМ антитела против антигена (в виде Fab-фрагмента) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, выполняя измерение в спектрометре, таком как спектрометр, оснащенный прерывателем потока (Aviv Instruments) или спектрофотометр SLM-AMINCO™ серии 8000 (RhermoSpectronic) с перемешиваемой кюветой. Вместо вышеописанного метода связывания амином (чип СМ5) могут быть использованы другие химические методы связывания антигена-мишени с поверхностью чипа (например, стрептавидин/биотин, гидрофобное взаимодействие или дисульфид), которые должны быть известны специалисту в данной области.
2. Фрагменты антител
В определенных вариантах осуществления изобретения антитело по настоящему изобретению представляет собой фрагмент антитела. Фрагменты антител включают, не ограничиваясь ими, Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv фрагменты и другие фрагменты, описанные ниже. С определенными фрагментами антител можно ознакомиться в публикации Hudson et al., Nat. Med. 9:129-134 (2003). Для ознакомления с scFv фрагментами см., например, публикацию Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); см. также WO 93/16185 и патенты США № 5571894 и 5587458. Для ознакомления с Fab и F(ab')2 фрагментами, содержащими остатки эпитопа, связывающего восстанавливающий рецептор, и обладающими более продолжительным временем полужизни in vivo, см. патент США № 5869046.
Диатела являются фрагментами антител с двумя антигенсвязывающими центрами, которые могут быть двухвалентными или биспецифическими. См., например, европейский патент № 404097, WO 1993/01161, публикации Hudson et al., Nat. Med. 9:129-134 (2003) и Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993). Триатела и тетратела также описаны в публикации Hudson et al., Nat. Med. 9:129-134 (2003).
Однодоменные антитела являются фрагментами антител, содержащими весь или часть вариабельного домена тяжелой цепи либо весь или часть вариабельного домена легкой цепи антитела. В определенных вариантах осуществления изобретения однодоменное антитело является однодоменным антителом человека (Domantis, Inc., Waltham, MA; см., например, патент США № 6248516 В1).
Фрагменты антител могут быть получены разными методами, которые включают, не ограничиваясь ими, протеолитическое расщепление интактного антитела, а также продуцирование рекомбинантными клетками-хозяевами (например, E. coli или фагом), рассмотренное в настоящем описании изобретения.
3. Химерные и гуманизированные антитела
В определенных вариантах осуществления изобретения антитело по настоящему изобретению является химерным антителом. Определенные химерные антитела описаны, например, в патенте США № 4816567 и публикации Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984). В одном примере химерное антитело содержит вариабельную область, отличную от вариабельной области человека (например, вариабельную область, выделенную у мыши, крысы, хомячка, кролика или примата кроме человека, такого как обезьяна) и константную область человека. В другом примере химерное антитело является антителом с ”измененным классом”, в котором класс или подкласс изменен по сравнению с исходным антителом. Химерные антитела включают антигенсвязывающие фрагменты.
В определенных вариантах осуществления изобретения химерное антитело является гуманизированным антителом. Антитело, отличное от антитела человека, обычно гуманизируют для уменьшения иммуногенности для человека при сохранении специфичности и сродства связывания исходного антитела, отличного от антитела человека. Гуманизированное антитело обычно содержит один или несколько вариабельных доменов, в которых гипервариабельные участки, например, CDR (или их части) выделены из антитела, отличного от антитела человека, и остовные области (или их части) выделены из последовательностей антитела человека. Гуманизированное антитело также необязательно содержит по меньшей мере часть константной области человека. В некоторых вариантах осуществления изобретения некоторые остатки остовной области в гуманизированном антителе заменены соответствующими остатками из антитела, отличного от антитела человека (например, антитела, из которого выделены остатки гипервариабельного участка), для сохранения или улучшения специфичности или сродства связывания антитела.
Гуманизированные антитела и методы их получения рассмотрены, например, в публикации Almagro and Fransson, Front. Biosci. 13: 1619-1633 (2008), а также описаны в публикациях Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci USA 87:10029-10033 (1989); в патентах США № 5821337, 7527791, 6982321 и 7087409; в публикациях Kashmiri et al., Methods 36:25-34 (2005) (где описан метод сополимеризации SDR (a-CDR); Padlan, Mol. Immunol. 28:489-498 (1991) (где описан метод ”поверхностной обработки”); Dall'Acqua et al., Methods 36:43-60 (2005) (где описан метод “перестановки остовной области”): Osbourn et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (где описан метод “регулируемого отбора” для перестановки остовной области).
Остовные области человека, которые могут быть использованы в процессе гуманизации, включают, не ограничиваясь ими, остовные области, выбираемые методом ”наилучшей подгонки” (см., например, публикацию Sims et al., J. Immunol. 151:2296 (1993)); остовные области, выделенные из консенсусной последовательности антител человека, включающих определенную подгруппу вариабельных областей легкой или тяжелой цепи (см., например, публикации Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); и Presta et al., J. Immunol., 151:2623 (1993)); зрелые (соматически созревшие) остовные области человека или гаметические остовные области человека (см., например, публикацию Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и остовные области, выделенные в результате скрининга библиотек остовных областей (см., например, публикации Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
4. Антитела человека
В определенных вариантах осуществления изобретения антитело по настоящему изобретению является антителом человека. Антитела человека могут быть получены разными методами, известными в данной области. Антитела человека описаны в публикациях van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5:368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Антитела человека могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано с целью продуцирования интактных антител человека или интактных антител с вариабельными областями человека в ответ на антигенную стимуляцию. Такие животные обычно содержат все или часть локусов иммуноглобулина человека, которые заменяют локусы эндогенного иммуноглобулина, либо присутствуют вне хромосом или произвольно интегрированы в хромосомы животного. У трансгенных мышей локусы эндогенного иммуноглобулина обычно инактивированы. С методами получения антител человека у трансгенных животных можно ознакомиться в публикации Lonberg, Nat. Biotech. 23:1117-1125 (2005). См. также, например, патенты США № 6075181 и 6150584, в которых описан метод XENOMOUSE™; патент США № 5770429, в котором описан метод HuMab®; патент США № 7041870, в котором описан метод К-М MOUSE®, и публикацию заявки на патент США № US 2007/0061900, в которой описан метод VelociMouse®). Вариабельные области человека из интактных антител, образуемых такими животными, могут быть далее модифицированы, например, путем объединения с другой константной областью человека.
Антитела человека могут быть также получены методами на основе гибридом. В научной литературе описаны линии клеток миеломы человека и гетеромиеломы мыши-человека, используемые для продуцирования моноклональных антител человека. (См., например, публикации Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987) и Boerner et al., J. Immunol., 147:86 (1991)). Антитела человека, полученные методом В-клеточных гибридом человека, описаны также в публикации Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительными методами являются методы, описанные, например, в патенте США № 7189826 (где описано получение моноклональных антител IgM человека из линий клеток гибридомы) и публикации Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (где описаны гибридомы типа ”человек-человек”). Метод гибридом человека (метод Триома) также описан в публикациях Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005).
Антитела человека могут быть также получены путем выделения последовательностей вариабельного домена клона Fv, выбираемых из библиотек отображения на фаге, выделенных у человека. Такие последовательности вариабельного домена затем могут быть объединены с требуемым константным доменом человека. Ниже описаны методы выбора антител человека из библиотек антител.
5. Антитела, выделенные из библиотек
Антитела по настоящему изобретению могут быть выделены путем скрининга комбинаторных библиотек с целью обнаружения антител, обладающих требуемой активностью или активностями. Например, в данной области известен целый ряд методов создания библиотек отображения на фаге и скрининга таких библиотек в отношении антител, обладающих требуемыми характеристиками связывания. Такие методы рассмотрены, например, в публикации Hoogenboom et al., in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, HJ, 2001), а также описаны в публикациях McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); and Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
При осуществлении определенных методов отображения на фаге наборы генов VH и VL областей отдельно клонируют при помощи полимеразной цепной реакции (ПЦР) и рекомбинируют произвольно в библиотеках отображения на фаге, которые затем исследуют в отношении антигенсвязывающего фага, как описано в публикации Winter et al., Ann. Rev. Immunol., 12:433-455 (1994). На фаге обычно отображены фрагменты антител, в частности, одноцепочечные Fv (scFv) фрагменты или Fab фрагменты. Библиотеки из иммунизированных источников позволяют получить высокоаффинные антитела к иммуногену без необходимости создания гибридом. Альтернативно может быть клонирован непроцессированный набор (например, человека) для создания одного источника антител к широкому диапазону несобственных, а также собственных антигенов без какой-либо иммунизации, как описано в публикации Griffiths et al., EMBO J., 12:725-734 (1993). И наконец, непроцессированные библиотеки могут быть также созданы синтетическим путем в результате клонирования нереанжированных сегментов V-гена из стволовых клеток и использования затравок для ПЦР, содержащих произвольную последовательность для кодирования гипервариабельных участков CDR3 и выполнения реаранжировки in vitro, как описано в публикации Hoogenboom and Winter, J. Mol. Biol., 227:381-388 (1992). Публикации патентов, в которых описаны библиотеки отображения на фаге антител человека, включают, например, патент США № 5750373 и публикации патентов США № 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек антител человека, считаются антителами человека или фрагментами антител человека.
6. Мультиспецифические антитела
В определенных вариантах осуществления изобретения антитело по настоящему изобретению является мультиспецифическим антителом, например, биспецифическим антителом. Мультиспецифические антитела представляют собой моноклональные антитела, обладающие специфичностью связывания по меньшей мере с двумя разными сайтами. В определенных вариантах осуществления изобретения одна специфичность связывания относится к К11-связанному полиубиквитину и другая специфичность связывания относится к любому другому антигену. В определенных вариантах осуществления изобретения биспецифические антитела могут связываться с двумя разными эпитопами К11-связанного полиубиквитина. Биспецифические антитела могут быть также использованы для локализации цитотоксических агентов в клетках, экспрессирующих К11-связанный полиубиквитин. Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител.
Методы создания мультиспецифических антител включают, не ограничиваясь ими, рекомбинантную коэкспрессию двух пар тяжелой цепи-легкой цепи иммуноглобулина, обладающих разными специфичностями (см. публикации Milstein and Cuello, Nature 305:537 (1983)), WO 93/08829 и Traunecker et al., EMBO J. 10:3655 (1991)), и метод ”шар в лунку” (см., например, патент США № 5731168). Мультиспецифические антитела могут быть также получены методом электростатического наведения с целью создания гетеродимерных молекул Fc-фрагмента антитела (WO 2009/089004A1), методом перекрестного сшивания двух или более антител или фрагментов (см., например, патент США № 4676980 и публикацию Brennan et al., Science, 229:81 (1985)); методом использования лейциновых застежек-молний для создания биспецифических антител (см., например, публикацию Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992)); методом использования “диатела” для создания фрагментов биспецифического антитела (см., например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и методом использования димеров одноцепочечного Fv фрагмента (sFv) (см., например, публикацию Grubber et al., J. Immunol., 152:5368 (1994)); и методом получения триспецифических антител, описанным, например, в публикации Tutt et al., J. Immunol. 147:60 (1991).
В объем настоящего изобретения также входят генетически созданные антитела с тремя или более функциональными антигенсвязывающими центрами, включая ”антитела-осьминоги” (см., например, публикацию заявки на патент США 2006/0025576А1).
Антитело или его фрагмент по настоящему изобретению также включает ”Fab-фрагмент двойного действия” или “DAF”, содержащий антигенсвязывающий центр, который связывается с К11-связанным полиубиквитином, а также с другим антигеном (см., например, публикацию заявки на патент США 2008/0069820).
7. Варианты антител
Определенные варианты осуществления изобретения относятся к вариантам аминокислотных последовательностей антител по настоящему изобретению. Например, может быть желательно улучшить сродство связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получить путем внесения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или в результате синтеза пептидов. Такие модификации включают, например, делеции, инсерции и/или замены остатков в аминокислотных последовательностях антитела. Может быть получена любая комбинация делеций, инсерций и замен для создания конечной конструкции, при условии, что конечная конструкция обладает требуемыми характеристиками, например, связыванием с антигеном.
а) Варинты замен, инсерций и делеций
Определенные варианты осуществления изобретения относятся к вариантам антител, включающим одну или несколько замен аминокислот. Представляющими интерес сайтами для заместительного мутагенеза являются HVR и FR. Консервативные замены показаны в таблице 1 под заголовком ”консервативные замены”. Более значимые замены приведены в таблице 1 под заголовком “типичные замены” и описаны ниже со ссылкой на классы боковых цепей аминокислот. Замены аминокислот могут быть произведены в представляющем интерес антителе с последующим исследованием полученных продуктов с целью обнаружения антител, обладающих требуемой активностью, например, сохранившимся/улучшенным сродством связывания с антигеном, меньшей иммуногенностью или лучшими показателями ADCC или CDC.
Аминокислоты могут быть классифицированы с учетом общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены предполагают переход члена одного из указанных классов в другой класс.
Один тип заместительного варианта включает замену одного или нескольких остатков гипервариабельного участка исходного антитела (например, гуманизированного антитела или антитела человека). Полученный вариант, выбранный для дальнейшего исследования, обычно включает модификации (например, улучшения) определенных биологических свойств (например, лучшее сродство, меньшая иммуногенность) по сравнению с исходным антителом и/или по существу сохраняет определенные биологические свойства исходного антитела. Типичным заместительным вариантом является антитело с созревшей аффинностью, которое может быть создано, например, методами созревания аффинности на основе отображения на фаге, рассмотренными ниже. В кратком изложении данные методы включают мутацию одного или нескольких остатков HVR, отображение вариантных антител на фаге и скрининг с целью обнаружения конкретной биологической активности (например, сродства связывания).
Изменения (например, замены) могут быть произведены в гипервариабельных участках, например, для улучшения сродства связывания антитела. Такие изменения могут быть произведены в ”горячих точках” HVR, то есть в остатках, кодированных кодонами, в которых часто происходят мутации в процессе соматического созревания (см., например, публикацию Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или SDR (a-CDR), после чего полученный вариант VH или VL исследуют в отношении сродства связывания. Метод созревания аффинности путем создания библиотек и повторного выбора из вторичных библиотек описан, например, в публикации Hoogenboom et al., Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001)). В некоторых вариантах процесса созревания аффинности разнообразие вариабельных генов, выбранных для созревания, достигается любыми известными методами (такими как, например, подверженная ошибкам ПЦР, перестановка цепей или сайтнаправленный мутагенез с использованием олигонуклеотидов). Затем создают вторичную библиотеку. Производят скрининг созданной библиотеки для идентификации любых вариантов антител, обладающих требуемым сродством. Другой метод сообщения разнообразия направлен на HVR, в соответствии с которым рандомизируют несколько остатков HVR (например, одновременно 4-6 остатков). Остатки HVR, участвующие в связывании с антигеном, могут быть специфически идентифицированы, нрапример, при помощи мутагенеза со сканированием аланином или моделирования. Мишенями часто являются CDR-H3 и CDR-L3.
В определенных вариантах осуществления изобретения замены, инсерции или делеции могут быть произведены в одном или нескольких гипервариабельных участках, если такие изменения по существу не уменьшают способность антитела связываться с антигеном. Например, в HVR могут быть произведены консервативные изменения (например, вышеуказанные консервативные замены), которые по существу не уменьшают сродство связывания. Такие изменения могут быть произведены за пределами ”горячих точек” или SDR гипервариабельного участка. В определенных вариантах последовательностей VH и VL, представленных выше, HVR или остается без изменения, или содержит не более одной, двух или трех замен аминокислот.
Приемлемым методом идентификации остатков или областей антитела, которые могут быть мишенями для мутагенеза, является ”мутагенез со сканированием аланином”, который описан в публикации Cunningham and Wells (1989) Science, 244:1081-1085. В соответствии с данным методом идентифицируют остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu), которые заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения влияния, оказываемого на взаимодействие антитела с антигеном. Другие замены могут быть произведены в положениях аминокислот, характеризующихся функциональной чувствительностью к первичным заменам. Альтернативно или дополнительно кристаллическая структура комплекса антиген-антитело позволяет идентифицировать точки контактирования антитела с антигеном. Такие контактирующие остатки и соседние остатки могут быть подвергнуты направленному воздействию или удалены из кандидатов на замену. Варианты могут быть исследованы для определения наличия у них требуемых свойств.
Инсерции аминокислотной последовательности включают амино- и/или карбоксиконцевые слияния, длина которых находится в диапазоне от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции одного или нескольких аминокислотных остатков внутри последовательности. Примеры концевых инсерций включают антитело с N-концевым остатком метионила. Другие инсерционные варианты молекулы антитела включают слияние N- или С-конца антитела с ферментом (например, для ADEPT) или полипептидом, что увеличивает время полужизни антитела в кровяном русле.
b) Варианты гликозилирования
В определенных вариантах осуществления изобретения антитело по настоящему изобретению изменяют путем увеличения или уменьшения степени гликозилирования антитела. Сайты гликозилирования в антителе можно добавить или удалить, изменяя аминокислотную последовательность с возможностью создания или удаления одного или нескольких сайтов гликозилирования.
Если антитело включает Fc-область, можно заменить присоединенный к ней углевод. Нативные антитела, продуцированные клетками млекопитающих, обычно включают олигосахарид с разветвленной цепью, который обычно присоединяется при помощи N-связи к Asn297 СН2 домена Fc-области. См., например, публикацию Wright et al., TIBTECH 15:26-32 (1997). Указанный олигосахарид может включать разные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фруктозу, присоединенную к GlcNAc в главной цепи структуры олигонуклеотида. В некоторых вариантах осуществления изобретения олигосахарид в антителе по настоящему изобретению может быть модифицирован с целью создания вариантов антитела, обладающих определенными улучшенными свойствами.
Один вариант осуществления изобретения относится к вариантам антитела, в углеводной структуре которых отсутствует фукоза, присоединенная (прямо или непрямо) к Fc-области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы олпределяют, вычисляя среднее количество фукозы в сахарной цепи в положении Asn297 по сравнению с суммой всех гликоструктур, присоединенных к Asn297 (например, комплексные, гибридные структуры и структуры с высоким содержанием маннозы) при помощи масс-спектрометрии MALDI-TOF, описанной, например, в публикации WO 2008/077546. Asn297 означает остаток аспарагина, находящийся примерно в положении 297 Fc-области (нумерация EU остатков Fc-области); однако Asn297 может также находиться на расстоянии примерно ±3 аминокислот вверху или внизу от положения 297, то есть между положениями 294 и 300 из-за небольшой изменчивости последовательностей в антителах. Такие фукозилированные варианты могут характеризоваться улучшенной функцией ADCC. См., например, публикации патентов США №№ 2003/0157108 (Prestra, L), 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, относящихся к ”дефукозилированным” вариантам антител или вариантам антител с “отсутствием фукозы”, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO2002/031140; Okazaki et al., J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al., Biotech. Bioeng. 87:614 (2004). Примеры линий клеток, способных продуцировать дефукозилированные антитела, включают клетки CHO Lec13 с отсутствием фукозилирования белка (Ripka et al., Arch. Biochem. Biophys. 249:533-545 (1986); заявка на патент США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., в частности, в примере 11) и линии клеток с выключенным геном, таким как ген альфа-1,6-фукозилтрансферазы, FUT8, клетки СНО с выключенным геном (см., например, публикации Yamane-Ohnuki et al., Biotech. Bioeng. 87:614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO 2003/085107).
Настоящее изобретение далее относится к вариантам антител с рассеченными олигосахаридами, например, в которых олигосахарид, присоединенный к Fc-области антитела, рассечен GlcNAc. Такие варианты антител могут характеризоваться меньшим фукозилированием и/или улучшенной функцией ADCC. Примеры таких вариантов антител приведены, например, в WO 2003/011878 (Jean-Mairet et al.); в патенте США № 6602684 (Umana et al.) и в заявке на патент США 2005/0123546 (Umana et al.). В объем настоящего изобретения также входят варианты антител, содержащие по меньшей мере один остаток галактозы в олигосахариде, присоединенном к Fc-области. Такие варианты антител могут характеризоваться улучшенной функцией CDC. Такие варианты антител описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S) и WO 1999/22764 (Raju, S).
с) Варианты Fc-области
В определенных вариантах осуществления изобретения в Fc-области антитела по настоящему изобретению могут быть заменены одна или несколько аминокислот, в результате чего образуется вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-область IgG1, IgG2, IgG3 или IgG4 человека) с модификацией (например, заменой) аминокислоты в одном или нескольких положениях.
Определенные варианты осуществления изобретения относятся к варианту антитела, обладающему некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для применений, в которых важное значение имеет время полужизни антитела in vivo, при этом определенные эффекторные функции (такие как комплемент и ADCC) является ненужными или вредными. Для подтверждения ослабления/устранения активностей CDC и/или ADCC могут быть выполнены анализы цитотоксичности in vitro и/или in vivo. Например, могут быть выполнены анализы связывания Fc-рецептора (FcR) для подтверждения того, что антитело не связывается с FcγR (поэтому, вероятно, не обладает активностью ADCC), но сохраняет способность связываться с FcRn. Основные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках представлена в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Неограничивающие примеры анализов in vitro для оценки активности ADCC передставляющей интерес молекулы приведены в патенте США № 5500362 (см., например, публикации Hellstrom, I. et al., Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I. et al., Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); 5821337 (см. публикацию Bruggemann, M. et al., J. Exp. Med. 166:1351-1361 (1987)). Альтернативно могут быть использованы нерадиоактивные анализы (см., например, нерадиоактивный анализ цитотоксичности методом проточной цитометрии (CellTechnology, Inc., Mountain View, CA) и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI). Эффекторные клетки, подходящие для выполнения таких анализов, включают мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC представляющей интерес молекулы можно оценить in vivo, например, в животной модели, представленной в публикации Clynes et al., Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). Также могут быть выполнены анализы связывания C1q для подтверждения того, что антитело не способно связываться с C1q и, следовательно, не обладает активностью CDC. См., например, анализ связывания C1q и С3с ELISA в публикациях WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента может быть выполнен анализ CDC (см., например, публикации Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101:1045-1052 (2003) и Cragg, M.S. and M.J. Glennie, Blood 103:2738-2743 (2004)). Способность связывать FcRn и клиренс/время полужизни in vivo можно также определить методами, известными в данной области (см., например, публикацию Petkova, S.B. et al., Int'l. Immunol. 18(12):1759-1769 (2006)).
Антителами с ослабленной эффекторной функцией являются антитела с заменой одного или нескольких остатков 238, 265, 269, 270, 297, 327 и 329 Fc-области (патент США № 6737056). Такие мутанты Fc-области включают мутанты с заменами в двух или более положениях аминокислот 265, 269, 270, 297 и 327, включая так называемые мутанты Fc-области “DANA” с заменой остатков 265 и 297 аланином (патент США № 7332581).
В научной литературе описаны определенные варианты антител с улучшенным или ослабленным связыванием с FcR. (См., например, патент США № 6737056; WO 2004/056312 и публикацию Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001)).
В определенных вариантах осуществления изобретения вариант антитела содержит Fc-область с одной или несколькими заменами аминокислот, улучшающими ADCC, например, с заменами в положениях 298, 333 и/или 334 Fc-области (нумерация остатков EU).
В некоторых вариантах осуществления изобретения в Fc-области произведены такие замены, которые вызывают изменение (то есть улучшение или ослабление) связывания C1q и/или комплементзависимой цитотоксичности (CDC), например, описанные в патенте США № 6194551, WO 99/51642 и в публикации Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Антитела с увеличенным временем полужизни и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), отвечающим за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) and Kim et al., J. Immunol. 24:249 (1994)), описаны в завявке на патент США 2005/001493A1 (Hinton et al.). Указанные антитела содержат Fc-область с одной или несколькими заменами, улучшающими связывание Fc-области с FcRn. Такие варианты Fc-области включают варианты с заменами в положении одного или нескольких остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 Fc-области (патент США № 7371826).
См. также публикацию Duncan & Winter, Nature 322:738-40 (1988), патент США № 5648260, патент США № 5624821 и WO 94/29351, в которых приведены другие примеры вариантов Fc-области.
d) Варианты антител, генетически созданные с использованием цистеина
В определенных вариантах осуществления изобретения может быть желательно создать антитела с использованием цистеина, например, ”моноклональные тиоантитела”, в которых один или несколько остатков заменены остатками цистеина. В конкретных вариантах осуществления изобретения замененные остатки находятся на доступных сайтах антитела. В результате замены указанных остатков цистеином реакционноспособные тиоловые группы располагаются на доступных сайтах антитела и могут быть использованы для конъюгирования антитела с другими частями, такими как части лекарственного средства или линкерные части лекарственного средства, с созданием иммуноконъюгата, рассмотренного далее в настоящем описании изобретения. В определенных вариантах осуществления изобретения цистеином может быть заменен любой один или несколько следующих остатков: V205 (нумерация Kabat) легкой цепи, А118 (нумерация EU) тяжелой цепи и S400 (нумерация EU) Fc-области тяжелой цепи. Антитела, генетически созданные с использованием цистеина, могут быть получены методами, описанными, например, в патенте США № 7521541.
е) Производные антител
В определенных вариантах осуществления изобретения антитело по настоящему изобретению может быть далее модифицировано с введением дополнительных небелковых частей, известных в данной области и легко доступных. Части, пригодные для получения производных антител, включают, не ограничиваясь ими, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, не ограничиваясь ими, полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или статистические полимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропиональдегид полиэтиленгликоля обладает преимуществами в процессе приготовления благодаря устойчивости в воде. Указанный полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может изменяться, и в случае присоединения более одного полимера такие полимеры могут быть одниковыми или разными молекулами. Как правило, число и/или тип полимеров, используемых для получения производных антител, могут быть определены на основании показателей, которые включают, не ограничиваясь ими, конкретные улучшаемые свойства или функции антитела, использование производного антитела в терапии в определенных условиях и т.д.
Другой вариант осуществления изобретения относится к конъюгатам антитела и небелковой части, которые могут быть избирательно нагреты под воздействием излучения. В одном варианте осуществления изобретения небелковая часть является углеродной нанотрубочкой (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Излучение может иметь любую длину волны и включает, не ограничиваясь ими, длины волн, которые не причиняют вреда нормальным клеткам, но нагревают небелковую часть до температуры, при которой клетки, расположенные рядом с небелковой частью антитела, погибают.
В. Методы рекомбинантных ДНК и композиции
Антитела могут быть получены методами рекомбинантных ДНК и могут входить в состав композиций, например, описанных в патенте США № 4816567. Один вариант осуществления изобретения относится к выделенной нуклеиновой кислоте, кодирующей антитело против К11-связанного полиубиквитина по настоящему изобретению. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкие и/или тяжелые цепи антитела). Другой вариант осуществления изобретения относится к одному или нескольким векторам (например, векторам экспрессии), содержащим такую нуклеиновую кислоту. Другой вариант осуществления изобретения относится к клетке-хозяину, содержащей такую нуклеиновую кислоту. В одном из вариантов осуществления изобретения клетка-хозяин содержит (например, была трансформирована): (1) вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VH антитела. В одном из вариантов осуществления изобретения клетка-хозяин является эукариотической клеткой, например, клеткой яичника китайского хомячка (СНО) или лимфоидной клеткой (например, клеткой Y0, NS0, Sp20). Один вариант осуществления изобретения относится к способу получения антитела против К11-связанного полиубиквитина, который включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело по настоящему изобретению, в условиях, пригодных для экспрессии антитела, и необязательно, выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для получения антитела против К11-связанного полиубиквитина нуклеиновую кислоту, кодирующую антитела, например, в соответствии с приведенным выше описанием, выделяют и вводят в один или несколько векторов для последующего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована стандартными методами (например, при использовании олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Приемлемые клетки-хозяева, предназначенные для клонирования и экспрессии антителокодирующих векторов, включают прокариотические или эукариотические клетки, рассмотренные в настоящем описании изобретения. Например, антитела могут быть продуцированы в бактериях, в частности, когда отсутствует необходимость гликозилирования и не нужна эффекторная функция Fc-области. Для ознакомления с экспрессией фрагментов антител и полипептидов в бактериях см., например, патенты США № 5648237, 5789199 и 54840523. (См. также публикацию Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, в которой описана экспрессия фрагментов антител в E. coli). После экспрессии антитело может быть выделено из взвеси бактериальных клеток в растворимой фракции и подвергнуто дальнейшей очистке.
Помимо прокариот, эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи, являются приемлемыми хозяевами для клонирования или экспрессии антителокодирующих векторов и включают штаммы грибов и дрожжей, у которых ”гуманизированы” пути гликозилирования, что позволяет получить антитело с частично или полностью паттерном гликозилирования человека. См. публикации Gerngross, Nat. Biotech. 22:1409-1414 (2004) и Li et al., Nat. Biotech. 24:210-215 (2006).
Приемлемые клетки-хозяева для экспрессии гликозилированного антитела также могут быть выделены из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут быть использованы вместе с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток также могут быть использованы в качестве хозяев. См., например, патенты США №№ 5959177, 6040498, 6420548, 7125978 и 6417429 (в которых описан метод PLANTIBODIES™ для продуцирования авнтител в трансгенных растениях).
Клетки позвоночных также могут быть использованы в качестве хозяев. Например, могут быть использованы линии клеток млекопитающих, адаптированных для выращивания в суспензии. Другие примеры пригодных линий клеток-хозяев млекопитающих включают линию клеток почки обезьяны CV1, трансформированную SV40 (COS-7); линию эмбриональных клеток почки человека (клетки 293, описанные, например, в публикации Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почки детеныша хомячка (ВНК); клетки Сертоли мыши (клетки ТМ4, описанные, например, в публикации Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки рака шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени буйволовой крысы (BRL 3A); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, в публикации Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982); клетки MRC5 и клетки FS4. Другие пригодные линии клеток-хозяев млекопитающих включают клетки яичника китайкого хомячка (СНО), в том числе клетки DHFR- CHO (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и линии миеломных клеток, такие как Y0, NS0 и Sp2/0. Для ознакомления с определенными линиями клеток-хозяев млекопитающих, подходящих для продуцирования антител, см., например, публикацию Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003).
С. Анализы
Антитела против К11-связанного полиубиквитина по настоящему изобретению могут быть идентифицированы, подвергнуты скринингу или исследованы в отношении физических/химических свойств и/или биологических активностей при помощи разных анализов, известных в данной области.
1. Анализы связывания и другие анализы
В одном из аспектов настоящее изобретение относится к антителу по настоящему изобретению, исследуемому в отношении антигенсвязывающей активности известными методами, такими как ELISA, вестерн-блоттинг и т.д.
Другим аспектом настоящего изобретения являются конкурентные анализы, которые могут быть использованы для идентификации антитела, конкурирующего, например, с любым из Fab-фрагментов А3, А6, А9, В5, F5 или G3, с антителами G3, 1A11, 1C12, 1F12, 2A3, 2A6, 2D7, 2E6, 2G4 или гибридными антителами 1С12/2E6 или 2А3/2E6 (рассмотренными в настоящем описании изобретения) за связывание с К11-связанным полиубиквитином. В определенных вариантах осуществления изобретения такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), что и любой из Fab-фрагментов А3, А6, А9, В5, F5 или G3, антитела G3, 1A11, 1C12, 1F12, 2A3, 2A6, 2D7, 2E6, 2G4 или гибридные антитела 1С12/2E6 или 2А3/2E6 (рассмотренными в настоящем описании изобретения). Типичные методы картирования эпитопа, с которым связывается антитело, подробно описаны в публикации Morris (1996) ”Epitope Mapping Protocols”, in Methods in Molecular Biology, vol. 66 (Humana Press, Totowa, NJ).
При выполнении типичного конкуретного анализа иммобилизованный К11-связанный полиубиквитин инкубируют в растворе, содержащей первое меченое антитело, которое связывается с К11-связанным полиубиквитином (например, антитела G3, 1A11, 1C12, 1F12, 2A3, 2A6, 2D7, 2E6, 2G4 или гибридные антитела 1С12/2E6 или 2А3/2Е6), и второе немеченное антитело, исследуемое в отношении его способности конкурировать с первым антителом за связыванике с К11-связанным полиубиквитином. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контрольного эксперимента иммобилизованный К11-связанный полиубиквитин инкубируют в растворе, содержащем первое меченое антитело, при отсутствии второго немеченного антитела. После инкубации в условиях, допускающих связывание первого антитела с К11-связанным полиубиквитином, избыток несвязанного антитела удаляют и измеряют количество метки, связанной с иммобилизованным К11-связанным полиубиквитином. Значительно меньшее количество метки, связанной с иммобилизованным К11-связанным полиубиквитином в экспериментальном образце по сравнению с контрольным образцом, указывает на то, что второе антитело конкурирует с первым антителом за связывание с К11-связанным полиубиквитином. См. публикацию Harlow and Lane (1988), Antibodies: A Laboratory Manual, ch. 13 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
2. Анализы активности
В одном из аспектов настоящее изобретение относится к анализам, позволяющим идентифицировать антитела против К11-связанного полиубиквитина, обладающие биологической активностью. Биологическая активность может включать, например, модуляцию скорости деградации белков К11-связанного полиубиквитина в клетке или ткани и модуляцию скорости развития клеточного цикла. В объем настоящего изобретения входят антитела, обладающие такой биологической активностью in vivo и/или in vitro.
В определенных вариантах осуществления изобретения антитело по настоящему изобретению исследуют на наличие такой биологической активности.
D. Иммуноконъюгаты
Настоящее изобретение также относится к иммуноконъюгатам, содержащим антитело против К11-связанного полиубиквитина, конъюгированное с одним или несколькими цитотоксическими агентами, такими как химиотерапевтические средства или лекарственные средства, ингибиторы роста, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибного, растительного или животного происхождения или их фрагменты) или радиоактивные изотопы.
В одном из вариантов осуществления изобретения иммуноконъюгат является конъюгатом антитела с лекарственным средством (ADC), в котором антитело конъюгировано с одним или несколькими лекарственными средствами, которые включают, не ограничиваясь ими, майтанзиноид (см. патенты США № 5208020, 5416064 и европейский патент ЕР № 0425235 В1); ауристатин, такой как лекарственные части монометилауристатина DE и DF (ММАЕ и MMAF) (см. патенты США № 5635483, 5780588 и 7498298); доластатин; калихеамицин или его производное (см. патенты США № 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296; публикации Hinman et al., Cancer Res. 53:3336-3342 (1993) и Lode et al., Cancer Res. 58:2925-2928 (1998)); антрациклин, такой как дауномицин или доксорубицин (см. публикации Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); и патент США № 6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тезетаксел и ортатаксел; трихотецен и СС1065.
В другом варианте осуществления изобретения иммуноконъюгат содержит антитело по настоящему изобретению, конъюгированное с ферментативно активным токсином или его фрагментом, которые включают, не ограничиваясь ими, цепь дифтерийного токсина А, несвязывающиеся активные фрагменты дифтерийного токсина, цепи экзотоксина А (из Pseudomonas aeruginosa), цепь рицина А, цепь абрина А, цепь модекцина А, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены.
В другом варианте осуществления изобретения иммуноконъюгат содержит антитело по настоящему изобретению, конъюгированное с радиоактивным атомом с образованием радиоактивного конъюгата. Существует целый ряд радиоактивных изотопов, используемых для получения радиоактивных конъюгатов. Примеры таких радиоактивных изотопов включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Радиоактивный конъюгат, используемый для обнаружения, может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или I123, или спиновую метку для ядерно-магнитно-резонансной (ЯМР) томографии (известной также как магнитно-резонансная томография, MRI), такую как иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела с цитотоксическим агентом могут быть получены при помощи разных бифункциональных связывающих белок агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как гидрохлорид диметиладипимидата), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен методом, описанным в публикации Vitetta et al., Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является типичным хелатообразователем для конъюгирования радионуклеотида с антителом. См. публикацию WO94/11026. Линкер может быть ”отщепляемым линкером”, облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, могут быть использованы кислотолабильный линкер, пептидазачувствительный линкер, фотолабильный линкер, диметиловый линкер или дисульфидсодержащий линкер (Chari et al., Cancer Res. 52:127-131 (1992); патент США № 5208020).
Иммуноконъюгаты или ADC включают, не ограничиваясь ими, конъюгаты, полученные при помощи перекрестносшивающих реагентов, которые включают, не ограничиваясь ими, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил(4-винилсульфон)бензоат) и могут быть приобретены коммерческим путем (например, в компании Pierce Biotechnology, Inc., Rockford, IL., U.S.A).
Е. Методы диагностики и обнаружения и композиции, используемые при осуществлении указанных методов
В определенных вариантах осуществления изобретения любые антитела против К11-связанного полиубиквитина по настоящему изобретению могут быть использованы для обнаружения наличия К11-связанного полиубиквитинва в биологическом образце. Термин ”обнаружение”, как используется в настоящем описании, означает количественное или качественное обнаружение. В определенных вариантах осуществления изобретения биологический образец представляет собой клетку или ткань, которые содержат, не ограничиваясь ими, опухолевую клетку, мышечную клетку или нервную клетку.
Один вариант осуществления изобретения относится к антителу против К11-связанного полиубиквитина, используемому для диагностики или обнаружения. В другом аспекте настоящее изобретение относится к способу обнаружения наличия К11-связанного полиубиквитина в биологическом образце. В определенных вариантах осуществления изобретения указанный способ включает приведение в контакт биологического образца с антителом против К11-связанного полиубиквитина по настоящему изобретению в условиях, допускающих связывание антитела против К11-связанного полиубиквитина с полиубиквитином или полиубиквитинированным белком, и обнаружение комплекса, образованного между антителом против К11-связанного полиубиквитина и полиубиквитином или полиубиквитинированным белком. Такой метод может быть выполнен in vitro или in vivo. В одном варианте осуществления изобретения антитело против К11-связанного полиубиквитина используют для отбора индивидов, восприимчивых к лечению антителом против К11-связанного полиубиквитина, например, в тех случаях, когда К11-связанный полиубиквитин является биомаркером для отбора индивидов.
Типичные нарушения, которые могут быть диагностированы при помощи антитела по настоящему изобретению, включают заболевания или нарушения, связанные с клеточным циклом, которые могут представлять собой заболевания или нарушения, связанные с аберрантно ускоренным развитием клеточного цикла, либо заболевания или нарушения, связанные с аберрантно замеделенным развитием клеточного цикла. Одним объектом настоящего изобретения является заболевание или нарушение, связанное с аберрантно ускоренным развитием клеточного цикла, которое представляет собой рак. Другим объектом настоящего изобретения является заболевание или нарушение, связанное с аберрантно замедленным развитием клеточного цикла, которое представляет собой дегенеративное мышечное нарушение или дегенеративное нервное нарушение.
Определенные варианты осуществления изобретения относятся к меченым антителам против К11-связанного полиубиквитина. Метки включают, не ограничиваясь ими, непосредственно обнаруживаемые метки или части (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминесцентные и радиоактивные метки), а также такие части, как ферменты или лиганды, обнаруживаемые опосредованно, например, по ферментативной реакции или молекулярному взаимодействию. Типичные метки включают, не ограничиваясь ими, радиоактивные изотопы 32Р, 14С, 125I, 3H и 131I, флуорофоры, такие как хелатные комплексы с редкоземельными металлами или флуоресцеин и его производные, родамин и его производные, данзил, умбеллиферон, например, люциферазу светлячков и бактериальную люциферазу (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу из хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфат-дегидрогеназу, гетероциклические оксидазы, такие как уриказа и сантиноксидаза, связанные с ферментом, использующим пероксид водорода для окисления предшественника красителя, такого как HRP, лактопероксидазу или микропероксидазу, биотин/авитин, спиновые метки, бактериофаговые метки, устойчивые свободные радикалы и тому подобные.
F. Фармацевтические препараты
Фармацевтические препараты антитела против К11-связанного полиубиквитина по настоящему изобретению получают, смешивая такое антитело, обладающее требуемой степенью чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980)), в форме лиофилизованных препаратов или водных растворов. Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают, не ограничиваясь ими, буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорил бензалкония; хлорид бензетония; феноловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатообразователи, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы) и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG). Типичные фармацевтически приемлемые носители далее включают диспергаторы интерстициальных лекарственных средств, такие как растворимые нейтрально-активные гиалуронидаза-гликопротеины (sHASEGP), например, растворимые гиалуронидаза-гликопротеины РН-20 человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Определенные типичные sHASEGP и способы их применения, включая rHuPH20, описаны в публикациях патентов США № 2005/0260186 и 2006/0104968. Одним объектом настоящего изобретения является sHASEGP, объединенный с одной или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Типичные лиофилизованные препараты антител описаны в патенте США № 6267958. Водные препараты антител включают препараты, описанные в патенте США № 6171586 и WO 2006/044908, которые содержат гистидин-ацетатный буфер.
Препарат по настоящему изобретению может также содержать несколько активных ингредиентов, необходимых для лечения данного заболевания, предпочтительно, обладающих комплементарными активностями, не оказывающими вредного влияния друг на друга. Например, может быть желательно включить в такой препарат одно или несколько химиотерапевтических средств. Такие активные ингредиенты могут присутствовать в комбинации в количествах, являющихся эффективными для данной цели.
Активные ингредиенты могут быть заключены в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы в коллоидных системах доставки лекарственных средств (таких как, например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методы описаны в публикации Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты пролонгированного действия. Приемлемые препараты препаратов пролонгированного действия включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, которые представляют собой формованные изделия, например, пленки или микрокапсулы.
Препараты, используемые для введения in vivo, обычно являются стерильными. Препараты стерилизуют путем фильтрации через стерильные фильтрующие мембраны.
G. Способы лечения и композиции
В способах лечения могут быть использованы любые антитела против К11-связанного полиубиквитина по настоящему изобретению.
В одном из аспектов настоящее изобретение относится к антителу против К11-связанного полиубиквитина, предназначенному для использования в качестве лекарственного средства. В другом аспекте настоящее изобретение относится к антителу против К11-связанного полиубиквитина, предназначенному для использования при лечении нарушений, связанных с аберрантной регуляцией клеточного цикла (которые включают, не ограничиваясь ими, пролиферативные нарушения, такие как рак, и гипотрофические нарушения, которые включают, не ограничиваясь ими, дегенеративные мышечные нарушения и дегенеративные нервные нарушения). Определенные варианты осуществления изобретения относятся к антителу против К11-связанного полиубиквитина, предназначенному для использования в способе лечения. Определенные варианты осуществления изобретения относятся к антителу против К11-связанного полиубиквитина, предназначенному для использования в способе лечения индивида, страдающего нарушением, связанным с аберрантной регуляцией клеточного цикла, который включает введение индивиду эффективного количества антитела против К11-связанного полиубиквитина. В одном таком варианте осуществления изобретения указанный способ далее включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического средства, например, нижеописанного средства. Другие варианты осуществления изобретения относятся к антителу против К11-связанного полиубиквитина, предназначенному для изменения регуляции клеточного цикла, например, для регулирования скорости развития клеточного цикла. Определенные варианты осуществления изобретения относятся к антителу против К11-связанного полиубиквитина, предназначенному для использования в способе модуляции скорости развития клеточного цикла у индивида, который включает введение указанному индивиду эффективного количества антитела против К11-связанного полиубиквитина для модуляции развития клеточного цикла и регулирования скорости деления клеток. “Индивид” по любому из вышеуказанных вариантов осуществления изобретения предпочтительно является человеком.
В другом аспекте настоящее изобретение относится к использованию антитела против К11-связанного полиубиквитина для приготовления или получения лекарственного средства. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения нарушений, связанных с аберрантной регуляцией клеточного цикла (которые включают, не ограничиваясь ими, пролиферативные нарушения, такие как рак, и гипотрофические нарушения, которые включают, не ограничиваясь ими, дегенеративные мышечные нарушения и дегенеративные нервные нарушения). В другом варианте осуществления изобретения лекарственное средство предназначено для использования в способе лечения нарушения, связанного с аберрантной регуляцией клеточного цикла, который включает введение индивиду, страдающему таким нарушением, эффективного количества лекарственного средства. В одном из вариантов осуществления изобретения указанный способ далее включает введение индивиду эффективного количества по меньшей мере одного дополнительного лекарственного средства, например, нижеописанного средства. В другом варианте осуществления изобретения лекарственное средство предназначено для модуляции скорости развития клеточного цикла. В другом варианте осуществления изобретения лекарственное средство предназначено для использования в способе модуляции скорости развития клеточного цикла у индивида, который включает введение указанному индивиду эффективного количества лекарственного средства для регулирования скорости деления клеток. “Индивид” по любому из вышеуказанных вариантов осуществления изобретения может быть человеком.
Другом аспект настоящего изобретения относится к способу лечения нарушения, связанного с аберрантной регуляцией клеточного цикла. В одном из вариантов осуществления изобретения указанный способ включает введение индивиду, страдающему нарушением, связанным с аберрантной регуляцией клеточного цикла, эффективного количества антитела против К11-связанного полиубиквитина. В одном варианте осуществления изобретения указанный способ далее включает введение индивиду эффективного количества по меньшей мере одного дополнительного лекарственного средства, описанного ниже. “Индивид” по любому из вышеуказанных вариантов осуществления изобретения может быть человеком.
В другом аспекте настоящее изобретение относится к фармацевтическим препаратам, включающие любые антитела против К11-связанного полиубиквитина по настоящему изобретению, например, предназначенным для использования в любых вышеуказанных способах лечения. В одном из вариантов осуществления изобретения фармацевтический препарат включает любые антитела против К11-связанного полиубиквитина по настоящему изобретению и фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтический препарат включает любые антитела против К11-связанного полиубиквитина и по меньшей мере одно дополнительное терапевтическое средство, например, описанное ниже.
Антитела по настоящему изобретению могут быть использованы отдельно или в комбинации с другими лечебными средствами. Например, антитело по настоящему изобретению может быть введено по меньшей мере с одним дополнительным терапевтическим средством. В определенных вариантах осуществления изобретения дополнительное терапевтическое средство является химиотерапевтическим средством.
“Химиотерапевтическое средство” является химическим соединением, используемым при лечении рака. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), СРТ-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая адозелезин, карзелезин и синтетические аналоги бизелезина); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенстерин, преднимустин, трофосфамид, урамустин, нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма 1I и калихеамицин омега I1 (см., например, публикацию Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, в том числе динемицин А; эсперамицин; хромофор неокарциностатин и родственные хромопротеинэнедииновые хромофоры-антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMICIN® (в том числе морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадреналины, такие как аминоглутетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролининовая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина, лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (”Ara-C”); тиотепа; таксоиды, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, NJ), не содержащий кремофора, созданный на основе альбумина препарат паклитаксела в виде наночастиц ABRAXANETM (American Pharmaceutical Partners, Schaumberg, Illinois) и доксетаксел TAXOTERE® (Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейкововин; винорелбин (NAVELBINE®); новатрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты или производные любых из вышеуказанных соединений, а также комбинации двух или более вышеуказанных соединений, такие как CHOP, аббревиатура комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, аббревиатура схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейкововином.
В определение данного термина также входят антигормональные средства, которые регулируют, ослабляют, блокируют или ингибируют действие гормонов, способных стимулировать рост раковой опухоли, и часто применяются в виде системного лечения. Такие средства сами могут быть гормонами. В качестве примеров можно привести антиэстрогены и избирательные модуляторы рецепторов эстрогенов (SERM), включающие, например, тамоксифен (в том числе тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; антипрогестероны; средства, снижающие активность рецепторов эстрогенов (ERD); средства, подавляющие или блокирующие функцию яичников, например, агонисты релизинг-фактора лютеинизирующего гормона (LHRH), такие как LUPRON® и ацетат лейпролида ELIGARD®, ацетат госерелина, ацетат бусерелина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, подавляющие фермент ароматазу, который регулирует продуцирование эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, экземестан AROMASIN®, форместанин, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, в определение химиотерапевтических средств входят бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновая кислота/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®; а также троксацитабин (аналог 1,3-диоксоланнуклеозидцитозина); антисмысловые олигонуклеотиды, в частности, ингибирующие экспрессию генов в сигнальных путях, участвующих в аберрантной пролиферации клеток, такие как, например, РКС-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генотерапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX®; дитозилат лапатиниба (ErbB-2 и низкомолекулярный ингибитор тирозинкиназы EGFR, известный также как GW572016); и фармацевтически приемлемые соли, кислоты или производные любых вышеуказанных соединений.
Вышеописанная комбинированная терапия включает объединенное введение (когда два или более терапевтических средств входят в состав одного или разных препаратов) и раздельное введение, когда антитело по настоящему изобретению может быть введено до, одновременно и/или после введения дополнительного терапевтического средства и/или адъюванта. Антитела по настоящему изобретению могут быть также использованы в комбинации с лучевой терапией.
Антитело по настоящему изобретению (и любое дополнительное терапевтическое средство) может быть введено любым приемлемым способом, включающим парентеральное, внутрилегочное и интраназальное введение, и при желании местное применение, введение в место поражения. Парентеральные вливания включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может быть произведено любым приемлемым способом, например, в виде инъекций, таких как внутривенные или подкожные инъекции, в зависимости от того, является ли введение кратковременным или постоянным. В объем настоящего изобретения входят разные схемы дозирования, которые включают, не ограничиваясь ими, однократное или многократное введение в разные периоды времени, введение ударной дозы вещества и импульсное вливание.
Антитела по настоящему изобретению используют для получения препаратов, дозируют и вводят в соответствии с хорошо известной медицинской практикой. Факторы, учитываемые в данной связи, включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивида, причину нарушения, место доставки агента, способ введения, схему введения и другие факторы, известные лечащим врачам. Антитело необязательно должно входить в состав препарата вместе с одним или несколькими средствами, используемыми в настоящее время для предотвращения или лечения рассматриваемого нарушения. Эффективное количество других средств зависит от количества антитела, присутствующего в препарате, типа нарушения или лечения и других факторов, рассмотренных выше. Указанные средства обычно используют в дозах и в соответствии со спосабами введения, представленными в настоящем описании изобретения, или в количестве примерно 1-99% от указанных доз или в любой дозе и в соответствии с любым способом введения, определенными эмпирически и на основе клинической практики.
Локализация мишени, с которой связывается антитело по настоящему изобретению, может быть учтена при получении и введении антитела. Когда мишенью является внутриклеточная молекула, определенные варианты осуществления изобретения относятся к антителу или его антигенсвязывающему фрагменту, предназначенному для введения в клетку, в которой находится мишень. В одном из вариантов осуществления изобретения антитело по настоящему изобретению может быть экспрессировано внутри клетки в виде интратела. Термин ”интратело”, как используется в настоящем описании, означает антитело или его антигенсвязывающую часть, экспрессированные внутри клетки и способные избирально связываться с молекулой-мишенью, как описано в публикациях Marasco, Gene Therapy 4:11-15 (1997); Kontermann, Methods 34:163-170 (2004); в патентах США № 6004940 и 6329173; публикации заявки на патент США № 2003/0104402 и публикации РСТ № WO2003/077945. Внутриклеточная экспрессия интратела достигается путем введения в клетку-мишень нуклеиновой кислоты, кодирующей требуемое антитело или его антигенсвязывающую часть (при отсутствии лидерной последовательности дикого типа и секреторных сигналов, обычно связанных с геном, кодирующим данное антитело или его антигенсвязывающий фрагмент). Может быть использован любой стандартный метод введения нуклеиновых кислот в клетку, который включает, не ограничиваясь ими, микроинъекцию, баллистическую инъекцию, электропорацию, преципитацию фосфатом кальция, липосомы и трансфекцию ретровирусом, аденовирусом, аденосвязанным вирусом или векторы экспрессии на основе ДНК-вируса коровьей оспы, несущие представляющую интерес нуклеиновую кислоту. В клетку-мишень может быть доставлена одна или несколько нуклеиновых кислот, кодирующих все или часть антитела против полиубиквитина по настоящему изобретению, при этом будет экспрессировано одно или несколько интрател, способных связываться с полиубиквитином внутри клетки и модулировать один или нексколько сигнальных путей клетки, опосредованных полиубиквитином.
Другой вариант осуществления изобретения относится к интернализирующим антителам. Антитела могут обладать определенными свойствами, улучшающими доставку антител в клетки или могут быть модифицированы с приобретением таких свойств. В данной области известны методы создания таких свойств. Например, известен метод катионизации антитела для облегчения его поглощения клетками (см., например, патент США № 6703019). Липофексия или липосомы также могут быть использованы для доставки антитела в клетку. При использовании фрагментов антитела предпочтение обычно отдается наименьшему ингибирующему фрагменту, специфически связывающемуся с доменом связывания белка-мишени. Например, на основании последовательностей вариабельной области антитела могут быть созданы пептидные молекулы, сохраняющие способность связываться с последовательностью белка-мишени. Такие пептиды могут быть синтезированы химическими методами и/или созданы методами рекомбинантных ДНК. См., например, публикацию Marasco et al., Proc. Natl. Acad. Sci. USA 90:7889-7893 (1993).
Введение модулирующих полипептидов в клетки-мишени можно усилить методами, известными в данной области. Например, определенные последовательности, выделенные из Tat белка ВИЧ или белка Antennapedia homeodomain, могут обеспечить эффективное прохождение гетерологичных белков через клеточные мембраны. См., например, публикацию Chen et al., Proc. Natl. Acad. Sci. USA 96:4325-4329 (1999).
Когда связывающаяся мишень локализована в головном мозге, определенные варианты осуществления изобретения относятся к антителу или его антигенсвязывающему фрагменту, способным проникать через гематоэнцефалический барьер. Определенные нейродегенеративные заболевания связаы с повышением проницаемости гематоэнцефалического барьера, благодаря чему антитело или его антигенсвязывающий фрагмент могут легко проникать в головной мозг. В данной области известно несколько методов переноса молекул через неповрежденный гематоэнцефалический барьер, которые включают, не ограничиваясь ими, физические методы, методы на основе липидов и методы на основе рецепторов и каналов.
Физические методы переноса антитела или его антигенсвязывающего фрагмента через гематоэнцефалический барьер включают, не ограничиваясь ими, обход гематоэнцефалического барьера или создание отверстий в гематоэнцефалическом барьере. Методы обхода включают, не ограничиваясь ими, прямую инъекцию в головной мозг (см., например, публикацию Papanastassiou et al., Gene Therapy 9:398-406 (2002); интерстициальное вливание/доставку с усиленной конвекцией (см., например, публикацию Bobo et al., Proc. Natl. Acad. Sci. USA 91: 2076-2080 (1994)) и имплантацию доставляющего устройства в головной мозг (см., например, публикацию Gill et al., Nature Med. 9:589-595 (2003); и Gliadel Wafers™, Guildford Pharmaceutical). Методы создания отверстий в гематоэнцефалическом барьере включают, не ограничиваясь ими, ультразвук (см., например, публикацию патента США № 2002/0038086), повышение осмотического давления (например, путем введения маннита, повышающего осмотическое давление (Neuwelt, E.A., Implication of the Blood-Brain Barrier and its Manipulation, vols. 1&2, Plenum Press, N.Y. (1989))), увеличение проницаемости, например, при помощи брадикинина или усилителя проницаемости А-7 (см., например, патенты США № 5112596, 5268164, 5506206 и 5686416) и трансфекцию нейронов, расширяющих гематоэнцефалический барьер, вместе с векторами, содержащими гены, кодирующие антитело или антигенсвязывающий фрагмент (см., например, публикацию патента США № 2003/0083299).
Методы переноса антитела или антигенсвязывающего фрагмента через гематоэнцефалический барьер на основе липидов включают, не ограничиваясь ими, инкапсуляцию антитела или антигенсвязывающего фрагмента в липосомы, связанные с антителосвязывающими фрагментами, которые связываются с рецепторами на эндотелии сосудов гематоэнцефалического барьера (см., например, публикацию заявки на патент США № 2002/0025313), и заключают антитело или антигенсвязывающий фрагмент в частицы липопротеина низкой плотности (см., например, публикакцию заявки на патент США № 2004/0204354) или полипопротеин Е (см., например, публикацию заявки на патент США № 2004/0131692).
Методы переноса антитела или антигенсвязывающего фрагмента через гематоэнцефалический барьер на основе рецепторов и каналов включают, не ограничиваясь ими, блокаторы глюкокортикоида, повышающие проницаемость гематоэнцефалического барьера (см., например, публикации заявок на патент США № 2002/0065259, 2003/0162695 и 2005/0124533); активацию калиевых каналов (см., например, публикацию заявки на патент США № 2005/0089473); ингибирование транспортеров лекарственного средства АВС (см., например, публикацию заявки на патент США № 2003/0073713); покрытие антител трансферрином и модуляцию активности одного или нескольких рецепторов трансферрина (см., например, публикацию заявки на патент США № 2003/0129186) и катионизацию антител (см., например, патент США № 5004697).
Используемая для профилактики или лечения заболевания соответствующая доза антитела по настоящему изобретению (применяемого отдельно или в комбинации с одним или несколькими другими дополнительными терапевтическими средствами) зависит от типа подлежащего лечению заболевания, типа антитела, тяжести и развития заболевания, введения антитела для профилактики или лечения, предшествующего лечения, истории болезни индивида, реакции на антитело и решения лечащего врача. Антитело по настоящему изобретению вводят индивиду однократно или в несколько приемов. В зависимости от типа и тяжести заболевания первичная доза, вводимая индивиду, может составлять примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг - 10 мг/кг) в виде однократного введения, нескольких раздельных введений или непрерывного вливания. Одна типичная суточная доза может составлять примерно от 1 мкг/кг до 100 мг/кг или больше в зависимости от вышеуказанных факторов. При повторном введении в течение нескольких дней или дольше в зависимосми от состояния индивида лечение может быть продолжено до требуемого подавления симптомов заболевания. Одна типичная доза антитела составляет от около 0,05 мг/кг до около 10 мг/кг. Таким образом, индивиду может быть введена одна или несколько доз, равных примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая комбинация указанных доз). Такие дозы можно вводить через определенные периоды времени, например, один раз в неделю или один раз в три недели (например, так, чтобы индивид получил примерно от двух до двадцати доз или, например, около шести доз антитела). Может быть введена первичная более высокая доза и затем одна или несколько более низких доз. Однако могут быть использованы другие схемы введения. Ход лечения можно легко контролировать при помощи стандартных методов и анализов.
Следует отметить, что любые вышеуказанные препараты могут быть получены при использовании иммуноконъюгата по настоящему изобретению вместо или дополнительно к антителу против К11-связанного полиубиквитина.
Н. Изделия
В одном из аспектов настоящее изобретение относится к изделиям, содержащим вещества, используемые для лечения, профилактики и/или диагностики вышеуказанных нарушений. Изделие включает емкость с этикеткой или вкладышем в упаковку. Приемлемые емкости включают, например, бутылочки, флаконы, шприцы, мешки для внутривенного раствора и т.д. Емкости могут быть изготовлены из разных материалов, таких как стекло или пластик. В емкости находится композиция, которая отдельно или в комбинации с другой композицией может быть эффективно использована для лечения, профилактики и/или диагностики состояния, при наличии стерильного доступа к содержимому емкости (например, емкость может представлять собой мешок для внутривенного раствора или флакон с пробкой, проницаемой для иглы для подкожных инъекций). По крайней мере один активный агент в композиции является антителом по настоящему изобретению. На этикетке или вкладыше должно быть указано, что композиция предназначена для лечения данного состояния. Кроме того, изделие по настоящему изобретению может включать (а) первую емкость, содержащую композицию, содержащую антитело по настоящему изобретению, и (b) вторую емкость, содержащую композицию, включающую цитотоксический агент или терапевтическое средство. Изделие в данном варианте осуществления изобретения может далее включать вкладыш в упаковку с указанием того, что находящиеся в ней композиции могут быть использованы для лечения конкретного состояния. Альтернативно или дополнительно изделие может далее включать вторую (или третью) емкость, содержащую фармацевтически приемлемый буфер, например, бактериостатическую воду для инъекций (BWFI), физиологический раствор с фосфатным буфером, раствор Рингера и раствор декстрозы. Изделие может далее включать другие вещества, желательные с коммерческой точки зрения и с точки зрения пользователя, включающие другие буферы, разбавители, фильтры, иглы и шприцы.
Следует отметить, что любые вышеуказанные изделия могут включать иммуноконъюгат по настоящему изобретению вместо или дополнительно к антителу против К11-связанного полиубиквитина.
III. Примеры
Ниже приведены примеры способов и композиций по настоящему изобретению. Следует отметить, что могут быть выполнены разные другие варианты осуществления изобретения на основании общего описания, приведенного выше.
Пример 1. Выделение и исследование антител против К11-связанного полиубиквитина
Антитела против К11-связанного полиубиквитина были выделены стандартными методами отображения на фаге с использованием нескольких разных библиотек. Полноразмерный К11-связанный диубиквитин, синтезированный ферментативным методом (Michael Rape's lab, UC Berkeley), иммобилизировали на 96-луночных иммуноплашетах Maxisorb (NUNC). Планшеты сенсибилизировали в течение ночи при 4°С 5 мкг/мл К11-связанного диубиквитинв в 50 мМ натрий-карбонатного буфера, рН 9,6. Сенсибилизированные планшеты блокировали 200 мкл/лунку 2,5% молока в PBS, содержащем 0,05% твина 20 (PBST). Непроцессированную библиотеку фагов осаждали из исходного раствора глицерина 1/5 объема 20% PEG/2,5 M NaCl, ресуспендировали в 2,5% молока/PBST и инкубировали при 25°С в течение одного часа. Ресуспендированный фаг наносили (100 мкл/лунку) на блокированные планшеты и инкубировали, встряхивая, при 25°С в течение четырех часов. После связывания планшеты десять раз промывали PBST и фаг элюировали 150 мкл/лунку 50 мМ HCl/500 мМ KCl, встряхивая в течение 30 минут при 25°С. Элюат нейтрализовали 150 мкл/лунку 1М трис-буфера, рН 7,5, и размножали в E. coli XL-1-Blue (Stratagene) с добавлением фага-хелпера М13К07.
Амплифицированный фаг использовали для выполнения дополнительных циклов отбора антитела против К11-связанного диубиквитина. При выполнении циклов со второго по четвертый растворимый моноубиквитин или полиубиквитин с разными связями добавляли к фагу для встречного отбора. Во втором цикле использовали 10 мкг/мл растворимого моноубиквитина (Boston Biochem). В третьем и четвертом циклах использовали 10 мкг/мл каждого растворимого моноубиквитина, линейного диубиквитина, К48-связанный полиубиквитин 2-7 и К63-связанный полиубиквитин с 2-7 цепями (все вещества компании Boston Biochem).
Девяносто шесть отдельных клонов, полученных в результате выполнения третьего и четвертого циклов сортировки из каждой библиотеки выращивали на 96-луночном планшете в 1 мл бульона 2YT, содержащего 50 мкл/мл карбенициллина и 1010 фага/мл фага-хелпера М13К07, при 37°С в течение ночи при встряхивании. Клетки разрушали, супернатанты исследовали при помощи высокоэффективного анализа фага методом ELISA в отношении связывания с К11-связанным диубиквитином, моноубиквитином, линейным диубиквитином, К48-связанным полиубиквитином 2-7, К63-связанным полиубиквитином 2-7, антителом против gD (Genentech) или несенсибилизированной лункой. Все библиотеки отображения на фаге Fab-фрагментов содержали карбоксиконцевую метку gD в легкой цепи, позволяющую определить уровень отображения при исследовании связывания антитела против gD. Панель убиквитиновых белков иммобилизировали на 384-луночных иммунопланшетах Maxisorb (NUNC), как было указано выше. Планшеты сенсибилизировали при 4°С 2 мкг/мл каждого убиквитинового белка в 50 мМ натрий-карбонатного буфера, рН 9,6. Сенсибилизированные планшеты блокировали, встряхивая, 60 мкл/лунку 2,5% молока в PBST в течение одного часа при 25°С. Через один час блокирующий буфер удаляли и добавляли 20 мкл/лунку PBST и 10 мкл/лунку супернатанта фага. Планшеты инкубировали, встряхивая, при 25°С в течение одного часа. Планшет шесть раз промывали PBST. Для обнаружения связывания фага было использовано тридцать микролитров разведенного в отношении 1:5000 вторичного антитела против М13, конъюгированного с пероксидазой из хрена (GE Healthcare), в PBST. После промывки связанное вторичное антитело обнаруживали, используя субстрат ТМВ (KPL), гасили равным объемом 1 М раствора фосфорной кислоты и считывали спектрофотометрические данные при длине волны 450 нм.
Непроцессированную библиотеку отображения на фаге антипептидных Fab-фрагментов подвергали четырем циклам сортировки в отношении вышеуказанного очищенного К11-связанного диубиквитина (UC Berkeley), как было описано выше. Использованная бибилотека отображения на фаге антипептидных Fab-фрагментов содержала рандомизированные аминокислоты во всех трех CDR-областях тяжелой цепи и CDRL3 легкой цепи и была создана на основе остовной области модифицированного гуманизированного антитела 4D5 при наличии более длинной области CDRL1 и с возможностью изменения последовательности CDRL2. После выполнения четырех циклов сортировки не было обнаружено увеличения числа антител, специфически связывающихся с К11-связанным диубиквитином.
Затем непроцессированную библиотеку отображения на фаге Fab-фрагментов YSGX подвергали четырем циклам сортировки в отношении вышеуказанного очищенного К11-связанного диубиквитина (UC Berkeley), как было описано выше. Использованная библиотека отображения на фаге Fab-фрагментов YSGX содержала рандомизированные аминокислоты во всех трех CDR-областях тяжелой цепи и CDRL3 легкой цепи (см. опубликованную заявку на патент США № 2005-0106667 и публикацию Fellouse et al., 2007, J. Mol. Biol. 373:924-40) и была создана на основе гуманизированного антитела 4D5. После выполнения четырех циклов сортировки было обнаружено лишь умеренное трехкратное увеличение числа антител, связывающихся с К11-связанным диубиквитином. Все указанные антитела характеризовались слабым сигналом связывания с К11-связанным диубиквитином при наличии дополнительного слабого связывания с другими формами убиквитина и полиубиквитина.
И наконец, непроцессированную библиотеку отображения на фаге Fab-фрагмента VH подвергали четырем циклам сортировки в отношении вышеуказанного К11-связанного диубиквитина. Указанная библиотека отображения на фаге Fab-фрагментов VH содержала рандомизированные аминокислоты во всех трех CDR-областях тяжелой цепи (см. опубликованную заявку на патент США № US20050119455 и публикацию Lee C.W. et al., 2004, JMB 340:1073-93) и была создана на основе гуманизированного антитела 4D5. После выполнения четырех циклов сортировки было обнаружено двадцатичетырехкратное увеличение числа связывающихся антител. В результате сортировки данной библиотеки были обнаружены сильные антитела, специфичные к К11-связанному диубиквитину. Тяжелые цепи клонов из библиотеки VH, полученных после третьего и четвертого циклов сортировки, секвенировали. Исходя из структуры библиотеки VH предполагалось, что последовательности HVR H1, HVR H2 и HVR H3 являются специфичными к клону, в то время как последовательности остовной области тяжелой цепи и вся последовательность легкой цепи (последовательности HVR и остовных областей) являются инвариантными. Последовательность HVR L1 представляла собой RASQDVSTAVA (SEQ ID NO:2), последовательность CDR L2 представляла собой SASFLYS (SEQ ID NO:3) и последовательность HVR L3 представляла собой QQSYTTPPT (SEQ ID NO:4) (фигура 1А). Было идентифицировано шесть уникальных последовательностей тяжелой цепи (фигура 1В), которым были присвоены обозначения А3, А6, А9, В5, F5 и G3. Клон G3 сильнее всего связывался с К11-связанным диубиквитином и был наиболее специфичным по результатам вышеописанного анализа ELISA; данный анализ показал отсутствие связывания с моноубиквитином, линейным диубиквитином, К48-связанным полиубиквитином 2-7 или К63-связанным полиубиквитином 1-7 (фигура 2). Консенсусные аминокислотные последовательности гипервариабельных участков (HVR) тяжелых цепей указанных шести Fab-фрагментов представляли собой: HVR H1: X1 X2 X3 X4 Ile X5 (SEQ ID NO:24), где Х1 выбирают из серина и треонина, Х2 выбирают из аспарагина, аспарагиновой кислоты, серина и глицина, Х3 выбирают из тирозина, серина и треонина, Х4 выбирают из триптофана, аспарагиновой кислоты, глицина и тирозина и Х5 выбирают из серина и гистидина; HVR H2: Х6 Х7 Ile X8 P X9 G X10 T X11 (SEQ ID NO:25), гдк Х6 выбирают из глицина и аланина, Х7 выбирают из аспарагиновой кислоты, триптофана, глицина, глутаминовой кислоты и валина, Х8 выбирают из серина, тирозина и аспарагина, Х9 выбирают из аспарагиновой кислоты, аланина, гистидина и аспарагина, Х10 выбирают из тирозина и серина и Х11 выбирают из тирозина, аспарагиновой кислоты и аспарагина; и HVR H3: X12 X13 X14 X15 X16 X17 X18 X19 X20 X21 D (SEQ ID NO:26), где Х12 выбирают из аргинина и лизина, Х13 выбирают из глутаминовой кислоты, глицина, аспарагиновой кислоты и пролина, Х14 выбирают из серина, изолейцина, валина и триптофана, Х15 выбирают из триптофана, глицина, тирозина и фенилаланина, Х16 выбирают из триптофана, тирозина, лейцина, глицина и фенилаланина, Х17 выбирают из серина, тирозина, фенилаланина и глицина, Х18 выбирают из аланина, фенилаланина, тирозина и глицина или данная аминокислота отсутствует, Х19 выбирают из триптофана, глицина, аланина и тирозина или данная аминокислота отсутствует, Х20 является валином или отсутствует и Х21 выбирают из метионина и фенилаланина.
А. Продуцирование Fab-фрагмента клона G3
Клоны из библиотеки отображения на фаге Fab-фрагментов VH были экспрессированы под контролем промотора щелочной фосфатазы (PhoA) E. coli. Легкая цепь и тяжелая цепь содержали аминоконцевую бактериальную сигнальную последовательность stII, обеспечивающую секрецию в E. coli, и были экспрессированы из одного фагмидного вектора. Карбоксильный конец тяжелой цепи был гибридизирован в рамке считывания с лейциновой застежкой-молнией с последующим генным продуктом III (gpIII) бактериофага М13, делая возможным отображение двухвалентного Fab-zip-фрагмента на фаге. Для экспрессии растворимого Fab-фрагмента в фагмид G3 был введен стоп-кодон между концом константного домена СН1 Fab-фрагмента и началом лейциновой застежки-молнии. При помощи набора для сайтнаправленного мутагенеза QuickChange® Lightning (Stratagene) в стоп-кодон были введены мутагенные олигонуклеотиды RF6471-1 (TCTTGTGACAAAACTCACTAATAAC GCATGAAACAGCTAGAGG) (SEQ ID NO:33) и RF6471-2 (CCTCTAGCTGTTTCATGCGTTATTAGTGAGTTTTGTCACAAGA) (SEQ ID NO:34). Полученную растворимую плазмиду, экспрессирующую Fag-фрагмент клона G3, трансформировали в штамм 62А7 E. coli (Genentech) и культивировали на твердом агаре, содержащем карбенициллин. Одну колонию использовали для инокуляции 25 мл бульона 2YT, содержащего 50 мкг/мл карбенициллина. Культуру выращивали в течение ночи при 37°С и 5 мл культуры использовали для инокуляции 500 мл полной среды C.R.A.P. (3,57 г (NH4)2SO4, 0,71 г цитрата натрия 2Н2О, 1,07 г KCl, 5,36 г дрожжевого экстракта (сертифицированного), 5,36 г гиказы SF (Sheffield), рН доводили до 7,3, добавляя КОН, и объем доводили до 872 мл, добавляя ультрачистую, обработанную в автоклаве воду, охлажденную до 55°С, к которой добавляли (на литр) 110 мл 1 М раствора MOPS, рН 7,3, 11 мл 50% глюкозы и 7 мл 1 М раствора MgSO4) с 50 мкл/мл карбенициллина. Культуры выращивали, встряхивая, при 30°С в течение 24 часов. Клетки собирали центрифугированием и дебрисы хранили при -20°С. Fab-фрагмент очищали, ресуспендируя дебрис в 35 мл холодного промывочного буфера (физиологический раствор с фосфатным буфером (PBS)+150 мМ NaCl), содержащего 10 мкг/мл ДНКазыI (Invitrogen), 0,2 мг/мл лизоцима (USB) и 1 мМ фенилметилсульфонилфторида (Calbiochem). Осадок ресуспендировали при интенсивном перемешивании в течение 45 минут при 25°С. Дебрис осаждали центрифугированием и лизат вводили в 1 мл колонку с протеином А-сефарозой (GE Healthcare), предварительно уравновешенную холодным промывочным буфером. Колонку промывали 50 мл холодного промывочного буфера, элюировали 3 мл 0,1 М раствором уксусной кислоты и нейтрализовали 150 мкл 2 М Tris, рН 11,0. Fab-фрагмент концентрировали, используя фильтрующую центрифугу Amicon Ultra-15 (отсечение молекулярной массы 10 кДа, Millipore). Полученную концентрацию Fab-фрагментов определяли спектрофотометрически (1 OD280 = 1,5 мг/мл).
В. Анализ Fab-фрагмента клона G3
Сродство Fab-фрагмента клона G3 определяли методом резонанса поверхностных плазмонов (SPR) в устройстве BIACORE™ 3000 (GE Healthcare). Примерно 60 резонансных единиц (RU) К11-связанного диубиквитина (Genentech), К48-связанного диубиквитина (Boston Biochem) и К63-связанного диубиквитина (Boston Biochem) иммобилизировали на отдельных проточных кюветах чипа СМ5 в соответствии с инструкцией связывания амином, предоставленной производителем. Fab-фрагмент клона G3 в виде двукратных серийных разведений (0,5-500 нМ) в 10 мМ HEPES, рН 7,2, 150 мМ NaCl и 0,01% твина-20 (HBST) впрыскивали (60 мкл при скорости потока 30 мкл/минуту) в каждую проточную кювету, используя HBST в качестве рабочего буфера. Регистрировали сигнал для каждой проточной кюветы и вычитали эталонный сигнал для неконъюгированной и блокированной проточной кюветы. По истечении периода диссоциации, равного восьми минутам, поверхность чипа регенерировали 20 мкл 10 мМ HCl. Данные соотносили с моделью связывания 1:1 со смещающейся базовой линией. Константы скорости реакции и константы связывания вычисляли одновременно при помощи нелинейного регрессионного анализа, используя программное обеспечение, предоставленное производителем; значения указанных параметров показаны в таблице 2, верхний ряд. В таблице 2 представлены среднее значение (Avg.) и стандартное отклонение (Std. dev.) для трех измерений констант скорости реакции (ka и kd) и константы связывания (KD) Fab-фрагмента клона G3. Клон G3 связывается с К11-связанным диубиквитином с константой связывания, равной 105 нМ. Не было обнаружено связывания с К48-связанным диубиквитином или К63-связанным диубиквитином.
Свойства связывания Fab-фрагментов и антител против К11-связанного полиубиквитина
Связывание очищенного Fab-фрагмента клона G3 с панелью убиквитиновых белков исследовали при помощи анализа ELISA. К11-связанный диубиквитин (UC Berkeley), моноубиквитин (Boston Biochem), линейный диубиквитин (Boston Biochem), К48-связанный диубиквитин (Boston Biochem) и К63-связанный диубиквитин (Boston Biochem) иммобилизировали на 96-луночных иммунопланшетах Maxisorb. Планшеты сенсибилизировали при 25°С в течение двух часов 5 мкг/мл каждого белка в 50 мМ натрий-карбонатного буфера, рН 9,6, при встряхивании. Сенсибилизированные планшеты блокировали 200 мкл/лунку 2,5% молока в PBST, встряхивая в течение одного часа при 25°С. Производили двенадцать двукратных серийных разведений Fab-фрагмента клона G3 в 2,5% молока в PBST от 1,0 мкМ до 0,5 нМ. Через один час блокирующий буфер удаляли и добавляли 100 мкл/лунку Fab-фрагмента клона G3, полученного в результате каждого разведения, и инкубировали, встряхивая, при 25°С в течение одного часа. Планшеты промывали 12 раз PBST при помощи устройства для мойки планшетов. Для обнаружения связывания Fab-фрагмента использовали HRP-конъюгированное вторичное антитело, специфичное к антителу против легкой каппа-цепи человека (Sigma Aldrich), разведенное в отношении 1:5000 в PBST. Добавляли 100 мкл/лунку разведенного вторичного антитела и планшет инкубировали, встряхивая, при 25°С в течение 30 минут. Затем планшет 12 раз промывали PBST при помощи устройства для мойки планшетов и два раза промывали PBS вручную. Связанное вторичное антитело обнаруживали при помощи субстрата ТМВ (KPL) и гасили равным объемом 1 М раствора фосфорной кислоты. Значение оптической плотности считывали при длине волны 450 нм. Fab-фрагмент клона G3 связывался в зависимости от концентрации только с К11-связанным диубиквитином и не связывался с моноубиквитином, линейным диубиквитином, К48-связанным диубиквитином или К63-связанным диубиквитином (фигура 3А). Таким образом, клон G3 является высокоспецифичным к К11-связанному диубиквитину по результатам анализа ELISA.
Fab-фрагмент клона G3 далее исследовали при помощи конкурентного анализа ELISA, определяя значение IC50 для получения еще одной оценки сродства связывания. Получали исходный титр для анализа ELISA с целью определения концентрации Fab-фрагмента, при которой должен быть достигнут сигнал OD450=0,5. К11-связанный диубиквитин (Genentech) иммобилизировали на 96-луночных иммунопланшетах Maxisorb в течение ночи при 4°С в концентрации 1 мкг/мл в 50 мМ натрий-карбонатного буфера, рН 9,6. Сенсибилизированные планшеты блокировали 200 мкл/лунку 2,5% молока в PBST, встряхивая в течение одного часа при 25°С. Производили двенадцать двукратных серийных разведений Fab-фрагмента клона G3 в 2,5% молока в PBST от 1 мкМ до 0,5 нМ. Через один час блокирующий буфер удаляли, добавляли 100 мкл/лунку Fab-фрагмента клона G3, полученного в результате каждого разведения, и инкубировали, встряхивая, при 25°С в течение 15 минут. Затем планшет шесть раз промывали PBST при помощи устройства для мойки планшетов. Для обнаружения связывания Fab-фрагмента использовали HRP-конъюгированное вторичное антитело, специфичное к антителу козы против Fab-фрагмента человека (Sigma Aldrich) в PBST. Добавляли 100 мкл/лунку разведенного вторичного антитела и планшет инкубировали, встряхивая, при 25°С в течение 30 минут. Затем планшет 12 раз промывали PBST при помощи устройства для мойки планшетов и два раза промывали PBS вручную. Связанное вторичное антитело обнаруживали при помощи субстрата ТМВ (KRL) и гасили равным объемом 1 М раствора фосфорной кислоты. Значение оптической плотности считывали при длине волны 450 нм. Концентрация Fab-фрагмента, при которой OD450 = 0,5, была равна 94 нМ. К11-связанный диубиквитин с двукратным серийным разведением и 94 нМ Fab-фрагмента клона G3 в 2,5% молока в PBST инкубировали, перемешивая, при 25°С в течение одного часа. Количество несвязанного Fab-фрагмента при каждой концентрации К11-связанного диубиквитина измеряли, инкубируя смеси на 96-луночном иммунопланшете Maxisorb, который сенсибилизировали 1 мкг/мл К11-связанного диубиквитина и блокировали 2,5% молока в PBST. Смесь Fab/К11 инкубировали на планшете, встряхивая в течение 15 минут при 25°С. Затем планшет шесть раз промывали PBST при помощи устройства для мойки планшетов. Для обнаружения связывания Fab-фрагмента использовали HRP-конъюгированное вторичное антитело, специфичное к антителу козы против Fab-фрагмента человека (Sigma Aldrich), в PBST. Добавляли 100 мкл/лунку разведенного вторичного антитела и планшет инкубировали, встряхивая, при 25°С в течение 30 минут. Затем планшет 12 раз промывали PBST при помощи устройства для мойки планшетов и два раза промывали PBS вручную. Связанное вторичное антитело обнаруживали при помощи субстрата ТМВ (KRL) и гасили равным объемом 1 М раствора фосфорной кислоты. Значение оптической плотности считывали при длине волны 450 нм. Строили график оптической плотности в зависимости от концентрации К11-связанного диубиквитина, на котором показано, что IC50 равно 75 нМ (фигура 3В). Полученный результат сопоставим со значением KD, равным 105 нМ, которое было определено при выполнении вышеописанного анализа резонанса поверхностных плазмонов (SPR).
Способность Fab-фрагмента клона G3 специфически связываться с К11-связанным диубиквитином (UC Berkeley), моноубиквитином (Boston Biochem), линейным диубиквитином (Boston Biochem), К48-связанным диубиквитином (Boston Biochem) и К63-связанным диубиквитином (Boston Biochem) также исследовали при помощи вестерн-блоттинга. Один мкг каждого белка в однократном буфере LDS (Invitrogen) с восстановителем нагревали при 70°С в течение десяти минут и исследовали на 1,0 мм гелях NuPAGE с 4-12% бис-трис-буфера в буфере MES (Invitrogen) в двух одинаковых экспериментах. Один гель окрашивали кумассии голубым для обнаружения всех белков. Другой гель переносили методом мокрого переноса на один час при постоянном напряжении 30 В в 10% метанола и однократном буфере для переноса NuPAGE (Invitrogen) на 0,2 мкм нитроцеллюлозы (Invitrogen). Сайты неспецифического связывания на мембране блокировали путем инкубации при встряхивании в 5% молока в PBST в течение одного часа при 25°С. Затем мембрану инкубировали, встряхивая, в 5 мкг/мл Fab-фрагмента G3 в 5% молока в PBST в течение 1,5 часа при 25°С. Мембрану трижды промывали в PBST при встряхивании. Fab-фрагмент G3 обнаруживали, инкубируя мембрану с HRP-конъюгированным вторичным антителом, специфичным к антителу козы против Fab-фрагмента человека (Sigma Aldrich), при встряхивании в 5% молока в PBST в течение одного часа при 25°С. Затем мембрану трижды промывали в PBST и один раз в PBS. Вторичное антитело обнаруживали при помощи хемилюминесцентного субстрата Super Signal West Pico (Pierce Biotechnology) с последующим экспонированием блотов на пленке. Обнаруженный Fab-фрагмент клона G3 связывался только с К11-связанным диубиквитином и не связывался с моноубиквитином, линейным диубиквитином, К48-связанным диубиквитином или К63-связанным диубиквитином (см. фигуру 3С). Таким образом, Fab-фрагмент клона G3 является высокоспецифичным к К11-связанному диубиквитину также при выполнении вестерн-блоттинга.
Пример 2. Созревание аффинности Fab-фрагмента, специфичного к К11-связи
А. Превращение фагмида G3 в отображение моновалентного Fab-фрагмента и создание матрицы стоп-кодона
Фагмидный клон G3 из библиотеки VH превращали из двухвалентного Fab-zip-фрагмента в отображение моновалентного Fab-фрагмента в целях созревания аффинности. Лейциновую застежку-молнию между концом СН1 константного домена и gpIII удаляли путем мутагенеза Кункела (см. публикацию Kunkel, Proc. Natl. Acad. Sci. USA 82:488 (1985)). Одновременно вводили стоп-кодон ТАА в любую область CDR L1, CDR L2, CDR L3, CDR H3 или в обе CDR-области L3 и Н3 (в результате чего были соответственно получены матрицы стоп-кодона L1, L2, L3, H3 и L3/H3) для синтеза библиотеки. Стоп-кодоны сообщают вариабельность конкретной петле CDR, требуя репарации стоп-кодона для экспрессии и отображения на фаге непроцессированного Fab-фрагмента. Мутагенный олигонуклеотид F220-delzip (TCTTGTGACAAAACTCACAGTGGCGGTGGCTCTGGT) (SEQ ID NO:5) объединяли отдельно со всеми указанными ниже мутагенными олигонуклеотидами стоп-кодонов и 1 мкг ДНК Кункела фагмидного клона G3. Мутагенный олигонуклеотид стоп-кодона CDR L1, использованный для введения стоп-кодона ТАА в положение 24 (нумерация Kabat) CDR L1 легкой цепи, представлял собой 4D5LC1.stop (GTCACCATCACCTGCTAAGCCAGTCAGGATGTG) (SEQ ID NO:36). Мутагенный олигонуклеотимд стоп-кодона CDR L2, использованный для введения стоп-кодона ТАА в положение 50 (нумерация Kabat) CDR L2 легкой цепи представлял собой 4D5LC2.stop (GAAGCTTCTGATTTACTAAGCATCCTTCCTCTAC) (SEQ ID NO:37). Мутагенный олигонуклеотид стоп-кодона CDR L3, использованный для введения стоп-кодона ТАА в положение 89 (нумерация Kabat) CDR L3 легкой цепи представлял собой 4D5LC3.stop (GCAACTTATTACTGTTAACAATCTTATACTACTC) (SEQ ID NO:38). Мутагенный олигонуклеотид стоп-кодона CDR H3, использованный для введения стоп-кодона ТАА в положение 98 (нумерация Kabat) CDR H3 тяжелой цепи представлял собой VH5CDRH3:413Vh5SRo6 (GAGGACACTGCCGTCTATTATTGTGCTCGTGAGGCCTCGTAACTGCCCCCCTACGTTATGGACTACTGGGGTCAAGGAACACTAGTC) (SEQ ID NO:39). Полученные матрицы стоп-кодона фагмидного клона моновалентных Fab-фрагментов были использованы для создания библиотеки созревания аффинности.
В. Создание библиотеки созревания аффинности
Были использованы два метода созревания аффинности. В соответствии с первым методом были созданы библиотеки с вариабельностью аминокислот только в легкой цепи. Указанные библиотеки ”легких цепей” делали возможной легкую рандомизацию в любом положении CDR легкой цепи, как описано ниже. В соответствии со вторым методом были созданы библиотеки с вариабельностью аминокислот в CDR-областях тяжелых и легких цепей в разных комбинациях. Указанные библиотеки ”тяжелых цепей” характеризовались вариабельностью аминокислот, обнаруженной в природных антителах человека, или легкой рандомизацией в основном поверхностных остатков, как описано ниже.
Все библиотеки были созданы путем мутагенеза Кункела (см. публикацию Kunkel, Proc. Natl. Acad. Sci. USA 82:488 (1985)). В случае легкой рандомизации были синтезированы вырожденные олигонуклеотиды, в которых остаток дикого типа сохранялся в течение первых 50% времени и в течение последующих 50% времени был кодирован один из оставшихся 19 аминокислот. Для достижения легкой рандомизации были созданы олигонуклеотиды, в которых определенные положения нуклеотидов в течение 70% времени занимало указанное основание и в течение 10% времени занимало одно из трех других оснований (Gallop et al., J. Med. Chem. 37:1233 (1994)). Для олигонуклеотидов, в которых такая легкая рандомизация имела место в положении определенного основания, наличие легкой рандомизации указано числом в положении данного основания. Число ”5” показывает, что основание аденин находится в данном положении 70% времени, в то время как каждое из оснований гуанин, цитозин и тимин находится в данном положении 10% времени. Аналогичным образом число ”6” относится к гуанину, “7” относится к цитозину и ”8” относится к тимину, где кажое из трех других оснований присутствует только в течение 10% времени. В случае сильной рандомизации были синтезированы вырожденные олигонуклеотиды, в которых допускалась вариабельность аминокислот, обнаруженных в определенных положениях природных антител человека. В данном случае были использованы вырожденные кодоны, в которых буква ”R” кодирует гуанин или аденин, ”Y” кодирует тимин или цитозин, ”M” кодирует аденин или цитозин, ”К” кодирует гуанин или тимин, ”S” кодирует гуанин или цитозин, ”W” кодирует аденин или тимин, ”H” кодирует аденин, цитозин или тимин, ”B” кодирует гуанин, тимин или цитозин, ”V” кодирует гуанин, цитозин или аденин, ”D” кодирует гуанин, аденин или тимин и ”N” кодирует гуанин, аденин, цитозин или тимин.
Были созданы четыре библиотеки ”легких цепей”, обозначенные L1, L2, L3 и L1/L2/L3. Библиотека L1 занимала положения 24-34 (нумерация Kabat) слабо рандомизированной легкой цепи. Для создания библиотеки путем мутагенеза Кункела был использован олигонуклеотид L1
(GATAGGGTCACCATCACCTGC768676567756658686567577676686676T GGTATCAACAGAAACCAGGA) (SEQ ID NO:40) и 20 мкг ДНК Кункела матрицы стоп-кодона L1 (описанной в примере 2А). Библиотека L2 занимала положения 50-56 (нумерация Kabat) слабо рандомизированной легкой цепи. Для создания библиотеки путем мутагенеза Кункела был использован мутагенный олигонуклеотид L2
(AAAGCTCCGAAGCTTCTGATTTAC567676567887786857567GGAGTCCCTTCTCGCTTCTCT) (SEQ ID NO:41) и 20 мкг ДНК Кункела матрицы стоп-кодона L2 (описанной в примере 2А). Библиотека L3 занимала положения 89-97 (нумерация Kabat) слабо рандомизированной легкой цепи. Для создания библиотеки путем мутагенеза Кункела был использован мутагенный олигонуклеотид L3
(GACTTCGCAACTTATTACTGT756756567857577577776776577TTCGGACAGGGTACCAAGGTG) (SEQ ID NO:42) и 20 мкг ДНК Кункела матрицы стоп-кодона L3 (описанной в примере 2А). Библиотека L1/L2/L3 занимала положения 24-34, 50-56 и 89-97 (нумерация Kabat) слабо рандомизированной легкой цепи. Для создания библиотекм путем мутагенеза Кункела были использованы вышеописанные мутагенные олигонуклеотиды L1 (SEQ ID NO:40), L2 (SEQ ID NO:41) и L3 (SEQ ID NO:42) и 20 мкг ДНК Кункела матрицы стоп-кодона L3 (описанной в примере 2А).
Были созданы шесть библиотек ”тяжелых цепей”, обозначенные L1/L2/L3hard, L3/H1/H2, L3/H3, L1/H3, H2/H3 и Н3. Библиотека L1/L2/L3hard занимала положения 28-33, 50, 53, 55, 91-94 и 96 (нумерация Kabat) сильно рандомизированной легкой цепи, допуская вариабельность аминокислот, обнаруженных в указанных положениях природных антител человека. Мутагенные олигонуклеотиды L1 F111-L1 (ACCTGCCGTGCCAGTCAGRDTRKTRVWANWTHTGTAGCCTGGTATCAACAGAAAC) (SEQ ID NO:43) и F202-L1
L1 (ACCTGCCGTGCCAGTCAGRDTRKTRVWANW THTCTGGCCTGGTATCAACAGAAAC) (SEQ ID NO:44) смешивали в отношении 1:2, мутагенные олигонуклеотиды L2 F201-L2 L2 (CCGAAGCTTCTGATTTACKBGGCATCCAVCCTCTACTCTGGAGTCCCT) (SEQ ID NO:45) и F203-L2
(CCGAAGCTTCTGATTTACKBGGCATCCAVCCTCGMATCTGGAGTCCCTTCTCGC) (SEQ ID NO:46) смешивали в отношении 1:1 и мутагенные олигонуклеотиды L3 F133a (GCAACTTATTACTGTCAGCAATMTDMCRVT NHTCCTYKGACGTTCGGACAGGGTACC) (SEQ ID NO:47), F133b (GCAACTTATTACTGTCAGCAATMTDMCRVTNHTCCTTWTACGTTCGGACAGGGTACC) (SEQ ID NO:48), F133c (GCAACTTATTACTGTCAGCAASRTDMCRVTNHTCCTYKGACGTTCGGACAG GGTACC) (SEQ ID NO:49), F133d (GCAACTTATTACTGTCAGCAASRTDMCRVTNHT CCTTWTACGTTCGGACAGGGTACC) (SEQ ID NO:50) смешивали в отношении 1:1:1:1. Для создания библиотеки путем мутагенеза Кункела использовали равные количества каждой из указанных смесей и 20 мкг ДНК Кункела матрицы стоп-кодона L3 (описанной в примере 2А).
Библиотека L3/H1/H2 занимала положения 91-94, 96 (нумерация Kabat) легкой цепи и положения 30-32, 50, 52 (но не 52а), 53 и 54 (нумерация Kabat) слабо рандомизированной тяжелой цепи. Мутагенные олигонуклеотиды L3 F563-L3soft
(ACTTATTACTGTCAGCAA878857577577CCT777ACGTTCGGACAGGGTACC) (SEQ ID NO:51), F564-L3soft2 (ACTTATTACTGTCAGCAA878857577577CCTTWTACGTTCGGACAGGGTACC) (SEQ ID NO:52) и F565-L3soft3 (ACTTATTACTGTCAGCAA878857577577CCTYKGACGTTCGGACAGGGTACC) (SEQ ID NO:53) смешивали в отношении 1:0,5:1. Для создания библиотеки путем мутагенеза Кункела использовали равные количества смеси олигонуклеотидов L3 и мутагенные олигонуклеотиды G3CDRH1soft (GCAGCTTCTGGCTTCACCTTC878558878TATATTAGCTGGGTGCGTCAG) (SEQ ID NO:54) и G3CDRH2soft (GGCCTGGAATGGGTTGCT668ATT558CCT558668GGTTATACTTACTATGCCG) (SEQ ID NO:55) и 20 мкг ДНК Кункела матрицы стоп-кодона L3 (описанной в примере 2А).
Библиотека L3/H3 занимала положения 91-94, 96 (нумерация Kabat) легкой цепи и положения 98-100 и 100b (нумерация Kabat) слабо рандомизированной тяжелой цепи. Вышеописанные мутагенные олигонуклеотиды L3 F563-L3soft (SEQ ID NO:51), F564-L3soft2 (SEQ ID NO:52) и F565-L3soft (SEQ ID NO:53) смешивали в отношении 1:0,5:1. Для создания библиотеки путем мутагенеза Кункела использовали равные количества смеси олигонуклеотидов L3 и мутагенный олигонуклеотид G3CDRH3soft
(GTCTATTATTGTGCTCGTGAGTGGTAC888668668TAC688ATGGACTACTGGGGTCAAGGAACC) (SEQ ID NO:56) и 20 мкг ДНК Кункела матрицы стоп-кодона L3/H3 (описанной в примере 2А).
Библиотека L1/H3 занимала положения 28-33 (нумерация Kabat) сильно рандомизированной легкой цепи, допуская вариабельность аминокислот, обнаруженных в указанных положениях природных антител человека, и положения 98-100 и 100b (нумерация Kabat) слабо рандомизированной тяжелой цепи. Мутагенные олигонуклеотиды L1 F111-L1 (SEQ ID NO:43) и F202-L1 (SEQ ID NO:44) смешивали в отношении 1:2. Для создания библиотеки путем мутагенеза Кункела использовали равные количества смеси олигонуклеотидов L1 и мутагенный олигонуклеотид G3CDRH3soft (SEQ ID NO:56) и 20 мкг ДНК Кункела матрицы стоп-кодона L1 (описанной в примере 2А).
Библиотека Н2/Н3 занимала положения 50, 52 (но не 52а), 53, 54, 98-100 и 100b (нумерация Kabat) слабо рандомизированной тяжелой цепи. Для создания библиотеки путем мутагенеза Кункела использовали равные количества мутагенных олигонуклеотидов G3CDRH2soft и G3CDRH3soft (SEQ ID NO:55 и 56) и 20 мкг ДНК Кункела матрицы стоп-кодона Н3 (описанной в примере 2А).
Библиотека Н3 занимала положения 98-100 и 100b (нумерация Kabat) слабо рандомизированной тяжелой цепи. Для создания библиотеки путем мутагенеза Кункела использовали мутагенный олигонуклеотид G3CDRH3soft (SEQ ID NO:56) и 20 мкг ДНК Кункела матрицы стоп-кодона Н3 (описанной в примере 2А).
Реакции мутагенеза выполняли методом электропорации в электрокомпетентных клетках E. coli XL1-Blue (Stratagene) и культивировали, встряхивая, в 25 мл среды SOC в течение 45 минут при 37°С. Удаляли двадцать микролитров, вещества, подвергнутые десятикратным серийным разведениям, культивировали на твердых агаровых пластинках, содержащих карбенициллин, и выращивали в течение ночи при 37°С для определения размера библиотеки. Остальную культуру переносили в 500 мл бульона 2YT, содержащего 50 мкл/мл карбенициллина и 1010 фага/мл фага-хелпера М13К07. Клетки инфицировали, встряхивая в течение одного часа при 37°С. Добавляли 50 мкг/мл канамицина и культуры выращивали, встряхивая, еще семь часов при 37°С. Затем температуру снижали до 30°С и культуры выращивали в течение еще 22 часов. Каждая библиотека содержала по меньшей мере ~3,5×1010 колониеобразующих единиц (CFU). Фаг очищали от супернатанта культуры на протяжении двух циклов преципитации 1/5 объема 20% полиэтиленгликоля (PEG)/2,5M NaCl.
С. Сортировка библиотеки созревания аффинности
Библиотеки ”легких цепей” подвергали четырем циклам сортировки. Каждую из четырех библиотек сортировали отдельно и параллельно на протяжении всех четырех циклов следующим методом. Первый цикл представлял собой сортировку на планшете с использованием К11-связанного диубиквитина, иммобилизированного на 96-луночном иммунопланшете Maxisorb (NUNC). Планшеты сенсибилизировали в течение ночи при 4°С 5 мкг/мл К11-связанного диубиквитина (UC Berkeley) в 50 мМ натрий-карбонатного буфера, рН 9,6. Сенсибилизированные планшеты блокировали 200 мкл/лунку 2,5% молока в PBS, содержащем 0,05% твина-20 (PBST), встряхивая в течение одного часа при 25°С. Библиотеки фагов разводили до OD=2,0 в 2,5% молока в PBST и добавляли 30 мкг/мл моноубиквитина для противоотбора. Через один час удаляли блокирующий буфер, добавляли 100 мкл/лунку фага и инкубировали, встряхивая при 25°С в течение двух часов. После связывания планшет 20 раз промывали PBST, вручную наполняя лунки и сливая буфер между промывками. Фаг элюировали 150 мкл/лунку 50 мМ HCl/500 мМ KCl, встряхивая в течение 30 минут при 25°С. Элюат нейтрализовали 150 мкл/лунку 1 М Tris, рН 7,5, и затем размножали в E. coli XL1-Blue (Stratagene), добавляя фаг-хелпер М13К07.
Амплифицированный фаг использовали для выполнения дополнительных циклов отбора в отношении К11-связанного диубиквитина при сортировке в растворе. К11-связанный диубиквитин (UC Berkeley) биотинилировали трехкратным молярным избытком сульфо-NHS-биотина EZ-Link (Pierce Biotechnology). Во втором цикле сортировки нейтравидин (Pierce Biotechnology) иммобилизировали на 96-луночном иммунопланшете Maxisorb (NUNC). Планшеты сенсибилизировали в течение ночи при 4°С 5 мкг/мл нейтравидина в 50 мМ натрий-карбонатного буфера, рН 9,6. Сенсибилизированные планшеты блокировали 200 мкл/лунку 2,5% молока в PBST, встряхивая в течение одного часа при 25°С. Фаг, полученный в результате первого цикла сортировки, разводили до OD=1,0 в 2,5% молока в PBST c 250 нМ биотинилированного К11-связанного диубиквитина (UC Berkeley) и 10 мкг/мл моноубиквитина, линейного диубиквитина, К48-связанного полиубиквитина 2-7 и К63-связанного полиубиквитина 2-7 (все вещества компании Boston Biochem) для противоотбора. Фаг оставляли связываться с биотинилированным К11-связанным диубиквитином в растворе, вращая в течение двух часов при 25°С. После связывания фаг разводили в пять раз в 2,5% молока в PBST и фаг, связанный с биотинилированным К11-связанным диубиквитином, улавливали на планшетах, сенсибилизированных нейтравидином, встряхивая в течение 10 минут при 25°С. После улавливания планшет 30 раз промывали PBST, вручную наполняя лунки и удаляя буфер между промывками. Фаг элюировали 100 мкл/лунку 50 мМ HCl/500 мМ KCl, встряхивая в течение 30 минут при 25°С. Элюат нейтрализовали 100 мкл/лунку 1 М Tris, рН 7,5, и затем размножали в E. coli XL1-Blue (Stratagene), добавляя фаг-хелпер М13К07.
Жесткость последних циклов сортировки увеличивали тремя способами: уменьшая количество биотинилированного К11-связанного диубиквитина в процессе сортировки; увеличивая число и продолжительность промывок планшета и уменьшая продолжительность связывания с фагом. Третью сортировку выполняли аналогично вышеописанной второй сортировке за исключением увеличения числа промывок планшета до 40. Четвертую сортировку выполняли аналогично третьей сортировке за исключением уменьшения количества биотинилированного К11-связанного диубиквитина до 100 нМ, сокращения времени связывания до одного часа и выполнения четырех дополнительных промывок планшета. Промывные воды инкубировали, встряхивая при 25°С в течение 15 минут. Обогащение вычисляли для каждого цикла, сравнивая количество фага с К11-связанным диубиквитином с несенсибилизированной лункой или с лункой, сенсиблилизированной нейтравидином при сортировке в растворе. Обогащение наблюдалось во всех четырех циклах для всех четырех библиотек (см. таблицу 3).
После четырех циклов сортировки из каждой из четырех библиотек было получено 48 отдельных клонов (всего 192), которые выращивали на 96-луночном планшете в 1 мл бульона 2YT, содержащего 50 мкг/мл карбенициллина и 1010 фага/мл фага-хелпера М13К07. Супернатанты из указанных культур использовали для выполнения высокопроизводительных анализов фагов методом ELISA в отношении связывания с К11-связанным диубиквитином (UC Berkeley), моноубиквитином (Boston Biochem), линейным диубиквитином (Boston Biochem), К48-связанным полиубиквитином 2-7 (Boston Biochem), К63-связанным полиубиквитином 2-7 (Boston Biochem), антителом против gD (Genentech) или несенсибилизированной лункой (как описано в примере 1). Были идентифицированы тридцать два клона, которые характеризовались специфическим связыванием с К11-связанным диубиквитином.
Обогащение антител, связывающихся с К11-связанным полиубиквитином, в процессе созревания аффинности
пул
пул
Библиотеки ”тяжелых цепей” были подвергнуты четырем циклам сортировки. В первом цикле все четыре библиотеки сортировали параллельно и затем объединяли для сортировки по две. Сортировку на планшете выполняли в первом цикле точно так же, как было описано выше для библиотек ”легких цепей”. В последних циклах сортировки использовали амплифицированный фаг. Жесткость последних циклов сортировки увеличивали четырьмя способами: уменьшая количество биотинилированного К11-связанного диубиквитина, использованного в сортировке; увеличивая число и продолжительность промывок планшета; уменьшая продолжительность связывания с фагом и добавляя избыток небиотинилированного К11-связанного диубиквитина для конкуренции за связывание с фагом до улавливания нейтравидином. Вторую сортировку выполняли в растворе, как было описано выше для библиотек ”легких цепей” за исключением использования 100 нМ биотинилированного К11-связанного диубиквитина и объединения фага из всех шести библиотек и выполнения совместной сортировки. Третью сортировку выполняли аналогично описанию, приведенному для библиотек ”легких цепей”, за исключением использования 10 нМ биотинилированного К11-связанного диубиквитина и сокращения времени связывания до одного часа. Четвертую сортировку выполняли аналогично описанию, приведенному для библиотек ”легких цепей”, за исключением выполнения трех параллельных сортировок с использованием 5 нМ, 1 нМ и 0,5 нМ биотинилированного К11-связанного диубиквитина. Кроме того, после связывания с фагом в течение одного часа и до улавливания нейтравидином добавляли 30 мкг/мл небиотинилированного К11-связанного диубиквитина (UC Berkeley) и оставляли конкурировать за связывание с фагом при вращении в течение 30 минут при 25°С для отбора клонов с более медленными скоростями диссоциации. Обогащение вычисляли для каждого цикла, как было описано выше. Обогащение наблюдалось во всех четырех циклах (см. таблицу 3).
После четырех циклов сортировки было получено 192 клона, которые выращивали на 96-луночном планшете в 1 мл бульона 2YT, содержащего 50 мкг/мл карбенициллина и 1010 фага/мл фага-хелпера М13К07. Супернатанты из указанных культур использовали для выполнения высокопроизводительных анализов фагов методом ELISA в отношении связывания с К11-связанным диубиквитином, моноубиквитином, линейным диубиквитином, К48-связанным полиубиквитином 2-7, К63-связанным полиубиквитином 2-7, антителом против gD или несенсибилизированной лункой (как описано в примере 1). Были идентифицированы двадцать три клона, которые характеризовались специфическим связыванием с К11-связанным диубиквитином. Конкурентные анализы фагов методом ELISA выполняли для определения клонов с наибольшим увеличением сродства по сравнению с родительским клоном G3. Были использованы супернатанты фагов из анализов ELISA (пример 2С). Конкурентный анализ ELISA выполняли в соответствии с описанием для анализа ELISA с определением IC50 (пример 1В) за исключением использования супернатантов фагов вместо очищенного Fab-фрагмента и только одной концентрации (50 нМ) растворимого К11-связанного диубиквитина (Genentech). Конкурентный анализ также выполняли для каждого клона без добавления растворимого К11-связанного диубиквитина для определения сигнала связывания фага при отсутствии любого конкурирующего антигена. Процентное значение ингибирования связывания в присутствии 50 нМ К11-связанного диубиквитина вычисляли по формуле [1-(OD450 для 50 нМ К11/OD450 при отсутствии К11)]×100%. Родительский клон G3 в среднем характеризовался 33% ингибированием связывания в присутствии 50 нМ К11-связанного диубиквитина (см. таблицу 4). Для дальнейшего анализа были отобраны клоны, характеризующиеся 60% ингибированием или выше.
Значения IC50 для Fab-фрагментов с созревшей аффинностью и Fab-фрагментов родительского клона против К11-связанного полиубиквитина
D. Секвенирование клонов с созревшей аффинностью
Как легкие, так и тяжелые цепи клонов с наибольшим сродством, идентифицированные при выполнении конкурентного анализа фагов методом ELISA (пример 2С) были секвенированы. В общей сложности были идентифицированы восемь уникальных клонов с созревшей аффинностью (см. фигуры 4А и 4В) с несколькими идентичными сиблингами (см. таблицу 4). Клоны G3L1.1A11, G3L1.1C12, G3HC.2A3 и G3HC.2G4 содержали мутации только в CDR L1. Клоны G3HC.2A6 и G3HC.2D7 содержали мутации в CDR H3. Клон G3L2.1F12 содержал мутации в CDR L2, включая амбер-стоп-кодон, который мог быть заменен глутамином при экспрессии в штамме-супрессоре амбер-кодона, таком как E. coli XL1-Blue, использованном в сортировке фагов. Клон G3HC.2E6 содержал мутации только в CDR H2.
Консенсусные аминокислотные последовательности гипервариабельных участков (HVR) легкой цепи, характеризующиеся вариабельностью в вышеуказанных клонах, представляли собой: HVR L1: X22 X23 Ser X24 X25 X26 X27 X28 X29 X30 X31 (SEQ ID NO:73), где Х22 выбирают из аргинина и глицина, Х23 выбирают из аланина и валина, Х24 выбирают из глутамина и гистидина, Х25 выбирают из аспарагиновой кислоты, аспарагина и изолейцина, Х26 выбирают из лейцина и валина, Х27 выбирают из серина, аспарагиновой кислоты, глицина и глутаминовой кислоты, Х28 выбирают из треонина и серина, Х29 выбирают из аланина, валина и фенилаланина, Х30 выбирают из валина и изолейцина и Х31 выбирают из аланина и серина; и HVR L2: X32 X33 X34 Phe X35 Tyr Ser (SEQ ID NO:74), где Х32 выбирают из серина и аспарагина, Х33 выбирают из глутамина и аланина, Х34 выбирают из глутаминовой кислоты и серина и Х35 выбирают из лейцина и валина.
Консенсусные аминокислотные последовательности гипервариабельных участков (HVR) тяжелой цепи, характеризующиеся вариабельностью в вышеуказанных клонах, представляли собой: HVR H2: X36 Ile Asn Pro X37 Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val Lys Gly (SEQ ID NO:75), где Х36 выбирают из аланина и глицина и Х37 выбирают из аланина и аспарагина; и HVR H3: Glu Trp Tyr X38 X39 Gly Tyr Val Met Asp Tyr (SEQ ID NO:76), где Х38 выбирают из фенилаланина и тирозина и Х39 выбирают из глицина и аспарагиновой кислоты.
Е. Анализ специфичности фагов методом ELISA
Специфичность восьми клонов с созревшей аффинностью в отношении полиубиквитинов с разными связями оценивали при помощи анализа фагов методом ELISA. Анализы фагов методом ELISA выполняли в соответствии с описанием, приведенным в примере 1, за исключением того, что вместо супернатантов фагов были использованы шесть пятикратных серийных разведений очищенного фага, начиная с OD268=1,0. Все клоны с созревшей аффинностью связывались с К11-связанным диубиквитином в зависимости от концентрации фага (фигура 5). Только при наибольшей исследованной концентрации фага наблюдалось очень слабое связывание с К48-связанным полиубиквитином.
F. Продуцирование Fab-фрагмента, анализ сродства и создание гибридов
Вариабельные домены родительского клона G3 и восьми Fab-фрагментов с созревшей аффинностью клонировали в плазмиду, экспрессирующую Fab-фрагмент, с отсутствием метки gD в константном домене легкой цепи. Кроме того, амбер-стоп-кодон (TAG) в CDR L2 клона G3L2.1F12 был мутирован в CAG для кодирования глутамина. Мутагенные олигонуклеотиды 5'-G3LC1F12stopQ (CCGAAGCTTCTGATTTACAACCAGGAA TTCGTGTACAGCGGAGTC) (SEQ ID NO:77) И 3'-G2LCF12stopQ (GACTCCGCTGTA CACGAATTCCTGGTTGTAAATCAGAAGCTTCGG) (SEQ ID NO:78) были использованы для замены кодона TAG кодоном CAG при помощи набора для сайтнаправленного мутагенеза QuickChange® Lightning (Stratagene). Полученные плазмиды трансформировали в штамм E. coli 64В4 (Genentech), экспрессировали в виде растворимых Fab-фрагментов и очищали с использованием протеина А-сефарозы, как описано в примере 1. Очищенные Fab-фрагменты исследовали методом резонанса поверхностных плазмонов (SPR) для определения их сродства в соответствии с описанием, приведенным в примере 1, с использованием такого же чипа. Все восемь клонов характеризовались лучшими константами диссоциации (KD) в отношении К11-связанного диубиквитина по сравнению с исходной молекулой при отсутствии детектируемого связывания с К48-связанным или К63-связанным диубиквитином (см. таблицу 2).
Клоны с наибольшим сродством, содержащие мутации в легкой цепи, представляли собой клоны G3L1.1C12 и G3HC.2A3, у которых константы диссоциации были соответственно равны 35 нМ и 25 нМ. Оба клона содержали замены только в CDR L1 (см. фигуры 4А и 4В), при этом были отмечены лучшие показатели скоростей ассоциации (ka) и скоростей диссоциации (kd) (см. таблицу 2) по сравнению с родительским клоном G3. Клон с наибольшим сродством, содержащий мутации в тяжелой цепи, представлял собой G3HC.2E6 с константой диссоциации 47 нМ. Указанный клон содержал замены только в CDR H2, при этом наблюдалось улучшение только скорости диссоциации.
Благодаря структуре библиотек созревания аффинности, описанной в примере 2В, отсутствовала комбинация мутаций CDR, допускающая замены как в CDR L1, так и в CDR H2. Поэтому гибридные Fab-содержащие фагмиды были созданы при помощи стандартных методов клонирования с расщеплением рестрикционными ферментами, которые позволили объединить легкую цепь G3L1.1C12 и тяжелую цепь G3HC.2E6 (с образованием клона 1С12/2Е6) или легкую цепь G3HC.2A3 и тяжелую цепь G3HC.2E6 (с образованием клона 2А3/2Е6) (см. фигуры 6А и 6В). Указанные гибриды также экспрессировали в виде растворимых Fab-фрагментов, очищали и анализировали методом SPR, как описано в примерах 1С и 1D. Комбинации указанных тяжелых и легких цепей привели к дополнительному улучшению сродства (см. таблицу 2). Клоны 1С12/2Е6 и 2А3/2Е6 имели константы диссоциации 12 нМ в отношении К11-связанного диубиквитина, что соответствует почти девятикратному улучшению сродства по сравнению с Fab-фрагментом родительского клона G3 благодаря лучшим показателям скоростей ассоциации и диссоциации обоих гибридов. Кроме того, клоны 1С12/2Е6 и 2А3/2Е6 не связывались на детектируемом уровне с К48-связанным или К63-связанным диубиквитином.
G. Превращение в IgG и анализ сродства
Родительский Fab-фрагмент (G3) и два гибридных Fab-фрагмента с созревшей аффинностью (1С12/2E6 и 2A3/2Е6) были экспрессированы в клетках 293 в виде иммуноглобулинов человека (IgG). Экспрессирующие конструкции были получены путем клонирования вариабельных доменов Fab-фрагмента в экспрессирующих конструкциях pRK млекопитающих, кодирующих тяжелые и легкие цепи каппа-цепи IgG1 человека (Gorman et al., DNA Prot. Eng. Tech. 2:3-10 (1990)). IgG очищали при помощи аффинной хроматографии на колонках с протеином А-сефарозой стандартными методами (описанными для очистки Fab-фрагмента в примере 1) и вводили в PBS с использованием обессоливающих колонок PD10 (GE Healthcare).
Сродство гибридных Fab-фрагментов сначала определяли методом SPR путем связывания антигена амином прямо на чипе СМ5 (пример 2F). Для указанной цели использовали первичные амины с имеющимися боковыми лизиновыми цепями в антигене. Лизины, участвующие в образовании изопептидных связей, связывающих два убиквитиновых мономера друг с другом с образованием диубиквитина, были недоступны для связывания. Так как К11, К48 и К63-связыванные диубиквитины содержат разные остатки лизина, участвующие в образовании изопептидной связи, лизины, доступные для связывания с чипом, также отличаются друг от друга, поэтому для связывания с антителом могут быть доступны или недоступны разные эпитопы.
Во избежание возможных вызывающих путаницу эффектов лизинов, связанных с чипом, сродство IgG, полученного в данном примере, исследовали методом SPR с улавливанием IgG в устройстве BIACORE™ 3000 (GE Healthcare). Примерно 11500 резонансных единиц (RU) улавливающего антитела против Fc человека (GE Healtrhcare) иммобилизировали в первой и второй проточных кюветах чипа СМ5 в соответствии с инструкцией связывания амином, предоставленной производителем. Шестьдесят мкл 0,5 мкг/мл IgG в 10 мМ HEPES, рН 7,2, 150 мМ NaCl и 0,01% твина-20 (HBST) впрыскивали со скоростью потока 30 мкл/минуту во вторую проточную кювету, в результате чего было уловлено примерно 800 RU IgG. В первой проточной кювете находилось только улавливающее антитело, которое служило в качестве эталона. К11-связанный диубиквитин (Genentech), К48-связанный диубиквитин (Boston Biochem) или К63-связанный диубиквитин (Boston Biuochem) в виде двукратных серийных разведений (0,5-500 нМ) в HBST впрыскивали (всего 60 мкл при скорости потока 30 мкл/минуту) в первую и вторую проточные кюветы. Регистрировали сигнал каждой проточной кюветы и вычитали эталонный сигнал. После периода диссоциации, равного четырем минутам, поверхность чипа регенерировали 15 мкл 3 М раствора MgCl2. Данные сопоставляли с моделью связывания 1:1 с переносом массы IgG G3 или с моделью связывания 1:1 со смещающейся базовой линией для IgG 1С12/2Е6 и 2А3/2Е6. Константы скорости реакции и константы связывания вычисляли одновременно при помощи нелинейного регрессионного анализа, используя программное обеспечение, предоставленное производителем; полученные результаты показаны в таблице 5.
IgG родительского клона G3 имел значение KD для связывания с К11-связанным диубиквитином, равное 129 нМ, в то время как IgG клонов 1С12/2Е6 и 2А3/2Е6 имели значение KD 20 нМ. Указанные значения сродства были сопоставимы и находились в пределах допустимого двукратного диапазона ошибки для констант связывания, измеренных для таких же Fab-фрагментов методом прямого связывания антигена (см. таблицу 2). Кроме того, не было обнаружено детектируемого связывания с К48-связанным диубиквитином или К63-связанным диубиквитином.
Связывание гибридных IgG с полиубиквитиновыми молекулами, имеющими разные лизиновые связи, определенное методом резонанса поверхностных плазмонов (SPR)
Пример 3. Исследование гибридных антител с созревшей аффинностью против К11-связанного диубиквитина
А. Анализы специфичности IgG методом ELISA
Специфичность IgG родительского клона G3 и клонов 1С12/2Е6 и 2А3/2Е6 исследовали в отношении связывания с панелью убиквитиновых белков методом ELISA. К11-связанный диубиквитин (Genentech), моноубиквитин, линейный диубиквитин, К48-связанный диубиквитин, К63-связанный диубиквитин, К48-связанный полиубиквитин, К63-связанный полиубиквитин (все белки предоставлены компанией Boston Biochem) иммобилизировали на 96-луночных иммунопланшетах Maxisorb. Планшеты сенсибилизировали, встряхивая, при 25°С в течение двух часов 1 мкг/мл каждого белка в 50 мМ натрий-карбонатного буфера, рН 9,6. Сенсибилизированные планшеты блокировали при встряхивании 200 мкл/лунку 2,5% молока в PBST в течение одного часа при 25°С. Производили одиннадцать двукратных серийных разведений IgG родительского клона G3, клонов 1С12/2Е6 и 2А3/2Е6 в 2,5% молока в PBST от 20 мкг/мл до 0,02 мкг/мл. Через один час блокирующий буфер удаляли, добавляли 100 мкл/лунку каждого разведенного IgG и инкубировали, встряхивая, при 25°С в течение одного часа. Затем планшет шесть раз промывали PBST при помощи устройства для мойки планшетов. Для обнаружения связывания IgG использовали HRP-конъюгированное вторичное антитело, специфичное к Fcγ-фрагменту антитела козы против F(ab')2-фрагмента человека (Jackson Immunoresearch), разведенное в отношении 1:5000 в PBST. Добавляли сто мкл/лунку разведенного вторичного антитела и планшет инкубировали, встряхивая, при 25°С в течение 30 минут. Затем планшет 12 раз промывали PBST при помощи устройства для мойки планшетов и дважды промывали PBS вручную. Связанное вторичное антитело обнаруживали, используя субстрат ТМВ (KPL), и гасили равным объемом 1 М раствора фосфорной кислоты. Значение оптической плотности считывали при длине волны 450 нм. Все три IgG распознавали К11-связанный диубиквитин даже при очень низких концентрациях IgG. Примерно такой же сигнал связывания К11-связанного диубиквитина был обнаружен для G3, 1C12/2E6 и 2А3/2Е6 при каждой концентрации IgG нексмотря на то, что сродство связывания указанных белков отличалось в семь-девять раз. Таким образом, выполняя анализ методом ELISA, нельзя было установпть различие между сродством связывания IgG родительского клона и вариантов с созревшей аффинностью. Кроме того, при низких концентрациях все три IgG были высокоспецифичными, однако, при увеличении концентрации IgG до 20 мкг/мл в процессе выполнения данного анализа наблюдалось некоторое ограниченное неспецифическое связывание с К48-связанным полиубиквитином, К63-связанным диубиквитином и К63-связанным полиубиквитином в обоих клонах 1С12/2Е6 и 2А3/2Е6.
Для выявления более жестких условий, которые позволили бы установить различие между сродством связывания разных IgG и обеспечить более специфическое распознавание К11-связанного диубиквитина в данном анализе; анализ ELISA снова выполняли в буфере, содержащем 4 М мочевины (4 М мочевины, 20 мМ Tris, рН 7,5, 135 мМ NaCl, 1% тритона Х-100, 10% глицерина, 1 мМ EDTA, 1,5 мМ MgCl2). В указанных жестких условиях было обнаружено очень слабое связывание с К11-связанным диубиквитином IgG родительского клона G3 за исключением самой высокой испытанной концентрации IgG (20 мкг/мл) (фигура 7А). В отличие от этого при исследовании вариантов с созревшей аффинностью 1С12/2Е6 и 2А3/2Е6 было обнаружено сильное связывание при всех концентрациях, включая самую низкую концентрацию IgG, равную 0,02 мкг/мл. Кроме того, использование буфера с 4 М мочевины позволяет сохранить высокую степень специфичности к отношении К11-связанного диубиквитина. Только клон 1С12/2Е6 характеризовался очень слабым связыванием с К48-связанным полиубиквитином при самой высокой испытанной концентрации IgG. Клон 2А3/2Е6 не связывался ни с одной из форм убиквитина, кроме К11-связанного диубиквитина, даже при самой высокой испытанной концентрации IgG (20 мкг/мл). Поэтому в указанных жестких условиях более высокое сродство соответствует лучшей функции антител при выполнении анализа ELISA.
В. Анализы IgG методом вестерн-блоттинга
IgG родительского клона G3, клонов 1С12/2Е6 и 2А3/2Е6 сначала исследовали методом вестерн-блоттинга в отношении их способности обнаруживать чистые диубиквитиновые цепи. К11-связанный диубиквитин (Genentech), подвергнутый семи двукратным серийным разведениям от 1 мкг до 15 нг, и 1 мкг моноубиквитина, линейного диубиквитина, К48-связанного диубиквитина и К63-связанного диубиквитина (все белки предоставлены компанией Boston Biochem) в однократном буфере LDS (Invitrogen) нагревали при 70°С в течение десяти минут и исследовали на 1,0 мм гелях с 4-12% бис-трис-буфера NuPAGE (Invitrogen) в невосстановительных условиях в буфере MES (Invitrogen) в четырех одинаковых экспериментах. Один гель окрашивали кумассии для обнаружения всех белков. Три других геля переносили при постоянном напряжении 30 В в течение одного часа путем мокрого переноса в 10% метанола и однократном буфере для переноса NuPAGA (Invitrogen) до 0,2 мкм нитроцеллюлозы (Invitrogen). Сайты неспецифического связывания на мембранах блокировали, инкубируя при встряхивании в 5% молока в PBST в течение одного часа при 25°С. Затем мембраны инкубировали, встряхивая, в 1 мкг/мл IgG G3, 1C12/2E6 или 2А3/2Е6 в 5% молока в PBST в течение одного часа при 25°С. Мембраны трижды промывали в PBST при встряхивании. IgG обнаруживали, инкубируя мембрану при встряхивании с HRP-конъюгированным вторичным антителом, специфичным к Fcγ-фрагменту антитела козы против F(ab')2-фрагмента человека (Jackson Immunoresearch), разведенным в отношении 1:10000 в 5% молока в PBST, в течение одного часа при 25°С. Затем мембрану трижды промывали в PBST и один раз в PBS. Вторичное антитело обнаруживали, используя хемилюминесцентный субстрат Super Signal West Pico (Pierce Biotechnology) с последующим экспонированием блотов на пленке.
Все три IgG обнаруживали только К11-связанный диубиквитин и не обнаруживали моноубиквитин, линейный диубиквитин, К48-связанный диубиквитин или К63-связанный диубиквитин, из чего следует, что указанные IgG являются высокоспецифичными к К11-связанному диубиквитину по результатам анализа методом вестерн-блоттинга (см. фигуру 7В). Кроме того, варианты с созревшей аффинностью были гораздо более чувствительными, чем IgG родительского клона G3, так как были способны обнаружить даже 15 нг К11-связанного диубиквитина, в то врекмя как предел обнаружения IgG G3 был равен 125 нг при экспонировании блотов. Поэтому примерно семи-девятикратное увеличение сродства связывания гибридов по сравнению с родительским антителом нашло отражение в лучшей функции распознавания К11-связанного диубиквитина при выполнении анализа методом вестерн-блоттинга. Несмотря на более высокое сродство к требуемому антигену, специфичность связывания сохраняется, и не было обнаружено детектируемого связывания IgG 1С12/2Е6 или 2А3/2Е6 ни с одним из других испытанных форм убиквитина. Так как варианты с созревшей аффинностью 1С12/2Е6 и 2А3/2Е6 показали аналогичные результаты при выполнении анализов методами SPR, ELISA и вестерн-блоттинга, для дальнейшего исследования использовали только клон 2А3/2Е6.
Антитела, специфичные к К11-связи, были созданы против антигена К11-связанного диубиквитина, поэтому указанные антитела, вероятно, узнают саму связь или, более вероятно, окружающие поверхностные остатки на донорских и акцепторных убиквитинах, которые находятся с непосредственной близости благодаря конформации диубиквитина, возникающей в результате К11-связи. Так как диубиквитин является наименьшим распознаваемым звеном антигена и К11-связанный полиубиквитин является полимерной цепью с диубиквитином в качестве повторяющегося ”мономерного” звена, то указанные антитела должны также связываться с более длинными полиубиквитиновыми цепями, соединенными К11-связями. Для исследования данного вопроса IgG 2А3/2Е6 испытывали в отношении его способности обнаруживать чистые полиубиквитиновые цепи при выполнении вестерн-блоттинга. 1 мкг моноубиквитина (Boston Biochem), К48-связанного полиубиквитина 2-7 (Boston Biochem), К63-связанного полиубиквитина 2-7 (Boston Biochem) и К11-связанного полиубиквитина (Genentech) в однократном буфере LDS (Invitrogen) с восстановителем нагревали при 70°С в течение десяти минут и исследовали на 1,0 мм гелях с 4-12% бис-трис-буфера NuPAGE (Invitrogen) в восстановительных условиях в буфере MES (Invitrogen) в трех одинаковых экспериментах. Один гель окрашивали кумассии голубым SimplyBlue (Invitrogen) для обнаружения всех белков. Остальную часть вестерн-блоттинга выполняли, как было описано выше, за исключением того, что перенос на 0,45 мкм нитроцеллюлозу (Invitrogen) выполняли при напряжении 30 В в течение двух часов. В то время как контрольное пан-убиквитиновое антитело, P4D1, распознавало моноубиквитин, К48-связанный полиубиквитин 2-7, К63-связанный полиубиквитин 2-7 и К11-связанный полиубиквитин, IgG 2A3/2Е6 распознавал только К11-связанный полиубиквитин (см. фигуру 7С). Таким образом, так же, как в случае К11-связанного диубиквитина, антитело 2А3/2Е6 может обнаруживать полиубиквитиновые цепи, содержащие К11-связь и не узнает полиубиквитиновые цепи с другими связями.
Так как антитело 2А3/2Е6 могло специфически связываться с чистыми цепями К11-связанного полиубиквитина, далее исследовали способность IgG 2A3/2Е6 обнаруживать цепи К11-связанного полиубиквитина в лизатах цельных клеток млекопитающего и дрожжевых клеток. Клетки 293Т выращивали в модифицированной по способу Дульбекко среде Игла (DMEM) с высоким содержанием глюкозы, включающей 10% фетальной телячьей сыворотки (FBS) и 2 мМ L-глутамина. Клетки соскабливали с планшетов, центрифугировали со скоростью 2000 оборотов/мин в течение десяти минут при 4°С, промывали 20 мл холодного PBS и повторно центрифугировали. Клетки лизировали в буфере, содержащем 8 М мочевины, 50 мМ Tris, рН 7,5, 25 мМ NaCl, 10 мкл/мл 100-кратного объема протеазы Холта и ингибиторы фосфатазы (Pierce Biotechnology), 5 мМ EDTA (Pierce Biotechnology) и 2 мМ N-этилмалемида (NEM, Pierce Biotechnology), и в течение короткого периода времени обрабатывали ультразвуком для уменьшения вязкости. Лизат разводили в два раза до 4 М мочевины в буфере для иммунопреципитации (IP) (20 мМ Tris, рН 7,5, 135 мМ NaCl, 1% тритона Х-100, 10% глицерина, 1 мМ EDTA, 1,5 мМ MgCl2). Штамм YRG-2 Saccharomyces cerevisiae (Stratagene) выращивали в среде YEPD при 30°С в течение ночи. 18 мл клеток центрифугировали со скоростью 3000 оборотов/мин в течение 5 минут, промывали водой и повторно центрифугировали, получив при этом 400 мг дебриса. Клетки лизировали в соответствии с инструкциями производителя в 1 мл среды Y-PER (Pierce Biotechnology), содержащей 25 мкМ MG132 (Cayman Chemical), 2 мМ NEM (Pierce Biotechnology), 1 мМ PMSF (Calbiochem) и 5 мМ дитиотреитола (DTT).
Пятьдесят нанограммов К11-связанного диубиквитина (Genentech), 1 мкг К48-связанного диубиквитина (Boston Biochem), 1 мкг К63-связанного диубиквитина (Boston Biochem), 100 мкг всего белка из лизата клеток 293Т и 22 мкл клеточного лизата S. cerevisiae в однократном буфере LDS (Invitrogen) с восстановителем нагревали при 70°С в течение десяти минут и исследовали на 1,0 мм геле с 4-12% бис-трис-буфера NuPAGE (Invitrogen) в восстановительных условиях в буфере MES (Invigrogen) в двух одинаковых экспериментах. Перенос геля и вестерн-блоттинг выполняли в соответствии с приведенным выше описанием за исключением того, что перенос на 0,45 мкм нитроцеллюлозу (Invitrogen) производили при напряжении 30 В в течение двух часов. IgG 2A3/2Е6 обнаруживал положительный контрольный образец, К11-связанный диубиквитин и не обнаруживал отрицательные контрольные образцы, К48-связанный диубиквитин или К63-связанный диубиквитин (фигура 7D). Кроме того, клон 2А3/2Е6 мог распознавать высокомолекулярный мазок, характерный для полиубиквитина из лизата клеток 293Т, а также несколько высокомолекулярных полос из лизата дрожжевых клеток. Таким образом, указанный IgG мог обнаруживать цепи К11-связанного полиубиквитина из лизатов цельных клеток.
С. Иммунопреципитация автоубиквитинированного MuRF1
Для дальнейшего исследования специфичности антитела и определения возможности его использования для иммунопреципитации (IP) выполняли реакцию автоубиквитинирования для создания чистого субстрата, модифицированного полиубиквитиновыми цепями с несколькими связями. MuRF1 представляет собой убиквитинлигазу Е3, которая, как известно, подвергается автоубиквитинированию при отсутствии субстрата с цепями К11-связанного, К48-связанного и К63-связанного полиубиквитина при объединении с убиквитинактивирующим ферментом Е1, Ube1, и убиквитинконъюгирующим ферментом E2, UbcH5c (Kim, H.T. et al., 2007, JBS 282:17375-86). Реакции автоубиквитинирования выполняли, используя 100 нМ рекомбинантного фермента His6-Ube1 человека (Boston Biochem), 5 мкМ рекомбинантного фермента UbcH5c (Boston Biochem), 1 мкМ рекомбинантного фермента His6-MuRF1 (Boston Biochem), 100 мкМ рекомбинантного убиквитина человека (Boston Biochem), 20 мМ трис-буфера, рН 7,5, 20 мМ KCl, 5 мМ MgCl2, 2 мМ аденозинтрифосфата (АТР) и 1 мМ DTT в общем объеме 40 мкл, при 37°С в течение 1,5 часа. Реакции выполняли с использованием убиквитина дикого типа и мутантного убиквитина K11R (Boston Biochem) для предотвращения образования К11-связанных цепей с целью определения специфичности антитела. Шесть микролитров каждой реакционной смеси разводили в 100 раз, используя буфер для иммунопреципитации (20 мМ трис-буфера, рН 7,5, 135 мМ NaCl, 1% тритона Х-100, 10% глицерина, 1 мМ EDTA, 1,5 мМ MgCl2), содержащий 4 М, 2 М, 1 М, 0,5 М или 0 М мочевины. Каждую рекакционную смесь для иммунопреципитации (IP) предварительно осветляли 50 мкл динагранул протеина А (Invitrogen), вращая при 25°С в течение одного часа. Гранулы улавливали магнитом и супернатанты переносили в новые пробирки. Двадцать микрограммов IgG 2A3/2Е6 добавляли к каждой реакционной смеси для иммунопреципитации и инкубировали, вращая, при 25°С в течение ночи. На следующий день IgG улавливали 100 мкл динагранул протеина А на одну иммунопреципитацию и инкубировали с вращением при 25°С в течение 15 минут. Гранулы улавливали и промывали три раза 1 мл лизирующего буфера, содержащего соответствующее количество мочевины, и затем два раза 1 мл PBS, производя улавливание между промывками. Во время последней промывки гранулы переносили в новую пробирку. Вещество, подвергнутое иммунопреципитации (IP), элюировали, ресуспендируя гранулы в 20 мкл однократного буфера для образца LDS (Invitrogen) с восстановителем и инкубируя при 70°С в течение 10 минут.
Десять процентов каждой исходной реакционной смеси и 100% вещества, подвергнутого иммунопреципитации, исследовали на 1,0 мм гелях с 4-12% бис-трис-буфера NuPAGE (Invitrogen) в восстановительных условиях в буфере MES (Invitrogen). Вестерн-блоттинг выполняли в соответствии с приведенным выше описанием, используя пан-убиквитиновое антитело P4D1. Результаты исследования показали, что при всех испытанных концентрациях мочевины антитело 2А3/2Е6 было способно вызывать иммунопреципитацию автоубиквитинированного MuRF1 при использовании в реакции автоубиквитинирования убиквитина дикого типа (фигуры 8А и 8В). Кроме того, не было обнаружено иммунопреципитации остаточного моноубиквитина, присутствовавшего в исходной реакционной смеси.
Мутантный убиквитин K11R блокирует способность MuRF1 образовывать цепи К11-связанного полиубиквитина; однако, в результате автоубиквитинирования все же образуются К48-связанные и К63-связанные цепи. Поэтому весьма вероятно, что, если IgG 2A3/2Е6 является специфичным к К11-связанным цепям, то иммунопреципитация автоубиквитинированного MuRF1 будет отсутствовать при использовании мутантного убиквитина K11R. Такая ситуация действительно имела место при выполнении иммунопреципитации в присутствии 4 М мочевины, из чего следует, что IgG 2А3/2Е6 является высокоспецифичным к К11-связанным цепям в указанных условиях (фигура 8С). Данная специфичность утрачивается при уменьшении концентрации мочевины до 2 М. Такой результат совместим с повышенной специфичностью, наблюдаемой при использовании 4 М мочевины в анализах ELISA, рассмотренных в примере 3А, а также со специфичностью, имевшей место при использовании 4 М мочевины в реакциях иммунопреципитации с другими антителами, специфичными к убиквитиновой связи, созданными против К48 и К63 связей (см., например, антитела, описанные в опубликованной заявке на патент США № 20070218069).
Для дальнейшего исследования специфичности IgG в реакциях иммунопреципитации были выполнены четыре реакции автоубиквитинирования MuRF1 с использованием рекомбинантного убиквитина человека дикого типа, мутантного убиквитина K11R, мутантного убиквитина K48R и мутантного убиквитина K63R (Boston Biochem) в соответствии с приведенным выше описанием. Использование мутантов с заменой лизина аргинином предотвращает образование полиубиквитиновых связей специфическими лизинами. Четыре реакционные смеси разделяли и равные части подвергали иммунопреципитации, используя IgG 2A3/2Е6 и изотипически сходное контрольное антитело IgG1 с каппа-цепью, которое специфически не связывается с любой формой убиквитина (Genentech). Исходное вещество, полученное в результате выполнения каждой реакции автоубиквитинирования, а также каждый образец, подвергнутый иммунопреципитации, разделяли параллельными гелями для SDS-PAGE с целью окрашивания кумассии и выполнения анализа методом вестерн-блоттинга с использованием пан-убиквитинового антитела P4D1, описанного выше.
Как показано на фигуре 8D, IgG 2A3/2Е6 был способен вызвать иммунопреципитацию автоубиквитинированного MuRF1 только при наличии К11-связанных цепей (при использовании убиквитина дикого типа, мутантного убиквитина K48R или K63R). При использовании мутантного убиквитина K11R MuRF1 не мог произвести сборку К11-связанных цепей (см. приведенное ниже подтверждение, полученное при помощи масс-спектрометрии) и IgG 2A3/2Е6 не мог вызвать иммунопреципитацию любого автоубиквитинированного MuRF1 в указанных условиях. В отличие от этого изотипически сходное контрольное антитело не могло вызвать иммунопреципитацию любого автоубиквитинированного MuRF1 при выполнении любой из четырех реакций автоубиквитинирования.
С учетом сигнала вестерн-блоттинга пан-убиквитина масс-спектрометрический анализ был выполнен в высокомолекулярной области геля (>188 кДа). Часть геля, соответствующую данной области, вырезали и расщепляли трипсином в геле. Кусочки геля обесцвечивали, используя 50 мМ бикарбоната аммония/50% метанола, и затем сушили с ацетонитрилом (ACN). Для достижения эффективного поглощения трипсина кусочки геля инкубировали на льду в течение 2 часов с 20 нг/мкл модифицированного трипсина для секвекнирования (Promega), разведенного в 50 мМ бикарбоната аммония/5% ACN. Продукты расщепляли в течение ночи при 37°С и прекращали расщепление, добавляя 50% ACN/5% муравьиной кислоты (FA). К каждому образцу добавляли меченные изотопами пептиды, соответствующие внутреннему стандарту, (1 пмоль)до выполнения двух циклов экстракции. Экстрагированные пептиды полностью сушили и ресуспендировали в 10% ACN/5% FA/0,01% пероксида водорода в течение по меньшей мере 30 минут до выполнения масс-спектрометрического анализа. Образцы вводили в колонку С18 Thermo AQUASIL (2,1×150 мм) и разделяли при помощи капиллярной ЖХ Agilent 1200 со скоростью потока 200 мкл/мин в течение 26 минут с градиентом от 5% до 90% буфера В (98% ACN/0,1% FA). Масс-спектрометрию выполняли в устройстве ABI 4000 QTRAP методом сегментированного контроля нескольких реакций (MRM) для обнаружения меченых и немеченных пептидов в последовательности убиквитина. Количественное определение производили, сравнивая площади пиков у меченых и немеченных вариантов каждого пептида при помощи программного обеспечения ABI Multiquant 1.1.
В исходных образцах, полученных из реакционной смеси убиквитина дикого типа, была обнаружена смесь цепей К11, К48 и К63-связанных полиубиквитинов, в то время как в реакционных смесях с мутантами убиквитина K11R, K48R и K63R отсутствовали К11, К48 и К63 связи (фигура 8Е). В образце, подвергнутом иммунопреципитации IgG 2A3/2Е6 из реакционной смеси с использованием убиквитина дикого типа, профили полиубиквитиновых связей были аналогичны исходному веществу (см. фигуру 8Е), из чего следует, что большинство молекул субстрата имеют три основные связи (К11, К48 и К63). Аналогичные результаты были получены при исследовании антител против К48 и К63-связей (Newton, K. et al. 2008 Cell 134:668-678). В результате иммунопреципитации IgG 2A3/2Е6 из реакционных смесей, содержащих мутантные убиквитины K48R и K63R, был получен автоубиквитинированный MuRF1 с профилями полиубиквитиновых связей, аналогичными соответствующим исходным образцам. В отличие от этого IgG 2A3/2Е6 не вызвал иммунопреципитацию полиубиквитина из реакционных смесей, содержащих мутантный убиквитин K11R, из-за отсутствия связи-мишени. Полученные результаты показывают, что IgG 2A3/2Е6 является высокоспецифичным к К11-связанным цепям при выполнении иммунопреципитации. Как и ожидалось, изотипически сходное контрольное антитело было не в состоянии осадить убиквитин ни из одной из четырех реакционных смесей.
D. Иммунопреципитация из клеточных лизатов
Также исследовали способность IgG 2A3/2Е6 вызывать иммунопреципитацию цепей К11-связанного полиубиквитина из лизатов цельных клеток. Клетки 293Т выращивали в модифицированной по способу Дульбекко среде Игла (DMEM) с высоким содержанием глюкозы, включающей 10% фетальной телячьей сыворотки (FBS) и 2 мМ L-глутамина. Клетки трансфицировали плазмидами для сверхэкспрессии убиквитина человека дикого типа, К0 мутантного убиквитина (все семь лизинов были заменены аргинином) или псевдотрансфицировали (фигура 9А). Трансфекции производили в соответствии с инструкциями производителя, используя 25 мкг ДНК и 75 мкг липофектамина 2000 (Invitrogen) на пяти 10 см пластинках. Через сорок восемь часов после трансфекции клетки собирали и лизировали, как было описано выше. Концентрацию всего белка в каждом лизате доводили до 10 мг/мл в 8 М мочевины. Лизаты разводили до 4 М мочевины буфером для иммунопреципитации (20 мМ Tris, рН 7,5, 135 мМ NaCl, 1% тритона Х-100, 10% глицерина, 1 мМ EDTA, 1,5 мМ MgCl2), в результате чего концентрация всего белка была равна 5 мг/мл. Для каждой реакции иммунопреципитации использовали 1 мл (5 мг всего белка).
Помимо выполнения иммунопреципитации IgG 2A3/2Е6, было также использовано изотипически сходное контрольное антитело человека IgG1 с каппа-цепью, которое специфически не связывается ни с одной формой убиквитина (Genentech). Каждую реакционную смесь, подвергаемую иммунопреципитации, предварительно осветляли при помощи 100 мкл динагранул протеина А (Invitrogen), вращая при 25°С в течение двух часов, и затем центрифугировали со скоростью 14000 оборотов/мин в течение 2 минут для удаления осажденного вещества. Гранулы улавливали магнитом и супернатанты переносили в новые пробирки. Сорок мкг IgG 2А3/2Е6 или контрольного IgG добавляли к каждой реакционной смеси, подвергаемой иммунопреципитации, и инкубировали, вращая при 25°С в течение ночи. На следующий день IgG улавливали 200 мкл динагранул протеина А и инкубировали, вращая при 25°С в течение 15 минут. Уловленные гранулы промывали пять раз 1 мл буфера для иммунопреципитации с 4 М мочевины (4 М мочевины, 20 мМ Tris, рН 7,5, 135 мМ NaCl, 1% тритона Х-100, 10% глицерина, 1 мМ EDTA, 1,5 мМ MgCl2) и пять раз 1 мл PBS, улавливая гранулы после каждой промывки. Во время последней промывки гранулы переносили в новую пробирку. Вещество, осажденное путем иммунопреципитации, элюировали, ресуспендируя гранулы в 15 мкл однократного буфера для образца LDS (Invitrogen) с восстановителем и инкубируя при 70°С в течение 10 минут. При выполнении анализа методом вестерн-блоттинга 0,1% 5 мг/мл лизата цельных клеток (исходный) и 10% вещества, осажденного путем иммунопреципитации, исследовали на 1,0 мм геле с 4-12% бис-трис-буфера NuPAGE (Invitrogen) в восстановительных условиях в буфере MES (Invitrogen). Вестерн-блоттинг выполняли в соответствии с приведенным выше описанием, используя пан-убиквитиновое антитело P4D1. При выполнении масс-спектрометрического анализа 10% 5 мг/мл лизата цельных клеток (исходного) и 90% вещества, осажденного путем иммунопреципитации, исследовали на 1,0 мм геле с 4-12% бис-трис-буфера NuPAGE (Invitrogen) в восстановительных условиях в буфере MES (Invitrogen). Гель окрашивали красителем SimplyBlue (Invitrogen).
В пседотрансфицированном лизате присутствует относительно небольшое количество полиубиквитина, которое может быть подвергнуто иммунопреципитации клоном 2А3/2Е6 (фигура 9А). В случае сверхэкспрессии убиквитина дикого типа количество полиубиквитиновых цепей в лизате цельных клеток значительно увеличивается наряду с полиубиквитиновыми цепями, осажденными клоном 2А3/2Е6, из чего следует, что количество цепей К11-связанного полиубиквитина увеличивается при сверхэкспрессии убиквитина. Весьма удивительным является то, что в случае сверхэкспрессии мутантного убиквитина К0 (в котором все остатки лизина мутировали в аргинин и поэтому не могут образовывать полиубиквитиновые цепи, содержащие изопептидные связи) количество полиубиквитиновых цепей также увеличивается. Данный результат позволяет предположить, что сверхэкспрессия К0 вызывает повышенный синтез полиубиквитиновых цепей, содержащих эндогенный убиквитин. Большая часть указанных цепей должна быть К11-связанными, так как клон 2А3/2Е6 был способен вызывать их иммунопреципитацию. Чтобы проверить правильность данного вывода, выполняли масс-спектрометрический анализ в соответствии с приведенным выше описанием за исключением того, что кусочки геля инкубировали на льду в течение 45 минут с 20 нг/мкл модифицированного трипсина для секвенирования (Promega), разведенного в 50 мМ бикарбоната аммония/5% ACN, затем раствор трипсина удаляли, заменяли 50 мМ бикарбоната аммония/5% ACN и гидролизовали в течение ночи при 37°С. Анализировали две области полиакриламидного геля, окрашенного кумассии, молекулярная масса которых составляла >188 кДа (фигуры 9В и 9С).
Количественный анализ указанных образцов показал увеличение числа К11 связей, полученных в результате иммунопреципитации, по сравнению с процентным значением К11 связей, присутствующих в исходных лизатах (фигуры 9С и 9D). Обнаружение значительных уровней К48 и К63 связей позволяет предположить, что отдельные субстраты обычно содержат убиквитиновые цепи с разными связями в виде гетерогенных цепей со смешанными связями или, возможно, в виде гомогенных цепей, образованных лизинами отдельных субстратов. Иммунопреципитации, выполненные с использованием изотипически сходного контрольного антитела, показали наличие пренебрежимо малых количеств убиквитина в цепях во всех случаях (данные не показаны), что сопоставимо с результатами вестерн-блоттинга, представленными на фигуре 9А.
Хотя настоящее изобретение подробно описано в виде иллюстраций и примеров для лучшего понимания, приведенные описания и примеры не следует рассматривать как ограничение объема изобретения. Все патенты и научные публикации, приведенные в данной заявке, включены в настоящее описание изобретения в качестве ссылки в полном объеме.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-ПОЛИУБИКВИТИНОВЫЕ АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2630637C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2009 |
|
RU2547596C2 |
| АНТИТЕЛА ПРОТИВ BV8 И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2559542C2 |
| СИСТЕМА ЭКСПРЕССИИ И СЕКРЕЦИИ | 2013 |
|
RU2670491C2 |
| АНТИТЕЛА К JAGGED И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2666990C2 |
| АНТИТЕЛА ПРОТИВ NOTCH2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2580029C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К ФАКТОРУ D И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2678802C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К ФАКТОРУ D И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2474589C2 |
| АНТИТЕЛА ПРОТИВ НЕЙРОПИЛИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2571226C2 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |

































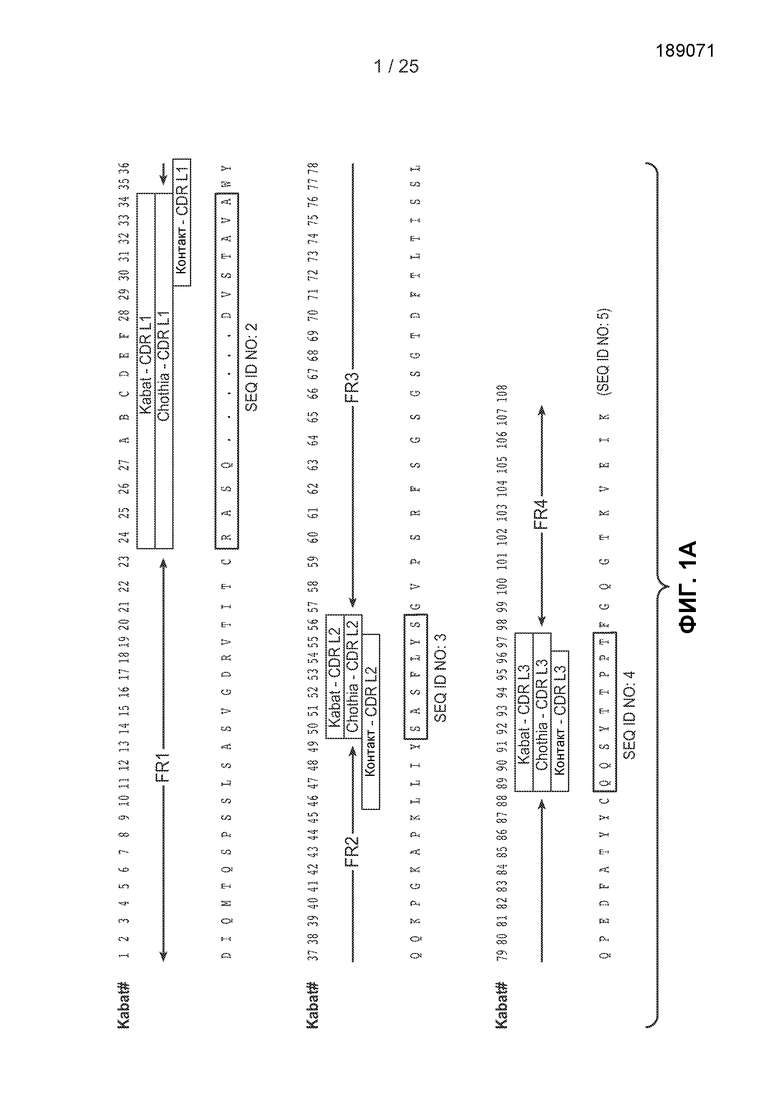
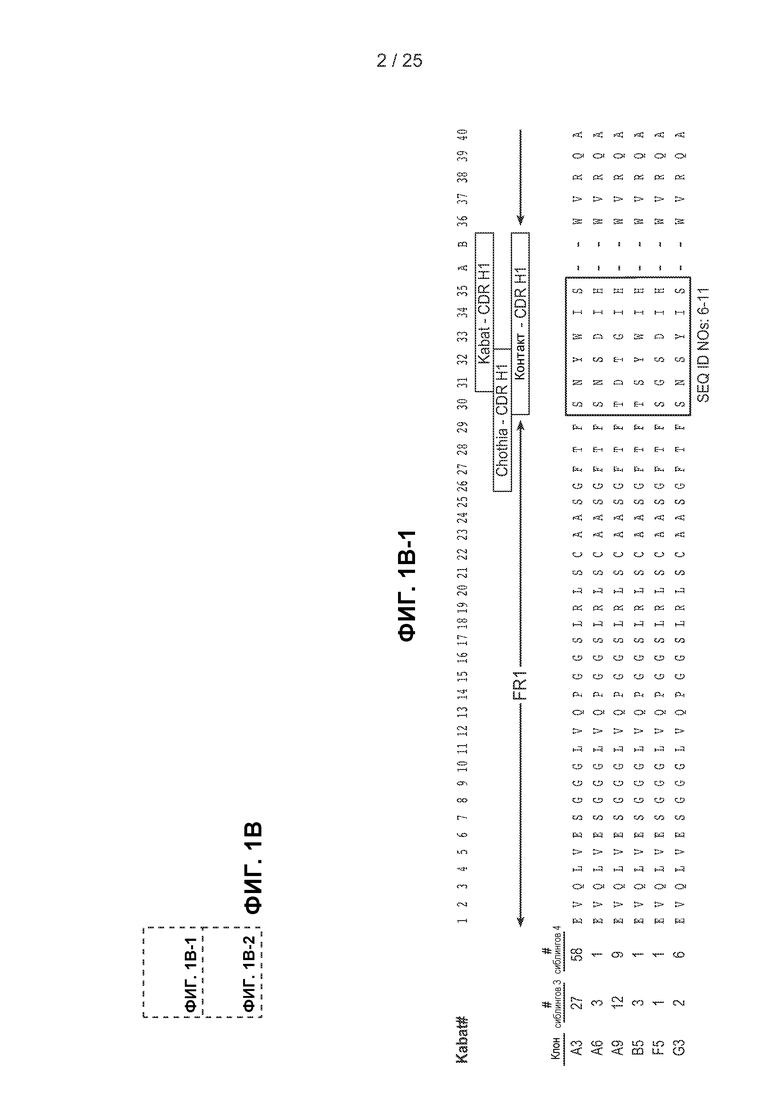
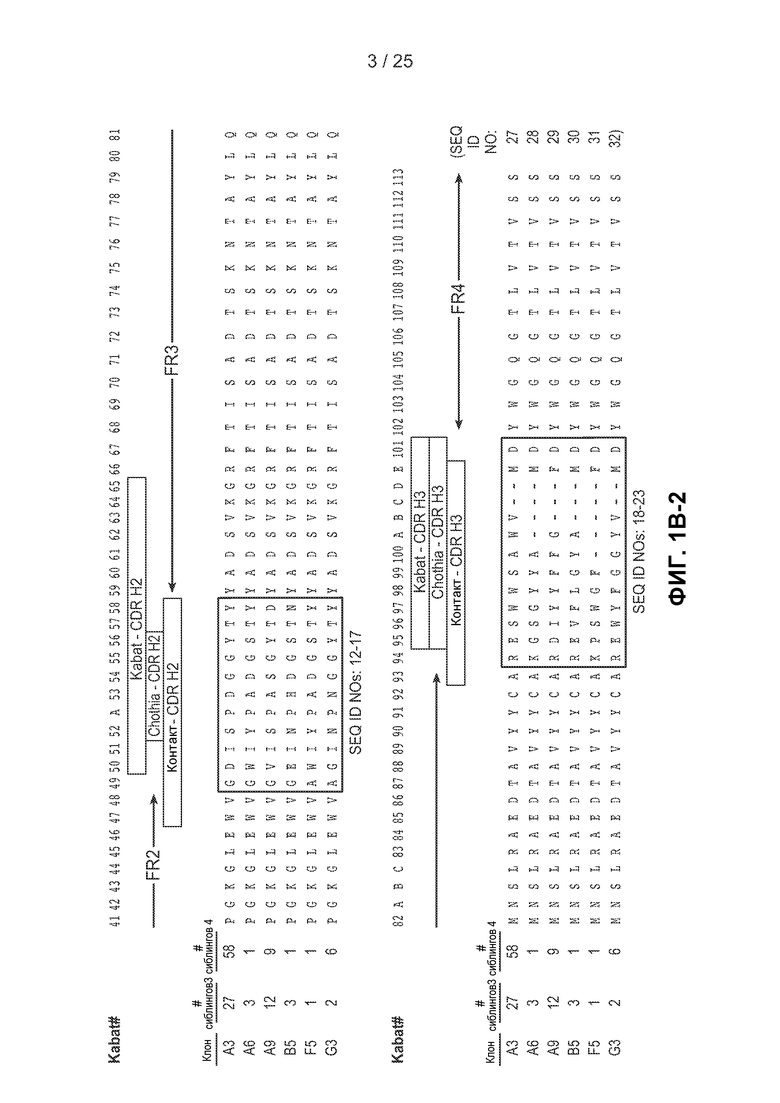
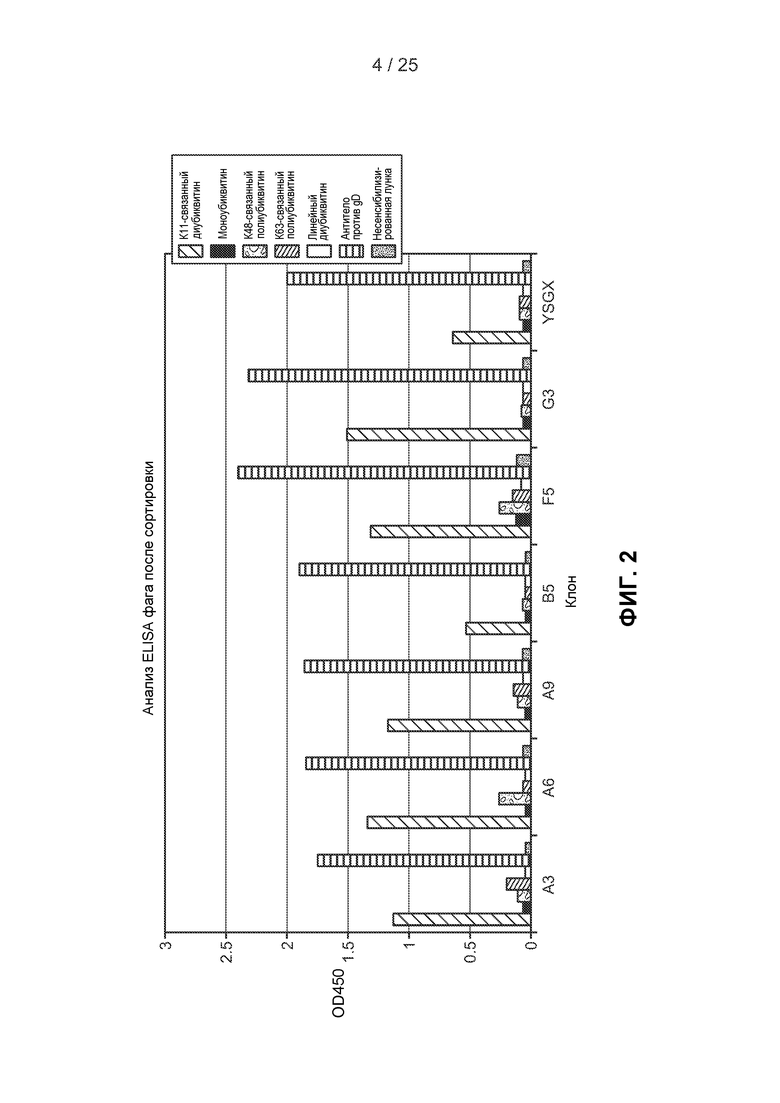
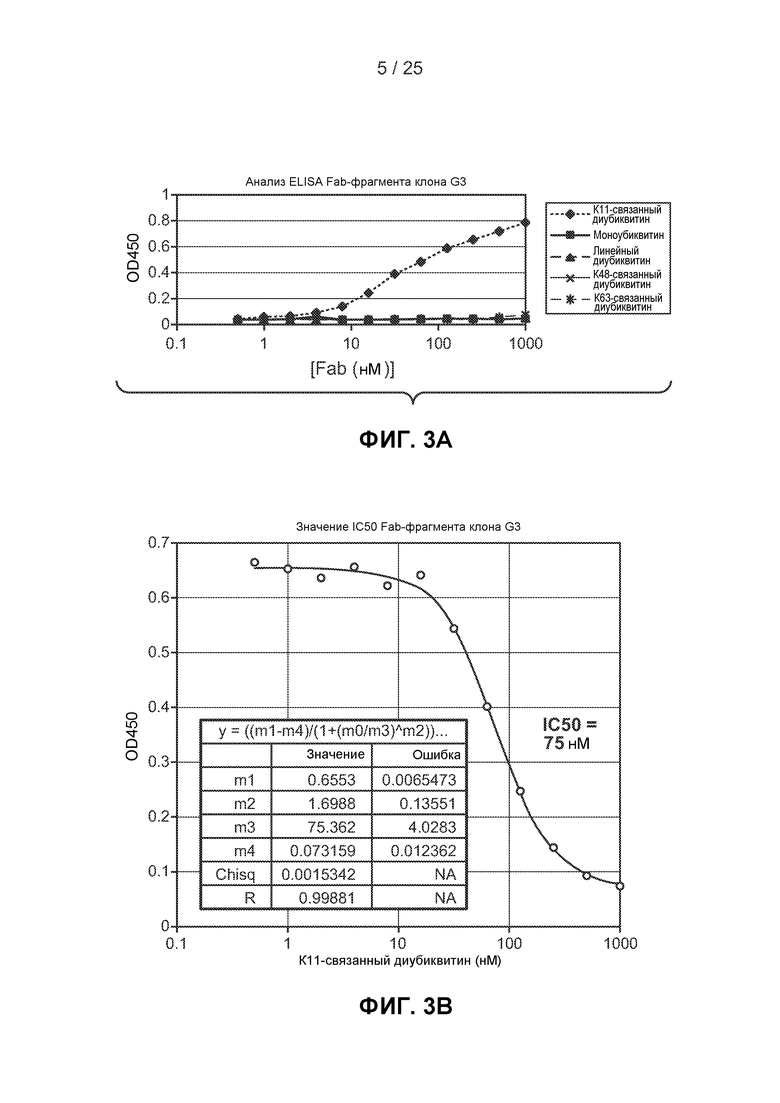

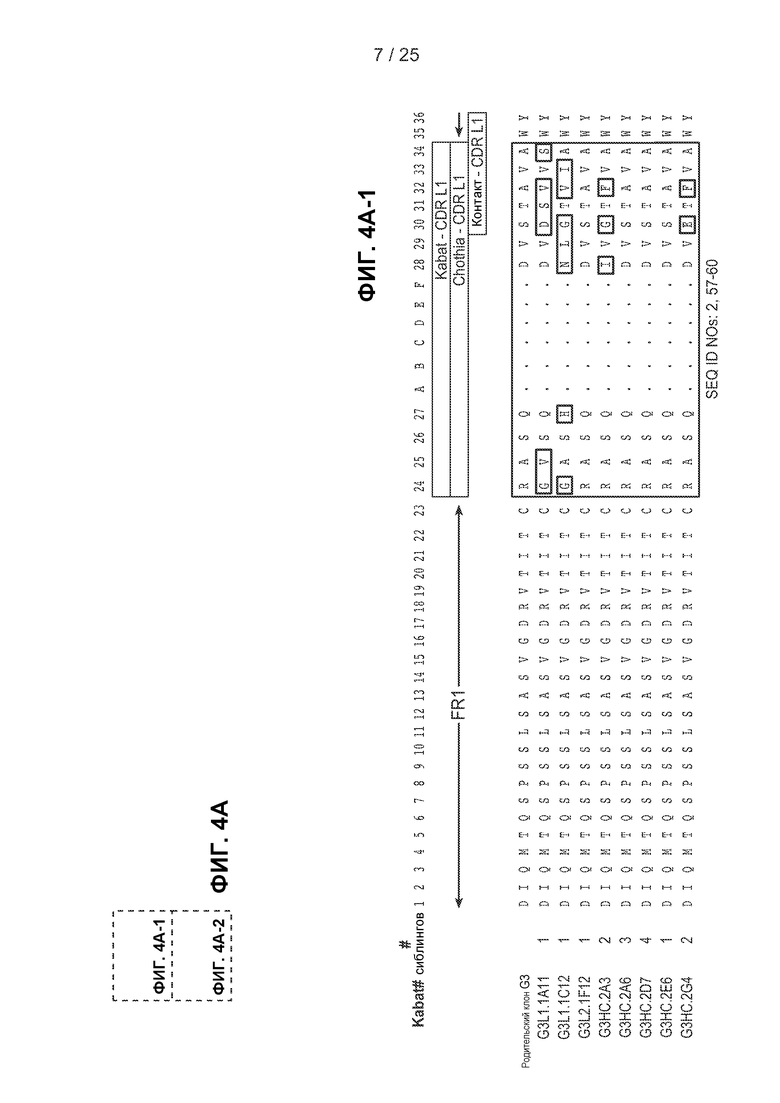
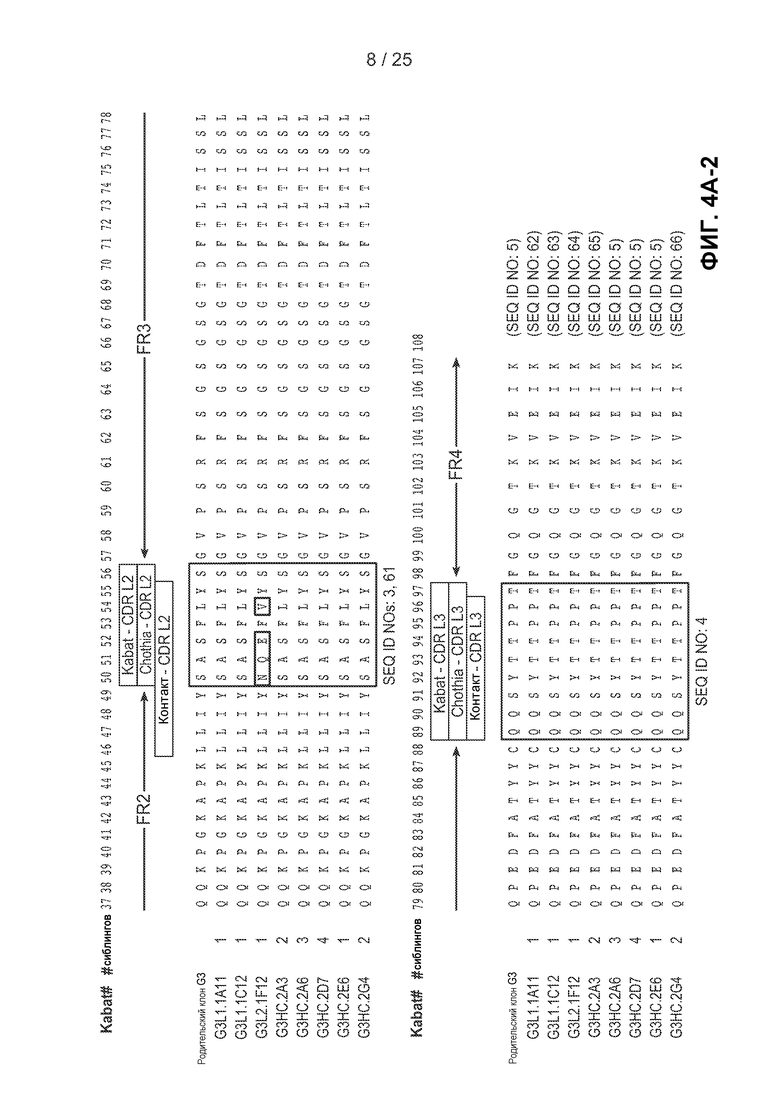
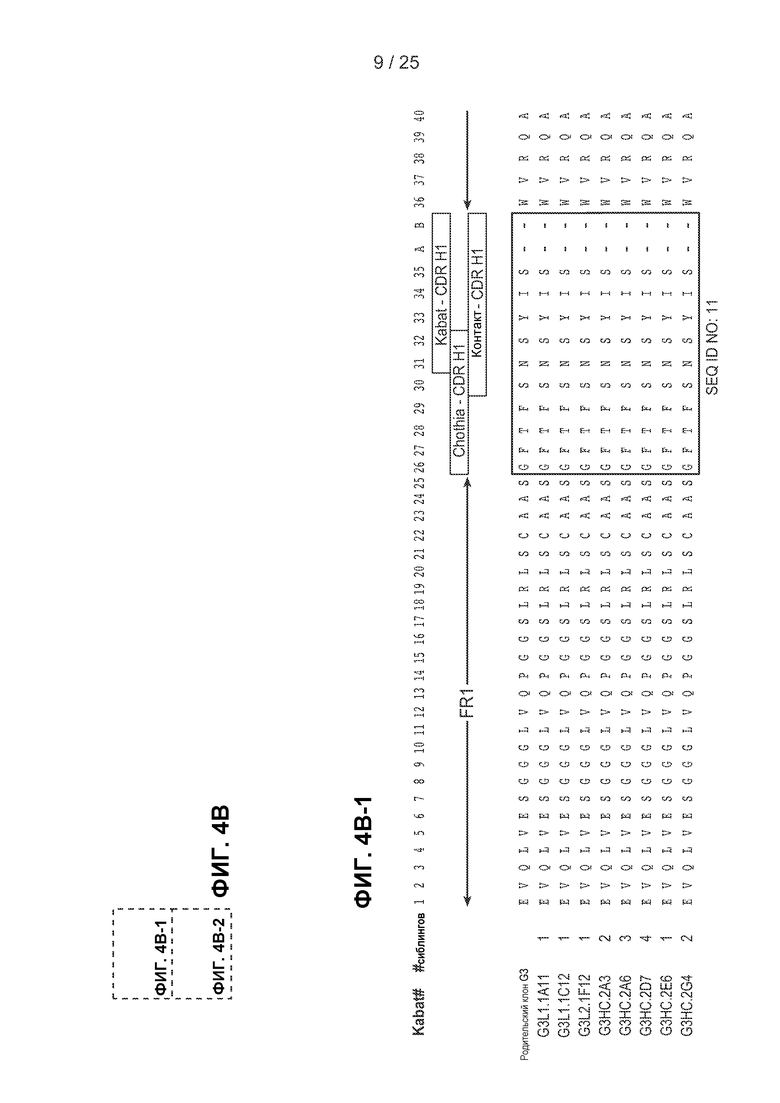
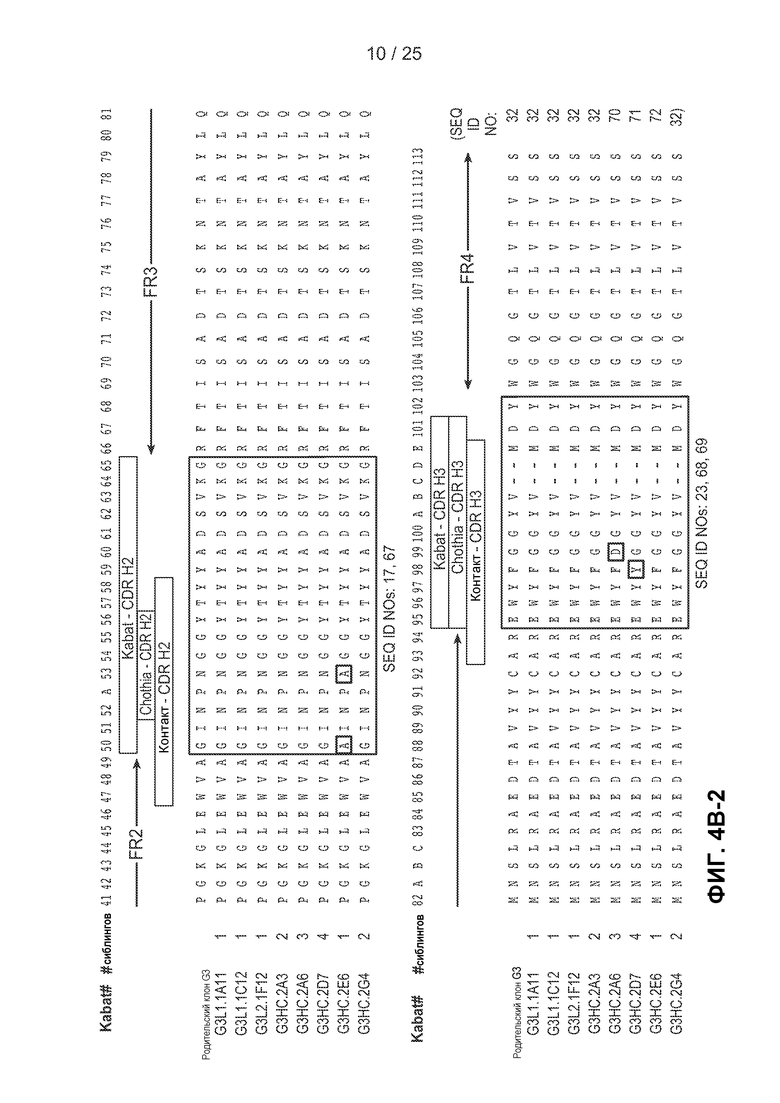
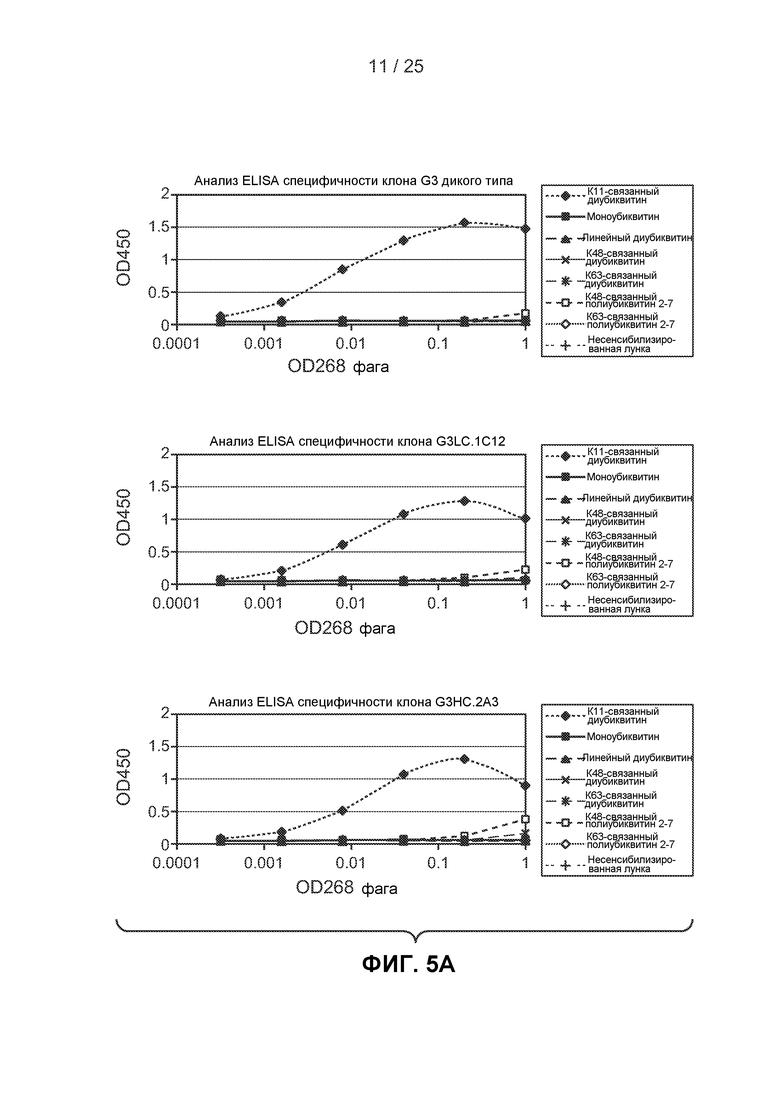
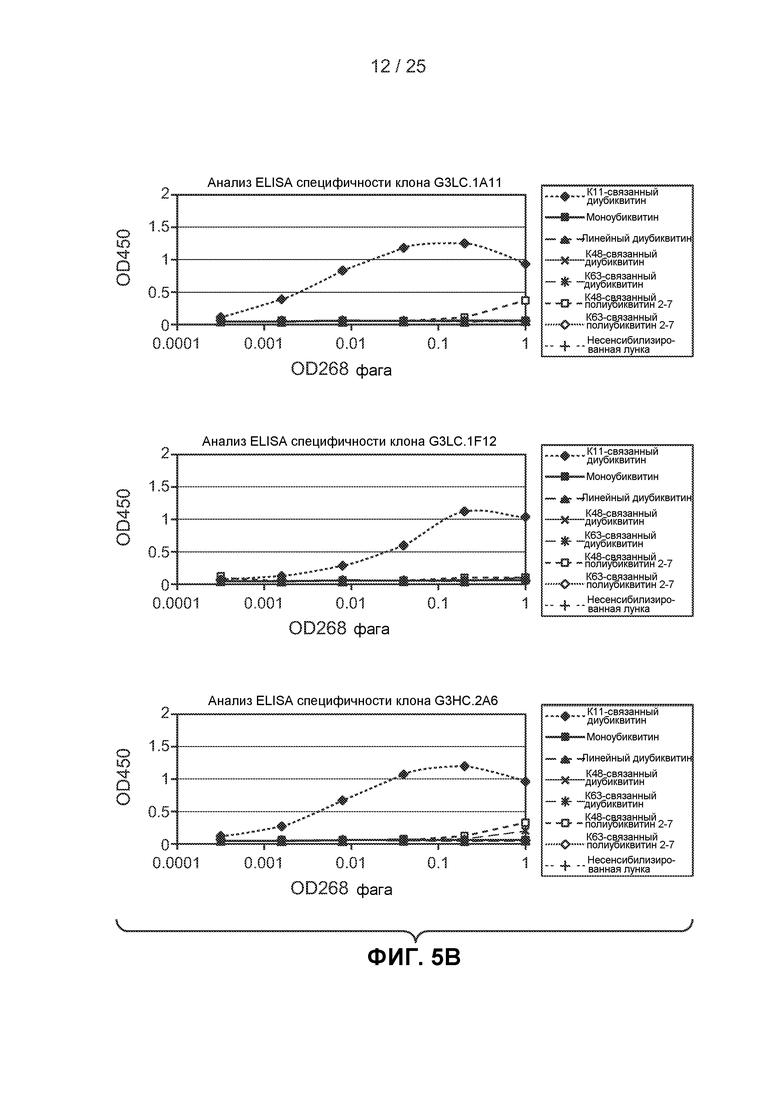
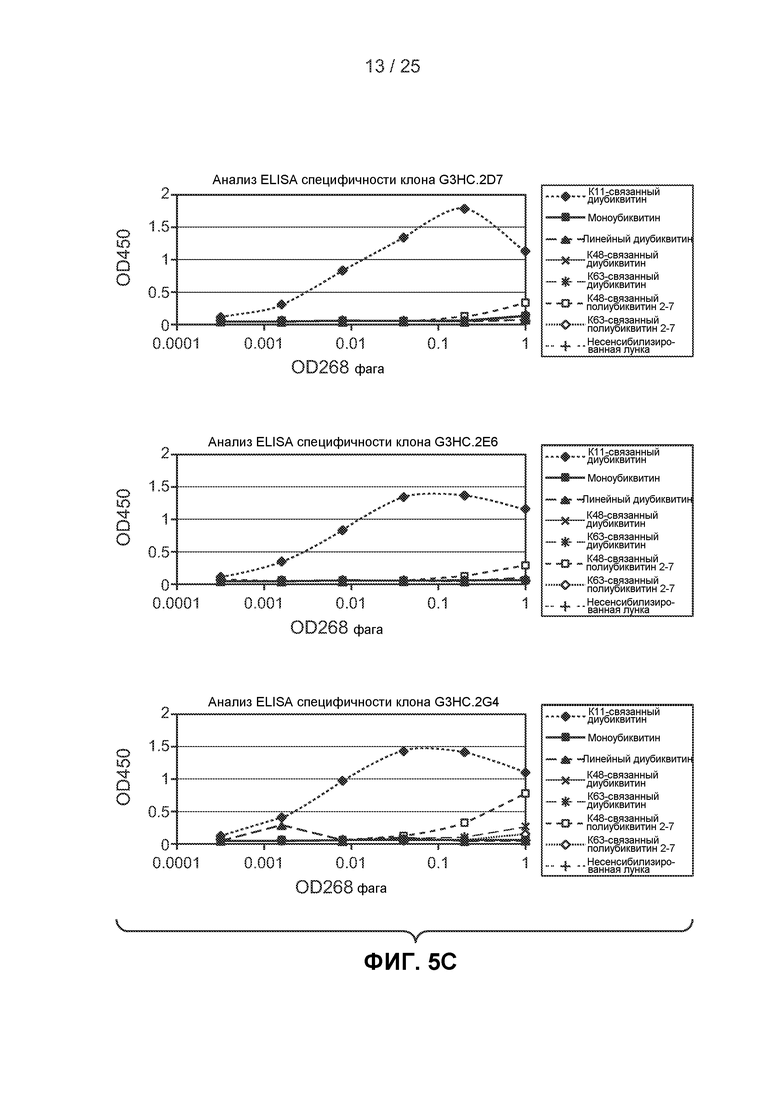
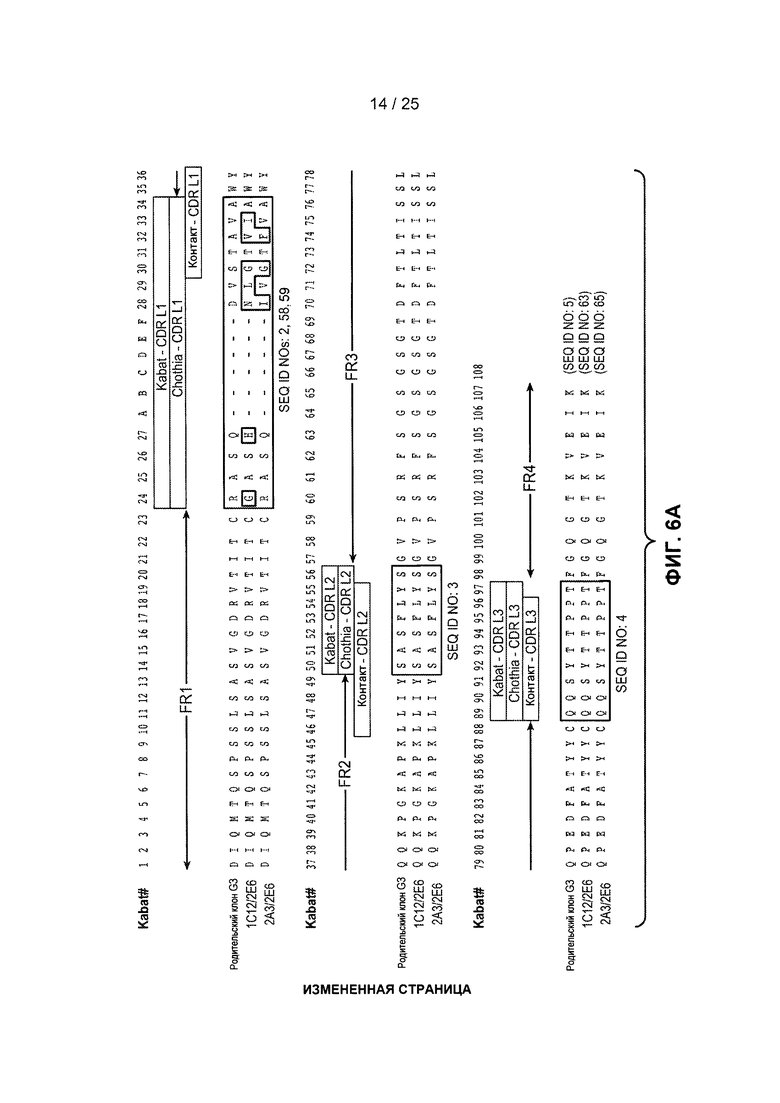
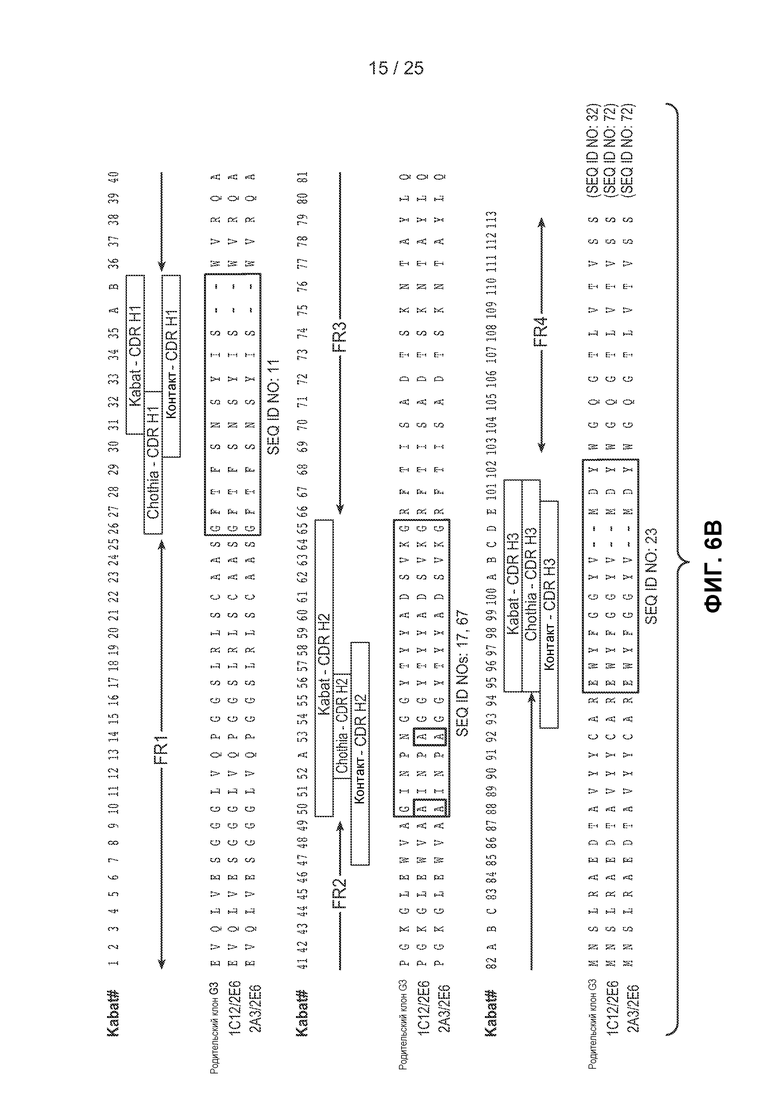
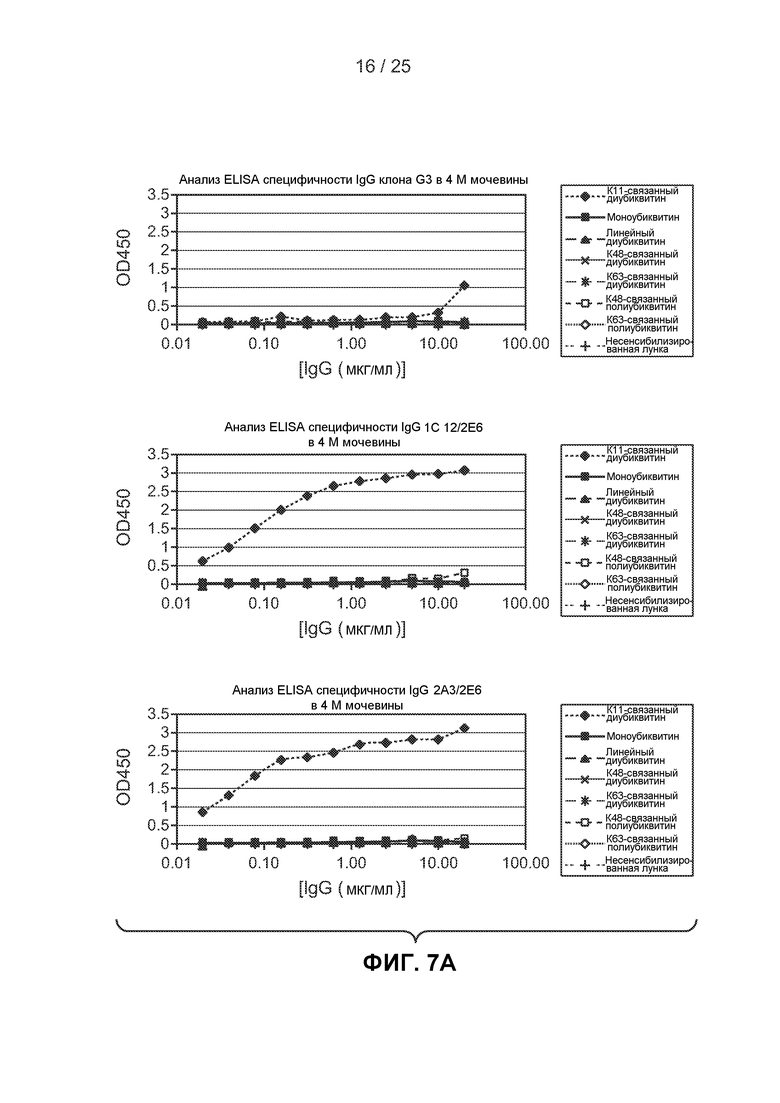

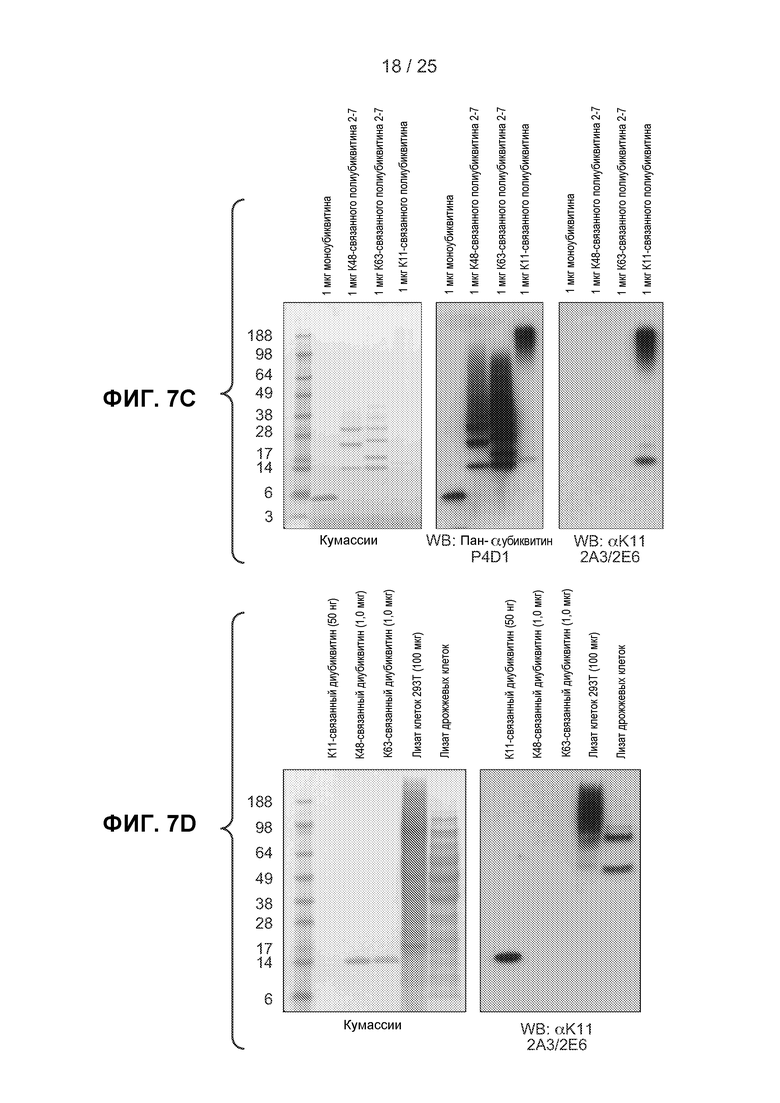
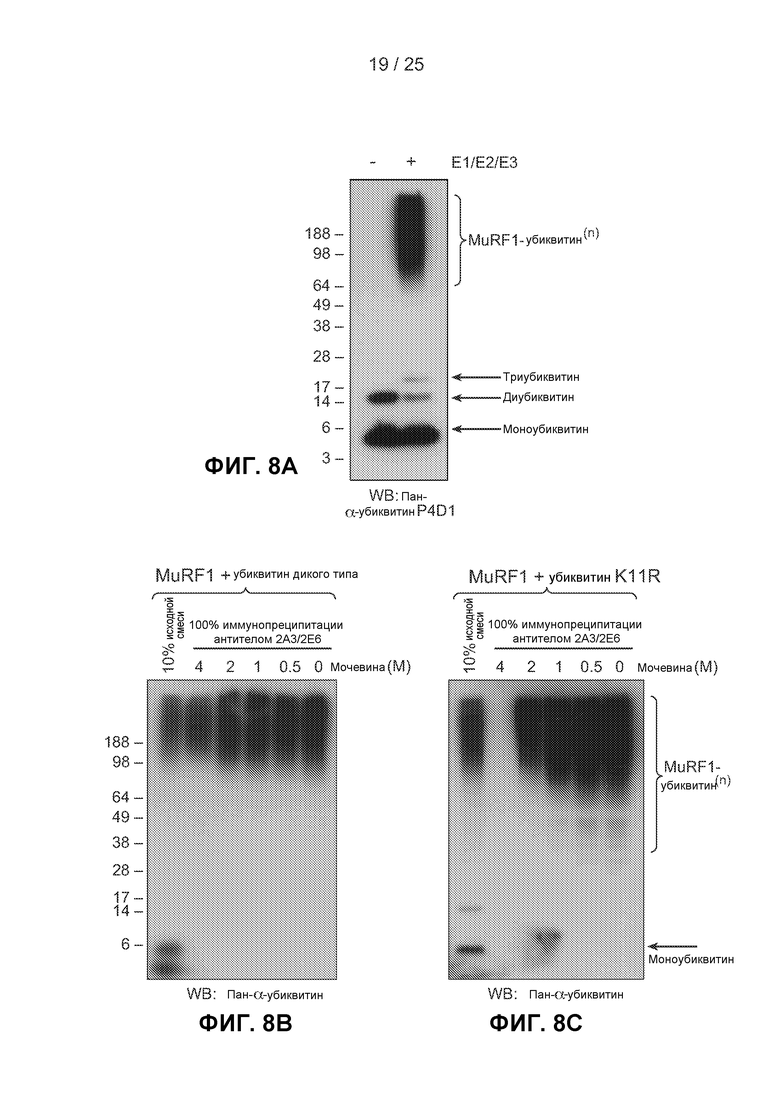
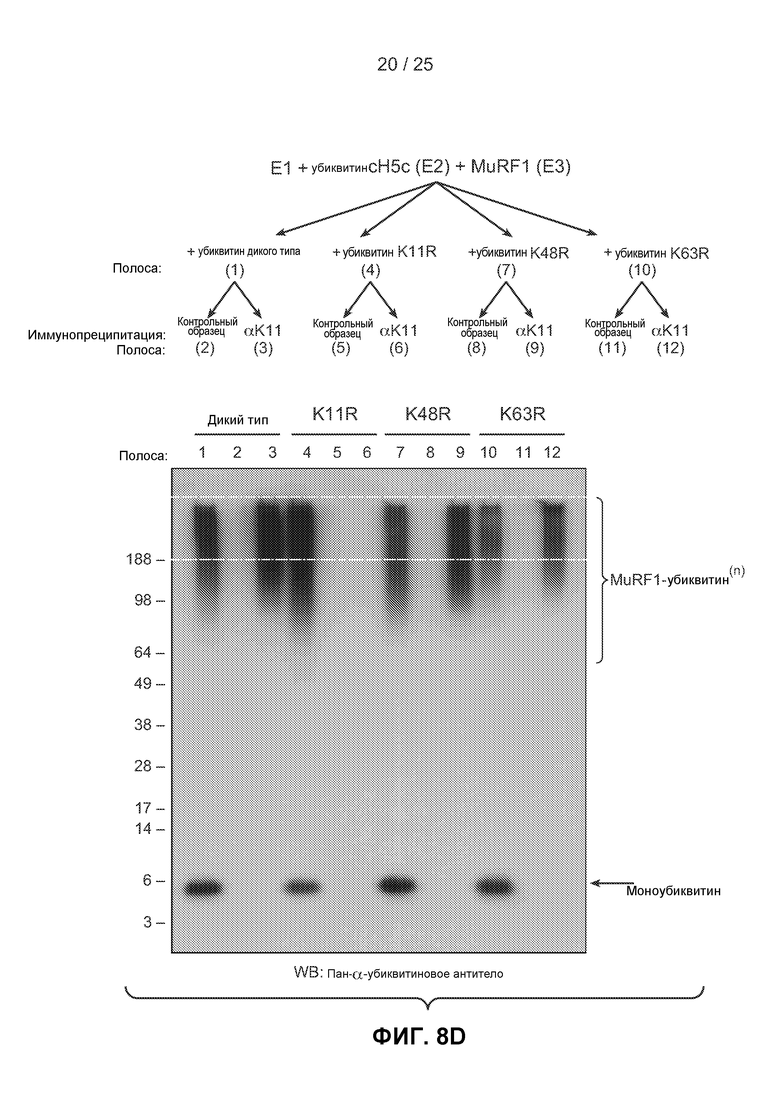
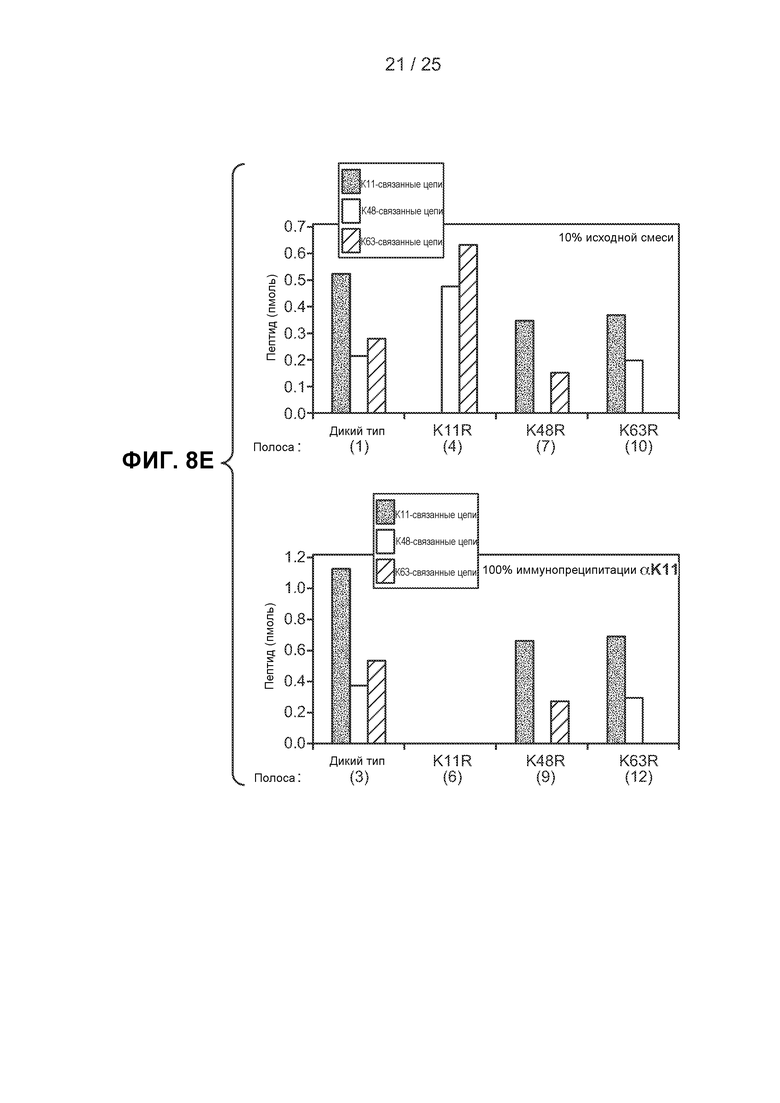
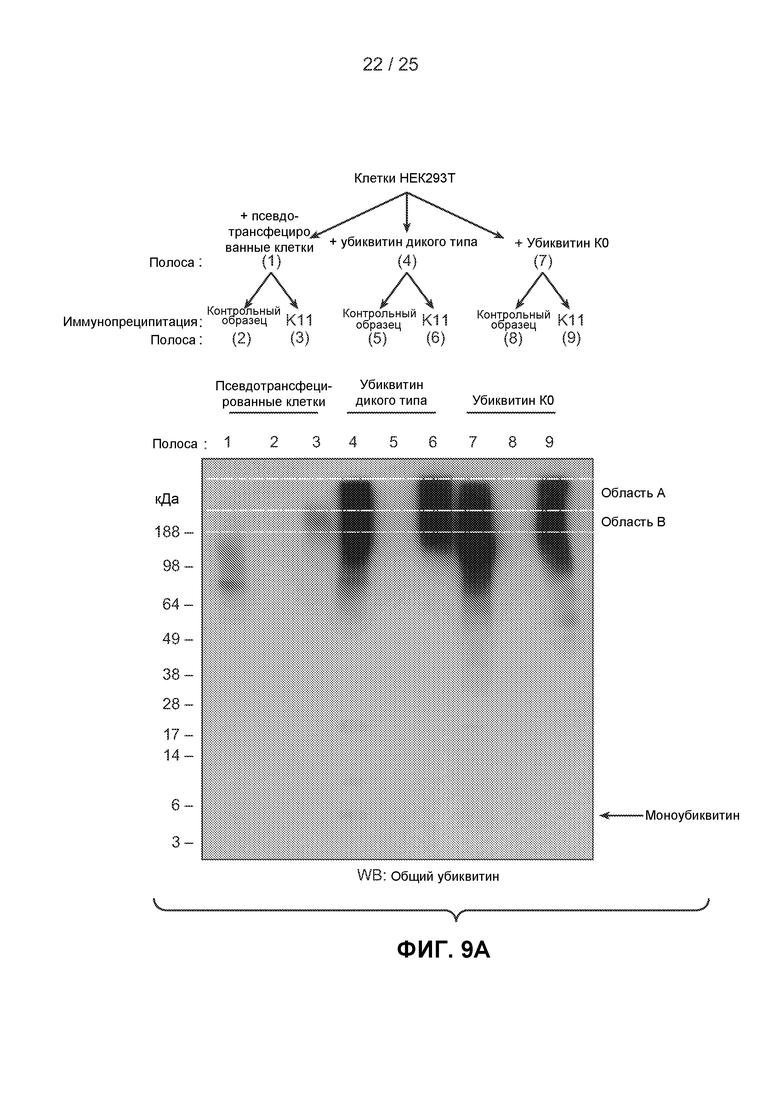
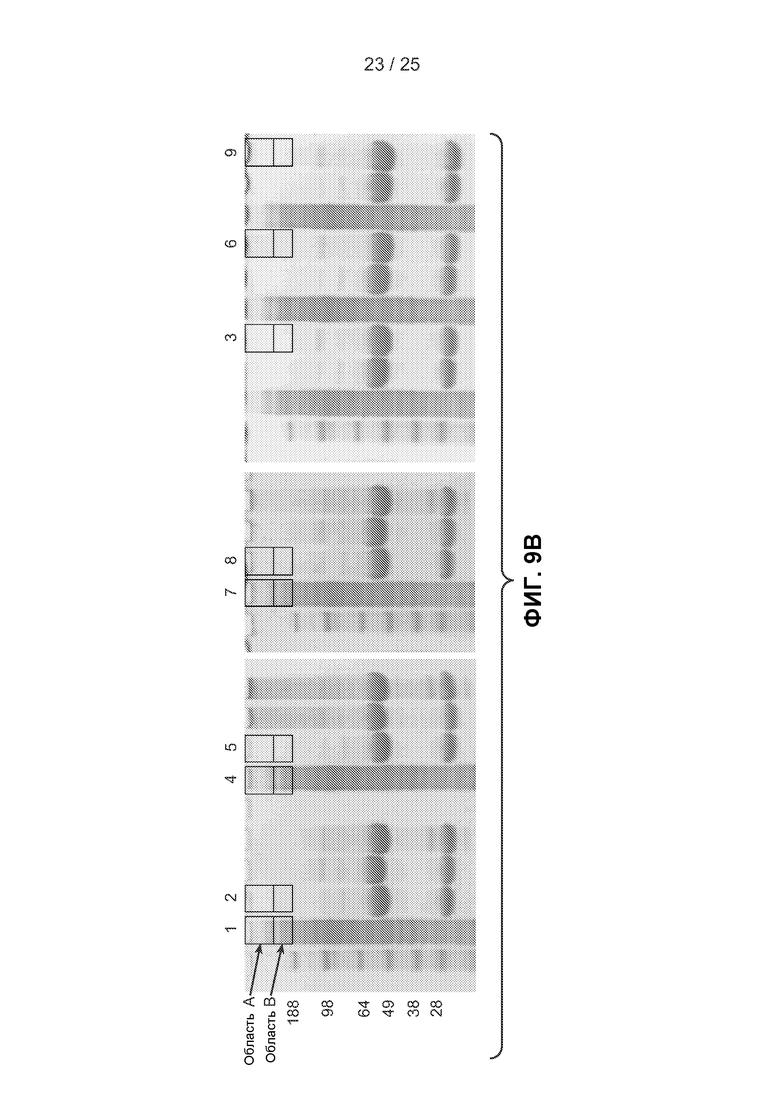
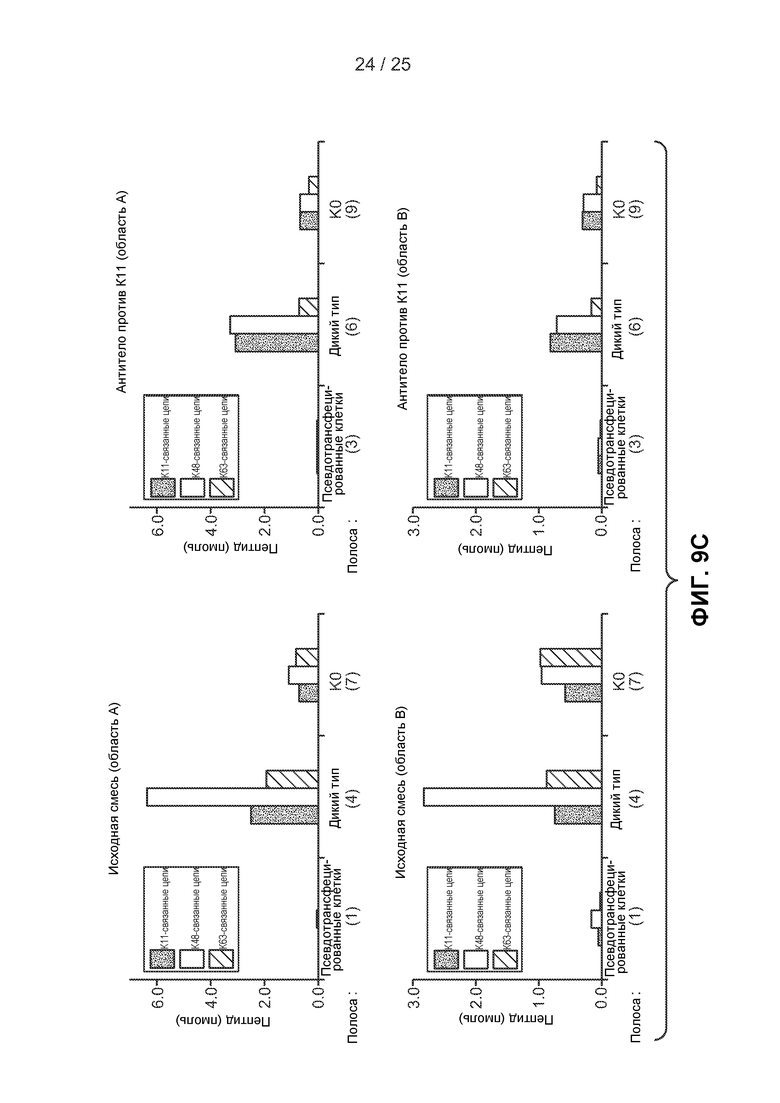
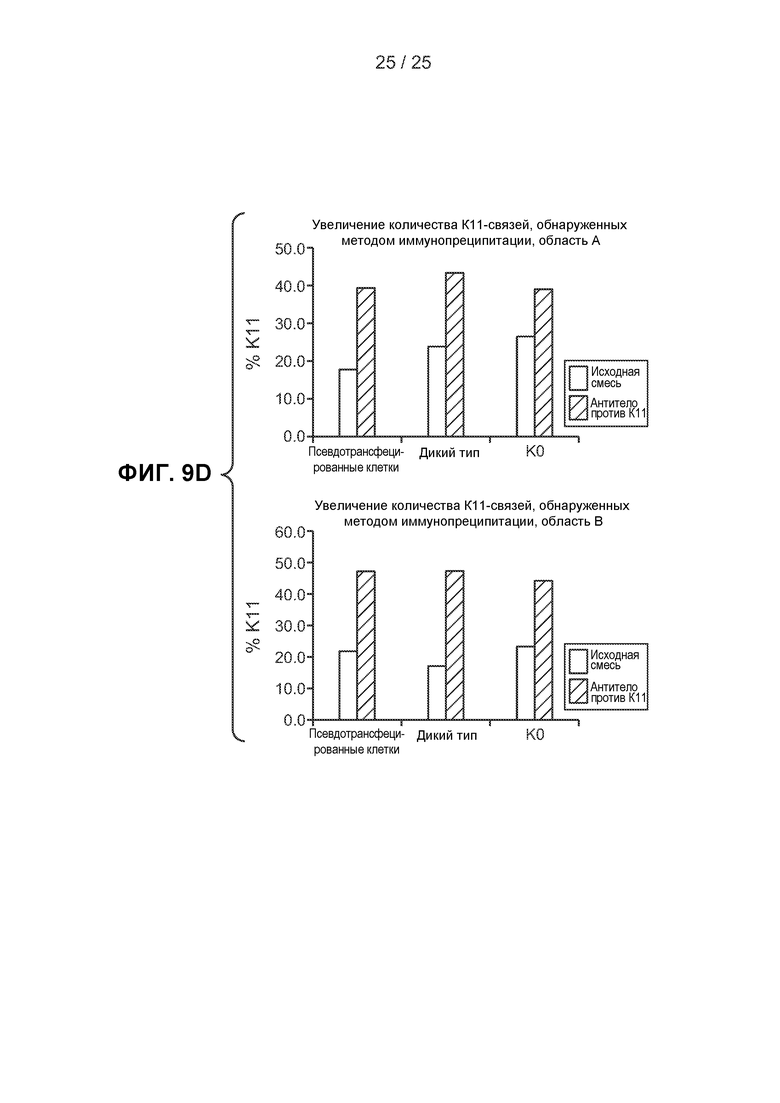
Данное изобретение относится к области иммунологии. Представлены моноклональное антитело и его фрагмент, которые связываются с K11-связанным полиубиквитином, охарактеризованные аминокислотными последовательностями гипервариабельных участков (HVR). Также рассмотрена выделенная нуклеиновая кислота, кодирующая антитело по изобретению; вектор экспрессии; клетка-хозяин и способ продуцирования антитела. Кроме того, предложены иммуноконъюгат и фармацевтический состав для лечения заболевания или нарушения, содержащий антитело по изобретению; применение антитела по изобретению для получения лекарственного средства; способ лечения индивида, страдающего заболеванием или нарушением, выбранным из рака, дегенеративного мышечного или нервного нарушения; а также способ определения присутствия K11-связанного полиубиквитина или полиубиквитинированного белка; способ отделения K11-связанного полиубиквитинированного белка и способ определения функции и/или активности K11-связанного полиубиктивина. Данное изобретение может найти дальнейшее применение в терапии и диагностике заболеваний, ассоциированных с образованием полиубиквитинов, содержащих связь, образованную лизином K11. 12 н. и 34 з.п. ф-лы, 9 ил., 5 табл., 3 пр.
1. Выделенное моноклональное антитело или его фрагмент, которые связываются с K11-связанным полиубиквитином, содержащие
последовательность HVR-L1, выбранную из SEQ ID NO: 2 и 57-60;
последовательность HVR-L2, выбранную из SEQ ID NO: 3 и 61;
последовательность HVR-L3, выбранную из SEQ ID NO: 4;
последовательность HVR-H1, выбранную из SEQ ID NO: 6-11;
последовательность HVR-H2, выбранную из SEQ ID NO: 12-17 и 67; и
последовательность HVR-H3, выбранную из SEQ ID NO: 18-23, 68 и 69.
2. Антитело по п.1, содержащее, соответственно,
последовательность HVR-L1 SEQ ID NO: 2,
последовательность HVR-L2 SEQ ID NO: 3 и
последовательность HVR-L3 SEQ ID NO: 4.
3. Антитело по п.1, содержащее последовательности HVR-H1, HVR-H2 и HVR-H3, соответствующие последовательностям, представленным для клонов A3, А6, А9, В5, F5 или G3 на фигуре 1В.
4. Антитело по п.1, содержащее последовательности HVR-L1, HVR-L2 и HVR-L3, соответствующие последовательностям, представленным для клонов 1А11, 1С12, 1F12, 2А3, 2А6, 2D7, 2Е6 или 2G4 на фигуре 4А.
5. Антитело по п.1, содержащее последовательности HVR-H1, HVR-H2 и HVR-H3, соответствующие последовательностям, представленным для клонов 1А11, 1С12, 1F12, 2А3, 2А6, 2D7, 2Е6 или 2G4 на фигуре 4В.
6. Антитело по п.1, содержащее последовательности HVR-L1, HVR-L2 и HVR-L3, соответствующие последовательностям, представленным для клонов 1С1/2Е6 или 2А3/2Е6 на фигуре 6А.
7. Антитело по п.1, содержащее последовательности HVR-H1, HVR-H2 и HVR-H3, соответствующие последовательностям, представленным для клонов 1С1/2Е6 или 2А3/2Е6 на фигуре 6В.
8. Антитело по п.1, содержащее
последовательность HVR-L1 SEQ ID NO: 2,
последовательность HVR-L2 SEQ ID NO: 3,
последовательность HVR-L3 SEQ ID NO: 4,
последовательность HVR-H1 SEQ ID NO: 11,
последовательность HVR-H2 SEQ ID NO: 17 и
последовательность HVR-H3 SEQ ID NO: 23.
9. Антитело по п.3, содержащее
последовательность HVR-L1 SEQ ID NO: 2,
последовательность HVR-L2 SEQ ID NO: 3,
последовательность HVR-L3 SEQ ID NO: 4,
последовательность HVR-H1 SEQ ID NO: 11,
последовательность HVR-H2 SEQ ID NO: 17 или 67 и
последовательность HVR-H3, выбираемую из SEQ ID NO: 23, 68 и 69.
10. Антитело по п.3, содержащее
последовательность HVR-L1, выбираемую из SEQ ID NO: 2, 57, 58 и 59,
последовательность HVR-L2 SEQ ID NO: 3 или 61,
последовательность HVR-L3 SEQ ID NO: 4,
последовательность HVR-H1 SEQ ID NO: 11,
последовательность HVR-H2 SEQ ID NO: 17 и
последовательность HVR-H3 SEQ ID NO: 23.
11. Антитело по п.3, содержащее
последовательность HVR-L1 SEQ ID NO: 58,
последовательность HVR-L2 SEQ ID NO: 3,
последовательность HVR-L3 SEQ ID NO: 4,
последовательность HVR-H1 SEQ ID NO: 11,
последовательность HVR-H2 SEQ ID NO: 67 и
последовательность HVR-H3 SEQ ID NO: 23.
12. Антитело по п.3, содержащее
последовательность HVR-L1 SEQ ID NO: 59,
последовательность HVR-L2 SEQ ID NO: 3,
последовательность HVR-L3 SEQ ID NO: 4,
последовательность HVR-H1 SEQ ID NO: 11,
последовательность HVR-H2 SEQ ID NO: 67 и
последовательность HVR-H3 SEQ ID NO: 23.
13. Антитело по п.3, содержащее аминокислотную последовательность легкой цепи, выбираемую из SEQ ID NO: 5 и 62-66.
14. Антитело по п.3, содержащее аминокислотную последовательность тяжелой цепи, выбираемую из SEQ ID NO: 27-32 и 70-72.
15. Антитело по п.3, содержащее аминокислотные последовательности легкой цепи и тяжелой цепи, которые по меньшей мере на 95% идентичны аминокислотным последовательностям одной из нижеследующих комбинаций последовательностей:
SEQ ID NO: 5 и 32;
SEQ ID NO: 63 и 32;
SEQ ID NO: 65 и 32;
SEQ ID NO: 5 и 72;
SEQ ID NO: 63 и 72; и
SEQ ID NO: 65 и 72;
SEQ ID NO: 62 и 32;
SEQ ID NO: 64 и 32;
SEQ ID NO: 5 и 70;
SEQ ID NO: 5 и 71;
SEQ ID NO: 66 и 32.
16. Антитело по п.15, содержащее аминокислотные последовательности легкой цепи и тяжелой цепи одной из нижеследующих комбинаций последовательностей:
SEQ ID NO: 5 и 32;
SEQ ID NO: 63 и 32;
SEQ ID NO: 65 и 32;
SEQ ID NO: 5 и 72;
SEQ ID NO: 63 и 72; и
SEQ ID NO: 65 и 72;
SEQ ID NO: 62 и 32;
SEQ ID NO: 64 и 32;
SEQ ID NO: 5 и 70;
SEQ ID NO: 5 и 71;
SEQ ID NO: 66 и 32.
17. Антитело по п.1, содержащее
последовательность HVR-L1, выбранную из SEQ ID NO: 2 и 57-60;
последовательность HVR-L2, выбранную из SEQ ID NO: 3 и 61;
последовательность HVR-L3 SEQ ID NO: 4;
последовательность HVR-H1 SEQ ID NO: 11;
последовательность HVR-H2, выбранную из SEQ ID NO: 17 и 67; и
последовательность HVR-H3, выбранную из SEQ ID NO: 23, 68 и 69.
18. Антитело по п.1, содержащее
последовательность HVR-L1 SEQ ID NO: 59;
последовательность HVR-L2 SEQ ID NO: 3;
последовательность HVR-L3 SEQ ID NO: 4;
последовательность HVR-H1 SEQ ID NO: 11;
последовательность HVR-H2 SEQ ID NO: 67; и
последовательность HVR-H3 SEQ ID NO: 23.
19. Антитело по п.1, содержащее
вариабельную область тяжелой цепи, содержащую последовательность, которая по меньшей мере на 95% по последовательности идентична последовательности SEQ ID NO: 72, и
вариабельную область легкой цепи, содержащую последовательность, которая по меньшей мере на 95% по последовательности идентична последовательности SEQ ID NO: 65.
20. Антитело по п.11, содержащее
вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 72, и
вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 65.
21. Антитело по любому из пп.1-20, где антитело не связывается с моноубиквитином.
22. Антитело по любому из пп.1-20, где антитело связывается с K11-связанным полиубиквитином, не связывается с K48-связанным полиубиквитином в жестких условиях, жесткие условия содержат 4М мочевину.
23. Антитело по любому из пп.1-20, где антитело связывается с K11-связанным полиубиквитином, не связывается с K63-связанным полиубиквитином в жестких условиях, жесткие условия содержат 4М мочевину.
24. Антитело по любому из пп.1-20, где антитело связывается с K11-связанным полиубиквитином, не связывается с K48-связанным полиубиквитином или K63-связанным полиубиквитином в жестких условиях, жесткие условия содержат 4М мочевину.
25. Выделенное антитело по любому из пп.1-20, где антитело специфически связывается с K11-связанным белком полиубиквитина.
26. Выделенное антитело по любому из пп.1-20, где антитело модулирует по меньшей мере полиубиквитин-опосредованный сигнальный путь.
27. Выделенное антитело по любому из пп.1-20, где антитело представляет собой гуманизированное антитело, химерное антитело или фрагмент антитела, которые связываются с K11-связанным полиубиквитином.
28. Выделенная нуклеиновая кислота, кодирующая антитело по любому из пп.1-27.
29. Вектор экспрессии, содержащий нуклеиновую кислоту по п.28.
30. Клетка-хозяин, содержащая нуклеиновую кислоту по п.28, экспрессирующая антитело по любому из пп.1-27.
31. Способ продуцирования антитела, специфически связывающегося с первым полиубиквитином, содержащим связь, образованную лизином K11, который включает культивирование клетки-хозяина по п.30 в условиях, обеспечивающих продуцирование указанного антитела.
32. Способ по п.31, который далее включает выделение антитела из клетки-хозяина.
33. Иммуноконъюгат для лечения заболевания или нарушения, содержащий антитело по любому из пп.1-27 и цитотоксическое средство, где заболевание или нарушение связано с K11-связанным полиубиквитином.
34. Фармацевтический состав для лечения заболевания или нарушения, содержащий антитело по любому из пп.1-27 и фармацевтически приемлемый носитель, где заболевание или нарушение связано с K11-связанным полиубиквитином.
35. Фармацевтический состав по п.34, который далее содержит дополнительное терапевтическое средство.
36. Антитело по любому из пп.1-27 для применения в качестве лекарственного средства для лечения заболевания или нарушения, связанного с K11-связанным полиубиквитином.
37. Антитело по любому из пп.1-27 для применения при лечении заболевания или нарушения, где заболевание или нарушение связано с K11-связанным полиубиквитином.
38. Антитело по п.37, в котором заболевание или нарушение выбирают из заболевания или нарушения, связанного с аберрантно ускоренным развитием клеточного цикла, и из заболевания или нарушения, связанного с аберрантно замедленным развитием клеточного цикла.
39. Антитело по п.38, в котором заболевание или нарушение, связанное с аберрантно ускоренным развитием клеточного цикла, является раком.
40. Антитело по п.38, в котором заболевание или нарушение, связанное с аберрантно замедленным развитием клеточного цикла, выбирают из дегенеративного мышечного нарушения и дегенеративного нервного нарушения.
41. Применение антитела по любому из пп.1-27 для получения лекарственного средства для лечения заболевания или нарушения, где заболевание или нарушение связано с K11-связанным полиубиквитином.
42. Применение по п.41, в котором лекарственное средство предназначено для лечения заболевания или нарушения, выбранного из рака, дегенеративного мышечного нарушения и дегенеративного нервного нарушения.
43. Способ лечения индивида, страдающего заболеванием или нарушением, выбранным из рака, дегенеративного мышечного нарушения и дегенеративного нервного нарушения, который включает
введение указанному индивиду эффективного количества антитела по любому из пп.1-27, где заболевание или нарушение связано с K11-связанным полиубиквитином.
44. Способ определения присутствия K11-связанного полиубиквитина или K11-связанного полиубиквитинированного белка в образце, предположительно содержащем полиубиквитин или полиубиквитинированный белок, который включает
осуществление воздействия на указанный образец по меньшей мере одного антитела по любому из пп.1-27 и
определение связывания по меньшей мере одного антитела с K11-связанным полиубиквитином или K11-связанным полиубиквитинированным белком в образце.
45. Способ отделения K11-связанного полиубиквитинированного белка от полиубиквитинированного белка, не связанного K11, в образце, который включает
приведение в контакт образца по меньшей мере с одним антителом по любому из пп.1-27.
46. Способ определения функции и/или активности K11-связанного полиубиквитина в клетке или образце, который включает
приведение в контакт клетки или образца по меньшей мере с одним антителом по любому из пп.1-27 и
оценку воздействия указанной стадии приведения в контакт клетки или образца.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| FUJIMURO MASAHIRO, HIDEYOSHI YOKOSAWA, "Production of antipolyubiquitin monoclonal antibodies and their use for characterization and isolation of polyubiquitinated proteins." Methods in enzymology, 2005, 399: 75-86 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СПОСОБЫ ИНГИБИРОВАНИЯ МИГРАЦИИ РАКОВЫХ КЛЕТОК | 2006 |
|
RU2404805C2 |
Авторы
Даты
2016-11-20—Публикация
2011-04-14—Подача