Данное изобретение описывает рекомбинантные молекулы МНС II класса, стабилизированные дисульфидной связью.
Молекула главного комплекса гистосовместимости (МНС) представляет собой центральный компонент иммунной системы позвоночных, находящийся на поверхности всех ядросодержащих клеток. МНС находится в двух основных формах, а именно МНС I и II класса. Важно, что обе версии образуют функциональные комплексы с подвергнутыми протеолизу пептидами, обозначаемыми Т-клеточными антигенными детерминантами, которые располагаются в той же самой клетке, которая экспрессирует указанный МНС. Полученный комплекс пептид/МНС (рМНС) впоследствии располагается в виде трансмембранного комплекса на поверхности клетки - данное явление описано в качестве антиген-презентации. рМНС, находящийся на клеточной поверхности, затем может взаимодействовать со своим когнатным партнером - рецептором T-клетки (TCR), находящемся на поверхности T-лимфоцитов.
Учитывая ключевую роль в адаптивном иммунитете, естественные и прикладные науки по существу заинтересованы в понимании взаимодействия pMHC-TCR на клеточном и молекулярном уровнях и, следовательно, в получении рекомбинантных версий обеих молекул. Кроме того, растет понимание того, что наличие таких рекомбинантных молекул очень важно для изучения и понятия биологии системы, а также для разработки новых терапевтических и диагностических препаратов.
Большое количество медицинских состояний требуют терапевтического вмешательства для модуляции активности иммунной системы пациента. Например, необходимо супрессировать аутоиммунные заболевания и аллергии, гиперактивное состояние иммунной системы и хроническое воспаление. В отличие от этого, иммуностимуляция является способом, подходящим для инфекций и рака, для активации и поражения иммунных клеток относительно раковых клеток. Кроме того, реципиенты трансплантатов обычно нуждаются в иммуносупрессии. Вместе все эти факты ведут к разработке большого количества иммуномодуляторов в промышленности, что оценивается в несколько миллиардов долларов.
Ключ к пониманию иммунного компонента при таких заболеваниях и отбор новых видов лечения состоит во взаимодействии между антиген-презентирующими клетками и T-клетками, или, более специфически, взаимодействии между молекулами МНС I и II класса и TCR. МНС II класса специфически связывается с экзогенными пептидами и представляет их для CD4+ T-хелперов (TH-клеток). Затем TH-клетка активируется и превращается в эффекторную клетку, которая секретирует различные цитокины. Такие цитокины активируют целый ряд других иммунных клеток, задействованных в защите от возникшей угрозы. Нарушение в данной системе может привести, например, к аутоиммунному заболеванию или выживаемости и делению раковых клеток. Таким образом, аутоиммунные заболевания характеризуются сильной взаимосвязью между МНС и инфильтрацией органа-мишени T-клетками.
Платформа для скрининга иммуномодулятора требует наличия стабильных, полностью функциональных и растворимых молекул МНС II класса. Важным является и то, что выработка растворимых молекул МНС II класса в настоящее время затруднена сложной проблемой, а именно, отсутствием молекулярной стабильности.
За последние несколько лет возможность получения растворимых молекул МНС I класса в виде тетрамеров (способ тетрамеров) стала революционной для основной и прикладной иммунологии (Constantin et al., 2002, Biological Research for Nursing, 4: 115-127). Причиной этому стал тот факт, что способ тетрамеров по существу повысил возможность отслеживать путь иммунного ответа специфическим образом относительно антигена и T-клеточного ответа, что оценивается, преимущественно, проточной цитометрией. Такая возможность также позволила более глубже понять иммунную систему и также может привести к возникновению новых диагностических инструментов.
В настоящее время тетрамерные реагенты в большой степени ограничены молекулами МНС I класса, так как должно было быть решено много технических вопросов, связанных с рекомбинантным получением молекул I класса. И в самом деле, относительно молекул МНС II класса, эта задача оказалась на деле значительно сложнее. Таким образом, в настоящее время не существует общего протокола получения тетрамеров МНС II класса, однако в литературе описаны отдельные примеры, представленные также в качестве имеющихся на рынке реагентов (Vollers, S. and Stem, L., 2008, Immunology 123: 305-313). В нескольких случаях, когда использовали тетрамеры МНС II класса, такие тетрамеры использовали в больших количествах, что оказало большое влияние на понимание развития болезни. Таким образом, принимая во внимание доказанное успешное влияние полученных рекомбинантных молекул МНС I класса, можно судить о наличии сильной и четкой мотивации со стороны науки и коммерческих предприятий, направленной на усилия по разработке новых молекул МНС II класса. Однако, учитывая имеющиеся на сегодняшний день проблемы, успех не гарантирован.
По причине частично не известных факторов, молекулу МНС II класса особенно трудно получить в виде устойчивой рекомбинантной молекулы в растворимой форме. Нативная молекула представлена в виде нековалентного трансмембранного гетеродимера, включающего α- и β-цепь, обе из которых имеют трансмембранные участки и принадлежат к суперсемейству иммуноглобулинов (Ig). Внеклеточный участок каждой цепи состоит из двух доменов, каждый включает примерно 90 аминокислотных остатков, при этом два дистальных мембранных домена, α1 и β1 домены, образуют решетчатую α/β структуру, играющую важную роль в связывании пептида с антигенными детерминантами T-клеток. Два проксимальных мембранных домена α2 и β2 образуют дискретные домены Ig. В α и β цепях участок из примерно 20 аминокислотных остатков соединяется с клеточной мембраной, а на цитоплазматической стороне мембраны располагается достаточно короткий пептидный сегмент.
Считается, что димеризация α и β цепей вызвана (i) трансмембранными сегментами, (ii) пептидным связыванием и (iii) обязательными вспомогательными компонентами, находящимися в мембране. Таким образом, после разделения от нативного содержания и получения в виде растворимой молекулы, молекула МНС II класса характеризуется присущей ей низкой устойчивостью и очень низкими уровнями выработки. Кроме того, должна соблюдаться обширная и материалоемкая, зависящая от отдельного случая оптимизация.
Кроме того, принимая во внимание указанные выше требования для димеризации, общие способы получения молекул МНС II класса представлены любым неестественным образом, т.е. любым способом, который отличается от получения с использованием мембраны клетки, которая естественным образом экспрессирует молекулы МНС II класса, например получения в качестве нерастворимых молекул, находящихся на поверхности других биологических молекул, клеток или частиц, например в виде нерастворимых молекул, экспрессируемых на поверхности фага путем слияния с белками капсида вируса, и считаются далеко не простыми.
Таким образом, на данный момент не существует какой-либо общей стратегии, позволяющей получить стабилизированный гетеродимер МНС II класса. Однако был проведен целый ряд исследований, которые представляют специфические для отдельных случаев успешные примеры и демонстрирующие сложность поставленной задачи. Такие примеры представлены (i) эктопической экспрессией связанного с мембраной гетеродимера МНС II класса на поверхности эукариотических клеток с использованием липидного линкера (якоря ГФИ), см. Wettstein et al., 1991, J. of Exp. Medicine, 174: 219-228; (ii) экспрессией экто доменов МНС II класса в клетках насекомых, см. Wallny et al., 1995, Eur. J. Immunology, 25: 1262-1266; (iii) введением гетерологичных мотивов димеризации, таких как лейциновых молний, C-терминально в молекулы МНС II класса в комбинации с получением клеток насекомых, см. Quarsten et al., 2001, J. Immunol., 167: 4861-4868, and Crawford et al., 2006, Immunological Reviews, 210: 156-170; (iv) получением химерных молекул антитело/МНС II класса в комбинации с получением клеток насекомых, см. Casares et al., 1997, Protein Engineering, 10: 1295-1301; (v) использованием систем бактериальной экспрессии, которые позволяют образовывать функциональные тримеры рМНС посредством повторного скручивания с использованием включенных молекул, см. Arimilli et al., 1995, J. Biol. Chem., 270:971-977; или (vi) использованием усеченной одноцепочечной версии МНС II класса бактериального происхождения, которая состоит только из доменов α1 и β1, которые обеспечивают образование функциональных молекул МНС посредством способов повторного скручивания и молекул включения, см. Burrows et al., 1999, Protein Engineering, 12: 771-778. Кроме того, Landais et al., 2009, J. Immunol., 183:7949-7957 описали систему экспрессии клетки насекомых, которая использует внутренние искусственные дисульфидные мостики в сочетании с экзогенными лейциновыми молниями для получения стабилизированных мышиных тетрамеров I-Ad OVA МНС II класса. Важным является тот факт, что, несмотря на повышенные уровни экспрессии, вызванные модификацией, ни одна из таких молекул с очевидно повышенной стабильностью не характеризовалась специфическим окрашиванием, свойственным T-клеткам.
Описанные здесь стратегии предоставляют существенные преимущества над используемыми ранее в науке системами, поскольку они не только обеспечивают общую стратегию, которая может быть применена ко всем молекулам МНС II класса, но также использоваться в системах экспрессии прокариотов, и не требует использования гетерологичных/экзогенных мотивов димеризации, таких как лейциновые молнии. Кроме того, описанные здесь стратегии используют для повышения функциональности, такой как свойственное для T-клеток окрашивание, что непосредственно характерно для введенных модификаций.
Удивительным является тот факт, что исследователи по изобретению идентифицировали общий способ, с использованием которого могут быть преодолены проблемы с нестабильностью, связанные с рекомбинантными молекулами МНС II класса, или уменьшены в большей степени. Такая стратегия включает получение рекомбинантных молекул МНС II класса, в которых присутствуют внеклеточные участки α и β цепей, а гетеродимер α и β цепей стабилизирован введенной рекомбинантным образом/искусственной дисульфидной связью, соединяющей две цепи с использованием доменного взаимодействия α2-β2. Дисульфидная связь блокирует молекулу в устойчивой конформации, в которой она полностью функциональна. Важным и преимущественным является тот факт, что данная стратегия для стабилизации гетеродимера МНС II класса изменчива и не ограничивается одним форматом рекомбинации, что позволяет избежать необходимости экстенсивной и материалоемкой, зависящей от случая оптимизации, описанной выше. Кроме того, в отличие от ряда существующих способов, данная стратегия может использоваться в системах экспрессии прокариотов/хозяевах-прокариотах, что само по себе удивительно, принимая во внимание тот факт, что в прокариотических клетках-хозяевах отсутствует сложный комплекс эукариотической клетки, что обычно требует правильного образования дисульфидной связи и, следовательно, образования функциональных молекул. Данное изобретение не только позволяет решить существующую в настоящее время проблему, мешающую проводить изучение и разработку иммуномодуляторов, но также может оказаться важным инструментом для разработки и модификации T-клеток и использования их в качестве способа терапии.
Таким образом, в одном аспекте данное изобретение описывает рекомбинантную молекулу МНС II класса, которая включает:
(i) весь или часть внеклеточного участка α-цепи МНС II класса;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса;
при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен, и (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса.
Как уже было указано выше, получение таких белков как молекулы МНС II класса, которые состоят из более чем одного полипептида и которые имеют трансмембранный домен, может быть затруднено без использования их нативных мембран, и особенно их растворимых форм, потому что во многих случаях белок стабилизируется, помимо всего прочего, собственным трансмембранным участком и, возможно, вспомогательными компонентами мембраны. Это характерно для молекул МНС II класса и отражено в литературе, где молекулы МНС II класса описаны как нестабильные, без возможности получения их с хорошим выходом, или неспособные распознавать и связывать пептиды. Таким образом, молекулы по данному изобретению представляют собой огромное преимущество в сравнении с известными ранее в науке, так как они являются стабильными и также могут распознавать и связывать пептиды, а также обеспечивать окрашивание T-клеток.
Как это было указано выше, нативные молекулы МНС II класса включают α- и β-цепь, обе из которых имеют трансмембранные участки и принадлежат к суперсемейству иммуноглобулинов (Ig). Внеклеточный участок каждой цепи состоит из двух доменов, каждый включает примерно 90 аминокислотных остатков, при этом два дистальных мембранных домена, α1 и β1 домены, образуют решетчатую α/β структуру, играющую важную роль в связывании пептида с антигенными детерминантами T-клеток. Два проксимальных мембранных домена α2 и β2 образуют дискретные домены Ig. В обеих α- и β-цепях участок из примерно 20 аминокислотных остатков соединяется с клеточной мембраной, а на цитоплазматической стороне мембраны располагается достаточно короткий пептидный сегмент.
Молекулы по данному изобретению включают весь или участок внеклеточного домена α-цепи МНС II класса или весь или участок внеклеточного домена β-цепи МНС II класса. Внеклеточный участок α-цепи МНС II класса включает сигнальную последовательность, мембранный дистальный домен α1 и мембранный проксимальный домен α2 (который образует дискретный домен Ig). Между трансмембранным доменом и доменом α2 существует также спейсерный фрагмент. Подобным образом, внеклеточный участок β-цепи МНС II класса включает сигнальную последовательность, мембранный дистальный домен β1 и мембранный проксимальный домен β2 (который образует дискретный домен Ig), а также спейсерный участок.
Таким образом, в контексте данного изобретения термин «внеклеточный участок α-цепи МНС II класса» не включает трансмембранный домен или цитоплазматический домен α-цепи. В самом деле, в преимущественных вариантах воплощения изобретения рекомбинантные молекулы МНС II класса не включают любые аминокислотные остатки указанного трансмембранного домена (т.е. аминокислоты, кодируемые указанными трансмембранными экзонами) или любые аминокислотные остатки указанных цитоплазматических доменов.
Подобным образом, в контексте данного изобретения термин «внеклеточный участок β-цепи МНС II класса» не включает трансмембранный домен или цитоплазматический домен β-цепи. В самом деле, в преимущественных вариантах воплощения изобретения рекомбинантные молекулы MHC II класса не включают любые аминокислотные остатки указанного трансмембранного домена (т.е. аминокислоты, кодируемые указанными трансмембранными экзонами) или любые аминокислотные остатки указанных цитоплазматических доменов.
Все указанные внеклеточные участки α- и/или β-цепи могут присутствовать в рекомбинантных молекулах по изобретению (т.е. сигнальный пептид, домен α1/β1, домен α2/β2 и спейсерный участок). Кроме того однако, в молекулах по изобретению необходимо присутствие только одной части внеклеточного участка α- и/или β-цепи, при условии, что рекомбинантные молекулы остаются функциональными относительно своей способности связываться с соответствующим пептидом, например, эффекторным пептидом T-клеток, и при условии, что указанные молекулы включают искусственные (не нативные) остатки цистеина в такой форме или конфигурации, что они могут использоваться для образования дисульфидной связи, необходимой для стабилизации рекомбинантной молекулы МНС II класса.
Сигнальный пептид может и не содержать α и/или β цепей рекомбинантных молекул МНС по изобретению, в частности молекула МНС II класса экспрессируется в клетках прокариотов. Такие структуры, в которых отсутствует соответствующее количество N-терминальных аминокислотных остатков, могут легко быть построены и получены специалистом в данной области. Они могут быть протестированы на предмет того, влияют ли такие пропуски на функцию, например, способность связываться с белком или активировать или окрашивать T-клетки, или стабильность молекулы.
Спейсерный участок также может отсутствовать полностью или быть усечен, например, как это показано в экспериментальных Примерах, в которых отсутствует спейсер α-цепи и 9 аминокислот спейсера β-цепи. Опять-таки, такие структуры, в которых отсутствует соответствующее количество аминокислотных остатков спейсера, могут быть легко построены и получены специалистом в данной области. Они также могут быть протестированы на предмет того, если такие пропуски влияют на функцию, например способность связываться с белком или активировать или окрашивать T-клетки, или стабильность молекулы.
Преимущественные молекулы по изобретению включают, по меньшей мере, часть домена α1 и, по меньшей мере, часть домена β1, при условии, что функция таких доменов, а именно связывание с белками или другие описанные здесь функции, например, представление таких белков для T-клеточных рецепторов (TCRs), не затронута. Кроме того, рекомбинантная молекула МНС II класса в целом должна оставаться функциональной в плане способности связываться с белками или других описанных здесь функций, например, представлять такие белки для T-клеточных рецепторов (TCRs). Преимущественно, присутствуют полные или целые домены α1 и/или β1, или по существу полные или целые домены α1 и/или β1, при этом указанные по существу полные или целые домены включают вариации из нативной последовательности, например вставки аминокислот, делеции или замены, которые не влияют на функцию таких доменов связываться с белками или другие функции, описанные в тексте данной заявки, например представлять такие белки для T-клеточных рецепторов (TCRs). Определение того, какие аминокислотные остатки могут быть мутированы, модифицированы или удалены без изменения такой функции, должно быть очевидно для специалиста в данной области. Другие преимущественные функции, которые свойственные для молекул МНС II класса, включают способность активировать T-клетки и, более преимущественно, способность окрашивать T-клетки.
Таким образом, такие преимущественные молекулы по изобретению включают достаточное количество остатков доменов α1 и β1 для способности связывать белки, например для представления таких белков для TCRs, для активации T-клеток или для обеспечения окрашивания T-клеток.
Другие преимущественные молекулы по изобретению включают, по меньшей мере, часть домена α2 и, по меньшей мере, часть домена β2 при условии, что присутствуют ненативные остатки цистеина, используемые для образования дисульфидной связи. Такие остатки цистеина необходимы в соответствующих ориентациях и на соответствующих расстояниях друг от друга, таким образом, между остатками цистеина может образоваться дисульфидный мостик, действуя для стабилизации рекомбинантной молекулы МНС II класса. Кроме того, рекомбинантная молекула МНС II класса в целом должна оставаться функциональной в плане способности связываться с белками или других описанных здесь функций, например представлять такие белки для T-клеточных рецепторов (TCRs). Преимущественно, присутствуют полные или целые домены α2 и/или β2, или по существу полные или целые домены α2 и/или β2, при этом указанные по существу полные или целые домены включат вариации из нативной последовательности, например, вставки аминокислот, делеции или замены, которые не влияют на образование дисульфидного мостика между доменами α2 и β2 и последующую стабилизацию рекомбинантной молекулы МНС II класса, и не влияют губительным образом на скручивание доменов α2 или β2. Определение того, какие аминокислотные остатки могут быть мутированы, модифицированы или удалены без изменения такой функции, должно быть очевидно для специалиста в данной области.
Расположение аминокислот различных структурных и функциональных доменов и участков α и β цепей МНС II класса широко известно и описано в науке, например, в Burrows et al, 1999 (см. выше). Расположение различных доменов также показано на Фигуре 3, и такая информация может быть легко использована для построения рекомбинантных молекул по изобретению, как это описано в тексте данной заявки (см. например Фигуру 7).
Соответствующие функциональные тесты для оценки способности рекомбинантных молекул по изобретению связываться с пептидом, активировать T-клетку или окрашивать T-клетки, также должны быть хорошо известны специалисту в данной области и должны включать, например, способы поверхностного плазменного резонанса (SPR), такие как Biacore, и способы проточной цитометрии, такие как FACS. Использование проточной цитометрии особенно преимущественно, так как она может использоваться в комбинации с живыми клетками.
В контексте данного изобретения термин «дисульфидная связь» описывает любой дисульфидный мостик, например введенный рекомбинантным образом или искусственный дисульфидный мостик, который образован между остатками цистеина, расположенными на домене α2 α-цепи и домене β2 β-цепи гетеродимера МНС II класса (т.е. является междуцепочечным относительно внутрицепочечной дисульфидной связи). Такие дисульфидные связи образуют ковалентную связь между α-цепью и β-цепью и действуют для стабилизации гетеродимера МНС II класса. Таким образом, рекомбинантные молекулы по изобретению устойчивы, но сохраняют полную функциональность, например, у них сохранена их нативная специфичность относительно когнатных лиганд T-клеточных рецепторов, и, преимущественно, они сохраняют свою способность активировать T-клетки или окрашивать T-клетки.
Свойство молекулы МНС II класса по изобретению оставаться устойчивой или стабилизированной может быть оценено с использованием хорошо известных способов, таких как повышенная устойчивость к тепловой денатурации (измерено, например, ИФА, SPR или циркулярным дихроизмом). Более преимущественный тест представляет собой оценку гетеродимеров на геле SDS PAGE. Интактные и стабильные гетеродимеры с дисульфидной связью могут быть легко замечены на геле SDS PAGE в невосстанавливающих условиях, при этом визуализируется полоса при соответствующем молекулярном весе, свойственном интактному гетеродимеру. Соответствующий анализ представлен в Примерах, см. Фигуры 5 и 10.
Такие дисульфидные связи образовываются между остатками цистеина, которые отсутствуют обычно в нативных доменах α2 и β2 MHC II класса. Таким образом, такие остатки цистеинов введены рекомбинантно или искусственным образом, например, путем сайт-специфической мутации соответствующих остатков не являющихся цистеином в нативной молекуле в цистеиновые остатки, что обеспечивает образование дисульфидной связи между нововведенными остатками цистеина в доменах α2 и β2. Такие связи также могут быть описаны в виде внутренних дисульфидных связей.
Соответствующие остатки для мутации в цистеин преимущественно имеют соответствующие β-атомы углерода, расположенные на расстоянии примерно 6Å (0,6 нм), 7Å (0,7 нм) или менее, например, в диапазоне от 4Å (0,4 нм) или от 5Å (0,5 нм) до 6,5Å (0,65 нм) или 7Å (0,7 нм), преимущественно в диапазоне от 5Å (0,5 нм) до 6,5Å (0,65 нм), более преимущественно в диапазоне от 4Å (0,4 нм) или 5Å (0,5 нм) до 5,6Å (0,56 нм) или 6Å (0,6 нм) друг от друга в нативном гетеродимере МНС II класса. Преимущественные сайты для мутации неизменны между видами и между изоформами и изотипами в отдельных видах. В частности, преимущественные сайты для мутации неизменны в последовательностях МНС II класса мыши и человека или между изотипами МНС II класса человека, такими как DP, DQ и DR, или между изотипами мыши, такими как I-Е и I-A.
Кроме того, преимущественные сайты для мутации идентифицируют путем структурной оценки на основе 3D наложения кристаллических структур. В этом случае могут быть исследованы остатки, образующие взаимодействие между доменами α2 и β2, и для дальнейшего анализа или мутации в остатки цистеина могут быть выбраны боковые цепи с β-атомами углерода, расположенными на расстоянии 7Å или менее (или на любом другом расстоянии или диапазоне расстояний, указанном выше) друг от друга. Способы проведения такой структурной оценки должны быть знакомы специалисту в данной области. Например, кристаллические структуры молекул МНС II класса имеются в свободном доступе для такого анализа, например они могут быть получены из банка данных белков RCSB PDB. В науке также представлено соответствующее программное обеспечение или другие способы для проведения подобного 3D наложения кристаллических структур, например, представлено такое программное обеспечение, как PyMOL, MOLMOL, DeepView, и другие, предназначенное для использования на веб-сайтах, такое как iSuperpose.
Для образования дисульфидной связи используют отдельные преимущественные пары сайтов, в которые вводят цистеин, представленные одной или несколькими следующими парами, т.е. одной или несколькими парами Pro 96α2-Ser 119β2 (положение 1), Ser 95α2-Ser 121β2 (положение 2), Arg 94α2- Asn 151β2 (положение 3), Phe 148α2-Gly 152β2 (положение 4), Pro 96α2-Thr 101β2 (положение 5), Pro 96α2-Ser 121β2 (положение 6), Ile 106α2-Asn 151β2 (положение 7) и Ser 95α2-Asp 122β2 (положение 8). Пары пронумерованы в соответствии с близостью β-атомов углерода и при использовании любой из таких пар преимущественно используют пары в положениях от 1 до 4 или от 1 до 3. В частности, преимущественно использование пары в положении 1 или положении 2.
Расположение аминокислот и природа аминокислоты в данном положении в парах остатков, расположенных в доменах α2 и β2 и описанных выше, соответствует мышиному изотипу I-Е молекул МНС II класса. Нумерация аминокислот относится к аминокислотам зрелого пептида (т.е. нумерация исключает сигнальный пептид). Типичная эталонная последовательность, которая может использоваться для идентификации расположения модифицированных остатков аминокислот, представлена последовательностью I-Е, указанной в базе данных IMGT и на Фигуре 3 (указана как Н-2ЕА*02 для α-цепи (SEQ ID NO: 1) и Н-2ЕВ*01 для β-цепи (SEQ ID NO: 2)). Действительно, остатки в положении 1, положении 2 и положении 3 промаркированы черной штриховкой на Фигуре 3, а положения других остатков могут быть легко определены на Фигуре 3.
Таким образом, если иное не определено, нумерация и зрелые аминокислотные остатки МНС II класса, описанные в тексте данной заявки, указаны в соответствии с системой IMGT, описанной в Lefranc, М-Р., et al., 2009 (Nuc. Acids Res., 37: D1006-D1012, издание базы данных), вместе с базами данных IMGT, указаны на следующих веб-сайтах: http://imgt.cines.fr; http://www.imgt.org. Соответствующие регистрационные номера GenBank также указаны в Примерах. Например, регистрационные номера для Н-2Е (мышиный I-Е) представлены К00971 (α-цепь) и AF050157 (β-цепь).
В преимущественных вариантах воплощения изобретения дисульфидная связь располагается между остатками цистеина, расположенными на остатках, соответствующих Pro 96α2-Ser 119β2 (положение 1), Ser 95α2-Ser 121β2 (положение 2) или Arg 94α2-Asn 151β2 (положение 3) зрелых полипептидов мышиного изотипа I-Е или эквивалентным положениям в альтернативном изотипе МНС II класса. Эталонные последовательности для определения расположения таких остатков цистеина описаны в тексте данной заявки.
Указанные выше преимущественные пары сайтов также представлены в Таблице 2 с использованием нумерации 1FNG, т.е. одной или несколькими парами Pro 96α2-Ser 118β2 (положение 1), Ser 95α2-Ser 120β2 (положение 2), Arg 94α2-Asn 150β2 (положение 3), Phe 148α2-Gly 151β2 (положение 4), Pro 96α2-Thr 100β2 (положение 5), Pro 96α2-Ser 120β2 (положение 6), Ile 106α2-Asn 150β2 (положение 7) и Ser 95α2-Asp 121β2 (положение 8), и нумерации IMGT. Для нумерации 1FNG порядковый номер аминокислоты в Таблице 2 соответствует нумерации в базе данных Protein Data Bank (PDB) с трехмерной структурной информацией о биологических макромолекулах, номеру записи PDB ID: 1FNG, и можно увидеть, что расположение соответствующих остатков β-цепи в записи в такой базе данных на одну аминокислоту меньше, чем эквивалентные остатки в последовательности базы данных IMGT. Таким образом, данная номенклатура немного отличается.
Эквивалентные остатки, представленные в Таблице 2 и на Фигуре 3, могут быть легко идентифицированы в других мышиных изотипах, например, изотипах I-A, или изотипах человека, например путем выравнивания с использованием программного обеспечения, такого как Clustal. Выравнивание с мышиным изотипом I-A представлено на Фигуре 3. Кроме того, типичные сопоставления с аллотипами человека HLA-DP, -DQ и -DR молекул МНС II класса представлены на Фигуре 7. Расположение эквивалентных остатков в положениях 1, 2 и 3 представлено в Таблице 2 и на Фигуре 3 и промаркировано черной штриховкой на Фигуре 7A для α-цепи и Фигуре 7B для β-цепи, а положения других остатков могут быть легко определены на Фигуре 7. Также видно, что положения α2 и β2 в Таблице 2 и на Фигуре 3 полностью сохранены во всем репертуаре HLA человека.
Таким образом, выравнивание последовательностей, представленное на Фигуре 7, вместе с представленной выше информацией может использоваться для поиска соответствующих остатков для мутации в цистеин в доменах α2 и β2 в любом аллеле МНС человека II класса для образования дисульфидной связи в требуемом месте. Подобные способы выравнивания могут использоваться для идентификации эквивалентных остатков в любом другом виде или изотипе.
Стабилизирующие дисульфидные связи, как это описано в тексте данной заявки, соответствуют другим способам и средствам стабилизации молекул МНС II класса, таким как описанные ранее способы и средства в науке. Например, дисульфидные связи могут использоваться в сочетании с различными мотивами димеризации, такие как мотивы лещиновых молний (например, как это описано в Quarsten et al., 2001 and Crawford et al., 2006, см. выше), или в сочетании со слияниями Ig (т.е. слияниями с участком Fc иммуноглобулина, например, как это описано в Casares et al., 1997, см. выше) и молекулами по изобретению вместе с векторами, кодирующими их, с разработкой соответствующим образом.
Как это указано в любом тексте данной заявки, экспрессия или выработка молекул по изобретению в прокариотических, например бактериальных, хозяевах преимущественны и в таких вариантах воплощения изобретения, в частности, в вариантах воплощения, в которых молекулы изолированы от включенных тел, преимущественно, чтобы, мотивы лейциновых молний или других мотивов димеризации не использовались.
Таким образом, преимущественный аспект изобретения описывает рекомбинантную молекулу МНС II класса, способную экспрессироваться в бактериальном хозяине и включающую:
(i) весь или часть внеклеточного участка α-цепи МНС II класса;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса;
при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен, и (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса.
Другой преимущественный аспект описывает рекомбинантную молекулу МНС II класса, которая включает:
(i) весь или часть внеклеточного участка α-цепи МНС II класса;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса;
при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен, и (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, и, кроме того, указанная рекомбинантная молекула не включает мотив лейциновой молнии. В других вариантах воплощения изобретения не включен мотив димеризации. В таких вариантах воплощения изобретения преимущественно, чтобы рекомбинантная молекула МНС II класса способна была экспрессироваться в прокариотическом, например, бактериальном, хозяине.
Несмотря на то, что дисульфидные связи по изобретению могут использоваться в сочетании с другими способами и средствами стабилизации молекул МНС II класса, указанные дисульфидные связи могут обеспечивать единственный способ стабилизации молекул МНС II класса. В самом деле, такие варианты воплощения изобретения являются преимущественными. В контексте данного изобретения термин «единственный способ стабилизации молекул МНС II класса» обозначает дисульфидные связи, обеспечивающие единственный или один способ стабилизации молекул в сравнении с любой стабилизацией, которая существует в природе или свойственна отдельной молекуле МНС II класса, например, дисульфидные связи по изобретению обеспечивают единственный или полностью искусственный или введенный рекомбинантно или ненативный способ стабилизации молекулы МНС II класса. Таким образом, такие варианты воплощения изобретения исключают использование других способов стабилизации, описанных в науке, таких как лейциновых молний или других мотивов димеризации.
Удивительным является тот факт, что таких дисульфидных связей достаточно для стабилизации молекул МНС II класса без каких-либо дополнительных ненативных способов стабилизации, таких как мотив димеризации, который представлен в описанных здесь данных, при чем такие молекулы отображаются в стабильной и функциональной форме на поверхности нитевидного бактериофага. Такой результат был очень удивительным, принимая во внимание факт того, что рекомбинантные молекулы, построенные по топологии складчатости Ig, были экспрессированы в прокариотическом хозяине. Складчатость Ig, которая в природе возникает только в домене эукариотов, требует наличия сохраненного моста S-S в интрадомене, который должен быть образован между нативными остатками цистеина (Halaby, D.M., et al., 1999, Protein Eng., 12 (7): 563)) для получения соответствующей функциональной топологии. Следовательно общепринято, что если такая молекула экспрессируется в прокариотическом хозяине, что неизбежно ведет за собой отсутствие сложного механизма шаперонов эукариотической клетки, необходимого для правильного образования моста S-S, очевидным является аберрантное образование моста S-S, что приводит к отсутствию функциональной экспрессии. Нельзя сказать, что рекомбинантные стратегии, включающие повышенное количество цистеинов, приводят к образованию определенных искусственных мостов S-S в таких системах, и, следовательно, обычно считаются непригодными. Таким образом, мы предоставили четкое доказательство того, что это не так, поскольку функциональные молекулы отображены на фаге, как это показано образованием ковалентного димера (Фигуры 5 и 10) со специфическим связыванием с когнатным лигандом (Фигура 6 и Фигура 9).
В одном варианте воплощения изобретения α- и β-цепи молекул МНС II класса по изобретению также включают внутрицепочечные дисульфидные связи, например, встречающиеся в природе внутрицепочечные связи, которые существуют между встречающимися в природе остатками цистеина. Такие встречающиеся в природе внутрицепочечные дисульфидные связи могут существовать, например, в доменах α2 и β2 для образования топологии складчатости Ig таких доменов. Кроме того, большинство молекул МНС II класса несут внутридоменный дисульфидный мостик в домене β1, который соединяет нижнюю часть β-слоя с участком α-спирали. Более того, многие молекулы МНС II класса включают дополнительный несвязанный цистеин в нижней части β-слоя домена β1, который не участвует в образовании любого дисульфидного мостика, но который может образовывать неправильные дисульфидные связи с введенными ненативными остатками цистеина. Таким образом, в преимущественных вариантах воплощения изобретения, в частности, в вариантах воплощения изобретения, в которых используется прокариотическая экспрессия, такой остаток удален, например путем мутации в альтернативный остаток, который сохраняет общую структуру, такой как серин или аланин. Специалист в данной области легко может найти место такого остатка цистеина в любом аллеле МНС II класса. Например, такой цистеин соответствует остатку 38 β-цепи в полной эталонной последовательности Н-2ЕВ*01 IMGT, как это показано на Фигуре 3B (SEQ ID NO: 2), или остатку 12 в зрелой эталонной последовательности IMGT (т.е. без сигнального пептида).
Другие остатки цистеина домена β1 (образующие мостик), которые также могут способствовать образованию неправильной дисульфидной связи с нововведенными ненативными остатками цистеина, также могут быть легко определены специалистом в данной области. Например, такие остатки цистеина расположены в положениях 42 и 106 полной эталонной последовательности Н-2ЕВ*01 IMGT, как это показано на Фигуре 3B (SEQ ID NO: 2), или положениях 16 и 80 соответственно в зрелой эталонной последовательности IMGT (т.е. без сигнального пептида). В альтернативных и преимущественных вариантах воплощения изобретения один или несколько таких остатков цистеина отсутствует. Это может быть достигнуто путем мутации одного или нескольких соответствующих нативных остатков цистеина в другой остаток аминокислоты, который не участвует в образовании дисульфидной связи, для предотвращения образования связи. Типичные остатки для замены цистеина должны быть представлены остатками, которые сохраняют общую структуру молекулы, например, сохраняют водородную связь. Преимущественным выбором будет Ser или Ala, как это описано выше.
Таким образом, описанное выше удаление одного или нескольких нативных остатков цистеина помогает предотвратить образование неправильной дисульфидной связи между нативными остатками цистеина и нововведенными ненативными остатками цистеина по изобретению. Таким образом, в преимущественных вариантах воплощения изобретения удалено один или более остатков нативного цистеина в домене β1. В особенных преимущественных вариантах воплощения изобретения один или несколько остатков цистеина соответствуют положениям 38, 42 или 106 полной эталонной последовательности Н-2ЕВ*01 (SEQ ID NO: 2) (или эквивалентным остаткам в зрелой эталонной последовательности), или один или несколько остатков цистеина в эквивалентных положениях в альтернативном изотипе МНС II класса удалены.
В контексте данного изобретения термин «функциональный пептид-связующий домен» описывает домен в рекомбинантной молекуле МНС II класса по изобретению, который способен связываться с пептидом, например, эффекторным пептидом T-клетки или пептидом антигена. Такое связывание с пептидом должно происходить на определяемом уровне, а соответствующие способы для определения связывания должны быть известны специалисту в данной области, например представлены способами поверхностного плазменного резонанса (SPR) или способами проточной цитометрии. В некоторых вариантах воплощения изобретения указанные пептиды связываются таким образом, что обеспечивается представление указанного пептида для TCR, или, по меньшей мере, возможно тестирование способности такого пептида быть представленным для TCR.
Преимущественно, такие пептиды связаны или ассоциированы с молекулой МНС II класса таким образом, что это позволяет связывание TCR с комплексом рМНС. Более преимущественно такое взаимодействие с TCR обеспечивает окрашивание или другую визуализацию Т-клеток, которые распознают комплекс рМНС. Преимущественно такой пептид-связующий домен способен связываться с пептидом и затем инициировать активацию T-клеток посредством TCR, например способен индуцировать T-хелперные клетки для секреции цитокинов, таких как ИЛ-2, или для индуцирования пролиферации (измерено, например, по введению BrdU в виде cpm). Такие пептид-связующие домены обычно образованы остатками из доменов α1 и β1 молекул МНС II класса.
Молекулы МНС II класса по изобретению могут быть представлены в пустой или ненагруженной форме, т.е. без пептида, связанного с описанным выше пептид-связующим доменом (т.е. не включать пептид). В таком случае молекулы МНС II класса могут быть впоследствии нагружены любым соответствующим пептидом in vitro. Такая нагрузка in vitro является преимущественной для используемых молекул МНС II класса, что позволяет придать стабильность гетеродимеру II класса, и такие молекулы получают уже с присоединенным пептидом, например, пептиды получают в виде ковалентно присоединенного белка слияния с β-цепью МНС посредством короткого линкера. In vitro нагрузка обеспечивает получение действительно общей молекулы МНС II класса без обеспечения разного вектора экспрессии для каждого отдельного комплекса МНС-пептид.
В некоторых вариантах воплощения изобретения рекомбинантные молекулы МНС II класса включают пептид, связанный или ассоциированный с указанным выше пептид-связующим доменом. Может использоваться любой пептид, который может связываться или быть ассоциированным с пептид-связующим доменом, образованным из остатков доменов α1 и β1 молекул МНС II класса. Как правило, такие пептиды имеют 12-25 мономерных звеньев и обычно выпячивают с обоих концов бороздки, образованной доменами α1 и β1.
В нативных молекулах МНС II класса такие пептиды получают из экзогенных антигенов. В данном изобретении может использоваться любой из таких пептидов. Например, некоторые специфические эффекторные пептиды T-клеток, которые представляют молекулы МНС II класса и обеспечивают связывание TCR и активацию T-клеток, были идентифицированы и задокументированы в науке, и любой из таких пептидов может использоваться в сочетании с данным изобретением. В частности, определенные пептиды, представленные молекулами МНС II класса, были идентифицированы как ассоциированные с отдельными заболеваниями, и в вариантах воплощения изобретения, в которых рекомбинантные молекулы МНС II класса ассоциированы с пептидом, такие специфические относительно заболевания пептиды являются преимущественными. Некоторые из таких пептидов описаны в науке, а другие будут идентифицированы в будущем; любой из таких пептидов будет подходить для использования с описанными молекулами МНС II класса.
Типичные пептиды, которые ассоциируются или связываются с пептид-связующим доменом молекул МНС II класса, представлены α-II-глиадином (N-PQPELPYPOPE-C), который, как оказалось, присутствует на молекулах HLA-DQ2 МНС II класса и который связан с развитием глютеновой болезни; пептидом hCkappa aa40-48 (N-WKIDGSERQ-C) человека, который присутствует на молекулах HLA-DR4 МНС II класса и который связан с развитием ревматоидного артрита; пептидом TTaa947-967 (N-FNNFTVSFWLRVPKVSASHLE-C) человека, который присутствует на молекулах HLA-DP1 МНС II класса и который связан с развитием тетануса; и пептидом, полученным из гемагглютинина (НА) из Н. influenza (aa110-120: N-SFERFEIFPKE-C), который представлен на молекулах I-Ed II класса мыши.
Кроме того, могут использоваться другие пептиды, например, для идентификации того, могут ли такие пептиды связываться с пептид-связующим доменом, а также того, могут ли они обеспечивать связывание T-клеток и, преимущественно, окрашивание T-клеток посредством TCR или обеспечивать активацию Т-клеток. Таким образом, молекулы по изобретению могут использоваться для идентификации новых и ранее неизвестных пептидов (например антигенных пептидов), действующих в качестве T-клеточных антигенных детерминант.
Также, рекомбинантные молекулы МНС II класса могут быть ассоциированы с иррелевантными или не являющимися эффекторными пептидами T-клеток (так называемыми пептидами-«вкладками»), которые могут высвобождаться из молекулы МНС II класса посредством расщепления линкера, который осуществляет их присоединение к молекуле МНС, и затем могут быть замещены интересующими эффекторными пептидами T-клеток в ходе пептид-обменной реакции in vitro.
Связывание или ассоциация таких пептидов с молекулой МНС II класса может быть облегчена любым соответствующим способом. Например, возможно разработать молекулы по изобретению таким образом, чтобы такие пептиды получали в сочетании с молекулами МНС II класса (например путем кодирования их одним и тем же вектором, например, кодирования их в виде ковалентно присоединенных пептидов к β-цепи МНС II класса или а-цепи МНС II класса посредством соответствующей линкерной последовательности, или с использованием разных векторов в одной и той же клетке-хозяине), что позволяет получить рекомбинантные молекулы МНС II класса, которые присутствуют или связаны или ассоциированы с указанным пептидом, подходящим для распознавания соответствующими T-хелперами. Соответствующие способы получения таких пептид-ассоциированных молекул описаны Kozono et al. 1994 (Nature, 369:151-154). Способ Kozono использует линкерный остаток 18 аа, однако в преимущественных вариантах воплощения изобретения используются более короткие линкеры, такие как линкер 15 аа (например, линкеры Gly-Ser, такие как (G4S)3) или линкерные остатки 6, 7 или 8 аа (например, линкеры Gly-Ser, такие как GSGSGS, GGSGSGS, SGSGSGS или SGGSGSGS), более преимущественно, линкерный остаток 6 аа.
Данное изобретение в целом применимо к любой молекуле МНС II класса, например, оно применимо к молекулам МНС II класса любых видов и любому подтипу молекул МНС II класса в рамках данного вида. В частности, идентифицированные здесь остатки для мутации в ненативные остатки цистеина для обеспечения образования одной или нескольких межцепочечных дисульфидных связей сохранены между видами, что обеспечивает универсальное применение способа. Таким образом, данное изобретение может быть применимо для всех молекул МНС II класса млекопитающих, например, человека, мыши, крысы, свиньи, козы и овцы, в частности, молекул человека и мыши. Например, данное изобретение применимо к молекулам МНС DP, DQ и DR II класса человека (т.е. трем идентифицированным функциональным типам молекул МНС II класса у человека), а также к молекулам I-A и I-Е мыши (например, молекулам I-Ed и I-Ek, преимущественно, I-Ed). Другие примеры молекул I-A и I-Е представлены в Таблице ниже.
Аллели МНС, экспрессированные обычно используемыми инбредными штаммами мышей
Более преимущественно, молекулы МНС II класса имеют человеческое происхождение.
Поскольку идентифицированные остатки для мутации в цистеин сохранены между видами, специалист в данной области сможет легко идентифицировать соответствующие, эквивалентные и подходящие остатки для мутации в любую молекулу МНС II класса из любого вида, что позволит получить рекомбинантные молекулы МНС II класса, стабилизированные одной или несколькими соответствующими межцепочечными дисульфидными связями.
В одном варианте воплощения изобретения рекомбинантная молекула МНС II класса экспрессируется на поверхности клетки или другой биологической единицы или частицы, например на поверхности нитевидного бактериофага. Такой формат в тексте данной заявки иногда может обозначаться как «нерастворимый» формат или «нерастворимые» молекулы. В таких вариантах воплощения изобретения α-цепь или β-цепь молекул МНС II класса по изобретению обычно получают в виде белков слияния с белком, который обычно экспрессируется на поверхности рассматриваемой молекулы или иным образом связан или ассоциирован с поверхностью рассматриваемой частицы.
Экспрессия в виде белка слияния с белком поверхности бактериофага преимущественна, и в таких вариантах воплощения изобретения предусмотрено слияние α-цепи или β-цепи молекул МНС II класса по изобретению с соответствующим белком на поверхности бактериофага. Преимущественные примеры представлены слиянием с gpIII, gpVIII, gpVII или gpIX, более преимущественно, с gpIII. Способ экспрессии молекул МНС II класса по изобретению на поверхности фаговых частиц должен быть очевиден для специалиста в данной области, и типичные способы и принципы описаны в Примерах. Преимущественный способ представлен примером, описанным в WO 09/024591.
В альтернативных вариантах воплощения изобретения рекомбинантные молекулы МНС представлены растворимыми молекулами, например, молекулами МНС II класса по изобретению, которые не ассоциированы или не экспрессируются на поверхности клетки или другой биологической частицы, такой как слияние с белком вирусного капсида или другими белками, что приводит к ассоциации с или образованию комплекса с поверхностью биологической частицы. Таким образом, типичные растворимые молекулы включают только внеклеточные участки (i) и (ii) молекул по изобретению, но также включают такие эктодомены, включающие другие короткие компоненты, которые не оказывают влияния на растворимость молекул, такие как короткие C-терминальные фрагменты, такие как тэги аффинности и/или мотивы димеризации. В зависимости от системы получения, такие растворимые молекулы могут секретироваться в клетках-хозяевах или быть получены из клеток-хозяев любым другим подходящим способом. Такие растворимые молекулы могут быть получены по существу в чистой форме или быть очищены или выделены. Например, такие растворимые молекулы могут быть получены в форме, которая по существу не содержит других белков.
В преимущественных вариантах воплощения изобретения рекомбинантные молекулы МНС II класса могут быть представлены в полимерной форме, например, с поливалентными свойствами. Такие полимерные формы часто являются преимущественными и позволяют связываться молекулам МНС II класса с рецепторами T-клеток, поскольку аффинность между одним комплексом рМНС и рецептором T-клеток обычно достаточно низкая. Такие полимерные формы включают множество (более одной) рекомбинантных молекул МНС II класса по изобретению. Преимущественно, каждое множество молекул МНС II класса идентично.
Может использоваться любой подходящий способ получения полимерных форм молекул МНС II класса, несколько из которых описаны в науке (см., например Vollers et al., 2008, выше). Один из преимущественных способов получения полимерных форм молекул МНС II класса по изобретению состоит в использовании дисплея на поверхности нитчатого бактериофага. В таких способах может использоваться естественная структура фаговых молекул для получения мономеров путем отбора соответствующего структурного белка фага, с которым сливаются и ассоциируются молекулы МНС II класса. Например, слияние с gpIII, gpVII или gpIX, преимущественно с gpIII, может использоваться для получения от 3 до 5 копий молекул МНС II класса на поверхности каждой фаговой частицы. Слияние с gpVIII может использоваться для получения дополнительного числа копий, кроме указанных (в фаге дикого типа существует примерно 2700 копий gpVIII). Таким образом, важным остается тот факт, что дисплей pVIII повышает валентность МНС, по меньшей мере, на один порядок в сравнении с дисплеем gpIII и способом классического тетрамера, что приводит к повышению чувствительности. Это позволит открыть новые и интересные способы применения.
Известные способы фаговых дисплеев и построения векторов, например, использование векторов фагемид и модифицированных типов фагов-хелперов, могут применяться для изменения числа копий молекул МНС II класса на поверхности фага. С учетом способности получения полимерных молекул МНС II класса на поверхности фага, преимущественно это позволяет получить или выработать полимерную молекулу МНС II класса в ходе одного быстрого, экономически эффективного процесса. Это резко контрастирует со стандартным способом использования тетрамера, который описан в Vollers et al., 2008, и в котором каждый компонент получают отдельным образом, смешивают, образуют комплекс и очищают до момента готовности реагента для дальнейшего применения.
Таким образом, преимущественные полимеры включают два или три, или четыре, или пять, или более рекомбинантных молекул МНС II класса, ассоциированных друг с другом. Такая ассоциация может проводиться с использованием способов, известных и описанных в науке, однако обычно она опосредована другим присоединением, например линкерной молекулой. Подходящие линкерные молекулы хорошо известны и описаны в науке, и, в частности, подходящие линкерные молекулы будут иметь множество сайтов связывания, к которым могут присоединяться рекомбинантные молекулы. Например, могут использоваться множество присоединяемых молекул, таких как авидин или стрептавидин (или любая другая молекула, которая связывает биотин поливалентным образом), каждая из которых может иметь множество сайтов связывания биотина. Таким образом, введение биотина в рекомбинантные молекулы МНС с использованием известных в науке способов (например, с использованием AviTag или других субстратов BirA для обеспечения ферментативного биотинилирования) позволит образовать полимеры, например, тетрамеры молекул МНС. В полимерные формы соответствующим образом могут быть также введены метки, например, с использованием флуоресцирующего стрептавидина или путем слияния метки с белком оболочки фага, например белком оболочки, который отличается от белка, используемого для дисплея молекулы МНС II класса. Введение таких меток позволяет легко определить тетрамеры с использованием различных известных способов. Например, использование флуоресцирующей метки позволяет использовать способы проточной цитометрии, такие как анализ FACS, что является особенно преимущественным.
Молекулы МНС II класса по изобретению или их полимеры также могут быть представлены в виде покрытия твердой основы, такой как плоскостного твердого носителя или твердого носителя частицы, например, мембраны, чашки или гранулы. Такие способы хорошо известны и описаны в науке.
Молекулы МНС II класса по изобретению и использование одной или нескольких введенных дисульфидных связей между доменами α2 и β2 молекулы МНС II класса для стабилизации указанной молекулы, как это описано в тексте данной заявки, совместимы со всеми известными ранее способами получения молекул МНС II класса. Таким образом, изобретение совместимо с любым известным ранее форматом молекулы МНС II класса, описанным в науке, и должно повысить эффективность получения и стабильности продукта. В частности, изобретение расширяет область применения и многофункциональность рекомбинантных молекул МНС II класса, поскольку такие молекулы в настоящее время могут быть получены в форме, стабилизированной дисульфидной связью, например, в виде (i) функциональных, растворимых молекул в периплазме бактерий, (ii) нефункциональных компонентов тел включения бактерий, которые могут быть переведены в растворимую форму и повторно конформированы в функциональные молекулы с последующей очисткой, преимущественно по существу с повышенным выходом, чем выход, указанный в используемых в настоящее время стандартных протоколах (который составляет максимум 30% от исходного материала, см., например Arimilli et al, 1995, выше), (iii) компонентов фагового дисплея в системах нитчатого бактериофага, (iv) слияний Ig в клетках эукариотов; и (v) растворимых молекул МНС II класса в клетках эукариотов.
Преимущественным является то, что способы (ii) - способ тел включения, и (iii) -способ фагового дисплея, непосредственно предоставит две важных области применения для эффективного использования рекомбинантных молекул МНС II класса, из которых способ (iii) является полностью новейшим. В этом отношении успешный функциональный дисплей рМНС II класса на вирионах нитчатого бактериофага никогда не был достигнут ранее, и это открывает новые или улучшенные пути применения, такие как (а) фаговый дисплей пептидных библиотек в контексте МНС II класса; (б) чрезвычайно быстрое и легкое получение любых необходимых комбинаций МНС II класса; и (в) поливалентный дисплей нитчатого бактериофага молекул МНС II класса в качестве альтернативы стандартным полимерам рМНС II класса, таким как тетрамеры, за исключением того, что вирионы могут быть получены за частичную стоимость и при высокой скорости.
Молекулы МНС II класса по изобретению имеют отдельную значимость и используются в качестве исследуемого реагента. Это особенно касается поливалентных форм, описанных в тексте данной заявки, и для форм фаговых дисплеев (которые могут быть легко разработаны в поливалентные благодаря архитектуре фаговых частиц, на которых отображены молекулы МНС II класса). Тетрамерные формы и формы фаговых дисплеев молекул МНС II класса, в частности поливалентные формы фаговых дисплеев, являются преимущественными в данном случае. Тетрамерные формы молекул МНС II класса по изобретению или поливалентные формы на фаговых дисплеях могут использоваться в качестве преимущественных альтернативных реагентов для любого применения, в котором используют стандартные тетрамеры. Преимущественная область применения, в которой могут использоваться молекулы по изобретению в качестве альтернативы стандартным тетрамерам, представлена окрашиванием МНС T-клеток, что обычно включает определение T-клеток на основе проточной цитометрии с использованием олигомеров рМНС, таких как димеры и олигомеры высшего порядка. Данные, представленные в тексте данной заявки, показывают, что молекулы МНС по данному изобретению могут использоваться в анализе проточной цитометрии для окрашивания T-клеток. Это является особенно преимущественным и важным свойством, поскольку много тетрамеров МНС II класса, используемых ранее, не способны окрашивать антигенспецифические клетки ТН, даже если такие тетрамеры могут активировать T-клетки. Таким образом, преимущественные молекулы МНС II класса по изобретению обладают способностью определяемо окрашивать T-клетки, например, с использованием проточной цитометрии. Такое свойство наблюдается, в частности, для полимерных или поливалентных форм молекул, однако окрашивание T-клеток может наблюдаться с использованием полимерных форм. Дополнительное преимущество полимерных форм фаговых дисплеев состоит в том, что в целом, для достижения такого же самого результата, например окрашивания T-клеток, могут использоваться пониженные титры фага.
Если такие молекулы МНС II класса используются в качестве реагентов, как это описано выше, они могут быть представлены с или без ассоциированного пептида. Такие реагенты могут быть представлены в виде белков или нуклеиновых кислот, кодирующих такие молекулы МНС II класса, например, в форме одного или нескольких векторов экспрессии.
Такие реагенты, в частности при использовании для окрашивания T-клеток, как это описано выше, могут использоваться для изучения ответа T-клеток на отдельные пептиды, например, для изучения репертуара и динамики T-клеточного ответа и для обеспечения прямого анализа ex vivo антигенспецифических CD4+ T-клеток, например в периферической крови. До настоящего времени анализ периферической крови был затруднительным, так как в нем использовали рекомбинантные молекулы МНС II класса. Они также могут использоваться для изоляции и идентификации антигенспецифических T-клеток in vivo, in vitro и ex vivo. Определенные таким образом T-клетки могут быть подвергнуты дальнейшему исследованию, размножению или активации, и могут быть потенциально использованы в лечении.
Рекомбинантные молекулы МНС II класса по изобретению также могут использоваться в качестве платформы для скрининга иммуномодуляторов. Критический этап в заболеваниях, которые охватывают иммунную систему, состоит во взаимодействии между антиген-представляющими клетками и T-клетками. В частности, комплекс МНС II класса на антиген-представляющих клетках играет важную роль, поскольку он связывается с экзогенными пептидами и представляет их для T-хелперов. Затем T-хелперы активируются и секретируют различные цитокины, которые активируют широкий диапазон эффекторных клеток.
Обеспечение стабильных и полностью функциональных молекул МНС II класса, таких как описаны в тексте данной заявки, и, в частности, растворимых форм таких молекул, жизненно важно для обеспечения платформы для скрининга иммуномодуляторов, которые могут модулировать, например повышать или понижать, экспрессию, взаимодействие между T-хелперами и молекулами МНС II класса с последующей активацией T-хелперов и эффекторных клеток. До данного изобретения такой скрининг был осложнен трудностями в получении стабильных молекул МНС II класса с высоким выходом и при низкой цене. Рекомбинантные молекулы МНС II класса по изобретению могут использоваться в качестве платформы для скрининга иммуномодуляторов.
Преимущественные молекулы МНС II класса для использования в таких способах описаны в тексте данной заявки. Преимущественно, указанные молекулы МНС II класса ассоциированы с болезнь-специфическими белками. Примеры таких белков описаны в тексте данной заявки и литературе и включают молекулу HLA-DQ2 человека, ассоциированную с болезнь-специфическими белками, такими как белки, специфические для глютеновой болезни или диабета I типа, молекулу HLA-DR4 МНС II класса человека, ассоциированную с болезнь-специфическими белками для ревматоидного артрита, и молекулу HLA-DP1 МНС II класса человека, ассоциированную с белками, специфическими для тетануса. Равным образом могут использоваться и другие белки, ассоциированные с молекулами МНС II класса по изобретению.
Т-клетки, которые могут специфическим образом распознавать болезнь-специфические пептиды в контексте МНС II класса, идентифицируют впоследствии, например с использованием молекул МНС II класса по изобретению, как это описано выше, или они могут быть получены другим образом (например, некоторые линии клеток уже были разработаны учеными), после чего может быть оценена способность одного или нескольких компонентов для модуляции взаимодействия между Т-клетками и антиген-представляющими клетками или последующих явлений, таких как секреция цитокинов и функция эффекторных клеток.
Рекомбинантные молекулы МНС II класса по изобретению и, в частности, форма фаговых дисплеев таких молекул, может использоваться в открытии антигенных детерминант, например, для идентификации и характеристики антигенных детерминант белков, распознаваемых T-клетками (антигенных детерминант T-клеток). Таким образом, дополнительный вариант воплощения изобретения описывает способ идентификаций антигенных пептидных детерминант, которые могут распознаваться T-клетками, при этом указанный способ включает этапы контакта рекомбинантной молекулы МНС II класса по изобретению с рецептором Т-клеток и определение связывания указанной рекомбинантной молекулы МНС II класса с указанными рецептором T-клеток. Связывание рецептора T-клеток является индикатором присутствия антигенной пептидной детерминанты, ассоциированной с молекулой МНС II класса, после чего такая антигенная детерминанта может быть дополнительно проанализирована и охарактеризована.
Например, библиотека антигенных детерминант может быть создана путем введения разнообразия в антигенный пептид, отображаемый в контексте фиксированного МНС. Такие библиотеки затем могут быть подвергнуты скринингу, например, с использованием рекомбинантных растворимых МНС или TCRs фаговых дисплеев, или других популяций T-клеток, например, T-клеток, полученных у пациентов. Это будет представлять собой самое важное усовершенствование в сравнении с используемыми в данный момент способами, которые основываются на низкой производительности библиотек бакуловируса и в дальнейшем имеют еще один недостаток, т.е. невозможность проведения селекции на живых клетках (Crawford et al., 2004, PLos Biology, 2: 0523-0533).
Рекомбинантные молекулы МНС II класса по изобретению могут использоваться в качестве реагентов для диагностики. Например, как это описано в тексте данной заявки, болезнь-специфические белки могут быть соединены в комплекс или ассоциированы с молекулами МНС II класса по изобретению, и они могут использоваться для определения присутствия или отсутствия болезнь-специфических T-клеток в образцах, например образцах крови, взятых у пациента, который потенциально имеет заболевание. Присутствие болезнь-специфических T-клеток, и, в частности, значительные количества болезнь-специфических T-клеток в сравнении, например с уровнями, отмечаемыми у пациента без заболевания, будет указывать на положительный диагноз.
Таким образом, дополнительный аспект по изобретению описывает способ определения антиген-специфических T-клеток в образце, при этом указанный способ включает этапы контакта рекомбинантной молекулы МНС II класса по изобретению с указанным образцом и определение связывания указанной рекомбинантной молекулы МНС II класса с указанными T-клетками. Связывание указанной рекомбинантной молекулы МНС II класса с T-клетками является индикатором присутствия антиген-специфических T-клеток.
Такие способы могут использоваться для определения присутствия болезнь-специфических T-клеток в образце и для диагностики присутствия или отсутствия заболевания. Соответствующие заболевания, которые могут быть диагностированы с использованием таких способов, представлены заболеваниями, при которых молекулы МНС II ассоциированы с болезнь-специфическими белками. Типичные заболевания описаны в тексте данной заявки и включают глютеновую болезнь, ревматоидный артрит, тетанус и грипп.
Захваченные болезнь-специфические T-клетки и взаимодействие между такими T-клетками и молекулами МНС II класса по изобретению также могут быть охарактеризованы для более полного понимания механизмов специфических заболеваний. Таким образом, это представляет собой еще один пример использования молекул МНС II класса по изобретению в качестве исследуемых реагентов, например, для мониторинга и характеристики специфических ответов T-клеток.
Рекомбинантные молекулы МНС II класса по изобретению, при ассоциации с пептидами, также могут использоваться в качестве мишени при аффинной зрелости TCR.
Специалисту в данной области станет очевидно, что рекомбинантные молекулы МНС II класса по изобретению могут быть получены с использованием любого из нескольких путей, хорошо известных и описанных в науке, однако преимущественным является использование способов рекомбинации.
Таким образом, способы генного клонирования могут использоваться для получения молекулы МНС II класса по изобретению, и соответствующие способы описаны, например, в J. Sambrook et al., Molecular Cloning, 2nd edition, Cold Spring Harbor Laboratory Press, 1989. Таким образом, молекулы нуклеиновых кислот включают последовательность, кодирующую цепь (например α- и/или β-цепь) молекулы МНС II класса по изобретению, или комплементарную последовательность, что образует дополнительные аспекты данного изобретения.
Молекулы нуклеиновых кислот, кодирующие α-цепь (т.е. цепь (i)) или β-цепь (т.е. цепь (ii)) молекул МНС II класса, как это описано в тексте данной заявки, могут быть получены или разработаны с использованием любого подходящего способа, например путем клонирования или синтеза. Такие последовательности могут быть, например, получены путем клонирования соответствующих последовательностей из соответствующих источников, например из таких клеток, как лейкоциты, выделенные из стандартных лейкоцитарных пленок, способов ПЦР, таких как стандартная ПЦР-ОТ, могут использоваться для клонирования соответствующих последовательностей с использованием соответствующих праймеров, разработанных с использованием последовательностей отдельного рассматриваемого аллеля МНС II класса, который представлен в GenBank, но еще легче его получить из базы данных IMGT. Также может проводиться полный генный синтез, особенно для прокариотической экспрессии, так как это обеспечит оптимизацию кодона, что может оказаться важным для максимального увеличения выхода.
Как только будут клонированы или синтезированы первичные последовательности, с использованием способов, хорошо известных и описанных в науке, например, путем сайт-специфического мутагенеза, могут быть введены любые необходимые модификации последовательностей для получения молекул нуклеиновых кислот., кодирующих мутированные остатки цистеина по изобретению.
Кроме того, при желании или необходимости, для получения молекул по изобретению могут быть изменены другие части α- и/или β-цепей молекул МНС II класса. Таким образом, например, нуклеотиды, кодирующие трансмембранные и цитоплазматические домены, могут быть удалены, поскольку много других различных участков, которые кажутся излишними для молекул по изобретению, остаются функциональными.
Как только будут получены фрагменты нуклеиновых кислот, кодирующие две цепи молекул МНС II класса по изобретению, такие фрагменты могут быть подвергнуты дополнительной манипуляции стандартными способами рекомбинации ДНК, например для включения других необходимых компонентов, регуляторных последовательностей и т.д., или для введения ненативных остатков цистеина или для удаления нативных остатков цистеина, как это описано в тексте данной заявки. Как правило или являясь частью такой дополнительной процедуры манипуляции, фрагменты нуклеиновой кислоты, кодирующие молекулы МНС II класса по изобретению, включены в один или несколько соответствующих векторов экспрессии и указанные векторы включены в клетку-хозяин для облегчения выработки молекул МНС II класса по изобретению. Такие векторы экспрессии и клетки-хозяева, содержащие такие векторы экспрессии, образуют дополнительные аспекты изобретения.
Таким образом, еще один аспект изобретения описывает вектор экспрессии, состоящий из одной или нескольких молекул нуклеиновых кислот по изобретению. Преимущественно, векторы экспрессии являются рекомбинантными. Преимущественно, указанные векторы дополнительно состоят из регуляторных последовательностей для транскрипции и трансляции белковой последовательности, кодируемой молекулой нуклеиновой кислоты по изобретению.
В еще одном аспекте изобретения описана клетка-хозяин, состоящая из одного или нескольких конструктов экспрессии или векторов экспрессии по изобретению. Также описаны клетки-хозяева, состоящие из одной или нескольких молекул нуклеиновых кислот по изобретению. В еще одном аспекте изобретения описана клетка-хозяин, экспрессирующая молекулу МНС II класса по изобретению.
В еще одном аспекте изобретения описан способ получения молекулы МНС II класса по данному изобретению, например состоящий из этапа культивации клетки-хозяина по изобретению. Преимущественные способы включают этапы (i) культивации клетки-хозяина, включающей один или несколько рекомбинантных векторов экспрессии или одну или несколько последовательностей нуклеиновых кислот по изобретению, в условиях, подходящих для экспрессии кодируемых α- и β-цепей молекул МНС II класса, и, в некоторых случаях, (ii) выделения или получения белка из клетки-хозяина или из среды роста/супернатанта. Такие способы получения также могут включать этап очистки белкового продукта. Преимущественно, такие способы получения проводят в прокариотической, например бактериальной, клетке-хозяине, такой как описанные в тексте данной заявки.
Таким образом, дополнительный аспект по изобретению описывает способ получения рекомбинантной молекулы МНС II класса, которая включает:
(i) весь или часть внеклеточного участка α-цепи МНС II класса;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса;
при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен, и при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса,
указанный способ включает экспрессию указанной рекомбинантной молекулы в прокариотическом, преимущественно, бактериальном, хозяине.
Как это указано выше, тот факт, что прокариотические клетки-хозяева могут использоваться для получения функциональных молекул МНС II класса по изобретению, включающих дисульфидные связи, является удивительным и преимущественным.
Поскольку молекулы МНС II класса по изобретению состоят более чем из одной полипептидной цепи (т.е. являются гетеродимерами), в некоторых вариантах воплощения изобретения, например в вариантах воплощения изобретения, которые включают фаговый дисплей, бактериальную периплазматическую экспрессию и эукариотическую экспрессию, все полипептиды преимущественно экспрессируются в одной и той же клетке-хозяине, из одного и того же или разного вектора экспрессии, таким образом, полные димерные белки могут быть собраны в клетке-хозяине и выделены или очищены впоследствии. Для других вариантов воплощения изобретения такая общая выработка в бактериях посредством преднамеренной выработки с тельцами включения приводит к тому, что каждая цепь должна быть экспрессирована в отдельных клетках-хозяевах (особенно в клетках-хозяевах одного и того же типа/штамма).
Могут использоваться любые подходящие системы экспрессии (например, могут использоваться прокариотические и эукариотические системы), и векторы экспрессии выбирают и разрабатывают соответствующим образом для обеспечения совместимости с используемой клеткой-хозяином. Таким образом, векторы экспрессии «подходят для трансформации клетки-хозяина», что обозначает, что векторы экспрессии состоят из одной или нескольких молекул нуклеиновой кислоты по изобретению и регуляторных последовательностей, выбираемых на основе используемой клетки-хозяина для экспрессии, и такие последовательности функционально связаны с молекулой нуклеиновой кислоты. Функциональная связанность обозначает, что нуклеиновая кислота связана с регуляторной последовательностью таким образом, чтобы обеспечить экспрессию нуклеиновой кислоты.
В вариантах воплощения изобретения, в которых молекулы МНС II класса представлены нерастворимым видом, например, отображены на поверхности другой биологической частицы или мембраны, дисплей молекул МНС по изобретению может быть достигнут посредством способа, описанного в науке. Например, в преимущественных вариантах воплощения изобретения, в которых молекулы МНС II класса по изобретению отображены на поверхности нитчатого бактериофага, может использоваться любой описанный в науке способ. Например, могут использоваться стандартные указания, представленные в "Phage Display in Biotechnology and Drug Discovery" by Sachdev S. Sidhu, 1995, or "Phage Display: A Laboratory Manual" by Barbas et al., 1994. Типичные способы и системы описаны, например в WO 09/024591 или представлены в экспериментальных Примерах.
В целом, использование фагемидных векторов преимущественно для аспектов с фаговыми дисплеями, что требует использования соответствующих штаммов хелперов, которые могут быть легко отобраны специалистом в данной области. На рынке представлено много соответствующих штаммов фагов-хелперов, таких как, например, фаг-хелпер VCSM13 (Stratagene) и HyperPhage™ (Progen Biotechnik GmbH), или может использоваться любой из таких фагов для гетеродимера МНС II класса, так как к выбранному покровному белку вводят одну цепь в виде белка слияния с α- или β-цепью, например gpIII или другим покровным белкам, обсуждаемым в тексте данной заявки, при этом вторая цепь представлена в виде растворимой молекулы, т.е. не слитой с покровным белком. Слияние с покровным белком часто проводят на N-конце указанного покровного белка. В прилагаемых Примерах β-цепь получают в виде белка слияния с покровным белком, и α-цепь получают в растворимой форме.
В векторах/фагемидных векторах могут присутствовать и другие подходящие компоненты, большинство из которых обычны для таких векторов. Например, обычно включают сигнальные последовательности, такие как pelB для направления белков к периплазматическому пространству, и содержат соответствующие последовательности промотора/оператора, сайтов связывания рибосом, точек начала репликации, точек прекращения транскрипции и т.д. В векторы экспрессии по данному изобретению могут быть введены типичный фагемидный вектор и компоненты, представленные на Фигуре 2, а также один или несколько подобных компонентов.
В вариантах воплощения изобретения, в которых пептид для связывания с белок-связующим доменом рекомбинантной молекулы МНС II класса должен быть предоставлен соответствующим образом, в соответствующем положении также могут быть введены конструкты/векторы экспрессии. Как правило, их получают в виде ковалентных белков слияния с α- или β-цепью, например к N-концу β-цепи, посредством линкерного пептида, примеры чего описаны в тексте данной заявки.
В вариантах воплощения изобретения, в которых молекулы МНС II класса представлены в растворимой форме, такие молекулы могут быть получены путем экспрессии тел включения в бактериальной клетке-хозяине, такой как E.coli., с последующим сворачиванием in vitro. Такое скручивание in vitro может проводиться в соответствующих условиях скручивания с использованием стандартных протоколов (например, как это описано в Qoronfleh et al., 2007, Protein Expression and Purification 55: 209-224) и их соответствующих модификациях.
Кроме того, растворимые молекулы МНС II класса по изобретению могут быть получены путем экспрессии в бактериальной клетке-хозяине, такой как Е.coli, при этом указанные молекулы получают в периплазме таких хозяев. Получение в периплазме может быть обеспечено путем использования соответствующего вектора экспрессии, например введением сигнального пептида, такого как pelB, который направляет белок к периплазматическому пространству.
Получение молекул МНС II класса по изобретению в прокариотическом хозяине, в частности хозяине-бактерии, является преимущественным вариантом воплощения изобретения. Такие способы получения совместимы с формами фаговых дисплеев и растворимыми формами описанных здесь молекул МНС II класса и могут использоваться для обеспечения больших количеств высокоочищенного белка. Получение в виде растворимых молекул из тел включения является особенно преимущественным для обеспечения больших количеств высокоочищенного белка. Рекомбинантные молекулы МНС II класса по изобретению, имеющие повышенную стабильность, обусловленную включением введенных рекомбинантно дисульфидных связей, особенно подходят для получения молекул с высоким выходом, и, преимущественно, обеспечивают больший выход продукции в виде функциональных молекул МНС II класса в сравнении с используемыми до этого времени способами (в настоящее время выход составляет в диапазоне менее 10% от исходного материала, что считается достаточно нормальным).
Для такого получения может использоваться любая подходящая прокариотическая или бактериальная клетка-хозяин. Преимущественные клетки-хозяева представлены грамотрицательными клетками-хозяевами, более преимущественно, Е.coli. Соответствующие хозяева Е.coli для форм фаговых дисплеев должны быть хорошо известны специалисту в данной области и включают, например XL1-синий. Преимущественные хозяева Е.coli для получения растворимых форм, в частности, если очистка от тел включения приводит к образованию производных Е.coli К 12, более преимущественно, с фенотипом BL21 или его производными (Тегре, К., Appi Microbiol Biotechnol. 2006 Sep; 72(2):211-22).
Соответствующие клетки-хозяева для растворимой периплазматической экспрессии должны быть хорошо известны специалисту в данной области (см., например анализ Terpe, К., Appl Microbiol Biotechnol. 2006 Sep; 72(2):211-22).
Кроме того, растворимые молекулы МНС II класса по изобретению могут быть получены путем экспрессии в эукариотических клеточных системах, таких как дрожжи (включая pichia), клетки млекопитающих или насекомых. Соответствующие клетки-хозяева для таких способов получения должны быть хорошо известны специалисту в данной области. Преимущественный вариант воплощения изобретения с использованием эукариотических клеток-хозяев представлен получением рекомбинантных молекул МНС II класса по изобретению в виде белка слияния с участком Fc иммуноглобулина (Ig), т.е. в виде белка слияния Ig, например как это описано в Casares et al,. 1997, выше. В таких вариантах воплощения изобретения участок Fc молекулы иммуноглобулина, например, участок Fc молекулы IgG2a, может быть слит с α- или β-цепью MHC II класса (как правило, с C-концом β-цепи) и использоваться для достижения димеризации α- и β-цепей рекомбинантных молекул МНС II класса по изобретению (т.е. молекул, содержащих искусственные дисульфидные связи по изобретению). Такие молекулы могут быть экспрессированы в клеточных системах насекомых (или другой соответствующей системе), например путем инфицирования клеток насекомых бакуловирусом, что приводит к получению молекул МНС II класса, стабилизированных дисульфидной связью.
Подходящие регуляторные последовательности для использования в векторах экспрессии по изобретению могут быть получены из различных источников, включая гены бактерий, грибов, вирусов, млекопитающих или насекомых (например см. регуляторные последовательности, описанные в Goeddel, 1990, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA, 1990). Выбор соответствующих регуляторных последовательностей зависит от выбранной клетки-хозяина и может быть с легкостью осуществлен специалистом в данной области. Примеры таких регуляторных последовательностей включают следующее: промотор транскрипции и энхансер или последовательность связывания РНК-полимеразы, последовательность связывания рибосом, включая сигнал начала трансляции. Кроме того, в зависимости от выбранной клетки-хозяина и используемого вектора, в вектор экспрессии могут быть включены и другие последовательности, такие как точка начала репликации, дополнительные сайты рестрикции ДНК, энхансеры и последовательности, индуцирующие транскрипцию.
Векторы экспрессии по изобретению также могут состоять из избирательного маркерного гена, облегчающего селекцию клетки-хозяина, трансформируемую или трансфицируемую рекомбинантной молекулой по изобретению. Примеры избирательных маркерных генов представлены генами, кодирующими белок, такой как неомицин и гигромицин, обладающий устойчивостью к определенным препаратам, β-галактозидазу, хлорамфеникол ацетилтрансферазу, люциферазу светлячка или иммуноглобулин или его участок, такой как участок Fc иммуноглобулина, преимущественно IgG. Следует иметь в виду, что избирательные маркеры могут быть введены в отдельный вектор из интересующей нуклеиновой кислоты.
Рекомбинантные векторы экспрессии также могут состоять из генов, кодирующих молекулу слияния, что обеспечивает повышенную экспрессию рекомбинантного белка, повышенную растворимость рекомбинантного белка и помощь в очистке отдельного рекомбинантного белка путем воздействия в качестве лиганда в ходе аффинной очистки (например могут присутствовать соответствующие «тэги» для очистки и/или идентификации, например тэги His, HA, FLAG или myc). Например, в отдельный рекомбинантный белок для обеспечения разделения рекомбинантного белка от молекулы слияния с последующей очисткой белка слияния может быть добавлен сайт протеолитического расщепления. Типичные векторы экспрессии молекул слияния включают pGEX (Amrad Corp., Melbourne, Australia), pMal (New England Biolabs, Beverly, MA) и pRIT5 (Pharmacia, Piscataway, NJ), которые обеспечивают слияние глутатион S-трансферазы (GST), мальтозо-E-связующего белка или белка A, соответственно, с рекомбинантным белком.
Другие необязательные компоненты векторов экспрессии включают последовательности для биотинилирования (в частности, для вариантов воплощения изобретения с полимерными формами), такие как AviTag или другой субстрат BirA, метки для определения, например флуоресцирующие метки для обеспечения проведения проточной цитометрии.
Векторы экспрессии могут быть введены в клетки-хозяева для получения трансформированной клетки-хозяина. Термины «трансформированный», «трансфицированный», «трансформация» и «трансфекция» обозначают введение нуклеиновой кислоты (например вектора) в клетку с использованием любого из описанных в науке способов. В контексте данного изобретения термин «трансформированная клетка-хозяин» также включает клетки, способные гликозилировать и трансформированные рекомбинантным вектором экспрессии по изобретению. Прокариотические клетки могут быть трансформированы нуклеиновой кислотой, например путем электропорации или трансформации, обусловленной кальция хлоридом. Например, нуклеиновая кислота может быть введена в клетки млекопитающих посредством стандартных способов, таких как ко-преципитация в присутствии кальция фосфата или кальция хлорида, трансфекции, опосредованной DEAE-декстраном, липофекции, электропорации или микроинъекции. Подходящие способы для трансформации и трансфекции клеток-хозяев описаны в Sambrook et al., 1989 и других лабораторных руководствах. Для аспектов изобретения, описывающих фаговый дисплей, могут использоваться соответствующие способы, представленные в виде общей книги о фаговых дисплеях "Phage Display in Biotechnology and Drug Discovery" by Sachdev S. Sidhu, 1995, or "Phage Display: A Laboratory Manual" by Barbas et al., 1994.
N-терминальные или C-терминальные белки слияния, состоящие из белков по изобретению, конъюгированных с другими молекулами, могут быть получены путем слияния в ходе способов рекомбинации. Полученные белки слияния содержат белок по изобретению, слитый с выбранным белком, например белком-маркером или белком-тэгом, как это описано в тексте данной заявки. Белки по изобретению также могут быть конъюгированы с другими белками с использованием известных способов. Например, белки могут быть соединены с использованием гетеробифункциональных тиол-содержащих линкеров, как это описано в WO 90/10457, т.е. N-сукцинимидил-3-(2-пиридилдитио-пропионата) или N-сукцинимидил-5 тиоацетата. Примеры белков, которые могут использоваться для получения белков слияния или конъюгатов, включают белки для связывания с клетками, такие как иммуноглобулины, гормоны, факторы роста, лектины, инсулин, липопротеин низкой плотности, глюкагон, эндорфины, трансферрин, бомбезин, азиалогликопротеин глутатион-3-трансферазу (GST), гемагглютинин (ГА) и усеченный myc.
Независимо от способа получения молекул нуклеиновых кислот, кодирующих первую молекулу МНС II класса по изобретению, дополнительные подходящие варианты молекул нуклеиновых кислот могут быть легко получены с использованием стандартных способов молекулярной биологии. Для подтверждения того, что любой вариант, мутант или молекула нуклеиновой кислоты второго поколения, кодирующие молекулу МНС II класса по изобретению, подходят для использования в данном изобретении, молекула нуклеиновой кислоты будет протестирована для подтверждения функциональности, как это описано в тексте данной заявки. Преимущественно, сегмент нуклеиновой кислоты вариантов, мутантов или антитела второго поколения также будет тестирован для подтверждения гибридизации при стандартных, более преимущественно, строгих стандартных условиях гибридизации. Типичные подходящие условия гибридизации включают гибридизацию в примерно 7% натрия додецилсульфата (SDS), примерно 0,5 М NaPO4, примерно 1 мМ ЭДТА при примерно 50°C; и промывание с примерно 1% SDS при примерно 42°C.
В контексте данного изобретения и прилагаемой формулы изобретения, формы единственного числа включают и формы множественного числа, если контекст четко не указывает иное.
Изобретение будет дополнительно описано со ссылкой на следующие неограничивающие Примеры и соответствующие графические материалы, а именно:
Фигура 1 представляет моделирование in silico мнимых дисульфидных мостиков, соединяющих домены α2-β2 мышиной молекулы МНС II класса I-Ek (PDB:1FNG). Указаны значения wt {верхняя часть) и соответствующие мутантные остатки (нижняя часть) положений трех верхних аа пар в Таблице 2: положение 1 (A), положение 2 (B) и положение 3 (C), включая соответствующие межатомные расстояния.
Фигура 2 представляет остов вектора фагемиды pFABDFN на основе дисплея pIII фагемиды pSEX81 (номер доступа в GenBank: Y14584). Фагемида может включать сегменты в пределах рамки считывания экзогенных последовательностей (указаны как E1 и E2) посредством кассетного обмена участков NcoI/SpeI и MluI/SfiI соответственно. I-Ed α-цепь (aa 26-204) и β-цепи (aa 27-216) были вставлены в E1 и Е2 соответственно. Сокращения: lacPO - промотор lac; sd - последовательность Shine-Dalgamo; pelB - сигнальная последовательность бактериальной пектат-лиазы; t - терминатор транскрипции T7; xPO - нативный промотор fkpA; FkpA - открытая рамка считывания fkpA; f1 IG - межгенный участок фага f1; AmpR - участок, кодирующий β-лактамазу; ColE1 - точка начала репликации.
Фигура 3 представляет множественные выравнивания последовательностей ClustalW2.02 в сравнении с эталонными последовательностями α-(A) и β-цепи (B) IMGT мышиной молекулы МНС II класса I-Е и I-A относительно клонированных I-Е (промаркировано _EL) и I-Ek (промаркировано 1FNG). Положения, выбранные для замещения цистеина, указаны черной штриховкой (нумерация согласно Таблицы 2/последовательности зрелого IMGT I-Е): положение 1 (α96-β118/α96-β119), положение 2 (α95-β120/α95-β121) и положение 3 (α94-β150/α94-β151). Полная длина последовательности IMGT α-цепи представлена как (Н-2ЕА*02) и иногда указана в тексте данной заявки как SEQ ID NO: 1. Полная длина последовательности IMGT β-цепи представлена как (Н-2ЕВ1*01) и иногда указана в тексте данной заявки как SEQ ID NO: 2. Зрелая последовательность IMGT α-цепи, т.е. последовательность полной цепи, за исключением сигнального пептида, иногда указана в тексте данной заявки как SEQ ID NO: 3 (Н-2ЕА*02 без сигнального пептида). Зрелая последовательность IMGT β-цепи, т.е. последовательность полной цепи, за исключением сигнального пептида, иногда указана в тексте данной заявки как SEQ ID NO: 4 (Н-2ЕВ1*01 без сигнального пептида). Указанные выше обозначения для каждой последовательности приведены относительно PDB ID: 1FNG и Burrows et al., 1999, Protein Engineering, 12: 771-778.
Фигура 4 представляет анализ целостности I-Ek pIII путем ИФА фага. Интересующие антитела были иммобилизированы, после чего дали прореагировать нормализированным количествам вирионов. Захваченные вирионы были определены с помощью конъюгата антитела к M13HRP, а ИФА был разработан с использованием считывания ТМВ при А450нм. В качестве контроля было включено Fab-специфическое антитело phOx-BSA.
Фигура 5 представляет анализ отображаемых уровней поливалентных I-Ed-pIII с использованием анализа SDS PAGE/вестерн-блоттинга, разработанного с антителом к pIII. Нумерация остатков согласно PDB ID: 1FNG (см. Таблицу 2).
Фигура 6а показывает, что фаги с дисплеем P96Cα2-S119Cβ2 (положение 1, Таблица 2) со стабилизацией I-Ed специфически окрашивают LD1 T-клетки гибридомы. LD1 клетки были блокированы и окрашены с использованием фагемидов I-Ed-pIII в течение 2 часов на льду с последующей инкубацией с биотинилированным конъюгатом антитела кролика к fd с биотином и стрептавидином PE. Сплошная линия обозначает дисплей HAaa110-120/I-Ed-pIII, а пунктирная линия обозначает дисплей I-Ed-pIII. Примечательно, что специфическое окрашивание достигается даже при очень низком титре (5×109 фагов/мл), в то время как максимально достигнутый титр составляет ~1013 фагов/мл.
Фигура 6b показывает, что фаги, представляющие R94Cα2-N151Cβ2 (положение 3, Таблица 2), S95Cα2-S121Cβ2 (положение 2, Таблица 2) или P96Cα2-S119Cβ2 (положение 1, Таблица 2) со стабилизацией I-Ed специфически окрашивают LD1 T-клетки гибридомы. LD1 клетки были окрашены с использованием фагемидов I-Ed-pIII в течение 30 минут при комнатной температуре с последующей инкубацией с биотинилированным конъюгатом антитела кролика к fd с биотином и стрептавидином АРС. Средняя интенсивность флуоресценции (MFI) для препарата каждого фага представлена в виде гистограммы. Примечательно, что специфическое окрашивание достигается даже при очень низком титре (2×109 фагов/мл), в то время как максимально достигнутый титр составляет ~1013 фагов/мл.
Фигура 7 представляет множественное выравнивание последовательностей ClustalW2.02 репрезентативных аллотипов IMGT МНС II класса человека и мыши с последовательностями I-Е, I-A, HLA-DP, -DQ и -DR. Выравнивание α-цепи представлено под A, и выравнивание β-цепи представлено под B соответственно. Положения, идентифицированные для замещений цистеина, как это указано в Таблице 2, на Фигуре 1 и Фигуре 3, представлены черной штриховкой. Все идентифицированные положения расположены на сохраненных доменах α2/β2.
Фигура 8 показывает наложение 8 разных структур HLA человека II класса, при этом четвертичная структура молекул главным образом сохранена, несмотря на обширный генный полиморфизм; таким образом, это позволяет провести валидацию выравниваний на Фиг.7 на структурном уровне (Фиг.8А). Сосредоточение, например на паре оснований R94α2-N150β2 (положение 3, Таблица 2) в глобальных наложенных структурах A, выявило неизменность положений для общей вариации RMSD от 0,29 до 1,18Å (Фиг.8B). Такие структуры могут считаться виртуально идентичными на топологическом уровне, так как наблюдаемые различия отмечались лишь в пределах экспериментальных вариаций, ожидаемых для независимых структур одной молекулы.
Фигура 9 указывает, что фаги, отображающие S95Cα2-S121Cβ2 (положение 2, Таблица 2) со стабилизацией HLA-DR или HLA-DQ2.5 специфически окрашивают клоны Т-клеток человека. Клетки Т18, TCC 820.26 и TCC 820.88 были блокированы и окрашены фагемидами, представляющими HLA II-pIII класса в течение 1 часа при комнатной температуре с последующей инкубацией на льду с биотинилированным конъюгатом антитела кролика к fd с биотином и стрептавидином-PE. Геометрическая средняя интенсивность (GMI) для препарата каждого фага представлена в виде гистограммы.
Фигура 10 представляет анализ уровней представления одновалентного (M13K07) и поливалентного (HyperPhage) I-Ed-pIII с помощью SDS PAGE в восстанавливающих и невосстанавливающих условиях с последующим вестерн-блоттингом с определением в присутствии антитела к pIII. Нумерация остатков согласно IMGT (см. Таблицу 2).
ПРИМЕРЫ
Пример 1
МАТЕРИАЛЫ И СПОСОБЫ
Структурная оценка, молекулярное моделирование и анализ последовательности
Кристаллическая структура (PDB ID: 1FNG) молекулы МНС мыши II класса I-Ek с разрешением 1,9Å в комплексе с пептидом, полученном из гемоглобина (Hb) (Hbaa65-76)1 использовалась для первичного предсказания дисульфидных связей. Были исследованы остатки, образующие взаимодействие между константными доменами α2-β2, и боковые цепи, в которых β-атомы углерода находились на расстоянии менее 7Å были отобраны для дальнейшего анализа. Вначале выбранные боковые цепи были заменены на цистеин путем in silico мутагенеза, при этом оптимальные ротамеры были выбраны с помощью сканера библиотеки ротамеров. В случаях, когда тиоловые группы выбранной пары оснований находились в субоптимальном положении для образования дисульфидной связи, двугранный угол χ1 боковых цепей был вручную повернут в необходимое положение. Затем локальные геометрические показатели были оптимизированы с использованием минимизации ограниченной энергии и силового поля Gromos96.
Транслированные эталонные последовательности IMGT мыши для Н-2Е (номер доступа в GenBank: K00971 и AF050157) и номер доступа в H-2А GenBank: V00832 и М13538), наши клонированные последовательности H-2Ed (см. ниже) и PDB: 1FNG Н-2E были выровнены с использованием ClustalW2.02 (http://www.ebi.ac.uk/) и обозначены вручную. Репрезентативные мышиные Н-2А и E, а также HLA-DP, DQ и DR человека были загружены из (http://imgt.cines.fr/textes/IMGTrepertoireMHC/LocusGenes/RepresentativeMHCgc.html), подвергнуты трансляции и выровнены с использованием ClustalW2.02 (http://www.ebi.ac.uk/). Используемые эталонные последовательности IMGT были следующими (коды доступа в GenBank (α-цепь/β-цепь)): I-A (V00832/ М13538), I-Е (K00971/AF050157), HLA-DP (X03100/M23907), HLA-DQ (M23907/U92032) и HLA-DR (J00204/AJ297583). Выравнивание было вручную затемнено согласно Н-2E и структурному анализу PDB ID: 1FNG. Такое выравнивание последовательностей было валидировано структурным соотношением и структурным наложением репрезентативных записей PDB: 1FNG (I-Ek), 1S9V (HLA-DQ2), 1JK8 (HLA-DQ8), 1DLH (HLA-DR1). 1BX2 (HLA-DR2), 1HQR (HLA-DR2a), 1A6A (HLA-DR3), 1D6E (HLA-DR4) и 2Q6W (HLA-DR52a). Программное обеспечение spdb viewer 3.7SP5 использовали для всех молекулярных визуализации и манипуляций.
Штаммы бактерий, фагов-хелперов и плазмид
Штамм Е.coli XL1-Blue и фага-хелпера VCSM13 были приобретены у компании Stratagene (LaJolla, CA, USA). Фаги-хелперы HyperPhage™ были приобретены у компании Progen Biotechnik GmbH (Heidelberg, Germany). Фагемида pIII pSEX813, несущая одноцепочечный Fv (scFv) со специфичностью относительно phOx-BSA, была любезно предоставлена компанией Affitech AS (Oslo, Norway), а также ее можно приобрести у компании PROGEN Biotechnik GmbH (Heidelberg, Germany). Фагемиды pSEX81-основанные pFAB-Display и pFABDFN, обладающие специфичностью к phOx-BSA, были описаны ранее4.
Линии клеток
T-клеточная гибридома LD15 специфична относительно пептида гемагглютинина вируса гриппа (аминокислоты 110-120; N-SFERFEIFPKE-C) при представлении на молекуле МНС мыши II класса I-Ed. Клон CD4+ T-клеток T18 человека специфичен относительно мышиного Ig С каппа (аминокислоты 40-48; N-WKJDGSERQ-С) и ограничен HLA-DR4 (DRA1, B1*0401) (PMID: 12456590). Клоны T-клеток человека TCC 820.26 и TCC 820.88 распознают антигенные детерминанты DQ2-αI (аминокислоты 57-68; N-QLQPFPQPELPY-C) и DQ2-αII(аминокислоты 62-72; N-PQPELPYPQPE-C) соответственно. Клетки были любезно предоставлены Dr. S.-W. Qiao (Institute of Immunology, University of Oslo, Oslo, Norway). Все клетки содержались в среде RPMI 1640, дополненной 10% ФБС, 0,1 мМ неосновных аминокислот, 1 мМ натрия пирувата, 50 мкМ монотиоглицерина и 12 мкг/мл гентамицина сульфата.
AT и дополнительные реагенты
Все среды и буферы были приготовлены по существу, как это описано в Sambrook et al6. Мышиное антитело к pIII, кроличье антитело к fd, кроличье антитело к конъюгату fd-биотин, овечье антитело к M13-HRP и овечье антитело к HRP мыши были приобретены у компаний MoBiTec (Goettingen, Germany), Sigma-Aldrich (Oslo, Norway) и Amersham Biosciences (Uppsala, Sweden) соответственно. Антитело к I-E/I-A 2G9 и конъюгаты стрептавидин-PE и стрептавилин-АРС были приобретены у компании BD Pharmingen (San Jose, CA, USA). Крысиное антитело к CD32 мыши 2.4G2 (АТСС® номер НВ-197™) было получено в лаборатории. Гаптен 2-фенилоксазол-5-он (phOx), конъюгированный с бычьим сывороточным альбумином (БСА), по существу было приготовлено согласно описанию7. Рестриктазы (RE) были приобретены у компании New England Biolabs (Ipswich, MA, USA), за исключением DpnI, которая была приобретена у компании Stratagene (LaJolla, CA, USA). Олигонуклеотиды ДНК были приобретены у компаний MWG Biotech AG (Ebersberg, Germany), DNA Technology (Aarhus, Denmark) или Sigma-Aldrich. БСА и Твин 20 были приобретены у компании Sigma-Aldrich (Oslo, Norway). ДНК полимераза Pfu Turbo была приобретена у Stratagene (LaJolla, CA, USA). Трипсин/ЭДТА были приобретены у компании BioWhittaker (Lonza Group Ltd., Visp, Switzerland).
Конструирование фагемиды-дисплея I-Ed-pIII
Гены H-2Е из клеток лимфомы A20 BALB/c B были подвергнуты ПЦР-ОТ и клонированы отдельным образом в эукариотический вектор pLNOH2, создав слияния I-Ed-Ig, как это описано в Casares et at8. Гены, кодирующие I-Ed и I-Edβ, были амплифицированы из таких векторов с использованием следующих пар праймеров: pFAB I-Eda fw (5'-TATACCATGGCCATCAAAGAGGAACACACCATCATCCAGG-3') и pFAB I-Eda rv (5'- TATAACTAGTCATTACTCCCAGTGCTTCCGCAGAG-3') для I-Edα, и pFAB I-Edb fw (5'-TATAACGCGTCAGAGACACCAGACCACGGTTTTTG-3') и pFAB I-Edb rv (5'-TATAGGCCGCAGCGGCCCCTTTCCACTCGACCGTGACAGGGT-3') для I-Edβ. Гены I-Ed были клонированы в фагемиду pFABDFN таким образом, что ген I-Edβ был слит с поверхностным белком М13 pIII, в то время как цепь I-Edα должна была быть получена в качестве растворимой частицы (Фиг.2). ДНК, кодирующая пептид гемагглютинина вируса гриппа (аа 110-120), и линкер 15 аа (G4S)3 были включены N-терминально в цепь I-Edβ с использованием сплайсинга генов путем перекрывания согласно описанию9 и следующих праймеров: рМНСНА SOEing fw (5'-AAAGGAAGGAGGTGGTGGCTCCGGTGGAGGGGGAAGTGGAGGTGGAGGGTCTGTCAGAGACACCAGACCACGGTT-3') и рМНСНА SOEing rv (5'-GGAGCCACCACCTCCTTCCTTTGGGAAGATCTCGAACCTTTCGAATGATACGCGTGCCATCGCCG-3'). В целях клонирования, сайт рестрикции PstI в гене I-Edβ был удален с использованием сайт-специфического мутагенеза QuikChange™ согласно протоколу производителя (Stratagene, LaJolla, CA, USA) с использованием праймеров QCIEdbPstI fw (5'-TGGACACGTACTGTAGACACAACTATGAGAT-3') и QCIEdbPstI rv (5'-ATCTCATAGTTGTGTCTACAGTACGTGTCCA-3'). Точечные мутации для введения дисульфидных связей были введены путем сайт-специфического мутагенеза QuikChange™ согласно протоколу производителя (Stratagene, LaJolla, CA, USA). Используемые праймеры были представлены следующими: Mut R94C I-Ed alfa fw (5'-GACTGTACTCTCCTGTAGCCCTGTGAACC-3') и Mut R94C I-Ed alfa rv (5'-GGTTCACAGGGCTACAGGAGAGTACAGTC-3') для мутации R94C в I-Edα, Mut N151C I-Ed beta fw (5'-CCTGGTCCGATGTGGAGACTGGACCTTC-3') и Mut N151C I-Ed beta rv (5'-GAAGGTCCAGTCTCCACATCGGACCAGG-3') для мутации N150C в I-Edβ, QCIEdaS95C fw (5'-ACTCTCCAGATGCCCTGTGAAC-3') и QCIEdaS95C rv (5'-GTTCACAGGGCATCTGGAGAGT-3') для мутации S95C в I-Edα, QCIEdbS120C fw (5'-GTCTGCTCTGTGTGTGACTTCTAC-3') и QCIEdbS120C rv (5'-GTAGAAGTCACACACAGAGCAGAC-3') для мутации S120C в I-Edβ, QCIEdaP96C fw (5'-CAGAAGCTGTGTGAACCTGGGA-3') и QCIEdaP96C rv (5'-TCCCAGGTTCACACAGCTTCTG-3') для мутации Р96С в I-Edα, и QCIEdbS118C fw (5'-CCTGGTCTGCTGTGTGAGTGAC-3') и QCIEdbS118C rv (5'-GTCACTCACACAGCAGACCAGG-3') для мутации в S118C I-Edβ.
Получение бактериофага, представляющего MHC II
Получение фагемиды из Е.coli XL1-Blue с использованием VCSM13 или фагов-хелперов HyperPhage™ и сборки вириона было подвергнуто мониторингу путем точечной титрации согласно описанию10.
ИФА захвата фага
Захватываемые AT и phOx-BSA были абсорбированы в лунках планшета для микротитрации MaxiSorp™ (Nunc, Roskilde, Denmark) в концентрациях от 2,5 до 5 мкг/мл в ФСБ, рН 7,4 в течение ночи при 4°C. Лунки были блокированы PBSTM (ФСБ с добавлением 0,05% о/о Твина 20 и 4% в/в обезжиренного молока) в течение 1 часа при комнатной температуре. Затем были добавлены нормализованные количества препаратов вириона (восстановленные VCSM13 образцы: 1×1010 KOEampR/лунка; восстановленные HyperPhage образцы: 1×108 KOEampR/лунка) с последующей реакцией в течение от 1 до 2 часов при комнатной температуре перед тем, как захваченные вирионы будут определены с использованием антитела к M13-HRP (1:5000) в течение 1 часа при комнатной температуре. Лунки содержали растворимый субстрат ТМВ (Merck KGaA, Darmstadt, Germany), затем по прошествии 30 минут и измерения поглощения при A450нм в них была добавлена 1М HCl.
SDS-PAGE u вестерн-блоттинг
Вирионы (108 KOEampR/дорожка) были разделены в восстанавливающих и невосстанавливающих условиях 4-12% Bis/Tris XT прогностическим анализом SDS-PAGE (Bio-Rad, Hercules, CA, USA), после чего был проведен блоттинг на мембрану из поливинилидена фторида (Millipore, Madison, USA) в буфере Трис/глицин (25 мМ Трис, 192 мМ глицина и 20% метанола, рН 8,3) при 25 V в течение 30 минут с использованием полусухого аппарата для блоттинга (Bio-Rad, Hercules, CA, USA). Мембрана была блокирована в PBSTM до того, как были определены слияния pIII с мышиным MAT к pIII (1:4000) с последующим воздействием овечьим антителом к HRP мыши (1:10000). Мембрана была промыта, затем был добавлен субстрат SuperSignal™ West Femto (Pierce, Rockford, IL, USA) и нанесен на пленку BioMax™ MR (Kodak, Femwald, Germany).
Конструирование HLA-DP, -DR и DQ с искусственными мостиками S-S
Гены, кодирующие репрезентативные HLA-DR (DRA*0101/ DRB1*1402) и -DQ (DQA1 *0501/ DQB1 *0301), как это определено IMGT (http://imgt.cmes.fr/), были синтезированы химическим образом (Genscript, Piscataway, NJ). Последовательности ДНК были оптимизированы путем коррекции кодона Е.coli, вслед за чем были введены точечные мутации для введения пары цистеина в положении 2 α2-β2 (Таблица 2). Фрагменты ДНК были клонированы в фагемиду pFABDFN, как это описано выше.
С другой стороны, гены, кодирующие репрезентативные HLA-DP(DPA1*0103/DPB1*0401), -DR (DRA*0101/DRB1*1402) и DQ (DQA1*0501/DQB1*0301), как это определено IMGT (http://imgt.cines.fr/), амплифицированы ПЦР-ОТ из свежеизолированных МКПК человека и клонированы в фагемиду pFABDFN, как это описано выше. Точечные мутации для введения пары цистеинов в положении 2 (Таблица 2) α2-β2 были введены путем сайт-специфического мутагенеза QuikChange™ согласно протоколу производителя (Stratagene, LaJolla, CA, USA). Используемые праймеры были представлены следующими (перечислены в Таблице 1): DPA_S95C_sense и DPA_S95C_antisense для мутации S95C в HLA-DPA α2-домене, DPB_S121C_sense и DPB_S121C_antisense для мутации S121C в HLA-DPB β2-домене, DRA_S95C_sense и DRA_S95C_antisense для мутации S95C в HLA-DRA α2-домене, DRB_S121C_sense и DRB_S121C_antisense для мутации S121C в HLA-DRB β2-домене, DQA_S95C_sense и DQA_S95C_antisense для мутации S95C в HLA-DQA α2-домене, DQB_S121C_sense и DQB_S121C_antisense для мутации S121C в HLA-DQB β2-домене,
Проточная цитометрия
Суспензии отдельных клеток LD1 были блокированы 15 минут на льду с 60% инактивированной теплом крысиной сывороткой и 200 мкг/мл MAT к CD32 (НВ197) в 1х ФСБ (Фигура 6а), или не были блокированы (Фигура 6b). Окрашивание дисплея I-Ed-pIII в присутствии HyperPhage проводили на льду в течение 2 часов в буфере окрашивания (1х ФСБ с 0,5% БСА) (Фигура 6а), или в течение 30 минут при комнатной температуре в 1х ФСБ с 1% БСА (Фигура 6b). Исходные параметры фага, представленного на Фигуре 6а, составляли 5×109 KOEampR для HAaa110-120-I-Ed дисплея и 1,6×1010 KOEampR для I-Ed дисплея. Исходные параметры фага, представленного на Фигуре 6b, составили 2×109 KOEampR для всех препаратов, за исключением фага-хелпера VCSM13 (отрицательный контроль, 1×1011 KOEkanR/мл). Затем образцы были инкубированы в течение 1 часа (Фигура 6а) или 30 минут (Фигура 6b) на льду с 10 мкг/мл биотинилированного кроличьего антитела к fd с последующим нахождением на льду в течение 15 минут с 2 мкг/мл стрептавидина РЕ.
Суспензии отдельных клеток в буфере окрашивания (1х ФСБ с 0,5% БСА) были приготовлены с использованием трех клонов T-клеток: T18, TCC 820.26 или TCC 820.88 соответственно. Клетки были окрашены при комнатной температуре в течение 1 часа в присутствии фагов с поливалентным (фаг HyperPhage) или одновалентным (фаг VCSM13) слиянием с HLA класса II-pIII (Фигура 9). Исходные параметры фагов были ~1×109 KOEampR (фигура 9а), ~2×109 KOEampR (Фигура 9b) и ~2×1012 KOEampR (Фигура 9c и d) соответственно. Затем образцы были инкубированы в течение 1 часа на льду с 10 мкг/мл биотинилированного кроличьего антитела к fd с последующим нахождением на льду в течение 30 минут с 2 мкг/мл стрептавидина-PE. Явления были зафиксированы с использованием проточного цитометра FACSCalibur (BD Biosciences) и проанализированы с использованием программного обеспечения CellQuest PRO (BD Biosciences).
РЕЗУЛЬТАТЫ
Молекулярное моделирование
В Таблице 2 (нумерация 1FNG) представлены расстояния для β-атомов углерода боковых цепей для отобранных пар оснований взаимодействующих константных доменов α2/β2 в структуре I-Edα/I-Ekβ (PDB ID: 1FNG). Мутагенез in silico и оптимизация боковой цепи для пар оснований в положениях от 1 до 3 привела к образованию дисульфидной связи на расстоянии между 2,03 и 2,07Å без изменения третичной структуры белка (Фиг.1). Данный результат указывает на то, что замены таких аминокислот реальны и приведут к образованию дисульфидных мостиков в мутантных полипептидах, и, следовательно, они были выбраны для дальнейшего анализа. Примечательно, что нумерация аа в PDB ID 1FNG отклоняется от нумерации последовательностей IMGT в β-цепи (см. Фиг.3B).
Таблица 2
Разработка слияния МНС-рIII
Сегменты генов I-Ed были вставлены в фагемиду pFABDFN таким образом, что α- и β-цепи были транслированы в виде двух отдельных полипептидов, при этом β-цепь была напрямую слита внутри рамки с N-концом белка капсида вируса pIII (Фиг.2). Обе цепи содержали N-терминальную сигнальную последовательность (pelB) для периплазматических взаимодействий. Вставленный участок α-цепи (Фиг.3A, H-2EA_EL) соответствует аминокислотам 26-204 в эталонной последовательности IMGT Н-2ЕА*02 (код доступа GenBank: K00971, SEQ ID NO: 1), представленной на Фигуре 3A. Подобным образом, использовали участок β-цепи, соответствующий аминокислотам 27-216 эталонной последовательности IMGT Н-2ЕВ1*01 (код доступа GenBank: AF050157, SEQ ID N0:2), представленный на Фигуре 3B (Фиг.3B, H-2EBJEL). Таким образом, положения для замены цистеина от 1 до 3 в Таблице 2 соответствуют положениям 94-96 α-цепи (Фиг.3A) и положениям 119, 121 и 151 β-цепи (Фиг.3B) зрелых пептидов (т.е. пептидов без сигнальных пептидов) соответственно, основываясь на эталонных последовательностях I-Е IMGT. Примечательно, что нумерация такого остатка β-цепи отличается от нумерации в файле шаблонов 1FNG.
Анализ дисплея МНС II-pIII, полученного из фагемид
Для сравнения предрасположенности и целостности дисплея молекул рМНС, был проведен ИФА фага путем захвата нормализированных количеств вирионов на моноклональном антителе (MAT) 2G9, специфичном относительно I-Е. Результаты показали, что все образцы распознавались MAT 2G9 дисплеем с высокой и низкой валентностью (Фиг.4), указывая на общее сохранение структурной целостности. MAT 2G9 связывается с β-цепью I-Е, которая была напрямую слита с pIII. Для оценки присутствия ковалентной димеризации α-цепи на фагах, нормализированное количество вирионов было проанализировано путем SDS PAGE в восстанавливающих и невосстанавливающих условиях с последующим определением антитела к pIII в ходе вестерн-блоттинга (Фиг.5). Результаты показали, что значительная пропорция ковалентных гетеродимеров присутствовала во всех образцах, за исключением wt (Фиг.5, ряд 5) и мутанта α95/β120, несущего пептид НА (Фиг.5, ряд 3). Однако последний образец неожиданно имел очень низкое содержание образца, что препятствовало правильности разрешения. После восстановления образцов, все образовавшиеся ковалентные комплексы были удалены (Фиг.5, ряды 11-20). Более того, как и для контроля антитела Fab (Фиг.5, ряды 10 и 20), для модифицированных молекул рМНС ожидалось образование только одного ковалентного гетеродимера, однако это было не так, так как во всех релевантных образцах образовалось множество таких видов. Такое явление в большей степени объясняется образованием аберрантного дисульфидного моста между нативными остатками цистеина и введенными мутациями. Таким образом, обнаружена только одна фракция, которая фактически представляет белок, в виде цепей, несущих нативные дисульфидные мостики в добавление к искусственно введенным мостикам в доменах α2-β2.
Подобный эксперимент проводился с параллельным анализом одновалентных и поливалентных дисплеев I-Ed-pIII. Результаты приведены на Фигуре 10. При низком уровне дисплея фагемида (одновалентном) примерно 1-10% вирионов несут белок слияния (Bradbury and Marks, J Immunol Methods. 2004, 290 (1-2):29.). Таким образом, в данных примерах не отмечалось присутствия белка слияния (образцы М13К07), несмотря на то, что такой белок был определен в ходе более чувствительного ИФА (Фигура 4).
рМНС-pIII в качестве реагентов окрашивания поверхности клеток
Для исследования возможности использования пептид-МНС II класса в виде слияния с pIII на бактериофаге в качестве реагентов окрашивания наподобие обычно используемых тетрамеров рМНС II, нами было проведено окрашивание клеток LD1 HAaa110-120/I-EdpIII или I-Ed-pIII без белка слияния. Как можно видеть на Фигуре 6а, окрашивание отсутствовало для I-Ed-pIII на бактериофагах, полученных без релевантного пептида, в то время как клетки, окрашенные HAaa110-120/I-Ed-pIII, обладали интенсивностью окрашивания примерно на 0,8 log больше. Как можно видеть на Фигуре 6b, пептид-специфическое окрашивание отмечалось для всех трех исследуемых дисульфидных мостиков. Положительное окрашивание отмечалось только для версий I-Ed-pIII с дисульфидной стабилизацией и только для версий, несущих антигенный пептид (HAaa110-120). Какой-либо значимой разницы между тремя рекомбинантными дисульфидными мостиками не отмечалось; таким образом, они должны функционировать с подобной эффективностью.
Для дальнейшего изучения функциональности рМНС-pIII, вирионы mCκaa40-48/HLA-DR4-pIII, αIaa57-68/HLA-DQ2.5 или αIIaa62-72/HLA-DQ2.5 были получены из фагемидов с использованием VCSM13 или HyperPhage™. Все слияния рМНС-pIII также были проведены без присутствия антигенного пептида в качестве контроля. Затем такие вирионы были протестированы в ходе экспериментов проточной цитометрии согласно описанию. Как можно видеть на Фигуре 9а, пептид-специфическое окрашивание отмечалось для клеток, окрашенных mCκaa40-48/HLA-DR4-pIII. На Фигуре 9b и 9c поливалентный и одновалентный дисплей αIaa57-68/HLA-DQ2.5 характеризовался пептид-специфическим окрашиванием. Примечательно, что исходный показатель фага составил 1012 KOEampR для дисплея VCSM13 αIaa57-68/HLA-DQ2.5. Пептид-специфическое окрашивание для αIIaa62-72-HLA-DQ2.5 показано на Фигуре 9d.
Обсуждение
Основным препятствием для эффективного использования растворимых, рекомбинантных молекул МНС II класса является проблема нестабильности таких рекомбинантных молекул. Однако был разработан целый ряд способов для преодоления такого ограничения, но на сегодняшний день какой-либо общий способ отсутствует11. Кроме того, все используемые в настоящее время способы являются дорогостоящими и трудоемкими процедурами, что фактически сводит на нет любые высокопроизводительные способы. Исследователи по изобретению обнаружили достойное решение такой проблемы путем слияния рекомбинантных молекул МНС II класса со способом фаговых дисплеев12. Это не только очень быстрая и недорогая технологическая платформа, но также и возможность проведения весьма разнообразного комбинаторного скрининга. С учетом огромной протяженности антигенных протеом, представленных молекулами, МНС будут значительно выигрывать для данной комбинаторной функции, например, в изучении антигенных детерминант. Однако на сегодняшний день такое изучение ограничено обременительным и низкопроизводительным способом, основанным на бакуловирусах13.
С использованием фаговых дисплеев, можно будет легко работать с порядками размера репертуара в тщательно задокументированной форме12. Несмотря на то, что такой дисплей был открыт для молекулы МНС I класса14-16, на сегодняшний день ни один из способов фаговых дисплеев для МНС I класса не был доказан как функциональный в качестве замены растворимых тетрамеров, так как все еще предстоит получить специфическое для клеток окрашивание16. В отличие от молекулы МНС I класса, которая может быть получена эффективным образом в качестве одного полипептида18, получение МНС II класса осложнено тем фактом, что он представлен гетеродимером из вносимых равный вклад, отдельных цепей11. Будучи построенными на топологии складчатой структуры Ig, функциональная складчатость МНС I и II класса также требует образования междоменных дисульфидных мостиков19.
Ключевым аспектом нативного взаимодействия между МНС II класса и его когнатным лигандом, рецептором T-клеток, является характерная слабая аффинность20. Для преодоления данного ограничения в чувствительности, когда рекомбинантные молекулы МНС II класса используют в качестве реагента для определения, полимеризация молекул в тетрамеры или пентамеры была необходимой. Получение таких полимеров подразумевает многоэтапный протокол с многочисленными манипуляциями. Использование фагового дисплея в данном случае обеспечивает легкую полимеризацию путем применения уже существующего способа, который обеспечивает полимерный дисплей на фаге21.
Исследователи по изобретению представляют стратегию получения функциональных молекул МНС II класса в фагемидном дисплее pIII. Для достижения этого две α- и β-цепи экспрессируются в виде двух отдельных полипептидных цепей в Е.coli, из них одну сливают с капсидом pIII и наводят на периплазму. В окисляющей периплазме две цепи образуют стабильные гетеродимеры путем введения нового искусственного дисульфидного мостика, укрепляющего взаимосвязь доменов α2 и β2. Для aa замещений в сохраненном взаимодействии α2-β2 молекулы мышиного МНС II класса I-Ed может использоваться множество положений, что позволяет вводить искусственные межцепочечные дисульфидные мостики (Фиг.1 и 3). Путем отображения таких искусственных молекул МНС на pIII с использованием стандартного и основанного на фагемиде фагового дисплея, ковалентные гетеродимеры представлены на вирионах (Фиг.5 и 10). Общая целостность молекулы сохранена, так как все молекулы, как wt, так и мутанты, остаются реакционоспособными относительно моноклонального антитела (МАВ 2G9), специфичного к молекуле МНС II класса I-E мыши (Фиг.4). Молекулы I-Ed были разработаны для представления хорошо охарактеризованного антигенного пептида HAaa110-120 22 в качестве ковалентного линкера для β-цепи, как это уже было описано ранее. С использованием фагов, представляющих такие рекомбинантные молекулы со стабилизацией дисульфидными мостиками в ходе проточной цитометрии было получено специфическое окрашивание LD1 T-клеточной гибридомы5, характерное для T-клеточного рецептора, специфического относительно комплекса I-Ed/HAaa110-120 (Фиг.6a и b). Важным является тот факт, что специфическое окрашивание отмечалось только для слияний I-Ed-pIII с дисульфидной стабилизацией в присутствии антигенного пептида, что и доказывает функциональность способа. Кроме того, поливалентный дисплей молекулы МНС оказался важным для окрашивания, так как для одновалентного дисплея (данные не приводятся) не отмечалось подобного окрашивания, что подчеркивает необходимость в повышении функциональной аффинности в сравнении с показателем, отмечаемым для нативного взаимодействия. Это представляет собой первый пример на сегодняшний день, в котором молекула МНС, представленная на фаге, использовалась для прямой визуализации специфических T-клеток, комплементарных классическому тетрамерному способу МНС.
Ключом к успеху является введение искусственного дисульфидного мостика, стабилизирующего взаимодействие α2-β2 в молекуле МНС II класса. Данный способ является общим, поскольку идентифицированные положения сохранены в большей степени среди молекул МНС II класса, включая HLA (Фиг.7 и 8). Такая общая природа доказывается тем фактом, что тестированию было подвергнуто также три других комплекса МНС II класса, а именно mCκaa40-48/HLA-DR4, αIaa57-68/HLA-DQ2.5 и αIIaa62-72/HLA-DQ2.5, и, как для всех слияний с pIII, было выявлено специфическое окрашивание клеток в ходе проточной цитометрии специфическим для антигенного пептида образом (Фиг.9). Как и ожидалось, окрашивание и зависимость поливалентного взаимодействия варьировали среди специфических комплексов рМНС II, с которыми реагировали клоны T-клеток. Таким образом, зависимость поливалентности не было явлением по принципу «все или ничего», и подтверждалось специфическим окрашиванием клеток в одновалентных версиях αIaa57-68/HLA-DQ2.5 и αIIaa57-68/HLA-DQ2.5. Способность положительного специфического окрашивания в ходе проточной цитометрии будет зависеть от параметров, таких как свойственная аффинность отдельного T-клеточного рецептора относительно рМНС, плотность рецептора на T-клетке и способность рецептора образовывать кластеры на мембране. Следует отметить, что поливалентное (Фиг.9b) и одновалетное (Фиг.9 с) окрашивание αIaa57-68/HLA-DQ2.5 было по существу идентичным, несмотря на 1000-кратную меньшую разницу в исходном количестве фагов для поливалентной версии.
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
1. Kersh, G.J. et al. Structural and Functional Consequences of Altering a Peptide MHC Anchor Residue. Journal of Immunology 166, 3345-3354 (2001).
2. Guex, N. & Peitsch, M.C. SWISS-MODEL and the Swiss-Pdb Viewer: an environment for comparative protein modeling. Electrophoresis 18, 2714-2723 (1997).
3. Welschof, M. et al. The antigen-binding domain of a human IgG-anti-F(ab')2 autoantibody. PNAS 94, 1902-1907 (1997).
4. Leset, G.A., Lunde, E., Bogen, В., Brekke, O.H. & Sandlie, I. Functional phage display of two murine α/β T-cell receptors is strongly dependent on fusion format, mode and periplasmic folding assistance. Protein EngDes Sel. 20, 461-472 (2007).
5. Taylor, A.H., Haberman, A.M., Gerhard, W. & Caton, A.J. Structure-function relationships among highly diverse T cells that recognize a determinant from influenza virus hemagglutinin. J Exp Med 172, 1643-1651 (1990).
6. Sambrook, J. & Russell, D.W. Molecular Cloning: A Laboratory Manual, Edn. 3. (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; 2001).
7. Makela, O., Kaartinen, M., Pelkonen, J.L. & Karjalainen, K. Inheritance of antibody specificity V. Anti-2-phenyloxazolone in the mouse. J Exp Med 148, 1644-1660 (1978).
8. Casares, S., Bona, C.A. & Brumeanu, T.D. Engineering and characterization of a murine MHC class II-immunoglobulin chimera expressing an immunodominant CD4 T viral epitope. Protein Eng 10, 1295-1301 (1997).
9. Horton, R.M., Cai, Z.L., Ho, S.N. & Pease, L.R. Gene splicing by overlap extension: tailor-made genes using the polymerase chain reaction. Biotechniques 8, 528-535 (1990).
10. Loset, G.A., Kristinsson, S.G. & Sandlie, I. Reliable titration of filamentous bacteriophages independent ofpIII fusion moiety and genome size by using trypsin to restore wild-type pill phenotype. BioTechniques 44, 551-554 (2008).
11. Vollers, S.S. & Stem, L.J. Class II major histocompatibility complex tetramer staining: progress, problems, and prospects. Immunology 123, 305-313 (2008).
12. Bratkovic, T. Progress in phage display: evolution of the technique and its applications. Cell Mol Life Sci (2009).
13. Crawford, F. et al. Use ofbaculovirus MHC/peptide display libraries to characterize T-cell receptor ligands. Immunol Rev 210,156-170 (2006).
14. Le Doussal, J., Piqueras, В., Dogan, I., Debre, P. & Gorochov, G. Phage display of peptide/major histocompatibility complex. J Immunol Methods 241, 147-158. (2000).
15. Kurokawa, M.S. et al. Expression of MHC class I molecules together with antigenic peptides on filamentous phages. Immunol Lett 80, 163-168 (2002).
16. Vest Hansen, N., Ostergaard Pedersen, L., Stryhn, A. & Buus, S. Phage display of peptide / major histocompatibility class I complexes. Eur J Immunol 31, 32-38 (2001).
17. Constantin, C.M., Bonney, E.E., Altman, J.D. & Strickland, O.L. Major histocompatibility complex (MHC) tetramer technology: an evaluation. Biol Res Nurs 4, 115-127 (2002).
18. Leisner, С.et al. One-Pot, Mix-and-Read Peptide-MHC Tetramers. PLoS ONE 3, e1678 (2008).
19. Halaby, D.M., Poupon, A. & Momon, J. The immunoglobulin fold family: sequence analysis and 3D structure comparisons. Protein Eng 12, 563-571 (1999).
20. Rudolph, M.G., Stanfield, R.L. & Wilson, I.A. How TCRs bind MHCs, peptides, and co-receptors. Annu Rev Immunol 24, 419-466 (2006).
21. Soltes, G. et al. On the influence of vector design on antibody phage display. Journal of Biotechnology 127, 626-637 (2007).
22. Schild, H. et al. Natural ligand motifs ofH-2E molecules are allele specific and illustrate homology to HLA-DR molecules. Int Immunol 7, 1957-1965 (1995).
23. Kozono, H., White, J., Clements, J., Marrack, P. & Kappler, J. Production of soluble MHC class II proteins with covalently bound single peptides. Nature 369, 151-154 (1994).
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ДЛЯ ВЫРАБОТКИ ТЕРАПЕВТИЧЕСКИХ АНТИТЕЛ ПРОТИВ КОМПЛЕКСОВ ПЕПТИД-MHC, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ВАРИАНТЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2819525C2 |
| Двухвалентное биспецифическое химерное антитело, включающее гетеродимер на основе MHC или MHC-подобных белков | 2021 |
|
RU2820683C2 |
| ОПОСРЕДОВАННЫЕ ГУМАНИЗИРОВАННЫМИ Т-КЛЕТКАМИ ИММУННЫЕ ОТВЕТЫ У НЕ ОТНОСЯЩИХСЯ К ЧЕЛОВЕКУ ЖИВОТНЫХ | 2016 |
|
RU2732628C2 |
| ОДНОЦЕПОЧЕЧНЫЕ РЕКОМБИНАНТНЫЕ Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ | 2003 |
|
RU2355703C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ МЫШИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ МОЛЕКУЛЫ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ | 2012 |
|
RU2660564C2 |
| РЕКОМБИНАНТНЫЕ МОЛЕКУЛЫ pMHC КЛАССА II | 2017 |
|
RU2777115C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ МЫШИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ МОЛЕКУЛЫ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ | 2012 |
|
RU2797549C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ В ОТНОШЕНИИ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ МЫШИ | 2012 |
|
RU2653433C2 |
| ИММУНОКОНЪЮГАТЫ ДЛЯ СПЕЦИФИЧЕСКОЙ ИНДУКЦИИ ЦИТОТОКСИЧНОСТИ Т-КЛЕТОК ПРОТИВ КЛЕТОК-МИШЕНЕЙ | 2016 |
|
RU2746021C2 |
| АНТИ-HLA-G АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2797724C2 |
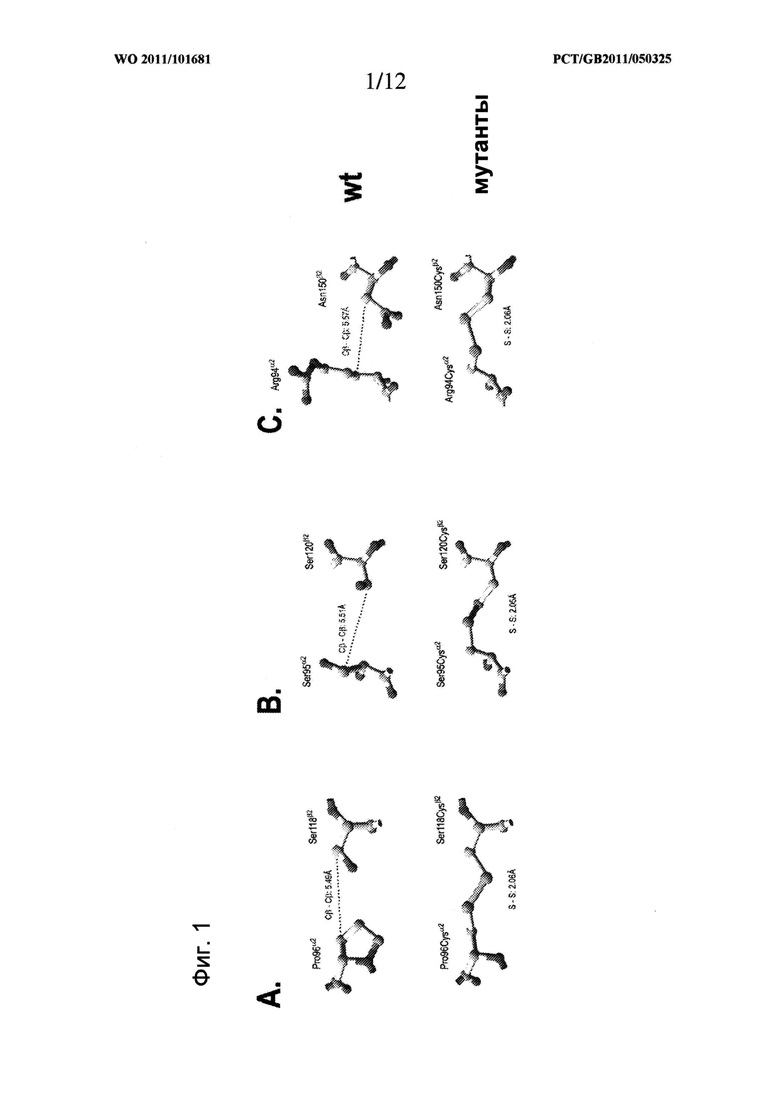
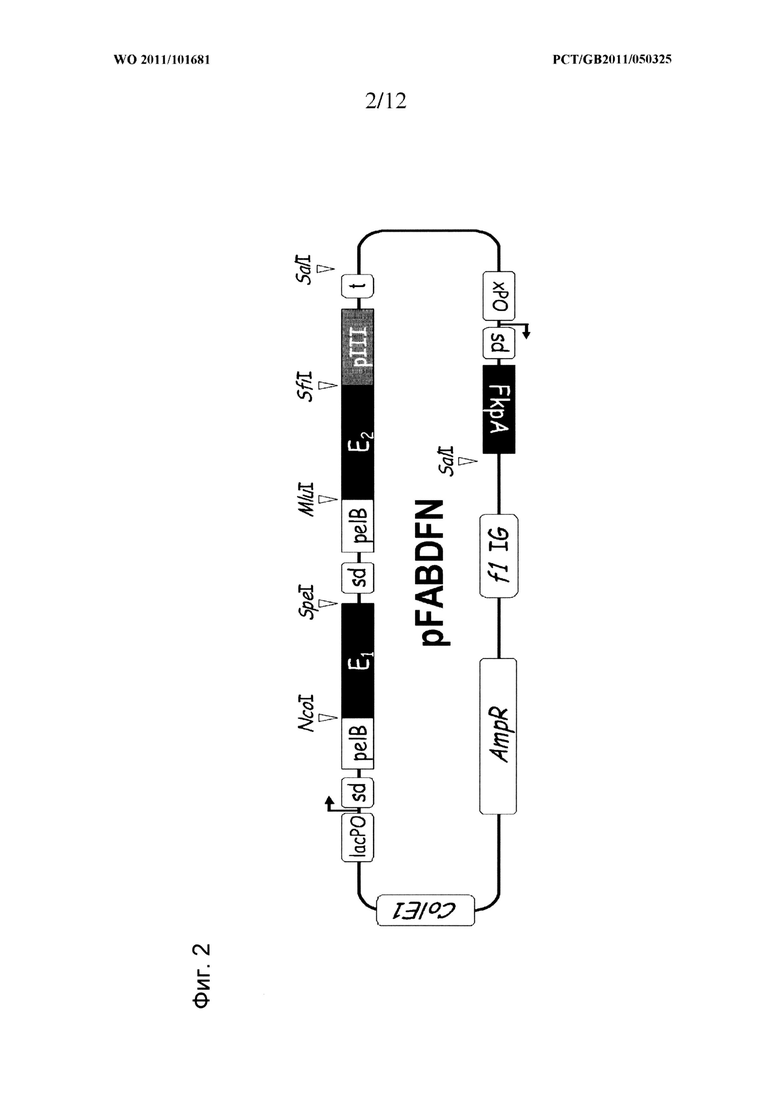

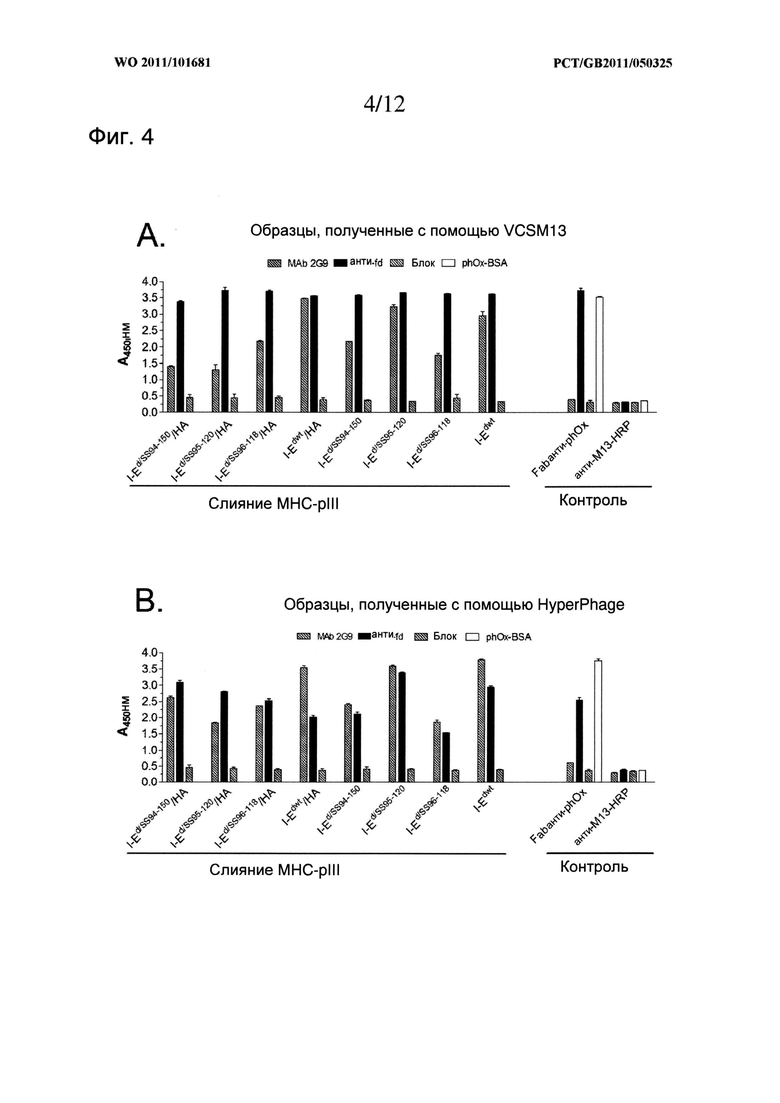
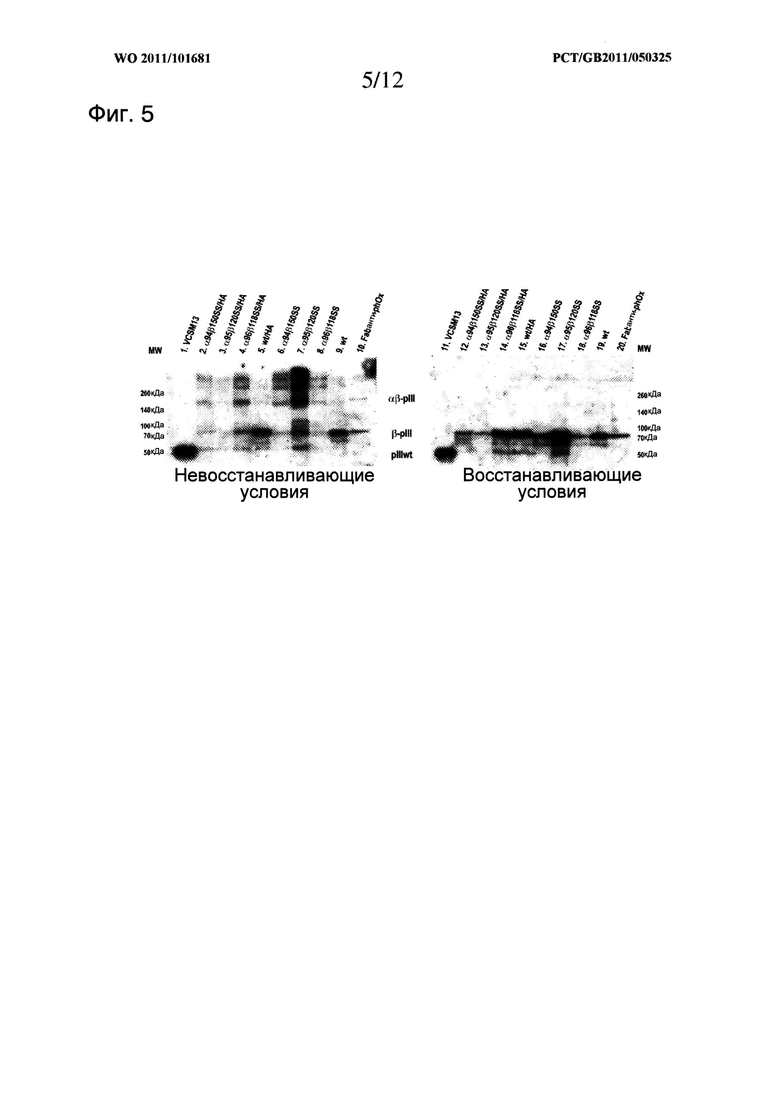
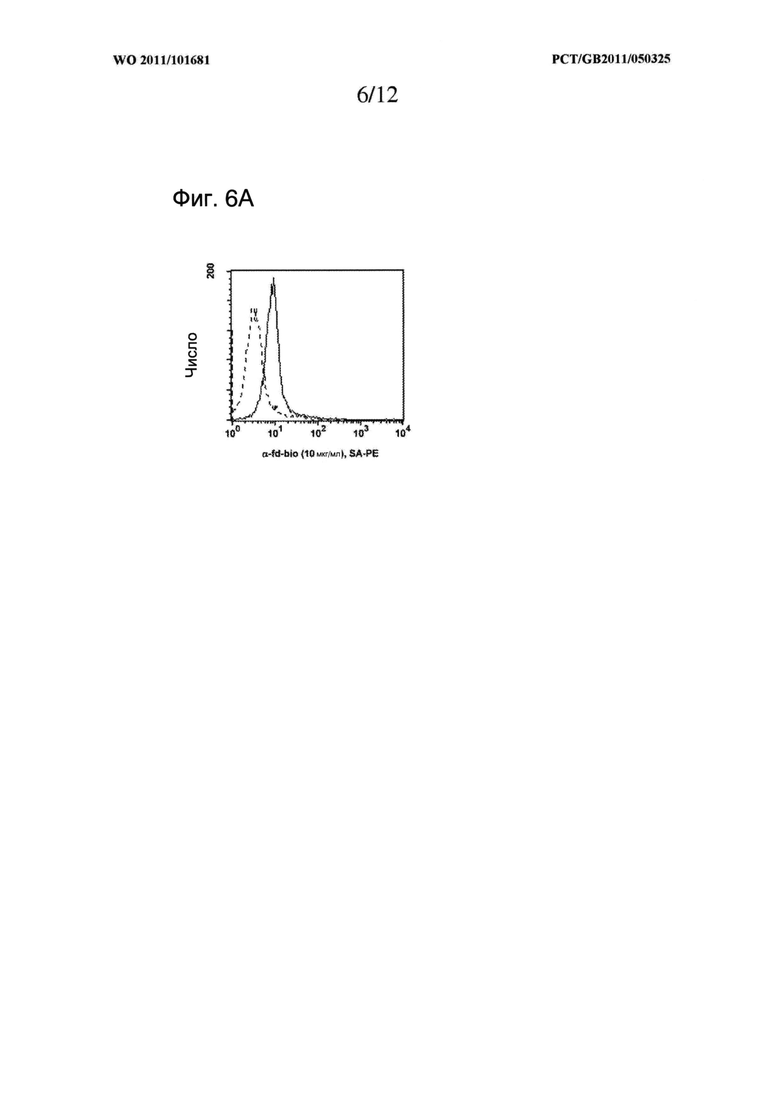
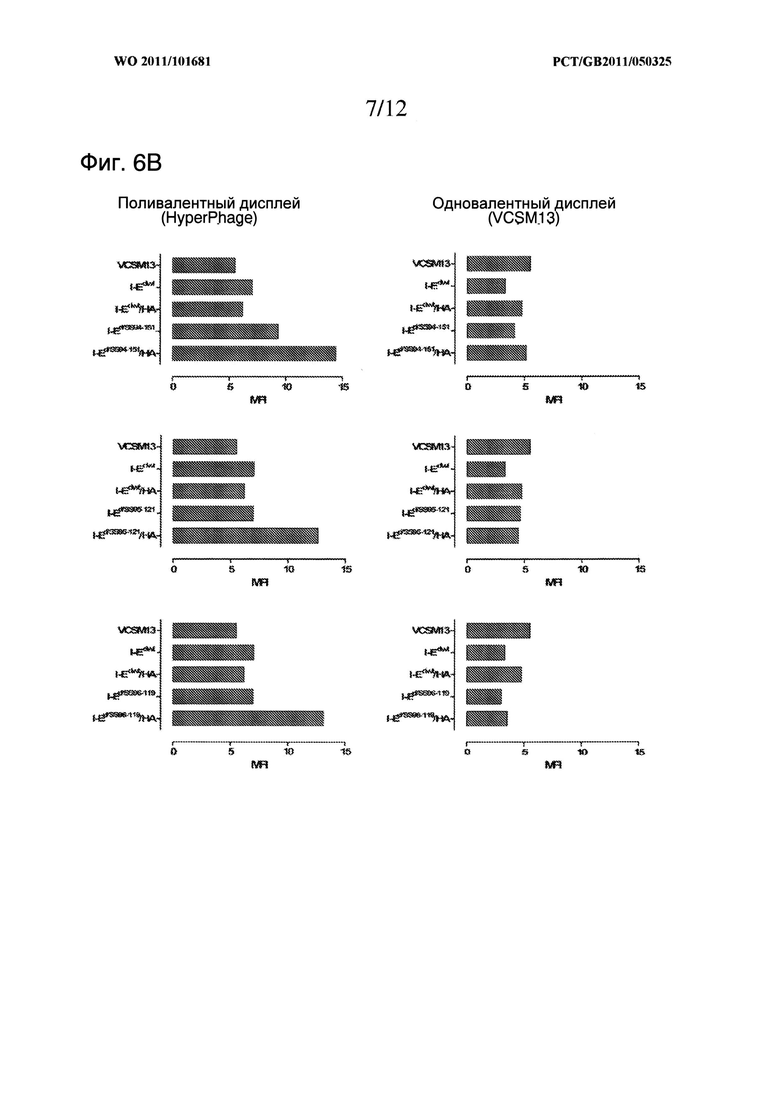


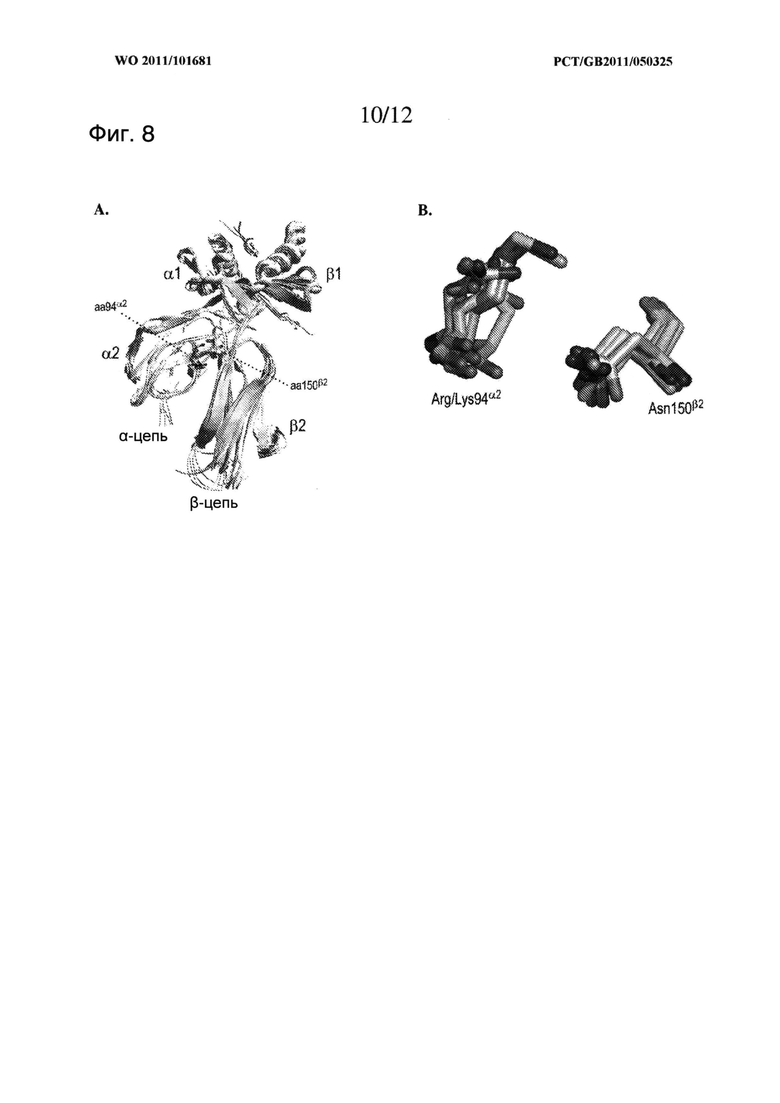
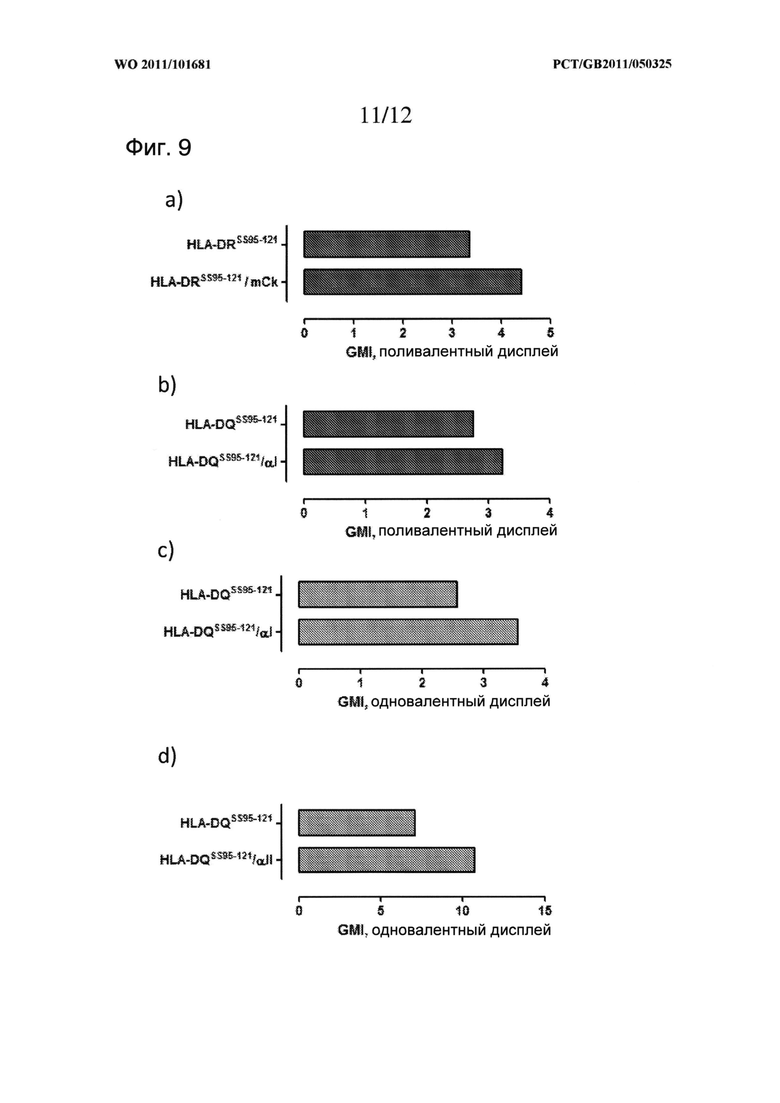
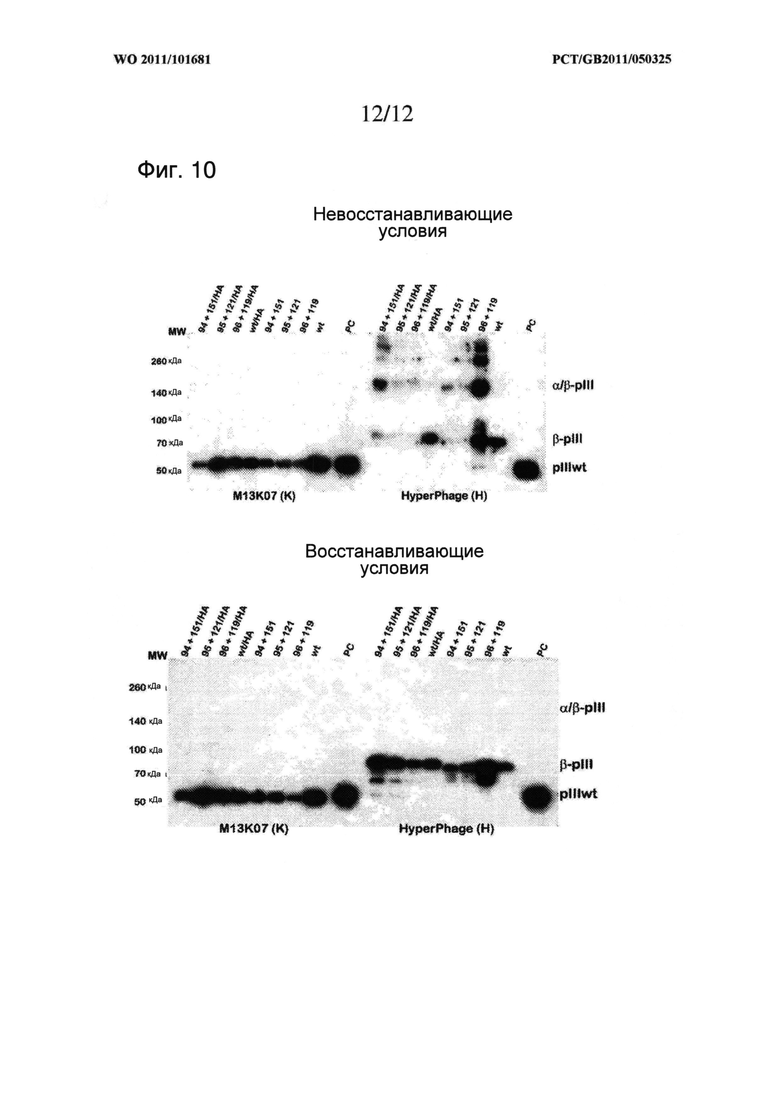
Изобретение относится к области биотехнологии, конкретно к получению рекомбинантных молекул МНС II класса, и может быть использовано в медицине. Рекомбинантная молекула МНС II класса включает: (i) весь или часть внеклеточного участка α-цепи МНС II класса; (ii) весь или часть внеклеточного участка β-цепи МНС II класса; при этом (i) и (ii) обеспечивают функциональный пептид-связующий домен и при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса и полученная рекомбинантная молекула не включает мотив лейциновой молнии. Изобретение позволяет получить рекомбинантные молекулы МНС II класса, стабилизированные дисульфидной связью. 11 н. и 21 з.п. ф-лы, 10 ил., 3 табл., 1 пр.
1. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2; и
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса,
при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии.
2. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что указанная дисульфидная связь расположена между остатками цистеина в положении Ser 95α2 - Ser 121β2 (положение 2) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса.
3. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что один или несколько остатков цистеина соответствуют положениям 38, 42 или 106 эталонной последовательности Н-2ЕВ*01 (SEQ ID NO: 2) или один или несколько остатков цистеина в эквивалентных положениях альтернативного изотипа МНС II класса удалены.
4. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что указанная рекомбинантная молекула экспрессируется на поверхности нитчатого бактериофага.
5. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса,
при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии,
при этом указанная рекомбинантная молекула экспрессируется на поверхности нитчатого бактериофага,
при этом указанная рекомбинантная молекула экспрессируется в виде белка слияния с белком фаговой поверхности gpIII, gpVII, gpVIII или gpIX.
6. Рекомбинантная молекула МНС II класса по п. 5, отличающаяся тем, что указанный белок на фаговой поверхности представлен gpIX.
7. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что указанная молекула представлена растворимой молекулой.
8. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2; и
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса, при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии,
при этом указанная молекула представлена растворимой молекулой, а (i) или (ii) указанной молекулы слиты с участком Fc иммуноглобулина.
9. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса,
при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии, и
указанная молекула является мультимерной.
10. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что (i) и (ii) указанной молекулы получены из молекул МНС II класса мыши или человека, предпочтительно человека.
11. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что указанная молекула получена из бактерии-хозяина.
12. Рекомбинантная молекула МНС II класса по п. 11, отличающаяся тем, что указанная бактерия-хозяин представлена Е. coli, предпочтительно производным Е. coli K12, более предпочтительно Е. coli с фенотипом BL21 или его производным.
13. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что указанная дисульфидная связь обеспечивает единственное средство стабилизации молекулы МНС II класса.
14. Рекомбинантная молекула МНС II класса по п. 1, отличающаяся тем, что указанная молекула способна окрашивать Т-клетки.
15. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса,
при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии, и
указанная молекула дополнительно включает пептид, связанный с указанным пептид-связующим доменом молекулы МНС II класса.
16. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что указанная дисульфидная связь расположена между остатками цистеина в положении Ser 95α2 - Ser 121β2 (положение 2) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса.
17. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что один или несколько остатков цистеина соответствуют положениям 38, 42 или 106 эталонной последовательности Н-2ЕВ*01 (SEQ ID NO: 2) или один или несколько остатков цистеина в эквивалентных положениях альтернативного изотипа МНС II класса удалены.
18. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что указанная рекомбинантная молекула экспрессируется на поверхности нитчатого бактериофага.
19. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что указанная молекула представлена растворимой молекулой.
20. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что (i) и (ii) указанной молекулы получены из молекул МНС II класса мыши или человека, предпочтительно человека.
21. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что указанная молекула получена из бактерии-хозяина.
22. Рекомбинантная молекула МНС II класса по п. 21, отличающаяся тем, что указанная бактерия-хозяин представлена Е coli, предпочтительно производным Е coli K12, более предпочтительно Е coli с фенотипом BL21 или его производным.
23. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что указанная дисульфидная связь обеспечивает единственное средство стабилизации молекулы МНС II класса.
24. Рекомбинантная молекула МНС II класса по п. 15, отличающаяся тем, что указанная молекула способна окрашивать Т-клетки.
25. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса,
при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии,
при этом указанная рекомбинантная молекула экспрессируется на поверхности нитчатого бактериофага,
при этом указанная рекомбинантная молекула экспрессируется в виде белка слияния с белком фаговой поверхности gpIII, gpVII, gpVIII или gpIX, и
указанная молекула дополнительно включает пептид, связанный с указанным пептид-связующим доменом молекулы МНС II класса.
26. Рекомбинантная молекула МНС II класса по п. 25, отличающаяся тем, что указанный белок на фаговой поверхности представлен gpIX.
27. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса,
при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии,
при этом указанная молекула представлена растворимой молекулой, а (i) или (ii) указанной молекулы слиты с участком Fc иммуноглобулина, и
указанная молекула дополнительно включает пептид, связанный с указанным пептид-связующим доменом молекулы МНС II класса.
28. Рекомбинантная молекула МНС II класса, включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса,
при этом (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, при этом дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
указанная рекомбинантная молекула не включает мотив лейциновой молнии, и указанная молекула является мультимерной, и
указанная молекула дополнительно включает пептид, связанный с указанным пептид-связующим доменом молекулы МНС II класса.
29. Рекомбинантная молекула МНС II класса, экспрессируемая с использованием прокариотического хозяина и включающая:
(i) весь или часть внеклеточного участка α-цепи МНС II класса, где указанная α-цепь содержит по меньшей мере часть домена α1 и по меньшей мере часть домена α2;
(ii) весь или часть внеклеточного участка β-цепи МНС II класса, где указанная β-цепь содержит по меньшей мере часть домена β1 и по меньшей мере часть домена β2;
при этом α1 домен α-цепи МНС II класса и β1 домен β-цепи МНС II класса обеспечивают функциональный пептид-связующий домен молекулы МНС II класса, и (i) и (ii) соединены дисульфидной связью между остатками цистеина, расположенными на α2 домене указанной α-цепи и β2 домене указанной β-цепи, и при этом указанные остатки цистеина не присутствуют в нативных доменах α2 и β2 МНС II класса, а дисульфидная связь стабилизирует рекомбинантную молекулу МНС II класса, и указанная дисульфидная связь расположена между остатками цистеина в положении Pro 96α2 - Ser 119β2 (положение 1), Ser 95α2 - Ser 121β2 (положение 2) или Arg 94α2 - Asn 151β2 (положение 3) мышиного изотипа I-Е или эквивалентных положениях в альтернативном изотипе МНС II класса, и
где указанная рекомбинантная молекула не включает мотив лейциновой молнии.
30. Способ идентификации пептидных эпитопов, распознаваемых Т-клетками, включающий этапы контакта рекомбинантной молекулы МНС II класса по п. 15 с рецептором Т-клеток и определение связывания указанной рекомбинантной молекулы МНС II класса с указанными рецептором Т-клеток, где указанный рецептор Т-клеток специфичен для пептидных эпитопов, связывающихся с указанной рекомбинантной молекулой МНС II класса.
31. Способ детекции антиген-специфических Т-клеток в образце, включающий этапы контакта рекомбинантной молекулы МНС II класса по п. 15 с указанным образцом и определение связывания указанной рекомбинантной молекулы МНС II класса с указанными Т-клетками, где указанный рецептор Т-клеток специфичен для пептидных эпитопов, связывающихся с указанной рекомбинантной молекулой МНС II класса.
32. Способ по п. 31, отличающийся тем, что его используют для определения присутствия болезнь-специфических Т-клеток в образце и для диагностики присутствия или отсутствия заболевания.
| WO 2006102170 A2, 28.09.2006 | |||
| WO 9806749 A2, 19.02.1998 | |||
| СПОСОБ ИДЕНТИФИКАЦИИ ЭПИТОПОВ Т-КЛЕТОК И ЕГО ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ МОЛЕКУЛ СО СНИЖЕННОЙ ИММУНОГЕННОСТЬЮ | 2002 |
|
RU2303264C2 |
Авторы
Даты
2016-12-10—Публикация
2011-02-18—Подача