Изобретение относится к биотехнологии, генной инженерии, микробиологической и медицинской промышленности и касается новых генетических конструкций и продуцентов, обеспечивающих в промышленных масштабах синтез рекомбинантного интерферона альфа-2b человека, свободного от метионина на N-конце, способа получения рекомбинантного (Met-) интерферона альфа-2b человека.
Интерферон альфа-2b (далее ИФН) представляет собой белок, содержащий 165 аминокислот, с молекулярной массой около 19000 дальтон, продуцируемый в организме человека активированными лейкоцитами. ИФН ингибирует рост многих типов клеток с нормальным и трансформированным фенотипом, а также оказывает противовирусное действие, индуцируя в клетках состояние резистентности к вирусным инфекциям и модулируя ответную реакцию иммунной системы, направленную на нейтрализацию вирусов или уничтожая инфицированные ими клетки. Данные свойства определяют ценность ИФН в качестве медицинского препарата для лечения заболеваний лимфатической системы и системы кроветворения (волосато-клеточный лейкоз, миеломная болезнь, тромбоцитоз и т.д.), солидных опухолей (саркома Капоши у больных СПИДом, почечная карцинома и т.д.), вирусных заболеваний (гепатит В, С, папиллома, грипп) и т.д.
Известны два основных принципа получения лейкоцитарного интерферона для терапевтических целей: получение "природного" ИФН из лейкоцитов донорской крови человека, индуцированных вирусами или другими индукторами ИФН, и получение "рекомбинантного" ИФН, продуцируемого рекомбинантными бактериальными клетками, дрожжевыми клетками или клеточными линиями животных.
"Природный" ИФН, полученный in vitro из лейкоцитов человека, является абсолютным аналогом ИФН по структуре и свойствам ИФН человека, который синтезируется в человеческом организме. Технология получения "природного" ИФН хорошо известна и описана во многих патентах (US 4745053, US 4680261, US 4548900, US 5391713, US 4873312, SU 1713591, RU 2066188, RU 2080873).
Основными недостатками получения ИФН из лейкоцитов человека являются низкий выход целевого продукта, высокая себестоимость и вероятность контаминации конечного продукта вирусами гепатитов В, С, иммунодефицита и другими вирусами человека и загрязнение индукторами, используемыми при культивировании лейкоцитов.
В настоящее время производство ИФН основано, главным образом, на использовании в качестве продуцентов микроорганизмов различной видовой принадлежности, созданных с помощью технологии рекомбинантных ДНК.
Существует достаточно много разнообразных рекомбинантных экспрессионных и регуляторных плазмидных векторов и сконструированных на их основе бактериальных и дрожжевых штаммов, синтезирующих ИФН.
Например, известен ряд продуцентов из рекомбинантных бактерий вида Pseudomonas putida (SU1364343, SU 1640996, SU 1591484, RU 1616143, RU 2142508), вида Eschechihia coli (Кравченко В.В. и др. Биоорганическая химия, 1987, т. 13, №9, с. 1186-1193; SU 1703691, RU 2054041, RU 2165455, RU 2258081, RU 2242516, RU 2319502, RU 2303063, RU 2326168), дрожжей Pichia pastoris (J.N. Garcia, J.A. Aguiar et. al. // High level expression of human IFN-2b in Pichia pastoris. // Biotecnologia Aplicada, 12(3)., 152-155., 1995, WO/2001/068827, WO/2007/099462).
Несмотря на то что рекомбинантные продуценты позволяют получить целевой продукт со значительно более высоким выходом, по сравнению с технологией получения "природного" ИФН, многие известные штаммы нестабильны и имеют уровень экспрессии интерферона, недостаточный для промышленного производства.
К существенным недостаткам дрожжевых продуцентов относится то, что в дрожжевых клетках существует процесс гликозилирования синтезированных белков, специфичный для дрожжевых клеток, что приводит к модификации целевого продукта. Кроме того, дрожжевые продуценты требуют крайне сложных условий для ферментации, связанных с необходимостью строго поддерживать в процессе биосинтеза концентрацию индуктора, например, концентрацию метанола.
Большинство из известных продуцентов вида E.coli синтезируют ИФН, содержащий на N-конце молекулы дополнительную аминокислоту метионин (Met), с которой инициируется синтез белка в бактериальной клетке. Присутствие дополнительной аминокислоты на N-конце ИФН делает продукт более иммуногенным. Длительное применение такого продукта в качестве терапевтического препарата, как правило, приводит к образованию специфических антител ко всем ИФН, как к природным, так и к рекомбинантным (Antonelli et.al. J. Inf. Disease 163:882-885, 1991; Quesada et.al. J. Clin. Oncology 3:1522-1528, 1985).
В связи с этим возникает необходимость удаления N-концевого метионина, что усложняет и повышает трудоемкость получения ИНФ при использовании известных штаммов E.coli.
Известно несколько способов удаления N-концевого метионина у целевого продукта.
В частности, N-концевой метионин может быть удален путем химического расщепления метионина in vitro реагентом бром цианом (CNBr) в кислых условиях. Однако данный метод не применим для получения Met" интерферона, в молекуле которого присутствуют внутренние метиониновые остатки (Boix, Е., et al. //Role of the N terminus in RNase A homologues: differences in catalytic activity, ribonuclease inhibitor interaction and cytotoxicity. // J. Mol. Biol., 1996, 257: 992-1007).
Во-вторых, N-концевой Met может быть удален in vitro ферментом аминопептидазой, полученной из микроорганизмов вида Aeromonas proteolytica (Notomista et al., 1999; Shapiro et al., 1988, US 5,763,215) или вида Bacillus licheniformis (US 6428997). Недостатком этого метода является многостадийность и высокая себестоимость конечного продукта, т.к. сначала получают Met+ интерферон и препаративные количества очищенного фермента аминопептидазы, далее проводят ферментативную обработку Met+ белка с последующим повторным выделением Met+ целевого продукта.
N-концевой метионин также может быть удален из рекомбинантного белка in vivo, если белок экспрессируется в форме гибридного белка, несущего сигнальный пептид, присоединенный к его N-концу. При транспорте гибридного белка через клеточную мембрану сигнальный пептид отщепляется ферментом сигнальной пептидазой. Известные генетические конструкции на основе метилотрофных дрожжей Hansenula polymorpha (Frank Muller, et al., 2002, // Production of IFNα-2a in Hansenula polymorpha // Process Biochemistry., 38., 15-25) и Pichia pastoris (WO/2001/068827, WO/2007/099462) реализуют данный принцип удаления N-концевой метионина.
Недостатками известных генетический конструкций является специфичное для дрожжевых клеток гликозилирование белков и большая степень некорректного отщепления сигнального пептида от белка интерферона, что приводит к получению модифицированного ИФН. Кроме того, сложность ферментации метилотрофных дрожжей приводит к высокой себестоимости конечного продукта.
Известные штаммы E.coli НМ 10703, НМ10711 и НМ10712, продуцируют ИФН в форме гибридного белка, несущего модифицированный сигнальный пептид термостабильного энтеротоксина II E.coli. При транспорте гибридного белка через клеточную цитоплазматическую мембрану сигнальный пептид отщепляется бактериальным ферментом - сигнальной пептидазой и Met- ИФН накапливается в периплазматическом пространстве бактериальной клетки. Продуктивность штаммов составляет около 1 г ИФН/100 o.e./1 литр культуральной среды (RU2230116 от 10.06.2004).
К существенным недостаткам указанных продуцентов относится следующее: 1) требуются сложные условия ферментации для получения высокоплотной культуры штамма продуцента (до 100 о.е.) и высокого уровня синтеза рекомбинантного белка, что приводит к повышению себестоимости продукта; 2) деградация рекомбинантного белка в периплазме; 3) высокая частота некорректного отщепления сигнального пептида от молекулы ИФН в процессе секреции в периплазму; 4) сложность масштабирования процесса выделения белков из периплазмы методом т.н. «холодного шока»; 5) высокая степень деградация рекомбинантного белка при получении «грубого экстракта» ИФН, т.к. белок находится в растворимой форме и легко подвержен воздействию бактериальных протеолитических ферментов.
Наиболее близким аналогом по технической сущности к предлагаемому изобретению является штамм E.coli BDEES4 и рекомбинантная плазмида pES4-4, содержащая промотор PT7, усилитель трансляции гена 10 фага Т7, последовательность искусственного гена рекомбинантного интерферона альфа 2b, последовательность гена β-лактамазы, детерминирующего устойчивость к антибиотику ампициллин, и терминатор транскрипции фага Т7. Уровень экспрессии интерферона составляет 20-30% от всех клеточных белков (RU 2258081 от 10.08.2005).
Основным недостатком известной плазмиды и штамма на ее основе является использование в плазмиде селективного гена β-лактомазы, детерминирующего устойчивость штамма к антибиотику ампициллин. При культивировании штамма β-лактомаза секретируется из бактериальной клетки и разрушает антибиотик. В результате чего в процессе ферментации происходит постоянное неконтролируемое снижение селективного давления для плазмидосодержащих клеток штамма, накопление безплазмидных клеток и, как следствие, снижение выхода интерферона. Кроме того, штамм-продуцент, содержащий плазмиду pES4-4, синтезирует ИФН с дополнительной аминокислотой метионин на N-конце молекулы.
Предлагаемое изобретение решает задачу конструирования бактериального штамма-продуцента, позволяющего получать in vivo рекомбинантный ИФН человека, не содержащий дополнительный N-концевой метионин с высоким выходом и по упрощенной технологии (от 400 мг с 1 л культуры).
Технический результат изобретения заключается в упрощении технологии получения in vivo свободного от метионина на N-конце ИФН человека, за счет создания двух рекомбинантных плазмидных ДНК pFM-IFN-17, pFM-AP и создания на их основе высокопродуктивного стабильного биплазмидного штамма Escherichia coli FM-IFN-AP (pFM-IFN-17, pFM-AP).
Технический результат достигается следующим.
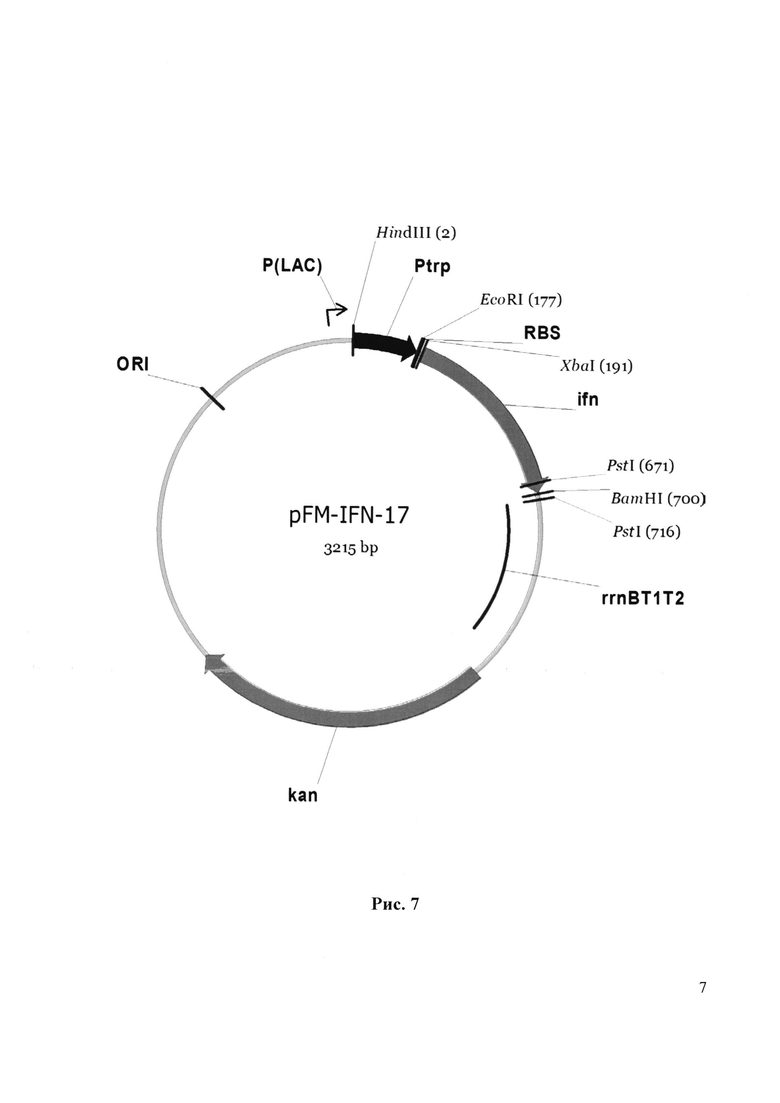
Рекомбинантная плазмидная ДНК pFM-IFN-17 кодирует синтез ИФН человека под контролем триптофанового лактозного промоторов и терминатора транскрипции rrnBT1T2, содержит в качестве генетического маркера синтетический ген kan, детерминирующий устойчивости к канамицину. Моноплазмидный штамм E.coli BL21, содержащий рекомбинантную плазмиду pFM-IFN-17, обладает высоким уровнем экспрессии ИФН (не менее 1 г с 1 л культуральной среды).
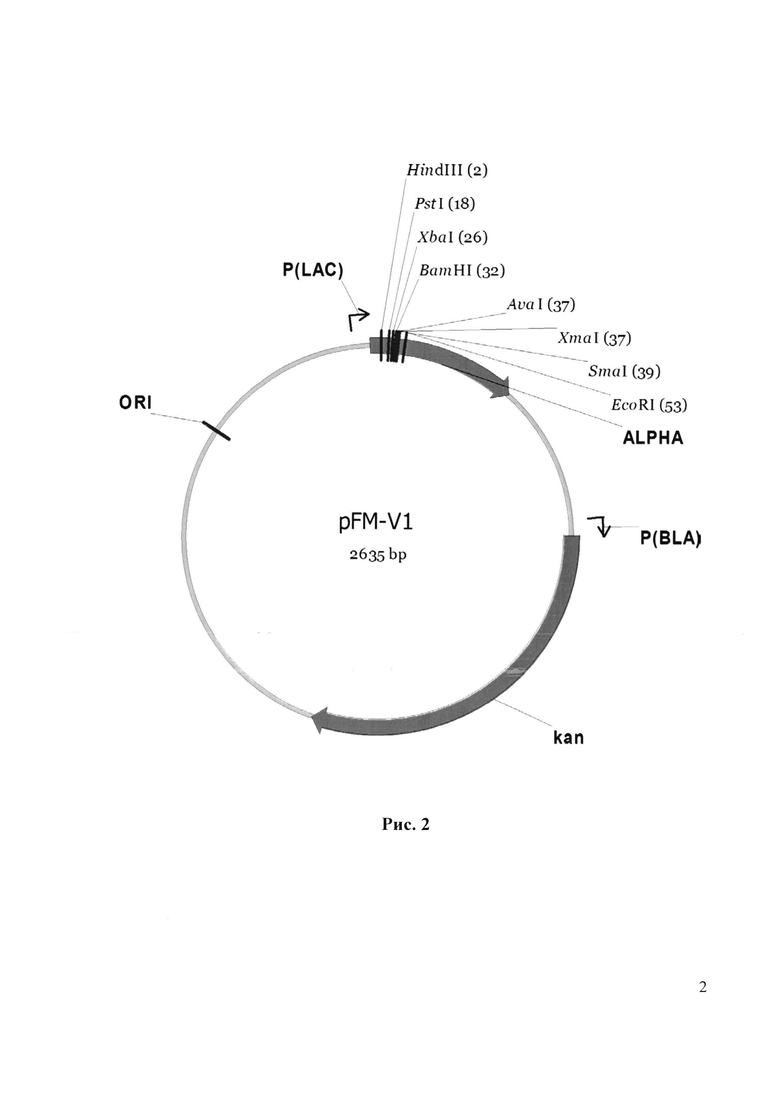
Плазмида pFM-IFN-17 имеет 3215 пар оснований (п.о.) и характеризуется наличием следующих фрагментов:
- фрагмент ДНК размером 194 п.о., включающий триптофановый промотор E.coli и последовательность Шайн Дельгарно (SD), ответственную за инициацию трансляции;
- синтетический фрагмент ДНК размером 503 п.о., включающий «оптимизированную» кодирующую часть гена интерферона альфа-2b человека; при оптимизации гена ИФН из последовательности были удалены внутренние ТАТА-boxes, chi-sites, RBS последовательности, АТ-богатые и GC-богатые последовательности, повторяющиеся последовательности и потенциальные вторичные структуры мРНК; codon usage был адаптирован для Е.coli, при этом параметр CAI (codon adaptation index) = 0,99;
- фрагмент ДНК плазмиды pKK223-3 размером 534 п.о., включающий последовательность строгого терминатора транскрипции rrnBT1T2, последовательности промотора и SD последовательность гена бета-лактомазы;
- синтетический фрагмент ДНК размером 810 п.о., включающий синтетический ген kan, обеспечивающий устойчивость к канамицину - аналога гена kan из транспозона Tn903, в котором удалены сайты рестрикции AvaI, ClaI, SmaI, HindIII; фрагмент ДНК размером 1173 п.о. плазмиды pUC19, включающий последовательность, ответственную за репликацию плазмиды (ori) и лактозный промотор.
Физическая карта плазмиды pFM-IFN-17 представлена на Рис. 7. Нуклеотидная последовательность синтетического гена ИФН человека, встроенного в плазмиду pFM-IFN-17 приведена на Рис. 5.
Рекомбинантная плазмидная ДНК pFM-AP кодирует синтез фермента метионин-аминопептидазы E.coli под контролем лактозного промотора и содержит в качестве генетического маркера ген cm, детерминирующий устойчивость к хлорамфениколу. Моноплазмидный штамм E.coli BL21, содержащий рекомбинантную плазмиду pFM-AP обладает повышенной активностью фермента метионин-аминопептидазы E.coli, обеспечивающий направленное удаление аминокислоты метионин с N-конца белков, синтезирующихся в бактериальных клетках in vivo.
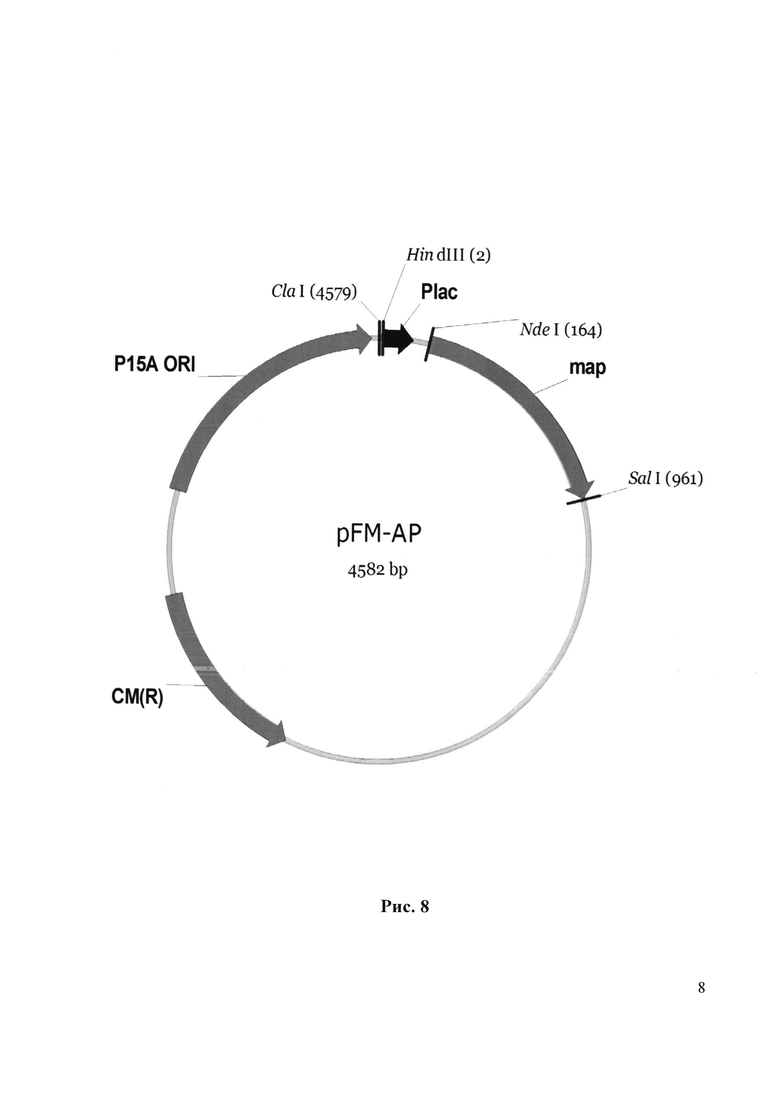
Плазмида pFM-AP имеет размер 4582 п.о. и характеризуется наличием следующих фрагментов:
- HindIII-SalI фрагмент ДНК плазмиды pACYC184 размером 3629 п.о., включающий последовательность, ответственную за репликацию плазмиды Р15А (ori) и ген cm, обеспечивающий устойчивость штамма Е.coli к хлорамфениколу;
- HindIII-NdeI - фрагмент ДНК размером 167 п.о., включающий лактозный промотор (Plac), последовательность Шайн Дельгарно (SD), ответственную за инициацию трансляции.
- NdeI-SalI - фрагмент ДНК размером 804 п.о., включающий ген фермента метионин аминопептидазы Е.coli.
Физическая карта плазмиды pFM-AP представлена на Рис. 8.
Рекомбинантный штамм бактерий E.coli FM-IFN получен путем последовательной трансформацией клеток штамма Е.coli BL21 рекомбинантными плазмидными ДНК pFM-AP и pFM-IFN-17.
Преимущества настоящего изобретения заключается, во-первых, в использовании стабильно наследуемой мультикопийной рекомбинантной плазмиды pFM-IFN-17, в которой под контролем индуцибельного триптофанового и лактозного промоторов и rrnBT1T2 терминатора транскрипции расположен синтетический ген ИФН с оптимизированными для клеток бактерий E.coli кодонами кодирующими соответствующие аминокислоты и детерминирующей высокий уровень экспрессии целевого продукта. Во-вторых, в использовании стабильно наследуемой плазмиды pFM-АР, в которой под контролем индуцибельного лактозного расположен ген метионин аминопептидазы E.coli детерминирующий высокий уровень экспрессии соответствующего фермента. В третьих, в использовании двух плазмид pFM-IFN-17 и pFM-AP при получении биплазмидного штамма E.coli FM-IFN, который детерминирует высокий уровень синтеза целевого продукта ИФН и фермента метионин аминопептидазы E.coli целенаправленно удаляющий N-концевой метионин с молекулы ИФН in vivo в процессе ферментации штамма-продуцента. В четвертых, в использовании биплазмидного штамма E.coli FM-IFN при получении in vivo (Met-) интерферона альфа 2b человека.
Штамм E.coli FM-IFN-17 характеризуется следующими признаками.
Культурально-морфологические признаки
Штамм обладает свойствами типичного представителя вида Escherichia coli. Клетки мелкие, прямые, утолщенной палочковидной формы, грамотрицательные, неспороносные.
Штамм хорошо растет на простых питательных средах. Колонии при росте штамма на L агаре - круглые, гладкие, выпуклые, мутные, блестящие, серые, с ровными краями. В жидких средах (в минимальной среде с глюкозой или в L-бульоне) штамм образует интенсивную ровную муть.
Физиолого-биохимические признаки
Штамм растет в аэробных условиях, при температуре в пределах от 4 до 42°С. Оптимум рН для роста составляет 6,5-7.5.
В качестве источника азота клетки штамма используют минеральные соли в аммонийной или нитратной формах; органические соединения, в частности, аминокислоты, пептон, триптон, дрожжевой экстракт и т.д.
В качестве источника углерода клетки штамма могут использоваться аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам
Штамм проявляет устойчивость к канамицину (до 100 мкг/мл) и хлорамфениколу (до 100 мкг/мл).
Особенность штамма
Продуцирует интерферон, не содержащий дополнительный N-концевой метионин.
Условия хранения штамма
Штамм хранится: под маслом в L-агаре с добавлением канамицина до концентрации 100 мкг/мл и хлорамфеникола до концентрации 20 мкг/мл; криоконсервированным в L-бульоне, содержащем 15% глицерина и соответствующие антибиотики, в ампулах при температуре минус 40°-70°С; или в лиофилизированном состоянии в ампулах при температуре плюс 4°С.
Штамм E.coli FM-IFN стабильно синтезирует интерферон альфа-2b, не содержащий дополнительный N-концевой метионин, с высоким уровнем экспрессии (до 400 мг с 1 л культуральной жидкости). Штамм технологичен и для достижения высокой продуктивности не требует особых условий для культивирования, а также применения сложных питательных сред.
Целевой продукт накапливается в количестве более 20-30% суммарного белка клетки в виде тел включения Использование нового продуцента, содержащего плазмиды pFM-IFN-17 и pFM-AP, позволит значительно повысить выход целевого продукта, а также упростить технологический процесс получения Met- ИНФ за счет упрощения стадии культивирования штамма, а также исключения необходимости в проведении дополнительных стадий по удалению N-концевого метионина.
Изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1. Конструирование рекомбинантной плазмиды pFM-IFN, обеспечивающей экспрессию синтетического гена ИФН
Способ получения рекомбинантной плазмиды pFM-IFN включает несколько последовательных этапов:
- конструирование векторной плазмиды pFM-V-1 (2635 п.о.);
- конструирование векторной плазмиды pFM-V-2 (2547 п.о.);
- конструирование рекомбинантной плазмиды pFM-IFN-1;
- конструирование рекомбинантной плазмиды pFM-IFN-17;
1.1. Конструирование векторной плазмиды pFM-V-1
Исходным вектором при получении векторной плазмиды pFM-V-1 служит вектор pUC19, в котором кодирующая последовательность гена бета-лактомазы, обеспечивающего устойчивость к ампициллину, заменена на кодирующую последовательность синтетического гена kan, обеспечивающего устойчивость к канамицину. Для получения векторной плазмиды pFM-V-1 проводят 2 раунда амплификации ДНК. Для первого раунда реакции амплификации используют два синтетических олигонуклеотида FMV1 и FMV2:
FMV1 - 5'-ATAATATTGAAAAAGGAAGAGTATGAGCCATATTCAACGGGAAAC-3'
FMV2 - 5'-GAGTAAACTTGGTCTGACAGTTAGAAAAACTCATCGAGCATC-3'
и в качестве матрицы ДНК синтетического гена kan - аналога гена kan из транспозона Tn903, в котором удалены сайты рестрикции AvaI, ClaI, SmaI, HindIII. Нуклеотидная последовательность синтетического гена kan, приведена на рис. 1
Амплификацию и все последующие проводят в ДНК-амплификаторе в буферном растворе, содержащем: 20 mM Tis-HCl, рН 8.8, 10 mM (NH4)2SO4, 10 mM KCl, 2 mM MgCl2, 0.1% Triton X100, 0.1 mg/ml BSA, 0.2 mM каждого dNTP, 1.25 ед. Pfu ДНК полимеразы, 100 нг ДНК матрицы при следующих режимах: прогревание - 5 мин при 96°С, далее 35 циклов ПЦР (режимы одного цикла: 30 с при 96°С, 30 с при 58°С, 1 мин при 72°С и затем финальная элонгация - 10 мин при 72°С). В результате ПЦР получают фрагмент размером 852 п.о., который электрофоретически очищают.
Для второго раунда амплификации используют векторную ДНК плазмиды pUC 19 и полученный фрагмент ДНК, полученный в первом раунде амплификации в эквимолярных количествах при следующих режимах: прогревание - 5 мин при 96°С, далее 6 циклов ПЦР (режимы одного цикла: 30 с при 96°С, 30 с при 58°С, 3 мин при 72°С и затем финальная элонгация - 10 мин при 72°С). Полученной ДНК во втором раунде ПЦР трансформируют в клетки штамма E.coli DH5 и высевают на среду LA, содержащую 100 мкг/мл канамицина. После инкубирования в течение 12 ч при 37°С, клоны отсевают, выделяют плазмидную ДНК, проводят рестрикционный анализ и определяют первичную структуру ДНК. В результате получают плазмиду pFM-V-1 размером 263-5 п.о. Рестрикционная карта рекомбинантной плазмиды pFM-V-1 приведена на рис. 2.
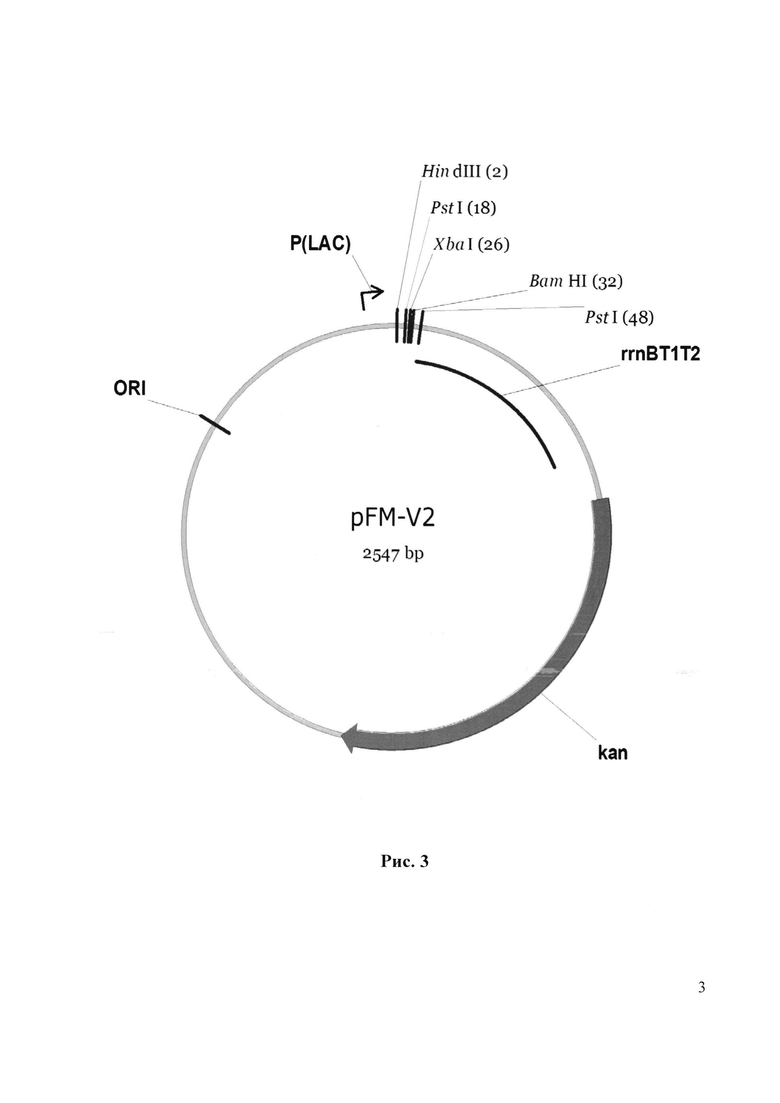
1.2. Конструирование векторной плазмиды pFM-V-2
Векторная плазмида pFM-V-2 представляет собой плазмиду pFM-V-1, в которой после сайта BamHI последовательность ДНК, кодирующая альфа LacZ пептид и промотор бета-лактомазы заменена на последовательность ДНК, кодирующая терминатор транскрипции rrnBT1T2 и промотор бета-лактомазы из ДНК вектора pKK223-3. Генетическое конструирование плазмиды pFV-V-2 осуществляют в два раунда амплификации ДНК с помощью полимеразной цепной реакции (ПЦР). Для первого раунда реакции амплификации используют два синтетических олигонуклеотида FMV3 и FMV4:
FMV3 - 5-
CAGGTCGACTCTAGAGGATCCGTCGACCTGCAGCTGTTTTGGCGGATGAGAGAA-3'
FMV4 - 5'-ACTCTTCCTTTTTCAATATTATTGAAG-3'
и в качестве матрицы ДНК плазмиды pKK223-3. ПЦР проводят при следующих режимах: прогревание - 5 мин при 96°С, далее 35 циклов ПЦР (режимы одного цикла: 30 с при 96°С, 30 с при 58°С, 1 мин при 72°С и затем финальная элонгация - 10 мин при 72°С). В результате ПЦР получают фрагмент размером 549 п.о., который электрофоретически очищают.
Для второго раунда амплификации используют векторную ДНК плазмиды pFM-V-1 и, полученный фрагмент ДНК в первом раунде амплификации, в эквимолярных количествах при следующих режимах: прогревание - 5 мин при 96°С, далее 6 циклов ПЦР (режимы одного цикла: 30 с при 96°С, 30 с при 58°С, 3 мин при 72°С и затем финальная элонгация - 10 мин при 72°С). Полученную ДНК во втором раунде ПЦР трансформируют в клетки штамма E.coli DH5 и высевают на среду LA, содержащую 100 мкг/мл канамицина, IPTG, X-gal. После инкубирования в течение 12 ч при 37°С, белые колонии пересевают, выделяют плазмидную ДНК, проводят рестрикционный анализ и определяют первичную структуру ДНК. В результате получают плазмиду pFM-V-2 размером 2547 п.о. Рестрикционная карта рекомбинантной плазмиды pFM-V-2 приведена на рис. 3.
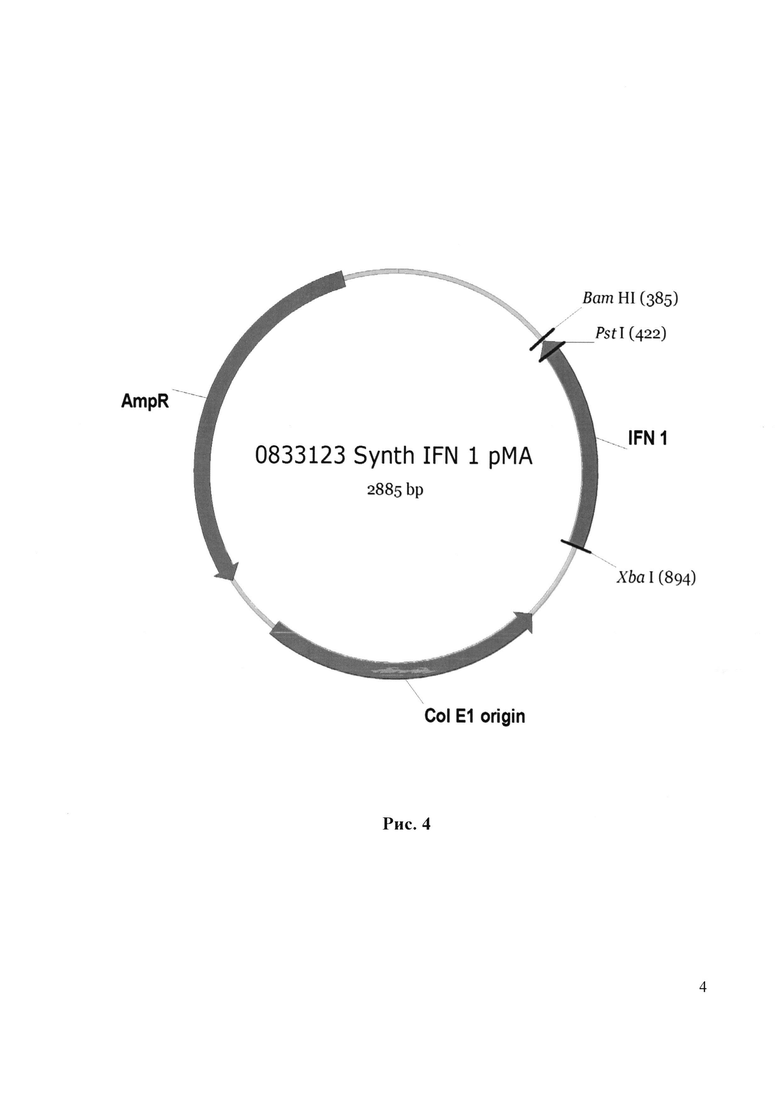
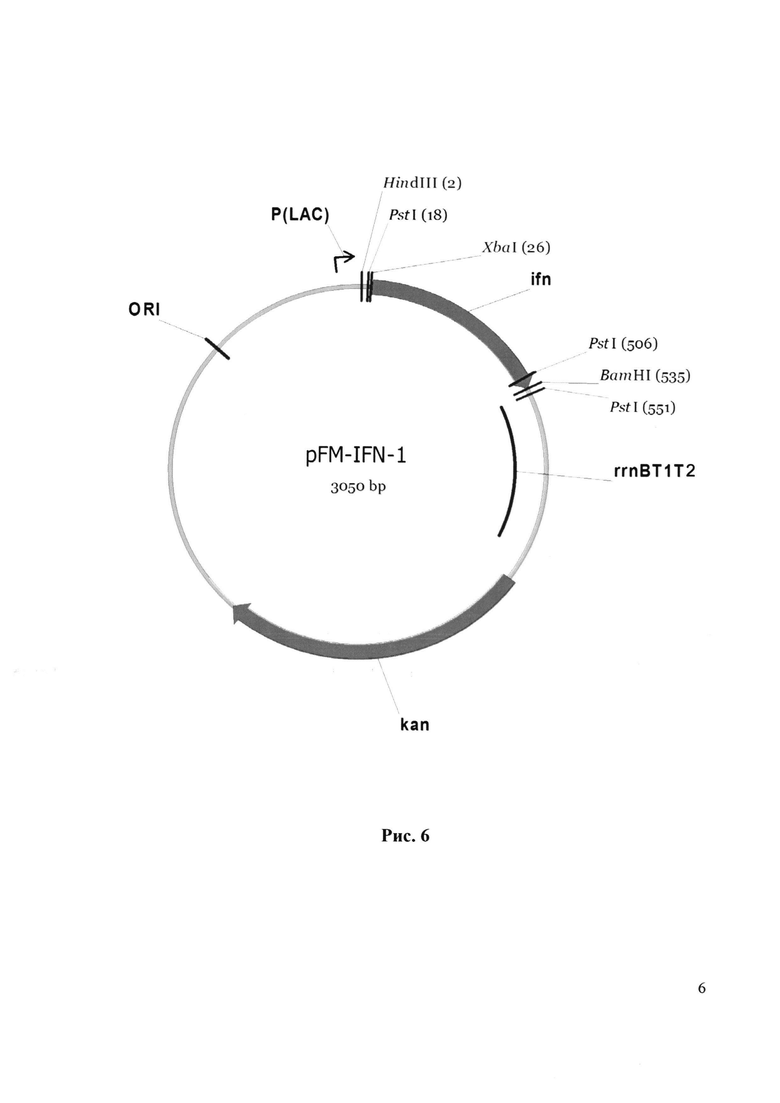
1.3. Конструирование векторной плазмиды pFM-IFN-1
Рекомбинантная плазмида pFM-IFN-1 представляет собой векторную плазмиду pFM-V-2, в которую клонирован синтетический фрагмент ДНК синтетический фрагмент ДНК размером 513 п.о., кодирующий альфа-2b интеферон человека по сайтам XbaI и BamHI. Этот фрагмент был получен стандартным методом химико-ферментативного синтеза и клонирован в составе рекомбинантной плазмиды 0833123_Synth_IFN_1pMA, размером 2885 п.о. Рестрикционная карта рекомбинантной плазмиды 0833123_Synth_IFN_1pMA приведена на рис. 4. Нуклеотидная последовательность синтетического гена интерферона альфа 2b человека приведена на рис. 5.
Конструирование рекомбинантной плазмиды pFM-IFN-1 проводят следующим образом:
Плазмиды pFM-V-2 и 0833123_Synth_IFN_1pMA обрабатывают ферментами рестрикции XbaI и BamHI. Полученные фрагменты XbaI-BamHI фрагмент ДНК размером 2547 п.о. из плазмиды pFM-V-2 и фрагмент ДНК размером 513 п.о. из плазмиды 0833123_Synth_IFN_1pMA очищают с помощью электрофореза в 1%-ном агарозном геле. Далее электрофоретически очищенные фрагменты объединяют, лигируют ферментом лигазой фага Т4.
ДНК трансформируют в клетки штамма E.coli DH и высевают на среду LA, содержащую 100 мкг/мл канамицина. После инкубирования в течение 12 ч при 37°С, клоны отсевают, выделяют плазмидную ДНК, проводят рестрикционный анализ и определяют первичную структуру ДНК.
В результате получают плазмиду pFM-IFN-1 размером 3242 п.о., содержащая синтетический ген интерферона альфа-2b человека. Рестрикционная карта рекомбинантной плазмиды pFM-IFN-1 приведена на рис. 6.
1.4. Конструирование векторной плазмиды pFM-IFN-17
Плазмида pFM-IFN-17 представляет собой плазмиду pFM-IFN-1, в которую клонирован фрагмент ДНК, кодирующий бактериальный триптофановый промотор Е.coli и SD последовательность по сайтам рестрикции HindIII-XbaI, размером 196 п.о.
HindIII-XbaI фрагмент ДНК размером 196 п.о., кодирующий триптофановый промотор Е.coli и SD последовательность, получают методом ПЦР, используя в качестве матрицы тотальную ДНК E.coli и праймеры FMV5 и FMV6 с последующей обработикой амплифицированного фрагмента ферментами рестрикции HindIII и XbaI.
FMV5 - 5'-AGCGAAGCTTCGTAAATCACTGCATAATTCGT-3'
FMV6 - 5'-AGGCTCTAGAGGCCTCCTGAATTCCTGGCGATACCCTTTTTACGT-3'
Далее, предварительно очищенный фрагмент HindIII-XbaI, и плазмида pFM-IFN-1, обработанная ферментами рестрикции HinIII и XbaI объединяют, лигируют ферментом лигазой фага Т4, ДНК трансформируют в клетки штамма E.coli DH5D и высевают на среду LA, содержащую 100 мкг/мл ампициллина. После инкубирования в течение 12 ч при 37°С, клоны отсевают, выделяют плазмидную ДНК, проводят рестрикционный анализ и определяют первичную структуру ДНК.
В результате получают плазмиду pFM-IFN-17 размером 3242 п.о., которая содержит синтетический ген интерферона альфа 2-b человека. Рестрикционная карта рекомбинантной плазмиды pFM-IFN-17 приведена на рис. 7.
Пример 2. Конструирование рекомбинантной плазмиды pFM-AP (4582 п.о.)
При получении рекомбинантной плазмиды pFM-AP ДНК плазмиды pACYC184 обрабатывают ферментами рестрикции HindIII и SalI с последующей электрофоретической очисткой в 1% агарозном геле размером 3629 п.о.
HindIII-SalI фрагмент ДНК размером 965 п.о., кодирующий лактозный промотор, SD последовательность и ген метионин аминопептидазы Е.coli, получают методом ПЦР в три этапа.
Для первого раунда реакции амплификации используют два синтетических олигонуклеотида FM-AP-1 и FM-AP-2 и в качестве матрицы ДНК вектора pUC19:
FM-AP-1 - 5' GTGAAAGCTTAACGCAATTAATGTGAGTTAG-3'
FM-AP-2 - 5'
GGGTCTTGATTGAGATAGCCATATGTATATCTCCTGAATTAGCTTGGCGTAATCATG
GTCATAGC-3'
ПЦР проводят при следующих режимах: прогревание - 5 мин при 96°С, далее 35 циклов ПЦР (режимы одного цикла: 30 с при 96°С, 30 с при 58°С, 30 с при 72°С и затем финальная элонгация - 10 мин при 72°С). В результате ПЦР получают фрагмент размером 186 п.о., содержащий лактозный промотор и SD последовательность, электрофоретически очищают в 1% агарозном геле.
Во втором раунде амплификации используют два синтетических олигонуклеотида FM-AP-3 и FM-AP-4, а в качестве матрицы тотальную ДНК E.coli.
FM-АР-3-5'
GCTATGACCATGATTACGCCAAGCTAATTCAGGAGATATACATATGGCTATCTCAA
ТСААОАССС-3'
FM-AP-4 - 5'-GGATGTCGACTTATTCGTCGTGCGAGATTATC-3'
ПЦР проводят при следующих режимах: прогревание - 5 мин при 96°С, далее 35 циклов ПЦР (режимы одного цикла: 30 с при 96°С, 30 с при 58°С, 1 мин при 72°С и затем финальная элонгация - 10 мин при 72°С). В результате ПЦР получают фрагмент размером 844 п.о., содержащий ген метионин аминопептидазы E.coli электрофоретически очищают в 1% агарозном геле.
В третьем раунде амплификации используют два синтетических олигонуклеотида FM-AP-1 и FM-AP-4, а в качестве матрицы два фрагмента полученных в первых двух амплификациях, с целью их объединения в один фрагмент. Размер объединенного фрагмента составляет 965 п.о.
Фрагмент размером 965 п.о. обрабатывают ферментами HindIII и SalI и электрофоретически очищают. Далее фрагменты HindIII/SalI вектора pACYC184 и объединенный HindIII/SalI размером 965 п.о. лигируют ферментом лигазой фага Т4, ДНК трансформируют в клетки штамма E.coli DH5 и высевают на среду LA, содержащую 20 мкг/мл хлорамфеникола. После инкубирования в течение 12 ч при 37°С, клоны отсевают, выделяют плазмидную ДНК, проводят рестрикционный анализ и определяют первичную структуру ДНК.
В результате получают плазмиду pFM-AP, размером 4582 п.о., кодирующая синтез метионин аминопептидазы E.coli, регулируемый лактозным промотором. Рестрикционная карта рекомбинантной плазмиды pFM-IFN-17 приведена на рис. 8.
Пример 3. Конструирование рекомбинантного штамма Escherichia coli FM-IFN
Путем трансформации клеток штамма Е.coli BL21 рекомбинантной плазмидой pFM-AP получают сначала реципиентный штамм Escherichia coli BL21 (pFM-AP). Трансформанты высевают на среду LA, содержащую 20 мкг/мл хлорамфеникола.
Далее реципиентный штамм Escherichia coli BL21 (pFM-AP) трансформируют рекомбинантной плазмидой pFM-IFN-17 и высевают на среду LA, содержащую 100 мкг/мл канамицина и 20 мкг/мл хлорамфеникола.
В результате получают биплазмидный штамм Escherichia coli FM-IFN, несущий две плазмиды pFM-IFN-17 и pFM-AP.
Пример 4. Культивирование штамма Е.coli FM-IFN
Посевной материал штамма Е.coli FM-IFN культивируют в течение 12 ч при 32°С в 1 л богатой среды LB и асептически вносят в ферментер, содержащий 9 л стерильной синтетической минерально-солевой среды, содержащей 2×М9, 1% глюкозы, 0,2% лактозы, следовые количества металлов 100 мг/мл канамицина и 40 мкг/мл хлорамфеникола.
Культивирование в ферментере проводят при температуре 32+1°С, поддерживая рН 6,9±0,15 путем автоматической подтитровки 40%-ным раствором гидроокиси натрия. Концентрацию растворенного кислорода в диапазоне (30±0,5)% от насыщения поддерживают путем изменения скорости оборотов мешалки от 100 до 800 об/мин и подачи воздуха от 1 до 15 л/мин. Концентрацию субстратов, в частности глюкозы и лактозы, поддерживают в течение ферментации путем подачи концентрированного раствора перистальтическим насосом используя pO2 и гравиметрический контроллеры.
Накопление интерферона в виде нерастворимой формы - "телец включений" контролируют с помощью фазово-контрастной микроскопии. Ферментацию останавливают по достижении максимальной оптической плотности (~25-30 о.е.). Содержание интерферона в биомассе клеток, получаемой с 1 л культуры, составляет 0.9-1.0 г интерферона.
По окончании ферментации культуральную жидкость сепарируют центрифугированием, бактериальную биомассу фасуют в полиэтиленовые пакеты и замораживают при температуре минус 70°С.
Пример 5. Способ получения (Met-) интерферона альфа-2b человека из биомассы штамма Е.coli FM-IFN
Получение интерферона проводят в три этапа.
1 этап. Выделение и очистка нерастворимой формы (Met-) интерферона альфа-2b человека
Выделение и очистку нерастворимой формы интерферона проводят по стандартной схеме (US Patent 5789551, RU 2165455, RU 2242516, A. Beldarrain, Y. Cruz, O. Cruz, M. Navarro, M.Gil., "Purification and conformational properties of human interferon alfa-2b produced in E.coli"., Biotechnol.Appl. Biochem., 2001., 33., 173-182). В конце процесса выделения и очистки нерастворимой формы интерферона (тельца включений или т.вкл.) из 200 грамм биомассы полученный материал суспендируют в 100 мл буфера (20 мМ Tris/HCl, рН 8.0).
2 этап. Растворение и ренатурация (Met-) интерферона альфа-2b человека Тельца включений растворяют добавлением гуанидин гидрохлорида до 6М и дитиотреитол до концентрации 5 мМ в конечном объеме 1,7 литров, инкубируют 2 час при комнатной температуре, центрифугируют (20000 g) и фильтруют (0,22 микрон). Полученный раствор интерферона вливают в емкость, содержащая 20 литров буфера - 20 мМ Tris/HCl, рН8.0, 150 μМ NaCl, 50 μМ CuSO4 при температуре 150°С. Далее добавляют PMSF до концентрации 0,2 мМ. Ренатурацию проводят в течение 10-12 часов при 150°С. Далее раствор интерферона фильтруют через мембранный фильтр с диаметром пор 0,22 микрона, проводят замену буфера на буфер - 20 мМ Tris/HCl, рН7.0, 0.1 мМ ЭДТА диафильтрацией на тангенциальных касетах (диаметр пор 10К) и окончательно концентрируют до объема 5 литров. Далее добавляют концентрированный раствор ацетата натрия 2,5 М до концентрации 25 мМ и инкубируют 10 12 часов при 40 С. Раствор интерферона фильтруют через мембранный фильтр с диаметром пор 0,22 микрон.
3 этап. Хроматографическая очистка (Met-) интерферона альфа-2b человека
Полученный раствор интерферона очищают на катионообменной смоле CM Sepharose FF (GE Healthcare). Интерферон элюируют градиентом создаваемый буфером 20 мМ Na цитрат, рН 5.0, 0.1 мМ ЭДТА и буфером 20 мМ Na цитрат, рН 5.0, 0.1 мМ ЭДТА, 0,5 М NaCl.
Раствор интерферона после катионообменника очищают на гидрофобной смоле Phenyl Sepharose HP (GE Healthcare).
Раствор интерферона после гидрофобной хроматографии очищают с помощью обратно-фазной хроматографии на сорбенте С18. Элюцию интерферона проводят градиентом двух буферов - буфер А (30% ацетонитрил, 0,1% трифторуксусная кислота) и буфер Б (80%) ацетонитрил, 0,1% трифторуксусная кислота).
Далее интерферон очищают на катионообменнике MacroPrep High S (BioRad).
Интерферон элюируют градиентом создаваемый буферами 20 мМ Na цитрат, рН 5.0, 0.1 мМ ЭДТА и 20 мМ Na цитрат, рН 5.0, 0.1 мМ ЭДТА, 1.0 М NaCl.
Окончательно интерферон очищают методом колоночной гель-фильтрации на смоле Sephacryl S200 или Superdex 75 (GE Healthcare). Хроматографию проводят в буфере 20 мМ Na цитрат, рН 5.0, 0,15 М NaCl, 0.1 мМ ЭДТА.
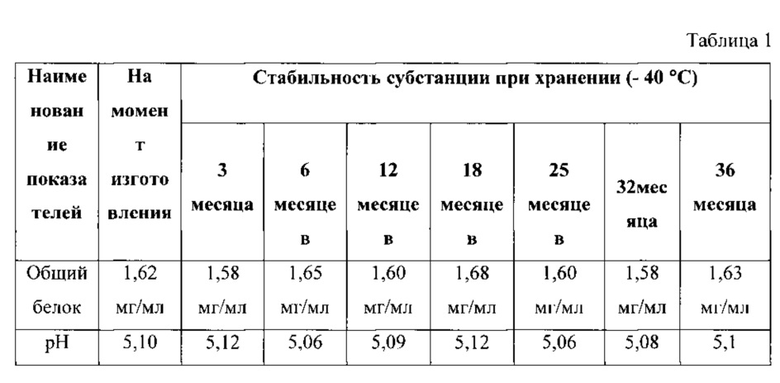
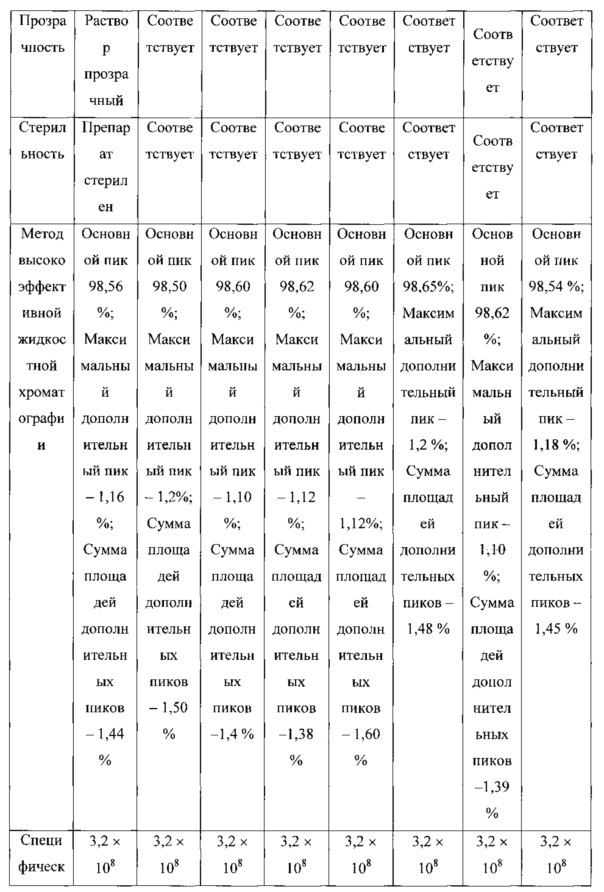
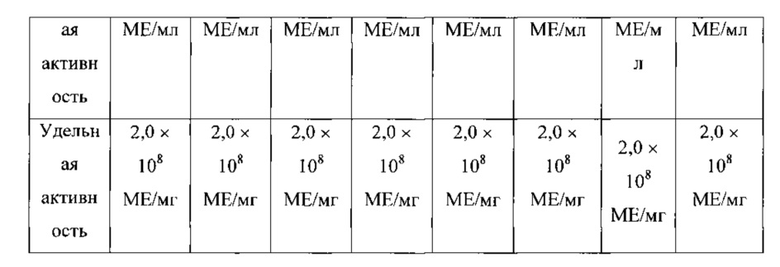
Описанный способ выделения и очистки рекомбинантного (Met-) интерферона альфа-2b человека дает возможность получать не менее 1-1,5 грамма субстанции интерферона фармакопейного качества за один цикл из примерно 200 грамм биомассы, получаемой с 10 л ферментационной среды. Полученный в результате использования указанной технологии конечный продукт сохраняет свои свойства в течение более 3 лет при хранении в замороженном состоянии при температуре не выше минус 40°С. Результаты исследования стабильности (Met-) интерферона альфа 2-b человеческий, рекомбинантный, концентрированный раствор (субстанция) при хранении минус 40°С, производства Биотехнологической компанией «Фирн М» на примере серии ФМ07 представлены в таблице 1.
Пример 6. Определение N-концевой последовательности интерферона, полученного из штамма E.coli FM-IFN
Анализ проводят на секвенаторе Precise 491-0 фирмы Applied Biosystems (Stafford, Texas, USA) в соответствии с классическим методом П. Эдмана, позволяющим последовательно отщеплять N-концевые аминокислотные остатки и анализировать их в оn-line режиме при помощи ВЭЖХ в виде фенилтиогидантоинов аминокислот (ФТГ).
Для определения аминокислоты цистеин в полипептидной цепи, образцы предварительно обрабатывают алкилирующим агентом 4-винилпиридином. Алкилирующий агент модифицирует цистеин после разрыва дисульфидных связей.
После обработки образец обессоливают с применением картриджей ProSorb (Applied Biosystems). Эта стадия пробоподготовки необходима для детектирования цистеина в виде пиридилэтил-ФТГ-производной.
В результате анализа установлено, что последовательность для восьми N-концевых аминокислот интерферона, синтезирующегося в штамме E.coli pFM-IFN, соответствует последовательности природного человеческого интерферона альфа-2b: Cys (в виде пиридилэтилцистеина)-Asp-Leu-Pro-Gln-Thr-His-Ser и не содержит N-концевого метионина.
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантная плазмида pFM-GCSF5, обеспечивающая экспрессию синтетического гранулоцитарного колониестимулирующего фактора человека, штамм бактерий Escherichia coli FM-GCSF - продуцент рекомбинантного гранулоцитарного колониестимулирующего фактора человека и способ его получения | 2018 |
|
RU2680886C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pSS5, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО АЛЬФА-2b ИНТЕРФЕРОНА, ШТАММ ESCHERICHIA COLI SS5 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО АЛЬФА-2b ИНТЕРФЕРОНА И СПОСОБ ПОЛУЧЕНИЯ ИНТЕРФЕРОНА АЛЬФА-2b | 1999 |
|
RU2165455C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ИНТЕРФЕРОНА АЛЬФА-2B, РЕКОМБИНАНТНАЯ ПЛАЗМИДА И ШТАММ ПРОДУЦЕНТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2003 |
|
RU2242516C1 |
| ПЛАЗМИДНЫЙ ВЕКТОР pRh15A ДЛЯ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21 DE3 - ПРОДУЦЕНТ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b | 2017 |
|
RU2697375C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pIF TREN, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА, И ШТАММ БАКТЕРИЙ Escherichia coli-ПРОДУЦЕНТ ПОЛИПЕПТИДА ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА | 2006 |
|
RU2326168C1 |
| РАСТВОР ДЛЯ ИНЪЕКЦИЙ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pSX50, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО АЛЬФА-2b ИНТЕРФЕРОНА, ШТАММ Escherichia coli SX50 - ПРОМЫШЛЕННЫЙ ШТАММ-ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО АЛЬФА-2b ИНТЕРФЕРОНА И СПОСОБ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ ИНТЕРФЕРОНА АЛЬФА-2b | 2006 |
|
RU2319502C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PES4-4, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОН АЛЬФА-2B ЧЕЛОВЕКА, И ШТАММ ESCHERICHIA COLI BDEES4 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА АЛЬФА-2B ЧЕЛОВЕКА | 2003 |
|
RU2258081C1 |
| Рекомбинантная плазмида pFM-FliC_syn, обеспечивающая экспрессию рекомбинантного белка флагеллина Salmonella (FliC), моноплазмидный штамм бактерий Escherichia coli FM-FliC_syn и способ получения рекомбинантного белка флагеллина Salmonella (FliC) | 2023 |
|
RU2831404C1 |
| Противовирусное средство в жидкой форме и способ его приготовления | 2021 |
|
RU2768656C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА, ШТАММ Saccharomyces cerevisiae - ПРОДУЦЕНТ ЗРЕЛОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ) | 2010 |
|
RU2427645C1 |


Изобретение относится к биотехнологии. Изобретение представляет собой рекомбинантный штамм бактерий E. coli FM-IFN, который получают путем последовательной трансформации клеток штамма Е. coli BL21 рекомбинантными плазмидными ДНК pFM-AP и pFM-IFN-17, рекомбинантную плазмидную ДНК pFM-AP размером 4582 п.о., которая кодирует синтез фермента метионин-аминопептидазы E.coli под контролем лактозного промотора и содержит в качестве генетического маркера ген cm, детерминирующий устойчивости к хлорамфениколу, рекомбинантную плазмидную ДНК pFM-IFN-17, размером 3215 п.о., которая кодирует синтез интерферона альфа-2b человека под контролем лактозного и триптофанового промотора и терминатора транскрипции rrnBT1T2 и содержит в качестве генетического маркера синтетический ген km, детерминирующий устойчивости к канамицину. Изобретение позволяет получать рекомбинантный интерферон альфа-2b человека, свободный от метионина на N-конце с высоким выходом и по упрощенной технологии. 3 н.п. ф-лы, 8 ил., 1 табл., 6 пр.
1. Рекомбинантная плазмида pFM-IFN-17, обеспечивающая экспрессию синтетического гена альфа-2b интерферона человека, имеющая размер 3215 п.о. и состоящая из следующих элементов: фрагмент ДНК размером 194 п.о, включающий триптофановый промотор E. coli и последовательность Шайн Дельгарно (SD), ответственную за инициацию трансляции; синтетический фрагмент ДНК размером 503 п.о., включающий оптимизированную кодирующую часть гена интерферона альфа-2b человека; фрагмент ДНК плазмиды рКК223-3 размером 534 п.о., включающий последовательность строгого терминатора транскрипции 1rrnBT1T2, последовательности промотора и SD последовательность гена бета-лактомазы; синтетический фрагмент ДНК размером 810 п.о., включающий синтетический ген kan, обеспечивающий устойчивость к канамицину - аналогу гена kan из транспозона Tn903, в котором удалены сайты рестрикции AvaI, ClaI, SmaI, HindIII; фрагмент ДНК размером 1173 п.о. плазмиды pUC19, включающий последовательности, ответственные за репликацию плазмиды (ori) и лактозный промотор.
2. Рекомбинантная плазмида pFM-AP, обеспечивающая экспрессию гена метионин аминопептидазы E. coli, имеющая размер 4582 п.о., и состоящая из следующих элементов: HindIII-SalI фрагмент ДНК плазмиды pACYC184 размером 3629 п.о., включающий последовательность, ответственную за репликацию плазмиды Р15А (ori) и ген cm; HindIII-NdeI - фрагмент ДНК размером 167 п.о., включающий лактозный промотор (Plac), последовательность Шайн Дельгарно; NdeI-SalI - фрагмент ДНК размером 804 п.о., включающий ген фермента метионин аминопептидазы Е. coli.
3. Биплазмидный штамм бактерий Escherichia coli FM-IFN, полученный встраиванием рекомбинантных плазмид pFM-IFN-17 по п. 1 и pFM-AP по п. 2 в родительский штамм Escherichia coli BL21 - продуцент рекомбинантного интерферона альфа-2b человека, свободного от метионина на N-конце.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pSS5, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО АЛЬФА-2b ИНТЕРФЕРОНА, ШТАММ ESCHERICHIA COLI SS5 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО АЛЬФА-2b ИНТЕРФЕРОНА И СПОСОБ ПОЛУЧЕНИЯ ИНТЕРФЕРОНА АЛЬФА-2b | 1999 |
|
RU2165455C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pIF TREN, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА, И ШТАММ БАКТЕРИЙ Escherichia coli-ПРОДУЦЕНТ ПОЛИПЕПТИДА ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА | 2006 |
|
RU2326168C1 |
| WO 1992001055 А1, 23.01.1992 | |||
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ИНТЕРФЕРОНА АЛЬФА-2B, РЕКОМБИНАНТНАЯ ПЛАЗМИДА И ШТАММ ПРОДУЦЕНТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2003 |
|
RU2242516C1 |
Авторы
Даты
2017-02-08—Публикация
2016-03-30—Подача