Настоящее изобретение относится к обнаружению модифицированных остатков цитозина и, в частности, к секвенированию нуклеиновых кислот, содержащих модифицированные остатки цитозина.
5-метилцитозин (5mC) является хорошо изученной эпигенетической меткой ДНК, которая играет важную роль в сайленсинге генов и стабильности генома, количество которой повышено в CpG-динуклеотидах (1). У многоклеточных животных 5mC может окисляться до 5-гидроксиметилцитозина (5hmC) семейством ферментов транслокации десять-одиннадцать (ten-eleven translocation, TET) (2, 3). Общие уровни 5hmC, в грубом приближении, в 10 раз ниже, чем уровни 5mC, и различаются между тканями (4). Относительно высокие количества 5hmC (~0,4% всех остатков цитозина) присутствуют в эмбриональных стволовых (ЭС) клеток, где, как предполагалось, 5hmC участвует в формировании и/или поддержании плюрипотентности (2, 3, 5-9). Предполагалось, что 5hmC является интермедиатом активного деметилирования ДНК, например, путем дезаминирования или дальнейшего окисления 5hmC до 5-формилцитозина (5fC) и 5-карбоксицитозина (5cC) ферментами TET с последующей эксцизионной репарацией оснований с участием тимин-ДНК-гликозилазы (TDG) или неспособностью сохранить указанную метку во время репликации (10). В то же время, 5hmC сам по себе также может являться эпигенетической меткой.
Обнаружение и количественное определение уровня 5hmC, присутствующего в общей геномной ДНК, может быть выполнено с использованием аналитических методов, включающих тонкослойную хроматографию и тандемную жидкостную хроматографию-масс-спектрометрию (2, 11, 12). Картирование геномной локализации 5hmC до сих пор осуществляли методами обогащения, в которых используются реактивы или антитела для 5hmC-специфического осаждения фрагментов ДНК, которые затем секвенируют (6-8, 13-15). Эти подходы с осаждением характеризуются относительно плохим разрешением (от десятков до сотен нуклеотидов) и дают лишь относительную количественную информацию, распределение которой имеет тенденцию к смещению в ходе обогащения. Количественное однонуклеотидное секвенирование 5mC осуществляют с использованием секвенирования с обработкой бисульфитом (BS-Seq, БС-секвенирование), при котором используется бисульфит-опосредованное дезаминирование цитозина в урацил, для которого соответствующая трансформация 5mC идет гораздо медленнее (16). Однако признано, что и 5mC, и 5hmC очень медленно дезаминируются в бисульфитной реакции и, таким образом, эти два основания невозможно различить (77, 18). Два относительно новых и элегантных одномолекулярных метода открыли перспективы в обнаружении 5mC и 5hmC при однонуклеотидном разрешении. Показано, что одномолекулярное секвенирование в реальном времени (SMRT) позволяет обнаружить производное 5hmC в геномной ДНК (19). Однако, требуется обогащение фрагментов ДНК, содержащих 5hmC, что приводит к потере количественной информации (19). 5mC можно обнаружить, хотя и с меньшей точностью, методом SMRT (19). Кроме того, у SMRT относительно высока частота ошибок последовательности (20), пиковый вызов модификаций является неточным (79), и указанную платформу еще не использовали для секвенирования полного генома. Белковые и твердотельные нанопоры позволяют разделить 5mC и 5hmC и обладают потенциалом для секвенирования неамплифицированных молекул ДНК с последующим применением (21, 22).
Авторы настоящего изобретения разработали способы, позволяющие отличать модифицированные остатки цитозина, например, 5-метилцитозин (5mC), 5-гидроксиметилцитозин (5hmC) и 5-формилцитозин (5fC) от цитозина (C) с однонуклеотидным разрешением. Эти способы применимы ко всем платформам секвенирования и могут быть полезны, например, при анализе геномной ДНК и/или РНК.
Один аспект настоящего изобретения обеспечивает способ идентификации модифицированного остатка цитозина в образце нуклеотидной последовательности, включающий:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) окисление или восстановление первой части указанной популяции,
(iii) обработку окисленной или восстановленной первой части указанной популяции и второй части указанной популяции бисульфитом,
(iv) секвенирование полинуклеотидов в первой и второй частях популяции после этапов ii) и iii) с получением первой и второй нуклеотидных последовательностей, соответственно, и;
(v) идентификацию остатков в первой и второй нуклеотидных последовательностях, которые соответствуют остатку цитозина в исследуемой нуклеотидной последовательности.
Остатки, идентифицированные в первой и второй нуклеотидных последовательностях, которые соответствуют остатку цитозина в исследуемой нуклеотидной последовательности, указывают на модификацию остатка цитозина.
Например, остатки цитозина могут присутствовать в исследуемой нуклеотидной последовательности в одном или более положениях. Можно идентифицировать остатки в указанных одном или более положениях первой и второй нуклеотидных последовательностей. Модифицированный цитозин в каком-либо положении исследуемой нуклеотидной последовательности можно идентифицировать на основе комбинации остатков, идентифицированных в первой и второй нуклеотидных последовательностях, соответственно (т.е. C и C, U и U, Сии или U и C) в этом положении. Модификации цитозина, на которые указывают различные комбинации, показаны в таблице 1.
Модифицированный остаток цитозина может содержать модификацию по положению 5. Подходящие модифицированные остатки цитозина включают 5-замещенные остатки цитозина.
Группы, которые могут быть замещены в положении 5 цитозина, включают метильную (m), гидроксиметильную (hm) или формильную (f) группы.
Способы, описанные здесь, могут быть полезны в идентификации и/или различении цитозина (C), 5-метилцитозина (5мС), 5-гидроксиметилцитозина (5hmC) и 5-формилцитозина (5-fC) в исследуемой нуклеотидной последовательности. Например, способы, описанные здесь, могут быть полезны в различении одного остатка из группы, состоящей из цитозина (C), 5-метилцитозина (5мС), 5-гидроксиметилцитозина (5hmC) и 5-формилцитозина (5-fC), от других остатков в группе.
В предпочтительном варианте модифицированные остатки цитозина, например, 5-гидроксиметилцитозин, в первой части указанной популяции не являются мечеными, например, такими группами заместителей, как глюкоза, перед окислением или восстановлением на этапе ii).
В некоторых вариантах реализации изобретения первая часть популяции полинуклеотидов может быть окислена. Например, остатки 5-гидроксиметилцитозина в первой части полинуклеотидов можно преобразовать в 5-формилцитозин (5fC) путем окисления, а затем обработать первую часть полинуклеотидов бисульфитом.
Способ идентификации модифицированного остатка цитозина в образце нуклеотидной последовательности может включать:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) окисление первой части указанной популяции,
(iii) обработку окисленной первой части указанной популяции и второй части указанной популяции бисульфитом,
(iv) секвенирование полинуклеотидов в первой и второй частях популяции после этапов ii) и iii) с получением первой и второй нуклеотидных последовательностей, соответственно, и
(v) идентификацию остатка в первой и второй нуклеотидных последовательностях, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности.
Идентификация остатка в каком-либо положении в одной или обеих из первой и второй нуклеотидных последовательностей как цитозина в одной или обеих из первой и второй нуклеотидных последовательностей указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин или 5-гидроксиметилцитозин.
5-гидроксиметилцитозин (5hmC) может быть идентифицирован в исследуемой нуклеотидной последовательности. Остаток урацила в первой нуклеотидной последовательности, в положении, соответствующем цитозину в исследуемой нуклеотидной последовательности, и цитозин в том же положении во второй нуклеотидной последовательности указывают на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-гидроксиметилцитозин (5hmC).
Например, способ идентификации остатка 5-гидроксиметилцитозина (5hmC) в исследуемой нуклеотидной последовательности или различения 5-гидроксиметилцитозина от цитозина (C), 5-метилцитозина и 5-формилцитозина (5fC) в исследуемой нуклеотидной последовательности может включать:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) окисление первой части указанной популяции,
(iii) обработку окисленной первой части указанной популяции и второй части указанной популяции бисульфитом,
(iv) секвенирование полинуклеотидов в первой и второй частях популяции после этапов ii) и iii) с получением первой и второй нуклеотидных последовательностей, соответственно, и;
(v) идентификацию остатка в первой и второй нуклеотидных последовательностях, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности,
причем присутствие остатка урацила в первой нуклеотидной последовательности и цитозина во второй нуклеотидной последовательности указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-гидроксиметилцитозин.
5-метилцитозин (5mC) может быть идентифицирован в исследуемой нуклеотидной последовательности. Цитозин в первой и второй нуклеотидных последовательностях в положении, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин (5mC).
Например, способ идентификации остатка 5-метилцитозина в исследуемой нуклеотидной последовательности или различения 5-метилцитозина от цитозина (C), 5-гидроксиметилцитозина (5hmC) и 5-формилцитозина (5fC) в исследуемой нуклеотидной последовательности может включать:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) окисление первой части указанной популяции,
(iii) обработку окисленной первой части указанной популяции и второй части указанной популяции бисульфитом,
(iv) секвенирование полинуклеотидов в первой и второй частях популяции после этапов ii) и iii) с получением первой и второй нуклеотидных последовательностей, соответственно, и
(v) идентификацию остатка в первой и второй нуклеотидных последовательностях, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности,
причем присутствие цитозина в первой и второй нуклеотидных последовательностях указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин (5mC).
Остатки урацила в первой и второй нуклеотидной последовательности в положении, соответствующем цитозину в исследуемой нуклеотидной последовательности, указывают на то, что остаток цитозина в исследуемой нуклеотидной последовательности не является ни 5-метилцитозином, ни 5-гидроксиметилцитозином, т.е. остаток цитозина является немодифицированным цитозином или 5-формилцитозином.
Сводная информация по модификациям цитозина в некотором положении в исследуемой нуклеотидной последовательности, на которые указывают конкретные комбинации цитозина и урацила в указанном положении в первой и второй нуклеотидных последовательностях, показана в Таблице 1.
Первую и вторую части популяции можно полинуклеотидов обработать бисульфитом и/или секвенировать одновременно или последовательно.
В некоторых вариантах реализации, в которых первая часть окислена на этапе ii), обработка второй части может не требоваться для идентификации или различения модифицированного остатка цитозина в исследуемой нуклеотидной последовательности. Например, в Таблице 1 показано, что окисления и обработки бисульфитом первой части полинуклеотидной популяции достаточно для идентификации 5-метилцитозина в исследуемой нуклеотидной последовательности. Способ идентификации остатка 5-метилцитозина в исследуемой нуклеотидной последовательности или различения 5-метилцитозина от цитозина (C), 5-гидроксиметилцитозина (5hmC) и 5-формилцитозина (5fC) в исследуемой нуклеотидной последовательности может включать:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) окисление указанной популяции,
(iii) обработку окисленной популяции бисульфитом,
(iv) секвенирование полинуклеотидов в популяции после этапов ii) и iii) для получения обработанной нуклеотидной последовательности, и
(v) идентификацию остатка в обработанной нуклеотидной последовательности, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности, причем присутствие цитозина в обработанной нуклеотидной последовательности указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин (5mC).
В некоторых вариантах реализации изобретения первая часть популяции полинуклеотидов может быть восстановлена на этапе ii). Способ идентификации модифицированного остатка цитозина в образце нуклеотидной последовательности может включать:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) восстановление первой части указанной популяции,
(iii) обработку восстановленной первой части указанной популяции и второй части указанной популяции бисульфитом,
(iv) секвенирование полинуклеотидов в первой и второй частях популяции после этапов ii) и iii) с получением первой и второй нуклеотидных последовательностей, соответственно, и
(v) идентификацию остатка в первой и второй нуклеотидных последовательностях, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности.
Это может быть полезно для идентификации и/или различения 5-формилцитозина (5-fC) в исследуемой нуклеотидной последовательности.
В вариантах реализации, где происходит восстановление первой части, цитозин в первой нуклеотидной последовательности в положении, соответствующем цитозину в исследуемой нуклеотидной последовательности, и остаток урацила в этом положении второй нуклеотидной последовательности указывают на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-формилцитозин; урацил в первой и второй нуклеотидных последовательностях в положении, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, указывают на то, что остаток цитозина в исследуемой нуклеотидной последовательности является немодифицированным цитозином; а цитозин и в первой, и во второй нуклеотидных последовательностях в положении, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности является 5-метилцитозином (5mC) или 5-гидроксиметилцитозином (5hmC).
Сводная информация по модификациям цитозина в некотором положении в исследуемой нуклеотидной последовательности в положении, на которые указывают конкретные комбинации цитозина и урацила в указанном положении в первой и второй нуклеотидных последовательностях, приведена в Таблице 1.
В некоторых вариантах реализации способы по настоящему изобретению могут включать секвенирование первой части окисленных и обработанных бисульфитом полинуклеотидов; второй части полинуклеотидов, обработанных бисульфитом; и третью часть полинуклеотидов из восстановленной и обработанной бисульфитом популяции. Например, способ может включать:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) обеспечение первой, второй и третьей частей указанной популяции,
(iii) окисление первой части указанной популяции,
(iv) восстановление третьей части указанной популяции,
(v) обработку первой, второй и третьей частей указанной популяции бисульфитом,
(vi) секвенирование полинуклеотидов в первой, второй и третьей частях популяции после этапов iii), iv) и v) с получением первой, второй и третьей нуклеотидных последовательностей, соответственно, и
(vii) идентификацию остатка в первой, второй и третьей нуклеотидных последовательностях, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности.
Это может быть полезно, например, для идентификации и/или различения 5-формилцитозина (5-fC) в исследуемой нуклеотидной последовательности от цитозина и/или других модифицированных цитозинов.
Урацил в положении в первой и второй нуклеотидных последовательностях, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, и цитозин в указанном положении в третьей нуклеотидной последовательности указывают на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-формилцитозин.
Цитозин в первой, второй и третьей нуклеотидных последовательностях в положении, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин (5mC).
Цитозин в положении второй и третьей нуклеотидных последовательностей, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, и остаток урацила в указанном положении в первой нуклеотидной последовательности указывают на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-гидроксиметилцитозин.
Урацил в первой, второй и третьей нуклеотидных последовательностях в положении, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой немодифицированный цитозин.
Сводная информация по модификациям цитозина в каком-либо положении исследуемой нуклеотидной последовательности, на которые указывают конкретные комбинации цитозина и урацила в указанном положении в первой, второй и третьей нуклеотидных последовательностей приведена в Таблице 1.
Исследуемая нуклеотидная последовательность может быть заранее известна, или ее можно определить. Исследуемая нуклеотидная последовательность представляет собой последовательность необработанных полинуклеотидов в популяции, т.е. полинуклеотидов, не подвергавшихся окислению, восстановлению или обработке бисульфитом. В исследуемой нуклеотидной последовательности модифицированные остатки цитозина не отличаются от цитозина. И 5-метилцитозин, и 5-формилцитозин, и 5-гидроксиметилцитозин в исследуемой нуклеотидной последовательности определяются или идентифицируются как остатки цитозина. Например, любой из способов, описанных в настоящем документе, может дополнительно включать:
обеспечение четвертой части популяции полинуклеотидов, включающей исследуемую нуклеотидную последовательность; и
секвенирование полинуклеотидов в четвертой части популяции с получением исследуемой нуклеотидной последовательности.
Последовательность полинуклеотидов в четвертой части может быть определена с использованием любой соответствующей методики секвенирования.
Могут быть определены положения одного или более остатков цитозина в исследуемой нуклеотидной последовательности. Это может быть выполнено путем стандартного анализа последовательности. Поскольку модифицированные остатки цитозина не различаются от цитозина, остатки цитозина в исследуемой нуклеотидной последовательности могут являться цитозином, 5-метилцитозином, 5-формилцитозином или 5-гидроксиметилцитозином.
Первую и вторую нуклеотидные последовательности и, необязательно, третью нуклеотидную последовательность можно сравнить с исследуемой нуклеотидной последовательностью. Например, можно идентифицировать остатки в первой и второй последовательностях и, необязательно, в третьей нуклеотидной последовательности в положениях, соответствующих одному или более остаткам цитозина в исследуемой нуклеотидной последовательности.
Модификацию остатка цитозина в исследуемой нуклеотидной последовательности можно определить на основании идентичности нуклеотидов в соответствующих положениях в первой и второй нуклеотидных последовательностях и, необязательно, третьей нуклеотидной последовательности.
Все полинуклеотиды в популяции содержат одну и ту же исследуемую нуклеотидную последовательность, т.е. исследуемая нуклеотидная последовательность идентична во всех полинуклеотидах в популяции.
Влияние различной обработки на остатки цитозина в исследуемой нуклеотидной последовательности можно определить, как описано в настоящем документе.
Исследуемая нуклеотидная последовательность может являться геномной последовательностью. Например, последовательность может полностью или частично включать последовательность гена, включая экзоны, интроны или выше- или нижележащие регуляторные элементы, или последовательность может включать геномную последовательность, не ассоциируемую с геном. В некоторых вариантах реализации исследуемая нуклеотидная последовательность может включать один или более CpG-островков.
Подходящие полинуклеотиды включают ДНК, предпочтительно геномную ДНК и/или РНК, например, геномную РНК (например, геномную РНК млекопитающих, растений или вирусов), мРНК, тРНК, рРНК и некодирующую РНК.
Полинуклеотиды, включающие исследуемую нуклеотидную последовательность, могут быть получены или выделены из образца клеток, например, клеток млекопитающих, предпочтительно клеток человека.
Подходящие образцы включают выделенные клетки и образцы тканей, например биоптаты.
Модифицированные остатки цитозина, включая 5hmC и 5fC, обнаружены в различных типах клеток, включая эмбриональные стволовые клетки (ЭСК) и нервные клетки (2, 3, 11, 37, 38).
Подходящие клетки включают соматические клетки и клетки зародышевой линии.
Подходящие клетки могут находиться на любой стадии развития, включая полностью или частично дифференцированные клетки или недифференцированные или плюрипотентные клетки, в том числе стволовые клетки, например, стволовые клетки взрослого организма или соматические стволовые клетки, зародышевые стволовые клетки или эмбриональные стволовые клетки.
Подходящие клетки также включают индуцированные плюрипотентные стволовые клетки (ИПСК), которые можно получить из соматической клетки любого типа в соответствии со стандартными методиками.
Например, полинуклеотиды, включающие исследуемую нуклеотидную последовательность, могут быть получены или выделены из нервных клеток, в том числе нейронов и глиальных клеток, сократительных клеток мышц, гладкомышечных клеток, клеток печени, гормон-синтезирующих клеток, клеток сальных желез, клеток островков поджелудочной железы, клеток коры надпочечников, фибробластов, кератиноцитов, эндотелиальных и уротелиальных клеток, остеоцитов и хондроцитов.
Подходящие клетки включают клетки, ассоциированные с заболеванием, например, раковые клетки, например, клетки карциномы, саркомы, лимфомы, бластомы или опухолевые клетки эмбрионального типа.
Подходящие клетки включают клетки с генотипом, характерным для генетического нарушения, например, болезни Хантингтона, муковисцидоза, серповидно-клеточной анемии, фенилкетонурии, синдрома Дауна или синдрома Марфана.
Способы экстракции и выделения указанной геномной ДНК из образцов клеток хорошо известны в данной области техники. Например, геномную ДНК или РНК можно выделить с использованием любого удобного метода выделения, например, экстракции фенолом/хлороформом и осаждения спиртом, центрифугирования в градиенте плотности хлорида цезия, твердофазной анионообменной хроматографии и методик на основе силикагеля.
В некоторых вариантах реализации полную геномную ДНК и/или РНК, выделенную из клеток, можно непосредственно использовать в качестве популяции полинуклеотидов после выделения, как описано в настоящем документе. В других вариантах реализации выделенную геномную ДНК и/или РНК возможно подвергают дальнейшим препаративным стадиям.
Для получения фрагментов геномной ДНК указанную геномную ДНК и/или РНК можно фрагментировать, например, путем обработки ультразвуком, разрезания или эндонуклеазного гидролиза. Фракции геномной ДНК и/или РНК можно использовать, как описано в настоящем документе. Подходящие фракции геномной ДНК и/или РНК могут определяться на основании размера или других критериев. В некоторых вариантах реализации фракцию фрагментов геномной ДНК и/или РНК, обогащенную CpG-островками (CGI) можно использовать, как описано в настоящем документе.
Геномная ДНК и/или РНК может быть денатурирована, например, путем нагревания или обработки денатурирующим агентом. Подходящие способы денатурации геномной ДНК и РНК хорошо известны в данной области техники.
В некоторых вариантах реализации геномная ДНК и/или РНК можно адаптировать для секвенирования перед окислением или восстановлением и обработкой бисульфитом или только обработкой бисульфитом. Характер адаптации зависит от планируемого способа секвенирования. Например, для некоторых способов секвенирования, праймеры можно лигировать со свободными концами фрагментов геномной ДНК и/или РНК после фрагментации. Подходящие праймеры могут содержать 5mC для предотвращения изменения последовательности праймеров во время окисления или восстановления и обработки бисульфитом или только обработки бисульфитом, как описано в настоящем документе. В других вариантах реализации геномную ДНК и/или РНК можно адаптировать для секвенирования после окисления или восстановления и обработки бисульфитом или только обработки бисульфитом, как описано в настоящем документе.
После фракционирования, денатурации, адаптации и/или других этапов подготовки геномную ДНК или РНК можно очистить с любым удобным способом.
После подготовки популяцию полинуклеотидов может быть представлена в форме, подходящей для дальнейшей обработки, как описано в настоящем документе. Например, популяция полинуклеотидов до обработки может находиться в водном растворе в отсутствие буфера, как описано в настоящем документе.
Полинуклеотиды для использования согласно описано в настоящем документе могут быть одно- или двуцепочечными.
Популяцию полинуклеотидов можно разделить на две, три, четыре или более отдельных частей, каждая из которых содержит полинуклеотиды, содержащие исследуемую нуклеотидную последовательность. Эти части можно независимо обрабатывать и секвенировать, как описано в настоящем документе.
В предпочтительном варианте части популяции полинуклеотидов не обрабатывают путем добавления меток или таких заместителей, как глюкоза, к остаткам 5-гидроксиметилцитозина в исследуемой нуклеотидной последовательности перед окислением и/или восстановлением.
Первая часть популяции полинуклеотидов, включающая исследуемую нуклеотидную последовательность, может быть окислена. Окисление приводит к превращению 5-гидроксиметилцитозина в исследуемой нуклеотидной последовательности в 5-формилцитозин. Окисление может быть не опосредовано ферментами, например, при использовании органического или неорганического химического окислителя, предпочтительно в денатурирующих условиях.
Первую часть может быть окислена путем обработки окислителем. Окислитель является любым агентом, подходящим для получения альдегида из спирта. Можно выбрать окислитель или условия, используемые на стадии окисления, обеспечивающие селективное окисление 5-гидроксиметилцитозина. Таким образом, другие функциональные группы полинуклеотида практически не окисляются на стадии окисления. Этап окисления, таким образом, не приводит к реакции остатков тимина или 5-метилцитозина, если они присутствуют. Агент или условия выбирают таким образом, чтобы минимизировать или предотвратить разрушение полинуклеотида.
Применение окислителя может привести к образованию некоторого количества соответствующего продукта, содержащего 5-карбоксицитозин. Образование указанного продукта не оказывает отрицательного влияния на способы идентификации, описанные в настоящем документе. В условиях бисульфитной реакции, используемых для преобразования 5-формилцитозина в урацил, также наблюдают преобразование 5-карбоксицитозина в урацил. Следует понимать, что упоминание 5-формилцитозина, получаемого окислением 5-гидроксиметилцитозина, может также относиться к продукту, содержащему 5-карбоксицитозин, также получаемый при указанном окислении.
Окислитель может быть неферментативным окислителем, например, органическим или неорганическим химическим соединением.
Подходящие окислители широко известны в данной области техники и включают оксиды металлов, например, KRuO4, MnO2 и KMnO4. Особенно полезными окислителями являются окислители, которые можно использовать в водной среде, поскольку она наиболее удобна для обработки полинуклеотида. В то же время, при возможности можно использовать окислители, подходящие для применения в органических растворителях.
В некоторых вариантах реализации окислитель может включать перрутенат-анион (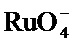
Предпочтительно, окислитель или условия окисления могут также сохранять полинуклеотид в денатурированном состоянии.
После обработки окислителем полинуклеотиды первой части можно очистить.
Очистку можно осуществить с помощью любой удобной методики очистки нуклеиновых кислот. Подходящие методики очистки нуклеиновых кислот включают хроматографию на спин-колонке.
Полинуклеотид можно подвергать дополнительным стадиям повторного окисления. Такие стадии осуществляют для максимизации преобразования 5-гидроксиметилцитозина в 5-формилцитозин. Это может быть необходимо, если полинуклеотид имеет вторичную структуру, подходящую для повторного отжига. Отожженная часть полинуклеотида может ограничивать или предотвратить доступ окислителя к указанной части структуры, защищая 5-гидроксицитозин от окисления.
В некоторых вариантах реализации первую часть популяции полинуклеотидов можно, например, подвергать нескольким циклам обработки окислителем с последующей очисткой. Например, можно выполнить один, два, три или более трех циклов.
В некоторых вариантах реализации первая часть популяции полинуклеотидов, включающей исследуемую нуклеотидную последовательность, может быть восстановлена. В других вариантах реализации третья часть популяции полинуклеотидов, включающей исследуемую нуклеотидную последовательность, может быть восстановлена. Восстановление первой или третьей части популяции полинуклеотидов приводит к преобразованию остатков 5-формилцитозина в исследуемой нуклеотидной последовательности в 5-гидроксиметилцитозин.
Первую или третью часть полинуклеотидов можно восстановить путем обработки восстановителем. Восстановитель является любым агентом, подходящим для получения спирта из альдегида. Можно выбрать восстановитель или условия, используемые на стадии восстановления, обеспечивающие селективное восстановление 5-формилцитозина. (т.е. восстановитель или условия восстановления селективны по отношению к 5-формилцитозину). Таким образом, другие функциональные группы полинуклеотида практически не восстанавливаются на стадии восстановления. Восстановитель или условия восстановления выбирают таким образом, чтобы минимизировать или предотвратить разрушение полинуклеотида.
Подходящие восстановители широко известны в данной области техники и включают NaBH4, NaCNBH4 и LiBH4. Особенно полезными восстановителями являются восстановители, которые можно использовать в водной среде, поскольку она наиболее удобна для обработки полинуклеотида. В то же время, при возможности можно использовать восстановители, подходящие для применения в органических растворителях.
После окисления и восстановления, соответственно, первую часть указанной популяции и, необязательно, третью часть указанной популяции обрабатывают бисульфитом. Вторую часть популяции, не подвергавшуюся окислению или восстановлению, также обрабатывают бисульфитом.
Обработка бисульфитом приводит к превращению остатков цитозина и 5-формилцитозина в полинуклеотиде в урацил. Как отмечалось выше, в случае присутствия 5-карбоксицитозина (продукта стадии окисления) указанный 5-карбоксицитозин преобразуется в урацил при обработке бисульфитом. Без конкретного теоретического обоснования полагают, что реакция 5-формилцитозина идет путем потери формильной группы с образованием цитозина, и последующего дезаминирования с образованием урацила. Полагают, что 5-карбоксицитозин образует урацил через последовательность стадий декарбоксилирования и дезаминирования. Обработку бисульфитом можно выполнить в условиях, обеспечивающих преобразование остатков цитозина и 5-формилцитозина в полинуклеотиде в урацил, как описано в настоящем документе.
Часть популяции можно обработать бисульфитом путем инкубации с ионами бисульфита (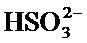
Использование ионов бисульфита (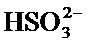
одним из признаков описанных в настоящем документе способов является преобразование неметилированного цитозина (который можно получить in situ из 5-формилцитозина или 5-карбоксицитозина) в урацил. Эта реакция обычно осуществляется за счет использования бисульфита. В то же время в общих аспектах изобретения для осуществления преобразования цитозина в урацил можно использовать любой реагент или условия реакции. Такие реагенты и условия выбирают так, чтобы 5-метилцитозин реагировал в небольшой степени или вообще не вступал в реакцию, а конкретнее - так, чтобы 5-метилцитозин реагировал в низкой степени или вообще не реагировал с образованием урацила. Реагент или, необязательно, дополнительный реагент также может преобразовывать 5-формилцитозин или 5-карбоксицитозин в цитозин или урацил.
После инкубации часть полинуклеотидов можно иммобилизовать, промыть, десульфонировать, элюировать и/или иным образом обработать в соответствии с необходимостью.
В некоторых вариантах реализации первую, вторую и третью части полинуклеотидов популяции можно амплифицировать описанной выше после обработки. Это может облегчить дальнейшие манипуляции и/или секвенирование. Изменения последовательности первой, второй и третьей частей полинуклеотидов сохраняются после амплификации. Подходящие методики амплификации полинуклеотидов хорошо известны в данной области техники и включают ПЦР. Присутствие остатков урацила (U) в каком-либо положении первой, второй и/или третьей частях популяции полинуклеотидов может быть определено или идентифицировано по присутствию остатка тимина (T) в указанном положении в соответствующем амплифицированном полинуклеотиде.
Как описано выше, полинуклеотиды можно адаптировать после окисления, восстановления и/или обработки бисульфитом для обеспечения их совместимости с методикой или платформой секвенирования. Характер адаптации зависит от методики или платформы секвенирования. Например, для секвенирования Solexa-lllumina обработанные полинуклеотиды можно фрагментировать, например, путем обработки ультразвуком или обработки эндонуклеазой рестрикции, репарировать, при необходимости, свободные концы полинуклеотидов и лигировать праймеры с указанными концами.
Полинуклеотиды можно секвенировать использованием любой удобной низко- или высокопроизводительной методики или платформы секвенирования, в том числе секвенирования по Сэнгеру (43), секвенирования Solexa-lllumina (44), секвенирования на основе лигирования (SOLiD™) (45), пиросеквенирования (46); импульсного секвенирования (SMRT™) (47, 48) и секвенирования с помощью полупроводниковых матриц (Ion Torrent™) (49).
Подходящие протоколы, реагенты и устройства для секвенирования полинуклеотидов хорошо известны в данной области техники и доступны для приобретения.
Можно идентифицировать остатки в первой, второй и/или третьей нуклеотидных последовательностях в положениях, соответствующих цитозину в исследуемой нуклеотидной последовательности.
Модификацию остатка цитозина в каком-либо положении исследуемой нуклеотидной последовательности можно определить на идентичности нуклеотидов в соответствующих положениях в первой, второй и, необязательно, третьей нуклеотидных последовательностях, как описано выше.
Можно определить степень или количество модификации цитозина в исследуемой нуклеотидной последовательности. Например, можно определить долю или количество 5-гидроксиметилцитозина и/или 5-метилцитозина в исследуемой нуклеотидной последовательности по сравнению с немодифицированным цитозином.
Полинуклеотиды, описанные в настоящем документе, например, популяцию полинуклеотидов или 1, 2, 3 или все 4 из первой, второй, третьей и четвертой частей популяции можно иммобилизовать на твердом носителе.
Твердый носитель представляет собой нерастворимое, не гелеобразное тело, представляющее собой поверхность, на которой можно иммобилизовать полинуклеотиды.
Примеры подходящих носителей включают предметные стекла, микролунки, мембраны или микрогранулы. Носитель может быть в гранулированной или твердой форме, в том числе, например, в виде планшета, пробирки, гранулы, шарика, фильтра, ткани, полимера или мембраны. Полинуклеотиды можно, например, иммобилизовать на инертном полимере, 96-луночном планшете, другом устройстве, аппарате или материале, который используется при секвенировании нуклеиновых кислот или в других исследованиях. Иммобилизация полинуклеотидов на поверхности твердых носителей хорошо известна в данной области техники. В некоторых вариантах реализации сам твердый носитель может быть иммобилизован. Например, микрогранулы можно иммобилизовать на второй твердой поверхности.
В некоторых вариантах реализации первую, вторую, третью и/или четвертую части популяции полинуклеотидов можно амплифицировать перед секвенированием. Предпочтительно, части популяции полинуклеотидов амплифицируют после обработки бисульфитом.
Подходящие способы амплификации полинуклеотидов хорошо известны в данной области техники.
После амплификации амплифицированные части популяции полинуклеотидов можно секвенировать.
С помощью компьютерного анализа последовательностей можно сравнить нуклеотидные последовательности и идентифицировать остатки в первой, второй и/или третьей нуклеотидных последовательностях в положениях, соответствующих цитозину в исследуемой нуклеотидной последовательности.
Можно идентифицировать нуклеотидные последовательности, например, CpG-островки, содержащие модификации цитозина в количестве, превышающем пороговое значение. Например, можно идентифицировать одну или более нуклеотидных последовательностей, в которых более 1%, более 2%, более 3%, более 4% или более 5% цитозина гидроксиметилировано.
Компьютерный анализ последовательностей можно осуществить с использованием любой компьютерной системы и программного обеспечения. Типичная компьютерная система включает центральный процессор (CPU), устройства ввода, устройства вывода и устройства хранения данных (например, ОЗУ). Предпочтительно, имеется монитор или другой дисплей. Компьютерная система может быть функционально связана с ДНК- и/или РНК-секвенатором.
Например, компьютерная система может включать процессор, пригодный для идентификации модифицированного цитозина в исследуемой нуклеотидной последовательности по сравнению с первой, второй и/или третьей нуклеотидными последовательностями, как описано в настоящем документе. Например, процессор может быть настроен для:
(a) идентификации положений остатков цитозина в исследуемой нуклеотидной последовательности,
(b) идентификации остатков в первой, второй и/или третьей нуклеотидных последовательностях в положениях остатков цитозина в исследуемой нуклеотидной последовательности,
(c) определения, на основании идентичности указанных остатков, присутствия или отсутствия модификации остатков цитозина в указанных положениях в исследуемой нуклеотидной последовательности.
Исследуемую нуклеотидную последовательность и первую, вторую и третью нуклеотидные последовательности можно вводить в процессор автоматически с ДНК- и/или РНК-секвенатора. Последовательности можно отображать, например, на мониторе.
Компьютерная система может дополнительно включать запоминающее устройство для хранения данных. Нуклеотидные последовательности, например, геномные последовательности, а также положения 5fC, 5hmC и других модифицированных остатков цитозина можно хранить на другом или том же устройстве памяти, и/или можно направлять на устройство вывода или отображать на мониторе. Это может облегчить картирование модифицированных остатков цитозина, например, 5hmC и 5fC, в геномной ДНК.
Идентификация и картирование модификаций цитозина, например, 5fC и 5hmC, в геноме могут быть полезны при изучении развития и функционирования нервной системы, дифференцировки, деления и пролиферации клеток, а также прогноза и диагностики таких заболеваний, как рак.
Идентификация и/или картирование модифицированных остатков цитозина, например, 5fC и 5hmC способами, описанными в настоящем документе, может, таким образом, быть полезным при заболеваниях.
Еще один аспект настоящего изобретения обеспечивает набор для применения в способе идентификации модифицированного остатка цитозина в образце нуклеотидной последовательности, описанном выше, включающий:
окислитель и/или восстановитель; и
бисульфитный реагент.
Подходящие окислители, восстановители и бисульфитные реагенты описаны выше.
Набор может дополнительно содержать популяцию контрольных полинуклеотидов, содержащих один или несколько модифицированных остатков цитозина, например, цитозин (C), 5-метилцитозин (5mC), 5-гидроксиметилцитозин (5hmC) или 5-формилцитозин (5fC). В некоторых вариантах реализации популяцию контрольных полинуклеотидов можно разделить на одну или более частей, причем каждая часть содержит отличающийся модифицированный остаток цитозина.
Указанный набор может включать инструкции по применению в способе идентификации модифицированного остатка цитозина в образце, описанном выше.
Набор может включать один или несколько других реагентов, необходимых для осуществления способа, например, буферные растворы, реагенты для секвенирования и другие реагенты. Набор для применения в идентификации модифицированных остатков цитозина может включать одно или более изделий и/или реагентов для осуществления способа, например, средство для обеспечения самого тестируемого образца, в том числе реагенты для выделения ДНК и/или РНК и реагенты для очистки, а также контейнеры для обработки образца (такие компоненты, как правило, являются стерильными).
Различные дополнительные аспекты и варианты реализации настоящего изобретения очевидны для специалистов в данной области техники в свете настоящего описания.
Все документы, упомянутые в настоящем описании, полностью включены в настоящую заявку посредством ссылок для всех целей.
Фразу "и/или", используемую в настоящем документе, следует рассматривать как конкретное описание каждого из двух указанных признаков или компонентов друг с другом или по отдельности. Например, "A и/или B" следует рассматривать как конкретное описание каждого из: (i) A, (ii) B и (iii) A и B, как если бы каждый из них по отдельности описывался в настоящем документе.
Если иное не следует из контекста, описания и определения особенностей, изложенных выше, не ограничиваются каким-либо конкретным аспектом или вариантом реализации настоящего изобретения и в равной степени применимы ко всем описанным аспектам и вариантам реализации.
Некоторые аспекты и варианты реализации настоящего изобретения будут проиллюстрированы примерами со ссылкой на фигуры, описанные ниже.
На Фигуре 1 показан способ секвенирования 5hmC с однонуклеотидным разрешением. На Фиг. 1A показана реакция 2ʹ-дезокси-5-формилцитидина (d5fC) с NaHSO3 (бисульфитом), нейтрализуемая NaOH в различные моменты времени с последующим анализом методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Показатели ошибки означают стандартное отклонение по трем повторам. На Фиг. 1B показана схема окислительной реакции с бисульфитом: окисление 5hmC в 5fC с последующей обработкой бисульфитом и NaOH для превращения 5fC в U. R-группа представляет собой ДНК. На Фиг. 1C показана диаграмма и таблица с изложением методик BS-Seq и oxBS-Seq. BS-Seq состоит из обработки исходной ДНК бисульфитом, а затем амплификации с последующим секвенированием. oxBS-Seq состоит из окисления исходной ДНК с последующей обработкой бисульфитом, амплификации, а затем секвенирования. Сравнение исходного и полученного в ходе BS-Seq и oxBS-Seq C позволяет различать, картировать и количественно определять 5mC и 5hmC.
На Фигуре 2A показаны бисульфитные профили 2ʹ-дезокси-5-формилцитозина, указывающие на общее декарбонилирование и дезаминирование до урацила. На Фигуре 2B показан бисульфитный профиль 2ʹ-дезокси-5-формил цитозина, указывающий на декарбоксилирование до цитозина, а затем - на и дезаминирование до урацила.
На Фигуре 3 показана количественная оценка окисления методом масс-спектрометрии (Фиг. 3A, 3B, 3D) и окислительная обработка бисульфитом при lllumina-секвенировании (Фиг. 3C). На Фиг. 3A показаны уровни 5hmC и 5fC (площади пиков, нормированные по T) в 15-мерных оцДНК-олигонуклеотидах до и после окисления KRuO4. На Фиг. 3B показаны уровни 5hmC и 5fC (концентрации, нормированные по 5mC по последовательности праймера) в 135-мерных фрагментах дцДНК до и после двух последовательных этапов окисления KRuO4. На Фиг. 3C показаны уровни преобразования C в T по результатам секвенирования lllumina двух фрагментов дцДНК, содержащих одиночный 5hmCpG (122-звенный) или несколько 5hmCpG (135-звенных) с последующими окислением и обработкой бисульфитом (получено по меньшей мере 950000 считываний на основание). 5mC также присутствовал в этих цепях для сравнения скоростей преобразования. На Фиг. 3D показаны уровни 5hmC и 5fC (концентрации, нормированные по 5mC по последовательности праймера) в ДНК клеток ES (J1), измеренные до и после окисления KRuO4. Все показатели ошибки представляли собой стандартное отклонение.
На Фигуре 4 показана степень разрушения цитозина после окисления согласно измерению изменений соотношений нуклеозидов после окисления KRuO4 в синтетической 15-звенной одноцепочечной (оц) ДНК, содержащей C (три повтора) (Фиг. 4A), синтетической 15-звенной оцДНК, содержащей 5mC (три повтора) (Фиг. 4B) и геномной ДНК клеток ES J1 (2 повтора после обработки ультразвуком и 2 -без обработки ультразвуком) (Фиг. 4C). Процентное изменение измеряли путем ВЭЖХ-анализа по площади пика нуклеозида после окисления, разделенной на площадь пика нуклеозида до окисления. Показатели ошибки представляли собой стандартные отклонения.
На Фигуре 5 показана ВЭЖХ-хроматограмма нуклеозидов, полученных гидролизом молекулы ДНК размером 140 п.о, содержащей 5hmC, до (Фиг. 5A) и после (Фиг. 5B) окисления.
На Фигуре 6 показана ВЭЖХ-хроматограмма нуклеозидов, полученных гидролизом ДНК размером 15 п.о, содержащей 5fC, до (Фиг. 6A) и после (Фиг. 6B) обработки бисульфитом.
На Фигуре 7 показана ВЭЖХ-хроматограмма нуклеозидов, полученных гидролизом молекулы ДНК размером 140 п.о, содержащей 5fC, до (Фиг. 7A) и после (Фиг. 7B) восстановления.
На Фигуре 8 показано секвенирование по Сэнгеру 122-звенной цепи ДНК с сайтом Clal (ATCGAT), содержащей C, 5mC или 5hmC после обработки oxBS. Хроматограмма показывает комплементарную последовательность матричной цепи. В противоположной цепи С-ДНК, С полностью преобразован в U, и показан как A на хроматограмме вместо G. 5mC-ДНК не преобразована, и на хроматограмме показаны G. 5птС-ДНК в основном преобразована, на хроматограмме показаны A с небольшой примесью непреобразованных G в данном проходе.
На Фигуре 9 показано количественное определение уровней 5mC и 5hmC в CGI по oxRRBS. На Фиг. 9A показано сравнение фракции непреобразованных остатков цитозина в CGI между наборами данных RRBS и oxRRBS; CGI со статистически значимыми нижними фракциями в наборе данных oxRRBS (красные) являются гидроксиметилированными CGI; частота ложноположительных результатов составила 3,7% согласно оценкам по количеству CGI с противоположной картиной (черные). На Фигуре 9В показано распределение уровней 5mC и 5hmC в CGI со значимыми уровнями соответствующей модификации. На Фигуре 9C показаны примеры геномных профилей RRBS и oxRRBS, перекрывающихся с профилями (h) MeDIP-Seq (6). CGI обозначены зелеными столбиками; для ясности данные вне CGI скрыты (серые области). Каждый столбик на графиках oxRRBS представляет одиночный CPG (в любой цепи ДНК). В увеличенных областях в нижней части графика показано однонуклеотидное разрешение данного способа. На Фигуре 9D показаны уровни 5mC и 5hmC в отдельных CGI, проверенные с использованием glucMS-КПЦР. Показаны значения oxRRBS в отдельных сайтах Mspl с показателями ошибки, представляющими собой 95% доверительные интервалы. GlucMS-КПЦР выполнили в двух повторностях, столбики представляют собой среднее значение, а черные точки - отдельные повторы. Два указанных способа демонстрируют хорошую корреляцию.
На Фигуре 10 показана ВЭЖХ-хроматограмма цепи РНК (SEQ ID NO: 7), гидролизованной до нуклеозидов, до (Фиг. 10A) и после (Фиг. 10B) окисления KRuO4. Использовали те же условия, что и для окисления ДНК. Времена удерживания нуклеозидов составили: C - 1,2 мин, U - 1,7 мин, G - 3,5 мин, A - 6,5 мин.
На Фигуре 11 показан результат секвенирования по Сэнгеру синтетической 100-звенной цепи ДНК, содержащей 5-формилцитозин (5fC) (частичная последовательность - ACGGA5fCGTA) после восстановления NaBH4 и обработки бисульфитом (redBS-Seq). На хроматограмме показана обратная последовательность, комплементарная частичной последовательности (TACGTCCAT - где положения, выделенные полужирным, происходят от 5fC или C). Положения 5fC и C (в скобках) показаны на матричной цепи на фигуре 11. Как 5fC, так и C дезаминированы при обработке бисульфитом. В то же время, 5fC преобразуется в 5hmC на стадии восстановления, а не дезаминируется; при этом дезаминирование C остается без изменений. Это позволяет различать 5fC и C при однонуклеотидном разрешении.
В Таблице 1 приведены результаты секвенирования для цитозина и модифицированных вариантов цитозина, обработанных различным образом.
В Таблице 2 приведены структуры цитозина (1a), 5-метилцитозина (5mC; 1b), 5-гидроксиметилцитозина (5hmC; 1c) и 5-формилцитозина (5fC; 1d)
В Таблице 3 показана сводная информация об эффективности окисления 5hmC в ДНК для некоторых примеров водорастворимых окислителей.
В Таблицах 4 и 5 показаны времена удерживания пиков на ВЭЖХ-хроматограммах ДНК (Фигуры 4, 5 и 6) и РНК (Фигура 10) соответственно.
Эксперименты
1. Методы
1.1 Окисление d5hmCTP до d5fCTP и d5cCTP с использованием MnO2
2,5 мкл d5hmCTP (100 мМ, Bioline) в 497,5 мкл H2O с 51,6 мг MnO2 (для d5fCTP) или 500 мг MnO2 (для d5cCTP) (Alpha Aeser) встряхивали при 50 градусах в течение 2 ч 30 мин. Затем MnO2 удаляли фильтрованием с использованием 0,5 мл 10 кДа колонок Amicon Ultra (Millipore) и лиофилизировали образец. Нуклеотидтрифосфат ресуспендировали (5 мМ) и дефосфорилировали щелочной фосфатазой (New England Biolabs) в течение ночи при 37°C.
1.2 Динамика реакции бисульфита с d5fC- и d5cC- нуклеозидами
9 мкл d5fC или d5cC (5 мМ), 0,5 мкл dA (0,1 М, Roche) и 2,5 мкл H2O смешивали, а затем добавляли 33 мкл 4 М NaHSO3 (MP Biochemicals). Полученный раствор разделили на три 15-мкл реакционные смеси и выдерживали при 50°C в темноте. 0,5-мкл фракции отбирали в различные моменты времени и обрабатывали 2,5 мкл H2O и 2 мкл NaOH (1 М). После выдерживания в течение по меньшей мере 30 мин при комнатной температуре их вводили в ВЭЖХ. Измеряли площади пиков, коррелировавшие с калибровочной кривой d5fC, d5cC, dC или dU, и стандартизовали по уровню dA на хроматограмме.
1.3 Гидролиз ДНК для ВЭЖХ-анализа
ДНК гидролизовали согласно протоколу, описанному в литературе (30), очищали с помощью 0,5 мл 10 кДа колонок Amicon Ultra столбцов и анализировали путем ВЭЖХ с использованием системы ВЭЖХ Agilent 1100 при скорости потока 1 мл/мин на 3,5 мкм, 3,0×150 мм колонке Eclipse XDB-C18. Температуру образца поддерживали при 45°C. Буферы для элюирования представляли собой буфер A (500 мМ ацетата аммония (Fisher) pH 5), буфер В (ацетонитрил) и буфер C (H2O). Буфер А поддерживали на уровне 1% на протяжении всего эксперимента; градиент для остальных буферов составлял: 0 мин - 0,5% В, 2 мин - 1% В, 8 мин - 4% В, 10 мин - 95% В.
Времена удерживания 2ʹ-дезоксинуклеозидов составили: 2ʹ-дезокси-5-карбоксицитидин (1,0 мин), 2ʹ-дезоксицитидин (1,8 мин), 2ʹ-дезокси-5-гидроксиметилцитидин (2,1 мин), 2ʹ-дезоксиуридин (2,7 мин), 2ʹ-дезокси-5-метилцитидин (4,0 мин), 2ʹ-дезоксигуанозин (4,5 мин), 2ʹ-дезокси-5-формилцитидин (5,4 мин), 2ʹ-деокситимидин (5,7 мин), 2ʹ-дезоксиаденозин (7,4 мин).
Аналогичный протокол использовали для гидролиза РНК для ВЭЖХ-анализа.
1.4 Одно- и двуцепочечные последовательности ДНК
15-звенные олигонуклеотиды приобрели у IBA и содержали цитозин, 5-метилцитозин или 5-гидроксиметилцитозин. 122-звенную и 135-звенную матрицу дцДНК и праймеры приобрели у Biomers. Все C в праймерах являлись остатками 5-метилцитозина. 5-гидроксиметилцитозин добавляли в цепь во всех других положениях цитозина путем ПЦР, используя d5hmCTP и полимеразу Fermentas DreamTaq.
1.5 Общее восстановление
ДНК (приблизительно 1 мкг-10 мкл) инкубировали на льду в течение 5 минут с 40 мкл NaBH4 (10000 эквивалентов на мкл). Затем реакционную смесь встряхивали при 25 градусах с открытой крышкой в темноте в течение 1 часа. Реакционную смесь очищали с использованием спин-колонок для быстрой очистки олигонуклеотидов (Roche).
1.6 Окисление Общее окисление
ДНК доводили до 24 мкл NaOH (конечная концентрация 0,05 М) на льду, затем добавляли 1 мкл раствора KRuO4 (Alpha Aeser) (15 мМ в 0,05 М NaOH), и выдерживали реакционную смесь на льду в течение 1 часа при периодическом встряхивании на вортексе. Реакционную смесь очищали с использованием спин-миниколонки для быстрой очистки олигонуклеотидов (Roche) (после четырех промывок 600 мкл H2O).
Указанные условия также использовали для окисления РНК.
Окисление одноцепочечной ДНК
1 мкг синтетической 15-мерной оцДНК окисляли в соответствии с процедурой общего окисления.
Двойное окисление синтетической двуцепочечной ДНК
ДцДНК осаждали этанолом, а затем фильтровали через спин-миниколонку для быстрой очистки олигонуклеотидов (после четырех промывок 600 мкл H2O). Для синтетической дцДНК требовалось двойное окисление, поскольку NaOH-денатурация не на 100% эффективна по отношению к раствору одиночного гомологичного фрагмента ДНК (в отличие от геномной ДНК).
1 мкг ДНК денатурировали в 0,05 М NaOH (общий объем 19 мкл) в течение 30 мин при 37°C. Затем реакционную смесь мгновенно охлаждали на льду и оставляли на 5 мин. Затем реакционную смесь окисляли в соответствии с процедурой общего окисления, но в общем объеме 20 мкл. Указанную ДНК повторно денатурировали в 0,05 М NaOH (общий объем 24 мкл) в течение 30 мин при 37°C. Затем реакционную смесь вновь мгновенно охлаждали на льду и оставляли на 5 мин и окисляли в соответствии с процедурой общего окисления.
Общее окисление геномной ДНК
ДНК (1 мкг или менее) осаждали этанолом перед окислением, а затем фильтровали через спин-миниколонку для быстрой очистки олигонуклеотидов (после четырех промывок 600 мкл H2O). ДНК денатурировали в 0,05 М NaOH (общий объем 24 мкл или 40 мкл) в течение 30 мин при 37°C. Затем реакционную смесь мгновенно охлаждали на льду и оставляли на 5 мин и окисляли в соответствии с процедурой общего окисления.
1.7 Секвенирование по Сэнгеру и lllumina-секвенирование дцДНК, подвергнутой окислению и обработке бисульфитом
Для секвенирования по Сэнгеру 1 мкг 122-звенной ДНК, содержавшей С, 5mC и 5hmC, окисляли в соответствии с процедурой двойного окисления дцДНК и обрабатывали бисульфитом с использованием набора Qiagen Epitect в соответствии с инструкциями изготовителя для образцов FFPE, за исключением того, что термический цикл проводили дважды. Указанные образцы затем подвергали секвенированию по Сэнгеру (Source Bioscience).
Для секвенирования lllumina 1 мкг 122-звенной и 135-звенной ДНК, содержавшей 5hmC, гидролизовали в течение ночи с помощью Dral (2 мкл, New England Biolabs) и Sspl (1 мкл, New England Biolabs). Гидролизованные полосы очищали в геле с использованием набора для гель-экстракции Fermentas GeneJET и лигировали метилированные адаптеры (lllumina) с использованием мастер-микса 1 для подготовки образца ДНК NEBNext. После окисления и обработки бисульфитом, как указано выше, лигированные фрагменты амплифицировали (18 циклов) с использованием Pfu Turbo Cx (Agilent) и адаптер-специфических праймеров (lllumina) с последующей очисткой с помощью гранул AMPure XP (Agencourt).
1.8 Масс-спектрометрия
Нуклеозиды получали из ДНК путем гидролиза DNA Degradase Plus (Zymo Research) в соответствии с инструкциями изготовителя и анализировали путем ЖХ-МС/МС на масс-спектрометре LTQ Orbitrap Velos (Thermo Scientific), оборудованном ионизатором на основе наноэлектрораспыления (Proxeon). Данные масс-спектрометрии 5hmC, 5fC и, в соответствующих случаях, 5mC и T, получали с высоким разрешением в режиме полного сканирования (R>40000 для протонированных псевдомолекуляных ионов и >50000 для сопровождающих протонированных основных фрагментарных ионов), а также в режиме мониторинга выбранной реакции (SRM) при мониторинге переходов 258 - >142,0611 (5hmC), 256 - >140,0455 (5fC), 242 - >126,0662 (5mC) и 243 - >127,0502 (T). Исходные ионы отбирали для SRM с окном выделения 4 единицы массы и фрагментировали методом диссоциации столкновением (HCD) с относительной энергией столкновения 20%, при R>14000 для фрагментарных ионов.
Площади пиков выделенных ионных хроматограмм соответствующих ионов для 5hmC и 5fC нормировали по аналогичным ионам для 5mC (при наличии) или Т, и количественно оценивали с использованием внешней калибровки по сравнению со стандартами, полученными гидролизом нуклеотидтрифосфатов или олигонуклеотидов.
1.9 Культура клеток ES и выделение ДНК
Клетки J1 ES (129S4/SvJae) приобрели в ATCC (кат. № SCRC-1010) и культивировали на γ-облученном фидерном слое первичных мышиных эмбриональных фибробластов при 37°C и 5% CO2 в полной среде для ЭС (DMEM 4500 мг/л глюкозы, 4 мМ L-глутамина и 110 мг/л пирувата натрия, 15% эмбриональной телячьей сыворотки, 100 Ед. пенициллина/100 мкг стрептомицина в 100 мл среды, 0,1 мМ несущественных аминокислот, 50 мкМ β-меркаптоэтанола, 103U LIF ESGRO®). Геномную ДНК получали из ЭС клеток при пересеве 14 или 20 с использованием мини-набора для получения ДНК/РНК Qiagen AllPrep.
1.10 oxRRBS
Библиотеки RRBS получали из окисленной и неокисленной ДНК на основе ранее опубликованного протокола (31). Вкратце, 2 мкг геномной ДНК гидролизовали Mspl (Fermentas) с последующей репарацией концов и присоединением А-хвоста фрагментом Кленова (Fermentas) и лигирования метилированных адаптеров (lllumina) ДНК-лигазой T4 (NEB). ДНК с лигированным адаптером, гидролизованную Mspl, подвергали электрофорезу в 3% агарозном геле, отбирали фрагменты по размеру (110-380 п.о.) с последующей быстрой очисткой в геле с использованием набора Qiagen QlAquick и осаждали этанолом.
Перед окислением выбранную по размеру ДНК фильтровали через спин-миниколонку для быстрой очистки олигонуклеотидов (после четырех промывок 600 мкл H2O) для удаления оставшихся буферов/солей и доводили до конечного объема 25 мкл. 5 мкл указанного раствора хранили для получения неокисленной библиотеки. Остальную часть окисляли в соответствии с процедурой общего окисления геномной ДНК.
Как окисленные, так и неокисленные образцы ДНК обрабатывали бисульфитом с использованием набора Qiagen Epitect в соответствии с инструкциями изготовителя для образцов FFPE, за исключением того, что термический цикл проводили дважды. Амплифицикацию конечной библиотеки (18 циклов) выполняли с использованием Pfu Turbo Cx (Agilent) и адаптер-специфических праймеров (lllumina), после чего библиотеки очищали с помощью гранул AMPure XP (Agencourt).
1.11 Секвенирование и выравнивание считываемых фрагментов
Секвенирование (одноконцевое, размер считываемых фрагментов 40 п.о.) проводили на платформе lllumina GAllx. Основания идентифицировали путем повторной обработки необработанных изображений с помощью OLB версии 1.8 после обратной обработки штрих-кода первых трех пар оснований (32). Выравнивание считываемых фрагментов после обработки бисульфитом с геномом мыши (сборка NCBIM37) выполняли с помощью Bismark v0.6.4 (33), используя настройки -n 1 -l 40 --phred64-quals --vanilla. Выравнивание, выполненное в Bismark с отдельными мономерными последовательностями LINE1 5ʹ выполняли несколько более строго (-n 0); опубликованные консенсусные последовательности использовали для выравнивания считываемых фрагментов с мономерами подтипов L1A (34), L1Tf и L1Gf (35).
Скорость преобразования при обработке бисульфитом оценивали по сравнению с количеством непреобразованных остатков цитозина во вставке, полученной с помощью фрагмента Кленова в сайтах 3ʹ Mspl считываемых при секвенировании фрагментов, которые были достаточно короткими для чтения указанных сайтов. Качество считывания phred на Зʹ-концах оставалось на высоком уровне. Рассчитанная скорость преобразования при обработке бисульфитом колебалась от 99,8% до 99,9%.
1.12 Обработка данных oxRRBS
Количество преобразованных и непреобразованных остатков цитозина в CGI (25) выделяли из каждого набора данных BS и oxBS. Для каждого положения CpG количество 5mC оценивали как процент непреобразованных остатков цитозина в каждом наборе данных oxBS, а количество 5hmC оценивали, вычитая указанное значение из процента непреобразованных остатков цитозина в соответствующем наборе данных BS. Общее количество на CGI рассчитывали путем объединения данных из всех CpG в пределах каждого CGI. CpG, собержавшие менее 10 считываемых фрагментов, исключали, как и CpG, для которых значение 5mC отклонялось от общего значения 5mC для CGI более чем на 20% или значение 5hmC отклонялось от общего значения более чем на 10%. После этого шага фильтрации отклоняющихся значений анализировали только CGI с 5 типичными CpG или более.
Для исследования CGI, содержавших уровни 5mC, значительно превышавшие ошибку бисульфитного преобразования набора данных oxBS, применяли биномиальный критерий с использованием отсечки p-значения, скорректированного по Бенджамини-Хохбергу, равной 0,01. Аналогично, биномиальный критерий использовали для отбора CGI со значительным количеством непреобразованных остатков цитозина в наборе данных BS; в указанных CGI тестировали различия между наборами данных BS и oxBS, применяя тест Фишера и используя отсечку скорректированного значения p, равную 0,05. CGI со значительно более низкой долей непреобразованных остатков цитозина в наборе данных oxBS оценивали как гидроксиметилированные CGI. CGI с противоположной картиной считали артефактами и использовали для оценки частоты ложноположительных результатов.
1.13 GlucMS-КПЦР
Количественную оценку уровней 5mC и 5hmC в сайтах Mspl с помоью glucMS-КПЦР осуществляли, как описано ранее (6).
2. Результаты
Мы следовали стратегии, которая должна обеспечить возможность различить 5mC и 5hmC в ДНК путем использования химических реакций, селективных для 5hmC, в частности, химического удаления гидроксиметильной группы и, соответственно, преобразования 5hmC в C, который затем легко преобразовывался в U путем дезаминирования, опосредованного бисульфитом. В ходе исследования химической активности 5-формилцитозина (5fC) наблюдали декарбонилирование и дезаминирование 5fC в урацил (U) при обработке бисульфитом, которая не модифицировала 5mC (Фиг. 1a). Это не описанное ранее преобразование показало, что секвенирование 5hmC можно выполнить путем селективного окисления 5hmC в 5fC и преобразования 5fC в U в ходе двухэтапной процедуры (Фиг. 1B). Хотя обычное BS-Seq приводит к определению 5mC и 5hmC как C, указанный подход секвенирования «с бисульфитным окислением» (oxBS-Seq) дает C только в положениях 5mC и, соответственно, позволяет определить количество 5hmC в конкретном нуклеотидном положении путем сравнения показаний BS-Seq и oxBS-Seq (Фиг. 1c).
Определили бисульфитные профили 2ʹ-дезокси-5-формилцитозина и 2ʹ-дезокси-5-карбоксицитозина (Фиг. 2A и 2B). 2ʹ-дезокси-5-формилцитозин и 2ʹ-дезокси-5-карбоксицитозин инкубировали с 2,9 М NaHSO4. Небольшие образцы реакционной смеси отбирали в разные моменты времени и обрабатывали 0,3 М NaOH. Их использовали непосредственно в ВЭЖХ-анализе. Профили ВЭЖХ согласовывались с общим декарбонилированием или декарбоксилированием цитозина, соответственно, с последующим быстрым дезаминированием до урацила.
Таким образом, нам требовалось специфическое окисление 5hmC в 5fC с использованием мягкого, совместимого с водными средами и селективного по сравнению с другими основаниями и каркасом ДНК окислителя. Мы протестировали диапазон потенциально подходящих водорастворимых окислителей (Таблица 3) и обнаружили, что перрутенат калия (KRuO4) обладал теми свойствами и эффективностью преобразования, к которым мы стремились. KRuO4 может, в принципе, окислять как спирты, так и двойные углерод-углеродные связи (23). Однако в наших исследованиях реакционной способности на синтетической 15-звенной одноцепочечной ДНК (оцДНК), содержащей 5hmC, мы создали условия, в которых KRuO4 обладал способностью к высокоспецифичному взаимодействию с 5hmC (количественное преобразование 5hmC в 5fC согласно масс-спектрометрии, Фиг. 3a). 15-звенная оцДНК, содержавшая С или 5 мС, а не 5hmC, не вступала в реакцию с KRuO4, специфическую по отношению к основаниям (Фиг. 4A, B). Кроме того, мы учитывали, что окисление KRuO4 может идти до образования карбоновой кислоты (23), однако в случае 5hmC в ДНК мы наблюдали только образование альдегида (5fC), даже при умеренном избытке окислителя. Окисление KRuO4 также могло окислять 5hmC в образцах, представленных двуцепочечной ДНК (дцДНК), при использовании начального этапа денатурации до добавления окислителя; это обеспечивало количественный выход преобразования 5hmC в 5fC по результатам масс-спектрометрии (Фиг. 3B).
Создали молекулу ДНК размером 140 п.о. (SEQ ID NO: 1), содержавшую 45 5hmC-нуклеозидов, встроенных посредством ПЦР с использованием 5-метилцитозиновых праймеров и hmCTP. Указанную ДНК окисляли KRuO4. До и после окисления ДНК гидролизовали до нуклеозидов с использованием бензоназы, фосфодиэстеразы I и щелочной фосфатазы. Указанную смесь затем анализировали методом ВЭЖХ с получением хроматограмм, показанных на Фигурах 5A (до окисления) и 5B (после окисления). Наблюдали почти полное превращение 5hmC в 5fC при отсутствии активности по отношению к другим нуклеозидам.
Одноцепочечную молекулу ДНК размером 15 п.о. (SEQ ID NO: 2), содержавшую 3 остатка 5fC, обрабатывали бисульфитом, как описано выше. До и после обработки бисульфитом ДНК гидролизовали до нуклеозидов с использованием бензоназы, фосфодиэстеразы I и щелочной фосфатазы. Указанную смесь затем анализировали методом ВЭЖХ с получением хроматограмм, показанных на Фигурах 6A и 6B.
После обработки бисульфитом оставался лишь очень маленький пик 5fC и присутствовало незначительное количество цитозина. Пик урацила на Фиг. 6B происходит от 5fC, а также от дезаминирования немодифицированного C.
Изготовили молекулу ДНК размером 140 п.о. (SEQ ID NO: 1), содержавшую 45 5fC-нуклеозидов, встроенных путем ПЦР. Указанную ДНК восстанавливали с помощью NaBH4, как описано выше. До и после восстановления образцы ДНК гидролизовали до нуклеозидов с использованием бензоназы, фосфодиэстеразы I и щелочной фосфатазы. Указанную смесь нуклеозидов затем анализировали методом ВЭЖХ с получением хроматограмм, показанных на Фигурах 7A (до восстановления) и 7B (после восстановления). Наблюдалось полное преобразование 5fC в 5hmC.
Окислительное бисульфитное преобразование сайта Clal (ATCGAT) в 122-п.о. двуцепочечной ДНК (SEQ ID NO: 3) исследовали для проверки эффективности и селективности окислительного бисульфитного способа. Двуцепочечный 122-п.о. фрагмент ДНК с единственным CpG в центре (в пределах сайта рестрикции Clal ATCGAT; SEQ ID NO: 3) амплифицировали с помощью ПЦР, используя 5-метилцитозиновые праймеры и СТР, 5mCTP или 5hmCTP. Амплифицированный продукт содержал 5-метилцитозин в областях праймеров и CpG, 5mCpG или 5hmCpG в центральном CpG.
Как описано выше, указанные три синтетических 122-звенных дцДНК, каждая из которых содержала C, 5mC либо 5hmC, окисляли KRuO4, а затем подвергали обычной процедуре бисульфитного преобразования. Каждую из трех цепей секвенировали по Сэнгеру (Фиг. 8).
C-содержащая цепь полностью преобразовалась в U (Фигура 8, график LH), 5mC-содержащая цепь не преобразовалась (Фигура 8, средний график), а 5hmC-содержащая цепь почти количественно преобразовалась в U и содержала следовые количества непреобразованного C (Фигура 8, график RH). В преобразованном материале выделялся главный пик аденина и остаточный пик гуанина, обусловленный небольшим количеством непреобразованного материала.
Для точного измерения эффективности преобразования 5hmC в U выполнили lllumina-секвенирование синтетической цепи, содержавшей 5hmC, после окисления с обработкой бисульфитом. Наблюдали общий уровень преобразования 5hmC в U, равный 94,5% (Фиг. 3C). Процедуру окисления с обработкой бисульфитом проводили также со второй цепью, содержавшей несколько остатков 5hmC в различном окружении; продемонстрирована аналогично высокая эффективность преобразования (94,7%) 5hmC в U (Фиг. 3C). Наконец, выполняли окисление геномной ДНК с помощью KRuO4 и продемонстрировали количественный выход преобразования 5hmC в 5fC согласно масс-спектрометрии (Фиг. 3D) без существенного разложения С (Фиг. 4C). Это доказательство основной идеи экспериментов показывает, что процедура окисления с обработкой бисульфитом специфически преобразовывала 5hmC в U в ДНК, не изменяя С и 5mC, обеспечивая количественное секвенирование с однонуклеотидным разрешением на общедоступных платформах (oxBS-SEQ).
Затем мы использовали принцип окисления с обработкой бисульфитом для количественного картирования 5hmC с высоким разрешением в геномной ДНК ES-клеток мыши. Мы решили объединить окисление с обработкой бисульфитом с упрощенной моделью бисульфитного секвенирования (RRBS) (24), что позволило выполнить селективное секвенирование части генома, высоко обогащенной CpG-островками (CGI), что обеспечивает необходимую глубину секвенирования для обнаружения этой менее распространенной метки. Для этого мы сформировали наборы данных RRBS и oxRRBS, достигавшие средней глубины секвенирования ~120 считываний на CpG, что при объединили дало в среднем ~3300 сигналов метилирования на CGI. После применения отсечек глубины и ширины (см. Материалы и методы) наши наборы данных охватили 55% (12660) всех CGI (25). Наши данные по RRBS (т.е. без окисления) хорошо коррелировали с опубликованными наборами данных RRBS и BS-Seq (24, 26).
Для выявления 5hmC-содержащих CGI мы исследовали различия между наборами данных RRBS и oxRRBS с использованием строгих критериев (см. Материалы и методы). Ожидалось, что большинство значимых различий были обусловлены CGI, содержавшими более низкий процент непреобразованных остатков цитозина в наборе oxRRBS по сравнению с набором RRBS. CGI, характеризовавшиеся обратной тенденцией, использовали для оценки частоты ложноположительных результатов, которая составила 3,7% (Фиг. 9A). Мы выявили 800 5mC-содержащих CGI, содержавших в среднем 3,3% (диапазон 0,2-18,5%) гидроксиметилированных CpG (Фиг. 9A и B). Мы также выявили 4577 5mC-содержащих CGI, в среднем содержавших 8,1% метилированных CpG (Фиг. 9B). Мы провели секвенирование независимого биологического дублированного образца той же клеточной линии ES, но при другом пересеве, содержавшего, по данным масс-спектрометрии, пониженные уровни 5hmC (0,10% по сравнению с 0,16% от всех C) и закономерно обнаружили меньшее количество 5hmC-содержащих CGI. Важно отметить, что 5mC-содержащие CGI присутствовали в обоих образцах, что указывало на хорошую количественную воспроизводимость.
Для проверки нашего способа мы выбрали 21 CGI-содержащий сайт рестрикции Mspl и выполнили количественную оценку уровней 5hmC и 5mC в указанных CpGs с помощью glucMS-КПЦР (28) (Фиг. 9D). Мы обнаружили хорошую корреляцию между количественным определением с помощью oxRRBS и glucMS-КПЦР (r=0,86, p=5Е-7 и r=0,52, p=0,01 для 5mC и 5hmC, соответственно).
Исследовали восстановительное бисульфитное преобразование (reBS-Seq) цепи ДНК, содержавшей 5-формилцитозин (5fC).
Синтетическую 100-звенную цепь ДНК (SEQ ID NO: 8), содержавшую последовательность ACGGA5fCGTA, подвергали восстановлению NaBH4, а затем обычной процедуре бисульфитного преобразования. Затем указанную цепь секвенировали по Сэнгеру (Фигура 11).
На фигуре 11 показан график секвенирования, представляющий часть обратной последовательности комплементарной цепи (TACGTCCAT). Положения 5fC и C выделены полужирным шрифтом и показаны в скобках на матричной цепи на фигуре 11. Как показано ранее, и 5fC, и C дезаминировались при бисульфитной обработке с образованием U, который показан в обратной последовательности комплементарной цепи на Фигуре 11 как A. В то же время восстановление NaBH4 преобразовывало 5fC в 5hmC, который не подвергался дезаминированию до U и показан в обратной последовательности комплементарной цепи на Фигуре 11 как G. Таким образом, секвенирование (с восстановлением и обработкой бисульфитом redBS-Seq) позволяло различать 5fC и C при однонуклеотидном разрешении.
Подводя итоги вышесказанному, мы показали, что способ oxBS-Seq позволял надежно картировать и количественно оценивать как 5mC, так и 5hmC на однонуклеотидном уровне. Окисление с обработкой бисульфитом также была совместима с несеквенирующими подходами, связанными с 5ʹ-3-активностью, например, Sequenom, как продемонстрировано в настоящем документе. Таким образом, сравнивая обработанную бисульфитом и окисленную последовательность и обработанную бисульфитом геномную ДНК, можно определить наличие 5-метилцитозина и 5-гидроксиметилцитозина, наряду с немодифицированным цитозином.
Например, остатки урацила в обработанной бисульфитом и окисленной последовательности и обработанной бисульфитом геномной ДНК в одном и том же положении указывают на присутствие немодифицированного цитозина. Остатки цитозина и в обработанной бисульфитом и окисленной последовательности, и в обработанной бисульфитом геномной ДНК в одном и том же положении указывают на присутствие 5-метилцитозина. Остаток цитозина в окисленной и обработанной бисульфитом последовательности геномной ДНК также указывает на присутствие 5-метилцитозина. Остаток цитозина в обработанной бисульфитом геномной ДНК и остаток урацила в окисленной и обработанной бисульфитом последовательности геномной ДНК в одном и том же положении указывает на присутствие 5-гидроксиметилцитозина.
5-формилцитозин также можно секвенировать с однонуклеотидным разрешением. 5fC можно количественно восстановить до hmC в геномной ДНК с использованием NaBH4 (как показано по данным ВЭЖХ). Сравнивая необработанную, обработанную бисульфитом, окисленную и обработанную бисульфитом, и восстановленную и обработанную бисульфитом последовательность геномной ДНК, можно определить наличие всех трех известных модификаций цитозина у млекопитающих - 5-метилцитозина, 5-гидроксиметилцитозина и 5-формилцитозина наряду с немодифицированным цитозином. Например, остатки урацила в i) обработанной бисульфитом, ii) окисленной и обработанной бисульфитом и iii) восстановленной и обработанной бисульфитом последовательности геномной ДНК в одном и том же положении (UUU) указывают на присутствие немодифицированного цитозина.
Остатки цитозина в i) обработанной бисульфитом, ii) окисленной и обработанной бисульфитом и iii) восстановленной и обработанной бисульфитом последовательности геномной ДНК в одном и том же положении (CCC) указывают на присутствие 5-метилцитозина.
Остаток цитозина в обработанной бисульфитом последовательности геномной ДНК; остаток урацила в окисленной и обработанной бисульфитом геномной ДНК в том же положении и, необязательно, остаток цитозина в восстановленной и обработанной бисульфитом последовательности геномной ДНК в том же положении (CUC) указывает на присутствие 5-гидроксиметилцитозина.
Остаток урацила в обработанной бисульфитом последовательности геномной ДНК; остаток цитозина в восстановленной и обработанной бисульфитом геномной ДНК в том же положении и, необязательно, остаток урацила в окисленной и обработанной бисульфитом последовательности геномной ДНК в том же положении (UCU) указывает на наличие 5-формилцитозина.
И модифицированные, и немодифицированные остатки цитозина считывались как цитозин при секвенировании реобработанной геномной ДНК.
ВЭЖХ-хроматограммы, показанные на Фигуре 10, подтверждают, что существенного разрушения РНК после окисления 28-нуклеотидной цепи РНК (SEQ ID NO: 7) не наблюдалось. Это означает, что окислительный подход также совместим с секвенированием модифицированных остатков цитозина, например, 5hmC, как описано в настоящем документе, в РНК.
Библиография
1. А.М. Deaton et al Genes Dev. 25, 1010 (May 15, 2011).
2. M. Tahiliani et al. Science 324, 930 (May 15, 2009).
3. S. Ito et al. Nature 466, 1129 (Aug 26, 2010).
4. A. Szwagierczak et al Nucleic Acids Res, (Aug 4, 2010).
5. K.P. Koh et al. Cell Stem Cell 8, 200 (Feb 4, 2011).
6. G. Ficz et al., Nature 473, 398 (May 19, 2011).
7. K. Williams et al. Nature 473, 343 (May 19, 2011).
8. W.A. Pastor et al. Nature 473, 394 (May 19, 2011).
9. Y. Xu et al. Mol. Cell 42, 451 (May 20, 2011).
10. M.R. Branco et al Nat. Rev. Genet. 13, 7 (Jan, 2012).
11. S. Kriaucionis et al Science 324, 929 (May 15, 2009).
12. M. Munzel et al. Angew. Chem. Int. Ed. 49, 5375 (Jul 2010).
13. H. Wu et al. Genes Dev. 25, 679 (Apr 1, 2011).
14. S.G. Jin et al Nuc. Acids. Res. 39, 5015 (Jul, 2011).
15. С.X. Song et al.. Nat. Biotechnol. 29, 68 (Jan, 2011).
16. M. Frommer et al. PNAS. U.S.A. 89, 1827 (Mar 1992).
17. Y. Huang et al. PLoS One 5, e8888 (2010).
18. C. Nestor et al Biotechniques 48, 317 (Apr, 2010).
19. С.X. Song et al. Nat. Methods, (Nov 20, 2011).
20. J. Eid et al. Science 323, 133 (Jan 2, 2009).
21. E.V. Wallace et al. Chem. Comm. 46, 8195 (Nov 21, 2010).
22. M. Wanunu et al. J. Am. Chem. Soc, (Dec 14, 2010).
23. G. Green, W et al J Chem Soc Perk T 1, 681 (1984).
24. A. Meissner et al. Nature 454, 766 (Aug 7, 2008).
25. R.S. lllingworth et al. PLoS genetics 6, (Sep, 2010).
26. M.B. Stadler et al. Nature 480, 490 (Dec 22, 2011).
27. J. Borgel et al et al Nat. Genet. 42, 1093 (Dec, 2010).
28. S.M. Kinney et al. J. Biol. Chem. 286, 24685 (Jul 15, 2011).
29. N. Lane et al. Genesis 35, 88 (Feb, 2003).
30. E.P. Quinlivan et al 3rd, Anal. Biochem. 373, 383 (Feb 2008).
31. H. Gu et al. Nat. Protoc. 6, 468 (Apr, 2011).
32. F. Krueger et al PLoS One 6, e16607 (2011).
33. F. Krueger et al Bioinformatics 27, 1571 (Jun 1, 2011).
34. S.A. Schichman et al Mol. Biol. Evol. 10, 552 (May, 1993).
35. J.L. Goodier et al. Genome research 11, 1677 (Oct, 2001).
36. C. Qin et al. Mol. Carcinog. 49, 54 (Jan, 2010).
37. Li et al Nucleic Acids (2011) Article ID 870726
38. Pfaffeneder, T. et al (2011) Angewandte. 50. 1-6.
39. Lister, R. et al (2008) Cell. 133. 523-536.
40. Wang et al (1980) Nucleic Acids Research. 8 (20), 4777-4790.
41. Hayatsu et al (2004) Nucleic Acids Symposium Series No. 48 (1), 261-262.
42. Lister et al (2009) Nature. 462. 315-22.
43. Sanger, F. et al PNAS USA, 1977, 74, 5463.
44. Bentley et al Nature, 456, 53-59 (2008).
45. KJ McKernan et al Genome Res. (2009) 19:1527-1541.
46. M Ronaghi et al Science (1998) 2815375363-365.
47. Eid et al Science (2009) 3235910133-138.
48. Korlach et al Methods in Enzymology 472 (2010) 431-455.
49. Rothberg et al (2011) Nature 475348-352.
Модельные последовательности
Модифицированные нуклеотиды выделены жирным курсивом
Модель 140-п.о. двуцепочечной ДНК (SEQ ID NO: 1):
CACATCCCACACTATACACTCATACATACCTGCTCACGACGACGCTGTACACCTACGTACTCGTGCACGCTCGTCACGTGATCGACCATGACTCTGACGCACTGAGGTATGGGAAGTAGTGAGTAGATTGTAGTAAGGAG
Модель 15-нуклеотидной одноцепочечной ДНК (SEQ ID NO:2): GAGACGACGTACAGG
Модель 122-п.о. двуцепочечной ДНК (SEQ ID NO:3):
CACATCCCACACTATACACTCATACATACCATTTAAATAAATTAAATAATATTAATATATCGATTAATAATAAATAATAATTAATTAATATTGGGAAGTAGTGAGTAGATTGTAGTAAGGAG
Модель 135-п.о. двуцепочечной ДНК (SEQ ID NO:4):
CACATCCCACACTATACACTCATACATACCATTTAACGATAAATTACAATAACGTATCTAATCATATCGATTAACTAATCGAAATAATAATTACGCATTAATATTGGGAAGTAGTGAGTAGATTGTAGTAAGGAG
Прямой праймер дцДНК (SEQ ID NO:5): CACATCCCACACTATACACTCATACATACC
Обратный праймер дцДНК (SEQ ID NO:6):
CTCCTTACTACAATCTACTCACTACTTCCC
Модельная последовательность 28-нуклеотидной РНК (SEQ ID NO: 7):
UGUGGGGAGGGCGGGGCGGGGUCUGGGG
100-нуклеотидная 5fC-содержащая последовательность (SEQ ID NO: 8) (положения 5fC показаны жирным курсивом)
GACGGACGTACGATCGAGCGAGGTCTTGGGTCAGCAGGTGGCGACTGTTAGCTCAGATGGCTAGCAAGTGGGTATGTATGAGTGTATAGTGTGGGATGTG
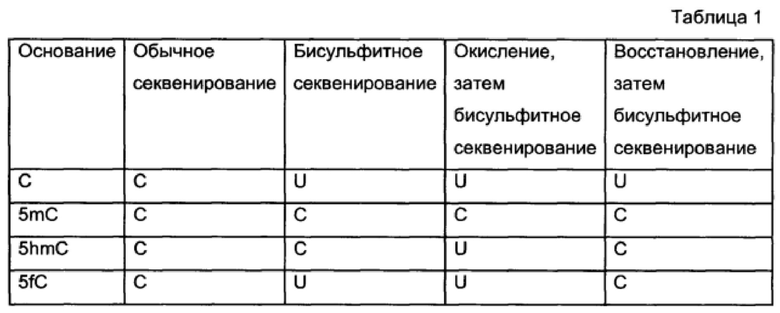
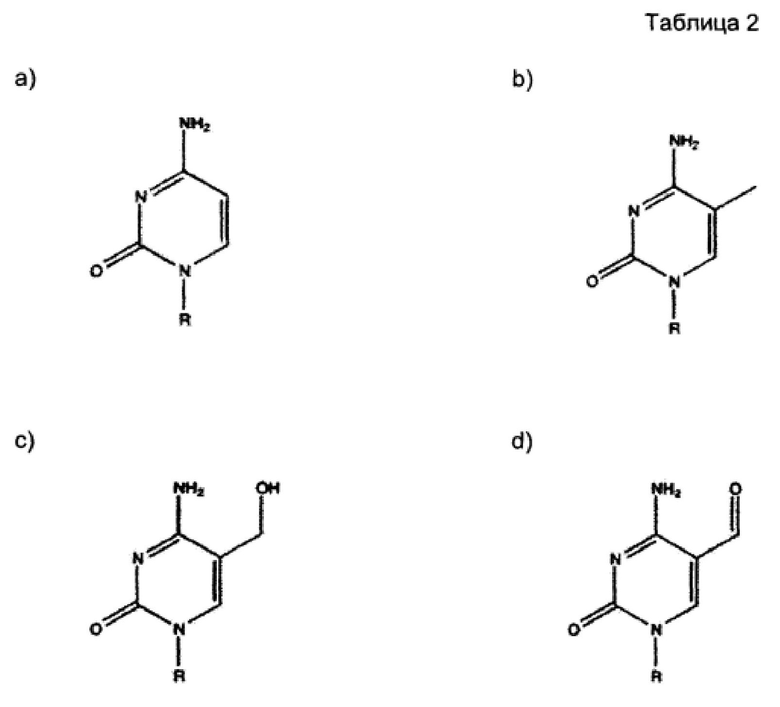
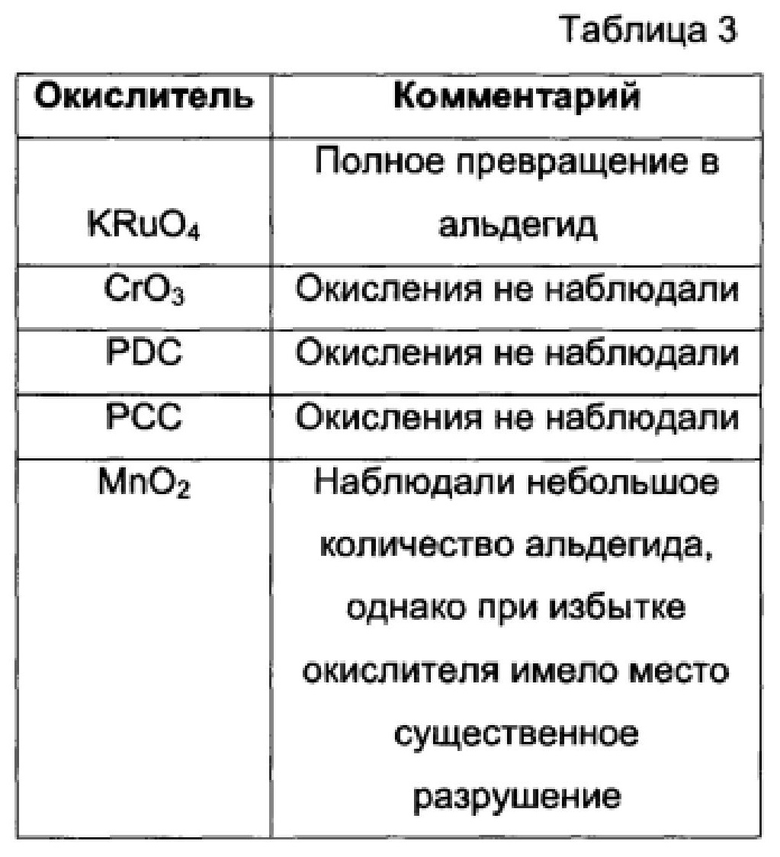
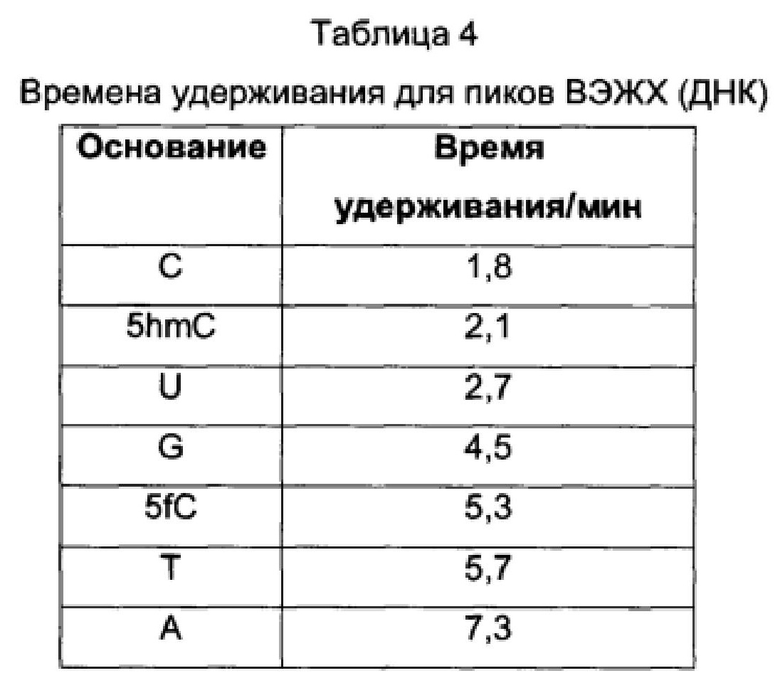
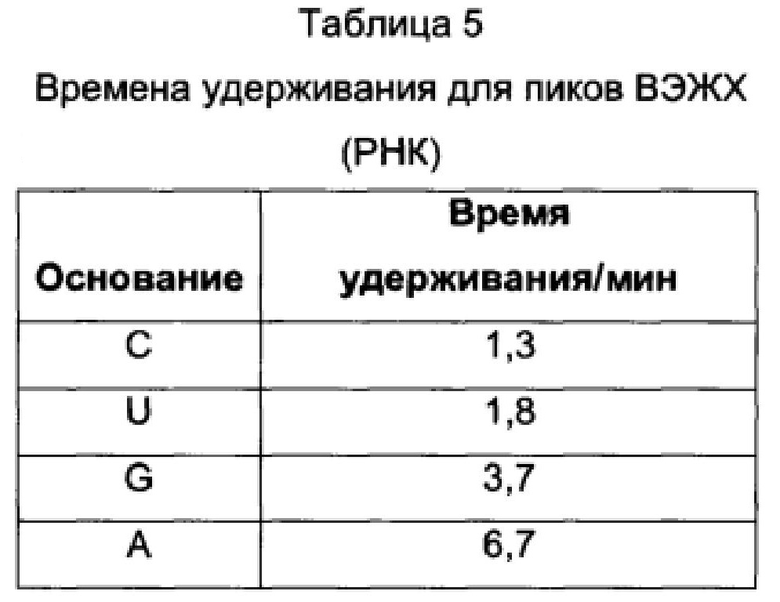
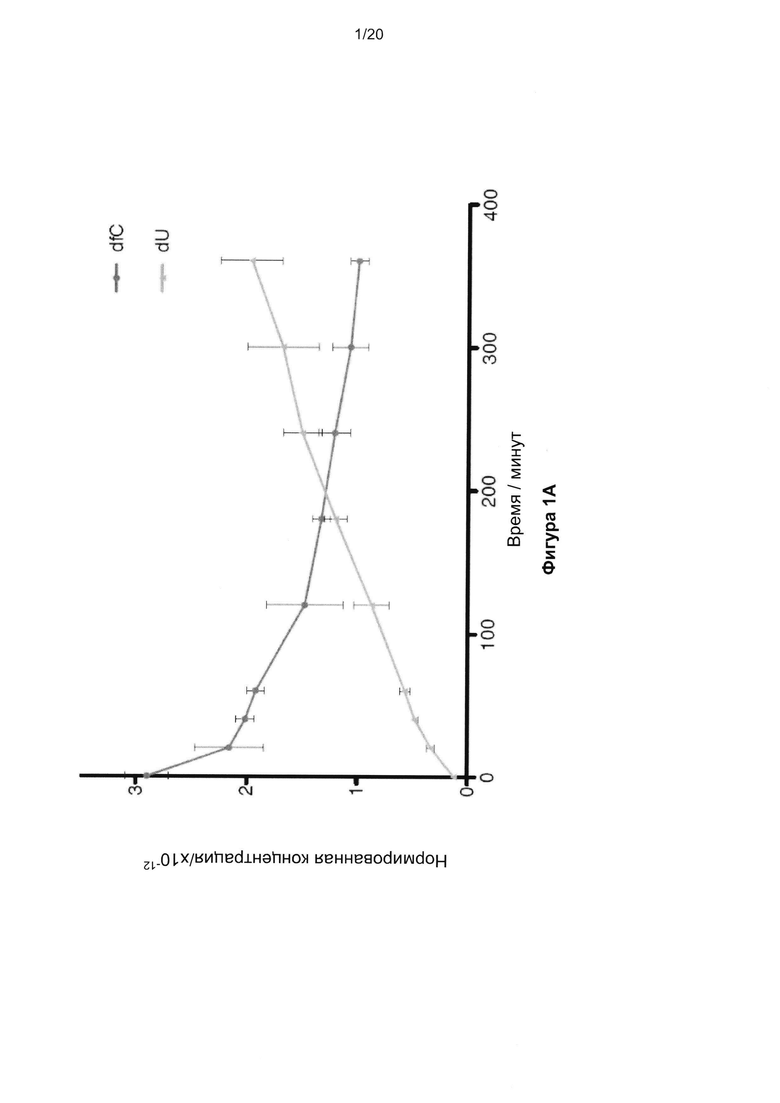
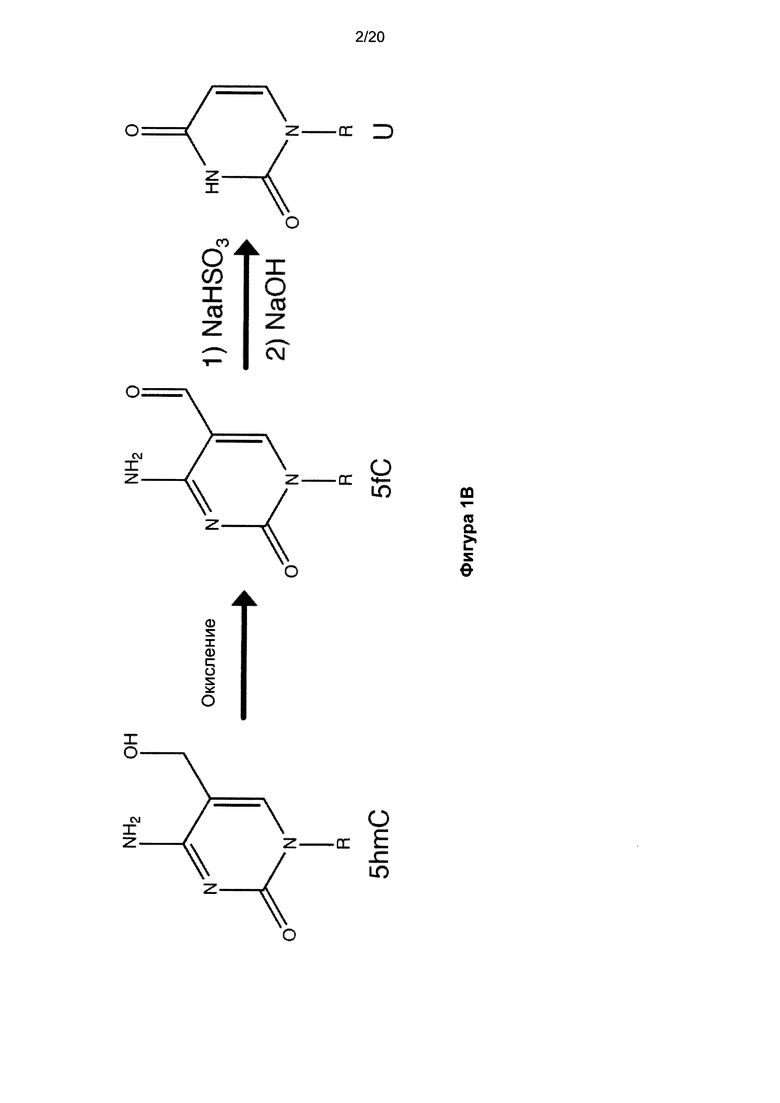
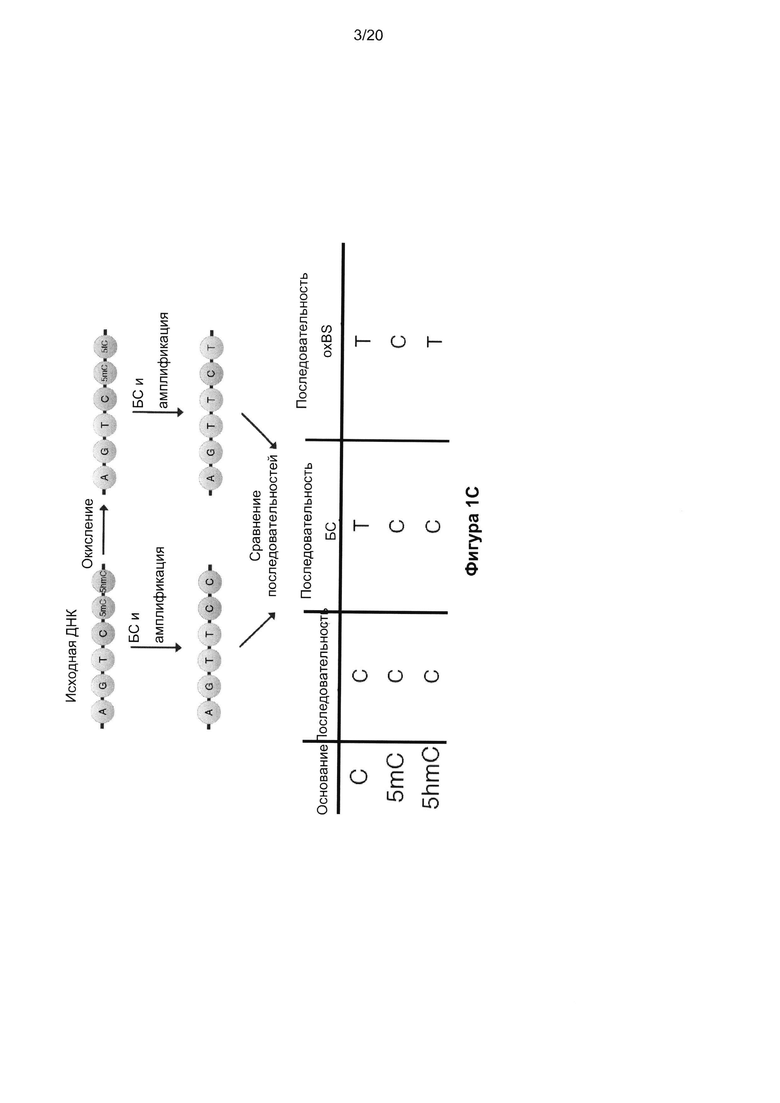
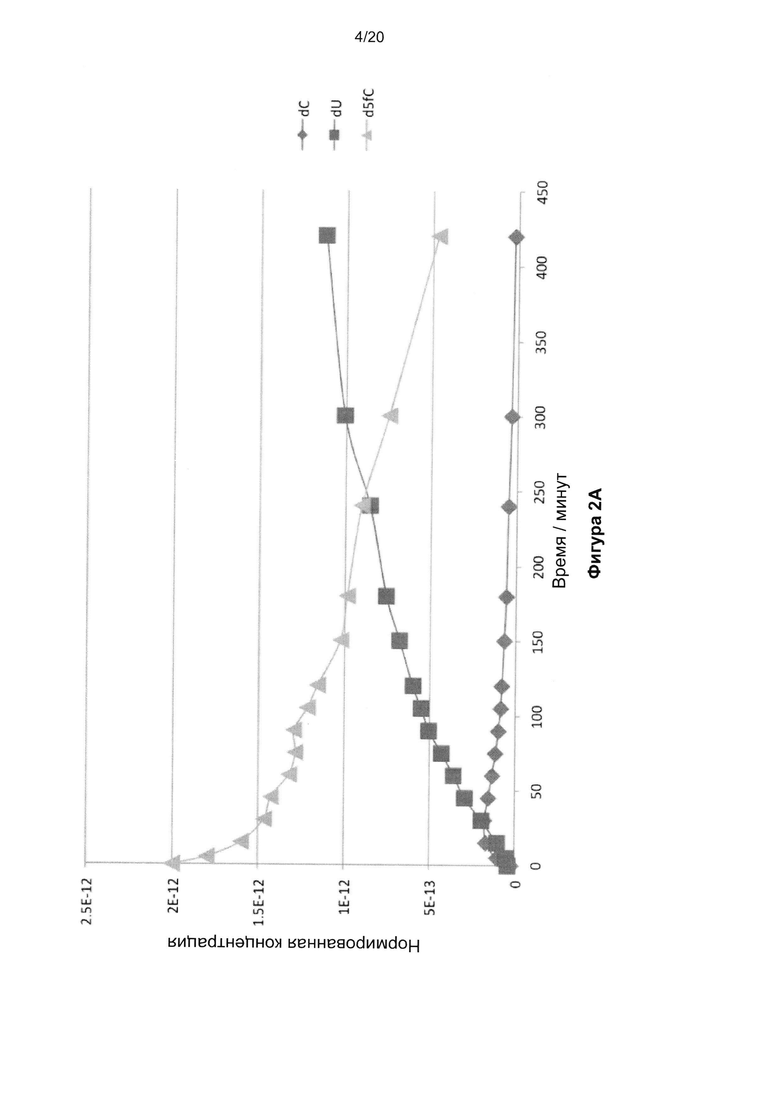
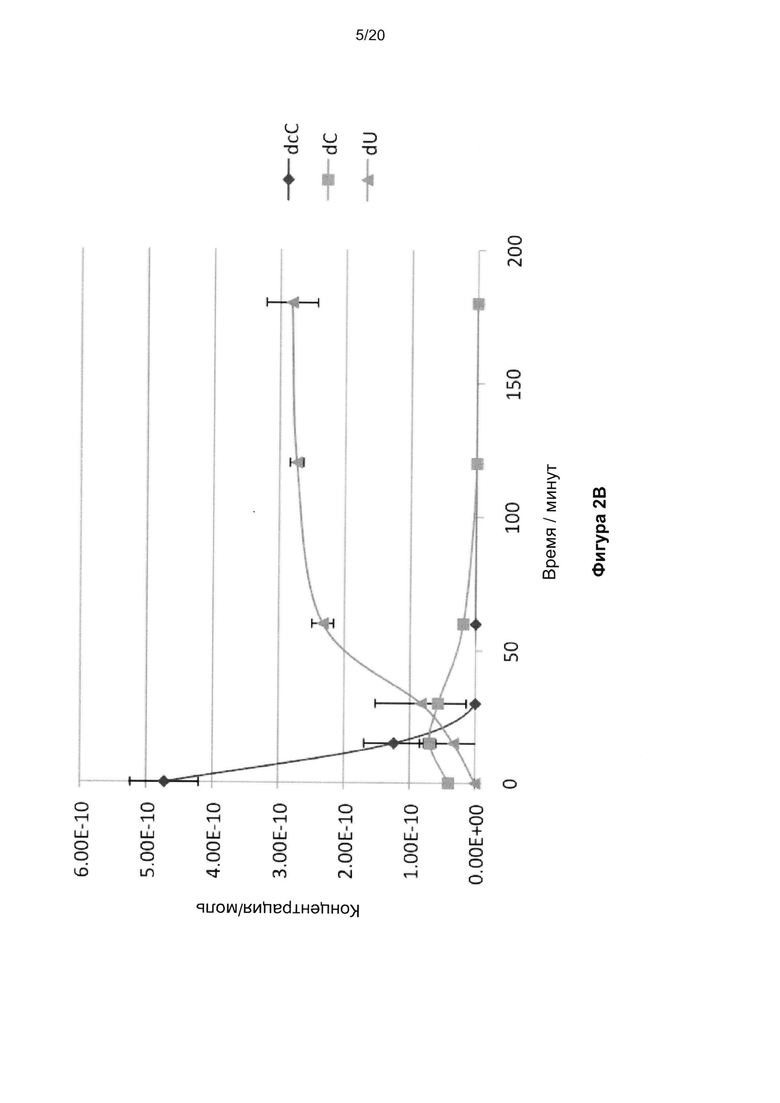
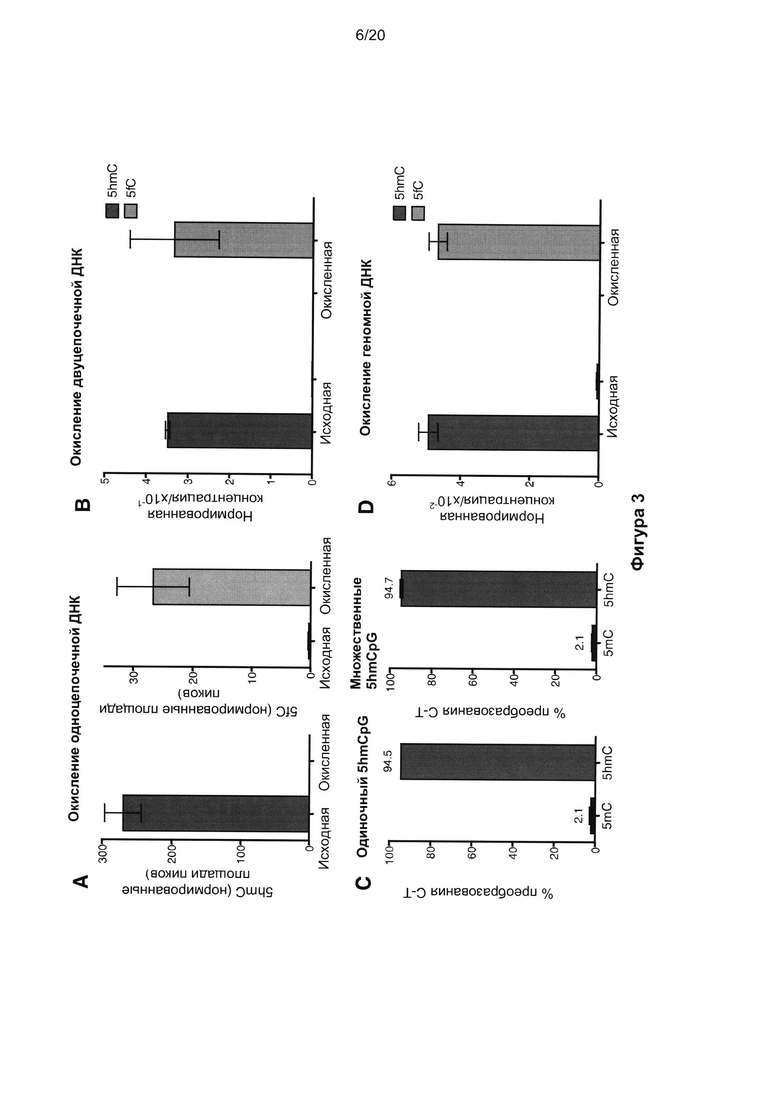
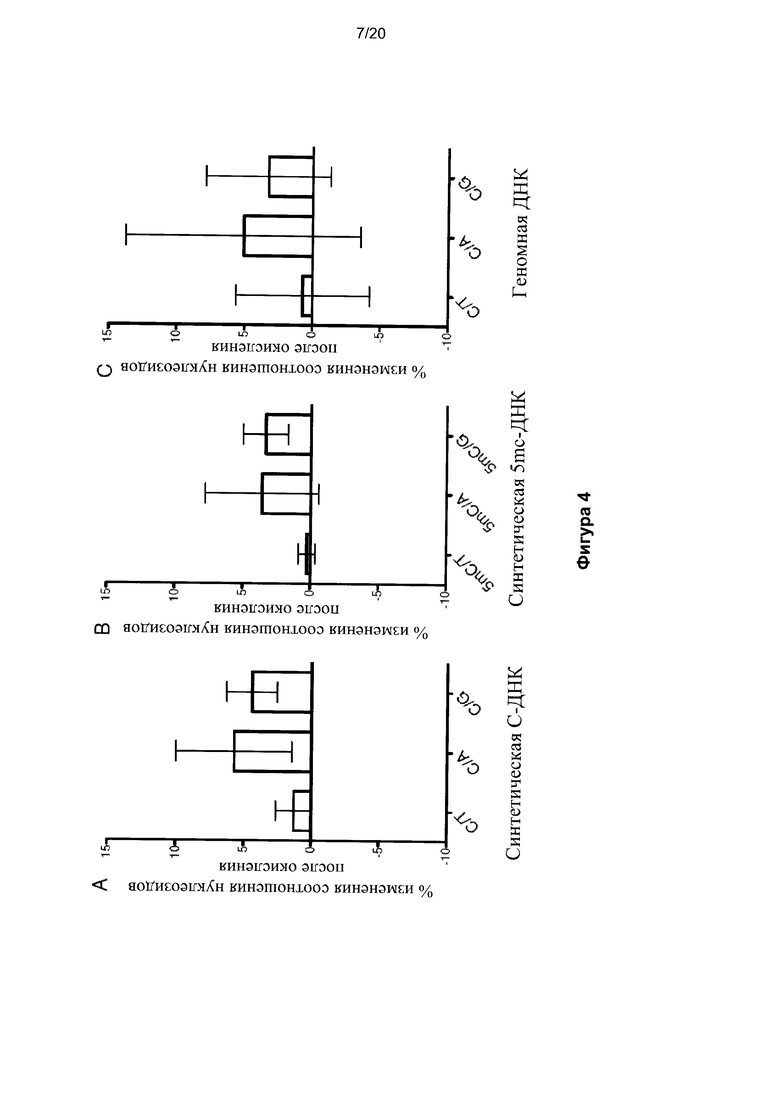
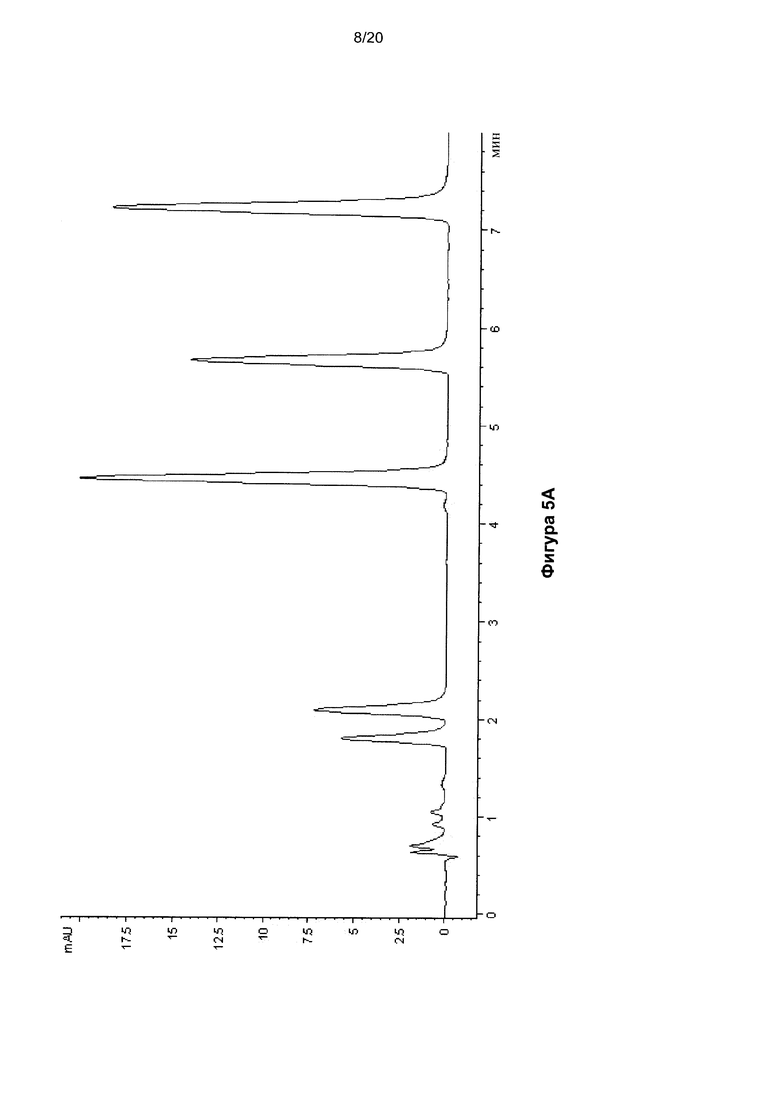
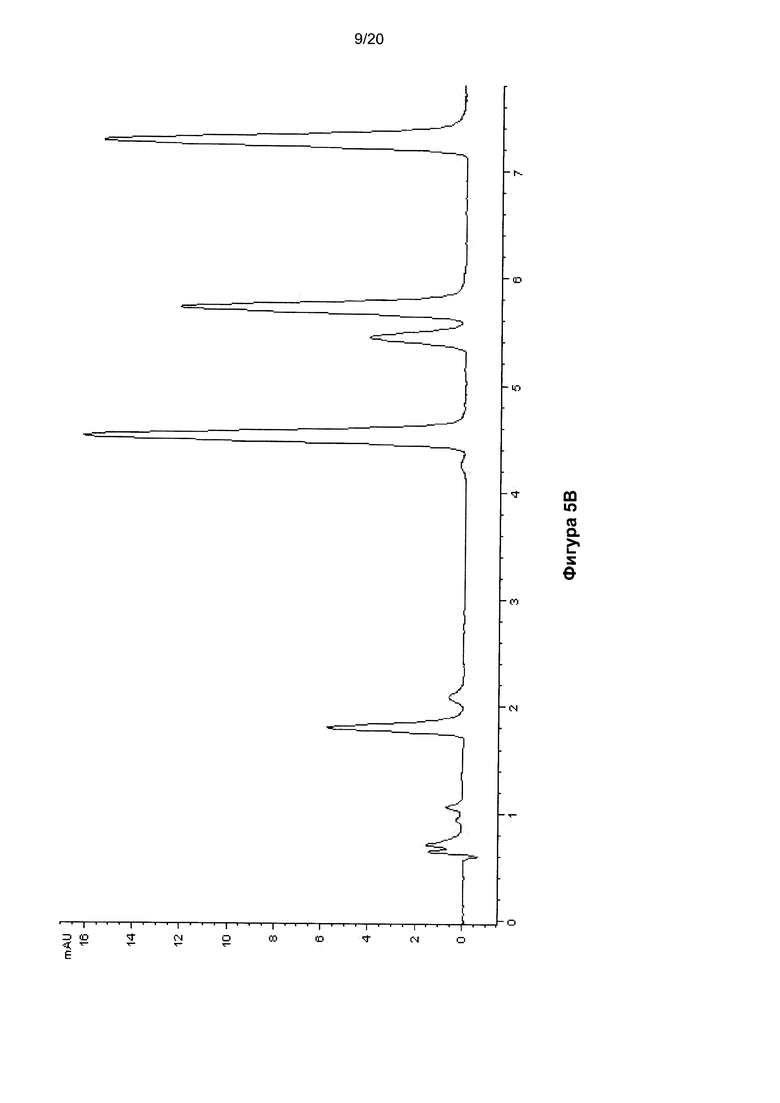
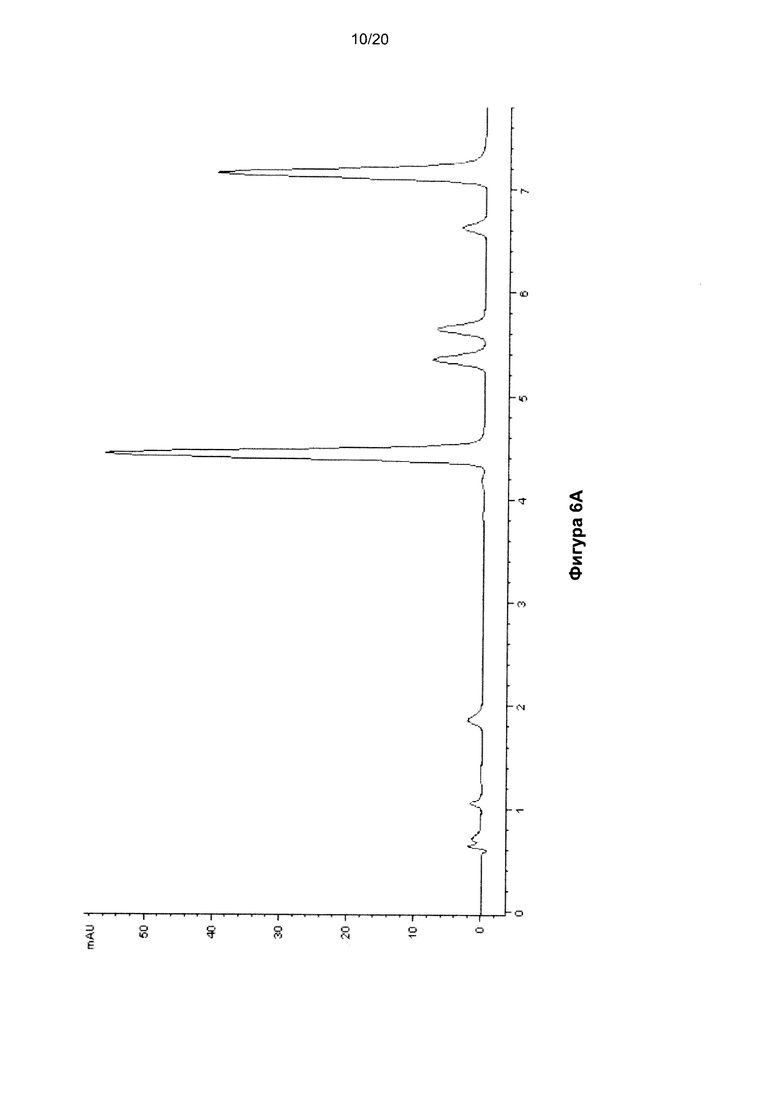
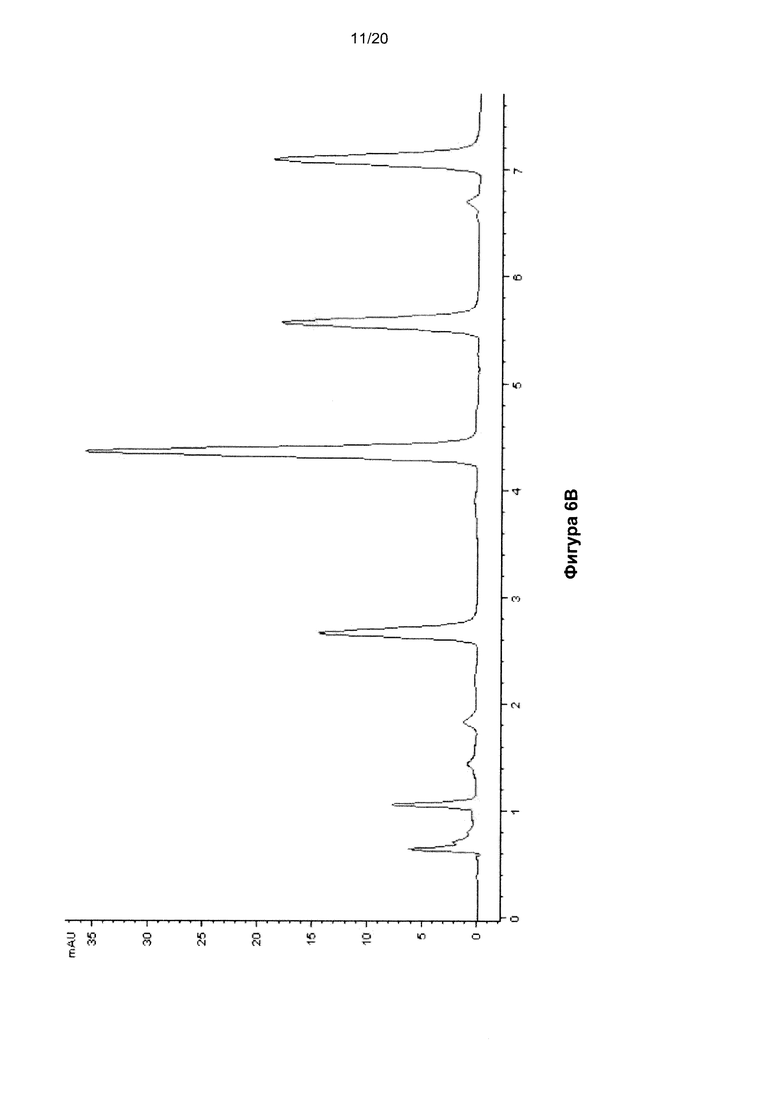
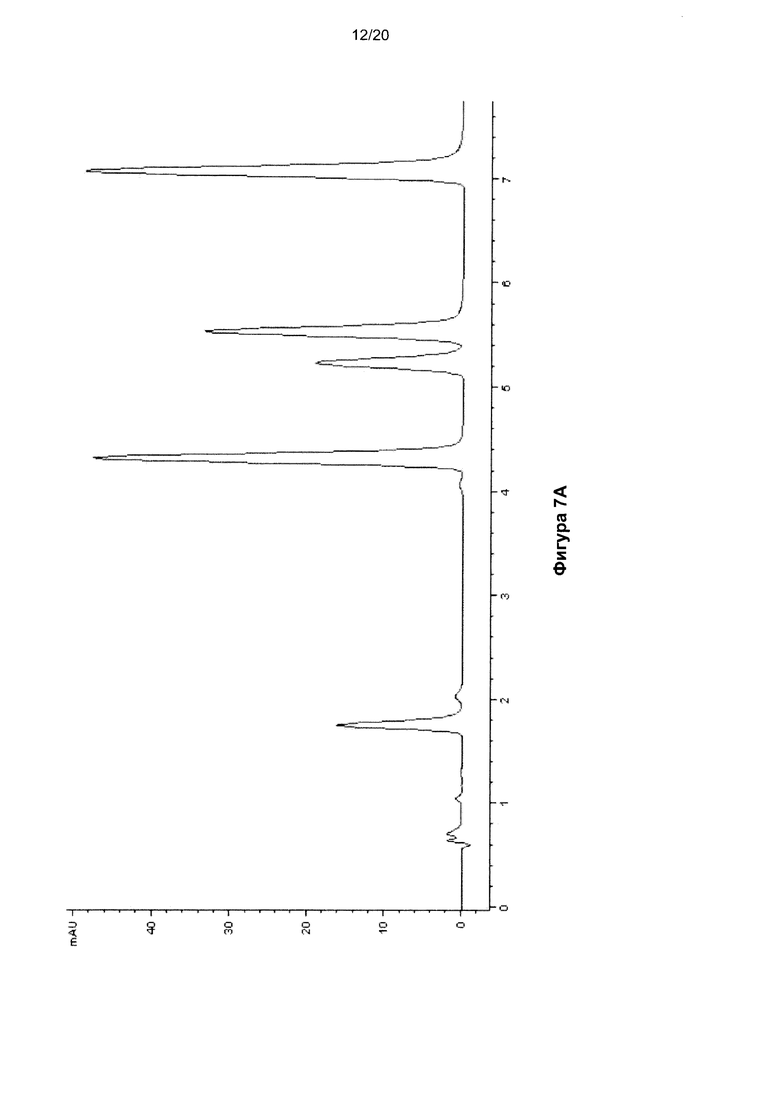
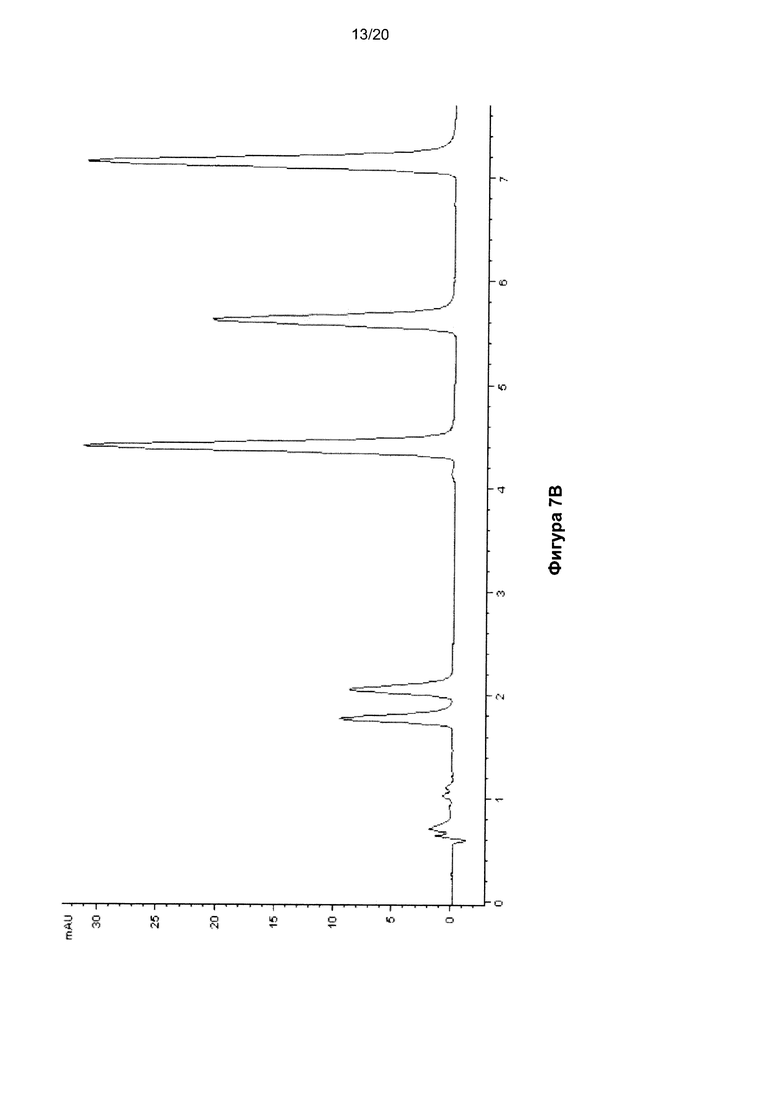
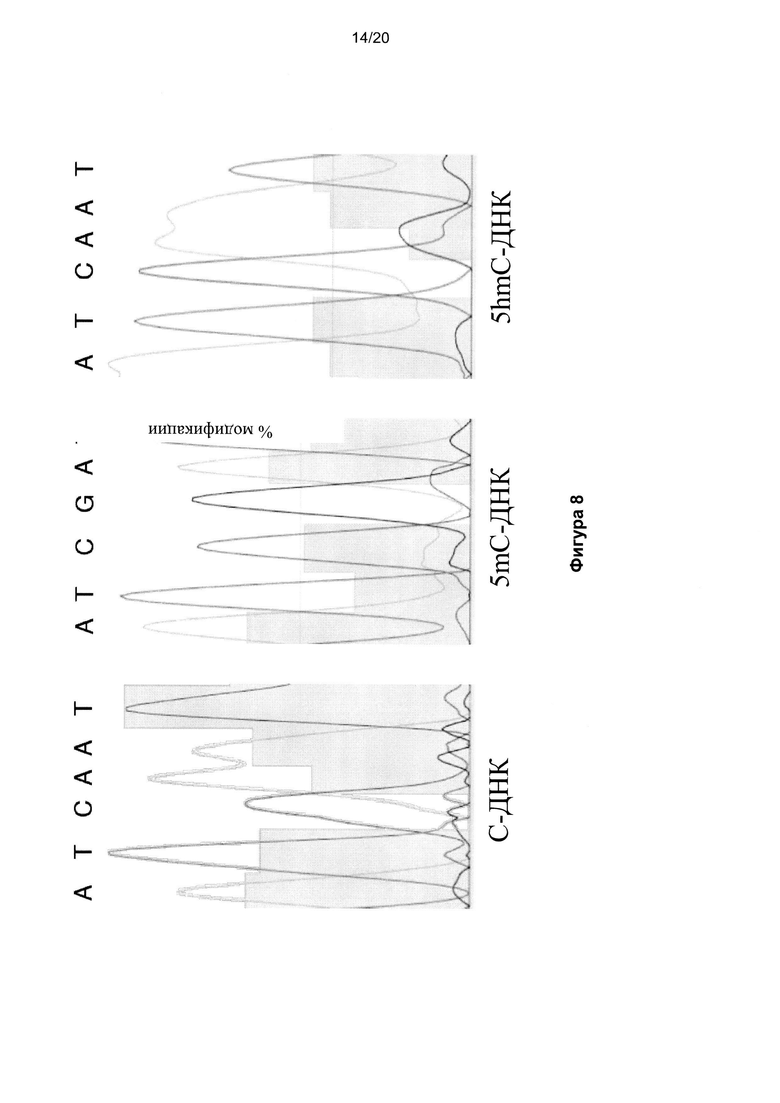
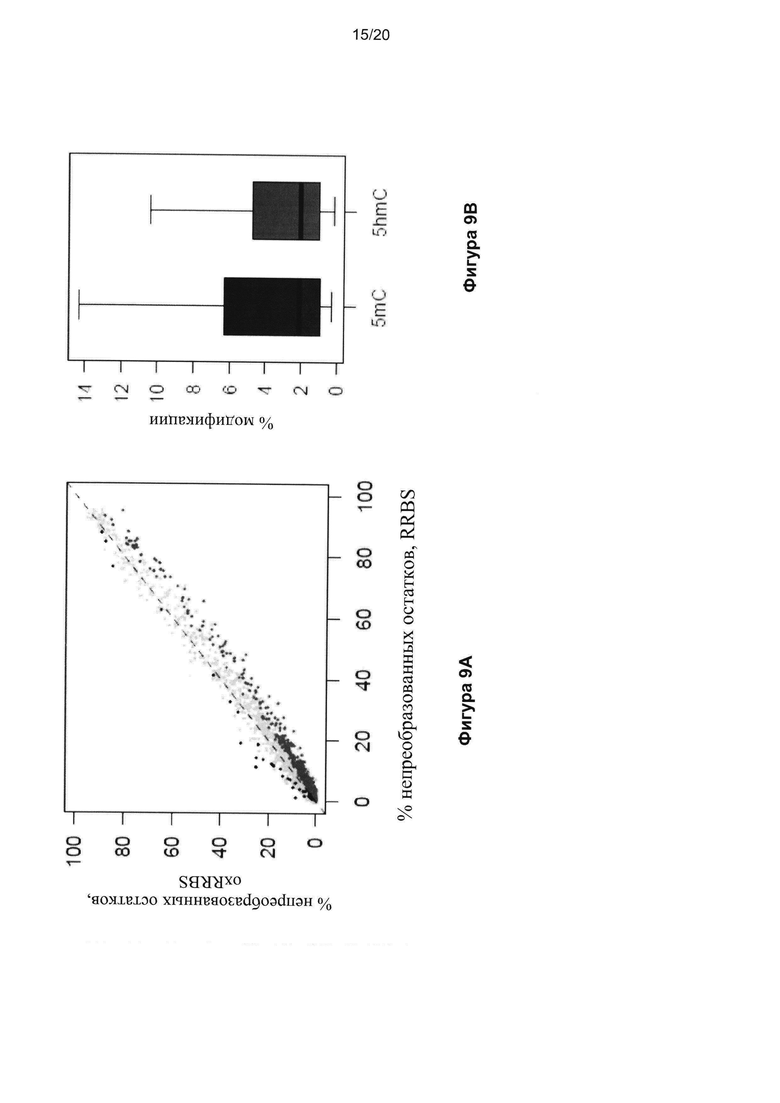
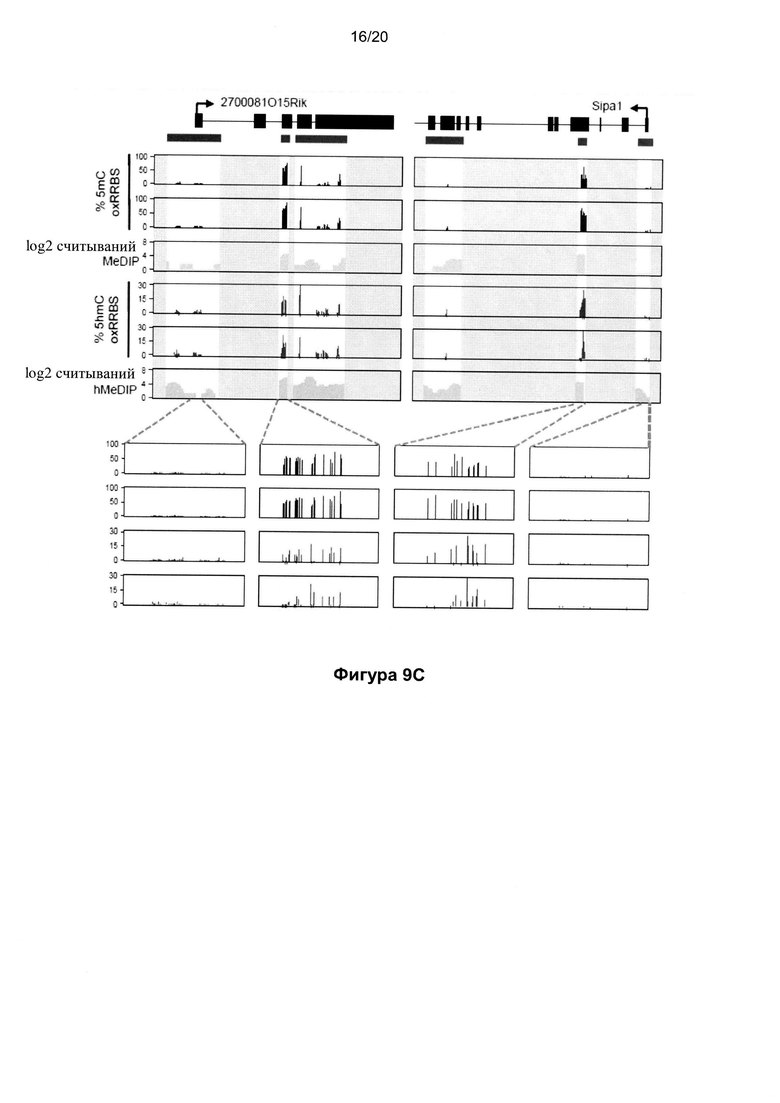
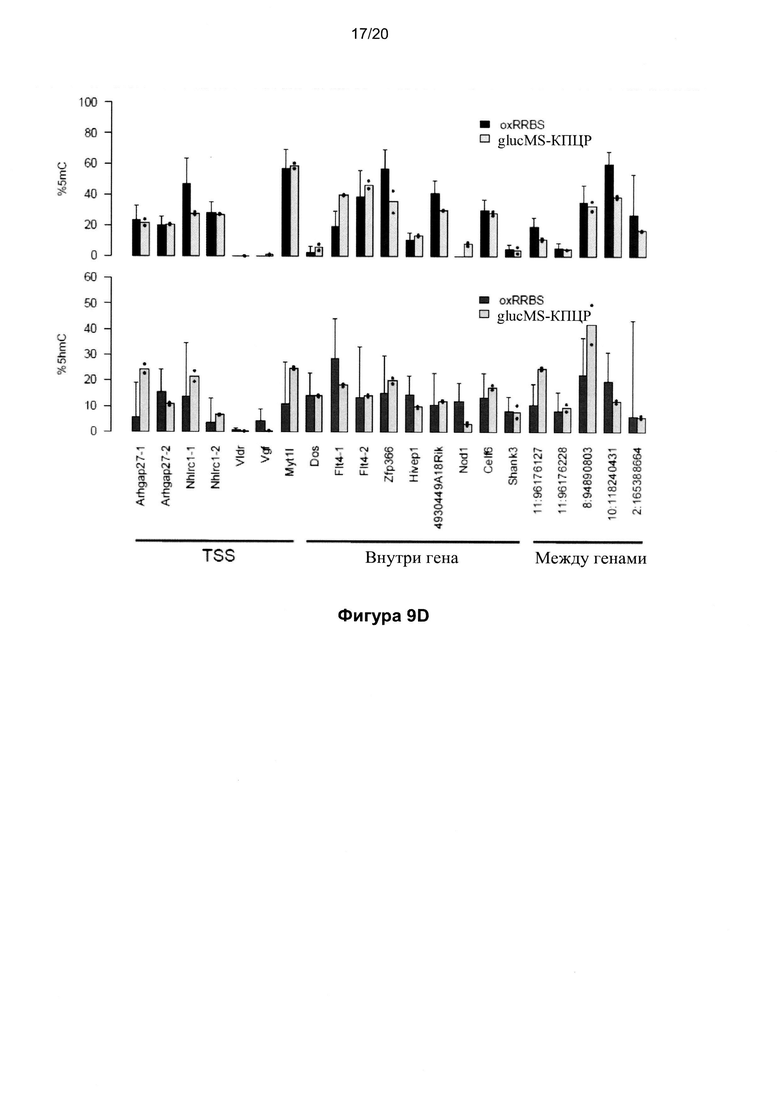
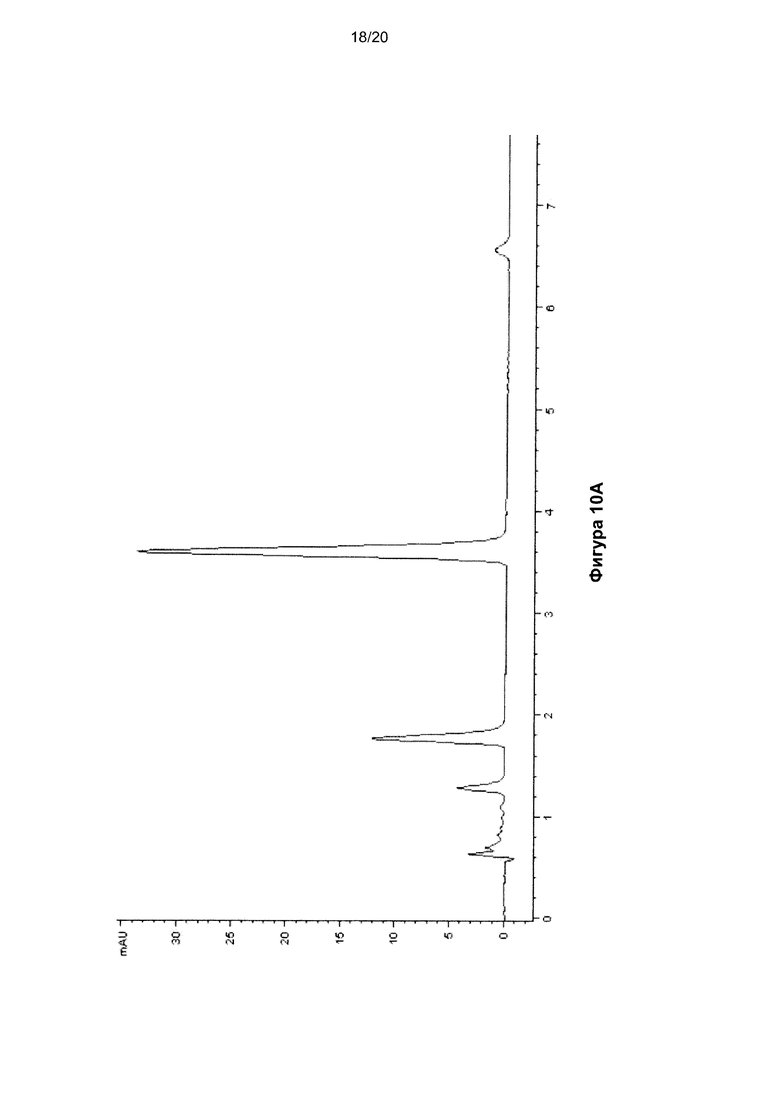
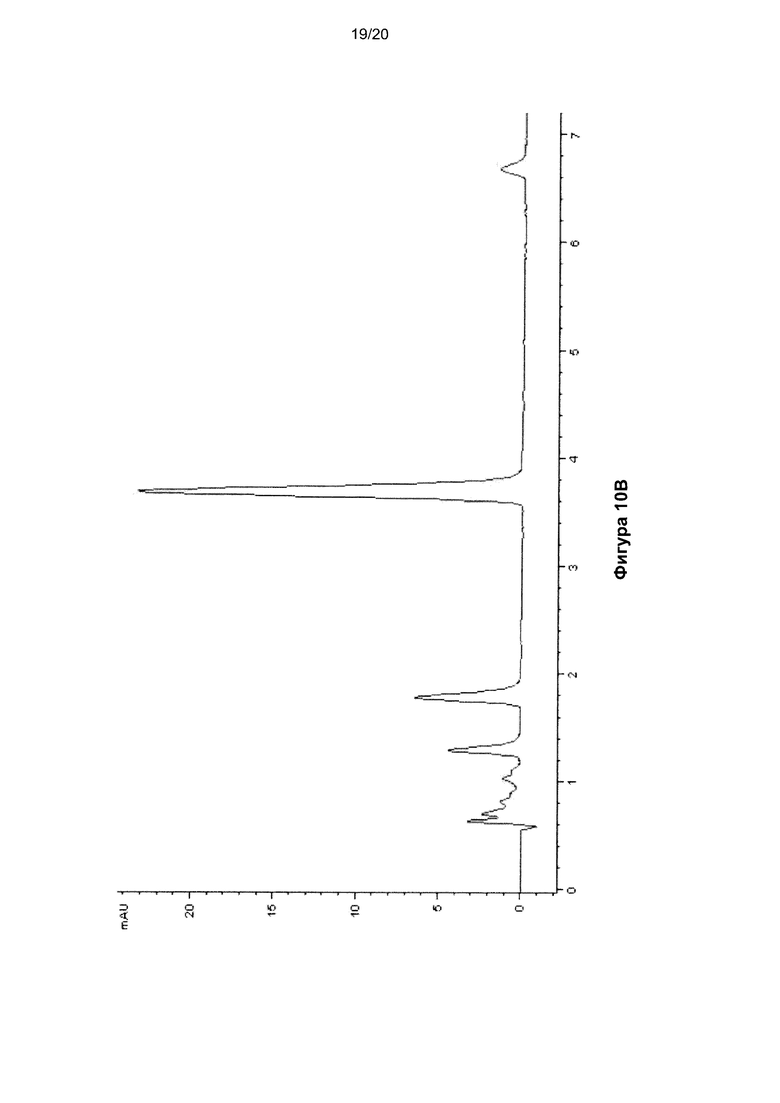

Группа изобретений относится к области биотехнологии, а именно к способам идентификации модифицированных остатков цитозина в исследуемой нуклеотидной последовательности. Обеспечивают популяцию полинуклеотидов, содержащих исследуемую нуклеотидную последовательность. Окисляют или восстанавливают первую часть указанной популяции, затем обрабатывают бисульфитом. Секвенируют полинуклеотиды в первой и второй частях популяции. Идентифицируют остаток в первой и второй нуклеотидных последовательностях, соответствующий остатку цитозина в исследуемой нуклеотидной последовательности. В частном варианте предложен способ идентификации 5-метилцитозина в исследуемой нуклеотидной последовательности. Осуществляют окисление популяции полинуклеотидов, обработку бисульфитом, секвенирование и идентификацию остатка в обработанной нуклеотидной последовательности. Присутствие цитозина в обработанной нуклеотидной последовательности указывает на наличие 5-метилцитозина в исследуемой нуклеотидной последовательности. Изобретения позволяют отличать остатки 5-метилцитозин, 5-гидроксиметилцитозин и 5-формилцитозин от цитозина с однонуклеотидным разрешением. Способы применимы ко всем платформам секвенирования и могут быть использованы при анализе геномной ДНК и/или РНК. 2 н. и 25 з.п. ф-лы, 5 табл., 11 ил.
1. Способ идентификации модифицированного остатка цитозина в исследуемой нуклеотидной последовательности, включающий следующие этапы:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) окисление или восстановление первой части указанной популяции,
(iii) обработку окисленной или восстановленной первой части указанной популяции и второй части указанной популяции бисульфитом,
(iv) секвенирование полинуклеотидов в первой и второй частях популяции после этапов ii) и iii) с получением первой и второй нуклеотидных последовательностей соответственно, и
(v) идентификацию остатка в первой и второй нуклеотидных последовательностях, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности.
2. Способ по п.1, отличающийся тем, что модифицированный цитозин представляет собой 5-метилцитозин, 5-гидроксиметилцитозин или 5-формилцитозин.
3. Способ по п.1, отличающийся тем, что первую часть указанной популяции окисляют на этапе (ii).
4. Способ по п.3, отличающийся тем, что указанное окисление обеспечивает селективное окисление остатков 5-гидроксиметилцитозина.
5. Способ по п.3, отличающийся тем, что этап (ii) включает множественные этапы окисления первой части популяции.
6. Способ по п.3, отличающийся тем, что указанную первую часть окисляют с использованием химического окислителя.
7. Способ по п.3, отличающийся тем, что указанную первую часть окисляют с использованием перрутенатного окислителя.
8. Способ по п.3, отличающийся тем, что указанную первую часть окисляют с использованием KRuO4.
9. Способ по п.3, отличающийся тем, что идентификация урацила в положении в первой нуклеотидной последовательности, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, и цитозина в том же положении во второй нуклеотидной последовательности указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-гидроксиметилцитозин.
10. Способ по п.3, отличающийся тем, что идентификация цитозина в положении в первой и во второй нуклеотидных последовательностях, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин.
11. Способ по п.3, отличающийся тем, что идентификация цитозина в положении в первой нуклеотидной последовательности, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин.
12. Способ по п.3, дополнительно включающий следующие этапы:
(vi) восстановление третьей части популяции полинуклеотидов, включающей исследуемую нуклеотидную последовательность,
(vii) обработку восстановленной третьей части указанной популяции бисульфитом,
(viii) секвенирование полинуклеотидов в третьей части после этапов (vi) и (vii) с получением третьей нуклеотидной последовательности, и
(ix) идентификацию остатка в третьей нуклеотидной последовательности, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности.
13. Способ по п.12, отличающийся тем, что идентификация урацила в положении в первой и второй нуклеотидных последовательностях, соответствующем остатку цитозина в исследуемой нуклеотидной последовательности, и цитозина в указанном положении в третьей нуклеотидной последовательности указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-формилцитозин.
14. Способ по п.1, отличающийся тем, что первую часть указанной популяции восстанавливают на этапе (ii).
15. Способ по п.14, отличающийся тем, что первую часть указанной популяции восстанавливают с использованием NaBH4.
16. Способ по п.14, отличающийся тем, что идентификация цитозина в положении в первой нуклеотидной последовательности, соответствующем цитозину в исследуемой нуклеотидной последовательности, и урацила в том же положении во второй нуклеотидной последовательности указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-формилцитозин.
17. Способ по п.14, отличающийся тем, что идентификация урацила в положении в первой и второй нуклеотидных последовательностях, соответствующем цитозину в исследуемой нуклеотидной последовательности, указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой немодифицированный цитозин.
18. Способ по п.12, дополнительно включающий:
обеспечение четвертой части популяции полинуклеотидов, включающих исследуемую нуклеотидную последовательность; и
секвенирование полинуклеотидов в указанной четвертой части популяции с получением исследуемой нуклеотидной последовательности.
19. Способ по п.1, отличающийся тем, что полинуклеотиды представляют собой геномную ДНК.
20. Способ по п.19, отличающийся тем, что геномная ДНК является геномной ДНК млекопитающего.
21. Способ по п.1, отличающийся тем, что полинуклеотиды представляют собой РНК.
22. Способ по п.21, отличающийся тем, что РНК является геномной РНК, мРНК, тРНК, рРНК или некодирующей РНК.
23. Способ по п.22, отличающийся тем, что геномная РНК является геномной РНК млекопитающего, растения или вируса.
24. Способ по п.18, отличающийся тем, что популяцию полинуклеотидов или одну или более из первой, второй, третьей и четвертой частей популяции иммобилизуют.
25. Способ по п.18, отличающийся тем, что одну или более из первой, второй, третьей и четвертой частей популяции амплифицируют перед секвенированием.
26. Способ по п.18, отличающийся тем, что одну или более из первой, второй, третьей частей популяции амплифицируют после обработки бисульфитом.
27. Способ идентификации 5-метилцитозина в исследуемой нуклеотидной последовательности, включающий следующие этапы:
(i) обеспечение популяции полинуклеотидов, содержащих исследуемую нуклеотидную последовательность,
(ii) окисление указанной популяции полинуклеотидов,
(iii) обработку окисленной популяции бисульфитом с получением окисленной, обработанной бисульфитом популяции полинуклеотидов,
(iv) секвенирование полинуклеотидов в окисленной, обработанной бисульфитом популяции с получением обработанной нуклеотидной последовательности, и
(v) идентификацию остатка в обработанной нуклеотидной последовательности, соответствующего остатку цитозина в исследуемой нуклеотидной последовательности,
причем присутствие цитозина в обработанной нуклеотидной последовательности указывает на то, что остаток цитозина в исследуемой нуклеотидной последовательности представляет собой 5-метилцитозин.
| WO 2011017760 A1, 17.02.2011 | |||
| СПОСОБ ОБНАРУЖЕНИЯ МЕТИЛИРОВАНИЯ ЦИТОЗИНА В ОБРАЗЦАХ ДНК | 2002 |
|
RU2332462C2 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ ВВЕДЕНИЯ СЕРНОЙ КИСЛОТЫ В МЕХАНИЧЕСКИЕ СУЛЬФАТНЫЕ ПЕЧИ | 1925 |
|
SU7028A1 |
| FLUSBERG B | |||
| A | |||
| ET AL: "Direct detection of DNA methylation during single-molecule, real-time sequencing", NATURE METHODS, NATURE PUBLISHING GROUP, 2010, v.7, no.6, p.461-465 | |||
| NOMURA A | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| GUPTA R | |||
| ET AL: "Advances in genome-wide DNA methylation analysis", BIOTECHNIQUES, 2010, v.49, no.4, p.iii-xi | |||
| WANUNU M | |||
| ET AL: "Discrimination of methylcytosine from hydroxymethylcytosine in DNA molecules", JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, 26.01.2011, v.133, no.3, p.486-492. | |||
Авторы
Даты
2017-03-13—Публикация
2012-07-27—Подача