Настоящее изобретение относится к бис-имин пиридиновым комплексам лантанидов.
В частности, настоящее изобретение относится к бис-имин пиридиновому комплексу лантанидов и их применению в каталитической системе для (со)полимеризации конъюгированных диенов.
Также настоящее изобретение относится к каталитической системе для (со)полимеризации конъюгированных диенов, содержащей указанный бис-имин пиридиновый комплекс лантанидов.
Дополнительно, настоящее изобретение относится к процессу (со)полимеризации конъюгированных диенов, в частности к способу полимеризации 1,3-бутадиена или изопропена, характеризующемуся тем, что его используют в указанной каталитической системе.
Известно, что стереоспецифическая (со)полимеризация конъюгированных диенов является очень важным процессом в химической промышленности для получения продуктов, которые представляют одни из самых широко используемых каучуков.
Например, известно, что 1,4-цис полибутадиен представляет синтетический эластомер, чьи свойства очень похожи на таковые натурального каучука. Для начала стереоспецифической полимеризации использовали множество каталитических систем для получения этого эластомера, как описано, например, Porri L. et al. в ((Comprehensive Polymer Science» (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol.4, Part II, p. 53-108.
Первая каталитическая система позволяет получить полибутадиен с содержанием 1,4-транс единиц в пределах от 70% до 90%, как описано в американском патенте US 3050513, и базируется на соединениях титана, содержащих йод, таких как, например, тетрайодид титана (TiI4), скомбинированных с гидридом алюминия, таким как, например, алюмогидрид лития, алюмогидрид натрия, алюгидрид калия, алюмогидрид рубидия, алюмогидрид цезия.
В этой области техники были предприняты усилия для получения каталитических систем, позволяющих получить полибутадиен с высоким содержанием 1,4-цис единиц.
Каталитические системы, позволяющие получить полибутадиен с содержанием 1,4-цис единиц, равным около 93%, описаны, например, W. Cooper в «The Stereo Rubbers» (1977), Ed. W. M. Saltman, Wiley, New York, p. 21 (catalytic system: AliBu3-TiI4); W. Marconi et al. в «Chimica Industriale» (1963), Vol. 45, p. 522 (catalytic system: AlEt3-AlEt2I-TiCl4); W. Marconi et al. в «Journal of Polymer Science» (1965), Part A, Vol. 3, p. 735 (catalytic system: AlHCl2⋅OEt2-TiCl4-AlI3).
Получение каталитических систем, характеризующихся более высокой стереоспецифичностью, позволяет получить полибутидиен с содержанием 1,4-цис единиц, равным около 96%, как описано, например, в отношении каталитических систем, содержащих кобальт, в итальянском патенте IT 592477 и Gippin M. et al. в «Industrial & Engineering Chemistry, Product Research and Development» (1962), Vol. 1(1), p. 32-39, в отношении каталитических систем, содержащих никель, Ueda et. al. в «Koogyo Kagaku Zasshi» (1963), Vol. 66, p. 1103, и Throckmorton et al. в «Rubber Chemistry and Technology» (1972), Vol. 45, p. 268-277.
Некоторые работы, относящиеся к применению каталитических систем, содержащих лантаниды для 1,4-цис полимеризации конъюгированных диенов, были опубликованы в первой половине шестидесятых.
Например, Saltman et al. в «Rubber Chemistry and Technology» (1973), Vol. 46, p. 1055 и в Throck-morton et al. в «Kautschuk und Gummi Kunstoffe» (1969), Vol. 22, p. 293, например, описано использование каталитических систем, содержащих церий. Однако эти каталитические системы вскоре перестали использовать из-за металлических остатков, остающихся в полимере, и вызывающих окисление самого полимера.
Применение каталитических систем, содержащих лантаниды, такие как, например неодим, празеодим и гадолиний, также известны, как описано, например, Hsieh H. L. et al. в «Rubber Chemistry and Technology» (1985), Vol. 58(1), p. 117-145. Полибутадиен, полученный при использовании этих каталитических систем, имеет содержание 1,4-цис единиц около 98%, обладает хорошей технологичностью и относительно широким распределением молекулярной массы.
Также известно применение каталитических систем, содержащих аллилы урана, позволяющих получение полибутадиена с очень высоким содержанием 1,4-цис единиц (то есть ≥99%), как описано, например, Lugli et al. в «Die Makromoleculare Chemie» (1974), Vol. 175, Issue 7, p. 2021-2027; De Chirico A. et al. в «Die Makromoleculare Chemie» (1974), Vol. 175, Issue 7, p. 2029-2038; Bruzzone M. et al. в «Rubber Chemistry and Technology» (1974), Vol. 47, p. 1175; Mazzei Α. в «Die Makromoleculare Chemie» (1981), Vol. 4, Issue Supplement 3, p. 61-72. Однако эти каталитические системы также перестали использовать из-за присутствия в полученных полимерах радиоактивных остатков.
Однако из приведенных выше документов выясняется, что применение каталитических систем, содержащих лантаниды, имеет преимущества в отношении применения катализаторов на основе титана, кобальта и никеля, ранее предложенных и применяемых в то время. В частности, каталитические системы, содержащие лантаниды, как указано выше, позволяют получить данные полимеры, в частности полибутадиен, с более высоким содержанием 1,4-цис единиц (≥97%), с более линейной структурой и, следовательно, более подходящих для получения шин, что представляет самое важное применение (около 80%) 1,4-цис полибутадиена. Дополнительно, указанные выше каталитические системы, содержащие лантаниды, не имеют катионной активности, и оказалось, что имеют более высокую активность при использовании в полимеризации в растворе в присутствии алифатических растворителей по сравнению с ароматическими растворителями, как описано, например, Ricci G. et al. в «Die Makromoleculare Chemie», Rapid Communications, (1986), Vol. 7, p. 335.
В дальнейшем были проведены исследования, целью которых являлся поиск новых каталитических систем, содержащих лантаниды, и/или улучшение каталитической активности уже известных каталитических систем.
В частности, исследования проводили главным образом на каталитических системах, содержавших неодим, поскольку эти каталитические системы имели более высокую каталитическую активность по сравнению с уже известными каталитическими системами, содержащими другие лантаниды, и они позволяют получить полимеры, которые после вулканизации имели более высокую устойчивость к старению по сравнению с полимерами, полученными при использовании каталитических систем, содержащих титан, кобальт и никель. Дополнительно, эти исследования также поддерживались широкой доступностью при низкой цене предшественников, включая неодим.
Например, в европейском патенте ЕР 0 076 535 описывается усовершенствованный способ (со)полимеризации конъюгированных диолефинов, включающий использование определенной каталитической системы, включающей по меньшей мере одно соединение металла, выбранное из таковых группы III в периодической таблице с атомным номером от 21 до 103, предпочтительно неодим, производное органического галида и металлоорганическое соединение, содержащее алюминий, такое как, например, гидрид алкил-алюминия или гидрид триалкил-алюминия. Указанный способ позволяет получить (со)полимеры с высоким содержанием 1,4-цис единиц (≥98%) и высокой линейностью.
В американском патенте US 4242232 описывается катализатор, содержащий (а) реакционную смесь, полученную в результате реагирования карбоксилата металла с атомным номером в пределах от 57 до 71, такого как, например, лантан, церий, празеодим, неодим с три-алкилом алюминия, (b) алкилом алюминия и/или гидридом алкила-алюминия и (с) кислотой Льюиса. Полибутадиен, полученный при использовании указанного катализатора, имеет содержание 1,4-цис единиц в пределах от 80% до 99%.
В своей простейшей форме каталитические системы, содержащие неодим, получают при использовании реакции между трихлоридом неодима как таковым или в виде комплекса с донорами (например, спирты, простые эфиры, трибутилфосфат, алкилсульфоксиды, амиды, пиридин) и триалкил алюминием (например, триизобутил алюминия, триэтил алюминия, триметил алюминия); в таком случае они представляют бинарные каталитические системы. Указанные бинарные каталитические системы описаны, например, Yang J. H. et al. в «Macromolecules» (1982), Vol. 15(2), p. 230-233; Porri L. et al. в «Macromolecular Symposia» (1998), Vol. 128, Issue 1, p. 53-61.
В качестве альтернативы, хлорид неодима может быть получен при проведении реакции соединения неодима (например, алкоголят, карбоксилат) с донором хлора (например, диэтилалюминий хлорид, этилалюминий дихлорид, триэтилбис-алюминий трихлорид, t-бутилхлорид) и последующей реакцией с алкилом алюминия или триалкилом алюминия; в таком случае они представляют тернарные каталитические системы. Указанные тернарные каталитические системы описаны, например,: Cabassi F. et al. в «Transition Metal Catalyzed Polymerizations» (1988), Quirk R. P. Ed., Cambridge University Press, MA, USA, p. 655-670; Ricci G. et al. в «Polymer Communications Guilford» (1987), Vol. 28, Issue 8, p. 223-226; или в итальянском патенте IT 1197465.
Порядок добавления компонентов (донор хлора, алкил алюминия или триалкил алюминия) к соединению неодима может быть очень важен для природы получаемой каталитической системы. При добавлении первым гидрида алкил-алюминия или триалкила-алюминия и только затем донора хлора фактически получают гомогенные катализаторы; и наоборот, когда донор хлора добавляют перед гидридом алкил-алюминия или триалкила-алюминия, получают гетерогенные системы, как указано, например, Porri et al. в «ACS Symposium Series» (2000), Vol. 749, Chapter 2, p. 15-30. Порядок добавления указанных выше компонентов также является решающим для каталитической активности и поли дисперсности получаемых в результате полимеров.
Однако в указанных выше бинарных и тернарных каталитических системах процент каталитически активного неодима относительно низкий, в норме в пределах от 7% до 8% (указанный процент относится к молярному проценту активного неодима по сравнению с общими молями использованного неодима, как указано, например, Marina N. G. et al. в «Doklady Akademii Nauk SSSR» (1982), Vol. 265, p. 1431-1433.
Гораздо более активны тернарные каталитические системы, содержащие более высокий процент каталитически активного неодима, полученные при проведении реакции между аллильными соединениями неодима, полученными реакцией между комплексом хлорида неодима с тетрогидрофураном (THF) и аллилом Гриньяра, и алкилом алюминия [например, триалкил-алюминия, метилалюмоксан (МАО), тетра-изобутилалюмоксан (TIBAO)], как указано, например, в итальянском патенте IT 1,228,442; или: Porri L. et al. в «Macromolecular Symposia» (1993), Vol. 66, p. 231-244; Porri L. et al. в «Polymer Preprints», «American Chemical Society Division Polymer Chemistry» (1998), Vol. 39, p. 214-215; Porri L. в «Recent developments in Lanthanide catalysts for 1,3-diene polymerization», в «ACS Symposium Series 749 - Olefin Polymerization: Emerging Frontiers» (2000), P. Arjunan, J. C. McGrath and T. Hanlon Eds., Oxford University Press, USA, p. 15-30. Указанные тернарные каталитические системы обеспечивают полибутадиен с более низкой полидисперсностью, чем у таковых, полученных при использовании указанных выше классических тернарных каталитических систем. Дополнительно, указанные тернарные каталитические системы также позволяют получить полиизопрен и/или другие полимеры, получаемые при (со)полимеризации замещенных бутадиенов, обеспечивая (со)полимеры с высоким содержанием 1,4-цис единиц (то есть содержание ≥90%). В частности, полимер, получаемый при полимеризации изопрена, имеющий содержание 1,4-цис единиц равное около 94%, может быть преимущественно использован для получения эластомерных смесей для получения шин.
Как указано выше, из-за того факта, что (со)полимеры конъюгированных диенов, в частности полибутадиен и полиизопрен, с высоким содержанием 1,4-цис единиц представляют полимеры самого широкого использования в промышленности, в частности для получения шин, все еще представляет большой интерес поиск новых каталитических систем, обеспечивающих указанные (со)полимеры.
Заявитель столкнулся с проблемой поиска нового бис-имин пиридинового комплекса лантанидов, который может быть использован в каталитической системе, позволяющей получить (со)полимеры конъюгированных диенов, в частности, полибутадиен и полиизопрен, линейный или разветвленный с высоким содержанием 1,4-цис единиц, то есть, содержание 1,4-цис единиц ≥99% в случае полибутадиена, и ≥98% в случае полиизопрена. Дополнительно, указанный полиизопрен имеет температуру стеклования (Tg) аналогичную таковой у натурального каучука.
Объект настоящего изобретения относится к бис-имин пиридиновому комплексу лантанидов с общей формулой (I):
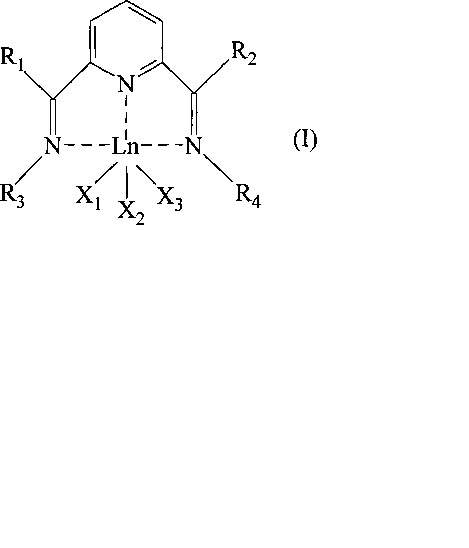
где:
- Ln представляет металл ряда лантанидов, предпочтительно выбранный из неодима (Nd), лантана (La), празеодима (Pr), гадолиния (Gd), европия (Eu), тербия (Tb), самария (Sm), эрбия (Er), иттербия (Yb);
- R1 и R2 одинаковые или отличаются друг от друга и представляют атом водорода; или их выбирают из линейных или разветвленных С1-С20, предпочтительно С1-C15 алкильных групп, необязательно замещенных циклоалкильных групп, необязательно замещенных арильных групп;
- R3 и R4 одинаковые или отличаются друг от друга и представляют атом водорода; или их выбирают из линейных или разветвленных С1-С20, предпочтительно C1-С15 алкильных групп, необязательно замещенных циклоалкильных групп, необязательно замещенных арильных групп;
- или R2 и R4 необязательно могут быть связаны друг с другом с образованием вместе с другими атомами, с которыми они связаны, насыщенного, ненасыщенного или ароматического цикла, содержащего от 3 до 6 атомов углерода, необязательно замещенных линейными или разветвленными С1-С20, предпочтительно С1-C15 алкильными группами, указанный цикл необязательно содержит другие гетероатомы, такие как, например, кислород, сера, азот, кремний, фосфор, селен;
- или R1 и R3 необязательно могут быть связаны друг с другом с образованием вместе с другими атомами, с которыми они связаны, насыщенного, ненасыщенного или ароматического цикла, содержащего от 3 до 6 атомов углерода, необязательно замещенных линейными или разветвленными С1-С20, предпочтительно C1-С15 алкильными группами, указанный цикл необязательно содержит другие гетероатомы, такие как, например, кислород, сера, азот, кремний, фосфор, селен;
- X1, X2 и X3 одинаковые или отличаются друг от друга, представляют атом галогена, такой как, например, хлор, бром, йод; или их выбирают из линейных или разветвленных С1-С20, предпочтительно C1-С15 алкильных групп, -OCOR5 или -OR5 групп, где R5 выбирают из линейных или разветвленных С1-С20, предпочтительно C1-С15 алкильных групп.
Для целей настоящего изобретения приведенные в описании настоящей патентной заявки и приложенной формуле изобретения определения числовых интервалов всегда включают крайние значения, если не указано иное.
Для целей настоящего изобретения приведенный в описании настоящей патентной заявки и приложенной формуле изобретения используемый термин «металл, принадлежащий к группе лантанидов» относится к любому металлу, принадлежащему в периодической таблице элементов к элементам с атомным номером в пределах от 57 до 71.
Следует отметить, что для целей настоящего изобретения приведенный в описании настоящей патентной заявки и приложенной формуле изобретения термин «Периодическая таблица элементов» относится к версии IUPAC «Периодической системы элементов» от 22 июня 2007, доступной на следующем вебсайте в интернете www.iupac.org/reports/periodic_table.
Используемый в описании настоящей патентной заявки термин «С1-С20 алкильные группы» относится к линейным или разветвленным алкильным группам, имеющим от 1 до 20 атомов углерода. Конкретные примеры С1-С20 алкильных групп представляют: метил, этил, n-пропил, изопропил, n-бутил, сек-бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, n-нонил, n-децил, 2-бутилоктил, 5-метилгексил, 4-этилгексил, 2-этилгептил, 2-этилгексил.
Используемый в описании настоящей патентной заявки термин «циклоалкильные группы» относится к циклоалкильным группам, имеющим от 3 до 30 атомов углерода. Указанные циклоалкильные группы необязательно могут быть замещены одной или более группой, одинаковой или отличающейся друг от друга, выбираемой из атомов галогенов; гидроксильных групп; С1-С12 алкильных групп; С1-С12 алкоксильных групп; цианогрупп; аминогрупп; нитрогрупп. Конкретные примеры циклоалкильных групп представляют: циклопропил, 2,2-дифторциклопропил, циклобутил, циклопентил, циклогексил, гексаметил-циклогексил, пентаметил-циклопентил, 2-циклооктилэтил, метилциклогексил, метоксициклогексил, фторциклогексил, фенилциклогексил.
Используемый в описании настоящей патентной заявки термин «арильные группы» относится к ароматическим карбоциклическим группам. Указанные ароматические карбоциклические группы необязательно могут быть замещены одной или более группой, одинаковой или отличающейся друг от друга, выбираемой из атомов галогенов, таких как, например, фтор, хлор, бром, предпочтительно фтор; гидроксильных групп; C1-C12 алкильных групп; С1-С12 алкоксильных групп; цианогрупп; аминогрупп; нитрогрупп. Конкретные примеры арильных групп представляют: фенил, метилфенил, триметилфенил, метоксифенил, гидроксифенил, фенилоксифенил, фторфенил, пентафторфенил, хлорфенил, бромфенил, нитрофенил, диметиламинофенил, нафтил, фенилнафтил, фенантрен, антрацен.
Используемый в описании настоящей патентной заявки термин «цикло» относится к системе, содержащей кольцо от 3 до 6 атомов углерода, необязательно содержащее дополнительно к атому азота другие гетероатомы, выбираемые из азота, кислорода, серы, кремния, селена, фосфора. Конкретные примеры цикло представляют: пиридин, тиадиазол.
Согласно предпочтительному варианту воплощения настоящего изобретения в указанном бис-имин пиридиновом комплексе лантанидов с общей формулой (I):
- Ln представляет неодим (Nd), празеодим (Pr), гадолиний (Gd), лантан (La), предпочтительно неодим (Nd);
- R1 и R2, одинаковые друг с другом и представляют атом водорода; или их выбирают из линейных или разветвленных С1-С20 алкильных групп, и предпочтительно представляют метальную группу; или их выбирают из необязательно замещенных циклоалкильных групп;
- R3 и R4 одинаковые или отличаются друг от друга и их выбирают из необязательно замещенных фенильных групп, или их выбирают из необязательно замещенных циклоалкильных групп;
- Χ1, Х2 и Х3 одинаковые друг с другом и представляют атом галогена, такой как, например, хлор, бром, йод, предпочтительно хлор.
Бис-имин пиридиновый комплекс лантанидов с общей формулой (I) по настоящему изобретению представляет любую физическую форму, такую как, например, выделенная и очищенная твердая форма, форма, растворенная подходящим растворителем, или нанесенная на подходящие органические или неорганические твердые вещества, предпочтительно имеющие физическую гранулярную или порошкообразную форму.
Бис-имин пиридиновый комплекс лантанидов с общей формулой (I) получают, начиная с лигандов, известных из предшествующего уровня техники.
Конкретные примеры лигандов, которые могут быть использованы для целей настоящего изобретения, представляют таковые со следующими формулами (L1)-(L8):
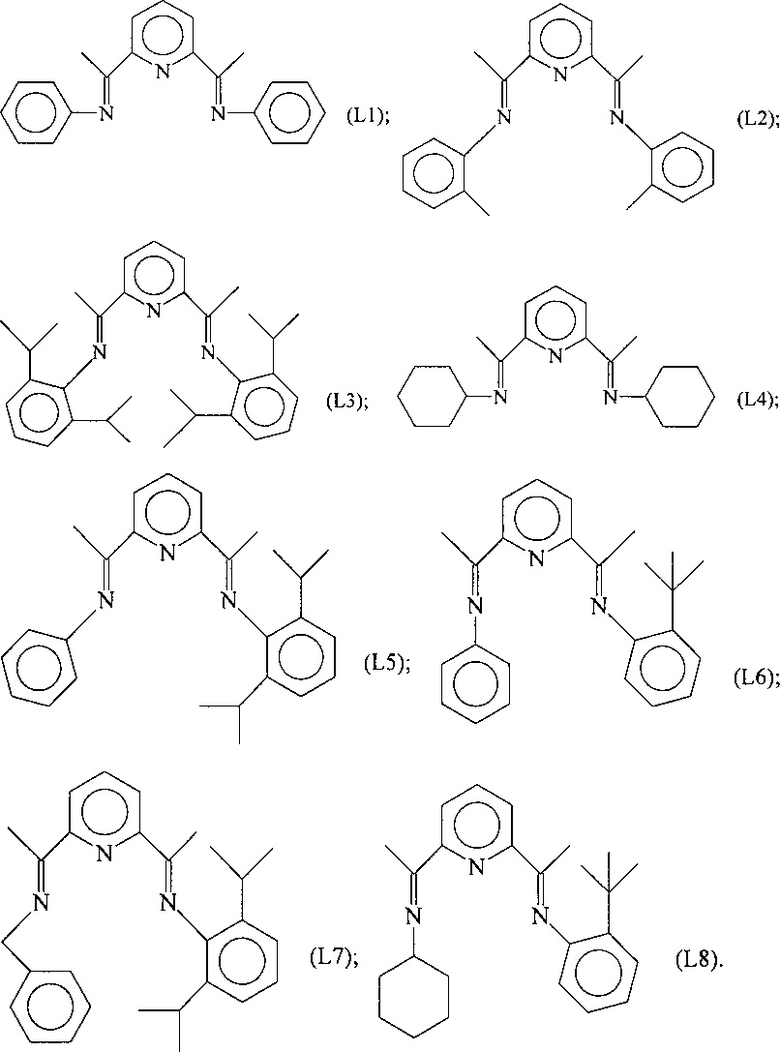
Указанные лиганды с формулами (L1)-(L8) могут быть получены при использовании процессов, известных из предшествующего уровня техники. Указанные лиганды с формулами (L1)-(L8) могут быть получены, например, при использовании реакции конденсации между первичными аминами и дикетонами, как указано, например, в международной патентной заявке WO 2002/10133 и WO 2002/34701.
Бис-имин пиридиновый комплекс лантанидов с общей формулой (I) может быть получен согласно процессам, известным из предшествующего уровня техники для получения аналогичных комплексов из других металлов, таких как, например, кобальт, никель. Указанный бис-имин пиридиновый комплекс лантанидов может быть получен, например, при использовании реакции между соединениями лантанидов с общей формулой Ln(X)3, где Ln и X имеют те же указанные выше значения, как таковые, или в комплексе с простыми эфирами [например, простой диэтиловый эфир, тетрагидрофуран (THF), диметоксиэтан], и лигандами, имеющими указанные выше формулы (L1)-(L8), в молярном соотношении лиганд (L)/лантанид (Ln) в пределах от 1 до 1,5, предпочтительно работающих в присутствии по меньшей мере одного эфирного растворителя [например, тетрагидрофуран (THF)], при комнатной температуре или выше. Полученный, таким образом, бис-имин пиридиновый комплекс лантанидов может быть затем удален при использовании способов, известных из предшествующего уровня техники, таких как, например, осаждение при использовании осадителя (например, пентана) с последующим отделением фильтрацией или декантированием и необязательно последующим растворением в подходящем растворителе с последующей низкотемпературной кристаллизацией.
Для целей настоящего изобретения используемый в описании настоящей патентной заявки термин «комнатная температура» относится к температуре в пределах от 20°С до 25°С.
Как указано выше, настоящее изобретение также относится к каталитической системе для (со)полимеризации конъюгированных диенов, содержащей указанный бис-имин пиридиновый комплекс лантанидов с общей формулой (I).
Следовательно, другой объект настоящего изобретения относится к каталитической системе для (со)полимеризации конъюгированных диенов, содержащей:
(a) по меньшей мере один бис-имин пиридиновый комплекс лантанидов с общей формулой (I);
(b) по меньшей мере один сокатализатор, выбираемый из:
(b1) алкилов алюминия с общей формулой (II)
Al(X')n(R6)3-n (II),
где X' представляет атом галогена, такой как, например, хлор, бром, йод, фтор; R6 выбирают из линейных или разветвленных С1-С20 алкильных групп, C3-С20 циклоалкильных групп, арильных групп, указанные группы необязательно замещены одним или более атомом кремния или германия; и n представляет целое число от 0 до 2;
(b2) алюмоксаны с общей формулой (III):
(R7)2-Al-O-[-Al(R8)-O-]p-Al-(R9)2 (III),
где R7, R8 и R9 одинаковые или отличаются друг от друга и представляют атом водорода, атом галогена, такой как, например, хлор, бром, йод, фтор; или их выбирают из линейных или разветвленных С1-С20 алкильных групп, C3-С20 циклоалкильных групп, арильных групп, указанные группы необязательно замещены одним или более атомом кремния или германия; и p представляет целое число от 0 до 1000;
(b3) соединения с общей формулой (IV):
D+E- (IV),
где D+ представляет кислоту Брэнстеда, отдающую протон и необратимо реагирующую с заместителем X бис-имин пиридинового комплекса лантанидов с общей формулой (I); Е- представляет совместимый анион, способный стабилизировать активные каталитические частицы, полученные при использовании реакции двух компонентов, и которые достаточно подвижны, чтобы быть удаленными олефиновым мономером, предпочтительно атом брома, еще более предпочтительно анион имеет формулу B(Ar)4(-), где заместители Ar одинаковые или отличаются друг от друга и выбраны из арильных групп, таких как, например, фенил, пентафторфенил, бис(трифторметил)фенил.
Конкретные примеры алкилов алюминия (b1), которые по существу используют для целей настоящего изобретения, представляют: три-метил-алюминий, три-(2,3,3-три-метил-бутил)-алюминий, три-(2,3-ди-метил-гексил)-алюминий, три-(2,3-ди-метил-бутил)-алюминий, три-(2,3-ди-метил-фенил)-алюминий, три-(2,3-ди-метил-гептил)-алюминий, три-(2-метил-3-этил-пентил)-алюминий, три-(2-метил-3-этил-гексил)-алюминий, три-(2-метил-этил-гептил)-алюминий, три-(2-метил-3-пропил-гексил)-алюминий, три-этил-алюминий, три-(2-этил-3-метил-бутил)-алюминий, три-(2-этил-3-метил-пентил)-алюминий, три-(2,3-ди-этил-пентил-алюминий), три-n-пропил-алюминий, три-изо-пропил-алюминий, три-(2-пропил-3-метил-бутил)-алюминий, три-(2-изо-пропил-3-метил-бутил)-алюминий, три-n-бутил-алюминий, три-изо-бутил-алюминий (TIBA), три-трет-бутил-алюминий, три-(2-изо-бутил-3-метил-пентил)-алюминий, три-(2,3,3-три-метил-пентил)-алюминий, три-(2,3,3-три-метил-гексил)-алюминий, три-(2-этил-3,3-ди-метил-бутил)-алюминий, три-(2-этил-3,3-ди-метил-пентил)-алюминий, три-(2-изо-пропил-3,3-диметил-бутил)-алюминий, три-(2-три-метилсилил-пропил)-алюминий, три-2-метил-3-фенил-бутил)-алюминий, три-(2-этил-3-фенил-бутил)-алюминий, три-(2,3-ди-метил-3-фенил-бутил)-алюминий, три-(2-фенил-пропил)-алюминий, три-[2-(4-фтор-фенил)-пропил]-алюминий, три-[2-(4-хлор-фенил)-пропил]-алюминий, три-[2-(3-изо-пропил-фенил-три-(2-фенил-бутил)-алюминий, три-(3-метил-2-фенил-бутил)-алюминий, три-(2-фенил-пентил)-алюминий, три-[2-(пента-фтор-фенил)-пропил]-алюминий, три-(2,2-дифенил-этил]-алюминий, три-(2-фенил-метил-пропил)-алюминий, три-пентил-алюминий, три-гексил-алюминий, три-циклогексил-алюминий, три-октил-алюминий, ди-этил-алюминий гидрид, ди-n-пропил-алюминий гидрид, ди-n-бутил-алюминий гидрид, ди-изо-бутил-алюминий гидрид (DIBAH), ди-гексил алюминий гидрид, ди-изо-гексил-алюминий гидрид, ди-октил-алюминий гидрид, ди-изо-октил-алюминий гидрид, этил-алюминий ди-гидрид, n-пропил-алюминий ди-гидрид, изо-бутил-алюминий ди-гидрид, ди-этил-алюминий хлорид, моно-этил-алюминий дихлорид, ди-метил-алюминий хлорид, ди-изобутил-алюминий хлорид, изо-бутил-алюминий дихлорид, этил-алюминий сесквихлорид и также соответствующие соединения, в которых один из углеводородных заместителей замещен атомом водорода, и таковые, в которых один или два углеводородных заместителя замещены изобутиловой группой. По существу предпочтительными являются триизобутилалюминий (TIBA), диизобутилалюминий гидрид (DIBAH).
Конкретные примеры алюмоксанов (b2), которые по существу используют для целей настоящего изобретения, представляют: метилалюмоксан (МАО), этил-алюмоксан, n-бутил-алюмоксан, тетра-изо-бутил-алюмоксан (ΤΙ-BAO), трет-бутил-алюмоксан, тетра-(2,4,4-три-метил-пентил)-алюмоксан (TIOAO), тетра-(2,3-ди-метил-бутил)-алюмоксан (TDMBAO), тетра-(2,3,3-три-метил-бутил)-алюмоксан (ТТМВАО). По существу предпочтительными являются метилалюмоксан (МАО), тетра-изо-бутил-алюмоксан (TIBAO). Указанные алюмоксаны могут быть получены при использовании процессов, известных из предшествующего уровня техники. Указанные алюмоксаны могут быть получены при использовании, например, реакции по меньшей мере одного три-алкил-алюминия или по меньшей мере одного ди-алкилалюминия монохлорида с водой или с солью, содержащей кристаллизационную воду, такой как, например, пентагидрат сульфата меди, алюминий сульфат гексадекагидрат в присутствии по меньшей мере одного органического растворителя, такого как, например, бензол, толуол, ксилол.
Конкретные примеры соединений (b3) с общей формулой (IV), которые по существу используют для целей настоящего изобретения, представляют: тетракис-пентафторфенил-борат, трибутиламмоний-тетракис-пентафторфенил-алюминат, трибутиламмоний-тетракис-[(3,5-ди-(трифторфенил)]-борат, трибутиламмоний-тетракис-(4-фторфенил)]-борат, Ν,Ν-диметилбензил-аммоний-тетракис пентафторфенил-борат, Ν,Ν-ди-метил-гексиламмоний-тетракис-пентафторфенил-борат, Ν,Ν-диметиланилин-тетракис-(пентафторфенил)-борат, N,N-диметиланилин-тетракис-(пентафторфенил)-алюминат, ди-(пропил)-аммоний-тетракис-(пентафторфенил)-борат), ди-(циклогексил)-аммоний-тетракис-(пентафторфенил)-борат, три-фенил-карбений-тетракис-(пентафторфенил)-борат, три-фенилкарбений-тетракис-(пентафторфенил)-алюминат. Предпочтительным является тетракис-пентафторфенил-борат.
В качестве альтернативы, соединения (b3) могут быть выбраны из соединений с формулой В(Ar)3; где Ar имеет те же значения, указанные выше; или из соединений с формулой В(Ar)3Р, где Ar имеет те же значения, указанные выше, а Ρ представляет необязательно замещенный пирроловый радикал.
Дополнительная информация, относящаяся к алкилам алюминия (b1), алюмоксанам (b2) и соединениям (b3), может быть найдена в международной патентной заявке WO 2011/061151.
Для целей настоящего изобретения используемые в описании настоящей патентной заявки термины «моли» и «молярное соотношение» относятся к соединениям, состоящим из молекул, и также относятся к атомам и ионам, опуская для последнего термины грамм-атом или атомное соотношение, даже если это научно правильнее.
Согласно предпочтительному варианту воплощения настоящего изобретения в указанной каталитической системе молярное соотношение между ланатанидами, присутствующими в бис-имин пиридиновом комплексе лантанидов с общей формулой (I), и алюминием, присутствующим в сокаталтизаторе (b), выбираемом из алкилов алюминия (b1) или алюмоксанов (b2), может составлять в пределах от 5 до 5000, предпочтительно от 10 до 1000.
Согласно предпочтительному варианту воплощения настоящего изобретения в указанной каталитической системе молярное соотношение между ланатанидами, присутствующими в бис-имин пиридиновом комплексе лантанидов с общей формулой (I), и бором, присутствующим в сокаталтизаторе (b), выбранном из соединений (b3) с общей формулой (IV), может составлять в пределах от 0,1 до 15, предпочтительно от 0,5 до 10.
Для целей настоящего изобретения в указанную выше каталитическую систему необязательно могут быть добавлены другие добавки или компоненты для того, чтобы привести в соответствие со специфическими практическими требованиями. Следовательно, полученные, таким образом, каталитические системы должны рассматриваться как входящие в объем притязаний настоящего изобретения. Добавки и/или компоненты, которые могут быть добавлены при получении и/или образованы каталитической системой, являющейся объектом настоящего изобретения, представляют, например, инертные растворители, такие как, например, алифатические и/или ароматические простые эфиры; слабо коардинирующие добавки (например, основание по Льюису), которые выбирают, например, из не полимеризуемых олефинов; пространственно затрудненных или электронно обедненных простых эфиров; галогенирующих агентов, таких как, например, галиды кремния, галогенированные углеводороды, предпочтительно хлорированные; или их смеси.
Указанная каталитическая система может быть получена согласно способам, известным из предшествующего уровня техники.
Указанная каталитическая система может быть, например, получена отдельно (предварительно) и затем введена в (со)полимеризуемую среду. В связи с этим указанная каталитическая система может быть получена реакцией по меньшей мере одного бис-имин пиридинового комплекса лантанидов с общей формулой (I) по меньшей мере с одним сокатализатором (b), необязательно в присутствии других добавок или компонентов, выбираемых из приведенных выше, в присутствии растворителя, такого как, например, толуол, гептан, при температуре в пределах от 20°C до 60°C в течение периода времени от 10 секунд до 10 часов, предпочтительно от 30 секунд до 5 часов. Более детальная информация по получению указанной каталитической системы может быть найдена в приведенных ниже Примерах.
В качестве альтернативы, указанная каталитическая система может быть получена in situ, то есть непосредственно в среде (со)полимеризации. В связи с этим указанная каталитическая система может быть получена введением бис-имин пиридинового комплекса лантанидов (а) с общей формулой (I), сокатализатора (b) и выбранного заранее (со)полимеризуемого конъюгированного диена(ов) по отдельности при условиях (со)полимеризации.
Для целей настоящего изобретения указанные выше каталитические системы также могут быть нанесены на подложку из инертных твердых веществ, предпочтительно состоящих из оксидов кремния и/или алюминия, таких как, например, силикагель, окись алюминия или кремниевые алюминаты. Известные технологии нанесения на подложку могут быть использованы для нанесения на подложку указанных каталитических систем, как правило, включающих контакт в подходящей инертной жидкой среде между носителем, необязательно активированным нагреванием до температуры более чем 200°C, и одним или обоими компонентами (а) и (b) каталитической системы, являющейся объектом настоящего изобретения. Для целей настоящего изобретения нет необходимости, чтобы оба компонента были нанесены на подложку, поскольку на поверхности носителя могут присутствовать бис-имин пиридиновый комплекс лантанидов (а) с общей формулой (I) или только сокатализатор (b). В последнем случае компонент, отсутствующий на поверхности, затем вступает в контакт с компонентом, нанесенном на подложку, в момент, в который катализатор активен для проведения полимеризации.
Также настоящее изобретение относится к способу (со)полимеризации конъюгированных диенов, характеризующемуся тем, что его используют в указанной каталитической системе.
Количество бис-имин пиридинового комплекса лантанидов (а) с общей формулой (I) и сокатализатора (b), которое может быть использовано при (со)полимеризации конъюгированных диенов, варьирует согласно проводимому процессу (со)полимеризации. В любом случае указанное количество составляет такое, которое позволяет получить молярное соотношение между лантанидами, присутствующими в бис-имин пиридиновом комплексе лантанидов (а) с общей формулой (I), и металлом, присутствующим в сокатализаторе (b), то есть алюминием, когда сокатализатор (b) выбирают из алкилов алюминия (b1) или алюмоксанов (b2), бором, когда сокатализатор (b) выбирают из соединений (b3) с общей формулой (IV), находящееся в пределах приведенных выше значений.
Конкретные примеры конъюгированных диенов, которые могут быть (со)полимеризованы при использовании каталитической системы по настоящему изобретению, представляют: 1,3-бутадиен, 2-метил-1,3-бутадиен (изопрен), 2,3-диметил-1,3-бутадиен, 1,3-пентадиен, 1,3-гексадиен, цикло-1,3-гексадиен. Предпочтительные (со)полимеризуемые конъюгированные диены представляют 1,3-бутадиен, изопрен. Указанные выше (со)полимеризуемые конъюгированные диены могут быть использованы как таковые или в смеси из двух или более диенов. В последнем случае, то есть при использовании смеси двух или более диенов, получают сополимер.
Согласно по существу предпочтительному варианту воплощения настоящего изобретения настоящее изобретение относится к процессу полимеризации 1,3-бутадиена или изопрена, характеризующемуся тем, что в нем используют указанную каталитическую систему.
Указанную (со)полимеризацию, как правило, проводят в присутствии полимеризационного растворителя, как правило, выбираемого из инертных органических растворителей, таких как, например, насыщенные алифатические углеводороды, такие как, например, бутан, пентан, гексан, гептан или их смеси; насыщенных циклоалифатических углеводородов, таких как, например, циклопентан, циклогексан или их смеси; моноолефинов, таких как, например, 1-бутен, 2-бутен или их смеси; ароматических углеводородов, таких как, например, бензол, толулол, ксилол или их смеси; галогенированных углеводородов, таких как, например, метилен хлорид, хлороформ, тетрахлорид углерода, трихлорэтилен, перхлорэтилен, 1,2-дихлорэтан, хлорбензол, бромбензол, хлортолуол; или их смесей. Предпочтительно (со)полимеризационный растворитель выбирают из насыщенных алифатических углеводородов.
В качестве альтернативы, указанная (со)полимеризация может быть проведена при использовании в качестве (со)полимеризационного растворителя того же самого (со)полимеризуемого конъюгированного диена(ов) согласно способу, известному как «процесс в массе».
Концентрация (со)полимеризуемого конъюгированного диена в указанном (со)полимеризационном растворителе, как правило, составляет в пределах от 5% по массе до 50% по массе, предпочтительно от 10% по массе до 20% по массе от общей массы смеси конъюгированный диен/растворитель.
Как правило, указанная (со)полимеризация может быть проведена при температуре в пределах от -70°C до +100°C, предпочтительно от -20°С до +80°С.
Что касается давления, то предпочтительно работать при давлении (со)полимеризуемых компонентов смеси.
Указанная (со)полимеризация может быть проведена, как непрерывно, так и периодически.
Как указано выше, использование бис-имин пиридинового комплекса лантанидов с общей формулой (I) позволяет получать (со)полимеры конъюгированных диенов, в частности, линейный или разветвленный полибутадиен и полиизопрен с высоким содержанием 1,4-цис единиц, то есть содержание 1,4-цис единиц ≥99% в случае полибутадиена, и ≥98% в случае полиизопрена.
Ниже для лучшего понимания настоящего изобретения и его практического воплощения приведены некоторые иллюстрирующие неограничивающие примеры.
ПРИМЕРЫ
Реагенты и материалы
Реагенты и материалы, используемые в следующих примерах настоящего изобретения, приведены в следующем списке вместе с другой необязательной предварительной обработкой и их поставщиками:
- анилин (Aldrich): дистиллированный перед использованием;
- комплекс неодим трихлорид/тетрагидрофуран [NdCl3 (2THF)]: полученный экстракцией неодима трихлорида (NdCl3) (Strem Chemicals) с тетрагидрофураном (THF) в точке кипения, как указано Yang J. H. et al. в «Macromolecules» (1982), Vol. 15(2), p. 230-233;
- тетрагидрофуран (THF) (Carlo Erba, RPE): выдерживали при температуре дефлегмации калия/бензофенона и затем дистиллировали в атмосфере азота;
- метанол (Carlo Erba, RPE): используют как таковой;
- этанол (Carlo Erba, RPE): используют как таковой;
- изопропиловый спирт (Carlo Erba, RPE): используют как таковой;
- муравьиная кислота (85%) (Carlo Erba, RPE): используют как таковую;
- о-толуидин (Aldrich): используют как таковой;
- 2-трет-бутиланилин (Aldrich): используют как таковой;
- 2,4,6-триметиланилин (Aldrich): используют как таковой;
- 2,6-ди-изопропиланилин (Aldrich): используют как таковой;
- циклогексиламин (Aldrich): используют как таковой;
- бензамин (Aldrich): используют как таковой;
- 2,6-ди-ацетилпиридин (Aldrich): используют как таковой;
- безводная уксусная кислота (Aldrich): используют как таковую;
- толуол (Aldrich): чистый, ≥99,5%, дистиллированный натрием (Na) в инертной атмосфере;
- 1,3-бутадиен (Air Liquide): чистый, ≥99,5%, выпаренный из контейнера перед каждым получением, высушенный прохождением через колонку, заполненную молекулярными ситами, и конденсированный внутри реактора, предварительно охлажденного до температуры -20°С;
- изопрен (Aldrich): чистый, ≥99%, дефлегмированный при использовании гидрида кальция, затем дистиллированный «ловушка на ловушке» («trap-to-trap») и выдержанный в атмосфере азота;
- тетра-изо-бутил-алюмоксан (TIBAO) (Akzo Nobel): 10% по массе раствор циклогексана;
- метилалюмоксан (Aldrich): 10% по массе раствор толуола;
- ди-изо-бутил-алюминий гидрид (DIBAH) (Aldrich): используют как таковой;
- Nd-2-этилгексаноат [Nd(OCOC17H15)3] (Strem): 0,05 M раствор в гептане;
- гептан (Aldrich): чистый, ≥99%, дистиллированный натрием (Na) в инертной атмосфере;
- пентан (Aldrich): чистый, ≥99%, дистиллированный натрием (Na) в инертной атмосфере;
- ди-этил-алюминий хлорид [AlEt2Cl] (Akzo Nobel): используют как таковой;
- три-изо-бутил алюминия [TIBA] (Akzo Nobel): используют как таковой;
- дейтерированный тетрахлорэтилен (C2D2Cl4)(Acros): используют как таковой
- дейтерированный хлороформ (CDCl3) (Acros): используют как таковой.
Используемые анализы и способы определения приведены ниже.
Элементный анализ
a) Определение Nd
Для определения массового количества металла Nd в бис-имин пиридиновом комплексе лантанидов, представляющем объект по настоящему изобретению, точно отвесили аликвоту, работу проводили в перчаточном боксе в потоке азота, образец около 30-50 мг поместили в платиновый тигель около 30 мл вместе со смесью 1 мл 40% фтористо-водородной кислоты (HF), 0,25 мл 96% серной (H2SO4) и 1 мл 70% азотной кислоты (HNO3). Затем тигли нагрели на плите, повысив температуру до появления белых серных паров (около 200°С). Полученную, таким образом, смесь охладили до комнатной температуры (20°С-25°С) и добавили 1 мл 70% азотной кислоты (HNO3) и затем нагрели смесь до появления паров. После повторения последовательности еще два раза получили прозрачный почти бесцветный раствор. Затем добавили 1 мл азотной кислоты (HNO3) и около 15 мл воды, нагревание не проводили и затем смесь нагревали до температуры 80°С в течение около 30 минут. Полученный, таким образом, образец развели водой с чистотой MilliQ до массы около 50 г, провели точную отвестку с получением раствора, который подвергли аналитическому инструментальному определению при использовании спектрометра Thermo Optek IRIS Advantage Duo spectrometer ICP-OES (оптическая детекция при использовании плазмы) при сравнении с растворами с известными концентрациями. Для этой цели провели калибровку кривой, полученной для каждого аналита, в пределах 0 частей на миллион - 10 частей на миллион, измеряя растворы с известными титрами, полученные разведением по массе центрифугированных растворов.
Полученный, как указано выше, раствор образца снова развели по массе с получением, таким образом, концентраций близких к таковым, использованным в контроле перед проведением спектрофотометрической детекции. Все образцы получали дважды. Результаты считаются приемлемыми, если единичные данные тестов при повторе отличаются не более чем на 2% относительно их среднего значения.
b) Определение хлора
Для этой цели образцы бис-имин пиридиновых комплексов лантанидов, являющихся объектом настоящего изобретения, около 30 мг - 50 мг точно отвесили в 100 мл стеклянную емкость в перчаточном боксе в потоке азота. Вне перчаточного бокса были добавлены 2 г карбоната натрия (Na2CO3) и 50 мл воды MilliQ. Затем смесь довели до точки кипения на плите при перемешивании магнитной мешалкой в течение около 30 минут. Ее оставили для охлаждения, добавили серную кислоту (H2SO4) разведенную 1/5, до момента, когда реакция стала кислой, и смесь титровали 0,1 Ν нитратом серебра (AgNO3) с использованием потенциометра титрометра.
с) Определение углерода, водорода, кислорода и азота
Определение углерода, водорода, кислорода и азота в бис-имин пиридиновых комплексах лантанидов, являющихся объектом настоящего изобретения, и также в лигандах, используемых для целей настоящего изобретения, проводят при использовании автоматического анализатора Carlo Erba Mod. 1106.
13С-ЯМР и 1H-ЯМР спектры
13С-ЯМР и 1H-ЯМР спектры регистрировали при использовании спектрометра с магнитно-ядерным резонансом модель Bruker Avance 400, при использовании дейтерированного тетрахлорэтилена (C2D2Cl4) при температуре 103°С, и гексаметилдисилоксана (HDMS) в качестве внутреннего стандарта или при использовании дейтерированного хлороформа (CDCl3), при 25°С и тетраметилсилана (TMS) в качестве внутреннего стандарта. Для этой цели использовали растворы лигандов, использованных в настоящем изобретении, или полимерных растворов с концентрациями равными 10% по массе от общей массы раствора лигандов, использованных в настоящем изобретении, или полимерном растворе, соответственно.
Микроструктуру полимеров [то есть, содержание 1,4-цис единиц, (%)] определяли при использовании анализа указанного выше спектра на основе указанного в литературе Mochel V. D. в «Journal of Polymer Science Part A-1: Polymer Chemistry» (1972), Vol. 10, Issue 4, p. 1009-1018, для полибутадиена; и Sato H. et al. в «Journal of Polymer Science: Polymer Chemistry Edition» (1979), Vol. 17, Issue 11, p. 3551-3558 для полиизопрена.
ИК спектры
ИК спектры (Фурье-ИК) регистрировали при использовании спектрофотометра Bruker IFS 48.
ИК спектры (Фурье-ИК) лигандов, использованных в настоящем изобретении, получили диспергированием анализируемого лиганда в безводном бромиде калия (KBr) (диски из KBr) или в суспензии медицинского масла (nujol) или тетраметилсилане (TMS).
ИК спектры (Фурье-ИК) бис-имин пиридиновых комплексов лантанидов, являющихся объектом настоящего изобретения, получили диспергированием анализируемого бис-имин пиридинового комплекса лантанидов в безводном бромиде калия (KBr) (диски из KBr) или в суспензии медицинского масла (nujol).
ИК спектры (Фурье-ИК) полимеров получили из полимерных пленок на таблетках бромида калия, указанные пленки получали отсадкой раствора анализируемого полимера в горячий о-дихлорбензол. Концентрация анализируемых полимерных растворов равна 10% по массе от общей массы полимерного раствора.
Термический анализ (DSC)
Точки плавления (Tm) и температуры кристаллизации (Тс) полимеров определяли при использовании термического анализа DSC («Дифференциальная сканирующая калориметрия»), который провели при использовании дифференциального сканирующего калориметра Perkin Elmer Pyris. Для этой цели анализировали 5 мг полимера при скорости сканирования от 1°С/минуту до 20°С/минуту в инертной атмосфере азота.
Температуру стеклования (Tg) полученных полимеров и натурального каучука (NR) определяли при использовании термического анализа DSC («Дифференциальная сканирующая калориметрия») и провели при использовании указанного выше калориметра при использовании следующей термической программы: изотерм 3 минуты при температуре +70°C; охлаждение от +70°C до -90°C при скорости 10°C/минуту; изотерм 3 минуты при температуре -90°С; нагревание от -90°С до +70°С при скорости 10°С/минуту.
Определение молекулярной массы
Определение молекулярной массы (MW) полученных полимеров проводили при использовании ГПХ («Gel Permeation Chromatography») при следующих условиях:
- насос Agilent 1100;
- детектор I.R. Agilent 1100;
- колонки PL Mixed-A;
- растворитель/элюент: тетрагидрофуран (THF);
- скорость потока: 1 мл/минуту;
- температура: 25°С;
- расчет молекулярной массы: универсальный метод калибровки.
Вычислили среднемассовую молекулярную массу (Mw) и индекс полидисперсности (PDI), соответствующие соотношению Mw/Mn (Μn=среднечисловая молекулярная масса).
Определение разветвленности
Определение разветвленности полимеров, полученных при использовании технологий ΓΠΧ/MALLS, проводили при использовании совместно детектора многоуглового измерения рассеянного света (MALLS) с традиционной системой элюирования SEC/RI, при следующих условиях:
- насос Agilent 1050;
- детектор I.R. Agilent 1050;
- детектор MALLS Dawn-DSP Wyatt - технология, λ=632,8 нм;
- колонки PL GEL Mixed-A (x4);
- растворитель/элюент: тетрагидрофуран (THF);
- скорость потока: 1 мл/минуту;
- температура: 25°С.
Следуя указанному выше, одновременно могут быть проведены абсолютные измерения молекулярной массы и радиуса вращения макромолекул, которые могут быть отделены при использовании хроматографической системы: количество света, рассеянного от макромолекул в растворе, по факту может быть использовано непосредственно для получения ее молекулярной массы, при этом изменение угла при рассеянии напрямую коррелирует со средними размерами. Основное соотношение, которое используют, представлено следующим уравнением (1):
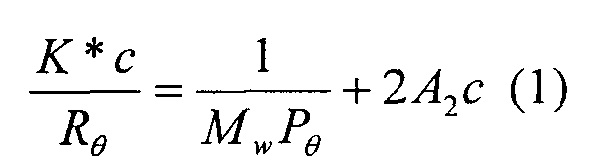
где:
- K* представляет оптическую постоянную, которая зависит от длины волны используемого света, коэффициента преломления (dn/dc) полимера, использованного растворителя;
- Mw представляет среднемассовую молекулярную массу;
- с представляет концентрацию полимерного раствора;
- Rθ представляет интенсивность рассеянного света, измеренную под углом θ (избыток фактора Рэлея);
- Рθ представляет функцию, описывающую изменение рассеянного света с углом, под которым его измеряют, для угла θ равно 0;
- А2 представляет второй вириальный коэффициент.
Для очень низких концентраций (как правило, система ГПХ), приведенное выше уравнение (1) сокращено до следующего уравнения (2):
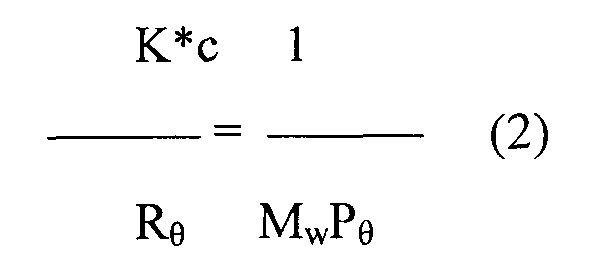
где K*, с, Rθ, Mw и Рθ имеют значения, указанные выше, и при проведении измерений под несколькими углами экстраполяция мертвой зоны по угловым координатам функции K*c/Rθ в отношение sen2θ/2 непосредственно обеспечивает молекулярную массу из показателей свободных членов уравнения и изгиба радиуса вращения.
Дополнительно, это измерение проводят для каждого сечения хроматограммы, т.е. можно получить распределение обоих, и молекулярной массы, и радиуса вращения.
Размеры макромолекул раствора напрямую зависят от степени их разветвленности: для одной и той же молекулярной массы, чем меньше размеры макромолекул относительно линейного коррелята, тем будет более высокая степень разветвленности.
Информация, относящаяся к макроструктуре полимера, может быть получена из выводов, сделанных, основываясь на показателях параметра а, который представляет изгиб кривой, коррелирующий с радиусом вращения, с молекулярной массой: при тех же самых условиях проведения анализа этот показатель снижается по сравнению с макроструктурой линейного типа, что указывает на присутствие полимера с разветвленным типом макроструктуры. Типичный показатель параметра α для линейного полибутадиена с высоким содержанием 1,4-цис единиц в тетрагидрофуране (THF) равен 0,58-0,60.
ПРИМЕР 1
Синтез лиганда с формулой (L1)
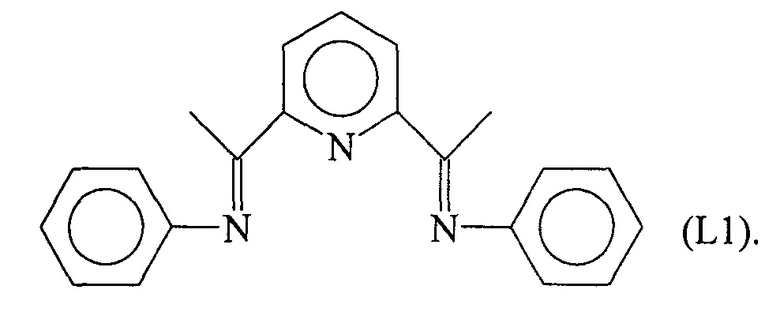
2,10 мл (0,023 молей) анилина ввели в реакционную колбу вместе с 5 мл метанола и 5 капелями муравьиной кислоты с получением раствора. Затем в указанный раствор капельно добавили 20 мл метанола, содержащего 1,79 г (0,011 молей) ди-ацетилпиридина при комнатной температуре. Раствор выдерживали при перемешивании в течение ночи с получением преципитата желтого микрокристаллического твердого вещества: указанное желтое твердое вещество извлекли фильтрацией, промыли холодным метанолом и высушили под вакуумом при комнатной температуре с получением 2,76 г желтого твердого вещества (выход =80%) с формулой (L1).
Элементный анализ [обнаружено (вычислено)]: С: 80,9% (80,5%); Н: 6,13%) (6,11%); N: 13,6% (13,4%).
Молекулярная масса (MW): 313,4.
Фурье-ИК (медицинское масло): 1632 см-1 v(C=N).
1H-NMR (CDCl3): 2,4 (s, 6Н), 6,84 (d, 4Н), 7,11 (t, 2Н), 7,36 (t, 4Н), 7,88 (t, 1Н), 8,36 (d, 2H).
ПРИМЕР 2
Синтез лиганда с формулой (L2)
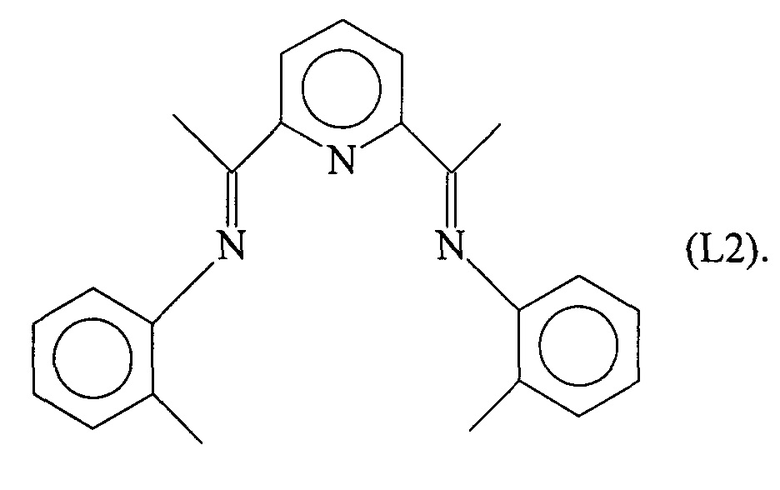
2,44 мл (0,023 молей) о-толуидина ввели в реакционную колбу вместе с 5 мл метанола и 5 капелями муравьиной кислоты с получением раствора. Затем в указанный раствор капельно добавили 20 мл метанола, содержащего 1,79 г (0,011 молей) 2,6-ди-ацетилпиридина при комнатной температуре. Раствор выдерживали при перемешивании в течение ночи с получением преципитата желтого микрокристаллического твердого вещества: указанное желтое твердое вещество извлекли фильтрацией, промыли холодным метанолом и высушили под вакуумом при комнатной температуре с получением 1,52 г желтого твердого вещества (выход =40%) с формулой (L2).
Элементный анализ [обнаружено (вычислено)]: С: 81,2% (80,9%); Н: 6,83% (6,76%); N: 12,2% (12,3%).
Молекулярная масса (MW): 341,46.
Фурье-ИК (медицинское масло): 1641 см-1 v(C=N).
1H-NMR (CDCl3): 2,4 (s, 6Н), 6,84 (d, 4Н), 7,11 (t, 2Н), 7,28 (t, 4Н), 7,91 (t, 1Н), 8,49 (d, 2H).
ПРИМЕР 3
Синтез лиганда с формулой (L3)
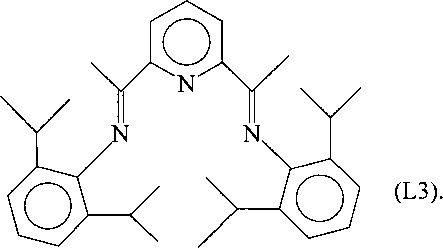
В метанол (10 мл) капельно добавили раствор (3,47 мл; 0,0184 молей) 2,6-диизопропиланилина, в метанол (25 мл) добавили раствор 2,6-диацетилпиридина (1,5 г; 0,0092 молей) и 5 капель муравьиной кислоты с получением раствора. Затем указанный раствор нагрели до температуры дефлегмации в течение 48 часов. На завершающей стадии раствор сконцентрировали до половины его объема и охладили в морозильнике с получением преципитата желтого микрокристаллического твердого вещества: указанное твердое желтое вещество отфильтровали, промыли холодным метанол и высушили под вакуумом при комнатной температуре с получением 3,5 г желтого твердого вещества (выход =80%) с формулой (L3).
Элементный анализ [обнаружено (вычислено)]: С: 81,9% (82,28%); H: 8,5% (9%); N: 8,72% (8,72%).
Молекулярная масса (MW): 481,72.
Фурье-ИК (медицинское масло): 1641 см-1 v(C=N).
1H-NMR (CDCl3): 1,15 (d, 24Н), 2,24 (s, 6H), 2,81 (m, 4H), 7,15 (m, 6H), 7,9-8,5 (m, 3Н).
ПРИМЕР 4
Синтез лиганда с формулой (L4)
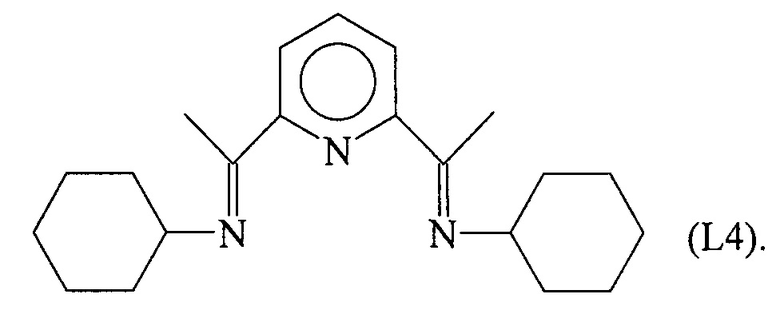
1,944 г (0,0196 молей) циклогексиламина ввели в реакционную колбу вместе с 10 мл этанола и 3 капелями муравьиной кислоты с получением раствора. Затем в указанный раствор капельно добавили 20 мл этанола, содержащего 1,6 г (0,0098 молей) 2,6-диацетилпиридина при комнатной температуре. Раствор выдерживали при перемешивании в течение ночи с получением преципитата белесого микрокристаллического твердого вещества: указанное белесое твердое вещество извлекли фильтрацией, промыли холодным метанолом и высушили под вакуумом при комнатной температуре с получением 1,5 г белесого твердого вещества (выход =47%) с формулой (L4).
Элементный анализ [обнаружено (вычислено)]: С: 76,68% (77,49%); Н: 9,42% (9,60%); N: 12,49% (12,91%).
Молекулярная масса (MW): 325,50.
Фурье-ИК (медицинское масло): 1641 см-1 v(C=N).
1H-NMR (CDCl3): 2,4 (s, 6Н), 6,84 (d, 4Н), 7,11 (t, 2Н), 7,28 (t, 4Н), 7,91 (t, 1H), 8,49 (d, 2H).
ПРИМЕР 5
Синтез лиганда с формулой (L5)
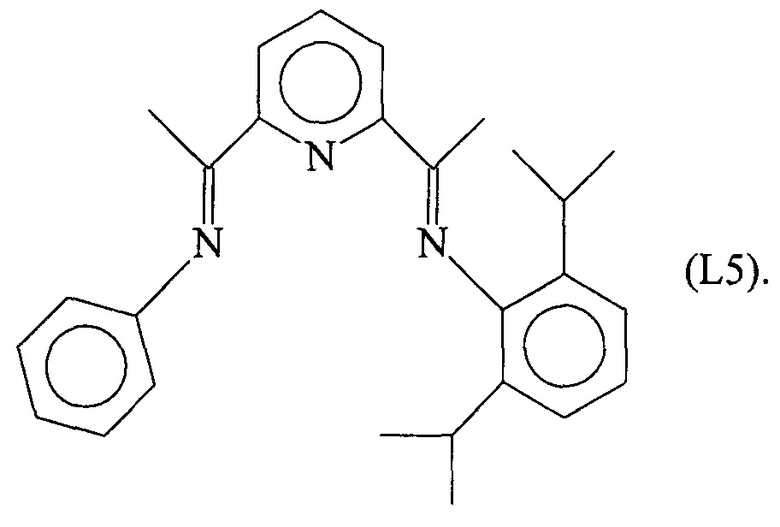
2,13 мл (0,012 молей) 2,6-диизопропиланилина ввели в реакционную колбу вместе с 5 мл метанола и 3 каплями муравьиной кислоты с получением раствора. Затем в указанный раствор капельно добавили 20 мл метанола, содержащего 1,93 г (0,012 молей) 2,6-ди-ацетилпиридина при комнатной температуре с получением преципитата желтого микрокристаллического твердого вещества: по прошествии 1 часа указанное желтое твердое вещество извлекли фильтрацией, промыли холодным метанолом и высушили под вакуумом при комнатной температуре с получением 2,53 г светло-желтого твердого вещества (выход =65%) с формулой (L5a):
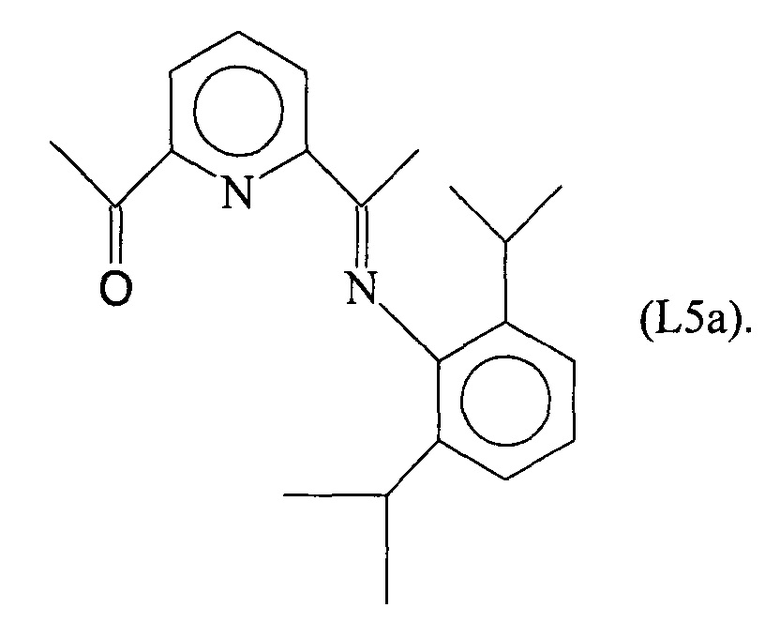
Элементный анализ [обнаружено (вычислено)]: С: 77,8% (78,2%); Н: 8,29% (8,13%); N: 8,51% (8,69%).
Молекулярная масса (MW): 322,45.
Фурье-ИК (медицинское масло): 1645 см-1 v(C=N).
1H-NMR (CDCl3): 1,16 (d, 6H), 1,17 (d, 6H), 2,28 (s, 3Н), 2,74 (m, 2H), 2,81 (s, 3Н), 7,08-7,22 (m, 3Н), 7,95 (t, 1H), 8,16 (dd, 1H), 8,58 (dd, 1H).
2,0 г (6,2⋅10-3 молей) соединения с формулой (L5a), полученного, как указано выше, растворили в 100 мл теплого изопропилового спирта с последующим добавлением 5 капель муравьиной кислоты и капельным добавлением 0,62 г (6,82⋅10-3 молей) свеже дистилированного анилина: всю смесь выдержали с использованием дефлегматора в течение 8 часов с получением 1,5 г желтого твердого вещества (выход =61%) с формулой (L5).
Элементный анализ [обнаружено (вычислено)]: С: 81,10%) (81,57%); Н: 7,93% (7,86%); N: 10,40% (10,57%).
Молекулярная масса (MW): 397,56.
Фурье-ИК (медицинское масло): 1637 см-1 v(C=O), 1639 см-1 v(C=N).
На Фигуре 11 показан спектр Фурье-ИК (медицинское масло) полученного лиганда с формулой (L5).
ПРИМЕР 6
Синтез лиганда с формулой (L6)
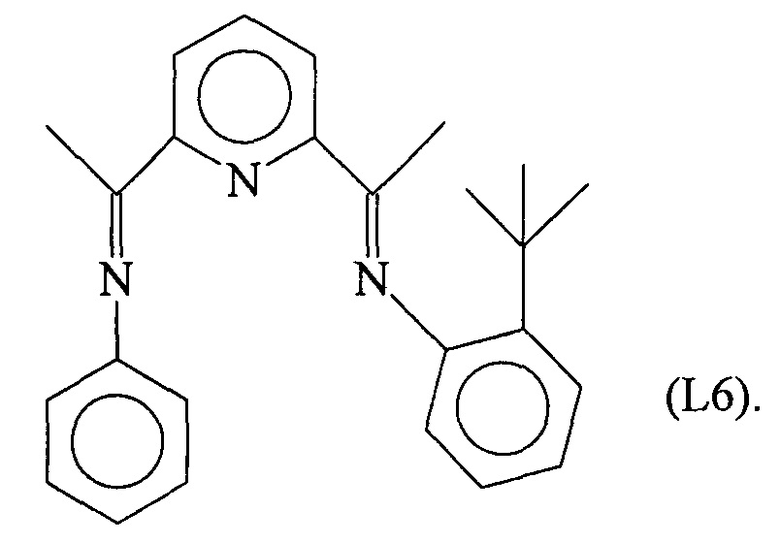
5,37 г (0,036 молей) 2,6-третбутиланилина ввели в реакционную колбу вместе с 15 мл метанола и 5 каплями муравьиной кислоты с получением раствора. Затем в указанный раствор капельно добавили 30 мл метанола, содержащего 5,87 г (0,036 молей) 2,6-диацетилпиридина, при комнатной температуре с получением преципитата желтого микрокристаллического твердого вещества: по прошествии 1 часа указанное желтое твердое вещество извлекли фильтрацией, промыли холодным метанолом и высушили под вакуумом при комнатной температуре с получением 9,84 г светло-желтого твердого вещества (выход =93%) с формулой (L6a):
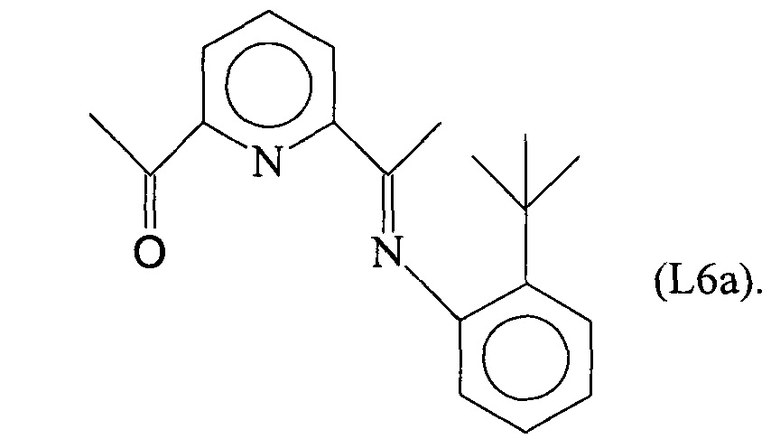
Элементный анализ [обнаружено (вычислено)]: С: 78,0% (77,5%); Н: 7,60% (7,53%); N: 9,65% (9,52%).
Молекулярная масса (MW): 294,4.
Фурье-ИК (медицинское масло): 1694 см-1 v(C=O), 1641 см-1 v(C=N).
1H-NMR (CDCl3): 1,39 (s, 9H), 2,41 (s, 3Н), 2,80 (s, 3Н), 2,54 (dd, 1H), 7,24 (m, 2H), 7,43 (dd, 1H), 7,95 (t, 1H), 8,13 (dd, 1H), 8,50 (dd, 1H).
6,90 г (2,35⋅10-2 молей) соединения с формулой (L6a), полученного, как указано выше, дефлегмировали в 100 мл абсолютного этанола с последующим капельным добавлением 2,19 г (2,35⋅10-2 молей) свеже дистиллированного анилина: всю смесь выдержали при температуре дефлегмации в течение 8 часов с получением 6,3 г желтого твердого вещества (выход =73%) с формулой (L6).
Элементный анализ [обнаружено (вычислено)]: С: 81,20% (81,26%); Н: 7,30% (7,37%); N: 11,47% (11,37%).
Молекулярная масса (MW): 369,50.
Фурье-ИК (медицинское масло): 1636 см-1 v(C=N).
ПРИМЕР 7
Синтез лиганда с формулой (L7)
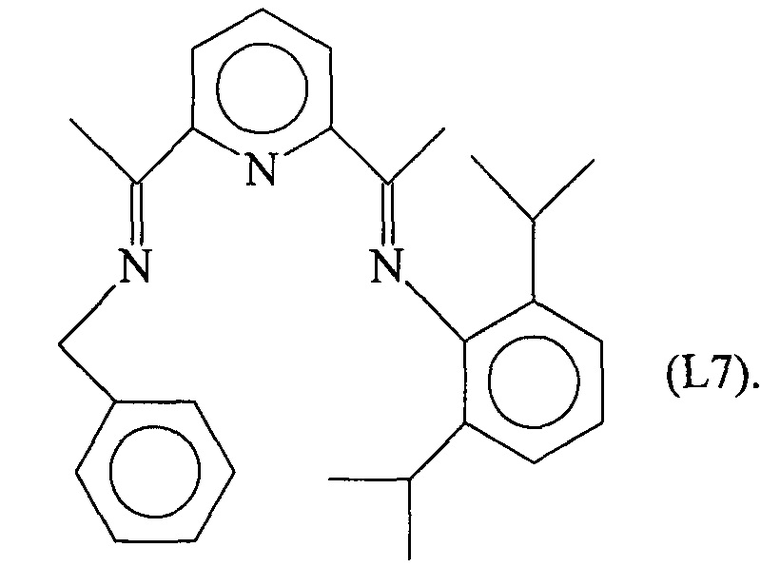
2,0 г (6,2⋅10-3 молей) соединения (L5a), полученного как указано выше, ввели в реакционную колбу со 100 мл абсолютного этанола и 0,75 г (6,82⋅10-3 молей) бензиламина и последующим добавлением 5 капель ледяной уксусной кислоты при перемешивании: всю смесь выдержали с использованием дефлегматора в течение 24 часов с получением 5,74 г светло-желтого твердого вещества (выход =65%) с формулой (L7).
Элементный анализ [обнаружено (вычислено)]: С: 81,2% (81,71%); Н: 8,1% (8,08%); N: 9,7% (10,21%).
Молекулярная масса (MW): 411,59.
Фурье-ИК (медицинское масло): 1634 см-1 v(C=N)
ПРИМЕР 8
Синтез лиганда с формулой (L8)
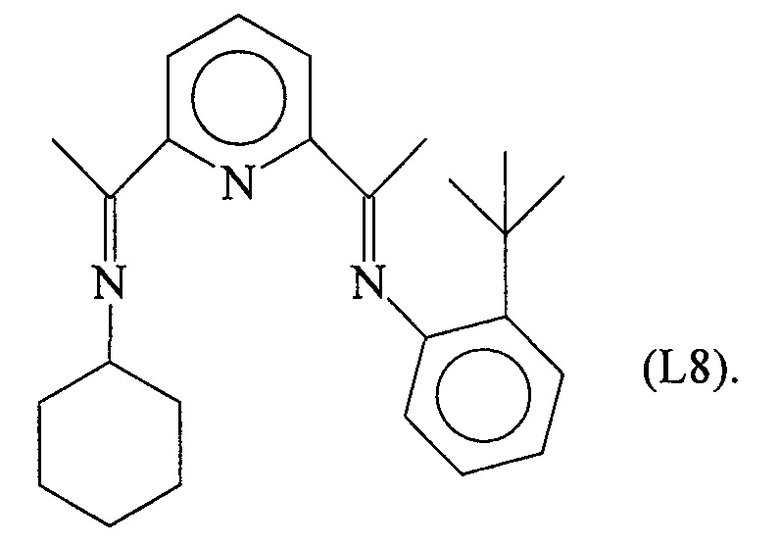
6,90 г (2,35⋅10-2 молей) соединения (L6a), полученного как указано выше, дефлегмировали в 100 мл абсолютного этанола с последующим капельным добавлением 2,30 г (2,35⋅10-2 молей) циклогексиламина: всю смесь выдержали при температуре дефлегмации в течение 8 часов с получением 5,74 г желтого твердого вещества (выход =65%) с формулой (L8).
Элементный анализ [обнаружено (вычислено)]: С:: 80,05% (79,95%); Н: 8,90% (8,86%); Ν: 11,20% (11,19%).
Молекулярная масса (MW): 375,55.
Фурье-ИК (медицинское масло): 1637 см-1 v(C=N).
ПРИМЕР 9
Синтез NdCl3(L1) [образец GL380/P1891]
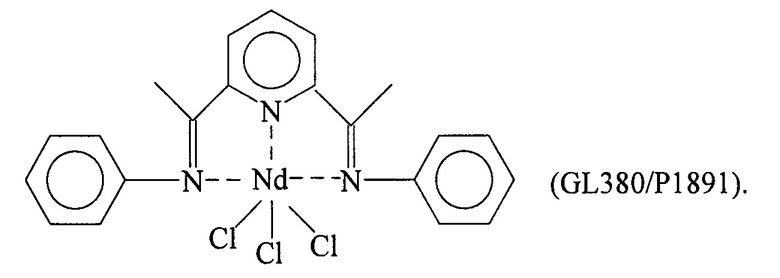
Комплекс неодим трихлорид/тетрагидрофуран [NdCl3(2THF)] (0,641 г; 1,6⋅10-3 молей) ввели в 100 мл реакционную колбу вместе с тетрагидрофураном (THF) (50 мл). Всю смесь выдержали при перемешивании при комнатной температуре в течение нескольких минут и добавили полученный по Примеру 1 лиганд с формулой (L1) (0,564 г; 1,8⋅10-3 молей; молярное соотношение L1/Nd=1,13). Всю смесь выдержали при перемешивании при комнатной температуре в течение 72 часов с получением очень плотной бело-зеленой суспензии. По окончанию реакции растворитель почти полностью удалили по объему под вакуумом и затем добавили пентан в избытке, и затем всю смесь отфильтровали с получением осадка бело-зеленого твердого вещества, который промывали несколько раз пентаном для удаления не прореагировавшего лиганда. Оставшийся на фильтре бело-зеленый осадок удалили и высушили под вакуумом с получением 0,780 г твердого продукта, соответствующего комплексу NdCl3(L1), что соответствует превращению 86,4% относительно введенного неодима.
Элементный анализ [обнаружено (вычислено)]: С: 44,60% (44,72%); Н: 3,30% (3,40%); N: 7,30% (7,45%); Cl: 19,0% (18,86%); Nd: 25,60% (25,57%).
Молекулярная масса (MW): 564,0.
Фурье-ИК (медицинское масло): 1645 см-1 v(C=N).
ПРИМЕР 10
Синтез NdCl3(L2) [образец GL360]
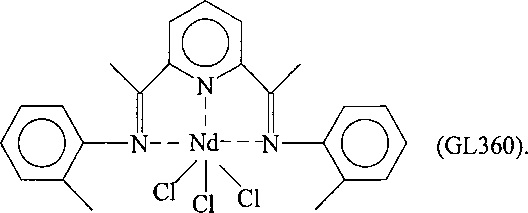
Комплекс неодим трихлорид/тетрагидрофуран [NdCl3(2THF)] (0,305 г; 7,72⋅10-4 молей) ввели в 100 мл реакционную колбу вместе с тетрагидрофураном (THF) (35 мл). Всю смесь выдержали при перемешивании при комнатной температуре в течение нескольких минут и добавили полученный по Примеру 2 лиганд с формулой (L2) (0,313 г; 9⋅10-4 молей; молярное соотношение L2/Nd=1,2). Всю смесь выдержали при перемешивании при комнатной температуре в течение 2 дней: сначала была получена зелено-желтая суспензия, которая затем в процессе реакции окрасилась в красный цвет. По окончанию реакции растворитель значительно уменьшили в объеме под вакуумом, и затем добавили пентан в избытке, после чего всю смесь отфильтровали с получением осадка красного твердого вещества. Оставшийся на фильтре осадок красного цвета удалили и высушили под вакуумом с получением 0,425 г твердого продукта, соответствующего комплексу NdCl3(L2), что соответствует превращению 93% относительно введенного неодима.
Элементный анализ [обнаружено (вычислено)]: С: 46,50% (46,66%); Н: 3,80% (3,92%); N: 6,90% (7,10%); Cl: 18,10% (17,96%); Nd: 24,50% (24,36%).
Молекулярная масса (MW): 592,05.
Фурье-ИК (медицинское масло): 1648 см-1 v(C=N).
ПРИМЕР 11
Синтез NdCl3(L4) [образец Р1888]
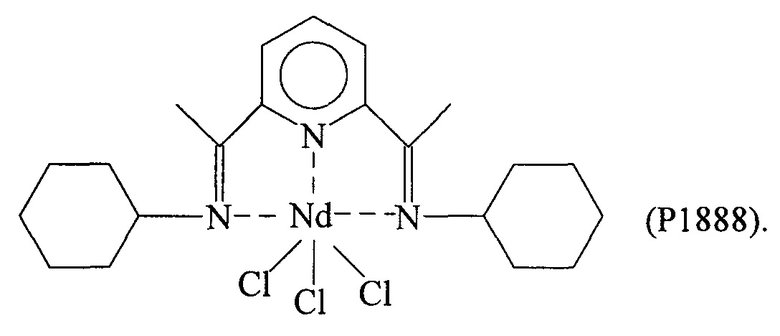
Комплекс неодим трихлорид/тетрагидрофуран [NdCl3(2THF)] (0,7 г; 1,8⋅10-3 молей) ввели в 100 мл реакционную колбу вместе с тетрагидрофураном (THF) (50 мл). Всю смесь выдержали при перемешивании при комнатной температуре в течение нескольких минут и добавили полученный по Примеру 3 лиганд с формулой (L4) (0,762 г; 2,3⋅10-3 молей; молярное соотношение L4/Nd=1,3). Всю смесь выдержали при перемешивании при комнатной температуре в течение 3 дней: сначала была получена желтоватая суспензия, которая затем в процессе реакции окрасилась в желто-красный цвет. По окончанию реакции растворитель значительно уменьшили в объеме под вакуумом и затем добавили пентан в избытке, после чего всю смесь отфильтровали с получением осадка желтоватого твердого вещества, который несколько раз промыли пентаном для удаления не прореагировавшего лиганда. Оставшийся на фильтре желтоватый осадок удалили и высушили под вакуумом с получением 0,860 г твердого продукта, соответствующего комплексу NdCl3(L4), что соответствует превращению 82,9% относительно введенного неодима.
Элементный анализ [обнаружено (вычислено)]: С: 43,60% (43,78%); Н: 5,30% (5,42%); N: 7,20% (7,29%); Cl: 18,5% (18,46); Nd: 25,10% (25,04%).
Молекулярная масса (MW): 576,0.
Фурье-ИК (медицинское масло): 1589 см-1 v(C=N).
ПРИМЕР 12
Синтез NdCl3(L5) [образец Ρ1963]
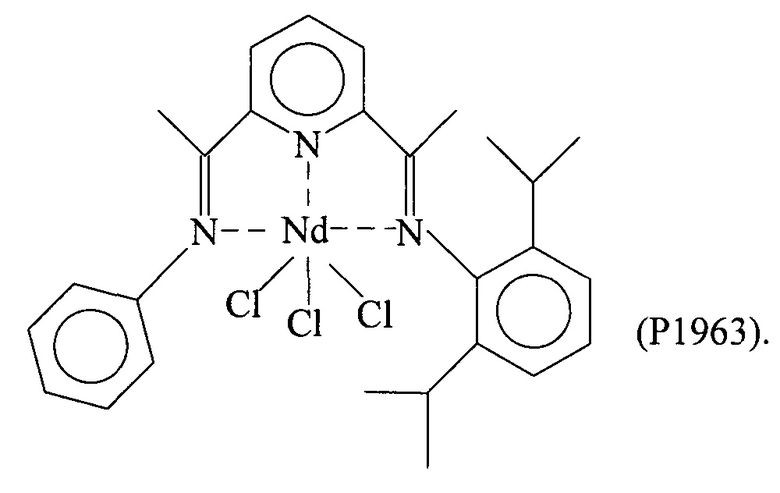
Комплекс неодим трихлорид/тетрагидрофуран [NdCl3(2THF)] (0,557 г; 9⋅10-3 молей) ввели в 100 мл реакционную колбу вместе с тетрагидрофураном (THF) (50 мл). Всю смесь выдержали при перемешивании при комнатной температуре в течение нескольких минут и добавили полученный по Примеру 5 лиганд с формулой (L5) (0,729 г; 1,83⋅10-3 молей; молярное соотношение L5/Nd=1,3). Всю смесь выдержали при интенсивном перемешивании при комнатной температуре в течение 4 дней с получением относительно гомогенного окрашенного в зеленый цвет раствора. По окончанию реакции растворитель частично удалили под вакуумом и затем добавили пентан в избытке, после чего всю смесь отфильтровали с получением зеленоватого осадка твердого вещества, который промыли несколько раз пентаном для удаления не прореагировавшего лиганда. Оставшийся на фильтре зеленоватый осадок удалили и высушили под вакуумом с получением 0,798 г твердого продукта, соответствующего комплексу NdCl3(L5), что соответствует превращению 87,9% относительно введенного неодима.
Элементный анализ [обнаружено (вычислено)]: С: 50,10% (50,03%); Н: 4,90% (4,82%); N: 6,60% (6,48%); Cl: 16,5% (16,41); Nd: 22,30% (22,25%).
Молекулярная масса (MW): 648,16.
Фурье-ИК (медицинское масло): 1643 см-1(vC=N-Nd); 1605 см-1 (v(Py)N-Nd).
На Фигуре 12 показан спектр Фурье-ИК комплекса NdCl3(L5).
ПРИМЕР 13
Синтез NDCl3(L6) [образец Ρ19651
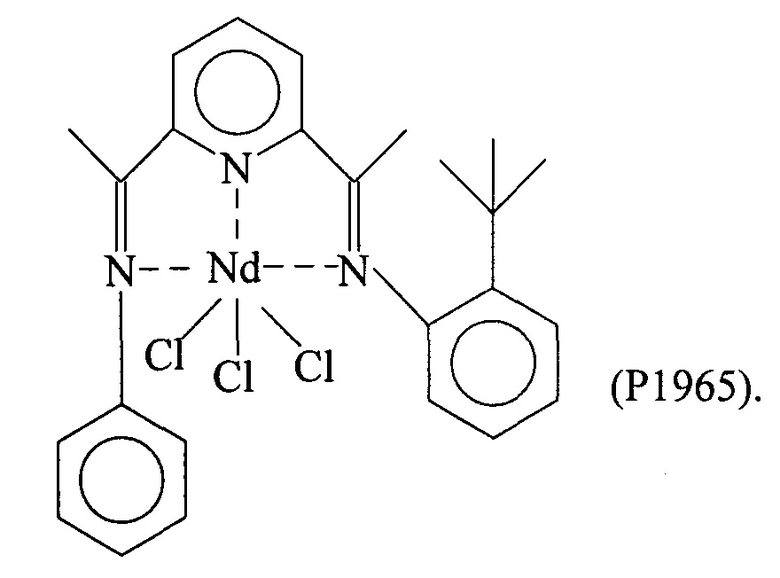
Комплекс неодим трихлорид/тетрагидрофуран [NdCl3(2THF)] (0,497 г; 1,26⋅10-3 молей) ввели в 100 мл реакционную колбу вместе с тетрагидрофураном (THF) (40 мл). Всю смесь выдержали при перемешивании при комнатной температуре в течение нескольких минут и добавили полученный по Примеру 6 лиганд с формулой (L6) (0,605 г; 1,64⋅10-3 молей; молярное соотношение L6/Nd=1,3). Всю смесь выдержали при перемешивании при комнатной температуре в течение 4 дней с получением относительно гомогенного зеленоватого раствора. По окончанию реакции растворитель частично удалили под вакуумом и затем добавили пентан в избытке, после чего всю смесь отфильтровали с получением осадка зеленоватого твердого вещества, который промыли несколько раз пентаном для удаления не прореагировавшего лиганда. Оставшийся на фильтре зеленоватый осадок удалили и высушили под вакуумом с получением 0,692 г твердого продукта, соответствующего комплексу NdCl3(L6), что соответствует превращению 88,5% относительно введенного неодима.
Элементный анализ [обнаружено (вычислено)]: С: 48,20%) (48,42%); Н: 4,30% (4,39%); N: 6,60% (6,78%); Cl: 17,2% (17,15%); Nd: 23,30% (23,26%).
Молекулярная масса (MW): 620,10.
Фурье-ИК (медицинское масло): 1645 (vC=N-Nd); 1605 см-1 (v(Py)N-Nd).
ПРИМЕР 14
Синтез NdCl3(L8) [образец Ρ1964]
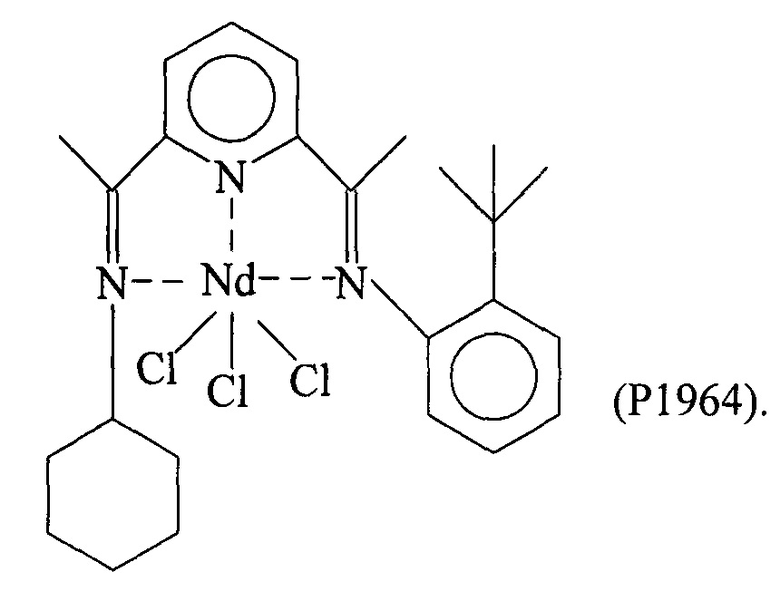
Комплекс неодим трихлорид/тетрагидрофуран [NdCl2(2THF)] (0,522 г; 1,32⋅10-3 молей) ввели в 100 мл реакционную колбу вместе с тетрагидрофураном (THF) (40 мл). Всю смесь выдержали при перемешивании при комнатной температуре в течение нескольких минут и добавили полученный по Примеру 8 лиганд с формулой (L8) (0,645 г; 1,72⋅10-3 молей; молярное соотношение L8/Nd=1,3). Всю смесь выдержали при перемешивании при комнатной температуре в течение 4 дней с получением относительно гомогенного зеленоватого раствора. По окончанию реакции растворитель частично удалили под вакуумом и затем добавили пентан в избытке, после чего всю смесь отфильтровали с получением осадка зеленоватого твердого вещества, который промыли несколько раз пентаном для удаления не прореагировавшего лиганда. Оставшийся на фильтре зеленоватый осадок удалили и высушили под вакуумом, с получением 0,645 г твердого продукта, соответствующего комплексу NdCl3(L8), что соответствует превращению 78% относительно введенного неодима.
Элементный анализ [обнаружено (вычислено)]: С: 48,10% (47,96%); Н: 5,40% (5,31%); N: 6,90% (6,71%); Cl: 19,5% (19,59%); Nd: 26,50% (26,56%).
Молекулярная масса (MW): 626,15.
Фурье-ИК (медицинское масло): 1643 (vC=N-Nd); 1604 см-1 (v(Py)N-Nd).
ПРИМЕР 15
(P1920)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 7 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,2 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 9 NdCl3(L1) [образец GL380/P1891] (2,8 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,6 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 3 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,603 г полибутадиена с содержанием 1,4-цис единиц >99%: дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 16
(Р1941)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,9 мл толуола и температуру полученного таким образом раствора довели до 20°С. Затем добавили метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1⋅10-2 молей, равный около 0,58 г) и затем получили комплекс по Примеру 9 NdCl3(L1) [образец GL380/P1891] (2,8 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,6 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 116 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,755 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 17
(А007)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 13,02 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 9 NdCl3(L1) [образец GL380/P1891] (2,8 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,6 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 8 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,443 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 18
(GL503)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,85 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,2 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 10 NdCl3 (L2) [образец GL360] (2,8 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,9 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 8 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,603 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
На Фигуре 2(b) показан спектр Фурье-ИК полученного полибутадиена.
ПРИМЕР 19
(GL416)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,75 мл толуола и температуру полученного таким образом раствора довели до 20°С. Затем добавили метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1⋅10-2 молей, равный около 0,58 г) и затем получили комплекс по Примеру 10 NdCl3(L2) [образец GL360] (2,95 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-2 молей, равной около 5,9 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 720 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,867 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 20
(А008)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 12,87 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 10 NdCl3(L2) [образец GL360] (2,95 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,6 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 4 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористоводородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,603 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 21
(GL596)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,9 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,2 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 11 NdCl3(L4) [образец Ρ1888] (2,9 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,8 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 3 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,668 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 22
(Р1942)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,8 мл толуола и температуру полученного таким образом раствора довели до 20°С. Затем добавили метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1⋅10-2 молей, равный около 0,58 г) и затем получили комплекс по Примеру 11 NdCl3(L4) [образец Ρ1888] (2,9 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,8 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 20 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,917 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 23
(Р1962)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 12,92 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 11 NdCl3(L4) [образец Ρ1888] (2,9 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,8 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 30 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористоводородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox 1076 (Ciba) с получением 0,637 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
На Фигуре 3 показан спектр 1Н-ЯМР и 13С-ЯМР полученного полибутадиена.
ПРИМЕР 24
(GL734)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,7 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,2 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 13 NdCl3(L6) [образец Ρ1965] (3,1 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,2 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 12 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 1,102 г полибутадиена с содержанием 1,4-цис единиц >99,7%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
На Фигуре 5 показан спектр 1Н-ЯМР и 13С-ЯМР полученного полибутадиена.
ПРИМЕР 25
(А001)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,8 мл толуола и температуру полученного таким образом раствора довели до 20°С. Затем добавили метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1⋅10-2 молей, равный около 0,58 г) и затем получили комплекс по Примеру 11 NdCl3(L6) [образец Ρ1965] (3,1 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,2 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 110 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,588 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 26
(А002)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 12,72 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 13 NdCl3(L6) [образец Ρ1965] (3,1 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,2 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 24 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористоводородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,605 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 27
(GL732)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,55 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,2 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 12 NdCl3(L5) [образец Ρ1963] (3,25 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,5 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 29 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,462 г полибутадиена с содержанием 1,4-цис единиц >99,9%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
На Фигуре 2(c) показан спектр Фурье-ИК полученного полибутадиена.
На Фигуре 6 показан спектр 1Н-ЯМР и 13С-ЯМР полученного полибутадиена.
ПРИМЕР 28
(А003)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,45 мл толуола и температуру полученного таким образом раствора довели до 20°С. Затем добавили метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1⋅10-2 молей, равный около 0,58 г) и затем получили комплекс по Примеру 12 NdCl3(L5) [образец Ρ1963] (3,25 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,5 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 116 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,287 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 29
(А004)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 12,57 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 12 NdCl3(L5) [образец Ρ1963] (3,25 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,5 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 60 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористоводородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,435 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 30
(GL733)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,65 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,2 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 14 NDCl3(L8) [образец Ρ1964] (3,15 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,3 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 29 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,280 г полибутадиена с содержанием 1,4-цис единиц >99,6%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
На Фигуре 2(d) показан спектр Фурье-ИК полученного полибутадиена.
На Фигуре 4 показан спектр 1H-ЯМР и 13С-ЯМР полученного полибутадиена.
ПРИМЕР 31
(A005)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 6,55 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили метилалюмоксан (МАО) в растворе толуола (6,3 мл; 1⋅10-2 молей, равный около 0,58 г) и затем получили комплекс по Примеру 14 NdCl3(L8) [образец Р1964] (3,15 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,3 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 116 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,312 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 32
(А006)
2 мл 1,3-бутадиена, равного около 1,4 г, конденсировали при низкой температуре (-20°С) в 25 мл пробирке. Затем добавили 12,67 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 14 NdCl3(L8) [образец Ρ1964] (3,15 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 6,3 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 60 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористоводородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,420 г полибутадиена с содержанием 1,4-цис единиц >99%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
ПРИМЕР 33
Предварительное получение тернарной каталитической системы AlEt2Cl/Nd(OCOC7H15)3/Al(1Bu)3
В 50 мл пробирку последовательно ввели 15 мл 0,05 M раствора неодим 2-этилгексаноата [Nd(ОСОС7Н15)3] в гептане (7,5⋅10-4 молей), 16,6 мл гептана и 0,29 мл диэтил алюминий хлорида (AlEt2Cl) (2,3⋅10-3 молей). При добавлении диэтил алюминий хлорида (AlEt2Cl) сразу же получили белесую суспензию, которую выдержали при перемешивании магнитной мешалкой при комнатной температуре в течение 15 минут. Затем добавили три-изо-бутилалюминий [Al(1Bu)3] (5,63 мл; 2,25×10-2 молей) и полученный раствор выдерживали в течение 2 часов при постоянном перемешивании при температуре 20°С с получением каталитической суспензии с концентрацией неодима равной 0,02 М.
ПРИМЕР 34
(сравнительный)
В 25 мл пробирке конденсировали 2 мл 1,3-бутадиена, равного около 1,4 г при низкой температуре (-20°С). Затем добавили 7 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили полученный по Примеру 33 тернарный катализатор AlEt2Cl/Nd(OCOC7H15)3/Al(1Bu)3 (0,5 мл; 1⋅10-5 молей Nd). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 1,25 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,78 г полибутадиена с содержанием 1,4-цис единиц равного около 96%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 1.
На Фигуре 1 показан спектр 1H-ЯМР полученного полибутадиена.
На Фигуре 2(a) показан спектр Фурье-ИК полученного полибутадиена.
Таблица 1
Полимеризация 1,3-бутадиена каталитическими системами, полученными in situ
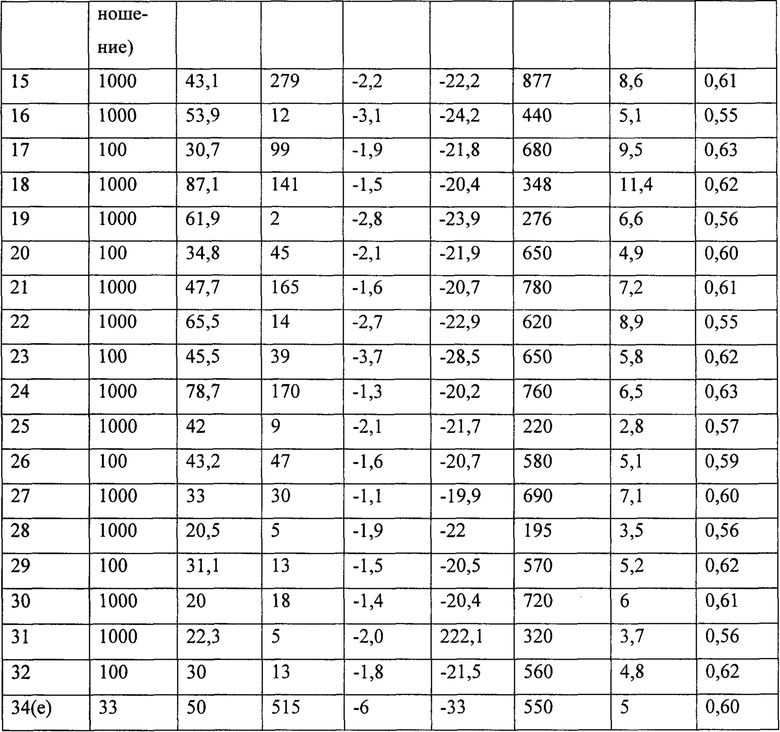
(a): количество молей 1,3-бутадиена, полимеризованного за час молем лантанида;
(b): точка плавления;
(c): температура кристаллизации;
(d): коэффициент линейности полибутадиена;
(e): полимеризацию провели с предварительным получением катализатора по Примеру 33.
ПРИМЕР 35
(GL760)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 7 мл гептана и температуру полученного таким образом раствора поддерживали равной 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,22 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 9 NdCl3(L1) [образец GL380/P1891] (2,8 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,6 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 45 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 1,129 г полиизопрена с содержанием 1,4-цис единиц равным 98%; дополнительные характеристики процесса и полученного полиизопрена приведены в Таблице 2.
На Фигуре 7 показан спектр 1H-ЯМР и 13С-ЯМР полученного полиизопрена.
ПРИМЕР 36
(GL800)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 7 мл гептана и температуру полученного таким образом раствора поддерживали равной 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,22 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 9 NdCl3(L1) [образец GL380/P1891] (2,8 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,6 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 50°С в течение 23 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 1,36 г полиизопрена с содержанием 1,4-цис единиц >98%, и температура стеклования (Tg) равна -66,0°С; дополнительные характеристики процесса и полученного полиизопрена приведены в Таблице 2.
На Фигуре 8 показана DSC диаграмма полученного полиизопрена.
ПРИМЕР 37
(GL805)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 13,2 мл гептана и довели температуру полученного таким образом раствора до 50°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 9 NdCl3 (L1) [образец GL380/P1891] (2,8 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,6 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 50°С в течение 24 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористоводородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 1,36 г полиизопрена с содержанием 1,4-цис единиц >98%: дополнительные характеристики процесса и полученного полиизопрена приведены в Таблице 2.
ПРИМЕР 38
(Р1885)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 6,83 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,22 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 10 NdCl3(L2) [образец GL360] (2,95 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,9 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 48 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористоводородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,447 г полиизопрена с содержанием 1,4-цис единиц >98%, и температура стеклования (Tg) равна -64,9°С; дополнительные характеристики процесса и полученного полиизопрена приведены в Таблице 2.
ПРИМЕР 39
(GL759)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 6,9 мл гептана и температуру полученного таким образом раствора довели до 20°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,22 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 11 NdCl3(L4) [образец Р1888] (2,9 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,8 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 45 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,307 г полиизопрена с содержанием 1,4-цис единиц >98%: дополнительные характеристики процесса и полученного полиизопрена приведены в Таблице 2.
ПРИМЕР 40
(GL799)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 6,9 мл гептана и температуру полученного таким образом раствора довели до 50°С. Затем добавили тетра-изо-бутил-алюмоксан (TIBAO) в растворе циклогексана (6,22 мл; 1⋅10-2 молей, равный около 2,9 г) и затем получили комплекс по Примеру 11 NdCl3(L4) [образец Ρ1888] (2,9 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,8 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 50°С в течение 22,5 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 1,36 г полиизопрена с содержанием 1,4-цис единиц >98%, и температура стеклования (Tg) равна -66,3°С; дополнительные характеристики процесса и полученного полиизопрена приведены в Таблице 2.
На Фигуре 9 показана DSC диаграмма полученного полиизопрена.
ПРИМЕР 41
(GL802)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 12,92 мл гептана и температуру полученного таким образом раствора довели до 50°С. Затем добавили ди-изо-бутил-алюминий гидрид (DIBAH) (0,18 мл; 1 ммоль, равный около 144 мг) и затем получили комплекс по Примеру 11 NdCl3(L4) [образец Р1888] (2,9 мл раствора толуола в концентрации равной 2 мг/мл; 1⋅10-5 молей, равной около 5,8 мг). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 50°С в течение 24 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 1,36 г полиизопрена с содержанием 1,4-цис единиц >98%; дополнительные характеристики процесса и полученного полиизопрена приведены в Таблице 2.
ПРИМЕР 42
(сравнительный)
2 мл изопрена, равного около 1,36 г, ввели при температуре 20°С в 25 мл пробирку. Затем добавили 7 мл гептана и температуру полученного таким образом раствора поддерживали равной 20°С. Затем добавили полученный по Примеру 33 тернарный катализатор AlEt2Cl/Nd(OCOC7H15)3/Al(1Bu)3 (0,5 мл; 1⋅10-5 молей Nd). Всю смесь выдержали при перемешивании магнитной мешалкой при температуре 20°С в течение 6 часов. Затем полимеризацию остановили добавлением 2 мл метанола, содержащего несколько капель хлористо-водородной кислоты. Затем полученный полимер коагулировали добавлением 40 мл раствора метанола, содержащего 4% антиоксиданта Irganox® 1076 (Ciba) с получением 0,544 г полибутадиена с содержанием 1,4-цис единиц равным около 94%; дополнительные характеристики процесса и полученного полибутадиена приведены в Таблице 2.
На Фигуре 1 показан спектр 1H-ЯМР полученного полиизопрена.
Таблица 2
Полимеризация изопрена каталитическими системами, полученными in situ
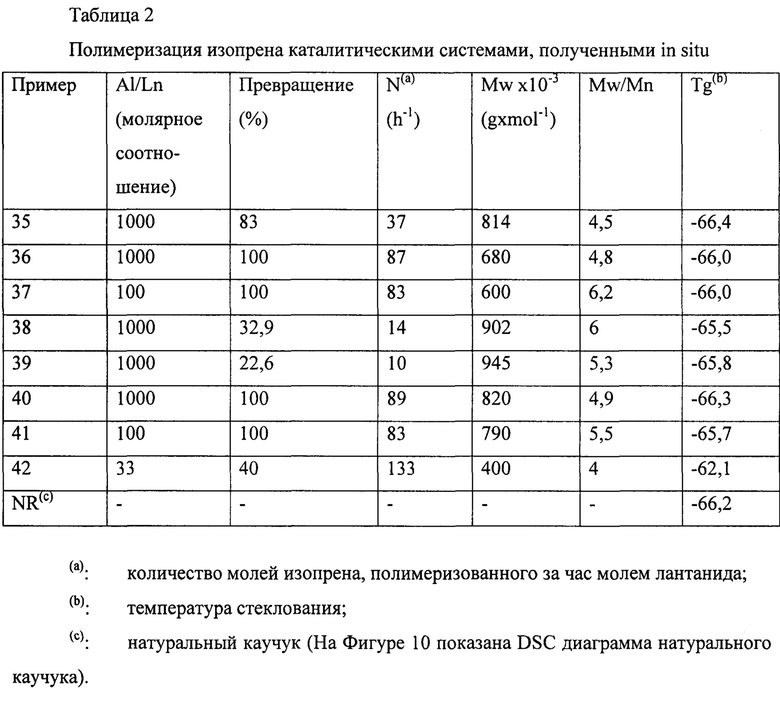
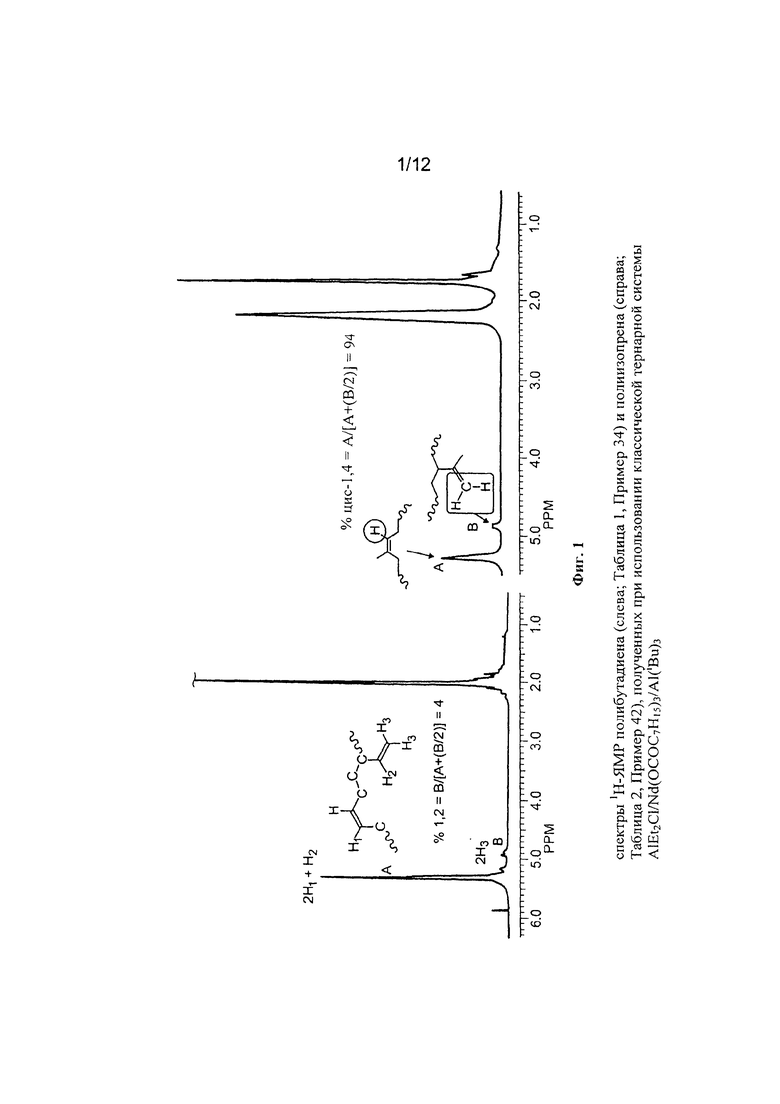
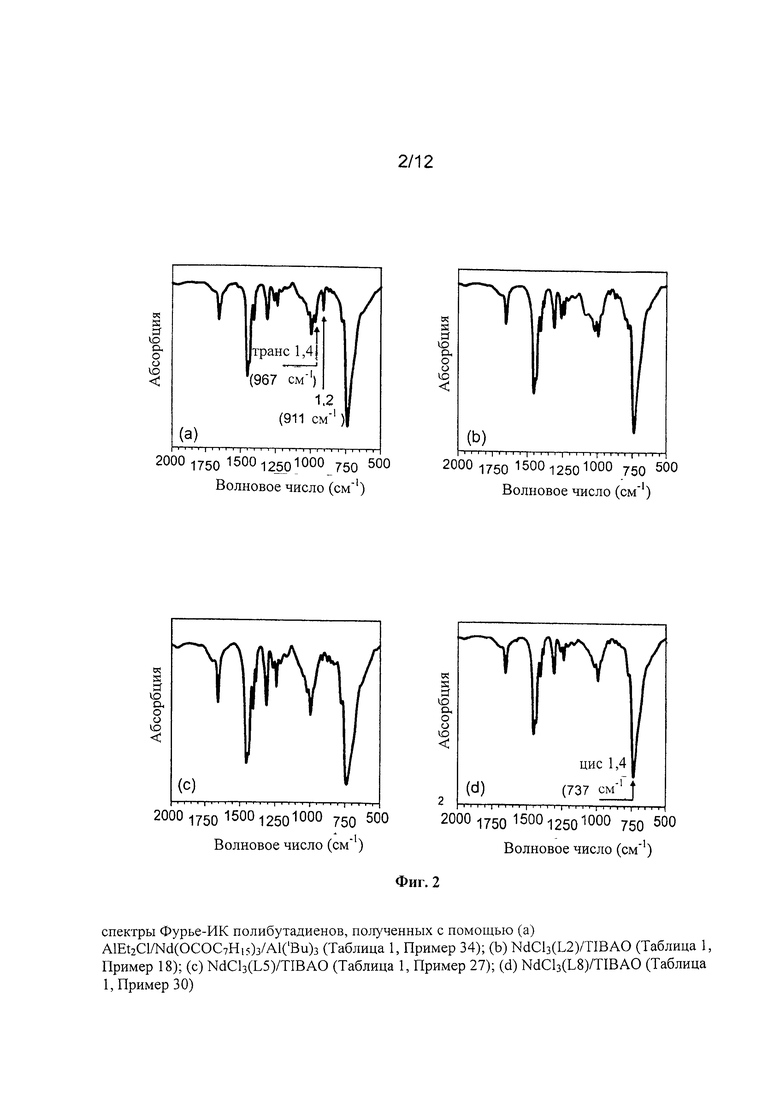
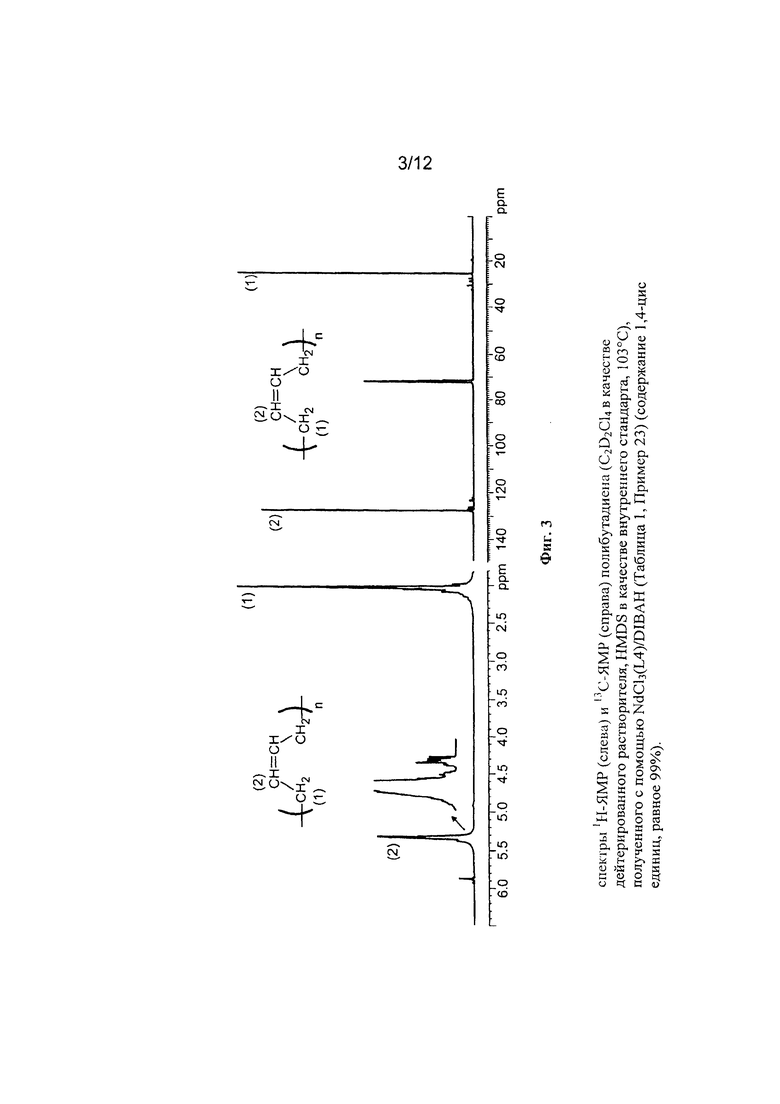
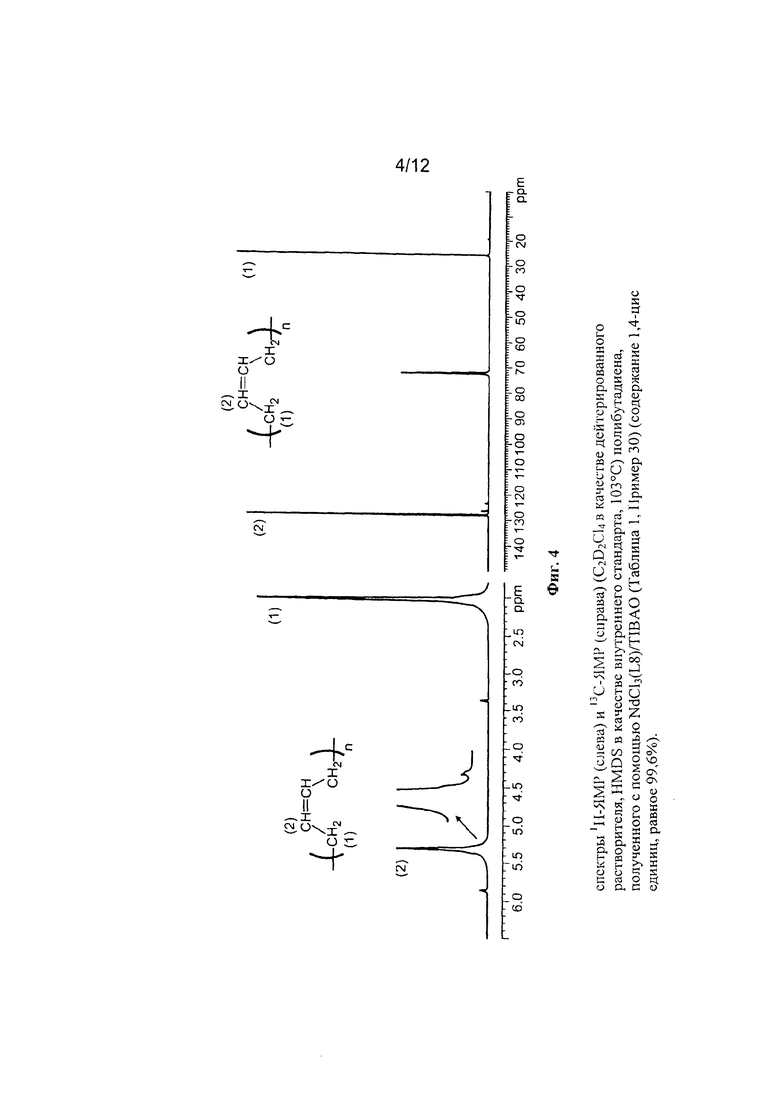
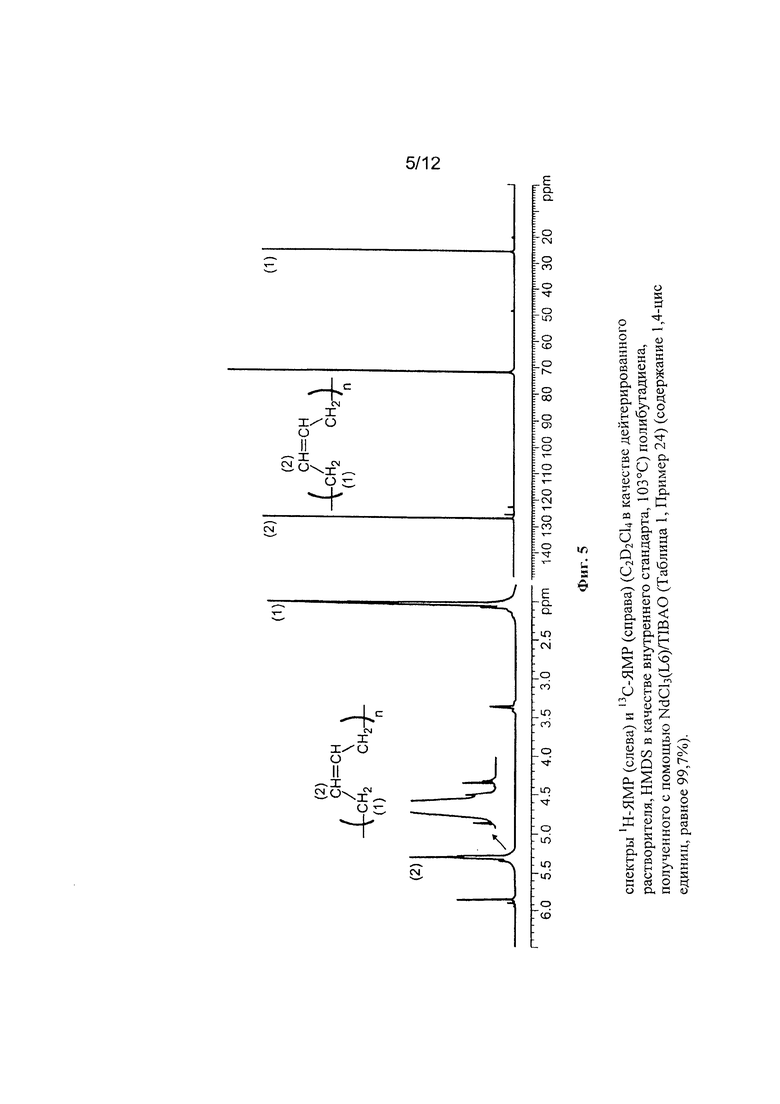
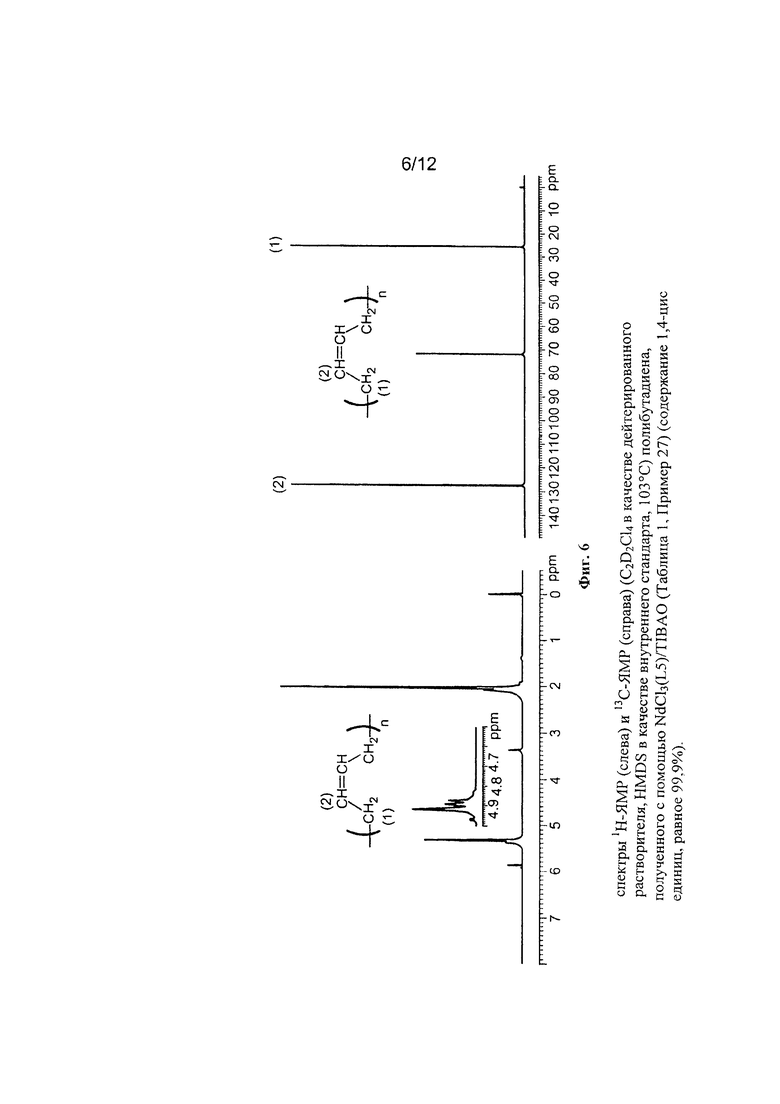
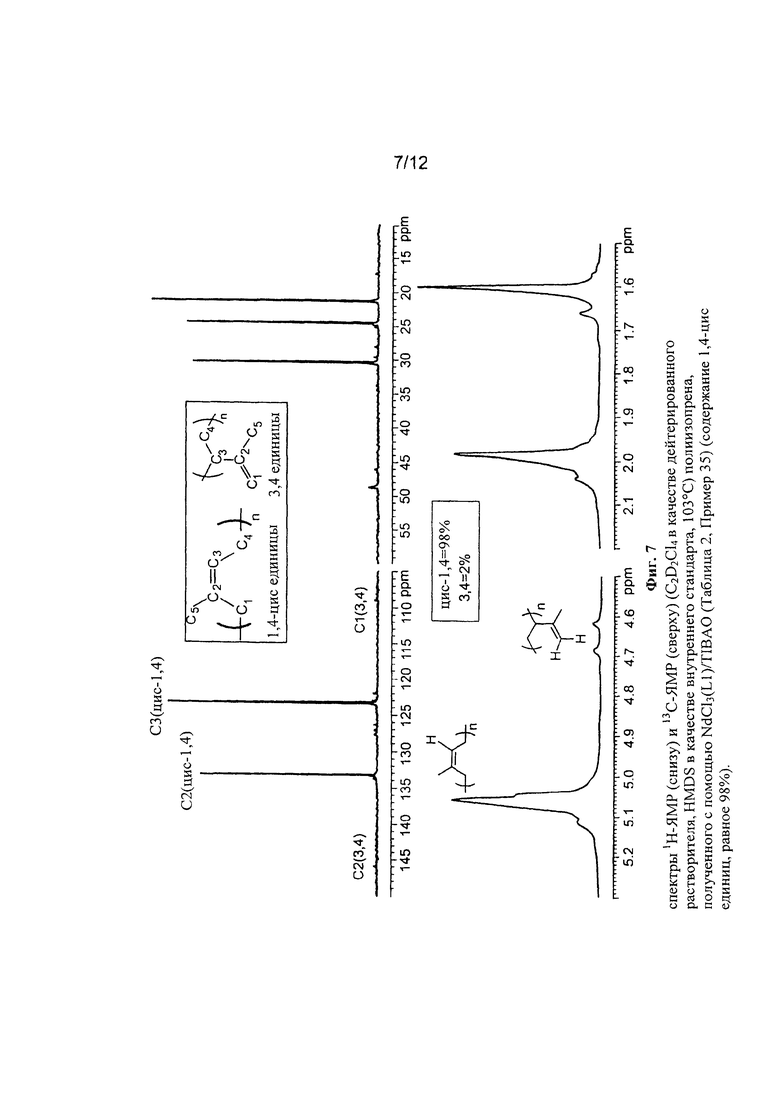
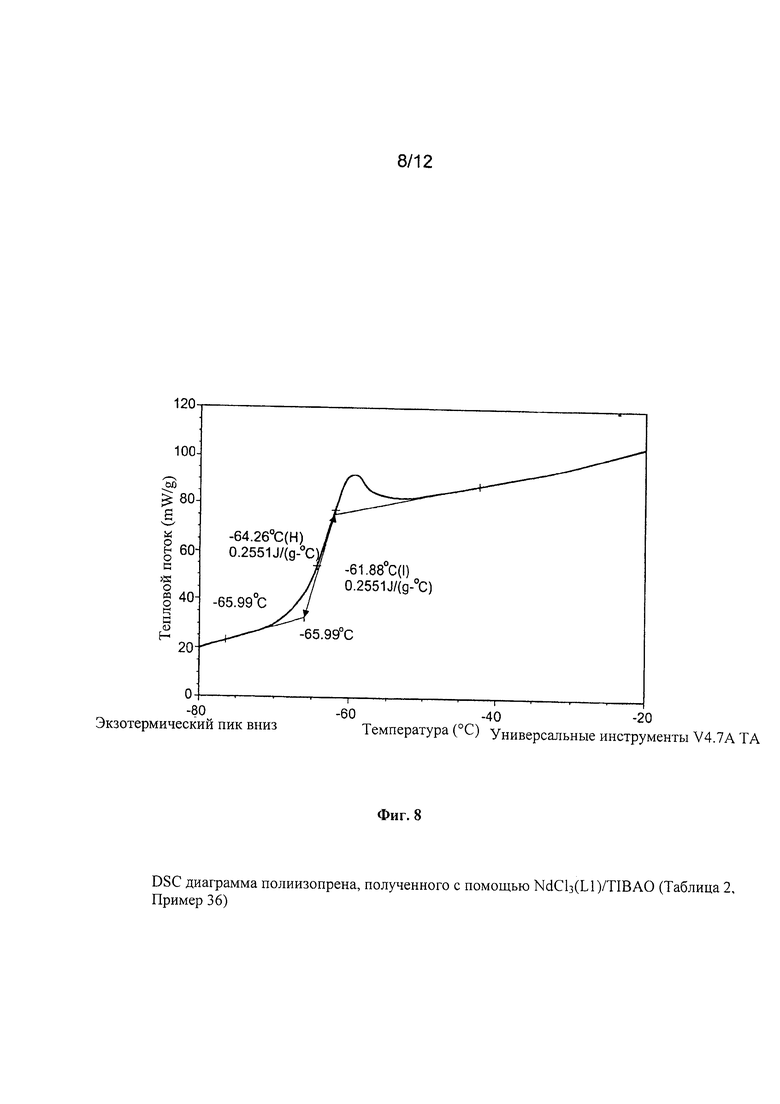
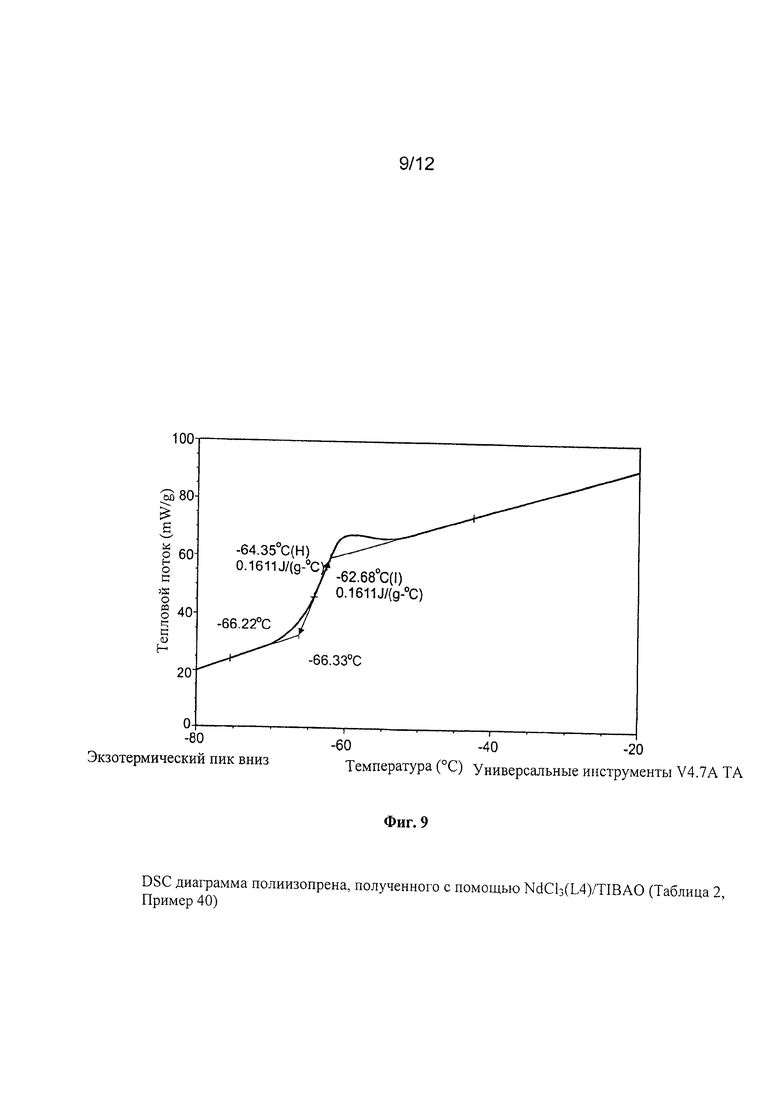
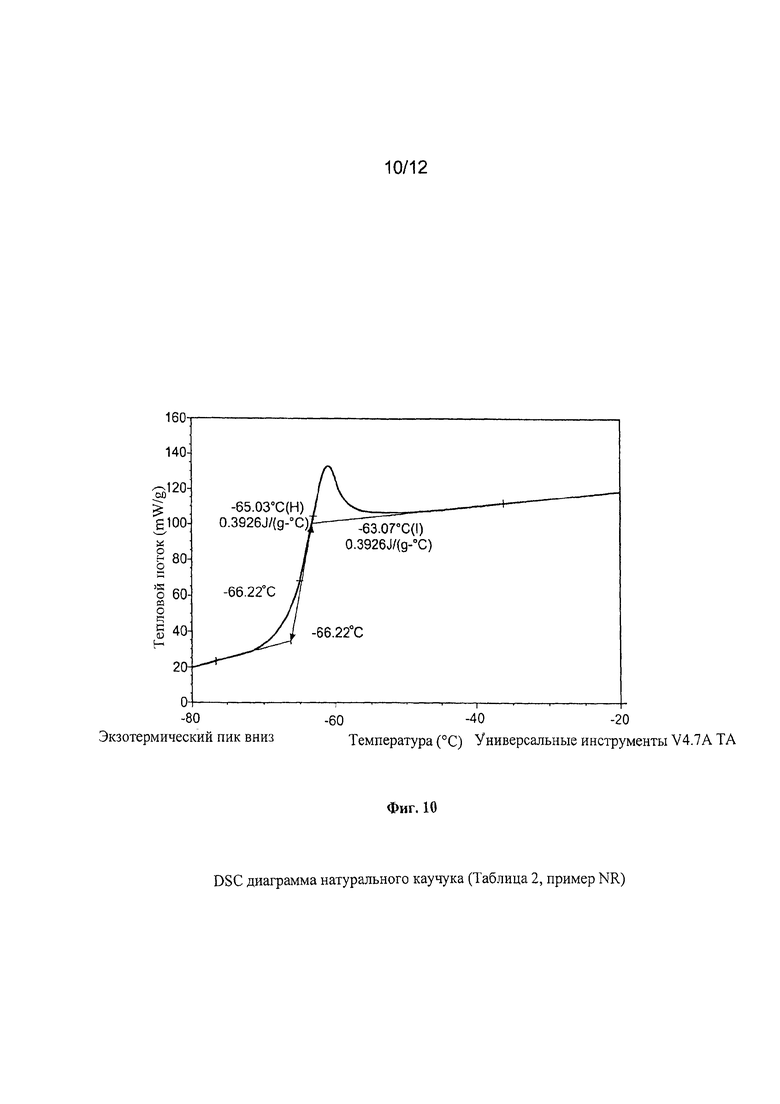
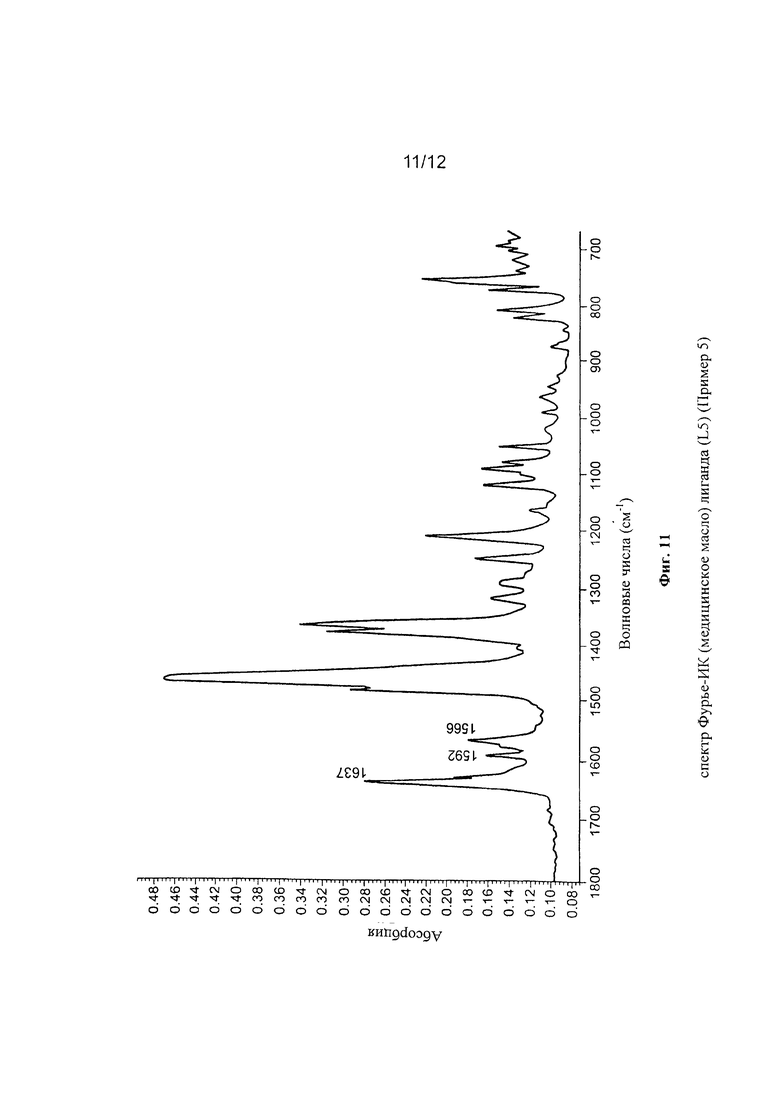
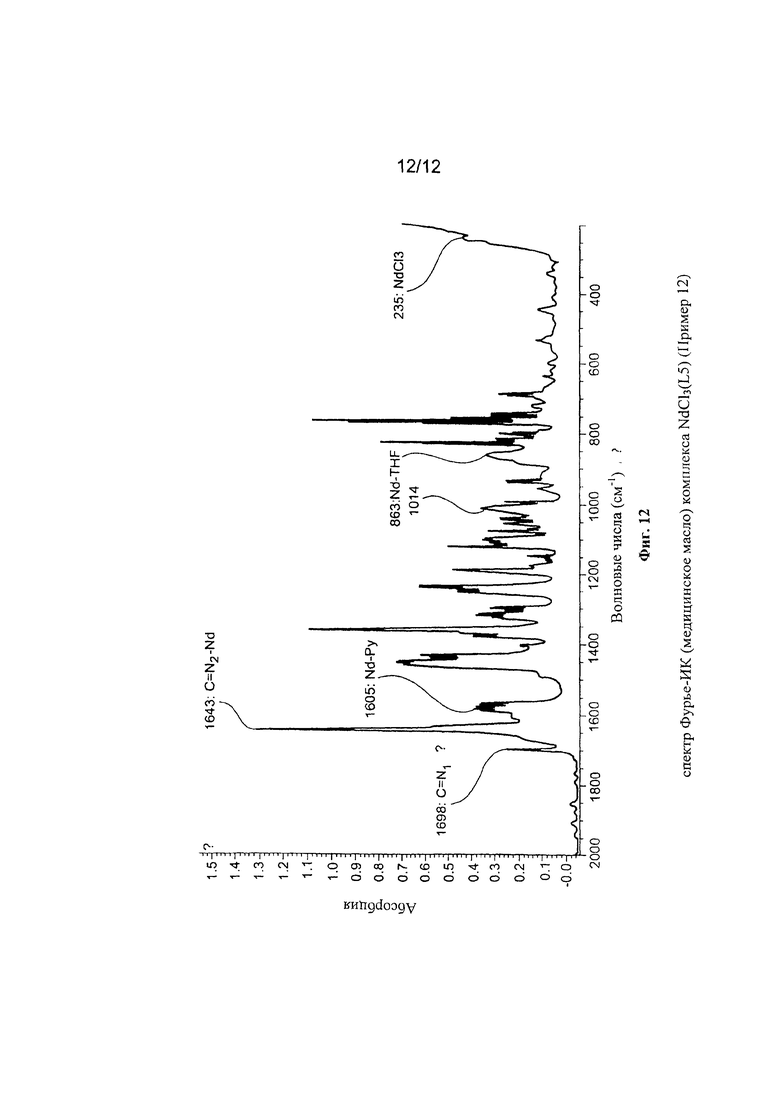
Изобретение относится к бис-имин пиридиновому комплексу лантанидов с общей формулой (I)
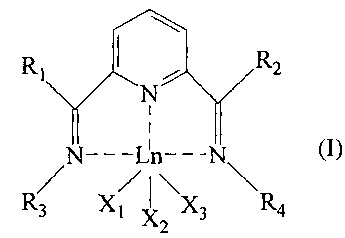
где Ln представляет неодим (Nd), R1 и R2 одинаковы и выбираются из линейных или разветвленных С1-С20 алкильных групп, R3 и R4 одинаковы или отличаются друг от друга и выбираются из необязательно замещенных циклоалкильных групп, необязательно замещенных арильных групп, Х1, Х2 и Х3 одинаковы и представляют атом галогена, такой как хлор, бром, йод. Также предложены каталитическая система для (со)полимеризации конъюгированных диенов, способ (со)полимеризации конъюгированных диенов и способ полимеризации 1,3-бутадиена или изопрена. Указанный бис-имин пиридиновый комплекс лантанидов с общей формулой (I) позволяет получить (со)полимеры конъюгированных диенов, в частности полибутадиен и полиизопрен с высоким содержанием 1,4-цис единиц. 4 н. и 3 з.п. ф-лы, 12 ил., 2 табл., 42 пр.
1. Бис-имин пиридиновый комплекс лантанидов с общей формулой (I)
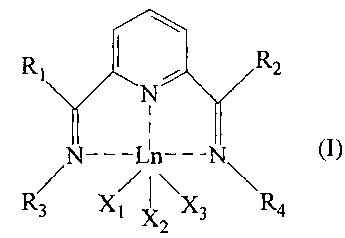
где Ln представляет неодим (Nd);
R1 и R2 одинаковы и выбираются из линейных или разветвленных С1-С20 алкильных групп;
R3 и R4 одинаковы или отличаются друг от друга и выбираются из необязательно замещенных циклоалкильных групп, необязательно замещенных арильных групп;
Х1, Х2 и Х3 одинаковы и представляют атом галогена, такой как хлор, бром, йод.
2. Каталитическая система для (со)полимеризации конъюгированных диенов, содержащая:
(a) по меньшей мере один бис-имин пиридиновый комплекс лантанидов с общей формулой (I) по п. 1;
(b) по меньшей мере один сокатализатор, выбираемый из:
(b1) алкилов алюминия с общей формулой (II)
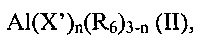
где X' представляет атом галогена, такой как хлор, бром, йод, фтор, или атом водорода;
R6 их выбирают из линейных или разветвленных C1-C20 алкильных групп, С3-С20 циклоалкильных групп, арильных групп, указанные группы необязательно замещены одним или более атомом кремния или германия;
n представляет целое число от 0 до 2;
(b2) алюмоксанов с общей формулой (III)
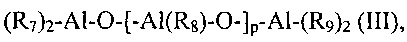
где R7, R8 и R9 одинаковы или отличаются друг от друга и представляют собой атом водорода, атом галогена, такой как хлор, бром, йод, фтор; или выбираются из линейных или разветвленных С1-С20 алкильных групп, С3-С20 циклоалкильных групп, арильных групп, указанные группы необязательно замещены одним или более атомом кремния или германия;
p представляет целое число от 0 до 1000.
3. Каталитическая система для (со)полимеризации конъюгированных диенов по п. 2, где указанный сокатализатор (b) выбирают из ди-изо-бутил-алюминия гидрида (DIBAH), метилалюмоксана (МАО), тетра-изо-бутил-алюмоксана (TIBAO).
4. Каталитическая система для (со)полимеризации конъюгированных диенов по пп. 2 или 3, где в указанной каталитической системе молярное соотношение между неодимом, присутствующим в бис-имин пиридиновом комплексе лантанидов (а) с общей формулой (I), и алюминием, присутствующим в сокатализаторе (b), выбираемом из алкилов алюминия (b1) или алюмоксанов (b2), составляет в пределах от 5 до 5000.
5. Способ (со)полимеризации конъюгированных диенов, характеризующийся тем, что в нем используют каталитическую систему по любому из пп. 2-4.
6. Способ (со)полимеризации по п. 5, где указанные конъюгированные диены представляют 1,3-бутадиен, изопрен.
7. Способ полимеризации 1,3-бутадиена или изопрена, характеризующийся тем, что в нем используют каталитическую систему по любому из пп. 2-4.
| Устройство записи информации на основе бистабильных переключателей | 1986 |
|
SU1367069A1 |
| WO 2004074333 A2, 02.09.2004 | |||
| US 20080114136 A1, 15.05.2008 | |||
| US 20100286350 A1, 11.11.2010 | |||
| КАТАЛИТИЧЕСКАЯ СИСТЕМА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ ЭЛАСТОМЕРОВ С ПОМОЩЬЮ ЭТОЙ СИСТЕМЫ | 2001 |
|
RU2268268C2 |
Авторы
Даты
2017-04-12—Публикация
2012-09-13—Подача