Изобретение относится к области молекулярной биологии и биотехнологии, в частности к способу консервации биологических материалов (кровь, моча, мазки-соскобы, суспензии растений, фитопатогены и т.п.), используемых в дальнейшем для проведения лабораторного анализа.
Известные способы консервации и транспортировки биологических материалов требуют либо замораживания в жидком азоте суспензии биологического материала со смесью соединений стабилизирующей композиции в водном растворе с получением твердых замороженных частиц, гранул, капель или нитей, либо заключения биологического материала в неагрессивную капсулу из металла, либо нанесения его на абсорбирующий бумажный лист, имеющий множество выборок зон, каждая выборка зоны имеет перфорацию, проходящую, по существу, по всему его периметру, так, чтобы препятствовать перетеканию капиллярного жидкого образца, из одной зоны в другую (RU 2573324, 20.01.2016; US 5516487, 14.05.1996; RU 2228617, 20.05.2004; WO 9957264, 11.11.1999). Однако ни одна из технологий консервации не давала в достаточной мере решения проблемы долгосрочной консервации биологического материала с сохранением их биологически и диагностически значимых свойств. На данный момент является актуальным создание простого способа для сохранения диагностически и биологически значимых свойств биологического материала в течение длительного времени.
Известен способ консервации биологических материалов путем сушки без замораживания с помощью стабилизирующей смеси веществ, включающей, по меньшей мере, два компонента: одно из группы, включающей моносахариды, дисахариды и цвиттерион с полярным остатком, второе вещество стабилизирующей смеси является цвиттерионом с неполярным остатком и представляет собой сложный эфир ацетилфенилаланина, аланин, цистеин, глицин, лейцин, метионин, триптофан, валин, саркозин. Стабилизированные биологические материалы обладают устойчивостью в процессе хранения при комнатной температуре и используются для диагностических и терапевтических целей (RU 2191003, 20.10.2002). Однако указанный способ сложен в исполнении и использовании.
Известен способ консервации биологических материалов, обеспечивающий сохранность нуклеиновых кислот путем получения лизата смешиванием биологического материала с консервирующим раствором, содержащим соединение гуанидина в количестве, достаточном для существенно полной денатурации содержащихся в образце нуклеаз, а также с компонентами, препятствующими деградации нуклеиновых кислот, а именно с восстановителем белковых S-S-связей в количестве, обеспечивающем существенно полное восстановление S-S-связей в белках лизата, с сильным детергентом, не образующим нерастворимого соединения с гуанидином, в количестве, достаточном для формирования мицелл в лизате, по крайней мере, с одним комплексоном ионов двух- и трехвалентных металлов в количестве, обеспечивающем его молярную концентрацию в лизате, заведомо более высокую, чем ожидаемая максимальная молярная концентрация ионов двух- и трехвалентных металлов, и буфером, поддерживающим значение рН лизата в диапазоне от 6 до 8. Способ обеспечивает сохранность нуклеиновых кислот при длительном хранении образцов в не замороженном состоянии (RU 2322058, 20.04.2008). Недостатками способа являются также его сложность выполнения и невысокая длительность хранения биологического материала, которая была прослежена только в течение 3, 7 и 14 суток.
В качестве ближайшего аналога нами рассмотрен способ консервации биологических материалов путем иммобилизации их на сухом носителе с последующим высушиванием. В соответствии с данным способом человеческий генетический образец или генетические образцы человека сохраняются в процессе домашнего самостоятельного хранения (US 5856102, 05.01.1999). Однако авторами не показана сохранность биологически значимых свойств образцов и длительность их хранения.
Сущность изобретения
Технический результат заключается в повышении сохранности диагностически и биологически значимых свойств биологического материала в течение длительного времени и расширении арсенала средств консервации биологических материалов, используемых в дальнейшем для проведения лабораторного анализа.
Технический результат достигается тем, что консервация биологических материалов включает иммобилизацию их на сухом носителе с последующим высушиванием, при этом в качестве носителя для иммобилизации используют крупнопористый химически нейтральный гидрофильный материал, который предварительно, перед иммобилизацией на него биологического материала, пропитывают консервирующим раствором, содержащим 0,7 М сахарозу, 1.5 М Tris HCl с рН 7,4 и 0,5 М этилендиаминтетрауксусную кислоту.
Сухой носитель пропитывают консервирующим раствором.
При этом консервирующий раствор сохраняет постоянство концентрации водородных ионов, с сохранением постоянного значения рН.
Кроме того, высушивание проводят в условиях, не допускающих разложение консервирующего раствора.
Восстановление высушенного биоматериала осуществляют путем его смыва водой или растворителем.
Пропитывание крупнопористого химически нейтрального гидрофильного материала носителя консервирующим раствором осуществляют до полного его пропитывания.
Кроме того, в способе консервация биологических материалов для предотвращения процесса гемолиза и сохранения гипобиоза растений консервирующий раствор содержит 0.7 М сахарозу. При этом он, пропитывая сухой носитель, позволяет длительно сохранять материал от растений и фитопатогенов.
Осуществление способа поясняются следующими примерами.
Пример 1
Перед нанесением реагента на крупнопористый химически нейтральный гидрофильный материал носителя готовят консервирующий раствор с определенной концентрацией. Предварительно готовили консервирующий раствор путем смешивания сахарозы, буфера Tris HCl и этилендиаминтетрауксусной кислоты. При этом 10 мл консервирующего раствора содержали в себе Tris - 1,5 М, рН подводили HCl до рН 7,4, сахарозы - 0,7 М, к ним добавляли 2 мл 0,5 М EDTA (рН 7,4).
Сухой носитель шириной 1 см и длиной 2.5 см, встроенный в картонный конверт, опускали в емкость с консервирующим раствором, содержащим 0,7 М сахарозу, 1.5 М Tris HCl (рН 7,4) и 2 мл 0,5 М EDTA и выдерживали в течение двух часов. Затем носитель высушивали в течение 1,5 часов при комнатной температуре.
На высушенный крупнопористый химически нейтральный гидрофильный материал носителя вносили 100-150 мкл крови, то есть до полного впитывания, и высушивали не менее 1.5 часов при комнатной температуре от 15° до 25°С.
Затем картонный конверт вместе с осушителем (гидрогелем) упаковали в зип-пакет, и хранили в бытовом холодильнике с температурой 2-5°С в течение не менее пяти лет до основного назначения (исследования методами полимеразной цепной реакции (ПЦР) и иммуноферментным анализом (ИФА)).
Для исследования биоматериалов, хранившихся на носителе, методами ПЦР и ИФА проводили восстановление их в жидкую форму. Для этого с использованием ножниц аккуратно разрезали носитель на три части, помещали их в 1,5 мл пробирку, содержащую 300 мкл дистиллированной воды. Пробирку оставляли при комнатной температуре на 10 мин, периодически встряхивая на вортексе. Затем центрифугировали пробирку, отбирали надосадочную жидкость и переносили ее в чистую пробирку. Полученную жидкую пробу использовали в дальнейшей работе.
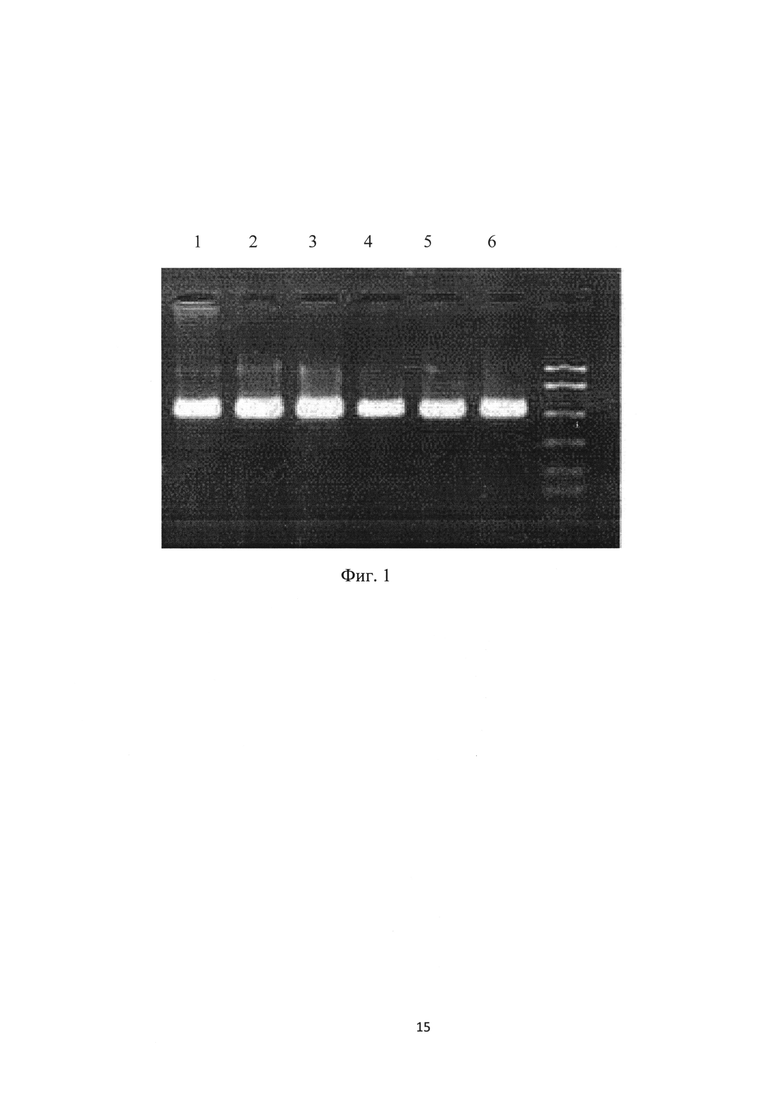
С использованием коммерческого набора реагентов для выделения ДНК/РНК из различных материалов производства ООО «БИОКОМ» проводили выделения ДНК и РНК микроорганизмов как с образцов с мембраны, так и из жидких образцов крови, отобранных с 3% раствором EDTA. ПЦР проводили согласно протоколу к наборам для амплификации, производства ООО «БИОКОМ». ИФА проводили с использованием коммерческого иммуноферментного набора реагентов IDEXX (США), определяли титры антител в крови животных к сальмонеллезу в нативных, так и в высушенных на носителе образцах. Результаты ПЦР анализа показаны на фиг. 1, где треки: 1-3 - выделенная ДНК Toxoplasma gondii из жидких образов крови, 4-6 - выделенная ДНК Toxoplasma gondii из сухих образцов крови, нанесенных на мембраны, пропитанные раствором, содержащим 0,7 М сахарозу, 1.5 M Tris HCl (рН 7,4) и 0,5 М EDTA. Для всех исследованных образцов полученные результаты в ИФА по определению антител с сухих мембран и нативных образцов коррелируют, что свидетельствует о стабильности консервированных сухих образцов.
Пример 2
В исследование брали листья картофеля и томата, пораженные X вирусом картофеля (PVX-Грибы), S вирусом картофеля (PVS-тля), M вирусом картофеля (PVM-тля), К вирусом томатов (TVK), L вирусом томатов (TVL). Из пораженных листьев картофеля и томатов отжимали сок. Предварительно готовили консервирующий раствор путем смешивания сахарозы, буфера Tris HCl и этилендиаминтетрауксусной кислоты. При этом 10 мл консервирующего раствора содержали в себе Tris - 1,5 М, рН подводили HCl до рН 7,4, сахарозы - 0,7 М, к ним добавляли 2 мл 0,5 М EDTA (рН 7,4).
Сухой носитель шириной 1 см и длиной 2.5 см, встроенный в картонный конверт, опускали в емкость с консервирующим раствором на 10 секунд до его полного пропитывания. Носитель высушивали в течение 1,5 часов при комнатной температуре. Иммобилизацию проводили путем внесения на высушенный крупнопористый химически нейтральный гидрофильный материал носителя 100-150 мкл сока растений с фитопатогенами. После чего носитель с нанесенным на него соком растений с фитопатогенами, заключенный в бумажный картон, высушивали в течение 1,5 часов при комнатной температуре от 15° до 25°С. Затем картонный конверт вместе с осушителем упаковали в зип-пакет и хранили в бытовом холодильнике с температурой 2-5°С в течение 5 лет до основного назначения (исследования проводили методами ПЦР и ИФА).
Для исследования фитопатогенов, хранившихся на носителе методами ПЦР и ИФА, проводили восстановление их в жидкую форму. Для этого с использованием ножниц аккуратно разрезали носитель на три части, помещали их в 1,5 мл пробирку, содержащую 300 мкл дистиллированной воды. Пробирку оставляли при комнатной температуре на 10 мин, периодически встряхивая на вортексе. Затем центрифугировали пробирку, отбирали надосадочную жидкость и переносили ее в чистую пробирку. Полученную жидкую пробу использовали в дальнейшей работе.
С использованием коммерческого набора реагентов для выделения ДНК/РНК из различных материалов производства ООО «БИОКОМ» проводили выделения ДНК картофеля и томатов. Далее проводили постановку полимеразной цепной реакции согласно протоколу к набору реагентов «PlantV-ПЦР-ядро», производства ООО «БИОКОМ». С использованием набора реагентов «ИММУНОТЕСТ-ХВК», производства ООО «БИОКОМ» определяли Х-вирус картофеля в нативных и в высушенных на носителе образцах. Работу проводили согласно инструкции по применению к набору «ИММУНОТЕСТ-ХВК». Результаты работы показали, что ДНК картофеля и томатов выявлялись из всех образцов как нативных, так и с сухого носителя. Результаты ИФА представлены в табл. 1
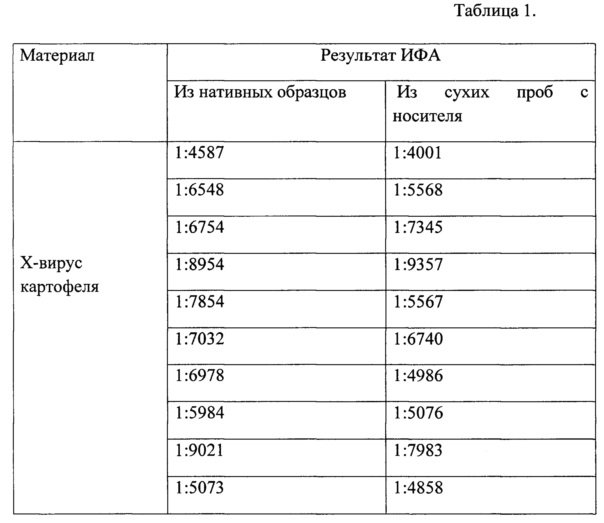
Таким образом, полученные результаты показывают, что данный способ консервации применим к растениям и фитопатогенам и сохраняет биологические и диагностические свойства исследуемого материала.
Пример 3
Проведено исследование сохранности биологических свойств лактобактерий, изолированных от пациенток в урогенитальных мазках. При этом предварительно готовили консервирующий раствор путем смешивания сахарозы, буфера Tris HCl и этилендиаминтетрауксусной кислоты. При этом 10 мл консервирующего раствора содержали в себе Tris - 1,5 М, рН подводили HCl до рН 7,4, сахарозы - 0,7 М, к ним добавляли 2 мл 0,5 М EDTA (рН 7,4). Сухой носитель шириной 1 см и длиной 2.5 см, встроенный в картонный конверт, опускали в емкость с раствором, содержащим 0,7 М сахарозу, 1.5 М Tris Hcl (рН 7,4) и 0,5 М EDTA, и выдерживали 10 секунд до полного его пропитывания. Носитель высушивали в течение 1,5 часов при комнатной температуре. Иммобилизацию проводили путем внесения на высушенный крупнопористый химически нейтральный гидрофильный материал носителя урогенитальные смывы до полного заполнения пространства материала.
Затем картонный конверт вместе с осушителем упаковали в зип-пакет и хранили в бытовом холодильнике с температурой 2-5°С в течение 5 лет до основного назначения (микробиологического исследования). Отрезанный кусочек носителя с сухим образцом помещали в пробирку, в которую добавляли воду для растворения сухого образца. Пробирку оставляли в штативе при комнатной температуре в течение 10 мин и периодически встряхивали на вортексе. Затем центрифугировали в течение 40 секунд при 10 тысячах об/мин. Полученную суспензию переносили в чистую пробирку и использовали при микробиологическом исследовании материала. При этом количество жизнеспособных лактобактерий варьировало в различных пределах. Результаты представлены в таблице 2.
Таблица 2. Количество жизнеспособных клеток в культурах лактобактерий, хранившихся на сухом носителе, предварительно пропитанном консервирующим раствором.


Полученные результаты показывают, что данный способ консервации позволяет сохранять биологические свойства материалов, нанесенных на сухую мембрану.
Пример 4
Из листьев картофеля, томатов отжимали сок, который наносили в количестве 100-150 мкл на крупнопористый химически нейтральный гидрофильный материал носителя, предварительно пропитанный консервирующим раствором, содержащим 0,7 М сахарозу, 1.5 М Tris HCl с рН 7,4 в конечной концентрации с добавлением к ним 2 мл 0,5 М этилендиаминтетрауксусной кислоты, и высушенный при комнатной температуре. После нанесения биологического материала носитель высушивали в течение 1,5 часов при комнатной температуре от 15° до 25°С. Затем картонный конверт с носителем биоматериала вместе с осушителем упаковали в зип-пакет и хранили в бытовом холодильнике с температурой 2-5°С в течение 5 лет. Для исследования биоматериалов растений, хранившихся на носителе методами ПЦР и ИФА, проводили восстановление их в жидкую форму. Для этого с использованием ножниц аккуратно разрезали носитель на три части, помещали их в 1,5 мл пробирку, содержащую 300 мкл дистиллированной воды. Пробирку оставляли при комнатной температуре на 10 мин, периодически встряхивая на вортексе. Затем центрифугировали пробирку, отбирали надосадочную жидкость и переносили ее в чистую пробирку. Полученную жидкую пробу использовали в дальнейшей работе. С использованием коммерческого набора реагентов для выделения ДНК/РНК из различных материалов производства ООО «БИОКОМ» проводили выделения ДНК картофеля и томатов. Далее проводили постановку полимеразной цепной реакции согласно протоколу к набору реагентов «Plant-ПЦР-ядро», производства ООО «БИОКОМ». Все исследованные биологические образцы из листьев картофеля и томатов, нанесенные на носитель, с последующем высушиванием, показали положительный результат при обнаружении ДНК. Результаты идентичны исследованию биологических образцов листьев картофеля и томатов из свежеполученной нативной суспензии (сок растений). Таким образом, изотонический консервирующий раствор для тканей растений обязательно должен содержать сахарозу. Экспериментальные данные показывают, что 0.7 М сахароза, используемая для консервации крови, достаточна и для длительной консервации биоматериала растений (сока).
Концентрации реагентов консервирующего раствора подобраны таким образом, чтобы сохранялась постоянная концентрация водородных ионов, то есть значение рН смеси в растворе сохранялось в значениях 7,4, так как его изменение ниже 7,4 приводит к защелачиванию, а выше 7,4 - к окислению биоматериала и соответственно к разрушению его клеток. А использование концентрации сахарозы в консервирующем растворе (0,7 М) обеспечивало длительное сохранение клеток биологического материала без повреждения, На примере 5 и 6 показано, что концентрация реагентов консервирующего раствора обеспечивает постоянство концентрации водородных ионов и длительное сохранение биологических и диагностических свойств клеток биоматериала.
Пример 5
Крупнопористый химически нейтральный гидрофильный материал, пропитанный консервирующим раствором, содержащим 0,7 М сахарозу, 1.5 М Tris HCl с рН 7,4 в конечной концентрации и с добавлением 2 мл 0,5 М этилендиаминтетрауксусной кислоты и иммобилизованными на него каплями крови и высушенными при комнатной температуре, еженедельно проверяли на значение рН. Для этого полоску лакмусовой бумажки смачивали дистиллированной водой, после чего ее клали непосредственно на носитель с сухими пятнами крови. По степени изменения окраски судили о реакции. Значение рН было стабильным (7.4) на протяжение всего периода исследования.
Пример 6
Консервирующие растворы, в состав которых входила сахароза 0,02 М, 0,2 М сахароза, 1.5 М Tris Hcl (рН 7,4) и 0,5 М EDTA (экспериментальные растворы), позволяли достаточно длительно сохранять эритроциты без гемолиза, но оказались непригодными при процессе восстановления сухих образцов в жидкую форму, т.е. образовывали трудноразбиваемый осадок. Восстановленная жидкая форма сухих образцов крови имеет консистенцию, подходящую для любых методов выделения нуклеиновый кислоты, то есть как на сорбенте, так и при спиртовым осаждении, а особенно для автоматизированных систем выделения, где консистенция образца имеет большое значение. И она была возможна только в результате хранения крови при довольно большой концентрации сахарозы в растворе (0,7 М). Также эффективным было совместное применение буфера (1,5 М Tris-HCl (рН 7,4) и с 2 мл 0,5 М ЭДТА) с сахарозой для сухого носителя. Концентрация ЭДТА (2 мл 0,5 М к 10 мл буфера) - стандартная концентрация используемая в буферных системах. А вот концентрация Tris HCl (1,5 М) подобрана экспериментальным путем, так как в процессе исследования было выявлено, что более низкая его концентрация (1 М, 0,5 М, 0,2 М) приводила к окислению проб, а большая (2 М, 2,5 М) к защелачиванию.
Таким образом, заявленный способ консервации биологических материалов обеспечивает повышение сохранности диагностически и биологически значимых свойств биологического материала в течение длительного времени за счет нанесения его на крупнопористый химически нейтральный гидрофильный носитель, пропитанный консервирующим раствором, способствующим предотвращению деградации клеток, за счет сохранения постоянства концентрации водородных ионов и постоянного значения рН, а также защитного действия, предотвращающего процесс гемолиза и сохраняющего гипобиоз растений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Универсальный способ выделения ДНК и лизирующая смесь для его осуществления | 2022 |
|
RU2807254C1 |
| Способ направленного истощения олигонуклеотидных библиотек для снижения неспецифической адсорбции при твердофазной селекции аптамеров на основе нуклеиновых кислот | 2015 |
|
RU2618872C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУХИХ БАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ | 2020 |
|
RU2738396C1 |
| Способ выделения РНК и ДНК из сухих биологических образцов, хранившихся на бумажном носителе, и набор для его осуществления | 2016 |
|
RU2628695C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК ИЗ КОСТНОГО МАТЕРИАЛА | 2019 |
|
RU2724506C1 |
| Способ хранения ДНК-содержащего растительного материала в широком диапазоне температур | 2017 |
|
RU2703058C2 |
| БЕЛКИ, ИНДУЦИРУЮЩИЕ МНОЖЕСТВЕННУЮ УСТОЙЧИВОСТЬ РАСТЕНИЙ К ФИТОПАТОГЕНАМ И ВРЕДИТЕЛЯМ | 2004 |
|
RU2333220C2 |
| Способ определения @ -субъединицы фактора роста нервов | 1989 |
|
SU1707540A1 |
| Способ выделения ДНК клинических изолятов Mycobacterium tuberculosis из ткани легкого | 2016 |
|
RU2659197C2 |
| СПОСОБ КОНСЕРВАЦИИ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ, ОБЕСПЕЧИВАЮЩИЙ СОХРАННОСТЬ НУКЛЕИНОВЫХ КИСЛОТ | 2005 |
|
RU2322058C2 |
Изобретение относится к области молекулярной биологии и биотехнологии, в частности к способу консервирования биологических материалов. Способ консервации биологических материалов включает иммобилизацию их на сухом носителе с последующим высушиванием. В качестве носителя для иммобилизации используют крупнопористый химически нейтральный гидрофильный материал, который предварительно, перед иммобилизацией на него биологического материала, пропитывают консервирующим раствором, содержащим 0,7 М сахарозу, 1.5 М Tris-HCl с рН 7,4 и 0,5 М этилендиаминтетрауксусную кислоту. Способ обеспечивает повышение сохранности диагностически и биологически значимых свойств биологического материала в течение длительного времени и расширение арсенала средств консервации биологических материалов, используемых в дальнейшем для проведения лабораторного анализа. 5 з.п. ф-лы, 1 ил., 2 табл., 6 пр.
1. Способ консервации биологических материалов, включающий иммобилизацию их на сухом носителе с последующим высушиванием, отличающийся тем, что в качестве носителя для иммобилизации используют крупнопористый химически нейтральный гидрофильный материал, который предварительно, перед иммобилизацией на него биологического материала, пропитывают консервирующим раствором, содержащим 0,7 М сахарозу, 1.5 М Tris-HCl с рН 7,4 и 0,5 М этилендиаминтетрауксусную кислоту.
2. Способ по п. 1, отличающийся тем, что сухой носитель пропитывают консервирующим раствором.
3. Способ по п. 1, отличающийся тем, что консервирующий раствор сохраняет постоянство концентрации водородных ионов, с сохранением постоянного значения рН.
4. Способ по п. 1, отличающийся тем, что высушивание проводят в условиях, не допускающих разложение консервирующего раствора.
5. Способ по п. 1, отличающийся тем, что восстановление высушенного биоматериала осуществляют путем его смыва водой или растворителем.
6. Способ по п. 1, отличающийся тем, что пропитывание крупнопористого химически нейтрального гидрофильного материала носителя консервирующим раствором осуществляют до полного его пропитывания.
| КОМПОЗИЦИЯ ДЛЯ ХРАНЕНИЯ ДНК-СОДЕРЖАЩИХ ПРЕПАРАТОВ ИЛИ ДНК (ВАРИАНТЫ) И ЕЕ ПРИМЕНЕНИЕ | 2014 |
|
RU2567145C1 |
| СТАБИЛИЗИРУЮЩАЯ КОМПОЗИЦИЯ ДЛЯ СУХОГО ХРАНЕНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ (ВАРИАНТЫ) | 2011 |
|
RU2573324C2 |
| СПОСОБ КОНСЕРВАЦИИ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ, ОБЕСПЕЧИВАЮЩИЙ СОХРАННОСТЬ НУКЛЕИНОВЫХ КИСЛОТ | 2005 |
|
RU2322058C2 |
| US 5856102 A1, 05.01.1999 | |||
| US 20040171139 A1, 02.09.2004 | |||
| US 5516487 A1, 14.05.1996. | |||
Авторы
Даты
2017-05-19—Публикация
2016-03-24—Подача