Изобретение относится к области фармакологии и пульмонологии, а именно к антифибролитическим средствам для лечения фиброза легких.
Идиопатический фиброз легких (idiopathic pulmonary fibrosis, IPF) - быстро прогрессирующая болезнь со смертельным исходом, обусловленная нарушением структурной организации легочных альвеол. Заболевание чаще всего встречается у пациентов в возрасте старше 50 лет. Отмечается преобладание заболевания у мужчин, соотношение полов составляет примерно 1,7:1 в пользу мужчин [1]. Прогноз заболевания неблагоприятный. В настоящее время отсутствуют какие-либо эффективные фармакологические подходы лечения этой болезни, поддерживаемые официальными медицинскими учреждениями, включая Food & Drug Administration (FDA). Трансплантация легкого успешна у больных терминальной стадией идиопатического фиброза легких, не страдающих сопутствующей патологией, в возрасте не старше 55 лет (что составляет <40% всех больных идиопатическим фиброзом легких). Следует особо отметить, что к настоящему времени в РФ было проведено около 50 успешно проведенных операций по пересадке легких, в то время как по данным НИИ Пульмонологии МЗ РФ количество больных с диагностированным фиброзом легких приближается к 500 тысяч. Сердечные гликозиды могут быть первым успешным подходом терапии этой болезни. Следует особо отметить, что для внедрения сердечных гликозидов в клинику не требуется дорогостоящих токсикологических исследований, т.к. эти соединения более 50 лет используются при лечении сердечной недостаточности [2].
Известны лекарственные средства, применяемые для лечения фиброзных заболеваний легких. В настоящее время для лечения фиброзных заболеваний легких используют препараты из группы глюкокортикостероидов (преднизолон), цитостатиков (циклофосфамид), иммунодепрессанты (азатиоприн), а также колхицин - препарат из группы средств, влияющих на обмен мочевой кислоты, обладающий также антифиброзым действием. Основным препаратом, назначаемым при идиопатическом фиброзе легких, является преднизолон. Однако эффективность терапии глюкокортикостероидами при идиопатическом легочном фиброзе составляет лишь 20-30%. В случае его неэффективности или противопоказаний, которые ограничивают область его применения, в качестве дополнительных препаратов назначают лекарственные средства из других групп (иммунодепрессанты и цитостатики). Предпочтение отдают комбинированным режимам терапии [1].
В феврале 2011 года Европейская комиссия одобрила для лечения взрослых пациентов, страдающих фиброзом легких, новый лекарственный препарат пирфенидон (коммерческое название Эсбриет). Управление контроля качества лекарственных средств и продуктов питания США (FDA) одобрило Эсбриет (пирфенидон) для лечения идиопатического легочного фиброза в США. В настоящее время препарат доступен на рынке 28-ми европейских стран и ряда стран мира (Канада, Япония, Южная Корея, Китай, Индия, Аргентина, Мексика и т.д.) [3, 4].
Все эти препараты имеют выраженные побочные эффекты, ухудшающие качество жизни пациентов. Одним из них является иммуносупрессорное действие, приводящее к ряду нежелательных эффектов.
Преднизолон (рег. №: Π N013537/01, Код ATX: Н02АВ06 (Prednisolone))-иммунодепрессивное, противоаллергическое, противовоспалительное лекарственное средство. Тормозит развитие симптомов воспаления: угнетает фагоцитоз, высвобождение лизосомальных ферментов, а также синтез и высвобождение медиаторов воспаления. Вызывает уменьшение проницаемости капилляров, торможение миграции лейкоцитов. Усиливает синтез липомодулина, ингибитора фосфолипазы А2, высвобождающей арахидоновую кислоту из фосфолипидных мембран, с одновременным ингибированием ее синтеза. Механизм иммунодепрессивного действия до конца не изучен. Известно, что преднизолон уменьшает количество Т-лимфоцитов, моноцитов и ацидофильных гранулоцитов. Уменьшает связывание иммуноглобулинов с рецепторами на поверхности клеток и тормозит синтез или высвобождение интерлейкинов путем уменьшения бластогенеза Т-лимфоцитов и уменьшения раннего иммунологического ответа. Тормозит проникновение иммунологических комплексов через мембраны и уменьшает концентрацию компонентов комплемента и иммуноглобулинов.
Противопоказания включают артериальную гипертензию, болезнь Иценко-Кушинга, психозы, почечную недостаточность, остеопороз, язвенную болезнь желудка и двенадцатиперстной кишки, сахарный диабет, бактериальный эндокардит, сифилис, туберкулез, беременность. К побочным эффектам относятся возбуждение, бессонница, артериальная гипертензия, отеки, гипокалиемия, алкалоз, аменорея, остеопороз, синдром Иценко-Кушинга, гипергликемия, иммунодефицит [5, 6].
Азатиоприн (рег. №: Ρ N001426/01, Код ATX: L04AX01 (Azathioprine)) - является структурным аналогом (антиметаболитом) аденина, гипоксантина и гуанина, входящих в состав нуклеиновых кислот (ДНК и РНК), нарушает биосинтез нуклеотидов и подавляет пролиферацию тканей. Иммунодепрессивное действие обусловлено гипоплазией лимфоидной ткани, снижением количества Т-лимфоцитов, нарушением синтеза иммуноглобулинов, появлением в крови атипичных фагоцитов и, в конечном итоге, подавлением клеточно-опосредованных реакций гиперчувствительности. К противопоказаниям относятся гиперчувствительность, угнетение гемопоэза (гипопластическая и апластическая анемия, лейкопения, лимфопения, тромбоцитопения), печеночная недостаточность, беременность, период лактации, детский возраст.
К побочным эффектам относятся: угнетение костномозгового кроветворения (лейкопения, тромбоцитопения, анемия), мегалобластный эритропоэз, макроцитоз, гемолитическая анемия; диспепсические и аллергические реакции, в также панувеит, острая почечная недостаточность, развитие вторичных инфекций, менингеальные реакции, интерстициальный пневмонит, алопеция, при длительном применении может оказывать мутагенное действия, вызывая хромосомные аберрации у человека, тератогенность, канцерогенность (злокачественные опухоли: лимфоретикулярные, эпителиальные, опухоли кожи на участках, подвергаемых воздействию солнечных лучей) [5, 6].
Циклофосфамид (рег. №: ЛС-001048, Код ATX: L01AA01 (Cyclophosphamide)) - противоопухолевое, цитостатическое, иммунодепрессивное, алкилирующее лекарственное средство. Биотрансформируется в печени с образованием активных метаболитов, оказывающих алкилирующее действие. Алкилирующие метаболиты атакуют нуклеофильные центры белковых молекул, образуют поперечные сшивки между нитями ДНК и блокируют митоз клеток. Иммунодепрессивное действие проявляется в подавлении пролиферации лимфоцитарных клонов (преимущественно В-лимфоцитов), участвующих в иммунном ответе. Противопоказания: гиперчувствительность, тяжелые нарушения функции почек, гипоплазия костного мозга, лейкопения (число лейкоцитов менее 3,5⋅109/л) и/или тромбоцитопения (число тромбоцитов менее 120⋅109/л), выраженная анемия, выраженная кахексия, терминальные стадии онкологических заболеваний, беременность, кормление грудью.
Побочные действия: 1) Со стороны органов ЖКТ: анорексия, стоматит, сухость во рту, тошнота, рвота, диарея, боль в желудке, желудочно-кишечные кровотечения, геморрагический колит, токсический гепатит, желтуха; 2) Со стороны нервной системы и органов чувств: астения, головокружение, головная боль, спутанность сознания, нарушение зрения; 3) Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): миелодепрессия, лейкопения, агранулоцитоз, тромбоцитопения, анемия, кровотечения и кровоизлияния, прилив крови к лицу, кардиотоксичность, сердечная недостаточность, сердцебиение, геморрагический миоперикардит, перикардит; 4) Со стороны респираторной системы: одышка, пневмонит, интерстициальный пневмосклероз; 5) Со стороны мочеполовой системы: геморрагический цистит, уретрит, фиброз мочевого пузыря, атипия клеток мочевого пузыря, гематурия, учащенное, болезненное или затрудненное мочеиспускание, гиперурикемия, нефропатия, отеки нижних конечностей, гиперурикозурия, некроз почечных канальцев, аменорея, угнетение функции яичников, азооспермия; 6) Со стороны кожных покровов: алопеция, гиперпигментация (ногтей на пальцах рук, ладоней), в/к кровоизлияния, покраснение лица, сыпь, крапивница, зуд, гиперемия, отечность, боль в месте инъекции; 7) Прочие: анафилактоидные реакции, болевой синдром (боль в спине, боку, костях, суставах), лихорадочный синдром, озноб, развитие инфекций, синдром неадекватной секреции АДГ, микседема (отечность губ), гипергликемия, повышение активности трансаминаз в крови.
При длительном применении (в течение нескольких лет) возможно развитие вторичных злокачественных опухолей (отдаленный эффект): миело- и лимфопролиферативные заболевания, рак мочевого пузыря (особенно у больных с геморрагическим циститом), рак почечной лоханки (отмечен у больного, находившегося на лечении по поводу церебрального васкулита) [5, 6].
Колхицин(пр., в составе препарата колхикум-дисперт, рег. №: Π №014955/01-2003, Код ATX: М04АС01 (Colchicin)) - колхицин угнетает синтез коллагена III типа и пролиферацию фибробластов, но не влияет на выработку медиаторов инициального повреждения (в особенности фактора а некроза опухолей и интерлейкина-1), угнетает лейко- и лимфопоэз, уменьшает утилизацию глюкозы фагоцитирующими и нефагоцитирующими лейкоцитами, стабилизирует мембраны лизосом нейтрофилов, препятствует образованию амилоидных фибрилл. Однако достоверных преимуществ по сравнению с преднизолоном не обнаружено [7]. К противопоказаниям относятся гиперчувствительность, заболевания желудочно-кишечного тракта и костного мозга, нейтропения, нарушения функции печени и почек, сердечно-сосудистая патология, гнойные инфекции, алкоголизм, беременность, пожилой возраст. В числе побочных эффектов диспептические явления, миелосупрессию (лейкопения, агранулоцитоз, апластическая анемия, тромбоцитопения - как правило, при длительном лечении), печеночная и почечная недостаточность [5, 6].
Таким образом, все вышеуказанные препараты обладают широким кругом противопоказаний, что ограничивает их использование у пациентов с соответствующей сопутствующей патологией, а также нежелательными побочными эффектами, среди которых - подавление иммунной системы. Наряду с этим данные препараты не обладают достаточной эффективностью. Так, положительные результаты при терапии с использованием глюкокортикостероидов (преднизолон) наблюдаются только у 15-20% больных, а увеличение дозы препарата приводит к проявлению побочных эффектов у 90% пациентов [8], а применение таких препаратов, как азатиоприн и циклофосфамид, существенно ограничено высоким риском развития побочных эффектов [9]. В связи с этим результаты использования данных препарато в терапии идиопатического фиброза легких нельзя назвать удовлетворительными - смертность от данного заболевания по-прежнему остается достаточно высокой [10].
Пирфенидон (входит в состав лекарственного препарата Esbriet, производитель Roche (Германия)) - новый препарат, обладающий антифибротическим действием и предназначенный для лечения идиопатического фиброза легких. Проникая в организм, он оказывает противовоспалительный эффект, блокирует фактор роста фибробластов, тромбоцитов, контролирует производство фиброзассоциированных белков и цитокинов [4]. Препарат также отнесен к группе иммунодепрессантов.
Пирфенидон представляет собой непептидную синтетическую молекулу с выраженным антифибротическим действием, основанным на снижении экспрессии TGF-β1, TNF-α, PDGF и коллагена I типа, благодаря чему снижается избыточное образование соединительной ткани в различных органах.
Инкубация с 500 и 1000 мг/мл существенно подавляет экспрессию коллагена I типа в течение 6 ч, стимулированную TGF-β1 в концентрации 5 нг/мл [11]. Клинические исследования также подтверждают способность препарата замедлять развитие фиброза [12]. В группе больных, получавших Пирфенидон, отмечалось повышение общей выживаемости. В ходе клинических испытаний Пирфенидон применялся в высоких (1800 мг) и низких дозах (1200 мг). У больных, которые получали Пирфенидон в высокой дозе, отмечалось существенное увеличение емкости легких по сравнению с пациентами, которые не принимали препарат.
К противопоказаниям относятся детский возраст до 18 лет; беременность; период лактации и индивидуальная непереносимость компонентов лекарственного средства. Побочные эффекты включают диспептические расстройства и аллергические реакции, фоточувствительность. Все это позволяет использовать препарат у широкого круга пациентов в независимости от сопутствующей патологии.
Тем не менее, существенным недостатком данного препарата является его высокая цена (от 800 евро), что существенно снижает его доступность для пациентов [3].
Таким образом, в результате исследования уровня техники можно сделать вывод о том, что имеющийся ассортимент средств для лечения идиопатического фиброза легких ограничен, а известные для применения лекарственные средства обладают большим количеством осложнений и ограниченной в связи с этим, областью применения.
Новый технический результат - поиск новых лекарственных средств для лечения идиопатического фиброза, дающих наименьшее число осложнений.
Для достижения нового технического результата предложено использовать сердечный гликозид дигитоксин в качестве антифибролитического средства для лечения идиопатического фиброза.
Новое свойство известного лекарственного средства было обнаружено в ходе проведения экспериментальных исследований.
Сердечный гликозид дигитоксин на протяжении длительного времени с успехом используют в терапии сердечной недостаточности.
Дигитоксин (номер в реестре лекарственных средств 67/554/34) - кардиотоническое, антиаритмическое, кардиостимулирующее лекарственное средство. Используется в составе комплексной терапии хронической сердечной недостаточности II (при наличии клинических проявлений) и III-IV функционального класса по классификации NYHA; тахисистолическая форма мерцания и трепетания предсердий пароксизмального и хронического течения (особенно в сочетании с хронической сердечной недостаточностью).
Механизм действия дигитоксина связан с транспортом Са2+ и Na+. Дигитоксин блокирует SH-группы Na+-K+ -АТФазы, повышает выход ионов Са2+ из саркоплазматического ретикулума [13].
Новое свойство известного лекарственного средства, а именно применение в качестве антифибролитического средства для лечения идиопатического фиброза легких, было обнаружено в ходе проведения экспериментальных исследований.
На основе экспериментальных исследований защитное действие сердечного гликозида было обнаружено при исследовании маркеров дифференцировки миофибробластов и экспрессии стрессовых волокон (α- и β-актина) в фибробластах, изолированных из легких пациентов, подвергшихся трансплантации легких. При этом была выявлена возможность лечения фиброзных заболеваний легких с применением сердечного гликозида дигитоксина.
В активации процесса образования патологической фиброзной ткани важную роль играет трансформирующий ростовой фактор -β1 (TGF-β1) [14]. Под действием TGF-β1 в фибробластах происходит увеличение экспрессии белков цитоскелета и сократительных белков (среди них - гладкомышечный α-актин), которые в норме обнаруживаются в гладкомышечных клетках [15]. Дополнительно происходит усиление секреции белков внеклеточного матрикса (коллагена и фибронектина). Такие фибробласты, имеющие промежуточный фенотип между фибробластами и гладкомышечными клетками, называются миофибробласты [16]. Миофибробласты неизменно обнаруживаются в гистологических пробах из легких больных легочным фиброзом, а их дифференцировка является ключевым процессом в патогенезе фиброзных заболеваний [15].
Фибробласты легких для экспериментальных исследований изолировали согласно описанной ранее методике [16].
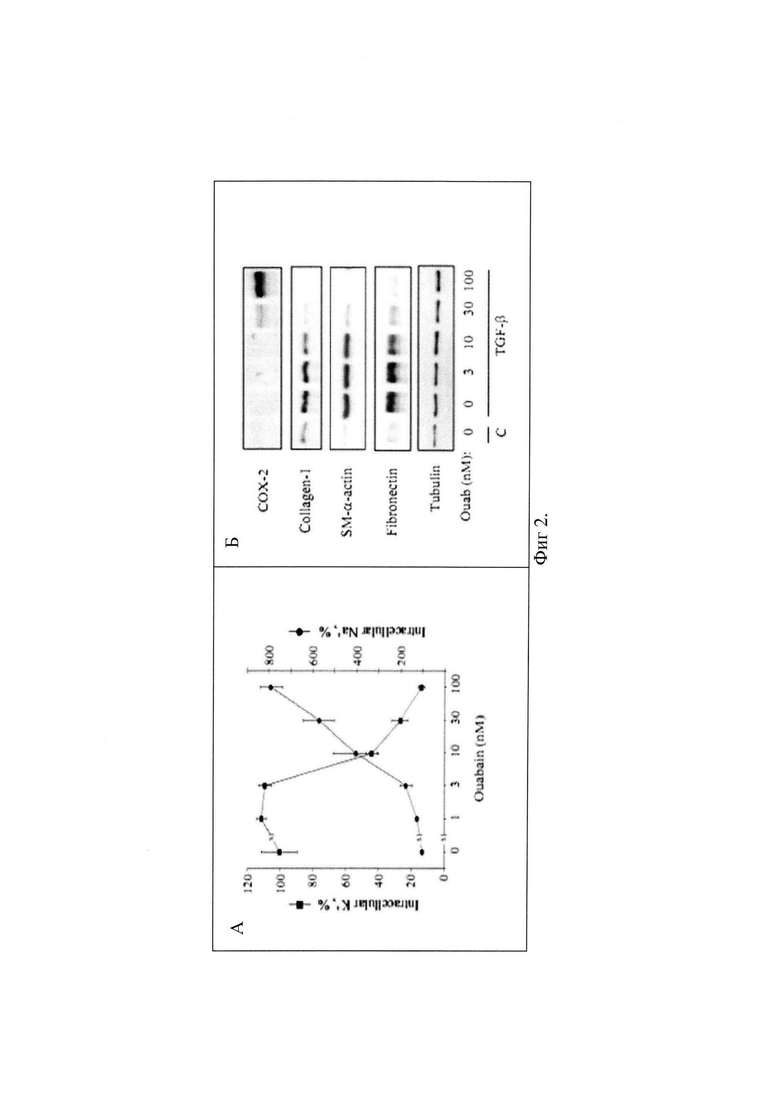
Чтобы определить влияние дигитоксина на дифференцировку миофибробластов, последние обрабатывали трансформирующим ростовым фактором β1 (TGF-β1) - индуктором процессов дифференцировки. Влияние дигитоксина на дифференцировку миофибробластов оценивали по изменению экспрессии маркеров дифференцировки миофибробластов: гладкомышечного α-актина, фибронектина и коллагена-1 согласно методике, описанной в [17, 18]. Для этого клетки инкубировали 48 ч в присутствии 1 нг/мл TGF-b1, 12, 25, 50 и 100 нМ дигитоксина, после чего клетки лизировали и определяли экспрессию белков мотодом вестерн-блот анализа с использованием первичных антител против коллагена-1, фибронектина, гладкомышечного α-актина. Как показано на Фиг. 1, обработка фибробластов легких человека TGF-β1 вызывала выраженное увеличение экспрессии маркеров дифференцировки миофибробластов (специфического гладкомышечного α-актина, фибронектина и коллагена-1). Дигитоксин (25, 50 и 100 нМ) ингибировал экспрессию маркеров миофибробластов в ответ на действие TGF-β1.
Полученные данные указывают на то, что дигитоксин снижает TGF-β-индуцированную дифференцировку миофибробластов посредством разрушения актиновых стрессовых волокон.
Основной мишенью действия сердечного гликозида дигитоксина является Na+-K+-АТФаза. Ингибирование Na+-K+-АТФазы приводит к увеличению соотношения внутриклеточных концентраций ионов натрия и калия ([Na+]i/[K+]i), которое может стимулировать экспрессию циклооксигеназы-2 (СОХ-2) - фермента, ограничивающего скорость синтеза простагландинов [19, 20]. Учитывая антифибротическое действие простагландинов через активацию протеинкиназы А (PKА) [21], мы изучили, оказывают ли сердечные гликозиды стимулирующее действие на экспрессию СОХ-2 в фибробластах легких человека (HLF) и как они влияют на дифференцировку миофибробластов.
Основной и общей мишенью действия всех сердечных гликозидов является Na+,K+-АТФаза [23]. В качестве ингибитора Na+,K+-АТФазы использовали другой сердечный гликозид - уабаин. Мы исследовали действие уабаина на [Na+]i/[K+]i, содержание СОХ-2 и экспрессию маркеров миофибробластов.
Концентрации ионов K+ и Na+ оценивали по распределению вне- и внутри клеток 86Rb и 22Na, соответственно, согласно методике, описанной в [22]. Было выявлено, что в клетках, обработанных TGF-β, уабаин (10 нМ) приводил к 3-кратному увеличению [Na+]i и 2-кратному снижению [K+]i (Фиг. 2А).
Исследование влияния уабаина на экспрессию СОХ-2 и маркеров дифференцировки фибробластов проводили методом вестерн-блот анализа как описано выше, уабаин (10, 30 и 100 нМ) существенно ингибировал экспрессию гладкомышечного - α-актина, коллагена-1 и фибронектина, при этом стимулирующее влияние на экспресиию СОХ-2 наблюдалось при действии уабаина в концентрациях свыше 10 нМ (Фиг. 2Б).
Таким образом, действие сердечного гликозида уабаина, связанное с подавлением TGF-β1-индуцированной дифференцировки фибробластов, обусловлено частичным ингибированием Na+-K+-АТФазы и увеличением соотношения внутриклеточных концентрации ионов натрия и калия ([Na+]i/[K+]i). Учитывая, что дигитоксин также действует через Na+-K+-АТФазу [23], полученные результаты справедливы и для дигитоксин.
Предлагаемый препарат сердечный гликозид дигитоксин на протяжении длительного периода времени с успехом используются в медицинской практике как кардиотонические и антиаритмические препараты, в связи с чем для его внедрения в клинику не требуется дорогостоящих токсикологических исследований. Как показали наши исследования, сердечный гликозид дигитоксин полностью подавляет дифференцировку фибробластов, индуцированную TGF-β1 (Фиг. 1). Такое действие обусловлено частичным ингибированием Na+,K+-АТФ-азы и увеличением соотношения внутриклеточных концентраций ионов натрия и калия.
Приведенные выше экспериментальные данные демонстрируют антифибротическое действие сердечного гликозида дигитоксина.
Известно, что к побочным эффектам данных препарата относятся диспептические расстройства, изменения со стороны центральной нервной системы (головная боль, депрессия, галлюцинации) [5]. Однако дигитоксин не оказывает иммуносупрессорного действия.
Еще одним важным преимуществом сердечного гликозида дигитоксина, помимо эффективного подавления фибротических процессов, является более доступная для пациента по сравнению с пирфенидоном цена препарата.
Источники информации:
1) Клинические рекомендации. Пульмонология // Под редакцией А.Г. Чучалина. - Москва: ГЭОТАР. - 2007. - 225 с.
2) Dmitrieva R.I. and Doris P.A. Cardiotonic steroids: potential endogenous sodium pump ligands with diverse function / R.I. Dmitrieva, P.A. Doris // Experimental biology and medicine. - 2002. - 227. - P. 561-569.
3) Esbriet: EPAR - European Medicines Agency - Europa [Электронный ресурс] URL: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002154/WC500103049.pdf.
4) Pirfenidone and anti-fibrotic therapy in selected patients: патент WO 2012162592 A1. №PCT/US 2012/039538; заявл. 25.05.2012; опубл. 29.11.2012.
5) Энциклопедия лекарств [Электронный ресурс] URL: http://www.rlsnet.ru/.
6) Vidal.ru - справочник лекарственных препаратов [Электронный ресурс] URL: http://www.vidal.ru/drugs/
7) Douglas W.W. Colchicine versus prednisone in the treatment of idiopathic pulmonary fibrosis: a randomized prospective study / W.W. Douglas, J.H. Ryu, S.J. Swensen, K.P. Offord, D.R. Schroeder, G.M. Caron, R.A. DeRemee //Am. J. Respir. Crit. Care Med. - 1998. - V. 158. - P. 220-225.
8) Daniels C.E. Treatment of idiopathic pulmonary fibrosis / C.E.Daniels, J.H. Ryu // Semin Respir Crit Care Med. - 2006. - V.27. - P. 668-676.
9) Авдеев C.H. Идиопатические интерстициальные пневмонии: особенности клинической картины и лечения / C.H. Авдеев // Фарматека. - 2009. - №19. - С. 12-19.
10) Spagnolo P. Idiopathic pulmonary fibrosis: Recent advances on pharmacological therapy / P. Spagnolo, T.M. Maher, L. Richeldi // Pharmacol Ther. - 2015. - 152. - P. 18-27.
11) Hisatomi K. Pirfenidone inhibits TGF-β1-induced over-expression of collagen type I and heat shock protein 47 in A549 cells / K. Hisatomi, H. Mukae, N. Sakamoto, Y. Ishimatsu, T. Kakugawa, S. Hara, H. Fujita, S. Nakamichi, H. Oku, Y. Urata, H. Kubota, K. Nagata, S. Kohno // BMC Pulmonary Medicine. - 2012. - 12. - P. 24.
12) Raghu G. Treatment of Idiopathic Pulmonary Fibrosis with a New Antifibrotic Agent, Pirfenidone Results of a Prospective, Open-label Phase II Study / G. Raghu, W.C. Johnson, D. Lockhart, Y. Mageto // AM J RESPIR CRIT CARE MED. - 1999. - 159. - P. 1061-1069.
13) Skou J.C. Further investigation on a Mg2++-Na+-activated adenosinetriphosphatase possibly related to the active transport of Na+and K+across the nerve cell membrane / J.C. Skou // Biochim Biophys Acta. - 1960. - 42. - P. 6-23.
14) Sime P.J. Adenovector-mediated gene transfer of active transforming growth factor-beta1 induces prolonged severe fibrosis in rat lung / P.J. Sime, Ζ. Xing, F.L. Graham, K.G. Csaky, J. Gauldie // The Journal of clinical investigation. - 1997. - 100. - P. 768-776.
15) Leask A. TGF-beta signaling and the fibrotic response / A. Leask, D.J. Abraham // Faseb J. - 2004. - 18. - P. 816-827.
16) Hinz B. The Myofibroblast. One Function, Multiple Origins / B. Hinz, S.H. Phan, V.J. Thannickal, A. Galli, M.L. Bochaton-Piallat, G. Gabbiani // Am J Pathol. - 2007. - 170(6). P. 1807-16.
17) Sandbo N.. Critical role of serum response factor in pulmonary myofibroblast differentiation induced by TGF-beta / N. Sandbo, S. Kregel, S. Taurin, S. Bhorade, N.O. Dulin // American journal of respiratory cell and molecular biology. - 2009. - 41. - P. 332-338.
18) Sandbo N. Delayed stress fiber formation mediates pulmonary myofibroblast differentiation in response to TGF-beta / N. Sandbo, A. Lau, J. Kach, C. Ngam, D. Yau, N.O. Dulin // Am J. Physiol Lung Cell Mol Physiol. - 2011. - 301. - P. L656-666.
19) Katoh K. Isolation and in vitro contraction of stress fibers / K. Katoh, Y. Kano, K. Fujiwara // Methods Enzymol. 2000. - 325. P. 369-380.
20) Wilborn J. Cultured lung fibroblasts isolated from patients with idiopathic pulmonary fibrosis have a diminished capacity to synthesize prostaglandin E2 and to express cyclooxygenase-2 / J. Wilborn, L.J. Crofford, M.D. Burdick, S.L. Kunkel, R.M. Strieter, M. Peters-Golden // The Journal of clinical investigation. 1995. - 95. P. 1861-1868.
21) Xaubet A. Cyclooxygenase-2 is up-regulated in lung parenchyma of chronic obstructive pulmonary disease and down-regulated in idiopathic pulmonary fibrosis / A. Xaubet, J. Roca-Ferrer, L. Pujols, J. Ramirez, J. Mullol, A. Marin-Arguedas, A. Torrego, J.M. Gimferrer, C. Picado // Sarcoidosis Vasc Diffuse Lung Dis. - 2004. - 21. - P. 35-42.
22) Huang S.K. Prostaglandin E2 Inhibits Specific Lung Fibroblast Functions Via Selective Actions of PKA and Epac-1 / S.K. Huang, S.H. Wettlaufer, J. Chung, M. Peters-Golden // American journal of respiratory cell and molecular biology. - 2008. - 39(4). - P. 482-489.
23) Akimova O.A. Cardiotonic steroids differentially affect intracellular Na+ and [Na+]i/[K+]i-independent signaling in C7-MDCK cells / O.A. Akimova, A.Y. Bagrov, O.D. Lopina, A.V. Kamernitsky, J. Tremblay, P. Hamet, S.N. Orlov // The Journal of biological chemistry. - 2005. - 280. P. 832-839.
Фиг. 1. Эффект дигитоксина и TGF-b1 на экспрессию коллагена-1, фибронектина, гладкомышечного a-актина в фибробластах легких человека. Клетки инкубировали 48 ч в присутствии 1 нг/мл TGF-b1, 12, 25, 50 и 100 нМ дигитоксина, после чего был приготовлен клеточный лизат и проанализирован методом иммуноблотинга с использованием первичных антител против коллагена-1, фибронектина, гладкомышечного а-актина.
Фиг. 2. (А) Дозозависимое действие уабаина на внутриклеточное содержание Na+ и K+ экспрессию СОХ-2, и экспрессию маркеров дифференцировки миофибробластов. А, HLF обрабатывали уабаином в течение 48 часов и оценивали его влияние на внутриклеточные концентрации Na+ и K+. Данные представлены как среднее ± ошибка среднего в экспериментах, полученных в трех пробах. (Б) Клетки HLF обрабатывали TGF-β (1 нг/мл) в присутствии возрастающих доз уабаина в течение 48 часов. Экстракты клеток исследовали методом Вестерн-блоттинга для определения экспрессии СОХ-2 и маркеров дифференцировки миофибробластов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Антифибролитическое средство | 2016 |
|
RU2621163C1 |
| ИНГИБИТОРЫ HDAC ДЛЯ ЛЕЧЕНИЯ ИДИОПАТИЧЕСКОГО ЛЕГОЧНОГО ФИБРОЗА И ДРУГИХ ВОСПАЛИТЕЛЬНЫХ НАРУШЕНИЙ ЛЕГКИХ | 2021 |
|
RU2833349C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОВОСПАЛИТЕЛЬНЫМ И АНТИФИБРОТИЧЕСКИМ ДЕЙСТВИЕМ В ЛЕГОЧНОЙ ТКАНИ ПРИ ЦИТОСТАТИЧЕСКОМ ВОЗДЕЙСТВИИ | 2013 |
|
RU2530651C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ В ФОРМЕ ТАБЛЕТКИ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩЕЙ ПИРФЕНИДОН, И ЕЁ ПРИМЕНЕНИЕ ДЛЯ ОСЛАБЛЕНИЯ СИМПТОМОВ ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ, КАПСУЛЯРНОЙ КОНТРАКТУРЫ МОЛОЧНОЙ ЖЕЛЕЗЫ И ФИБРОЗА ПЕЧЕНИ ЧЕЛОВЕКА | 2012 |
|
RU2682177C2 |
| ОРВЕПИТАНТ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО КАШЛЯ | 2016 |
|
RU2746601C2 |
| Способ моделирования сочетанной патологии легочного фиброза и экспериментального рака легкого | 2024 |
|
RU2838936C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ЛЕГКИХ, СОДЕРЖАЩЕЕ ПРОИЗВОДНОЕ ПИРАЗОЛА | 2021 |
|
RU2817989C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ТКАНЕЙ НА ОСНОВЕ КОМПОНЕНТОВ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ СРЕДСТВА | 2020 |
|
RU2766707C1 |
| АНТАГОНИСТЫ РЕЦЕПТОРА ЭНДОТЕЛИНА, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ РАННЕЙ СТАДИИ ИДИОПАТИЧЕСКОГО ФИБРОЗА ЛЕГКИХ | 2007 |
|
RU2435585C2 |
| Антитела против эотаксина 2, которые распознают дополнительные связывающие CCR3 хемокины | 2015 |
|
RU2705255C2 |

Изобретение относится к фармацевтической промышленности, а именно к средству для снижения TGF-β-индуцированной дифференцировки миофибробластов. Применение дигитоксина для снижения TGF-β-индуцированной дифференцировки миофибробластов. Дигитоксин эффективно снижает TGF-β-индуцированную дифференцировку миофибробластов и может применяться для лечения идиопатического фиброза легких при снижении числа осложнений. 2 ил.
Применение дигитоксина для снижения TGF-β-индуцированной дифференцировки миофибробластов.
| SRIVASTAVA M | |||
| Et all | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| US 20140187505 A1, 03.07.2014 | |||
| АВДЕЕВА О.Е | |||
| и др | |||
| Идиопатический фиброзирующий альвеолит | |||
| //Регулярные выпуски "РМЖ", N4 от 17.02.1998, Перечень данных [он-лайн] 17.02.1998 [Найдено 2016.11.22.]-найдено из Интернет: URL: http://www.rmj.ru/articles/pulmonologiya/IDIOPATIChESKIY_FIBROZIRUYuSchIY_ALYVEOLIT/ | |||
| Фиброз | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
Авторы
Даты
2017-06-01—Публикация
2016-02-16—Подача