Изобретение относится к медицине, а именно к иммунологии, может быть использовано в экспериментальной и клинической медицине при отборе иммуномодулирующих веществ с целью усиления иммунного ответа на вакцину.
Вакцинация людей против чумы, согласно Календарю прививок по эпидемическим показаниям [приказ Минздравсоцразвития РФ №51н от 31.01.2011 «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям»], предусматривает накожное введение вакцины чумной живой, которая формирует напряженный иммунитет продолжительностью 6-12 месяцев и предусматривает необходимость ежегодной ревакцинации людей, проживающих на эндемичной по чуме территории.
В связи с отсутствием в XXI веке крупных вспышек чумы оценить эффективность новых схем применения вакцины чумной живой, представляющей собой лиофилизированную живую культуру вакцинного штамма чумного микроба Yersinia pestis EV линии НИИЭГ, в контролируемых эпидемиологических испытаниях не представляется возможным, поэтому ведется непрерывный поиск косвенных критериев, адекватно характеризующих состояние клеточного или гуморального адаптивного иммунитета, а также возможность влияния на иммунный ответ у вакцинированных против чумы, модулируя его продолжительность и эффективность. При моделировании бубонной и легочной чумы на различных животных (лабораторные мыши, приматы) было показано, что высокий уровень титров антител к антигенам чумного микроба на фоне низкой активности синтеза цитокинов (IFN-y, TNF-α, IL-17) не защищал их от гибели при чумной инфекции [Elvin S.J. 2004; Parent М.А., 2005].
Как известно, в иммунопатогенезе чумы ведущая роль принадлежит клеточным факторам иммунитета [Philipovsky A.V., 2007]. В осуществлении противочумного иммунитета участвуют: фагоцитирующие мононуклеары, Т- и В-лимфоциты, а также медиаторы межклеточных взаимодействий - цитокины. Популяционные, субпопуляционные сдвиги, изменения функциональной активности иммунокомпетентных клеток в целом, свидетельствуют об эффективности формирующегося иммунобиологического процесса при вакцинации.
Клеточно-опосредованный противочумный иммунный ответ развивается по доминирующему Th1 пути, который связан с появлением и накоплением патоген-специфических Т-лимфоцитов, синтезирующих IFN-γ, TNF-α [Philipovsky A.V., 2007; Do Y., 2012]. IFN-γ - регулирует иммунный ответ и выраженность воспалительных реакций, является мощным активатором макрофагов, гранулоцитов, клеток эндотелия и индуктором экспрессии молекул главного комплекса гистососвместимости [Кетлинский С.А., 2008]. IFN-γ, TNF-α отведена большая роль в усилении бактерицидной активности макрофагов, а IL-17 - в формировании мукозального противочумного иммунитета [Lin J.S. 2011; Bi Y. et al., 2014]. Цитокины служат той организующей системой, которая формирует и регулирует весь комплекс защитных реакций организма при внедрении патогенов [Кетлинский С.А., 2008].
Цитокин IL-4 индуцирует селективное переключение В-клеток на синтез IgG1 и IgE, влияет на Т-клетки как фактор роста, способствуя дифференцировке Th2-лимфоцитов и усиливая тем самым антителообразование, определяя гуморальный иммунный ответ [Anderson D.M. et al., 2009; Щуковская Т.Н., 2011].
Одним из критериев оценки функциональной активности лимфоцитов при противочумной вакцинации является характеристика спонтанной и индуцированной лигандом TLR2 (КонА) в культуре клеток крови продукции цитокинов, например: IFN-γ - как биомаркера Th1 клеток, IL-4 - биомаркера Th2 клеток.
Иммуномодуляторы - это широкая группа природных или синтетических веществ, применяемых в терапевтических дозах и способных оказывать регулирующее влияние на иммунную систему.
При вакцинации имеет значение индивидуальный подбор иммуномодулирующего вещества, способствующего формированию полноценного и продолжительного поствакцинального иммунитета у конкретного человека. Иммуномодулирующие вещества обладают различной способностью влиять на функциональную активность клеток врожденного и адаптивного иммунитета человека. Иммуномодулятор может обладать избирательным эффектом на конкретный компонент иммунитета, но конечный эффект его воздействия на иммунную систему всегда будет многогранным [Хаитов P.M., Пинегин Б.В., 2005].
Таким образом, вещества, обладающие направленным модулирующим действием на иммунный ответ, могут способствовать эффективной борьбе с инфекцией, а их применение для включения в схемы специфической профилактики чумы приводит к повышению эффективности защиты макроорганизма от этой инфекции.
Известен способ отбора иммуномодуляторов [патент SU 1210790, А61В 10/00, A61K 39/00], включающий подкожное введение исследуемого препарата животным с последующей оценкой уровня 5-нуклеотидазной активности в перитонеальных макрофагах.
Известен способ оценки иммуномодулирующей активности препаратов [патент RU 2175135, G01N 33/53], основанный на определении феномена стягивания в различные фазы биологического ритма и дифференцировки специфического и неспецифического компонентов иммуномодулирующего эффекта после подкожного введения испытуемого вещества лабораторным животным.
Известен способ оценки эффективности применения иммуномодулятора имунофана при экспериментальной холере [патент RU 2481791, А61В 10/00, A61K 38/08, А61Р 43/00, G09B 23/28], разработанный для изучения эффективности иммуномодуляторов для профилактики и лечения холеры, основанный на введении иммуномодулятора взрослым кроликам на протяжении 20 дней (10 инъекций по 0,2 мкг препарата в 0,3 мл новокаина через день) и последующем заражении животных культурами вирулентного штамма холерного вибриона, с учетом результата по его влиянию на развитие энтеропатогенного или холерогенного эффектов в изолированной петле тонкого кишечника взрослых кроликов.
Известен способ повышения иммуногенности вакцин против опасных инфекций [патент RU 2391999, A61K 39/10, A61K 38/00], заключающийся в том, что вакцинный штамм 82 Brucella abortus и 75/79-АВ Brucella abortus, находящихся в RS-(SR) форме, вводят животным одновременно с иммуномодулятором иммунофаном, чем добиваются повышения специфического бруцеллезного иммунитета у животных в 2 раза.
Известен способ повышения иммуногенности антигенов B.pseudomallei при экспериментальном мелиоидозе [патент RU 2483752, A61K 39/02], который предусматривает иммунизацию животных с использованием поверхностных мелиоидозных антигенов в липосомальной форме, а для дополнительной стимуляции механизмов клеточного иммунитета вместе с цитокинами вводят иммуномодулятор бестим.
Известен способ ингибирования пролиферативного Т-клеточного ответа у животных посредством применения композиций, содержащих гистамин [патент WO 993014754 A61K 31/415, A61K 38/17, A61K 39/35, A61K 39/39, А61Р 37/00, C07D 233/00, C07D 233/64]. Однако все эти способы разработаны для животных или с применением животных.
Известен способ оценки эффективности применения иммуномодулятора тималина при острых гнойных хирургических заболеваниях [патент RU 2147436, A61K 35/26, AK 35/00], основанный на определении уровня лейкоцитов в крови больного до и после назначения иммуномодулятора. Однако изобретение строится на односторонней оценке иммуномодулирующего эффекта по характеристике одного из показателей - количеству лейкоцитов, требуется введения иммуномодулятора больным, что не позволяет использовать вновь разрабатываемые иммуномодулирующие вещества, не прошедшие соответствующие клинические испытания, а также способ не пригоден для адекватной характеристики состояния адаптивного иммунитета, а, следовательно, и не дает возможность оценить иммуномодулирующую эффективность того или иного вещества при вакцинальном процессе.
Наиболее близкими к предполагаемому являются способ оценки иммуномодулирующей активности химических и физических средств [патент BY 4621, G01N 33/50, G01N 33/53], основанный на обработке тестируемым средством 1/5 части суспензии лейкоцитов, с последующим удалением иммуномодулятора и оценкой его отсроченного эффекта на иммунологические параметры в условиях сокультивирования обработанных иммуномодулятором и интактных клеток по сравнению с клетками, культивированными в среде и способ определения активности иммуномодулятора [патент SU 1665310, G01N 33/80], в основе которого лежит добавление иммуномодулятора в среду с иммунокомпетентными клетками, для создания единых условий культивирования. Оценка стимулирующего эффекта заключается в учете внутриклеточного содержания циклического АМФ в Т-лимфоцитах в присутствии и в отсутствии иммуномодулятора.
Недостатками описанных способов являются:
- усложненная процедура пробо-подготовки тестируемого образца - получение культуры иммунокомпетентных клеток, посредством выделения их на градиенте-плотности фикол-верографине, или отстаивание образца для получения смеси лейкоцитов;
- необходимость предварительного титрования иммуномодулирующего вещества для определения в реакции лейкоцитолиза на клетках здоровых лиц наименьшего разведения препарата, не оказывающего повреждающего действия на клетки (жизнеспособность клеток не менее 95%);
- методы позволяют характеризовать иммуномодулирующую активность тестируемого вещества, но не оценивают иммуномодулирующий эффект на состояние адаптивного иммунитета у человека в конкретной ситуации, например, в условиях вакцинации.
При анализе патентной и научно-технической информации не выявлено способа отбора веществ, обладающих направленной модулирующей активностью на иммунную систему лиц, вакцинированных против чумы.
Выбор критериально значимых показателей для оценки направленного иммуномодулирующего действия вещества при противочумной вакцинации является сложным вопросом.
Известно, что существует две различные субпопуляции Т-хелперных клеток - Th1 и Th2, различающиеся по спектру секретируемых ими цитокинов, определяющих специфические функции данных клеток. Уровень продукции ключевых цитокинов - биомаркеров Th1 клеток и цитокинов - биомаркеров Th2 клеток косвенно отражает функциональное состояние иммунной системы макроорганизма. Действие иммуномодулирующих веществ направлено на восстановление баланса между Th1 и Th2 клетками, за счет стимуляции той или иной группы клеток. Критерием эффективности противочумной вакцинации считается оценка состояния клеточного звена адаптивного противочумного иммунитета, характеризующегося продукцией определенных маркерных Th1 и Th2 цитокинов.
Задачей предлагаемого изобретения является повышение информативности, унификация и упрощение процедуры отбора веществ с направленной модулирующей активностью на иммунную систему лиц, вакцинированных против чумы.
Для решения поставленной задачи предложен способ, позволяющий ex vivo проводить отбор веществ для направленной модуляции иммунного ответа у вакцинированных против чумы людей на суспензии клеток крови, полученной до и через месяц после вакцинации, инкубируемой с тестируемым веществом при 37°С в течение 24 ч, и определением в образцах продукции цитокинов - IL-17, IFN-γ, TNF-α, IL-4, являющихся биомаркерами Th1 и Th2 клеток, с последующей математической обработкой полученных данных с использованием коэффициентов (К) и индексов (И), вычисляемых по формулам
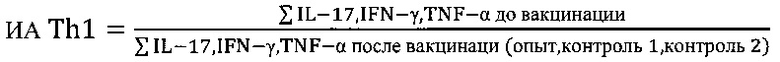
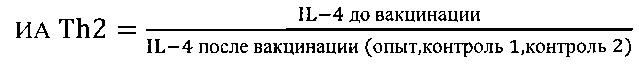
где ИА - индекс активности биомаркеров Th1 и Th2 клеток соответственно
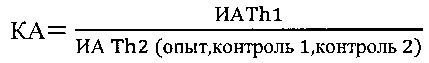
где: КА - коэффициент функциональной активности Т-клеточного звена иммунной системы
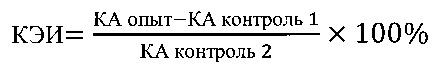
где: КЭИ - коэффициент эффективности стимуляции тестируемым веществом Т-клеточного звена иммунной системы;
опыт - продукция цитокинов в крови вакцинированных на фоне индукции тестируемым веществом;
контроль 1 - спонтанная продукция цитокинов в крови вакцинированных;
контроль 2 - индуцированная стандартным Т-клеточным митогеном конканавалином А (ConA) продукция цитокинов в крови вакцинированных;
Тестируемое вещество считается пригодным для направленной модуляции иммунного ответа при противочумной вакцинации людей, если в опытах ex vivo значение КЭИ для этого вещества превышает КЭИ для контроля 2 в диапазоне от 1,5 до 3,0 раз.
Способ позволяет проводить отбор веществ с иммуномодулирующей активностью ex vivo.
Способ осуществляется следующим образом: гепаринизированную венозную кровь, полученную от добровольцев до и через 1 месяц после противочумной вакцинации, разводят в соотношении 1:4 средой RPMI 1640, содержащей 100 мкг/мл гентамицина. Разведенный культуральной средой образец делят на три части. В одну часть добавляют 100 мкл физиологического раствора (контроль 1), во вторую часть добавляют 100 мкл Т-клеточного митогена конканавалина A (Con А, лиганд TLR2) в конечной концентрации 15 мкг/мл (контроль 2), в третью часть - 100 мкл тестируемого вещества. Опытные и контрольные образцы инкубируют в течение 24 ч при 37°С, после чего осаждают центрифугированием при 400 g в течение 15 мин. Затем определяют в образцах продукцию цитокинов, с использованием коммерческих наборов реагентов и известных стандартных методов, например методом твердофазного иммуноферментного анализа (ИФА).
Определяют в образцах (опыт, контроль 1, контроль 2) продукцию цитокинов - IL-17, IFN-γ, TNF-α, IL-4 и проводят математическую обработку полученных данных, определяя индекс активности биомаркеров для Th1 и Th2 клеток (ИА), коэффициент функциональной активности Т-клеточного звена иммунной системы (КА), коэффициент эффективности стимуляции тестируемым веществом Т-клеточного звена иммунной системы (КЭИ). При этом если в опытах ex vivo значение КЭИ для тестируемого вещества превышает КЭИ для контроля 2 в диапазоне от 1,5 до 3,0 раз, тестируемое вещество считается пригодным для направленной модуляции иммунного ответа при противочумной вакцинации людей.
Эффективность предлагаемого способа отбора иммуномодулирующих веществ подтверждена примерами.
Пример 1. Оценка иммуномодулирующего эффекта коммерческого препарата азоксимера бромид у лиц, вакцинированных против чумы вакциной чумной живой (производства «Ставропольский научно-исследовательский противочумный институт», серия 24).
У 8 здоровых добровольцев в утренние часы из кубитальной вены брали по 2 мл венозной крови в вакуумные пробирки, содержащие гепарин 20 МЕ/мл. Затем людей накожно вакцинировали вакциной чумной живой в область правого плеча. Повторно кровь у добровольцев забирали спустя месяц после вакцинации.
Для определения продукции цитокинов к 2 мл гепаринизированной венозной крови добавляли 8 мл среды RPMI 1640, содержащей 100 мкг/мл гентамицина (соотношение 1:4). Из 10 мл крови разведенной культуральной средой готовили 3 образца по 3 мл. В один образец добавляли 100 мкл физиологического раствора (контроль 1), во второй - 100 мкл Т-клеточного митогена конканавалина A (Con А, лиганд TLR2) в конечной концентрации 15 мкг/мл (контроль 2), в третий - 100 мкл коммерческого препарата азоксимера бромид в конечной концентрации 100 мкг/мл (опыт). Опытные и контрольные образцы инкубировали в течение 24 ч при 37°С. По окончании культивирования клетки осаждали центрифугированием при 400 g в течение 15 мин. Полученные супернатанты можно хранить до 6 месяцев при температуре -20°С при однократном замораживании. Определение концентрации цитокинов в образцах крови, взятых до и после вакцинации, проводили одновременно в строгом соответствии с инструкциями к сертифицированным наборам реагентов для иммуноферментного определения цитокинов с использованием коммерческого набора реагентов («гамма ИНТЕРФЕРОН-ИФА-БЕСТ», «ИНТЕРЛЕЙКИН-4-ИФА-БЕСТ», «ИНТЕРЛЕЙКИН-17-ИФА-БЕСТ», «альфа-ФНО-ИФА-БЕСТ» ЗАО «Вектор-Бест», Россия). Измерение оптической плотности осуществляли через 2-3 мин после остановки реакции на микропланшетном фотометре Stat Fax-3200 (Awareness Technology, USA) с использованием программы расчета концентраций по многоточечной калибровке (PGM) при длине волны 450 нм.
Полученные количественные показатели по уровню продукции определяемых цитокинов подвергали математической обработке по разработанным формулам
I этап определение активности биомаркеров Th1 клеток
в опыте
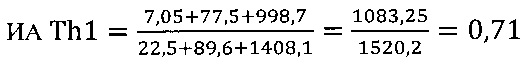
в контроле 1
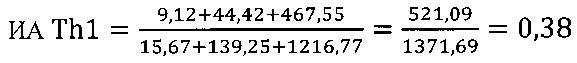
в контроле 2
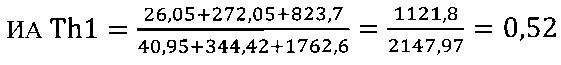
II этап определение активности цикотинов биомаркеров Th2 клеток
в опыте
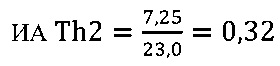
в контроле 1
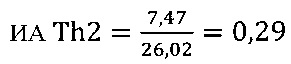
в контроле 2
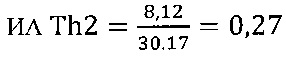
III этап вычисление коэффициента функциональной активности Т-клеточного звена иммунной системы
в опыте
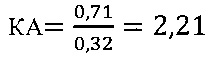
в контроле 1
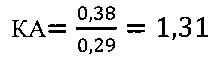
в контроле 2
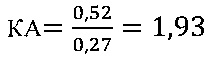
IV этап вычисление коэффициента эффективности стимуляции азоксимером бромидом Т-клеточного звена иммунной системы
в опыте
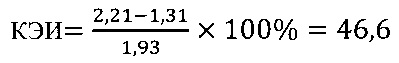
в контроле 2
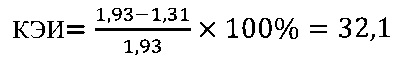
Иммуномодулирующий эффект коммерческого препарата азоксимера бромида согласно установленным значениям используемого коэффициента эффективности стимуляции Т-клеточного звена иммунной системы (КЭИ) в опытной группе (46,6) в 1,5 раза превышает аналогичный показатель в контроле 2 (32,1), что свидетельствует о направленном модулирующем действии азоксимера бромида на Т-клеточное звено иммунитета у вакцинированных против чумы.
Пример 2. Оценка иммуномодулирующего эффекта монофосфорилированного липида A (MPL) у лиц, вакцинированных против чумы вакциной чумной живой (производства «Ставропольский научно-исследовательский противочумный институт», серия 11-13).
У 10 здоровых добровольцев в утренние часы из кубитальной вены брали по 2 мл венозной крови в вакуумные пробирки, содержащие гепарин 20 МЕ/мл. Затем людей накожно вакцинировали вакциной чумной живой в область правого плеча. Повторно кровь у добровольцев забирали спустя месяц после вакцинации.
Для определения продукции цитокинов к 2 мл гепаринизированной венозной крови добавляют 8 мл среды RPMI 1640, содержащей 100 мкг/мл гентамицина (соотношение 1:4). 10 мл крови, разведенной культуральной средой, делили на 3 части по 3 мл. В одну часть добавляли 100 мкл физиологического раствора (контроль 1), во вторую - 100 мкл Т-клеточного митогена конканавалина A (Con А, лиганд TLR2) в конечной концентрации 15 мкг/мл (контроль 2), в третью - 100 мкл коммерческого препарата липид A (MPL) в конечной концентрации 1 мкг/мл (опыт). Подготовленные образцы исследовали аналогично описанию в примере 1.
Полученные количественные показатели по уровню продукции определяемых цитокинов подвергали математической обработке по разработанным формулам
I этап определение активности биомаркеров Th1 клеток
в опыте
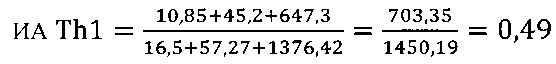
в контроле 1
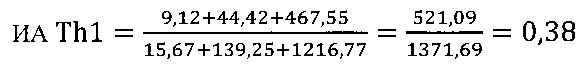
в контроле 2
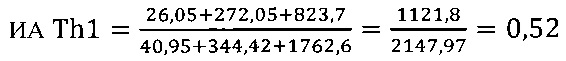
II этап определение активности цикотинов биомаркеров Th2 клеток
в опыте
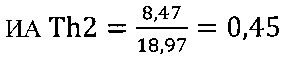
в контроле 1
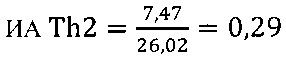
в контроле 2
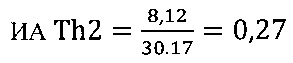
III этап вычисление коэффициента функциональной активности Т-клеточного звена иммунной системы
в опыте
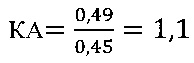
в контроле 1
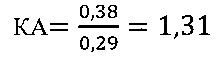
в контроле 2
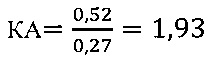
IV этап вычисление коэффициента эффективности стимуляции MPL Т-клеточного звена иммунной системы:
в опыте
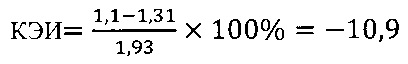
в контроле 2
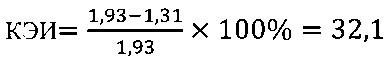
Иммуномодулирующий эффект коммерческого препарата липида A (MPL) согласно установленным значениям используемого коэффициента эффективности стимуляции Т-клеточного звена иммунной системы (КЭИ) в опытной группе (-10,2) в 2,9 раза ниже аналогичного показателя в контроле 2 (32,1) и имеет отрицательный знак впереди, что свидетельствует об отсутствии необходимого направленного модулирующего действия липида А на Т-клеточное звено иммунитета у вакцинированных против чумы.
Пример 3. Оценка иммуномодулирующего эффекта даларгина у лиц, вакцинированных против чумы вакциной чумной живой (производства «Ставропольский научно-исследовательский противочумный институт», серия 24).
У здорового добровольца (М., 25 лет) в утренние часы из кубитальной вены брали
2 мл венозной крови в вакуумные пробирки, содержащие гепарин 20 МЕ/мл. Затем накожно вакцинировали вакциной чумной живой в область правого плеча. Повторно кровь забирали спустя месяц после вакцинации.
Для определения продукции цитокинов к 2 мл гепаринизированной венозной крови добавляют 8 мл среды RPMI 1640, содержащей 100 мкг/мл гентамицина (соотношение 1:4). 10 мл крови, разведенной культуральной средой, делили на 3 части по
3 мл. В одну часть добавляли 100 мкл физиологического раствора (контроль 1), во вторую - 100 мкл Т-клеточного митогена конканавалина A (Con А, лиганд TLR2) в конечной концентрации 15 мкг/мл (контроль 2), в третью - 100 мкл даларгина в конечной концентрации 50 мкг/мл (опыт). Подготовленные образцы исследовали аналогично описанию в примере 1.
Полученные количественные показатели по уровню продукции определяемых цитокинов, подвергали математической обработке по разработанным формулам
I этап определение активности биомаркеров Th1 клеток
в опыте
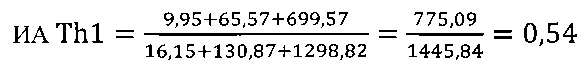
в контроле 1
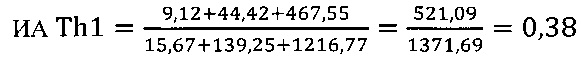
в контроле 2
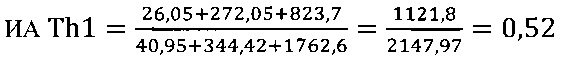
II этап определение активности цикотинов биомаркеров Th2 клеток
в опыте
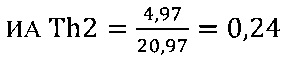
в контроле 1
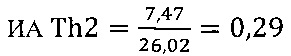
в контроле 2
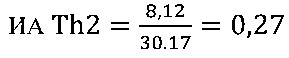
III этап вычисление коэффициента функциональной активности Т-клеточного звена иммунной системы
в опыте
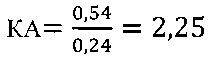
в контроле 1
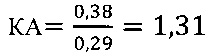
в контроле 2
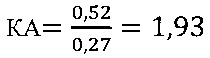
IV этап вычисление коэффициента эффективности стимуляции даларгином Т-клеточного звена иммунной системы
в опыте
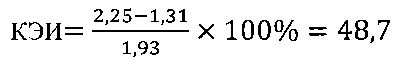
в контроле 2
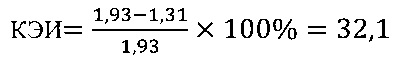
Иммуномодулирующий эффект вещества даларгин согласно установленным значениям используемого коэффициента эффективности стимуляции Т-клеточного звена иммунной системы (КЭИ) в опытной группе (48,7) в 1,5 раза превышает аналогичный показатель в контроле 2 (32,1), что свидетельствует о направленном модулирующем действии тестируемого вещества на Т-клеточное звено иммунитета у вакцинированных против чумы.
Эффективность способа как при индивидуальном подборе иммуномодулирующего препарата, так и при анализе групп вакцинированных людей представлена в приведенных примерах и таблице. Данные, приведенные в таблице, подтверждают, что изобретение осуществимо, его использование позволяет проводить отбор веществ для направленной модуляции иммунного ответа при вакцинации против чумы. В опытах ex vivo показано, что изменения КЭИ для различных препаратов при инкубации их с кровью лиц, 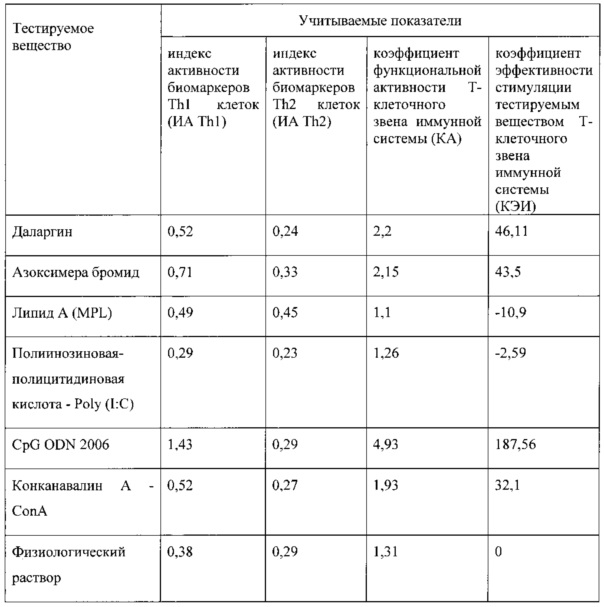
вакцинированных (ревакцинированных) вакциной чумной живой, колеблется от -2,59 до 187,56.
Предлагаемое изобретение повышает доступность, информативность и безопасность оценки тестируемых веществ для направленной модуляции иммунного ответа при вакцинации против чумы, за счет одномоментной оценки уровня продукции цитокинов - биомаркеров функциональной активности Th1 клеток (IL-17, IFN-γ, TNF-α) и Th2 клеток (IL-4) в крови (ex vivo) до и спустя 1 месяц после вакцинации при инкубации образцов крови с испытуемыми иммуномодулирующими веществами.
Впервые предложено использовать для отбора веществ, обладающих направленной модуляцией иммунного ответа в условиях противочумной вакцинации, ex vivo оценку продукции биомаркерных цитокинов у вакцинированных людей до и через 1 месяц после вакцинации посредством инкубации образца крови вакцинированного с тестируемым веществом и последующей математической обработкой полученных данных.
Таким образом, предлагаемый способ с применением подобранных показателей и разработанных критериев позволяет повысить информативность, унифицировать и упростить процедуру отбора коммерческих препаратов и вновь разрабатываемых веществ для их применения с целью направленной модуляции иммунного ответа при вакцинации против чумы.
Источники информации
1. Кетлинский С.А. Th17 - новая линия дифференцировки Т хелперов: обзор данных. Цитокины и воспаление. 2009. 8(2): 3-15.
2. Хаитов P.M., Пинегин Б.В. Современные иммуномодуляторы. Классификация. Механизм действия. Москва: ФАРМАРУС ПРИНТ. 2005: 27.
3. Щуковская Т.Н., Смолькова Е.А., Шмелькова Т.П., Клюева С.Н., Бугоркова С.А. Индуцированная продукция IFN-γ и IL-4 как показатель функциональной активности Th1- и Th2-клеток у вакцинированных против чумы людей. Эпидемиология и вакцинопрофилактика. 2011. 6(61): 78-83.
4. Anderson D.M., Ciletti N.A., Lee-Lewis Н. et al. Pneumonic plague pathogenesis and immunity in Braun Norway rats // The American Journal of Pathology. 2009. 174: 910-921.
5. Bi Y., Zhou J., Yang H., Wang X., Zang X., Wang Q., Wu X., Han Y., Song Y., Tan Y., Du Z., Yang H., Zhou D., Cui Y., Zhou L., Yan Y., Zhang P., Guo Z., Wang X., Liu G., Yang R. IL-17A produced by neutrophils protects against pneumonic plague through orchestrating IFN-γ-activated macrophage programming. J. Immunology. 2014. 192(2): 704-713.
6. Do Y., Didierlaurent A.M., Ryu S., Koh H., Park C.G., Park S., Perlin D.S., Powell B.S., Steinman R.M. Induction of pulmonary mucosal immune responses with a proteinvaccine targeted to the DEC-205/CD205 receptor. Vaccine. 2012. 30(45): 6359-67.
7. Elvin S.J., Williamson E.D. Stat 4 but not Stat 6 mediated immune mechanisms are essential in protection against plague. Microb. Pathog. 2004. 37(4): 177-184.
8. Lin J.S., L.W. Kummer, F.M. Szaba, S.T. Smiley IL-17 Contributes to Cell-Mediated Defense against Pulmonary Yersiniapestis Infection. Immunol. 2011. 186(3): 1675-1684.
9.
10. Parent M.A., Berggren K.N., Kummer L.W., Wilhelm L.B., Szaba F.M., Mullarky I.K., Smiley S.T. Cell-mediated protection against pulmonary Yersinia pestis infection. Infect. Immun. 2005. 73: 7304-7310.
11. Philipovskiy A.V., Smiley S. T. Vaccination with Live Yersinia pestis Primes CD4 and CD8 T Cells That Synergistically Protect against Lethal Pulmonary Y. pestis Infection. Infection and Immunity. 2007. 75(2): 878-885.
12. Патент RU 2175135.
13. Патент RU 2481791.
14. Патент RU 2391999.
15. Патент RU 2483752.
16. Патент RU 2147436.
17. Патент SU 1210790.
18. Патент SU 1665310.
19. Патент BY 4621.
20. Патент WO 1993014754.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ применения комплекса водорастворимых антигенов чумного микроба для оценки уровня противочумного иммунитета | 2019 |
|
RU2725872C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ДЛИТЕЛЬНОСТИ ПЕРИОДА АНТИГЕНЕМИИ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2010 |
|
RU2439566C1 |
| АДЪЮВАНТ | 2020 |
|
RU2736933C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА И ДРУГИХ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И ВАКЦИНА, ПОЛУЧЕННАЯ ПО НАЗВАННОМУ СПОСОБУ | 2001 |
|
RU2262950C2 |
| Способ определения специфического клеточного иммунного ответа на антигены коронавируса (SARS-COV-2) | 2021 |
|
RU2780369C1 |
| ПРИМЕНЕНИЕ МОНОМИКОЛИЛГЛИЦЕРИНА (MMG) В КАЧЕСТВЕ АДЪЮВАНТА | 2008 |
|
RU2479317C2 |
| Средство, обладающее иммуномодулирующей активностью | 2017 |
|
RU2657819C1 |
| ВАКЦИНА, СОДЕРЖАЩАЯ ЭКСТРАКТ РИБОСОМНОГО БЕЛКА (RPE) И Th1- АКТИВИРУЮЩИЙ АДЪЮВАНТ | 2009 |
|
RU2521499C2 |
| СПОСОБ РЕГИСТРАЦИИ РЕАКЦИИ АНТИГЕН-АНТИТЕЛО ДЛЯ ОЦЕНКИ ИММУНИТЕТА У ПРИВИТЫХ ПРОТИВ ЧУМЫ ЛЮДЕЙ С ПОМОЩЬЮ ЦИТОМЕТРИЧЕСКОЙ ТЕХНОЛОГИИ | 2024 |
|
RU2837555C1 |
| СПОСОБ ОЦЕНКИ ИММУНОГЕННОСТИ ВАКЦИНЫ ЧУМНОЙ ЖИВОЙ С ИСПОЛЬЗОВАНИЕМ АНТИГЕНСПЕЦИФИЧЕСКИХ КЛЕТОЧНЫХ ТЕСТОВ IN VITRO | 2018 |
|
RU2680697C1 |
Изобретение относится к медицине и представляет собой способ отбора веществ для направленной модуляции иммунного ответа при вакцинации против чумы людей, характеризующийся тем, что выполняется ex vivo на суспензии клеток крови, полученной до и через месяц после вакцинации, инкубированных с тестируемым веществом при 37°С в течение 24 ч с определением в образцах продукции цитокинов - IL-17, IFN-γ, TNF-α, IL-4 и последующей математической обработкой полученных данных с использованием коэффициентов и индексов, и при значении коэффициента эффективности стимуляции тестируемым веществом Т-клеточного звена иммунной системы (КЭИ) тестируемого вещества, превышающего КЭИ для контроля 2 в диапазоне от 1,5 до 3,0 раз, тестируемое вещество считается пригодным для направленной модуляции иммунного ответа. Осуществление изобретения позволяет повысить информативность, ускорить и унифицировать отбор веществ для направленной модуляции иммунного ответа при вакцинации против чумы. 3 пр., 1 табл.
Способ отбора веществ для направленной модуляции иммунного ответа при вакцинации против чумы людей, характеризующийся тем, что выполняется ex vivo на суспензии клеток крови, полученной до и через месяц после вакцинации, инкубированных с тестируемым веществом при 37°С в течение 24 ч и определением в образцах продукции цитокинов - IL-17, IFN-γ, TNF-α, IL-4 с последующей математической обработкой полученных данных с использованием коэффициентов (К) и индексов (И), вычисляемых по формулам
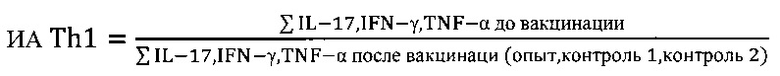
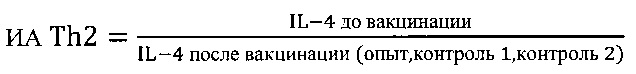
где ИА - индекс активности биомаркеров Th1 и Th2 клеток соответственно
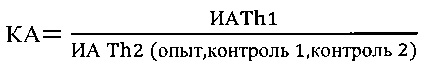
где КА - коэффициент функциональной активности Т-клеточного звена иммунной системы

где КЭИ - коэффициент эффективности стимуляции тестируемым веществом Т-клеточного звена иммунной системы;
опыт - продукция цитокинов в крови вакцинированных на фоне индукции тестируемым веществом;
контроль 1 - спонтанная продукция цитокинов в крови вакцинированных;
контроль 2 - индуцированная стандартным Т-клеточным митогеном конканавалином А (ConA) продукция цитокинов в крови вакцинированных;
при значении КЭИ тестируемого вещества, превышающего КЭИ для контроля 2 в диапазоне от 1,5 до 3,0 раз, тестируемое вещество считается пригодным для направленной модуляции иммунного ответа.
| УСТРОЙСТВО ДЛЯ ОХРАНЫ СЕЙФОВ, ДЕНЕЖНЫХ ЯЩИКОВ И Т.П. ХРАНИЛИЩ | 1925 |
|
SU4621A1 |
| Способ определения активности иммуномодулятора | 1987 |
|
SU1665310A1 |
| Способ отбора иммуномодуляторов | 1983 |
|
SU1210790A1 |
| ВЕРКИНА Л.М | |||
| Оценка эффективности вакцинации против чумы по модуляции функциональных свойств макрофагов при подкожном и аэрогенном введении вакцины // Автореф | |||
| дисс | |||
| к | |||
| мед | |||
| наук | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
Авторы
Даты
2017-06-01—Публикация
2016-03-15—Подача