Изобретение относится к медицине, точнее к клинической иммунологии, и может быть использовано для отбора лекарственных препаратов с иммуномодулирующей ак- тивностью, а также для определения индивидуальной чувствительности к ним при назначении иммунокорригирующей терапии.
Цель изобретения - ускорение и повышение точности способа за счет стандартных, единых условий культивирования иммунокомпетентных клеток на разных полупроницаемых мембранах в единой экспериментальной системе.
Способ осуществляется следующим образом.
10 мл крови помещают в раствор эти- лендиаминтетрауксусной кислоты (10 мл
крови на 2 мл 2,7-ного раствора), разводят раствором Хенкса без Са++, Мо++, наслаивают на раствор фиколла-верографина, имеющий плотность 1,077. После центрифугирования при 400 об/мин 45 мин собирают мононуклеарные клетки, концентрировавшиеся над слоем фиколла, отмывают фосфатным буфером (1500 об/мин, 15 мин, три раза), ресуспендируют в среде культивирования, содержащей антибиотики и 20% инактивированной человеческой сыворотки IV группы, доводят концентрацию клеток до ЮхЮ6 в мл. Часть мононуклеар- ных клеток используют для выделения фракции Т-лимфоцитов. Для этого 4х106 мононуклеарных клеток соединяют с равным объемом 1%-ной взвеси эритроцитов барана, центрифугируют при 1000 об/мин
О С СЛ СО
о
10 мин, выдерживают 60 мин при +4°С, осторожно ресуспендируют и наносят на новую порцию фиколла. Центрифугируют при 400 об/мин 45 мин, собирают фракции}, сконцентрировавшуюся на дне пробирки, добавляют к ней 1 мл дистиллированной воды для лизиса эритроцитов, отмывают в фосфатном буфере (1500 об/мин, 10 мин), ресуспендируют в среде культивирования и доводят концентрацию Т клеток до 10х10бвмл.
В два сосуда со средой культивирования помещают по пять полупроницаемых мембран (1, 2, 3, 4, 5). На мембраны 1 и 2 обоих сосудов помещают фракцию Т-клеток в объеме 0,05 мл, а на мембраны 3,4,5 обоих сосудов - фракцию мононуклеарных клеток в таком же обьеме. Среду культивирования сосуда 1 (опыт) дополняют иммуномодуля- тором в соответствующей концентрации. В среду культивирования сосуда 2 (контроль) добавляют такое же количество среды культивирования. Сосуды с помещенными в них мембранами выдерживают при +37°С 48 ч. После этого вынимают мембраны 1, 2, 3, 4 из обоих сосудов, а в среду культивирования сосуда 1 и 2, в которой остались мембраны 5, добавляют 3Н-тимидин и культивируют еще 4 ч.
На мембранах 1 опытного и контрольного сосудов определяют экспрессию рецептора для Fc фрагмента IgG на Т-клетках, Для этого мембраны помещают в пробирки, содержащие 1 %-ную взвесь эритроцитов быка, сенсибилизированных кроличьим IgG, выдерживают при +37°С 15 мин, а затем при +4°С 1 ч. Находящиеся на мембранах клетки фиксируют 20%-ным раствором формалина и окрашивают гематоксилин-эозином общепринятым способом. В световом микроскопе подсчитывают процент розеток, образовавшихся на мембранах в присутствии и отсутствии иммуномодуляторов.
На мембранах 2 опытного и контрольного сосудов определяют внутриклеточное со- держание циклического АМФ в Т-лимфоцитах в присутствии и отсутствии иммуномодулятора. Для этого мембраны подвергают многократному замораживанию и оттаиванию в ЭДТА-буфере для разрушения Т-клеток. Дальнейшее определение циклического АМФ проводят по методике, предлагаемой фирмой Amersham. поставляющей наборы для определений циклических нуклеотидов.
На мембранах 3 опытного и контрольного сосудов определяют экспрессию рецепторов для эритроцитов барана на мононуклеарных клетках. Для этого мембраны опускают в пробирки с 1%-ной
взвесью эритроцитов барана, выдерживают при + 37°С 15 мин, а затем при + 4°С 60 мин. Находящиеся на мембранах клетки фиксируют 20%-ным раствором формалина и окрашивают гематоксилин- эозином известным способом. В световом микроскопе подсчитывают процент розеток, образовавшихся на опытной и контрольной мембранах.
0 На мембранах 4 опытного и контрольного сосудов определяют экспрессию рецепторов к СЗ-компоненту комплемента на мононуклеарных клетках. Для этого мембраны опускают в пробирки, содержащие 1 % 5 взвеси эритроцитов быка, сенсибилизированных антиэритроцитарными антителами и комплементом, выдерживают при +37°С 15 мин и фиксируют 20%-ным раствором формалина. Окрашивают клетки гематокси- 0 лин-зозином и в световом микроскопе подсчитывают число розеток на опытной и контрольной мембранах.
На мембранах 5 опытного и контрольного сосудов определяют способность имму- 5 номодулятора индуцировать пролиферацию покоящихся лимфоцитов. Для этого мембраны отмывают от невключившегося в клетки 3Н-тимидина и оценивают уровень пролиферации на каждой из них радиометриче- 0 ским методом.
П р и м е р 1. Исследовали кровь здорового донора описанным способом. В качестве иммуномодулятора использовали тактивин. Результаты оценки действия так- 5 тивина на параметры функциональной активности лимфоцитов суммированы в табл.1,
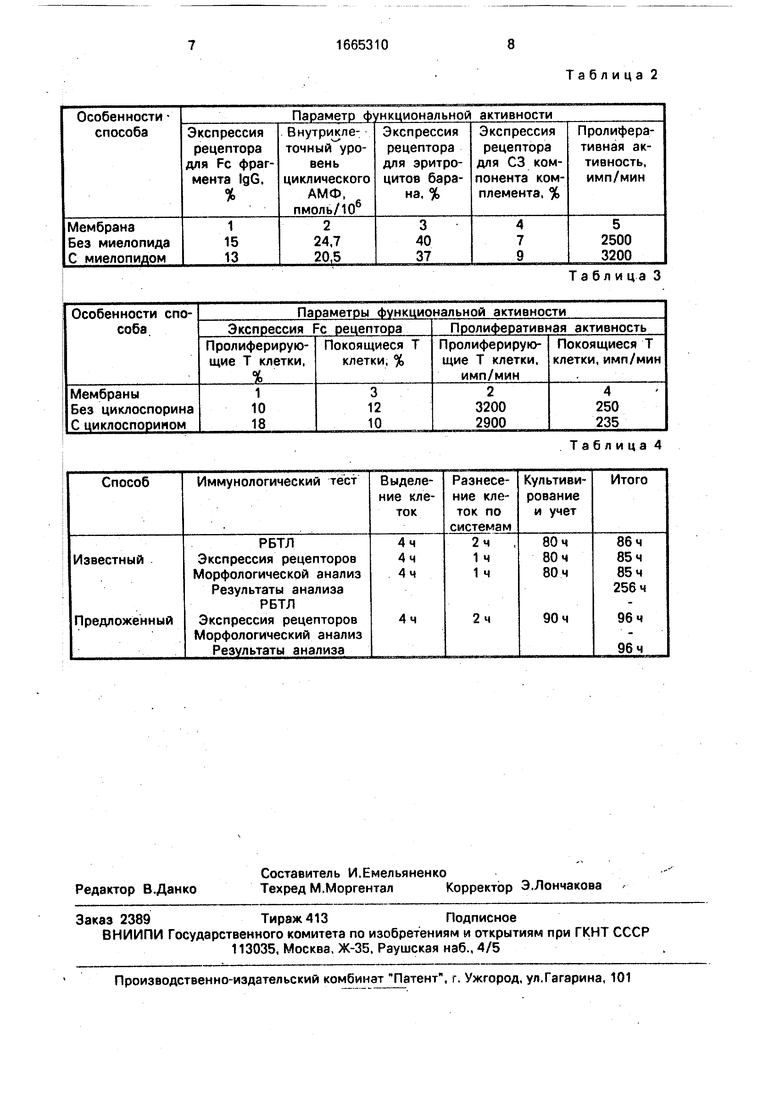
Данные проведенного анализа свидетельствуют, что тактивин увеличивает экс- 0 прессию Fc рецептора на Т-лимфоцитах, снижая при этом внутриклеточный уровень циклического АМФ, и не влияет на остальные исследованные параметры функциональной активности лимфоцитов. 5 П р и м е р 2. Способом, описанным в примере 1, из крови здорового донора выделяли фракцию Т-клеток. В двух сосудах со средой культивирования размещали по 5 полупроводниковых мембран 1-5, на кото- 0 рые наносили по 0.5 мл Т-клеток. В двух сосудах со средой култивирования размещали по 5 полупроницаемых мембран (1-5), на которые наносили по 0,05 мл Т-клеток. Осуществляли стимуляцию Т-клеток в каж- 5 дом из сосудов к пролиферации путем добавления в среду культивирования митогенной дозы (5 мкг/мл) конканавалина А и инкубации при +37°С 48 ч. Стимулирог ванные Т- клетки переносили в два других сосуда со средой культивирования, не содержащей конканавалин А. Первый сосуд (опыт) дополняли иммуномодулятором (мие- лопид) в дозе 30 мкг/мл, а во второй (конт- роль) добавляли соответствующее количество среды культивирования. Через 24 ч инкубации при 37°С измеряли параметры функциональной активности пролифери- рую.щих Т-клеток на каждой из мембран описанным способом. Результаты исследования влияния миелопида на пролифериру- ющие Т-клетки представлены в табл.2.
Данные проведенного анализа свидетельствуют, что конканавалин несколько увеличивает пролиферативную активность Т-лимфоцитов, но не влияет на остальные исследованные параметры функциональной активности,
П р и м е р 3. Способом, описанным в примере 1, из крови здорового донора выделяли фракцию Т-клеток. В двух сосудах со средой культивирования размещали по две полупроницаемые мембраны, на которые наносили по 0,05 мл Т-клеток. В сосуд 1 с мембранами 1 и 2 добавляли митогенную дозу конканавэлина А, а в сосуд 2 с мембра- нами 3 и 4 - соответствующее количество среды культивирования. Оба сосуда инкубировали при +37°С 48 ч. После этого в сосуд 3 со средой культивирования переносили мембрану 1 из сосуда 1 и мембрану 3 из сосуда 2. В сосуд 4 со средой культивирования переносили мембрану 2 из сосуда 1 и мембрану 4 из сосуда 2. Таким образом, в каждом из сосудов 3 и 4 находятся по две мембраны, на одной из которых культивиру- ются покоящиеся лимфоциты, а на другой - стимулированные митогеном к пролиферации. В сосуд 3 (опыт) добавляют иммуномо- дулятор (циклоспорин) в дозе 4 мкг/мл, а в сосуд 4 (контроль) - соответствующее коли- чество среды культивирования. После инкубации при +37°С 24 ч измеряли параметры функциональной активности пролиферирующих и покоящихся Т-клеток способам описанными в примере 1. Результаты иссте довачия влияния циклоспорина на пролифе рирующие и покоящиеся Т-клетки представлены в табл.3.
Таким образом, исследование эффектов циклоспорина в единой экспериментальной системе позволило выявить различие его действия на покоящиеся и пролиферирую- щие клетки: препарат не оказывал влияния на покоящиеся лимфоциты, но стимулировал экспрессию рецептора для Fc фрагмента IgG на пролиферирующих клетках и несколько ингибировал их пролиферацию.
Таким образом, ускорение способа достигается за счет того, что все тесты осуществляют в единой экспериментальной системе.
Сравнение предлагаемого и известного способов приведено в табл 4.
В предложенном способе произведена стандартизация условий выделения и культивирования исследуемых клеток (для всех иммунологических тестов клетки помещаются на одинаковые мембраны в одном сосуде). Это исключает ошибки, связанные с изменением функциональной активности клеток, культивируемых в различных условиях, что повышает точность способа.
Формула изобретения Способ определения активности имму- номодулятора путем добавления его в среду с иммунокомпетентными клетками с последующим определением их функциональной активности, отличающийся тем, что, с целью ускорения и повышения точности способа за счет стандартных единых условий культивирования, иммунокомпетент- ные клетки помещают на разные полупроницаемые мембраны, а их купьтиви- рование проводят в единой экспериментальной системе.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки иммунорегуляторной активности лимфоцитов | 1987 |
|
SU1665306A1 |
| СПОСОБ ДОКЛИНИЧЕСКОГО ТЕСТИРОВАНИЯ ИММУНОМОДУЛИРУЮЩИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2010 |
|
RU2519641C2 |
| Способ определения индивидуальной чувствительности к иммуномодулятору | 1988 |
|
SU1658094A1 |
| МОНОМОЛЕКУЛЯРНЫЙ ХИМЕРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР К РАКОВОМУ АНТИГЕНУ СА125 | 2018 |
|
RU2747095C2 |
| Способ первичного скрининга химических соединений на иммуномодулирующую активность | 1989 |
|
SU1704084A1 |
| СПОСОБ ОБОГАЩЕНИЯ РЕГУЛЯТОРНЫХ CD4CD25FOXP3T-КЛЕТОК ЧЕЛОВЕКА ex vivo | 2010 |
|
RU2437933C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ CD4+CD25+Foxp3+ Т-ЛИМФОЦИТОВ ЧЕЛОВЕКА ex vivo, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ | 2008 |
|
RU2391401C2 |
| СПОСОБ ПРОЛИФЕРАЦИИ КЛЕТОК LAK | 2007 |
|
RU2462511C2 |
| СПОСОБ МОДИФИКАЦИИ МОНОЦИТОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ ДЛЯ ПОВЫШЕНИЯ ИХ ПАРАКРИННОЙ АКТИВНОСТИ ПРИ АУТОЛОГИЧЕСКОЙ ТРАНСПЛАНТАЦИИ | 2012 |
|
RU2497947C1 |
| Средство, обладающее иммуномодулирующей активностью | 2019 |
|
RU2734420C1 |
Изобретение относится к области медицины, в частности к клинической иммунологии, и может быть использовано для отбора лекарственных препаратов и для определения индивидуальной чувствительности к ним при назначении иммунокоррегирующей терапии. Целью изобретения является ускорение и повышение точности способа за счет того, что при добавлении исследуемого иммуномодулятора в среду с иммунокомпетентными клетками создаются единые условия культивирования путем помещения клеток на разные полупроницаемые мембраны, а их культивирование проводят в единой экспериментальной системе. Это исключает ошибки, связанные с изменением функциональной активности клеток, культивируемых в различных условиях, что повышает точность способа, при этом способ ускоряется в 2,5 раза.
Таблица 1
Таблица 2
Таблица 3
Таблица 4
| Методические материалы по экспериментальному (фармакологическому) и клиническому испытанию иммуномодулиру- ющего действия фармакологических средств | |||
| МЗ СССР | |||
| Фармакологический Комитет | |||
| Колосниковая решетка с чередующимися неподвижными и движущимися возвратно-поступательно колосниками | 1917 |
|
SU1984A1 |
| с | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
1991-07-23—Публикация
1987-06-19—Подача