Изобретение относится к области органической химии, а именно к способу получения новых индивидуальных соединений класса 1,7-диазаспиро[4.4]нонана, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
Известны структурные аналоги заявленных соединений, получаемые из 4-бензоилоксициклонона (Collect. Czech. Chem. Commun. 1982, 47, 950-960). Синтез структурных аналогов осуществляется по следующей схеме:
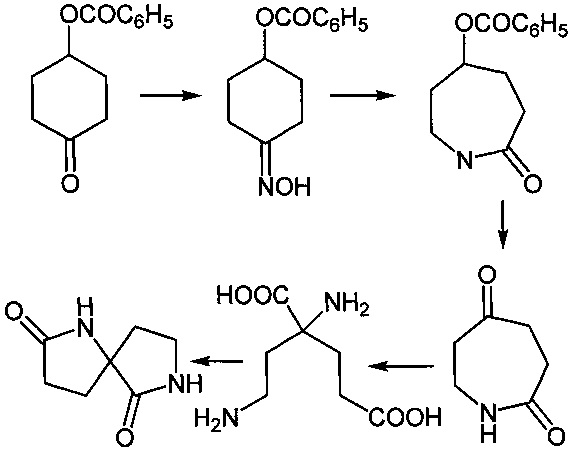
К недостаткам данного способа относится невозможность получения 4-ароил-3-гидрокси-1-(2-гидроксифенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дионов.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе 4-ароил-3-гидрокси-1-(2-гидроксифенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дионов.
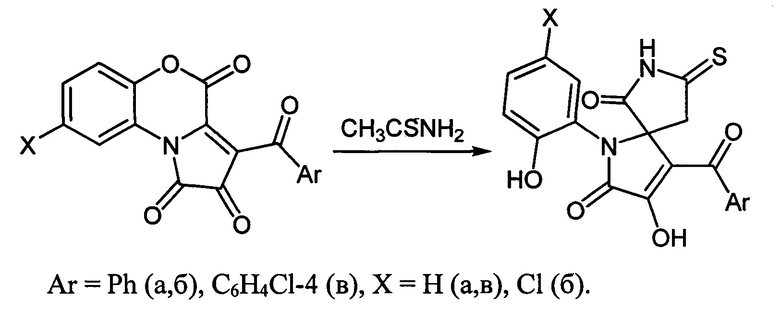
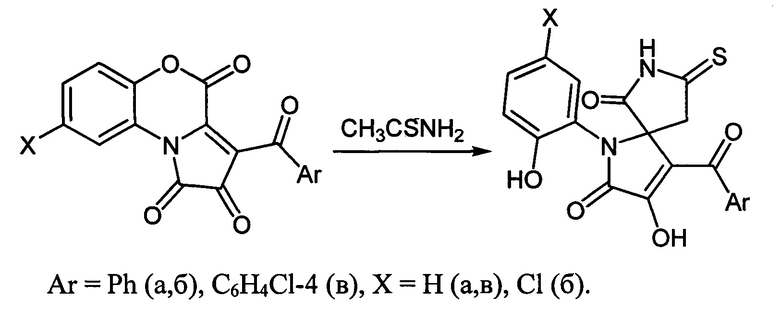
Поставленная задача осуществляется путем кипячения 3-ароилпирроло[2,1-с][1,4]бензоксазин-1,2,4-трионов (Ia-в) с тиоацетамидом в среде инертных апротонных растворителей по следующей схеме:
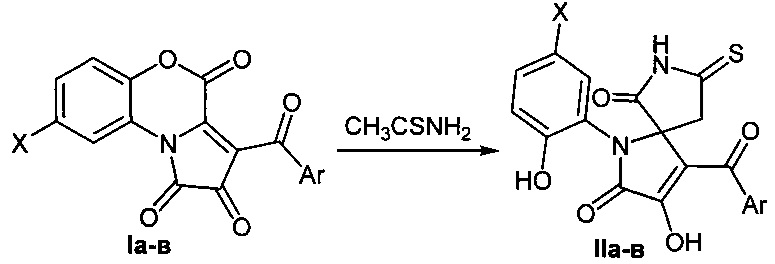
I и II: Ar=Ph (а, б), C6H4Cl-4 (в), X=Н (а, в), Cl (б).
Процесс ведут при температуре 110°С, а в качестве растворителя используют сухой толуол.
Из патентной и технической литературы не были выявлены способы получения 4-ароил-3-гидрокси-1-(2-гидроксифенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дионов, имеющие сходные признаки с заявленным способом, а именно не использовались исходные продукты, растворитель, в котором проходит реакция, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. 4-Бензоил-3-гидрокси-1-(2-гидроксифенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дион (IIа).
К раствору 3.0 ммоль 3-бензоилпирроло[2,1-е][1,4]бензоксазин-1,2,4-триона (1а) в 20 мл сухого толуола добавляли раствор 4.5 ммоль тиоацетамида в 5 мл сухого толуола, кипятили 30 мин, охлаждали, выпавший осадок отфильтровывали, перекристаллизовывали из толуола. Выход 84%, т.пл. 173-178°С (разл., толуол). Соединение (IIа) C20H14N2O5S.
Найдено, %: С 60.84; Н 3.55; N 7.28.
Вычислено, %: С 60.91; Н 3.58; N 7.10.
Соединение (IIа) - желтое кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, труднорастворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (Па), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний групп ОН и NH при 3226 см-1, лактамных и тиолактамной карбонильных групп при 1740 и 1707 см-1, кетонной карбонильной группы C(Ph)=O при 1666 см-1.
В спектре ЯМР 1Н соединения (Па), снятом в растворе ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют синглет енольного протона ОН группы при 13.18 м.д., синглет фенольного протона ОН группы при 10.12 м.д., дублет дублетов метиленовых протонов С9Н2 при 3.39 м.д.
Пример 2. 4-Бензоил-3-гидрокси-1-(2-гидрокси-5-хлорфенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дион (IIб).
К раствору 3.0 ммоль 3-бензоил-8-хлорпирроло[2,1-с][1,4]бензоксазин-1,2,4-триона (16) в 20 мл сухого толуола добавляли раствор 4.5 ммоль тиоацетамида в 5 мл сухого толуола, кипятили 30 мин, охлаждали, выпавший осадок отфильтровывали, перекристаллизовывали из смеси толуола и этилацетата (5:1). Выход 81%, т.пл. 188-192°С (разл., толуол-этилацетат, 5:1). Соединение (IIб) C20H13ClN2O5S.
Найдено, %: С 55.90; Н 3.15; N 6.42.
Вычислено, %: С 56.01; Н 3.06; N 6.53.
Соединение (IIб) - желтое кристаллическое вещество легкорастворимое в ДМСО и ДМФА труднорастворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIб), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний групп ОН и NH при 3184 см-1, лактамных и тиолактамной карбонильных групп при 1748 и 1704 см-1, кетонной карбонильной группы С(Ar)=0 при 1667 см-1.
В спектре ЯМР 1Н соединения (IIб), снятом в растворе ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют синглет енольного протона ОН группы при 13.26 м.д., синглет фенольного протона ОН группы при 10.52 м.д., дублет дублетов метиленовых протонов С9H2 при 3.41 м.д.
Пример 3. 3-Гидрокси-1-(2-гидроксифенил)-8-тиоксо-4-(4-хлорбензоил)-1,7-диазаспиро[4.4]нон-3-ен-2,6-дион (IIв).
К раствору 3.0 ммоль 3-(4-хлорбензоил)пирроло[2,1-с][1,4]бензоксазин-1,2,4-триона (1в) в 20 мл сухого толуола добавляли раствор 4.5 ммоль тиоацетамида в 5 мл сухого толуола, кипятили 30 мин, охлаждали, выпавший осадок отфильтровывали, перекристаллизовывали из толуола. Выход 92%, т.пл. 208-211°С (разл., толуол). Соединение (IIв) C20H13ClN2O5S.
Найдено, %: С 56.21; Н 3.27; N 6.41.
Вычислено, %: С 56.01; Н 3.06; N 6.53.
Соединение (IIв) - желтое кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, труднорастворимое в обычных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIв), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний групп ОН и NH при 3252 см-1, лактамных и тиолактамной карбонильных групп при 1742 и 1705 см-1, кетонной карбонильной группы С(Ar)=0 при 1666 см-1.
В спектре ЯМР 1Н соединения (IIв), снятом в растворе ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют синглет енольного протона ОН группы при 13.16 м.д., синглет фенольного протона ОН группы при 10.11 м.д., дублет дублетов метиленовых протонов С92 при 3.37 м.д.
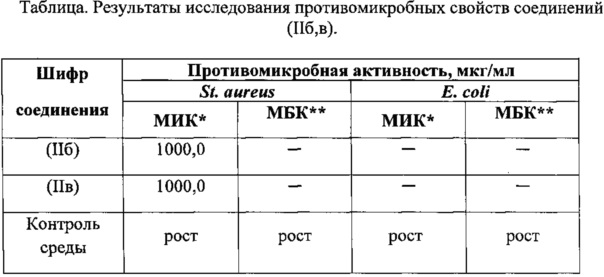
Пример 4. Фармакологическое исследование 4-ароил-3-гидрокси-1-(2-гидроксифенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дионов (IIб, в) на наличие противомикробной активности.
Для исследований использовали общепринятый метод двукратных серийных разведений [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Фисенко В.П. (ред.). - М.: ИИА Ремедиум, 2000. - С. 264-273]. Готовили исходные разведения микроорганизмов в физиологическом растворе из суточной агаровой культуры по оптическому стандарту мутности (ОСО) на 5 ME. Микробная нагрузка соответствовала 2,5*105 микробных тел в 1 мл. Микробную взвесь вносили в изготовленные разведения препаратов в питательной среде. Предварительно все соединения растворяли в 0,5 мл диметилсульфоксида.
Противомикробные свойства химических веществ изучали на 2-х музейных условно-патогенных штаммах микроорганизмов: Staphylococcus aureus (штамм 906) и Escherichia coli (штамм 1257), полученных в ФГБУ «Научный центр экспертизы средств медицинского применения» Минздравсоцразвития России. Факт ингибирования (торможения роста) микробных клеток в разведениях препаратов отмечали после 20-часового термостатирования при 37°С. Окончательные результаты фиксировали через 7 суток после высева на скошенный агар РПА. Максимально испытанная концентрация соединений соответствовала 1000,0 мкг/мл. Противомикробную (ингибирующую, бактерицидную) активность оценивали по минимально действующей концентрации.
Анализ полученных данных показал:
-выявлен ингибирующий эффект в отношении золотистого стафилококка в концентрации 1000,0 мкг/мл у соединений (IIб, в).
Изобретение относится к области органической химии, а именно к способу получения 4-ароил-3-гидрокси-1-(2-гидроксифенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дионов, отличающемуся тем, что 3-ароилпирроло[2,1-с][1,4]бензоксазин-1,2,4-трионы подвергают взаимодействию с тиоацетамидом в среде инертного апротонного растворителя с последующим выделением целевых продуктов. Технический результат: разработан способ получения соединений, обладающих противомикробным действием. 1 з.п. ф-лы, 1 табл., 4 пр.
1. Способ получения 4-ароил-3-гидрокси-1-(2-гидроксифенил)-8-тиоксо-1,7-диазаспиро[4.4]нон-3-ен-2,6-дионов, отличающийся тем, что 3-ароилпирроло[2,1-с][1,4]бензоксазин-1,2,4-трионы подвергают взаимодействию с тиоацетамидом в среде инертного апротонного растворителя с последующим выделением целевых продуктов:
2. Способ по п. 1, отличающийся тем, что в качестве растворителя используют сухой толуол.
| Zsuzsanna Majer и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Commun., 47, 1982, стр.950-960 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2017-08-04—Публикация
2016-05-25—Подача