Изобретение относится к области органической химии, а именно к способам получения новых индивидуальных соединений класса 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
Известны структурные аналоги заявленных соединений, получаемые из 5-алкоксикарбонил-1H-пиррол-2,3-дионов и монофенилмочевины (Дубовцев А.Ю., Денисламова Е.С., Силайчев П.С, Дмитриев М.В, Масливец А.Н. ХГС.2016, 52 (7), 467-472. [Dubovtsev A.Y., Denislamova E.S., Silaichev P.S., Dmitriev M.V., Maslivets A.N. Chem. Heterocyclic Соmр. 2016, 52, 467-472.] doi 10.1007/s10593-016-1913-8). Синтез структурных аналогов осуществляется по следующей схеме:
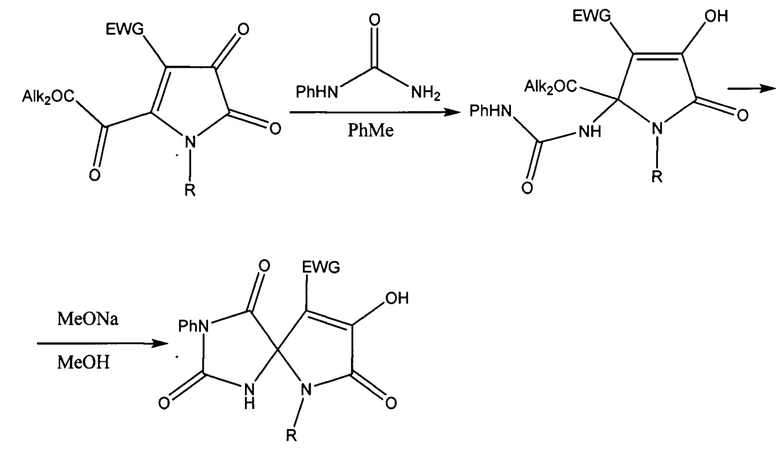
К недостаткам данного способа относится невозможность получения 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро [4.4]нон-8-ен-2,4,7-трионов.
Поставленная задача осуществляется путем взаимодействия 3-ароилпирроло[2,1-с][1,4]бензоксазин-1,2,4-трионов I с дифенилмочевиной, проводимом путем кипячения реагентов в толуоле по следующей схеме:
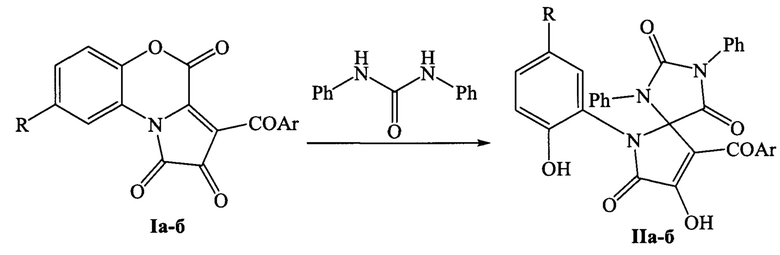
I и II: Аr=Ph, R=Cl (a); Ar=С6Н4Сl-4, R=Н (б).
Из патентной и технической литературы не были выявлены способы получения 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов, имеющие сходные признаки с заявленным способом, а именно, не использовались исходные продукты, растворители, в которых проходит реакция, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. 9-бензоил-8-гидрокси-6-(5-хлор-2-гидроксифенил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трион (IIа).
К раствору 1.0 ммоль пирролдиона (Iа) в 15 мл сухого толуола добавляли 1.0 ммоль дифенилмочевины, кипятили 60 мин к (до исчезновения фиолетовой окраски исходного пирролдиона Iа), охлаждали, выпавший осадок отфильтровывали. Выход 76%, т.пл. 245-248°С (разл., толуол). Соединение (IIа) C31H20ClN3O6.
Найдено, %: С, 65.82; Н, 3.54; N, 7.43.
Вычислено, %: С, 65.79; Н, 3.56; N, 7.42.
Соединение (IIа) - желтое высокоплавкое кристаллическое вещество, плавящееся с разложением, легкорастворимое в ДМСО и ДМФА, растворимое в ацетоне, хлороформе, 1,2-дихлорэтане, 1,4-диоксане, этилацетате, труднорастворимое в ароматических углеводородах, четыреххлористом углероде, нерастворимое в алканах и воде. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIа), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний групп ОН при 3330, 3192 см-1, лактамных карбонильных групп С2=O, С4=O, С7=O при 1796, 1720 см-1, ароильной карбонильной группы при 1690 см-1.
В спектре ЯМР 1H соединения (IIа), снятом в растворе ДМСО-d6, кроме сигналов протонов алифатических заместителей, ароматических колец и связанных с ними групп, присутствуют уширенные синглеты протона фенольной группы ОН в области 10.62 м.д.
Пример 2. 8-гидрокси-6-(2-гидроксифенил)-9-(4-хлорбензоил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трион (IIб).
К раствору 1.0 ммоль пирролдиона (Iб) в 15 мл сухого толуола добавляли 1.0 ммоль дифенилмочевины, кипятили 60 мин к (до исчезновения фиолетовой окраски исходного пирролдиона Iб), охлаждали, выпавший осадок отфильтровывали. Выход 78%, т.пл. 210- 214°С (разл., толуол). Соединение (IIб) C31H20ClN3O6.
Найдено, %: С, 65.77; Н, 3.55; N, 7.45.
Вычислено, %: С, 65.79; Н, 3.56; N, 7.42.
Соединение (IIб) - желтое высокоплавкое кристаллическое вещество, плавящееся с разложением, легкорастворимое в ДМСО и ДМФА, растворимое в ацетоне, хлороформе, 1,2-дихлорэтане, 1,4-диоксане, этилацетате, труднорастворимое в ароматических углеводородах, четыреххлористом углероде, нерастворимое в алканах и воде. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIб), снятого в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний групп ОН и NH при 3336 см-1, лактамных карбонильных групп С2=O, С4=O, С7=O при 1794, 1720 см-1, ароильной карбонильной группы при 1671 см-1.
В спектре ЯМР 1Н соединения (IIб), снятом в растворе ДМСО-d6, кроме сигналов протонов алифатических заместителей, ароматических колец и связанных с ними групп, присутствуют уширенные синглеты протона фенольной группы ОН в области 10.18 м.д.
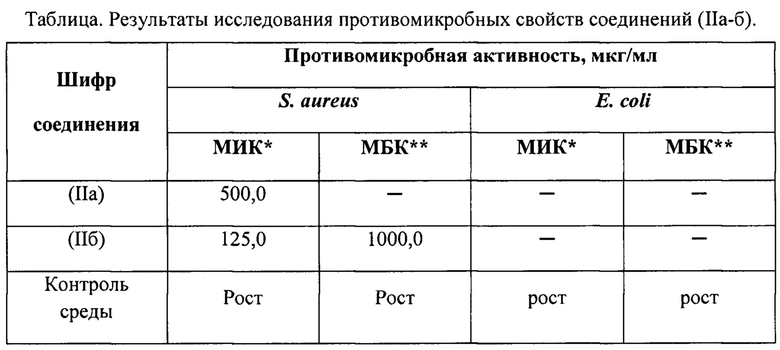
Пример 3. Фармакологическое исследование 9-ароил-8-гидрокси-6-(2-гидроксифенил)-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов (IIа-б) на наличие противомикробной активности.
Для исследований использовали общепринятый метод двукратных серийных разведений в жидкой питательной среде микрометодом [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ -М.: И-во Медицина, 2005]. Готовили исходные разведения микроорганизмов в физиологическом растворе из суточной агаровой культуры по оптическому стандарту мутности (ОСО) на 5 ME с использованием денситометра. После ряда разведений конечная концентрация клеток в опыте составляла 2,5×105 клеток/мл.
Противомикробные свойства химических веществ изучали на 3-х коллекционных условно-патогенных штаммах микроорганизмов: Staphylococcus aureus (штамм 906), Escherichia coli (штамм 1257).
В лунках стерильного 96 луночного плоскодонного микропланшета готовили два параллельных ряда двукратных серийных разведений химических соединений в бульоне РПБ, Сабуро. В каждой лунке содержалось 150 мкл определенной концентрации испытуемого вещества и 150 мкл инокулята культуры. В последних рядах содержалась питательная среда и культура в равных объемах (контроль). Максимально испытанная концентрация соответствовала 1000,0 мкг/мл, минимальная - 1,0 мкг/мл. Микропланшет помещали в термостат спектрофотометра Epoch и замеряли оптическую плотности (ОП) при длине волны 540 нм. Через 24 часа и 7 суток вновь регистрировали ОП культуральной жидкости.
Результаты оценивали с помощью программного обеспечения Gen 5 спектрофотометра для микропланшет Epoch. Последняя лунка ряда с задержкой роста и показателями ОП равной оптической плотности контрольной лунки соответствует минимальной подавляющей концентрацией соединения.
Анализ полученных данных показал:
- соединение IIа обладает ингибирующим действием в концентрации 500,0 в отношении штамма Staphylococcus aureus.
- выявлен ингибирующий эффект в отношении Staphylococcus aureus в концентрации 125,0 мкг/мл у соединения IIб, бактерицидные свойства достигнуты в концентрации 1000,0 мкг/мл.
Изобретение относится к способу получения 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов формулы IIа-б путем взаимодействия 3-ароилпирроло[2,1-с][1,4]бензоксазин-1,2,4-трионов формулы Ia-б с дифенилмочевиной, проводимого путем кипячения реагентов в толуоле по следующей схеме
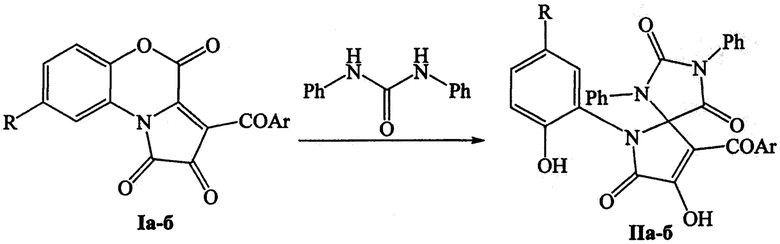 , где I и II: Ar=Ph, R=Cl (а); Ar=C6H4Cl-4, R=Н (б). Технический результат: разработан способ получения 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов, обладающих противомикробной активностью. 1 табл., 3 пр.
, где I и II: Ar=Ph, R=Cl (а); Ar=C6H4Cl-4, R=Н (б). Технический результат: разработан способ получения 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов, обладающих противомикробной активностью. 1 табл., 3 пр.
Способ получения 9-ароил-8-гидрокси-6-(2-гидроксиарил)-1,3-дифенил-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов формулы IIа-б путем взаимодействия 3-ароилпирроло[2,1-с][1,4]бензоксазин-1,2,4-трионов формулы Ia-б с дифенилмочевиной, проводимого путем кипячения реагентов в толуоле по следующей схеме
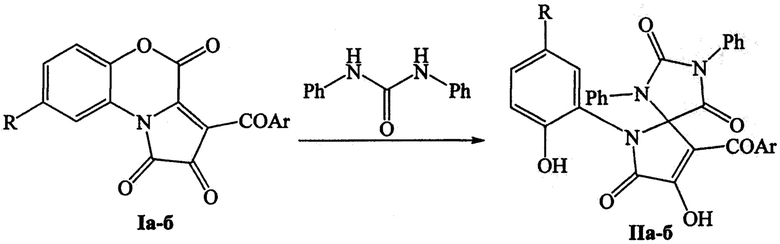
где I и II: Ar=Ph, R=Cl (а); Ar=C6H4Cl-4, R=Н (б).
| Dubovtsev, Aleksei Yu | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| 9-Ароил-8-гидрокси-6-(2-гидроксиэтил)-1,3,6-триазаспиро[4,4]нон-8-ен-2,4,7-трионы, обладающие анальгетической активностью, и способ их получения | 2019 |
|
RU2707197C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛ 1,7-ДИАРИЛ-9-АРОИЛ-4-БЕНЗОИЛ-3-ГИДРОКСИ-2,6-ДИОКСО-1,7-ДИАЗАСПИРО[4.4]НОН-3,8-ДИЕН-8-КАРБОКСИЛАТОВ, ПРОЯВЛЯЮЩИХ АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ | 2013 |
|
RU2537999C1 |
| Krolenko, Konstantin Yu | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2022-03-17—Публикация
2021-06-24—Подача