ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной непредварительной заявке, поданной согласно 37 CFR §1.53(b), испрашивается приоритет согласно 35 USC §119(e) в соответствии с предварительной заявкой на выдачу патента США №61/916,657, поданной 16 декабря 2013 года, содержание которой включено во всей своей полноте в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Изобретение относится к полиморфным формам ингибитора PI3K, соединения GDC-0032, называемого (2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид. Изобретение также относится к способам получения полиморфных форм GDC-0032 и способам использования фармацевтических композиций на основе полиморфных форм GDC-0032 для in vitro, in situ и in vivo диагностики или лечения клеток млекопитающих, или ассоциированных с ними патологических состояний.
УРОВЕНЬ ТЕХНИКИ
Фосфоинозитид-3-киназы (PI3K) представляют собой липидные киназы, которые фосфорилируют липиды по 3-гидроксильному остатку инозитольного кольца (Whitman et al. (1988) Nature, 332:664). Образованные PI3-киназами 3-фосфорилированные фосфолипиды (PIP3) действуют в качестве вторичных мессенджеров, рекрутируя киназы с липид-связывающими доменами (включая гомологичные плекстрину (РН) области), такие как Akt и фосфоинозитид-зависимая киназа-1 (PDK1). Связывание Akt с мембранными PIP3 вызывает перемещение Akt к плазматической мембране, приводя Akt в контакт с PDK1, который отвечает за активацию Akt. Фосфатаза с противоопухолевой активностью, PTEN, дефосфорилирует PIP3 и поэтому действует в качестве отрицательного регулятора Akt активности. PI3-киназы Akt и PDK1 важны в регуляции многих клеточных процессов, включая регуляцию клеточного цикла, пролиферацию, выживаемость, апоптоз и подвижность, и являются существенными компонентами молекулярных механизмов заболеваний, таких как рак, диабет и иммунное воспаление (Vivanco et al. (2002) Nature Rev. Cancer 2:489; Phillips et al. (1998) Cancer 83:41).
Основной изоформой PI3-киназы при раке является PI3-киназа класса I, р110 α (альфа) (US 5824492; US 5846824; US 6274327). Другие изоформы вовлечены в сердечно-сосудистые и иммунно-воспалительные заболевания (Workman Р (2004) Biochem Soc Trans 32: 393-396; Patel et al. (2004) Proceedings of the American Association of Cancer Research (Abstract LB-247) 95th Annual Meeting, March 27-31, Orlando, Florida, USA; Ahmadi K and Waterfield MD (2004) Encyclopedia of Biological Chemistry (Lennarz W J, Lane M D eds) Elsevier/Academic Press). Путь передачи сигнала посредством PI3-киназы/Akt/PTEN представляет собой притягательную мишень для разработки противораковых лекарственных средств, т.к. ожидается, что данные агенты будут ингибировать пролиферацию, обращать подавление апоптоза и преодолевать резистентность раковых клеток к цитотоксическим средствам. (Folkes et al. (2008) J. Med. Chem. 51: 5522-5532; Yaguchi et al. (2006) Jour, of the Nat. Cancer Inst. 98(8): 545-556). The PI3K-PTEN-AKT signaling pathway is deregulated in a wide variety of cancers (Samuels Y, Wang Z, Bardellil A et al. High frequency of mutations of the PIK3CA gene in human cancers. (2004) Science; 304 (5670): 554; Carpten J, Faber AL, Horn C. "A transforming mutation in the pleckstrin homology domain of AKT1 in cancer" (2007) Nature; 448: 439-444).
GDC-0032, также известный как таселисиб, RG7604, или имеющий название по ИЮПАК: (2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид, обладает сильной PI3K активностью (Ndubaku et al. (2013) Jour. Med. Chem. 56(11):4597-4610; WO 2013/182668; WO 2011/036280; US 8242104; US 8343955) и исследуется на пациентах с местно-распространенными или метастазирущими солидными опухолями (Juric et al. "GDC-0032, a beta isoform-sparing PI3K inhibitor: Results of a first-in-human phase la dose escalation study", 2013 (April 07) Abs LB-64 American Association for Cancer Research Annual Meeting).
Многочисленные кристаллические формы лекарственной субстанции с различными свойствами в твердом состоянии могут проявлять различия в биодоступности, сроке хранения и поведении в ходе переработки. Порошковая рентгеновская дифракция является эффективным инструментом для идентификации различных кристаллических фаз за счет их уникальных дифрактограмм.
Фармацевтическая промышленность часто сталкивается с явлением множественных полиморфных форм одного и того же кристаллического химического соединения. Полиморфизм часто характеризуется, как способность лекарственной субстанции существовать в двух или более кристаллических фазах, которые имеют различный порядок и/или конформации молекул в кристаллической решетке, давая кристаллы с разными физико-химическими свойствами. Ключевым фактором, определящим успех лекарственного продукта, является способность производить выбранную полиморфную форму с высокой степенью надежности.
Регуляторные органы во все мире требуют принятия разумных усилий для идентификации полиморфных форм лекарственных субстанций и проверки взаимопревращений полиморфов. Благодаря часто непредсказуемому поведению полиморфов и их соответствующим различиям в физико-химических свойствах, необходимо продемонстрировать, что постоянство свойств сохраняется для разных производственных серий одного и того же продукта. Надлежащее понимание полиморфного ландшафта и природы полиморфов лекарственных препаратов будет содействовать стабильности производства.
Знание кристаллической структуры на атомном уровне и межмолекулярных взаимодействий дает важную информацию для установления абсолютной конфигурации (энантиомеров), идентификации фаз, контроля качества и усовершенствования процессов контроля и оптимизации. Рентгеновская дифракция широко признана, как надежный инструмент для анализа кристаллической структуры фармацевтических веществ и идентификации кристаллических форм.
Наличие монокристалла лекарственного вещества предпочтительно, так как позволяет быстро и точно устанавливать структуру. Однако не всегда можно получить кристалл подходящего размера для сбора данных. В таких случаях кристаллическая структура может быть определена при помощи данных рентгеновской порошковой дифракции, полученных путем проведения измерений при обычных условиях и/или при разной температуре или влажности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к полиморфным формам PI3K ингибитора I (таселисиб, GDC-0032, RG7604, CAS Reg. No. 1282512-48-4, Genentech, Inc.) называемого (2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазе-пин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид, имеющего следующую структуру:
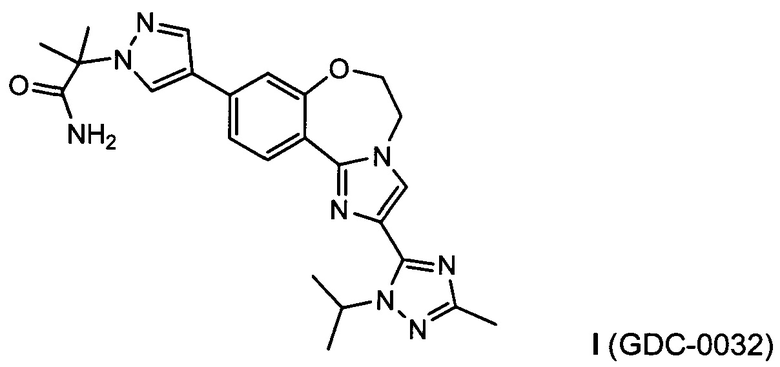
и его стереоизомерам, геометрическим изомерам, таутомерам и фармацевтически приемлемым солям.
Другой аспект настоящего изобретения относится к фармацевтической композиции на основе полиморфной формы таселисиба.
Еще один аспект настоящего изобретения относится к способу лечения гиперпролиферативных заболеваний у млекопитающих при помощи полиморфной формы таселисиба.
Следующий аспект настоящего изобретения относится к способу получения кристаллического полиморфа таселисиба.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 представлено ORTEP изображение А Формы GDC-0032, монометанолят сольват. Эллипсоиды анизотропного замещения атомов показаны с уровнем вероятности 50%.
На Фигуре 2 показана рентгеновская порошковая дифрактограмма (XRPD) для А формы GDC-0032, моно-метанолят.
На Фигуре 3 представлено ORTEP изображение А формы GDC-0032, не сольватированной. Эллипсоиды анизотропного замещения атомов показаны с уровнем вероятности 50%.
На Фигуре 4 показана схема упаковки GDC-0032 вдоль кристаллографической оси а.
На Фигуре 5 показана схема упаковки GDC-0032 вдоль кристаллографической оси b.
На Фигуре 6 показана схема упаковки GDC-0032 вдоль кристаллографической оси с.
На Фигуре 7 показаны водородные связи GDC-0032 вдоль кристаллографической оси с.
На Фигуре 8 показано очевидное π-стэкинг взаимодействие в GDC-0032.
На Фигуре 9 показана рассчитанная порошковая дифрактограмма GDC-0032.
На Фигуре 10 приведена XRPD дифрактограмма для В формы GDC-0032.
На Фигуре 11 показаны термические данные для В формы GDC-0032.
На Фигуре 12 показаны данные FT-IR (инфракрасная спектроскопия с преобразованием Фурье) для В формы GDC-0032.
На Фигуре 13 приведена XRPD дифрактограмма для С формы GDC-0032, изоамиловый спирт.
На Фигуре 14 приведена XRPD дифрактограмма для D формы GDC-0032, моногидрат.
На Фигуре 15 показано наложение XRPD дифрактограмм для Е формы GDC-0032 (сверху) и В формы (снизу).
На Фигуре 16 показано наложение XRPD дифрактограмм для F формы GDC-0032 (сверху) и В Формы (снизу).
На Фигуре 17 показано наложение XRPD дифрактограмм для G формы GDC-0032 (в середине), К формы (сверху) и В формы (снизу).
На Фигуре 18 показано наложение XRPD дифрактограмм для I формы GDC-0032 (сверху), G формы (в середине) и В формы (снизу).
На Фигуре 19 показано наложение XRPD дифрактограмм для J1 формы GDC-0032 (сверху) и В формы (снизу).
На Фигуре 20 показано наложение XRPD дифрактограмм для J2 формы GDC-0032 (сверху) и В формы (снизу).
На Фигуре 21 показано наложение XRPD дифрактограмм для K формы GDC-0032 (сверху) и В формы (снизу).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Если не определено иначе, технические и научные термины, используемые здесь, имеют такое же значение, которое обычно подразумевается специалистом в данной области техники, которому принадлежит это изобретение, и соответствуют следующим:
ОПРЕДЕЛЕНИЯ
Слова «содержать», «содержащий», «включать», «включающий» и «включает», используемые в настоящем описании и в формуле изобретения, предназначены для определения наличия определенных признаков, целых чисел, компонентов или стадий, но они не мешают наличию или добавлению одного или нескольких других признаков, целых чисел, компонентов, стадий или их групп.
Используемый здесь термин «около», когда он применяется в отношении положений пиков рентгеновской порошковой дифрактограммы, означает присущую пикам вариабельность, зависящую, например, от калибровки используемого оборудования, способа получения полиморфа, возраста кристаллического материала и т.п., в зависимости от используемой аппаратуры. В данном случае погрешность измерения прибора составляет около +-0.2 градуса 2-тета(θ). Специалисту в данной области техники, который может извлечь пользу из данного описания, понятно использование слова «около» в данном контексте. Термин «около» в отношении других определенных параметров, например, содержания воды, Cmax, tmax, AUC, скорости растворения, температуры и времени, указывает на присущую вариабельность, например, при измерении или достижении параметра. Специалисту в данной области техники, который может извлечь пользу из данного описания, будет понятна варабельность параметра, подразумевающая использование слова «около».
«Полиморф» в контексте настоящего изобретения означает существование различных кристаллических форм одного соединения в определенных гидратных состояниях, то есть свойство некоторых соединений и комплексов. Таким образом, полиморфы представляют собой различные твердые формы, имеющие одну и ту же молекулярную формулу, но при этом каждый полиморф может иметь отличающиеся физические свойства. Поэтому одно соединение может существовать в различных полиморфных формах, каждая из которых имеет различные и отличные от других физические свойства, такие как профиль растворимости, температура плавления, гигроскопичность, форма частиц, плотность, текучесть, прессуемость и/или пики рентгеновской дифрактограммы. Растворимость каждого полиморфа может варьировать, таким образом, идентификация существования фармацевтиеских полиморфов важна для получения лекарственных средств с предсказуемым профилем растворимости. Желательно изучить все твердые формы лекарственного средства, включая все полиморфные формы, и определить стабильность, параметры растворения и текучести каждой полиморфной формы. Полиморфные формы можно различить в лаборатории, при помощи рентгеновской дифракционной спектроскопии и других методов, таких как инфракрасная спектроскопия. Общий обзор полиморфов и фармацевтических применений полиморфов представлен в работах G.М. Wall, Pharm Manuf. 3:33 (1986); J.K. Haleblian and W. McCrone, J. Pharm. Sci., 58:911 (1969); "Polymorphism in Pharmaceutical Solids, Second Edition (Drugs and the Pharmaceutical Sciences)", Harry G. Brittain, Ed. (2011) CRC Press (2009); and J.K. Haleblian, J. Pharm. Sci., 64, 1269 (1975), которые включены в настоящее описание в виде ссылки.
Аббревиатура "XRPD" означает порошковую дифракцию рентгеновских лучей, аналитический метод, с помощью которого измеряют и определяют углы связей и расстояния в кристаллических веществах, используя дифрацию рентгеновского излучения. Анализ данных XRPD основан на общем виде полученной порошковой рентгенограммы (рентгенограмм) в отношении к известному отклику системы дифракции рентгеновских лучей, применяемой для сбора данных. Для характеристики типа порядка твердого тела в образце порошка могут быть использованы положение, форма, ширина и относительная интенсивность распределения дифракционных пиков, которые могут присутствовать на порошковой дифрактограмме. Положение, форма и интенсивность любого широкого диффузного рассеяния (гало) в верхней части аппаратного фона могут быть использованы для характеристики уровня и типа беспорядка твердого тела. Совместная интерпретация порядка и беспорядка твердого тела, наблюдаемая в образце порошка, позволяет на качественном уровне определить макро-структуру образца.
Термины «лечить» и «лечение» относятся к терапевтическому лечению и профилактике или предупредительным мерам, благодаря которым у объекта предупреждается или снижается (ослабевает) нежелательное физиологическое изменение или расстройство, такое как рост, развитие или распространение рака. Для целей настоящего изобретения полезные или желательные клинические результаты включают, но не ограничиваются следующими: облегчение симптомов, уменьшение степени заболевания, стабилизированное состояние заболевания (т.е. отсутствие ухудшения), отсрочку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (частичную или полную), определяемые или не определяемые. «Лечение» также может означать пролонгированное выживание в сравнении с предполагаемым выживанием в случае отсутствия лечения. К тем, кто нуждается в лечении, относятся те, кто уже находится в определенном состоянии или имеет заболевание, а также те, у кого есть склонность к развитию определенного состояния или заболевания, или те, у которых определенное состояние или заболевание предупреждают.
Словосочетание «терапевтически эффективное количество» означает количество соединения в соответствии с настоящим изобретением, которое (i) лечит определенное заболевание, состояние иди рассторойство, (ii) ослабляет, улучшает или устраняет один или более симптомов определенного заболевания, состояния или расстройства или (iii) предупреждает или позволяет отсрочить появление одного или более симптомов определенного заболевания, состояния или расстройства, описанного здесь. В случае рака терапевтически эффективное количество лекарственного средства может сокращать число раковых клеток, уменьшать размер опухоли, ингибировать (т.е. до некоторой степени замедлять и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. до некоторой степени замедлять и предпочтительно останавливать) метастазирование опухоли; ингибировать до некоторой степени рост опухоли и/или облечать до некоторой степени один или более симптомов, ассоциированных с раком. До определенной степени лекарственное средство может препятствовать росту и/или уничтожать существующие раковые клетки, может быть цитостатическим и/или цитотоксическим. Эффективность раковой терапии может быть измерена, например, оценкой времени до прогрессирования заболевания (ТТР) и/или определением скорости ответа (RR).
Термины «рак» и «раковый» относятся или описывают физиологическое состояние млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. «Опухоль» включает одну или более раковых клеток. Примеры рака включают, но неограничиваются следующими: карцинома, лимфома, бластома, саркома, лейкемия или лимфоидные опухоли. Более частные примеры таких раковых заболеваний включают: плоскоклеточный рак (например, плоскоклеточный рак эпителия), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких ("NSCLC"), аденокарциному легких и плоскоклеточный рак легких, рак брюшины, гепатоклеточный рак, рак кишечника или желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, эндометриальную или маточную карциному, карциному слюнной железы, рак почек, рак простаты, рак наружных женских половых органов, рак щитовидной железы, гепатокарциному, карциному анального канала, карциному мужского полового члена, а также рак головы и рак шеи. Используемый здесь термин рак желудочно-кишечного тракта включает рак желудка, который может развиваться в любой части желудка и может распространяться через желудок и к другим органам, особенно пищеводу, легким, лимфоузлам и печени.
Термин «гематопоэтическая опухоль» означает рак или гиперпролиферативное заболевание, возникшее при вовлечении в гемопоэз таких клеток, как лейкоциты, лимфоциты, натуральные клетки-киллеры, плазматические клетки, и миелоидные клетки, такие как нейтрофилы и моноциты. Гематопоэтические опухоли включают неходжкинскую лимфому, большую диффузную гематопоэтическую лимфому фолликулярную симфому, мантийноклеточную лимфому, хронический лимфолейкоз, множественную миелому, острый миелогенный лейкоз и миелоидный лейкоз. Лимфоцитарный лейкоз (или лимфобластический) включает острую лимфобластическую лейкемию (ALL) и хроническую лимфобластическую лейкемию (CLL). Миелогенный лейкоз (также «миелоидный» или «не-лимфоцитарный») включает острый миелоидный лейкоз (или миелобластоз) (AML) и хронический миелогенный лейкоз (CML).
«Химиотерапевтический агент» представляет собой биологическое (макромолекулярное) или химическое (малую молекулу) соединение, полезное в лечении рака, вне зависимости от механизма действия. Химиотерапевтические агенты включают, но не ограничиваются следующими: 5-FU (5-фторурацил), доцетаксел, эрибулин, гемцитабин, GDC-0973, GDC-0623, паклитаксел, тамоксифен, фулвестрант, дексаметазон, пертузумаб, трастузумаб эмтанзин, трастузумаб и летрозол.
Термин «мелкопитающее» включает, но не ограничиваются следующими: люди, мыши, крысы, морские свинки, обезьяны, собаки, кошки, лошади, коровы, свиньи и овцы.
Термин «листовка-вкладыш» используется для обозначения инструкции по применению, обычно вкладываемой в коммерческую упаковку терапевтического продукта, которая содержит информацию о показаниях, применении, дозировках, приеме, противопоказаниях и/или предупреждениях, касающихся использования таких терапевтических продуктов.
Словосочетание «фармацевтически приемлемая соль» как используют в настоящем изобретении, относится к фармацевтически приемлемым органическим или неорганическим солям соединения настоящего изобретения. Примеры солей включают следующие соли: сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконатн, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат ("мезилат"), этансульфонат, бензолсульфонат, п-толуолсульфонат и памоатную (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)), но не ограничиваются ими. Фармацевтически приемлемая соль может содержать включения другой молекулы, такой как ацетат-ион, сукцинат-ион или другой противоион. Противоион может быть органической или неорганической группой, которая стабилизирует заряд исходного соединения. Кроме того, фармацевтически приемлемая соль может иметь более чем один заряженный атом в своей структуре. Примеры, в которых несколько заряженных атомов являются частью фармацевтически приемлемой соли, могут иметь несколько противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или более заряженных атомов и/или один или более противоионов.
Если соединение по изобретению является основанием, требуемую фармацевтически приемлемую соль можно получить любым подходящим способом, известным в данной области техники, например обработкой свободного основания неорганической кислотой, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и подобные, или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глукуроновая кислота или галактуроновая кислота, альфа-гидроксикислотой, такой как лимонная кислота или винная кислота, аминокислотой, такой как аспарагиновая кислота или глутаминовая кислота, ароматической кислотой, такой как бензойная кислота или коричная кислота, сульфоновой кислотой, такой как п-толуолсульфоновая кислота или этансульфоновой кислотой или подобными.
Если соединение по изобретению представляет собой кислоту, требуемую фармацевтически приемлемую соль можно получить любым подходящим способом, например, обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксидом щелочного металла или гидроксидом щелочноземельного металла или подобными. Иллюстративные примеры подходящих солей включают, но не ограничиваются следующими: органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, поученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
Нужная фармацевтически приемлемая соль может быть получена любым подходящим способом, известным из уровня техники. Например, обработкой свободного основания неорганической кислотой, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и подобные, или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глукуроновая кислота или галактуроновая кислота, альфа-гидроксикислотой, такой как лимонная кислота или винная кислота, аминокислотой, такой как аспарагиновая кислота или глутаминовая кислота, ароматической кислотой, такой как бензойная кислота или коричная кислота, сульфоновой кислотой, такой как п-толуолсульфоновая кислота или этансульфоновой кислотой или подобными. Кислоты, которые обычно рассматриватся, как подходящие для получения фармацевтически полезных или приемлемых солей из основных фармацевтических соединений, обсуждаются, например, в работах P. Stahl et al., Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use. (2002) Zurich: Wiley-VCH; S. Berge et al., Journal of Pharmaceutical Sciences (1977) 66(1) 1 19; P. Gould, International J. of Pharmaceutics (1986) 33201217; Anderson et al., The Practice of Medicinal Chemistry (1996), Academic Press, New York; Remington's Pharmaceutical Sciences, 18th ed., (1995) Mack Publishing Co., Easton PA; и в The Orange Book (Food & Drug Administration, Washington, D.C. на соответствующем сайте). Эти публикации включены сюда в виде ссылки.
Словосочетание "фармацевтически приемлемый" означает, что вещество или композиция должна быть химически и/или токсилогически совместимой с другими ингредиентами, содержащимися в формуляции, и/или с млекопитающим, которого нужно лечить.
"Сольват" относится к ассоциату или комплексу одной или более молекул растворителя и соединения по изобретению. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваются следующими: вода, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусная кислота и этаноламин. Термин "гидрат" относится к комплексу, в котором молекула растворителя является водой.
Термин "хиральный" относится к молекулам, которые обладают свойством неналожимости зеркальных изображений молекулы, тогда как термин "ахиральная" относится к молекулам, зеркальные изображения которых можно наложить друг на друга.
Термин "стереоизомеры" относится к соединениям, которые имеют одинаковую химическую структуру, но отличаются расположением атомов или групп в пространстве.
"Диастереомер" относится к стереоизомеру с двумя или более хиральными центрами, молекулы которого не являются зеркальным отображением друг друга. Диастереомеры обладают разными физическими свойствами, например, разными температурами плавления, температурами кипения, спектральными свойствами и реакционноспособностью. Смеси диастереомеров можно разделить аналитическими методами высокого разрешения, такими как электрофорез и хроматография.
"Энантиомеры" относятся к двум стереоизомерам соединения, представляющим собой зеркальные отражения друг друга, не совмещаемые в пространстве.
Стереохимические определения и условные обозначения, используемые в настоящем изобретении, обычно соответствуют S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Соединения по изобретению могут содержать асимметрические или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Подразумевается, что все стереоизомерные формы соединений настоящего изобретения, включая диастереомеры, энантиомеры и атропизомеры, но неограничиваясь ими, а также их смеси, такие как рацемические смеси, образуют часть настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения приставки D и L, или R и S используют для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (центров). Приставки d и l или (+) и (-) применяют для обозначения знака вращения плоскости поляризованного света соединением, причем (-) или l обозначает, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. Для данной химической структуры эти стереоизомеры являются идентичными, за исключением того, что они являются зеркальными изображениями друг друга. Конкретный стереоизомер также может называться энантиомером, а смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, которая может образовываться при отсутствии стереоселективности или стереоспецифичности химической реакции или способа. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных молекул, не обладающих оптической активностью.
Термин "таутомер" или "таутомерная форма" относится к структурным изомерам с различными энергиями, которые взаимопревращаются благодаря низкоэнергетическому барьеру. Например, у протонных таутомеров (также известных как прототропные таутомеры) взаимопревращение происходит посредством миграции протона, такой как при кето-енольной и имин-енаминовой изомеризации. Таутомеры валентности включают взаимопревращения при реорганизации некоторых из связывающих электронов.
ПОЛИМОРФЫ GDC-0032
Настоящее изобретение включает полиморфы GDC-0032 и процессы, способы и реагенты для получения полиморфов GDC-0032, представленных Формулой I (Roche RG7604, CAS Reg. No. 1282512-48-4):
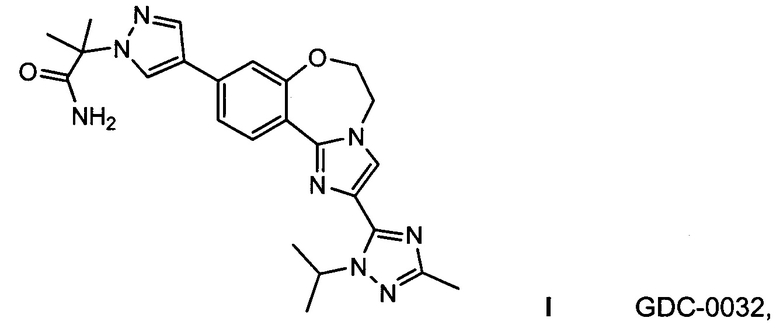
называемого 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамид (US 8242104; WO 2011/036280, которые непосредственно включены в качестве ссылки). Как используется здесь, GDC-0032 включает все стереоизомеры, геометрические изомеры, таутомеры и их фармацевтически приемлемые соли.
Триклинные параметры ячейки и рассчитанный объем для В формы GDC-0032 являются следующими а=9.7944(14), b=10.4767(11), 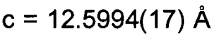 , α=96.145(10), β=95.749(11), β=115.072(9)°,
, α=96.145(10), β=95.749(11), β=115.072(9)°,  . Вес ассиметрической единицы в кристаллической структуре В формы GDC-0032, рассчитанный по формуле 460.541 amu⋅(единица формы)-1 с Z=2, приводит к рассчитанной плотности 1.33 г/см3. Пространственная группа была определена как Р-1 (№2). Данные кристалла и полученные параметры кристаллографических данных представлены в Таблице 8 Примера 13.
. Вес ассиметрической единицы в кристаллической структуре В формы GDC-0032, рассчитанный по формуле 460.541 amu⋅(единица формы)-1 с Z=2, приводит к рассчитанной плотности 1.33 г/см3. Пространственная группа была определена как Р-1 (№2). Данные кристалла и полученные параметры кристаллографических данных представлены в Таблице 8 Примера 13.
Качество полученной структуры среднее, что показывает значение R (R-value) 0.060 (6%). Как правило, наиболее надежно определенные структуры имеют значения R в диапазоне от 0.02 до 0.05 (Glusker, Jenny Pickworth; Trueblood, Kenneth N. Crystal Structure Analysis: A Primer, 2nd ed.; Oxford University press: New York, (1985), p. 87).
На фигуре 3 приведено изображение ORTEP для GDC-0032., Присутствует конфомационная разупорядоченность при С6 с атомом углерода частично занимающим два различных положения (31.3% для С6а и 68.7% % для C6b). Молекула, наблюдаемая в ассиметрической ячейке одиночной кристаллической структуры, соответствует молекулярной структуре Формулы I. Ассиметрическая ячейка, показанная на Фиг. 3, содержит одну молекулу GDC-0032.
На Фигурах 4, 5 и 6, показаны схемы упаковки вдоль кристаллографических осей a, b и с, соответственно. Пустоты, доступные для растворителя, отсутствуют. Водородные связи представлены на Фигуре 7. Водородные связи формируют димер голова-хвост с амидным N108, действующим как донор водорода, и триазиновым N25, действующим, как акцептор (схема нумерации соответствует Фигуре 3). Расстояние донор-акцептор составляет 2.965 (5)  , и угол связи донор-водород-акцептор составляет 153 (3)°. Также присутствует очевидное межмолекулярное π-взаимодействие (пи-стэкинг) в GDC-0032 димере между бензольным кольцом одной молекулы и имидазольным кольцом второй молекулы (Фигура 8).
, и угол связи донор-водород-акцептор составляет 153 (3)°. Также присутствует очевидное межмолекулярное π-взаимодействие (пи-стэкинг) в GDC-0032 димере между бензольным кольцом одной молекулы и имидазольным кольцом второй молекулы (Фигура 8).
Фигура 9 показывает рассчитанную порошковую дифрактограмму (XRPD) В формы GDC-0032, полученную на основе данных монокристалла. Экспериментальная XRPD дифрактограмма В формы GDC-0032 показана на Фигуре 10. Рассчитанная порошковая рентгенограмма, полученная на основе данных монокристалла, и экспериментальная регтгенограмма были получены при 150°C и приблизительно 295°C, соответственно. Из-за разницы температур может иметь место анизотропное увеличение или уменьшение параметров единичной ячейки а, b, с и углов α, β, γ, вызывающее смещение пиков в двух дифрактограммах относительно друг друга. Все пики, присутствующие на экспериментальной дифрактограмме, представлены и на рассчитанной дифрактограмме, показывая, что основной материал вероятно имеет одну фазу, и что это та же фаза, что и в монокристалле.
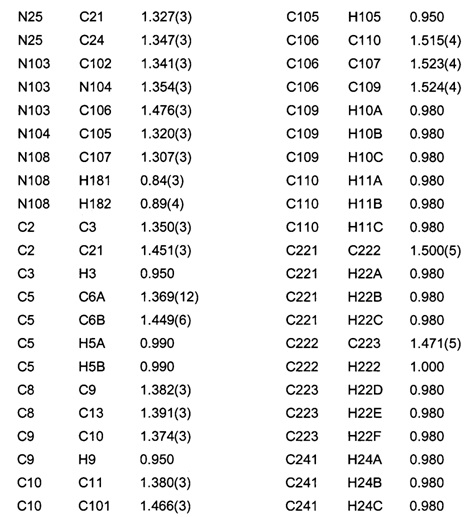
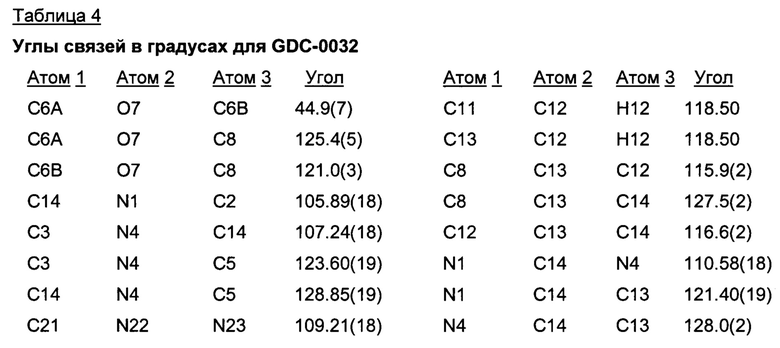
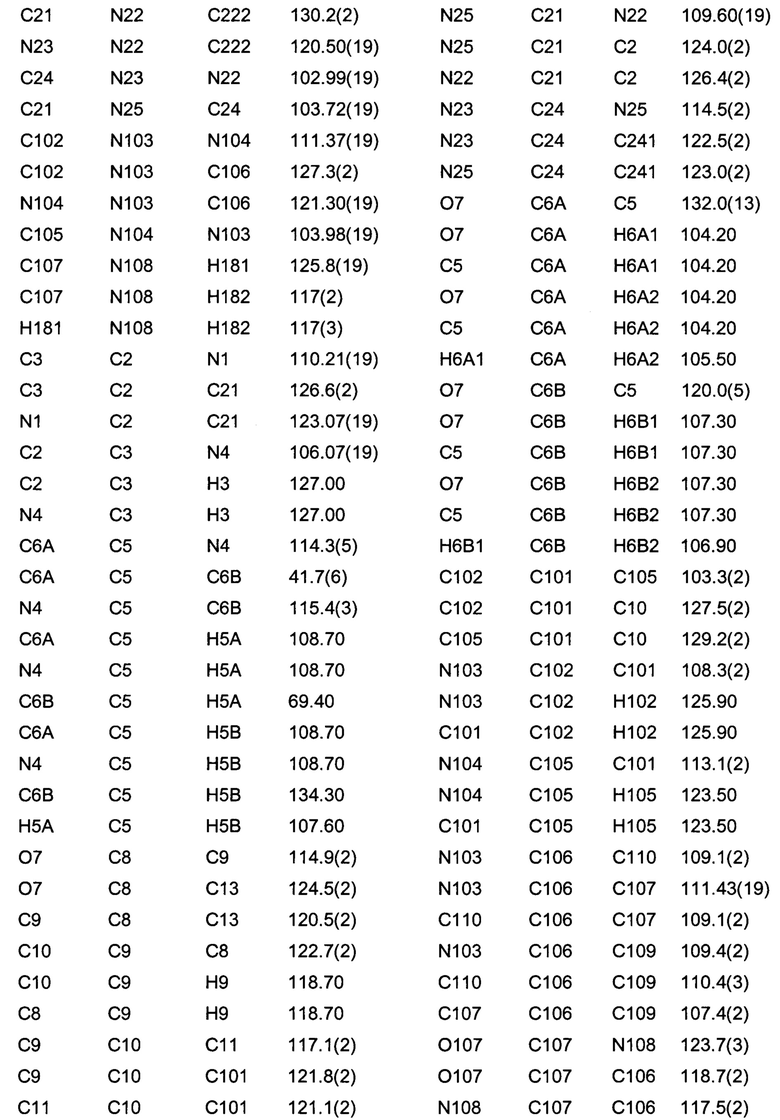
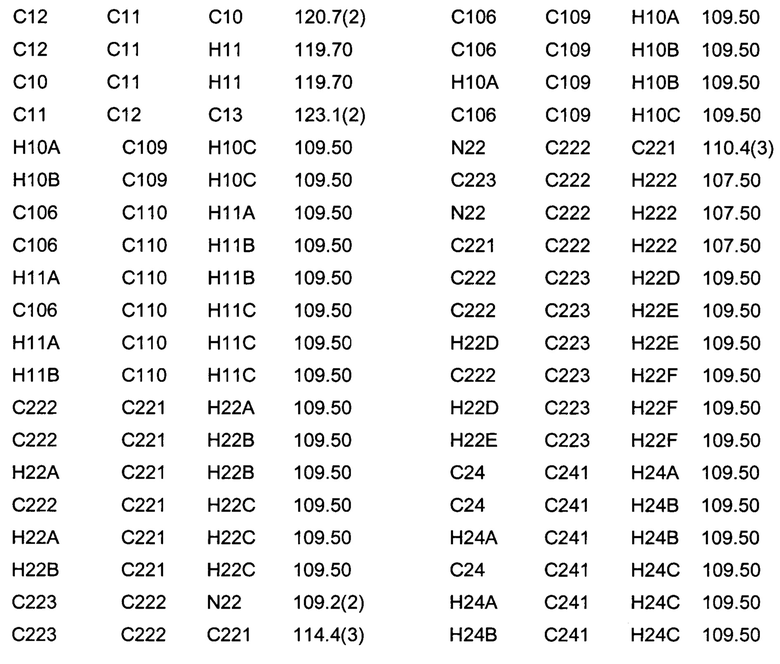
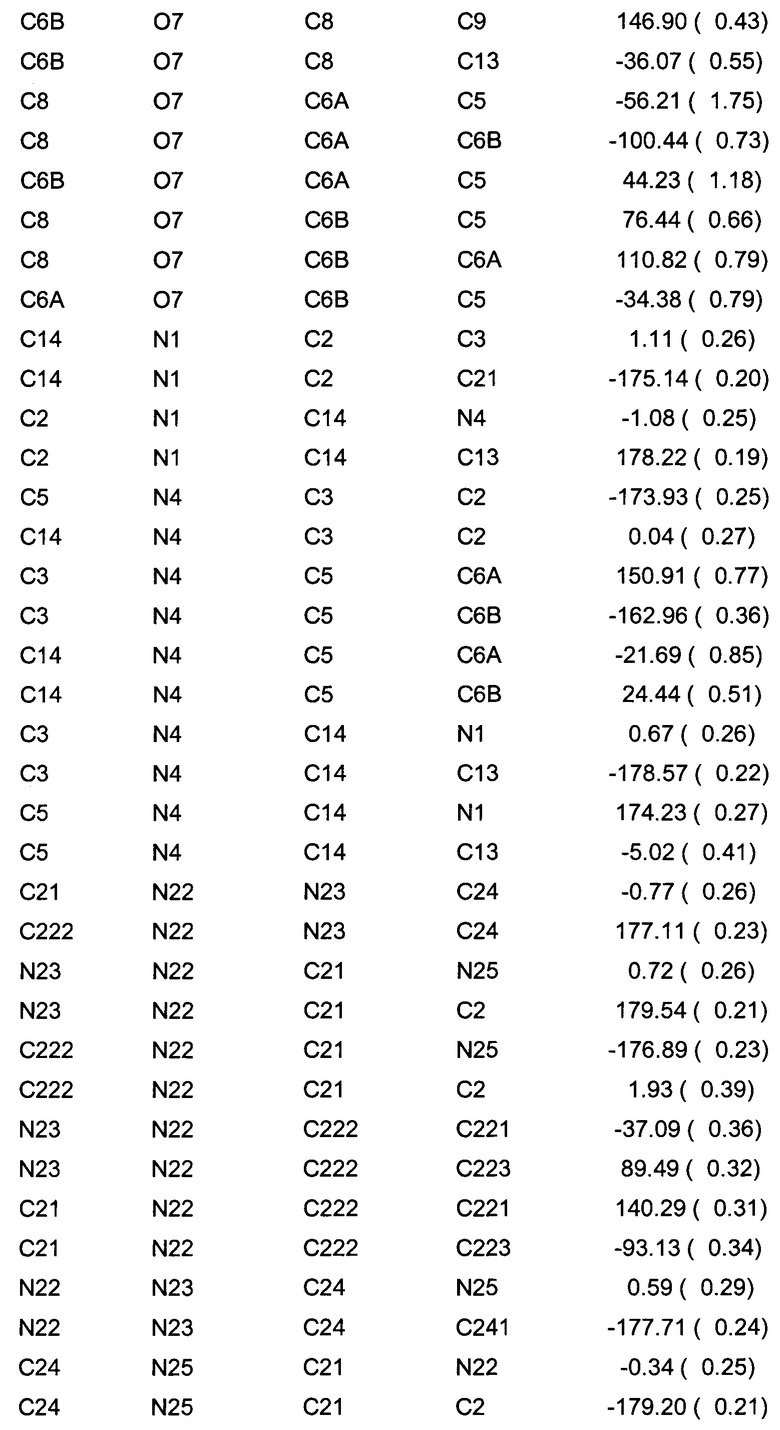
Позиционные параметры полиморфной формы В и их рассчитанные стандартные отклонения (Таблица 1), анизотропные температурные коэффициенты (Таблица 2), длины связей (Таблица 3), углы связей (Таблица 4), водородные связи и углы (Таблица 5) и торсионные углы (Таблица 6) показаны ниже.
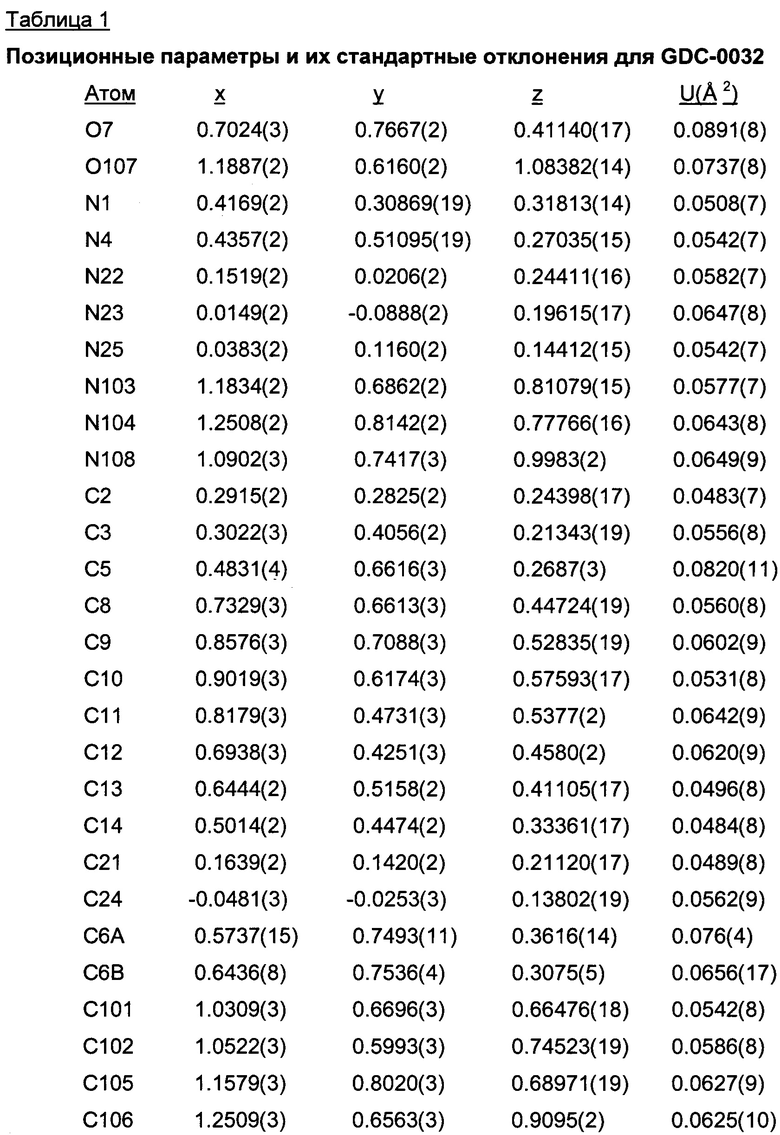
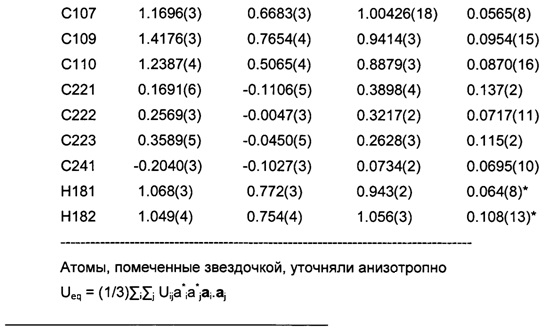
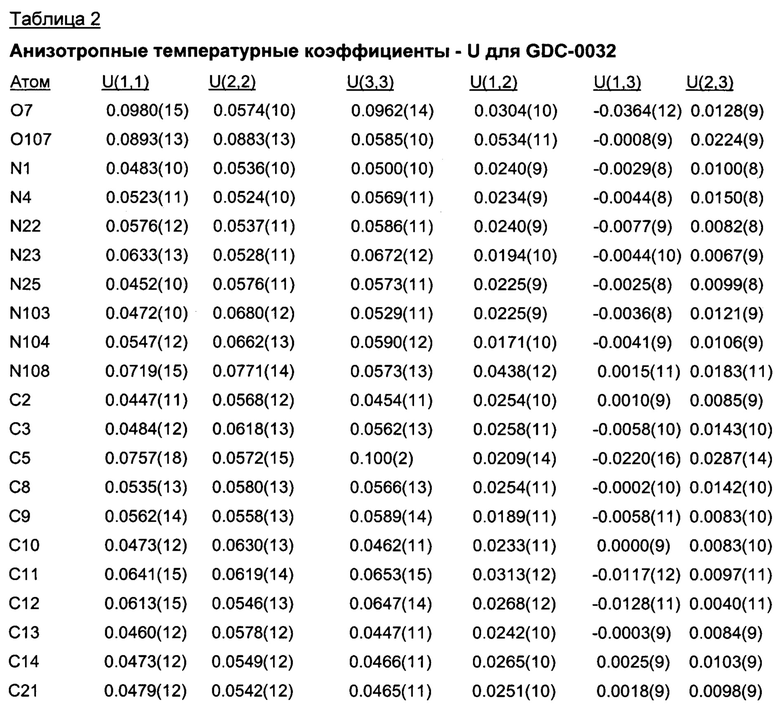
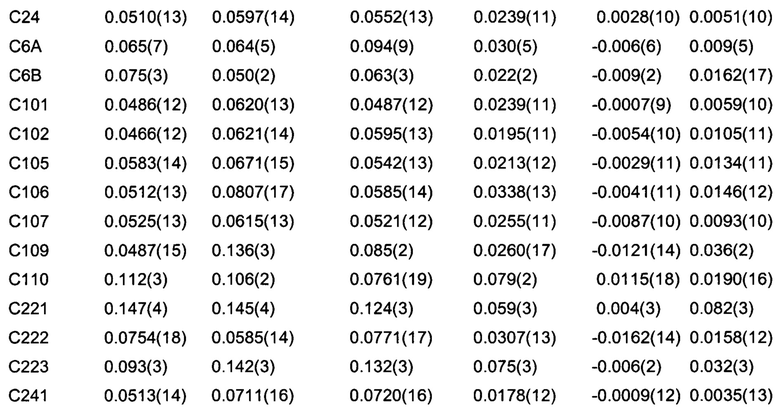
Формула анизотропного температурного коэффициента:
ехр[-2πh2a*2U(1,1)+k2b*2U(2,2)+I2c*2U(3,3)+2hka*b*U(1,2)+2hla*c*U(1,3)
+2klb*c*U(2,3)],
где a*, b* и с* параметры обратной кристаллической решетки.

Цифры в скобках - стандартные погрешности в цифрах самого младшего разряда.
Цифры в скобках - стандартные погрешности в цифрах самого младшего разряда.

Числа в скобках - стандартные погрешности в цифрах самого младшего разряда.

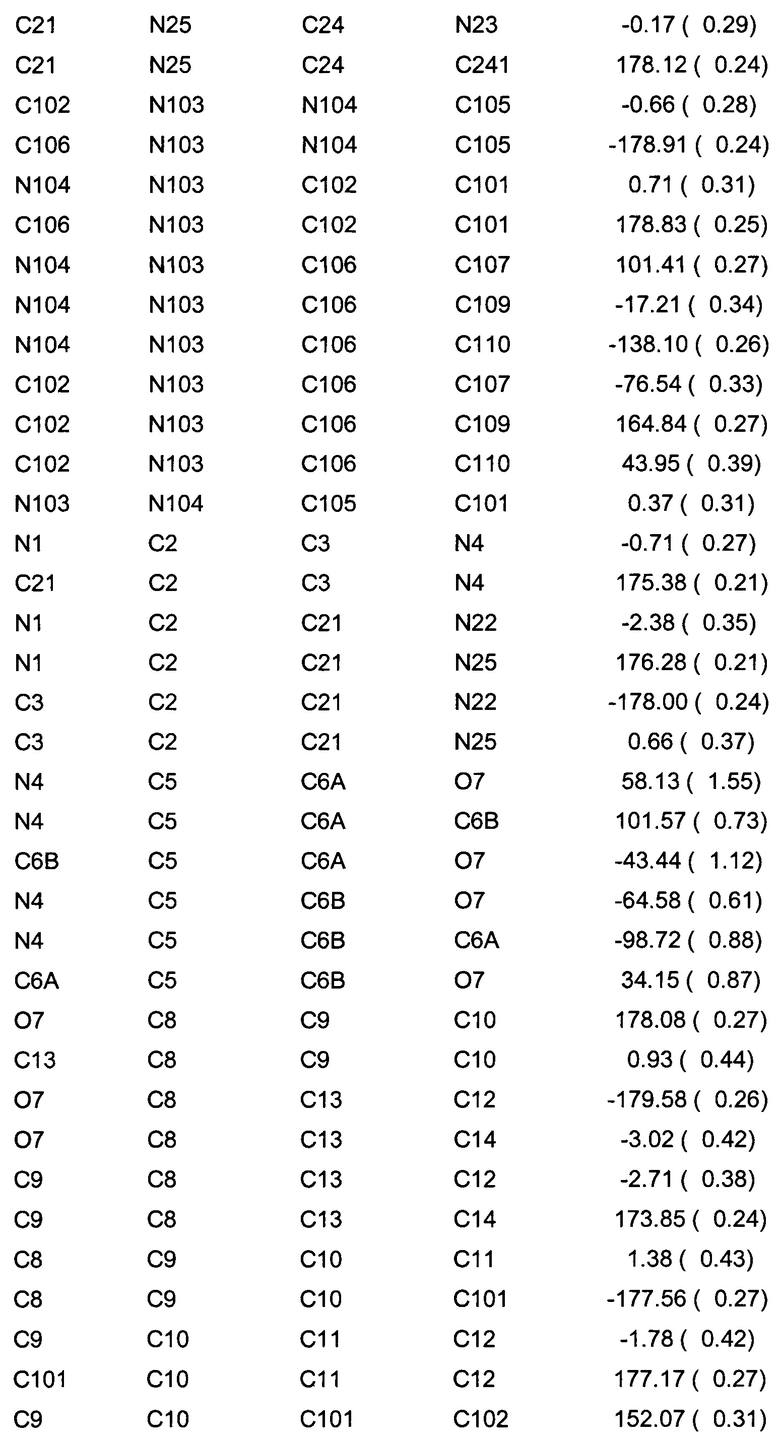
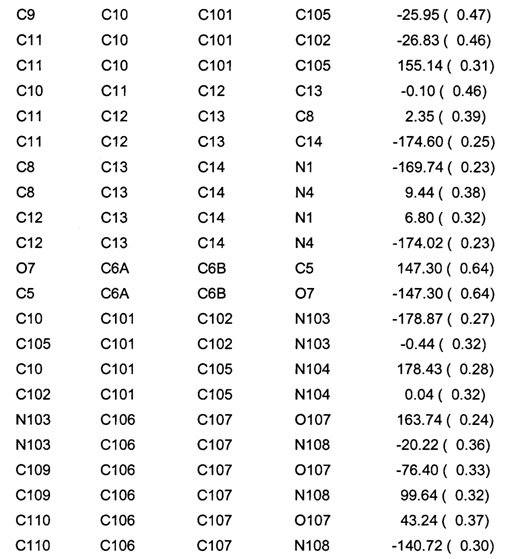
Цифры в скобках - стандартные погрешности в цифрах самого младшего разряда.
Скрининг физических форм приводит к характеризации различных кристаллических фаз, полиморфов, гидратов и сольватов GDC-0032. Растворимость GDC-0032 определяли в 23 растворителях/смесях растворителей при двух разных температурах (Пример 2). Несколько полиморфных форм GDC-0032 были охарактеризованы, включая, но не ограничиваясь следующими:
Форма А, метанолят
Форма А наблюдалась в экспериментах с присутствием метанола. Изначально она была охарактеризована посредством анализа твердого вещества в экспериментах, сделанных вручную. Как было определено при помощи PLM (микроскопия в поляризованном свете) и XRPD (Фигура 2), Форма А представляет собой кристаллическое вещество. Суспендирование Формы А в воде давало предполагаемый смешанный гидрат-метанолят. Термогравиметрический анализ (TGA) Формы А показал потерю веса около 6,5% при 125°C, что соответствует потере одного моля метанола (теоретическая потеря массы для моно-метанолята: 6,5%). DSC (дифферинциальная сканирующая калориметрия) показала, что эндотерма при 105-125°C (макс) соответствует потере веса в TGA, за которой следует эндотерма 257°C, которая атрибутируется как плавление и подтверждается высокотемпературной микроскопией. Термическая десольватация метанолята в азоте или вакууме приводит к образованию Формы В, хотя и с уменьшенными размерами частиц. Суспендирование Формы А в присутствии воды при 50°C дает Форму D, моно-гидрат. Суспендирование в воде при комнатной температуре дает после высушивания смесь Формы А и Формы D. Неясно, является ли влажный материал смесью форм или смешанным гидрат-метанолят сольватом. Кроме того, частично десольватированная Форма А содержит 0.6 моль метанола. Определение структуры монокристалла, кристаллизованного из метанола, подтвердило, что Форма А - это моно-метанолят. На Фигуре 1 представлено изображение ORTEP Формы A GDC-0032, монометанолят сольват.
Форма В, без растворителя
Форма В - это несольватированная форма, полученная из нескольких растворителей путем десольватации растворителей. Форма В также была идентифицирована, как Форма II. Согласно XRPD дифрактограмме (Фигура 10) и PLM (микроскопия в поляризованном свете), Форма В является кристаллической. Фигура 11 демонстрирует, что термогравиметрический анализ (TGA) Формы В показывает отсутствие потери веса или незначительную потерю до 200°C. Небольшая потеря массы, обычно менее 0.5%, наблюдаемая между 200 и 270°C, вероятно, связана с включением кристаллизующегося растворителя в кристаллы. DSC-анализ показал, что единичный эндотермический процесс, происходивший при 257°C, связан с плавлением. DVS данные для Формы В показали низкую кинетическую гигроскопичность с менее чем 0.3% прироста массы при 95% относительной влажности (RH). Небольшой гистерезис наблюдался в цикле десорбции. Материал был все еще Формой В после DVS эксперимента. Суспендирование Формы В в воде, как с Твином 80, так и без него, не приводило к превращению в гидрат. Форма В осталась неизменной после ускоренных тестов стабильности при 40°C и 75% RH. Фигура 12 показывает FT-IR спектр Формы В. Определение структуры монокристалла подтвердило, что Форма В не является сольватированной или гидратированной.
Форма В полиморфа была выбрана для разработки на основании критериев, включающих: склонность к образованию полиморфа, а не псевдо-полиморфа, кристалличность, термоаналитические данные, например, точка плавления, гигроскопичность, физическая стабильность, химическая стабильность в твердом состоянии, растворимость, механическое напряжение (прочность), свойства порошка, возможность крупномасштабного производства (технологичность) и аспекты формуляции.
Форма С, моно-изоамил алкоголят сольват
Форма С была получена только из изоамилового спирта и первоначально образовывалась при 5°C. Это наблюдалось только в течение работ по кристаллизации. Согласно данным XRPD дифрактограммы (Фигура 13) и PLM, форма является кристаллической. Термогравиметрический анализ (TGA) невысушенного, влажного образца показал общую потерю массы около 15%. Эта потеря веса происходила в две стадии: потеря 5.2% массы наблюдалась при температуре от обычной до 105°C и потеря следующих 9.8% массы наблюдалась при 105-125°C (температура кипения изоамилового спирта 130°C). Теоретическая потеря массы составила 16.1% для моно-сольвата и 8.7% для геми-сольвата. Кристаллическая структура Формы С была определена в Базеле. Форма D представляет собой моно-изоамил алкоголят. Десольвация Формы С в вакууме при 60°C дает несольватированную форму В. DSC данные показывают сильную четкую эндотерму при 109°C, за которой следует сильная эндотерма, предположительно соответствующая плавлению Формы В, при 257°C. Неизвестно, является ли эндотерма при 109°C инконгруентным плавлением сольвата и/или одновременным превращением в Форму В. Супензионные эксперименты по взаимопревращению с Формой В в чистом изоамиловом спирте показали, что Форма В преимущественно существует при температуре приблизительно 20°C или выше. Сольват, Форма С, преимущественно образуется при температуре около 15°C или ниже.
Форма D, моно-гидрат
Форма D представляет собой гидрат, полученный в водных растворителях с высокой активностью воды. Не наблюдалось ее образование из Формы В в присутствии чистой воды, воды, содержащей твин или при осторожном перетирании материала в присутствии воды как при обычной температуре, так и при 60°C. Согласно данным XRPD дифрактограммы (Фигура 14) и PLM, Форма D является кристаллической. Термические данные (TGA) показали потерю массы 3.7% (моногидрат теоретически 3.3%) до 100°C. Чтобы избежать риска потенциальной влажной грануляции, была проведена серия изотермических TGA анализов. Согласно TGA, полная дегидратация наблюдалась в течение 15 минут при 100°C и в течение 40 минут при 60°C. Данные DSC показали эндотерму при 94°C (начало), соответствующую потере массы в TGA. Очевидно перекрывающиеся плавление/рекристаллизация наблюдались при 137 и 150°C соответственно, за которыми следовало плавление, видимо Формы В, при 257°C. Дополнительных исследований для характеризации этих переходов не проводилось. Проведенное определение структуры монокристалла подтвердило, что Форма D представляет собой моно-гидрат.
Форма Е, моно-трифторэтанолят
Форма Е была получена из системы растворителей, содержащих 2,2,2-трифторэтанол и определена, как кристаллическая посредством XRPD. На Фигуре 15 данные XRPD дифрактограммы для Формы Е перекрываются с Формой В. Термические данные для Формы Е показали потерю массы 18.1% до температуры 160°C (теоретическая потеря массы для моно-трифторэтанолята: 17.8%). Потеря массы была определена при помощи TG-MS, как 2,2,2-трифторэтанол. DSC анализ показал присутствие широкой эндотермы при 122°C, связанной с десольватацией, а также четкой сильной эндотермы при 257°C. Предполагается, но не было продемонстрировано, что эндотерма при 257°C возникает из-за плавления Формы В. Трактовка структуры монокристалла подтвердила, что Форма Е представляет собой моно-трифторэтанолят.
Форма F, моно-ацетонитрил сольват
Форма F была получена из ацетонитрила и ацетонитрила с этанолом. Согласно данным XRPD, Форма F является кристаллической. На Фигуре 16 данные XRPD XRPD дифрактограммы для Формы F перекрываются с Формой В. Термогравиметрический анализ (TGA) показал потерю массы 7.7% до температуры 240°C (теоретическая потеря массы для моно-ацетонитрила сольвата: 8.2%). Потеря массы была определена при помощи TG-MS, как этанол и ацетонитрил. DSC анализ показал присутствие широкой эндотермы при 124°C, соответствующей потере массы в TGA, за которой следовала сильная эндотерма при 252°C. Предполагается, но не было продемонстрировано, что эндотерма при 252°C возникает из-за плавления Формы В. Трактовка структуры монокристалла подтвердила, что Форма F представляет собой моно-ацетонитрил сольват. Детали будут сообщены отдельно. Хотя на основании данных монокристалла Форма F обозначена как моно-ацетонитрил сольват, данные TG-MS показывают, что в данном случае может существовать изоморфный смешанный этанол-ацетонитрил сольват.
Форма G, моно-этанолят
Форма G была получена из этанола и определена посредством XRPD, как кристаллическая и в значительной степени изоморфная по отношению к Форме Е и Форме К (Фигура 17). Термогравиметрический анализ (TGA) показал потерю массы 9.6% при температуре до 160°C (теоретическая потеря массы для моно-этанолята: 9.1%). Потеря массы была определена при помощи TG-MS, как этанол. DSC анализ показал присутствие широкой эндотермы при 117°C, соответствующей потере этанола, за которой следовала сильная эндотерма при 256°C. В отдельных экспериментах было показано, что Форма G превращается в Форму В при нагревании при уменьшенном давлении. Форма G представляет собой моно-этанолят GDC-0032 и изоморфна трифторэтанол сольвату, форме Е, кристаллическая структура которой была определена.
Форма Н, моно-хлороформ сольват
Форма Н представляет собой моно-хлороформ сольват GDC-0032. Эта форма была идентифицирована только посредством трактовки структуры монокристалла. Других характеризующих ее данных получено не было. Молекулы хлороформа занимают каналы в структуре.
Форма I, моно-тетрагидрофуран сольват
Форма I была получена из тетрагидрофурана (THF) и определена посредством XRPD, как кристаллическая и в значительной степени изоморфная по отношению к Форме Е и Форме G (Фигура 18). Термогравиметрический анализ (TGA) показал потерю массы 15.0% при температуре до 180°C (теоретическая потеря массы для моно-THF сольвата: 13.5%). Потеря массы была определена при помощи TG-MS, как THF. SDTA анализ показал, что возможно присутствует комбинация эндотерма/экзотерма приблизительно при 130°C, соответствующая потере массы и конверсии, за которой следовала сильная эндотерма при 252°C (макс), предположительно соответствующая плавлению Формы В. Форма I представляет собой тетрагидрофуран сольват и в значительной степени изоморфна Форме Е и Форме G
Образец J
Материалы образца J были получены хододным испарением из ацетона (Образец J1), ацетона-воды (Образец J2) и ТГФ (Образец J3). Согласно XRPD дифрактограмме (Фигуры 19 и 20), образец J является кристаллическим. Образцы J2 и J3 - изоморфны. Вещества обозначали в соответствии с разупорядоченностью структуры образцов порошка, предполагая, что вещества представляют собой частично десольватированные структуры. К тому же, не совсем ясно, какая взаимосвязь существует между Формой I и Образцом J3. Термогравиметрический анализ (TGA) Образца J1 показал потерю массы 6.8% при температуре до 240°C (теоретическая потеря массы для геми-ацетон сольвата: 5.9%, потеря массы для моно-ацетон сольвата: 11.2%), причем основная потеря массы происходит при температуре ниже 120°C. Потеря массы была определена при помощи TG-MS, как ацетон. SDTA анализ показал наличие сильных эндотерм при при 252°C (макс) для обоих образцов. Базовая линия для Образца J2 в SDTA анализе была слишком шумной, чтобы сделать заключение о возможных формах превращений. Образец J3 был выделен из водного ТГФ. Характеризующие его данные не собирались. Возможно, существует изоморфный сольват (смешанный сольват) Образца J, содержащий ТГФ. Образец J может состоять из частичных сольватов ацетона и возможно, из частичного сольвата ТГФ.
Образец К
Образец К был выделен из 2,2,2-трифторэтанола. Согласно XRPD дифрактограммам (Фигуры 19 и 20), образец J является кристаллическим, но при этом кажется менее кристаллическим, чем другие формы (Фигура 21). Возможно, присутствует небольшое количество Формы Е. Более того, могут присутствовать аморфные или дефектные фазы. Поэтому данный образец не был обозначен, как форма. Термогравиметрический анализ (TGA) показал потерю массы 19.8% при температуре до 240°C, причем основная потеря массы происходит при температуре ниже 140°C. Основное вещество было определена при помощи TG-MS, как 2,2,2-трифторэтанол (теоретическая потеря массы для моно-трифторэтанолята: 17.8%). SDTA анализ показал присутствие широкой эндотермы приблизительно при 125°C, связанную с потерей веса, и сильную эндотерму при 252°C (макс), предположительно за счет плавления Формы В. Вероятно вешество состоит из моно-трифторэтанол сольвата.
Образец L
Образец L был выделен из изопропанола. Согласно XRPD дифрактограмме, этот материал в значительной степени изоморфен Формам Е, G и I.
Образец М
Образец М был выделен из суспензии 1,2-дихлорэтан(DCE)-нитрометан испарением метилэтилкетон-гептана, а также охлаждением с использованием 2-метилтетрагидрофуран(2-МеТНР)-гептана. Существует небольшие различия между образцами порошков, но неизвестно, свидетельствуют они о качестве данных или различия обусловлены различием в структуре веществ. Образец, полученный из 1-пропанол-DCE был похож на полученный из нитрометан-DCE. Образец М из 1,2-дихлорэтан(ОСЕ)-нитрометана анализировали при помощи TGA и DSC. Термогравиметрический анализ (TGA) показал потерю массы 10.7% при температуре 132°C. Природа растворителя не была определена (теоретически для геми-дихлорэтан сольвата: 9.7%, теоретически для нитрометан сольвата: 11.7%). DSC анализ показал присутствие широкой эндотермы при 115°C, связанной с потерей веса в TGA, и сильную эндотерму при 257°C (макс), вероятно связанную с плавлением Формы В. Материал, полученный из 1-пропанола, тажке анализировали при помощи DSC. DSC анализ показал присутствие широкой эндотермы при 93°C, за которой следовала сильная эндотерма при 254°C. Широкая изотерма вероятно связана с потерей веса, но TGA данные не собирали. Также были проведены отдельные эксперименты с использованием DCE и 2-Me-THF. DSC данные для суспензии DCE показали очень широкую эндотерма при 75°C (начало) с двумя возможными максимумами при 85°C и 104°C, за которыми следовала сильная эндотерма при 256°C. DSC анализ для 2-MeTHF показал сильную эндотерму при 254°C. Здесь может присутствовать слабое превращение в базовой линии, но возможные превращения не были отмечены из-за неопределенности, вызванной очень маленьким размером образца. Широкая эндотерма для DCE вероятно связвана с потерей веса, хотя термогравиметрический анализ ни для одного из образцов не проводился. Образец М может представалять серию легко десольватируемых сольватов.
Образец N
Образец N изучали в автоматическом режиме при испарении этанол-α,α,α-трифтортолуола (BTF) и 1,2-диметоксиэтангептана. Согласно дифрактограмме XRPD, вещества были кристаллическими. Данные диметоксиэтана, вероятно, представляют собой структуру порошка Формы В. Термогравиметрический анализ проводился для суспензии этанол-BTF. TGA показал небольшую потерю массы при температуре до 200°C. DSC анализ показал одну эндотерму при 258°C. Неясно, представляют ли термические данные данные из того же материала, что и данные для порошка, полученного испарением из этанол- BTF.
РЕНТГЕНОВСКИЙ АНАЛИЗ МОНОКРИСТАЛЛА И ПОРОШКОВАЯ ДИФРАКЦИЯ
Анализ ренгтгеновских порошковых дифрактограмм (XRPD) проводили с использованием коммерчески доступного аналитического программного обечпечения. XRPD используется для изучения различных кристаллических фаз, полиморфов, гидратов или сольватов, благодаря их уникальным дифрактограммам. Наряду с абциссой (горизонтальная ось) наносили так называемые 2-тета значения - серии углов между падающими и отраженными лучами. По ординате (вертикальная ось) указывали интенсивность рассеяных регнтгеновских лучей, зарегистрированных детектором. Набор пиков служил уникальной характеристикой (отпечатком) элементарной кристаллографической ячейки внутри кристалла. Элементарная кристаллографическая ячейка представляет собой самый маленький 3D-фрагмент на атомном уровне, который повторяется периодически в трех измерениях на протяжении всего кристалла. Все кристаллические вещества отличаются своими элементарными кристаллографическими ячейками (и поэтому - положениями пиков). Путем сравнения измеренных положений пиков с известными из базы данных может быть осуществлена однозначная идентификация кристаллического вещества. Для чистых веществ положения всех пиков являются функцией трех параметров а, b, с и трех углов альфа, бета, гамма (α, β, γ), определяющих элементарный параллелепипед, который составляет элементарную кристаллографическую ячейку.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ФОРМУЛЯЦИИ
Формулирование полиморфных форм GDC-0032, Формулы I, может быть осуществлено в соответствии со стандартной фармацевтической практикой для использования в терапевтической комбинации для терапевтического лечения (включая профилактическое лечение) гиперпролиферативных заболеваний у млекопитающих, включая людей. Настоящее изобретение относится к фармацевтической композиции, содержащей GDC-0032 вместе с одним или более фармацевтически приемлемых носителей, глидантов, разбавителей или наполнителей.
Подходящие носители, разбавители, глиданты и наполнители хорошо известны специалисту в данной области техники и включают материалы, такие как карбогидраты, воски, водорастворимые и/или набухающие полимеры, гидрофильные или гидрофобные материалы, желатин, масла, растворители, воду и подобные.
Формуляции могут быть приготовлены с использованием стандартных методик растворения и смешения. Соединение настоящего изобретения обычно формулируют в фармацевтические дозированные формы для обеспечения легко контролируемого дозирования лекарственного средства и облегчения соблюдения пациентом предписанного режима.
Фармацевтическая композиция (или формуляция) для применения может быть упакована различными способами, в зависимости от применяемого способа введения лекарственного средства. Обычно изделие для продажи включает контейнер, содержащий фармацевтическую формуляцию в подходящей форме. Подходящие контейнеры хорошо известны специалистам в данной области техники и включают материалы, такие как флаконы (пластиковые и стеклянные), саше, ампулы, пластиковые пакетики, металлические цилиндры и подобные. Контейнер может содержать элемент для защиты от неумелого обращения для предотвращения несанкционированного доступа к содержимому упаковки. Кроме того, на контейнере размещена этикетка, на которой описано содержимое контейнера. Этикетка может также содержать соответствующие предостережения.
Фармацевтические формуляции полиморфной формы GDC-0032 можно получить для различных путей и типов введения с фармацевтически приемлемыми разбавителями, носителями, наполнителями, глидантами или стабилизаторами (Remington's Pharmaceutical Sciences (1995) 18th edition, Mack Publ. Co., Easton, PA), в форме лиофилизированной композиции, измельченного порошка или водного раствора. Получение формуляций можно проводить смешением при температуре окружающей среды и подходящем pH, и при требуемой степени чистоты, с физиологически приемлемыми носителями, т.е. носителями, которые являются нетоксичными для реципиентов в используемых дозах и концентрациях. Значение pH формуляции в основном зависит от конкретного применения и концентрации соединения, и может варьировать от приблизительно 3 до приблизительно 8.
Фармацевтические формуляции предпочтительно являются стерильными. В частности, формуляции, применяемые для in vivo введения, дожны быть стерильными. Такая стерилизация легко осуществляется с использованием фильтрации через стерильные фильтрационные мембраны.
Фармацевтическая формуляция обычно может храниться в виде твердой композиции, таблетки, гранулы, капсулы, лиофилизированного состава или в виде водного раствора.
Фармацевтические формуляции по настоящему изобретению могут быть разделены на дозы и введены таким образом, т.е. в тех количествах, концентрациях, в том режиме, курсе, с той основой и тем путем введения, которые согласуются с надлежащей медицинской практикой. В этом контексте принимаемые к рассмотрению факторы включают конкретное подвергаемое лечению заболевание, клиническое состояние отдельного пациента, причину заболевания, место введения средства, способ введения, протокол введения и другие факторы, известные практикующим врачам.
Подходящие разбавители, носители, наполнители и стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях, и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фенол, бутиловый, этиловый или бензиловый спирт; алкилпарабены, такие как метилпарабен или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); полипептиды с малой молекулярной массой (приблизительно менее 10 остатков); полипептиды, белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как лактоза, сахароза, маннит, трегалозу или сорбит; образующие соли противоионы, такие как натрий; комплексы с металлами (например, Zn-белковые комплексы); и/или неионные сурфактанты, такие как TWEEN™, включая Твин 80, PLURONICS™ или полиэтиленгликоль (PEG), включая PEG400. Активные фармацевтические ингредиенты могут быть также заключены в микрокапсулы, полученные, например, методами коацервации или путем полимеризации на границе раздела фаз, например, в микрокапсулы из гидроксиметилцеллюлозы или желатина и в микрокапсулы из поли(метилметакрилата), соответственно, или находиться в коллоидных системах доставки лекарств (например, липосомы, микросферы из альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методики раскрыты в Remington's Pharmaceutical Sciences 18th edition, (1995) Mack Publ. Co., Easton, PA. Другие примеры лекарственных формуляций могут быть найдены в Liberman, Н. A. and Lachman, L, Eds., Pharmaceutical Dosage Forms, Marcel Decker, Vol 3, 2nd Ed., New York, NY.
Фармацевтически приемлемые глиданты могут быть выбраны из диоксида кремния, порошка целлюлозы, микрокристаллической целлюлозы, стеаратов металлов, алюмосиликата натрия, бензоата натрия, карбоната кальция, силиката кальция, кукурузного крахмала, карбоната магния, талька, не содержащего асбест, стеаровета С, крахмала, крахмала 1500, лаурилсульфата магния, оксида магния и их комбинаций. Фармацевтические формуляции подразумевают те подходящие пути введения, которые подробно описаны в настоящей заявке. Для удобства формуляции могут быть представлены в виде дозированной лекарственной формы и могут быть приготовлены одним из способов, хорошо известных в данной обрасти фармацевтики. Основные методики и формуляции могут быть найдены в Remington's Pharmaceutical Sciences 18th Ed. (1995) Mack Publishing Co., Easton, PA. Такие способы включают стадию соединения активного вещества с носителем, который состоит из одного или более вспомогательных ингредиентов. Обычно формуляции готовят путем равномерного и однородного соединения активного вещества с жидкими носителями или тонко измельченными твердыми носителями, или и теми и другими, и затем, если необходимо, формованием продукта.
Фармацевтические композиции могут быть представлены в форме стерильных инъекционных препаратов, таких как стерильные инъекционные водные или масляные суспензии. Эти суспензии могут быть получены известными методами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильный препарат для инъекций может также представлять собой раствор или суспензию в нетоксичном разбавителе или растворителе, пригодном для парентерального введения, такой как раствор в 1,3-бутандиоле, или готовиться из лиофилизированного порошка. Подходящие носители и разбавители, например, включают: воду, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, удобно в качестве растворителя или суспендирующей среды использовать обычные стерильные масла. Для этой цели можно использовать любое мягкое масло, включая синтетические моно- или диглицериды. Для получения инъекционных препаратов могут быть использованы также жирные кислоты (такие как олеиновые).
ВВЕДЕНИЕ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ
Фармацевтические композиции по изобретению могут вводиться любым способом, подходящим для состояния, которое лечится. Подходящие способы введения включают оральный, парентеральный (включая подкожный, внутримышечный, внутривенный, внутриартериальный, ингаляционный, интрадермальный, интратекальный, эпидуральный и инфузионный способы), трансдермальный, ректальный, назальный, местный (включая буккальный и сублингвальный), вагинальный, внутрибрюшинный, внутрилегочный и интраназальный. Местное введение также может включать применение трансдермального введения с помощью трансдермальных пластырей или приборов для ионофореза. Формуляция лекарственных средств обсуждается в Remington's Pharmaceutical Sciences, 18th Ed., (1995) Mack Publishing Co., Easton, PA. Другие примеры лекарственных форм можно найти у Liberman, Н.A. and Lachman, L, Eds., Pharmaceutical Dosage Forms, Marcel Decker, Vol 3, 2nd Ed., New York, NY. Для местной иммуносупрессорной терапии соединения можно вводить в область поражения, включая перфузию или иное контактирование трансплантата с супрессором перед трансплантацией. Специалистам в данной области будет понятно, что предпочтительный путь может варьировать в зависимости, например, от состояния реципиента. В том случае, когда соединение вводят перорально, то его можно формулировать в виде пилюли, капсулы, таблетки и т.д. с фармацевтически приемлемым носителем, глидантом или наполнителем. В том случае, когда соединение вводят парентерально, то его можно формулировать с фармацевтически приемлемым носителем или растворителем для парентерального введения и в разовой лекарственной инъекционной форме, как подробно описано ниже.
Доза полиморфной формы GDC-0032 для лечения людей может находиться в пределах примерно от 1 мг до примерно 100 мг, например, составлять от примерно 3 мг до примерно 20 мг соединения. Дозу можно вводить один раз в день (QD), дважды в день (BID) или чаще в зависимости от фармакокинетических (PK) и фармакодинамических (PD) свойств препарата, включая всасывание, распределение, метаболизм и выделение определенного соединения. Кроме того, на дозу и схему введения могут оказывать влияние токсические факторы. Для введения перорально пилюлю, капсулу или таблетку можно принимать дважды в день, ежедневно или реже, например, еженедельно или раз две или три недели в течение определенного периода времени. Схему можно повторять в течение ряда терапевтических курсов.
СПОСОБЫ ЛЕЧЕНИЯ
Полиморфы GDC-0032 могут отличаться по биодоступности in vivo. Так, полиморфы, раскрытые здесь, могут применяться для получения лекарственных средств с различными характеристиками для лечения гиперпролиферативных заболеваний, таких как рак.
Можно создавать лекарственные средства на основе GDC-0032, которые будут обладать существенно различающимися уровнями адсорбции со значениями Cmax от приблизительно 0.0 нг/мл до 5.0 мкг/мл. Это позволяет получать лекарственные композиции на основе GDC-0032, которые будут незначительно или существенно адсорбироваться субъектами, подвергающимися лечению. Одним из вариантов изобретения является модулирование терапевтического действия GDC-0032 посредством выбора подходящей полиморфной формы или смеси таких форм для лечения пациента. Например, полиморфная форма GDC-0032, обладающая наибольшей биодоступностью, может быть выбрана из раскрытых в настоящем описании, поскольку она представляется более безопасной для субъекта, подвергающегося лечению.
Способы по изобретению можно использовать для лечения гиперпролиферативных заболеваний, таких как рак у млекопитающих (например, людей) полиморфными формами GDC-0032. Например, способы полезны для диагностики, мониторинга и лечения множественной миеломы, лимфомы, лейкемий, рака предстательной железы, рака молочной железы, гепатоклеточной карциномы, рака легких, рака поджелудочной железы и/или колоректального рака у млекопитающих (например, человека).
Способы по изобретению можно применять для ингибирования аномального клеточного роста с использованием полиморфной формы GDC-0032.
Терапевтические комбинации: (1) полиморфной формы GDC-0032 и (2) химиотерапевтического агента можно использовать для лечения заболеваний, состояний и/или нарушений, включая, но не ограничиваясь теми, которые характеризуются через активацию PI3 киназного пути. Соответственно, другой аспект настощего изобретния включает способы лечения заболеваний или состояний, которые могут подвергаться лечению путем ингибирования липидных киназ, включая PI3-киназу. В одном из вариантов способ лечения солидных опухолей или злокачественных заболеваний включает введение терапевтической комбинации, как объединенной формуляции или путем раздельного введения, млекопитающему, где терапевтическая комбинация содержит терапевтически эффективное количество GDC-0032 и терапевтически эффективное количество одного или более терапевтических агентов, выбранных из 5-фторурацила, доцетакселя, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитакселя, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтансина, трастузумаба и летрозола. Терапевтические комбинации: (1) полиморфной формы GDC-0032 и (2) химиотерапевтического агента можно использовать для лечения гиперпролиферативных заболеваний или состояний, включая злокачественные заболевания, опухоли, рак и неопластические ткани, наряду с предраковыми и не-неопластическими или незлокачественными гиперпролиферативными нарушениями. В одном из вариантов пациента человека лечат с помощью терапевической комбинации и фармацевтически приемлемого носителя, адьюванта или наполнителя, где GDC-0032 или его метаболит присутствует в упомянутой терапевтической комбинации в количестве, достаточном для детектируемого ингибирования активности PI3-киназы.
Злокачественные заболевания включают не-Ходжкинскую лимфому, большую диффузную гемопоэтическую лимфому, фолликулярную лимфому, мантийноклеточную лимфому, хроническую лимфоцитарную лейкемию, множественную миелому, острый миелоидный лейкоз (AML) и хронический миелоидный лейкоз (MCL).
Другой аспект настоящего изобретения относится к фармацевтической композиции или терапевтической комбинации для применения в лечении заболеваний или состояний, описанных здесь для млекопитающих, например, человека, страдающего от такого заболевания или состояния. Также предлагается применение фармацевтической композиции для изготовления лекарственного средства для лечения заболеваний или состояний, описанных здесь для теплокроных животных, таких как млекопитающие, например, человек, страдающий от такого заболевания.
Еще один аспект настоящего изобретения относится к фармацевтической композиции, описанной здесь, для применения в лечении гиперпролиферативных заболеваний, выбранных из множественной миеломы, лимфомы, лейкемий, рака предстательной железы, рака молочной железы, гепатоклеточной карциномы, рака легких, рака поджелудочной железы и колоректального рака.
Еще один аспект настоящего изобретения относится к применению фармацевтической композиции, описанной здесь, для лечения гиперпролиферативного заболевания, выбранного из множественной миеломы, лимфомы, лейкемий, рака предстательной железы, рака молочной железы, гепатоклеточной карциномы, рака легких, рака поджелудочной железы и колоректального рака.
Следующий аспект настоящего изобретения относится к применению кристаллического полиморфа, описанного здесь, в качестве терапевтически активного вещества.
Следующий аспект настоящего изобретения относится к кристаллическому полиморфу, описанному здесь, для применения в лечении гиперпролиферативного заболевания, выбранного из множественной миеломы, лимфомы, лейкемий, рака предстательной железы, рака молочной железы, гепатоклеточной карциномы, рака легких, рака поджелудочной железы и колоректального рака.
Следующий аспект настоящего изобретения относится к кристаллическому полиморфу, описанному здесь, для применения в производстве лекарственного средства для лечения гиперпролиферативного заболевания, выбранного из множественной миеломы, лимфомы, лейкемий, рака предстательной железы, рака молочной железы, гепатоклеточной карциномы, рака легких, рака поджелудочной железы и колоректального рака.
Следующий аспект настоящего изобретения относится к применению кристаллического полиморфа, описанного здесь, для лечения гиперпролиферативного заболевания, выбранного из множественной миеломы, лимфомы, лейкемий, рака предстательной железы, рака молочной железы, гепатоклеточной карциномы, рака легких, рака поджелудочной железы и колоректального рака.
Еще один аспект настоящего изобретения относится к изобретению, как оно описано выше.
КОМБИНАЦИОННАЯ ТЕРАПИЯ
Полиморфные формы GDC-0032 могут применяться в комбинации с определенными химиотерапевтическими агентами для лечения гиперпролиферативного заболевания, включая солидные опухоли, или злокачественные заболевания наряду с предраковыми и не-неопластическими или незлокачественными гиперпролиферативными нарушениями. В определенных воплощениях полиморфную форму GDC-0032 комбинируют с химиотерапевтическим агентом в единой формуляции, такой как таблетка, пилюля, капсула или раствор для одновременного введения комбинации. В других вариантах полиморфную форму GDC-0032 и химиотерапевтический агент вводят согласно режиму дозирования или курсу терапии в раздельных формуляциях, таких как отдельные таблетки, пилюли, капсулы или растворы для поледовательного введения полиморфной формы GDC-0032 и химиотерапевтического агента, выбранного из 5-фторурацила, доцетакселя, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитакселя, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтансина, трастузумаба и летрозола. Химиотерапевтический агент обладает противогиперпролиферативными свойствами или применим для лечения гиперпролиферативного нарушения. Комбинация GDC-0032 и химиотерапевтического агента может обладать синергетическими свойствами. Химиотерапевтический агент в фармацевической комбинации, формуляции или режиме дозирования предпочтительно обладает дополнительной активностью к активности полиморфной формы GDC-0032, и таким образом они не оказывают негативного влияния друг на друга. Такие соединения терапевтических комбинаций могут вводиться в количествах, которые эффективны для нужного назначения. В одном из вариантов фармацевтическая формуляция по данному изобретению содержит GDC-0032 и химиотерапевтический агент, как описано в настоящем документе. В другом варианте терапевтическая комбинация вводится с использованием режима дозирования, где терапевтически эффективное количество полимофной формы GDC-0032 вводится в интервале от двух раз в день до одного раза в три недели (q3wk), а терапевтически эффективное количество химиотерапевтического агента вводится отдельно, чередованием, в интервале от двух раз в день до одного раза в три недели.
Терапевтические комбинации по изобретению включают полиморфную форму GDC-0032 и химиотерапевтический агент, выбранный из 5-фторурацила, доцетакселя, эрибулина, гемцитабина, GDC-0973, GDC-0623, паклитакселя, тамоксифена, фулвестранта, дексаметазона, пертузумаба, трастузумаба эмтансина, трастузумаба и летрозола, для раздельного, одновременного или последовательного применения в лечении гиперпролиферативного нарушения.
Комбинационную терапию можно осуществлять в режиме одновременного или последовательного введения. При последовательном введении комбинацию можно вводить двумя или более введениями. Комбинированное введение включает совместное введение, с применением раздельных формуляций или единую фармацевтическую формуляцию, и последовательное введение в любом порядке, при котором предпочтительно имеется период времени, когда оба (или все) активные агенты одновременно проявляют биологическую активность.
Подходящие дозы любого из вышеупомянутых совместно вводимых агентов являются дозами, применяемыми в настоящее время, и они могут быть снижены, благодаря комбинированному действию (синергии) нового обнаруженного агента и других химиотерапевтических агентов или видов лечения, так что повышается терапевтический индекс или снижается токсичность или другие побочные эффекты или последствия.
В конкретном варианте осуществления противораковой терапии терапевтическую комбинацию можно совмещать с хирургической и радиотерапией, как дополнительными видами терапии. Таким образом, комбинационная терапия согласно настоящему изобретению включает введение полиморфной формы GDC-0032 и применение одного или более других воздействий или способов лечения рака. Количества полиморфной формы GDC-0032 и химиотерапевтического агента (агентов) и соответствующие режимы введения выбирают с целью достижения желаемого комбинированного терапевтического эффекта.
ГОТОВЫЕ ИЗДЕЛИЯ
В другом варианте осуществления настоящее изобретение относится к изделию, или «набору», содержащему полиморфную форму GDC-0032, применимую для лечения заболеваний и нарушений, описанных выше. В одном варианте осуществления набор включает контейнер, содержащий полиморфную форму GDC-0032. Набор может дополнительно содержать этикетку или листовку-вкладыш внутри упаковки или ассоциированную с контейнером. Термин «листовка-вкладыш» используют для указания инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов и содержащих информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предостережениях, касающихся применения таких терапевтических продуктов. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, блистерную упаковку и так далее. Контейнер может быть изготовлен из различных материалов, таких как стекло или пластик. Контейнер может содержать GDC-0032 или содержащую его формуляцию, которая эффективна для лечения состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет или флакон с раствором для внутривенного введения, снабженный ограничителем, поддающимся прокалыванию иглой для подкожных инъекций). По крайней мере, один активный агент в композиции представляет собой полиморфную форму GDC-0032. На этикетке или вкладыше в упаковку указано, что композиция используется для лечения выбранного состояния, такого как рак. В одном варианте осуществления этикетка или листок-вкладыш показывают, что композицию, содержащую соединение формулы I, можно применять для лечения заболевания, появившегося в результате аномального роста клеток. Этикетка или листовка-вкладыш могут также указывать, что композицию можно применять для лечения других заболеваний. В качестве альтернативы, или в дополнение, изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Он может дополнительно содержать другие вещества, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Набор может дополнительно содержать указания по введению полиморфной формы GDC-0032 и, при наличии, вторую фармацевтическую фомуляцию. Например, если набор содержит первую композицию, содержащую GDC-0032, и вторую фармацевтическую формуляцию, набор может дополнительно содержать указания по одновременному, последовательному или раздельному введению первой и второй фармацевтических композиций нуждающемуся в лечении пациенту.
В другом варианте осуществления наборы подходят для доставки содержащих полиморфную форму GDC-0032 твердых пероральных форм, таких как таблетки или капсулы. Такие наборы предпочтительно включают в себя некоторое количество разовых доз. Такие наборы могут включать в себя карточку с дозировками, ориентированную в порядке их предполагаемого употребления. Примером такого набора является «блистерная упаковка». Блистерные упаковки хорошо известны в индустрии производства упаковок и широко используются для упаковки дозированных лекарственных форм. При желании, может быть предоставлена памятка, например, в виде чисел, букв или других пометок, или вложен календарь, на котором отражены дни в протоколе приема лекарств, в которые должны вводиться дозы лекарства.
В соответствии с одним вариантом осуществления набор может включать в себя (а) первый контейнер с содержащейся в нем полиморфной формой GDC-0032; и необязательно (b) второй контейнер с содержащимся в нем второй фармацевтической формуляцией, где вторая фармацевтическая формуляция содержит второе соединение с анти-гиперпролиферативной активностью. В качестве альтернативы, или в дополнение, набор может дополнительно включать в себя третий контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Он может дополнительно содержать другие вещества, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Когда набор содержит полиморфную форму GDC-0032 и второй терапевтический агент, например, химиотерапевтический агент, набор может включать контейнер для раздельного содержания композиций, такой, как разделенный на части флакон или пакет с делениями, сделанный из фольги, однако отдельные композиции могут также содержаться в одной, неразделенной упаковке. Обычно набор содержит указания по введению отдельных компонентов. Набор является особенно предпочтительным, когда отдельные компоненты предпочтительно вводить в различных лекарственных формах (например, пероральной и парентеральной), когда они вводятся при различных интервалах дозирования или когда лечащий врач желает провести титрование отдельных компонентов комбинации.
ПРИМЕРЫ
ПРИМЕР 1 Выделение и физико-химические характеристики GDC-0032
GDC-0032 получали в соответствии с патентом US 8242104 и заявкой "Способ получения бензоксазепиновых соединений", US №. 61/779619, подана 13 марта 2013, которые включены сюда посредством ссылки. Суспензию 1,15 кг, 2,5 моль (2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазе-пин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамида (GDC-0032, Формула I) в МеОН (6 л, 5 объемов) помещали в стеклянный реактор объемом 50 л. Дополнительный МеОН (24 л, 21 объем) добавляли к смеси, которую затем нагревали до 65°C. Получали гомогенную смесь. Si-тиол (Silicycle, Inc., 0.23 кг, 20% масс) добавляли к раствору через дополнительный порт и перемешивали смесь в течение 3 часов. Затем ее фильтровали теплой через Аврора-фильтр (температура 60°C, тонкий фильтр), и сразу же переносили во второй реактор объемом 50 л с уменьшенным давлением. Затем раствор нагревали до внутренней температуры (IT) 65°C. Гомогенный раствор охлаждали до 54°C, и добавляли в реактор с уменьшенным давлением кристаллы-затравку GDC-0032 (12 г, 1% масс) в МеОН (50 мл). Далее смесь охлаждали до 20°C в течение более чем 16 часов. Твердый осадок отфильтровывали через Аврора-фильтр и сушили при 80°C в течение 72 часов с получением 921 г (выход 80%) GDC-0032 в виде метанолят сольвата (форма А по данным XRPD дифрактограммы), который переносили в предварительно взвешенную заряженную емкость.
В изоляторе осадок суспендировали в изопропилацетате (IPAc) (8 л, 7 об.) и переносили в чистый 10 л реактор. Смесь перемешивали в течение 1 часа при температуре 60°C (IT). Затем осадок фильтровли через систему Аврора и сушили при 80°C (оболочка) в течение 96 часов. Образец GDC-0032 извлекали и анализировали посредством газовой хроматографии (GC) (IPAc=1%). Стремясь достичь более эффективной сушки, в изоляторе API (активную фармацевтическую субстанцию) помещали в два стеклянных подноса и герметизировали сушильную емкость до сушки в вакуумном сушильном шкафу при 100°C в течение 16 часов. Газовая хроматография (GC) (IPC: Q12690V2) показала, что все еще сохраняется 1% растворителя. В результате получали 760 г (скорректированный выход 68%, 68 мас. %, чистота по данным жидкостной хроматографии (LC) 99.9%) твердого белого вещества (форма В по данным XRPD рентгенограммы).
Влажный GDC-0032 (340.7 г) помещали в 2-х литровую полиэтиленовую (HDPE) бутыль и суспендировали в 0,8 л. изоамилового спирта (IAA). Суспензию переносили в реактор объемом 20 л и разбавляли 6,7 л в колбе с круглым дном (всего 22 об.). Белую кашицу нагревали до получения раствора (внутреннюю температуру доводили до 118°C и затем охлаждали до 109°C). Раствор фильтровали через тонкий фильтр (0,2 мкМ фильтр). Колбу сверху снабжали мешалкой и фильтрат превращали в кашицу в изоамиловом спирте (344 мл, 21 об.). Смесь нагревали до 95°C (внутренняя температура) пока осадок не растворялся. Готовили суспензию древесного угля (10 мас. %, 0.16 г) и силикагеля Silicycle thiol (10 мас., 0.16 г) в изоамиловом спирте (1 об., 16 мл) и смесь перемешивали при 90-95°C в течение 1 часа, а затем фильтровали (через Celite®). Прозрачный раствор янтарного цвета охлаждали до 73°C (температурный диапазон для затравки = 70±5°C) и добавляли затравку GDC-0032 (10 мас. %, 0.16 г). Нагревание прекращали, и смесь оставляли на ночь при перемешивании (200 оборотов/мин), позволяя ей остыть до комнатной температуры. Через 17 часов белое твердое вещество отфильтровывали, начиная с медленной гравитационной фильтрации, и затем применяли вакуум. Осадок высушивали отсасыванием жидкости в течение 20 мин при перемешивании, пока не был получен легко сыпучий порошок. Вес влажного вещества до сушки в печи = 16 г. Вещество сушили в печи при 100°C в течение 24 часов и затем отбирали образцы для тестирования. Сушку продолжали при 100°C в течение следующих 24 часов. 1Н ЯМР (ДМСО d6) δ 8.38 (т), 8.01 (с), 7.87 (с), 7.44, 7.46 (д), 7.36 (с), 7.18 (шир. с), 6.81 (шир. с), 5.82 (м), 3.99 (с), 2.50 (с), 2.26 (с), 1.75 (с), 1.48, 1.46 (д).
GDC-0032 API представляет собой белое или почти белое твердое вещество. Оно является кристаллическим, что подтверждается четкими пиками его XRPD дифрактограммы, и имеет температуру плавления 258°C. На сегодняшний день идентифицированы различные физические формы свободного основания GDC-0032, включая безводную форму (Форма В), гидрат и различные сольваты. Форма В имеет температуру плавления в диапазоне от 256°C to 258°C. Форму В стабильно получали в API-процессе. Форма В не проявляет никаких изменений, будучи оставлена при высокой влажности в течение по меньшей мере 6 месяцев. Кроме того, в экспериментах по изучению стабильности для API не наблюдалось никаких физических превращений указанной формы. Поэтому Форма В была выбрана в качестве наиболее подходящей кристаллической формы для дальнейшего исследования. Воспроизводимость и стабильность кристаллической формы отслеживали в течение API синтеза и стабильности. GDC-0032 не гигроскопично, впитывает менее 0,2% по весу при 95% относительной влажности (RH) в динамическом эксперименте по поглощению влаги. GDC-0032 представляет собой слабое основание с величиной pKa порядка 3.19 и log Р порядка 2.5, как определяли при помощи потенциометрического титрования.
ПРИМЕР 2 Оценка растворимости
Растворимость GDC-0032 API оценивали как функцию pH и различных буферов и наполнителей для формуляции

ПРИМЕР 3 Формуляции и таблетирование GDC-0032
Очищенный (2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазе-пин-9-ил)-1Н-пиразол-1-ил)-2-метилпропан-амид I (GDC-0032) подвергали сухой грануляции и с использованием роллерного уплотнителя (соответствующий способ описан у Не et al. (2007) Jour, of Pharm. Sci., 96(5): 1342-1355), формовали в виде таблеток, содержащих в качестве эксципиентов лактозу, микрокристаллическую целлюлозу (AVICEL® РН 01, FMC BioPolymer, 50 мкМ частицы), кроскармеллозу натрия (Ac-Di-Sol®, FMC BioPolymer) и стеарат магния.
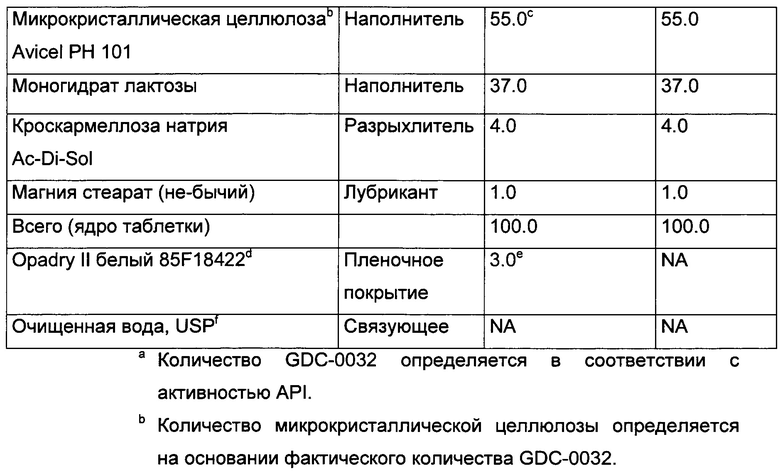
ПРИМЕР 4 Кристаллизация GDC-0032
Растворимость GDC-0032 была определена в 23 растворителях/смесях растворителей при двух различных температурах: абсолютированный этанол, метанол, изопропанол, ацетон, этилацетат, изопропил ацетат, тетрагидрофуран, 2-бутанон, метанол/вода (50/50), 2,2,2-трифторэтанол (ТРЕ),2-бутанон, TFE/этилацетат (50/50), TFE/ацетон (50/50), TFE/вода (50/50), ацетонитрил, ацетонитрил/вода (50/50), ацетон/вода (50/50), трет-бутил метиловый эфир, н-гептан, этанол/этил ацетат (50/50), этанол/ацетон (50/50), метанол/вода (90/10), этанол/ацетонитрил (50/50). GDC-0032 был растворим во всех, за исключением этилацетата, изопропилацетата, тетрагидрофурана, трет-бутил метилового эфира и н-гептана.
Для каждого эксперимента приблизительно 5-10 мг материала взвешивали во флаконе объемом 40 мл. В случае 2,2,2-трифторэтанола (TFE), использовали около 40 мг из-за высокой растворимости GDC-0032 в этом растворителе. В каждом флаконе к твердому веществу добавляли растворитель порциями по 20 мкл до растворения или до достижения минимальной концентрации 0,2 мг/мл. Растворение оценивали визуально при двух температурах: комнатной температуре (RT) и более высокой температуре (Tmax=50 или 70°C, выбранной таким образом, чтобы точка кипения растворителя была выше, чем Tmax). Растворимость суспензий определяли при помощи ВЭЖХ.
ПРИМЕР 5 Кристаллизационный скрининг
Был проведен кристаллизационный скрининг высокой разрешающей способности. GDC-0032 растворяли в N,N-диметилформамиде при 65°C. Раствор в DMF раскапывали в 96-луночный планшет. Расворитель выпаривали и заменяли 16 различными чистыми растворителями и 80 смесями растворителей. Смеси растворителей готовили, добавляя градиент воды, этанола, 1,2-дихлорэтана или гептана. Типичные соотношения составляли 800:0, 640:160, 480:320, 320:480, 160:640, 0:800. Один из планшетов выпаривали в атмосфере азота при комнатной температуре (выпаривание). Циклопентил метиловый эфир добавляли в качестве антирастворителя в лунки второго планшета (осаждение). Оба планшета нагревали до 65°C, затем один планшет охлаждали до 10°C в течение более чем 12 часов (охлажденный планшет), а второй выдерживали при температуре 65°C в течение 1 недели (планшет с суспензией при 65). Растворители декантировали и получившиеся осадки анализировали поляризационной микроскопией (PLM). Осадки, которые оказались кристаллическими по данным PLM, анализировали порошковой рентгеновской дифракцей (XRPD). Материалы, которые имели различные порошовые дифрактограммы, далее анализировали при помощи Рамановской спектроскопии.
Монокристалл: растворы для монокристаллов были получены для Формы А, Формы В, Формы С, Формы Е и Формы К.
Термоциклирование GDC-0032 в органических растворителях: Приблизительно 60 мг исходного материала взвешивали во флаконе объемом 8 мл. Четыре суспензии были приготовлены в TFE/этилацетате (50/50), метаноле, этаноле и ацетоне. Проводили термоциклирование суспензий при температуре между 60°C и 20°C или между 50°C и 20°C. Скорости охлаждения и нагревания составляли 10°C/час и время выдержки при каждой температуре состаляло 30 минут. Цикл повторяли около пяти раз. В конце термоциклирования отслеживали наличие достаточного количества твердого вещества и выпаривали растворитель. Твердые частицы анализировали при помощи XRPD и цифрового воспроизведения изображений.
Эксперименты с использованием затравки: Эксперименты с 10 и 20 мас. % затравочных кристаллов проводили на 8 мл шкале с использованием 60 мг исходного материала. Готовили две суспензии в TFE/этилацетате (50/50) и в метаноле и нагревали до 60°C. Спустя час после момента установления равновесия суспензии фильтровали при 60°C. Далее к фильтрату при 60°C добавляли затравочные кристаллы и охлаждали смесь до 5°C со скоростью охлаждения 5°C/час и выдерживали при этой температуре в течение 10 часов. Твердые частицы отделяли и сушили, маточный раствор испаряли. Все твердые частицы анализировали при помощи XRPD и цифрового воспроизведения изображений.
Холодное испарение с горячей фильтрацией. Готовили две суспензии в этаноле и ацетоне при 50°C и через час после установления момента равновесия суспензии фильтровали при той же температуре. Затем насыщенные растворы охлаждали до 5°C со скоростью охлаждения 5°C/час и выдерживали при этой температуре в течение ночи. После выдерживания никаких тведых осадков не наблюдалось, и растворители выпаривали. Полученные твердые частицы анализировали при помощи XRPD и цифрового воспроизведения изображений.
Растворимость GDC-0032 в метаноле при высокой температуре: Определяли растворимость GDC-0032 в метаноле при высокой температуре при 45°C и 55°C. Из приблизительно 15 мг исходного материала и 500 мл метанола готовили две суспензии. Затем суспензии помещали в две печи, при 45°C и 55°C. Спустя 24 часа после установления равновесия обе суспензии визуально оценивали. В обоих случаях растворение было неполным. Влажные твердые осадки отделяли от маточного раствора и сушили для проведения XRPD и оцифровки изображений. Маточный раствор выпаривали, а твердые частицы анализировали при помощи XRPD и цифрового воспроизведения изображений.
Термоциклирование GDC-0032 в органических растворителях с затравкой проводиди в шести растворителях, растворы в которых готовили при 60°C (максимальная температура для ацетона составляла 50°C). Спустя несколько часов после момента установления равновесия суспензии фильтровали при Tmax. После фильтрации несколько мг исходного материала добавляли к каждому насыщенному раствору и затем термоциклировали от Tmax до 20°C со скоростью охлаждения 5°C/час и обратно до Tmax, со скоростью нагревания 10°C/час, при этом время выдержки при Tmax и 20°C составляло 15 мин. Перемешивание в данных экспериментах не использовалось. Циклы повторяли от 13 до 17 раз. После проведения термоциклирования растворы выдерживали при 5°C в течение 3 дней. По окончанию экспериментов оказалось, что осажденных твердых частиц недостаточно для анализа, и было решено медленно выпарить растворители. Полученные твердые частицы анализировали при помощи XRPD, цифрового воспроизведения изображений, анализатора размера частиц Malvern и с использованием микроскопии.
Проводили диффузию паров в растворы GDC-0032, содержащие затравку, с использованием 3х растворителей и 3х антирастворителей. Для этих экспериментов при комнатной температуре готовили три насыщенных раствора в трех растворителях. Спустя несколько часов после момента установления равновесия суспензии фильтровали при комнатной температуре в 8 мл флаконы. Несколько мг исходного материла (затравка) добавляли к этим насыщенным растворам. Затем 8 мл флаконы с затравкой помещали в 40 мл флакон, содержащий 3 мл антирастворителя. Растворы подвергали воздействию паров растворителя в течение двух недель. По окончанию экспериментов оказалось, что осажденных твердых частиц недостаточно для анализа, и было решено медленно выпарить растворители. Полученные твердые частицы анализировали при помощи XRPD и цифрового воспроизведения изображений.
Приготовление Формы А:
К 189 мг GDC-0032 добавляли 2 мл метанола. Супензию нагревали до 65°C в течение 30 минут и затем охлаждали до 3°C и оставляли перемешиваться на ночь. Осадок собирали фильтрацией и выделяли еще во влажном состоянии с растворителем.
Приготовление Формы А:
Суспензию, содержащую 585,4 мг соединения (лот 978822, Форма В) и 10 мл метанола перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 6 дней. Продукт осаждали центрифугированием и удаляли маточный раствор пипеткой. Кристаллы анализировали во влажном состоянии.
Приготовление монокристалла Формы В:
Кристаллы, подходящие для определения структуры монокристалла GDC-0032, были получены растворением GDC-0032 в этилацетате с последующей диффузией паров с использованием пентана.
Приготовление Формы С:
GDC-0032 (103.8 мг) был частично растворен в горячем изоамиловом спирте (5 мл) при 90°C. Суспензию медленно охлаждали до 5°C и суспендировали при 5°C в течение 2 дней. Твердое вещество собирали фильтрацией и анализировали во влажном состоянии с растворителем в герметичном рентгеновском кристаллодержателе.
Приготовление Формы С:
В закрытом стеклянном флаконе растворяли 4,98 г соединения (лот BS1302SA01, Форма В) в 166,7 г изоамилового спирта при 95°C. Прозрачный раствор быстро охлаждали при перемешивании путем погружения флакона в водяную баню со льдом. Полученную суспензию оставляли перемешиваться на 9 дней при 5°C. Кристалы отделяли фильтрацией и сушили в условиях окружающей среды в течение 4 дней.
Приготовление Формы D:
GDC-0032 (98,7 мг) суспендировали в водном растворе н-бутанола (1:1 об.: об., 1 мл) в течение 3 дней. Осадок собирали микроцентрифугированием через фильтр в герметичный контейнер. XRPD анализ образца проводили пока он находился во влажном состоянии с растворителем.
Приготовление Формы D:
В закрытом стеклянном флаконе растворяли 388,7 мг соединения (лот 978822, Форма В) в 7,4 мл смеси н-пропанол/вода (10%-об./об. воды) при 75°C. Прозрачный раствор линейно охлаждали при 22°C в течение 8 часов. После отбора кристаллов для рентгеновского анализа монокристалла остаток суспензии перемешивали до тех пор, пока кристаллы не отделяли фильтрацией и высушивали при 40°C/400 мбар в течение 16 часов.
Приготовление Формы Е:
В закрытом стеклянном флаконе растворяли 521,1 мг соединения (лот 978822, Форма В) в 1,5 мл трифторэтанола при 75°C. После контролируемого охлаждения прозрачный раствор хранили при 10°C. Монокристаллы получали спустя 8 дней. После отбора кристаллов для рентгеновского анализа монокристалла остаток суспензии перемешивали при температуре окружающей среды в течение ночи до того, как флакон открывали, чтобы растворитель полностью испарился в условиях окружающей среды. Кристаллы анализировали без последующей обработки.
Приготовление Формы Е:
Суспензию GDC-0032 (59,6 мг) в 2,2,2-трифторэтаноле (1 мл) и этилацетате (1 мл) нагревали до 60°C и выдерживали в течение одного часа. Суспензию фильтровали еще горячей, добавляли Форму В GDC-0032 (6 мг), охлаждали суспензию до 5°C со скоростью 5°C/час и выдерживали в течение 10 часов. Твердые частицы собирали и анализировали с использованием XRPD.
Приготовление Формы F:
Насыщенный раствор GDC-0032 в ацетонитриле готовили при 60°C путем суспендирования Формы В GDC-0032 (30 мг) в ацетонитриле (7 мл) при 60°C. Спустя несколько часов после установления равновесия суспензию фильтровали при Tmax. После фильтрации несколько мг GDC-0032 добавляли в каждый насыщенный раствор и затем термоциклировали от Tmax до 20°C со скоростью охлаждения 5°C/час, и обратно, до Tmax, со скоростью нагревания 10°C/час, при этом время выдержки при Tmax и 20°C составляло 15 мин. Перемешивание в данных экспериментах не использовалось. Циклы повторяли 13 раз. После проведения термоциклирования растворы выдерживали при 5°C в течение 3 дней. По окончанию экспериментов оказалось, что осажденных твердых частиц недостаточно для анализа, и было решено медленно выпарить растворители. Полученные твердые частицы анализировали при помощи XRPD, цифрового воспроизведения изображений, анализатора размера частиц Malvern и с использованием микроскопии.
Приготовление Формы F:
Суспензию, содержащую 400,2 мг соединения (лот 978822, Форма В) и 7,2 мл ацетонитрила перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 24 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 2 дней.
Приготовление Формы G:
Форму В GDC-0032 (11,9 мг) растворяли в абсолютном этаноле (5,5 мл) и выпаривали под вакуумом при комнатной температуре.
Приготовление Формы Н:
При комнатной темпереатуре растворяли GDC-0032 (20,5 мг) в хлороформе (600 мкл). Раствор оставляли выстаиваться на 6 месяцев, пока растворитель медленно не испарялся, давая кристалл, пригодный для структурного анализа.
Приготовление Формы Н:
Суспензию, содержащую 385,8 мг соединения (лот 978822, Форма В) и 6,9 мл хлороформа, перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 24 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Маточный раствор оставляли испаряться при условиях окружающей среды. Кристаллы анализировали без дальнейшей обработки.
Приготовление Формы J:
Суспензию, содержащую 457,8 мг соединения (лот 978822, Форма В) и 8,2 мл диоксана, перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 24 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Маточный раствор оставляли испаряться при условиях окружающей среды. Кристаллы высушивали при 50°C/5 мбар в течение 15 минут.
Приготовление Формы К:
В закрытом стеклянном флаконе растворяли 302,7 мг соединения (лот 978822, Форма В) в 5,4 мл уксусной кислоты при температуре окружающей среды. К прозрачному раствору добавляли 4,2 мл н-гептана. Полученную суспензию оставляли перемешиваться на ночь при температуре окружающей среды. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы анализировали во влажном состоянии.
Приготовление Формы L:
В закрытом стеклянном флаконе растворяли 199,7 мг соединения (лот 978822, Форма В) в 12,0 мл изопропанола при 90°C. Прозрачный раствор линейно охлаждали до 22°C в течение 8 часов. После отбора кристаллов для рентгеновского анализа монокристалла, остаток суспензии перемешивали при температуре окружающей среды в течение ночи. Кристаллы анализировали без последующей обработки.
Приготовление Формы М:
Суспензию, содержащую 470,5 мг соединения (лот 978822, Форма В) и 8,5 мл дихлорметана, перемешивали в закрытом стеклянном флаконе при 5°C в течение 15 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы оставляли сушиться на ночь при условиях окружающей среды.
Приготовление Формы N:
Суспензию, содержащую 389,5 мг соединения (лот 978822, Форма В) и 7,0 мл нитроэтана, перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 24 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 2 дней.
Приготовление Формы О:
Суспензию, содержащую 480,7 мг соединения (лот 978822, Форма В) и 8,7 мл тетрахлорида углерода, перемешивали в закрытом стеклянном флаконе при 60°C в течение 14 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 17 часов.
Приготовление Формы Р:
Суспензию, содержащую 469,8 мг соединения (лот 978822, Форма В) и 8,5 мл пропионитрила, перемешивали в закрытом стеклянном флаконе при 60°C в течение 14 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 17 часов.
Приготовление Формы Q:
Суспензию, содержащую 488,6 мг соединения (лот 978822, Форма В) и 8,8 мл смеси 2-метоксиэтанол/вода 85/15 (об./об.), перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 24 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 15 минут.
Приготовление Формы R:
Суспензию, содержащую 389,5 мг соединения (лот 978822, Форма В) и 7,0 мл нитроэтана, перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 24 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 2 дней.
Приготовление Формы S:
Суспензию, содержащую 387.2 мг соединения (лот 978822, Форма В) и 7,0 мл 1.2-дихлорэтана, перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 24 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при условиях окружающей среды.
Приготовление Формы Т:
Суспензию, содержащую 397,5 мг соединения (лот 978822, Форма В) и 7,2 мл н-пропанола, перемешивали в закрытом стеклянном флаконе при 5°C в течение 6 недель. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 40°C/400 мбар в течение 5 часов в присутствии н-пропанола.
Приготовление Формы U:
В закрытом стеклянном флаконе растворяли 235,6 мг соединения (лот 978822, Форма В) в 9,4 мл изобутанола при 85°C. Прозрачный раствор линейно охлаждали до 40°C в течение 8 часов. После отбора кристаллов для рентгеновского анализа монокристалла, остаток суспензии оставляли при температуре окружающей среды на 4 дня. Растворитель послностью выпаривали при условиях окружающей среды, и высушивали кристаллы при 50°C/5 мбар в течение 27 часов.
Приготовление Формы V:
Суспензию, содержащую 498,1 мг соединения (лот 978822, Форма В) и 9,0 мл 2-метилтетрагидрофурана, перемешивали в закрытом стеклянном флаконе при 20°C в течение 6 недель. Кристаллы собирали фильтрованием на центрифуге и анализировали во влажном состоянии.
Приготовление истинной полиморфной Формы W:
Суспензию, содержащую 330 мг соединения (лот 978822, Форма В) и 6,0 мл смеси диоксан/вода 1/1 (об./об.), перемешивали в закрытом стеклянном флаконе при температуре от 20 до 25°C в течение 5 недель. Кристаллы собирали фильтрованием на центрифуге и высушивали при 70°C/5 мбар в течение 2 дней.
Приготовление Формы X гидрата:
Суспензию, содержащую 498,9 мг соединения (лот 978822, Форма В) и 10 мл метанола, перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 4 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 2 дней.
Приготовление Формы Y: полугидрата X:
Суспензию, содержащую 498,9 мг соединения (лот 978822, Форма В) и 10 мл метанола, перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 4 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при 50°C/5 мбар в течение 2 дней и затем оставляли при температуре окружающей среды над водной суспензией LiCl (относительная влажность (RH) - 11%) на 20 дней. В ходе анализа влажность поддерживали на уровне 11% - RH.
Приготовление Формы Z:
Суспензию, содержащую 488.1 мг соединения (лот 978822, Форма В) и 8,8 мл диизопропилкетона, перемешивали в закрытом стеклянном флаконе при 5°C в течение 15 дней. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при условиях окружающей среды.
Приготовление Формы АА диоксана полусольват:
Суспензию, содержащую 426,0 мг соединения (лот 978822, Форма В) и 7,7 мл смеси диоксан/вода 1/1 (об./об.), перемешивали в закрытом стеклянном флаконе при температуре окружающей среды в течение 5 недель. Продукт осаждали центрифугированием, и удаляли пипеткой маточный раствор. Кристаллы высушивали при температуре окружающей среды / 500 мбар в течение 30 минут.
Приготовление истинной полиморфной Формы АВ:
В закрытом стеклянном флаконе растворяли 4.98 мг соединения (лот BS1302SA01, Форма В) в 166.7 г изоамилового спирта при 95°C. При перемешивании прозрачный раствор быстро охлаждали путем погружения в водяную баню со льдом. Полученную суспензию оставляли перемешиваться при 5°C на 9 дней. Кристаллы отделяли фильтрованием и высушивали при 50°C/5 мбар в течение 2 дней.
Приготовление Формы АС:
В закрытом стеклянном флаконе растворяли 200,8 мг соединения (лот 978822, Форма В) в 7,7 мл тетрагидрофурана при 75°C. Прозрачный раствор линейно охлаждали до 20°C в течение 10 часов. После отбора кристаллов для рентгеновского анализа монокристалла, остаток суспензии оставляли при температуре окружающей среды на ночь. Кристаллы анализировали без дальнейшей обработки.
ПРИМЕР 6 Аналитические методы с использованием порошковой рентгеновской дифракции (XRPD)
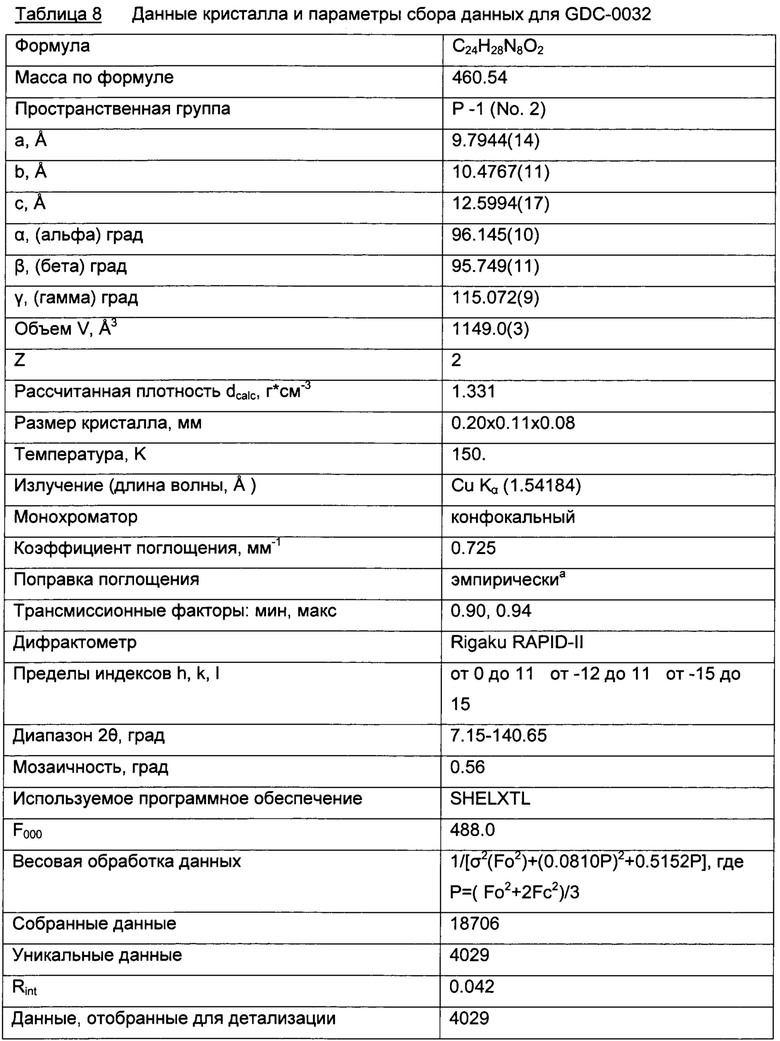
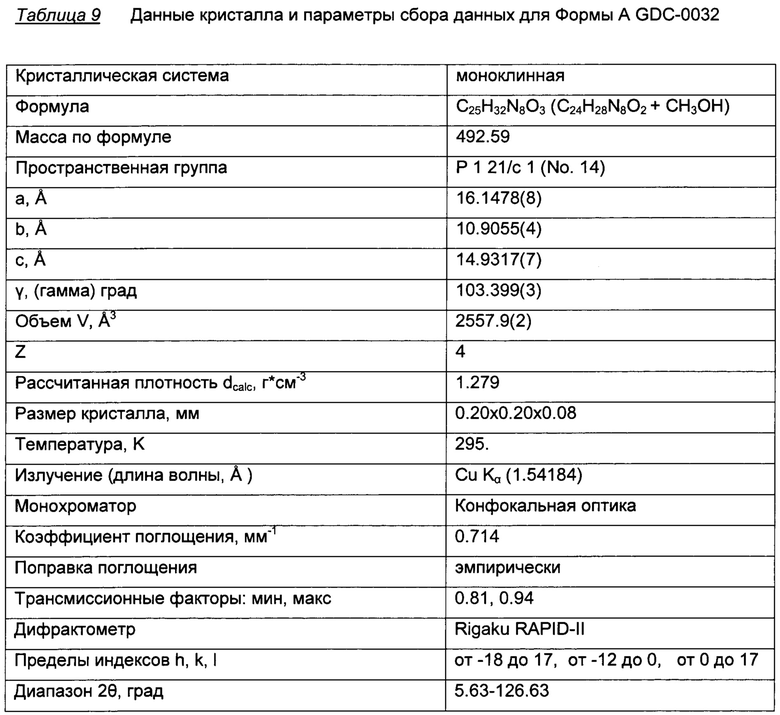
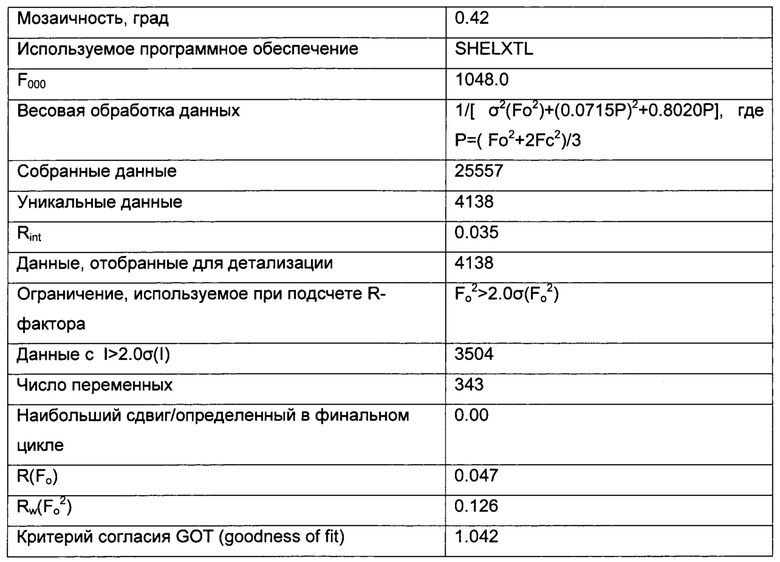

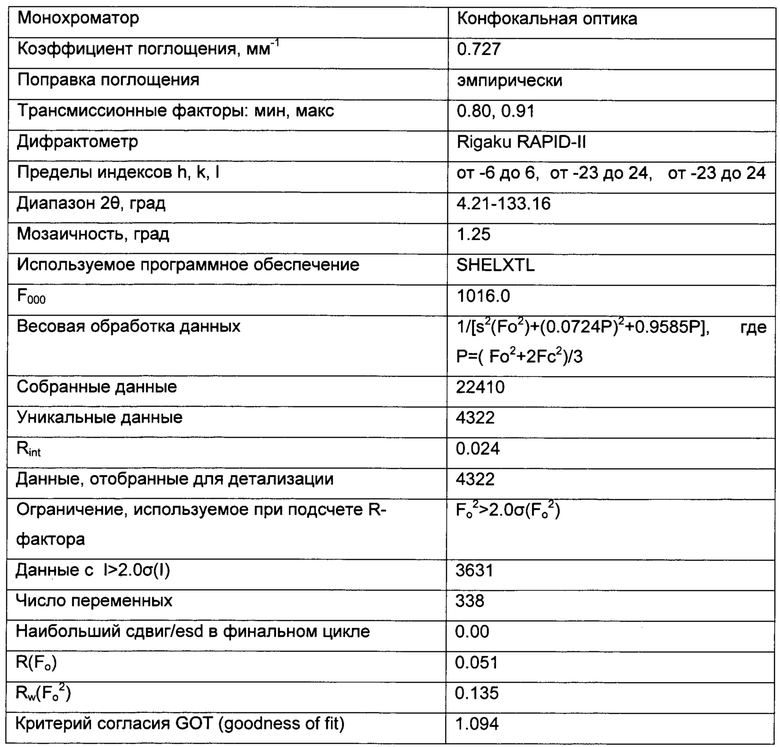

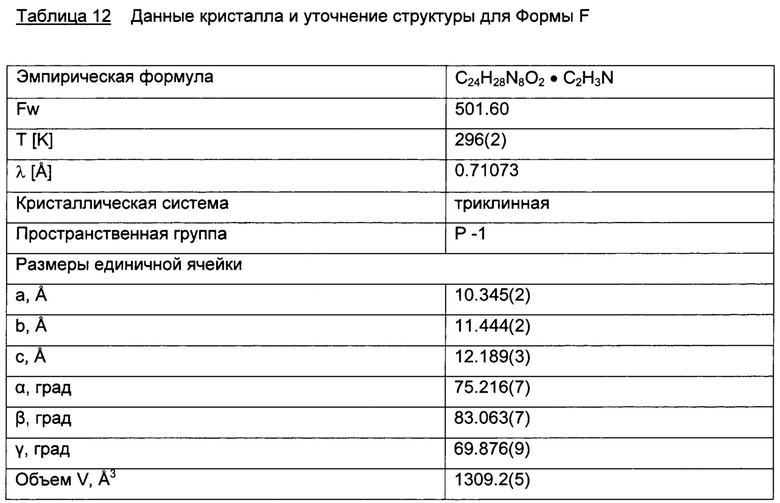
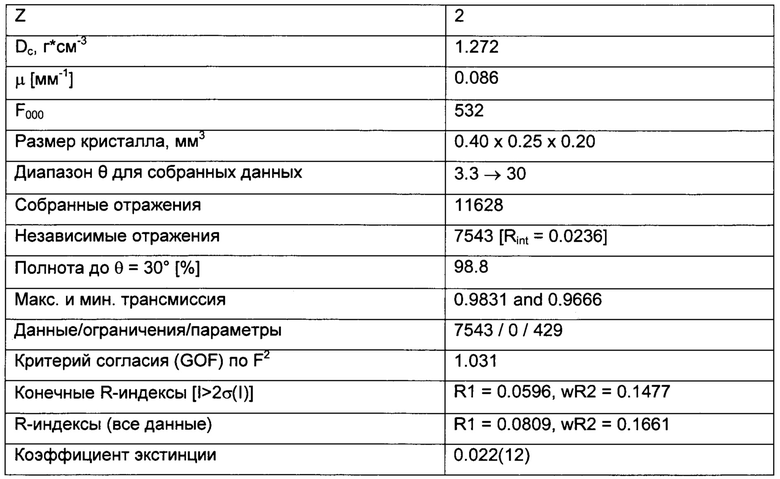
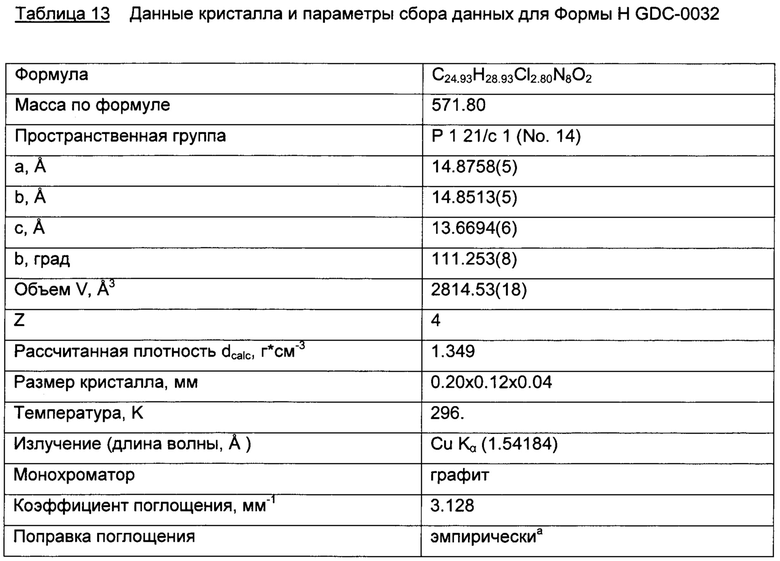
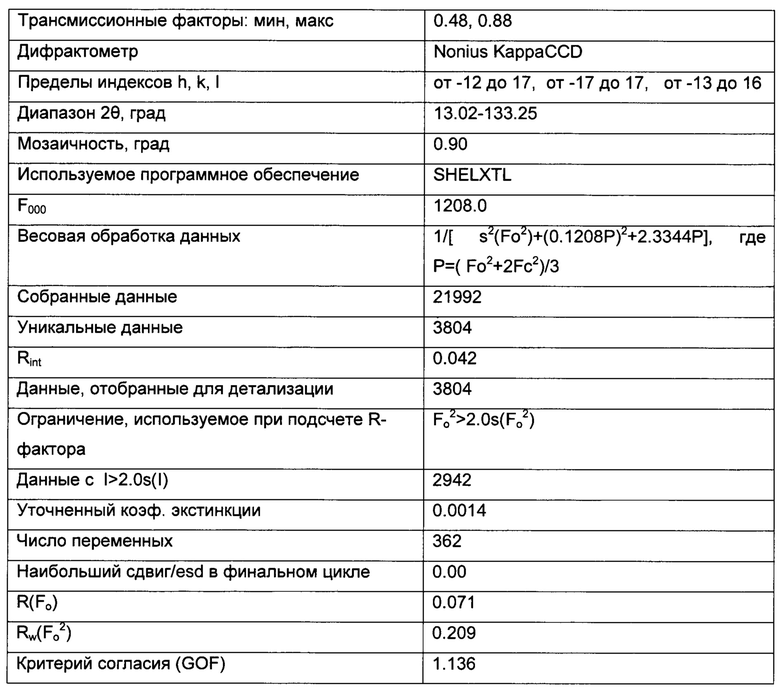
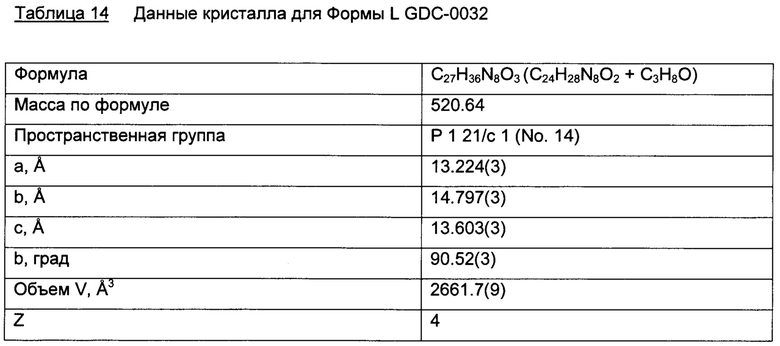
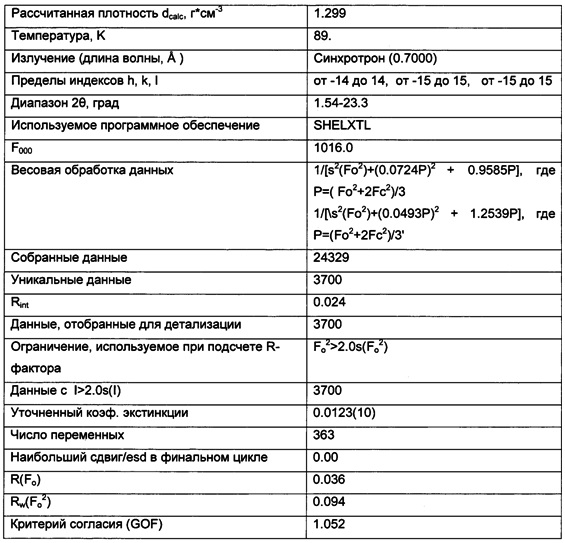
ПРИМЕР 7 Порошковая рентгеновская дифракция (PXRD)
Порошковые рентгенограммы образцов были получены с использованием порошкового дифрактометра Rigaku MiniFlex II®. Источник излучения работал при напряжении 30 кВ и силе тока 15 мА. Каждый образец помещали в углубление алюминиевого держателя, прикрывая предметным стеклом, чтобы обеспечить хорошую структуру поверхности, и вставляли в держатель. Образцы сканировали при углах 2θ от 2° до 40° со скоростью сканирования, равной 2°/мин и шагом 0.02°.
XRPD анализ проводили с использованием PANalytical X'Pert Pro® дифрактометра. Падающий пучок получали с использованием Cu Kα (альфа) излучения 1.54057  , обеспечиваемого дистационным источником Optix с точной фокусировкой. Для фокусировки Cu Kα (альфа) рентгеновского излучения источника через образец и на детектор было использовано эллиптическое многослойное зеркало. Напряжение трубки и сила тока были установлены на 45 кВ и 40 мА соответственно. Диапазон сканирования составил от 1,01 до 39.98° 2θ, с размером шага 0.017°/мин при скорости сканирования 3.3°/мин в течение всего времени сбора данных, 718 секунд. Для калибровки прибора был использован кремниевый стандарт. Четкие пики на рентгенограмме указывают на то, что образец является кристаллическим. Характерные спектры показаны на фигурах 2, 10, 13-21.
, обеспечиваемого дистационным источником Optix с точной фокусировкой. Для фокусировки Cu Kα (альфа) рентгеновского излучения источника через образец и на детектор было использовано эллиптическое многослойное зеркало. Напряжение трубки и сила тока были установлены на 45 кВ и 40 мА соответственно. Диапазон сканирования составил от 1,01 до 39.98° 2θ, с размером шага 0.017°/мин при скорости сканирования 3.3°/мин в течение всего времени сбора данных, 718 секунд. Для калибровки прибора был использован кремниевый стандарт. Четкие пики на рентгенограмме указывают на то, что образец является кристаллическим. Характерные спектры показаны на фигурах 2, 10, 13-21.
Сигнальная пластина дифрактометра Rigaku Rapid II снабжена медным источником рентгеновского излучения высокой интенсивности MicroMax002+.
ПРИМЕР 8 Дифференциальная сканирующая калориметрия (DSC)
Для определения термических свойств образцов порошков применяли диффеенциальный сканирующий калориметр ТА Instruments (модель Q100) с механическим кулером и стандартной ячейкой (сконфигурированной также, как и тигель образца). Каждый образец помещали в закрытый алюминевый тигель с крышкой, содержащей одно или ни одного отверстия, и вставляли в ячейку дифференциальной сканирующей калориметрии (DSC). Ячейку продували азотом со скоростью примерно 50 см3/мин. Ячейку и образец уравновешивали при 20°C. Затем ячейку нагревали до 250-350°C со скоростью 10.00°C/мин, отслеживая разность теплового потока между пустым эталонным тиглем и тиглем с образцом.
ПРИМЕР 9 Термогравиметрический анализ (TGA)
При помощи термогравиметрического анализа (TGA) изменение веса определяется как функция температуры. Мониторинг веса образца в процессе нагревания в TGA приборе (ТА Instruments, модель Q500) давал график зависимости массы от температуры. В тигель DSC, закрепленный на держателе образца, помещали 0,1-2 миллиграмма образца. Держатель образца нагревали в TGA от 25 до 300°C при скорости нагревания 10°C/мин. Для продувки использовали сухой газообразный N2. Изотермические анализы проводили путем нагревании образца при скорости 10°C/мин до желаемой температуры и затем выдерживали образец при этой температуре по меньшей мере 200 минут.
ПРИМЕР 10 Инфракрасная спектроскопия с преобразованием Фурье (FT-IR)
FT-IR спектры регистрировали на приборе ThermoFisher Scientific FT-IR: Nicolet 6700.
ПРИМЕР 11 Динамическая сорбция паров (DVS)
Для автоматического сбора данных сорбции паров был использован сорбционный гравиметрический анализатор ТА Instruments Q5000SA. В качестве калибровочных стандартов использовали NaCl и PVP. Образцы перед анализом не высушивали. Данные по адсорбции и десорбции собирали при 25°C в диапазоне от 5 до 95% относительной влажности (RH) с шагом 10% RH при продувке азотом. Перед переходом к следующему диапазону RH образцы выдерживали при соответствующей RH в течение 1 часа. Данные не корректировались в отношении исходного содержания влаги в образцах.
ПРИМЕР 12 Аналитический метод ВЭЖХ
Анализ ВЭЖХ проводили с использованием системы Agilent 1200SL HPLC, снабженной ультрафиолетовым (UV) и масс-спектрометрическим (MS) детекторами при условиях, приведенных ниже:
Интегрирование для соединения выражали как процент площади пика, рассчитанной по площади каждого пика в хроматограмме, за исключением «инжекционного пика», к общей площади пиков. Процент площади пика конкетного соединения использовали как показатель чистоты компонента в образце.
ПРИМЕР 13 Сбор данных для полиморфа Формы В
Бесцветную иглу GDC-0032 (С24Н28N8O2), имеющую примерные размеры 0.20×0.11×0.08 мм, размещали на стекловолокне (fiber) в случайной ориентации. Предварительную оценку и сбор данных проводили с использованием Cu Kalpha излучения 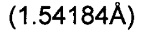 на дифрактометре Rigaku Rapid II®, оборудованном конфокальной оптикой. Уточнения проводили на LINUX PC, используя SHELX97® (Sheldrick, G.М. Acta Cryst., (2008), A64, 112). Константы ячейки для собранных данных получали с использованием метода наименьших квадратов, используя углы 18706 отражений в диапазоне 4<q<70°. Уточненная мозаичность (mosaicity) по DENZO/SCALEPACK составила 0.56°, что указывает на среднее качество кристалла (Z. Otwonowski and W. Minor, Methods Enzymol (1997) 276:307). Пространственную группу определяли программой XPREP [1]. Систематические погасания отсутствовали, пространственная группа была определена, как Р -1(# 2). Данные собирали при температуре 150 (1)K. Данные были собраны с максимальным углом 2q составляющим 140.65°.
на дифрактометре Rigaku Rapid II®, оборудованном конфокальной оптикой. Уточнения проводили на LINUX PC, используя SHELX97® (Sheldrick, G.М. Acta Cryst., (2008), A64, 112). Константы ячейки для собранных данных получали с использованием метода наименьших квадратов, используя углы 18706 отражений в диапазоне 4<q<70°. Уточненная мозаичность (mosaicity) по DENZO/SCALEPACK составила 0.56°, что указывает на среднее качество кристалла (Z. Otwonowski and W. Minor, Methods Enzymol (1997) 276:307). Пространственную группу определяли программой XPREP [1]. Систематические погасания отсутствовали, пространственная группа была определена, как Р -1(# 2). Данные собирали при температуре 150 (1)K. Данные были собраны с максимальным углом 2q составляющим 140.65°.
Обработка данных: Каркасные структуры интегрировали с использованием DENZO-SMN (Sheldrick, G.М. Acta Cryst., 2008, А64, 112). В целом, было собрано 18706 отображений, из которых 4029 были уникальными. Для обработки данных использовали поправку Лоренца и поправку на поляризацию. Линейный коэффициент поглощения составлял 7,25/мм для Cu Kα излучения. Вводили эмпирическую поправку на поглощение с использованием SCALEPACK. Коэффициенты пропускания находились в пределах от 0.90 до 0.94. Интенсивности эквивалентных отражений усредняли. Согласованный коэффициент усреднения составлял 4,2% в расчете на интенсивность. Параметры триклинной ячейки и рассчитанный объем составили: а=9.7944(14), b=10.4767(11), 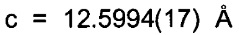 , α=96.145(10), β=95.749(11), β=115.072(9)°,
, α=96.145(10), β=95.749(11), β=115.072(9)°, 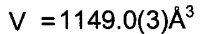 . Для Z=2 и F.W.=460.54, рассчитанная плотность составила 1.331 г/см3.
. Для Z=2 и F.W.=460.54, рассчитанная плотность составила 1.331 г/см3.
Разрешение и уточнение структуры: Разрешение структуры осуществляли прямыми методами, используя SIR2004 (М.С. Burla, et al., J. Appl. Crystalogr., (2005) 38:381). Оставшиеся атомы располагали в максимумах разностного синтеза Фурье. Атомы водорода включали в уточнение, но привязывали к атомам, с которыми они связаны. Структуру уточняли полноматричным методом наименьших квадратов, с минимизацией функции.
Уточнение проводили на LINUX PC, используя SHELX-97.
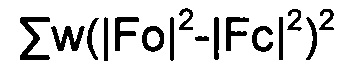
Весовой фактор w определяли как
1/[s2(Fo2)+(0.0810P)2+0.5152P], где P=(Fo2+2Fc2)/3.
Факторы рассеивания брали из "International Tables for Crystallography" ("International Tables for Crystallography", Vol. C, Kluwer Academic Publishers, Utrecht, The Netherlands, (1992), Tables 4.2.6.8 and 6.1.1.4.). Для уточнения было использовано 4029 отражений. Однако, только 3257 отражений с 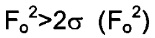 были использованы при расчете R1. Последний цикл уточнения включал 330 переменных параметров и конвергировался (наибольшее отклонение параметра составило менее 0.01 от его стандартного отклонения) с невзвешенными и средневзвешенными согласованными коэффициентами:
были использованы при расчете R1. Последний цикл уточнения включал 330 переменных параметров и конвергировался (наибольшее отклонение параметра составило менее 0.01 от его стандартного отклонения) с невзвешенными и средневзвешенными согласованными коэффициентами:
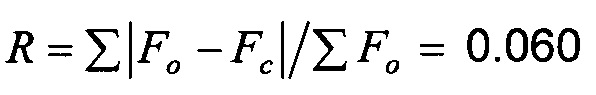
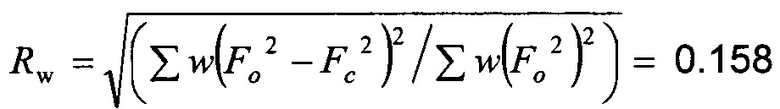
Параметр GOF (критерий согласия) был равен 1.061. Наивысший пик в конечном расхождении Фурье имел высоту 0.41 е/А3. Минимальный отрицательный пик имел высоту -0.33 е/А3.
Рассчитанная порошковая дифрактограмма: Рассчитанную порошковую дифрактограмму получали для Cu излучения, используя Mercury 2.3 (Mercury CSD2.3 (Build RC4), ICDD, 2009), а атомные координаты, пространственную группу, параметры единичной ячейки - из данных монокристалла. Поскольку данные монокристалла собирали при низких температурах (150 К), ожидались некоторые расхождения между рассчитанной и экспериментальной порошковой рентгенограммами. Обычно этот сдвиг является функцией 2θ (тэта), но так как термическое сжатие кристалла неизвестно, это может быть и не так.
Изображения ORTEP и схемы упаковки были получены с использованием программы ORTEP III (Johnson, С.K. ORTEPIII, Report ORNL-6895, Oak Ridge National Laboratory, TN, U.S.A. (1996). OPTEP-3 for Windows V1.05, Farrugia, L.J., J. Appl. Crystalogr. (1997), 30:565) с пакетом программного обеспечения PLATON (Spek, A.L. PLATON. Molecular Graphics Program. Utrecht University, Utrecht, The Netherlands, (2008); Spek, A.L, J. Appl. Crystalogr. (2003), 36:7). Атомы представлены в виде эллипсоидов анизотропных тепловых колебаний с уровнем вероятности 50%. Схемы упаковки были получены с использованием программного обеспечения Mercury visualization. Водородные связи представлены пунктирными линиями.
Рентгеновская порошковая дифракция (XRPD): Данные для XRPD дифрактограммы собирали в SSCI, подразделении Aptuit, с использованием X'Pert Pro дифрактометра (PANanalytical). Образец анализровали с использованием Cu излучения, обеспечиваемого дистационным источником Optix с точной фокусировкой. Эллиптическое многослойное зеркало использовали для фокусировки Cu Kα рентгеновских лучей через образец и на детектор. Образец размещали в виде сэндвичевой конструкции между пленками толщиной 3 мкм, анализировали в трансмиссионной геометрии и вращали для оптимизации статистики по ориентации. Для минимизации фонового излучения, генерируемого воздухом, применяли прерывание луча и короткое антирассеивающее удлинение. Для минимизации рассеяния от аксиальной дивергенции использовали щели Соллера для падающего и дифрагированного лучей. Дифрактограммы получали с использованием сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца. Параметры сбора данных для дифрактограммы представлены над изображением дифрактограммы в разделе "Сбор данных". Перед анализом анализировали силиконовый стандарт (NIST SRM 640с) для выверки положения пика Si 111.

Хотя вышеупомянутое изобретение было подробно описано при помощи иллюстраций и примеров для целей наилучшего понимания, описание и примеры не должны толковаться, как ограничивающие объем изобретения. Соответственно, все приемлемые модификации и эквиваленты могут быть рассмотрены, как входящие в объем изобретения, определенный последующими пунктами формулы изобретения. Раскрытия всех патентных и научных источников, приведенных в настоящем описании, включено во всей их полноте в качестве ссылки.
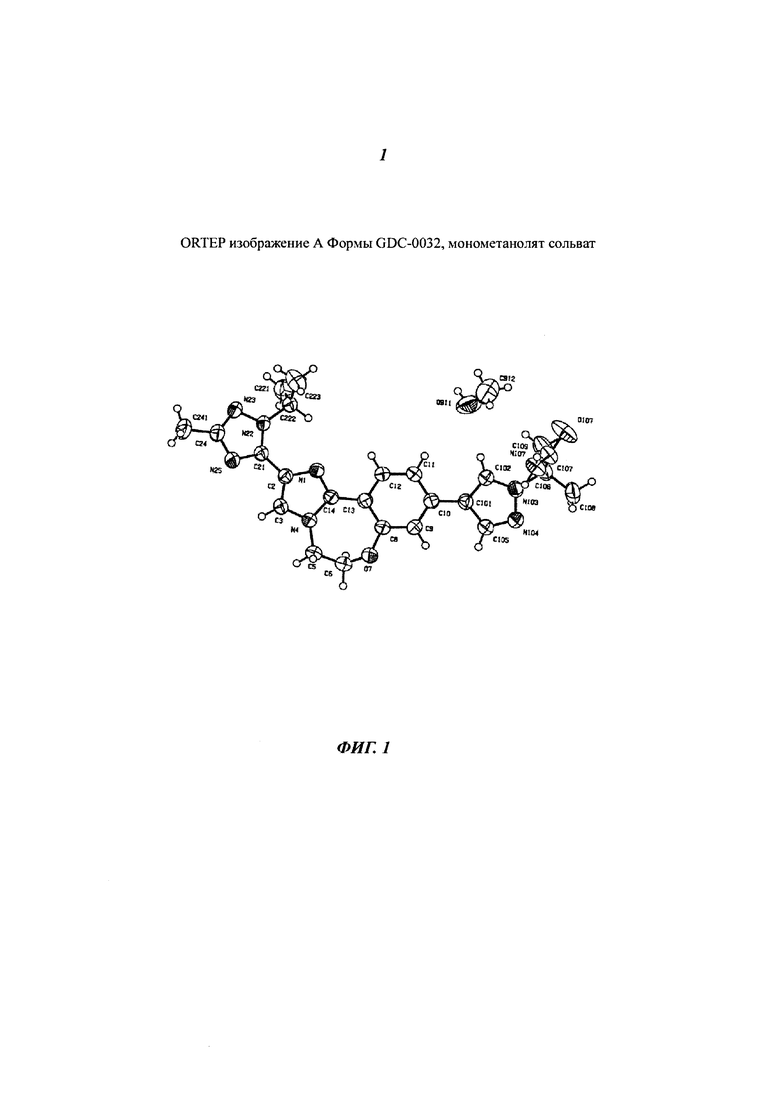
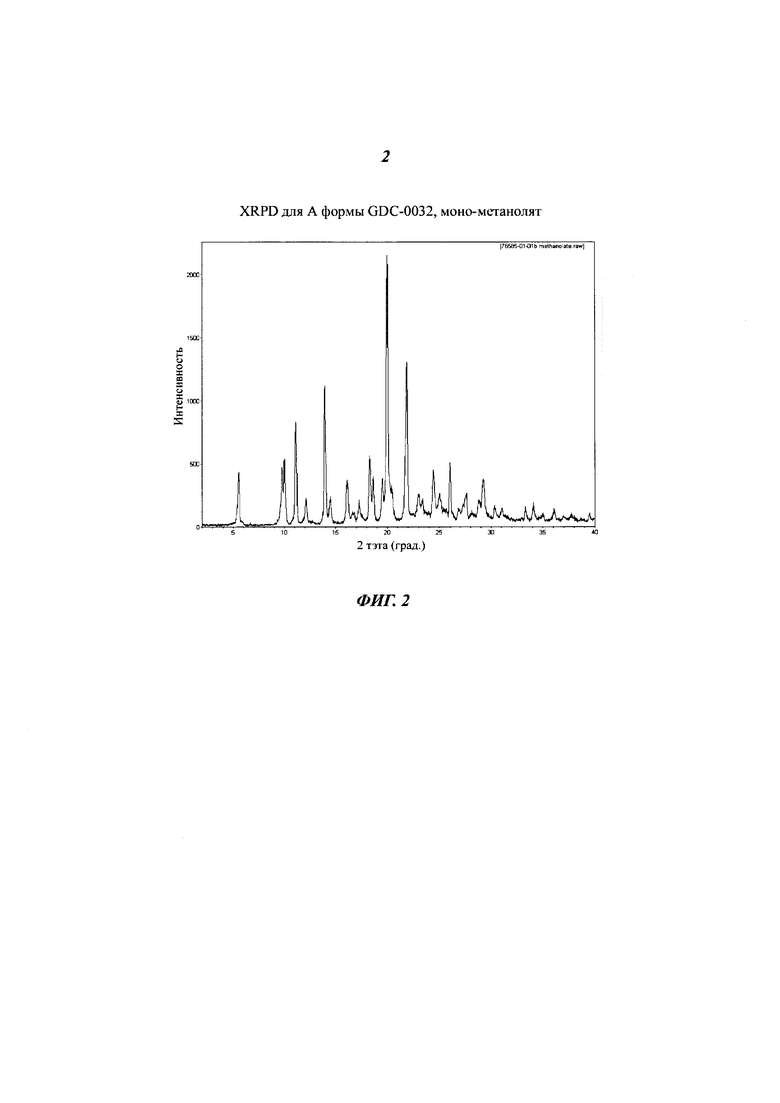
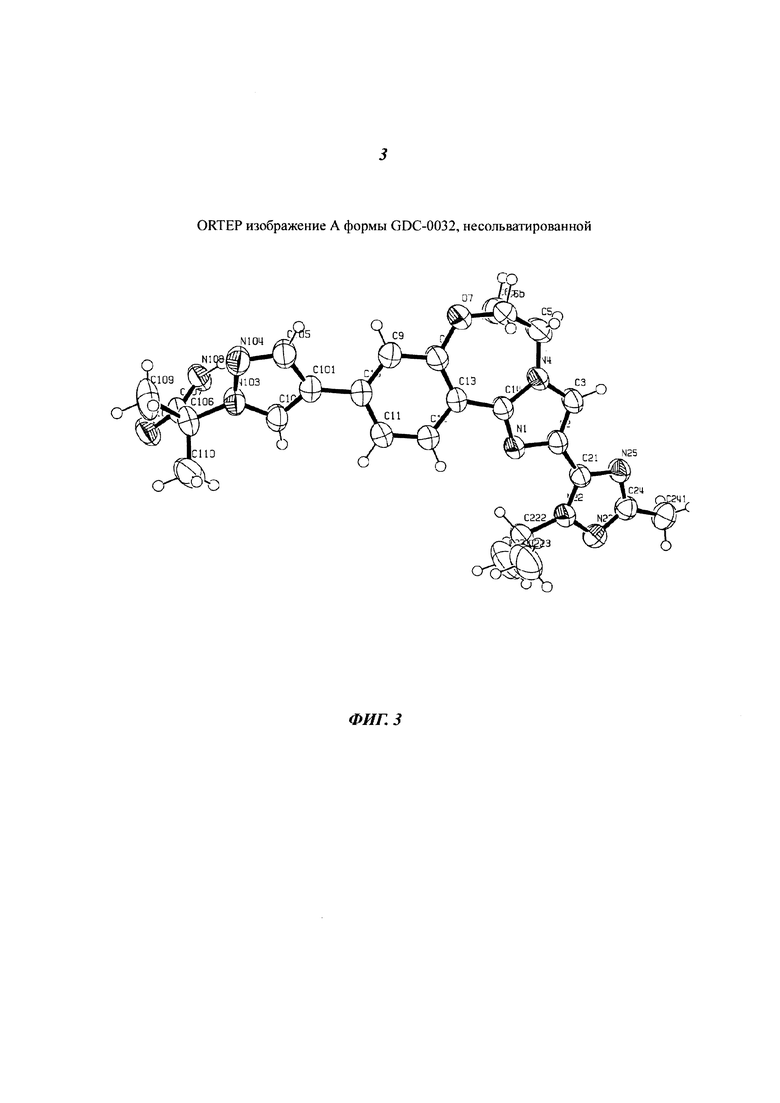





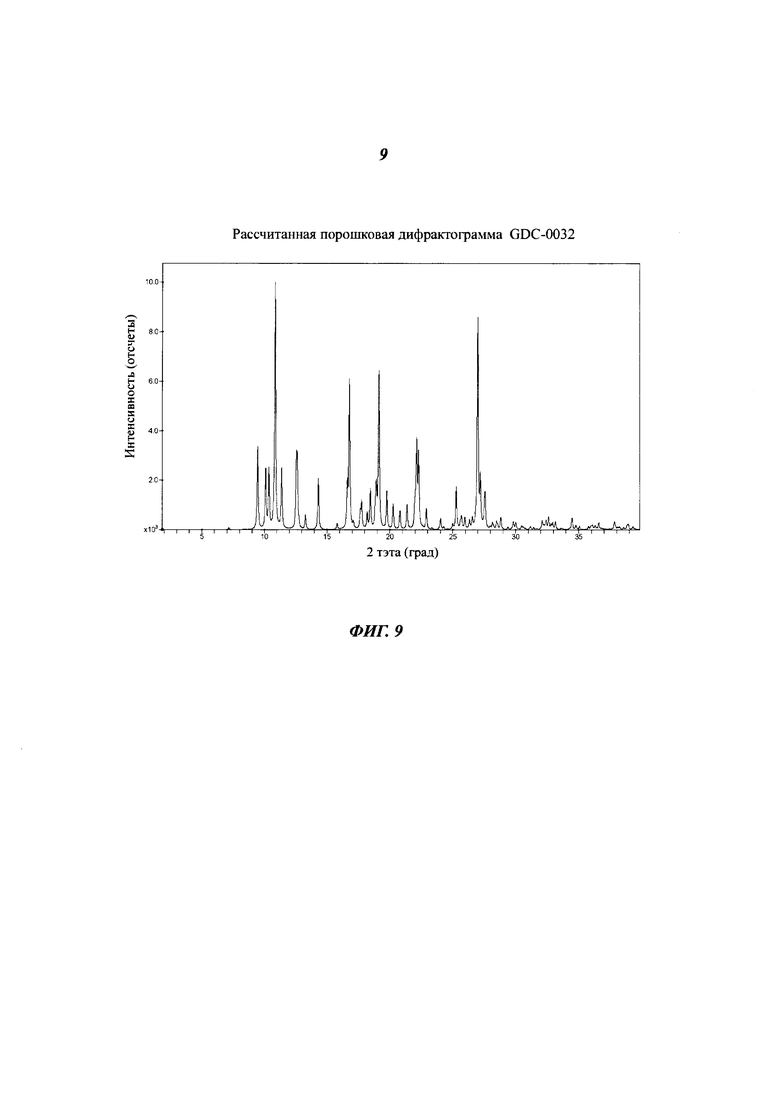
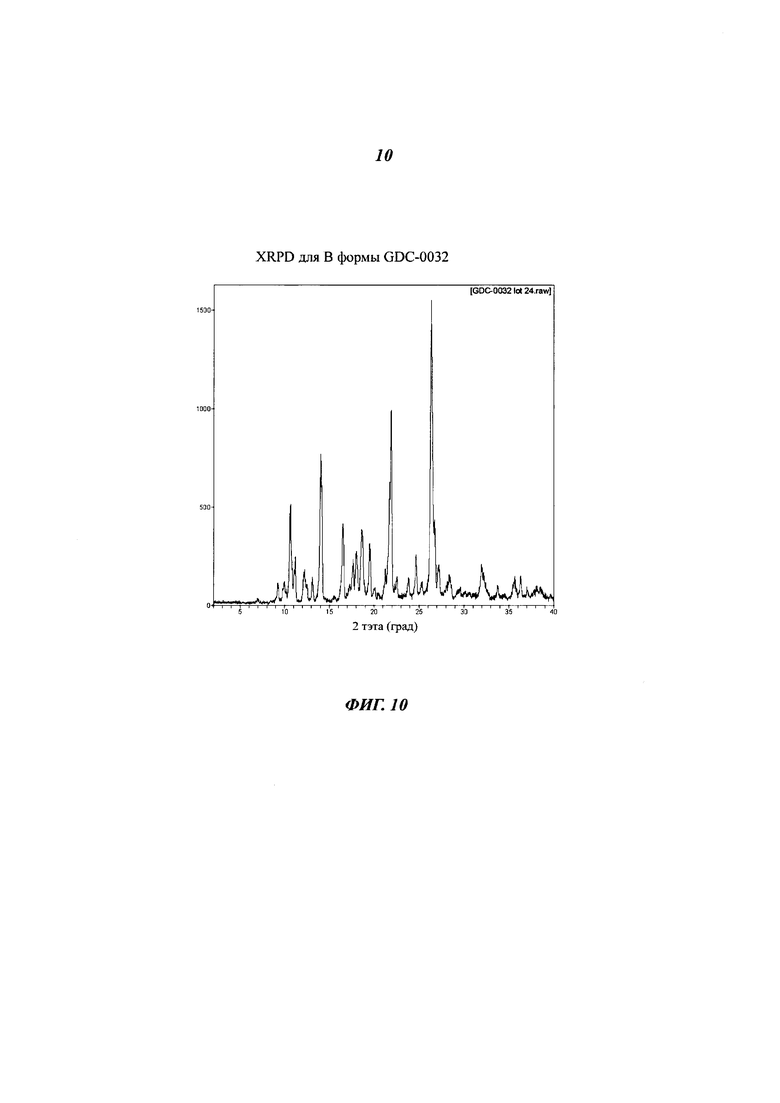
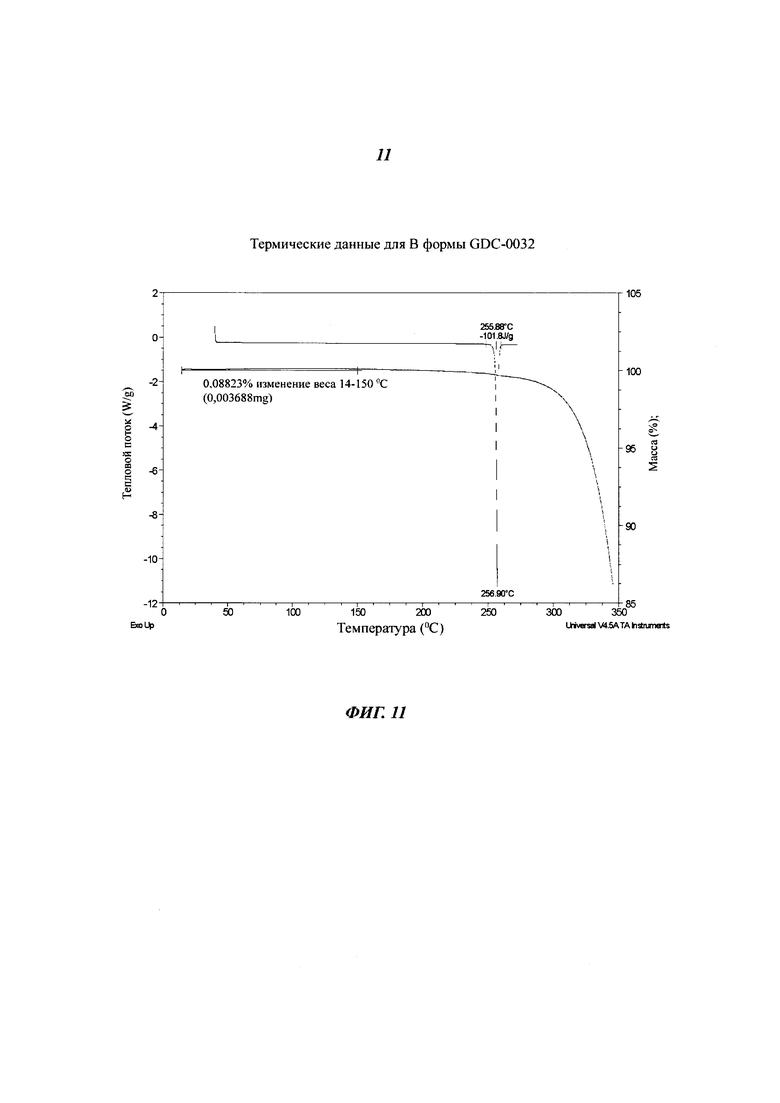
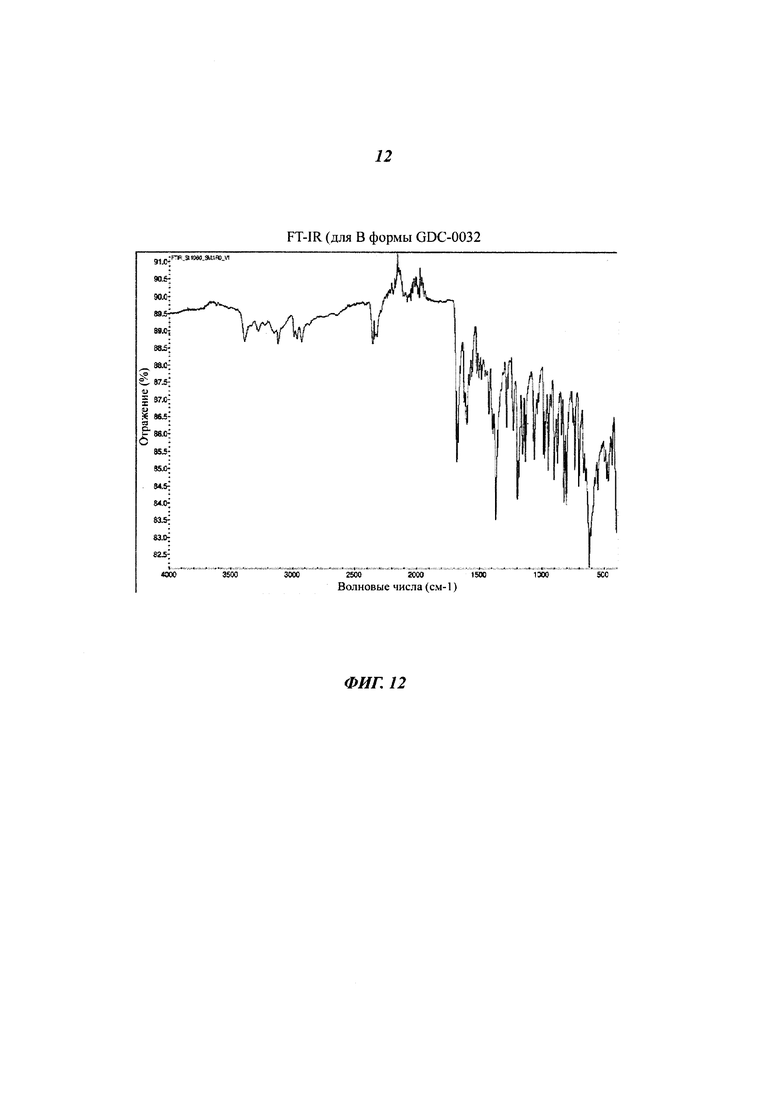
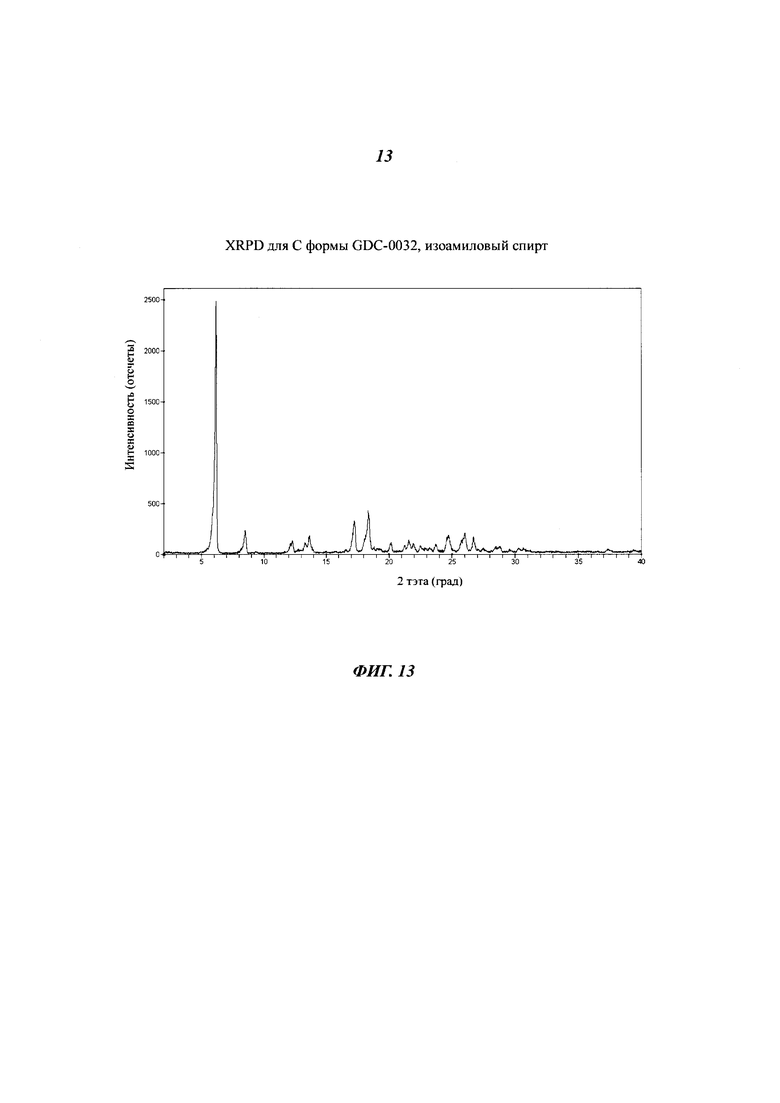
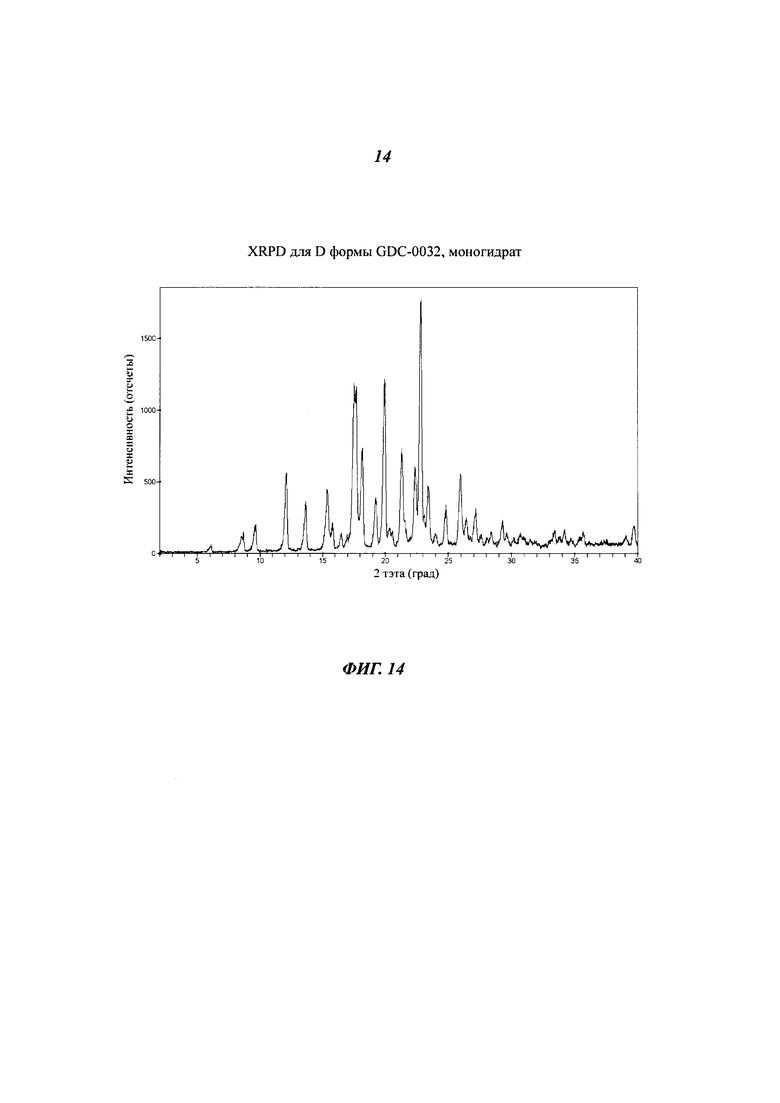
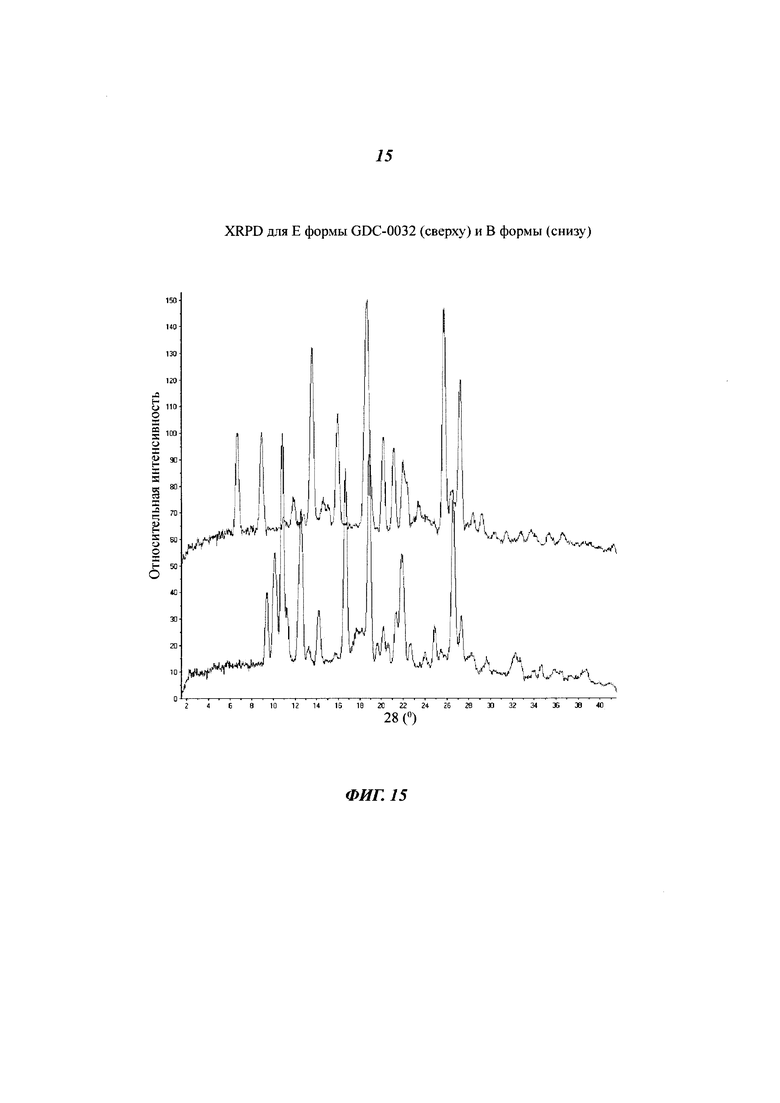
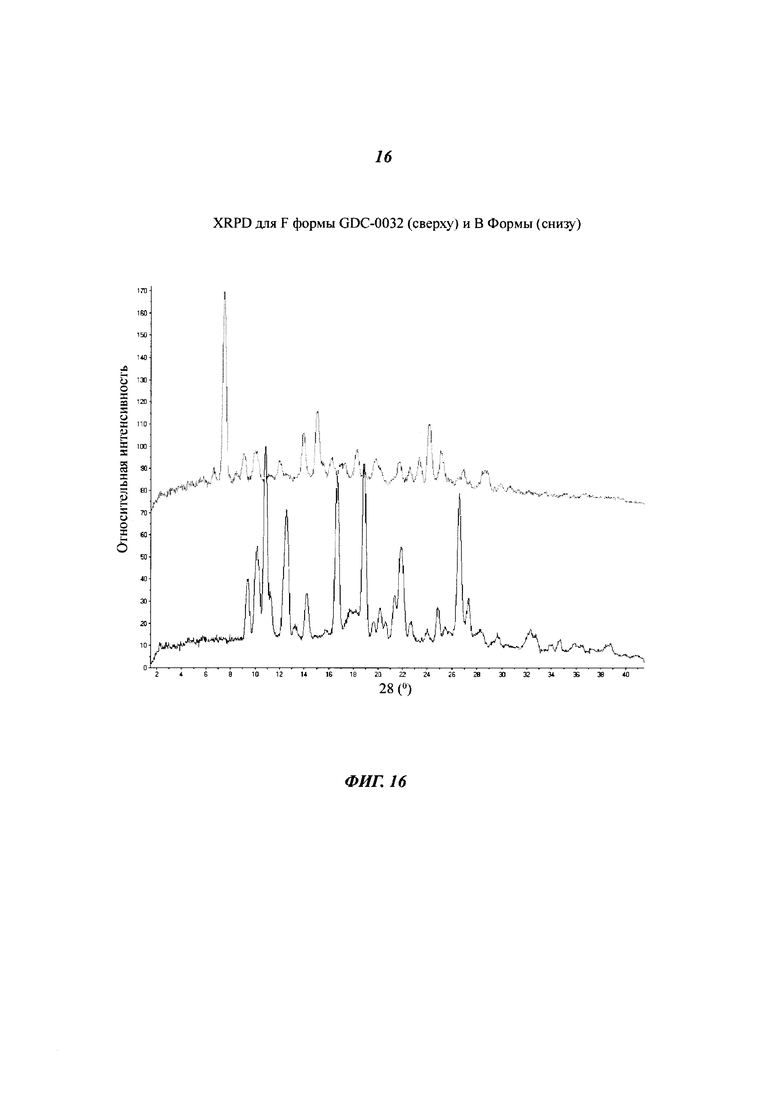
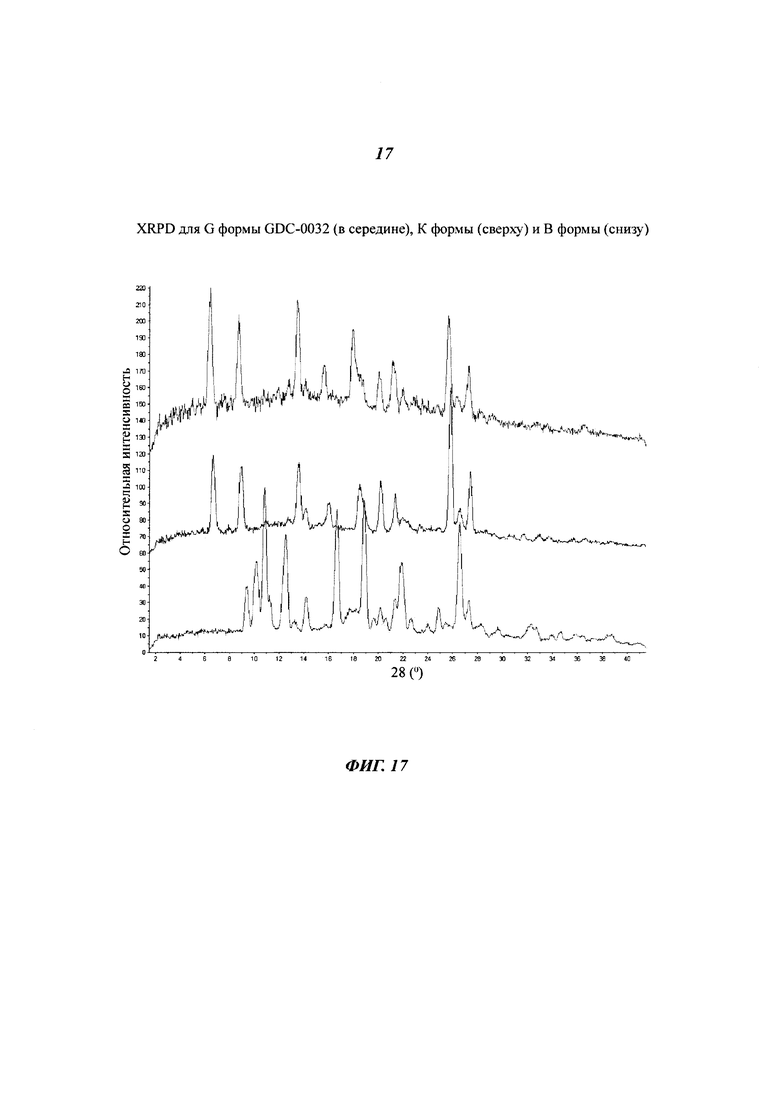
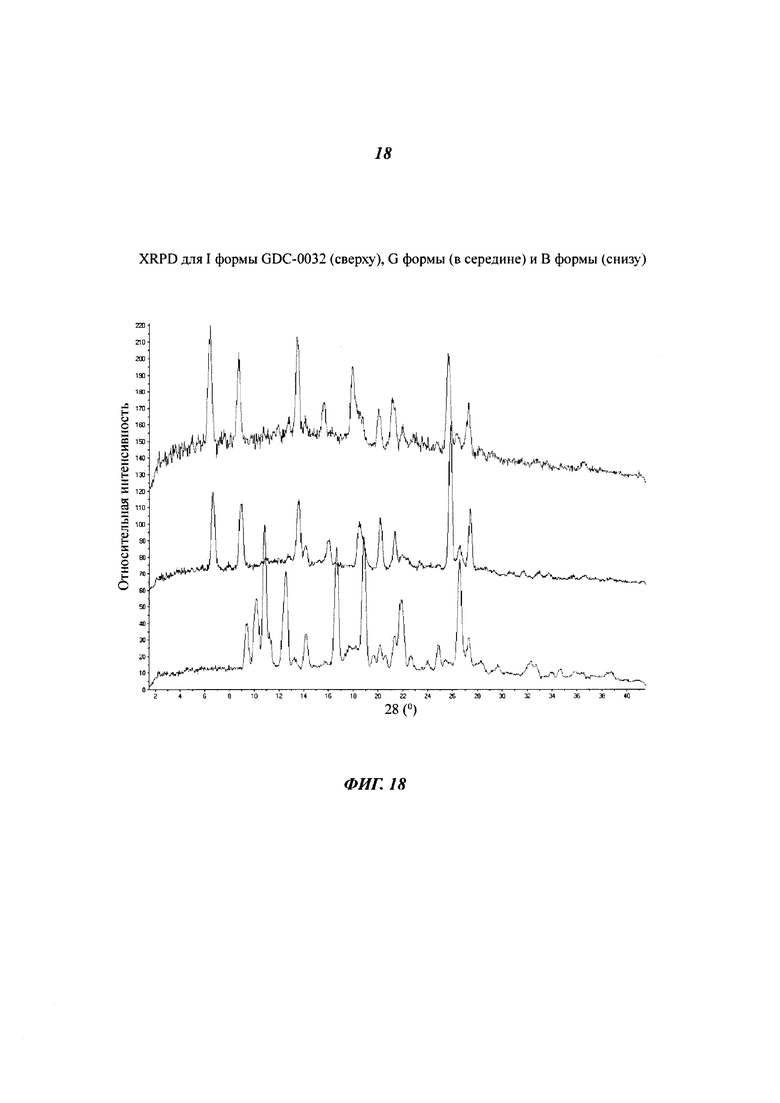
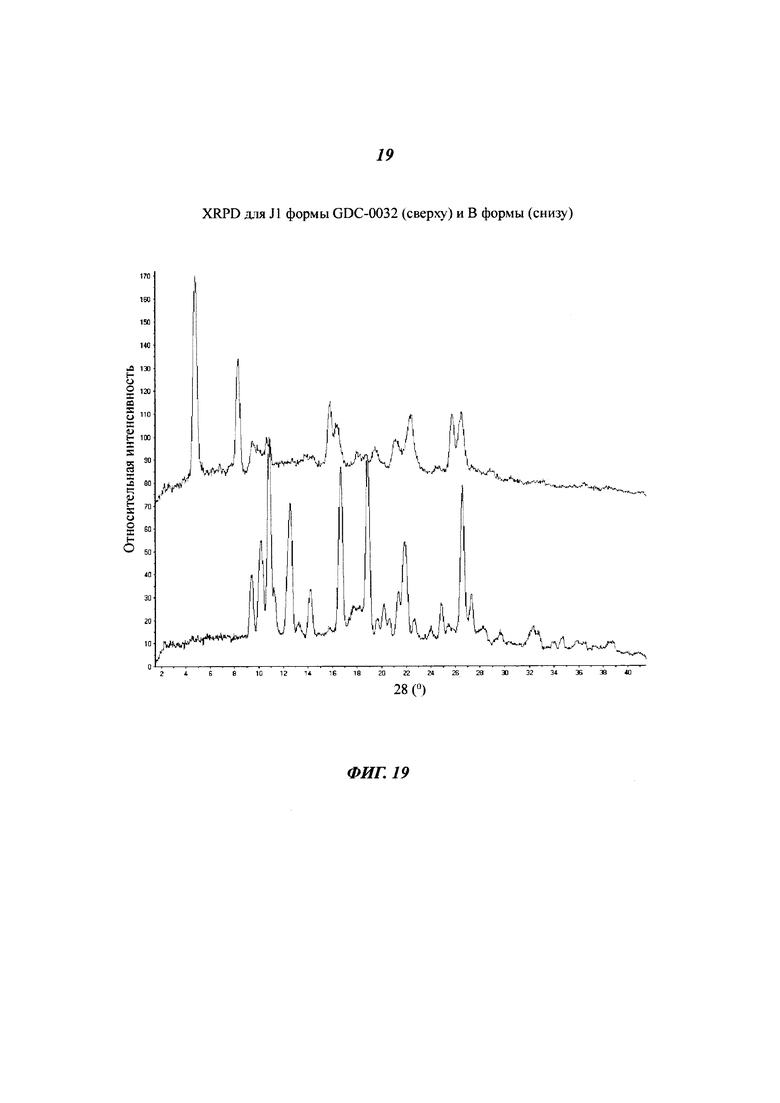
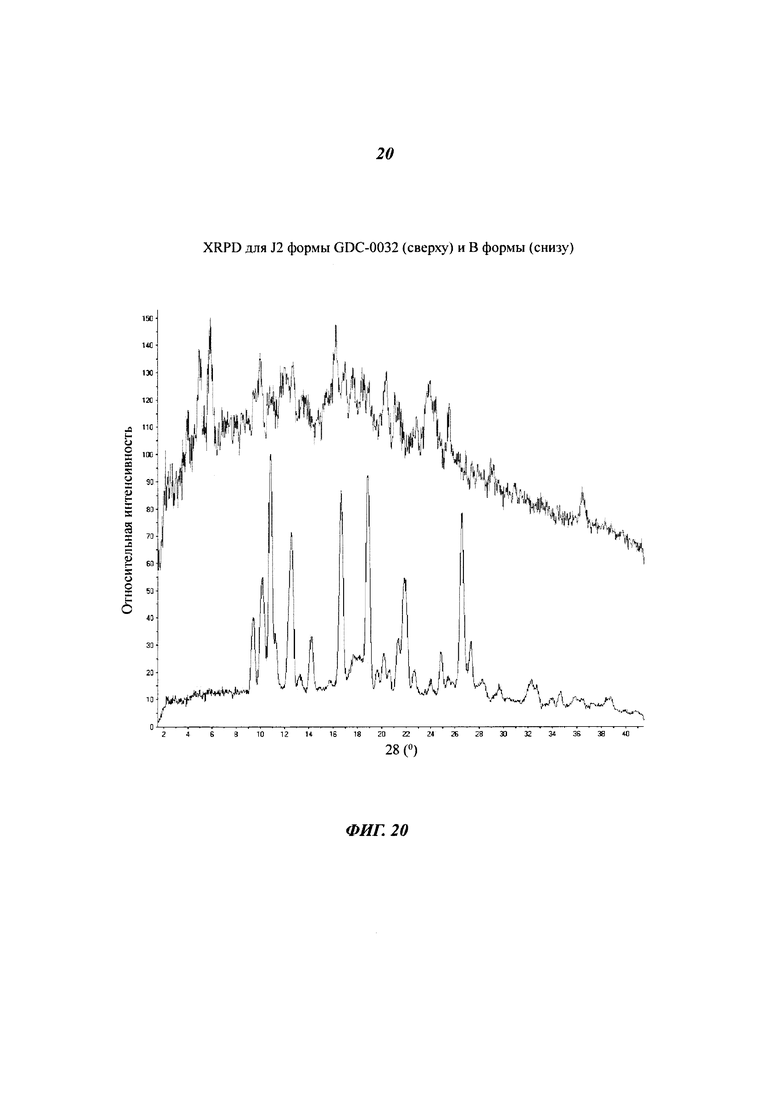
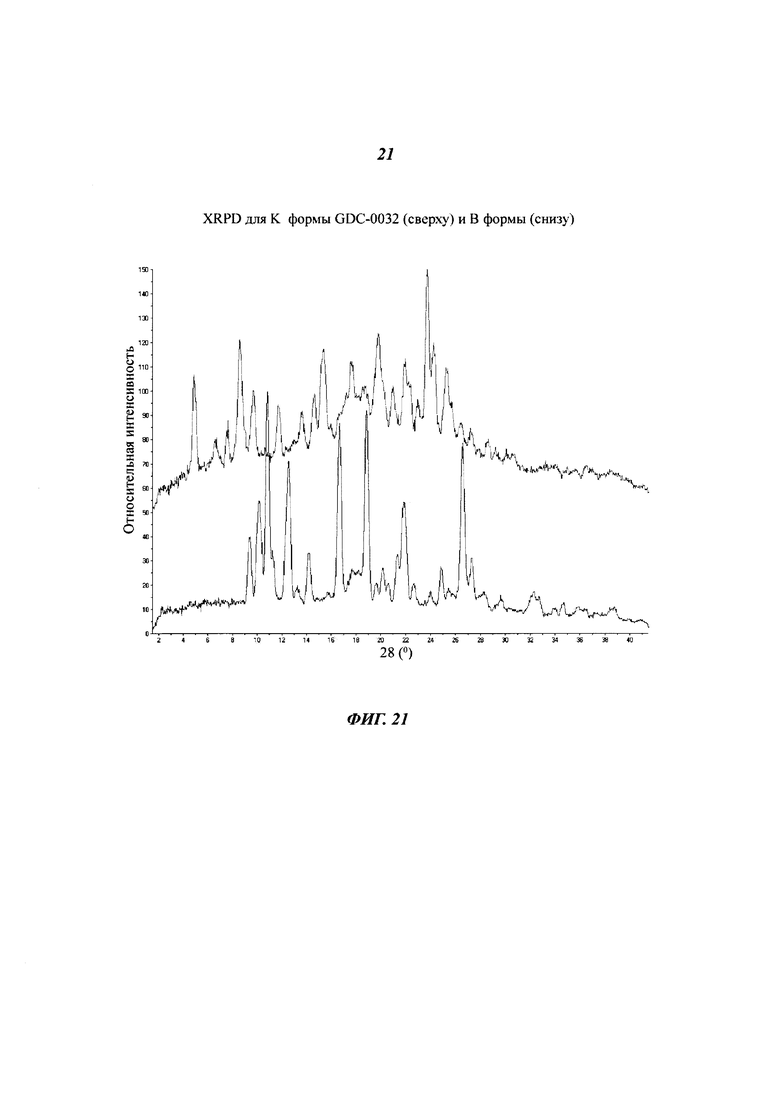
Изобретение относится к способу получения кристаллического полиморфа 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамида (GDC-0032, таселисиб), включающему нагревание суспензии в изоамиловом спирте и охлаждение смеси, посредством чего образуется кристаллический полиморф, характеризующийся рентгеновской порошковой дифрактограммой, имеющей характеристические пики, выраженные в градусах 2-тэта при приблизительно 9.40, 10.84, 16.72, 18.7 и 26.60. Технический результат: разработан способ получения кристаллического полиморфа 2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамида, который обладает гигроскопичностью, физической стабильностью, химической стабильностью в твердом состоянии. 21 ил., 15 табл., 13 пр.
Способ получения кристаллического полиморфа (2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f]имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамида, включающий нагревание суспензии (2-(4-(2-(1-изопропил-3-метил-1Н-1,2,4-триазол-5-ил)-5,6-дигидробензо[f] имидазо[1,2-d][1,4]оксазепин-9-ил)-1Н-пиразол-1-ил)-2-метилпропанамида в изоамиловом спирте и охлаждение смеси, посредством чего образуется кристаллический полиморф, характеризующийся рентгеновской порошковой дифрактограммой, имеющей характеристические пики, выраженные в градусах 2-тэта при приблизительно 9.40, 10.84, 16.72, 18.7 и 26.60.
| CHUDI O | |||
| NDUBAKU ET AL, "Discovery of 2-{ 3-[2-(1-Isopropyl-3-methyl-1 H -1,2-4-triazol-5-yl)-5,6-dihydrobenzo[f]imidazo[1,2- d ][1,4]oxazepin-9-yl]-1 H -pyrazol-1-yl} -2-methylpropanamide (GDC-0032): A [beta]-Sparing Phosphoinositide 3-Kinase Inhibitor with High Unbound Exposure and Robust in Vivo Antitumor Activity", JOURNAL OF MEDICINAL CHEMISTRY, т | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| RU2012117398 A, 10.11.2013. | |||
Авторы
Даты
2018-06-19—Публикация
2014-12-15—Подача