ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/651757, поданной 25 мая 2012 г., содержание которой включено в настоящую заявку во всей полноте посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым производным салициловой кислоты, композициям, содержащим указанные соединения, и способам ингибирования активности STAT3 или лечения рака, в котором задействован STAT3/5, такого как рак головного мозга, молочной железы, толстой кишки, гематологическая опухоль, рак легких, яичников и простаты, с применением указанных соединений.
УРОВЕНЬ ТЕХНИКИ
STAT3 постоянно активируется при множестве видов рака человека, включая все основные карциномы, в том числе рак молочной железы, головного мозга, толстой кишки, поджелудочной железы, яичников и плоскоклеточный рак головы и шеи (SCCHN), и меланомы, а также некоторые виды гематологических опухолей (Bowman T, et al (2000) Oncogene 19, 2474-88, и Darnell, J.E. (2005) Nat. Med. 11, 595-596). Таким образом, существует растущий интерес к разработке видов противораковой терапии, действие которых основано на ингибировании постоянно активного STAT3, в частности, в качестве стратегии борьбы с раком в случаях, когда лечащие врачи стремятся улучшить результаты, и/или когда даже обеспечение удовлетворительного стандарта лечения, включающего уход за пациентом, качество жизни и результаты, является затруднительным.
Глиобластома (ГБМ) считается самым агрессивным и летальным видом рака головного мозга и имеет медиану выживаемости после лечения примерно 15 месяцев. К сожалению, указанные скромные результаты могут быть достигнуты только в случае относительно молодых (т.е. возрастом <70) и в остальном здоровых пациентов. Пожилые пациенты с ГБМ, количество которых велико, и пациенты с плохим состоянием здоровья на момент постановки диагноза имеют значительно более короткий период выживаемости при аналогичной терапии. Кроме того, ГБМ встречается чаще у стареющего населения. Более того, в отличие от более распространенных видов рака, таких как рак легких, молочной железы и толстой кишки, ГБМ не поддается предотвращению или обнаружению на раннее стадии, когда лечение, как может ожидаться, является существенно более эффективным. Кроме того, несмотря на десятилетия интенсивных исследований, значительные улучшения общей выживаемости не были достигнуты. Таким образом, разработка терапевтических подходов для удовлетворения указанной неудовлетворенной потребности является чрезвычайно важной.
Было показано, что опухоли головного мозга содержат редкие субпопуляции опухолевых стволовых клеток головного мозга (BTSC), которые обладают такими свойствами стволовых клеток, как клоногенное самообновление, мультипотентность и онкогенность. Значительное самообновление и пролиферативная способность BTSC в сочетании с их нечувствительностью к традиционным методам радио- и химиотерапии позволяют предположить, что они являются неотъемлемой частью процессов роста и рецидива ГБМ после лечения. Таким образом, BTSC представляют собой «источник заболевания», требующий новых терапевтических подходов для эффективного устранения для улучшения результатов лечения ГБМ.
Белки STAT были изначально открыты, как латентные цитоплазматические факторы транскрипции, которые являются проводниками ответа на сигналы от цитокинов и факторов роста (Darnell, J.E., Jr. (1996) Recent Prog. Norm. Res. 51, 391-403; Darnell, J.E. (2005) Nat. Med. 11, 595-596). Семь членов семейства, STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b и STAT6, опосредуют некоторые физиологические эффекты, включая рост и дифференцировку, выживание, развитие и воспаление. STAT представляют собой белки, содержащие домен SH2. После связывания лиганда с рецепторами цитокинов или факторов роста STAT подвергается фосфорилированию по важному остатку тирозина (Tyr705 для STAT3) рецепторами факторов роста, цитоплазматическими Янус-киназами (Jaks) или киназами семейства Src. Два фосфорилированных и активированных мономера STAT димеризуются при помощи взаимных взаимодействий pTyr-домен SH2, перемещаются в ядро и связываются со специфичными ДНК-чувствительными элементами целевых генов, таким образом индуцируя транскрипцию генов (Darnell, J.E., Jr. (1996) Recent Prog. Norm. Res. 51, 391-403; Darnell, J.E. (2005) Nat. Med. 11, 595-596). В отличие от нормального сигнального пути STAT многие солидные и гематологические опухоли человека маскируют аномальную активность STAT3 (Turkson, J. Expert Opin. Ther. Targets 2004, 8, 409-422; Darnell, J.E., Jr. (1996) Recent Prog. Norm. Res. 51, 391-403; Darnell, J.E. (2005) Nat. Med. 11(6), 595-596; Bowman, T. et al. (2000) Oncogene 19(21), 2474-2488; Buettner, et al. (2002) Clin. Cancer Res. 8(4), 945-954; Yu, H. и Jove. R. (2004) Nat. Rev. Cancer 4(2), 97- 105; Haura, E.B., et al. (2005) Nat. Clin. Pract. Oncol. 2(6), 315-324).
Следует отметить, что белок STAT3 представляет собой один из семи членов семейства белков STAT, являющихся факторами транскрипции. STAT3 активируется путем фосфорилирования тирозина 705 (Y705), что инициирует образование комплекса двух фосфорилированных мономеров STAT3 (pSTAT3). Гомодимеры pSTAT3 образуются благодаря взаимным взаимодействиям домен Src гомологов 2 (SPI2) STAT3-pY705 STAT3. Гомодимеры pSTAT3:pSTAT3 перемещаются в ядро и связываются с ДНК, инициируя транскрипцию целевого гена STAT3. Ранее направленное действие в отношении STAT3 обеспечивали с применением доминантно-негативных конструкций, олигонуклеотидов или, наиболее часто, фосфопептидных агентов, которые имитируют нативную последовательность, содержащую pY705.
К сожалению, указанные ингибиторы быстро разлагаются in vivo, что ограничивает их клиническое применение. Для решения указанных проблем были разработаны ингибиторы STAT3, состоящие из небольших молекул, предназначенные для лечения раковых заболеваний, при которых задействован гиперактивированный белок STAT3. В международной заявке на патент WO 2012/018868 были выявлены ингибиторы на основе кислот, которые с высокой активностью и селективно блокируют димеризацию и активность связывания ДНК STAT3, в частности соединение 45O, также называемое BP-1-102 (иногда в настоящем описании называемое соединением 1). Соединение 45O согласно международной заявке на патент WO 2012018868 с высокой активностью подавляет разнообразные онкогенные свойства различных выращенных раковых клеток (рака молочной железы, легкого, поджелудочной железы, простаты, легкого), включая: пролиферацию клеток, безъякорный рост клеток, миграцию, инвазивность и подвижность. Оно является селективным к STAT3 и в 10 раз менее активно связывается со STAT1, на 93% гомологичным белком STAT. Оно оказывало незначительное действие на фосфорилирование Shc, Src, Jak-1/2, Erk1/2 или Akt или не оказывало его вообще, а также не влияло на нетрансформированные клетки (клетки NIH 3T3, мышиные эмбриональные фибробласты, не содержащие STAT3, или стромальные клетки тимуса мышей, кроме того, не действовало на трансформированные клетки, не содержащие активированный STAT3).
Кроме того, BP-1-102 обладало выраженным противоопухолевым действием in vivo в моделях ксенотрансплантатов рака легких или молочной железы у мышей, которое приводило к существенному уменьшению объема опухоли. Вестерн-блоты остаточных опухолей у мышей, подвергавшихся лечению, указывали на зависящее от дозы подавление pSTAT3, cMyc, циклина D1, Bc1-xL, сурвивина и ФРЭС.
Кроме того, генетические и иные молекулярные данные показывают, что устойчивое фосфорилирование STAT3 опосредовано нарушениями предшествующих Tyr киназ, а также указывают на то, что для поддержания и прогрессирования опухолей в раковых клетках требуется наличие конститутивно активного и димеризованного STAT3. Таким образом, в различных исследованиях для подтверждения правильности концепции (Turkson, J., et al. Mol. Cancer Ther. 2004, 3(3), 261-269; Turkson, J., et al. J. Biol. Chem. 2001, 276(48), 45443-45455; Siddiquee, K.; et al. Proc. Natl. Acad. Sci. U.S.A. 2007, 104, 7391-7396.; Turkson, J.; et al. Mol. Cancer Ther. 2004, 3, 1533-1542; и Turkson, J.; et al. J. Biol. Chem. 2005, 280(38), 32979-32988) было показано, что ингибирование активации STAT3 или нарушение димеризации вызывает гибель раковых клеток и регрессию опухоли. Таким образом, ингибиторы STAT3, состоящие из небольших молекул, обеспечивают средства для исследования молекулярной динамики клеточных процессов с участием STAT3 для понимания роли STAT3 в качестве сигнального медиатора и молекулярного медиатора явлений, приводящих к карциногенезу и прогрессированию злокачественных опухолей. Кроме того, так как путь STAT3 является ключевым для развития разнообразных типов раковых заболеваний человека, включая все основные типы карцином, включая карциномы молочной железы, головного мозга, толстой кишки, поджелудочной железы, яичников и плоскоклеточные карциномы головы и шеи (SCCHN) и меланомы, а также некоторые гематологические опухоли (Bowman T, et al. (2000) Oncogene 19, 2474-88, and Darnell, J.E. (2005) Nat. Med. 11, 595-596), прямое ингибирование STAT3 может обеспечивать способ прямого воздействия на молекулярные мишени для эффективной борьбы с указанными раковыми заболеваниями и в частности с агрессивными формами, такими как GBM.
В оригинальной статье Карро с соавторами (Carro et al., Nature, 463(7279): 318-325, 2010) продемонстрировали, что ген-сигнальный трансдуктор и активатор транскрипции 3 (STAT3), имеющий аномальную активность при GBM, является очень важным медиатором роста опухоли и терапевтической резистентности при GBM. При плохо поддающихся лечению раковых заболеваниях головного мозга, таких как глиомы, астроцитомы и глиобластомы, происходит конститутивная активация STAT3. Кроме того, все больше данных, полученных в последнее время с использованием разнообразных небольших молекул, косвенно ингибирующих STAT3 за счет направленного действия на предшествующие молекулы, такие как члены семейства JAK, явно указывают на то, что сигнальный путь STAT3 является важным для выживания и пролиферации клеток BTSC и GBM in vitRo и in vivo. Тем не менее, из-за направленного действия в отношении широкого диапазона мишеней существующие лекарственные средства для лечения GBM имеют ограниченную возможность использования для лечения вследствие многочисленных побочных эффектов. Таким образом, лекарственные средства, обладающие способностью более специфичной блокировки активности STAT3, могут обеспечивать эффективный способ лечения пациентов с GBM.
Сигнальный путь STAT5, так же как и сигнальный путь STAT3, временно активируется в нормальных клетках и деактивируется различными цитозольными и ядерными регуляторами, включая фосфатазы SOCS, PIAS и протеосомальная деградация. Так же как и STAT3, STAT5 стал известен из-за того, что его нарушения встречаются при раковых заболеваниях и развитии опухолей у человека, было обнаружено, что его конститутивная активация происходит при многих раковых заболеваниях, включая рак молочной железы, печени, простаты, крови, кожи, головы и шеи (Muller, J., et al. ChemBioChem 2008, 9, 723-727). В раковых клетках обычно происходит конститутивное фосфорилирование STAT5, что приводит к нарушенной экспрессии генов-мишеней STAT5 и вызывает злокачественную трансформацию. В раковых клетках, содержащих постоянно активированный STAT5, происходит сверхэкспрессия антиапоптотических белков, таких как Bc1-xL, Myc и MCL-1, что обеспечивает значительную резистентность к естественным апоптотическим сигналам и вводимым химиотерапевтическим агентам. Особенно следует отметить, что STAT5 был определен как ключевой регулятор при развитии и прогрессировании острого миелоидного (ОМЛ) и острого лимфобластного лейкоза (ОЛЛ; Gouilleux-Gruart, V., et al. Leukemia and Lymphoma 1997, 28, 83-88; Gouilleux-Gruart, V., et al. Blood 1996, 87, 1692-1697; Weber-Nordt, R. M., et al. Blood 1996, 88, 809-816). Кроме того, было показано, что ингибиторы предшествующих активаторов STAT5 (таких как JA и FLT3) обладают перспективными противораковыми свойствами (Pardanani, A., et al. Leukemia 2011, 25, 218-225; Quintas-Cardama, A., et al. Nature Reviews Drug Discovery 2011, 10, 127-140).
Следует отметить, что медицинские преимущества ингибирования STAT3/5 не ограничиваются применением к различным формам рака, описанным в настоящей заявке, в которых указанные мишени являются конститутивно активированными, и подходят для применения для лечения других состояний, в которых указанные пути играют ключевую роль, включая, но, не ограничиваясь ими, аутоиммунные нарушения (Harris, T.J.; et al Immunol. (2007) 179(7): 4313-4317), воспаление, связанное с артритом (Miyamoto. T, et al, Arthritis Research & Therapy (2012), 14(Suppl 1):P43), воспалительное заболевание кишечника (IBD) (World J GastRoenterol.(2008) 14(33): 5110-5114.), диабет (Mashili, F.; et al (2013) Diabetes 62(2), 457-465), синдром раздраженного кишечника (IBS); почечную болезнь (Weimbs, T., (2013) JAK-STAT, 2(2), 0-1) и трансплантацию органов (Debonera, F.; et al (2001) J. Surg. Res. 96(2), 289-295).
Несмотря на успехи в разработках лекарственных средств, направленных на определение ингибиторов активности белка STAT, все еще существует нехватка соединений, которые являются сильнодействующими, эффективными и селективными активаторами STAT3 и STAT5, а также являются эффективными при лечении рака и других заболеваний, связанных с дисфункцией STAT3, STAT5 или обоих указанных белков, и заболеваний, в которых задействован один из STAT3 и STAT5 или оба указанных белка. Кроме того, все еще существует потребность в оптимизации эффективности и снижении лабильности фармакокинетических свойств существующих соединений. Указанные и другие потребности удовлетворяются посредством настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с целью(ями) настоящего изобретения, реализованными и подробно описанными в настоящей заявке, в одном из аспектов настоящее изобретение относится к соединениям, подходящим для применения в качестве ингибиторов STAT3.
В другом аспекте описаны соединения и продукты способов получения или их фармацевтически приемлемые соли, гидраты, сольваты или полиморфы являющиеся модуляторами активности STAT3 и/или STAT5, способы получения указанных соединений, фармацевтические композиции, содержащие указанные соединения, и способы лечения расстройств, связанных с нарушением активности STAT3, с применением указанных соединений.
В другом аспекте настоящее изобретение относится к соединениям, которые связываются с белком STAT3 и отрицательно модулируют активность STAT3.
В другом аспекте настоящее изобретение относится к соединениям, которые связываются с белком STAT5 и отрицательно модулируют активность STAT5.
Также описаны фармацевтические композиции, содержащие терапевтически эффективное количество описанных соединений и фармацевтически приемлемого носителя.
Описаны способы лечения расстройства, связанного с нарушением активности STAT3/STAT5, предпочтительно гиперактивности или сверхэкспрессии, у млекопитающих, включающие стадию введения млекопитающему терапевтически эффективного количества описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
Также описаны способы ингибирования активности STAT3 и/или STAT5 у млекопитающих, включающие стадию введения млекопитающему терапевтически эффективного количества по меньшей мере одного из описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
Также описаны способы ингибирования активности STAT3 и/или STAT5 по меньшей мере в одной клетке, включающие стадию приведения по меньшей мере одной клетки в контакт с эффективным количеством по меньшей мере одного из описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
Также описаны способы применения по меньшей мере одного из описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
В одном из аспектов предложено соединение формулы I, как определено в настоящей заявке:
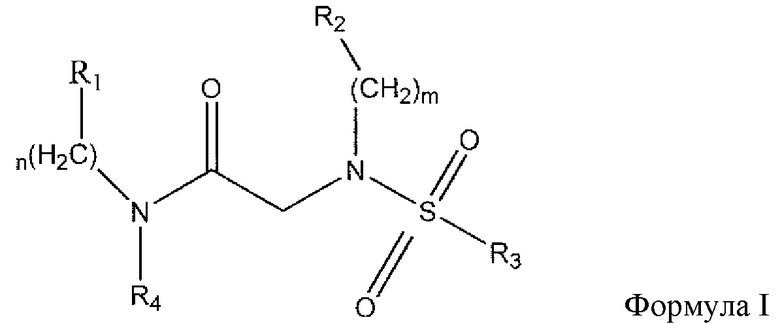 ,
,
или его фармацевтически приемлемая соль, сольват или пролекарство, где каждый из m и n независимо представляет собой целое число от 0 до 3;
R1 выбран из A1, A2, -(A1)-(A2), -(A2)-(A3), -(A3)-(A2), -(A3)-(A4), -(A5)-(A1)-(A7), -(A5)-(A2)- (A8), -(A5)-(A3)-(A7) и -(A5)-(A6)-L-(A7); A1 представляет собой C3-6 циклоалкил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R5, (C=O)OR5 и (C=O)NHR5; A2 представляет собой C3-6 циклоалкил или гетероциклоалкил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R6, (C=O)OR6 и (C=O)NHR6; A3 представляет собой арил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R7, (C=O)OR7 и (C=O)NHR7; A4 представляет собой арил, замещенный 1-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R8, (C=O)OR8 и (C=O)NHR8; A5 выбран из C3-6 циклоалкила, C3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СО2Н, (C=O)R9, (C=O)OR9 и (C=O)NHR9; А6 выбран из С3-6 циклоалкила, С3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СО2Н, (C=O)R10, (C=O)OR10 и (C=O)NHR10; А7 выбран из С3-6 циклоалкила, С3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1- б галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СO2Н, (C=O)R11, (C=O)OR11 и (C=O)NHR11; А8 выбран из С3-6 циклоалкила, С3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СO2Н, (C=O)R12, (C=0)0R12 и (C=O)NHR12; L выбран из -(С=O)- и -SO2-; R2 выбран из С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С1-6 галогеналкила, С2-6 галогеналкенила, С2-6 галогеналкинила, С1-6 полигалогеналкила, С2-6 полигалогеналкенила, С2-6 полигалогеналкинила; или R2 представляет собой арил, замещенный 0-5 группами, независимо выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)OR12 и (C=O)NHR12; R3 представляет собой арил, замещенный 0-5 группами, независимо выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 алкила, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси и (С1-6)-алк-(С1-6)-полигалогеналкокси; каждый из R5, R6, R7, R8, R9, R10, R11 и R11 независимо выбран из водорода, C1-6 алкила, C1-6 галогеналкила и C1-6 полигалогеналкила; или фармацевтически приемлемая соль, гидрат, сольват или полиморф указанного соединения,
где R2 выбран из группы, состоящей из:
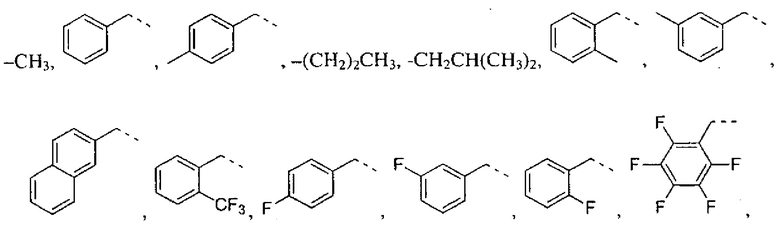
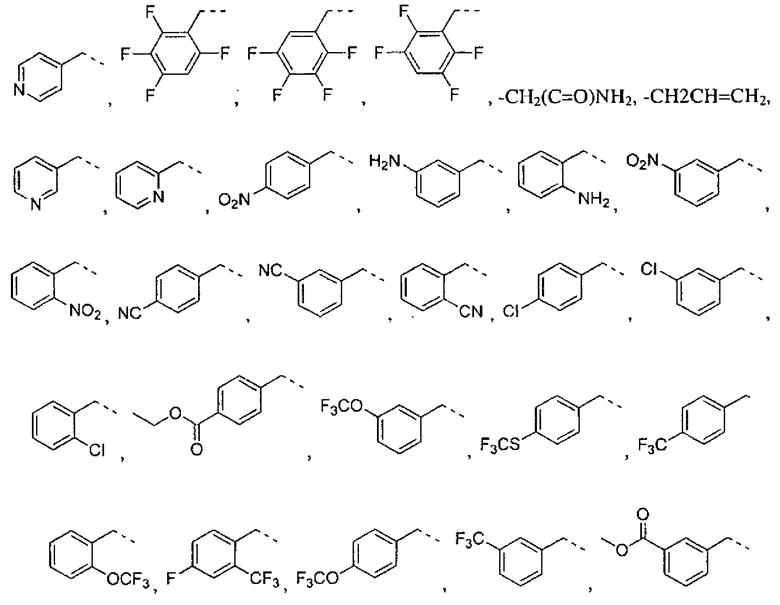
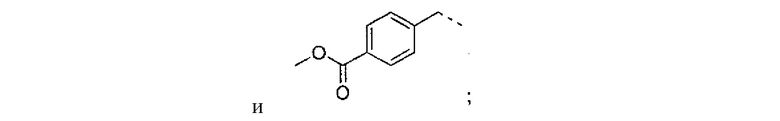
где R4 представляет собой структуру, представленную формулой:
 ,
,
где R4 представляет собой структуру, представленную формулой:
 ,
,
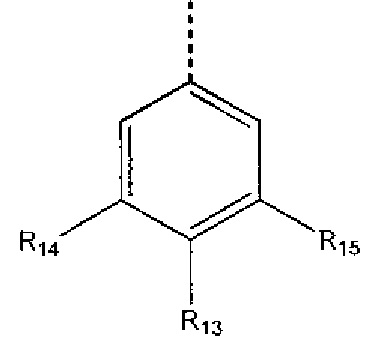
где R13 выбран из группы, состоящей из -OH, -COR16, -CN, -CH2PO(OH)2, -СН2Р(O)3(CH2СН3)2, -NO2, -NHR17 и 1Н-тетразола;
R16 выбран из группы, состоящей из -OH, -O-C(1-2)алкила, -OCH2OC(O)CH3, -OCH2OС(O)-трет-бутила и -NHOH,
R17 выбран из группы, состоящей из -H, -C(O)C(O)CH2CH3, -C(O)C(O)OH и -C(O)CH2-1H-тетразола,
R14 представляет собой -H, или, если R13 представляет собой -COR16, и R16 представляет собой OH, R14 представляет собой -F, -OС(O)СН3; и
R15 представляет собой Н, или, если R13 представляет собой -COR16, R16 представляет собой OH, и R14 представляет собой Н, R15 представляет собой -F, - OС(O)СН3;
R13 представляет собой -Н, если R14 представляет собой -OH, или оба из R14 и R15 представляют собой -COOH.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и эффективное количество описанного соединения или его фармацевтически приемлемой соли, гидрата, сольвата или полиморфа.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение, описанное в настоящей заявке, или его фармацевтически приемлемую соль, сольват или пролекарство и приемлемое вспомогательное вещество.
В другом аспекте настоящего изобретения предложен способ ингибирования активности STAT3 и/или STAT5, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства.
В другом аспекте настоящего изобретения предложен способ лечения или предотвращения рака, связанного с нарушением активности STAT3/STAT5 (предпочтительно их гиперактивности или сверхэкспрессии), включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства. В альтернативном аспекте рак выбран из солидных или гематологических опухолей. В другом аспекте рак представляет собой рак, в котором задействован активированный STAT3 и/или STAT5. Такой рак может представлять собой, например, рак молочной железы, печени, простаты, крови, кожи, головы, шеи, глиобластому или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства при получении лекарственных средств для ингибирования активности STAT3 и/или STAT5.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства при получении лекарственных средств для лечения или предотвращения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства для ингибирования активности STAT3 и/или STAT5.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства для лечения или предотвращения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз, связанного с нарушением активности STAT3/STAT5, такого как, рак молочной железы, простаты или головного мозга.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, описанная в настоящей заявке, для применения для ингибирования активности STAT3 и/или STAT5.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, описанная в настоящей заявке, для применения для лечения или предотвращения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
Также описаны способы получения лекарственных средств, включающие объединение по меньшей мере одного из описанных соединений или по меньшей мере одного из описанных продуктов с фармацевтически приемлемым носителем или разбавителем. В другом аспекте настоящее изобретение относится к применению описанного соединения при получении лекарственных средств для лечения расстройства, связанного с нарушением активности STAT3/STAT5 (таким как гиперактивность или сверхэкспрессия). В другом аспекте настоящее изобретение относится к применению описанного соединения при получении лекарственных средств для лечения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
Дополнительные преимущества настоящего изобретения частично представлены в описании ниже и частично являются очевидными из описания или могут быть изучены при реализации настоящего изобретения на практике. Преимущества настоящего изобретения реализованы и достигнуты при помощи элементов и комбинаций, указанных в прилагаемой формуле изобретения. Следует понимать, что общее описание, представленное выше, и подробное описание, представленное ниже, являются только иллюстративными и пояснительными и не ограничивают настоящее изобретение.
Настоящее изобретение может быть легче понято при помощи подробного описания изобретения, представленного ниже, и включенных в него примеров.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1А приведен график, на котором сравнивают соединение 1 и соединения 22, 31, 32 и 33 из библиотеки BTSC30M;
на ФИГ. 1В приведена таблица, в которой показаны значения IC50 соединений, исследуемых на ФИГ. 1А, в отношении BTSC, 25EF, 67EF, 73E, 84EF и 127EF;
на ФИГ. 2A показана нечувствительность различных соединений в отношении ряда киназ и структурных белков;
на ФИГ. 2B проиллюстрированы кривые ППР, на которых изображена аффинность связывания лучших соединений и белков STAT3/5;
на ФИГ. 3 проиллюстрирована древовидная диаграмма, на которой показано, что соединение 27 не ингибирует ни одну из 101 исследуемых киназ, где факт ингибирования определяют как ингибирование >35%.
на ФИГ. 4 показан вестерн-блот анализ трех соединений с лучшей активностью в отношении BTSC 147M и их сравнение с хорошо изученным ингибитором Jak2 WP1066 в концентрации 1 мкМ в отношении BTSCM 73M;
на ФИГ. 5 проиллюстрированы определенные значения IC50 контроля (стауроспорина) в отношении выбранных киназ;
на ФИГ. 6 приведена таблица, в которой показаны концентрации киназ в элюатах, измеренные путем кПЦР;
на ФИГ. 7 приведена калибровочная кривая, полученная с использованием 10 нМ Fam-pYLPQTV и разбавленных белков STAT3 и STAT1 (от 5,0 мкл до 2,4 нМ) с конечной 10% концентрацией в ДМСО;
на ФИГ. 8 проиллюстрирован скрининг соединений 22, 31, 32 и 33 в отношении различных BTSC, где для каждого соединения скрининг проводили два раза в различных концентрациях;
на ФИГ. 9 проиллюстрировано выживание клеток поджелудочной железы 10.05 пациентов, которым вводили ингибиторы STAT3;
на ФИГ. 10 проиллюстрировано действие предварительной обработки ингибитором STAT3 и последующей стимуляции цитокином IL6 в течение 15 минут на клетки пациента с Pa03C с низким пассажем;
на ФИГ. 11 проиллюстрировано действие ингибитора STAT3 31 на клеточную линию пациента с раком поджелудочной железы (Pa03C) с низким пассажем, помещенную в 96-луночный планшет с покрытием 1% очищенного агара в среду, содержащую 3% матригеля, с использованием ассоциированных с раком фибробластов и без них;
на ФИГ. 12 показано, что соединение 31 с высокой активностью снижает жизнеспособность в 12 из 15 различных опухолевых клеточных линий множественной миеломы, что определено путем исследования MTT, со значениями ED50 в диапазоне 2-6 мкМ;
на ФИГ. 13 показано окрашивание гематоксилином/эозином - окрашивание сплошных гиперклеточных участков опухоли (белый цвет) гематоксилином в клетках BT73 без использования (A) и с использованием (B) ингибитора 31;
на ФИГ. 14 проиллюстрировано действие соединения 31 на снижение экспрессии pSTAT у мышей с ортотопическим ксенотрансплантатом клеток рака мозга BT73;
на ФИГ. 15 проиллюстрировано действие соединения 31 на снижение пролиферации опухолевых клеток мозга BT73;
на ФИГ. 16 проиллюстрирован повышенный апоптоз (окрашивание TUNEL) у мышей, которым вводили соединение 31;
На ФИГ. 17 показана концентрация соединения 31 в мозге после введения различных дозировок (10 мг/кг и 25 мг/кг), определенная путем ЖХМС;
на ФИГ. 18 показана концентрация соединения 31 в мозге, определенная путем ЖХМС;
на ФИГ. 19 показана концентрация соединения 32 в мозге, определенная путем ЖХМС;
На ФИГ. 20 показана флуоресценция клеточной линии 2071 NIC после обработки соединением 31 (SH-04-54) или BP1-102; и
На ФИГ. 21 показана флуоресценция различных клеточных линий NIC после обработки соединением 31 (SH-04-54) или BP1-102.
ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ
Следует понимать, что, если не указано иное, соединения, композиции, изделия, системы, устройства и/или способы, раскрытые и описанные в настоящей заявке, не ограничиваются конкретными способами синтеза и конкретными реагентами, т.е. могут изменяться. Также следует понимать, что терминология, применяемая в настоящей заявке, используется с целью описания конкретных аспектов и не является ограничивающей. Хотя при тестировании или реализации на практике настоящего изобретении можно использовать любые способы и материалы, аналогичные или эквивалентные описанным в настоящей заявке, ниже описаны способы и материалы, приведенные в качестве примеров.
Все публикации, упомянутые в настоящем изобретении, включены в настоящую заявку посредством ссылки для раскрытия и описания способов и/или материалов с применением указанных публикаций. Описание публикаций, обсуждаемых в настоящей заявке, приведено только в том объеме, который они имели на момент подачи настоящей заявки. Никакую информацию, приведенную в настоящей заявке, не следует считать признанием того, что настоящее изобретение не может быть датировано задним числом на основании предшествующего изобретения. Кроме того, даты публикации, приведенные в настоящей заявке, могут отличаться от фактических дат публикации, которые могут требовать независимого подтверждения.
Номенклатура соединений, включая органические соединения, применяемая в настоящей заявке, основана на использовании тривиальных названий, рекомендаций ИЮПАК (Международный союз теоретической и прикладной химии), IUBMB (Международный союз биохимии и молекулярной биологии) или CAS (Химическая реферативная служба). В случае наличия одной или более стереохимических отличительных особенностей для обозначения стереохимического старшинства, E/Z номенклатуры и т.п. можно использовать правила Кана-Ингольда-Прелога. Если указано название соединения, специалист в данной области может легко установить его структуру при помощи системного подхода, заключающегося в применении правил номенклатуры к составным фрагментам структуры соединения, или с применением коммерчески доступного программного обеспечения, такого как CHEMDRAW™ (Cambridgesoft Corporation, U.S.A.)
Формы единственного числа «a», «an» и «the», применяемые в настоящем описании и прилагаемой формуле изобретения, включают формы множественного числа, если из контекста явно не следует иное. Таким образом, например, термины «функциональная группа», «алкил» или «остаток» включают смеси двух или более указанных функциональных групп, алкилов или остатков и т.п.
В настоящей заявке диапазоны могут быть выражены в виде указания от «примерно» одного конкретного значения и/или до «примерно» другого конкретного значения. Если указан такой диапазон, другой аспект включает от одного конкретного значения и/или до другого конкретного значения. Аналогично, следует понимать, что, если значения указаны в форме приближений при помощи антецедента «примерно», конкретное значение образует другой аспект. Также следует понимать, что оба концевых значения каждого из диапазонов являются значимыми и независимыми от другого концевого значения. Также следует понимать, что в настоящей заявке описано множество значений, и что каждое из значений также описывается в настоящей заявке в форме «примерно». Например, если описывается значение «10», также описывается «примерно 10». Также следует понимать, что включается каждое значение между двумя конкретными значениями. Например, если описывается диапазон от 10 до 15, то также описываются 11, 12, 13 и 14.
Указания в описании и прилагаемой формуле изобретения на массовые доли конкретного элемента или компонента в композиции означают массовое отношение между элементом или компонентом и любыми другими элементами или компонентами в композиции или изделии, для которого указаны массовые доли. Таким образом, в соединении, содержащем 2 массовые доли компонента X и 5 массовых долей компонента Y, X и Y содержатся в массовом отношении 2:5 и представлены в указанном отношении вне зависимости от наличия в соединении других дополнительных компонентов.
Если не указано иное, массовое процентное содержание (масс.%) компонента указано в пересчете на общую массу состава или композиции, в которой содержится компонент.
Термины «возможный» или «возможно», применяемые в настоящей заявке, означают, что описываемое событие или условие может происходить и может не происходить, и что описание включает случаи, когда указанное событие или условие происходит, и случаи, когда указанное событие или условие не происходит.
Используемые в настоящем описании термины «STAT3», «сигнальный трансдуктор и активатор транскрипции 3 (ответ в острой фазе)» и «сигнальный трансдуктор и активатор транскрипции 3», которые можно применять взаимозаменяемо, относятся к фактору транскрипции, кодируемому геном, который у человека обозначен как ген STAT3, который имеет локус генной карты 17q21 и описан цитогенетической полосой EntRez Gene: 17q21.31; цитогенетической полосой Ensembl: 17q21.2; и цитогенетической полосой HGNC: 17q21. Термин STAT3 относится к белку человека, содержащему 770 аминокислот и имеющему молекулярную массу примерно 88068 Да. Термин включает сплайсированные изоформы или варианты, а также включает белки, которые имеют альтернативные обозначения: APRF, MGC 16063, фактор ответа острой фазы, ДНК-связывающий белок APRF, HIES, используемые специалистами в данной области для описания белка, кодируемого геном STAT3 человека. Термин также включает ортологи или гомологи указанного гена, содержащиеся у животных, отличных от человека.
Термин «STAT5», применяемый в настоящей заявке, относится к STAT5A и/или STAT5B. Если требуется конкретное указание на STAT5A или STAT5B, в настоящей заявке используется конкретный термин.
Используемые в настоящем описании термины «STAT5A» и «сигнальный трансдуктор и активатор транскрипции 5A», которые можно применять взаимозаменяемо, относятся к фактору транскрипции, кодируемому геном, который у человека обозначен как ген STAT5A, который имеет локус генной карты, описанный цитогенетической полосой EntRez Gene: 17ql 1.2; цитогенетической полосой Ensembl: 17q21.2; и цитогенетической полосой HGNC: 17ql 1.2. Термин STAT5A относится к белку человека, содержащему 794 аминокислоты и имеющему молекулярную массу примерно 90647 Да. Термин включает сплайсированные изоформы или варианты, а также включает белки, которые имеют альтернативные обозначения, такие как MGF и STAT5, используемые специалистами в данной области для описания белка, кодируемого геном STAT5A человека. Термин также включает ортологи или гомологи указанного гена, содержащиеся у животных, отличных от человека.
Используемые в настоящем описании термины «STAT5B» и «сигнальный трансдуктор и активатор транскрипции B», которые можно применять взаимозаменяемо, относятся к фактору транскрипции, кодируемому геном, который у человека обозначен как ген STAT5B, который имеет локус генной карты, описанный цитогенетической полосой EntRez Gene: 17ql 1.2; цитогенетической полосой Ensembl: 17q21.2; и цитогенетической полосой HGNC: 17ql 1.2. Термин STAT5A относится к белку человека, содержащему 787 аминокислоты и имеющему молекулярную массу примерно 89866 Да. Термин включает сплайсированные изоформы или варианты, а также включает белки, которые имеют альтернативные обозначения, такие как фактор транскрипции STAT5B, используемые специалистами в данной области для описания белка, кодируемого геном STAT5A человека. Термин также включает ортологи или гомологи указанного гена, содержащиеся у животных, отличных от человека.
Термин «субъект», применяемый в настоящей заявке, относится к позвоночным, таким как млекопитающие, рыбам, птицам, рептилиям или амфибиям. Таким образом, субъект согласно способам, описанным в настоящей заявке, может представлять собой человека, нечеловекообразного примата, лошадь, свинью, кролика, собаку, овцу, козу, корову, кошку, морскую свинку или грызуна. Термин не указывает на конкретный возраст или пол. В одном из аспектов субъект является млекопитающим. Термин «пациент» в настоящей заявке относится к субъекту, страдающему от рака, предпочтительно от глиобластомы. Термин «пациент» включает человека и ветеринарных субъектов.
Термин «лечение», применяемый в настоящей заявке, относится к медицинской терапии пациента с целью излечения, облегчения, стабилизации или предотвращения заболевания, патологического состояния или расстройства. Указанный термин включает активное лечение, т.е. лечение, направленное на улучшение при заболевании, патологическом состоянии или расстройстве, и казуальное лечение, т.е. лечение, направленное на устранение причины, связанной с заболеванием, патологическим состоянием или расстройством. Кроме того, указанный термин включает паллиативное лечение, т.е. лечение, предназначенное, главным образом, для облегчения симптомов, а не для излечения заболевания, патологического состояния или расстройства; профилактическое лечение, т.е. лечение, направленное на минимизирование или частичное или полное ингибирование развития заболевания, патологического состояния или расстройства; и поддерживающее лечение, т.е. лечение, применяемое в дополнение к другому виду терапии, направленное на улучшение при заболевании, патологическом состоянии или расстройстве. В различных аспектах термин охватывает любое лечение субъекта, в том числе млекопитающего (например, человека), и включает: (i) предотвращение возникновения заболевания у субъекта, который может иметь предрасположенность к заболеванию, но у которого заболевание ранее не диагностировалось; (ii) ингибирование заболевания, т.е. прекращение его развития; или (iii) облегчение заболевания, т.е. обеспечение регрессии заболевания. В одном из аспектов субъект представляет собой млекопитающее, такое как примат, и в другом аспекте субъект представляет собой человека. Термин «субъект» также включает домашних животных (например, кошек, собак и т.п.), сельскохозяйственных животных (например, крупный рогатый скот, лошадей, свиней, овец, коз и т.п.) и лабораторных животных (например, мышей, кроликов, крыс, морских свинок, плодовых мушек и т.п.).
Термин «предотвращать» или «предотвращение», применяемый в настоящей заявке, относится к препятствованию, устранению, избеганию, упреждению, прекращению или затруднению происхождения чего-либо, в частности предварительных действий. Следует понимать, что, если не указано иное, в случае применения в настоящей заявке одного из терминов «снижать», «ингибировать» или «предотвращать» также подразумевается использование двух остальных терминов.
Термин «диагностирование», применяемый в настоящей заявке, означает подвергание физическому обследованию специалистом, например, врачом, и установление наличия состояния, которое можно диагностировать или лечить соединениями, композициями или способами, описанными в настоящей заявке. Например, «диагностирование расстройства, которое можно лечить путем ингибирования STAT3» означает подвергание физическому обследованию специалистом, например, врачом, и установление наличия состояния, которое можно диагностировать или лечить соединениями или композициями, способными ингибировать или отрицательно модулировать STAT3. Также, например, «диагностирование необходимости ингибирования STAT3» означает подвергание физическому обследованию специалистом, например, врачом, и установление наличия состояния, характеризующегося нарушением активности STAT3. Такой диагноз может относиться к расстройству, такому как онкологическое расстройство или заболевание, рак и/или расстройство неконтролируемой пролиферации клеток и т.п., как описано в настоящей заявке. Например, термин «диагностирование необходимости ингибирования активности STAT3» относится к физическому обследованию специалистом, например, врачом, и установлению наличия состояния, которое можно диагностировать или лечить путем ингибирования активности STAT3. Например, «диагностирование необходимости модуляции активности STAT3» означает подвергание физическому обследованию специалистом, например, врачом, и установление наличия состояния, которое можно диагностировать или лечить путем модуляции активности STAT3, например, отрицательной модуляции. Например, «диагностирование необходимости лечения одного или более расстройств неконтролируемой пролиферации клеток, связанных с нарушением активности STAT3» означает подвергание физическому обследованию специалистом, например, врачом, и установление наличия одного или более расстройств неконтролируемой пролиферации клеток, например, рака, связанных с нарушением активности STAT3.
Выражение «рак, зависимый от STAT3 или STAT5», применяемое в настоящей заявке, относится к раку, в котором задействован конститутивно активированный STAT3 или STAT5.
Фраза «установление необходимости лечения расстройства» или т.п., применяемая в настоящей заявке, относится к выбору субъекта на основе необходимости лечения расстройства. Например, необходимость лечения расстройства (например, расстройства, связанного с активностью STAT3) у субъекта может иметь установлена на основе более раннего диагноза, поставленного специалистом, а затем субъект можно подвергать лечению расстройства. Следует понимать, что в одном из аспектов установление необходимости лечения может быть осуществлено специалистом, отличным от специалиста, ставившего диагноз. Также следует понимать, что в другом аспекте введение может быть осуществлено специалистом, который будет проводить введение и в дальнейшем.
Термин «введение», применяемый в настоящей заявке, относится к любому способу, обеспечивающему доставку фармацевтического препарата субъекту. Указанные способы хорошо известны специалистам в данной области и включают, но не ограничиваются ими, пероральное введение, трансдермальное введение, введение путем ингаляции, назальное введение, местное введение, интравагинальное введение, офтальмологическое введение, интрадуральное введение, интрацеребральное введение, ректальное введение, сублингвальное введение, трансбуккальное введение и парентеральное введение, включая введение путем инъекции, такие как внутривенное введение, внутриартериальное введение, внутримышечное введение и подкожное введение. Введение может быть непрерывным или прерывистым. В различных аспектах препарат можно вводить терапевтически; т.е. вводить для лечения существующего расстройства или состояния. В других аспектах препарат можно вводить профилактически; т.е. вводить для предотвращения заболевания или состояния.
Термин «приведение в контакт», применяемый в настоящей заявке, относится к объединению описанного соединения и клетки, белка-мишени STAT3 или другого биологического объекта таким образом, что соединение оказывается способным воздействовать на активность мишени (например, сплайсосомы, клетки и т.п.) напрямую, т.е. путем взаимодействия с самой мишенью, или опосредованно, т.е. путем взаимодействия с другой молекулой, кофактором, фактором или белком, от которых зависит активность мишени.
Термины «эффективное количество» и «количество, эффективное», применяемые в настоящей заявке, относятся к количеству, которое является достаточным для достижения целевого результата или воздействия на нежелательное состояние. Например, «терапевтически эффективное количество» относится к количеству, которое является достаточным для достижения целевого терапевтического результата или воздействия на нежелательные симптомы, но, как правило, является недостаточным для проявления нежелательных побочных эффектов. Конкретная терапевтически эффективная дозировка для любого конкретного пациента зависит от различных факторов, включая расстройство, подвергающееся лечению, и тяжесть расстройства; конкретную применяемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения; способ введения; скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные средства, применяемые в комбинации или совместно с конкретным применяемым соединением, и другие факторы, хорошо известные в области медицины. Например, специалист в данной области может начинать дозирование соединения с уровней, которые меньше, чем требуемые для достижения целевого терапевтического эффекта, и постепенно увеличивать дозировку до достижения целевого эффекта. При желании эффективная суточная доза может быть разделена на несколько доз для удобства введения. Следовательно, разовые дозы могут содержать суточную дозу композиции или количества, суммарно составляющие суточную дозу. Лечащий врач может регулировать дозировку в случае наличия противопоказаний. Дозировку можно варьировать и вводить в виде одной или более ежедневных доз в течение одного или нескольких дней. Рекомендации по соответствующим дозировкам для конкретных классов фармацевтических препаратов можно найти в литературе. В различных аспектах препарат можно вводить в «профилактически эффективном количестве»; т.е. в количестве, эффективном для предотвращения заболевания или состояния.
«EC50», применяемый в настоящей заявке, относится к концентрации вещества (например, соединения или лекарственного средства), которая требуется для 50% эффекта действия агониста или стимулятора биологического процесса или компонента процесса, включая белок, субъединицу, органеллу, рибонуклеопротеин и т.п. В одном из аспектов EC50 может относиться к концентрации вещества, требуемой для 50% эффекта действия агониста или стимулятора in vivo, как далее определено в настоящей заявке. В другом аспекте EC50 относится к концентрации агониста или стимулятора, вызывающей ответ, равный половине максимального ответа.
«IC50», применяемый в настоящей заявке, относится к концентрации вещества (например, соединения или лекарственного средства), которая требуется для 50% ингибирования биологического процесса или компонента процесса, включая белок, субъединицу, органеллу, рибонуклеопротеин и т.п. В некоторых случаях IC50 может относиться к концентрации вещества в плазме, требуемой для 50% ингибирования in vivo, как далее определено в настоящей заявке. Как правило, IC50 относится к полумаксимальной (50%) ингибирующей концентрации (IC) вещества, требуемой для ингибирования процесса или активности in vitRo.
«STAT3 IC50», применяемый в настоящей заявке, относится к концентрации вещества (например, соединения или лекарственного средства), которая требуется для 50% ингибирования активности STAT3. В некоторых случаях IC50 может относиться к концентрации вещества в плазме, требуемой для 50% ингибирования активности или процесса in vivo, как далее определено в настоящей заявке, например, роста опухоли у животного или человека. В других случаях STAT3 IC50 относится к полумаксимальной (50%) ингибирующей концентрации (IC) вещества или соединения, требуемой для ингибирования процесса или активности in vitRo context, например, бесклеточного или клеточного исследования. Например, STAT3 IC50 может относиться к полумаксимальной концентрации, требуемой для ингибирования роста клеток. Как описано ниже, ответ измеряют в клеточных линиях с аномальной активностью STAT3. Альтернативно, ответ измеряют в клеточных линиях с постоянно активным STAT3. Ответ можно определять с применением клеточной линии, полученной на основе рака молочной железы человека, рака поджелудочной железы человека и рака простаты человека. Например, ответ можно измерять с применением клеточной линии, выбранной из MDA-MB-231, Panc-1 и DU-145. Также можно применять клеточные линии, трансфицированные специфическими генами. Например, ответ можно измерять с применением клеточной линии, трансфицированной v-Src. Альтернативно, клеточная линия, трансфицированная v-Src, представляет собой постоянную клеточную линию. В некоторых случаях STAT3 IC50 представляет собой полумаксимальную концентрацию, требуемую для ингибирования активности STAT3 в бесклеточном исследовании, например, исследовании методом сдвига электрофоретической подвижности («EMSA»). Альтернативно, STAT3 IC50 представляет собой полумаксимальную концентрацию, требуемую для ингибирования роста клеток, жизнеспособности клеток или активности миграции клеток.
Используемый в настоящем описании термин "STAT3 Kd" относится к аффинности связывания соединения или вещества к STAT3, определенной в исследовании in vitRo. Значение Kd вещества в отношении белка можно определять при помощи различных способов, известных специалистам в данной области, например, путем равновесного диализа, аналитического ультрацентрифугирования и анализа плазмонного поверхностного резонанса ("ППР"). Используемый в настоящем описании термин STAT3 Kd обычно определяют как отношение констант скорости ассоциации и диссоциации, определенных при помощи анализа ППР с использованием очищенного белка STAT3.
Используемый в настоящем описании термин "STAT3 Ki" относится к константе ингибирования замещения зонда STAT3 SH2 в белке STAT3. Например, STAT3 SH2 может представлять собой GpYLPQTV, содержащий флуоресцентную метку. Согласно настоящему описанию флуоресцентная метка представляет собой 5-карбоксифлуоресцеин, хотя можно использовать и другие флуоресцентные зонды, которые специалисты в данной области относят к подходящим и удобным.
Термин «фармацевтически приемлемый» описывает материал, который не является нежелательным с биологической или другой точки зрения, т.е. не приводит к проявлению нежелательных биологических процессов в недопустимых уровнях или к нежелательным взаимодействиям.
Термин «производное», применяемый в настоящей заявке, относится к соединению, имеющему структуру, полученную из структуры исходного соединения (например, соединения, описанного в настоящей заявке), и к соединениям, структуры которых достаточно схожи со структурами соединений, описанных в настоящей заявке, что дает специалистам в данной области основание ожидать от указанных соединений демонстрации свойств, таких же или схожих со свойствами заявленных соединений, или придания, в качестве соединения-предшественника, свойств, таких же или схожих со свойствами заявленных соединений. Примеры производных включают соли, сложные эфиры, амиды, соли сложных эфиров или амидов и N-оксиды исходных соединений.
Термин «фармацевтически приемлемый носитель», применяемый в настоящей заявке, относится к стерильным водным или неводным растворам, дисперсиям, суспензиям или эмульсиям, а также стерильным порошкам для восстановления в растворы или дисперсии для инъекций перед применением. Примеры подходящих водных и неводных веществ-носителей, разбавителей, растворителей или носителей, включая воду, этанол, многоатомные спирты (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), карбоксиметилцеллюлозу и подходящие смеси указанных соединений, растительные масла (такие как оливковое масло) и органические сложные эфиры, подходящие для инъекций, такие как этилолеат. Требуемую текучесть можно поддерживать, например, путем применения материалов покрытия, таких как лецитин, путем поддерживания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Указанные композиции также могут содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергаторы. Предотвращение действия микроорганизмов можно обеспечивать путем добавления различных антибактериальных и противогрибковых агентов, таких как парабен, хлорбутанол, фенол, сорбиновая кислота и т.п. Также может быть желательно добавлять изотонические агенты, такие как сахара, хлорид натрия и т.п. Пролонгированное всасывание фармацевтической формы для инъекции можно обеспечивать путем добавления агентов, таких как моностеарат алюминия и желатин, которые замедляют всасывание. Депо-формы для инъекций получают путем формования микроинкапсулированных матриц лекарственного средства в биоразлагаемые полимеры, такие как полилактид-полигликолид, поли(ортоэфиры) и поли(ангидриды). В зависимости от соотношения лекарственного средства и полимера и природы конкретного применяемого полимера можно контролировать скорость высвобождения лекарственного средства. Составы в форме депо для инъекций также получают путем введения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма. Составы для инъекций могут быть стерилизованы, например, путем фильтрования через фильтр, удерживающий бактерии, или путем добавления стерилизующих агентов в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной среде для инъекций перед применением. Подходящие инертные вещества-носители могут включать сахара, такие как лактоза. Желательно, чтобы по меньшей мере 95% по массе частиц активного ингредиента имели эффективный размер частиц в диапазоне от 0,01 до 10 микрометров.
Термин «остатки химических частиц», применяемый в настоящем описании и в прилагаемой формуле изобретения, относится к фрагменту, входящему в конечный продукт конкретной схемы реакции, состав на основе продукта или химическую продукцию, независимо от того, получен ли фрагмент фактически из химических частиц.
Термин «замещенный», применяемый в настоящей заявке, включает все допустимые заместители органических соединений. В широком смысле допустимые заместители включают алициклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Иллюстративные заместители включают, например, заместители, описанные ниже. Допустимый заместитель может быть один или несколько, и они могут быть одинаковыми или различными для соответствующих органических соединений. В настоящем описании гетероатомы, такие как азот, могут иметь водородные и/или любые другие допустимые заместители органических соединений, описанные в настоящей заявке, соответствующие валентностям гетероатомов. Настоящее описание не ограничивается допустимыми заместителями органических соединений в какой-либо степени. Кроме того, термины «замещение» или «замещенный» подразумевают, что указанное замещение находится в соответствии с допустимой валентностью замещенного атома и заместителя, и замещение приводит к образованию стабильного соединения, например, соединения, которое не подвергается самопроизвольному превращению, например, путем перегруппировки, циклизации, отщепления и т.п. Также предполагается, что в некоторых аспектах, если явно не указано иное, отдельные заместители могут быть дополнительно замещены (т.е. могут являться дополнительно замещенными или незамещенными).
При определении различных терминов «A1», «A2», «А3» и «А4» используются в настоящей заявке в качестве общих символов для представления различных конкретных заместителей. Указанные символы могут представлять собой любые заместители, не ограничиваясь заместителями, описанными в настоящей заявке, и в одном случае они могут представлять собой одни конкретные заместители, а в другом случае они могут представлять собой другие заместители.
Термин «алкил», применяемый в настоящей заявке, представляет собой разветвленную или неразветвленную насыщенную углеводородную группу, содержащую от 1 до 24 атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, изобутил, н-пентил, изопентил, изопентил, неопентил, гексил, гептил, октил, нонил, децил, додецил, тетрадецил, гексадецил, эйкозил, тетракозил и т.п. Алкильная группа может быть циклической или ациклической. Алкильная группа может быть разветвленной или неразветвленной. Также алкильная группа может быть замещена одной или более группами, включая, но, не ограничиваясь ими, алкильную, циклоалкильную, алкокси-, амино-, простую эфирную, галогенидную, гидроксильную, нитро-, силильную, сульфоксо- или тиольную группы, описанные в настоящей заявке. Группа «низшего алкила» представляет собой алкильную группу, содержащую от одного до шести (например, от одного до четырех) атомов углерода.
В настоящей заявке «алкил» обычно относится как к незамещенным алкильным группам, так и к замещенным алкильным группам; тем не менее, термин «замещенные алкильные группы» отдельно используется в настоящей заявке для обозначения наличия конкретного(ых) заместителя(ей) в алкильной группе. Например, термин «галогенированный алкил» или «галогеналкил» относится к алкильной группе, замещенной одним или более галогенами, например, фтором, хлором, бромом или йодом. Термин «алкоксилалкил» относится к алкильной группе, замещенной одной или более алкоксигруппами, описанными ниже. Термин «алкиламино» относится к алкильной группе, замещенной одной или более аминогруппами, описанными ниже, и т.п. Если в одном случае используется термин «алкил», а в другом случае используется конкретный термин, такой как «алкиловый спирт», это не означает, что термин «алкил» также не относится к конкретному термину, такому как «алкиловый спирт» и т.п. [0086] Указанный подход также применяется в отношении других групп, описанных в настоящей заявке. Т.е. в то время как термин, такой как «циклоалкил», относится как к незамещенным, так и к замещенным циклоалкильным фрагментам, замещенные фрагменты могут быть отдельно определены в настоящей заявке; например, конкретный замещенный циклоалкил может представлять собой, например, «алкилциклоалкил». Аналогично, замещенный алкокси может представлять собой, например, «галогенированный алкокси», конкретный замещенный алкенил может представлять собой, например, «алкениловый спирт», и т.п. Кроме того, использование общего термина, такого как «циклоалкил», и конкретного термина, такого как «алкилциклоалкил», не означает, что общий термин также не включает конкретный термин.
Термин «циклоалкил», применяемый в настоящей заявке, представляет собой неароматическое кольцо, на основе углерода, состоящее по меньшей мере из трех атомов углерода. Примеры циклоалкильных групп включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, норборнил и т.п. Термин «гетероциклоалкил» представляет собой вид циклоалкильной группы, определенной выше, и представляет собой «циклоалкил», в котором по меньшей мере один из кольцевых атомов углерода заменен на гетероатом, включая, но, не ограничиваясь ими, азот, кислород, серу или фосфор. Циклоалкильная группа и гетероциклоалкильная группа могут быть замещенными или незамещенными. Циклоалкильная группа и гетероциклоалкильная группа могут быть замещены одной или более группами, включая, но, не ограничиваясь ими, алкильную, циклоалкильную, алкокси-, амино-, простую эфирную, галогенидную, гидроксильную, нитро-, силильную, сульфоксо- или тиольную группы, описанные в настоящей заявке.
Термин «полиалкиленовая группа», применяемый в настоящей заявке, представляет собой группу, содержащую две или более CH2 группы, соединенные друг с другом. Полиалкиленовая группа может быть представлена формулой (CH2)a-, где «а» представляет собой целое число от 2 до 500.
Термины «алкокси» и «алкоксил», применяемые в настоящей заявке, относятся к алкильной или циклоалкильной группам, связанным через эфирную связь; т.е. «алкокси» группа может быть представлена в виде OA1, где A1 представляет собой алкил или циклоалкил, описанный выше. «Алкокси» также включает полимеры на основе алкоксигрупп, описанных выше; т.е. алкокси может представлять собой простой полиэфир, такой как OA1-OA2 или OA1-(OA2)a-OA3, где «а» представляет собой целое число от 1 до 200, и A1, A2 и A3 представляют собой алкильные и/или циклоалкильные группы.
Термин «алкенил», применяемый в настоящей заявке, представляет собой углеводородную группу, содержащую от 2 до 24 атомов углерода, структурная формула которой содержит по меньшей мере одну двойную связь углерод-углерод. Асимметричные структуры, такие как (A1A2)C=C(A3A4), включают как E-, так и Z-изомеры. Это предполагается для структурных формул согласно настоящей заявке, в которых содержится асимметричный алкеновый фрагмент, или может быть явно обозначено символом C=C. Алкенильная группа может быть замещена одной или более группами, включая, но, не ограничиваясь ими, алкильную, циклоалкильную, алкокси-, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную, гетероарильную, альдегидную, амино-, карбоксильную, сложную эфирную, простую эфирную, галогенидную, гидроксильную, кетонную, азидную, нитро-, силильную, сульфоксо- или тиольную группы, описанные в настоящей заявке.
Термин «циклоалкенил», применяемый в настоящей заявке, представляет собой неароматическое кольцо, на основе углерода, состоящее по меньшей мере из трех атомов углерода и содержащее по меньшей мере одну двойную связь углерод-углерод, т.е. C=C. Примеры циклоалкенильных групп включают, но не ограничиваются ими, циклопропенил, циклобутенил, циклопентенил, циклопентадиенил, циклогексенил, циклогексадиенил, норборненил и т.п. Термин «гетероциклоалкенил» представляет собой вид циклоалкенильной группы, определенной выше, и представляет собой «циклоалкенил», в котором по меньшей мере один из кольцевых атомов углерода заменен на гетероатом, включая, но, не ограничиваясь ими, азот, кислород, серу или фосфор. Циклоалкенильная группа и гетероциклоалкенильная группа могут быть замещенными или незамещенными. Циклоалкенильная группа и гетероциклоалкенильная группа могут быть замещены одной или более группами, включая, но, не ограничиваясь ими, алкильную, циклоалкильную, алкокси-, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную, гетероарильную, альдегидную, амино-, карбоксильную, сложную эфирную, простую эфирную, галогенидную, гидроксильную, кетонную, азидную, нитро-, силильную, сульфоксо- или тиольную группы, описанные в настоящей заявке.
Термин «алкинил», применяемый в настоящей заявке, представляет собой углеводородную группу, содержащую от 2 до 24 атомов углерода, структурная формула которой содержит по меньшей мере одну тройную связь углерод-углерод. Алкинильная группа может быть незамещенной или замещенной одной или более группами, включая, но, не ограничиваясь ими, алкильную, циклоалкильную, алкокси-, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную, гетероарильную, альдегидную, амино-, карбоксильную, сложную эфирную, простую эфирную, галогенидную, гидроксильную, кетонную, азидную, нитро-, силильную, сульфоксо- или тиольную группы, описанные в настоящей заявке.
Термин «циклоалкинил», применяемый в настоящей заявке, представляет собой неароматическое кольцо, на основе углерода, состоящее по меньшей мере из семи атомов углерода и содержащее по меньшей мере одну тройную связь углерод-углерод. Примеры циклоалкинильных групп включают, но не ограничиваются ими, циклогептинил, циклооктинил, циклононинил и т.п. Термин «гетероциклоалкинил» представляет собой вид циклоалкинильной группы, определенной выше, и представляет собой «циклоалкинил», в котором по меньшей мере один из кольцевых атомов углерода заменен на гетероатом, включая, но, не ограничиваясь ими, азот, кислород, серу или фосфор. Циклоалкинильная группа и гетероциклоалкинильная группа могут быть замещенными или незамещенными. Циклоалкинильная группа и гетероциклоалкинильная группа могут быть замещены одной или более группами, включая, но, не ограничиваясь ими, алкильную, циклоалкильную, алкокси-, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную, гетероарильную, альдегидную, амино-, карбоксильную, сложную эфирную, простую эфирную, галогенидную, гидроксильную, кетонную, азидную, нитро-, силильную, сульфоксо- или тиольную группы, описанные в настоящей заявке.
Термин «арил», применяемый в настоящей заявке, представляет собой группу, содержащую любую ароматическую группу, на основе углерода, включая, но, не ограничиваясь ими, бензольную, нафталиновую, фенильную, бифенильную, феноксибензольную группы и т.п. Термин «арил» также включает «гетероарил», который представляет собой группу, содержащую ароматическую группу, в которой по меньшей мере один из кольцевых атомов ароматической группы представляет собой гетероатом. Примеры гетероатомов включают, но не ограничиваются ими, азот, кислород, серу и фосфор. Аналогично, термин «негетероарил», который также охватывается термином «арил», определяет группу, ароматическое кольцо которой не содержит гетероатомов. Арильная группа может быть замещенной или незамещенной. Арильная группа может быть замещена одной или более группами, включая, но, не ограничиваясь ими, алкильную, циклоалкильную, алкокси-, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную, гетероарильную, альдегидную, амино-, карбоксильную, сложную эфирную, простую эфирную, галогенидную, гидроксильную, кетонную, азидную, нитро-, силильную, сульфоксо- или тиольную группы, описанные в настоящей заявке. Термин «биарил» представляет собой конкретный вид арильных групп и охватывается термином «арил». Биарил относится к двум арильным группам, связанным друг с другом с помощью конденсированной кольцевой структуры, как в нафталине, или соединенным при помощи одной или более связей углерод-углерод, как в бифениле.
Термин «альдегид», применяемый в настоящей заявке, представлен формулой -C(O)H. В настоящем описании «C(O)» представляет собой сокращенное обозначение карбонильной группы, т.е. C=O.
Термины «амин» или «амино», применяемые в настоящей заявке, представлены формулой -NA1A2, где A1 и A2 независимо могут представлять собой водород или алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке.
Термин «алкиламино», применяемый в настоящей заявке, представлен формулой -NH(алкил), где алкил является таким, как описано в настоящей заявке. Типичные примеры включают, но не ограничиваются ими, метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу, бутиламиногруппу, изобутиламиногруппу, (втор-бутил)аминогруппу, (трет-бутил)аминогруппу, пентиламиногруппу, изопенитламиногруппу, (трет-пентил)аминогруппу, гексиламиногруппу и т.п.
Термин «диалкиламино», применяемый в настоящей заявке, представлен формулой -NH(алкил)2, где алкил является таким, как описано в настоящей заявке. Типичные диэтиламиногруппу, дипропиламиногруппу, диизопропиламиногруппу, дибутиламиногруппу, диизобутиламиногруппу, ди(втор-бутил)аминогруппу, ди(трет-бутил)аминогруппу, дипентиламиногруппу, диизопенитламиногруппу, ди(трет- пентил)аминогруппу, дигексиламиногруппу, N-этил-М-метиламиногруппу, K-метил-N-пропиламиногруппу, N-этил-N-пропиламиногруппу и т.п.
Термин «карбоновая кислота», применяемый в настоящей заявке, представлен формулой -C(O)OH.
Термин «сложный эфир», применяемый в настоящей заявке, представлен формулой -OC(O)A1 или -C(O)OA1, где A1 может представлять собой алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке. Термин «сложный полиэфир», применяемый в настоящей заявке, представлен формулой -(A1O-(O)C-A2-C(O)O)a- или - (A1O(O)C-A2-OC(O))a-, где A1 и A2 независимо могут представлять собой алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке, и «a» представляет собой целое число от 1 до 500. «Сложный полиэфир» представляет собой термин, применяемый для описания группы, получаемой при взаимодействии между соединением, содержащим по меньшей мере две карбоксильные группы, с соединением, содержащим по меньшей мере две гидроксильные группы.
Термин «простой эфир», применяемый в настоящей заявке, представлен формулой A1OA2, где A1 и A2 независимо могут представлять собой алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке. Термин «простой полиэфир», применяемый в настоящей заявке, представлен формулой -(A1O-A2O)a-, где A1 и A2 независимо могут представлять собой алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке, и «a» представляет собой целое число от 1 до 500. Примеры простых полиэфирных групп включают полиэтиленоксид, полипропиленоксид и полибутиленоксид.
Термин «галоген», применяемый в настоящей заявке, относится к фтору, хлору, брому и йоду. Термин «гетероцикл», применяемый в настоящей заявке, относится к моно- или полициклической ароматической или неароматической кольцевой системе, в которой по меньшей мере один кольцевой атом отличается от углерода. Гетероциклы включают азетидин, диоксан, фуран, имидазол, изотиазол, изоксазол, морфолин, оксазол, оксазол, включая 1,2,3-оксадиазол, 1,2,5-оксадиазол и 1,3,4-оксадиазол, пиперазин, пиперидин, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролидин, тетрагидрофуран, тетрагидропиран, тетразин, включая 1,2,4,5-тетразин, тетразол, включая тетразол и 1,2,4,5-тетразол, тиадиазол, включая 1,2,3-тиадиазол, 1,2,5-тиадиазол и тиадизол, тиазол, тиофен, триазин, включая 1,3,5-триазин и 1,2,4-триазин, триазол, включая 1,2,3-триазол, 1,3,4-триазол, и т.п.
Термин «гидроксил», применяемый в настоящей заявке, представлен формулой -OH.
Термин «кетон», применяемый в настоящей заявке, представлен формулой -A1C(O)A2, где A1 и A2 независимо могут представлять собой алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке.
Термин «азид», применяемый в настоящей заявке, представлен формулой -N3.
Термин «нитро», применяемый в настоящей заявке, представлен формулой -NO2.
Термин «нитрил», применяемый в настоящей заявке, представлен формулой -CN.
Термин «сульфоксо», применяемый в настоящей заявке, представлен формулой -S(O)A1, -S(O)2A1, -OS(O)2A1 или -OS(O)2OA1, где A1 может представлять собой водород или алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке. В настоящем описании «S(O)» представляет собой сокращенное обозначение S=0. Термин «сульфонил», применяемый в настоящей заявке, относится к сульфоксогруппе, представленной формулой -S(O)2A1, где A1 может представлять собой водород или алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке. Термин «сульфон», применяемый в настоящей заявке, относится к сульфоксогруппе, представленной формулой A1S(O)2A2, где A1 и A2 независимо могут представлять собой алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке. Термин «сульфоксид», применяемый в настоящей заявке, относится к сульфоксогруппе, представленной формулой A1S(O)A2, где A1 и A2 независимо могут представлять собой алкильную, циклоалкильную, алкенильную, циклоалкенильную, алкинильную, циклоалкинильную, арильную или гетероарильную группы, описанные в настоящей заявке.
Термин «тиол», применяемый в настоящей заявке, представлен формулой -SH.
«R1», «R2», «R3», «Rn», где n представляет собой целое число, применяемые в настоящей заявке, независимо могут относиться к одной или более группам, перечисленным выше. Например, если R1 представляет собой алкильную группу с линейной цепью, один или более атомов водорода алкильной группы могут быть замещены гидроксильными группами, алкоксигруппами, алкильными группами, галогенами и т.п. В зависимости от выбранных групп первая группа может быть включена во вторую группу, или, альтернативно, первая группа может быть привита (т.е. присоединена) ко второй группе. Например, фраза «алкильная группа, содержащая аминогруппу» означает, что аминогруппа может быть включена в основную цепь алкильной группы. Альтернативно, аминогруппа может быть присоединена к основной цепи алкильной группы. Включение или присоединение первой группы ко второй группе определяется природой выбранных групп.
Как описано в настоящей заявке, соединения согласно настоящему изобретению могут содержать «возможно замещенные» фрагменты. В целом, термин «замещенный», как в сочетании с термином «возможно», так и без него, означает, что один или более атомов водорода указанного фрагмента замещены подходящими заместителями. Если не указано иное, «возможно замещенная» группа может содержать подходящий заместитель в каждом замещаемом положении, и, если более одного положения в любой данной структуре могут быть замещены более, чем одним, заместителем, выбранным из указанной группы, заместители в каждом положении могут быть одинаковыми или могут различаться. Комбинации заместителей, предусмотренные настоящим изобретением, предпочтительно представляют собой комбинации, которые приводят к образованию стабильных или химически возможных соединений. Также предполагается, что в некоторых аспектах, если не указано иное, отдельные заместители могут быть дополнительно замещены (т.е. могут являться дополнительно замещенными или незамещенными).
Термин «стабильный», применяемый в настоящей заявке, относится к соединениям, которые по существу не изменяются при воздействии, что позволяет осуществлять их получение, детектирование и, в некоторых аспектах, выделение, очистку и применение для одной или более целей, описанных в настоящей заявке.
Подходящие одновалентные заместители при атоме углерода, который может иметь заместители, «возможно замещенной» группы независимо представляют собой галоген; -(CH2)0-4R0; -(CH2)0-4OR0; -O(CH2)0-4R0, -O-(CH2)0-4C(O)OR0; -(CH2)0-4CH(OR0)2: -(CH2)0-4Ph, который может быть замещен R0; -(CH2)0-4O(CH2)0-1Ph, который может быть замещен R0; -CH=CHPh, который может быть замещен R0; -(CH2)0-4O(CH2)0-1-пиридил, который может быть замещен R0; -NO2; -CN; -N3; -(CH2)0-4N(R0)2; -(CH2)0-4N(R0)C(O)R0; -N(R0)C(S)R0; -(CH2)0-4N(R0)C(0)NR02; -N(R0)C(S)NR02; -(CH2)0-4N(R0)C(O)OR0; -N(R0)N(R0)C(O)R0; -N(R0)N(R0)C(O)NR02; -N(R0)N(R0)C(O)OR0; -(CH2)0-4C(O)R0; -C(S)R0; -(CH2)0-4C(O)OR0, -(CH2)0-4C(O)SR0; -(CH2)0-4C(O)OsiR03; -(CH2)0-4OC(O)R0; -OC(O)(CH2)o-4SR-; SC(S)SR0; -(CH2)0-4SC(O)R0; -(CH2)0-4C(O)NR02; -C(S)NR02; -C(S)SR0; -SC(S)SR0, -(CH2)0-4OC(O)NR02; -C(O)N(OR0)R0; -C(O)C(O)R0; -C(O)CH2C(O)R0; -C(NOR0)R0; -(CH2)o-4SSR0; -(CH2)0-4S(O)2R0; -(CH2)0-4S(O)2OR0; -(CH2)0-4OS(O)2R0; -S(O)2NR02; -(CH2)0-4S(O)R0; -N(R0)S(O)2NR02; -N(R0)S(O)2R0; -N(OR0)R0; -C(NH)NR02; -P(O)2R0; -P(O)R02; -OP(O)R02; - OP(O)(OR0)2; SiR03; -(C1-4 линейный или разветвленный алкилен)O-N(R0)2; или -(C1-4 линейный или разветвленный алкилен)C(O)ON(R0)2, где каждый из R0 может быть замещен, как описано ниже, и независимо может представлять собой водород, С1-6 алифатическую группу, -CH2Ph, -O(CH2)0-1Ph, -CH2-(5-6-членное гетероарильное кольцо) или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы, или, несмотря на приведенное выше определение, два независимых R0 вместе с их промежуточным(и) атомом(ами) образуют 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы, которое может быть замещено, как описано ниже.
Подходящие одновалентные заместители при R0 (или кольце, образованном двумя независимыми R0 вместе с их промежуточными атомами) независимо представляют собой галоген, -(CH2)0-2R*, -(галогенR*), -(CH2)0-2OH, -(CH2)0-2OR*, -(CH2)0-2CH(OR*)2; -O(галогенR*), -CN, -N3, -(CH2)0-2C(O)R*, -(CH2)0-2C(O)OH, -(CH2)0-2C(O)OR*, -(CH2)0-2SR*, -(CH2)0-2SH, -(CH2)0-2NH2, -(CH2)0-2NHR*, -(CH2)0-2NR*2, -NO2, -SiR*3, -OSiR*3, -C(O)SR*, -(C1-4 линейный или разветвленный алкилен)C(O)OR* или -SSR*, где каждый из R* является незамещенным или, в случае приставки «галоген», является замещенным только одним или более галогенами и независимо выбран из C1-4 алифатической группы, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители при насыщенном атоме углерода в R* включают =0 и =S.
Подходящие двухвалентные заместители при насыщенном атоме углерода «возможно замещенной» группы включают следующие: =0, =S, =NNR*2, =NNHC(O)R*, =NNHC(O)OR*, =NNHS(O)2R*, =NR*, =NOR*, -O(C(R*2))2-3O- или -S(C(R*2))2-3S-, где каждый из R* независимо выбран из водорода, С1-6 алифатической группы, которая может быть замещенной, как описано ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители, которые связываются с вицинальными атомами углерода, которые могут иметь заместители, «возможно замещенной» группы, включают: -O(CR*2)2-3O-, где каждый из R* независимо выбран из водорода, С1-6 алифатической группы, которая может быть замещенной, как описано ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы.
Подходящие заместители при алифатической группе в R* включают галоген, -R*, -(галогенR*), -OH, -OR*, -O(галогенR*), -CN, -C(O)OH, -C(O)OR*, -NH2, -NHR*, -NR*2 или -NO2, где каждый из R* является незамещенным или, в случае приставки «галоген», является замещенным только одним или более галогенами и независимо выбран из C1-4 алифатической группы, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы.
Подходящие заместители при атоме азота, который может иметь заместители, «возможно замещенной» группы включают R+, -NR+2, -C(O)R+, -C(O)OR+, -C(O)C(O)R+, -C(O)CH2C(O)R+, -S(O)2R+, -S(O)2NR+2, -C(S)NR+2, -C(NH)NR+2 или -N(R+)S(O)2R+; где каждый из R+ независимо выбран из водорода, С1-6 алифатической группы, которая может быть замещенной, как описано ниже, незамещенного -OPh или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы, или, несмотря на приведенное выше определение, два независимых R+ вместе с их промежуточным(и) атомом(ами) образуют 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы.
Подходящие заместители при алифатической группе R• включают галоген, -R•, -(галогенR•), -OH, -OR•, -О(галогенR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2 или -NO2, где каждый из R• является незамещенным или, в случае приставки «галоген», является замещенным только одним или более галогенами и независимо выбран из C1-4 алифатической группы, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатомов, независимо выбранных из азота, кислорода или серы.
Термин «уходящая группа» относится к атому (или группе атомов) с электроноакцепторной способностью, который может быть удален в виде стабильного фрагмента вместе со связывающей электронной парой. Примеры подходящих уходящих групп включают галогениды - в том числе хлор-, бром- или йод— и псевдогалогениды (сложные эфиры сульфокислот) - в том числе трифлат, мезилат, тозилат и брозилат. Также предполагается, что гидроксильный фрагмент может быть превращен в уходящую группу с помощью реакции Мицунобу.
Термины «гидролизуемая группа» и «гидролизуемый фрагмент» относятся к функциональной группе, которая может быть подвергнута гидролизу, например, в щелочных или кислотных условиях. Примеры гидролизуемых остатков включают, без ограничений, галогенангидриды кислот, активированные карбоновые кислоты и другие защитные группы, известные в данной области (см., например, «Protective Groups in Organic Synthesis» T.W. Greene, P.G.M. Wuts, Wiley-Interscience, 1999).
Термин «органический остаток» обозначает остаток, содержащий углерод, т.е. остаток, содержащий по меньшей мере один атом углерода, и включает, но не ограничивается ими, углеродсодержащие группы, остатки или радикалы, описанные выше. Органические остатки могут содержать различные гетероатомы или могут связываться с другими молекулами через гетероатом, включая кислород, азот, серу, фосфор и т.п. Примеры органических остатков включают, но не ограничиваются ими, алкилы или замещенные алкилы, алкокси или замещенные алкокси, моно- или дизамещенные амино, амидные группы и т.п. Органические остатки предпочтительно могут содержать от 1 до 18 атомов углерода, от 1 до 15 атомов углерода, от 1 до 12 атомов углерода, от 1 до 8 атомов углерода, от 1 до 6 атомов углерода или от 1 до 4 атомов углерода. В другом аспекте органический остаток может содержать от 2 до 18 атомов углерода, от 2 до 15 атомов углерода, от 2 до 12 атомов углерода, от 2 до 8 атомов углерода, от 2 до 4 атомов углерода или от 2 до 4 атомов углерода.
Близким синонимом термина «остаток» является термин «радикал», который в настоящем описании и прилагаемой формуле изобретения относится к фрагменту, группе или субструктуре молекулы, описанным в настоящей заявке, независимо от способа получения молекулы. В некоторых вариантах реализации радикал (например, алкил) может являться дополнительно модифицированным (т.е. замещенным алкилом) путем присоединения к нему одного или более «заместителей радикалов». Если в настоящей заявке не указано иное, количество атомов в конкретном радикале не является критическим для настоящего изобретения.
«Органические радикалы», в качестве термина, описанного и применяемого в настоящей заявке, содержат один или более атомов углерода. Органический радикал может содержать, например, от 1 до 26 атомов углерода, от 1 до 18 атомов углерода, от 1 до 12 атомов углерода, от 1 до 8 атомов углерода, от 1 до 6 атомов углерода или от 1 до 4 атомов углерода. В другом аспекте органический радикал может содержать от 2 до 26 атомов углерода, от 2 до 18 атомов углерода, от 2 до 12 атомов углерода, от 2 до 8 атомов углерода, от 2 до 6 атомов углерода или от 2 до 4 атомов углерода. Органические радикалы часто содержат атомы водорода, связанные по меньшей мере с некоторыми из атомов углерода органического радикала. В некоторых вариантах реализации органический радикал может содержать от 1 до 10 неорганических гетероатомов, связанных с ним и в нем, включая галогены, кислород, серу, азот, фосфор и т.п. Примеры органических радикалов включают, но не ограничиваются ими, алкильные, замещенные алкильные, циклоалкильные, замещенные циклоалкильные, монозамещенные амино-, дизамещенные амино-, ацилокси-, циано-, карбокси-, карбоалкокси-, алкилкарбоксамидные, замещенные алкилкарбоксамидные, диалкилкарбоксамидные, замещенные диалкилкарбоксамидные, алкилсульфонильные, алкилсульфинильные, тиоалкильные, тиогалогеналкильные, алкокси-, замещенные алкокси-, галогеналкильные, галогеналкокси-, арильные, замещенные арильные, гетероарильные, гетероциклические или замещенные гетероциклические радикалы, описанные в настоящей заявке. Неограничивающие примеры органических радикалов, которые содержат гетероатомы, включают алкоксирадикалы, трифторметоксирадикалы, ацетоксирадикалы, диметиламинорадикалы и т.п.
«Неорганические радикалы», в качестве термина, описанного и применяемого в настоящей заявке, не содержат атомов углерода и, следовательно, состоят только из атомов, отличных от углерода. Неорганические радикалы содержат комбинации атомов, выбранных из водорода, азота, кислорода, кремния, фосфора, серы, селена и галогенов, таких как фтор, хлор, бром и йод, которые могут присутствовать по отдельности или могут быть объединены в химически стабильные комбинации. Неорганические радикалы содержат 10 или меньше, предпочтительно от одного до шести или от одного до четырех неорганических атомов, перечисленных выше, соединенных друг с другом. Примеры неорганических радикалов включают, но не ограничиваются ими, амино-, гидрокси-, галогенные, нитро-, тиольные, сульфатные, фосфатные и другие широко известные неорганические радикалы. Неорганические радикалы не содержат в своем составе металлические элементы периодической таблицы (такие как щелочные металлы, щелочноземельные металлы, переходные металлы, лантаноидные металлы и актиноидные металлы), хотя указанные ионы металлов иногда могут выступать в качестве фармацевтически приемлемого катиона для неорганических анионных радикалов, таких как сульфатные, фосфатные или другие неорганические анионные радикалы. Если иное не указано в настоящей заявке, неорганические радикалы не содержат металлоидов, таких как бор, алюминий, галлий, германий, мышьяк, олово, свинец или теллур, или инертных газов.
Соединения, описанные в настоящей заявке, могут содержать одну или более двойных связей и, следовательно, могут образовывать цис/транс (E/Z) изомеры, а также другие конформационные изомеры. Если не указано иное, настоящее изобретение включает все возможные изомеры, а также смеси таких изомеров.
Если не указано иное, формула с химическими связями, представленными только в виде сплошных линий, а не клиньев или пунктирных линий, подразумевает все возможные изомеры, например, энантиомеры и диастереомеры и смеси изомеров, такие как рацемические или скалемические смеси. Соединения, описанные в настоящей заявке, могут содержать один или более асимметричных центров и, следовательно, могут образовывать диастереомеры и оптические изомеры. Если не указано иное, настоящее изобретение включает все возможные диастереомеры, а также их рацемические смеси, по существу, чистые разделенные энантиомеры, все возможные геометрические изомеры и фармацевтически приемлемые соли указанных соединений. Также включены смеси стереоизомеров и конкретные выделенные стереоизомеры. Продуктами способов синтеза, применяемых для получения указанных соединений, или способов рацемизации или эпимеризации, известных специалистам в данной области, могут являться смеси стереоизомеров.
Многие органические соединения существуют в оптически активных формах, способных вращать плоскость плоскополяризованного света. При описании оптически активного соединения префиксы D и L или R и S используют для обозначения абсолютной конфигурации хирального(ых) центра(ов) молекулы. Префиксы d и l или (+) и (-) применяют для обозначения знака вращения плоскости плоскополяризованного света соединением, где (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для конкретной химической структуры указанные соединения, называемые стереоизомерами, являются идентичными за исключением того, что они представляют собой зеркальные отражения друг друга, не совмещаемые в пространстве. Конкретный стереоизомер также может называться энантиомером, а смесь указанных изомеров обычно называют энантиомерной смесью. 50:50 смесь энантиомеров называется рацемической смесью. Многие соединение, описанные в настоящей заявке, могут иметь один или более хиральных центров и, следовательно, могут существовать в различных энантиомерных формах. При желании хиральный атом углерода можно обозначать звездочкой (*). Если связи хирального атома углерода в представленных формулах изображены сплошными линиями, это означает, что формула охватывает (R)- и (S)-конфигурации хирального атома углерода, а, следовательно, оба энантиомера и их смеси. В данной области, если требуется указать абсолютную конфигурацию хирального атома углерода, одну из связей хирального атома углерода можно изображать в виде клина (связь с атомом, расположенным над плоскостью), а другую связь можно изображать в виде клина из нескольких коротких параллельных линий (связь с атомом, расположенным под плоскостью). Для обозначения (R)- и (S)-конфигураций хирального атома углерода можно использовать систему Кана-Ингольда-Прелога.
Соединения, описанные в настоящей заявке, содержат атомы с природным изотопным составом и атомы, имеющие изотопный состав, отличный от природного. Описанные соединения могут являться изотопно-мечеными или изотопно-замещенными соединениями, аналогичными описанным соединения за исключением того, что в них один или более атомов заменены атомами, имеющими атомный вес или массовое число, отличные от естественного атомного веса или массового числа. Примеры изотопов, которые могут быть включены в соединения согласно настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 16O, 17O, 35S, 18F и 36Cl, соответственно. Соединения также включают пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, которые входят в объем настоящего изобретения. Некоторые изотопно-меченые соединения согласно настоящему изобретению, например, соединения, в которые включены радиоактивные изотопы, такие как H и C, подходят для применения при исследованиях распределения в тканях лекарственных средств и/или субстратов. Изотопы трития, т.е. 3H, и углерода-14, т.е. 14C, являются особенно предпочтительными из-за простоты их получения и детектирования. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может обеспечивать конкретные терапевтические преимущества в результате более высокой метаболической стабильности, например, повышенный период распада in vivo или более низкие требуемые дозировки, и, следовательно, может быть предпочтительным в некоторых случаях. Изотопно-меченые соединения согласно настоящему изобретению и их пролекарства можно получать при помощи способов, описанных ниже, путем замещения не изотопно-меченых реагентов на легкодоступные изотопно-меченые реагенты.
Соединения, описанные в настоящей заявке, могут присутствовать в виде сольватов. В некоторых случаях растворитель, применяемый при получении сольвата, представляет собой водный раствор, и сольват называют гидратом. Соединения могут присутствовать в виде гидратов, которые могут быть получены, например, путем кристаллизации из растворителя или из водного раствора. В указанном случае одна, две, три или произвольное число молекул сольвата или воды могут объединяться с соединениями согласно настоящему изобретению с образованием сольватов и гидратов. Если не указано иное, настоящее изобретение включает все возможные сольваты.
Термин «сокристалл» обозначает физическое объединение двух или более молекул, обладающее стабильностью благодаря нековалентным взаимодействиям. Один или более компонентов указанного молекулярного комплекса обеспечивают стабильную основу кристаллической решетки. В некоторых случаях молекулы-гости включены в кристаллическую решетку в виде ангидридов или сольватов, см., например, «Crystal Engineering of the Composition of Pharmaceutical Phases. Do Pharmaceutical Cocrystals Represent a New Path to Improved Medicines?» Almarasson, O., et. al., The Royal Society of ChemistRy, 1889-1896, 2004. Примеры сокристаллов ключают и-толуолсульфокислоту и бензолсульфокислоту.
Следует понимать, что некоторые соединения, описанные в настоящей заявке, могут находиться в виде таутомерного равновесия. Например, кетоны с α-водородом могут существовать в виде равновесия между кето-формой и енольной формой.
 .
.
Аналогично, амиды с N-водородом могут существовать в виде равновесия между амидной формой и формой имидокислоты. Если не указано иное, настоящее изобретение включает все возможные таутомеры.
Известно, что химические вещества образуют твердые вещества, которые присутствуют в различных состояниях упорядоченности, называемых полиморфными формами или модификациями. Различные модификации полиморфных веществ могут значительно различаться по своим физическим свойствам. Соединения согласно настоящему изобретению могут присутствовать в различных полиморфных формах, некоторые из которых могут являться метастабильными. Если не указано иное, настоящее изобретение включает все возможные полиморфные формы.
В некоторых аспектах структура соединения может быть представлена формулой:
 ,
,
которая является эквивалентной формуле:
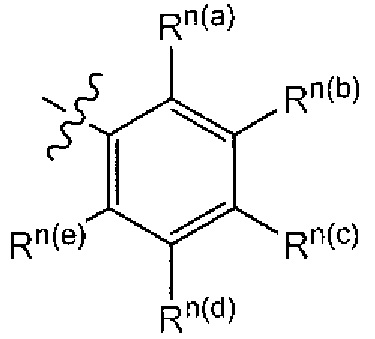 ,
,
где n обычно представляет собой целое число. Т.е. Rn представляет собой пять независимых заместителей, Rn(a), Rn(b), Rn(c), Rn(d) и Rn(e). Термин «независимые заместители» означает, что каждый из R заместителей может быть определен независимо. Например, если в одном случае Rn(a) представляет собой галоген, то Rn(b) не обязательно является галогеном в указанном случае.
Описаны соединения, применяемые для получения композиций согласно настоящему изобретению, а также композиции, применяемые в способах, описанных в настоящей заявке. Эти и другие материалы описаны в настоящей заявке, и следует понимать, что, если описаны комбинации, подмножества, выборки, группы и т.п. указанных материалов, но при этом не могут быть отдельно описаны все индивидуальные соединения и комбинации и сочетания указанных соединений, все из них подразумеваются и описаны в настоящем изобретении. Например, если описаны конкретные соединения и ряд модификаций, которые могут быть применены к молекулам соединений, отдельно предполагается каждая из комбинаций и сочетаний соединений и возможных модификаций, если не указано иное. Указанный подход применяется ко всем аспектам настоящей заявки, включая, но, не ограничиваясь ими, стадии способов получения и применения композиций согласно настоящему изобретению. Таким образом, если существует множество дополнительных стадий, которые могут быть проведены, следует понимать, что каждая из таких дополнительных стадий может быть проведена в любом конкретном варианте реализации или комбинации вариантов реализации способов согласно настоящему изобретению.
В одном из аспектов настоящее изобретение относится к соединениям, подходящим для применения в качестве ингибиторов STAT3/STAT5. В другом аспекте описанные соединения и продукты описанных способов получения являются модуляторами активности STAT3/STAT5. В различных аспектах настоящее изобретение относится к соединениям, которые связываются с белком STAT3 и отрицательно модулируют активность STAT3. В других аспектах настоящее изобретение относится к соединениям, которые связываются с белком STAT5 и отрицательно модулируют активность STAT5. В другом аспекте описанные соединения ингибируют активность STAT3/5.
В одном из аспектов соединения согласно настоящему изобретению подходят для применения для лечения рака, связанного с нарушением активности STAT3/STAT5, такого как рак молочной железы, простаты или головного мозга и глиобластома, и других заболеваний, в которых задействован белок STAT3/5, как описано далее в настоящей заявке.
Предполагается, что каждое из описанных производных может являться возможно замещенным. Также предполагается, что любые производные могут быть не включены в настоящее изобретение. Понятно, что описанные соединения можно получать при помощи описанных способов. Также понятно, что описанные соединения можно использовать в описанных способах применения.
В одном из аспектов настоящего описания предложено соединение формулы I:

или его фармацевтически приемлемая соль, сольват или пролекарство,
где каждый из m и n независимо представляет собой целое число от 0 до 3;
R1 выбран из A1, A2, -(A1)-(A2), -(A2)-(A3), -(A3)-(A2), -(A3)-(A4), -(A5)-(A1)-(A7), -(A5)-(A2)-(A8), -(A5)-(A3)-(A7) и -(A5)-(A6)-L-(A7); A1 представляет собой С3-6 циклоалкил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R5, (C=O)OR5 и (C=O)NHR5; A2 представляет собой C3-6 циклоалкил или гетероциклоалкил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R6, (C=O)OR6 и (C=O)NHR6; A3 представляет собой арил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкилтио, C1-6 галогеналкилтио, C1-6 полигалогеналкилтио, C1-6 алкиламино, C1-6 диалкиламино, (C1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-полигалогеналкилтио, CO2H, (C=O)R7, (C=O)OR7 и (C=O)NHR7; A4 представляет собой арил, замещенный 1-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкилтио, C1-6 галогеналкилтио, C1-6 полигалогеналкилтио, C1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R8, (C=O)OR8 и (C=O)NHR8; A5 выбран из C3-6 циклоалкила, C3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкилтио, C1-6 галогеналкилтио, C1-6 полигалогеналкилтио, C1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R9, (C=O)OR9 и (C=O)NHR9; A6 выбран из C3-6 циклоалкила, C3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкилтио, C1-6 галогеналкилтио, C1-6 полигалогеналкилтио, C1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R10, (C=O)OR10 и (C=O)NHR10; A7 выбран из C3-6 циклоалкила, C3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкилтио, C1-6 галогеналкилтио, C1-6 полигалогеналкилтио, C1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R11, (C=O)OR11 и (C=O)NHR11; A8 выбран из C3-6 циклоалкила, C3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкилтио, C1-6 галогеналкилтио, C1-6 полигалогеналкилтио, C1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R12, (C=O)OR12 и (C=O)NHR12; L выбран из -(C=O)- и -SO2-; R2 выбран из C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C1-6 галогеналкила, C2-6 галогеналкенила, C2-6 галогеналкинила, C1-6 полигалогеналкила, C2-6 полигалогеналкенила, C2-6 полигалогеналкинила; или R2 представляет собой арил, замещенный 0-5 группами, независимо выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкилтио, C1-6 галогеналкилтио, C1-6 полигалогеналкилтио, C1-6 алкиламино, C1-6 диалкиламино, (C1-6)-алк-(C2-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)OR12 и (C=O)NHR12; R3 представляет собой арил, замещенный 0-5 группами, независимо выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 алкила, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкиламино, C1-6 диалкиламино, (C1-6)-алк-(C1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси и (С1-6)-алк-(С1-6)-полигалогеналкокси; каждый из R5, R6, R7, R8, R9, R10, и R11 R11 независимо выбран из водорода, C1-6 алкила, C1-6 галогеналкила и C1-6 полигалогеналкила; или фармацевтически приемлемая соль, гидрат, сольват или полиморф указанного соединения,
где R2 выбран из группы, состоящей из:
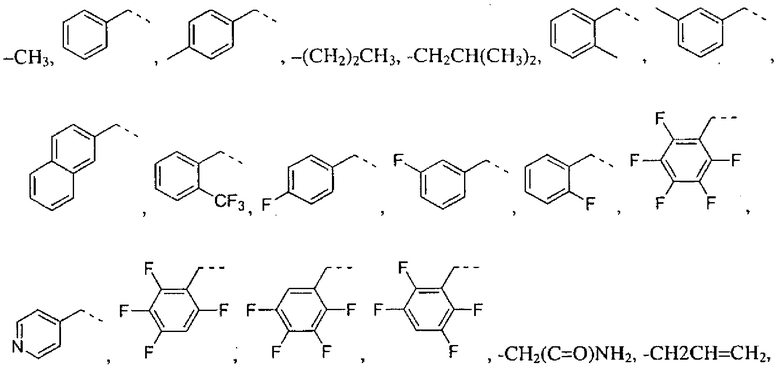
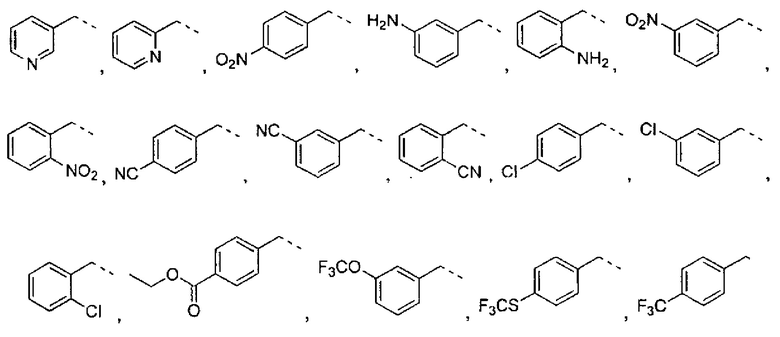
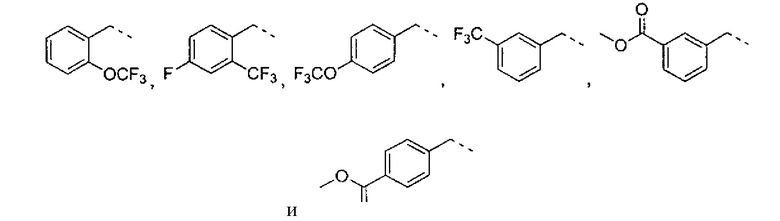 ,
,
где R3 выбран из структуры, представленной формулой
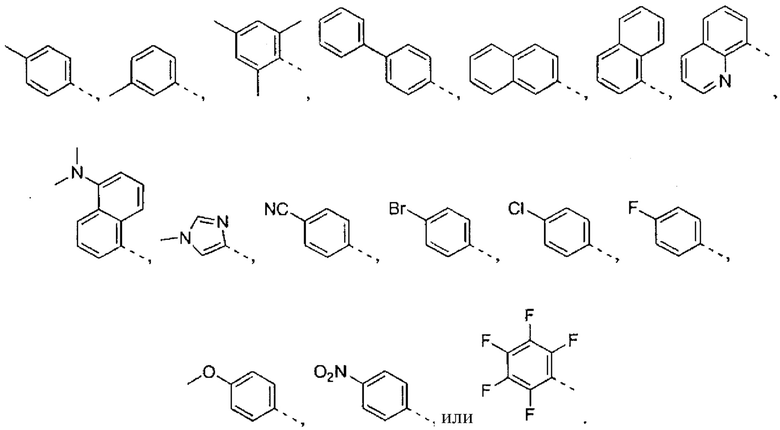 ,
,
где R4 представляет собой структуру, представленную формулой:
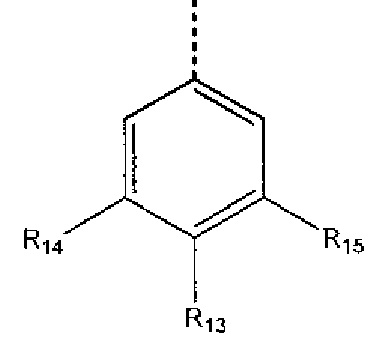 ,
,
где R13 выбран из группы, состоящей из -OH, -COR16, -CN, -CH2PO(OH)2, - СН2Р(O)3(СН2СН3)2, -NO2, -NHR17 и 1Н-тетразола;
R16 выбран из группы, состоящей из: -OH, -O-C(1-2)алкила, -OCH2OC(O)CH3, -OCH2OС(O)-трет-бутила и -NHOH,
R17 выбран из группы, состоящей из: -H, -C(O)C(O)CH2CH3, -C(O)C(O)OH и -C(O)CH2-1H-тетразола,
R14 представляет собой -H, или, если R13 представляет собой -COOH, R14 представляет собой -F, -OC(O)CH3; и
R13 представляет собой -H, если R14 представляет собой -OH, или оба из R14 и R15 представляют собой -COOH.
В одном из аспектов настоящего изобретения предложена направленная библиотека аналогов 4-(2-(фенилсульфонамидо)ацетамидо)салициловой кислоты, обладающие свойствами пролекарств и потенциальных биоизостеров, а также функциональностью, подходящей для имитации салициловой кислоты. Указанные соединения исследовали на ингибирование активности STAT3/5. Два указанных белка задействованы при различных видах рака. Далее в настоящей заявке показано, что соединения согласно настоящему изобретению являются более эффективными по сравнению с другими соединениями, подходящими для применения для лечения различных видов рака. Помимо улучшения клеточной и ГЭБ проницаемости пролекарства, предложенные в настоящей заявке, предназначены для защиты анионной гидроксильной или карбоксильной групп салициловой кислоты или обеих указанных групп. В указанном подсемействе алкильные (39-40), ацетоксиметильное (AOM) (26), пивалоилоксиметильное (POM) (27) и ацетилированные (22, 23) пролекарства салициловой кислоты получали для повышения клеточной проницаемости (таблица 1). Кроме салициловой кислоты получали фосфотирозиновое фосфонатное производное 1, соединение 21, и аналог пролекарства, 20. Для исследования структурно-функциональной взаимосвязи меняли относительное положение гидрокси- и карбоксигрупп в кольце (38), гидроксильный заместитель заменяли на фтор (33, 43) или полностью удаляли и заменяли на водород (31, 42). Электроотрицательные фторированные аналоги, 33, 43, приводили к меньшей полярности ингибитора благодаря снижению заряда на карбоксилатной группе и, таким образом, приводили к улучшению клеточной проницаемости. Дополнительным преимуществом удаления или замены гидроксильной группы на фтор являлось предотвращение фазы II глюкуронидации. Для дальнейшего изучения роли салициловой кислоты в связывании STAT3 получали N-гидроксиламино-(32, 44), сульфонамидные (12-15), сульфонаминное (16), тетразольное (35, 41) и N-гидроксиоксаминовые (28, 46) производные. Также получали пролекарственные аналоги биоизостеров (17-18). Соединения 12-13 и 36, содержащие объемную гидрофобную нафтильную группу или бензольную группу, соответственно, не содержат активного салицилового фрагмента и были синтезированы в качестве отрицательного контроля. Химические способы синтеза всех указанных соединений приведены в настоящей заявке.
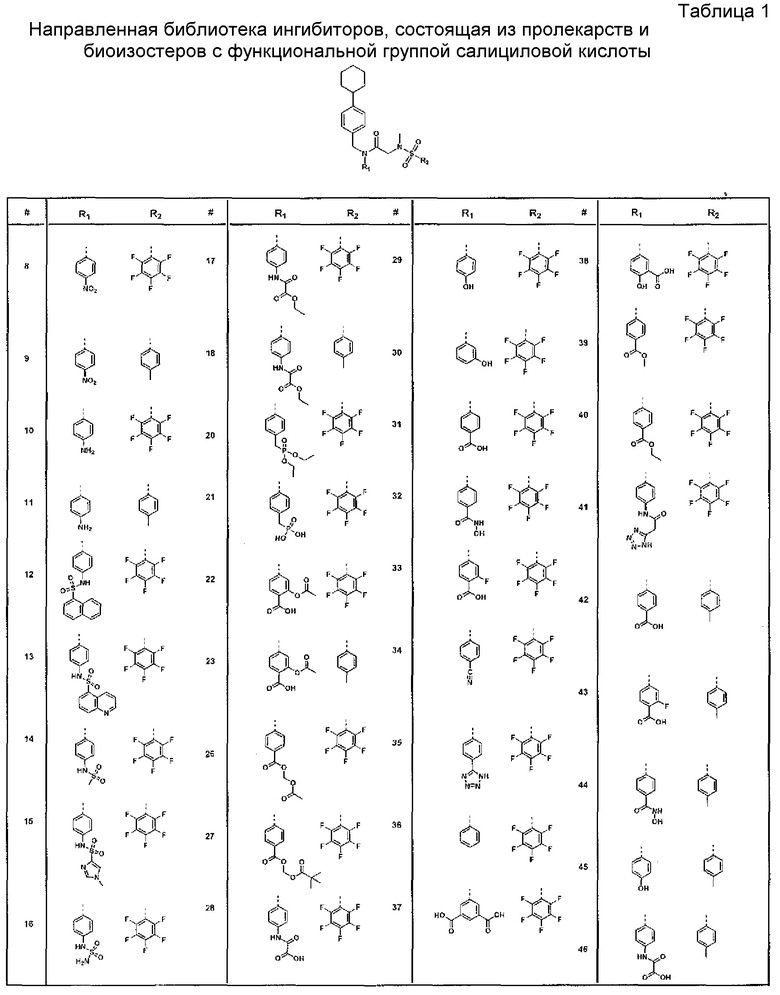
Сначала проводили скрининг библиотеки в отношении набора трех типовых линий GBM BTSC, полученных у пациентов с GBM, включая очень агрессивные линии GBM BTSC, BTSC73M, BTSC30M и BTSC68EF. Диссоциированные сферы BTSC высевали в количестве 1500 клеток/96-лунок и обрабатывали лекарственным соединением или носителем (ДМСО) через 1 день после помещения в планшет. Через 72 часа определяли жизнеспособность клеток после введения лекарственного средства в исследовании alamarBlue™ (InvitRogen) согласно инструкциям производителя. Все эксперименты с культурами проводили в трех повторностях, и для расчетов использовали минимальное значение, полученное для трех лунок. Значения IC50, полученные по результатам этих экспериментов, сравнивали со значениями для соединения BP-1-102 (также называемого в указанных экспериментах соединение 1) и кукурбитацина, ингибитора JAK2 и наиболее активного ингибитора BTSC до настоящего времени, используемых в качестве веществ сравнения (таблица 2).
Тем не менее, плохая ГЭБ проницаемость отрицательно влияет на клиническую значимость кукурбитацина. В соответствии с другими данными, полученными для других опухолевых клеток, содержащих активированный STAT3, соединение 1 имело активность в диапазоне низких мкМ (фиг. ^). Наиболее удивительно, что полученная библиотека содержала ряд более высокоактивных ингибиторов, которые имели значения цитотоксичной IC50 в диапазоне низких наномолей (нМ) в отношении BTSC, включая неожиданную активность в отношении 73M. Следует отметить, что толуильные аналоги (R2 = толуил, 18, 23, 42-46) имели низкую растворимость и значительно более низкую активность по сравнению с соединениями, где R2 представлял собой пентафторбензол, из которых получали гомогенные растворы. Четыре наиболее активных соединения, 22, 31, 32 и 33, которые имели значения IC50 в диапазоне от 100 нМ до 3,8 мкМ, дополнительно исследовали в отношении BTSC, 25M, 67EF, 73EF, 84EF и 127EF, которые являются молекулярно гетерогенными GBM человека (фиг. 1А и 1B). В целом, соединения 22 и 31-33 имели наиболее выраженную активность в отношении всех 8 исследуемых BTSC, где значения EC50 находились в диапазоне 66-1145 нМ. Тем не менее, среди четырех наиболее активных агентов соединение 31, содержащее заместитель бензойной кислоты, имело значительно более высокую активностью в отношении большого числа BTSC. Очень важно отметить, что соединение 31, имеющее значение EC50 66 ± 33,9 нМ в отношении 127EF, представляет собой наиболее активный ингибитор BTSC, состоящий из небольших молекул, даже более активный по сравнению с кукурбитацином (EC50=630 нМ и 700 нМ в отношении 30M и 73M, соответственно).
С учетом цитотоксичности в диапазоне нМ исследовали биологическое действие указанных соединений на здоровые клетки. Ряд астроцитов эмбрионов здорового человека подвергали воздействию трех лучших ингибиторов в концентрации не более 5 мкМ (в 10-20 раз выше, чем полученное значение IC50 в отношении BTSC). Как показано на фиг. 2А, соединения 22, 31 и 32 имели минимальную токсичность при концентрации не более 5 мкМ в отношении клеток здорового человека, что явным образом определяет терапевтический диапазон указанных агентов при GBM.
Далее для подтверждения сохранения аффинности связывания STAT3 проводили эксперименты связывания с использованием плазмонного поверхностного резонанса (ППР) на ProteOn XPR36 (Bio-rad). Вкратце, полноцепочечный белок STAT3 с меткой His (SignalChem) иммобилизовали на чувствительном чипе THE (bio-Rad, Ontario, Canada). Для определения констант скорости ассоциации и диссоциации (kon и koff) проводили оценку связывания лекарственное средство-белок при различных концентрациях. Наиболее удивительно, что все четыре соединения имели высокую активность связывания в нМ диапазоне (фиг. 2В). Было показано, что соединение 31 обладало наиболее высокой активностью связывания, значение Kd(koff/kon)=300±27 нМ. Таким образом, соединение 31 согласно полученным выше результатам с учетом их сравнения с данными, известными из уровня техники, представляет собой наиболее активный ингибитор нефосфорилированного STAT3, известный в настоящее время, который имеет значения Kd в отношении белка STAT3 в диапазоне низких нМ. Исследования, отраженные на ФИГ. 2В, проводили для нескольких концентраций, т.е. 5,000, 1,667, 0,556 и 0,185 мкМ.
Затем для оценки разрушения комплексов фосфопептид:домен SH2 STAT3 соединения испытывали в исследовании с флуоресцентной поляризацией (FP), таком как сообщалось ранее Schust, J., et al. (Anal. Biochem. 330, 114-118, 2004) и Wu, P. et al. (Anal. Biochem. 249, 29-36, 1997). Вкратце, пептидный зонд, меченый флуоресцеином (5-FAM-GpYLPQTV-NH2 (CanPeptide), инкубировали с белком STAT3 (SignalChem) и ингибитором в течение 30 минут, а затем анализировали на флуориметре Tecan M1000 (Tecan). Строили график зависимости поляризованной флуоресценции от концентрации ингибитора и определяли значения IC50 путем подстановки в кривую зависимости доза- ответ. Множество новых производных имели улучшенную активность связывания по сравнению с соединением 1. Как и ожидалось, во внеклеточных условиях пролекарственные аналоги 17-20, 22, 26-27 и 39-40 не обладали активностью связывания. Кроме того, используемое в качестве отрицательного контроля соединение 36, в котором отсутствовала обеспечивающая связывание группа салициловой кислоты, не препятствовало взаимодействию STAT3:фосфопептид. Соединения, содержащие нейтральный амидосульфонамидный заместитель, обладали более низкой активностью ингибирования. Введение в качестве заместителя гидроксиламина (32) приводило к значительному улучшению активности ингибирования. Наконец, в хорошем соответствии с данными ППР соединение 27 представляло собой наиболее активный ингибитор STAT3. Кроме того, соединение 31 имело >5-кратную селективность в отношении STAT3 и STAT5 по сравнению со STAT1, который обладает противоопухолевым действием.
Клеточные уровни активированного STAT3 определяли при помощи вестерн-блот анализов фосфорилированного STAT3, включая, Y705, а также pSTAT3 S727 и нижележащие гены-мишени, Bc1-xL и циклин D1. Блокировка домена SH2 STAT3 не должна ингибировать фосфорилирование S727, но только Y705. Для анализа белков после введения лекарственного средства сферы BTSC разрушали до отдельных клеток и 1×106 клеток обрабатывали лекарственным средством или носителем (ДМСО) в различных концентрациях и в различные моменты времени. 15 мкг белка помещали в 7,5% или 10% гели для ДСН-ПААГ и переносили в систему транс-блот на мембраны из нитроцеллюлозы. Блоты окрашивали антителами: фосфо-Y705, фосфо-S727, Bc1-xL, циклином D1, PARP и актином. Полосы визуализировали с использованием системы ECL Plus™ Western Blotting Detection System и Hyperfilm™ (Amersham). Наиболее удивительно, что при 1 мкМ четыре лучших соединения с высокой активностью подавляли pSTAT3 (Y705), но не влияли на общие концентрации STAT3 или pSTAT3 S727 (уровень). Кроме того, побочное действие в отношении киназных мишеней, включая MAPK или EGFR, а также структурного белка Р-тубулина, не наблюдали. Следует отметить, что соединения 22, 31 и 32 с наибольшей активностью подавляли pSTAT3 (Y705). Для определения возможной зависимости наблюдаемых биологических ответов от концентрации STAT3 и кроме того для определения точной активности ингибирования pSTAT3 выбранные BTSC обрабатывали лучшими ингибиторами в различных концентрациях (0, 0,1, 0,5, 1,0 и 5,0 мкМ) и лизаты подвергали вестерн-блот анализу. Наиболее удивительно, что наблюдали зависящее от дозы уменьшение уровня pSTAT3, а также высокоактивное ингибирование нижележащих мишеней, задействованных в росте и выживании клеток, циклина D1 и Bc1-xL. Особенно следует отметить, что соединение 31, обладавшее наибольшей активностью в отношении BTSC, обеспечивало зависящее от дозы уменьшение уровня pSTAT3, которое хорошо коррелировало с наблюдаемой цитотоксичностью и подавлением нижележащих мишеней. В частности, обработка соединением 31 в концентрации 500 нМ полностью подавляла сигнал pSTAT3. Соединения 22 и 32, хоть и были незначительно менее активными, также ингибировали pSTAT3 в концентрации в диапазоне нМ.
Для дополнительной оценки побочного действия проводили скрининг соединений 22, 31 и 32 in vitRo для определения активности в отношении пяти киназ, связанных с раком, c-Src, ERK1, AKT, JaK1 и JaK2 в концентрации 5 мкМ (в 10-15 раз выше по сравнению с определенным значением IC50 в отношении BTSC). Вкратце, в этом исследовании для определения активности переноса фосфорила киназами использовали систему радиометрического детектирования. Три лучших ингибитора имели умеренную или даже незначительную активность в отношении указанной группы киназ. Например, все три соединения незначительно ингибировали Akt1, Erk1 и JaK1 и при этом только лишь умеренно ингибировали c-Src и JaK2 (~50% ингибирование киназной активности). Таким образом, так как концентрация ингибитора, требуемая для эффективного ингибирования киназы, была в 15 раз выше по сравнению со значениями IC50 в отношении BTSC, было показано, что биологическая активность не являлась результатам ингибирования предшествующей JaK киназы.
Для более полного исследования возможного побочного действия проводили скрининг соединения 31 в отношении кинома (101 различная киназа, DiscoveRx™ KINOMEscan), а также белков и рецепторов (21 биологически важный рецептор, связанный с G-Белком (GPCR)). В скрининге кинома киназы, меченные ДНК, обрабатывали соединением 31 (500 нМ) и инкубировали с иммобилизованным лигандом, предназначенным для присоединения целевой киназы. Для измерения уровня иммобилизованных киназ после обработки соединением 31 использовали ультрачувствительную количественную ПЦР (кПЦР). Уровни иммобилизованных киназ сравнивали с контрольными образцами и факт ингибирования фиксировали, если количество захваченных киназ падало ниже порогового значения 35%. В скрининге GPCR для оценки активности соединения 31 применяли широко используемую платформу исследования GPCR PathHunter с Р-аррестином (DiscoveRx). GPCR по праву считают наиболее важным семейством мембранных рецепторов вследствие их первостепенной роли в регулировании внутриклеточной сигнальной трансдукции. В результате GPCR входят в число наиболее тщательно исследованных мишеней для лекарственного воздействия в фармацевтической промышленности. Важно отметить, что соединение 32 не обладало побочной активностью в отношении любого из 21 исследуемых GPCR (500 нМ). Кроме того, соединение 31 в той же концентрации (500 нМ) обладало незначительным действием в отношении типового семейства киназ, включая большое число киназ, содержащих домены SH2 (JaK1 и JaK2) и SH3 (Fes, Fer, Fyn). Отсутствие побочной киназной активности проиллюстрировано на древовидной диаграмме tReeSpot (ФИГ. 3). С учетом того, что по оценкам существует 117 доменов SH2 и ~300 доменов SH3, было важно, что соединение 31 обладало относительной селективностью в отношении целевого домена SH2 STAT3, что способствует минимизации нежелательных биологических явлений. В целом, соединение 31 обладало отличительной цитотоксичностью в отношении диапазона BTSC человека, не обладало токсичностью в отношении астроцитов эмбрионов человека при концентрациях в 15-20 раз выше по сравнению со значением IC50, с высокой активностью подавляло pSTAT3 в концентрациях в диапазоне нМ, что хорошо коррелировало со значениями Kd in vitRo в диапазоне нМ (ППР), ингибировало нижележащие мишени STAT3 и не имело значительного побочного действия в терапевтических дозах, что было определено в скринингах кинома и GPCR.
Наконец, для установления клинической значимости ингибиторов активность соединения 31 сравнивали с лучшим ингибитором JaK2, WP1066, в отношении 73M, одной из наиболее агрессивных линий BTSC (ФИГ. 4). Сравнительные вестерн-блот анализы показали равное подавление pSTAT3 при концентрации ингибитора 1 мкМ. Тем не менее, следует отметить, что ингибиторы предшествующей JaK киназы страдали от недостаточной селективности к киназам и низкой эффективности in vivo, включая проницаемость через гематоэнцефалический барьер. Как отмечалось ранее, соединения, описанные в настоящей заявке, не ингибируют JaK в терапевтических дозах и, по-видимому, действуют путем непосредственного ингибирования STAT3.
Вкратце, наиболее активные нефосфорилированные ингибиторы домена SH2 STAT3, непосредственно связывающиеся с ним, синтезировали и исследовали согласно настоящему описанию. Кроме того, проводили оценку их применения в отношении GBM BTSC, которые, как сообщалось в последнее время, имеют высокий уровень гиперактивированного STAT3, который, что важно отметить, является основным медиатором онкогенеза рака головного мозга и резистентности BTSC к лекарственным средствам. Соединение 31 обладало наивысшей аффинностью связывания STAT3 среди нефосфорилированных ингибиторов, состоящих из небольших молекул, подобных лекарственным средствам (ППР, Kd = 315 нМ), и, как было показано, эффективно препятствует взаимодействиям БТЛТЗ/фосфопептид. Кроме того, в исследованиях цельных клеток ингибиторы, приведенные в настоящем описании, эффективно подавляли фосфорилирование STAT3 и нижележащих белковых мишеней (циклина D1 и Bc1-xL). В первый раз был явным образом продемонстрирован потенциал использования ингибиторов STAT3 для лечения BTSC и его клиническая эффективность при клиническом применении для лечения GBM.
В настоящем описании были выявлены новые высокоактивные ингибиторы STAT3, проводили исследования миметиков салициловой кислоты. Тем не менее, авторы настоящего изобретения также исследовали другие ингибиторы STAT3, такие как те, о которых сообщалось в международной заявке на патент WO 2012/018868. Указанные специфические соединения содержат заместители при R4 в формуле 1, приведенной выше. Тем не менее, с учетом определенного положения R1, R2 и R3 и подтверждения того, что полученные соединения являются ингибиторами STAT3, специалистам в данной области техники также должны понимать, что согласно настоящему изобретению помимо предполагаемых модификаций R4 и другие заместители, предложенные в международной заявке на патент WO 2012/018868, также могут обеспечивать соединение, обладающее активностью ингибирования STAT3. Тем не менее, следует понимать, что модификации, предложенные в настоящем описании, обеспечивают новые соединения, обладающие значительно улучшенной активностью ингибирования STAT3.
Предполагается, что количество соединения согласно настоящему изобретению, требуемое для применения для лечения, зависит не только от конкретного применяемого соединения, но также от способа введения, природы состояния, требующего лечения, и возраста и общего состояния пациента, и, в конечном счете, определяется лечащим врачом. В целом, вводимое количество определяется эмпирически и обычно находится в диапазоне от примерно 10 мкг до 100 мг/кг массы тела реципиента.
Требуемая доза для удобства может быть представлена в виде единичной дозы или может быть разделена на несколько доз, вводимых через соответствующие интервалы, например, в виде двух, трех, четырех или более доз в день.
Фармацевтические композиции включают, без ограничений, композиции, подходящие для перорального (включая трансбуккальное и сублингвальное), трансдермального или парентерального (включая внутримышечное, подкожное и внутривенное) введения или находящиеся в форме, подходящей для введения путем ингаляции.
При необходимости, составы можно представлять в виде отдельных дозируемых форм и можно получать при помощи любого из способов, хорошо известных в области фармации. Способы получения фармацевтических композиций могут включать стадии приведения соединения, описанного в настоящей заявке, в контакт с фармацевтически приемлемыми вспомогательными веществами, а затем, если необходимо, формования продукта с получением требуемого состава, в том числе с нанесением покрытия, при желании.
Фармацевтические композиции, подходящие для перорального введения, можно представлять в виде отдельных форм, таких как капсулы, крахмальные капсулы или таблетки, содержащих заранее определенное количество активного ингредиента; в виде порошков или гранул; в виде растворов, суспензий или эмульсий. Таблетки и капсулы для перорального введения могут содержать традиционные вспомогательные вещества, такие как связующие агенты, наполнители, смазывающие вещества, разрыхлители или смачивающие агенты. Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными в данной области. Жидкости для перорального применения могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта, требующего смешивания с водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, эмульгаторы, неводные носители (которые могут включать пищевые масла) или консерванты.
Соединения и комбинации, описанные в настоящей заявке, также могут подходить для парентерального введения (например, путем инъекции, например, болюсной инъекции или непрерывной инфузии) и могут быть представлены в виде единичной дозируемой формы в ампулах, заранее заполненных шприцах, контейнерах для инфузии малых дозировок или многодозных контейнерах с добавлением консервантов. Композиции могут находиться в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может находиться в форме порошка, полученного путем асептического выделения стерильного твердого вещества или путем лиофилизации из раствора, готового для восстановления перед применением в подходящем носителе, например, в стерильной воде или солевом растворе.
Композиции, подходящие для местного введения через ротовую полость, включают леденцы, содержащие активный ингредиент на ароматизированной основе, обычно сахарозе и аравийской камеди или трагаканте; пастилки, содержащие активный ингредиент на инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе.
Для введения путем ингаляции соединения и комбинации, описанные в настоящей заявке, могут быть представлены в форме композиции в виде сухого порошка, например, порошковой смеси соединения и подходящей порошковой основы, такой как лактоза или крахмал. Порошковая композиция может быть представлена в виде единичной дозируемой формы, например, в капсулах или картриджах, или в желатиновых или блистерных упаковках, из которых порошок можно вводить при помощи ингалятора или инсуффлятора.
Соединения, описанные в настоящей заявке, могут содержать хиральный центр, который приводит к образованию энантиомеров. Таким образом, соединения могут существовать в форме двух различных оптических изомеров, т.е. (+)- и (-)-энантиомеров. Все такие энантиомеры и их смеси, в том числе рацемические и скалемические смеси индивидуальных энантиомеров, включены в объем настоящего изобретения. Индивидуальные энантиомеры можно получать при помощи способов, хорошо известных специалистам в данной области, таких как хиральная ВЭЖХ, ферментативное разделение и хиральной вспомогательной дериватизации.
Также предполагается, что соединения согласно настоящему изобретению могут содержать более одного хирального центра. Таким образом, соединения согласно настоящему изобретению могут существовать в форме различных диастереомеров. Все такие диастереомеры и их смеси включены в объем настоящего изобретения. Индивидуальные диастереомеры можно получать при помощи способов, хорошо известных в данной области, таких как ВЭЖХ, кристаллизация и хроматография.
Термин «сольват» обозначает, что соединение, описанное в настоящей заявке, содержит один или более фармацевтически приемлемых растворителей, включая воду, приводящую к получению гидратов. Сольват может содержать одну или более молекул растворителя на молекулу соединения или может содержать одну или более молекул соединения на молекулу растворителя. Иллюстративные неограничивающие примеры гидратов включают моногидрат, дигидрат, тригидрат и тетрагидрат или полугидрат. В одном из вариантов реализации растворитель может удерживаться в кристалле различными способами, и, следовательно, молекулы растворителя могут занимать положения в решетке кристалла, или они могут образовывать связи с солями соединений, описанных в настоящей заявке. Сольват(ы) должен(ны) быть «приемлемым(и)» с точки зрения отсутствия вредного воздействия на реципиента. Сольватация может быть исследована при помощи способов, известных в данной области, таких как способ определения потерь при высушивании (LOD).
Сокращения, используемые в описании получения соединений согласно настоящему изобретению:
Получение соединений согласно настоящему изобретению
Соединения согласно настоящему изобретению можно получать в соответствии со способами, описанными в следующих схемах реакции 1 и 2 и примерах, или их модификациями с применением легкодоступных исходных веществ, реагентов и обычными способами или их вариациями, хорошо известными среднему специалисту в области органической химии.
Конкретные значения переменных на схемах приведены только в иллюстративных целях и не ограничивают описанные способы.
Схема 1:
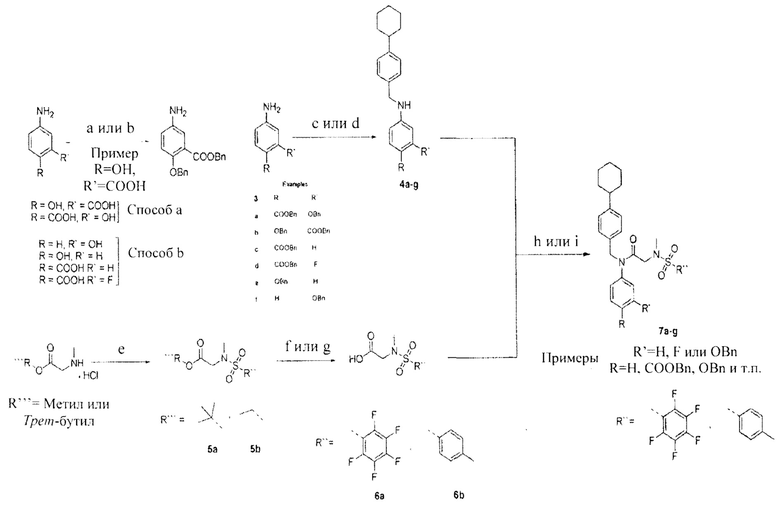 .
.
На схеме 1; a) BnBr, KOtBu, ДМФ, 0°C→КТ, 5 ч; затем BnBr, KOtBu, ДМФ, 0°C→КТ, 16 ч, 61%; b) BnBr, KOtBu, ДМФ, 0°C→КТ, 16 ч (74%) c) альдегид, AcOH, 4 Å МС, MeOH, 45°C, 3 ч; 2. NaCNBH3, КТ, 12 ч, 74-91%; d) альдегид, AcOH, 4 Å МС, CH3CH2Cl2, 30 мин; затем Na(OAc)3BH, КТ, 12 ч, 77-98%; e) C5F5SO2Cl или N-TsCl, ДИПЭА, CH3CN, 0°C, КТ, 1 ч, 92-95%; f) ДХМ:ТФК, 2:1, КТ, 1 ч, 95%; g) LiOH⋅H2O, ТГФ/H2O, 3:1, КТ, 1 ч, 80-85%) h) PPh3Cl2, 100°C нагрев СВЧ-излучением, CHCl3, 30 мин, 60-87%; i) (COCl)2, ДМФ(кат), ДИПЭА, CH2Cl2, КТ, 16 ч, 71-80%. N-TsCl = пара-толуолсульфонилхлорид; ДИПЭА = N,N-диизопропилэтиламин; ДМФ = N,N-диметилформамид; ТФК = трифторуксусная кислота; (COCl)2 = оксалилхлорид; ТГФ = тетрагидрофуран, LiOH⋅H2O, гидрат гидроксида лития.
Схема 2:
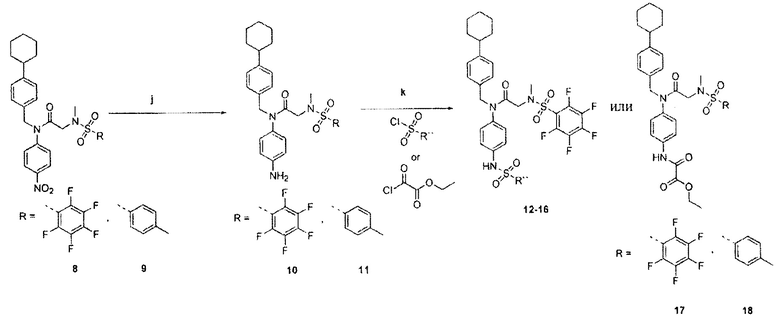
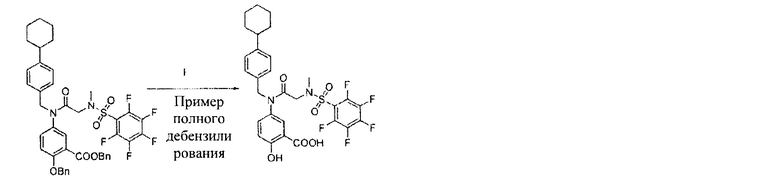
На схеме 2: j) SnCh⋅2H2O, MeOH, кипение, 16 ч, 78%; k) "R-SO2Cl, пиридин, ДХМ, 0°C→КТ, 16 ч, 81% l) H2, 10% Pd/C, MeOH/ТГФ, 1:1, КТ, 1-16 ч, 85-99%. SnCl2⋅2H2O = дигидрат хлорида олова, ДХМ = дихлорметан.
Химические способы
Безводные растворители, метанол, ДМСО, CH2Cl2, ТГФ и ДМФ, приобретали в Sigma Aldrich и использовали непосредственно из герметичных бутылок. 4А молекулярные сита, также приобретенные в Sigma Aldrich, активировали путем нагревания до 300°C в вакууме в течение ночи. Все реакции проводили в стеклянной посуде, высуженной в сушильном шкафу, и степень прохождения реакций определяли при помощи тонкослойной хроматографии (ТСХ) с применением силикагеля (визуализировали в УФ-свете или путем окрашивания, получаемого при обработке KMnO4 или реагентом Ханессиана). 400 МГц ЯМР-спектрометр Bruker применяли для получения 1H- и 13C-ЯМР спектров в CDCl3, CD3OD или d6-DMSO. Все химические сдвиги в ЯМР-спектрах (5) указывали в долях на миллион после калибровки с остаточным изотопным растворителем и константы взаимодействия (J) указывали в Гц. Перед началом биологических исследований чистоту ингибитора оценивали при помощи обращенно-фазовой ВЭЖХ (ОФ ВЭЖХ) по методу Water. Исследование при помощи ОФ ВЭЖХ проводили с применением колонки Microsorb-MV 300 Å C18 250 мм × 4,6 мм с потоком элюента 1 мл/мин и с применением градиента смесей (A) воды с 0,1% ТФК и (B) ацетонитрила, содержащего 10% H2O и 0,1% ТФК. Чистоту лигандов подтверждали с применением линейного градиента от 50% A и 50% B до 100% B после исходных 2 минут 100% A и второго линейного градиента от 100% A до 100% B. Линейный градиент представлял собой изменение композиции растворителей (I) на 5,2% в минуту и УФ-детектирования при 254 нм или (II) на 1,8% в минуту и детектирования при 254 нм и в обоих случаях заканчивался 100% B в течение 5 минут. При описании результатов ВЭЖХ времена удерживания для каждого из условий записывали вместе с чистотой в соответствующем порядке. Биологически оцененные соединения характеризуются >95% химической чистотой, измеренной при помощи ВЭЖХ. Следовые количества в результатах ВЭЖХ представлены в виде дополнительной информации.
Общая методика а (монобензилирование спиртов или кислот). К раствору аминобензиловых спиртов или 4-аминобензойной кислоты (1,0 экв.) в ДМФ (0,1 М) при 0°C при перемешивании добавляли KOtBu (1,1 экв.). Через 15 мин по каплям добавляли бензилбромид (1,1 экв.) и реакционную смесь перемешивали в течение ночи, а затем реакцию гасили H2O. Затем раствор несколько раз экстрагировали этилацетатом и органические слои объединяли. Затем органические слои промывали H2O и солевым раствором, а затем концентрировали, сушили над Na2SO4 и концентрировали в вакууме. Полученный остаток очищали с применением автоматизированного колоночного хроматографа Biotage Isolera с градиентом EtOAc и гексана, а затем сушили при пониженном давлении.
Общая методика b (дибензилирование салициловой кислоты). К раствору 4-аминосалициловой кислоты (6,00 г, 39,2 ммоль) в ДМФ (0,1 М) при 0°C при перемешивании добавляли KOtBu (4,84 г, 43,2 ммоль). Через 15 мин по каплям добавляли бензилбромид (5,14 мл, 43,2 ммоль). Суспензию перемешивали при КТ в течение дополнительных 4 ч, а затем реакционный сосуд снова охлаждали до 0°C. Добавляли еще 1,1 экв. KtOBu (2,84 г, 43,2 ммоль), а затем по каплям добавляли бензилбромид (5,14 мл, 43,2 ммоль). Затем реакционную смесь перемешивали в течение ночи и реакцию гасили H2O. Затем раствор несколько раз экстрагировали этилацетатом и органические слои объединяли. Затем органические слои промывали H2O и солевым раствором, а затем концентрировали, сушили над Na2SO4 и концентрировали в вакууме. Полученный остаток очищали с применением автоматизированного колоночного хроматографа Biotage Isolera с градиентом EtOAc и гексана, а затем сушили при пониженном давлении.
Общая методика c (восстановительное аминирование с применением цианоборгидрида натрия). К раствору анилина (1 экв.) и уксусной кислоты (1,1 экв.) в безводном MeOH (0,1 М) при перемешивании с 4 Å молекулярными ситами добавляли 4-циклогексилбензальдегид (1,5 экв.). Затем раствор нагревали до 45°C в течение 3 ч, а затем охлаждали до КТ. После добавляли NaCNBH3 (1,5 экв.) и реакционную смесь перемешивали при КТ в течение ночи. После завершения реакции, определяемого при помощи ТСХ, реакционную смесь концентрировали в вакууме и абсорбировали непосредственно с применением силикагеля для проведения очистки при помощи колоночной хроматографии с применением градиента EtOAc и гексана.
Общая методика d (восстановительное аминирование с применением триацетоксиборгидрида натрия). К раствору анилина (1 экв.) и уксусной кислоты (1,1 экв.) в безводном дихлорэтане (0,1 М) при перемешивании с 4 Å молекулярными ситами добавляли 4-циклогексилбензальдегид (1,5 экв.). Затем раствор перемешивали при КТ в течение 5 мин, после чего добавляли Na(OAc)3BH (1,5 экв.) и реакционную смесь перемешивали при КТ в течение ночи. После завершения реакции, определяемого при помощи ТСХ, реакционную смесь концентрировали в вакууме и абсорбировали непосредственно с применением силикагеля для проведения очистки при помощи колоночной хроматографии с применением градиента EtOAc и гексана.
Общая методика e (сульфонилирование вторичного амина). Раствор метиламино (1 экв.) и ДИПЭА (3 экв.) растворяли в безводном ацетонитриле и охлаждали до 0°C перед добавлением 2,3,4,5,6-пентафторбензол-1-сульфонилхлорида или TsCl (1,1 экв.) с получением целевого продукта. Полученный раствор перемешивали при КТ в течение ночи. Растворитель удаляли и остаток повторно растворяли в CH2Cl2. Затем органические слои последовательно промывали 0,1 М раствором HCl, насыщенным раствором NaHCO3 и солевым раствором. Затем органические слои сушили над Na2SO4 и концентрировали в вакууме с получением 6а или 6b. Продукт использовали далее без дополнительной очистки.
2,3,4,5,6-Пентафтор-N-метилфенилсульфонамидо)уксусная кислота (f). Раствор 6a растворяли в ТФК и сразу разбавляли ДХМ с получением 1:1 раствора ТФК:ДХМ (0,1 М). Реакционную смесь перемешивали при КТ в течение одного часа и совместно выпаривали с MeOH (3x), а затем CHCl3 (4x) почти досуха. Остаток повторно растворяли в EtOAc и гексане, загружали в колонку Biotage Isolera и очищали с применением градиента MeOH и ДХМ.
Общая методика g (гидролиз сложного эфира с применением гидроксида лития). Сложный метиловый или этиловый эфиры (1,0 экв.) растворяли в 3:1 смеси ТГФ:Н2O. Затем добавляли LiOH (1,1 экв.) и через 30 минут при помощи ТСХ подтверждали завершение реакции. Реакционную смесь разбавляли водой, подкисляли (pH~5,5) KH2PO4 и экстрагировали EtOAc. Органические слои промывали солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Реакционную смесь очищали при помощи колоночной флэш-хроматографии с применением изократической смеси растворителей (35:7:1 ДХМ:MeOH:H2O).
Общая методика h (амидное сочетание пептидов, промотируемое РРh3Сl2). К раствору кислоты (1,1 экв.) в CHCl3 (0,1 М) добавляли PPh3Cl2 (2,5 экв.). После пяти минут перемешивания при КТ одной порцией добавляли амин (1,0 экв.) и реакционную смесь грели в микроволновом реакторе при 125°C в течение 15 минут. Реакционную смесь концентрировали в вакууме и абсорбировали непосредственно с применением силикагеля для проведения очистки при помощи колоночной хроматографии с применением градиента EtOAc и гексана.
Общая методика i (конденсация, опосредованная оксалилхлоридом). К раствору кислоты (1,0 экв.) в безводном CH2O2 (0,1 М) при 0°C добавляли оксалилхлорид (1,2 экв.), а затем каплю ДМФ. Реакционную смесь перемешивали при 0°C в течение 1 ч в атмосфере осушенного азота, а затем концентрировали в вакууме. Затем реакционную смесь повторно растворяли в безводном CH2O2 (0,1 М). После перемешивания в течение 5 мин к реакционной смеси при 0°C добавляли амин (1,2 экв.) и триэтиламин (2,5 экв.) и реакционную смесь перемешивали при КТ в течение двух часов. Затем реакцию гасили H2O и водный слой несколько раз экстрагировали этилацетатом. Затем объединенные органические слои промывали солевым раствором и сушили над Na2SO4, растворитель удаляли при пониженном давлении. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (смесью гексан/этилацетат) с получением целевого продукта.
Восстановление нитросоединения до амина (j). Раствор (название нитросоединения) (143 мг, 0,4 ммоль) и дигидрата хлорида олова (II) (445 мг, 1,97 ммоль) в ДХМ/MeOH (2:1) (0,1 М) при перемешивании грели при 70°C до завершения реакции, определяемого при помощи ТСХ. Реакционную смесь концентрировали в вакууме, разбавляли водой и несколько раз экстрагировали этилацетатом. Затем органические слои объединяли, промывали насыщенным раствором NaHCO3, сушили над безводным Na2SO4 и фильтровали, растворитель удаляли при пониженном давлении. Продукт очищали с применением Biotage Isolera с градиентом 50% смесью БЮАс:гексан с получением белого твердого вещества (91%).
Общая методика k (сульфонилирование функциональных групп анилина). Амин со свободными функциональными группами растворяли в 1:1 смеси ДХМ/пиридин (0,1 М) и охлаждали до 0°C. По каплям добавляли требуемый сульфонилхлорид или этил-2-хлор-2-оксоацетат и реакционную смесь перемешивали до завершения реакции, определяемого при помощи ТСХ. Растворитель выпаривали и полученный остаток адсорбировали из CH2Cl2 на силикагеле и очищали на колонке Biotage Isolera с градиентом смесями EtOAc : гексан.
Общая методика 1 (гидрогенолиз сложного бензилового эфира и простого бензилового эфира). Кислоту, спирт или салициловую кислоту, защищенные бензилом (1 экв.), при перемешивании растворяли в смеси MeOH/ТГФ (1:2) (0,1 М). Раствор тщательно дегазировали и осторожно добавляли 10% Pd/C (10 мг/ммоль). Перед помещением реакционной смеси в атмосферу H2 через раствор в течение 5 минут продували газообразный H2, а затем реакционную смесь непрерывно перемешивали в течение 3 ч. Газообразный H2 удаляли и реакционную смесь фильтровали через целит для удаления Pd катализатора, а затем концентрировали при пониженном давлении. Полученный остаток адсорбировали из CH2O2 на силикагеле и очищали на колонке Biotage Isolera с градиентом смесями MeOH и ДХМ.
Синтез бензилгидроксиламинового производного (m) 19b
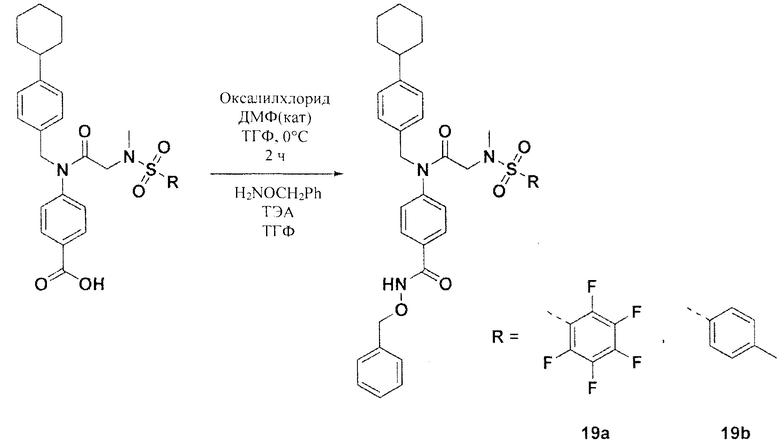 .
.
К раствору кислоты (50 мг, 0,09 ммоль) в безводном ТГФ (1 мл) при 0°C добавляли оксалилхлорид (25,6 мкМ, 0,32 ммоль) и каплю ДМФ. Реакционную смесь перемешивали при 0°C в течение двух часов, а затем концентрировали в вакууме и помещали в глубокий вакуум на 15 минут. Затем реакцию продолжали путем повторного растворения в ТГФ (1 мл) с последующим добавлением O-бензилгидроксиламина (21,7 мкМ, 0,18 ммоль) и триэтиламина (52 мкМ, 0,37 ммоль). Реакционную смесь перемешивали при КТ в течение 1 ч, а затем реакцию гасили H2O и водный слой несколько раз экстрагировали этилацетатом. Затем объединенные органические слои промывали солевым раствором и сушили над Na2SO4, растворитель удаляли при пониженном давлении. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (50% смесью гексан/этилацетат) с получением целевого продукта (13) в виде белого твердого вещества (51 мг, 79%).
Синтез (4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензил)фосфоновой кислоты (n)
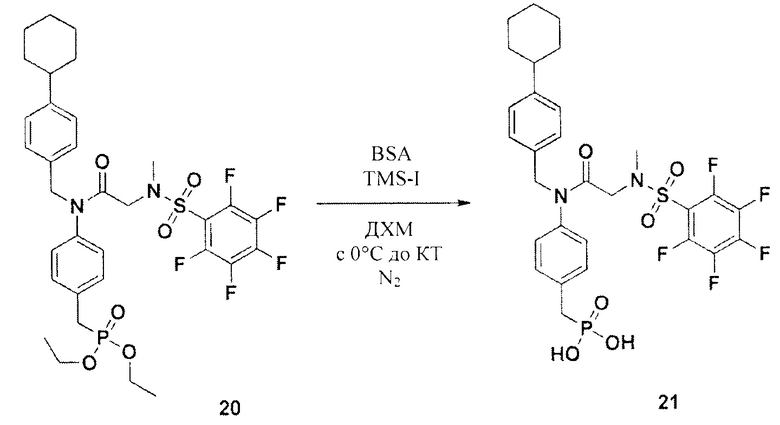 .
.
Иодтриметилсилан (11,94 мкМ, 0,084 ммоль) по каплям добавляли к раствору фосфоната (30 мг, 0,042 ммоль) и бис(триметилсилил)трифторацетамида (11,25 мкМ, 0,046 ммоль) в безводном ДХМ при 0°C. Реакционную смесь выдерживали в атмосфере азота и перемешивали в течение 1 ч при 0°C, медленно нагревали до комнатной температуры и перемешивали в течение еще 1 ч. Раствор концентрировали в вакууме и очищали при помощи ВЭЖХ с получением целевого продукта (20 мг, 74%).
Ацетилирование салициловай кислоты (о)
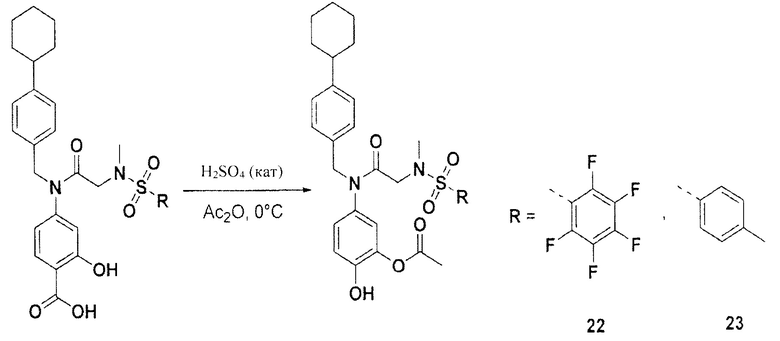
Каплю концентрированной серной кислоты добавляли к раствору целевой салициловой кислоты (30 мг, 0,05 ммоль) в уксусном ангидриде (0,5 мл) при 0°C и в атмосфере сухого азота. Реакционную смесь перемешивали при КТ до завершения реакции, определяемого при помощи ТСХ, а затем реакционную смесь охлаждали до 0°C и реакцию гасили ледяной водой. Смесь концентрировали в вакууме и очищали при помощи колоночной хроматографии на силикагеле (5% смесью метанол/дихлорметан) с получением ацетилированного продукта (21 мг, 60%).
Синтез 4-(1Н-тетразол-5-ил)анилина (р)
 .
.
Смесь 4-аминобензонитрила (100 мг, 0,85 ммоль), азида натрия (110,2 мг, 1,69 ммоль), ДМФ (8,5 мл) и хлорида аммония (45,3 мг, 0,85 ммоль) грели на масляной бане в течение 24 ч при 125°С. После завершения реакции, определяемого при помощи ТСХ, смесь подкисляли 1 н. раствором НСl и экстрагировали этилацетатом (3х). Объединенные этилацетатные слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Тетразольное соединение очищали при помощи колоночной хроматографии на силикагеле (90% смесью СН2Сl2/МеОН) с получением целевого продукта (102 мг, 74%).
Синтез сложных метилового и этилового эфиров (q)
SOCl2 (5 экв) по каплям добавляли к охлажденному раствору 4-аминобензойной кислоты (1 экв) в спирте (MeOH или EtOH). Затем реакционную смесь перемешивали при КТ в течение 30 минут. После завершения реакции, определяемого при помощи ТСХ, реакционную смесь концентрировали в вакууме и абсорбировали непосредственно с применением силикагеля для проведения очистки на хроматографической колонке.
Синтез сложных пиволоксильного и ацетоксиметилового эфиров (r)
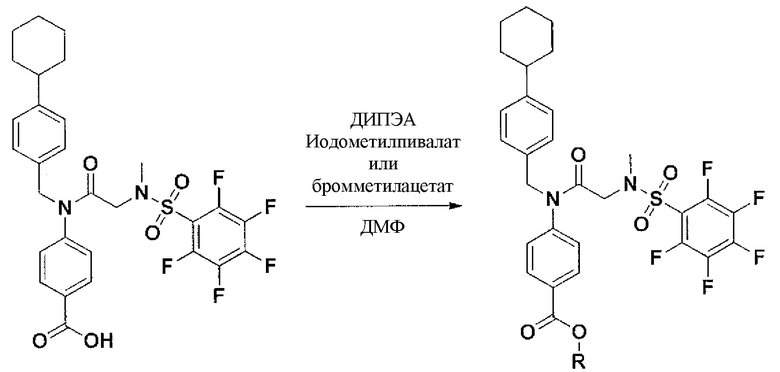
 .
.
Свободную кислоту (1,0 экв) растворяли в безводном ДМФ. Одной порцией добавляли дважды перегнанный ДИПЭА (2,1 экв), а затем добавляли иодометилпивалат или бромметилацетат (2,0 экв). Реакционную смесь накрывали оловянной фольгой и проводили реакцию при КТ в течение 24 часов. Реакционную смесь разбавляли водой и несколько раз экстрагировали EtOAc. Объединенные органические слои промывали водой и солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Концентрированный продукт повторно растворяли в растворе для ВЭЖХ согласно условию B. Указанный раствор очищали при помощи препаративной ВЭЖХ и сразу лиофилизировали из раствора элюента.
Пример 1 – Соединение 5а
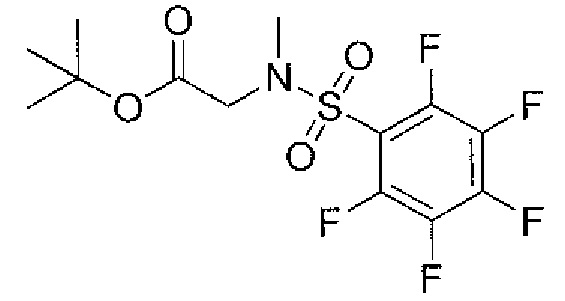 .
.
Трет-бутил-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетат.
Химическая формула: C13H14F5NO4S.
Молекулярная масса: 375,31.
Соединение 5а синтезировали в соответствии с общим способом а с получением конечного продукта 5а в виде белого твердого вещества (93%). δH (400 МГц, d-CDCl3) 1,37 (с, 9H, CH3), 3,03 (с, 3H, CH3), 4,10 (с, 2H, CH2); δC (100 МГц, d-CDCl3) 27,5, 35,3, 51,5, 115,6, 136,4, 144,8, 145,9, 167,0; МСНР (ЭР+). Вычислено [C13H14F5NO4S+H] 376,06, наблюдали 376,09.
Пример 2 – Соединение 5b
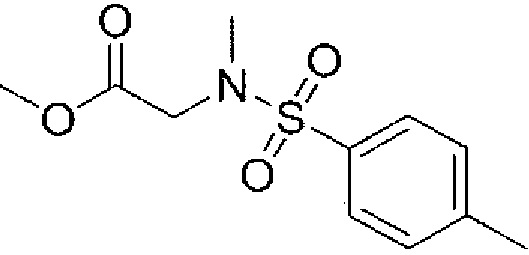 .
.
Метил-2-(N,4-диметилфенилсульфонамидо)ацетат.
Химическая формула: C11H15NO4S.
Молекулярная масса: 257,31.
Соединение 5b синтезировали в соответствии с общим способом а с получением конечного продукта 5b в виде белого твердого вещества (91%). δH (400 МГц, d-CDCl3) 2,42 (с, 3H, CH3), 2,87 (с, 3H, CH3), 3,65 (с, 3H, CH3), 3,96 (с, 2H, CH2), 7,30 (д, J=8,0 Гц, 2H, CH), 7,68 (д, J=8,2 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 21,1, 35,2, 50,3, 52,0, 126,9, 134,6, 143,0, 168,3; МСНР (ЭР+). Вычислено [C11H15NO4S+H] 258,08, наблюдали 258,29.
Пример 3 – Соединение 6a
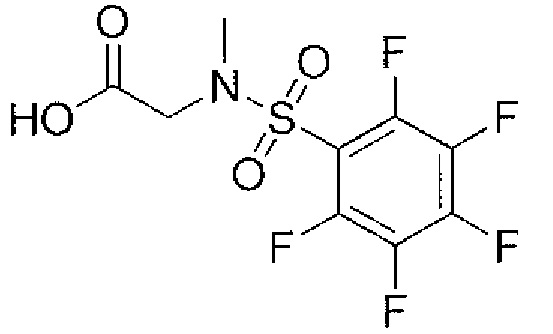 .
.
2-(2,3,4,5,6-Пентафтор-N-метилфенилсульфонамидо)уксусная кислота.
Химическая формула: C9H6F5NO4S.
Молекулярная масса: 319,21.
Соединение 6а синтезировали в соответствии с общим способом а с получением конечного продукта 6а в виде коричневого твердого вещества (95%). δH (400 МГц, d-CDCl3) 2,86 (с, 3H, CH3), 4,10 (с, 2H, CH2); δC (100 МГц, d-CDCl3) 35,4, 51,8, 115,3, 136,4, 145,9, 167,1; МСНР (ЭР+). Вычислено [C9H6F5NO4S+H] 320,00, наблюдали 319,97.
Пример 4 – Соединение 6b
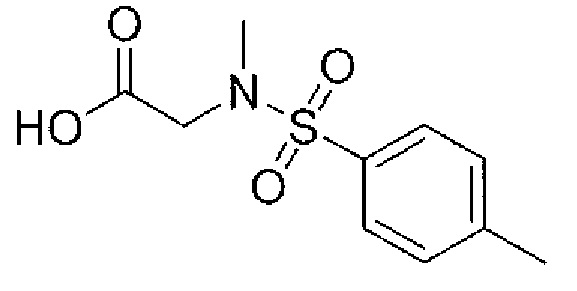 .
.
2-(N,4-Диметилфенилсульфонамидо)уксусная кислота.
Химическая формула: C10H13NO4S.
Молекулярная масса: 243,28.
Соединение 6b синтезировали в соответствии с общим способом g с получением конечного продукта 6b в виде белого твердого вещества (84%). δH (400 МГц, d-CDCl3) 2,32 (с, 3H, CH3), 2,76 (с, 3H, CH3), 3,86 (с, 2H, CH2), 7,21 (д, J=8,0 Гц, 2H, CH), 7,68 (д, J=8,2 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 20,8, 35,1, 50,0, 126,7, 134,2, 143,1, 172,9; МСНР (ЭР+). Вычислено [C10H13NO4S+H] 244,06, наблюдали 244,28.
Пример 5 - Соединение 3а
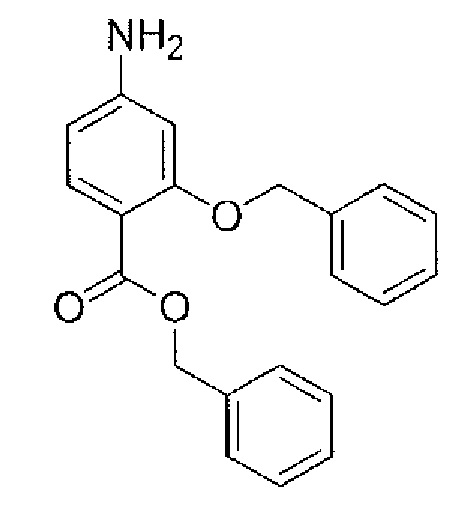 .
.
Бензил-4-амино-2-(бензилокси)бензоат.
Химическая формула: C21H19NO3.
Молекулярная масса: 333,3805.
Соединение 3а синтезировали в соответствии с общим способом а с получением конечного продукта 3а в виде оранжевого твердого вещества (71%). δH (400 МГц, d-CDCl3) 4,13 (шир, 2H, NH2), 5,05 (с, 2H, CH2), 5,35 (с, 2H, CH), 6,19-6,23 (м, 2H, CH), 7,31-7,49 (м, 10H, CH), 7,81-7,86 (м, 1H, CH); δC (100 МГц, d-CDCl3) 65,8, 70,3, 99,1, 106,7, 126,9, 127,6, 127,8, 128,0, 128,4, 134,4, 136,6, 136,7, 152,5, 160,8, 165,8; МСНР (ЭР+). Вычислено [C21H19NO3+Na] 356,13, наблюдали 356,33.
Пример 6 - Соединение 3b
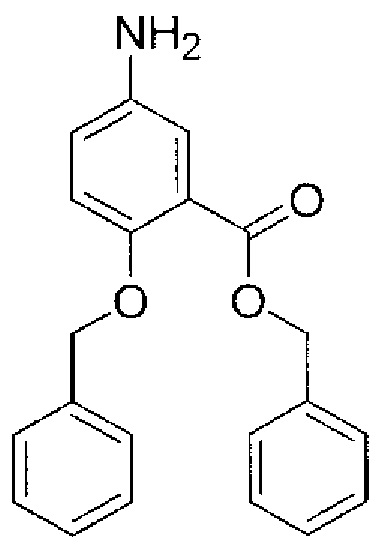 .
.
Бензил-5-амино-2-(бензилокси)бензоат.
Химическая формула: C21H19NO3.
Молекулярная масса: 333,38.
Соединение 3b синтезировали в соответствии с общим способом а с получением конечного продукта 3b в виде желтого твердого вещества (75%). δH (400 МГц, d-CDCl3) 4,21 (шир, 2H, NH2), 5,10 (с, 2H, CH2), 5,33 (с, 2H, CH2), 7,35-7,48 (м, 10H, CH); δC (100 МГц, d-CDCl3) 67,1, 70,8, 100,1, 105,4, 110,2, 126,4, 127,3, 127,9, 128,2, 128,1, 134,8, 136,3, 136,5, 152,5, 160,2, 165,7; МСНР (ЭР+). Вычислено [C21H19NO3+Na] 356,13, наблюдали 356,14.
Пример 7 – Соединение 3c
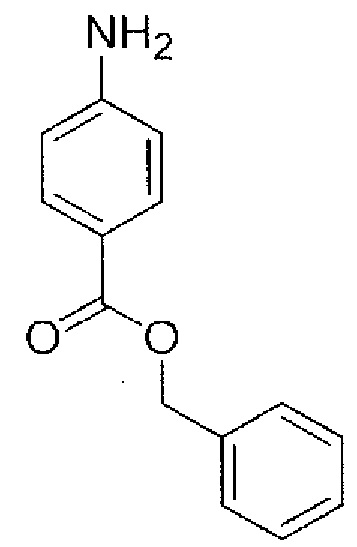 .
.
Бензил-4-аминобензоат.
Химическая формула: C14H13NO2.
Молекулярная масса: 227,26.
Соединение 3c синтезировали в соответствии с общим способом b с получением конечного продукта 3с в виде белого твердого вещества (82%). δH (400 МГц, d-CDCl3) 4,25 (шир, 2H, NH2), 5,38 (с, 2H, CH), 6,63 (д, J=8,2 Гц, 2H, CH), 7,33-7,51 (м, 5H, CH), 7,96 (д, J=8,2 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 66,1, 113,7, 118,9, 127,9, 128,0, 131,7, 136,6, 151,5, 166,6; МСНР (ЭР+). Вычислено [C14H13NO2+Na] 250,08, наблюдали 250,07.
Пример 8 - Соединение 3d
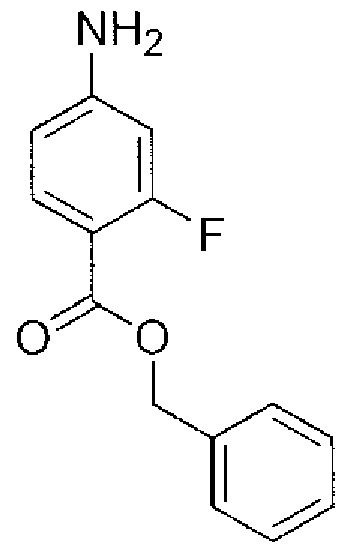
Бензил-4-амино-2-фторбензоат.
Химическая формула: C14H12FNO2.
Молекулярная масса: 245,25.
Соединение 3d синтезировали в соответствии с общим способом b с получением конечного продукта 3d в виде белого твердого вещества (98%). δH (400 МГц, d-CDCl3) 4,15 (шир, 2H, NH2), 5,34 (с, 2H, CH), 6,31-6,36 (м, 1H, CH), 6,38-6,43 (м, 1H, CH), 7,28-7,45 (м, 5H, CH), 7,76-7,82 (м, 1H, CH); δC (100 МГц, d-CDCl3) 66,1, 113,7, 118,9, 127,9, 128,0, 128,7, 131,7, 136,6, 151,5, 166,6; МСНР (ЭР+). Вычислено [C14H12FNO2+Na] 268,07, наблюдали 268,06.
Пример 9 – Соединение 3e
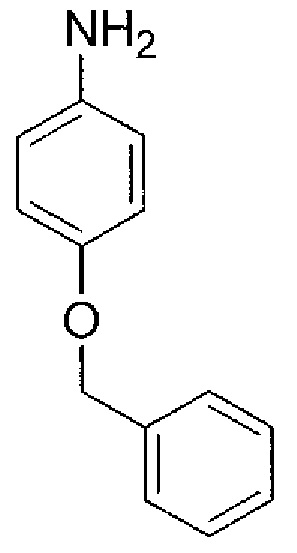 .
.
4-(Бензилокси)анилин.
Химическая формула: C13H13NO.
Молекулярная масса: 199,25.
Соединение 3е синтезировали в соответствии с общим способом b с получением конечного продукта 3е в виде серого твердого вещества (84%). δH (400 МГц, d-CDCl3) 3,66 (шир, 2H, NH2), 5,03 (с, 2H, CH2), 6,29-6,35 (м, 2H, CH), 6,38-6,44 (м, 2H, CH), 7,03-7,1 (м, 1H, CH), 7,29-7,45 (м, 5H, CH); δC (100 МГц, d-CDCl3) 68,1, 114,2, 116,6, 125,0, 127,5, 128,1, 136,9; МСНР (ЭР+). Вычислено [C13H13NO+H] 199,19, наблюдали 199,23.
Пример 10 – Соединение 3f
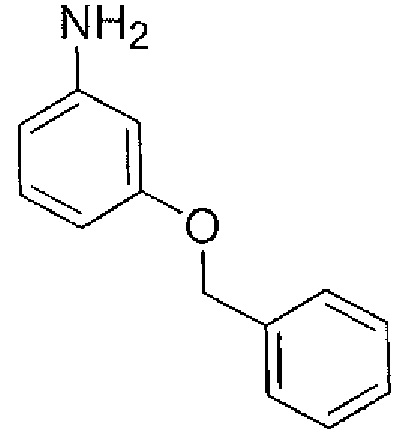
3-(Бензилокси)анилин.
Химическая формула: C13H13NO.
Молекулярная масса: 199,2484.
Соединение 3f синтезировали в соответствии с общим способом с получением конечного продукта 3f в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 3,66 (шир, 2H, NH2), 5,03 (с, 2H, CH2), 6,29-6,34 (м, 2H, CH), 6,38-6,43 (м, 1H, CH), 7,03-7,1 (м, 1H, CH), 7,31-7,45 (м, 5H, CH); δC (100 МГц, d-CDCl3) 70,9, 102,7, 105,6, 107,3, 126,5, 127,5, 128,1, 130,1, 151,2, 160,4; МСНР (ЭР+). Вычислено [C13H13NO+H] 199,19, наблюдали 199,23.
Пример 11 – Соединение 4a
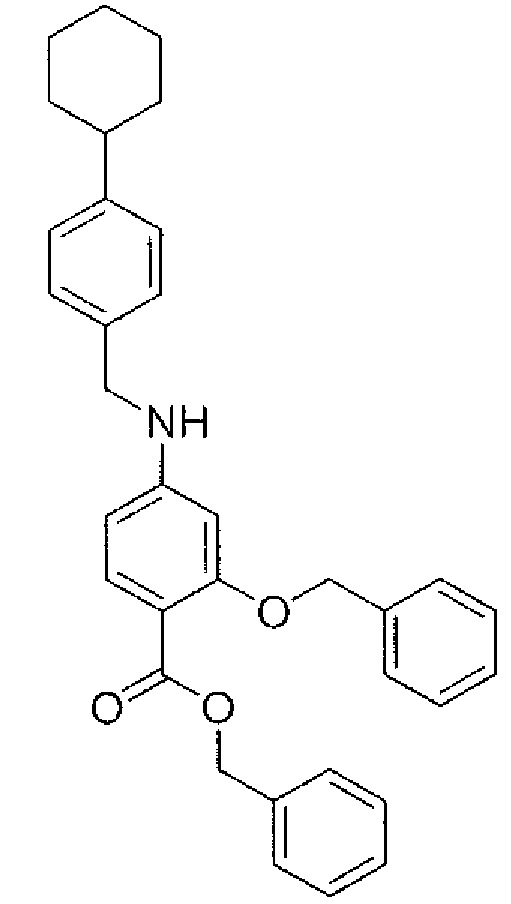 .
.
Бензил-2-(бензилокси)-4-((4-циклогексилбензил)амино)бензоат.
Химическая формула: C34H35NO3.
Молекулярная масса: 505,65.
Соединение 4а синтезировали в соответствии с общим способом c с получением конечного продукта 4а в виде оранжевого твердого вещества. δH (400 МГц, d-CDCl3) 1,25-1,48 (м, 5H, CH2), 1,73-1,94 (м, 5H, CH2), 2,48-2,52 (м, 1H, CH), 4,30 (с, 2H, CH2), 5,05 (с, 2H, CH2), 5,35 (с, 2H, CH2), 6,68-6,75 (м, 1H, CH), 6,19-6,23 (м, 2H, CH), 6,86-6,92 (м, 1H, CH), 7,16-7,22 (м, 2H, CH), 7,30-7,48 (м, 10H, CH), 7,37-7,4 (м, 2H, CH); δC (100 МГц, d-CDCl3) 26,1, 26,6, 34,3, 44,1, 47,1, 65,5, 70,2, 97,3, 104,9, 108,1, 125,9, 126,8, 127,2, 127,4, 128,1, 133,9, 134,8, 135,2, 136,6, 147,3, 152,8, 160,6, 165,7; МСНР (ЭР+). Вычислено [C34H35NO3+Na] 528,65, наблюдали 528,35.
Пример 12 – Соединение 4b
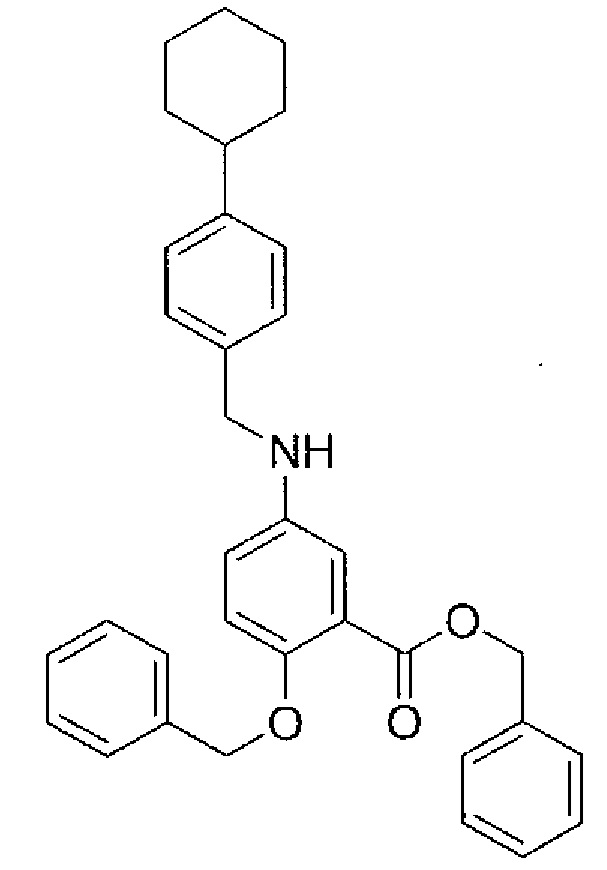 .
.
Бензил-2-(бензилокси)-5-((4-циклогексилбензил)амино)бензоат.
Химическая формула: C34H35NO3.
Молекулярная масса: 505,65.
Соединение 4b синтезировали в соответствии с общим способом c с получением конечного продукта 4b в виде оранжевого твердого вещества (86%). δH (400 МГц, d-CDCl3) 1,29-1,49 (м, 5H, CH2), 1,72-1,95 (м, 5H, CH2), 2,44-2,56 (м, 1H, CH), 4,25 (с, 2H, CH2), 5,05 (с, 2H, CH2), 5,4 (с, 2H, CH2), 6,68-6,75 (м, 1H, CH), 6,86-6,92 (м, 1H, CH), 7,16-7,22 (м, 3H, CH), 7,25-7,36 (м, 10H, CH), 7,37-7,4 (м, 2H, CH); δC (100 МГц, d-CDCl3) 26,1, 34,4, 44,2, 48,6, 66,6, 72,2, 115,6, 116,8, 117,6, 121,7, 126,9, 127,2, 127,5, 127,9, 128,1, 128,3, 128,6, 136,1, 136,3, 137,2, 142,4, 147,2, 150,5, 166,6; МСНР (ЭР+). Вычислено [C34H35NO3+Na] 528,65, наблюдали 528,35.
Пример 13 – Соединение 4с
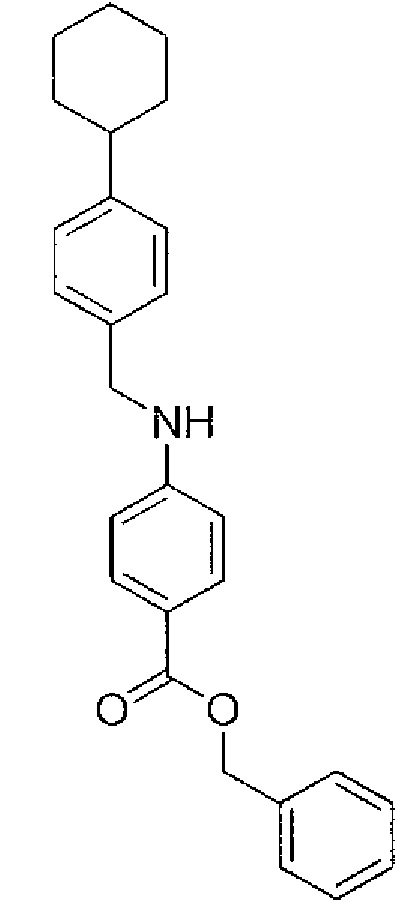 .
.
Бензил-4-((4-циклогексилбензил)амино)бензоат.
Химическая формула: C27H29NO2.
Молекулярная масса: 399,52.
Соединение 4с синтезировали в соответствии с общим способом d с получением конечного продукта 4с в виде белого твердого вещества (88%). δH (400 МГц, d-CDCl3) 1,48 (м, 5H, CH2), 1,71-1,93 (м, 5H, CH2), 2,42-2,55 (м, 1H, CH), 4,35 (с, 2H, CH2), 5,36 (с, 2H, CH2), 6,87 (д, J=8,0 Гц, 2H, CH), 7,10-7,16 (м, 4H, CH), 7,33-7,47 (м, 5H, CH), 8,10 (д, J=8,0 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 26,2, 26,5, 34,1, 44,1, 46,8, 66,9, 126,9, 128,2, 128,4, 128,5, 128,4, 131,3, 133,4, 135,1, 147,8, 165,1, 165,7; МСНР (ЭР+). Вычислено [C27H29NO2+H] 399,22, наблюдали 399,16.
Пример 14 - Соединение 4d
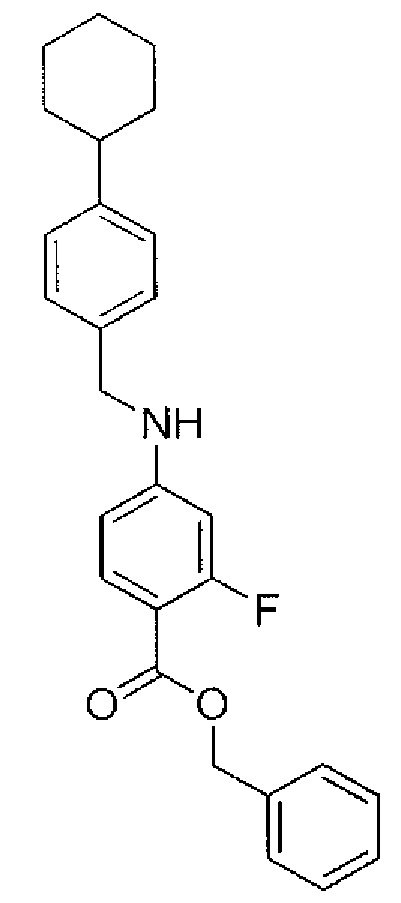 .
.
Бензил-4-((4-циклогексилбензил)амино)-2-фторбензоат.
Химическая формула: C27H28FNO2.
Молекулярная масса: 417,52.
Соединение 4d синтезировали в соответствии с общим способом d с получением конечного продукта 4d в виде белого твердого вещества (98%). δH (400 МГц, d-CDCl3) 1,26-1,49 (м, 5H, CH2), 1,72-1,95 (м, 5H, CH2), 2,48-2,56 (м, 1H, CH), 4,31 (с, 2H, CH2), 4,72 (шир, 1H, NH), 5,34 (с, 2H, CH2), 6,27-6,32 (м, 1H, CH), 6,36-6,41 (м, 1H, CH), 7,22 (д, J=Гц, 2H, CH), 7,27 (д, J=8,1 Гц, 2H, CH), 7,32-7,49 (м, 5H, CH), 7,78-7,84 (м, 1H, CH); δC (100 МГц, d-CDCl3) 25,9, 26,8, 34,3, 44,1, 47,3, 65,9, 106,2, 108,3, 127,2, 127,4, 127,8, 128,4, 133,4, 134,9, 136,4, 147,6, 153,5, 153,6, 162,9, 164,3, 165,6; МСНР (ЭР+). Вычислено [C27H28FNO2+H] 418,21, наблюдали 419,38.
Пример 15 - Соединение 4e
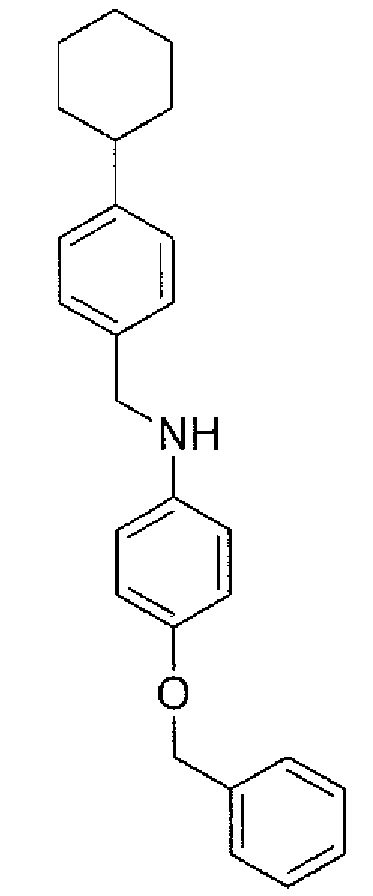 .
.
4-(Бензилокси)-]У-(4-циклогексилбензил)анилин.
Химическая формула: C26H29NO.
Молекулярная масса: 371,51.
Соединение 4е синтезировали в соответствии с общим способом c с получением конечного продукта 4е в виде желтого твердого вещества (86%). δH (400 МГц, d-CDCl3) 1,50 (м, 5H, CH2), 1,29-1,48 (м, 5H, CH2), 2,43-2,56 (м, 1H, CH), 4,25 (с, 2H, CH2), 5,01 (с, 2H, CH2), 6,58-6,65 (м, 2H, CH), 6,84-6,90 (м, 2H, CH), 7,20 (д, J=7,9 Гц, 2H, CH), 7,31 (д, J=8,2 Гц, 2H, CH), 7,33-7,46 (м, 5H, CH); δC (100 МГц, d-CDCl3) 26,2, 26,9, 34,5, 44,3, 70,9, 113,9, 116,2, 127,0, 127,5, 127,6, 127,7, 128,5, 136,9, 137,7, 142,9, 147,1, 151,4; МСНР (ЭР+). Вычислено [C26H29NO+H] 371,23, наблюдали 372,25.
Пример 16 - Соединение 4f
 .
.
3-(Бензилокси)-N-(4-циклогексилбензил)анилин.
Химическая формула: C26H29NO.
Молекулярная масса: 371,51.
Соединение 4f синтезировали в соответствии с общим способом d с получением конечного продукта 4f в виде желтого твердого вещества (76%). δH (400 МГц, d-CDCl3) 1,42 (м, 5H, CH2), 1,71-1,91 (м, 5H, CH2), 2,43-2,54 (м, 1H, CH), 4,26 (с, 2H, CH2), 5,01 (с, 2H, CH2), 6,27-6,33 (м, 2H, CH), 6,35-6,40 (м, 1H, CH), 7,06-7,13 (м, 1H, CH), 7,19 (д, J=8,1 Гц, 2H, CH), 7,28 (д, J=8,1 Гц, 2H, CH), 7,31-7,45 (м, 5H, CH); δC (100 МГц, d-CDCl3) 26,2, 26,5, 34,1, 44,1, 49,5, 70,1, 103,1, 106,8, 106,9, 114,1, 116,4, 127,3, 127,5, 127,6, 128,5, 136,9, 137,7, 147,1; МСНР (ЭР+). Вычислено [C26H29NO+H] 371,23, наблюдали 372,28.
Пример 17 - Соединение 4g
 .
.
Дибензил-5-((4-циклогексилбензил)амино)изофталат.
Химическая формула: C35H35NO4.
Молекулярная масса: 533,6567.
Соединение 4g синтезировали в соответствии с общим способом d с получением конечного продукта 4g в виде желтого твердого вещества (88%). δH (400 МГц, d-CDCl3) 1,31-1,42 (м, 5H, CH2), 1,74-1,89 (м, 5H, CH2), 2,41-2,50 (м, 1H, CH), 4,94 (с, 2H, CH2), 5,31 (с, 4H, CH2), 7,01-7,14 (м, 4H, CH), 7,37-7,52 (м, 10H, CH), 7,81-7,86 (м, 2H, CH), 8,42 (м, 2H, CH); δC (100 МГц, d-CDCl3) 26,1, 26,5, 34,1, 49,1, 67,2, 68,1, 116,1, 118,5, 119,1, 126,1, 127,1, 127,5, 127,9, 138,4, 138,7, 141,2, 144,3, 147,5, 161,4, 166,1; МСНР (ЭР+). Вычислено [C35H35NO4+H] 534,32, наблюдали 534,17.
Пример 18 - Соединение 4h
 .
.
Диэтил-4-((4-циклогексилбензил)амино)бензилфосфонат.
Химическая формула: C24H34NO3P.
Молекулярная масса: 415,5054.
Соединение 4h синтезировали в соответствии с общим способом c с получением конечного продукта 4h в виде желтой маслянистой жидкости (78%). δH (400 МГц, d-CDCl3) 1,24 (т, J=7,1 Гц, 6H, CH3), 1,34-1,45 (м, 5H, CH2), 1,70-1,89 (м, 5H, CH2), 2,43-2,54 (м, 1H, CH), 3,01 (с, 3H, CH3), 3,10 (с, 1H, CH), 3,16 (с, 1H, CH), 3,93-4,04 (м, 4H, CH2), 4,25 (м, 2H, CH2), 6,58 (д, J=8,2 Гц, 2H, CH), 7,10 (д, J=7,9 Гц, 2H, CH), 7,17 (д, J=8,0 Гц, 2H, CH), 7,27 (д, J=8,0 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 16,2, 16,3, 26,0, 26,8, 48,0, 61,8, 61,9, 112,9, 113,0, 126,9, 127,5, 130,4, 130,5, 136,5, 147,0; МСНР (ЭР+). Вычислено [C24H34NO3P+Н] 416,24, наблюдали 416,32.
Пример 19 - Соединение 4i
 .
.
N-(4-Циклогексилбензил)-4-(1#-тетразол-5-ил)анилин.
Химическая формула: C20H23N5.
Молекулярная масса: 333,43.
Соединение 4i синтезировали в соответствии с общим способом d с получением конечного продукта 4i в виде белого твердого вещества (89%). δH (400 МГц, d-МеОD3) 1,23-1,45 (м, 5H, CH2), 1,71-1,91 (м, 5H, CH2), 2,45-2,55 (м, 1H, CH), 4,31 (д, J=5,3 Гц, 2H, CH2), 4,71 (шир, 1H, NH), 6,55 (д, J=8,8 Гц, 2H, CH), 7,20-7,28 (м, 4H, CH), 8,10 (д, J=8,8 Гц, 2H, CH); δC (100 МГц, d-C2D6CO) 113,1, 121,5, 126,6, 143,2, 154,3; МСНР (ЭР+). Вычислено [C20H23N5+H] 334,20, наблюдали 334,31.
Пример 20 - Соединение 4j
 .
.
N-(4-Циклогексилбензил)-4-нитроанилин.
Химическая формула: C19H22N2O2.
Молекулярная масса: 310,39.
Соединение 4j синтезировали в соответствии с общим способом c с получением конечного продукта 4j в виде желтого твердого вещества (85%). δH (400 МГц, d-CDCl3) 1,21-1,47 (м, 5H, CH2), 1,72-1,92 (м, 5H, CH2), 2,45-2,57 (м, 1H, CH), 4,28 (д, J=5,3 Гц, 2H, CH2), 4,78 (шир, 1H, NH), 6,57 (д, J=8,9 Гц, 2H, CH), 7,19-7,29 (м, 4H, CH), 8,10 (д, J=8,9 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 25,2, 26,1, 34,1, 43,2, 48,7, 113,5, 126,2, 127,5, 128,5, 136,9, 137,7, 145,1, 154,4; МСНР (ЭР+). Вычислено [C19H22F5N2O2+H] 311,16, наблюдали 311,21.
Пример 21 - Соединение 4k
 .
.
Метил-4-((4-циклогексилбензил)амино)бензоат.
Химическая формула: C21H25NO2.
Молекулярная масса: 323,43.
Соединение 4k синтезировали в соответствии с общим способом c с получением конечного продукта 4k в виде коричневого твердого вещества (81%). δH (400 МГц, d-CDCl3) 1,26-1,47 (м, 5H, CH2), 1,64-1,91 (м, 5H, CH2), 2,37-2,54 (м, 1H, CH), 3,91 (с, 3H, CH3), 4,32 (с, 2H, CH2), 6,79 (д, J=7,4 Гц, 2H, CH), 7,01-7,14 (м, 4H, CH), 7,89 (д, J=8,0 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 25,2, 26,1, 34,3, 43,6, 48,1, 51,8, 112,3, 122,1, 126,4, 131,2, 137,3, 147,6, 152,4, 165,8; МСНР (ЭР+). Вычислено [C21H25NO2+Na] 346,18, наблюдали 345,88.
Пример 22 - Соединение 41
 .
.
Этил-4-((4-циклогексилбензил)амино)бензоат.
Химическая формула: C22H27NO2.
Молекулярная масса: 337,46.
Соединение 41 синтезировали в соответствии с общим способом c с получением конечного продукта 41 в виде белого твердого вещества (81%). δH (400 МГц, d-CDCl3) 1,46 (м, 8H, CH2), 1,64-1,91 (м, 5H, CH2), 2,38-2,54 (м, 1H, CH), 4,31 (кв, J=7,1 Гц, 2H, CH2), 4,32 (с, 2H, CH2), 6,64 (д, J=7,9 Гц, 2H, CH), 7,01-7,14 (м, 4H, CH), 7,86 (д, J=8,1 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 14,3, 25,4, 26,1, 34,5, 44,1, 48,1, 60,3, 112,3, 122,1, 126,4, 128,1, 131,8, 136,9, 147,6, 151,4, 166,8; МСНР (ЭР+). Вычислено [C22H27NO2+Na] 360,19, наблюдали 359,89.
Пример 23 - Соединение 7a
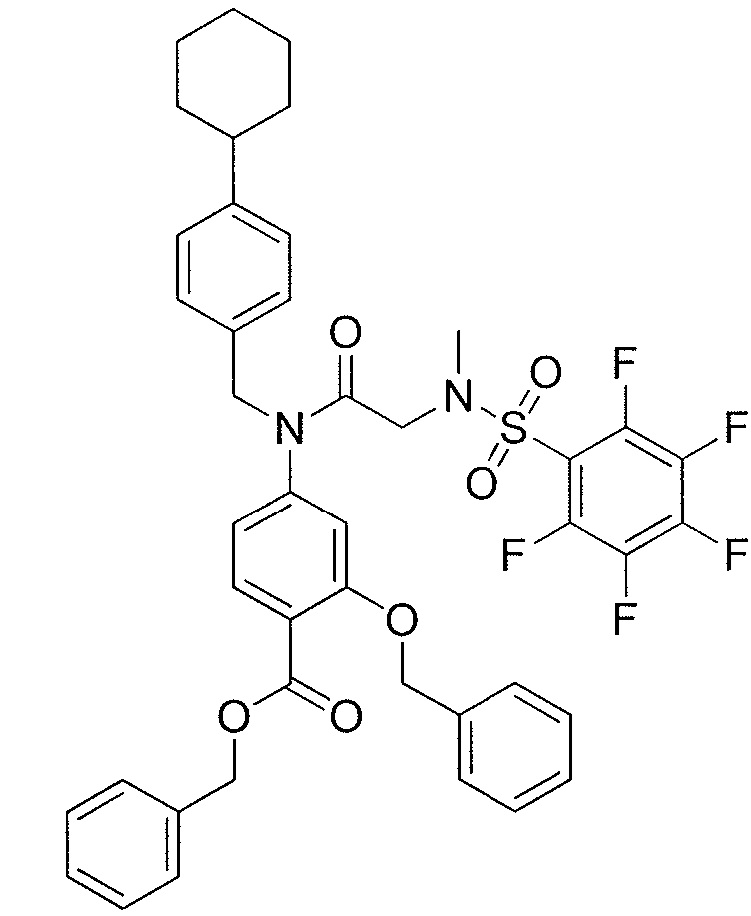 .
.
Бензил-2-(бензилокси)-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метил фенил сульфонамидо)ацетамидо)бензоат.
Химическая формула: C43H39F5N2O6S.
Молекулярная масса: 806,84.
Соединение 7а синтезировали в соответствии с общим способом d с получением конечного продукта 7а в виде желтой маслянистой жидкости (81%). δH (400 МГц, d-CDCl3) 1,33-1,41 (м, 5H, CH2), 1,70-1,85 (м, 5H, CH2), 2,42-2,51 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,84 (с, 2H, CH2), 4,47 (с, 2H, CH2), 4,76 (с, 2H, CH2), 5,38 (с, 2H, CH2), 6,43 (с, 1H CH), 6,68 (д, J=8,0 Гц, 1H, CH), 6,95 (д, J=7,0 Гц, 2H, CH), 7,10 (д, J=7,2 Гц, 2H, CH), 7,30-7,41 (м, 10H, CH), 7,85 (дд, J=8,0 и 1,2 Гц, 1H, CH); δC (100 МГц, d-CDCl3) 26,1, 26,7, 34,3, 35,3, 44,2, 51,9, 52,7, 67,1, 70,7, 112,0, 114,1, 115,9, 119,8, 121,0, 127,1, 127,2, 128,1, 128,3, 128,5, 128,6, 128,7, 133,3, 133,4, 135,6, 135,7, 137,8, 141,6, 142,9, 144,2, 147,9, 158,7, 165,2, 165,8; МСНР (ЭР+) Вычислено [C43H39F5N2O6S+H] 807,84, наблюдали 807,79.
Пример 24 – Соединение 7b
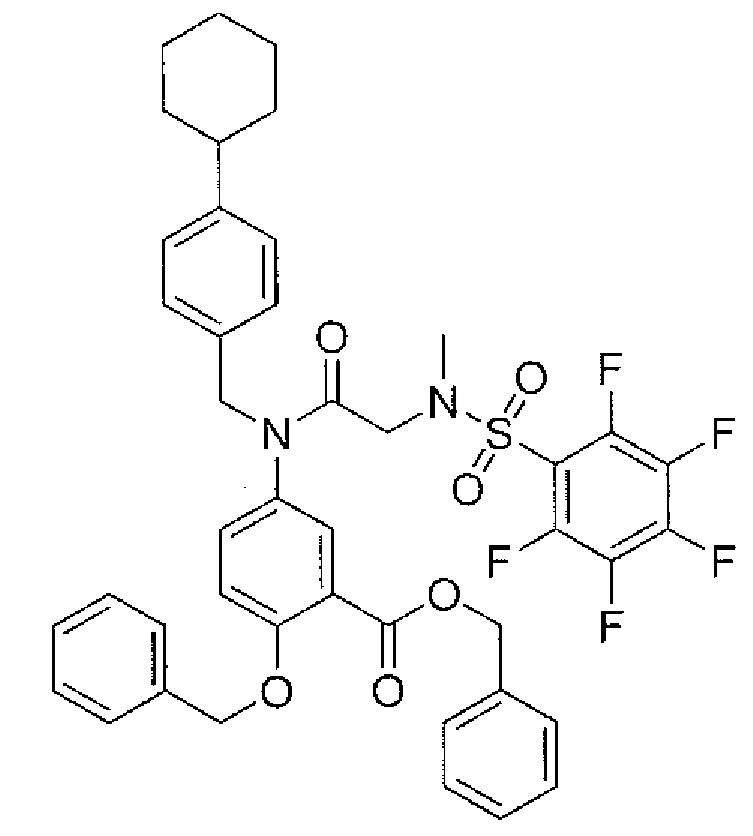 .
.
Бензил-2-(бензилокси)-5-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метил фенил сульфонамидо)ацетамидо)бензоат.
Химическая формула: C43H39F5N2O6S.
Молекулярная масса: 806,84.
Соединение 7b синтезировали в соответствии с общим способом h с получением конечного продукта 7b в виде оранжевого твердого вещества (68%). δH (400 МГц, d-CDCl3) 1,33-1,43 (м, 5H, СH2), 1,72-1,89 (м, 5H, СH2), 2,42-2,52 (м, 1H, CH), 3,10 (с, 3H, СН3), 3,94 (с, 2H, СH2), 4,67 (с, 2Ы, СH2), 5,15 (с, 2H, СH2), 5,33 (с, 2H, СH2), 6,93-6,99 (м, 4Н, СН), 7,06-7,12 (м, 2H, СН), 7,31-7,45 (ш, 10Н, СН), 7,53-7,56 (м, 1Н, СН); δC (100 МГц, d-CDCl3) 26,0, 26,7, 34,3, 35,8, 44,1, 52,3, 53,1, 67,1, 34,4, 44,2, 48,6, 66,6, 72,2, 114,6, 121,9, 126,8, 127,1, 127,5, 127,9, 128,1, 128,3, 128,5, 128,6, 131,3, 132,3, 133,2, 133,4, 135,5, 135,7, 147,6, 157,9, 165,1, 166,3; МСНР (ЭР+). Вычислено [C43H39F5N2O6S+Na] 829,84, наблюдали 829,28.
Пример 25 – Соединение 7с
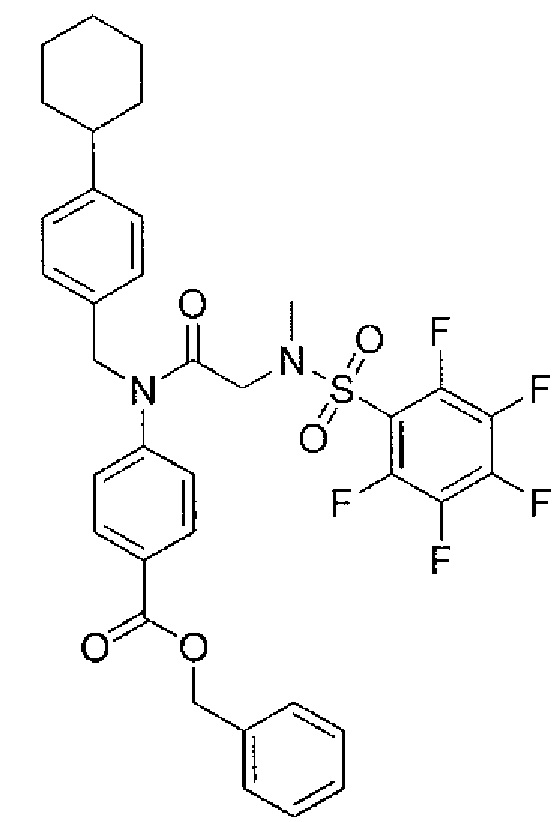 .
.
Бензил-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензоат.
Химическая формула: C36H33F5N2O5S.
Молекулярная масса: 700,71.
Соединение 7с синтезировали в соответствии с общим способом h с получением конечного продукта 7с в виде белого твердого вещества (78%). δH (400 МГц, d-CDCl3) 1,48 (м, 5H, CH2), 1,71-1,93 (м, 5H, CH2), 2,42-2,55 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,96 (с, 2H, CH2), 4,79 (с, 2H, СH2), 5,38 (с, 2H, СH2), 6,90 (д, J=8,0 Гц, 2H, CH), 7,10-7,16 (м, 4H, CH), 7,33-7,47 (м, 5H, CH), 8,10 (д, J=8,0 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 26,1, 34,3, 35,8, 44,1, 52,2, 53,0, 66,9, 126,9, 128,2, 128,3, 128,4, 128,5, 128,6, 131,4, 133,1, 147,8, 165,1, 165,7; МСНР (ЭР+). Вычислено [C36H33F5N2O5S+H] 723,19, наблюдали 723,13.
Пример 26 - Соединение 7d
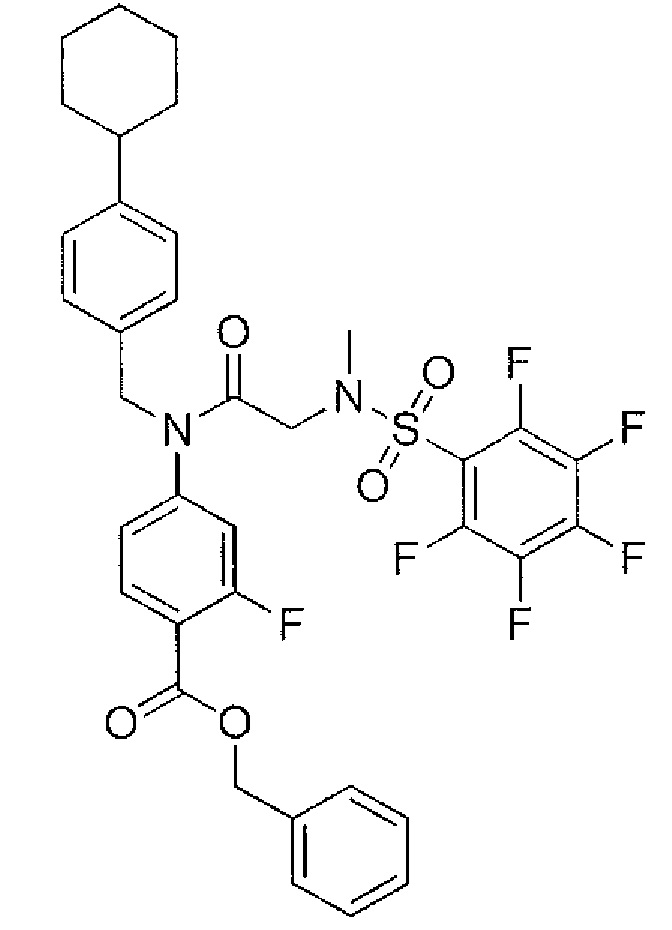 .
.
Бензил-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метил фенилсульфонамидо)ацетамидо)-2-фторбензоат.
Химическая формула: C36H32F6N2O5S.
Молекулярная масса: 718,7051.
Соединение 7d синтезировали в соответствии с общим способом h с получением конечного продукта 7d в виде бесцветной маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,23-1,46 (м, 5H, CH2), 1,71-1,91 (м, 5H, CH2), 2,42-2,52 (м, 1H, CH), 3,1 (с, 3H, CH3), 3,98 (с, 2H, CH2), 4,21 (с, 2H, СH2), 4,76 (с, 2H, CH2), 5,38 (с, 2H, СH2), 6,81-6,91 (м, 2H, CH), 6,98 (д, J=7,9 Гц, 2H, CH), 7,32-7,47 (м, 5H, CH), 7,93-7,99 (м, 1H, CH); δC (100 МГц, d-CDCl3) 25,9, 26,8, 34,2, 35,8, 44,2, 52,1, 52,9, 67,2, 106,5, 108,3, 116,9, 123,9, 127,2, 127,4, 128,1, 128,4, 128,6, 132,7, 133,2, 135,1, 147,5, 162,9, 165,6; МСНР (ЭР+). Вычислено [C36H32F6N2O5S+H] 718,19, наблюдали 719,32.
Пример 27 – Соединение 7f
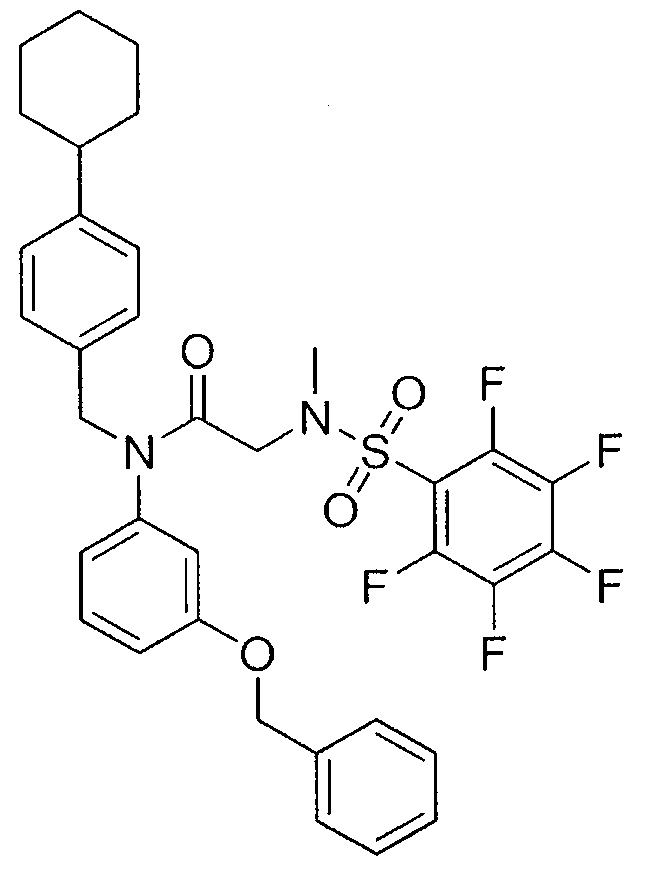 .
.
N-(3-(Бензилокси)фенил)-N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C35H33F5N2O4S.
Молекулярная масса: 672,7045.
Соединение 7f синтезировали в соответствии с общим способом h с получением конечного продукта 7f в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,26-1,44 (м, 5H, CH2), 1,72-1,91 (м, 5H, CH2), 2,42-2,51 (м, 1H, CH), 3,11 (с, 3H, CH3), 3,96 (с, 2H, CH2), 4,65 (с, 2H, CH2), 5,02 (с, 2H, CH2), 6,74-6,82 (м, 2H, CH), 6,89-6,93 (м, 1H, CH), 6,95 (д, J=8,0 Гц, 2H, CH), 7,12 (д, J=7,9 Гц, 2H, CH), 7,31-7,45 (м, 5H, CH); δC (100 МГц, d-CDCl3) 26,2, 25,9, 34,1, 35,3, 44,11, 51,2, 52,2, 71,3, 115,4, 123,5, 127,1, 128,1, 128,2, 128,9, 132,5, 133,1, 136,1, 147,4, 157,8, 165,1; МСНР (ЭР+). Вычислено [C35H33F5N2O4S+Na] 695,21, наблюдали 696,30.
Пример 28 – Соединение 7g
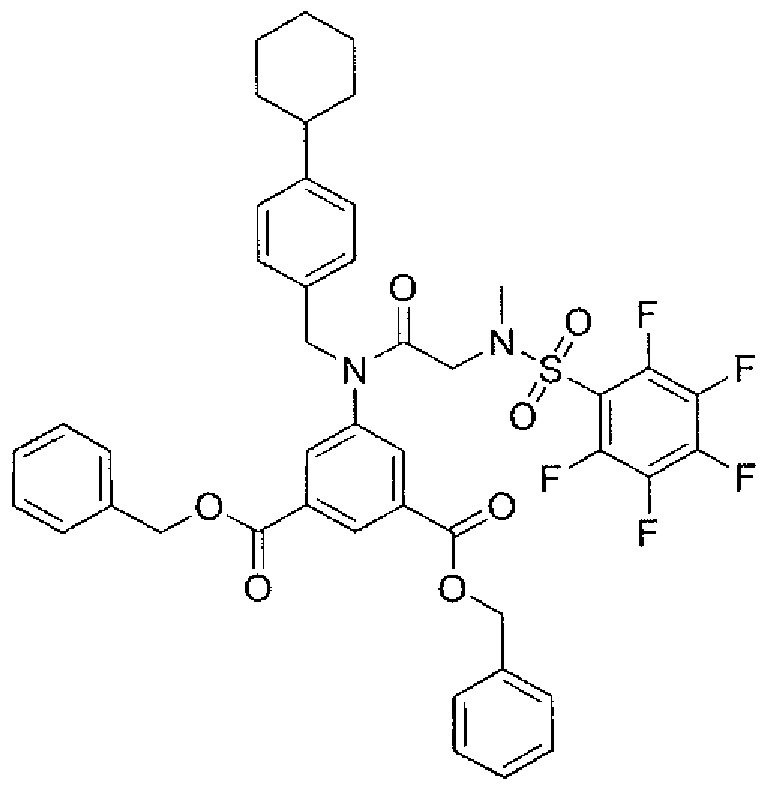 .
.
Дибензил-5-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метил фенил сульфонамидо)ацетамидо)изофталат.
Химическая формула: C44H39F5N2O7S.
Молекулярная масса: 834,8467.
Соединение 7g синтезировали в соответствии с общим способом h с получением конечного продукта 7g в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,38-1,51 (м, 5H, CH2), 1,75-1,81 (м, 5H, CH2), 2,43-2,52 (м, 1H, CH), 3,11 (с, 3H, CH3), 3,91 (с, 2H, CH2), 4,69 (с, 2H, CH2), 5,31 (с, 4H, CH2), 7,13-7,18 (м, 4H, CH), 7,37-7,52 (м, 10H, CH), 7,79-7,85 (м, 2H, CH), 8,40 (с, 1H, CH); δC (100 МГц, d-CDCl3) 26,3, 26,6, 34,5, 35,1, 48,2, 67,1, 68,4, 117,2, 118,1, 120,2, 126,3, 126,8, 127,3, 127,7, 127,9, 134,5, 138,1, 138,4, 141,1, 144,5, 147,7, 165,1, 166,4, 166,9; МСНР (ЭР+). Вычислено [C44H39F5N2O7S+H] 835,61, наблюдали 836,17.
Пример 29 - Соединение 7h
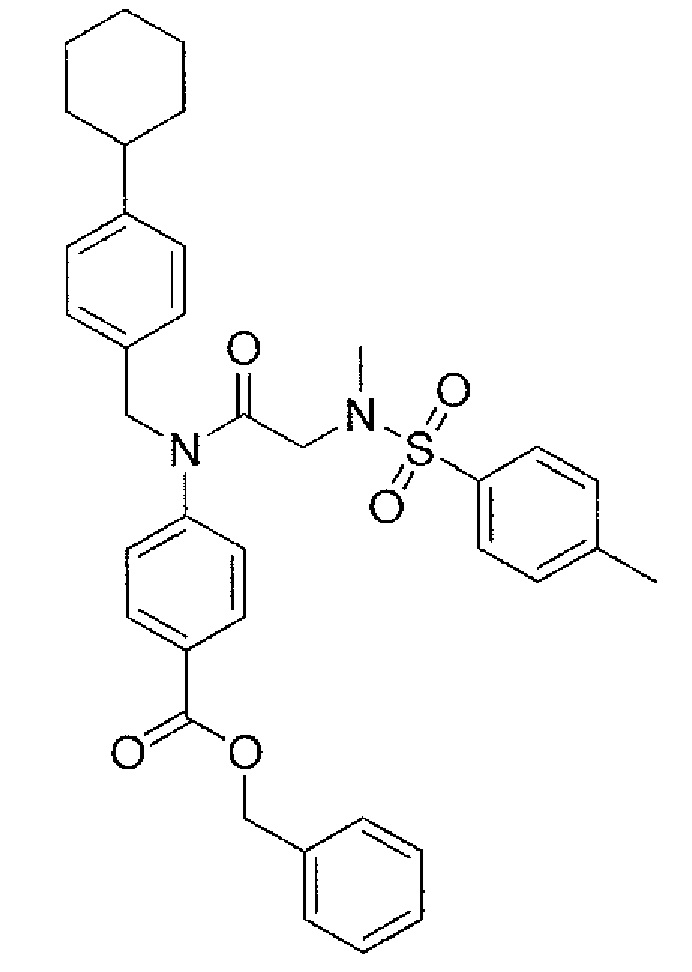 .
.
Бензил-4-(N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)бензоат.
Химическая формула: C37H40N2O5S.
Молекулярная масса: 624,79.
Соединение 7h синтезировали в соответствии с общим способом h с получением конечного продукта 7h в виде белого твердого вещества (91%). δH (400 МГц, d-CDCl3) 1,26-1,46 (м, 5H, CH2), 1,70-1,93 (м, 5H, CH2), 2,40 (с, 3H, СH3), 2,43-2,53 (м, 1H, CH), 2,87 (с, 3H, СH3), 3,76 (с, 2H, CH2), 4,82 (с, 2H, CH2), 5,38 (с, 2H, CH2), 7,04 (д, J=8,0 Гц, 2H, СH), 7,11 (с, J=8,1 Гц, 2H, СH), 7,26 (д, J=8,0 Гц, 2H, СH), 7,32-7,43 (м, 5H, СH), 7,45 (д, J=8,0 Гц, 2H, СH), 7,63 (д, J=8,3 Гц, 2H, СH), 8,10 (д, J=8,3 Гц, 2H, СH); 6с (100 МГц, d-CDCl3) 21,4, 26,0, 26,8, 34,3, 35,7, 44,1, 51,5, 52,9, 66,9, 70,2, 126,9, 127,4, 128,2, 128,3, 128,6, 129,4, 129,4, 131,2, 133,5, 135,2, 135,6, 143,3, 144,9, 147,5, 165,3, 166,6; МСНР (ЭР+). Вычислено [C37H40N2O5S+H] 625,27, наблюдали 625,31.
Пример 30 – Соединение 7i
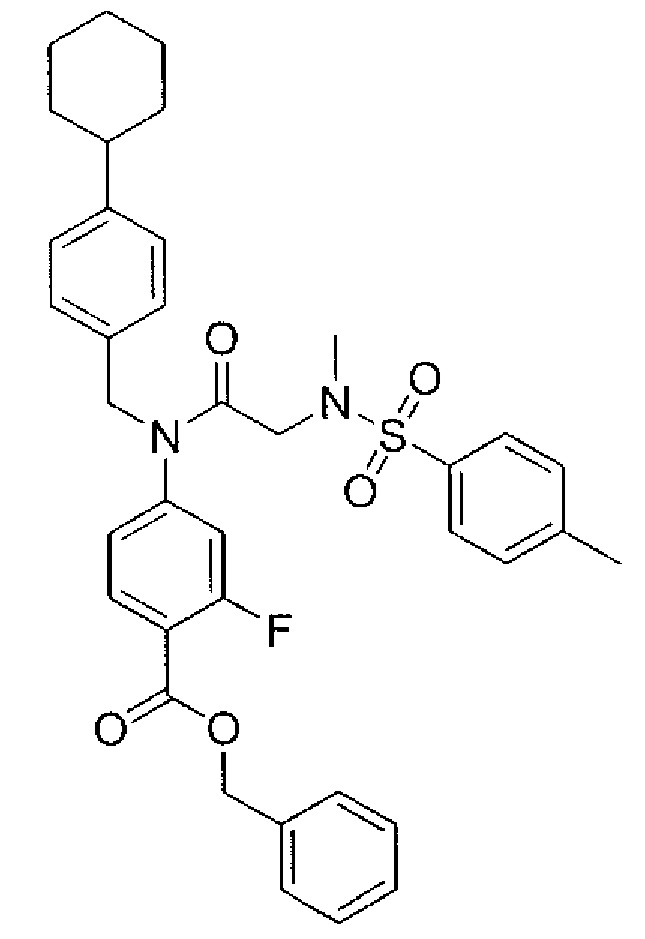 .
.
Бензил-4-(N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)-2-фторбензоат.
Химическая формула: C37H39FN2O5S.
Молекулярная масса: 642,78.
Соединение 7i синтезировали в соответствии с общим способом h с получением конечного продукта 7i в виде белого твердого вещества (80%). δH (400 МГц, d-CDCl3) 1,46 (м, 5H, CH2), 1,70-1,93 (м, 5H, CH2), 2,41 (с, 3H, CH3), 2,45-2,51 (м, 1H, CH), 2,86 (с, 3H, CH3), 3,76 (с, 2H, CH2), 4,82 (с, 2H, CH2), 5,38 (с, 2H, CH2), 6,82-6,93 (м, 2H, CH), (д, J=8,2 Гц, 2H, CH), 7,12 (д, J=8,2 Гц, 2H, CH), 7,27 (с, J=8,0 Гц, 2H, CH), 7,30-7,46 (м, 5H, CH), 7,63 (д, J=8,0 Гц, 2H, CH), 7,93-7,98 (м, 1H, CH); δC (100 МГц, d-CDCl3) 26,0, 26,7, 34,2, 35,8, 44,1, 51,6, 52,9, 67,2, 71,3, 126,9, 127,4, 128,1, 128,3, 128,4, 128,6, 133,2, 135,1, 135,3, 143,3, 147,3, 147,8, 163,1, 163,4, 166,6; МСНР (ЭР+). Вычислено [С37H39N2O5S+H] 643,26, наблюдали 643,39.
Пример 31 – Соединение 7j
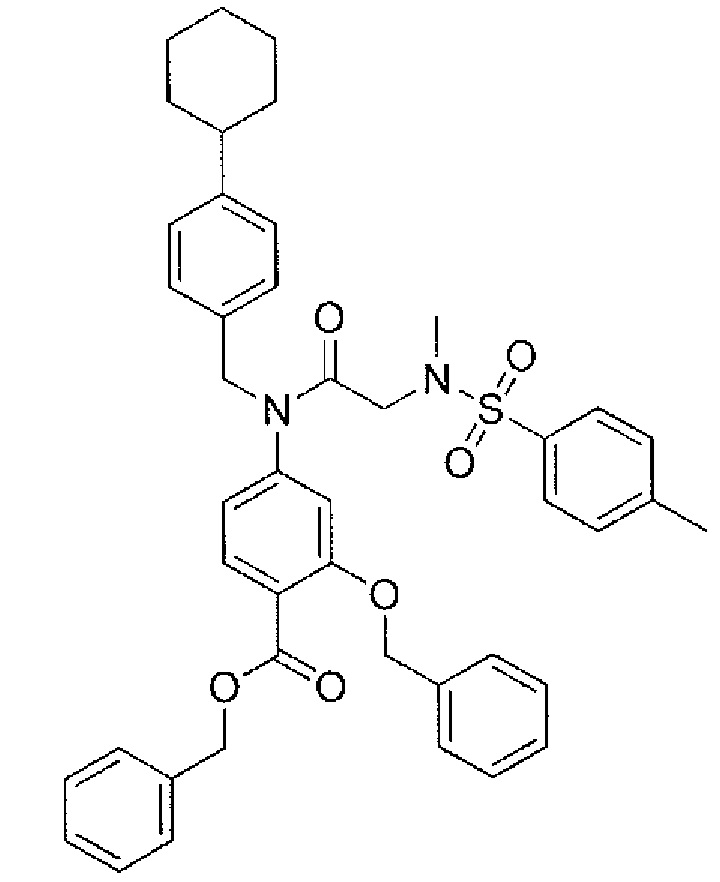 .
.
Бензил-2-(бензилокси)-4-(N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)бензоат.
Химическая формула: C44H46N2O6S.
Молекулярная масса: 730,91.
Соединение 7j синтезировали в соответствии с общим способом h с получением конечного продукта 7j в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,21-1,41 (м, 5H, CH2), 1,71-1,88 (м, 5H, CH2), 2,30 (с, 3H, СH3), 2,40-2,48 (м, 1H, CH), 3,1 (с, 3Н, СH3), 3,58 (с, 2Н, CH2), 4,57 (с, 2H, CH2), 4,79 (с, 2H, CH2), 5,28 (с, 2Н, CH2), 6,59 (дд, J=8,2 и 1,5 Гц, 1H, CH), 6,93 (д, J=8,0 Гц, 2H, СН), 7,02 (д, J=8,0 Гц, 2H, СН), 7,14-7,35 (м, 12Н, СН), 7,52 (д, J=8,2 Гц, 2H, СН), 7,75 (д, J=8,2 Гц, 2H, СН); δC (100 МГц, d-CDCl3) 21,4, 25,9, 26,4, 34,2, 35,7, 44,1, 51,1, 52,3, 66,5, 70,4, 114,1, 119,9, 120,5, 126,8, 127,3, 127,8, 128,0, 128,1, 128,4, 128,5, 128,7, 129,3, 133,0, 133,8, 135,2, 135,6, 143,1, 144,9, 147,6, 158,6, 165,2, 166,6; МСНР (ЭР+). Вычислено [С44Н46N2O6S+H] 731,32, наблюдали 731,28.
Пример 32 – Соединение 7k
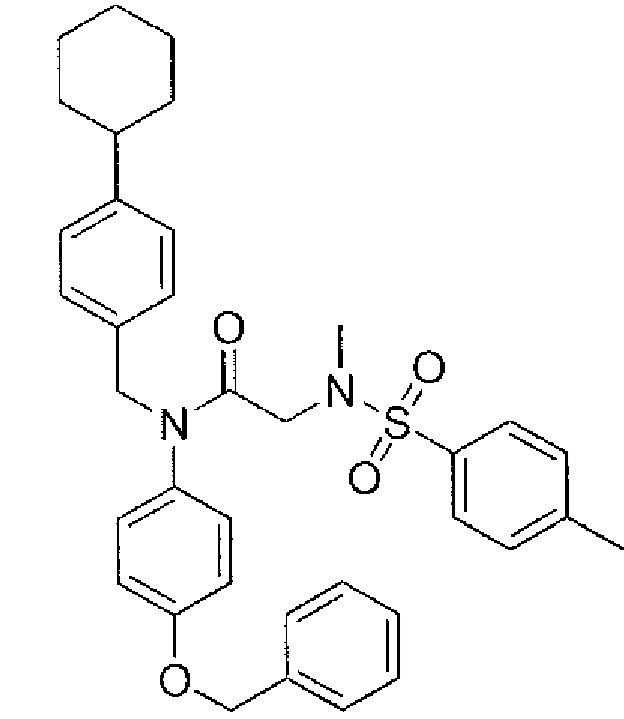 .
.
N-(4-(бензилокси)фенил)-N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамид.
Химическая формула: C36H40N2O4S.
Молекулярная масса: 596,78.
Соединение 7к синтезировали в соответствии с общим способом h с получением конечного продукта в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,31-1,46 (м, 5Н, СН2), 1,71-1,91 (м, 5H, СН2), 2,42 (с, 3Н, СН3), 2,44-2,51 (м, 1H, СН), 2,89 (с, 3H, СН3), 3,74 (с, 2Н, СН2), 4,73 (с, 2Н, СН2), 5,05 (с, 2Н, СН2), 6,89 (д, J=8,8 Гц, 2Н, СН), 6,93 (д, J=8,8 Гц, 2Н, СН), 7,05 (д, J=8,0 Гц, 2Н, СН), 7,10 (д, J=8,0 Гц, 2Н, СН), 7,27 (д, J=8,2 Гц, 2Н, СН), 7,31-7,45 (м, 5Н, СН), 7,67 (д, J=8,2 Гц, 2Н, СН); δC (100 МГц, d-CDCl3) 21,4, 26,1, 26,8, 34,3, 35,7, 44,1, 51,3, 53,1, 70,2, 115,7, 126,7, 127,4, 128,1, 128,5, 128,7, 129,3, 129,4, 133,5, 134,2, 135,6, 136,2, 143,1, 147,3, 158,5, 167,2; МСНР (ЭР+). Вычислено [C36H40N204S+Hg/5] 597,28, наблюдали 597,34.
Пример 33 – Соединение 8
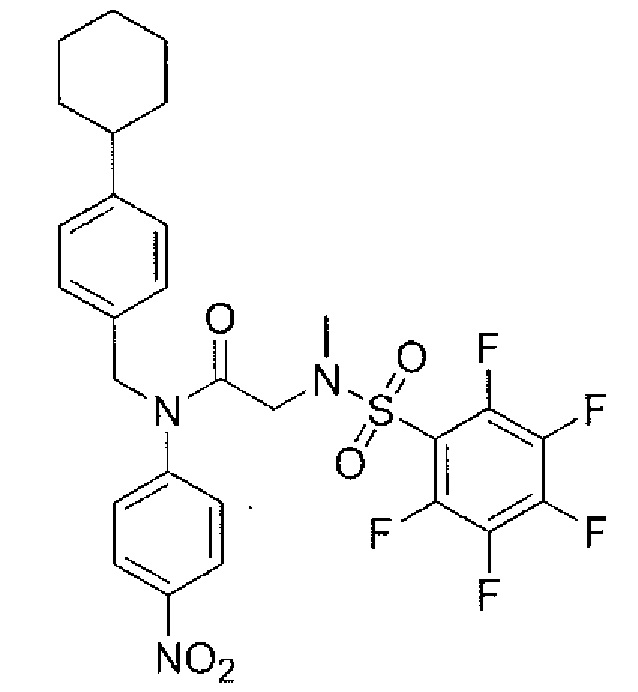
N-(4-Циклогексилбензил)-N-(4-нитрофенил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C28H26F5N3O5S.
Молекулярная масса: 611,5802.
Соединение 8 синтезировали в соответствии с общим способом h с получением конечного продукта 8 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,26-1,44 (м, 5H, CH2), 1,69-1,86 (м, 5H, CH2), 2,41-2,53 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,98 (с, 2H, CH2), 4,78 (с, 2H, CH2), 6,97 (д, J=7,5 Гц, 2H, CH), 7,13 (д, J=7,5 Гц, 2H, CH), 7,21 (д, J=8,3 Гц, 2H, CH), 8,24 (д, J=8,6 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 25,9, 26,6, 34,2, 44,1, 52,2, 53,1, 125,2, 127,2, 128,4, 129,2, 132,5, 148,2, 146,9, 147,8, 165,6; МСВР (ЭР+). Вычислено [C28H26F5N3O5S+H] 612,5881, наблюдали 612,1582; ВЭЖХ (I) tR=31,615 мин (100,0%), (II) tR=48,560 мин (100,0%).
Пример 34 - Соединение 9
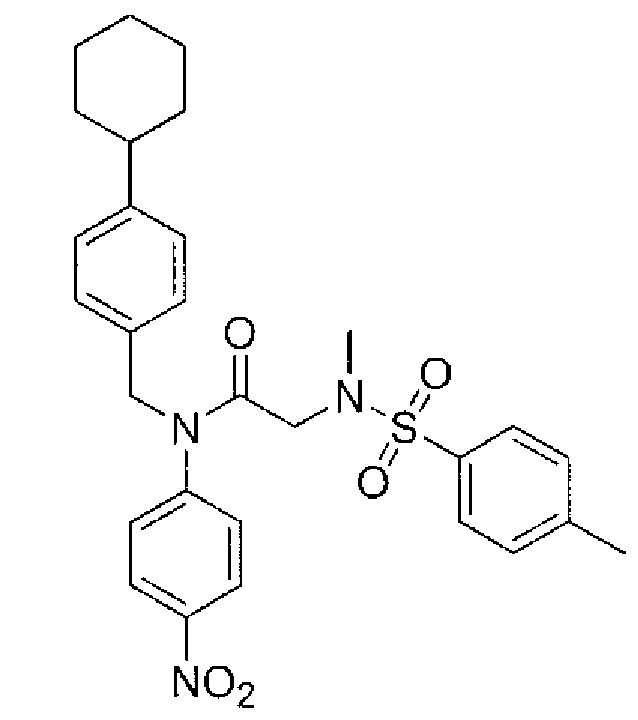
N-(4-Циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)-N-(4-нитрофенил)ацетамид
Химическая формула: C29H33N3O5S.
Молекулярная масса: 535,6544.
Соединение 9 синтезировали в соответствии с общим способом h с получением конечного продукта 9 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,27-1,44 (м, 5H, CH2), 1,68-1,89 (м, 5H, CH2), 2,41 (с, 3H, СH3), 2,43-2,50 (м, 1H, CH), 2,83 (с, 3Ы, CH3), 3,76 (с, 2H, CH2), 4,86 (с, 2H, CH2), 7,04 (д, J=7,9 Гц, 2H, CH), 7,11 (д, J=7,9 Гц, 2H, CH), 7,21-7,29 (м, 4H, CH), 7,61 (д, J=8,3 Гц, 2H, CH), 8,21 (д, J=8,3 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 21,4, 25,7, 26,6, 34,3, 35,8, 44,2, 52,1, 53,1, 124,9, 127,1, 127,4, 128,4, 128,49 129,5, 133,1, 134,6, 143,4, 146,6, 146,9, 147,8, 166,6; МСВР (ЭР+) Вычислено [C29H33N3O5S+H] 536,6624, наблюдали 536,2222; ВЭЖХ (I) tR=28,939 мин (100,0%), (II) tR=46,607 мин (100,0%).
Пример 35 - Соединение 10
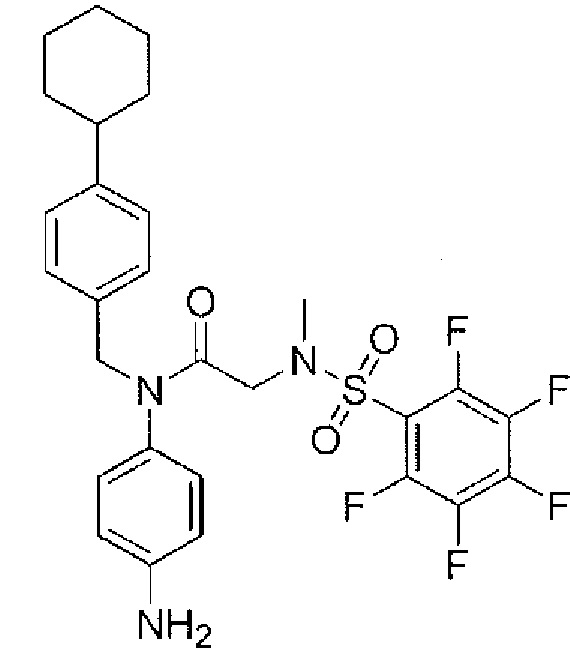 .
.
N-(4-Аминофенил)-N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид
Химическая формула: C28H28F5N3O3S.
Молекулярная масса: 581,5972.
Соединение 10 синтезировали в соответствии с общим способом j с получением конечного продукта 10 в виде бесцветной маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,43 (м, 5H, CH2), 1,70-1,88 (м, 5H, CH2), 2,41-2,52 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,78 (с, 2H, CH2), 3,96 (с, 2H, CH2), 4,63 (с, 2H, NH2), 6,59 (д, J=8,3 Гц, 2H, CH), 6,71 (д, J=8,3 Гц, 2H, CH), 6,97 (д, J=7,7 Гц, 2H, CH), 7,10 (д, J=7,7 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 26,3, 34,1, 35,6, 44,2, 51,5, 53,2, 120,9, 126,2, 127,7, 129,1, 131,3, 135,1, 136,9, 147,1, 165,8; МСВР (ЭР+). Вычислено [C28H28F5N3O3S+H] 582,6052, наблюдали 582,1859; ВЭЖХ (I) tR=20,503 мин (94,4%), (II) tR=40,315 мин (95,3%).
Пример 36 - Соединение 11
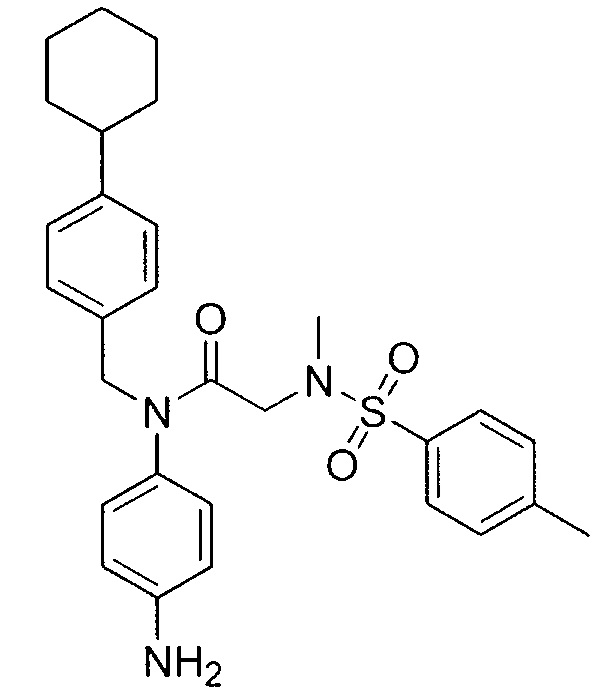 .
.
N-(4-Аминофенил)-N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамид.
Химическая формула: C29H35N3O3S.
Молекулярная масса: 505,6715.
Соединение 11 синтезировали в соответствии с общим способом j с получением конечного продукта 11 в виде бесцветной маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,25-1,45 (м, 5H, СН2), 1,71-1,89 (м, 5H, СН2), 2,40 (с, 3H, СН3), 2,42-2,53 (м, 1H, СН), 2,87 (с, 3H, СН3), 3,74 (с, 2Н, СН2), 4,71 (с, 2Н, СН2), 6,57 (д, J=8,6 Гц, 2Н, СН), 6,71 (д, J=8,6 Гц, 2Н, СН), 7,02-7,11 (м, 4Н, СН), 7,25 (д, J=7,0 Гц, 2Н, СН), 7,65 (д, J=8,2 Гц, 2Н, СН); δC (100 МГц, d-CDCl3) 21,4, 26,1, 26,7, 34,3, 35,7, 44,1, 51,2, 53,1, 115,5, 126,6, 127,4, 128,8, 129,1, 129,3, 130,9, 134,4, 135,6, 143,0, 146,6, 147,1, 167,4; МСВР (ЭР+). Вычислено [C29H35N3O3S+Н] 506,6794, наблюдали 506,2467; ВЭЖХ (I) tR=15,995 мин (100,0%), (II) tR=36,789 мин (100,0%).
Пример 37 – Соединение 12
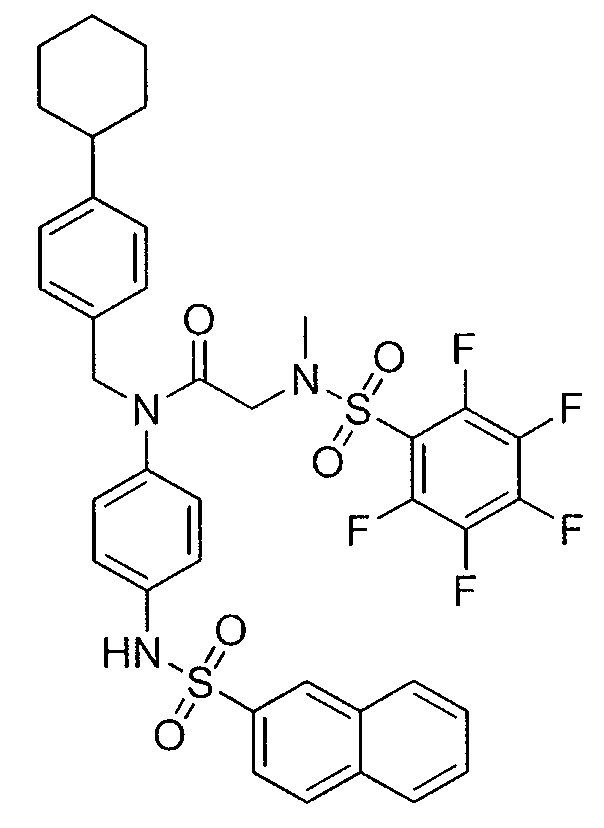 .
.
N-(4-Циклогексилбензил)-N-(4-(нафтален-2-сульфонамидо)фенил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C38H34F5N3O5S2.
Молекулярная масса: 771,8157.
Соединение 12 синтезировали в соответствии с общим способом d с получением конечного продукта 12 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,30-1,43 (м, 5H, CH2), 1,71-1,90 (м, 5H, CH2), 2,37-2,48 (м, 1H, CH), 3,01 (с, 3H, CH3), 3,75 (с, 2H, CH2), 4,58 (с, 2H, CH2), 6,79 (д, J=8,3 Гц, 2H, CH), 6,84 (д, J=7,9 Гц, 2H, CH), 6,99 (д, J=7,9 Гц, 2H, CH), 7,09 (д, J=8,4 Гц, 2H, CH), 7,43 (шир, 1H, NH), 7,59-7,71 (м, 2H, CH), 7,74-7,79 (м, 1H, CH), 7,86-7,95 (м, 3H, CH), 8,35-8,41 (м, 1H, CH); δC (100 МГц, d-CDCl3) 26,7, 34,2, 35,7, 44,0, 52,1, 52,9, 121,8, 122,0, 126,7, 127,7, 127,8, 128,4, 128,8, 129,1, 129,5, 131,8, 133,2, 134,9, 135,5, 136,6, 137,1, 147,6, 165,9; МСВР (ЭР+). Вычислено [C38H34F5N3O5S2+H] 772,8236, наблюдали 772,1938; ВЭЖХ (I) tR=32,086 мин (95,8%), (II) tR=47,265 мин (96,9%).
Пример 38 – Соединение 13
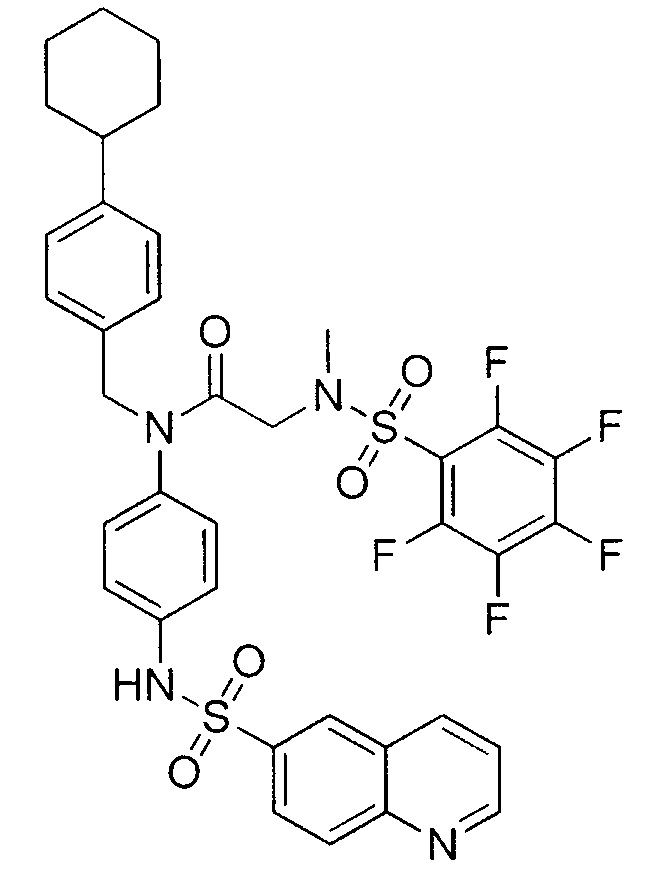 .
.
N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метил фенилсульфонамидо)-N-(4-(хинолин-6-сульфонамидо)фенил)ацетамид.
Химическая формула: C37H33F5N4O5S2.
Молекулярная масса: 772,8037.
Соединение 13 синтезировали в соответствии с общим способом d с получением конечного продукта 13 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,28-1,44 (м, 5H, CH2), 1,70-1,88 (м, 5H, CH2), 2,38-2,48 (м, 1H, CH), 3,01 (с, 3H, CH3), 3,72 (с, 2H, CH2), 4,55 (с, 2H, CH2), 6,72 (д, J=8,4 Гц, 2H, CH), 6,82 (д, J=7,9 Гц, 2H, CH), 6,98-7,06 (м, 4H, CH), 7,59-7,68 (м, 2H, CH), 8,10 (д, J=8,0 Гц, 1H, CH), 8,32 (д, J=7,5 Гц, 1H, CH), 8,36 (д, J=7,1 Гц, 1H, CH), 8,61 (шир, 1H, NH), 9,12-9,16 (м, 1H, CH); δC (100 МГц, d-CDCl3) 25,9, 26,7, 34,2, 35,7, 44,0, 52,1, 52,9, 122,4, 122,8, 125,6, 126,7, 128,28, 128,74, 128,82, 131,5, 133,2, 133,84, 135,1, 136,7, 137,3, 137,5, 142,9, 147,5, 141,2, 166,0; МСВР (ЭР+). Вычислено [C37H33F5N4O5S2+H] 773,8117, наблюдали 773,1871; ВЭЖХ (I) tR=29,764 мин (95,6%), (II) tR=47,224 мин (97,8%).
Пример 39 – Соединение 14
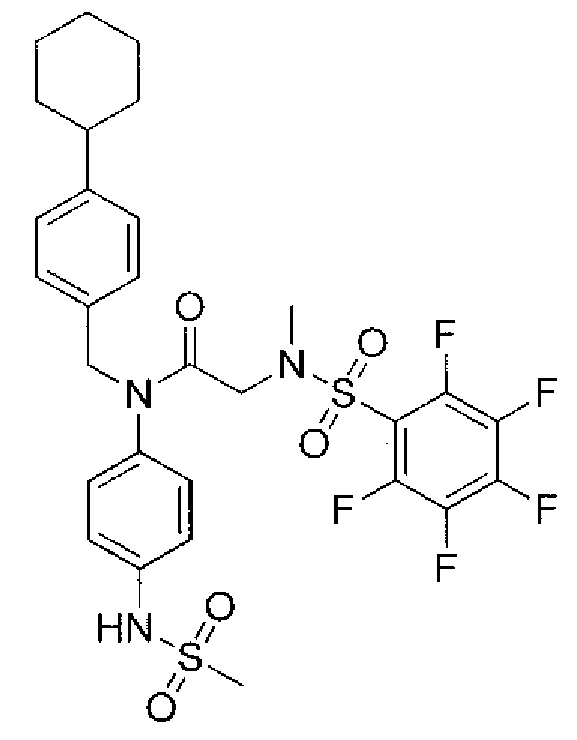 .
.
N-(4-Циклогексилбензил)-N-(4-(метилсульфонамидо)фенил)-2-(2,3,4,5,6-пентафтор-N-метил фенил сульфонамидо)ацетамид.
Химическая формула: C29H30F5N3O5S2.
Молекулярная масса: 659,6876.
Соединение 14 синтезировали в соответствии с общим способом d с получением конечного продукта 13 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,26-1,48 (м, 5H, CH2), 1,69-1,89 (м, 5H, CH2), 2,41-2,52 (м, 1H, CH), 3,05 (с, 3H, CH3), 3,10 (с, 3H, CH3), 3,94 (с, 2H, CH2), 4,68 (с, 2H, CH2), 6,93-7,02 (м, 4H, CH), 7,10 (д, 2H, J=7,7 Гц, CH), 7,21 (д, J=8,4 Гц, 2H, CH), 7,41 (шир, 1H, NH); δC (100 МГц, d-CDCl3) 26,0, 26,7, 34,3, 35,8, 39,7, 44,10, 52,20, 53,09, 120,7, 126,9, 128,4, 129,5, 133,3, 136,4, 137,5, 147,6, 166,1; МСВР (ЭР+). Вычислено [C29H30F5N3O5S2+H] 660,6956, наблюдали 660,1634; ВЭЖХ (I) tR=26,394 мин (95,55%), (II) tR=44,372 мин (94,33%).
Пример 40 - Соединение 15
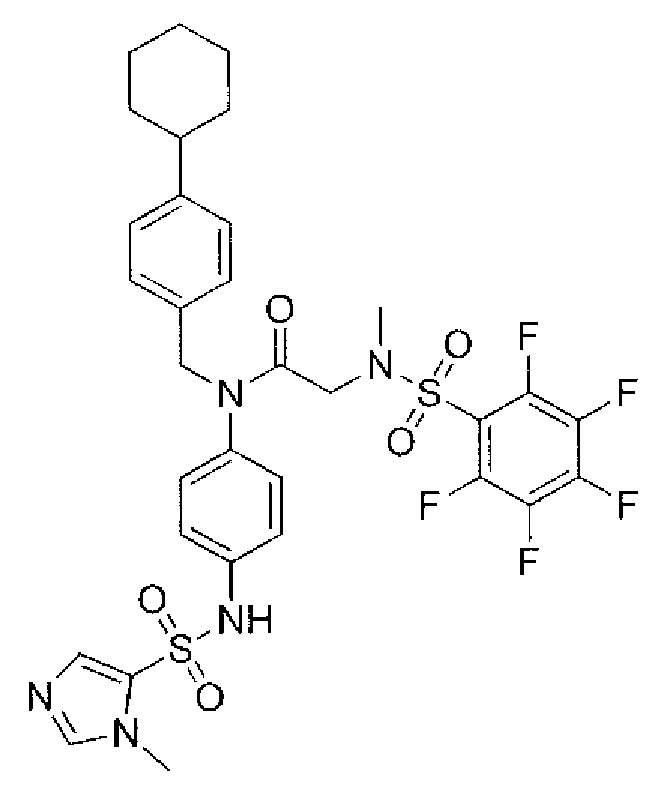 .
.
N-(4-Циклогексилбензил)-N-(4-(1-метил-1H-имидазол-5-сульфонамидо)фенил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C32H32F5N5O5S2.
Молекулярная масса: 725,1765.
Соединение 15 синтезировали в соответствии с общим способом d с получением конечного продукта 14 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,30-1,47 (м, 5H, CH2), 1,70-1,94 (м, 5H, CH2), 2,42-2,53 (м, 1H, CH), 3,07 (с, 3H, CH3), 3,70 (с, 3H, CH3), 3,86 (с, 2H, CH2), 4,62 (с, 2H, CH2), 6,85 (д, J=8,3 Гц, 2H, CH), 6,94 (д, J=7,7 Гц, 2H, CH), 7,10 (д, J=7,9 Гц, 2H, CH), 7,34 (д, J=8,4 Гц, 2H, CH), 7,41 (с, 1H, CH), 7,56 (с, 1H, CH), 10,23 (с, 1H, CH); δC (100 МГц, d-CDCl3) 26,0, 26,7, 34,1, 34,3, 35,8, 44,0, 52,1, 122,3, 124,9, 126,8, 128,2, 128,8, 133,4, 136,3, 137,8, 138,7, 139,3, 147,5, 166,2; МСВР (ЭР+). Вычислено [C32H32F5N5O5S2+H] 726,1843, наблюдали 726,1821; ВЭЖХ (I) tR=23,409 мин (94,7%), (II) tR=42,488 мин (94,9%).
Пример 41 – Соединение 16
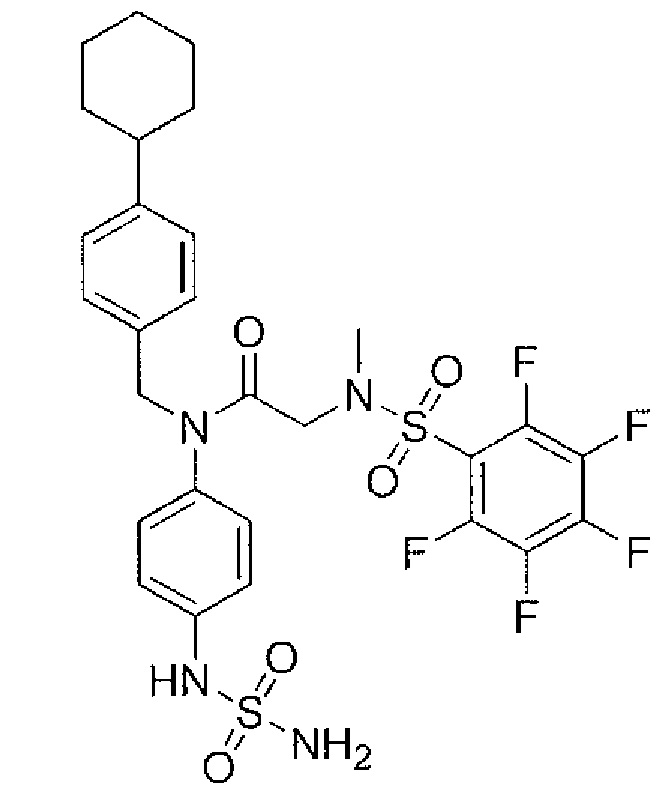 .
.
N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)-N-(4-(сульфамоиламино)фенил)ацетамид.
Химическая формула: C28H29F5N4O5S2.
Молекулярная масса: 660,6757.
Соединение 16 синтезировали в соответствии с общим способом d с получением конечного продукта X в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,28-1,44 (м, 5H, CH2), 1,70-1,89 (м, 5H, CH2), 2,41-2,50 (м, 1H, CH), 3,06 (с, 3H, CH3), 3,92 (с, 2H, CH2), 4,68 (с, 2H, CH2), 5,10 (шир, 2H, №), 6,94-7,01 (м, 4H, CH), 7,10 (д, J=7,9 Гц, 2H, CH), 7,19 (д, J=8,4 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 25,9, 26,7, 34,3, 35,7, 44,1, 52,2, 121,0, 126,9, 128,4, 129,2, 133,3, 136,3, 137,6, 147,6, 166,3; МСВР (ЭР+). Вычислено [C28H29F5N4O5S2+H] 661,6836, наблюдали 661,1575; ВЭЖХ (I) tR=23,259 мин (90,9%), (II) tR=42,445 мин (91,4%).
Пример 42 - Соединение 17
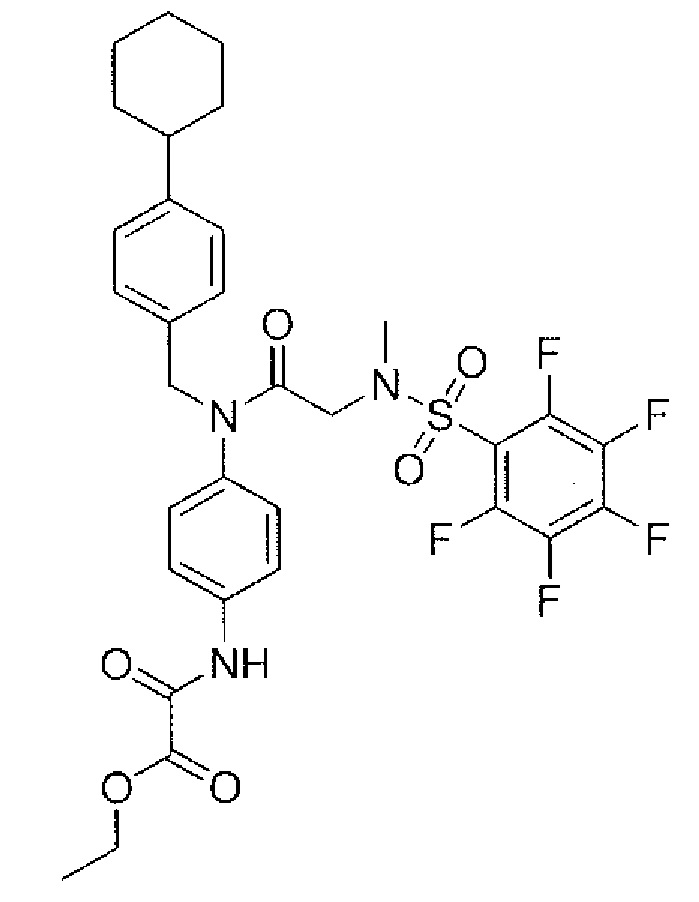 .
.
Этил-2-((4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)фенил)амино)-2-оксоацетат.
Химическая формула: C32H32F5N3O6S.
Молекулярная масса: 681,6700.
Соединение 17 синтезировали в соответствии с общим способом k с получением конечного продукта 17 в виде бесцветной маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,46 (м, 8H, CH2 и CH3), 1,69-1,90 (м, 5H, CH2), 2,41-2,52 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,94 (с, 2H, CH2), 4,41 (кв, J=7,2 Гц, 2H, Ш2), 4,70 (с, 2H, Ш2), 6,92-7,02 (м, 4H, CH), 7,10 (д, J=7,7 Гц, 2H, CH), 7,67 (д, J=8,3 Гц, 2H, CH), 9,02 (шир, 1H, NH); δC (100 МГц, d-CDCl3) 13,9, 26,1, 26,8, 34,3, 35,9, 44,1, 52,2, 53,1, 63,8, 121,0, 126,9, 128,6, 129,1, 136,7, 136,8, 147,7, 154,0, 160,6, 166,2; МСВР (ЭР+). Вычислено [C32H32F5N3O6S+H] 682,6779, наблюдали 682,1994; ВЭЖХ (I) tR=28,867 мин (93,7%), (II) tR=46,469 мин (95,6%).
Пример 43 – Соединение 18
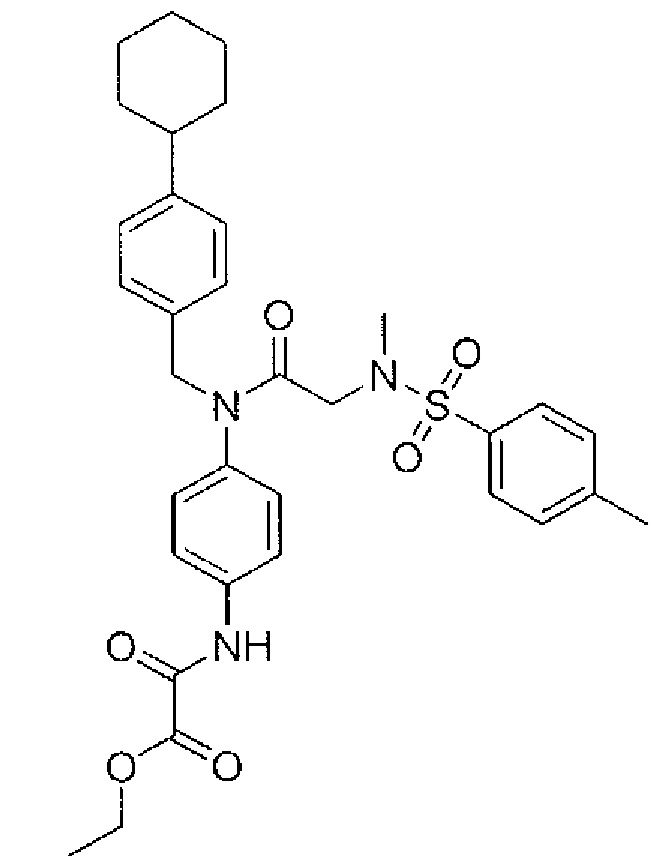 .
.
Этил-2-((4-(N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)фенил)амино)-2-оксоацетат.
Химическая формула: C33H39N3O6S.
Молекулярная масса: 605,7443.
Соединение 18 синтезировали в соответствии с общим способом g с получением конечного продукта 18 в виде бесцветной маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,23-1,41 (м, 5H, CH2), 1,42 (т, J=7,2 Гц, 3H, CH3), , 1,69-1,86 (м, 5H, CH2), 2,40 (с, 3H, CH3), 2,42-2,52 (м, 1H, CH), 2,85 (с, 3H, CH3), 3,72 (с, 2H, CH2), 4,41 (кв, J=7,2 Гц, 2H, CH2), 4,75 (с, 2H, CH2), 6,95-7,05 (м, 4H, CH), 7,10 (д, J=7,8 Гц, 2H, CH), 7,24 (д, J=7,4 Гц, 2H, CH), 7,58-7,67 (м, 4H, CH), 9,01 (с, 1H, NH); δC (100 МГц, d-CDCl3) 13,8, 21,4, 26,1, 34,2, 35,6, 44,1, 51,4, 53,1, 63,7, 120,9, 126,7, 128,7, 129,2, 129,4, 133,9, 135,2, 136,4, 137,3, 143,2, 147,4, 154,1, 160,6, 166,7; МСВР (ЭР+). Вычислено [C33H39N3O6S+H] 606,7522, наблюдали 606,2635; ВЭЖХ (I) tR=25,724 мин (100,0%), (II) tR=44,185 мин (100,0%).
Пример 44 – Соединение 19а
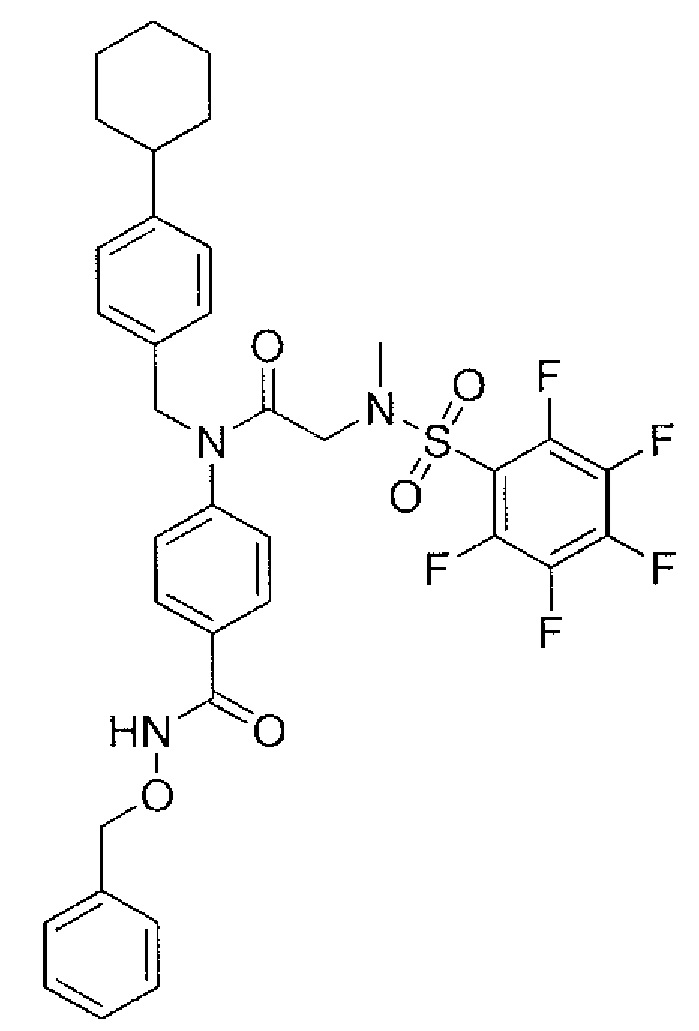 .
.
N-(Бензилокси)-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензамид.
Химическая формула: C36H34F5N3O5S.
Молекулярная масса: 715,73.
Соединение 19a синтезировали в соответствии с общим способом m с получением конечного продукта 19a в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,27-1,45 (м, 5H, CH2), 1,69-1,91 (м, 5H, CH2), 2,41-2,53 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,89 (с, 2H, CH2), 4,71 (с, 2H, CH2), 5,01 (с, 2H, CH2), 6,90-7,10 (м, 4H, CH), 7,11-7,15 (м, 2H, CH), 7,33-7,45 (м, 5H, CH), 7,63-7,70 (м, 1H, CH), 8,10 (д, J=8,3 Гц, 1H, CH), 8,72-8,91 (шир, 1H, NH); δC (100 МГц, d-CDCl3) 25,9, 26,7, 34,2, 35,8, 44,1, 52,2, 53,0, 78,4, 126,9, 128,4, 128,5, 128,6, 128,9, 129,1, 130,9, 131,8, 132,9, 148,0, 158,9, 159,9, 161,2, 166,7; МСНР (ЭР+). Вычислено [C36H34N3F5N3O5S+Na] 738,20, наблюдали 738,15.
Пример 45 – Соединение 19b
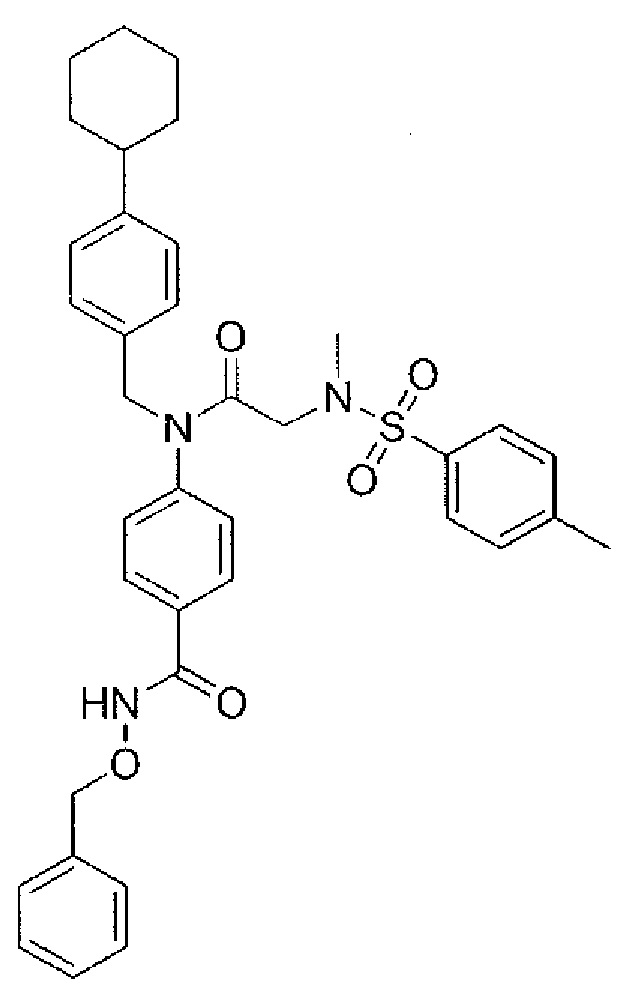 .
.
N-(Бензилокси)-4-(N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)бензамид.
Химическая формула: C37H41N3O5S.
Молекулярная масса: 639,80.
Соединение 19b синтезировали в соответствии с общим способом m с получением конечного продукта 19b в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,28-1,45 (м, 5H, CH2), 1,69-1,91 (м, 5H, CH2), 2,41 (с, 3H, CH3), 2,42-2,50 (м, 1H, CH), 2,83 (с, 3H, CH3), 3,68 (с, 2H, CH2), 4,77 (с, 2H, CH2), 5,03 (с, 2H, CH2), 6,97-7,11 (м, 6H, CH), 7,22-7,30 (м, 2H, CH), 7,33-7,48 (м, 5H, CH), 7,61 (д, J=8,3 Гц, 2H, CH), 7,65-7,71 (м, 2H, CH), 8,72-8,91 (шир, 1H, КЫ); δC (100 МГц, d-CDCl3) 21,4, 25,9, 26,7, 34,3, 35,7, 44,1, 51,5, 52,9, 59,1, 117,1, 126,9, 127,4, 128,1, 128,5, 128,6, 128,7, 129,2, 129,4, 133,5, 135,1, 143,3, 147,6, 158,9, 159,9, 161,2, 166,7; МСНР (ЭР+). Вычислено [C37H41N3O5S+Na] 640,28, наблюдали 640,41.
Пример 46 – Соединение 20
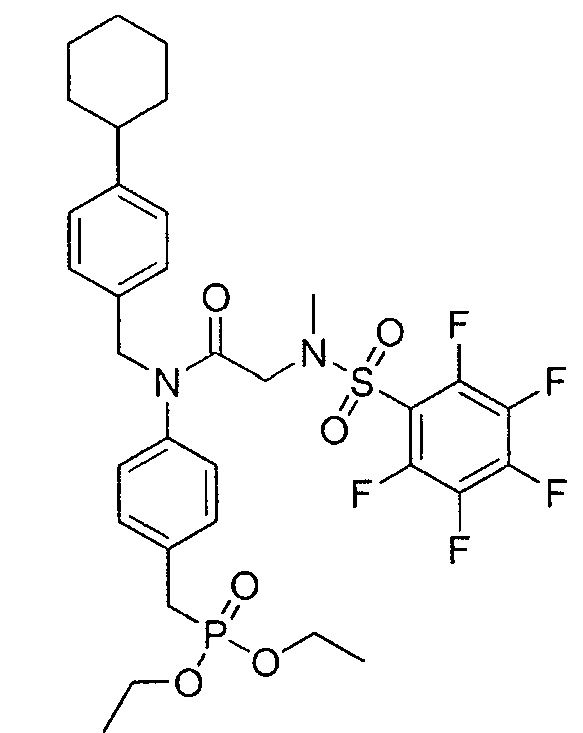 .
.
Диэтил-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензилфосфонат.
Химическая формула: C33H38F5N2O6PS.
Молекулярная масса: 716,6954.
Соединение 20 синтезировали в соответствии с общим способом i с получением конечного продукта 20 в виде вязкой оранжевой маслянистой жидкости (74%). δH (400 МГц, d-CDCl3) 1,23 (т, J=6,9 Гц, 6H, CH3), 1,27-1,47 (м, 5H, CH2), 1,70-1,87 (м, 5H, CH2), 2,4-2,5 (м, 1H, CH), 3,08 (с, 3H, CH3), 3,10 (с, 1H, CH), 3,16 (с, 1H, CH), 3,92 (с, 2H, CH2), 3,95-4,07 (м, 4H, CH2), 4,73 (с, 2H, CH2), 6,98 (д, J=7,7 Гц, 2H, CH), 7,03 (д, J=7,7 Гц, 2H, CH), 7,10 (д, J=7,9 Гц, 2H, CH), 7,31-7,37 (м, 2H, CH); бе (100 МГц, d-CDCl3) 15,1, 15,2, 25,7, 26,4, 34,1, 44,1, 51,5, 52,5, 62,3, 62,5, 126,4, 128,1, 128,2, 131,1, 131,2, 133,7, 138,9, 147,1, 166,7; МСВР (ЭР+). Вычислено [C33H38F5N2O6PS+Н] 717,7033, наблюдали 717,2198; ВЭЖХ (I) tR=29,18 мин (96,1%), (II) tR=41,38 мин (95,1%).
Пример 47 – Соединение 21
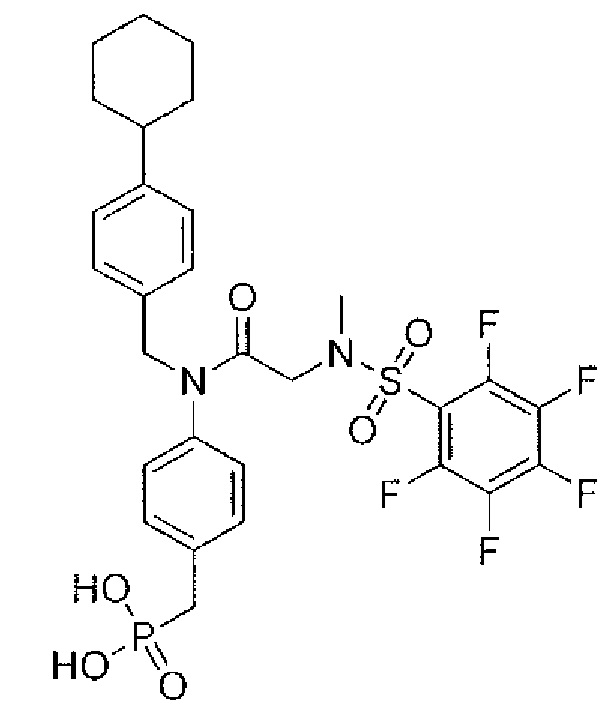 .
.
(4-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензил)фосфоновая кислота.
Химическая формула: C29H30F5N2O6PS.
Молекулярная масса: 660,5891.
Соединение 21 синтезировали в соответствии с общим способом n с получением конечного продукта 21 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,27-1,42 (м, 5H, CH2), 1,70-1,87 (м, 5H, CH2), 2,40-2,50 (м, 1H, CH), 3,03 (с, 3H, CH3), 3,10 (с, 2H, CH2), 3,90 (с, 2H, CH2), 4,65 (с, 2H, CH2), 6,89-7,05 (м, 4H, CH), 7,11 (д, J=8,1 Гц, 2H, CH), 7,20-7,31 (м, 2H, CH); δC (100 МГц, d-(CD3)2SO) 25,7, 26,4, 34,1, 35,5, 43,5, 44,1, 51,5, 53,4, 126,4, 128,1, 128,2, 131,1, 131,2, 133,7, 138,9, 147,1, 166,7; МСВР (ЭР+). Вычислено [C29H30F5N2O6PS+H] 661,5970, наблюдали 661,1566; ВЭЖХ (I) tR=17,489 мин (97,9%), (II) tR=38,028 мин (100,0%).
Пример 48 - Соединение 22
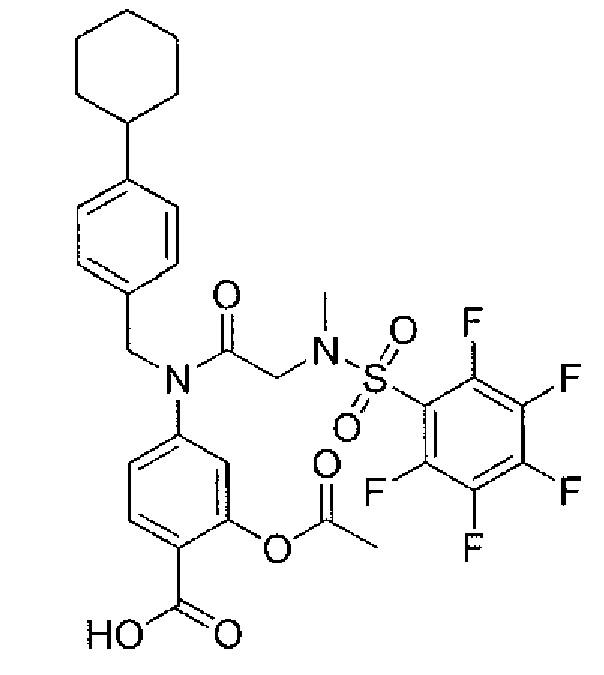 .
.
2-Ацетокси-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензойная кислота.
Химическая формула: C31H29F5N2O7S.
Молекулярная масса: 668,1616.
Соединение 22 синтезировали в соответствии с общим способом о с получением конечного продукта 22 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,32-1,48 (м, 5H, CH2), 1,70-1,88 (м, 5H, CH2), 2,32 (с, 3H, CH3), 2,43-2,51 (м, 1H, CH), 3,10 (с, 3H, CH3), 4,00 (с, 2H, CH2), 4,76 (с, 2H, CH2), 6,82 (с, 1H, CH), 6,93-7,02 (м, 3H, CH), 7,12 (д, J=7,7 Гц, 2H, CH), 8,10 (д, J=8,1 Гц, 1H, CH); δC (100 МГц, J-(CD3)2SO) 20,5, 26,0, 26,4, 33,6, 36,3, 44,3, 52,1, 53,4, 118,4, 120,0, 120,1, 123,0, 125,6, 130,8, 139,2, 158,8, 159,0, 168,0; МСВР (ЭР+). Вычислено [C31H29F5N2O7S+H] 669,1691, наблюдали 669,1701; ВЭЖХ (I) tR=24,679 мин (93,9%), (II) tR=43,441 мин (93,3%).
Пример 49 - Соединение 23
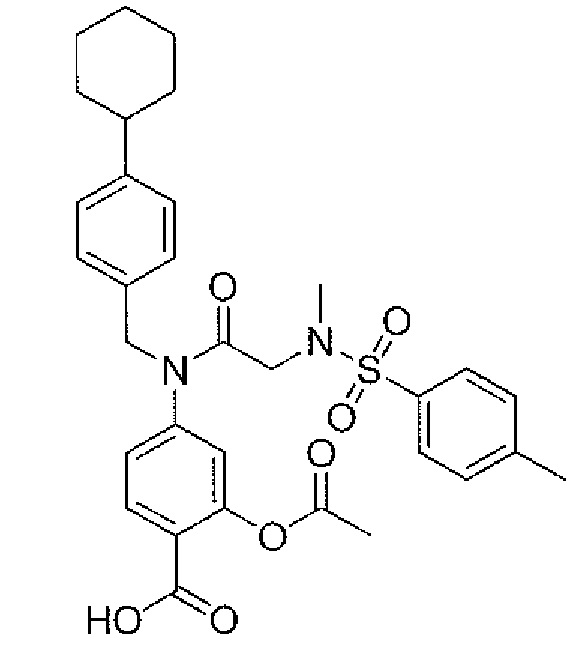 .
.
2-Ацетокси-4-(N-(4-циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)бензойная кислота.
Химическая формула: C32H36N2O7S.
Молекулярная масса: 592,7024.
Соединение 23 синтезировали в соответствии с общим способом о с получением конечного продукта 23 в виде желтой маслянистой жидкости. δH (400 МГц, d-CT>Ch) 1,24-1,47 (м, 5H, СН2), 1,70-1,91 (м, 5H, СН2), 2,32 (с, 3H, СН3), 2,40 (с, 3H, СН3), 2,43-2,52 (м, 1H, СН), 2,83 (с, 3H, СН3), 3,77 (с, 2H, СН2), 4,85 (с, 2H, СН2), 6,87 (с, 1H, СН), 7,03 (д, 1H, J=8,1 Гц, СН), 7,11 (д, J=7,9 Гц, 2Н, СН), 7,13 (д, J=7,9 Гц, 1H, СН), 7,27 (д, J=8,4 Гц, 2Н, СН); δC (100 МГц, J-(CD3)2SO) 20,9, 25,8, 26,2, 29,5, 33,6, 36,3, 44,3, 52,1, 53,4, 118,4, 120,1, 120,5, 123,0, 123,1, 125,6, 130,8, 134,9, 139,2, 142,5, 147,1, 158,8, 159,0, 168,0, 169,2; МСВР (ЭР+). Вычислено [C32H36N2O7S+Н] 593,7104, наблюдали 593,2316; ВЭЖХ (I) tR=22,090 мин (94,8%), (II) tR=41,402 мин (96,3%).
Пример 50 – Соединение 24
 .
.
4-(1Н-Тетразол-5-ил)анилин.
Химическая формула: C7H7N5.
Молекулярная масса: 161,1640.
Соединение 24 синтезировали в соответствии с общим способом p с получением конечного продукта 24 в виде белого порошка (74%). δH (400 МГц, d-MeOD3) 4,34 (шир, 2H, NH2), 6,51 (д, J=8,9 Гц, 2H, CH), 7,71 (с, J=8,9 Гц, 2H, CH); δC (100 МГц, J-C2D6CO) 113,4, 121,6, 126,8, 143,1, 154,2; МСНР (ЭР+). Вычислено [C7H7N5+H] 161,07, наблюдали 162,16.
Пример 51 - Соединение 25a
 .
.
Метил-4-аминобензоат.
Химическая формула: C8H9NO2.
Молекулярная масса: 151,16.
Соединение 25a синтезировали в соответствии с общим способом q с получением конечного продукта 25a в виде коричневого твердого вещества (91%). δH (400 МГц, d-CDCl3) 3,83 (с, 3H, CH3), 3,90-3,95 (шир, 2H, CH2), 6,61 (д, J=8,8 Гц, 2H, CH), 7,84 (д, J=20 8,8 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 51,6, 114,1, 120,1, 131,5, 151,2, 167,4; МСНР (ЭР+). Вычислено [C8H9NO2+H] 152,07, наблюдали 152,04.
Пример 52 - Соединение 25b
 .
.
Этил-4-аминобензоат.
Химическая формула: C9H11NO2.
Молекулярная масса: 165,19.
Соединение 25b синтезировали в соответствии с общим способом q с получением конечного продукта 25b в виде коричневого твердого вещества (87%). δH (400 МГц, d-CDCl3) 1,34 (т, J=7,0 Гц, 3H, CH3), 3,95-4,02 (шир, 2H, NH2), 4,31 (кв, J=7,1 Гц, 2H, CH2), 6,63 (д, J=8,0 Гц, 2H, CH), 7,86 (д, J=8,0 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 14,5, 60,2, 114,1, 120,2, 131,5, 152,1, 167,9; МСНР (ЭР+). Вычислено [C9H11NO2+Н] 166,09, наблюдали 166,1.
Пример 53 - Соединение 26
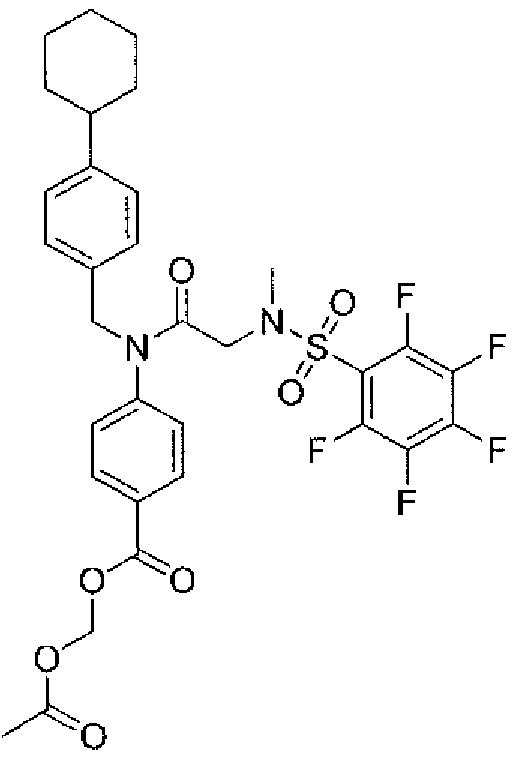 .
.
Ацетоксиметил-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензоат.
Химическая формула: C32H31F5N2O7S.
Молекулярная масса: 682,6548.
Соединение 26 синтезировали в соответствии с общим способом r с получением конечного продукта 26 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,27-1,46 (м, 5H, CH2), 1,69-1,92 (м, 5H, CH2), 2,14 (с, 3H, CH3), 2,42-2,52 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,94 (с, 2H, CH2), 4,74 (с, 2H, CH2), 5,98 (с, 2H, CH2), 6,95 (д, J=7,5 Гц, 2H, CH), 7,05-7,15 (м, 4H, CH), 8,10 (д, J=8,3 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 20,6, 26,0, 26,7, 34,2, 35,8, 44,1, 52,2, 53,0, 79,6, 126,9, 127,8, 128,0, 128,2, 128,4, 131,7, 132,9, 147,8, 164,0, 165,7, 169,4; МСВР (ЭР+). Вычислено [C32H31F5N2O7S+H] 683,6627, наблюдали 683,1877; ВЭЖХ (I) tR=30,783 мин (97,3%), (II) tR=47,872 мин (100,0%).
Пример 54 – Соединение 27
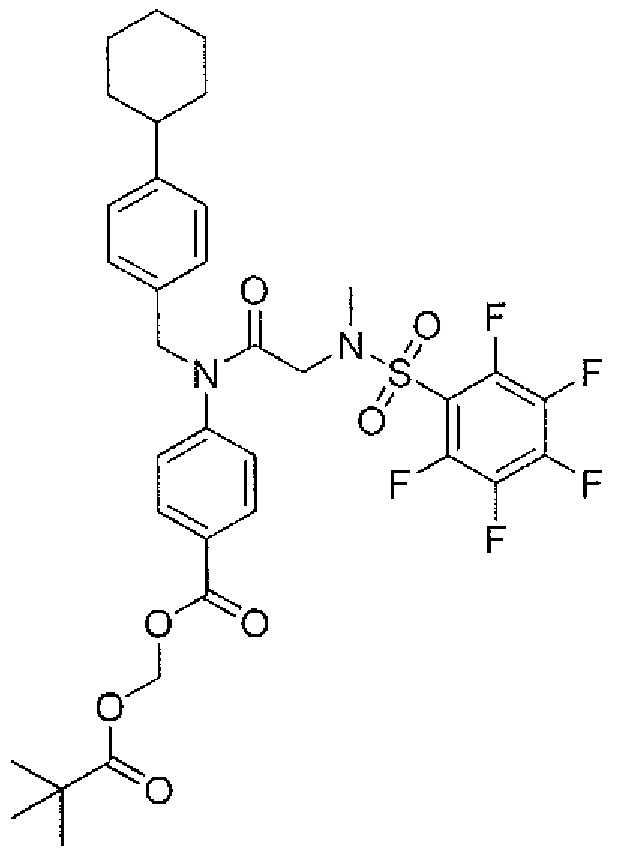 .
.
(Пивалоилокси)метил-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензоат.
Химическая формула: C35H37F5N2O7S
Молекулярная масса: 724,7345.
Соединение 27 синтезировали в соответствии с общим способом r с получением конечного продукта 27 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,23 (с, 9H, CH3), 1,34-1,44 (м, 5H, CH2), 1,71-1,89 (м, 5H, CH2), 2,42-2,52 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,94 (с, 2H, CH2), 4,74 (с, 2H, CH2), 5,99 (с, 2H, CH2), 6,96 (д, J=7,7 Гц, 2H, CH), 7,06-7,13 (м, 4H, CH), 8,10 (д, J=8,6 Гц, 2H, CH); δH (100 МГц, d-CDCl3) 26,0, 26,6, 26,7, 34,2, 35,8, 44,1, 52,2, 53,0, 80,0; МСВР (ЭР+). Вычислено [C35H37F5N2O7S+H] 725,7424, наблюдали 725,2339; ВЭЖХ (I) tR=35,701 мин (96,2%), (II) tR=52,017 мин (99,5%).
Пример 55 – Соединение 28
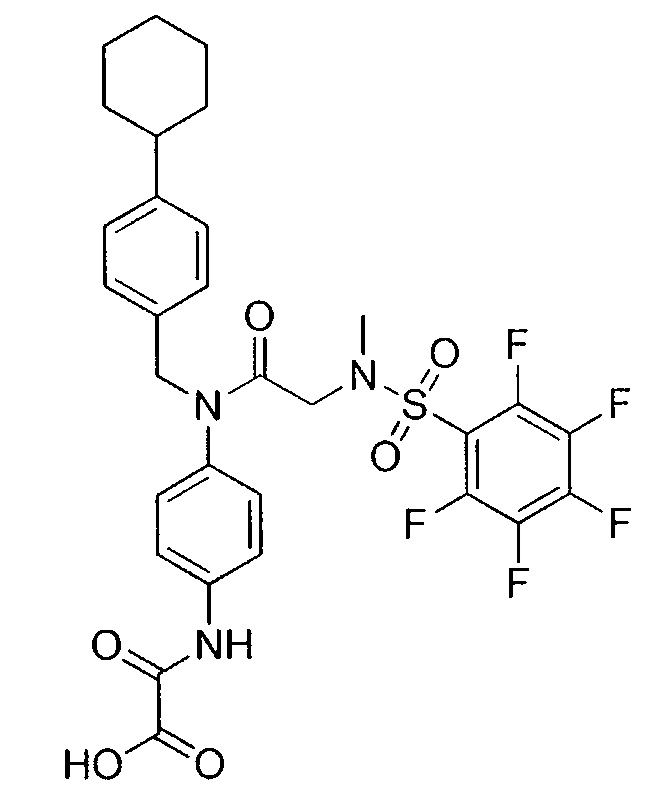 .
.
2-((4-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)фенил)амино)-2-оксоуксусная кислота.
Химическая формула: C30H28F5N3O6S.
Молекулярная масса: 653,62.
Соединение 28 синтезировали в соответствии с общим способом g с получением конечного продукта 28 в виде белого твердого вещества. δH (400 МГц, d-(CD3)2SO) 1,25-1,40 (м, 5H, CH2), 1,62-1,80 (м, 5H, CH2), 2,37-2,55 (м, 1H, CH), 2,97 (с, 3H, CH3), 3,97 (с, 2H, CH2), 4,67 (с, 2H, CH2), 6,98 (д, J=7,5 Гц, 2H, CH), 7,03-7,13 (м, 4H, CH), 7,83 (д, J=7,9 Гц, 2H, CH), 10,54 (шир, 1H, NH); δC (100 МГц, d-CDCl3) 26,1, 26,7, 34,2, 35,9, 44,2, 52,4, 53,3, 121,0, 126,9, 128,6, 129,1, 133,4, 136,7, 136,8, 147,7, 154,2, 160,5, 166,1; МСВР (ЭР+). Вычислено [C30H28F5N3O6S+H] 653,1619, наблюдали 654,1691; ВЭЖХ (I) tR=23,256 мин (92,9%), (II) tR=42,389 мин (90,7%).
Пример 56 – Соединение 29
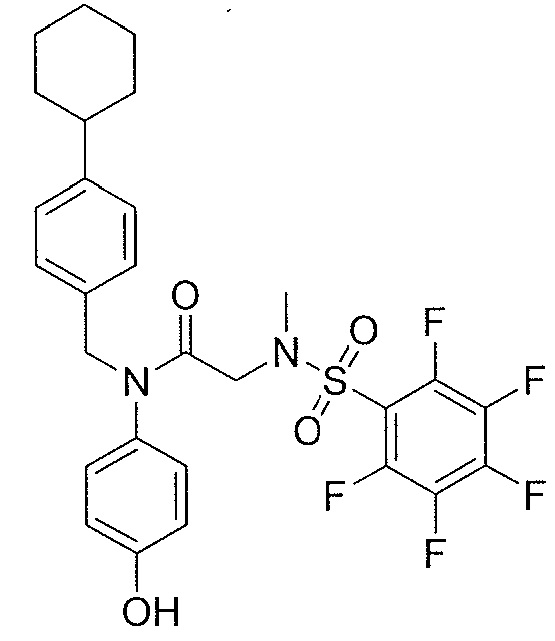 .
.
N-(4-Циклогексилбензил)-N-(94-гидроксифенил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C28H27F5N2O4S.
Молекулярная масса: 582,5820.
Соединение 29 синтезировали в соответствии с общим способом l с получением конечного продукта 29 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,28-1,53 (м, 5H, CH2), 1,72-1,95 (м, 5H, CH2), 2,41-2,58 (м, 1H, CH), 3,10 (с, 3H, CH3), 4,01 (с, 2H, CH2), 4,71 (с, 2H, CH2), 6,75 (д, J=8,4 Гц, 2H, CH), 6,82 (д, J=8,4 Гц, 2H, CH), 7,01 (д, J=7,7 Гц, 2H, CH), 7,13 (д, J=7,8 Гц, 2H, CH), 7,36 (шир, 1H, OH); δC (100 МГц, d-CDCl3) 26,0, 26,8, 34,3, 35,8, 44,1, 52,2, 53,4, 116,5, 126,8, 128,5, 129,1, 131,8, 133,3, 147,6, 156,7, 167,2; МСВР (ЭР+). Вычислено [C28H27N5O4S+H] 583,5899, наблюдали 583,1702; ВЭЖХ (I) tR=27,039 мин (99,7%), (II) tR=45,289 мин (99,98%).
Пример 57 - Соединение 30
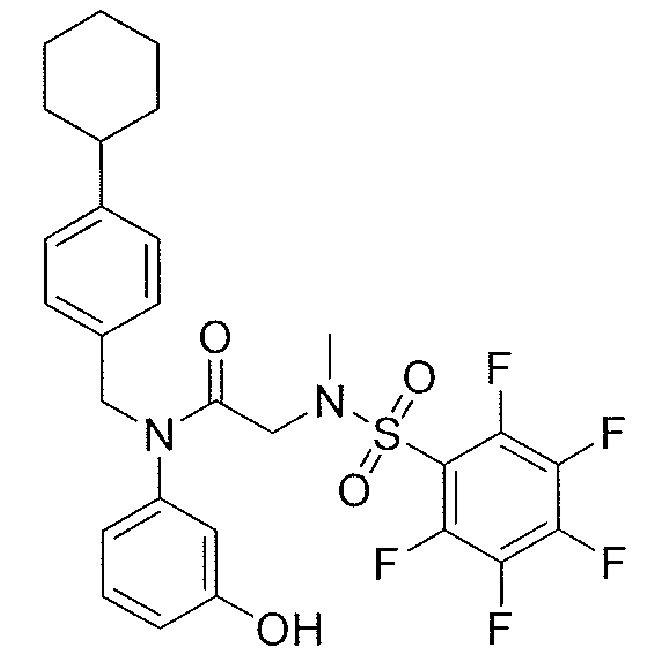 .
.
N-(4-Циклогексилбензил)-N-(3-гидроксифенил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C28H27F5N2O4S.
Молекулярная масса: 582,5820.
Соединение 30 синтезировали в соответствии с общим способом 1 с получением конечного продукта 30 в виде белого твердого вещества (77%). δH (400 МГц, d-CDCl3) 1,28-1,45 (м, 5H, СН2), 1,70-1,93 (м, 5H, СН2), 2,41-2,53 (м, 1H, СН), 3,08 (с, 3H, СН3), 4,02 (с, 2Н, СН2), 4,70 (с, 2Н, СН2), 6,39 (шир, 1H, ОН), 6,51 (д, J=7,4 Гц, 2Н, СН), 6,79 (д, J=8,1 Гц, 1H, СН), 7,01 (д, J=7,7 Гц, 2Н, СН), 7,10 (д, J=7,7 Гц, 2Н, СН), 7,13-7,21 (м, 1H, СН); δC (100 МГц, d-CDCl3) 26,1, 26,8, 34,3, 35,9, 44,2, 52,2, 53,2, 115,1, 116,0, 119,9, 126,9, 128,5, 130,9, 133,5, 141,2, 147,7, 157,3, 166,5; МСВР (ЭР+). Вычислено [C28H37F5N2O4S+Н] 538,5899, наблюдали 583,1703; ВЭЖХ (I) tR=26,890 мин (98,1%), (II) tR=45,172 мин (100%).
Пример 58 – Соединение 31
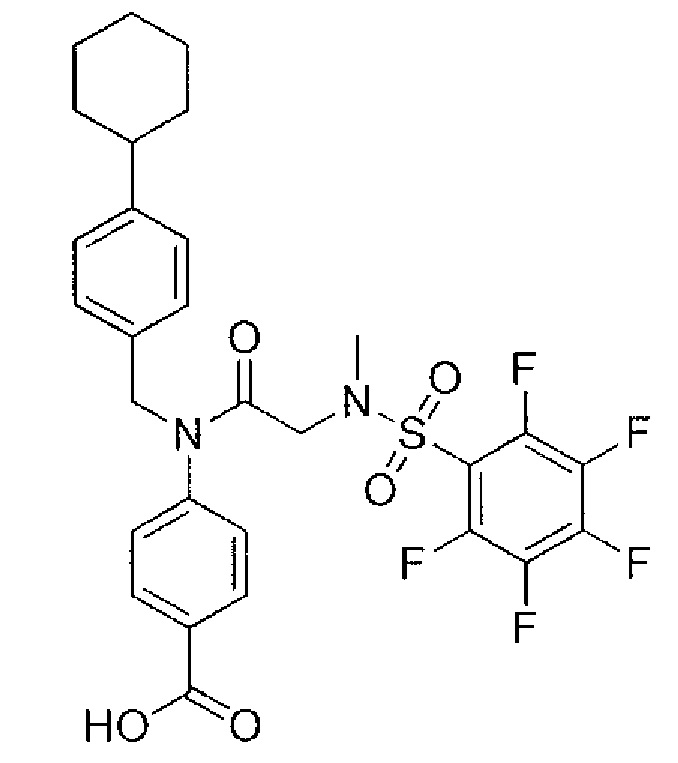 .
.
4-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)-N-гидроксибензамид.
Химическая формула: C29H27F5N2O5S.
Молекулярная масса: 610,5921.
Соединение 31 синтезировали в соответствии с общим способом 1 с получением конечного продукта 31 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,30-1,46 (м, 5H, CH2), 1,71-1,88 (м, 5H, CH2), 2,42-2,52 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,97 (с, 2H, CH2), 4,76 (с, 2H, CH2), 6,97 (д, J=7,7 Гц, 2H, CH), 7,06-7,15 (д, 4H, CH), 8,11 (д, J=Гц, 2H, CH); δC (100 МГц, d-CDCl3) 26,0, 26,8, 34,3, 35,9, 44,1, 52,3, 53,2, 127,1, 128,4, 128,5, 129,9, 131,9, 132,9, 147,9, 166,0, 170,6, 177,6; МСВР (ЭР+). Вычислено [C29H27F5N2O5S+H] 611,6000, наблюдали 611,1642; ВЭЖХ (I) tR=26,244 мин (100,0%), (II) tR=44,532 мин (100,0%).
Пример 59 - Соединение 32
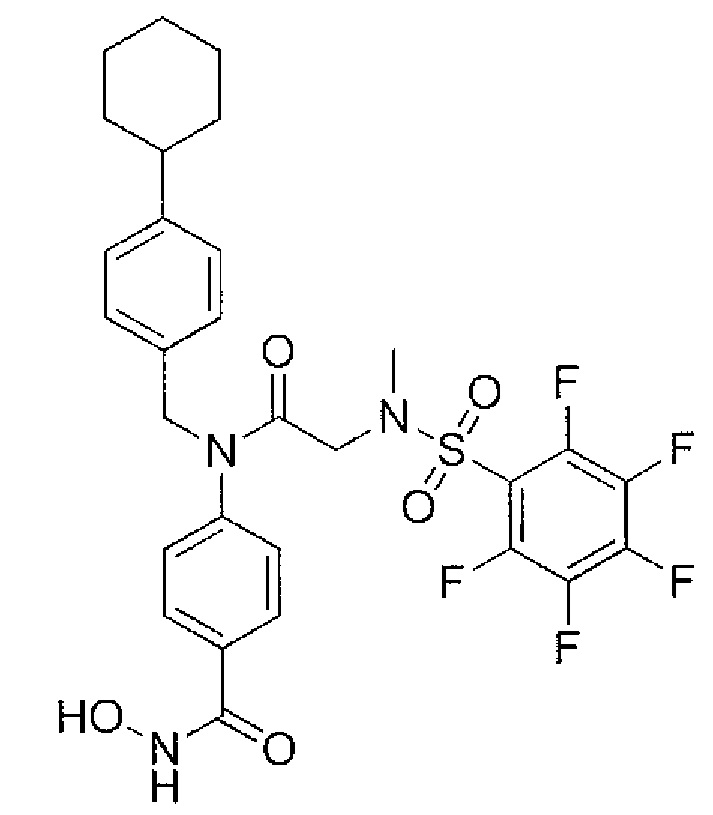 .
.
4-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)-N-гидроксибензамид.
Химическая формула: C29H28F5N3O5S.
Молекулярная масса: 625,61.
Соединение 32 синтезировали в соответствии с общим способом 1 с получением конечного продукта 32 в виде оранжевого твердого вещества. δH (400 МГц, d-MeOD) 1,27-1,43 (м, 5H, CH2), 1,71-1,87 (м, 5H, CH2), 2,41-2,51 (м, 1H, CH), 3,10 (с, 3H, CH3), 4,01 (с, 2H, CH2), 4,78 (с, 2H, CH2), 6,98-7,01 (м, 2H, CH), 7,10 (д, J=7,2 Гц, 2H, CH), 7,15-7,23 (м, 2Н, CH), 7,72-7,81 (м, 2H, CH); δC (100 МГц, d-MeOD) 25,7, 26,4, 34,12, 34,8, 44,1, 51,4, 126,5, 128,1, 128,3, 133,5, 136,7, 136,8, 147,7, 154,2, 165,4, 166,6; МСВР (ЭР+). Вычислено [C29H28F5N3O5S+Н] 626,6147, наблюдали 626,1742; ВЭЖХ (I) tR=22,843 мин (97,9%), (II) tR=44,120 мин (97,2%).
Пример 60 - Соединение 33
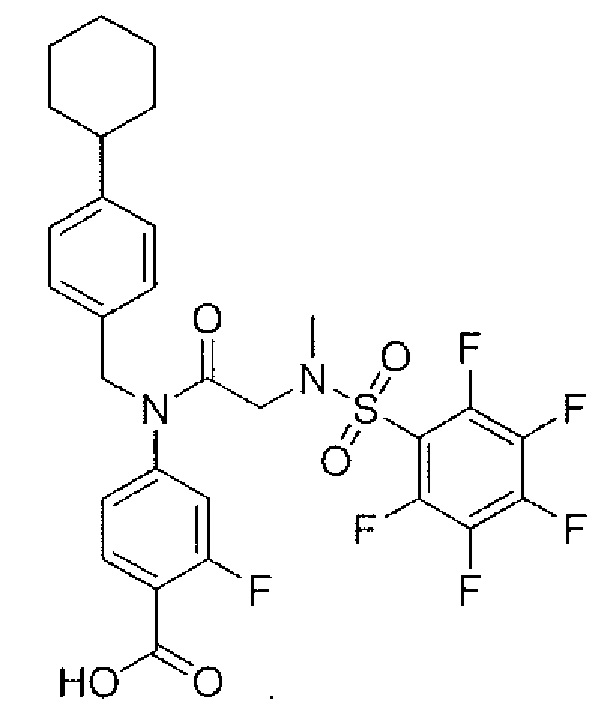 .
.
4-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)-2-фторбензойная кислота.
Химическая формула: C29H26F6N2O5S.
Молекулярная масса: 628,58.
Соединение 33 синтезировали в соответствии с общим способом 1 с получением конечного продукта 33 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,26-1,48 (м, 5H, CH2), 1,70-1,91 (м, 5H, CH2), 2,41-2,54 (м, 1H, CH), 3,10 (с, 3H, CH3), 4,03 (с, 2H, CH2), 4,77 (с, 2H, CH2), 6,84-6,96 (м, 2H, CH), 6,99 (д, J=7,7 Гц, 2H, CH), 7,13 (д, J=7,7 Гц, 2H, CH), 8,03 (т, J=7,9 Гц, 1H, CH), 9,42 (шир, 1H, OH); δC (100 МГц, d-CDCl3) 26,0, 26,8, 34,3, 35,9, 44,2, 52,3, 53,2, 127,3, 128,3, 132,7, 134,2, 148,2, 161,4, 164,0, 165,9, 167,8, 177,5; МСВР (ЭР+). Вычислено [C29H26F5N2O5S+H] 629,5905, наблюдали 629,1545; ВЭЖХ (I) tR=25,136 мин (97,8%), (II) tR=43,841 мин (97,8%).
Пример 61 - Соединение 34
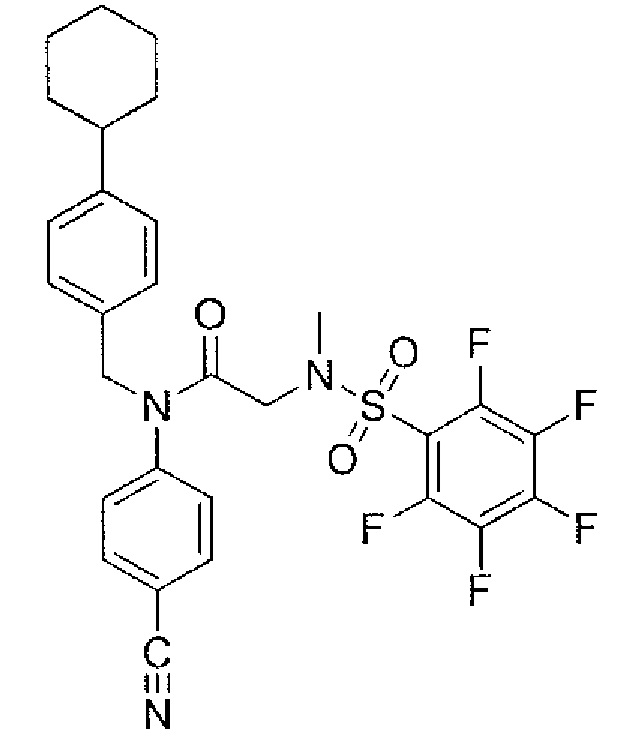 .
.
N-(4-Цианофенил)-N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C29H26F5N3O3S.
Молекулярная масса: 591,5921.
Соединение 34 синтезировали в соответствии с общим способом h с получением конечного продукта 34 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,28-1,45 (м, 5H, CH2), 1,69-1,89 (м, 5H, CH2), 2,40-2,53 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,93 (с, 2H, CH2), 4,76 (с, 2H, CH2), 6,97 (д, J=7,4 Гц, 2H, CH), 7,10-7,18 (м, 4H, CH), 7,65 (д, J=7,7 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 26,0, 26,7, 34,3, 35,7, 44,0, 52,0, 52,9, 61,8, 112,2, 117,6, 128,3, 129,1, 132,9, 133,7, 147,9, 165,8; МСВР (ЭР+). Вычислено [C29H26F5N3O3S+H] 592,6000, наблюдали 592,1707; ВЭЖХ (I) tR=29,752 мин (100,0%), (II) tR=47,312 мин (99,78%).
Пример 62 - Соединение 35
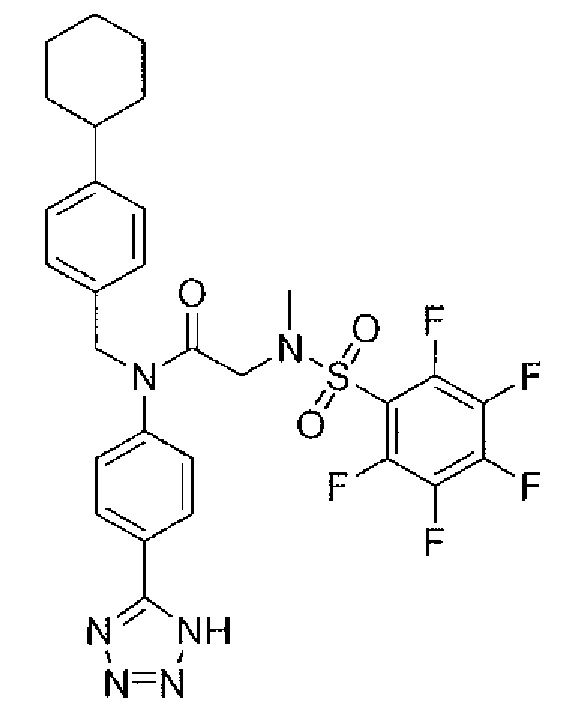 .
.
N-(4-(1Н-Тетразол-5-ил)фенил)-N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C29H27F5N6O3S.
Молекулярная масса: 634,6201.
Соединение 35 синтезировали в соответствии с общим способом h с получением конечного продукта 35 в виде белого поро1Hка (82%). δH (400 МГц, d-CDCl3) 1,25-1,41 (м, 5Н, СН2), 1,64-1,84 (м, 5H, СН2), 2,38-2,51 (м, 1H, СН), 3,10 (с, 3H, СН3), 3,96 (с, 2H, СН2), 10 4,75 (с, 2Н, СН2), 6,97 (д, J=7,4 Гц, 2Н, СН), 7,05-7,18 (м, 4H, СН), 8,03-8,10 (м, 2H, СН); δC (100 МГц, d-CDCl3) 26,1, 26,7, 34,3, 35,9, 44,1, 52,3, 53,4, 115,4, 127,1, 128,5, 129,1, 132,9, 142,3, 147,9, 157,1, 166,6; МСВР (ЭР+). Вычислено [C29H27N6O3S+Н] 635,6280, наблюдали 635,1858; ВЭЖХ (I) tR=24,461 мин (99,7%), (II) tR=43,295 мин (99,3%).
Пример 63 – Соединение 36
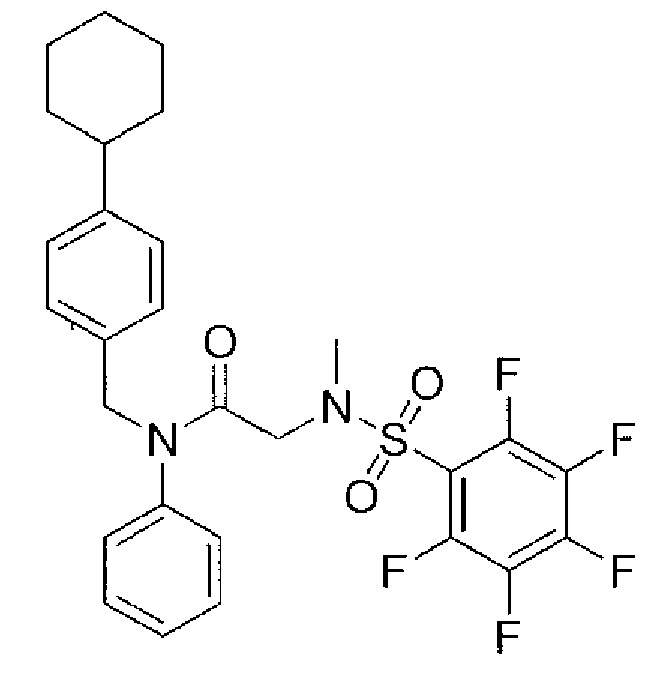 .
.
N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)-N-фенилацетамид
Химическая формула: C28H27F5N2O3S.
Молекулярная масса: 566,5826.
Соединение 36 синтезировали в соответствии с общим способом h с получением конечного продукта 36 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,28-1,45 (м, 5H, СН2), 1,71-1,93 (м, 5H, СН2), 2,42-2,53 (м, 1H, СН), 3,10 (с, 3H, СН3), 3,95 (с, 2H, 10 СН2), 4,72 (с, 2Н, СН2), 6,96-7,03 (м, 4Н, СН), 7,11 (д, J=7,9 Гц, 2Н, СН), 7,34-7,41 (м, 3H, СН); δC (100 МГц, d-CDCl3) 26,1, 26,8, 34,4, 35,8, 44,2, 52,3, 53,2, 126,9, 128,2, 128,5, 128,8, 130,1, 133,6, 140,2, 147,6, 166,2; МСВР (ЭР+). Вычислено [C28H27F5N2O3S+Н] 567,5905, наблюдали 567,1752; ВЭЖХ (I) tR=22,657 мин (99,6%), (II) tR=49,267 мин (98,9%).
Пример 64 – Соединение 37
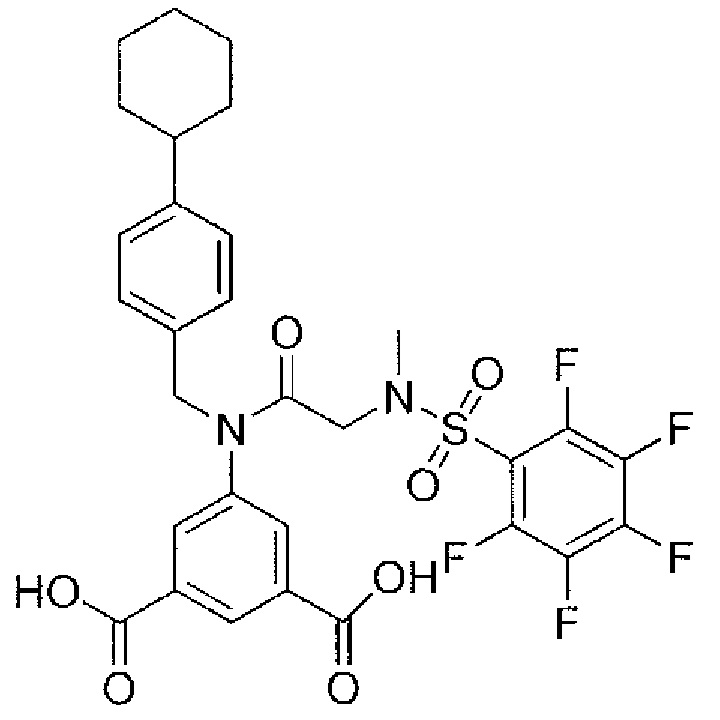 .
.
5-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)изофталевая кислота.
Химическая формула: C30H27F5N2O7S.
Молекулярная масса: 654,6016.
Соединение 37 синтезировали в соответствии с общим способом 1 с получением конечного продукта 37 в виде белого твердого вещества. δH (400 МГц, d-(CD3)2SO) 1,21-1,42 (м, 5H, CH2), 1,64-1,79 (м, 5H, CH2), 2,40-2,51 (м, 1H, CH), 3,01 (с, 3H, CH3), 3,97 (с, 2H, CH2), 4,77 (с, 2H, CH2), 7,01 (д, J=7,4 Гц, 2H, CH), 7,12 (д, J=7,4 Гц, 2H, CH), 7,84-7,89 (м, 2H, CH), 8,41 (с, 1H, CH); δC (100 МГц, d-(CD3)2SO) 25,8, 26,8, 34,2, 35,8, 43,7, 52,5, 53,1, 127,2, 128,5, 130,1, 133,3, 133,5, 134,1, 140,4, 141,1, 147,1, 166,1, 166,4; МСВР (ЭР+). Вычислено [C30H27F5N2O7S+H] 655,6095, наблюдали 655,1537; ВЭЖХ (I) tR=18,18 мин (93,4%), (II) tR=35,28 мин (94,5%).
Пример 65 - Соединение 38
 .
.
5-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)-2-гидроксибензойная кислота.
Химическая формула: C29H27F5N2O6S.
Молекулярная масса: 626,5915.
Соединение 38 синтезировали в соответствии с общим способом 1 с получением конечного продукта 38 в виде бесцветной маслянистой жидкости. δH (400 МГц, d-(CD3)2SO) 1,26-1,44 (м, 5H, CH2), 1,71-1,87 (м, 5H, CH2), 2,42-2,50 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,94 (с, 2H, CH2), 4,68 (с, 2H, CH2), 7,01 (д, J=7,4 Гц, 2H, CH), 7,12 (д, J=7,4 Гц, 2H, CH), 7,84-7,89 (м, 2H, CH), 8,41 (с, 1H, CH); δC (100 МГц, d-CDCl3) 25,8, 26,8, 34,2, 35,8, 43,7, 52,5, 53,1, 127,2, 128,5, 130,1, 133,3, 133,5, 134,1, 140,4, 141,1, 147,1, 166,1, 166,4; МСВР (ЭР+). Вычислено [C29H27F5N2O6S+H] 627,5994, наблюдали 627,1588; ВЭЖХ (I) tR=26,235 мин (99,4%), (II) tR=44,654 мин (96,4%).
Пример 66 - Соединение 39
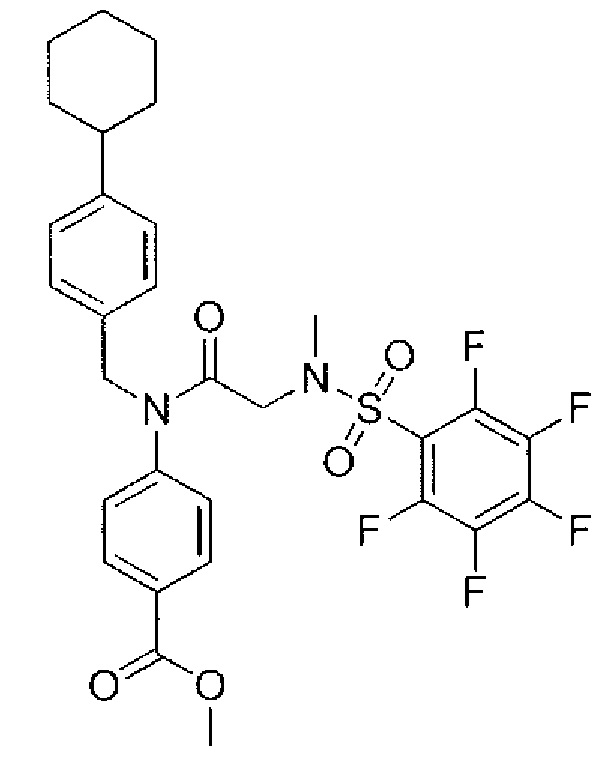 .
.
Метил-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензоат.
Химическая формула: C30H29F5N2O5S.
Молекулярная масса: 624,6187.
Соединение 39 синтезировали в соответствии с общим способом h с получением конечного продукта 39 в виде белого твердого вещества (74%). δH (400 МГц, d-CDCl3) 1,26-1,49 (м, 5H, CH2), 1,66-1,93 (м, 5H, CH2), 2,37-2,54 (м, 1H, CH), 3,07 (с, 3H, CH3), 3,90 (с, 3H, CH3), 3,94 (с, 2H, CH2), 4,73 (с, 2H, CH2), 6,95 (д, J=7,4 Гц, 2H, CH), 7,01-7,14 (м, 4H, CH), 8,02 (д, J=8,3 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 25,1, 26,7, 34,2, 35,8, 44,0, 48,5, 51,8, 53,5, 126,8, 128,1, 128,4, 131,2, 133,2, 147,6, 152,4, 165,1, 166,3, 165,8; МСВР (ЭР+). Вычислено [C30H29F5N2O5S+H] 625,6266, наблюдали 625,1784; ВЭЖХ (I) tR=32,188 мин (99,6%), (II) tR=49,208 мин (99,6%).
Пример 67 - Соединение 40
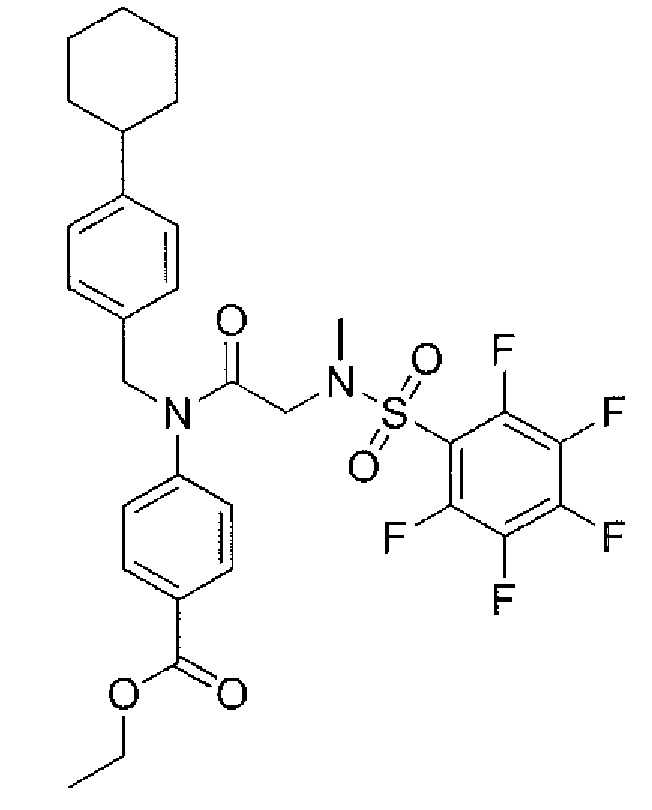 .
.
Этил-4-(N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)бензоат.
Химическая формула: C31H31F5N2O5S.
Молекулярная масса: 638,6453.
Соединение 40 синтезировали в соответствии с общим способом h с получением конечного продукта 40 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,32-1,46 (м, 8H, CH2 и CH3), 1,70-1,86 (м, 5H, CH2), 2,42-2,52 (м, 1H, CH), 3,10 (с, 3H, CH3), 3,94 (с, 2H, CH2), 4,39 (кв, J=7,2 Гц, 2H, CH2), 4,73 (с, 2H, CH2), 6,96 (д, J=7,9 Гц, 2H, CH), 7,1 (д, J=8,3 Гц, 2H, CH), 7,10 (д, J=7,9 Гц, 2H, CH), 8,10 (д, J=8,3 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 14,1, 26,0, 26,7, 34,2, 35,8, 44,0, 52,2, 53,0, 61,3, 126,9, 128,2, 128,4, 131,3, 133,1, 147,8, 152,6, 165,3, 165,7, 165,8; МСВР (ЭР+). Вычислено [C31H31F5N2O5S+H] 639,6532, наблюдали 639,1956; ВЭЖХ (I) tR=33,512 мин (100,0%), (II) tR=50,144 мин (100,0%).
Пример 68 - Соединение 41
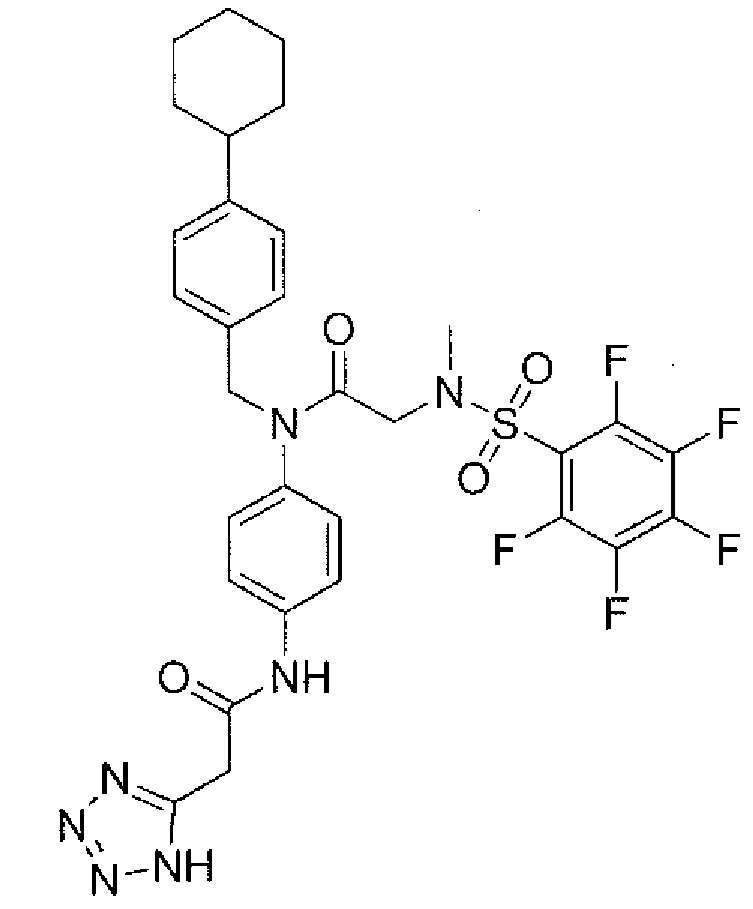 .
.
N-(4-(2-(1H-Тетразол-5-ил)ацетамидо)фенил)-N-(4-циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамид.
Химическая формула: C31H30F5N7O4S.
Молекулярная масса: 691,6714.
Соединение 41 синтезировали в соответствии с общим способом h с получением конечного продукта 41 в виде желтой маслянистой жидкости. δH (400 МГц, d-(CD3)2SO) 1,22-1,44 (м, 5H, CH2), 1,64-1,82 (м, 5H, CH2), 2,41-2,50 (м, 1H, CH), 3,01 (с, 3H, CH3), 3,98 (с, 2H, CH2), 4,10 (с, 2H, CH2), 4,69 (с, 2H, CH2), 7,00 (д, J=7,9 Гц, 2H, CH), 7,05-7,18 (м, 4H, CH), 7,60 (д, J=8,6 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 20,7, 26,7, 31,6, 34,2, 36,7, 44,1, 52,1, 53,1, 97,8, 121,4, 126,9, 128,4, 133,3, 137,8, 147,6, 163,1, 166,2, 176,9; МСВР (ЭР+). Вычислено [C31H30F5N7O4S+H] 692,6794, наблюдали 692,2072; ВЭЖХ (I) tR=21,636 мин (97,6%), (II) tR=9,452 мин (99,12%).
Пример 69 - Соединение 42
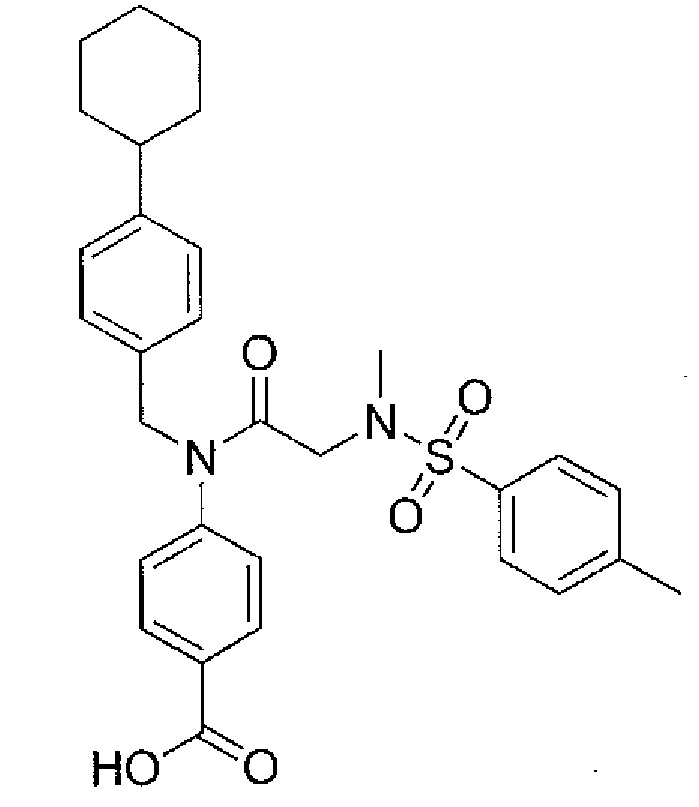 .
.
4-(N-(4-Циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)бензойная кислота.
Химическая формула: C30H34N2O5S.
Молекулярная масса: 534,6664.
Соединение 42 синтезировали в соответствии с общим способом I с получением конечного продукта 43 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,25-1,41 (м, 5H, CH2), 1,71-1,89 (м, 5H, CH2), 2,41 (с, 3H, CH3), 2,44-2,51 (м, 1H, CH), 2,86 (с, 3H, CH3), 3,77 (с, 2H, CH2), 4,83 (с, 2H, CH2), 7,04 (д, J=7,4 Гц, 2H, CH), 7,10-7,16 (м, 4H, CH), 7,27 (д, J=8,1 Гц, 2H, CH), 7,63 (д, J=8,2 Гц, 2H, CH), 8,10 (д, J=8,2 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 21,4, 25,9, 26,8, 29,5, 34,3, 35,8, 44,1, 53,1, 126,8, 127,4, 129,3, 129,6, 131,6, 133,5, 135,2, 137,5, 143,3, 145,1, 146,5, 147,1, 166,7, 169,4; МСВР (ЭР+). Вычислено [C30H34N2O5S+H] 535,6743, наблюдали 535,2259; ВЭЖХ (I) tR=20,701 мин (100,0%), (II) tR=40,495 мин (100,0%).
Пример 70 - Соединение 43
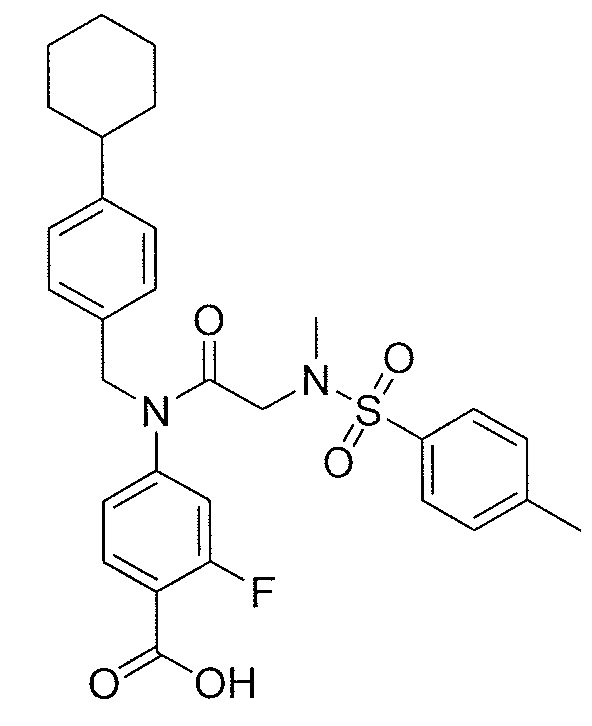 .
.
4-(N-(4-Циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)-2-фторбензойная кислота.
Химическая формула: C30H33FN2O5S.
Молекулярная масса: 552,6568.
Соединение 43 синтезировали в соответствии с общим способом I с получением конечного продукта 44 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,26-1,44 (м, 5H, CH2), 1,70-1,89 (м, 5H, CH2), 2,41 (с, 3H, CH3), 2,42-2,54 (м, 1H, CH), 2,85 (с, 3H, CH3), 3,81 (с, 2H, CH2), 4,84 (с, 2H, CH2), 6,85-6,98 (м, 2H, CH), 7,05 (д, J=7,7 Гц, 2H, CH), 7,12 (д, J=7,7 Гц, 2H, CH), 7,3 (д, J=8,1 Гц, 2H, CH), 7,63 (д, J=7,9 Гц, 2H, CH), 7,96-8,03 (м, 1H, CH); δC (100 МГц, d-CDCl3) 21,4, 25,8, 26,7, 34,3, 35,7, 44,1, 51,8, 53,1, 127,5, 129,5, 132,7, 133,1, 134,2, 134,9, 136,8, 137,1, 148,2, 161,4, 164,0, 165,9, 167,8; МСВР (ЭР+). Вычислено [C30H33FN2O5S+H] 553,6648, наблюдали 553,2158; ВЭЖХ (I) tR=20,972 мин (97,1%), (II) tR=40,669 мин (94,40%).
Пример 71 - Соединение 44
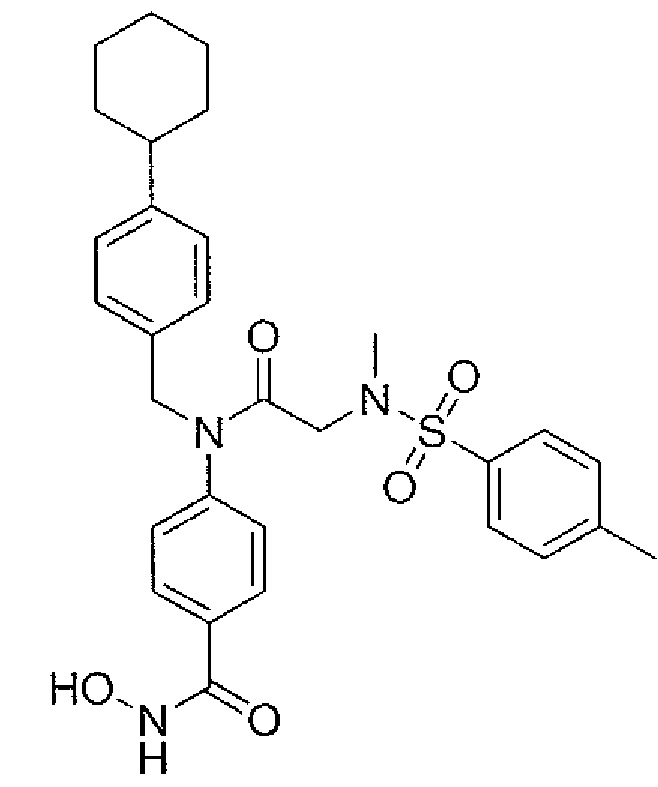 .
.
4-(N-(4-Циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)-N-гидроксибензамид.
Химическая формула: C30H35N3O5S.
Молекулярная масса: 549,68.
Соединение 44 синтезировали в соответствии с общим способом I с получением конечного продукта 45 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,26-1,46 (м, 5H, СН2), 1,70-1,87 (м, 5H, СН2), 2,39 (с, 3H, СН3), 2,42-2,50 (м, 1H, СН), 2,81 (с, 3H, СН3), 3,63 (с, 1H, NH), 3,70 (шир, 1H, ОН), 3,89 (с, 2H, СН2), 4,85 (с, 2H, СН2), 7,03-7,14 (м, 4Н, СН), 7,18-7,24 (м, 2Н, СН), 7,31 (д, J=7,5 Гц, 2Н, СН), 7,53 (д, J=7,5 Гц, 2Н, СН), 7,75 (д, J=7,0 Гц, 2Н, СН); δC (100 МГц, d-CDCl3) 21,4, 25,9, 26,7, 29,6, 34,3, 35,8, 44,1, 51,4, 53,1, 119,8, 126,9, 127,4, 128,1, 129,2, 132,5, 134,3, 135,3, 143,2, 147,3, 163,1, 167,6; МСВР (ЭР+). Вычислено [C30H35N3O5S+Н] 550,6889, наблюдали 550,2370; ВЭЖХ (I) tR=14,977 мин (96,5%), (II) tR=37,687 мин (97,2%).
Пример 72 - Соединение 45
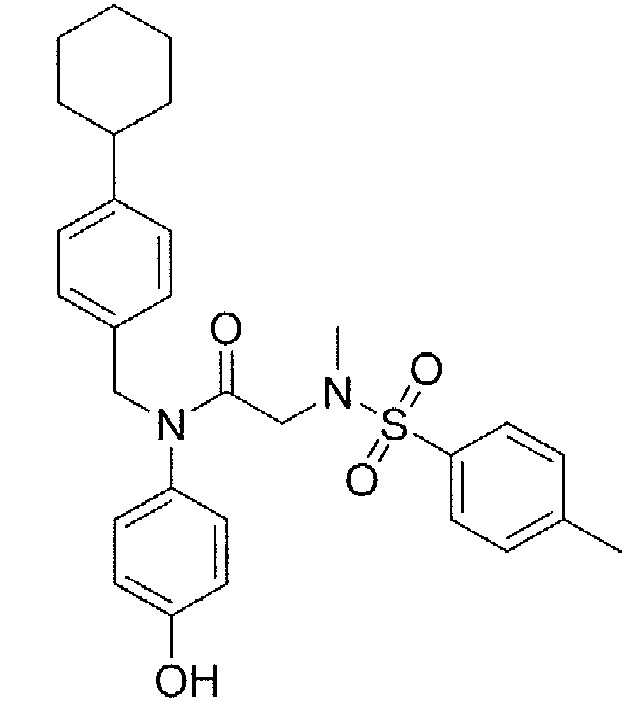 .
.
N-(4-Циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)-N-(4-гидроксифенил)ацетамид.
Химическая формула: C29H34N2O4S.
Молекулярная масса: 506,6563.
Соединение 45 синтезировали в соответствии с общим способом I с получением конечного продукта 46 в виде желтой маслянистой жидкости. δH (400 МГц, d-CDCl3) 1,28-1,44 (м, 5H, CH2), 1,71-1,89 (м, 5H, CH2), 2,39 (с, 3H, CH3), 2,42-2,50 (м, 1H, CH), 2,86 (с, 3H, CH3), 3,74 (с, 2H, CH2), 4,73 (с, 2H, CH2), 6,36 (шир, 1H, OH), 6,76-6,83 (м, 4H, CH), 7,04 (д, J=8,1 Гц, 2H, CH), 7,1 (д, J=7,9 Гц, 2H, CH), 7,25 (д, J=7,4 Гц, 2H, CH), 7,64 (д, J=8,1 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 21,4, 25,8, 26,5, 34,3, 35,8, 44,1, 51,4, 53,1, 116,3, 126,6 127,4, 128,7, 129,3, 132,7, 134,0, 135,3, 143,2, 147,3, 156,1, 167,6; МСВР (ЭР+). Вычислено [C29H34N2O4S+H] 507,6642, наблюдали 507,2312; ВЭЖХ (I) tR=21,567 мин (100,0%), (II) tR=41,184 мин (100,0%).
Пример 73 - Соединение 46
 .
.
2-((4-(N-(4-Циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)фенил)амино)-2-оксоуксусная кислота.
Химическая формула: C31H35N3O6S.
Молекулярная масса: 577,6911.
Соединение 46 синтезировали в соответствии с общим способом g с получением конечного продукта 47 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,24-1,41 (м, 5H, CH2), 1,71-1,86 (м, 5H, CH2), 2,45 (с, 3H, CH3), 2,41-2,53 (м, 1H, CH), 2,87 (с, 3H, CH3), 3,71 (с, 2H, CH2), 4,77 (с, 2H, CH2), 6,98-7,01 (м, 4H, CH), 7,12 (д, J=7,8 Гц, 2H, CH), 7,31 (д, J=7,3 Гц, 2H, CH), 7,53-7,59 (м, 4H, CH); δC (100 МГц, d-CDCl3) 25,9, 26,2, 34,1, 35,3, 44,2, 51,6, 53,4, 63,6, 121,1, 126,5, 128,2, 129,1, 129,7, 133,1, 135,5, 136,8, 137,4, 143,1, 154,4, 161,2, 165,9, 167,1; МСВР (ЭР+). Вычислено [C31H35N3O6S+H] 578,6990, наблюдали 578,2319; ВЭЖХ (I) tR=19,967 мин (100,0%), (II) tR=39,811 мин (97,9%).
Пример 74 - Соединение 47
 .
.
4-(N-(4-Циклогексилбензил)-2-(2,3,4,5,6-пентафтор-N-метилфенилсульфонамидо)ацетамидо)-2-гидроксибензойная кислота.
Химическая формула: C29H27F5N2O6S.
Молекулярная масса: 626,59.
Соединение 47 синтезировали в соответствии с общим способом I с получением конечного продукта 42 в виде бесцветной маслянистой жидкости. δH (400 МГц, d6-ДМСО) 1,33-1,41 (м, 5H, CH2), 1,68-1,85 (м, 5H, CH2), 2,42-2,51 (м, 1H, CH), 3,10 (с, 3H, CH3), 4,13 (с, 2H, CH2), 4,76 (с, 2H, CH2), 6,75 (дд, J=8,4 и 2,0 Гц, 1H, CH), 6,68 (д, J=8,0 Гц, 1H, CH), 7,10 (д, J=7,0 Гц, 2H, CH), 7,12 (д, J=8,0 Гц, 2H, CH), 7,81 (д, J=8,4 Гц, 1H, CH); δC (100 МГц, d6-ДМСО) 25,3, 26,1, 34,7, 35,5, 44,1, 51,3, 51,7, 115,7, 118,4, 118,9, 125,9, 127,4, 131,3, 133,8, 145,9, 146,2, 161,4, 165,2, 171,2; МСНР (ЭР+). Вычислено [C29H27F5N2O6S+Н] 627,15, наблюдали 627,15.
Пример 75 - Соединение 48
 .
.
4-(N-(4-Циклогексилбензил)-2-(N,4-диметилфенилсульфонамидо)ацетамидо)-2-гидроксибензойная кислота.
Химическая формула: C30H34N2O6S.
Молекулярная масса: 550,67.
Соединение 48 синтезировали в соответствии с общим способом I с получением конечного продукта 48 в виде белого твердого вещества. δH (400 МГц, d-CDCl3) 1,26-1,45 (м, 5H, CH2), 1,71-1,89 (м, 5H, CH2), 2,42 (с, 3H, CH3), 2,43-2,51 (м, 1H, CH), 2,88 (с, 3H, CH3), 3,86 (с, 2H, CH2), 4,81 (с, 2H, CH2), 6,61 (д, J=8,3 Гц, 1H, CH), 6,68-6,72 (м, 1H, CH), 7,10 (д, J=8,1 Гц, 2H, CH), 7,12 (д, J=8,1 Гц, 2H, CH), 7,27 (д, J=8,4 Гц, 1H, CH), 7,66 (д, J=8,1 Гц, 2H, CH), 7,87 (д, J=8,1 Гц, 2H, CH); δC (100 МГц, d-CDCl3) 21,3, 25,3, 26,5, 34,1, 36,2, 42,1, 43,4, 51,3, 52,0, 112,8, 116,3, 118,8, 126,8, 127,1, 127,6, 131,0, 134,3, 141,2, 146,7, 147,1, 161,8, 167,0, 171,5; МСНР (ЭР+). Вычислено [C29H27F5N2O6S+H] 627,1582, наблюдали 627,1551; МСВР (ЭР+). Вычислено [C30H34N2O6S+H] 551,2223, наблюдали 551,2210; ВЭЖХ (I) tR=24,351 мин (98,1%), (II) tR=52,80 мин (98,2%).
Пример 76 - Скрининг киназ и GPCR
Проводили оценку исследуемого соединения, вводимого в виде одной 5 мкМ дозы в двух повторностях. IC50 контрольного соединения исследовали по 10 дозам, проводя 3-кратные последовательные разбавления, начиная с 20 мкМ. Взаимодействия проводили с использованием 10 мкМ АТФ.
Предварительный скрининг в отношении АКТ, c-Src, ERK1, JaK1 и JaK2 проводили в Reaction Biology Corporation (www.reactionbiology.com, Malvern, PA) при помощи платформы для исследования «HotSpot». Специфические пары киназа/субстрат, а также требуемые кофакторы получали в реакционном буфере: 20 мМ ГЭПЭС pH 7,5, 10 мМ MgCl2, 1 мМ ЭГТА, 0,02% Brij35, 0,02 мг/мл БСА, 0,1 мкМ Na3VO4, 2 мМ DTT, 1% ДМСО. Скрининг проводили в двух повторностях для одной концентрации 5 мкМ. Лунку с реакционной смесью, содержащую исследуемое соединение, обрабатывали смесью АТФ (Sigma, St. Louis MO) и 33P АТФ (Perkin Elmer, Waltham MA) до достижения конечной концентрации 1 мкМ. IC50 контрольного соединения (стауроспорина) исследовали по 10 дозам, проводя 3-кратные последовательные разбавления, начиная с 20 мкМ. Лунки с реакционной смесь выдерживали при комнатной температуре в течение 120 минут, после чего помещали пятно каждой реакционной смеси на ионообменную фильтровальную бумагу P81 (Whatman Inc., Piscataway, NJ). Несвязанные фосфаты удаляли путем промывки фильтров избытком 0,75% фосфорной кислоты. Вычитали фоновый сигнал, определенный с использованием контрольных реакционных смесей, и данные киназной активности выражали в виде остаточной киназной активности в исследуемых образцах в процентах по сравнению с реакционными смесями, содержащими носитель (диметилсульфоксид). Все значения IC50 (таблица 3) получали при помощи Prism (GraphPad Software) (ФИГ. 5), там же проводили аппроксимацию кривой.
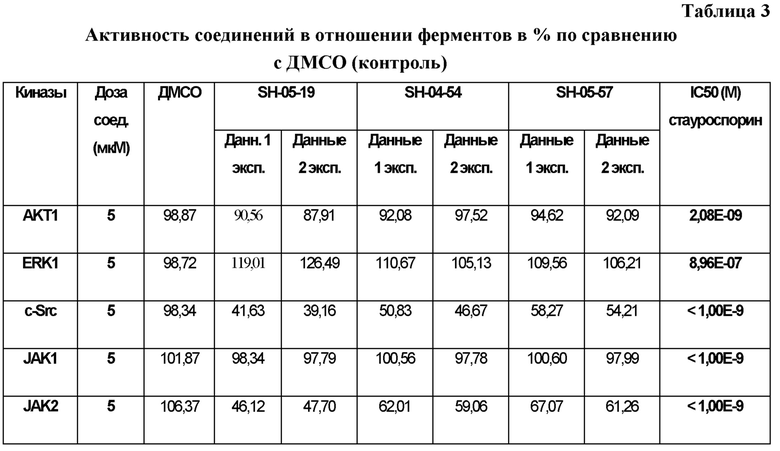
Проводили второй скрининг в отношении 101 выбранной киназы. Проводили оценку одной 500 нМ дозы исследуемого соединения. Штаммы фагов T7 с киназными метками параллельно выращивали в 24-луночных блоках в хозяине E. coli, полученном из штамма BL21. E. coli выращивали до логарифмической фазы роста, после чего инфицировали фагом T7 из замороженного маточного раствора (множественность инфекции = 0,4) и инкубировали путем встряхивания при 32°C до прохождения лизиса (90-150 минут). Лизаты центрифугировали (6000×g) и фильтровали (0,2 мкм) для удаления любых сгустков клеток. Оставшиеся киназы вырабатывались клетками HEK- 293, после чего их метили ДНК для проведения простого детектирования количественной ПЦР (кПЦР). Магнитные зерна с покрытием стрептавидина обрабатывали биотинилированными лигандами, состоящими из небольших молекул, в течение 30 минут при комнатной температуре для получения аффинных смол для требуемых киназных исследований. Зерна, содержащие лиганды, блокировали избытком биотина и промывали блокирующим буфером (SeaBlock (Pierce), 1% БСА, 0,05% Tween 20, 1 мМ DTT) для удаления несвязанного лиганда, а также для уменьшения неспецифического связывания фагов. Реакции связывания проводили путем объединения киназ, аффинных зерен с присоединенными лигандами и соединения 31 в 1x буфере для связывания (20% SeaBlock, 0,17x ФСБ, 0,05% Tween 20, 6 мМ DTT). Соединение 31 получали в виде 40x маточных растворов в 100% ДМСО и разбавляли непосредственно во время исследования. Все взаимодействия проводили в полипропиленовых 384-луночных планшетах в конечном объеме 40 мкл. Исследуемые планшеты встряхивали при комнатной температуре в течение 1 часа и аффинные зерна промывали промывочным буфером (1x ФСБ, 0,05% Tween 20). После промывки зерна повторно суспендировали в буфере для элюирования (1x ФСБ, 0,05% Tween 20, 0,5 мкМ небиотинилированного аффинного лиганда) и инкубировали встряхивая при комнатной температуре в течение 30 минут. Измеряли концентрацию киназ путем кПЦР (ФИГ. 6).
Исследования цитотоксичности
Сферы BTSC разрушали до отдельных клеток с использованием фермента Accumax (Innovative Technologies), высевали в количестве 1500 клеток/96-лунок и обрабатывали лекарственным средством или носителем (ДМСО) через день после внесения в планшет. Исследования цитотоксичности независимо повторяли в больнице Sickkids с использованием линий BTSC 25M, 67EF, 73EF, 84EF и 127EF. Сферы BTSC разрушали до отдельных клеток, как указано выше, и помещали в 96-луночные планшеты в трех повторностях в количестве 3000 клеток/96 лунок. В обеих сериях экспериментов использовали лекарственные средства, последовательно разбавленные в диапазоне от 5 мкМ до 100 нМ в случае первой серии, и от 25 мкМ до 10 нМ. Жизнеспособность клеток после обработки лекарственным средством определяли через три дня при помощи исследования alamarBlue™ (InvitRogen) согласно инструкциям производителя. Все эксперименты с культурами проводили в трех повторностях и для расчетов использовали минимальное значение, полученное для трех лунок. Ниже в таблице 4 проиллюстрированы результаты скрининга библиотеки в отношении различных BTSC в исследовании Alamar Blue™.
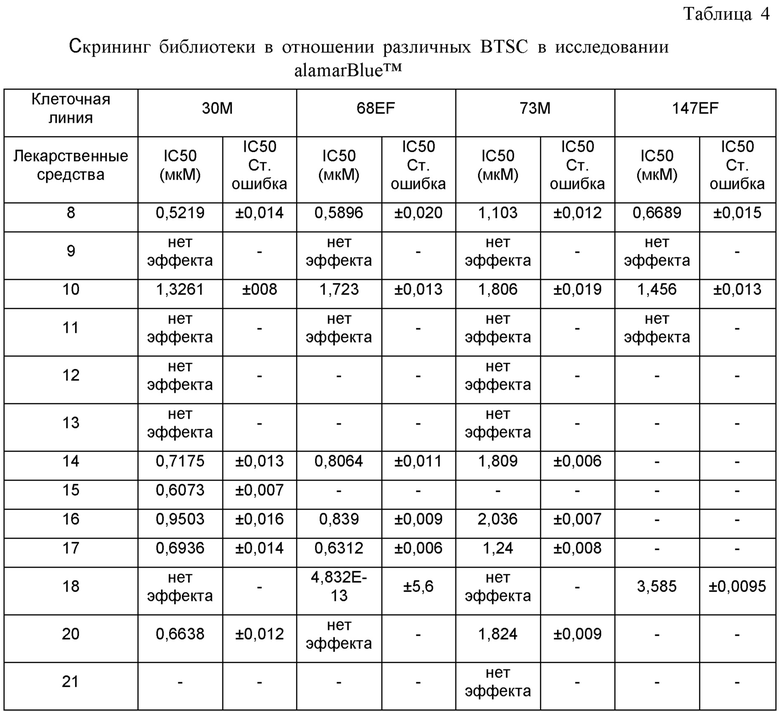
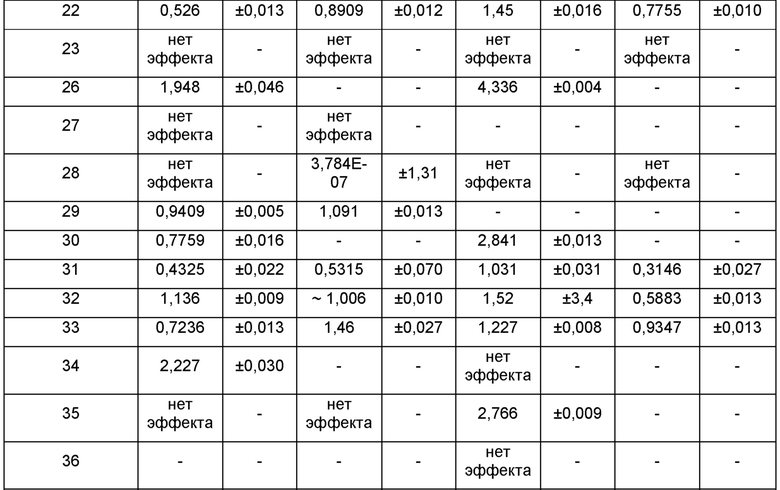
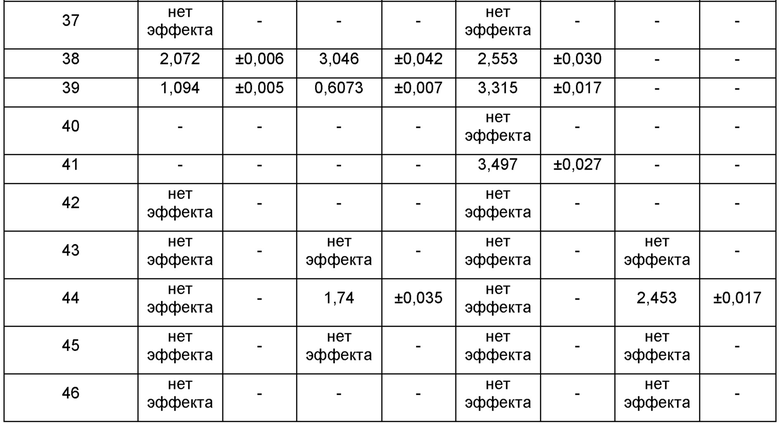
С учетом того, что оценку IC50 проводили в исследованиях с использованием одновременно соединения 1, известного из уровня техники, и соединений 22 и 31-33, результаты можно считать окончательными. Соединения согласно настоящему изобретению обладают улучшенными значениями IC50 по сравнению с соединением 1 (см. таблицу 5 ниже).
Вестерн-блот
Проводили лизис сфер BTSC в модифицированном буфере RIPA, дополненном коктейлем ингибиторов протеазы Complete Mini (Roche) и фосфатазы Halt (Thermo Scientific). Для анализа белков после обработки лекарственным средством сферы BTSC разрушали до отдельных клеток и 1×106 клеток обрабатывали лекарственным средством или носителем (ДМСО) в течение 2, 24 или 72 часов. 15 мкг белка помещали в 7,5% или 10% гели для ДСН-ПААГ и переносили в систему транс-блот на мембраны из нитроцеллюлозы. Блоты окрашивали следующими антителами: фосфо-STATS Y705 (1:1000, Cell Signalling Technology), фосфо-STATS S727 (1:1000, Cell Signalling Technology), STAT3 (1:1000, Santa Cruz Biotechnology), Bc1-xL (1:1000, Cell Signalling Technology), циклином D1 (1:1000, Cell Signalling Technology), PARP (1:1000, Cell Signalling Technology) и актином (1:2500, Santa Cruz Biotechnology). Вторичные козьи антикроличьи антитела, конъюгированные с HRP (Cell Signalling Technology), использовали в разбавлении 1:2000, а ослиные антимышиные, ослиные антикозьи и козьи антикроличьи (Calbiochem) использовали в разбавлении 1:6000. Полосы визуализировали с использованием системы детектирования ECL Plus Western Blotting Detection System и Hyperfilm (Amersham).
Сферическая культура опухоли головного мозга
GBM BTSC выращивали из группы образцов опухолей, полученных после получения информированного согласия у взрослых пациентов с GBM при помощи оперативного вмешательства согласно приведенному ранее описанию (Kelly et al, Stem Cells 2009), одобренных экспертным советом по этике университета Калгари. Вкратце, культуры BTSC начинали выращивать в бессывороточной определенной питательной среде (SFM) для образования в культуре неслипшихся сфер через 7-21 день. Первичные сферические опухоли выращивали для проведения нескольких пассажей, а затем хранили в замороженном виде в 10% ДМСО (Sigma Aldrich) в бессывороточной определенной среде перед использованием в экспериментах. Нейрональные стволовые клетки эмбрионов человека также выращивали согласно приведенному выше описанию, после чего инициировали их дифференцировку в астроциты путем добавления 10% эмбриональной бычьей сыворотки и удаления EGF, FGF-2 и гепарина сульфата.
Исследование флуоресцентной поляризации
STAT3, STAT5 и STAT1: Исследования флуоресцентной поляризации проводили на устройстве Infinite M1000 (Tecan, Crailsheim, Germany) с использованием черных 384-луночных круглодонных планшетов (Corning). Используемый буфер содержал 50 мМ NaCl, 10 мМ ГЭПЭС, pH 7,5, 1 мМ ЭДТА и 2 мМ дитиотреитола и ДМСО в конечной концентрации 5%.
Исследуемые соединения растворяли в ДМСО и разбавляли в среде для разбавления, состоящей из 50 мМ NaCl, 10 мМ ГЭПЭС, pH 7,5, 1 мМ ЭДТА и 2 мМ дитиотреитола. Пептид с флуоресцентной меткой pYLPQTV (FAM-pYLPQTV) выдерживали в конечной концентрации 10 нМ в буферном растворе. Немеченый пептид pYLPQTV растворяли в ДМСО и разбавляли в среде для разбавления для использования в качестве положительного контроля. Калибровочную кривую получали с использованием 10 нМ Fam-pYLPQTV и разбавленных белков STAT3 и STAT1 (от 5,0 мкл до 2,4 нМ) в конечной 10% концентрации в ДМСО (ФИГ. 7).
Среднюю точку кривой насыщения использовали для определения концентрации STAT3, требуемой для конкурентного исследования флуоресцентной поляризации. 7,5 мкл пептидов FAM-pYLPQTV добавляли 384-луночные планшеты с плоскими лунками, уже содержащие 15 мкл 750 нМ раствора белка STAT3. В планшет по отдельности добавляли 7,5 мкл раствора молекул ингибитора (и положительного контроля). Конечные концентрации ингибитора составляли 100 мкл, 50 мкл, 25 мкл, 12,5 мкл, 6,3 мкл или 3,1 мкл. 10% буферный раствор ДМСО инкубировали в течение 15-30 минут, после чего проводили измерение сигнала на Infinite M1000. Результаты, полученные для соединений 22, 31, 32 и 33, проиллюстрированы на ФИГ. 8.
Исследования плазмонного поверхностного резонанса (ППР)
Взаимодействие STAT3, меченного His, с небольшими молекулами исследовали с использованием ППР спектроскопии. Эксперименты по определению связывания проводили с использованием биосенсора ProteOn XPR36 (Bio-Rad) при 25°C и чувствительного датчика HTE (Bio-Rad, Ontario, Canada). В проточные ячейки чувствительного датчика помещали раствор никеля с расходом 30 мкл/мин в течение 120 секунд для насыщения поверхности tRis-NTA ионами Ni(II). Очищенные меченные His STAT3 и STAT5 (SignalChem, British Columbia, Canada) в буфере PBST (ФБС с 0,005% (об./об.) TweeN-20 и 0,001% ДМСО pH 7,4) впрыскивали в вертикальном направлении в первый и второй каналы датчика, соответственно, с расходом 25 мкг/мл в течение 300 секунд, что давало в среднем ~8000 резонансных единиц (RU). После промывки буфером PBST отслеживали связывание ингибиторов с иммобилизованными белками путем впрыскивания каждой из указанных небольших молекул в концентрации из некоторого диапазона, а также холостой пробы с расходом 100 мкл/мин в течение 200 секунд. После завершения впрыскивания ингибитора, состоящего из небольших молекул, подвижный буфер оставляли на 600 секунд для протекания через иммобилизованные субстраты для прохождения диссоциации неспецифически связанных ингибиторов. После диссоциации ингибиторов поверхность датчика регенерировали путем впрыскивания 1 M NaCl с расходом 100 мкл/мин в течение 18 секунд. Для поправок на неспецифическое связывание использовали промежуточный канал сравнения, а канал с холостой пробой, используемый при каждом впрыскивании анализируемого вещества, применяли в качестве второго контроля для поправки на возможный дрейф исходного уровня. Данные анализировали с использованием программного обеспечения ProteOn Manager Software версии 3.1. Для определения значений KD использовали модель связывания Langmuir 1:1.
Для валидации протокола проводили контрольные эксперименты.
Связывание последовательности пептида STAT5 со STAT5, меченным His, согласно протоколу, указанному выше:
KD(stat3)=262 14,9 мкМ;
KD(stat5)=262 нМ.
Связывание последовательности пептида STAT3 со STAT3, меченным His, согласно протоколу, указанному выше:
KD(stat3)=135 нМ;
KD(stat5)=Связывание не происходит.
Сравнительные данные WP1066 и кукурбитацина
Так как указанные ингибиторы разработаны для направленного действия на STAT3, они являются наиболее активными в отношении клеточных линий, которые в высокой степени зависят от белка STAT3. BTSC входят в число самых смертельных STAT3-зависимых раковых клеточных линий, выявленных в настоящее время, этим объясняется такая чувствительность указанных клеточных линий к предложенным ингибиторам STAT3. Тем не менее, в соответствии с ожиданиями указанные соединения также можно применять для лечения других раковых заболеваний. Это объясняется тем, что, так как соединения, описанные в настоящей заявке, могут эффективно уничтожать очень резистентные и крайне смертельные BTSC, которые практически нечувствительны к большинству химиотерапевтических агентов, указанные соединения также можно применять для лечения различных других раковых клеток.
Для оценки возможности применения соединений согласно настоящему изобретению для лечения других форм рака, отличных от рака головного мозга, определяли значения IC50 для соединений 22, 31, 32, 23 и 33 (также называемых в таблице SH-04-08, SH-04-54, SH-05-07, SH-05-19 и SH-05-23, соответственно) в отношении других STAT3-зависимых раковых клеток, таких как клетки рака молочной железы (MDA-MB- 468), простаты (PPC1 или DU145) и клетки лейкемии (ОМЛ-2), а также BTSC 30M. Результаты приведены ниже в таблице 6.
Рак поджелудочной железы
Клеточную линию рака поджелудочной железы (Panc10.05) с низким пассажем, полученную у пациентов, помещали в 96-луночные планшеты (3×103 на лунку) и оставляли для роста на ночь. Добавляли ингибиторы STAT3 31, 41, 42 и 38 в указанных концентрациях. Выживание клеток определяли через 72 часа после добавления лекарственного средства с использованием исследования MTS. Результаты приведены на ФИГ. 9.
На ФИГ. 9 проиллюстрировано высокоактивное биологическое действие исследуемых ингибиторов STAT3 в отношении клеточной линии рака поджелудочной железы, полученной у пациента. Значения ED50 (IC50), вычисленные для соединений 31, 41, 42 и 38 составляют 6,2, 16,4, 16,7 и 4,8 мкМ, соответственно.
Вестерн-блот анализ ингибирования pSTAT3
Клеточные линии рака поджелудочной железы человека (Ра03С и Panc10.05) с низким пассажем помещали в 6-луночные планшеты (2×105 и 8×104, соответственно) и оставляли для роста на ночь. Ингибиторы STAT3 добавляли за 1 час до стимуляции IL-6 (50 нг/мл, 15 мин). Ингибиторы STAT3 присутствовали в смеси во время стимуляции IL-6. Собирали клетки и проводили лизис для вестерн-блот анализа. Для визуализации фосфорилирования STAT3 использовали антитело, фосфо-специфическое к STAT3 (Y705), а полное антитело к STAT3 использовали для нормирования активации STAT3. Антитела приобретали в Cell Signaling и использовали в разбавлении 1:1000.
Как можно увидеть на фигуре 10, соединение 31 с высокой активностью ингибирует фосфорилирование белка STAT3 в клетках рака поджелудочной железы de novo.
Как можно увидеть на ФИГ. 11, соединение 31 эффективно уничтожает опухолевые клетки, выращенные в 3D культурах в присутствии ассоциированных с раком фибробластов (CAF) или без них. На ФИГ. 11 проиллюстрировано действие ингибитора STAT3 31 в отношении клеточной линии рака поджелудочной железы (Ра03С) с низким пассажем, полученной у пациента, помещенной в 96-луночный планшет с покрытием 1% очищенного агара в среду, содержащую 3% матригель, с использованием ассоциированных с раком фибробластов или без них. Отношение опухоли к CAF составляло 1:4. Сферические опухоли начинали образовываться примерно на 3 день, а ингибитор STAT3 31 добавляли на 4 и 8 день. Цитотоксичность определяли путем флуоресценции в исследовании Alamar Blue на 11 день.
Множественная миелома
Цитотоксичность MTT
Для определения жизнеспособности клеток MM клетки HMCL высевали в 96- луночные планшеты в трех повторностях с плотностью 20000 клеток/лунка и инкубировали с соединением 16i и 21h с увеличивающимися концентрациями или с ДМСО, используемым в качестве контроля, жизнеспособность клеток определяли при помощи колориметрического анализа с использованием MTT (3-(4,5-диметилтиазол)-2,5- дифенилтетразолия). Результаты приведены на ФИГ. 12.
На ФИГ. 12 проиллюстрировано, что соединение 31 с высокой активностью уменьшает жизнеспособность клеток в 12 из 15 различных опухолевых клеточных линий множественной миеломы, что определено в исследовании MTT, где рассчитанные значения ED50 находились в диапазоне 2-6 мкМ.
Рак головного мозга
Для вестерн-блота сферы BTSC разрушали с использованием Accumax (eBioscience) и помещали в планшеты в количестве 106 клеток/1,5 мл среды. Клетки обрабатывали носителем (ДМСО) или лекарственным средством и собирали сгустки клеток в выбранные моменты времени. Для экстракции белка проводили лизис BTIC в модифицированном буфере RIPA (50 мМ tRis, 150 мМ NaCl, 0,1% SDS, 0,5% Na деоксихолат, 1% NP-40), дополненном коктейлями ингибиторов протеазы Complete Mini (Roche) и фосфатазы Halt (Thermo Scientific). Количественную оценку концентраций белков проводили в исследовании белков BioRad; 11-15 мкг белка помещали в 7,5% или 12% полиакриламидный гель с додецилсульфатом натрия для электрофореза (ДСН- ПААГ) и переносили в систему транс-блот на мембраны из нитроцеллюлозы. Блоты окрашивали первичными антителами, а затем вторичными антителами, конъюгированными с пероксидазой хрена (HRP). Первичные антитела включали JAK2, p-JAK2, EGFR, pEGFR (Y1068), p-STAT3 Y705, p-STAT3 S727, циклин D1, p-Akt S473, Akt, p-Erk1/2 T202/Y204, p-S6 S235/236, PARP, β-тубулин, PDGRβ, pPDGFRβ Y1009 (Cell Signaling Technology), Erk1/2 (Millipore), STAT3 и актин (Santa Cruz Biotechnology). Вторичные антитела включали ослиное антимышиное, ослиное антикозье и козье антикроличье (Calbiochem). Полосы визуализировали с использованием хемилюминесцентного субстрата SuperSignal West Pico (Thermo Scientific) и Hyperfilm (Amersham).
Для определения целевого действия in vivo сферы BTIC клеток BT73 разрушали под действием фермента (Accumax, eBioscience) до суспензий отдельных клеток. Клетки промывали ФСБ и повторно суспендировали в количестве 105 клеток на 3 мкл среды для получения ортотопических ксенотрансплантатов. Каждой из шести мышей с диабетом без ожирения и с тяжелым комбинированным иммунодефицитом (NOD SCID) вводили ксенотрансплантат 105 клеток BT73, который стереотактически имплантировали в правый стриатум. Через семь дней после имплантации мышей случайным образом распределяли на когорты, которым вводили носитель или лекарственное средство, и суммарно 10 доз вводили в виде и.п. инъекций по схеме 4 дня инъекций, 3 дня отдыха. Мышам, которых лечили с использованием лекарственного средства, вводили 10 мг/кг дозу соединения 31, повторно суспендированного в 100 мкл 50% полиэтиленгликоля 300 (ПЭГ 300, Sigma-Aldrich) в воде. Мышам, которым вводили носитель, вводили такой же объем 50% ПЭГ 300 в воде. Мышей умерщвляли через два часа после введения инъекции с последней дозой лекарственного средства с использованием смертельной дозы пентобарбитала натрия, после чего проводили перфузию 4% параформальдегида (ПФА) через сердце.
Удаляли головной мозг, фиксировали в 4% ПФА и изготавливали 12 мкм срезы из замороженного материала для гистологических и иммуногистохимических исследований. Согласно стандартным протоколам проводили окрашивание гематоксилином и эозином (H&E). Иммуногистохимический анализ проводили путем инкубации с первичными антителами в течение ночи при 4°C, а затем с наборами мышиного IgG или кроличьего IgG Vectastain Elite (Vector Laboratories), детектирование осуществляли с использованием субстрата DAB и контрастного окрашивания гематоксилином (Sigma-Aldrich) согласно инструкциям производителя. Первичные антитела включали - STAT3 S727 (Cell Signaling Technology) и Ki67 (NovocastRa). Вторичные антитела включали козье антикроличье антитело, конъюгированное с биотином (Jackson Immunoresearch). Ксенотрансплантированные опухолевые клетки, в которых прошел апоптоз, также детектировали с использованием набора ApopTag Plus In Situ Peroxidase Apoptosis Detection Kit (Chemicon International, Inc., Temecula, CA) согласно инструкциям производителя (исследование TUNEL). Графические изображения результатов гистологических и иммуногистохимических исследований и исследования TUNEL получали на сканнере Olympus Slide Scanner с использованием программного обеспечения OlyVia в блоке регенерации на установке для микроскопических нейробиологических исследований в университете Калгари.
Результаты окрашивания гематоксилином/эозином приведены на ФИГ. 13, на которой проиллюстрированы среды мозга мышей NOD-SCID, содержащие опухоли из клеток BT73 у контрольных мышей и мышей, которым вводили ингибитор 31. Лечение с использованием соединения 31 приводило к значительному уменьшению числа опухолевых клеток.
На ФИГ. 14 проиллюстрировано действие соединения 31, выражающееся в уменьшении экспрессии pSTAT у мышей, которым ортотопически вводили ксенотрансплантаты клеток рака головного мозга BT73. Как можно увидеть на ФИГ. 14, соединение 31 обладало эффективностью целевого воздействия, выраженного в уменьшении уровня активированного фосфо-STAT, что продемонстрировано пониженным окрашиванием обработанных опухолей в иммуногистохимическом исследовании. Срезы мозга (A) после введения носителя и (B) ингибитора 31. Нижние фотографии представляют собой сильно увеличенные изображения опухолей, приведенных на верхних фотографиях.
На ФИГ. 15 проиллюстрировано действие соединения 31 в отношении уменьшения пролиферации опухолевых клеток мозга BT73. У мышей, которым вводили ингибитор 31, наблюдали пониженную экспрессию маркера пролиферации Ki67. Срезы мозга (A) после введения носителя и (B) ингибитора 31. Нижние фотографии представляют собой сильно увеличенные изображения опухолей, приведенных на верхних фотографиях.
На ФИГ. 16 проиллюстрирован повышенный апоптоз (окрашивание TUNEL) у мышей, которым вводили соединение 31. В опухолях мышей, которым вводили соединение 31, наблюдали более интенсивное окрашивание TUNEL, которое указывает на апоптотическую гибель клеток. Фотография (A) соответствует срезу мозга после введения носителя, а фотография (B) соответствует срезу после введения соединения 31. Нижние фотографии представляют собой сильно увеличенные изображения опухолей, приведенных на верхних фотографиях.
В настоящем описании было показано, что соединение 31 является эффективным в отношении уменьшения уровня активированного фосфо-БТАТ3 в опухолях, полученных путем ортотопической ксенотрансплантации стволовых клеток опухолей мозга человека в мозг мышей NOD-SCID, а также уменьшает пролиферацию и увеличивает смертность опухолевых клеток. Предполагается, что другие соединения согласно настоящему изобретению имеют такие же свойства. Действительно, в других исследованиях, таких как отмечено выше в настоящем описании, показано, что соединение 31 имеет свойства, схожие с другими исследуемыми соединениями. В указанном эксперименте по исследованию рака головного мозга соединение 31 использовали для демонстрации общих характеристик соединений согласно настоящему изобретению.
Проницаемость гематоэнцефалического барьера
10 мг/кг соединений 31 и 32 вводили трем мышам BID и.п. в течение пяти дней, у всех мышей образцы крови собирали два раза (30 мин и 300 мин). Плазму выделяли из крови путем центрифугирования и хранили при -20°C до проведения анализа. Также для каждой дозировки собирали образцы мозга у одной мыши. Концентрации соединений определяли путем ЖХ-МС.
Как можно увидеть на ФИГ. 17, было обнаружено, что соединение 31 содержится в мозге в различных дозировках (10 мг/кг и 25 мг/кг), что определено путем ЖХМС.
Соединение 31 накапливается в головном мозге в концентрации до 0,7 мкМ в модельных исследованиях мышей.
Как можно увидеть на ФИГ. 18, соединение 31 накапливается в головном мозге мышей в концентрации до 300 нМ в модельных исследованиях мышей после введения 10 мг/кг дозы.
Как можно увидеть на ФИГ. 19, соединение 32 накапливается в головном мозге мышей в концентрации ~1,2 мкМ в модельных исследованиях мышей после введения 10 мг/кг дозы.
Концентрация соединения 31 в плазме увеличивалась зависящим от дозы образом от 0,24 мкМ до 0,58 мкМ для 10 и 25 мг/кг, соответственно. Тем не менее, через 5 часов после введения обеих доз соединение уже не обнаруживали, что указывает на быстрый клиренс. Концентрация соединений 31 и 32 в плазме значительно не изменялась в интервале от 30 мин до 300 мин. В случае соединения 31, в головном мозге мышей после введения 10 мг/кг дозы содержалось примерно 0,3 мкМ соединения. Концентрация соединения 32 в головном мозге мышей после введения 10 мг/кг дозы составляла ~1,2 мкМ. Приведенные выше данные явным образом указывают на то, что соединения согласно настоящему изобретению могут преодолевать гематоэнцефалический барьер.
Рак молочной железы
Ингибирование пролиферации клеточных линий опухоли молочной железы ErbB2 (NIC)
Проводили оценку ингибирования соединениями пролиферации клеточных линий опухоли молочной железы ErbB2 (NIC), содержащих активированную форму ErbB2, при помощи исследования CyQuant. Проводили непосредственное сравнение соединения 31 и BP-1-102 в диапазоне концентраций.
Протокол исследования пролиферации CyQuant
Три отдельные клеточные линии вируса опухоли молочной железы мышей ErbB2 (NIC) повторно суспендировали в 10% ФСБ и среде SingleQuots DMEM до достижения конечной концентрации 40000 клеток на 1 мл. Клетки помещали в концентрации 4000 клеток в 100 мкл среды на лунку в 96-луночные планшеты NUNC и инкубировали в течение 24 часов при 37°C и 5% CO2. Через 24 часа откачивали среду и заменяли ее на обычную среду, среду + ДМСО (1:1000) или среду, содержащую лекарственное средство в соответствующей концентрации (BP 1-102 5 мкМ, 10 мкМ или 20 мкМ или соединение 31, также называемое в настоящем описании SH-04-54, в концентрации 5 мкМ, 10 мкМ или 20 мкМ). Каждое испытание проводили в четырех повторностях. В предварительно определенные моменты времени: сразу после, через 24 часа, через 48 часов и через 72 часа после введения, из клеток удаляли среду и планшеты хранили при -80°C, закрыв оловянной фольгой. При необходимости все планшеты размораживали и грели до комнатной температуры.
Набор для исследования пролиферации CyQuant Cell Proliferation Assay производства InvitRogen использовали для измерения содержания ДНК. Согласно инструкции буфер для лизиса клеток разбавляли 1:20 водой, а затем раствор CyQuant GR разбавляли 1:400 в лизисном буфере. В каждую лунку добавляли по 200 мкл раствора Cyquant и планшеты хранили в защищенном от света месте. Затем планшеты инкубировали в течение 2-5 минут без доступа света, после чего исследовали на флуоресцентном анализаторе микропланшетов с использованием фильтров с максимумами длин волн возбуждения 480 нм и испускания 520 нм. Вычисляли средние значения по четырем повторностям и SEM выражали в виде «усов». В некоторых случаях поглощение нормировали по ДМСО, используемому в качестве контроля.
На ФИГ. 20 клетки помещали в количестве 4000 клеток на лунку в 96-луночный планшет, инкубировали в течение 24 часов, затем обрабатывали соединением 31 в концентрации 5 мкМ, 10 мкМ и 20 мкМ в течение 24, 48 и 72 часов. Планшеты хранили при -80°C. Планшеты размораживали и обрабатывали с использованием набора для исследования пролиферации Cyquant Cell Proliferation Assay производства InvitRogen, при помощи которого измеряли содержание ДНК. Флуоресценцию измеряли на флуоресцентном анализаторе микропланшетов с фильтрами 480 нм и 520 нм. Каждую точку определяли по четырем повторностям, SEM выражали в виде «усов».
На ФИГ. 21 клетки помещали в количестве 4000 клеток на лунку в 96-луночный планшет, инкубировали в течение 24 часов, затем обрабатывали ВР1-102 или соединением 31 в концентрации 5 мкМ в течение 24, 48 и 72 часов. Планшеты хранили при -80°C. Планшеты размораживали и обрабатывали с использованием набора для исследования пролиферации Cyquant Cell Proliferation Assay производства InvitRogen, при помощи которого измеряли содержание ДНК. Флуоресценцию измеряли на флуоресцентном анализаторе микропланшетов с фильтрами 480 нм и 520 нм. Каждую точку определяли по четырем повторностям, SEM выражали в виде «усов».
Должно быть понятно, что соединение 31 обладает высокой активностью в концентрации 5 мкМ в отношении клеточных линий опухоли молочной железы MMTV ErbB2 (NIC) и полностью ингибирует пролиферацию клеток 2071 NIC. Было показано, что соединение 31 обладает более высокой активностью в отношении трех различных клеточных линий NIC 2071, 8518 и 9822 по сравнению с BP1-102.
Несмотря на то, что изобретение было описано при помощи конкретных вариантов реализации, следует понимать, что его можно дополнительно модифицировать, и предполагается, что настоящая заявка в целом охватывает любые изменения, применения или модификации изобретения в соответствии с принципами изобретения и включает указанные отклонения от предложенного изобретения, которые являются известными или традиционными для области техники, к которой относится изобретение, это может относиться к отличительным признакам, приведенным выше в настоящем описании, а также к объему последующей прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОЛОГИЧЕСКИ ДОСТУПНАЯ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ КОФЕЙНАЯ КИСЛОТА, ОТНОСЯЩАЯСЯ К ПРОТИВООПУХОЛЕВЫМ ЛЕКАРСТВЕННЫМ СРЕДСТВАМ | 2007 |
|
RU2456265C2 |
| ЛЕЧЕНИЕ ИЛИ ПРОФИЛАКТИКА ПРОЛИФЕРАТИВНЫХ СОСТОЯНИЙ | 2010 |
|
RU2705548C2 |
| СОЕДИНЕНИЯ СУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ STAT5 | 2015 |
|
RU2707094C2 |
| ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА, НАЦЕЛЕННЫЕ НА УКОРОЧЕННЫЕ БЕЛКИ АДЕНОМАТОЗНОГО ПОЛИПОЗА ТОЛСТОГО КИШЕЧНИКА (АРС) | 2014 |
|
RU2727516C2 |
| АГЕНТЫ, СВЯЗЫВАЮЩИЕСЯ С АМИЛОИДАМИ | 2010 |
|
RU2517174C2 |
| ПРОИЗВОДНЫЕ ТАКСАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2137764C1 |
| ФЕНИЛКАРБАМАТЫ И ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА ГИДРОЛАЗЫ АМИДОВ ЖИРНЫХ КИСЛОТ (FAAH) И МОДУЛЯТОРОВ D3 ДОПАМИНОВОГО РЕЦЕПТОРА (D3DR) | 2014 |
|
RU2693457C2 |
| СПИРООКСИНДОЛЬНЫЕ АНТАГОНИСТЫ MDM2 | 2010 |
|
RU2553269C2 |
| АНАЛОГИ ТАМАНДАРИНА И ДИДЕМНИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2001 |
|
RU2323000C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ, АКТИВИРУЮЩИЕ ФЕРМЕНТЫ | 2013 |
|
RU2652989C2 |
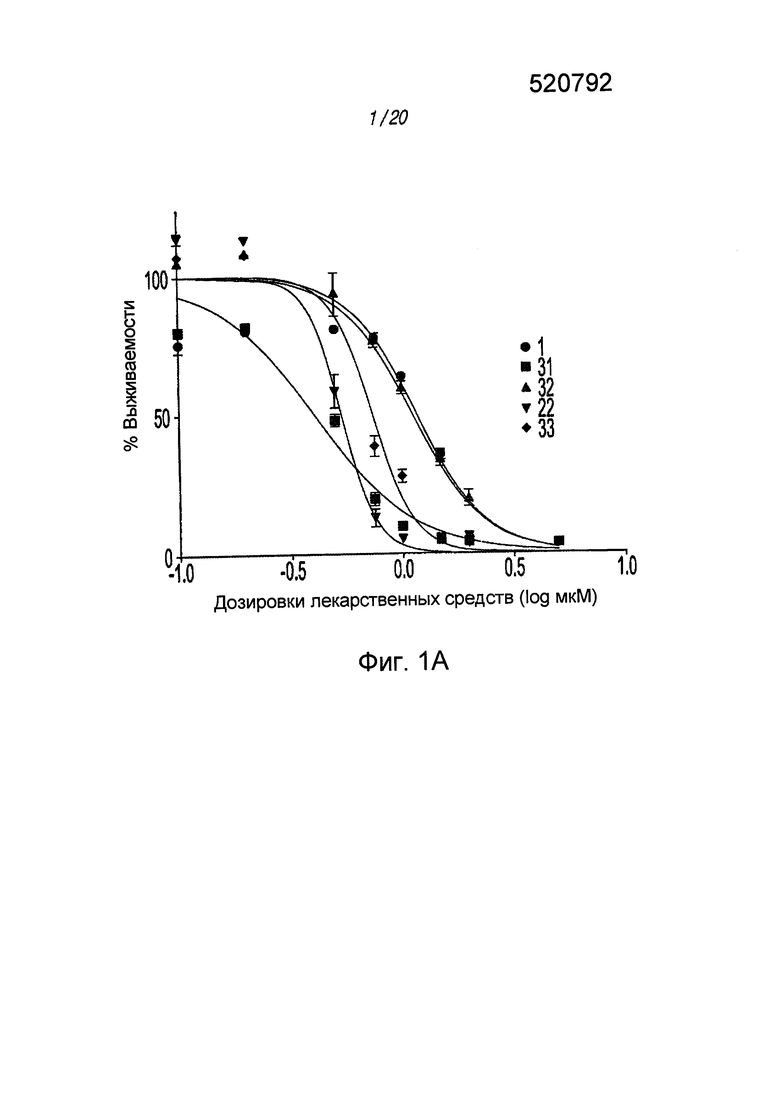
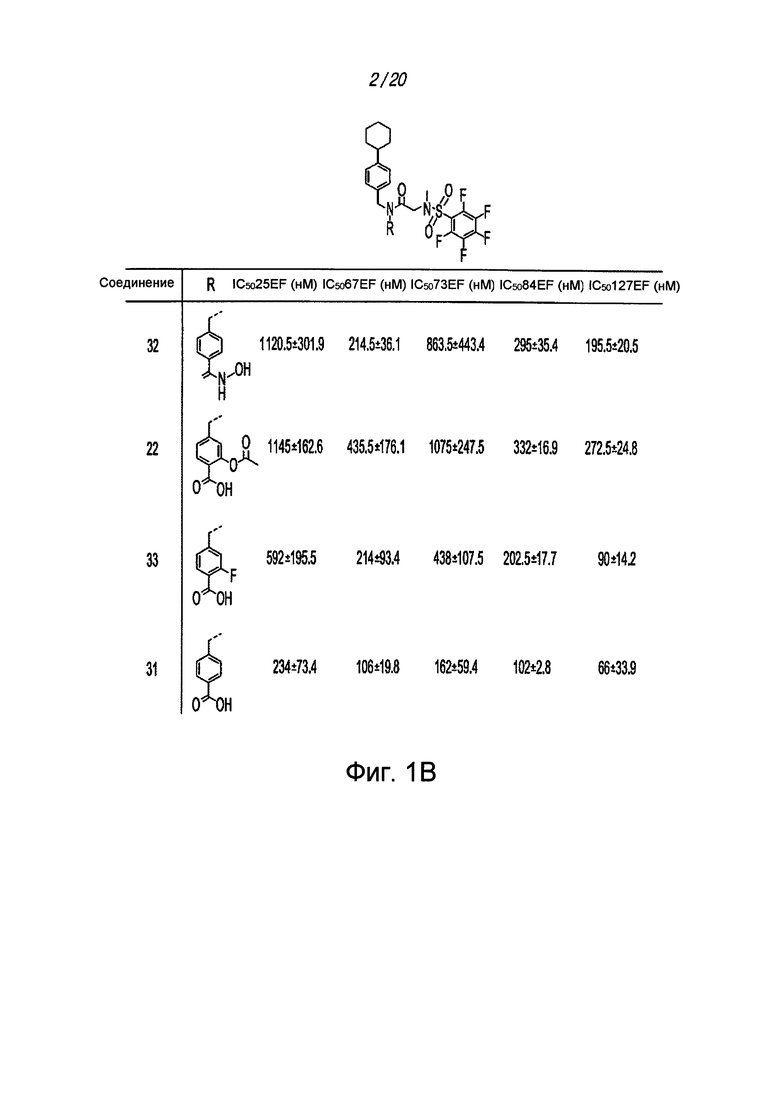
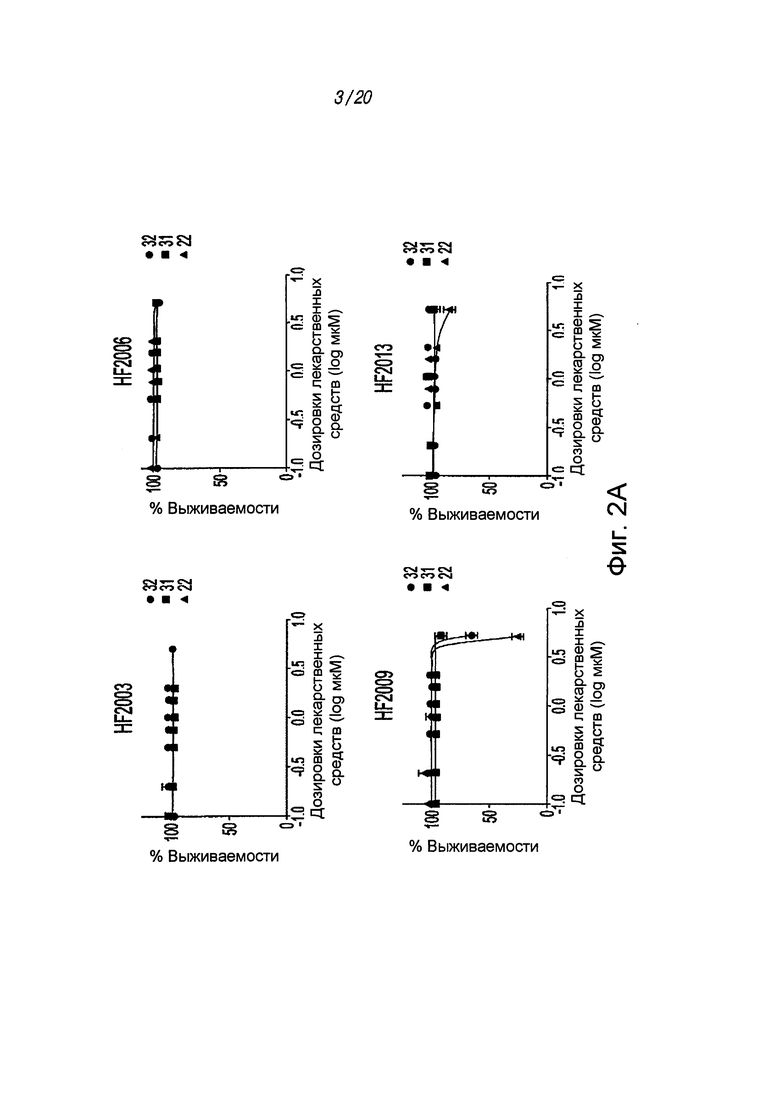
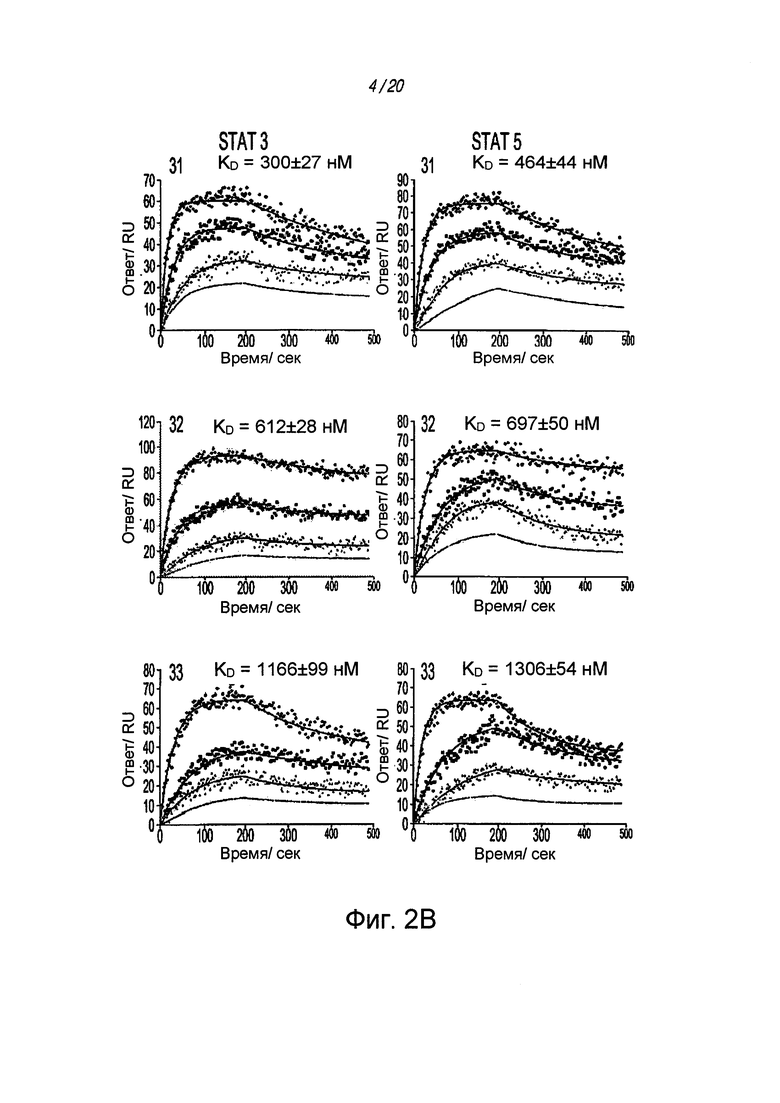
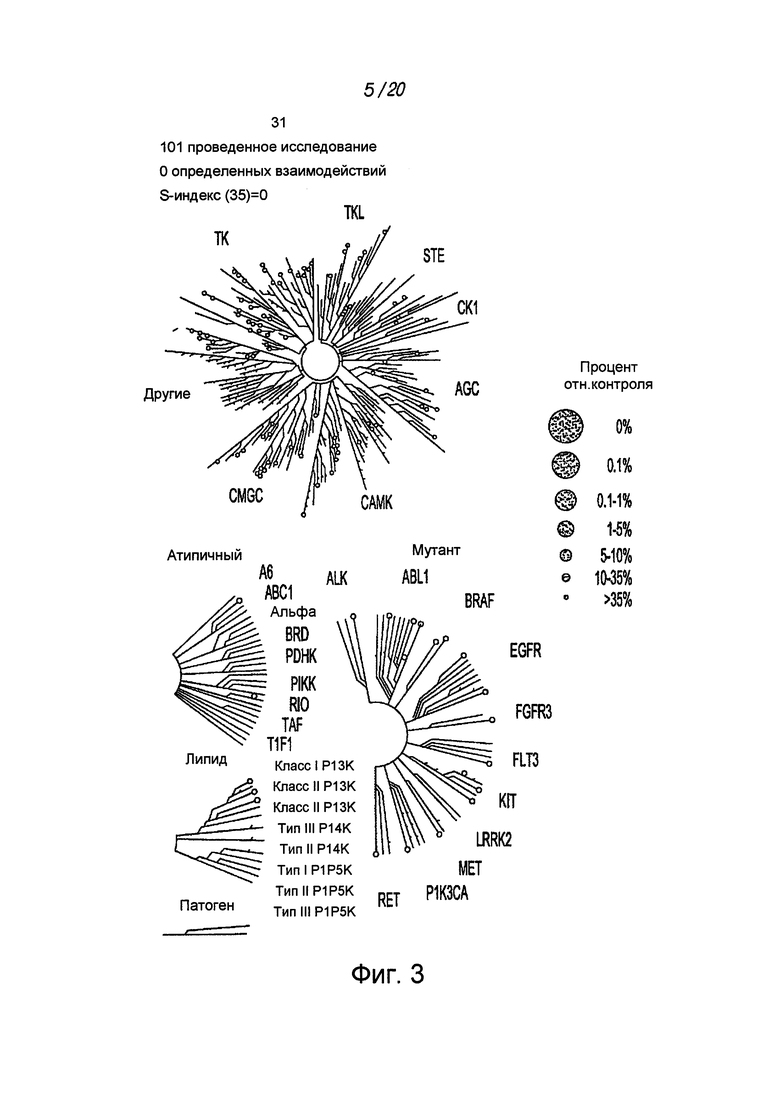
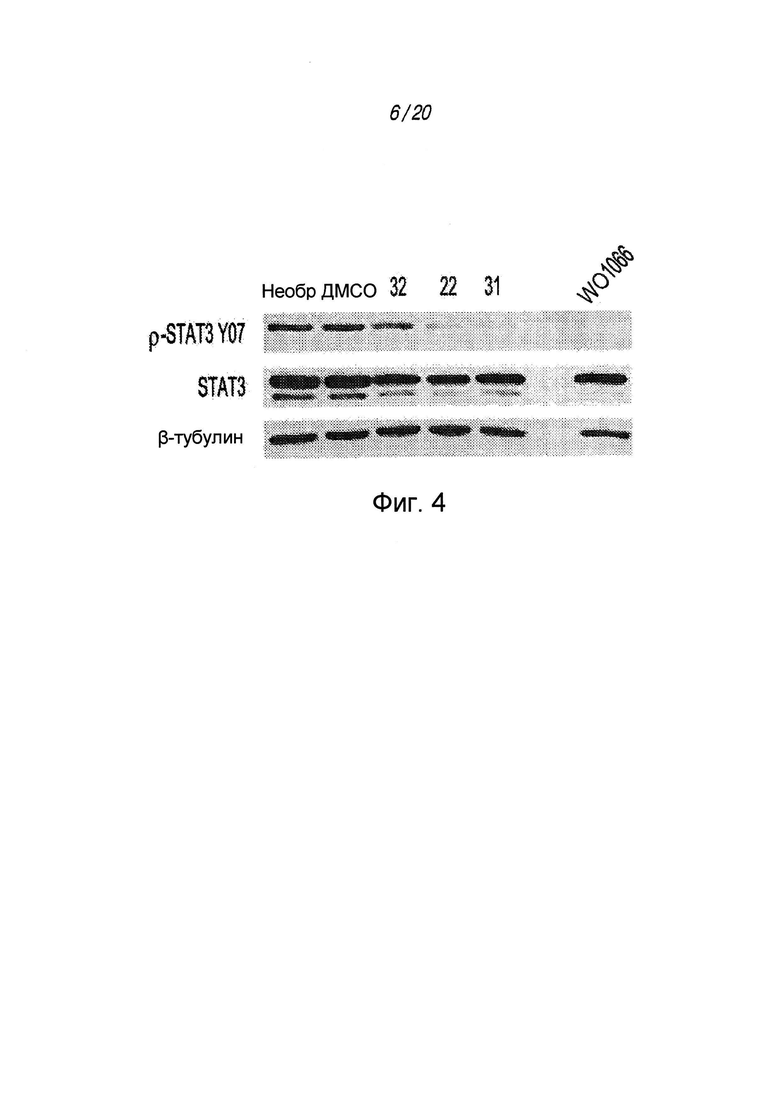
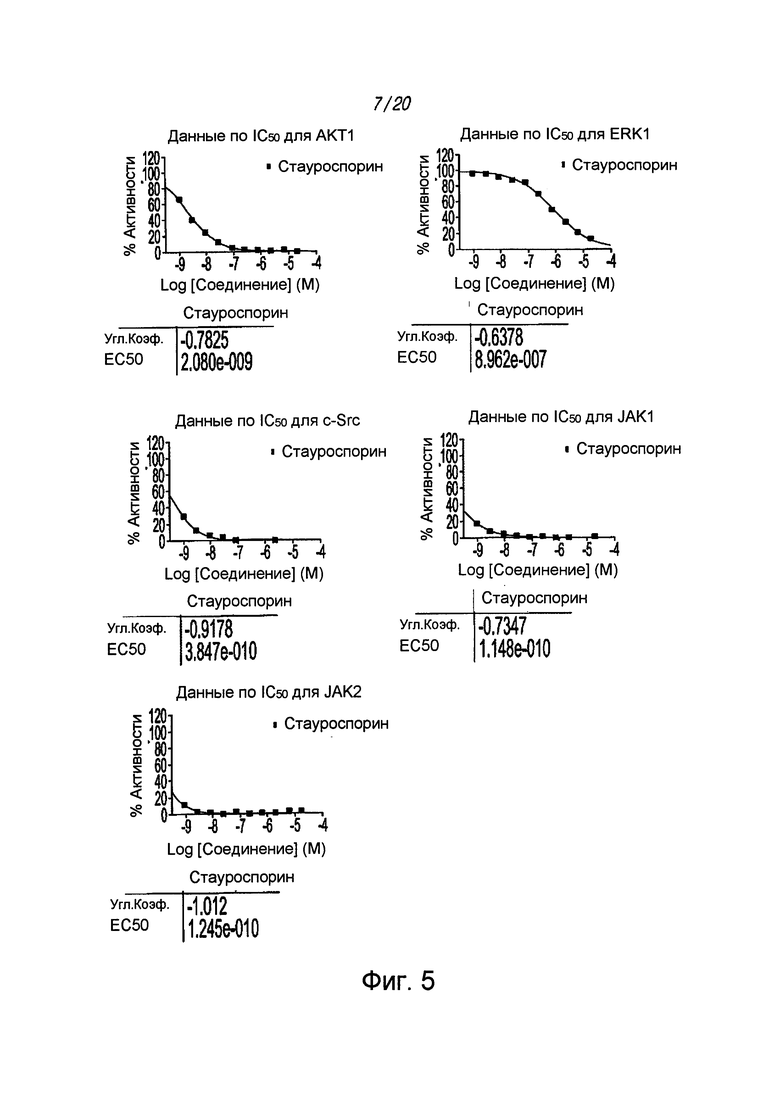
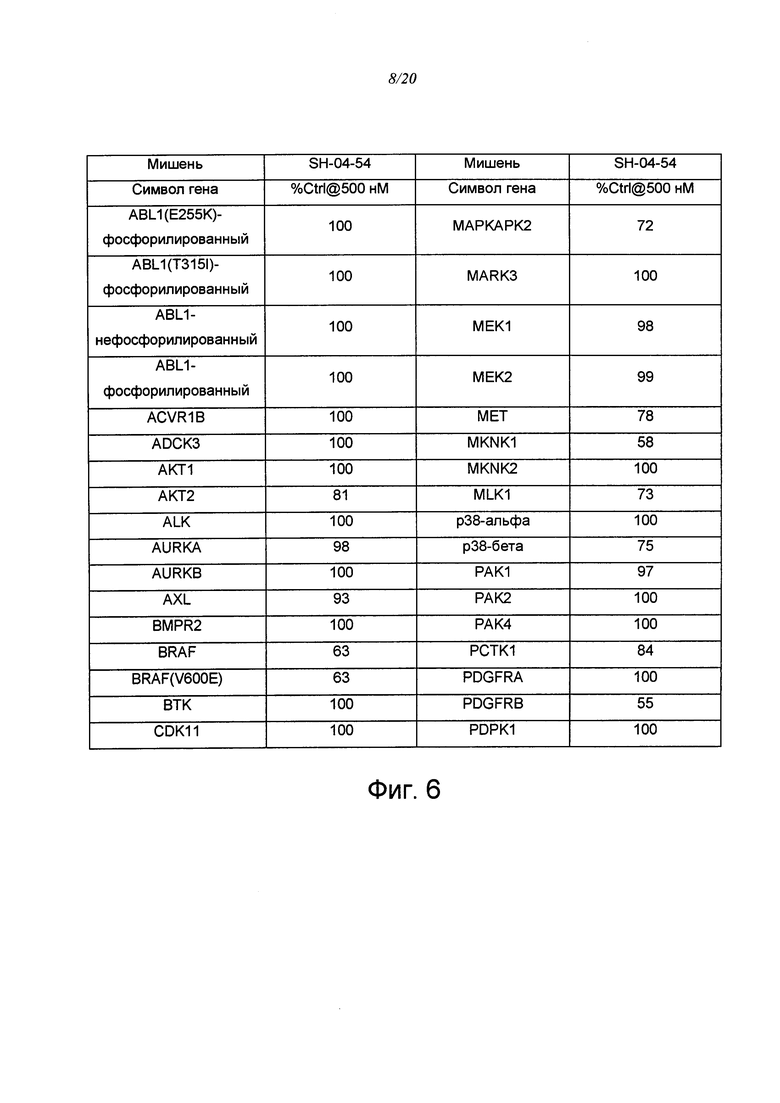
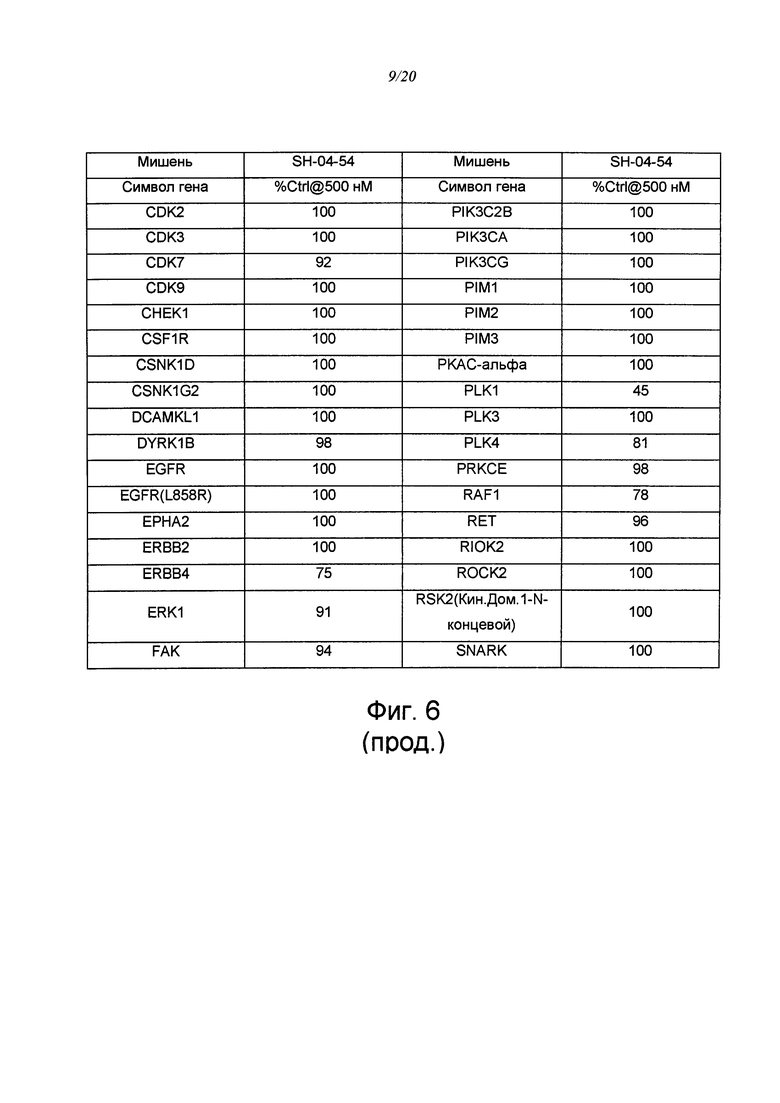
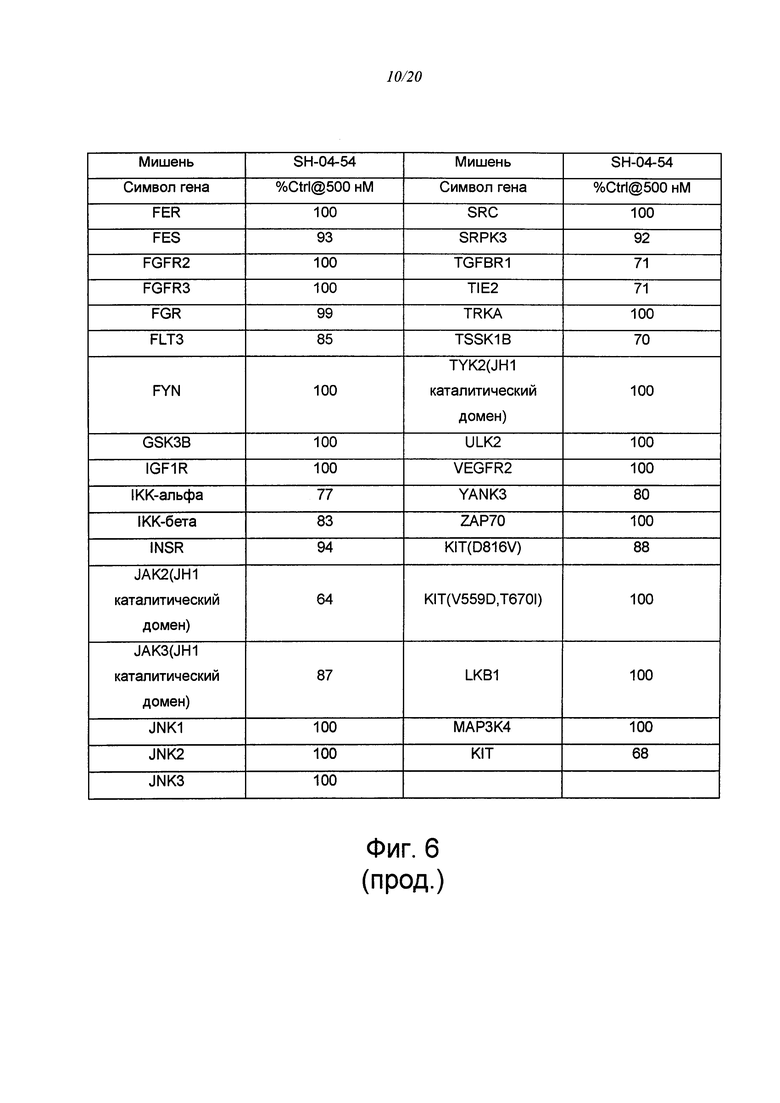
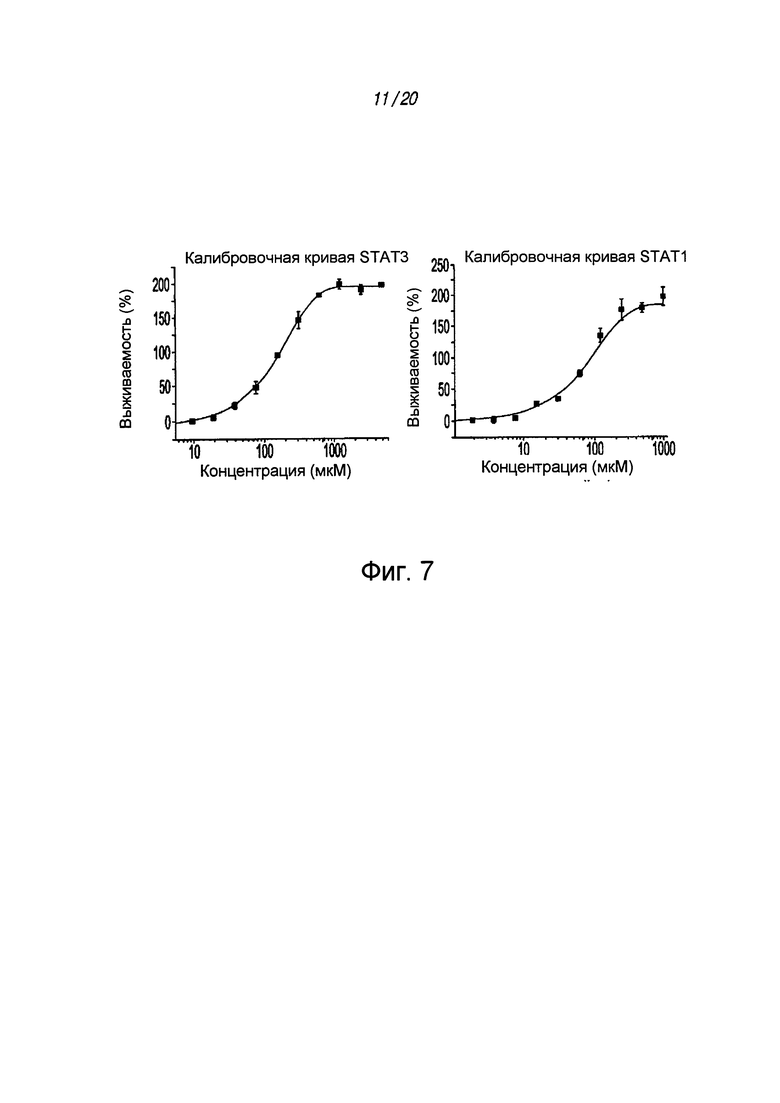

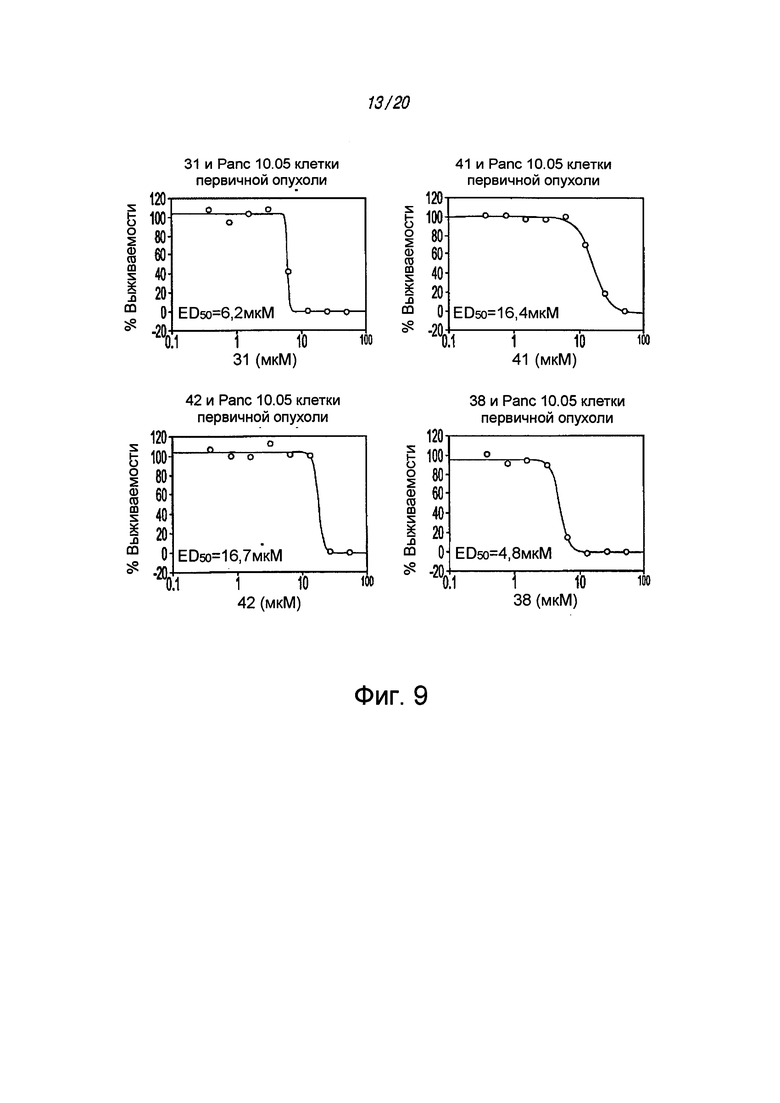
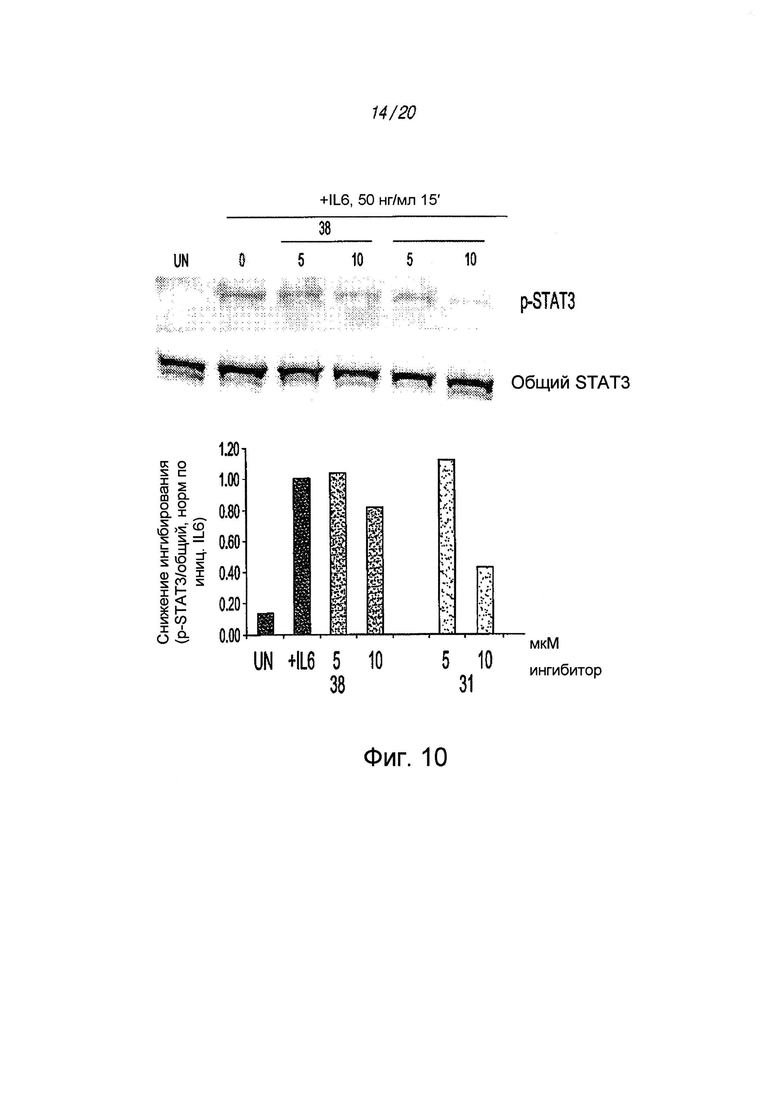
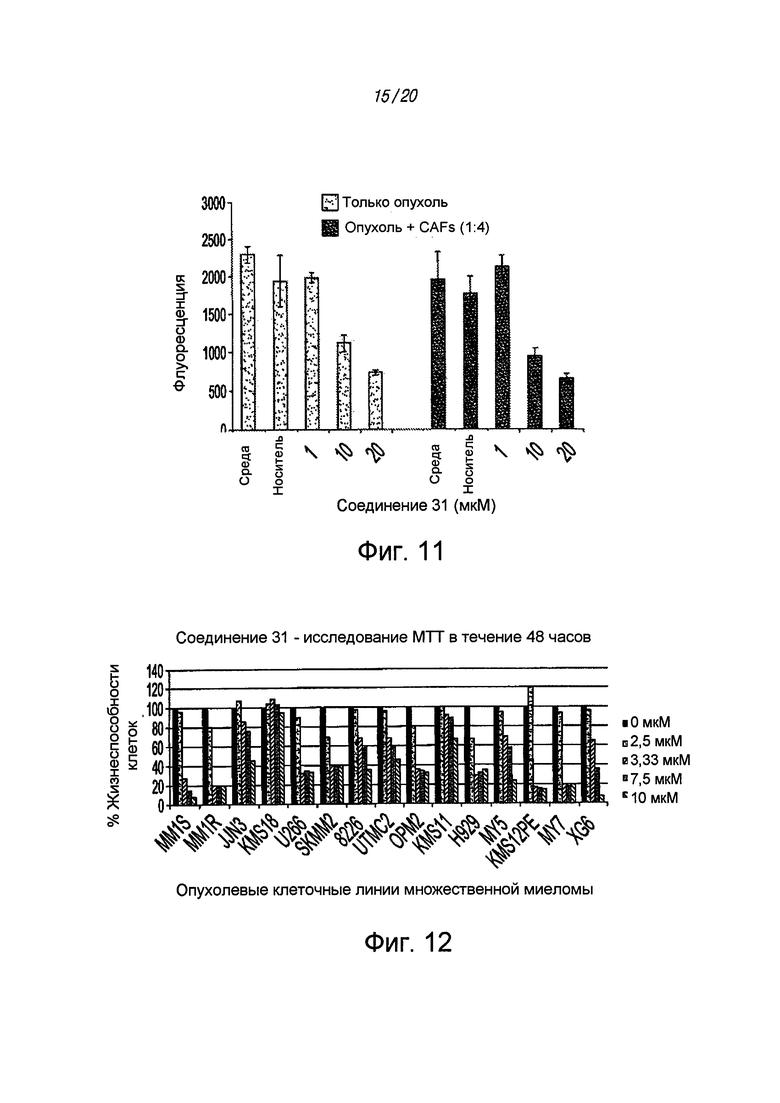
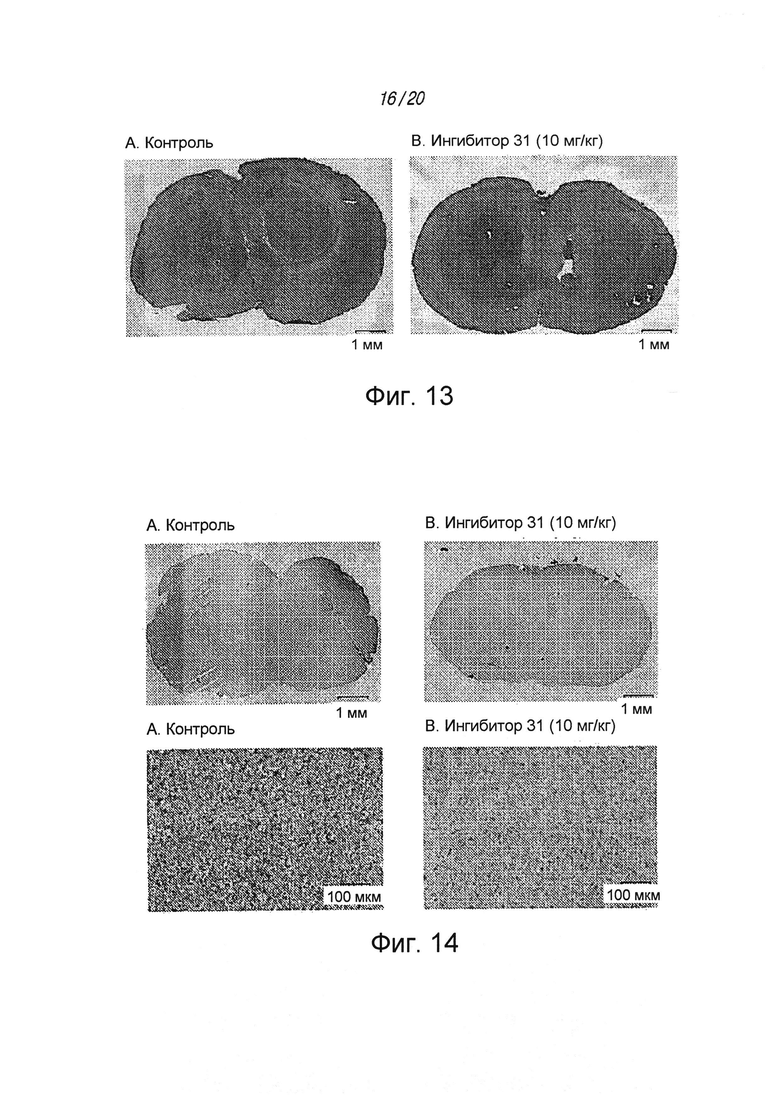
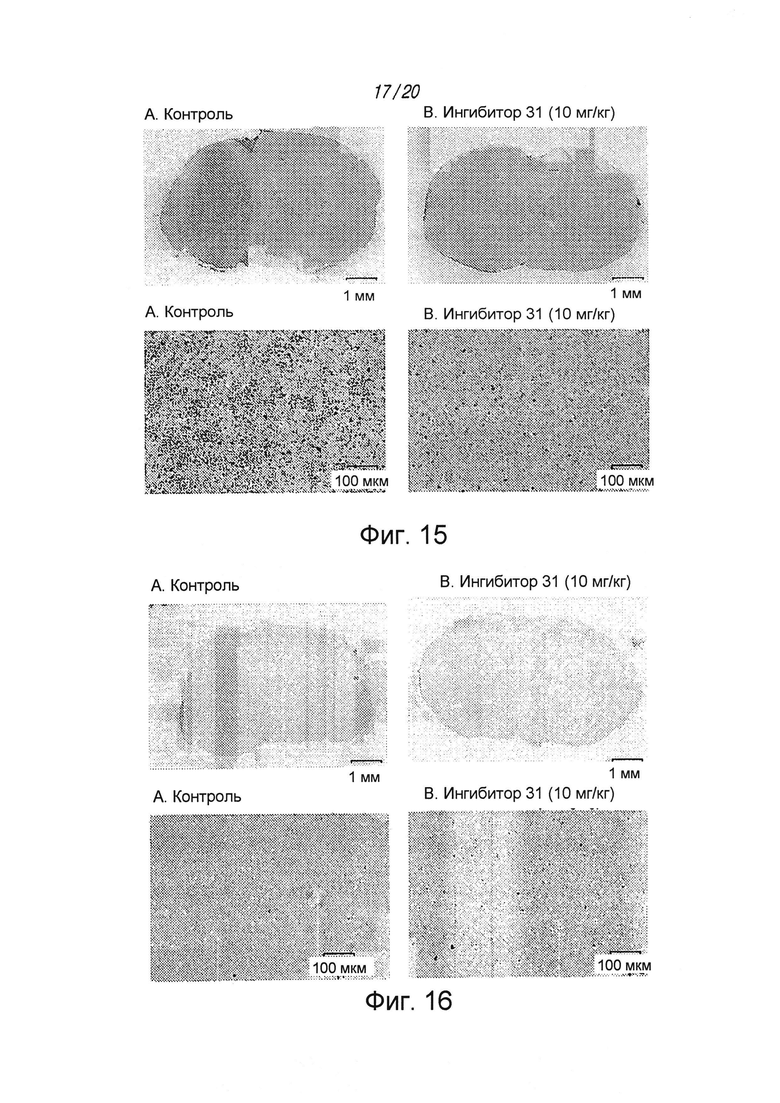
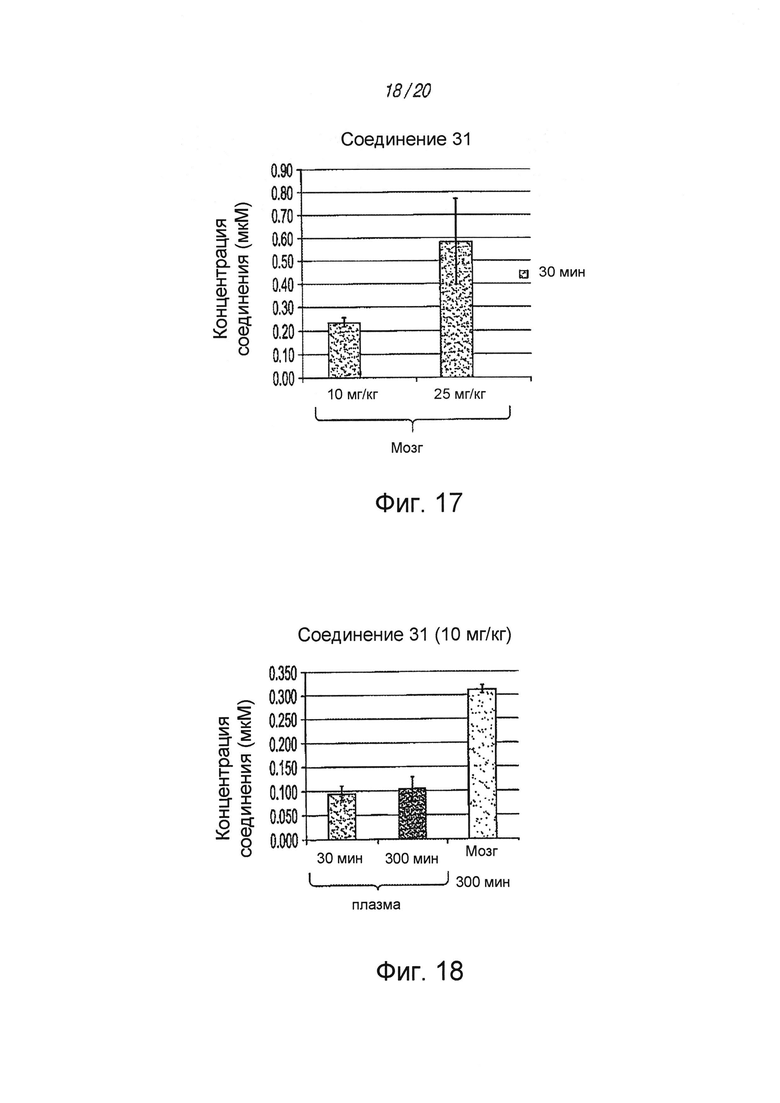
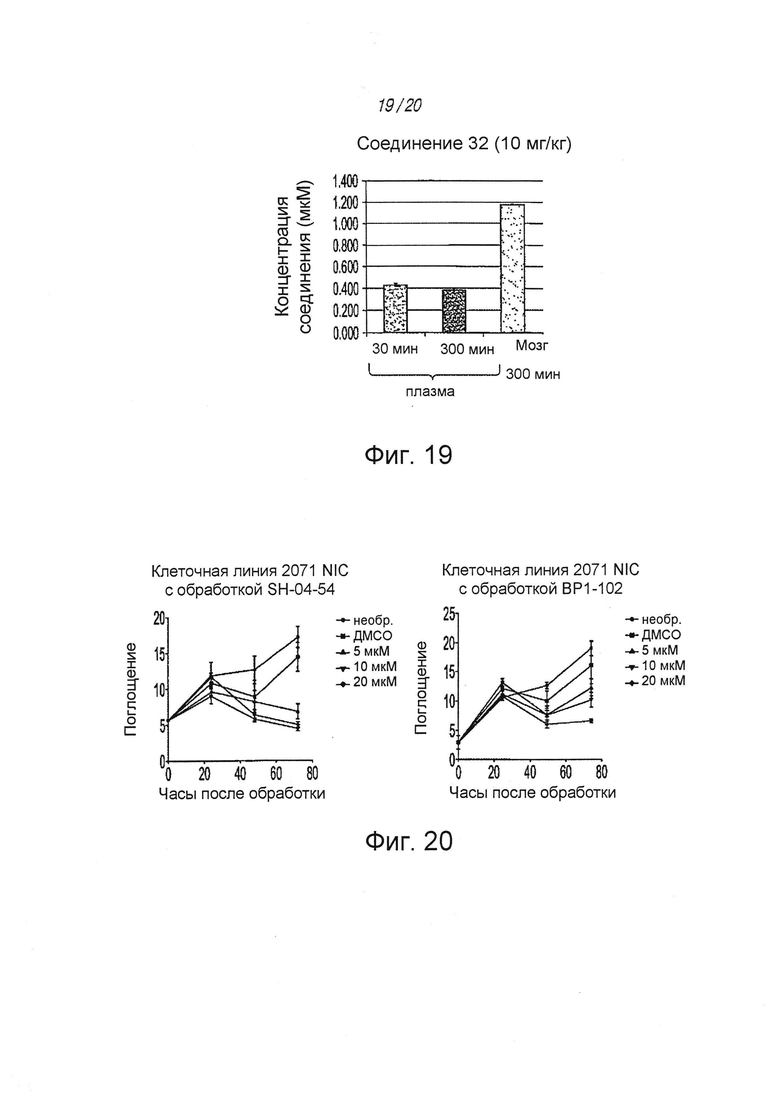
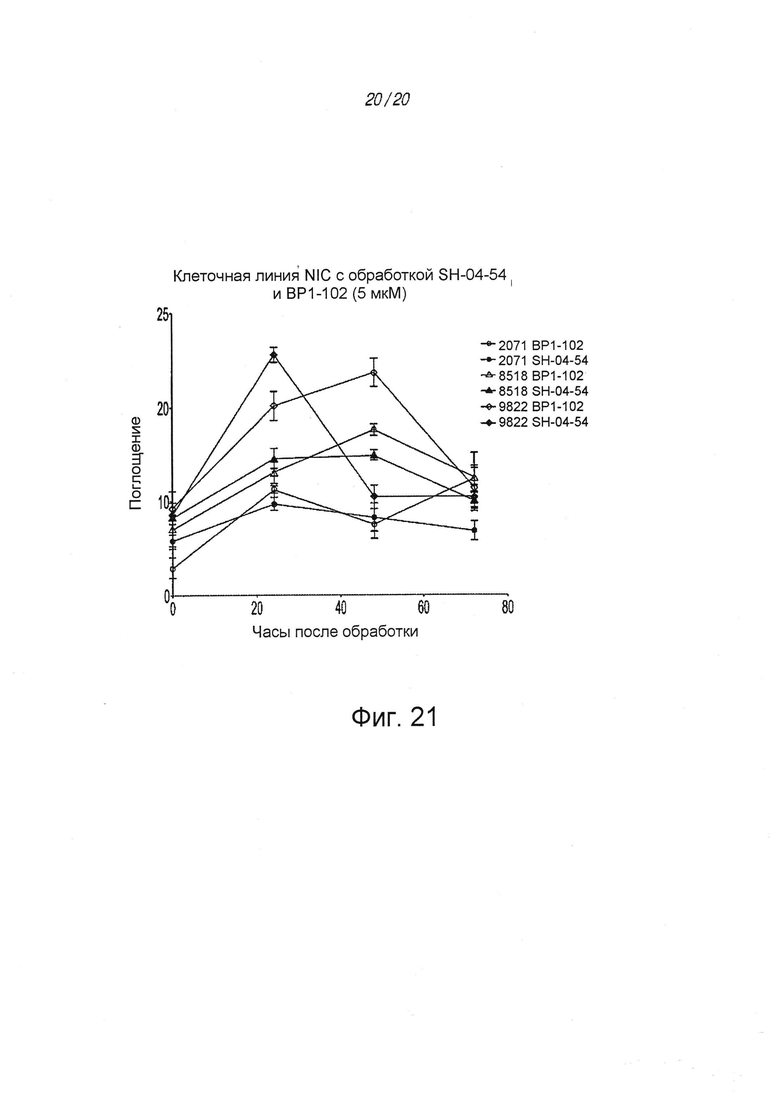
Изобретение относится к соединениям, выбранным из указанной ниже группы, а также их фармацевтически приемлемым солям, которые обладают ингибирующей активностью в отношении STAT3 и/или STAT5. Изобретение относится также к фармацевтической композиции, включающей указанные соединения, их применению для получения лекарственного средства для ингибирования активности STAT3 и/или STAT5 или для лечения рака, где раковые клетки содержат активированный STAT3 или STAT5. Кроме того, изобретение относится к ряду других конкретных соединений подобной структуры, фармацевтической композиции, включающей указанные соединения, их применению для получения лекарственного средства для ингибирования активности STAT3 и/или STAT5 или для лечения рака, где раковые клетки содержат активированный STAT3 или STAT5. 8 н. и 12 з.п. ф-лы, 21 ил., 6 табл., 76 пр.
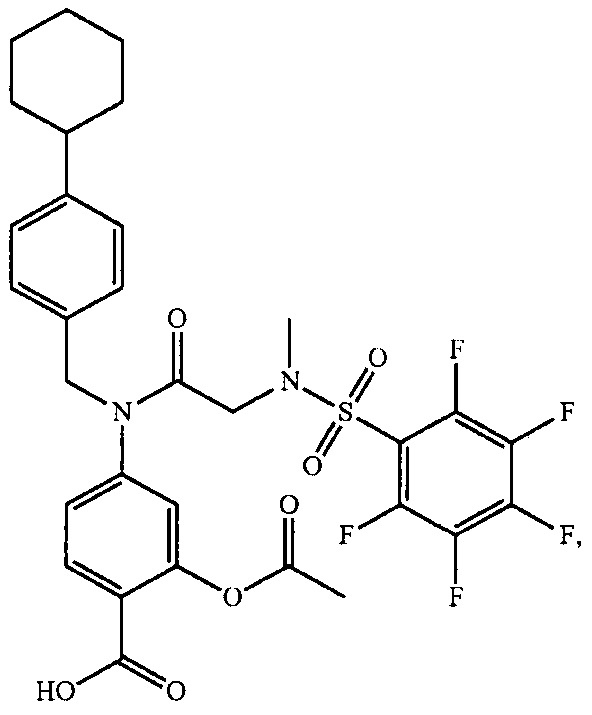
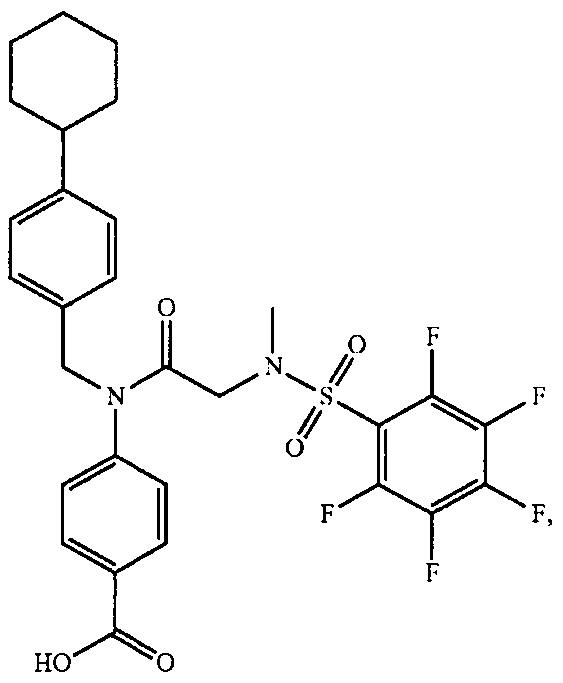
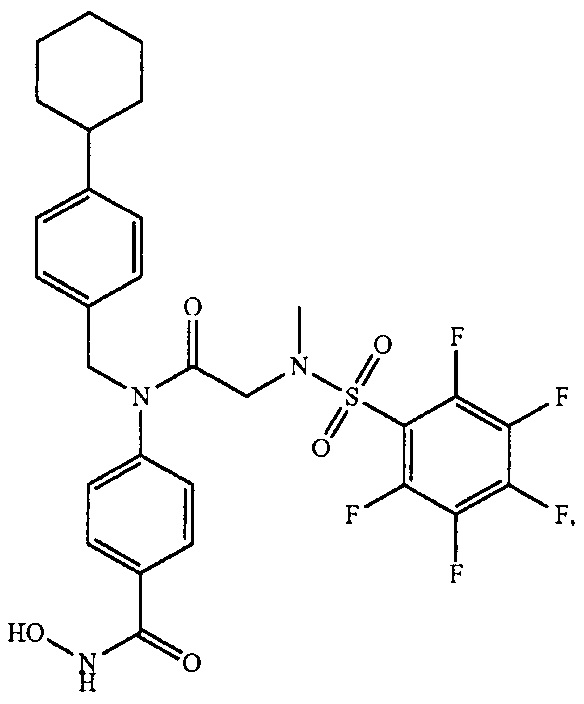
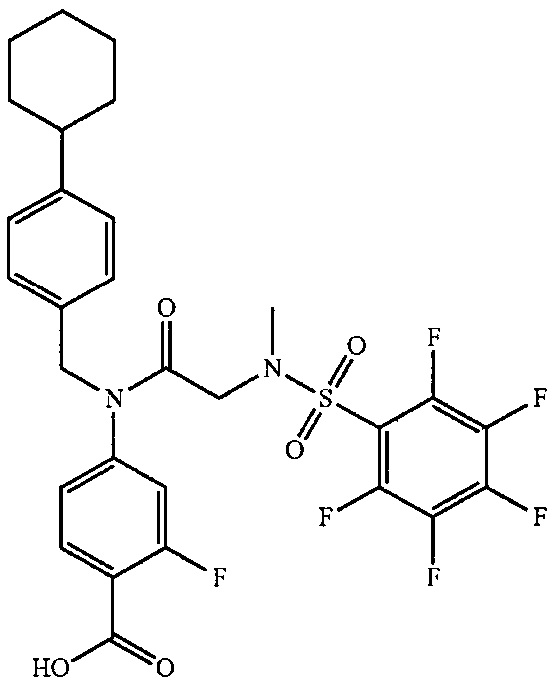
1. Соединение, выбранное из группы, состоящей из
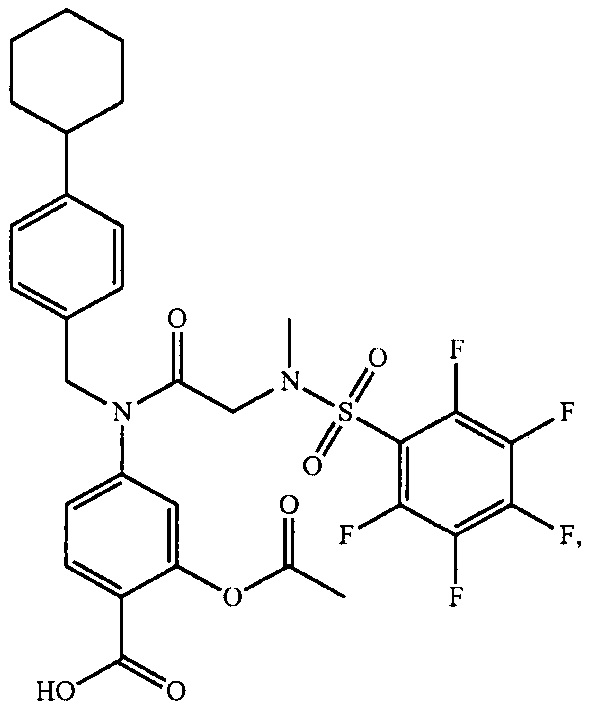 ,
, 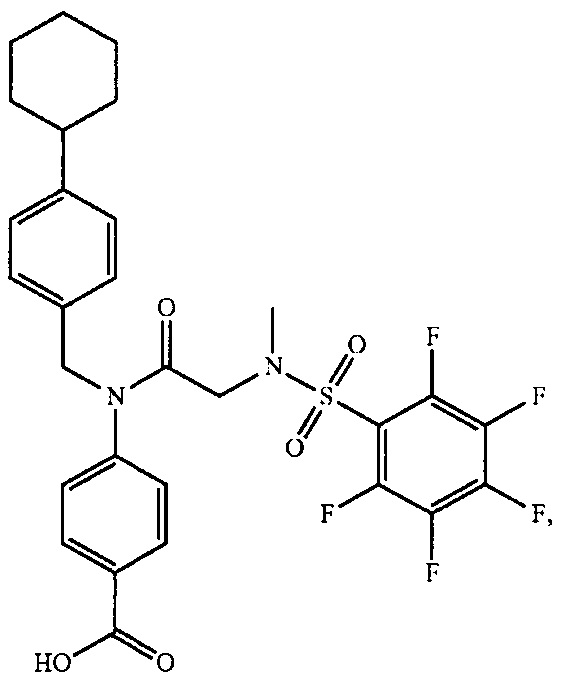 ,
,
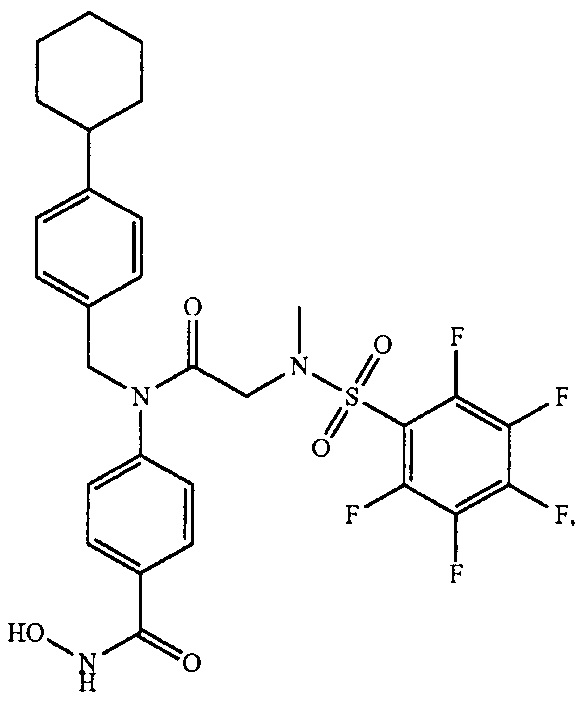 и
и 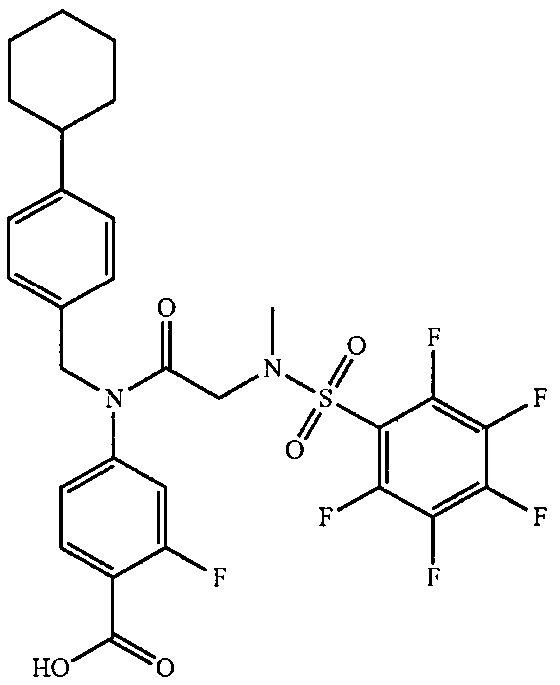 ,
,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, представляющее собой
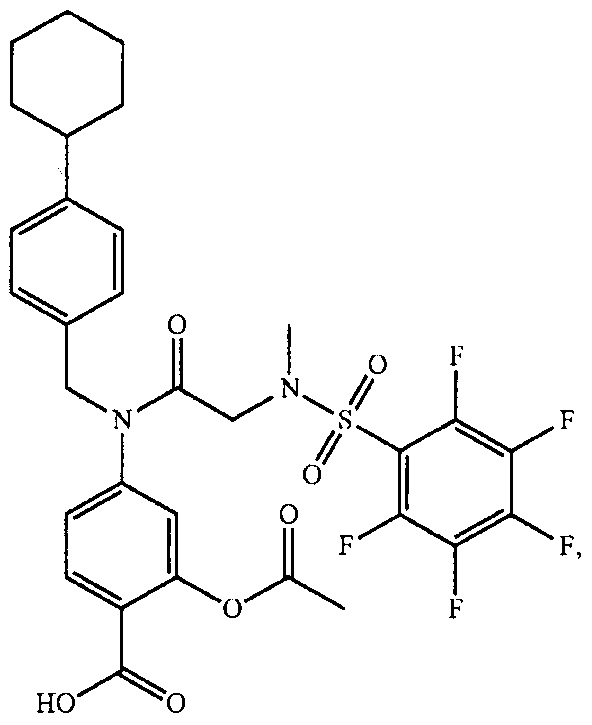 .
.
3. Соединение по п.1, представляющее собой
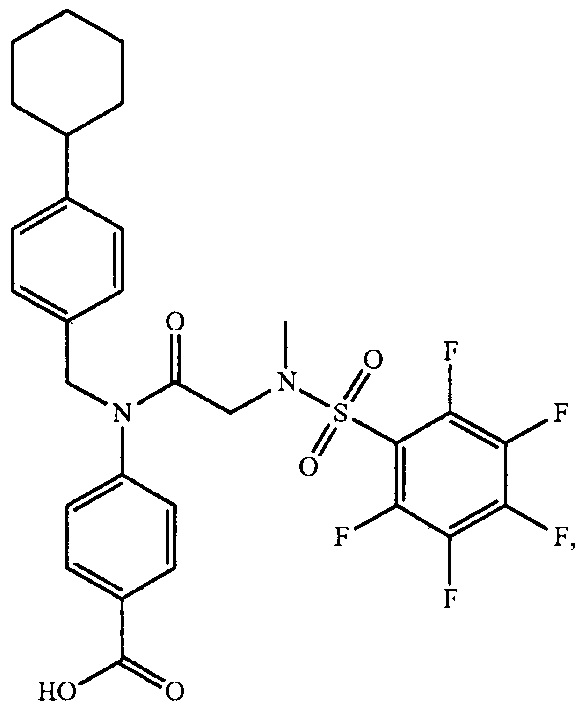 .
.
4. Соединение по п.1, представляющее собой
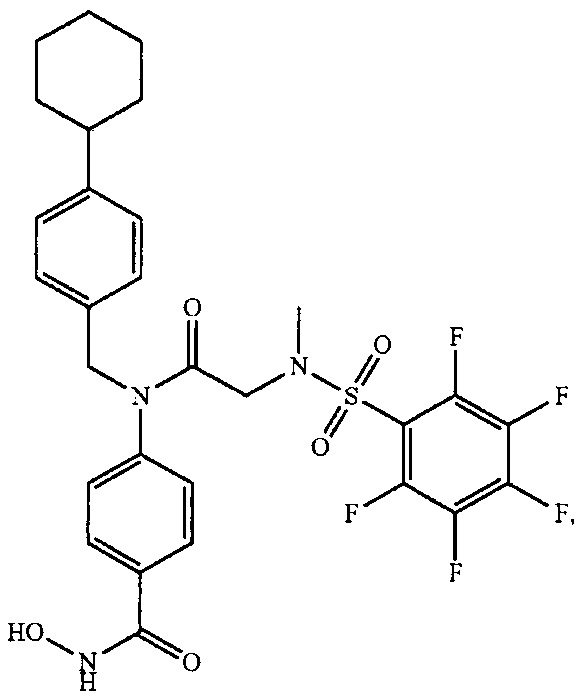 .
.
5. Соединение по п.1, представляющее собой
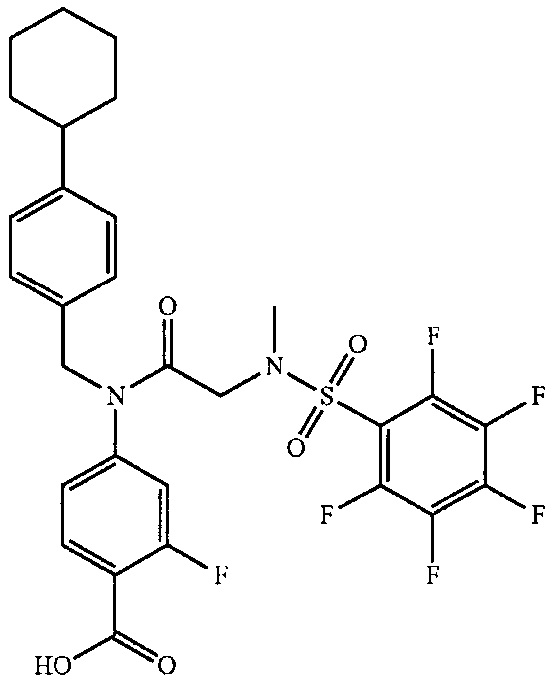 .
.
6. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении STAT3 и/или STAT5, включающая эффективное количество соединения по п.1 или его фармацевтически приемлемой соли и приемлемое вспомогательное вещество.
7. Применение соединения по п.1 или его фармацевтически приемлемой соли для получения лекарственного средства для ингибирования активности STAT3 и/или STAT5 у пациента.
8. Применение соединения по п.1 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака, где раковые клетки содержат активированный STAT3 или STAT5.
9. Применение по п.8, где указанный рак выбран из солидных или гематологических опухолей.
10. Применение по п.9, где указанный рак выбран из группы, состоящей из рака молочной железы, рака печени, рака простаты, рака поджелудочной железы, рака крови, рака кожи, рака головы, рака шеи и множественной миеломы.
11. Применение по п.9, где указанный рак выбран из группы, состоящей из рака головного мозга, острого миелоидного лейкоза (ОМЛ) и острого лимфобластного лейкоза.
12. Применение по п.9, где указанный рак представляет собой глиобластому.
13. Соединение, выбранное из группы, состоящей из
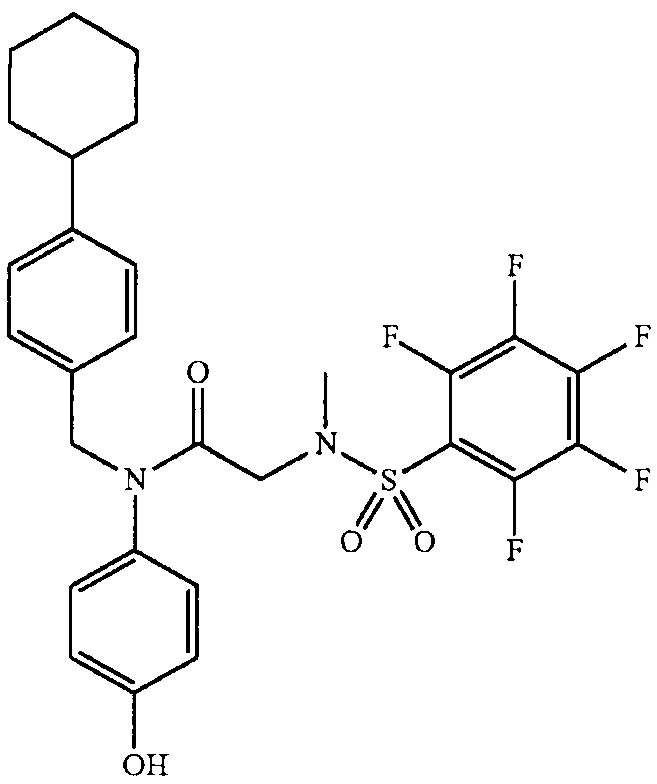 ,
, 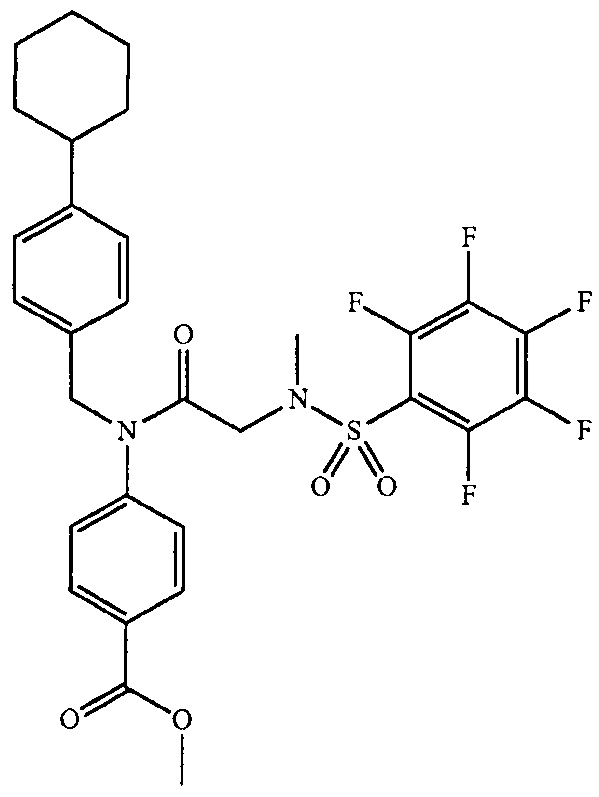 ,
,
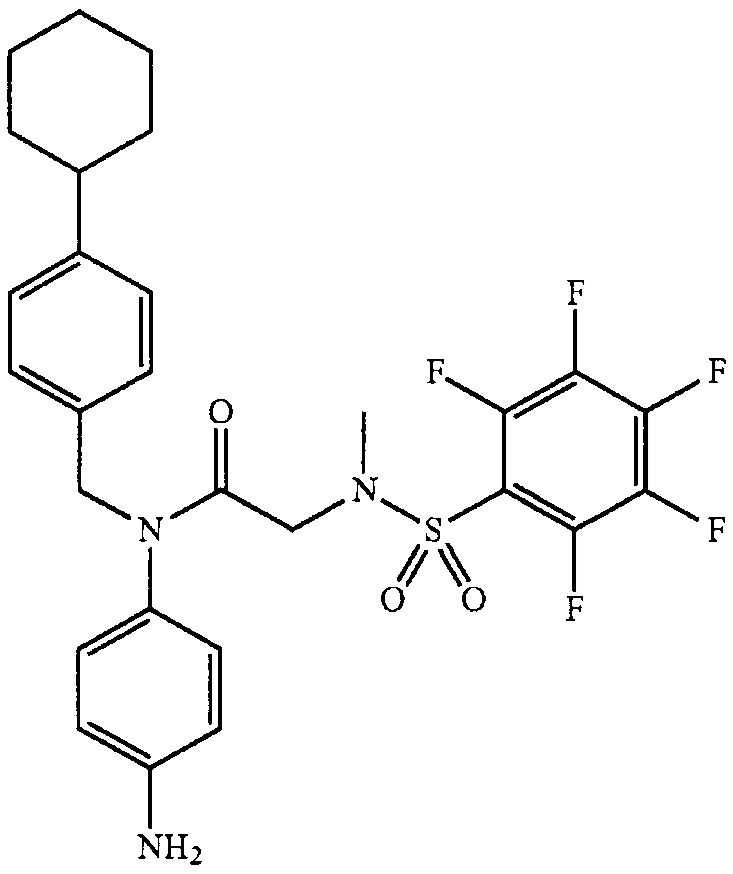 ,
, 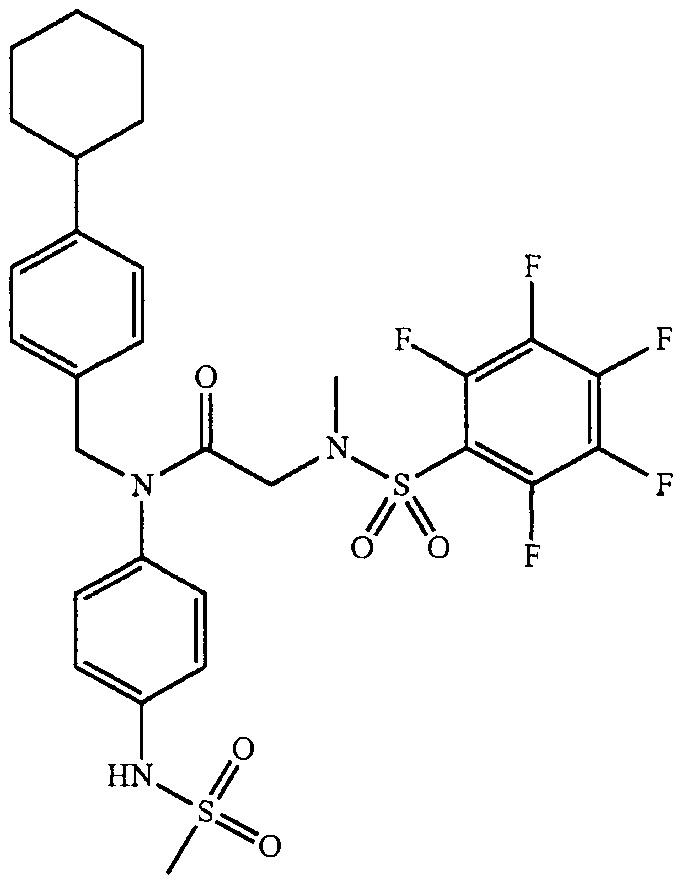 ,
,
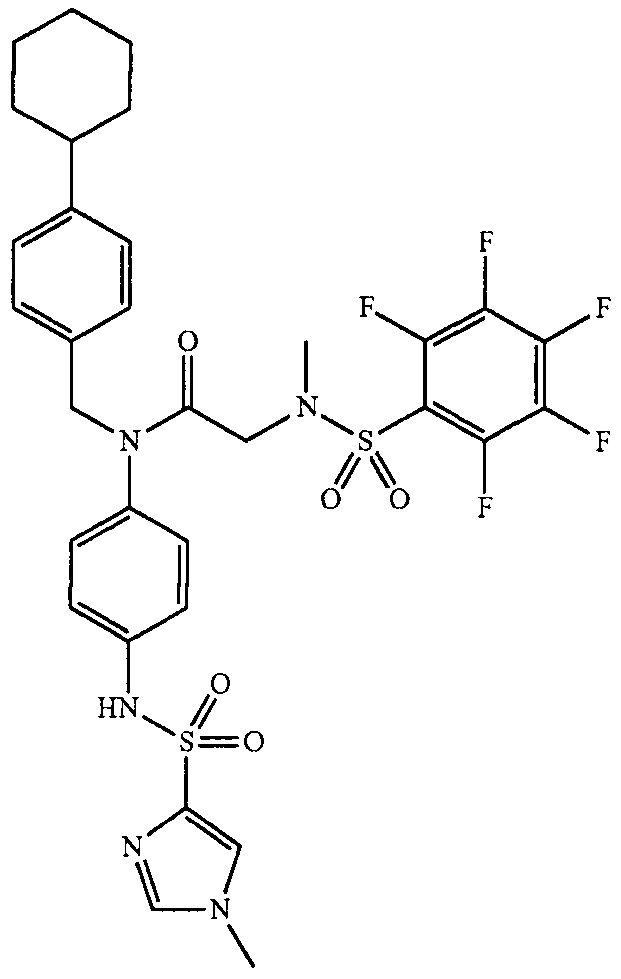 ,
, 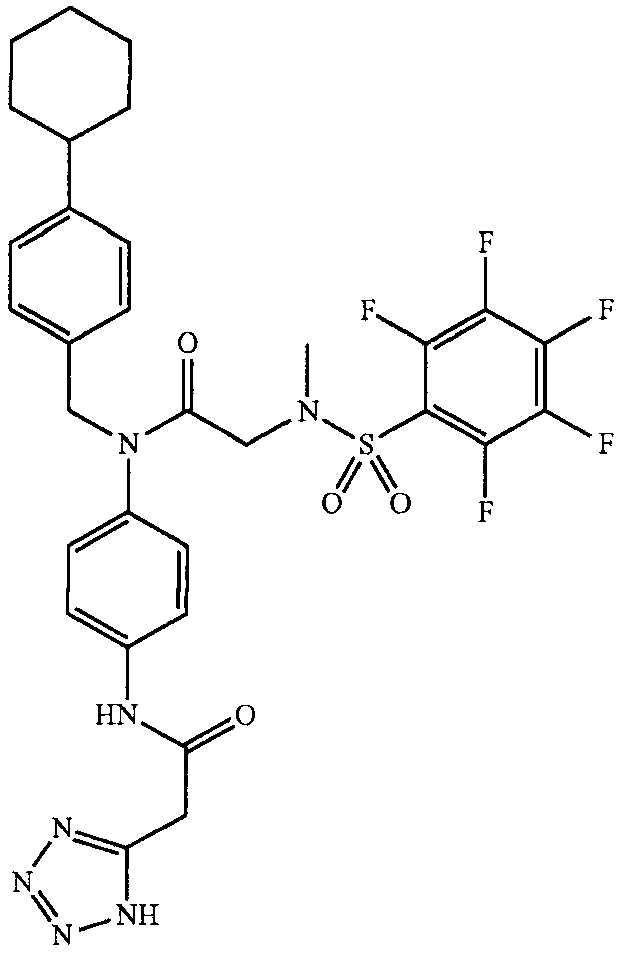 ,
,
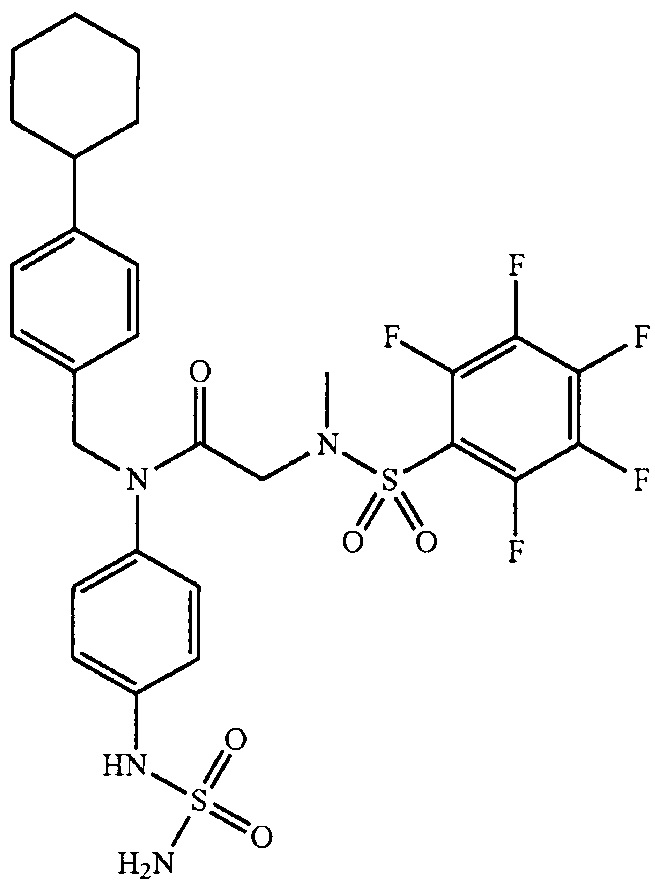 ,
, 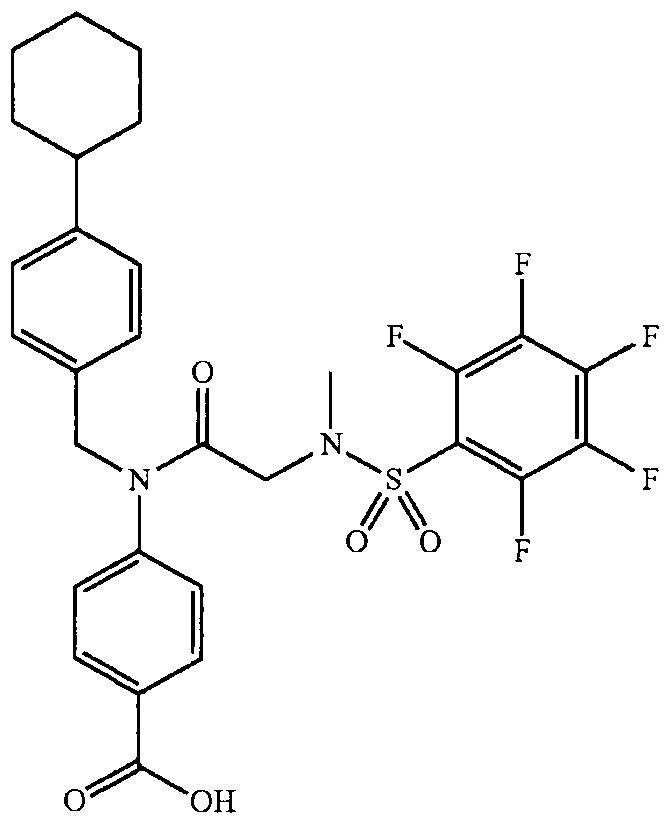 ,
,
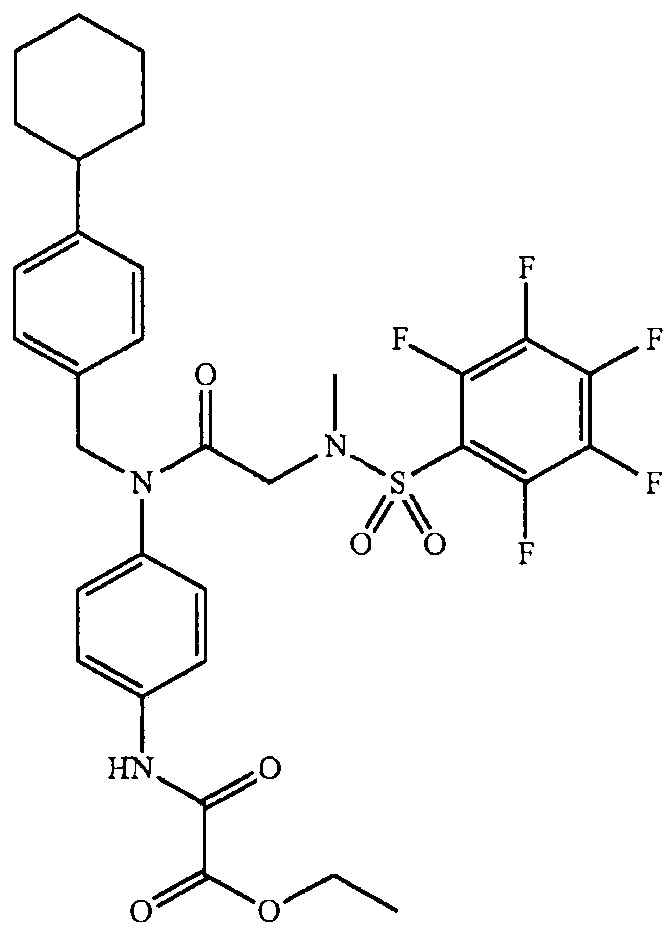 ,
, 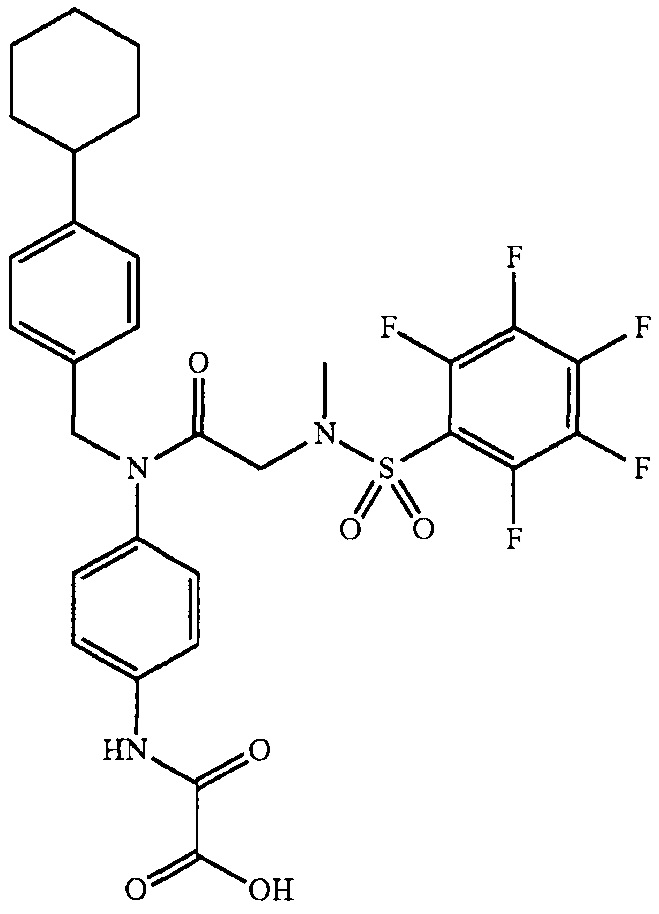 ,
,
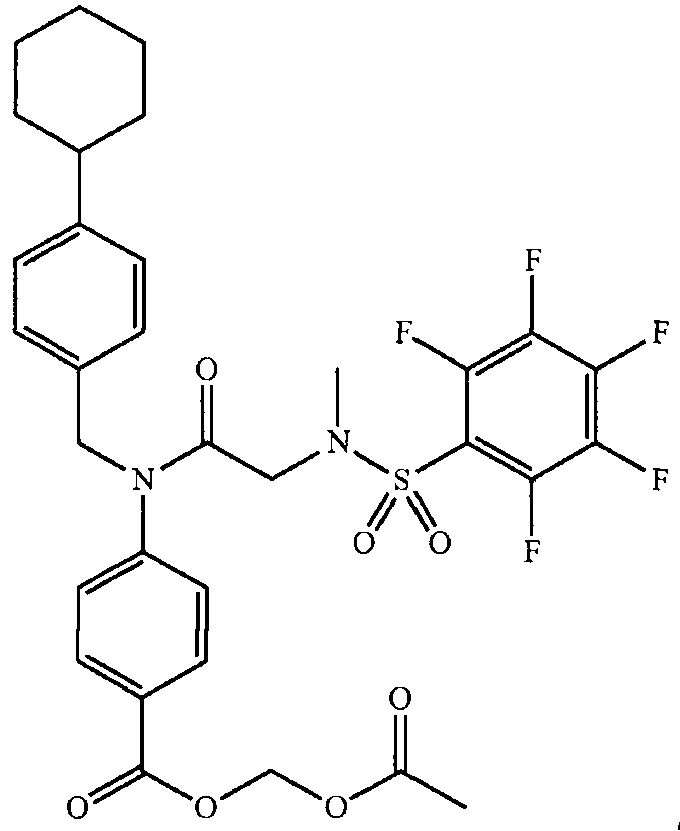 ,
, 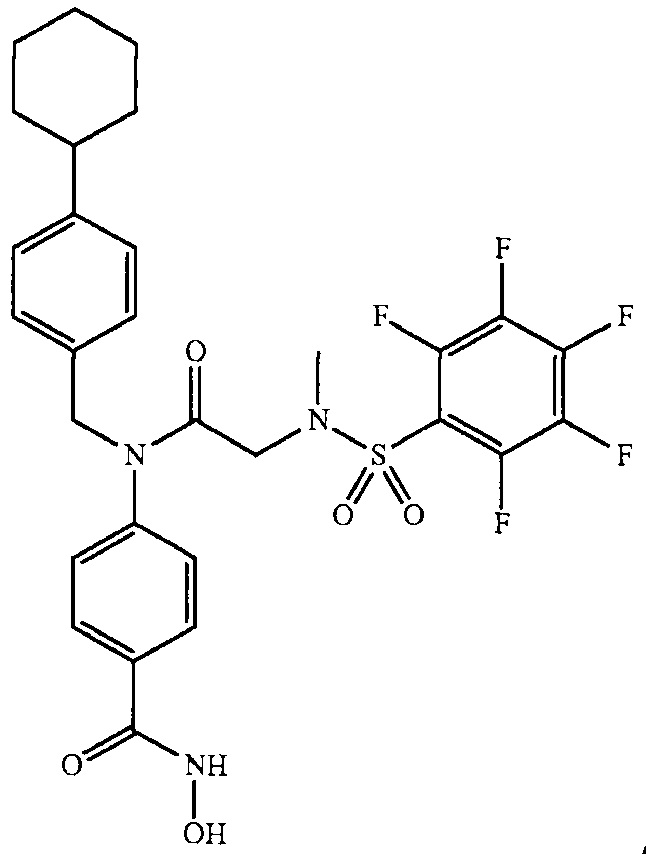 ,
,
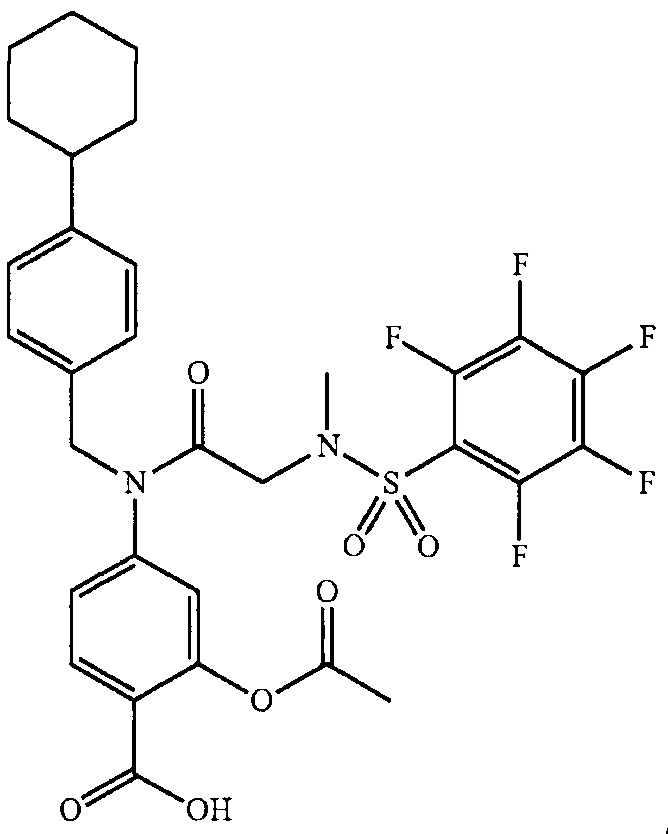 ,
, 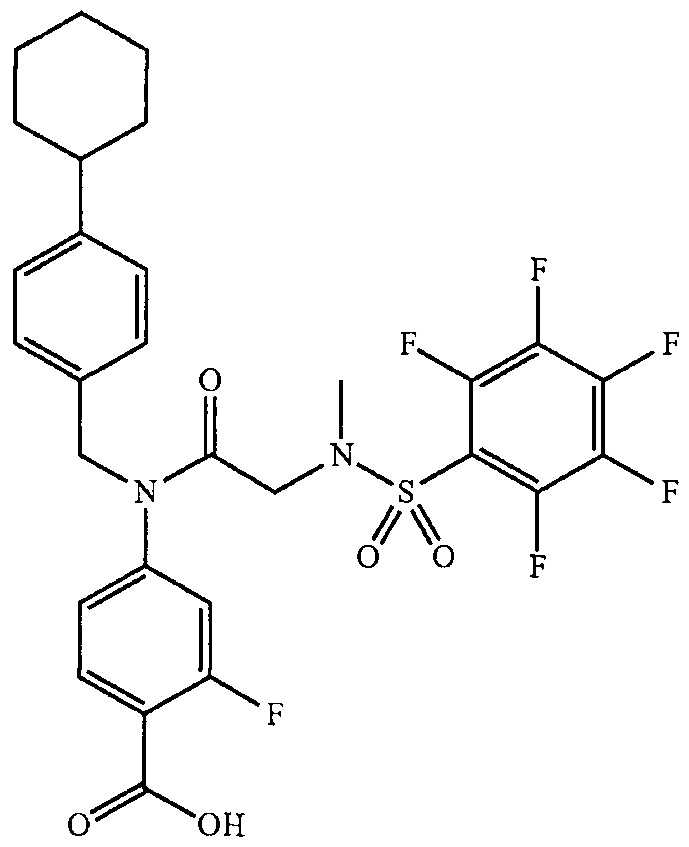 ,
,
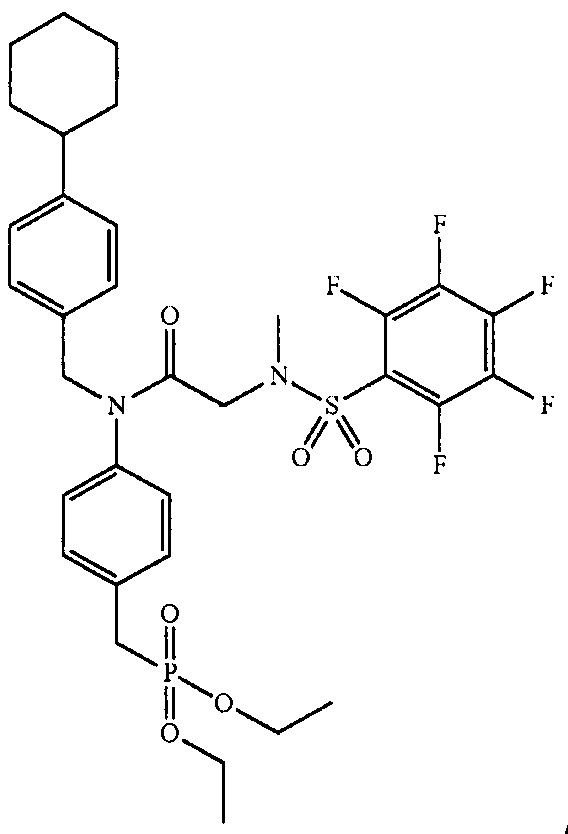 ,
, 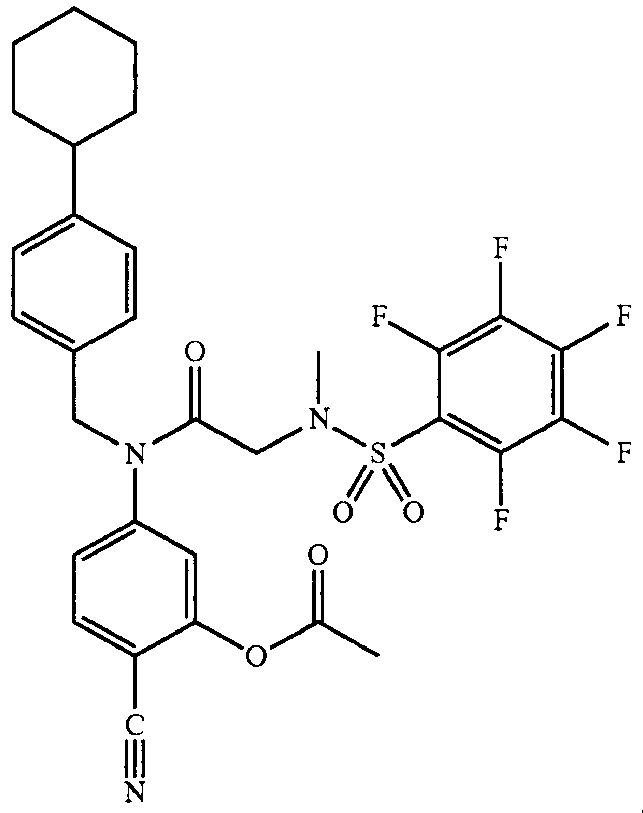 ,
,
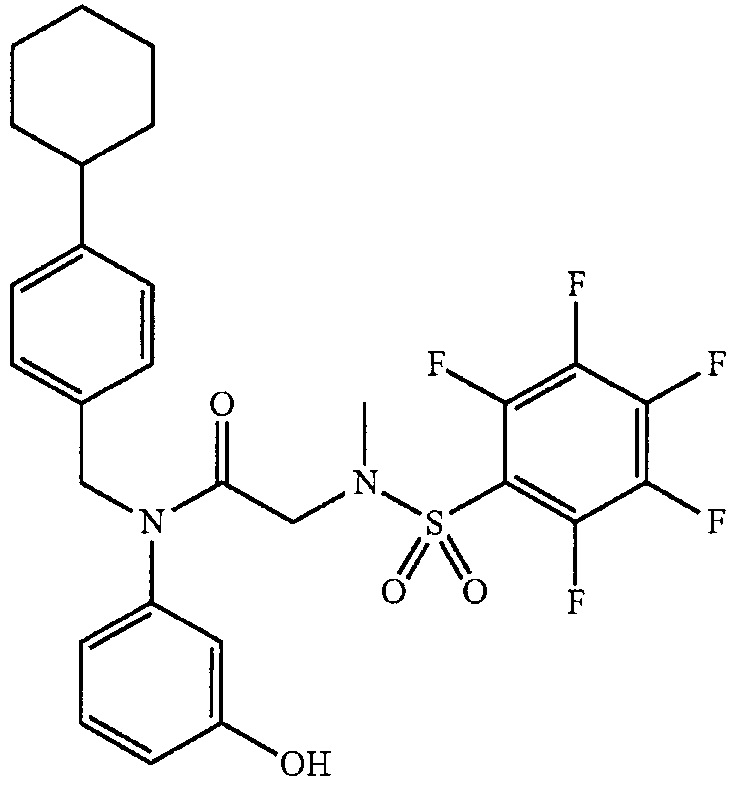 ,
, 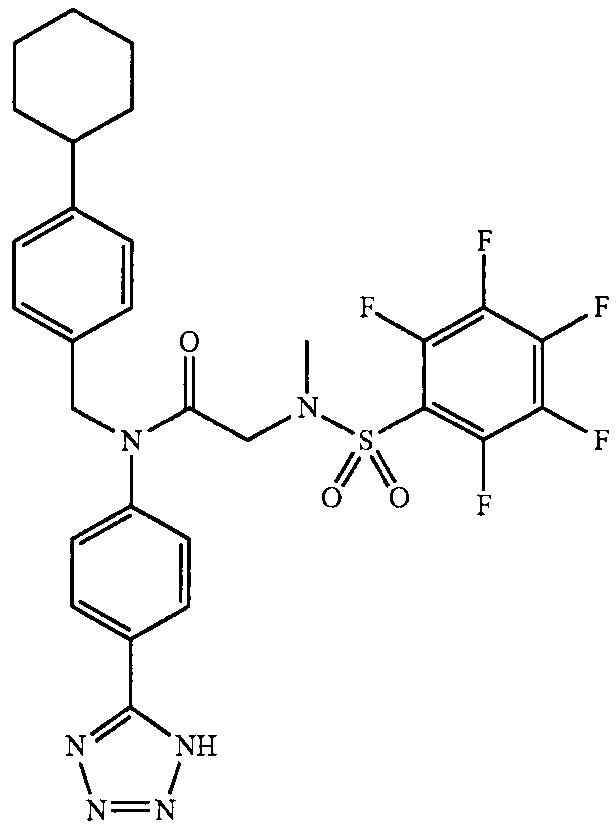 ,
,
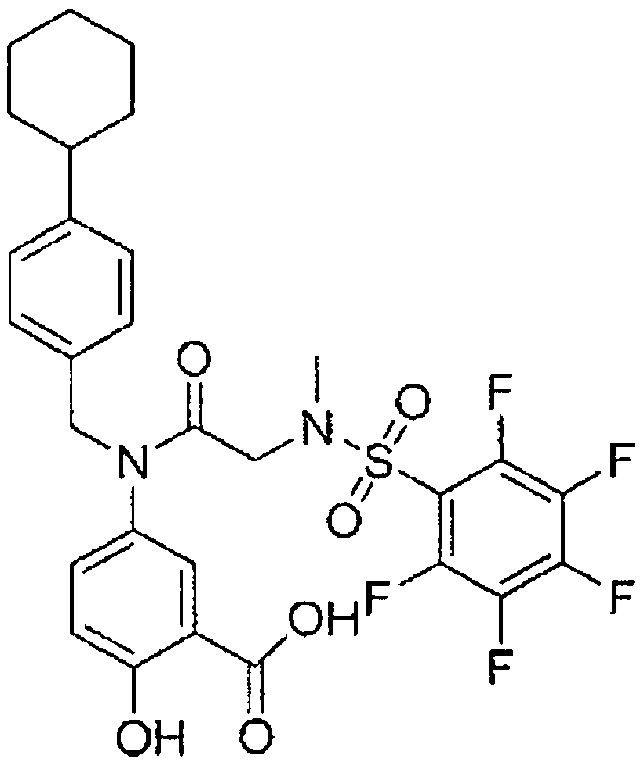 ,
, 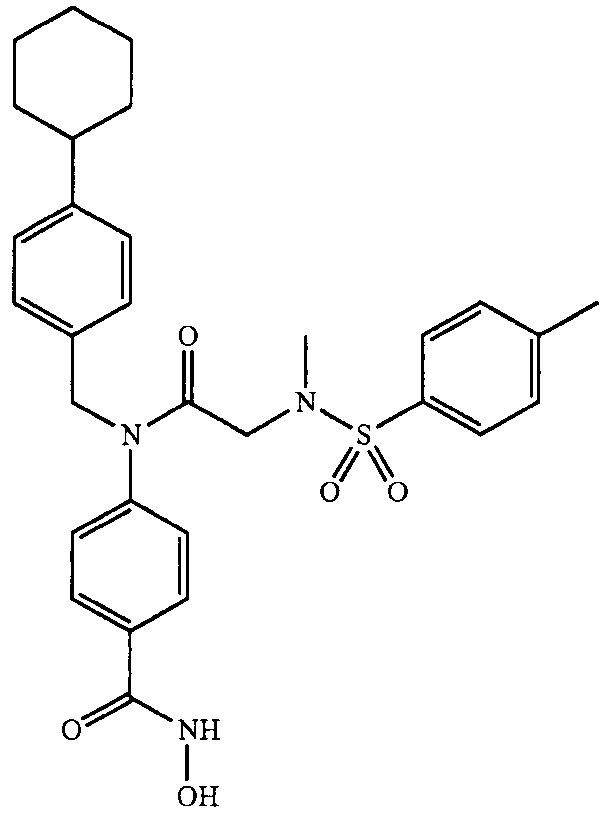 ,
,
 и
и  .
.
14. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении STAT3 и/или STAT5, включающая эффективное количество соединения по п.13 или его фармацевтически приемлемой соли и приемлемое вспомогательное вещество.
15. Применение соединения по п.13 или его фармацевтически приемлемой соли для получения лекарственного средства для ингибирования активности STAT3 и/или STAT5 у пациента.
16. Применение соединения по п.13 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака, где раковые клетки содержат активированный STAT3 или STAT5.
17. Применение по п.16, где указанный рак выбран из солидных или гематологических опухолей.
18. Применение по п.17, где указанный рак выбран из группы, состоящей из рака молочной железы, рака печени, рака простаты, рака поджелудочной железы, рака крови, рака кожи, рака головы, рака шеи и множественной миеломы.
19. Применение по п.17, где указанный рак выбран из группы, состоящей из рака головного мозга, острого миелоидного лейкоза (ОМЛ) и острого лимфобластного лейкоза.
20. Применение по п.17, где указанный рак представляет собой глиобластому.
| B.D.G | |||
| PAGE ET AL., Small Molecule STAT5-SH2 Domain Inhibitors Exhibit Potent Antileukemia Activity, J | |||
| MED | |||
| CHEM., 2011, Vol | |||
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| ПАРАШЮТНОЕ ПРИСПОСОБЛЕНИЕ ДЛЯ АЭРОПЛАНА | 1924 |
|
SU1047A1 |
| B.D.G | |||
| PAGE ET AL., Identification of a non-phosphorylated, cell permeable, small molecule ligand for the STAT3 SH2 domain, BIOORG | |||
| MED | |||
| CHEM | |||
| LETT., 2011, Vol | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| ВОЗДУШНАЯ СИСТЕМА ДЛЯ АВТОМАТИЧЕСКОЙ РАСТРУСКИ И ПЕРЕНОСА КРОШЕНОГО ТАБАКА | 1925 |
|
SU5605A1 |
| S | |||
| FLETCHER ET AL., Antagonism of the STAT3-STAT-3 Protein Dimer with Salicylic Acid Based Small Molecules, CHEM | |||
| MED | |||
| CHEM., 2011, 6, pp | |||
| Коловратный двигатель | 1924 |
|
SU1459A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| S | |||
| FLETCHER ET AL., Disruption of Transcriptionally Active STAT3 Dimers with Non-phosphorylated, Salicylic Acid-Based Small Molecules: Potent in vitro and Tumor Cell Activities, CHEM | |||
| BIO | |||
| CHEM., 2009, Vol | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Автоматический сцепной прибор американского типа | 1925 |
|
SU1959A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| RU 2009116653 A, 10.11.2010. | |||
Авторы
Даты
2018-01-23—Публикация
2013-05-24—Подача