Настоящее изобретение относится к биотехнологии, болеем конкретно к микробиологическому синтезу белков. Настоящее изобретение, в частности, относится к способу получения белков посредством генетически модифицированных микроорганизмов и, кроме того, обеспечивает микроорганизмы, которые применяются в таких способах. Настоящее изобретение дополнительно относится к применению таких микроорганизмов для получения белков.
Микроорганизмы могут применяться для получения ценных веществ. Ценными веществами являются, например, низкомолекулярные соединения, например пищевые добавки или фармацевтически активные соединения, или белков, для которых, в свою очередь, существует большая промышленная область применения благодаря многообразию белков. Во-первых, метаболические свойства рассматриваемых микроорганизмов применяются и/или модифицируются для того, чтобы получить ценные вещества; во-вторых, предпочтительно применяются микроорганизмы, экспрессирующие гены представляющих интерес белков.
Для биотехнологического получения в промышленном масштабе рассматриваемые микроорганизмы культивируются в ферментерах, которые адаптированы в соответствии с метаболическими свойствами микроорганизмов. В ходе культивирования микроорганизмы метаболизируют подаваемый субстрат и образуют желательный продукт, который, после окончания ферментации, как правило, отделяют от организмов-производителей и очищают и/или концентрируют из суспензии ферментера и/или ферментационной среды. При ферментативном получении белков в качестве субстрата, как правило, применяется сложное богатое белками сырье в дополнение к источнику углерода (как правило, глюкоза). Получение белков, таким образом, соответствует биотрансформации белкового субстрата в целевой белок. Для этого требуется сложный гидролиз белкового субстрата в отдельные аминокислоты, которые затем доступны для биосинтеза целевого белка.
Для ферментации микроорганизмов имеется исчерпывающий уровень техники, который простирается от оптимизации рассматриваемых штаммов, например, с точки зрения скорости образования и использования питательных веществ, через техническое конструирование ферментеров для полученных ценных веществ из рассматриваемых микроорганизмов и/или ферментационной среды.
Как правило, при микробиологической ферментации желательны очень высокие выходы продукта. Например, в международной патентной заявке WO 91/02792 рассматривается улучшенное ферментативное получение щелочной протеазы из Bacillus lentus в оптимизированном штамме Bacillus licheniformis под контролем генных регуляторных последовательностей из Bacillus licheniformis, более конкретно промотора Bacillus licheniformis.
В публикациях Wu et al. (J. Bacteriol. 173(16), 4952-8 (1991); Appl. Environ. Microbiol. 68(7), 3261-9 (2002)) предлагается выключение протеаз, эндогенно экспрессирумых микроорганизмом, чтобы повысить выход целевого белка. Это предлагается для предотвращения протеолитического расщепления целевого белка и фокусирования способности микроорганизмов к синтезу на целевом продукте.
Все еще существует большая потребность в способах микробиологической ферментации, которые обеспечивают высокий выход продукта. Авторами настоящего изобретения неожиданно и в противоречие с вышеизложенными публикациями было обнаружено, что специфическая дополнительная экспрессия конкретной вспомогательной протеазы предпочтительна для выхода продукта.
Задачей настоящего изобретения является повышение выхода продукта, в особенности белка, при микробиологической ферментации.
Настоящее изобретение обеспечивает способ получения белка посредством микроорганизма, содержащий стадии (а) введения в микроорганизм первой экспрессионной конструкции, которая кодирует белок; (b) введения в микроорганизм второй экспрессионной конструкции, которая кодирует вспомогательную протеазу, которая отлична от белка и которая содержит аминокислотную последовательность, которая по меньшей мере на 50% идентична аминокислотной последовательности, показанной как SEQ ID NO. 1, где вспомогательная протеаза имеет протеолитическую активность; (с) экспрессии белка и вспомогательной протеазы в микроорганизме.
Способ согласно настоящему изобретению необязательно дополнительно содержит дополнительную стадию способа (d) культивирования микроорганизма.
В предпочтительных вариантах выполнения настоящего изобретения способ согласно настоящему изобретению представляет собой ферментационный способ.
Введение и экспрессия вспомогательной протеазы в микроорганизм/внутри микроорганизма неожиданным образом не приводит к уменьшению выхода белкового продукта (целевого белка), например, благодаря протеолитической активности экспрессируемой вспомогательной протеазы, которая могла бы разрушать синтезированный целевой белок. Напротив, экспрессия вспомогательной протеазы вызывает увеличение выхода белкового продукта. В предпочтительных вариантах выполнения настоящего изобретения, вспомогательная протеаза участвует в гидролизе белкового субстрата и осуществляет, предпочтительно вместе с другими, кодируемыми хромосомами протеазами (=физиологические протеазы) микроорганизма, улучшенное расщепление белкового субстрата, так что больше необходимых молекул-предшественников, больше конкретных аминокислот, на единицу времени, доступны для синтеза целевого белка в процессе получения. В таких вариантах выполнения настоящего изобретения, субстратная специфичность физиологических протеаз и субстратная специфичность вспомогательной протеазы поэтому дополняют друг друга, предпочтительно с точки зрения расщепления субстрата микроорганизмом.
В этом отношении, в других предпочтительных вариантах выполнения настоящего изобретения нет необходимости, чтобы вспомогательная протеаза составляла существенную часть продукта ферментации. Вспомогательная протеаза оказывает, в этом отношении, положительный эффект на экспрессию белка и, следовательно, на выход белкового продукта, даже когда ее часть в продукте ферментации является маленькой или даже неустанавливаемой. Предпочтительно, ее часть в продукте ферментации составляет менее 25% и, с возрастающим предпочтением, менее 20 мас.%, 15 мас.%, 10 мас.%, 8 мас.%, 7 мас.%, 6 мас.%, 5 мас.%, 2.5 мас.%, 2 мас.%, 1.5 мас.%, 1 мас.%, 0.5 мас.%, 0.1 мас.% и 0.05 мас.%. Продуктом ферментации, в этом отношении, является та композиция, в которой белок присутствует после того, как способ согласно настоящему изобретению был осуществлен, микроорганизм был культивирован в культуральной среде, и при необходимости микроорганизм был разрушен для высвобождения из него белка, если белок не был секретирован указанным микроорганизмом. Предпочтительно, микроорганизмы или их фрагменты отделяются от продуктов ферментации.
В предпочтительном варианте выполнения настоящего изобретения, способом согласно настоящему изобретению поэтому является способ повышения экспрессии белка в микроорганизме. Имеется повышенная экспрессия белка, когда способ согласно настоящему изобретению обеспечивает большое количество белка по сравнению с подобным способом, который отличается от способа согласно настоящему изобретению только отсутствием стадии b), что приводит к тому, что вспомогательная протеаза, следовательно, не экспрессируется в микроорганизме на стадии способа с). Два сравниваемых способа, в этом отношении, осуществляются при одинаковых условиях, с одинаковой продолжительностью и с микроорганизмами, которые отличаются только присутствием или отсутствием вспомогательной протеазы.
Экспрессионная конструкция представляет собой последовательность нуклеиновой кислоты, которая обеспечивает возможность экспрессии белка или вспомогательной протеазы в микроорганизме. Она содержит генетическую информацию, то есть последовательность нуклеиновой кислоты (ген), который кодирует белок или вспомогательную протеазу. Экспрессия последовательности нуклеиновой кислоты представляет собой превращение в генный продукт (продукты), кодируемый указанной последовательностью, то есть в полипептид (белок) или во множество полипептидов (белков). Термины полипептид и белок применяются в описании настоящего изобретения в качестве синонимов. В целях настоящего изобретения, экспрессия поэтому означает биосинтез рибонуклеиновой кислоты (РНК) и белков из генетической информации. В общем, экспрессия содержит транскрипцию, то есть синтез информационной рибонуклеиновой кислоты (мРНК) на основе ДНК (дезоксирибонуклеиновой кислоты) последовательности гена, и трансляцию мРНК в соответствующую полипептидную цепь, которая может быть дополнительно посттрансляционной модифицирована. Экспрессия белка соответственно описывает его биосинтез из генетической информации, которая присутствует согласно настоящему изобретению в микроорганизме.
Экспрессионная конструкция дополнительно содержит по меньшей мере одну последовательность нуклеиновой кислоты, предпочтительно ДНК, имеющую функцию контроля экспрессии последовательности нуклеиновой кислоты, кодирующей белок или вспомогательную протеазу (известную как генная регуляторная последовательность). Генной регуляторной последовательностью является в этом случае любая последовательность нуклеиновой кислоты, которая, посредством ее присутствия в конкретном микроорганизме, воздействует на, предпочтительно повышает, скорость транскрипции той последовательности нуклеиновой кислоты, которая кодирует белок или вспомогательную протеазу. Предпочтительно, это промоторная последовательность, так как такая последовательность необходима для экспрессии последовательности нуклеиновой кислоты. Однако экспрессионная конструкция согласно настоящему изобретению может также содержать другие генные регуляторные последовательности, например одну или более энхансерных последовательностей. Поэтому экспрессионная конструкция в целях настоящего изобретения содержит функциональную единицу, состоящую из гена и промотора. Они могут, но не обязательно, присутствовать в качестве физического объекта.
Присутствие по меньшей мере одного промотора необходимо для экспрессионной конструкции согласно настоящему изобретению. Поэтому промотор, как понимается, означает ДНК последовательность, которая обеспечивает регуляторную экспрессию гена. Промоторная последовательность является природным компонентом гена и часто располагается на 5' его конце и поэтому перед РНК-кодирующей областью. Предпочтительно промоторная последовательность в экспрессионной конструкции согласно настоящему изобретению располагается на 5' против хода транскрипции последовательности нуклеиновой кислоты, кодирующей белок или вспомогательную протеазу. Наиболее важным свойством промотора является специфическое взаимодействие с по меньшей мере одним ДНК-связывающим белком или полипептидом, который опосредует начало транскрипции гена посредством РНК полимеразы и обозначается как фактор транскрипции. Множество факторов транскрипции и/или других белков часто участвует в начале транскрипции посредством РНК полимеразы. Поэтому промотором предпочтительно является ДНК последовательность, имеющая промоторную активность, то есть ДНК последовательность, с которой связывается по меньшей мере один фактор транскрипции по меньшей мере временно, чтобы инициировать транскрипцию гена. Сила промотора измеряется скоростью транскрипции экспрессируемого гена, то есть числом РНК молекул, более конкретно молекул мРНК, образуемых в единицу времени. Промотором экспрессионной конструкции согласно настоящему изобретению может быть эндогенный промотор микроорганизма. Такая промоторная последовательность поэтому присутствует в микроорганизме естественным образом. Альтернативно, промотор экспрессионной конструкции согласно настоящему изобретению может также вводиться в микроорганизм рекомбинантным образом. Это также относится ко всем другим генным регуляторным последовательностям, которые может иметь экспрессионная конструкция согласно настоящему изобретению.
Первая экспрессионная конструкция кодирует белок. Поэтому она содержит последовательность нуклеиновой кислоты, кодирующую указанный белок. С этой целью, любая желательная последовательность нуклеиновой кислоты, которая может быть в ходе трансляции превращена в белок, в принципе, является подходящей. В этом случае, это тот белок, который должен быть получен с применением способа согласно настоящему изобретению (целевой белок). Предпочтительно это фермент, более предпочтительно фермент, как описывается далее.
Вторая экспрессионная конструкция кодирует вспомогательную протеазу. Вспомогательная протеаза отличается от белка, то есть вспомогательная протеаза и белок имеют различные аминокислотные последовательности. Вспомогательная протеаза содержит аминокислотную последовательность, которая идентична аминокислотной последовательности, указанной как SEQ ID NO. 1, до степени по меньшей мере 50% и, с возрастающим предпочтением, до степени по меньшей мере 55%, 60%, 65%, 70%, 72%, 74%, 76%, 78%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и наиболее предпочтительно до степени 100%. Особенно предпочтительно вспомогательная протеаза имеет аминокислотную последовательность, которая по меньшей мере на 50% идентична аминокислотной последовательности, указанной как SEQ ID NO. 1, и идентична, с возрастающим предпочтением, до степени по меньшей мере 55%, 60%, 65%, 70%, 72%, 74%, 76%, 78%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и наиболее предпочтительно до степени 100%.
Идентичность последовательности нуклеиновой кислоты и аминокислотной последовательности определяется сравнением последовательностей. Такое сравнение достигается посредством принятия подобных последовательностей в нуклеотидных последовательностях или аминокислотных последовательностях одна другой. Указанное сравнение последовательностей предпочтительно осуществляется на основе алгоритма BLAST, который известен из уровня техники и обычно примнется (смотрите, например, Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, D.J. (1990) "Basic local alignment search tool." J. Mol. Biol. 215: 403-410, и Altschul, Stephan F., Thomas L. Madden, Alejandro A. Schaffer, Jinghui Zhang, Hheng Zhang, Webb Miller, and David J. Lipman (1997): "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs"; Nucleic Acids Res., 25, стр.3389-3402), и осуществляется, главным образом, путем принятия подобных последовательностей нуклеотидов или аминокислот в последовательности нуклеиновых кислот или аминокислотных последовательностях друг другу. Ассигнование в форме таблицы рассматриваемых положений называется выравниванием. Другим доступным из уровня техники алгоритмом является алгоритм FASTA. Сравнения последовательностей (выравнивания), более конкретно множество сравнений последовательностей, как правило, осуществляется с применением компьютерных программ. Часто применяемыми являются, например, серии Clustal (смотрите, например, Chenna et al. (2003): Multiple sequence alignment with the Clustal series of programs. Nucleic Acid Research 31, 3497- 3500), T-Coffee (смотрите, например, Notredame et al. (2000): T-Coffee: A novel method for multiple sequence alignments. J. Mol. Biol. 302, 205-217) или программы на основе указанных программ и алгоритмов. В целях настоящего изобретения сравнения последовательностей и выравнивания предпочтительно осуществляются с применением компьютерной программы Vector NTI Suite 10.3 (Invitrogen Corporation, 1600 Faraday Avenue, Carlsbad, California, USA) с применением заданных стандартных параметров (по умолчанию).
Такое сравнение делает возможным выявление подобия сравниваемых последовательностей друг другу. Подобие, как правило, выражается в виде процента идентичности, то есть доли идентичных нуклеотидов или аминокислотных остатков в одинаковых положениях или положениях, соответствующих друг другу в выравнивании. Расширенный термин гомология учитывает консервативные аминокислотные замещения в случае аминокислотных последовательностей, то есть аминокислоты, имеющие подобные свойства, потому что они, как правило, осуществляют подобные активности или функции внутри белка. Поэтому подобие сравниваемых последовательностей может также быть представлено в виде процента гомологии или процента подобия. Значения идентичности и/или гомологии могут сообщаться для полипептидов или генов целиком или только для конкретных областей. Гомологичные или идентичные области различных последовательностей нуклеиновых кислот или аминокислотных последовательностей поэтому определяются сходством в последовательностях. Они часто имеют одинаковые или подобные функции. Они могут быть маленькими или содержать только несколько нуклеотидов или аминокислот. Такие маленькие области часто осуществляют существенные функции для всей активности белка. Поэтому можно рекомендовать для базовой последовательности сравнивать только конкретные возможно небольшие области. Если иного не указано, значение идентичности или гомологии в контексте настоящего изобретения относятся, однако, ко всей длине различных указанных последовательностей нуклеиновых кислот или аминокислотных последовательностей. В случае белков, более конкретно ферментов и, в контексте настоящего изобретения, особенно протеаз, значения также относятся к различным зрелым белкам, если иного не указано. Если иного не указано, взгляд на последовательность всегда направлен на зрелый полностью процессированный белок, даже если связанные гены кодируют незрелую форму, которая после трансляции далее процессирует в зрелую форму.
Вспомогательная протеаза имеет, кроме того, протеолитическую активность. Поэтому она является каталитически активной, то есть она является активным ферментом. Определение ферментативной активности, осуществляемое согласно обычным средствам в данной области техники, может в этом отношении адаптироваться к конкретному типу фермента. Способы определения активности подобны известным специалистам области ферментной технологии и являются рутинными для таких специалистов. Способы определения протеазной активности раскрываются, например, в Tenside, том 7 (1970), стр.125-132. Протеолитическая активность может, кроме того, быть определена через высвобождение хромофора паранитроанилина (pNA) из субстрата suc-L-Ala-L-Ala-L-Pro-L-Phe-п-нитроанилид (suc-AAPF-pNA). Протеаза расщепляет субстрат и высвобождает pNA, высвобождение pNA вызывает увеличение поглощения при 410 нм, причем его изменение во времени является измерением ферментативной активности (смотрите Del Mar et al., 1979). Измерение осуществляется при температуре 25°С, при рН 8.6 и длине волны 410 нм. Время измерения составляет 5 мин при интервале измерения от 20°С до 60°С. Протеазная активность предпочтительно приводится в PU (протеазных единицах).
Нуклеиновые кислоты и экспрессионные конструкции согласно настоящему изобретению могут быть получены известными способами для модификации нуклеиновых кислот. Такими способами являются, например, представленные в относящихся к данной области техники руководствах, таких как руководство Fritsch, Sambrook и Maniatis, "Molecular cloning: a laboratory manual". Cold Spring Harbor Laboratory Press, New York, 1989, и известных специалистам в области биотехнологии. Примерами таких способов является химический синтез или полимеразная цепная реакция (PCR), при необходимости вместе с другими стандартными способами в молекулярной биологии и/или химии или биохимии.
Настоящее изобретение особенно подходит для рекомбинантного получения белков, более конкретно ферментов. С этой целью, первая и вторая экспрессионные конструкции вводятся в микроорганизм, предпочтительно посредством трансформации. В этом отношении, конкретная экспрессионная конструкция или ее части предпочтительно вводятся посредством векторов, более конкретно экспрессионных векторов. Однако также возможно только для частей экспрессионной конструкции, предпочтительно по меньшей мере нуклеиновой кислоты, кодирующей белок или вспомогательную протеазу, вводиться в микроорганизм таким образом, что полная экспрессионная конструкция создается в микроорганизме. Это может, например, достигаться посредством вектора, который делает возможным введение гена для белка и/или гена для вспомогательной протеазы в клетку-хозяина в уже существующий генетический элемент, такой как хромосома, хромосомальная ДНК или другие вектора, так что, например, эндогенный промотор применяется для экспрессии гена для белка или гена для вспомогательной протеазы. Более конкретно, ген, кодирующий вспомогательную протеазу, может быть функционально связан таким образом с эндогенным промотором микроорганизма и затем составляет вторую экспрессионную конструкцию. Поэтому термин «введение» охватывает возможность, что экспрессионная конструкция вводится, предпочтительно трансформируется, полностью в микроорганизм, но также возможно, что только часть экспрессионной конструкции, особенно предпочтительно нуклеиновая кислота, кодирующая вспомогательную протеазу, вводится, предпочтительно трансформируется, в микроорганизм, и полная экспрессионная конструкция возникает только в микроорганизме. Однако в целях настоящего изобретения по меньшей мере часть экспрессионной конструкции всегда вводится в микроорганизм.
Вектора известны специалистам в области биотехнологии. В частности, при применении в бактериях они представляют собой специфические плазмиды, то есть кольцевые генетические элементы. В целях настоящего изобретения экспрессионные конструкции предпочтительно клонируются в вектор. Вектора могут, например, включать те, которые происходят из бактериальных плазмид, из вирусов или из бактериофагов, или преимущественно синтетические вектора или плазмиды, содержащие элементы очень различного происхождения. Другие генетические элементы, присутствующие в каждом случае, обеспечивают создание векторов в микроорганизмах через множество генераций в виде стабильных единиц. В этом отношении, в целях настоящего изобретения не существенно, создаются ли они внехромосомно в виде отдельных единиц или интегрируются в хромосому или хромосомальную ДНК. Одна из множества систем выбирается в зависимости от конкретного случая. Критическими факторами могут быть, например, достигаемое число копий, доступные системы селекции, включая особенно антибиотические устойчивости, или культивируемость микроорганизмов, способных включать вектора.
Экспрессионные вектора могут, кроме того, регулироваться через изменения условий культивирования, например изменение плотности клеток или добавление конкретных соединений. Примером такого соединения является производная галактозы изопропил-β-D-тиогалактопиранозид (IPTG), которая применяется в качестве активатора бактериального лактозного оперона (lac оперон).
В другом варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что белок естественным образом не присутствует в микроорганизме, и/или вспомогательная протеаза естественным образом не присутствует в микроорганизме.
В этом отношении признак «естественным образом не присутствует» означает, что белок или вспомогательная протеаза не являются эндогенным белком или ферментом микроорганизма. Поэтому белок или вспомогательная протеаза не могут экспрессироваться в микроорганизме последовательностью нуклеиновой кислоты, которая является частью хромосомальной ДНК микроорганизма в форме дикого типа. Поэтому белок или вспомогательная протеаза и/или последовательность нуклеиновой кислоты, кодирующая белок или вспомогательную протеазу, не присутствуют в форме дикого типа микроорганизма и/или не могут быть выделены из формы дикого типа микроорганизма. Предпочтительно белок, естественным образом не присутствующий в микроорганизме, или вспомогательная протеаза, естественным образом не присутствующая в микроорганизме, или последовательность нуклеиновой кислоты, кодирующая белок ли вспомогательную протеазу, должны специфически вводиться в микроорганизм с применением способов на основе генетических технологий, так что микроорганизм должен быть обогащен белком или вспомогательной протеазой или последовательностью нуклеиновой кислоты, кодирующей белок или вспомогательную протеазу. Однако белок или вспомогательная протеаза могут естественным образом присутствовать в другом микроорганизме, относящемся к обсуждению, исключительно микроорганизме, используемом в методе.
Как белок, так и вспомогательная протеаза, могут не присутствовать естественным образом в микроорганизме. Однако, в альтернативном варианте выполнения настоящего изобретения, белок может естественным образом присутствовать в микроорганизме, и вспомогательная протеаза может не присутствовать естественным образом в микроорганизме. В другом альтернативном варианте выполнения настоящего изобретения белок может естественным образом не присутствовать в микроорганизме, и вспомогательная протеаза может естественным образом присутствовать в микроорганизме.
В другом варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что вспомогательная протеаза замещает по меньшей мере одну кодируемую хромосомой протеазу в микроорганизме. В этом случае, по меньшей мере одна существующая хромосомальная протеаза замещается гетерологичной протеазой, которая действует в качестве вспомогательной протеазы согласно настоящему изобретению. Предпочтительно последовательность нуклеиновой кислоты, кодирующая вспомогательную протеазу, вводится в хромосомальную последовательность нуклеиновой кислоты, кодирующую протеазу микроорганизма, в результате кодируемая хромосомой протеаза является функционально инактивированной. Микроорганизм экспрессирует вспомогательную протеазу вместо кодируемой хромосомой протеазы. Для экспрессии вспомогательной протеазы возможно применять оригинальный промотор, применяемый для кодируемой хромосомой протеазы, так что вторая экспрессионная конструкция содержит в этом случае не только последовательность нуклеиновой кислоты, кодирующую вспомогательную протеазу, но также промоторную последовательность кодируемой хромосомой протеазы, то есть естественную промоторную последовательность микроорганизма. Альтернативно, возможно применять промотор, специально предназначенный для вспомогательной протеазы, так что вторая экспрессионная конструкция не содержит в этом случае промоторную последовательность кодируемой хромосомой протеазы, помимо последовательности нуклеиновой кислоты, кодирующей вспомогательную протеазу. Предпочтительно вторая экспрессионная конструкция содержит в этом случае естественным образом не присутствующую промоторную последовательность микроорганизма. Если применяется промотор, специально предназначенный для вспомогательной протеазы, он предпочтительно вводится вместе с последовательностью нуклеиновой кислоты, кодирующей вспомогательную протеазу, в хромосомальную последовательность нуклеиновой кислоты, кодирующую протеазу микроорганизма. В другом альтернативном варианте выполнения настоящего изобретения, для экспрессии вспомогательной протеазы, возможно применение как кодируемой хромосомой протеазы, так и промотора, специально предназначенного для вспомогательной протеазы.
В другом варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что вспомогательная протеаза экспрессируется в микроорганизме в дополнение к кодируемым хромосомой протеазам. В этом случае дополнительная протеолитическая активность обеспечивается в микроорганизме гетерологичной протеазой, которая действует в качестве вспомогательной протеазы согласно настоящему изобретению. Поэтому вторая экспрессионная конструкция содержит предпочтительно по меньшей мере последовательность нуклеиновой кислоты, кодирующую вспомогательную протеазу, а также промотор, предназначенный для экспрессии вспомогательной протеазы. Предпочтительно вторая экспрессионная конструкция содержит в этом случае естественным образом не присутствующую промоторную последовательность микроорганизма.
В конкретном варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что вспомогательная протеаза замещает в микроорганизме по меньшей мере одну кодируемую хромосомой протеазу, которая содержит аминокислотную последовательность, обозначенную как SEQ ID NO. 2, до степени по меньшей мере 80% и, с возрастающим предпочтением, до степени по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и наиболее предпочтительно до степени 100%. Особенно предпочтительно кодируемая хромосомой протеаза имеет аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности, обозначенной как SEQ ID NO. 2, и идентична, с возрастающим предпочтением, до степени по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и, в частности, особенно предпочтительно до степени 100%. Особенно предпочтительно такая протеаза замещается в микроорганизме, которым является бактерия, более предпочтительно одна из рода Bacillus и, в контексте настоящего изобретения, предпочтительно Bacillus licheniformis.
В другом варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что экспрессия белка повышается посредством экспрессии вспомогательной протеазы. Как уже пояснено выше, экспрессия вспомогательной протеазы в предпочтительном варианте выполнения настоящего изобретения вызывает повышение выхода белкового продукта. Это достигается посредством повышенной экспрессии, то есть повышенного синтеза белка, микроорганизмом. Вспомогательная протеаза участвует в гидролизе белкового субстрата и приводит к, при необходимости вместе с другими кодируемыми хромосомой протеазами, улучшенному расщеплению белкового субстрата, который подается микроорганизму в ходе его культивирования. В результате больше необходимых молекул-предшественников, больше конкретных аминокислот доступны для синтеза белка.
Этот выход определяется скоростью транскрипции последовательности нуклеиновой кислоты, кодирующей белок, и ее трансляцией в целевой белок, то есть числом белков, создаваемых в единицу времени. Стадия трансляции включена в определение экспрессии. В качестве сравнения выступает способ, который отличается от способа согласно настоящему изобретению отсутствием вспомогательной протеазы. Такое сравнение осуществляется для микроорганизмов одного типа и при одинаковых условиях, для того чтобы обеспечить сопоставимость измерений.
В другом варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что белком является фермент, более конкретно протеаза, амилаза, целлюлаза, гемицеллюлаза, маннаназа, танназа, ксиланаза, ксантаназа, ксилоглюканаза, 6-глюкозидаза, пектиназа, каррагиназа, пергидролаза, оксидаза, оксидоредуктаза или липаза. Особенно предпочтительно белком является протеаза. Полученная протеаза (=целевая протеаза) затем одновременно также участвует в гидролизе белкового субстрата и может предпочтительно приводить к дальнейшему улучшенному расщеплению белкового субстрата.
Например, возможно применение способа согласно настоящему изобретению для получения предпочтительно упомянутых ниже ферментов.
Среди протеаз субтилизины являются предпочтительными. Их примерами являются субтилизины BPN' и Carlsberg, протеаза РВ92, субтилизины 147 и 309, щелочная протеаза из Bacillus lentus, субтилизин DY и ферменты, относящиеся к субтилазам, но не к субтилизинам в более узком смысле, к ним относятся термитаза, протеиназа К и протеазы 1W3 и TVV7. Субтилизин Carlsberg доступен в другой разработанной форме под торговым наименованием Alcalase® от Novozymes A/S, Bagsvrd, Denmark. Субтилизины 147 и 309 продаются компанией Novozymes под торговым наименованием Esperase® или Savinase®. Полученньши из DSM 5483 протеазами из Bacillus lentus являются варианты протеаз, известные под наименованием BLAP®. Другими предпочтительными протеазами являются, кроме того, ферменты, известные под названием PUR, например. Другими протеазами являются, кроме того, ферменты, доступные под торговыми наименованиями Dura2ym®, Relase®, Everlase®, Nafizym®, Natalase®, Kannase® и Ovozyme® от компании Novozymes, ферменты, доступные под торговыми наименованиями, Purafect®, Purafect® OxP, Purafect® Prime, Excellase® и Properase® от компании Genencor, фермент, доступный под торговым наименованием Protosol® от компании Advanced Biochemicals Ltd., Thane, India, фермент, доступный под торговым наименованием Wuxi® от компании Wuxi Snyder Bioproducts Ltd., China, ферменты, доступные под торговыми наименованиями, Proleather® и Protease Р® от компании Amano Pharmaceuticals Ltd., Nagoya, Japan, и фермент, доступный под торговым наименованием Proteinase К-16 от компании Као Corp., Tokyo, Japan. Также предпочтительными являются, кроме того, протеаза из Bacillus gibsonii и Bacillus pumilus, которые раскрываются в международных заявках на патент WO 2008/086916 и WO 2007/131656.
Примерами амилаз являются а-амилазы из Bacillus licheniformis, из Bacillus amyloliquefaciens или из Bacillus stearothermophilus и, в частности, также другие их разработки, улучшенные для применения в моющих средствах или очищающих средствах. Фермент из Bacillus licheniformis доступен от компании Novozymes под торговым наименованием Termamyi® и от Danisco/Genencor под торговым наименованием Purastar®ST. Далее разработанные продукты α-амилазы доступны от компании Novozymes под торговыми наименованиями Duramyl® и Termamyl®ultra, от Danisco/Genencor под торговым наименованием Purastar®OxAm и от Daiwa Seiko Inc., Tokyo, Japan, как Keistase®. α-Амилаза от Bacillus amyloliquefaciens продается компанией Novozymes под торговым наименованием BAN®, и производные варианты α-амилазы из Bacillus stearothermophilus подобным образом продаются компанией Novozymes под торговыми наименованиями BSG® и Novamyl®. Кроме того, α-амилазу из Bacillus sp.A 7-7 (DSM 12368) и циклодекстрин глюканотрансферазу (CGTase) из Bacillus agaradherens (DSM 9948) необходимо упомянуть. Подобным образом, подходящими являются конденсированные молекулы всех вышеупомянутых молекул. Более того, другие разработки α-амилазы из Aspergillus niger и A. Oryzae являются подходящими, причем указанные другие разработки доступны под торговыми наименованиями Fungamyl® от Novozymes. Другими предпочтительными коммерческими продуктами являются, например, амилаза Powerase® от Danisco/Genencor и амилазы Amylase-LT®, Stainzyme® и Stainzyme plu®, последние от Novozymes. Варианты этих ферментов, получаемые точечными мутациями, могут также быть получены согласно настоящему изобретению. Другие предпочтительные амилазы раскрываются в публикациях WO 00/60060, WO 03/002711, WO 03/054177 и WO 07/079938, описание которых включено в настоящую заявку в полном объеме посредством ссылки и релевантное содержание которых включено в настоящую заявку в полном объеме посредством ссылки. Амилазами, получаемыми согласно настоящему изобретению, являются, кроме того, предпочтительно α-амилазы.
Примерами липаз или кутиназ являются липазы, доступные в неизмененном виде, или далее усовершенствованные, из Humicola lanuginosa (Thermomyces lanuginosus), более конкретно с аминокислотным замещением D96L. Они продаются, например, компанией Novozymes под торговыми наименованиями Lipolase®, Lipolase®Ultra, LipoPrime®, Lipozyme® и Lipex®. Кроме того, возможно получить, например, кутиназы, которые были первоначально выделены из Fusarium solani pisi и Humicola insolens. Из Danisco/Genencor возможно получить, например, липазы или кутиназы, исходные ферменты которых были первоначально выделены из Pseudomonas mendocina и Fusarium solanii. Другими важными коммерческими продуктами, которые необходимо упомянуть, являются препараты Ml Lipase® и Lipomax®, первоначально продаваемые Gist-Brocades (сейчас Danisco/Genencor), и ферменты, продаваемые Meito Sangyo KK, Japan, под торговыми наименованиями Lipase MY-30®, Lipase OF® и Lipase PL®, и, кроме того, продукт Lumafast® от Danisco/Genencor.
Примеры целлюлаз (эндоглюканаз, EG) содержат последовательности грибковых эндоглюканаза(ЕС)-обогащенных целлюлазных препаратов, или другие их разработки, которые поставляются компанией Novozymes под торговым наименованием Celluzyme®. Продукты Endolase® и Carezyme®, подобным образом доступные от Novozymes, основываются на 50 кДа EG и 43 кДа EG, соответственно, от Humicola insolens DSM 1800. Другие коммерческие продукты указанной компании, которые могут быть получены, представляют собой Cellusoft®, Renozyme® и Celluclean®. Дополнительно возможно получение, например, целлюлазы, которые доступны от АВ Enzymes, Finland, под торговыми наименованиями Ecostone® и Biotouch® и которые по меньшей мере частично основаны на 20 кДа EG от Melanocarpus. Другие целлюлазы от АВ Enzymes представляют собой Econase® и Ecopulp®. Другими подходящими целлюлазами являются из Bacillus sp. CBS 670.93 и CBS 669.93, причем одна из Bacillus sp.CBS 670.93 доступна от Danisco/Genencor под торговым наименованием Puradax®. Другие коммерческие продукты Danisco/Genencor, которые могут быть получены, представляют собой "Genencor detergent cellulase L" и IndiAge Neutra.
Согласно настоящему изобретению также возможно получить варианты этих ферментов, получаемые точечными мутациями. Особенно предпочтительными целлюлазами являются варианты целлюлазы Thielavia terrestris, которые раскрываются в международном опубликованной заявке WO 98/12307, целлюлазы из Melanocarpus, более конкретно Melanocarpus albomyces, которые раскрываются в международной опубликованной заявке WO 97/14804, EGIII целлюлазы из Trichoderma reesei, которые раскрываются в европейской патентной заявке ЕР 1305432, или варианты, получаемые из них, более конкретно те, которые раскрываются в европейских патентных заявках ЕР 1240525 и ЕР 1305432, а также целлюлазы, которые раскрываются в международных публикациях WO 1992006165, WO 96/29397 и WO 02/099091. Описание указанных документов включено в настоящую заявку в полном объеме посредством ссылки, и релевантное содержание которых включено в описание настоящего изобретения в полном объеме посредством ссылки.
Кроме того, возможно получить другие ферменты, которые охватываются термином гемицеллюлазы. Они включают, например, маннаназы, ксантанлиазы, ксантаназы, пектинлиазы (=пектиназы), пектинэстеразы, пектатлиазы, ксилоглюканазы, ксиланазы, пуллюланазы и п-глюканазы. Ферментами, подходящими в этом отношении, являются доступные под торговым наименованием Gamanase®, Pektinex AR® и Pectaway® от Novozymes, под наименованием Rohapec® B1L от АВ Enzymes и под торговым наименованием Pyrofase® от Diversa Corp., San Diego, CA, USA. п-Глюканазы, полученная от Bacillus subtilis, доступна под торговым наименованием Cereflo® от Novozymes. Гемицеллюлазами, особенно предпочтительными согласно настоящему изобретению, являются маннаназы, которые продаются, например, под торговыми наименованиями Mannaway® от Novozymes или Purabrite® от Genencor.
Кроме того, также возможно получать оксидоредуктазы, например оксидазы, оксигеназы, каталазы, пероксидазы, такие как галопероксидазы, хлорпероксидазы, бромпероксидазы, лигнинпероксидазы, глюкозопероксидазы или марганец пероксидазы, диоксигеназы или лакказы (фенолоксидазы, полифенолоксидазы). Подходящими коммерческими продуктами, которые необходимо упомянуть, являются Demlite 1 и 2 от Novozymes. Другие ферменты раскрываются в международных патентных заявках WO 98/45398, WO 2005/056782, WO 2004/058961 и WO 2005/124012.
В другом варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что микроорганизмом является бактерия.
Бактерии являются предпочтительными микроорганизмами в способе согласно настоящему изобретению. Бактерии имеют непродолжительное время генерации и незначительные потребности в отношении условий культивирования. В результате возможно получить низкозатратные способы культивирования или способы получения. Кроме того, в случае бактерий в ферментационной технологии специалисты в данной области техники имеют богатейший опыт. Подходящими могут быть как грамотрицательные, так и грамположительные бактерии.
В случае грамотрицательных бактерий, например Escherichia coli, многообразие белков секретируется в периплазматическое пространство, то есть в компартмент между двумя мембранами, заключающими клетки. Это может быть предпочтительно для конкретных применений. Кроме того, также возможно конфигурировать грамотрицательные бактерии таким образом, что они способны секретировать экспрессированные белки не только в периплазматическое пространство, но также и в среду, окружающую бактерии. Напротив, грамположительные бактерии, например Bacilli, или микроорганизмы, такие как Actinomycetaceae или другие представители Actinomycetales, не имеют внешней мембраны, и поэтому секретированные белки немедленно высвобождаются в среду, окружающую бактерии, в общем культуральную среду, от которой экспрессированные белки могут быть очищены. Они могут быть выделены прямо среды или далее процессироваться.
Предпочтительные согласно настоящему изобретению бактерии выбираются из группы родов Escherichia, Klebsiella, Burkholderia, Bacillus, Staphylococcus, Corynebakterium, Arthrobacter, Streptomyces, Stenotrophomonas, Pseudomonas и Vibrio. Особенно предпочтительно, бактерией является выбранная из группы Escherichia coli, Klebsiella planticola, Burkholderia glumae. Bacillus licheniformis, Bacillus lentus, Bacillus amyloliquefaciens. Bacillus subtilis. Bacillus alcalophilus, Bacillus globigii. Bacillus gibsonii. Bacillus pumilus, Staphylococcus camosus, Corynebacterium glutamicum, Arthrobacter oxidans, Streptomyces lividans, Streptomyces coelicolor, Stenotrophomonas maltophilia и Vibrio metschnikovii. Особенно предпочтительными являются Bacillus licheniformis.
Однако микроорганизмом может также быть эукариотическая клетка, отличающаяся тем, что она имеет ядро. В отличие от прокариотических клеток, эукариотические клетки способны к посттрансляционной модификации сформированного белка. Их примерами являются грибы, такие как Actinomycetaceae, или дрожжи, такие как Saccharomyces или Kluyveromyces. Это может быть особенно предпочтительным, когда, например, белки должны подвергаться, в сочетании с их синтезом, специфическим модификациям, которые обеспечиваются такими системами. Модификации, которые эукариотические системы осуществляют в особенности в сочетании с синтезом белков, включают, например, связывание низкомолекулярных соединений, таких как мембранные якоря или олигосахариды. Такие олигосахаридные модификации могут, например, быть желательны для уменьшения аллергенности экспрессированного белка. Совместная экспрессия с ферментами, естественным образом формируемыми такими клетками, например целлюлазами или липазами, также может быть предпочтительна. Кроме того, термофильные грибковые экспрессионные системы могут, например, быть особенно подходящими для экспрессии резистентных к температуре белков или вариантов.
Микроорганизмы, подлежащие применению согласно настоящему изобретению, могут быть модифицированы с точки зрения их требований в отношении условий культивирования, могут иметь другие или дополнительные селекционные маркеры или могут экспрессировать еще другие или дополнительные белки. Более конкретно, микроорганизмами могут быть те, которые трансгенно экспрессируют множество целевых белков. Предпочтительно они секретируют белок (целевой белок) в среду, окружающую микроорганизм.
Микроорганизмы в способах согласно настоящему изобретению могут быть культивированы и ферментированы обычным образом, например в периодических системах или непрерывных системах. В первом случае подходящая культуральная среда инокулируется микроорганизмами, и белок собирается из среды после периода, который должен быть определен экспериментально. Непрерывная ферментация включает достижение стабильного состояния, в которой, сравнительно долгого периода, клетки частично умирают, а также растут снова, и сформированный белок может быть удален в то же время из среды.
Способами согласно настоящему изобретению предпочтительно являются ферментационные способы. Ферментационные способы, среди прочего, известны из уровня техники и составляют фактическую стадию промышленного производства, в общем, после подходящего способа очистки полученного белка. Все ферментационные способы, включающие способ согласно настоящему изобретению для получения белка, составляют варианты выполнения настоящего изобретения.
Способы ферментации, отличающиеся тем, что ферментация осуществляется через стратегию подвода, представляют собой конкретную возможность. В этом случае компоненты среды, которые потребляются непрерывной культурой, подаются дополнительно. В результате может быть получена значительно повышенная как плотность клеток, так и клеточная масса или сухая масса. Кроме того, ферментация может также быть разработана таким образом, что нежелательные метаболические продукты отфильтровываются или нейтрализуются буфера или противоинов, соответственно в каждом случае.
Полученный белок может быть собран из ферментационной среды. Такой способ ферментации предпочтителен после выделения белка из микроорганизма, то есть процессинга продукта из клеточной массы (сухой массы). Это может быть достигнуто, например, посредством обеспечения подходящих микроорганизмов одним или более подходящими маркерами секреции или механизмами и/или транспортными системами, так что микроорганизм секретирует белок в ферментационную среду. В отсутствие секреции альтернативно возможно выделить белок из клетки-хозяина, то есть очистить белок от клеточной массы, например посредством осаждения с сульфатом аммония или этанолом, или хроматографической очистки.
Настоящее изобретение, кроме того. обеспечивает микроорганизм, получаемый способом, содержащим стадии (а) введение в микроорганизм первой экспрессионной конструкции, которая кодирует белок; (b) введение в микроорганизм второй экспрессионной конструкции, которая кодирует вспомогательную протеазу, которая отличается о белка и которая содержит аминокислотную последовательность, указанную как SEQ ID NO. 1 (=Blap S), где вспомогательная протеаза имеет протеолитическую активность.
Следовательно, при этом речь идет обо всех микроорганизмах, которые могут применяться в способах согласно настоящему изобретению. Все факты, признаки и варианты выполнения, которые описаны для способов согласно настоящему изобретению, относятся также к этому объекту изобретения. Поэтому ссылка явно делается в этом месте на описание в соответствующем месте с указанием на то, что указанное описание также относится к микроорганизмам согласно изобретению.
Согласно особенно предпочтительным вариантам выполнения настоящего изобретения микроорганизмы согласно настоящему изобретению отличаются тем фактом, что
(a) белок естественным образом не присутствует в микроорганизме, и/или
(b) вспомогательная протеаза естественным образом не присутствует в микроорганизме, и/или
(c) вспомогательная протеаза замещает по меньшей мере одну кодируемую хромосомой протеазу в микроорганизме, или вспомогательная протеаза экспрессируется в микроорганизме в дополнение к кодируемым хромосомой протеазам, и/или
(d) экспрессия вспомогательной протеазы повышает экспрессию белка, и/или
(e) микроорганизмом является бактерия, предпочтительно выбранная из группы родов Escherichia, Klebsiella, Burkholderia, Bacillus, Staphylococcus, Corynebakterium, Arthrobacter, Streptomyces, Stenotrophomonas, Pseudomonas и Vibrio, более предпочтительно она выбирается из группы родов Escherichia coli, Klebsiella planticola, Burkholderia glumae, Bacillus licheniformis, Bacillus lentus, Bacillus amyloliquefaciens, Bacillus subtilis, Bacillus alcalophilus, Bacillus globigii, Bacillus gibsonii, Bacillus pumilus, Staphylococcus camosus, Corynebacterium glutamicum, Arthrobacter oxidans, Streptomyces lividans, Streptomyces coelicolor, Stenotrophomonas maltophilia и Vibrio metschnikovii. Особое предпочтение отдается Bacillus licheniformis.
Микроорганизмы согласно настоящему изобретению предпочтительно применяются в способах согласно настоящему изобретению для получения белка. Поэтому настоящее изобретение, кроме того, обеспечивает применение микроорганизма согласно настоящему изобретению для получения белка, более конкретно фермента.
Все факты, признаки и варианты выполнения, которые описаны для соответствующих изобретению способов или микроорганизмов, также относятся к данному объекту изобретения. Поэтому ссылка явно делается в этом месте на описание в соответствующем месте с указанием на то, что указанное описание также относится к применениям согласно изобретению.
Примеры
Все стадии молекулярно биологических методик осуществляются согласно стандартным способам, как раскрывается, например, в руководстве Fritsch, Sambrook and Maniatis "Molecular cloning: a laboratory manual". Cold Spring Harbor Laboratory Press, New York, 1989, или подобных релевантных работах. Ферменты, наборы и устройства применяются согласно инструкциям соответствующих производителей.
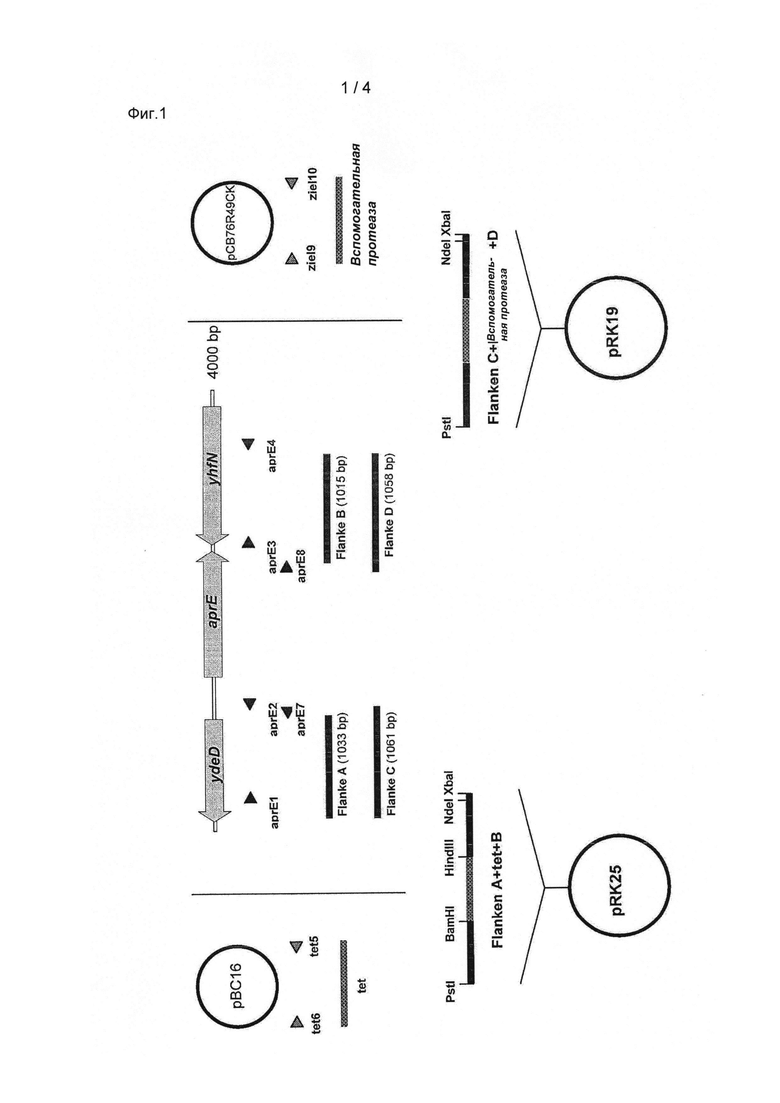
Пример 1: Замещение гена, кодирующего протеазу согласно SEQ ID NO. 2 (aprE) геном, кодирующим вспомогательную протеазу согласно SEQ IDNO.1, в Bacillus licheniformis.
Следующие олигонуклеотиды применялись в качестве праймеров (указано в 5'→3' ориентации):
aprE1 (SEQ ID NO. 3) AAACTGCAGCGTACCGGCTCCTTGAAAGG
aprE2 (SEQ ID NO. 4) GAGAAGACTAAGCTTCCCGAGGATCCCGAATGACAGG AGATTGCTCCATC
aprE3 (SEQ ID NO. 5) TTCGGGATCCTCGGGAAGCTTAGTCTTCTCATTCTGAT GAAGGTTGTTCAATATTTTGA ATCC
aprE4 (SEQ ID NO. 6) AAATCTAGATAGACCTCGAAGAGGAGAAGC tet5 (SEQ ID NO.7) GCGGATCCAAACGGGCCATATTGTTGTATAAG tet6 (SEQ ID NO.8) CCAAGCTTCTCTCGTATCTTTTATTCAGCAATCGC
aprE7 (SEQ ID NO. 9) CGAAAGTATGAATAGACCGCTTCAGCCTGGCAGGGAA AGAGGTCCCGAGG
aprE8 (SEQ ID NO. 10) CTGCCGCTCAATAACATATTCTAACAAATAGCATATAG AAAAAGCTAGTG
zie19 (SEQ ID NO. 11) CTGCCAGGCTGAAGCGGTCTATTCATACTTTCGAACTG AACATTTTTCTA
ziel10 (SEQ ID NO. 12) ATTTGTTAGAATATGTTATTGATCGGCAGCTTCGACAT TGATCAGACCTT
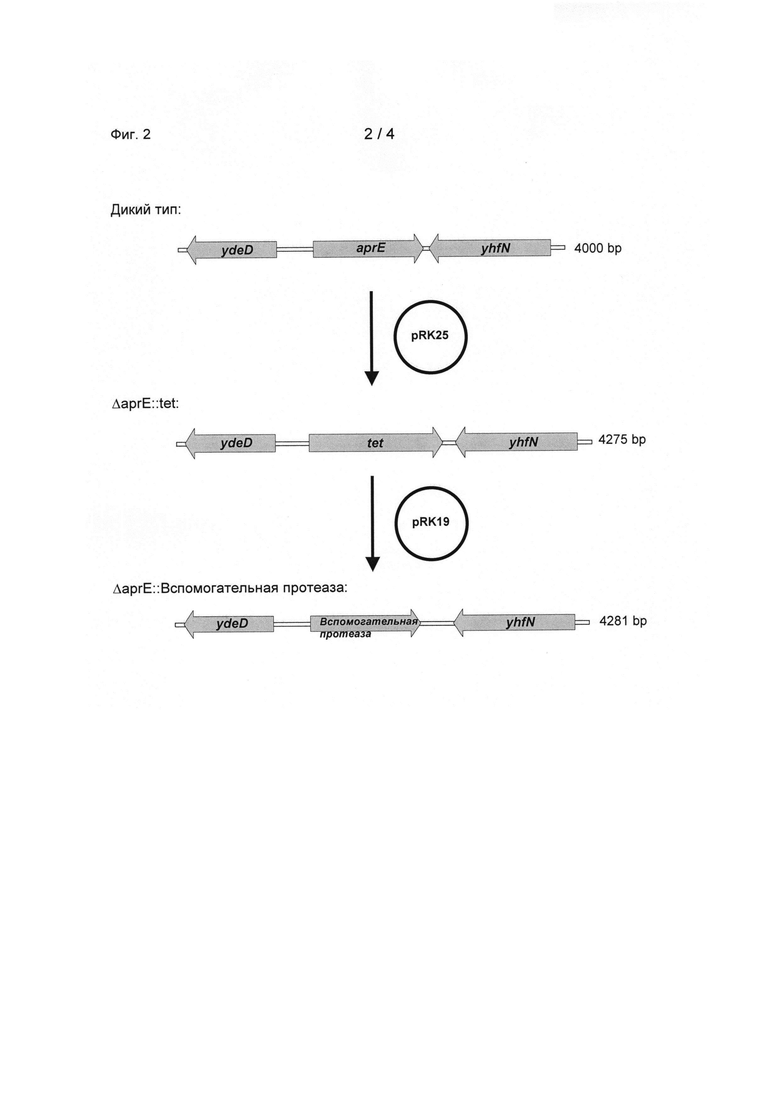
Замещение достигается с применением промежуточной стадии, в которой ген aprE сначала замещается резистентным к тетрациклину геном tet. Для замещения гена aprE геном tet праймеры aprE1 и aprE2 и праймеры aprE3 и aprE4 применялись для амплификации сегментов последовательности 1033 bp и 1015 bp, соответственно, в направлении в 3'-5' направлении и в направлении в 5'-3' от гена aprE (фланкирующие последовательности А и В). Благодаря соответствующим липким концам праймеров aprE2 и aprE3 две фланкирующие последовательности соединяются посредством полимеразной цепной реакции (ПЦР) слияния с применением внешних праймеров aprE1 и aprE4. Продукт 2018 ПЦР слияния клонировали в Pstl и Xbal сайты рестрикции вектора рЕ194 (Horinouchi & Weisblum, J. Bacteriol. (150), pages 804 fi. (1982)). Ген tet амплифицировали из плазмиды рВС16 (Bemhard et al., J. Bacteriol. (133), pages 897ff., (1978)) с применением праймеров tet5 и tet6 и клонировали в центральные сайты рестрикции BamHI и Hindlll слитых фланкирующих последовательностей aprE (смотрите Фиг.1). Полученная плазмида pRK25 была трансформирована в Bacillus licheniformis. Селекция достигалась как с 5 мкг/мл эритромицина, а также 15 мкг/мл тетрациклина при 30°С. После культивирования при 42°С клоны с интегрированным вектором идентифицировали посредством роста на 0.3 мкг/мл эритромицина. После возобновленного культивирования при 42°С, но без применения эритромицина, получили клоны, которые подвергли скринингу на резистентность к тетрациклину и посредством ПЦР на успешное замещение гена аргЕ геном tet (Bacillus licheniformis AaprE::tet, смотрите Фиг.2).
Для замещения гена tet геном, кодирующим вспомогательную протеазу согласно SEQ ID NO. 1, праймеры aprE1 и aprE7 и праймеры аргЕ8 и aprE4 применялись для амплификации сегментов последовательности 1061 bp и 1058 bp, соответственно, в направлении в 3'-5' направлении и в направлении в 5'-3' от гена aprE (фланкирующие последовательности С и D). Ген, кодирующий вспомогательную протеазу согласно SEQ ID NO. 1, амплифицировали из плазмиды pCB76R49CK с применением праймеров zie19 и zie110. Благодаря соответствующим липким концам праймеров aprE7 и zie19 и aprE8 и ziel10 две фланкирующие последовательности соединяются с продуктом ПЦР вспомогательной протеазой полимеразной цепной реакции (ПЦР) слияния с применением внешних праймеров aprEl и аргЕ4. Продукт 3704 bp ПЦР слияния клонировали в Pstl и Ndel сайты рестрикции вектора pRK25 (смотрите Фиг.1). Плазмида pRK19, полученная трансформацией в Bacillus lichenifbrmis AaprE::tet (смотрите выше). Селекцию обеспечили с применением 5 мкг/мл эритромицина при 30°С. После культивирования при 42°С клоны с интегрированньм вектором идентифицировали посредством роста на 0.3 мкг/мл эритромицина. После возобновленного культивирования при 42°С, но без применения антибиотика, получили клоны, которые подвергли скринингу посредством ПЦР на успешное замещение гена tet геном, кодирующим вспомогательную протеазу согласно SEQ ID NO. 1 (Bacillus lichenifbrmis AaprE:: вспомогательная протеаза, смотрите Фиг.2).
Пример 2:
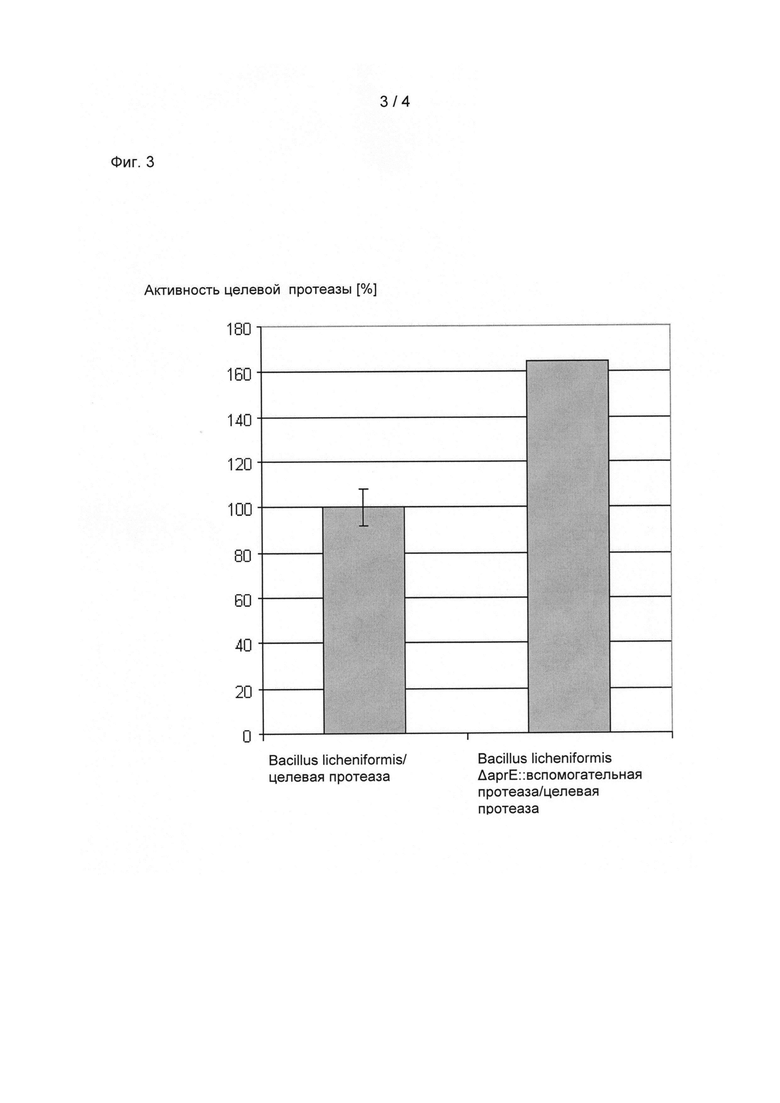
Ферментативное получение протеазы (целевого белка) с применением штамма-производителя Bacillus lichenifbrmis AaprE:: вспомогательная протеаза.
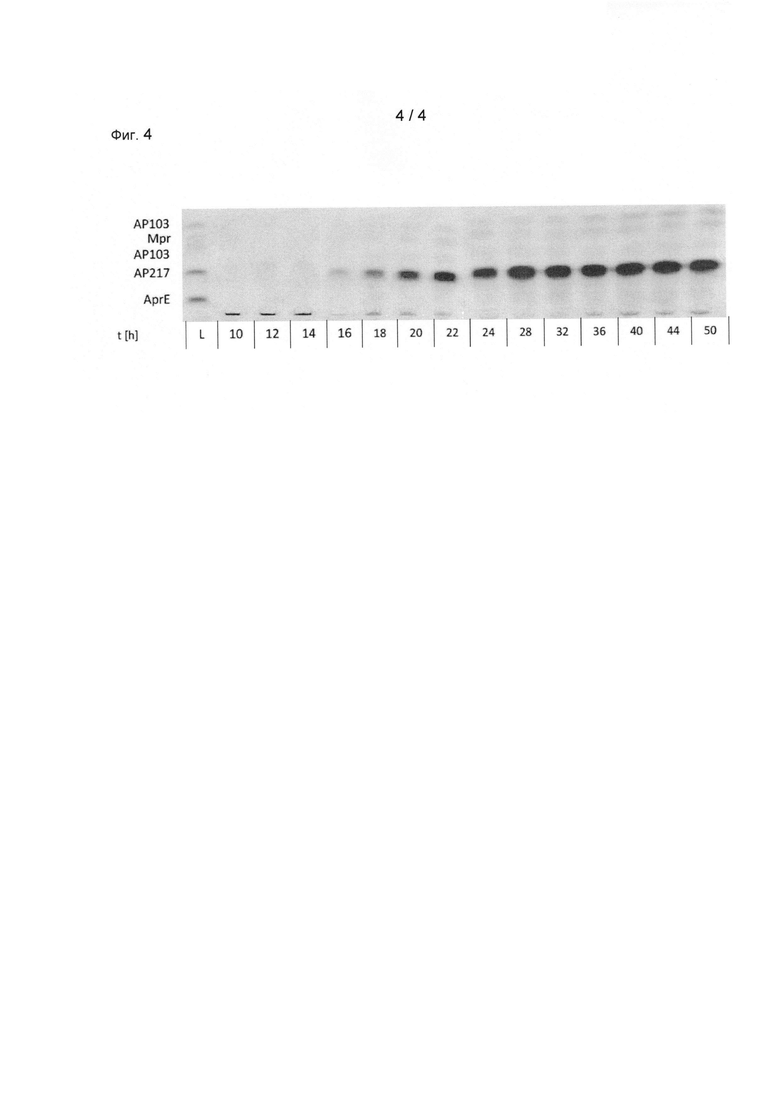
Исходные штамм Bacillus lichenifbrmis и мутант с замещением AaprE:: вспомогательная протеаза были трансформированы с применением плазмиды для получения протеазы (целевого белка). Полученные штаммы-производители применялись в стандартном способе ферментации и определяли полученные протеазные активности. По сравнению с исходным штаммом выход в лабораторном ферментере объемом 2 литра повысился на 65% (смотрите Фиг.3). Измеренные протеазные активности, по существу, основаны на активности целевой протеазы, так как экспрессия целевой протеазы была заметно повышена. Это исследовали посредством анализа секреции ферментационного супернатанта культуры Bacillus lichenifbrmis AaprE:: вспомогательная протеаза/целевая протеаза посредством нативного электрофореза на полиакриламидном геле (смотрите Фиг.4; t означает время культивирования; АР103 является вспомогательной протеазой (две линии); АР217 является целевой протеазой). По сравнению с целевой протеазой в культуральном супернатанте присутствует очень маленькое количество вспомогательной протеазы.
Описание чертежей
Фиг.1: Схема показывает конструкцию векторов pRK25 и pRK19 для хромосомного замещения гена, кодирующего протеазу согласно SEQ ID NO. 2 (aprE), резистентным к тетрациклину геном tet и геном, кодирующим вспомогательную протеазу согласно SEQ ID NO. 1, соответственно. Стрелки обозначают рамки считывания енов ydeD, aprE и yhfN, показывают праймеры и полосы показывают продукты ПЦР.
Фиг.2: Локализация гена aprE в Bacillus licheniformis. Показана ситуация для дикого типа (наверху), pRK-19-опосредованное замещение гена aprE резистентным к тетрациклину геном tet (посередине) и рКК25-опосредованное замещение резистентного к тетрациклину гена tet геном, кодирующим вспомогательную протеазу согласно SEQ ID NO. 1 (внизу).
Фиг.3: Относительные выходы штамма-производителя Bacillus licheniformis/целевая протеаза и Bacillus licheniformis AaprE:: вспомогательная протеаза/целевая протеаза. Штаммы применялись в стандартном способе ферментации для получения целевой протеазы.
Фиг.4: Анализ секреции ферментационного супернатанта в способе согласно настоящему изобретению или в микроорганизме согласно настоящему изобретению (Bacillus licheniformis AaprE:: вспомогательная протеаза/целевая протеаза, смотрите также Фиг.3) посредством нативного электрофореза на полиакриламидном геле. Повышенная протеазная активность, по существу, основана на активности целевой протеазы, так как ее экспрессия и секреция были существенно повышены (t: время культивирования; АР 103: вспомогательная протеаза (две полосы); АР217: целевая протеаза; Mpr: волнительный маркер размера).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭКСПРЕССИИ | 2013 |
|
RU2644199C2 |
| ЭКСПРЕССИОННЫЕ ВЕКТОРЫ ДЛЯ УЛУЧШЕННОЙ СЕКРЕЦИИ БЕЛКА | 2012 |
|
RU2661790C2 |
| Способы и композиции, содержащие варианты сериновой протеазы | 2012 |
|
RU2663114C2 |
| ФЕРМЕНТ ПРОТЕАЗА И ЕГО ПРИМЕНЕНИЯ | 2012 |
|
RU2611043C2 |
| СПОСОБ АМПЛИФИЦИРОВАНИЯ ЛОКУСОВ В БАКТЕРИАЛЬНОЙ КЛЕТКЕ | 2009 |
|
RU2577985C2 |
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2008 |
|
RU2536255C2 |
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2014 |
|
RU2733541C2 |
| ПОЛУЧЕНИЕ 1,4 ДИАМИНОБУТАНА | 2010 |
|
RU2577967C2 |
| СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ ИЛИ ПРЕВРАЩЕНИЯ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА | 2006 |
|
RU2441912C2 |
| УЛУЧШЕННАЯ ПРОДУКЦИЯ БЕЛКА В BACILLUS | 2008 |
|
RU2515112C2 |




Группа изобретений относится к области биотехнологии. Представлен способ получения белка протеазы посредством бактерии рода Bacillus путем введения в нее первой экспрессионной конструкции, которая кодирует целевой белок протеазу, и второй экспрессионной конструкции, которая кодирует отличную от целевого белка вспомогательную протеазу с аминокислотной последовательностью SEQ ID NO: 1, и дальнейшей экспрессии указанных протеаз в указанном микроорганизме. Представлен микроорганизм рода Bacillus для получения протеазы, включающий первую экспрессионную конструкцию, которая кодирует указанную целевую протеазу, и вторую экспрессионную конструкцию, которая кодирует отличную от целевого белка вспомогательную протеазу с аминокислотной последовательностью SEQ ID NO: 1. Группа изобретений позволяет повысить выход целевого белка протеазы при микробиологической ферментации. 3 н. и 5 з.п. ф-лы, 4 ил., 2 пр.
1. Способ получения белка посредством микроорганизма, включающий стадии:
(a) введение в микроорганизм первой экспрессионной конструкции, которая кодирует белок;
(b) введение в микроорганизм второй экспрессионной конструкции, которая кодирует вспомогательную протеазу, которая отличается от белка и которая содержит аминокислотную последовательность, обозначенную как SEQ ID NO. 1, при этом вспомогательная протеаза имеет протеолитическую активность;
(c) экспрессию белка и вспомогательной протеазы в микроорганизме,
причем
микроорганизмом является бактерия рода Bacillus,
вспомогательная протеаза замещает по меньшей мере одну кодируемую хромосомой протеазу в микроорганизме, и
белком является протеаза, которая естественным образом не присутствует в микроорганизме.
2. Способ по п.1, отличающийся тем, что вспомогательная протеаза естественным образом не присутствует в микроорганизме.
3. Способ по п.1, отличающийся тем, что вспомогательная протеаза замещает в микроорганизме по меньшей мере одну кодируемую хромосомой протеазу, которая содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности, обозначенной как SEQ ID NO. 2.
4. Способ по п.1, отличающийся тем, что экспрессия белка усиливается посредством экспрессии вспомогательной протеазы.
5. Способ по п.1, отличающийся тем, что микроорганизм выбирается из группы Bacillus licheniformis, Bacillus lentus, Bacillus amyloliquefaciens, Bacillus subtilis, Bacillus alcalophilus, Bacillus globigii, Bacillus gibsonii и Bacillus pumilus.
6. Микроорганизм для получения протеазы, получаемый способом, включающим стадии:
(a) введение в микроорганизм первой экспрессионной конструкции, которая кодирует белок;
(b) введение в микроорганизм второй экспрессионной конструкции, которая кодирует вспомогательную протеазу, которая отличается от белка и которая содержит аминокислотную последовательность, обозначенную как SEQ ID NO. 1, при этом вспомогательная протеаза имеет протеолитическую активность,
причем
микроорганизмом является бактерия рода Bacillus,
вспомогательная протеаза замещает по меньшей мере одну кодируемую хромосомой протеазу в микроорганизме, и
белком является протеаза, которая естественным образом не присутствует в микроорганизме.
7. Микроорганизм по п.6, отличающийся тем, что:
(b) вспомогательная протеаза естественным образом не присутствует в микроорганизме, и/или
(d) экспрессия вспомогательной протеазы усиливает экспрессию белка, и/или
(е) микроорганизм выбран из группы Bacillus licheniformis, Bacillus lentus, Bacillus amyloliquefaciens, Bacillus subtilis, Bacillus alcalophilus, Bacillus globigii, Bacillus gibsonii и Bacillus pumilus.
8. Применение микроорганизма по п.6 или 7 для получения протеазы.
| EP 1873251 А1, 02.01.2008 | |||
| WO 2009094084 А1, 30.07.2009 | |||
| Машина для изготовления валеных маншон | 1932 |
|
SU29599A1 |
| Машина для изготовления валеных маншон | 1932 |
|
SU29599A1 |
| RU 2009105503 A, 27.08.2010 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЛОГИЧНОГО БЕЛКА | 1994 |
|
RU2143495C1 |
Авторы
Даты
2018-01-24—Публикация
2012-04-05—Подача