Настоящее изобретение относится к биотехнологии, болеем конкретно к микробиологическому синтезу белков. Настоящее изобретение в частности относится к способу получения белков посредством генетически модифицированных микроорганизмов и, кроме того, обеспечивает микроорганизмы, которые применяются в таких способах. Настоящее изобретение дополнительно относится к применению таких микроорганизмов для получения белков.
Микроорганизмы могут применяться для получения ценных веществ. Ценными веществами являются, например, низкомолекулярные соединения, например, пищевые добавки или фармацевтически активные соединения, или белков, для которых, в свою очередь, существует большая промышленная область применения благодаря многообразию белков. Во-первых, метаболические свойства рассматриваемых микроорганизмов применяются и/или модифицируются для того, чтобы получить ценные вещества; во-вторых, предпочтительно применяются микроорганизмы, экспрессирующие гены представляющих интерес белков.
Для биотехнологического получения в промышленном масштабе, рассматриваемые микроорганизмы культивируются в ферментерах, которые адаптированы в соответствии с метаболическими свойствами микроорганизмов. В ходе культивирования, микроорганизмы метаболизируют подаваемый субстрат и образуют желательный продукт, который, после окончания ферментации, как правило отделяют от организмов-производителей и очищают и/или концентрируют из суспензии ферментера и/или ферментационной среды. При ферментативном получении белков, в качестве субстрата, как правило, применяется сложное богатое белками сырье в дополнение к источнику углерода (как правило, глюкоза). Получение белков, таким образом, соответствует биотрансформации белкового субстрата в целевой белок. Для этого требуется сложный гидролиз белкового субстрата в отдельные аминокислоты, которые затем доступны для биосинтеза целевого белка.
Для ферментации микроорганизмов имеется исчерпывающий уровень техники, который простирается от оптимизации рассматриваемых штаммов, например, с точки зрения скорости образования и использования питательных веществ, через техническое конструирование ферментеров для полученных ценных веществ из рассматриваемых микроорганизмов и/или ферментационной среды.
Применение бактерий при микробиологических ферментациях фундаментально описано. Бактерии характеризуются короткими временами генерации и низкими требованиями к условиям культивации. Следовательно, могут осуществляться экономичные способы культивации и/или способы получения. Более того, специалист в данной области техники имеет богатый опыт в отношении бактерий, применяемых в процессах ферментации. Предпочтение отдается грамположительным бактериям, так как они секретируют продуцируемый белок (целевой белок) в окружающую их среду.
Как правило, при микробиологической ферментации желательны очень высокие выходы продукта. Например, в международной патентной заявке WO 91/02792 рассматривается улучшенное ферментативное получение щелочной протеазы из Bacillus lentos в оптимизированном штамме Bacillus licheniformis под контролем генных регуляторных последовательностей из Bacillus licheniformis, более конкретно промотора Bacillus licheniformis.
Альтернативные для Bacillus licheniformis продуцирующие организмы, с помощью которых могут достигаться сравнительно высокие или даже улучшенные выходы продукта, в достаточной степени не описаны в уровне техники. Существует также большая необходимость в способах микробиологической ферментации, которые обеспечивают высокий выход продукта.
Задачей настоящего изобретения является повышение выхода продукта, в особенности белка, при микробиологической ферментации.
Настоящее изобретение обеспечивает способ получения белка посредством микроорганизма, содержащий следующие стадии:
(a) введение экспрессионной конструкции в микроорганизма, которая содержит промотор и нуклеиновую кислоту, кодирующую белок;
(b) Экспрессия белка в микроорганизме,
где микроорганизм относится к виду Bacillus pumilus.
Способ согласно настоящему изобретению необязательно дополнительно содержит дополнительную стадию способа (с) культивирования микроорганизма.
В предпочтительных вариантах выполнения настоящего изобретения способ согласно настоящему изобретению представляет собой ферментационный способ.
Неожиданно было обнаружено, что применение бактерий вида Bacillus pumilus в таком способе обеспечивает высокий выход продукта и поэтому является предпочтительным. Посредством применения Bacillus pumilus в качестве продуцирующего организма возможно обеспечение преимуществ, в частности увеличенного выхода продукта. Применяемым в качестве ссылочного в этом отношении является Bacillus licheniformis, продуцирующий организм, описанный в уровне техники, который промышленно применяется в большем ряде процессов микробиологический ферментации.
В предпочтительном варианте выполнения настоящего изобретения, способом согласно настоящему изобретению, поэтому является способ повышения экспрессии белка в микроорганизме. Имеется повышенная экспрессия белка, когда способ согласно настоящему изобретению обеспечивает большое количество белка по сравнению с подобным способом, который отличается от способа согласно настоящему изобретению только тем фактом, что применяются бактерии вида Bacillus licheniformis, предпочтительно дикого типа. Оба способа, которые сравниваются в этом отношении, применяются при идентичных условиях, которые являются настолько оптимальными, насколько возможно для микроорганизмов, и в течение одинакового периода времени.
Экспрессионная конструкция представляет собой последовательность нуклеиновой кислоты, которая обеспечивает возможность экспрессии белка в микроорганизме. Она содержит генетическую информацию, то есть последовательность нуклеиновой кислоты (ген), который кодирует белок. Экспрессия последовательности нуклеиновой кислоты представляет собой превращение в генный продукт (продукты), кодируемый указанной последовательностью, то есть в полипептид (белок) или во множество полипептидов (белков). Термины полипептид и белок применяются в описании настоящего изобретения в качестве синонимов. В целях настоящего изобретения, экспрессия, поэтому означает биосинтез рибонуклеиновой кислоты (РНК) и белков из генетической информации. В общем, экспрессия содержит транскрипцию, то есть синтез информационной рибонуклеиновой кислоты (мРНК) на основе ДНК (дезоксирибонуклеиновой кислоты) последовательности гена, и трансляцию мРНК в соответствующую полипептидную цепь, которая может быть дополнительно посттрансляционно модифицирована. Экспрессия белка соответственно описывает его биосинтез из генетической информации, которая присутствует согласно настоящему изобретению в микроорганизме.
Экспрессионная конструкция дополнительно содержит по меньшей мере одну последовательность нуклеиновой кислоты, предпочтительно ДНК, имеющую функцию контроля экспрессии последовательности нуклеиновой кислоты, кодирующей белок (известную как генная регуляторная последовательность). Генной регуляторной последовательностью является в этом случае любая последовательность нуклеиновой кислоты, которая, посредством ее присутствия в конкретном микроорганизме, воздействует на, предпочтительно повышает, скорость транскрипции той последовательности нуклеиновой кислоты, которая кодирует белок. Предпочтительно, это промоторная последовательность, так как такая последовательность необходима для экспрессии последовательности нуклеиновой кислоты. Однако экспрессионная конструкция согласно настоящему изобретению может также содержать другие генные регуляторные последовательности, например, одну или более энхансерных последовательностей. Поэтому экспрессионная конструкция в целях настоящего изобретения содержит функциональную единицу, состоящую из гена и промотора. Они могут, но не обязательно, присутствовать в качестве физического объекта.
Присутствие по меньшей мере одного промотора необходимо для экспрессионной конструкции согласно настоящему изобретению. Поэтому промотор, как понимается, означает ДНК последовательность, которая обеспечивает регуляторную экспрессию гена. Промоторная последовательность является природным компонентом гена и часто располагается на 5' его конце и поэтому перед РНК-кодирующей областью. Предпочтительно промоторная последовательность в экспрессионной конструкции согласно настоящему изобретению располагается на 5' против хода транскрипции последовательности нуклеиновой кислоты, кодирующей белок. Наиболее важным свойством промотора является специфическое взаимодействие с по меньшей мере одним ДНК-связывающим белком или полипептидом, который опосредует начало транскрипции гена посредством РНК полимеразы и обозначается как фактор транскрипции. Множество факторов транскрипции и/или других белков часто участвует в начале транскрипции посредством РНК полимеразы. Поэтому промотором предпочтительно является ДНК последовательность, имеющая промоторную активность, то есть ДНК последовательность. С которой связывается по меньшей мере один фактор транскрипции по меньшей мере временно, чтобы инициировать транскрипцию гена. Сила промотора измеряется скоростью транскрипции экспрессируемого гена, то есть числом РНК молекул, более конкретно молекул мРНК, образуемых в единицу времени. Промотором экспрессионной конструкции согласно настоящему изобретению может быть эндогенный промотор микроорганизма. Такая промоторная последовательность поэтому присутствует в микроорганизме естественным образом. Альтернативно, промотор экспрессионной конструкции согласно настоящему изобретению может также вводиться в микроорганизм рекомбинантным образом. Это также относится ко всем другим генным регуляторным последовательностям, которые может иметь экспрессионная конструкция согласно настоящему изобретению. Промотор в экспрессионной конструкции, как применяется в способе согласно настоящему изобретению. Вызывает экспрессию последовательности нуклеиновой кислоты, кодирующей белок (целевой белок) в экспрессионной конструкции.
В предпочтительном варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем, что промотор содержит последовательность нуклеиновой кислоты, которая выбирается из:
(a) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 1, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(b) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 2, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%,99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(c) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 3, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(d) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 4, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%.
В альтернативном варианте выполнения настоящего изобретения промотор имеет последовательность нуклеиновой кислоты как описано выше.
Было обнаружено, что особенно высокие выходы продукта белка могут быть достигнуты в способе согласно настоящему изобретению с такими промоторными последовательностями.
Предпочтительно промотор отличается тем, что он содержит последовательность нуклеиновой кислоты, идентичную последовательности нуклеиновой кислоты SEQ ID NO. 1, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%, и промотор вызывает скорость транскрипции гена, экспрессируемого им, которая соответствует по меньшей мере скорости транскрипции промотора согласно SEQ ID NO. 1. Альтернативно, промотор отличается тем, что он содержит последовательность нуклеиновой кислоты, идентичную последовательности нуклеиновой кислоты SEQ ID NO. 2, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%, и промотор вызывает скорость транскрипции гена, экспрессируемого им, которая соответствует по меньшей мере скорости транскрипции промотора согласно SEQ ID NO. 2.
Согласно другому альтернативному варианту выполнения настоящего изобретения промотор отличается тем, что он содержит последовательность нуклеиновой кислоты, идентичную последовательности нуклеиновой кислоты SEQ ID NO. 3, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%, и промотор вызывает скорость транскрипции гена, экспрессируемого им, которая соответствует по меньшей мере скорости транскрипции промотора согласно SEQ ID NO. 3.
Согласно другому альтернативному варианту выполнения настоящего изобретения промотор отличается тем, что он содержит последовательность нуклеиновой кислоты, идентичную последовательности нуклеиновой кислоты SEQ ID NO. 4, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%, и промотор вызывает скорость транскрипции гена, экспрессируемого им, которая соответствует по меньшей мере скорости транскрипции промотора согласно SEQ ID NO. 4.
В другом альтернативном варианте выполнения настоящего изобретения промотор имеет последовательность нуклеиновой кислоты как описано выше.
Идентичность последовательности нуклеиновой кислоты и аминокислотной последовательности определяется сравнением последовательностей. Такое сравнение достигается посредством принятия подобных последовательностей в нуклеотидных последовательностях или аминокислотных последовательностях одна другой. Указанное сравнение последовательностей предпочтительно осуществляется на основе алгоритма BLAST, который известен из уровня техники и обычно примнется (смотрите, например, Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, D.J. (1990) "Basic local alignment search tool." J. Mol. Biol. 215: 403-410, и Altschul, Stephan F., Thomas L. Madden, Alejandro A. Schaffer, Jinghui Zhang, Hheng Zhang, Webb Miller, and David J. Lipman (1997): "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs"; Nucleic Acids Res., 25, стр. 3389-3402), и осуществляется, главным образом, путем принятия подобных последовательностей нуклеотидов или аминокислот в последовательности нуклеиновых кислот или аминокислотных последовательностях друг другу. Ассигнование в форме таблицы рассматриваемых положений называется выравниванием. Другим доступным из уровня техники алгоритмом является алгоритм FASTA. Сравнения последовательностей - (выравнивания), более конкретно множество сравнений последовательностей, как правило, осуществляется с применением компьютерных программ. Часто применяемыми являются, например, серии Clustal (смотрите, например, Chenna et al. (2003): Multiple sequence alignment with the Clustal series of programs. Nucleic Acid Research 31, 3497- 3500), T-Coffee (смотрите, например, Notredame et al. (2000): T-Coffee: A novel method for multiple sequence alignments. J. Mol. Biol. 302, 205-217) или программы на основе указанных программ и алгоритмов. В целях настоящего изобретения сравнения последовательностей и выравнивания предпочтительно осуществляются с применением компьютерной программы Vector NTI Suite 10.3 (lnvitrogen Corporation, 1600 Faraday Avenue, Carlsbad, California, USA) с применение заданных стандартных параметров (по умолчанию).
Такое сравнение делает возможным выявление подобия сравниваемых последовательностей друг другу. Подобие, как правило, выражается в виде процента идентичности, то есть доли идентичных нуклеотидов или аминокислотных остатков в одинаковых положениях или положениях, соответствующих друг другу в выравнивании. Расширенный термин гомология учитывает консервативные аминокислотные замещения в случае аминокислотных последовательностей, то есть аминокислоты, имеющие подобные свойства, потому что они, как правило, осуществляют подобные активности или функции внутри белка. Поэтому подобие сравниваемых последовательностей может также быть представлено в виде процента гомологии или процента подобия. Значения идентичности и/или гомологии могут сообщаться для полипептидов или генов целиком или только для конкретных областей. Гомологичные или идентичные области различных последовательностей нуклеиновых кислот или аминокислотных последовательностей поэтому определяются сходством в последовательностях. Они часто имеют одинаковые или подобные функции. Они могут быть маленькими или содержать только несколько нуклеотидов или аминокислот. Такие маленькие области часто осуществляют существенные функции для всей активности белка. Поэтому можно рекомендовать для базовой последовательности сравнивать только конкретные возможно небольшие области. Если иного не указано, значение идентичности или гомологии в контексте настоящего изобретения относятся, однако, ко всей длине различных указанных последовательностей нуклеиновых кислот или аминокислотных последовательностей. В случае белков, более конкретно ферментов и, в контексте настоящего изобретения, особенно протеаз, значения также относятся к различным зрелым белкам, если иного не указано. Если иного не указано, взгляд на последовательность всегда направлен на зрелый полностью процессированный белок, даже если связанные гены кодируют незрелую форму, которая после трансляции далее процессирует в зрелую форму.
Экспрессионная конструкция, подлежащая введению в микроорганизм в способе согласно настоящему изобретению, также кодирует белок. Следовательно она содержит последовательность нуклеиновой кислоты, которая кодирует этот белок. Для этих целей, в принципе, может применяться любая желательная последовательность нуклеиновой кислоты, которая может транслироваться в белок. Согласно настоящему изобретению белком является белок, который должен быть получен с помощью способа согласно настоящему изобретению (целевой белок). Предпочтительно белком является фермент, особенно предпочтительно фермент как описано далее.
Нуклеиновые кислоты и экспрессионные конструкции согласно настоящему изобретению могут быть получены известными способами для модификации нуклеиновых кислот. Такими способами являются, например, представленные в относящихся к данной области техники руководствах, таких как руководство Fritsch, Sambrook и Maniatis, "Molecular cloning: a laboratory manual", Cold Spring Harbor Laboratory Press, New York, 1989, и известных специалистам в области биотехнологии. Примерами таких способов является химический синтез или полимеразная цепная реакция (PCR), при необходимости вместе с другими стандартными способами в молекулярной биологии и/или химии или биохимии.
Настоящее изобретение особенно подходит для рекомбинантного получения белков, более конкретно ферментов. С этой целью, экспрессионная конструкция вводятся в микроорганизм, предпочтительно посредством трансформации. В этом отношении, конкретная экспрессионная конструкция или ее части предпочтительно вводятся посредством векторов, более конкретно экспрессионных векторов. Однако также возможно только для частей экспрессионной конструкции, предпочтительно по меньшей мере нуклеиновой кислоты, кодирующей белок, вводиться в микроорганизм таким образом, что полная экспрессионная конструкция создается в микроорганизме. Это может, например, достигаться посредством вектора, который делает возможным введение гена для белка в клетку-хозяина в уже существующий генетический элемент, такой как хромосома, хромосомальная ДНК или другие вектора, так что, например, эндогенный промотор применяется для экспрессии гена для белка. Поэтому термин «введение» охватывает возможность, что экспрессионная конструкция вводится, предпочтительно трансформируется, полностью в микроорганизм, но также возможно, что только часть экспрессионной конструкции, особенно предпочтительно нуклеиновая кислота, кодирующая белок, вводится, предпочтительно трансформируется, в микроорганизм, и полная экспрессионная конструкция возникает только в микроорганизме. Однако в целях настоящего изобретения по меньшей мере часть экспрессионной конструкции всегда вводится в микроорганизм.
Вектора известны специалистам в области биотехнологии. В частности при применении в бактериях они представляют собой специфические плазмиды, то есть кольцевые генетические элементы. В целях настоящего изобретения экспрессионные конструкции предпочтительно клонируются в вектор. Вектора могут, например, включать те, которые происходят из бактериальных плазмид, из вирусов или из бактериофагов, или преимущественно синтетические вектора или плазмиды, содержащие элементы очень различного происхождения. Другие генетические элементы, присутствующие в каждом случае, обеспечивают создание векторов в микроорганизмах через множество генераций в виде стабильных единиц. В этом отношении, в целях настоящего изобретения не существенно создаются ли они внехромосомно в виде отдельных единиц или интегрируются а хромосому или хромосомальную ДНК. Одна из множества систем выбирается в зависимости от конкретного случая. Критическими факторами могут быть, например, достигаемое число копий, доступные системы селекции, включая особенно антибиотические устойчивости, или культивируемость микроорганизмов, способных включать вектора.
Экспрессионные вектора могут, кроме того, регулироваться через изменения условий культивирования, например, изменение плотности клеток или добавление конкретных соединений. Примером такого соединения является производная галактозы изопропил-β-D-тиогалактопиранозид (IPTG), которая применяется в качестве активатора бактериального лактозного оперона (lac оперон).
В другом варианте выполнения настоящего изобретения способ согласно настоящему изобретению отличается тем фактом, что белок естественным образом не присутствует в микроорганизме.
В этом отношении признак «естественным образом не присутствует» означает, что белок не является эндогенным белком или ферментом микроорганизма. Поэтому белок не может экспрессироваться в микроорганизме последовательностью нуклеиновой кислоты, которая является частью хромосомальной ДНК микроорганизма в форме дикого типа. Поэтому белок и/или последовательность нуклеиновой кислоты, кодирующая белок, не присутствую в форме дикого типа микроорганизма и/или не могут быть выделены из формы дикого типа микроорганизма. Предпочтительно белок, естественным образом не присутствующий в микроорганизме, или последовательность нуклеиновой кислоты, кодирующая белок, должны специфически вводиться в микроорганизм с применением способов на основе генетических технологий, так что микроорганизм должен быть обогащен белком последовательностью нуклеиновой кислоты, кодирующей белок. Однако белок может естественным образом присутствовать в другом микроорганизме, относящемся к обсуждению, исключительно микроорганизме, используемом в методе.
В другом варианте выполнения настоящего изобретения способ отличается тем, что белком является фермент, в частности кислотная целлюлаза, альфа-амилаза, альфа-ацетодекарбоксилаза, аминопептидаза, амилаза, арабаназа, бета-глюканаза, бета-глюкозидаза, бета-маннозидаза, карагиназа, карбогидраза, каталаза, целлобиоз-оксидаза, целлюлаза, химозин, эндо-1,3-бета-глюканаза, эндо-1,3(4)-бета-глюканаза, эндо-1,4-бета-ксиланаза, эндопептидаза, эстераза, эксопептидаза, G4-амилаза, глюкоамилаза, глюкозооксидаза, глюкозидаза, гликолипаза, гемицеллюлаза, лакказа, липаза, лизфосфолипаза, мальтогенная амилаза, маннаназа, нейтральная протеаза, нуклеаза, оксидаза, оксидоредуктаза, пектатлиаза, пектиназа, пектинэстераза, пентозаназа, пергидролаза, фосфолипаза, фитаза, полигалактуроназа, протеаза, протеиназа, пуллуланаза, фермент реннет, рамногалактуроназа, субтилизин, танназа, трансфераза, трансглутаминаза, ксантаназа, ксиланаза, ксилоглюканаза или их смеси. Особенно предпочтительно белком является протеаза. В особенно предпочтительных вариантах выполнения способа согласно настоящему изобретению продуцируемая протеаза (=целевая протеаза) также одновременно участвует в гидролизе белкового субстрата для микроорганизма и может предпочтительно приводить к дальнейшему улучшению расщепления белкового субстрата. Следовательно, в этом случае для микроорганизма доступны улучшенные питательные условия.
Например, возможно применение способа согласно настоящему изобретению для получения предпочтительно упомянутых ниже ферментов.
Среди протеаз субтилизины являются предпочтительными. Их примерами являются субтилизины BPN' и Carlsberg, протеаза РВ92, субтилизины 147 и 309, щелочная протеаза из Bacillus lentus, субтилизин DY и ферменты, относящиеся к субтилазам, но не к субтилизинам в более узком смысле, к ним относятся термитаза, протеиназа К и протеазы 1W3 и TVV7. Субтилизин Carlsberg доступен в другой разработанной форме под торговым наименованием Alcalase® от Novozymes A/S, Bagsvrd, Denmark. Субтилизины 147 и 309 продаются компанией Novozymes под торговым наименованием Esperase® или Savinase®. Полученными из DSM 5483 протеазами из Bacillus lentus являются варианты протеаз, известные под наименованием BLAP®. Другими предпочтительными протеазами являются, кроме того, ферменты, известные под названием PUR, например. Другими протеазами являются, кроме того, ферменты, доступные под торговыми наименованиями Durazym®, Relase®, Everlase®, Nafizym®, Natalase®, Kannase® и Ovozyme® от компании Novozymes, ферменты, доступные под торговыми наименованиями, Purafect®, Purafect® ОхР, Purafect® Prime, Excellase® и Properase® от компании Genencor/Danisco, фермент, доступный под торговым наименованием Protosol® от компании Advanced Biochemicals Ltd., Thane, India, фермент, доступный под торговым наименованием Wuxi® от компании Wuxi Snyder Bioproducts Ltd., China, ферменты, доступные под торгоыми наименованиями, Proleather® и Протеаза Р® от компании Amano Pharmaceuticals Ltd., Nagoya, Japan, и фермент, доступный под торговым наименованием, Протеиназа К-16 от компании Као Corp., Tokyo, Japan. Также предпочтительными являются, кроме того, протеаза из Bacillus gibsonii и Bacillus pumilus, которые раскрываются в международных заявках на патент W02008/086916 и W02007/131656.
Примерами амилаз являются α-амилазы из Bacillus licheniformis, из Bacillus amyloliquefaciens или из Bacillus stearothermophilus и, в частности, также другие их разработки, улучшенные для применения в моющих средствах или очищающих средствах. Фермент из Bacillus licheniformis доступен от компании Novozymes под торговым наименованием Termamyl® и от Danisco/Genencor под торговым наименованием Purastar®ST. Далее разработанные продукты α-амилазы доступны от компании Novozymes под торговыми наименованиями Duramyl® и Termamyl® ultra, от Danisco/Genencor под торговым наименованием Purastar®OxAm и от Daiwa Seiko Inc., Tokyo, Japan, как Keistase®. α-Амилаза от Bacillus amyloliquefaciens продается компанией Novozymes под торговым наименованием BAN®, и производные варианты α-амилазы из Bacillus stearothermophilus подобным образом продаются компанией Novozymes под торговыми наименованиями BSG® и Novamyl®. Кроме того, α-амилазу из Bacillus sp. А 7-7 (DSM 12368) и циклодекстрин глюканотрансферазу (CGTase) из Bacillus agaradherens (DSM 9948) необходимо упомянуть. Подобным образом, подходящими являются конденсированные молекулы всех вышеупомянутых молекул. Более того, другие разработки α-амилазы из Aspergillus niger и A. Oryzae являются подходящими, причем указанные другие разработки доступны под торговыми наименованиями Fungamyl® от Novozymes. Другими предпочтительными коммерческими продуктами являются, например, амилаза Powerase® от Danisco/Genencor и амлазы Амилаза-LT®, Stainzyme® и Stainzyme plu®, последние от Novozymes. Варианты этих ферментов, получаемые точечными мутациями, могут также быть получены согласно настоящему изобретению. Другие предпочтительные амилазы раскрываются в публикациях WO 00/60060, WO 03/002711, WO 03/054177 и WO 07/079938, описание которых включено в настоящую заявку в полном объеме посредством ссылки, и релевантное содержание которых включено в настоящую заявку в полном объеме посредством ссылки. Амилазами, получаемыми согласно настоящему изобретению, являются, кроме того, предпочтительно α-амилазы.
Примерами липаз или кутиназ являются липазы, доступные в неизмененном виде, или далее усовершенствованные, из Humicola lanuginosa (Thermomyces lanuginosus), более конкретно с аминокислотным замещением D96L. Они продаются, например, компанией Novozymes под торговыми наименованиями Lipolase®, Lipolase®Ultra, LipoPrime®, Lipozyme® и Lipex®. Кроме того, возможно получить, например, кутиназы, которые были первоначально выделены из Fusarium solani pisi и Humicola insolens. Из Danisco/Genencor возможно получить, например, липазы или кутиназы, исходные ферменты которых были первоначально выделены из Pseudomonas mendocina и Fusarium solanii. Другими важными коммерческими продуктами, которые необходимо упомянуть, являются препараты M1 Липаза® и Lipomax®, первоначально продаваемые Gist-Brocades (сейчас Danisco/Genencor), и ферменты, продаваемые Meito Sangyo КК, Japan, под торговыми наименованиями Липаза MY-30®, Липаза OF® и Липаза PL®, и, кроме того, продукт Lumafast® от Danisco/Genencor.
Примеры целлюлаз (эндоглюканаз, EG) содержат последовательности грибковых эндоглюканаза(ЕG)-обогащенных целлюлазных препаратов, или другие их разработки, которые поставляются компанией Novozymes под торговым наименованием Celluzyme®. Продукты Endolase® и Carezyme®, подобным образом доступные от Novozymes, основываются на 50 кДа EG и 43 кДа EG, соответственно, от Humicola insolens DSM 1800. Другие коммерческие продукты указанной компании, которые могут быть получены, представляют собой Cellusoft®, Renozyme® и Celluclean®. Дополнительно возможно получение, например, целлюлазы, которые доступны от АВ Enzymes, Finland, под торговыми наименованиями Ecostone® и Biotouch®, и которые по меньшей мере частично основаны на 20 кДа EG от Melanocarpus. Другие целлюлазы от АВ Enzymes представляют собой Econase® и Ecopulp®. Другими подходящими целлюлазами являются из Bacillus sp. CBS 670.93 и CBS 669.93, причем одна из Bacillus sp.CBS 670.93 доступна от Danisco/Genencor под торговым наименованием Puradax®. Другие коммерческие продукты Danisco/Genencor, которые могут быть получены, представляют собой "Genencor detergent целлюлаза L" и IndiAge Neutra.
Согласно настоящему изобретению также возможно получить варианты этих ферментов, получаемые точечными мутациями. Особенно предпочтительными целлюлазами являются варианты целлюлазы Thielavia terrestris, которые раскрываются в международном опубликованной заявке WO 98/12307, целлюлазы из Melanocarpus, более конкретно Melanocarpus albomyces, которые раскрываются в международной опубликованной заявке WO 97/14804, EGIII целлюлазы из Trichoderma reesei, которые раскрываются в европейской патентной заявке ЕР 1305432, или варианты, получаемые из них, более конкретно те, которые раскрываются в европейских патентных заявках ЕР 1240525 и ЕР 1305432, а также целлюлазы, которые раскрываются в международных публикациях WO 1992006165, WO 96/29397 и WO 02/099091. Описание указанных документов включено в настоящую заявку в полном объеме посредством ссылки, и релевантное содержание которых включено в описание настоящего изобретения в полном объеме посредством ссылки.
Кроме того, возможно получить другие ферменты, которые охватываются термином гемицеллюлазы. Они включают, например, маннаназы, ксантанлиазы, ксантаназы, пектинлиазы (=пектиназы), пектинэстеразы, пектатлиазы, ксилоглюканазы, ксиланазы, пуллюланазы и п-глюканазы. Ферментами, подходящими в этом отношении, являются доступные под торговым наименованием Gamanase®, Pektinex AR® и Pectaway® от Novozymes, под наименованием Rohapec® B1L от АВ Enzymes и под торговым наименованием Pyrofase® от Diversa Corp., San Diego, CA, USA. п-Глюканаза, полученная от Bacillus subtilis, доступна под торговым наименованием Cereflo® от Novozymes. Гемицеллюлазами, особенно предпочтительными согласно настоящему изобретению, являются маннаназы, которые продаются, например, под торговыми наименованиями Mannaway® от Novozymes или Purabrite® от Genencor.
Кроме того, также возможно получать оксидоредуктазы, например, оксидазы, оксигеназы, каталазы, пероксидазы, такие как галопероксидазы, хлорпероксидазы, бромпероксидазы, лигнинпероксидазы, глюкозопероксидазы или марганец пероксидазы, диоксигеназы или лакказы (фенолоксидазы, полифенолоксидазы). Подходящими коммерческими продуктами, которые необходимо упомянуть, являются Denilite 1 и 2 от Novozymes. Другие ферменты раскрываются в международных патентных заявках WO 98/45398, WO 2005/056782, WO 2004/058961 и WO 2005/124012.
В другом варианте выполнения настоящего изобретения способ отличается тем, что микроорганизмом является Bacillus pumilus DSM 14395. Этот штамм был депонирован 01.03.2001 в DSMZ (DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, InhoffenstraBe 7 B, 38124 Braunschweig, Deutschland) и был идентифицирован DSMZ как штамм Bacillus pumilus (DSM ID 01-197). Как показано в примерах, приведенных в настоящей заявке, с помощью этого штамма в процессах микробиологической ферментации были достигнуты очень хорошие выходы продукта.
В другом варианте выполнения настоящего изобретения, штамм, применяемый в способе согласно настоящему изобретению, является генетически модифицированным. В результате генетической модификации выход продукта предпочтительно еще повышается, или свойства продукта предпочтительно модифицируются. Продукт, как понимается в контексте настоящего изобретения, означает экспрессированный белок, который присутствует в ферментационной среде. Например, его запах уменьшается, его цвет ослабляется и/или продукт очищается (т.е. становится менее мутным) или его плотность уменьшается. Под генетической модификацией в этом отношении не подразумевается введение экспрессионной конструкции на стадии (а) способа. Скорее, микроорганизм вида Bacillus pumilus, применяемый в способе согласно настоящему изобретению, уже был генетически модифицирован до того, как экспрессионная конструкция вводится в микроорганизм на стадии (а) способа. Предпочтительно, наличие генетической модификации устанавливается по сравнению с Bacillus pumilus дикого типа, в частности Bacillus pumilus DSM 14395. Под генетической модификацией в этом отношении понимаются замещения, вставки и/или делеции. Предпочтительно генетическая модификация вызывает функциональное изменение, например функциональную дезактивацию, гена микроорганизма. Функциональное изменение, например, функциональная дезактивация, гена затем вызывает увеличение и/или улучшение продукции белка и поэтому улучшенный выход продукта и/или получение продукта с одним или более улучшенными свойствами. Функциональная дезактивация, как понимается, означает, что генный продукт (генные продукты), кодируемый (кодируемые) этим геном более не образуется (образуются) или образуется (образуются) в биологически неактивной форме, так что он (они) не может (могут) более выполнять свою функцию (функции) микроорганизме. В этом отношении, функциональная дезактивация гена может в частности осуществляться посредством полного или частичного замещения его на альтернативный ген. Этот альтернативный ген может затем экспрессироваться вместо первоначально присутствующего гена. Следовательно, первоначально присутствующий ген функционально дезактивируется, вместо этого экспрессируется альтернативный ген, и в результате происходит функциональное изменение. Альтернативным геном может быть ген, родственный первоначальному ген (более 50% идентичности с первоначальным геном) или ген, неродственный первоначальному гену (50% или менее идентичность с первоначальным геном). Например, альтернативный ген может вводиться в кодирующую последовательность первоначального гена посредством вставки. В результате, первоначальный ген функционально дезактивируется, и вместо него экспрессируется альтернативный ген. Генетическая последовательность может присутствовать либо в последовательности, кодирующей генный продукт, либо в ген-регуляторной последовательности, принадлежащей гену.
Микроорганизмы, применяемые согласно настоящему изобретению. Могут быть модифицированы, например, в отношении их требований к условиям культуры, могут быть модифицированы в отношении их поведения движения, также могут быть модифицированы в отношении их способности к спорообразованию, могут быть модифицированы в отношении определенного метаболического пути - например, для того чтобы подавить образование неприятного запаха в ходе ферментации -, или еще в отношении других или дополнительных маркеров секреции.
Генетически модифицируемыми в этом отношении являются все гены в штамме Bacillus pumilus, применяемом в способе согласно настоящему изобретению, для которых существует эквивалент в геноме Bacillus pumilus, который раскрывается в публикации Gioia et al., PLoS ONE, 9: e928 (2007). В этой публикации описывается первый геном Bacillus pumilus с полными последовательностями. Указанная публикация в полном объеме ее описания включена в настоящую заявку посредством ссылки.
Кроме того, все гены в штамме Bacillus pumilus, применяемом в способе согласно настоящему изобретению, для которых существует эквивалент в одном или более геномах приведенных далее микроорганизмов, могут быть генетически модифицированы:
Agrobacterium radiobacter К84, Agrobacterium tumefaciens str. C58, Agrobacterium vitis S4, Arcobacter butzleri ED-1, Arcobacter nitrofigilis DSM 7299, Arcobacter sp. L, Aromatoleum aromaticum EbNl, Arthrobacter aurescens TC1, Arthrobacter chlorophenolicus A6, Arthrobacter phenanthrenivorans Sphe3, Arthrobacter sp.FB24, Bacillus amyloliquefaciens DSM 7, Bacillus amyloliquefaciens FZB42, Bacillus anthracis str. Ames, Bacillus atrophaeus 1942, Bacillus cellulosilyticus DSM 2522, Bacillus cereus ATCC 10987, Bacillus cereus ATCC 14579, Bacillus cereus B4264, Bacillus clausii KSM-K16, Bacillus coagulans 36D1, Bacillus cytotoxicus NVH 391-98, Bacillus halodurans C-125, Bacillus licheniformis ATCC 14580, Bacillus megaterium DSM 319, Bacillus pseudofirmus OF4, Bacillus pseudomycoides DSM 12442 (305 parts in a CON entry), Bacillus pumilus SAFR-032, Bacillus selenitireducens MLS 10, Bacillus subtilis BSn5,, Bacillus subtilis subsp. spizizenii str. W23, Bacillus subtilis subsp.spizizenii TU-B-10), Bacillus subtilis subsp. subtilis RO-NN-1, Bacillus subtilis subsp. subtilis str. 168, Bacillus thuringiensis BMB1713, Bacillus thuringiensis serovar konkukian str. 97-27T, Bacillus thuringiensis serovar thuringiensis str. T01001, Bacillus tusciae DSM 2912, Bacillus weihenstephanensis KBAB4, Bifidobacterium adolescentis ATCC 15703, Bifidobacterium animalis subsp. lactis V9, Bifidobacterium bifidum PRL2010, Bifidobacterium breve UCC2003, Bifidobacterium dentium Bdl, Bifidobacterium longum DJO10A, Bifidobacterium longum NCC27051, Bifidobacterium longum subsp. infantis ATCC 15697, Bradyrhizobium sp. ORS 278, Brevibacillus brevis NBRC 100599, Corynebacterium aurimucosum ATCC 700975, Corynebacterium diphtheriae NCTC 13129, Corynebacterium efficiens YS-314, Corynebacterium glutamicum ATCC 13032, Corynebacterium glutamicum R, Corynebacterium jeikeium K411, Corynebacterium kroppenstedtii DSM 44385, Corynebacterium pseudotuberculosis FRC41, Corynebacterium resistens DSM 45100, Corynebacterium ulcerans BR-AD22, Corynebacterium urealyticum DSM 7109, Corynebacterium variabile DSM 44702, Desulfovibrio aespoeensis Aspo-2, Desulfovibrio alaskensis G20, Desulfovibrio desulftaricans subsp. desulfuricans str. ATCC 27774, Desulfovibrio magneticus RS-1, Desulfovibrio salexigens DSM 2638, Desulfovibrio vulgaris RCH1, Desulfovibrio vulgaris str. Miyazaki F, Desulfurobacterium thermolithotrophum DSM 11699, Enterobacter aerogenes KCTC 2190, Enterobacter asburiae LF7a, Enterobacter cloacae subsp.cloacae ATCC 13047 Enterobacter sp. 638 Escherichia coli 536, Escherichia coli APEC 01, Escherichia coli CFT073, Escherichia coli O103:H2 str. 12009, Escherichia coli SE11, Escherichia coli SE 15-, Escherichia fergusonii ATCC 35469T chromosome, Ethanoligenens harbinense YUAN-3, Eubacterium cylindroides T2-87 draft, Eubacterium eligens ATCC 27750, Eubacterium limosum KIST612, Eubacterium rectale M104/1 draft, Eubacterium siraeum 70/3 draft, Exiguobacterium sibiricum 255-15, Exiguobacterium sp. AT1b, Flavobacteriaceae bacterium 3519-10, Flavobacterium branchiophilum FL-15, Flavobacterium johnsoniae UW101, Flavobacterium psychrophilum JIP02/86, Geobacillus kaustophilus HTA426, Geobacillus sp. C56-T3, Geobacillus sp.WCH70, Geobacillus sp. Y4.1MC1, Geobacillus sp. Y412MC52 Geobacillus sp. Y412MC61, plasmid pGYMC6101, Geobacillus thermodenitrificans NG80-2, Geobacillus thermoglucosidasius C56-YS93, Geobacter bemidjiensis Bern Geobacter lovleyi SZ, Geobacter metallireducens GS-15 Geobacter sp. FRC-32, Geobacter sp. M18, Geobacter sp. M21, Geobacter sulfurreducens PCA, Geobacter uraniireducens Rf4, Gloeobacter violaceus PCC 74212, Gluconacetobacter diazotrophicus PA15, ATCC 49037, Gluconacetobacter xylinus NBRC 3288, Gluconobacter oxydans 621H, Hydrogenobaculum sp. Y04AAS1, Lactobacillus acidophilus 30SC, Lactobacillus amylovorus GRL 1112, Lactobacillus brevis ATCC 367, Lactobacillus buchneri NRRL B-30929, Lactobacillus casei ATCC 334, Lactobacillus casei BD-II, Lactobacillus casei BL23, Lactobacillus casei LC2W, Lactobacillus crispatus ST 10, Lactobacillus delbrueckii subsp. bulgaricus ND02, Lactobacillus fermentum CECT 5716, Lactobacillus gasseri ATCC 33323, Lactobacillus helveticus H10, Lactobacillus johnsonii NCC 533, Lactobacillus kefiranofaciens ZW3, Lactobacillus plantarum WCFS1, Lactobacillus reuteri SD2112, Lactobacillus rhamnosus GG, Lactobacillus rhamnosus GG ATCC 53103, Lactobacillus ruminis ATCC 27782, Lactobacillus sakei subsp. sakei 23K, Lactobacillus salivarius CECT 5713), Lactobacillus sanfranciscensis TMW 1.1304, Mannheimia succiniciproducens MBEL55E, Mycobacterium abscessus chromosome, Mycobacterium africanum GM041182, Mycobacterium avium 104, Mycobacterium bovis BCG str. Tokyo 172, Mycobacterium canettii CIPT 140010059, Mycobacterium gilvum PYR-GCK, Mycobacterium marinum M, Mycobacterium smegmatis str. MC2 155, Mycobacterium sp. JDM601, Mycobacterium sp. JLS, Mycobacterium sp. KMS, Mycobacterium sp. MCS, Mycobacterium sp. Spyrl, Mycobacterium vanbaalenii PYR-1, Pseudomonas aeruginosa NCGM2.S17, Pseudomonas brassicacearum subsp. brassicacearum NFM421, Pseudomonas entomophila L48 chromosome, Pseudomonas fluorescens Pf-5, Pseudomonas fulva 12-X, Pseudomonas mendocina NK-01, Pseudomonas putida KT2440+, Pseudomonas syringae pv. phaseolicola 1448A, Pseudomonas stutzeri DSM 4166, Pseudomonas syringae pv. syringae B728a+, Pseudomonas syringae pv. tomato str. DC3000/, Stenotrophomonas maltophilia K279a strain K279a, Streptobacillus moniliformis DSM 12112, Streptomyces avermitilis MA-4680, Streptomyces bingchenggensis BCW-1, Streptomyces cattleya NRRL 8057 main chromosome, Streptomyces clavuligerus ATCC 27064, Streptomyces coelicolor, Streptomyces flavogriseus ATCC 33331, Streptomyces griseus subsp.griseus NBRC 13350, Streptomyces scabiei 87.22, Streptomyces sp. SirexAA-E, Streptomyces venezuelae ATCC 10712, Streptomyces violaceusniger Tu 4113, Sulfobacillus acidophilus TPY, Thermobifida fusca YX, Thermotoga lettingae TMO, Thermotoga marítima MSB8, Thermotoga naphthophila RKU-10, Thermotoga neapolitana DSM 4359, Thermotoga petrophila RKU-1, Thermotoga sp. RQ2, Thermovibrio ammonifícans HB-1, Thermus thermophilus HB27, Xanthomonas albilineans, Xanthomonas axonopodis pv. citrumelo Fl), Xanthomonas axonopodis pv. citri str. 306/, Xanthomonas campestris pv. campestris str. 8004, Xanthomonas euvesicatoria, Xanthomonas oryzae pv. oryzae
Помимо процитированных публикаций, модифицируемые гены, в частности их последовательности, доступны в публично доступных базах данных, например, в базе данных KEGG (Kyoto Encyclopedia of Genes and Genomes) по ссылке http://vsrww.genome.jp/kegg или в базе данных NCBI (National Center for Biotechnology Information, U.S. National Library of Medicine, 8600 Rockville Pike, Bethesda, MD 20894, USA) по ссылке http://www.ncbi.nlm.nih.gov. База данных KEGG была разработана в 1995 лабораториями во главе с Kanehisa et al. „Куоtо University Bioinformatics Center" и „Нuman Genome Center of the University of Tokyo". Помимо отдельных генов эти базы данных также содержат информацию и последовательности для целых геномов или больших частей генома различных микроорганизмов.
Генетическая эквивалентность в контексте настоящей заявке характеризуется, прежде всего, наиболее высокой возможной гомологичностью последовательностей между геном штамма Bacillus pumilus, применяемого согласно настоящему изобретению, и геном штамма Bacillus pumilus, описанного Gioia et al. и/или геном микроорганизмов, приведенных выше. Во-вторых, генетическая эквивалентность характеризуется подобным видом функции, т.е. соответствующие друг другу гены штамма Bacillus pumilus, применяемого согласно настоящему изобретению, и штамма Bacillus pumilus, описанного Gioia et al., и/или микроорганизмов, приведенных выше, имеют подобный вид функции в соответствующем микроорганизме.
С помощью этой генной и/или геномной информации возможно идентифицировать соответствующий ген в штамме Bacillus pumilus, применяемом в способе согласно настоящему изобретению, посредством ссылки на сравнения последовательностей. На основе генетической информации, в частности информации о последовательности, из генома штамма Bacillus pumilus, описанного Gioia et al. и/или из генома приведенных выше микроорганизмов, специалист в данной области техники может установить, путем сравнения последовательностей и/или стандартной молекулярно-биологической методики, последовательность нуклеиновой кислоты с самым высоким соответствием последовательности в геноме штамма Bacillus pumilus, которая должна подвергаться генетической модификации и затем применяться в способе согласно настоящему изобретению. Подтверждение подобного вида функции, т.е. функциональной эквивалентности, может быть сделано посредством сравнительных экспериментов с соответствующими микроорганизмами, в которых, в каждом случае, ген, сравниваемый на основе сравнения последовательностей, является модифицированным (предпочтительно функционально дезактивированным) таким же образом, и наблюдается, есть ли одинаковый тип модификаций, в частности фенотипических модификаций, возникающих в обоих микроорганизмах. Если, например, модификация, в частности функциональная дезактивация, рассматриваемого гена в штамме Bacillus pumilus, описанном Gioia et al. и/или в приведенных выше микроорганизмах, связана с изменением метаболической активности, поведения подвижности или спорообразования, и если наблюдается соответствующее изменение в применяемом и модифицированном согласно настоящему изобретению штамме Bacillus pumilus, тогда это рассматривается как подтверждение правильного установления. Соответствующие способы являются стандартными в области генетики, в частности генетики микроорганизмов, и широко известны специалистам в этой области.
В особенно предпочтительном варианте выполнения настоящего изобретения спорообразование микроорганизма ингибировано. Это предпочтительно достигается посредством функциональной дезактивации его гена spoIV (yqfD) или его генетического эквивалента, особенно предпочтительно посредством делеции гена spoIV (yqfD) или его генетического эквивалента или его частей. Было обнаружено, что в случае штамма Bacillus pumilus, спорообразование которого ингибировано таким образом, в способе согласно настоящему изобретению достигается особенно высокий выход продукта.
Микроорганизмы в способах согласно настоящему изобретению могут быть культивированы и ферментированы обычным образом, например в периодических системах или непрерывных системах. В первом случае подходящая культуральная среда инокулируется микроорганизмами, и белок собирается из среды после периода, который должен быть определен экспериментально. Непрерывная ферментация включает достижение стабильного состояния, в которой, сравнительно долгого периода, клетки частично умирают, а также растут снова, и сформированный белок может быть удален в то же время из среды.
Способами согласно настоящему изобретению предпочтительно являются ферментационные способы. Ферментационные способы, среди прочего, известны из уровня техники и составляю фактическую стадию промышленного производства, в общем, после подходящего способа очистки полученного белка. Все ферментационные способы, включающие способ согласно настоящему изобретению для получения белка, составляют варианты выполнения способов настоящего изобретения.
Способы ферментации, отличающиеся тем, что ферментация осуществляется через стратегию подвода, представляют собой конкретную возможность. В этом случае компоненты среды, которые потребляются непрерывной культурой, подаются дополнительно. В результате может быть получена значительно повышенная как плотность клеток, так и клеточная масса или сухая масса. Кроме того, ферментация может также быть разработана таким образом, что нежелательные метаболические продукты отфильтровываются или нейтрализуются буфера или противоинов, соответственно в каждом случае.
Полученный белок может быть собран из ферментационной среды. Такой способ ферментации предпочтителен после выделения белка из микроорганизма, то есть процессинга продукта из клеточной массы (сухой массы). Это может быть достигнуто, например, посредством обеспечения подходящих маркеров секреции или механизмами и/или транспортными системами, так что микроорганизм секретирует белок в ферментационную среду. В отсутствии секреции альтернативно возможно выделить белок из клетки-хозяна, то есть очистить белок от клеточной массы, например, посредством осаждения с сульфатом аммония или этанолом, или хроматографической очистки.
Другим объектом настоящего изобретения является микроорганизм, который получают посредством способа, который охватывает следующие стадии:
(a) введение экспрессионной конструкции в микроорганизма, которая содержит промотор и нуклеиновую кислоту, кодирующую белок;
(b) экспрессия белка в микроорганизме,
где микроорганизм относится к виду Bacillus pumilus.
Следовательно, при этом речь идет обо всех микроорганизмах, которые могут применяться в способах согласно настоящему изобретению. Все факты, признаки и варианты выполнения, которые описаны для способов согласно настоящему изобретению, относятся также к этому объекту изобретения. Поэтому, ссылка явно делается в этом месте на описание в соответствующем месте с указанием на то, что указанное описание также относится к микроорганизмам согласно изобретению.
Особенно предпочтительные варианты выполнения микроорганизмов согласно настоящему изобретения отличаются тем, что:
(а) промотор содержит последовательность нуклеиновой кислоты, которая выбирается из:
(i) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 1, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(ii) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 2, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%,
(iii) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 3, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(iv) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 4, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%,
и/или
(b) белок естественным образом не присутствует в микроорганизме, и/или
(c) белком является фермент, в частности кислотная целлюлаза, альфа-амилаза, альфа-ацетодекарбоксилаза, аминопептидаза, амилаза, арабаназа, бета-глюканаза, бета-глюкозидаза, бета-маннозидаза, карагиназа, карбогидраза, каталаза, целлобиоз-оксидаза, целлюлаза, химозин, эндо-1,3-бета-глюканаза, эндо-1,3(4)-бета-глюканаза, эндо-1,4-бета-ксиланаза, эндопептидаза, эстераза, эксопептидаза, G4-амилаза, глюкоамилаза, глюкозооксидаза, глюкозидаза, гликолипаза, гемицеллюлаза, лакказа, липаза, лизфосфолипаза, мальтогенная амилаза, маннаназа, нейтральная протеаза, нуклеаза, оксидаза, оксидоредуктаза, пектатлиаза, пектиназа, пектинэстераза, пентозаназа, пергидролаза, фосфолипаза, фитаза, полигалактуроназа, протеаза, протеиназа, пуллуланаза, фермент реннет, рамногалактуроназа, субтилизин, танназа, трансфераза, трансглутаминаза, ксантаназа, ксиланаза, ксилоглюканаза, предпочтительно протеаза или альфа-амилаза, или их смеси,
и/или
(d) микроорганизмом является Bacillus pumilus DSM 14395, и/или
(e) спорообразование микроорганизма ингибировано, предпочтительно в результате модификации гена spoIV (yqfD), в частности в результате делеции гена spoIV (yqfD) или его частей, и/или
(f) микроорганизм является генетически модифицированным.
Наиболее предпочтительные варианты выполнения микроорганизмов согласно настоящему изобретения отличаются тем, что:
(а) промотор содержит последовательность нуклеиновой кислоты, которая выбирается из:
(i) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 1, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(ii) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 2, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%,
и/или
(b) белок естественным образом не присутствует в микроорганизме, и/или
(c) белком является протеаза, предпочтительно субтилизин, или альфа-амилаза и/или
(d) микроорганизмом является Bacillus pumilus DSM 14395, и/или
(e) спорообразование микроорганизма ингибировано, предпочтительно в результате модификации гена spoIV (yqfD), в частности в результате делеции гена spoIV (yqfD) или его частей, и/или
(f) микроорганизм является генетически модифицированным.
Другие особенно предпочтительные варианты выполнения микроорганизмов согласно настоящему изобретения отличаются тем, что:
(а) промотор содержит последовательность нуклеиновой кислоты, которая выбирается из:
(i) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 1, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(ii) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 2, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%,
(iii) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 3, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
(iv) Последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 4, на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%,
и/или
(b) белок естественным образом не присутствует в микроорганизме, и/или
(c) белком является альфа-амилаза
и/или
(d) микроорганизмом является Bacillus pumilus DSM 14395, и/или
(e) спорообразование микроорганизма ингибировано, предпочтительно в результате модификации гена spoIV (yqfD), в частности в результате делеции гена spoIV (yqfD) или его частей, и/или
(f) микроорганизм является генетически модифицированным.
Один особенно предпочтительный вариант выполнения микроорганизмов согласно настоящему изобретению, отличается тем, что:
(a) промотор содержит последовательность нуклеиновой кислоты, которая идентична последовательности нуклеиновой кислоты SEQ ID NO. 3 на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
и/или
(b) белок естественным образом не присутствует в микроорганизме, и/или
(c) белком является альфа-амилаза
и/или
(d) микроорганизмом является Bacillus pumilus DSM 14395, и/или
(e) спорообразование микроорганизма ингибировано, предпочтительно в результате модификации гена spoIV (yqfD), в частности в результате делеции гена spoIV (yqfD) или его частей, и/или
(f) микроорганизм является генетически модифицированным.
Другой особенно предпочтительный вариант выполнения микроорганизмов согласно настоящему изобретению, отличается тем, что:
(a) промотор содержит последовательность нуклеиновой кислоты, которая идентична последовательности нуклеиновой кислоты SEQ ID NO. 1 на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
и/или
(b) белок естественным образом не присутствует в микроорганизме, и/или
(c) белком является альфа-амилаза и/или
(d) микроорганизмом является Bacillus pumilus DSM 14395, и/или
(e) спорообразование микроорганизма ингибировано, предпочтительно в результате модификации гена spoIV (yqfD), в частности в результате делеции гена spoIV (yqfD) или его частей, и/или
(f) микроорганизм является генетически модифицированным.
Наиболее предпочтительный вариант выполнения микроорганизмов согласно настоящему изобретению, отличается тем, что:
(a) промотор содержит последовательность нуклеиновой кислоты, которая идентична последовательности нуклеиновой кислоты SEQ ID NO. 2 на по меньшей мере 80% и особенно предпочтительно на по меньшей мере 81,0%, 82,0%, 83,0%, 84,0%, 85,0%, 86,0%, 87,0%, 88,0%, 89,0%, 90,0%, 91,0%, 92,0%, 93,0%, 94,0%, 95,0%, 96,0%, 97,0%, 98,0%, 99,0%, 99,2%, 99,3%, 99,4%, 99,5% и наиболее предпочтительно на 100%;
и/или
(b) белок естественным образом не присутствует в микроорганизме, и/или
(c) белком является альфа-амилаза и/или
(d) микроорганизмом является Bacillus pumilus DSM 14395, и/или
(e) спорообразование микроорганизма ингибировано, предпочтительно в результате модификации гена spoIV (yqfD), в частности в результате делеции гена spoIV (yqfD) или его частей, и/или
(f) микроорганизм является генетически модифицированным.
Микроорганизмы согласно настоящему изобретению предпочтительно применяются в способах согласно настоящему изобретению для получения белка. Поэтому настоящее изобретение, кроме того, обеспечивает применение микроорганизма согласно настоящему изобретению для получения белка, более конкретно фермента.
Все факты, признаки и варианты выполнения, которые описаны для соответствующих изобретению способов или микроорганизмов, также относятся к данному объекту изобретения. Поэтому, ссылка явно делается в этом месте на описание в соответствующем месте с указанием на то, что указанное описание также относится к применениям согласно изобретению.
Примеры
Все стадии молекулярно биологических методик осуществляются согласно стандартным способам, как раскрывается, например, в руководстве Fritsch, Sambrook and Maniatis "Molecular cloning: a laboratory manual", Cold Spring Harbor Laboratory Press, New York, 1989, или подобных релевантных работах. Ферменты, наборы и устройства применяются согласно инструкциям соответствующих производителей.
Пример 1:
Сравнение ферментационного получения протеазы (целевой белок) с помощью Bacillus pumilus и Bacillus licheniformis
Три различные экспрессионные плазмиды, как приведено далее, которые в каждом случае содержат ген, кодирующий протеазу (целевой белок), а также функциональный промотор, были трансформированы как в штамм Bacillus licheniformis, так и в штамм Bacillus pumilus. Трансформированные штаммы применяли для ферментативного получения протеазы. Применяемый штамм Bacillus licheniformis раскрывается в международной заявке на патент WO 91/02792. Применяемым штаммом Bacillus pumilus был штамм Bacillus pumilus DSM 14395, в котором ген spoIV (yqfD) был функционально дезактивирован посредством делеции. Применяемыми промоторами были последовательности нуклеиновых кислот согласно SEQ ID NO. 1 и SEQ ID NO. 2. Промотор располагали в соответствующих экспрессионных плазмидах, в каждом случае у 5' -конца последовательности нуклеиновой кислоты, кодирующей протеазу. Применялись следующие плазмиды (Таблица 1):

После трансформации экспрессионных плазмид в соответствующие микроорганизмы, полученные продуцирующие штаммы применялись в стандартном процессе ферментации в лабораторном ферментере, объемом 2 л (время культуры 48 ч), и полученные протеазные активности определяли посредством высвобождения хромофор пара-нитроанилина (pNA) из субстрата suc-L-Ala-L-Ala-L-Pro-L-Phe-п-нитроанилид (AAPF). Протеаза расщепляет субстрат и высвобождает pNA. Высвобождение pNA вызывает увеличение поглощения при 410 нм, прогресс этого явления со временем является мерой ферментативной активности (смотрите Del Mar et al., 1979). Измерение осуществляется при температуре 25°С, при рН 8,6, и длине волны 410 нм. Время измерения составляет 5 минут, и интервал измерений составляет от 20 с до 60 с.
По сравнению с Bacillus licheniformis, выход в случае Bacillus pumilus в качестве продуцирующего организма значительно увеличился (смотрите Таблица 2). Приведенными значениями являются измеренные относительные протеазные активности для Bacillus pumilus, которые основаны на полученной протеазной активности для Bacillus licheniformis в каждом случае, которая принимается как 100%.

Пример 2:
В этом примере ферментативное получение протеазы (целевой белок) в Bacillus pumilus исследовали с экспрессионными конструкциями, которые содержали различные промоторы. Экспрессионные плазмиды 1 и 3 применяли с промоторами согласно SEQ ID NO. 1 и SEQ ID NO. 2, как описано в Примере 1. Другой применяемой экспрессионной плазмидой (контроль) была экспрессионная плазмида, которая отличалась от плазмид 1 и 3 тем фактом, что вместо промотора из Bacillus pumilus применялся промотор из Bacillus licheniformis, который раскрывается в международной заявке на патент WO 91/02792 (promotor of the АТСС 53926 alkaline protease gene"; смотрите Примеры 5, 6 и Фиг. 27 в WO 91/02792). Применяемым штаммом Bacillus pumilus, как и в Примере 1, был штамм Bacillus pumilus DSM 14395, в котором ген spoIV (yqfD) был функционально дезактивирован посредством делеции.
Этот штамм трансформировали конкретными экспрессионными плазмидами. Полученные продуцирующие штаммы применялись в стандартном процессе ферментации в лабораторном ферментере, объемом 2 л, и полученные протеазные активности определяли посредством высвобождения хромофор пара-нитроанилина (pNA) из субстрата suc-L-Ala-L-Ala-L-Pro-L-Phe-п-нитроанилид (AAPF), как описано в Примере 1. По сравнению с контрольным штаммом, выход с плазмидами 1 и 3 значительно увеличился (смотрите Таблицу 3). Приведенными значениями являются измеренные относительные протеазные активности для штаммов, содержащих плазмиды 1 и 3, которые основаны на полученной протеазной активности для контрольного штамма, которая принимается как 100%.

Пример 3:
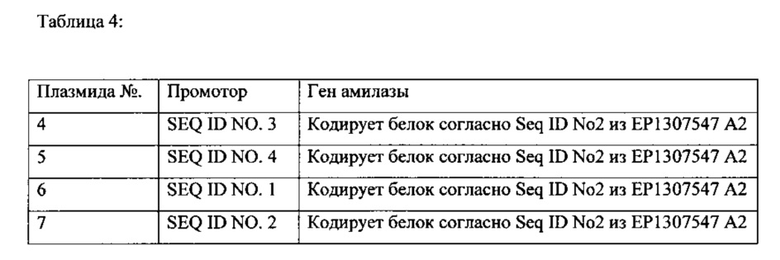
Две различные экспрессионные плазмиды, как приведено далее, которые в каждом случае содержат ген, кодирующий амилазу (целевой белок), а также функциональный промотор, были трансформированы как в штамм Bacillus licheniformis, так и в штамм Bacillus pumilus. Трансформированные штаммы применяли для ферментативного получения амилазы. Применяемый штамм Bacillus licheniformis раскрывается в международной заявке на патент WO 91/02792. Применяемым штаммом Bacillus pumilus был штамм Bacillus pumilus DSM 14395, в котором ген spoIV (yqfD) был функционально дезактивирован посредством делеции. Применяемыми промоторами были последовательности нуклеиновых кислот согласно SEQ ID NO. 3 и SEQ ID NO. 4 (амилазный промотор из Bacillus amyloliquefaciens, как описано в Palva,I., Pettersson,R.F., Kalkkinen,N., Lehtovaara,P., Sarvas,M., Soderlund,H., Takkinen,K. and Kaariainen,L. "Nucleotide sequence of the promoter and NH2-terminal signal peptide region of the alpha-amilase gene from Bacillus amyloliquefaciens"; Gene 15 (1), 43-51 (1981)).. Промотор располагали в соответствующих экспрессионных плазмидах, в каждом случае у 5' -конца последовательности нуклеиновой кислоты, кодирующей амилазу. Применялись следующие плазмиды (Таблица 4):
После трансформации экспрессионных плазмид в соответствующие микроорганизмы, полученные продуцирующие штаммы применялись в стандартном процессе ферментации в лабораторном ферментере, объемом 2 л (время культуры 48 ч), и определяли полученные амилазные активности
Для определения амилолитической активности в TAU применялся модифицированный п-нитрофенилмальтогептаозид, в котором терминальная единица глюкозы блокирована бензилиденовой группой; он расщепляется амилазой с образованием свободного п-нитрофенилолигосахарида, который, в свою очередь, превращается в глюкозу и п-нитрофенол посредством вспомогательных ферментов глюкоамилазы и альфа-глюкозидазы. Следовательно, количество высвободившегося п-нитрофенола пропорционально амилазной активности. Измерение осуществляется, например, с помощью набора для тестирования Quick-Start® от Abbott, Abott Park, Illinois, USA. Увеличение поглощения (405 нм) в тестируемой порции определяется при 37°С в течение 3 минут по сравнению с контрольным значением посредством фотометра. Калибровка осуществляется посредством фермента-стандарта с известной активностью (например, Maxamyl®/Purastar® 2900 от компании Genencor с 2900 TAU/g). Оценка осуществляется посредством нанесения на график разности поглощения dE (405 нм) в минуту относительно концентрации фермента стандарта.
В Таблице 5 приводятся измеренные относительные амилазные активности для Bacillus pumilus, которые основаны на амилазной активности для Bacillus licheniformis, полученной с плазмидой 4 (промотор согласно SEQ ID No 3), которая принималась как 100%.

Неожиданно было обнаружено, что промотор согласно Seq ID No 3 в В. pumilus (который, как правило, не продуцирует какую-нибудь свою собственную амилазу) является особенно подходящим для достижения очень высокого выхода гетерологически экспрессируемой амилазы.
Пример 4:
В этом примере ферментативное получение амилазы (целевой белок) в Bacillus pumilus исследовали с экспрессионными конструкциями, которые содержали различные промоторы. Экспрессионные плазмиды 4, 6 и 7 применяли с промоторами согласно SEQ ID NO. 3, 1 и SEQ ID NO. 2, как описано в Примере 3. Применяемым штаммом Bacillus pumilus, как и в Примере 1, был штамм Bacillus pumilus DSM 14395, в котором ген spoIV (yqfD) был функционально дезактивирован посредством делеции. Этот штамм трансформировали конкретными экспрессионными плазмидами. Полученные продуцирующие штаммы применялись в стандартном процессе ферментации в лабораторном ферментере, объемом 2 л, и полученные амилазные активности определяли как в Примере 3.
В Таблице 6 приводятся измеренные относительные амилазные активности для вышеуказанных штаммов В. Pumilus, содержащих плазмиды 4, 6 и 7, которые основаны на амилазной активности для штамма В. Pumilus, содержащего плазмиду 4, которая принималась как 100%.
По сравнению с плазмидой 4, которая уже является особенно подходящей для гетерологической экспрессии амилазы в В. pumilus (смотрите Таблицу 5), с плазмидой 7 был достигнут подобный высокий выход амилазы, а в случае плазмиды 6 был достигнут даже более высокий выход амилазы (смотрите Таблицу 6).

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭКСПРЕССИИ | 2012 |
|
RU2642324C2 |
| ЭКСПРЕССИОННЫЕ ВЕКТОРЫ ДЛЯ УЛУЧШЕННОЙ СЕКРЕЦИИ БЕЛКА | 2012 |
|
RU2661790C2 |
| УЛУЧШЕННАЯ ПРОДУКЦИЯ БЕЛКА В BACILLUS | 2008 |
|
RU2515112C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ЭНДОПЕПТИДАЗНОЙ АКТИВНОСТЬЮ, И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2011 |
|
RU2583293C2 |
| ФЕРМЕНТ ПРОТЕАЗА И ЕГО ПРИМЕНЕНИЯ | 2012 |
|
RU2611043C2 |
| ПОЛУЧЕНИЕ 1,4 ДИАМИНОБУТАНА | 2010 |
|
RU2577967C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ ТЕРМОСТАБИЛЬНЫХ СЕРИНОВЫХ ПРОТЕАЗ | 2017 |
|
RU2771261C2 |
| СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ ИЛИ ПРЕВРАЩЕНИЯ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА | 2006 |
|
RU2441912C2 |
| ТАНДЕМНЫЙ ПРОМОТОР, ФУНКЦИОНИРУЮЩИЙ В БАКТЕРИИ РОДА Bacillus, ТРАНСФОРМИРОВАННАЯ БАКТЕРИЯ РОДА Bacillus - ПРОДУЦЕНТ ЦЕЛЕВОГО ПРОДУКТА, СОДЕРЖАЩАЯ УКАЗАННЫЙ ПРОМОТОР, И СПОСОБ ПОЛУЧЕНИЯ ЦЕЛЕВОГО ПРОДУКТА С ИСПОЛЬЗОВАНИЕМ УКАЗАННОЙ БАКТЕРИИ | 2019 |
|
RU2723722C1 |
| БАКТЕРИОЦИН ПРОТИВ ЛИСТЕРИЙ | 2001 |
|
RU2250267C2 |

Изобретение относится к области биохимии, генной инженерии и биотехнологии, в частности к способу получения белка с помощью микроорганизма. Настоящий способ включает введение экспрессионной конструкции в микроорганизм, которая содержит промотор и нуклеиновую кислоту, кодирующую белок, и экспрессию белка в микроорганизме. Указанный способ отличается тем, что микроорганизм относится к виду Bacillus pumilus и его спорообразование ингибировано в результате делеции гена spoIV или его частей. Настоящий способ позволяет получать целевой белок с высоким выходом. 1 з.п. ф-лы, 6 табл., 4 пр.
1. Способ получения протеина с помощью микроорганизма, включающий стадии:
(a) введение экспрессионной конструкции в микроорганизм, которая содержит промотор и нуклеиновую кислоту, кодирующую белок;
(b) экспрессия белка в микроорганизме,
где микроорганизм относится к виду Bacillus pumilus и где спорообразование Bacillus pumilus ингибировано в результате делеции гена spoIV или его частей.
2. Способ по п. 1, отличающийся тем, что
(a) промотор содержит последовательность нуклеиновой кислоты, которая выбирается из:
(i) последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 1, на по меньшей мере 80%;
(ii) последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 2, на по меньшей мере 80%;
(iii) последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 3, на по меньшей мере 80%;
(iv) последовательности нуклеиновой кислоты, идентичной последовательности нуклеиновой кислоты SEQ ID NO. 4, на по меньшей мере 80%;
и/или
(b) белок естественным образом не присутствует в микроорганизме, и/или
(c) белком является фермент, в частности кислотная целлюлаза, альфа-амилаза, альфа-ацетодекарбоксилаза, аминопептидаза, амилаза, арабаназа, бета-глюканаза, бета-глюкозидаза, бета-маннозидаза, карагиназа, карбогидраза, каталаза, целлобиоз-оксидаза, целлюлаза, химозин, эндо-1,3-бета-глюканаза, эндо-1,3(4)-бета-глюканаза, эндо-1,4-бета-ксиланаза, эндопептидаза, эстераза, эксопептидаза, G4-амилаза, глюкоамилаза, глюкозооксидаза, глюкозидаза, гликолипаза, гемицеллюлаза, лакказа, липаза, лизофосфолипаза, мальтогенная амилаза, маннаназа, нейтральная протеаза, нуклеаза, оксидаза, оксидоредуктаза, пектатлиаза, пектиназа, пектинэстераза, пентозаназа, пергидролаза, фосфолипаза, фитаза, полигалактуроназа, протеаза, протеиназа, пуллуланаза, фермент реннет, рамногалактуроназа, субтилизин, танназа, трансфераза, трансглутаминаза, ксантаназа, ксиланаза, ксилоглюканаза, предпочтительно протеаза, или альфа-амилаза, или их смеси,
и/или
(d) микроорганизмом является Bacillus pumilus DSM 14395, и
(e) спорообразование Bacillus pumilus ингибировано в результате делеции гена spoIV (yqfD) или его частей, и/или
(f) микроорганизм является генетически модифицированным.
| CHEN Q et al., Study on Bacillus pumilus as a recipient strain for genetic engineering of Bacillus, Yi chuan xue bao, 1989 | |||
| YANG C et al., Cloning, characterization and application of the promoter of alkaline protease gene in Bacillus pumilus, Yi Chuan, 2007 | |||
| Feng Y et al., Fermentation of starch for enhanced alkaline protease production by constructing an alkalophilic Bacillus pumilus strain, Applied microbiology and biotechnology, 2001 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГИАЛУРОНАНА В РЕКОМБИНАНТНОЙ КЛЕТКЕ-ХОЗЯИНЕ | 2002 |
|
RU2346049C2 |
Авторы
Даты
2018-02-08—Публикация
2013-01-29—Подача