Область техники, к которой относится изобретение
Настоящее изобретение относится к новым антителам, связывающимся с фосфорилхолином (ФХ) и/или конъюгатами ФХ, и обладающим удивительно эффективными свойствами in vivo.
Предшествующий уровень техники
Перечисление или обсуждение в данном описании документа, явно опубликованного ранее, не обязательно является подтверждением того, что данный документ является частью существующего уровня техники или относится к общеизвестным знаниям.
Несмотря на доступные способы лечения сердечно-сосудистых заболеваний, острый коронарный синдром (ОКС) является главной причиной смерти в промышленно-развитых странах. ОКС происходит в результате образования тромба в полости коронарной артерии, что связано с хроническим воспалением стенки артерии. Воспаление артерии начинается с образования липидного ядра и инфильтрации воспалительных клеток, что приводит к образованию бляшки. Нестабильные бляшки содержат по существу некротизированное ядро и апоптотические клетки, разрушающие эндотелий и способные приводить к разрыву бляшки с обнажением подлежащего коллагена, фактора Виллебранда (фВ), тканевого фактора, липидов, и гладких мышц, обеспечивающих инициацию адгезии, активации и агрегации тромбоцитов (Libby et al. 1996. Macrophages and atherosclerotic plaque stability. Curr Opin Lipidol 7, 330-335 («Макрофаги и стабильность атеросклеротической бляшки»)). ОКС лечат с применением комбинации антитромбоцитарных средств, медикаментов для снижения холестерина (например, статинов), антикоагулянтов, а также хирургической реканализации посредством чрескожной коронарной ангиопластики (ЧКА) и имплантации стентов.
Антитромбоцитарные средства, такие как ингибиторы ЦОГ-1 (циклооксигеназы-1) (например, аспирин), антагонисты рецептора АДФ (например, тиклопедин и клопидогрел) и антагонисты гликопротеиновых рецепторов IIb/IIIa, как было показано, снижают частоту тяжелых сердечных приступов (ТСП) в ряде различных клинических испытаний (Dupont et al., 2009. ʺAntiplatelet therapies and the role of antiplatelet resistance in acute coronary syndromeʺ. Thromb Res 124, 6-13 («Антитромбоцитарная терапия и роль антитромбоцитарной резистентности при остром коронарном синдроме»)). Однако у части пациентов при долговременной антитромбоцитарной терапии продолжаются сердечно-сосудистые приступы. Далее, хроническая профилактическая терапия может занимать до двух лет, прежде чем будут достигнуты максимальные благоприятные эффекты, и многие пациенты подвержены высокому риску рецидива заболевания. Имеется период вплоть до 6-12 месяцев после инфаркта миокарда, когда пациент подвержен последующим тяжелым сердечным приступам, часто из-за повторной окклюзии, обусловленной рестенозом (Tabas. 2010. Macrophage death and defective inflammation resolution in atherosclerosis. Nat Rev Immunol 10, 36-46 («Гибель макрофагов и дефектное разрешение воспаления при атеросклерозе»)).
Соответственно, имеется существенная потребность в средствах лечения, направленных специально на профилактику дальнейшего прогрессирования развития бляшки и стимуляцию регрессии бляшки, позволяющую существенно уменьшить приступы во время этого периода.
Фосфорилхолин, группа полярной головки на некоторых фосфолипидах, играет существенную роль в сердечно-сосудистых заболеваниях. Активные формы кислорода, образуемые при коронарном воспалении, вызывают окисление липопротеина низкой плотности (ЛПНП) с образованием окисленного ЛПНП (оЛПНП). Фактически, сердечнососудистые заболевания (ССЗ), такие как атеросклероз, нестабильная стенокардия, или острый коронарный синдром, как было показано, связаны с повышенными уровнями о ЛПНП в плазме крови (Itabe and Ueda. 2007. Measurement of plasma oxidized low-density lipoprotein and its clinical implications. J Atheroscler Thromb 14, 1-11 («Измерение уровня окисленного липопротеина низкой плотности в плазме и его клиническое значение»)). ЛПНП является циркулирующей липопротеиновой частицей, содержащей липиды с ФХ группой полярной головки и белок апо-В100.
При окислении ЛПНП образуются ФХ-содержащие нео-эпитопы, не присутствующие в немодифицированном ЛПНП. Вновь экспонированный ФХ на оЛПНП распознается фагоцитарными рецепторами на макрофагах, такими как CD36, и образовавшийся о ЛПНП, поглощенный макрофагом, приводит к образованию провоспалительных пенистых клеток в стенке сосуда. Окисленный ЛПНП также распознается рецепторами на поверхности эндотелиальных клеток, и как отмечалось, стимулирует ряд ответов, включая эндотелиальную дисфункцию, апоптоз, и реакцию на несвернутые белки (Gora et al. 2010. Phospholipolyzed LDL induces an inflammatory response in endothelial cells through endoplasmic reticulum stress signaling. FASEB J 24(9):3284-97 («Фосфолиполизированный ЛПНП индуцирует воспалительный ответ в эндотелиальных клетках посредством передачи стрессовых сигналов через эндоплазматический ретикулум»)). ФХ нео-эпитопы также экспонируются на ЛПНП после модификации фосфолипазой А2 или аминовыми активными метаболитами заболеваний, такими как альдегиды, образуемые при окислении гликозилированных белков. Эти поочередно измененные частицы ЛПНП также являются провоспалительными факторами ССЗ.
Было показано, что антитела к фосфорилхолину (ФХ) связываются с окисленным или иным образом модифицированным ЛПНП и блокируют провоспалительную активность оЛПНП в исследованиях in vitro или на моделях in vivo (Shaw et al. 2000. Natural antibodies with the T15 idiotype may act in atherosclerosis, apoptotic clearance, and protective immunity. J Clin Invest 105, 1731-1740 («Натуральные антитела с T15 идиотипом могут действовать при атеросклерозе, апоптотическом расщеплении, и защитном иммунитете»); Shaw et al. 2001. Human-derived anti-oxidized LDL autoantibody blocks uptake of oxidized LDL by macrophages and localizes to atherosclerotic lesions in vivo. Arterioscler Thromb Vase Biol 21, 1333-1339 («Человеческие антитела к окисленным ЛПНП блокируют поглощение окисленных ЛПНП макрофагами и локализованы в атеросклеротических поражениях in vivo»)).
Далее, исследование клинических данных показало, что низкие уровни натуральных IgM анти-ФХ антител связаны с повышенным риском ТСП у больных с ОКС (Frostegard, J. 2010. Low level natural antibodies against phosphorylcholine: a novel risk market and potential mechanism in atherosclerosis and cardiovascular disease. Clin Immunol 134, 47-54 («Низкий уровень натуральных антител к фосфорилхолину: новый маркер риска и потенциальный механизм атеросклероза и сердечно-сосудистого заболевания»)).
Соответственно, имеется потребность в молекулах анти-ФХ антител, которые можно эффективно применять в терапии, в частности, полных человеческих анти-ФХ антителах, пригодных для лечения человека. Как известно авторам заявки, на сегодняшний день известный уровень техники не позволяет обеспечить терапевтически эффективные человеческие анти-ФХ антитела. Идентификация таких антител затруднена тем фактом, что способы скрининга человеческих антител с анти-ФХ-связывающей активностью in vitro плохо обеспечивают прогноз терапевтической активности in vivo.
С учетом этого, в данной области техники имеется потребность в молекулах человеческих анти-ФХ антител, обладающих эффективными и выгодными свойствами при использовании в системах in vivo, в частности, при использовании в лечении у человека.
Описание изобретения
Настоящая заявка описывает получение и анализ новых антител и фрагментов антител, содержащих новые антигенсвязывающие участки, способные связывать фосфорилхолин и/или конъюгаты фосфорилхолина.
В первом аспекте настоящее изобретение обеспечивает антитело или фрагмент антитела, способный связываться с фосфорилхолином и/или конъюгатом фосфорилхолина, где антитело или фрагмент антитела содержит вариабельный домен тяжелой цепи (VH) и/или вариабельный домен легкой цепи (VL), и где:
(a) VH домен содержит аминокислотную последовательность, включающую один, два, или предпочтительно три гипервариабельных участка (CDR), выбранных из группы, состоящей из:
- последовательности CDR1, содержащей аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17;
- последовательности CDR2, содержащей аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и
- последовательности CDR3, содержащей аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 19. 20, 21 или 22; и/или
(b) VL домен содержит аминокислотную последовательность, включающую один, два, или предпочтительно три гипервариабельных участка (CDR), выбранных из группы, состоящей из:
- последовательности CDR4, содержащей аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 23 или 24;
- последовательности CDR5, содержащей аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25;
- последовательности CDR6, содержащей аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26.
В одном варианте осуществления в соответствии с первым аспектом настоящего изобретения, антитело или фрагмент антитела содержит VH домен, включающий аминокислотную последовательность, содержащую последовательность CDR1, последовательность CDR2 и CDR3, как указано выше, и/или VL домен, включающий аминокислотную последовательность, содержащую последовательность CDR4, последовательность CDR5 и CDR6, как указано выше.
В другом варианте осуществления первого аспекта настоящего изобретения, антитело или фрагмент антитела включает:
- VH домен, содержащий аминокислотную последовательность, включающую все три из последовательностей CDR1, CDR2 и CDR3, присутствующие в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, или аминокислотной последовательности, обладающей по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью с аминокислотной последовательностью из любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15; и/или
- VL домен, содержащий аминокислотную последовательность, включающую все три из последовательностей CDR4, CDR5 и CDR6, присутствующие в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16, или аминокислотной последовательности, обладающей по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью с аминокислотной последовательностью из любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16.
В другом варианте осуществления первого аспекта настоящего изобретения антитело или фрагмент антитела включает вариабельный домен тяжелой цепи (VH) и/или вариабельный домен легкой цепи (VL), где:
- VH домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, или аминокислотную последовательность, обладающую по меньшей мере 50%, 60%, 70%, 80%, 85%, 90% или 95%-ной идентичностью аминокислотной последовательности к любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, или 15; и
- VL домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16, или аминокислотную последовательность, обладающей по меньшей мере 50%, 60%, 70%, 80%, 85%, 90% или 95%-ной идентичностью аминокислотной последовательности к любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16.
SEQ ID NO: 1 является вариабельным доменом тяжелой цепи (VH) антитела X19-А05, как описано в следующих примерах, и имеет последовательность:

и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVCSNAVCRPTAYDAFDI (SEQ ID NO: 19).
SEQ ID NO: 2 является вариабельным доменом легкой цепи (VL) антитела Х19-А05, и имеет последовательность:
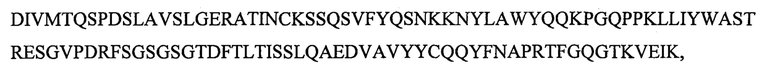
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYQSNKKNYLA (SEQ ID NO: 23);
VL CDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26).
SEQ ID NO: 3 является вариабельным доменом тяжелой цепи (VH) антитела М99-В05, как описано в следующих примерах, и имеет последовательность:

и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVCSNGVCRPTAYDAFDI (SEQ ID NO: 20),
SEQ ID NO: 4 является вариабельным доменом легкой цепи (VL) антитела М99-В05, и имеет последовательность:
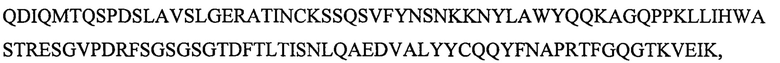
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYNSNKKNYLA (SEQ ID NO: 24);
VL CDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26),
SEQ ID NO: 5 является вариабельным доменом тяжелой цепи (VH) антитела X19-А01, как описано в следующих примерах, и имеет последовательность:
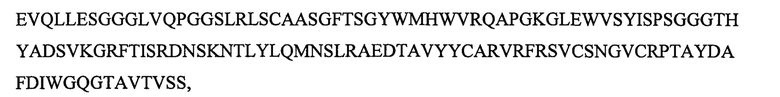
и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVCSNGVCRPTAYDAFDI (SEQ ID NO: 20).
SEQ ID NO: 6 является вариабельным доменом легкой цепи (VL) антитела Х19-А01, и имеет последовательность:
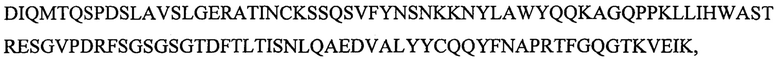
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYNSNKKNYLA (SEQ ID NO: 24);
VL CDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26),
SEQ ID NO: 7 является вариабельным доменом тяжелой цепи (VH) антитела X19-А03, как описано в следующих примерах, и имеет последовательность:
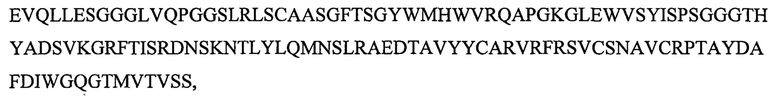
и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVCSNAVCRPTAYDAFDI (SEQ ID NO: 19).
SEQ ID NO: 8 является вариабельным доменом легкой цепи (VL) антитела Х19-А03, и имеет последовательность:
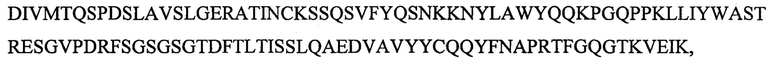
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYQSNKKNYLA (SEQ ID NO: 23);
VLCDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26).
SEQ ID NO: 9 является вариабельным доменом тяжелой цепи (VH) антитела X19-А07, как описано в следующих примерах, и имеет последовательность:

и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVCSNGVCRPTAYDAFDI (SEQ ID NO: 20),
SEQ ID NO: 10 является вариабельным доменом легкой цепи (VL) антитела X19-А07, и имеет последовательность:
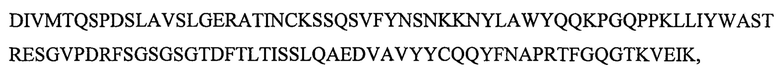
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYNSNKKNYLA (SEQ ID NO: 24);
VL CDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26).
SEQ ID NO: 11 является вариабельным доменом тяжелой цепи (VH) антитела X19-А09, как описано в следующих примерах, и имеет последовательность:

и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVCSNGVCRPTAYDAFDI (SEQ ID NO: 20),
SEQ ID NO: 12 является вариабельным доменом легкой цепи (VL) антитела X19-А09, и имеет последовательность:
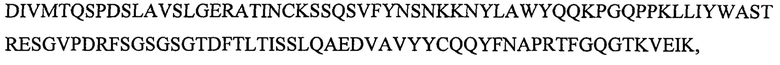
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYNSNKKNYLA (SEQ ID NO: 24);
VLCDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26),
SEQ ID NO: 13 является вариабельным доменом тяжелой цепи (VH) антитела X19-А11, как описано в следующих примерах, и имеет последовательность:

и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVSSNGVSRPTAYDAFDI (SEQ ID NO: 21).
SEQ ID NO: 14 является вариабельным доменом легкой цепи (VL) антитела X19-A11, и имеет последовательность:
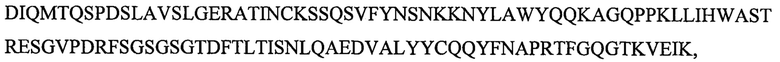
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYNSNKKNYLA (SEQID NO: 24);
VL CDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26).
SEQ ID NO: 15 является вариабельным доменом тяжелой цепи (VH) антитела X19-С01, как описано в следующих примерах, и имеет последовательность:
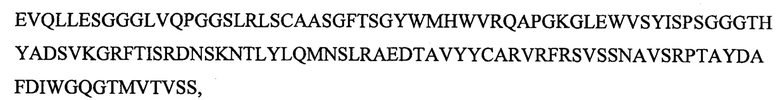
и включает гипервариабельные участки (CDR):
VH CDR1: GYWM (SEQ ID NO: 17);
VH CDR2: YISPSGGGTHYADSVKG (SEQ ID NO: 18);
VH CDR3: VRFRSVSSNAVSRPTAYDAFDI (SEQ ID NO: 22).
SEQ ID NO: 16 является вариабельным доменом легкой цепи (VL) антитела X19-С01, и имеет последовательность:
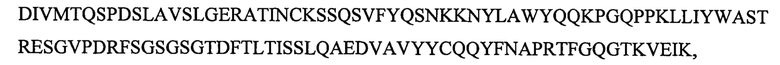
и включает гипервариабельные участки (CDR):
VL CDR4: KSSQSVFYQSNKKNYLA (SEQ ID NO: 23);
VL CDR5: WASTRES (SEQ ID NO: 25);
VL CDR6: QQYFNAPRT (SEQ ID NO: 26).
Итоговая сводка SEQ ID NO, как определено выше, показана далее:
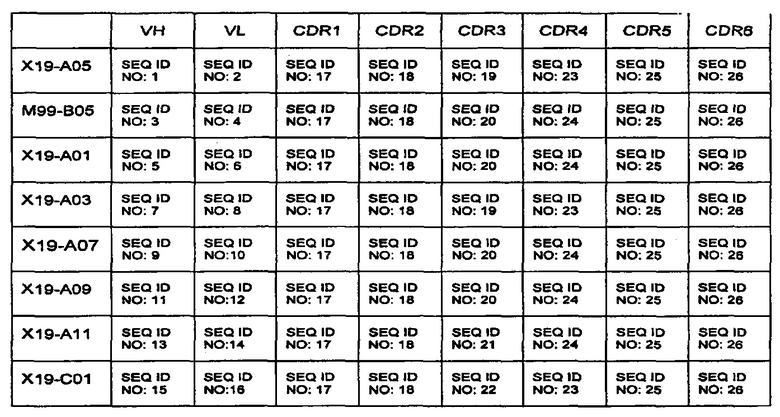
В другом варианте осуществления первого аспекта изобретения, антитело или фрагмент антитела основаны на VH и/или VL доменах Х19-А05 антитела, и таким образом:
VH домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 1 и/или (ii) содержит CDR1 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17; CDR2 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 19; и/или
- VL домен (iii) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 2, и/или (iv) содержит CDR4 последовательность, включающую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 23; CDR5 последовательность, включающую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25; и CDR6 последовательность, включающую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность SEQ ID NO: 1, a VL домен содержал последовательность SEQ ID NO: 2.
Антитело или фрагмент антитела из данного варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот в СН области. СН область или ее фрагмент могут быть соединены с VH доменом. Не имеется конкретного ограничения СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров человеческих СН областей. Примерные человеческие СН области для применения в данном контексте включают:

SEQ ID NO: 27 является СН областью М99-В05, и имеет последовательность СН области человеческого IgGl (UniProtKB/Swiss-Prot: P01857,1). SEQ ID NO: 28 является СН областью Х19-А05. SEQ ID NO: 28 отличается от SEQ ID NO: 27 по удаленному терминальному К (Lys) в СН области SEQ ID NO: 28, что позволяет снизить или устранить возможность разрушения пептидазами.
Антитело или фрагмент антитела из данного варианта осуществления может в дополнение или альтернативно содержать константную область легкой цепи (CL) или ее фрагмент, который может содержать, например, по мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Не имеется конкретных ограничений CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в настоящем изобретении включает:
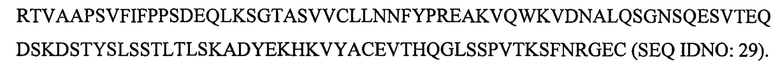
SEQ ID NO: 29 является CL областью M99-B05 и Х19-А05, и имеет последовательность CL области человеческой каппа цепи (UniProtKB/Swiss-Prot: Р01834Д).
В соответствии с настоящим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 1, связанную с СН областью SEQ ID NO: 28, a VL домен содержал последовательность из SEQ ID NO: 2, связанную с CL областью из SEQ ID NO: 29.
В другом варианте осуществления первого аспекта настоящего изобретения антитело или фрагмент антитела основаны на VH и/или VL доменах антитела М99-В05, и таким образом:
- VH домен (i) содержит аминокислотную последовательность, обладающую примерно 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 3 и/или (ii) содержит CDR1 последовательность, содержащей аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17; CDR2 последовательность, включающую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 20; и/или
- VL домен (iii) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 4 и/или (iv) содержит CDR4 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 24, CDR5 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25, и CDR6 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 3, a VL домен содержал последовательность из SEQ ID NO: 4.
Антитело или фрагмент антитела из данного варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области. СН область или ее фрагмент могут быть соединены с VH областью. Нет конкретного ограничения для СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров человеческих СН областей. Примерные человеческие СН области для применения в данном контексте включают SEQ ID NO: 27 и SEQ ID NO: 28.
Антитело или фрагмент антитела из данного варианта осуществления могут в дополнение или альтернативно дополнительно содержать константную область легкой цепи (CL) или ее фрагмент, где фрагмент может включать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Нет конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в данном контексте включает SEQ ID NO: 29.
В соответствии с этим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 3, связанную с СН областью из SEQ ID NO: 27 или 28, a VL домен содержал последовательность из SEQ ID NO: 4, связанную с CL областью из SEQ ID NO: 29.
В другом варианте осуществления первого аспекта настоящего изобретения, антитело или фрагмент антитела основаны на VH и/или VL доменах из антитела Х19-А01, и таким образом:
- VH домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 5 и/или (ii) содержит CDR1 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17, CDR2 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18, и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 20; и/или
- VL домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 6; и/или (iv) содержит CDR4 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 24; CDR5 последовательность, включающую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25; и CDR6 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 5, a VL домен содержал последовательность из SEQ ID NO: 6.
Антитело или фрагмент антитела из данного варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области. СН область или ее фрагмент могут быть соединены с VH доменом. Нет конкретного ограничения СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров СН областей. Примерные человеческие СН области для применения в данном контексте включают SEQ ID NO: 27 и SEQ ID NO: 28.
Антитело или фрагмент антитела из данного варианта осуществления может в дополнение или альтернативно дополнительно содержать константную область легкой цепи (CL) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Нет конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в данном контексте включает SEQ ID NO: 29.
В соответствии с этим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 5, связанную с СН областью из SEQ ID NO: 27 или 28, a VL домен содержал последовательность из SEQ ID NO: 6, связанную с CL областью из SEQ ID NO: 29.
В другом варианте осуществления первого аспекта настоящего изобретения антитело или фрагмент антитела основаны на VH и/или VL доменах антитела Х19-А03, и таким образом:
- VH домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17; CDR2 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 19; и/или
- VL домен (iii) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 8 и/или (iv) содержит CDR4 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 23; CDR5 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25; и CDR6 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 7, a VL домен содержал последовательность из SEQ ID NO: 8.
Антитело или фрагмент антитела из этого варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области. СН область или ее фрагмент могут быть соединены с VH доменом. Нет конкретных ограничений СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники содержится много примеров человеческих СН областей. Примерные человеческие СН области для применения в этом контексте включают SEQ ID NO: 27 и SEQ ID NO: 28.
Антитело или фрагмент антитела из данного варианта осуществления может в дополнение или альтернативно дополнительно содержать константную область легкой цепи (CL) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Нет конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в данном контексте включает SEQ ID NO: 29.
В соответствии с этим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 7, связанную с СН областью из SEQ ID NO: 27 или 28, a VL домен содержал последовательность из SEQ ID NO: 8, связанную с CL областью из SEQ ID NO: 29.
В другом варианте осуществления первого аспекта настоящего изобретения антитело или фрагмент антитела основаны на VH и/или VL доменах антитела Х19-А07, и таким образом:
- VH домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 9, и/или (ii) содержит CDR1 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17; CDR2 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 20; и/или
- VL домен (iii) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% 100%-ной идентичностью с последовательностью SEQ ID NO: 10; и/или (iv) содержит CDR4 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 24; CDR5 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25; и CDR6 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность SEQ ID NO: 9, a VL домен содержал последовательность SEQ ID NO: 10.
Антитело или фрагмент антитела из данного варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области. СН область или ее фрагмент могут быть соединены с VH доменом. Нет конкретного ограничения СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров СН областей. Примерные человеческие СН области для применения в данном контексте включают SEQ ID NO: 27 и SEQ ID NO: 28.
Антитело или фрагмент антитела из данного варианта осуществления может в дополнение или альтернативно дополнительно содержать константную область легкой цепи (CL) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Нет конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в данном контексте включает SEQ ID NO: 29.
В соответствии с этим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 9, связанную с СН областью из SEQ ID NO: 27 или 28, a VL домен содержал последовательность из SEQ ID NO: 10, связанную с CL областью из SEQ ID NO: 29.
В другом варианте осуществления первого аспекта настоящего изобретения антитело или фрагмент антитела основаны на VH и/или VL доменах Х19-А09 антитела, и таким образом:
- VH домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 11; и/или (ii) содержит CDR1 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17; CDR2 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 20; и/или
- VL домен (iii) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 12; и/или (iv) содержит CDR4 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 24; CDR5 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25; и CDR6 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность SEQ ID NO: 11, a VL домен содержал последовательность SEQ ID NO: 12.
Антитело или фрагмент антитела из данного варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области. СН область или ее фрагмент могут быть соединены с VH доменом. Нет конкретного ограничения СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров СН областей. Примерные человеческие СН области для применения в данном контексте включают SEQ ID NO: 27 и SEQ ID NO: 28.
Антитело или фрагмент антитела из данного варианта осуществления может в дополнение или альтернативно дополнительно содержать константную область легкой цепи (CL) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Нет конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в данном контексте включает SEQ ID NO: 29.
В соответствии с этим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 11, связанную с СН областью из SEQ ID NO: 27 или 28, a VL домен содержал последовательность из SEQ ID NO: 12, связанную с CL областью из SEQ ID NO: 29.
В другом варианте осуществления первого аспекта настоящего изобретения антитело или фрагмент антитела основаны на VH и/или VL доменах антитела X19-A11, и таким образом:
- VH домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 13, и/или (ii) содержит CDR1 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17; CDR2 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 21; и/или
- VL домен (iii) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 14; и/или (iv) содержит CDR4 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 24; CDR5 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25; и CDR6 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность SEQ ID NO: 13, a VL домен содержал последовательность SEQ ID NO: 14.
Антитело или фрагмент антитела из данного варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области. СН область или ее фрагмент могут быть соединены с VH доменом. Нет конкретного ограничения СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров СН областей. Примерные человеческие СН области для применения в данном контексте включают SEQ ID NO: 27 и SEQ ID NO: 28.
Антитело или фрагмент антитела из данного варианта осуществления может в дополнение или альтернативно дополнительно содержать константную область легкой цепи (CL) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Нет конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в данном контексте включает SEQ ID NO: 29.
В соответствии с этим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 13, связанную с СН областью из SEQ ID NO: 27 или 28, a VL домен содержал последовательность из SEQ ID NO: 14, связанную с CL областью из SEQ ID NO: 29.
В другом варианте осуществления первого аспекта настоящего изобретения антитело или фрагмент антитела основаны на VH и/или VL доменах антитела Х19-С01, и таким образом:
- VH домен (i) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 15, и/или (ii) содержит CDR1 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 25%, 50%, 75% или 100%-ной идентичностью с последовательностью SEQ ID NO: 17; CDR2 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 18; и CDR3 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 4%, 9%, 13%, 18%, 22%, 27%, 31%, 36%, 40%, 45%, 50%, 54%, 59%, 63%, 68%, 72%, 77%, 81%, 86%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 22; и/или
- VL домен (iii) содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью с последовательностью SEQ ID NO: 16 и/или (iv) содержит CDR4 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 5%, 11%, 17%, 23%, 29%, 35%, 47%, 52%, 58%, 64%, 70%, 76%, 82%, 94% или 100%-ной идентичностью с последовательностью SEQ ID NO: 23; CDR5 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 14%, 28%, 42%, 57%, 71%, 85% или 100%-ной идентичностью с последовательностью SEQ ID NO: 25; и CDR6 последовательность, содержащую аминокислотную последовательность, обладающую по меньшей мере 11%, 22%, 33%, 44%, 55%, 66%, 77%, 88% или 100%-ной идентичностью с последовательностью SEQ ID NO: 26. Может быть предпочтительно, чтобы VH домен содержал последовательность SEQ ID NO: 15, a VL домен содержал последовательность SEQ ID NO: 16.
Антитело или фрагмент антитела из данного варианта осуществления может дополнительно содержать константную область тяжелой цепи (СН) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области. СН область или ее фрагмент могут быть соединены с VH доменом. Нет конкретного ограничения СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров СН областей. Примерные человеческие СН области для применения в данном контексте включают SEQ ID NO: 27 и SEQ ID NO: 28.
Антитело или фрагмент антитела из данного варианта осуществления может в дополнение или альтернативно дополнительно содержать константную область легкой цепи (CL) или ее фрагмент, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области. CL область или ее фрагмент могут быть соединены с VL доменом. Нет конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерная человеческая CL область для применения в данном контексте включает SEQ ID NO: 29.
В соответствии с этим вариантом осуществления может быть предпочтительно, чтобы VH домен содержал последовательность из SEQ ID NO: 15, связанную с СН областью из SEQ ID NO: 27 или 28, a VL домен содержал последовательность из SEQ ID NO: 16, связанную с CL областью из SEQ ID NO: 29.
В различных предыдущих вариантах осуществления обсуждение СН областей и их фрагментов также предназначено для включения применения другого варианта. Вариант включает последовательность, обладающую примерно 100%-ной идентичностью с последовательностью установленной СН области или ее фрагмента, такую как более 50%, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%-ная идентичность последовательности. Соответственно, варианты СН области или ее фрагменты могут иметь одно или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160 или более) различий в последовательности, по сравнению с установленной СН областью или ее фрагментом. Различия в последовательности могут быть обусловлены добавлением одной или нескольких аминокислот, делецией одной или нескольких аминокислот, и/или заменой одной или нескольких аминокислот, по сравнению с установленной СН областью или ее фрагментом. Когда имеется более одного различия, различия могут быть в смежных или несмежных положениях.
Подобным образом, в различных предшествующих вариантах осуществления обсуждение CL областей и их фрагментов также предусматривает опцию применения любого варианта. Вариант включает последовательность, обладающую менее 100%-ной идентичностью с последовательностью установленной CL области или ее фрагмента, такую как более 50%, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%-ная идентичность последовательности. Соответственно, варианты CL области или ее фрагмента могут иметь одно или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160 или более) различий в последовательности, по сравнению с установленной CL областью или ее фрагментом. Различия в последовательности могут быть обусловлены добавлением одной или нескольких аминокислот, делецией одной или нескольких аминокислот, и/или заменой одной или нескольких аминокислот, по сравнению с установленной CL областью или ее фрагментом. Когда имеется более одного различия, они могут быть в смежных или не несмежных положениях.
В антителе или фрагменте антитела в соответствии с вышеизложенными вариантами осуществления может быть предпочтительно, чтобы VH домен, VL домен, или предпочтительно оба VH и VL домены содержали аминокислотную последовательность, обладающую 100%-ной идентичностью последовательности, или в случае установленных SEQ ID NO, соответствующую индивидуальным CDR последовательностям одной или нескольких (например, двум или трем) из установленных SEQ ID NO.
Альтернативно, VH домен, VL домен, или оба VH и VL домены, могут содержать аминокислотную последовательность, обладающую менее чем 100%-ной идентичностью последовательности, или в случае установленных SEQ ID NO, соответствующую индивидуальным CDR последовательностям одной или нескольких (например, двум или трем) из установленных SEQ ID NO.
В соответствии с первым аспектом настоящего изобретения, последовательность, содержащая аминокислотную последовательность, обладающую менее 100%-ной идентичностью с установленной SEQ ID NO, может быть последовательностью, имеющей одно или несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) различий в последовательности, по сравнению с установленной SEQ ID NO. Различия в последовательности могут быть обусловлены добавлением одной или нескольких (например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) аминокислот, делецией одной или нескольких (например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) аминокислот, и/или заменой одной или нескольких (например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) аминокислот, по сравнению с установленной SEQ ID NO. Если имеется более одного различия, то они могут быть в смежных или несмежных положениях.
Одна или несколько различий в последовательности в вариантной антигенсвязывающей области, обладающая менее 100%-ной, но по меньшей мере 80%, 85%, 90%, 95%-ной идентичностью последовательности с установленной SEQ ID NO, выбранной из SEQ ID NO: 1-16, может присутствовать, или находиться исключительно, в аминокислотной последовательности, образующей одну или несколько каркасных областей. Каркасные области содержат аминокислотные области, не образующие CDR, как определено в настоящей заявке.
В дополнение или альтернативно, одно или несколько различий последовательности в антигенсвязывающей области, обладающая менее 100%-ной, но по меньшей мере 80%, 85%, 90%, 95%-ной идентичностью последовательности с установленной SEQ ID NO, выбранной из SEQ ID NO: 1-16, может присутствовать, или находиться исключительно в аминокислотной последовательности, образующей одну или несколько гипервариабельных областей (CDR). CDR в SEQ ID NO: 1-16 определены выше, а также показаны в Таблицах 2 и 3 ниже.
Во всех вариантах осуществления первого аспекта настоящего изобретения, в целом высокие уровни модификаций последовательности без существенного изменения характеристик связывания и/или эффективности антитела или фрагмента антитела in vivo могут находиться скорее в каркасных областях, чем в CDR.
Так, например, в другом варианте осуществления CDR или антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения могут содержать вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен, вставок и/или делеций, по сравнению с «исходной» CDR последовательностью, определенной одной из SEQ ID NO: 17-26, и предпочтительно, не более чем с 5, 4, 3, 2 или 1 аминокислотными заменами, вставками и/или делециями; может быть предпочтительно, чтобы число аминокислотных замен, вставок и/или делеций в CDR последовательности не снижало уровень идентичности менее чем до 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, по сравнению с соответствующей определенной SEQ ID NO.
В дополнение и/или альтернативно, каждая каркасная область в антителе или фрагменте антитела в соответствии с первым аспектом настоящего изобретения может содержать вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислотных замен, вставок и/или делеций, по сравнению с соответствующей каркасной последовательностью, присутствующей в любой из VH или VL последовательностей, определенных SEQ ID NO: 1-16, и необязательно не более чем 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислотных замен, вставок и/или делеций; может быть предпочтительно, чтобы число аминокислотных замен, вставок и/или делеций, содержащихся в любой каркасной области, не снижало уровень идентичности последовательности до менее чем 10%, 20%, 30%, 40% 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, по сравнению с соответствующей определенной SEQ ID NO.
Замены в одной или нескольких из каркасных или гипервариабельных областей могут быть консервативными или неконсервативными заменами. «Консервативные замены» означают такие комбинации, как Gly, Ala, Val, Ile, Leu, Asp, Glu, Asn, Gln, Ser, Thr, Lys, Arg, Phe и Tyr.
Различия в последовательности могут, например, быть введены для того, чтобы последовательность антигенсвязывающей(их) области(ей), была более близкой к последовательностям эмбрионального типа; чтобы повысить стабильность антитела или фрагмента антитела, содержащего вариантную(ые) антигенсвязывающую(ие) область(и); чтобы снизить иммуногенность антитела или фрагмента антитела, содержащего вариантную(ые) антигенсвязывающую(ие) область(и); и/или чтобы устранить или уменьшить свойства, которые могут быть нежелательными в процессе производства. Неограничивающие примеры подходящих различий последовательности показаны в примерах со ссылкой на те различия, которые были введены в последовательности тяжелой и/или легкой цепи М99-В05 для получения Х19-А01, Х19-А03, Х19-А05, X19-А07, Х19-А09, Х19-А11, и/или Х19-С01.
Такие варианты могут быть получены с применением способов белковой инженерии и сайт-направленного мутагенеза, как описано ниже, или альтернативных способов, хорошо известных в данной области техники.
Если VH домен, VL домен, или оба VH и VL и домены антитела или фрагмента антитела из первого аспекта настоящего изобретения содержат одну или несколько аминокислотных последовательностей, обладающих 100%-ной идентичностью с одной или несколькими последовательностями, установленными в SEQ ID NO, то в одном варианте осуществления способность антитела или фрагмента антитела связываться с фосфорилхолином и/или конъюгатом фосфорилхолина может быть, например, по существу эквивалентной (т. е. по меньшей мере 80%, 85%, 90% или 95%) или большей, чем способность соответствующего «исходного» антитела или фрагмента антитела, где VH домен и VL домен соответствующего «исходного» антитела или фрагмента антитела содержит аминокислотную последовательность, обладающую 100%-ной идентичностью с последовательностью, установленной в SEQ ID NO.
Таким образом, например, если антитело или фрагмент антитела основаны на антителе Х19-А05, a VH домен содержит аминокислотную последовательность, обладающую менее чем 100%-ной, но по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью с последовательностью SEQ ID NO: 1; и/или VL домен содержит аминокислотную последовательность, обладающую менее чем 100%-ной, но по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью с последовательностью SEQ ID NO: 2, то способность антитела или фрагмента антитела связываться с фосфорилхолином и/или конъюгатом фосфорилхолина может быть, например, по существу эквивалентной связывающей способности соответствующего «исходного» антитела или фрагмента антитела, содержащего VH домен, включающий последовательность из SEQ ID NO: 1 и VL домен, включающий последовательность из SEQ ID NO: 2. В этом контексте «соответствующее «исходное» антитело или его фрагмент» означает, что различие между подразумеваемым «антителом или фрагментом антитела» и «соответствующим «исходным» антителом или фрагментом антитела» имеется в одном или обоих VH и/или VL доменах. В одном варианте осуществления соответствующее исходное антитело является антителом, имеющим последовательность из VH, VL, СН и CL областей из X19-А05, то есть, VH домена из SEQ ID NO: 1, связанного с СН областью из SEQ ID NO: 28, и VL домена из SEQ ID NO: 2, связанного с CL областью из SEQ ID NO: 29.
То же самое относится, с необходимыми поправками, к другому антителу или фрагменту антитела, указанным выше, где VH и/или VL домены содержат одну или несколько аминокислотных последовательностей, обладающих менее чем 100%-ной идентичностью с одной или нескольким из последовательностей, установленных SEQ ID NO, а «соответствующие «исходное» антитело или фрагмент антитела» для целей определения эквивалентности связывания фосфорилхолина и/или конъюгата фосфорилхолина отличаются только по одной или обеим последовательностям из VH и/или VL домена, и/или содержат последовательность, включающую аминокислотную последовательность, обладающей 100%-ной идентичностью с последовательностью, установленной в SEQ ID NO.
Соответственно, если антитело или фрагмент антитела основаны на М99-В05, в одном варианте осуществления соответствующее исходное антитело является антителом, имеющим последовательность из VH, VL, СН и CL областей М99-В05, то есть, VH домена из SEQ ID NO: 3, связанного с СН областью из SEQ ID NO: 27, и VL домена из SEQ ID NO: 4, связанного с CL областью из SEQ ID NO: 29.
В связи с этим, способность антитела или фрагмента антитела к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина можно определить любым подходящим способом, например, с помощью поверхностного плазмонного резонанса (ППР), для измерения связывания антитела или фрагмента антитела с фосфорилхолином, иммобилизованным (например, через аминофениловый линкер) на твердой поверхности, такой как ППР биосенсор Biacore.
В дополнительном варианте осуществления антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения конкурирует со «сравнительным» антителом или фрагментом антитела за связывание с ФХ или конъюгатом ФХ, как определено в настоящей заявке (например, при определении в ИФА или ППР анализе). В этом контексте сравнительное антитело или фрагмент антитела может содержать VH и VL домены, и необязательно также СН и CL домены из Х19-А05 (как определено SEQ ID NO: 1, 2, 28 и 29, соответственно), М99-В05 (как определено SEQ ID NO: 3, 4, 27 и 29), Х19-А01 (как определено SEQ ID NO: 5, 6, 27 и 29, соответственно), Х19-А03 (как определено SEQ ID NO: 7, 8, 27 и 29, соответственно), Х19-А07 (как определено SEQ ID NO: 9, 10, 27 и 29, соответственно), Х19-А09 (как определено SEQ ID NO: 11, 12, 27 и 29, соответственно), Х19-А11 (как определено SEQ ID NO: 13, 14, 27 и 29, соответственно) или Х19-С01 (как определено SEQ ID NO 15, 16, 27 и 29, соответственно), и предпочтительно, отличается от анализируемого антитела или фрагмента антитела только вариацией последовательности в VH и/или VL областях. Термин «конкурирует» означает, что включение эквимолярных количеств антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения и «сравнительного» антитела в анализе может снизить выявляемый уровень связывания с ФХ или конъюгатом ФХ сравнительного антитела на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более, например, по существу на 100%, по сравнению с выявляемым уровнем связывания с ФХ или конъюгатом ФХ «сравнительного» антитела в том же самом анализе при отсутствии антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения.
Как обсуждается в примерах ниже, М99-В05 связывается с аминофенилфосфорилхолином с кажущей константной диссоциации около 150 нМ. В одном варианте осуществления антитело или фрагмент антитело в соответствии с настоящим изобретением связывается с иммобилизованным аминофенилфосфорилхолином с кажущейся Kd не более чем около 500 нМ, около 400 нМ, около 300 нМ, около 250 нМ, около 200 нМ, около 190 нМ, около 180 нМ, около 170 нМ, около 160 нМ, около 155 нМ, около 150 нМ или менее, при анализе в условиях (таких как условия ППР, использованные в примерах), обеспечивающих связывание антитела или фрагмента антитела, имеющего VH и VL домены из М99-В05 (как определено SEQ ID NO: 3 и 4, соответственно) с иммобилизованным аминофенилфосфорилхолином с кажущейся Kd около 150 нМ. В этом контексте, термин «примерно» применяют для обозначения значения, находящегося в пределах ±20%, 15%, 10%, 5%, 4%, 3%, 2% или 1% от установленного значения.
Как также обсуждается в примерах ниже, М99-В05 может блокировать высвобождение МСР-1 из моноцитов в ответ на стимуляцию оЛПНП с IC50 в наномолярном диапазоне. В другом варианте осуществления антитело или фрагмент антитела из настоящего изобретения блокируют высвобождение МСР-1 из моноцитов в ответ на стимуляцию оЛПНП с IC50 менее примерно 10 нМ, примерно 5 нМ, примерно 4 нМ, примерно 3 нМ, примерно 2,8 нМ, примерно 2,6 нМ, примерно 2,4 нМ, примерно 2 нМ, примерно 1,8 нМ, примерно 1,6 нМ, примерно 1,4 нМ, примерно 1,3 нМ, примерно 1,2 нМ, примерно 1,1 нМ, примерно 1,0 нМ, примерно 0,9 нМ, примерно 0,8 нМ, примерно 0,7 нМ или меньше при анализе в условиях (таких, как описано в примерах ниже), обеспечивающих IC50 для антитела или фрагмента антитела, имеющего VH и VL доменов М99-В05 (как определено SEQ ID NO: 3 и 4, соответственно) в диапазоне 0,7-2,6 нМ. В этом контексте, термин «примерно» используют для обозначения величины в пределах ±20%, 15%, 10%, 5%, 4%, 3%, 2% или 1% от установленного значения.
Способность антитела или фрагмента антитела в соответствии с настоящим изобретением к связыванию с конъюгатом фосфорилхолина можно определить с помощью способов, эквивалентных тем, что описаны выше, заменяя фосфорилхолин конъюгатом фосфорилхолина. Подходящие конъюгаты фосфорилхолина включают те, что описаны выше, включая фосфорилхолиновый компонент, связанный с носителем, необязательно через спейсер, такой как конъюгаты ФХ-БСА и ФХ-ГЛУ. Предпочтительно, если определяют способность антитела или фрагмента антитела к связыванию с конъюгатом фосфорилхолина, ее определяют по способности антитела или фрагмента антитела к специфическому связыванию с фосфорилхолиновым компонентом в конъюгате фосфорилхолина. Ее можно определить с помощью методик, известных в данной области техники, таких как сравнение способности антитела или фрагмента антитела к связыванию с фосфорилхолиновым конъюгатом и соответствующей молекулой, не содержащей фосфорилхолинового компонента.
В одном варианте осуществления антитело или фрагмент антитела из настоящего изобретения может содержать VH домен и VL домен в линейной полипептидной последовательности.
В другом варианте осуществления антитело или фрагмент антитела из настоящего изобретения может содержать каждый из VH домена и VL домена в отдельной полипептидной последовательности. В этом варианте осуществления может быть предпочтительно, чтобы отдельная полипептидная последовательность была напрямую или опосредованно связана (например, одной или несколькими дисульфидными связями между отдельными полипептидными последовательностями).
В другом варианте осуществления VH домен может быть соединен с СН областью, или ее фрагментом, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300, 320 или больше аминокислот из СН области, или вариантом СН области или ее фрагмента, как описано выше. Связь может быть прямым слиянием через пептидную связь, так чтобы VH домен и СН область были представлены в виде единого полипептида, или связь может осуществляться через линкер, такой как пептидный или другой линкер, или через прямую химическую связь, иную чем пептидная связь. Не имеется конкретного ограничения СН области, хотя в одном варианте осуществления она является человеческой СН областью. В данной области техники имеется много примеров человеческих СН областей. Примерные человеческие СН области для применения в данном контексте включают SEQ ID NO: 27 и SEQ ID NO: 28. При использовании любых СН областей могут быть введены терминальные аминокислотные модификации (включая делецию или маскирование путем добавления другой аминокислоты или другого химического компонента) для снижения или устранения возможности разрушения пептидазами.
В другом варианте осуществления VL домен может быть соединен с CL областью, или ее фрагментом, где фрагмент может содержать, например, по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или больше аминокислот из CL области, или вариантом CL области или ее фрагмента, как описано выше. Связь может быть прямым слиянием через пептидную связь, так чтобы VL домен и CL область были представлены в виде единого полипептида, или связь может осуществляться через линкер, такой как пептидный или другой линкер, или через прямую химическую связь, иную чем пептидная связь. Не имеется конкретного ограничения CL области, хотя в одном варианте осуществления она является человеческой CL областью. В данной области техники имеется много примеров человеческих CL областей. Примерные человеческие CL области для применения в данном контексте включают SEQ ID NO: 29. При использовании любых CL областей могут быть введены терминальные аминокислотные модификации (включая делецию или маскирование путем добавления другой аминокислоты или другого химического компонента) для снижения или устранения возможности разрушения пептидазами.
В другом варианте осуществления антитело или фрагмент антитела из настоящего изобретения может содержать VH домен, связанный с СН областью в одной полипептидной последовательности, и VL домен, связанный с CL областью в другой отдельной полипептидной последовательности. В данном варианте осуществления может быть предпочтительно, чтобы отдельные полипептидные последовательности были напрямую или опосредованно связаны (например, одной или несколькими дисульфидными связями между отдельными полипептидными последовательностями).
В другом варианте осуществления антитело или фрагмент антитела из настоящего изобретения могут содержать:
- первую тяжелую цепь, содержащую первый VH домен, соединенный с первой СН областью;
- первую легкую цепь, содержащую первый VL домен, соединенный с первой CL областью;
- вторую тяжелую цепь, содержащую второй VH домен, соединенный со второй СН областью;
- вторую легкую цепь, содержащую второй VL домен, соединенный со второй CL областью; и
Где, необязательно, первая легкая и первая тяжелая цепи, напрямую или опосредованно связаны вместе (например, одной или несколькими дисульфидными связями между отдельными полипептидными последовательностями), и вторая легкая и вторая тяжелая цепи, напрямую или опосредованно связаны вместе (например, одной или несколькими дисульфидными связями между отдельными полипептидными последовательностями), и кроме того, необязательно, первая и вторая тяжелые цепи, напрямую или опосредованно связаны вместе (например, одной или несколькими дисульфидными связями между отдельными полипептидными последовательностями).
В другом варианте осуществления антитело или фрагмент антитела из настоящего изобретения могут быть моноклональным антителом, более предпочтительно, человеческим моноклональным антителом.
Антитело или фрагмент антитела из настоящего изобретения может быть гуманизированным антителом или гибридным антителом.
В одном предпочтительном варианте осуществления антитело или фрагмент антитела из настоящего изобретения является изолированным антителом или фрагментом антитела.
В другом варианте осуществления антитело или фрагмент антитела из настоящего изобретения может содержать одну или несколько аминокислотных последовательностей, содержащих VH, VL, CDR1, CDR2, CDR3, CDR4, CDR5 и/или CDR6 последовательности, описанные выше, привитые на белковые остовы иммуноглобулинов с применением стандартных методик белковой инженерии. Специалисту в данной области техники понятно, что различные белковые остовы доступны для применения и общеизвестны в данной области техники. Итоговым результатом является сохранение антигенсвязывающей активности на новом остове.
Например, остовы иммуноглобулинов могут быть получены из IgA, IgE, IgG1, IgG2a, IgG2b, IgG3, IgM. Остовы могут быть получены из иммуноглобулина от любого млекопитающего, такого как мыши, крысы, кролики, козы, верблюды, ламы, приматы. Может быть предпочтительно, чтобы иммуноглобулиновый остов был получен из человеческих иммуноглобулинов.
Фрагменты антител в соответствии с первым аспектом настоящего изобретения могут быть получены с помощью стандартных методик молекулярной биологии, или путем расщепления очищенных антител с применением ферментов (например, пепсина или папаина), генерирующих эти фрагменты. Примеры таких фрагментов антител в соответствии с настоящим изобретением включают одноцепочечные антитела, Fv, scFv, Fab, F(ab')2, Fab', Fd, dAb, CDR или scFv-Fc фрагменты или нанотела, или диатела, или любой фрагмент, который может быть стабилизирован, например, путем пэгилирования, но не ограничиваются ими.
Второй аспект настоящего изобретения обеспечивает фармацевтическую композицию, содержащую антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения, и фармацевтически приемлемый носитель или наполнитель. Необязательно, единственными антителами или фрагментами антител, присутствующими в композиции, являются те, что относятся к первому аспекту настоящего изобретения. Более предпочтительно, они могут быть одним типом антитела или фрагмента антитела, присутствующего в композиции, например, где тип определяют в отношении аминокислотной последовательности, молекулярной массы и/или специфичности связывания с фосфорилхолином. В этом отношении, специалисту в данной области техники понятно, что возможны определенные уровни вариации в последовательностях антител или фрагментов антител в любой популяции, например, из-за N-концевой вариации и/или частичной деградации; соответственно, в данном контексте, композицию считают содержащей один тип антител или фрагмента антител, если, например, по меньшей мере примерно 80%, примерно 90%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99% или по существу 100% по массе от выявляемого уровня антител или фрагментов антител в композиции принадлежат к одному типу, как определено в отношении аминокислотной последовательности, молекулярной массы и/или специфичности связывания с фосфорилхолином.
Третий аспект настоящего изобретения обеспечивает антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтическую композицию в соответствии со вторым аспектом настоящего изобретения, для применения в медицине, например, для применения в способе терапевтического, хирургического лечения или диагностики, проводимой для организма человека или животного, или для их образца ex vivo.
Например, третий аспект настоящего изобретения обеспечивает антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтическую композицию в соответствии со вторым аспектом настоящего изобретения, для применения с целью предотвращения, профилактики, и/или лечения млекопитающих, включая людей, против атеросклероза, связанного с атеросклерозом заболевания, или сердечно-сосудистого заболевания.
Другими словами, третий аспект настоящего изобретения обеспечивает применение антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтической композиции в соответствии со вторым аспектом настоящего изобретения, в производстве медикамента для предотвращения, профилактики, и/или лечения млекопитающих, включая людей, против атеросклероза, связанного с атеросклерозом заболевания, или сердечно-сосудистого заболевания.
Также обеспечивается способ предотвращения, профилактики и/или лечения млекопитающего, включая человека, против атеросклероза, связанного с атеросклерозом заболевания, или сердечно-сосудистого заболевания, где способ включает этап применения у млекопитающего антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтической композиции в соответствии со вторым аспектом настоящего изобретения.
Третий аспект настоящего изобретения также обеспечивает антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтическую композицию в соответствии со вторым аспектом настоящего изобретения, для применения в профилактике, предотвращении и/или лечения болезни Альцгеймера.
Другими словами, третий аспект настоящего изобретения обеспечивает применение антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтической композиции в соответствии со вторым аспектом настоящего изобретения, в производстве медикамента для профилактики, предотвращения и/или лечения болезни Альцгеймера.
Также обеспечивается способ иммунизации и профилактики, предотвращения и/или лечения субъекта от болезни Альцгеймера, где способ включает этап применения у субъекта антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтической композиции в соответствии со вторым аспектом настоящего изобретения.
Третий аспект настоящего изобретения также обеспечивает антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтическую композицию в соответствии со вторым аспектом настоящего изобретения, для применения в иммунизации или профилактике, или предотвращении или лечении метаболического заболевания у млекопитающих, включая людей.
Другими словами, третий аспект настоящего изобретения обеспечивает применение антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтической композиции в соответствии со вторым аспектом настоящего изобретения, в производстве медикамента для профилактики, предотвращения или лечения метаболического заболевания у млекопитающих, включая людей.
Также обеспечивается способ иммунизации или профилактики, или лечения метаболических заболеваний у млекопитающего, такого как человек, где способ включает этап применения у млекопитающего антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения, или фармацевтической композиции в соответствии со вторым аспектом настоящего изобретения.
Метаболическое заболевание, которое упоминают или лечат в соответствии с третьим аспектом настоящего изобретения, может, например, быть состоянием, выбранным из группы, состоящей из метаболического синдрома, резистентности к инсулину, нарушения толерантности к глюкозе, гипергликемии, диабета I типа, диабета II типа, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии, и синдрома поликистозных яичников (СПКЯ).
Четвертый аспект настоящего изобретения обеспечивает молекулу нуклеиновой кислоты, включающую последовательность, кодирующую антитело или фрагмент антитела, или полипептидную цепь, образующую часть антитела или фрагмента антитела, в соответствии с первым аспектом настоящего изобретения. Молекулой нуклеиновой кислоты может быть, например, ДНК или РНК. Молекула нуклеиновой кислоты может содержать дополнительную последовательность с 5' и/или 3' стороны от последовательности, кодирующей антитело или фрагмент антитела или их часть, в соответствии с первым аспектом настоящего изобретения. Такие 5' и 3' последовательности могут включать последовательности регуляции транскрипции и/или трансляции, такие как последовательности промотора и/или терминатора, хорошо известные в данной области техники, и могут, например, быть выбраны так, чтобы быть функциональными в выбранной клетке-хозяине. Соответственно, молекула нуклеиновой кислоты может содержать кассету экспрессии, которая после трансформации в выбранную клетку-хозяин может быть экспрессирована системами транскрипции и/или трансляции клетки-хозяина для обеспечения продукции кодированного антитела или фрагмента антитела, или части антитела или фрагмента антитела, образующей полипептидную цепь, в соответствии с первым аспектом настоящего изобретения.
Пятый аспект настоящего изобретения обеспечивает вектор или плазмиду, содержащую одну или несколько последовательностей нуклеиновых кислот в соответствии с четвертым аспектом настоящего изобретения. Если антитело или фрагмент антитела содержит более одной полипептидной цепи, то вектор или плазмида может, например, содержать нуклеиновую кислоту, кодирующую последовательность для каждой полипептидной цепи, так что клетка-хозяин, трансформированная вектором или плазмидой, может экспрессировать все полипептидные цепи, присутствующие в антителе или фрагменте антитела.
Соответственно, пятый аспект также обеспечивает применение вектора или плазмиды в трансформации клетки-хозяина. Способы трансформации клеток-хозяев векторами или плазмидами хорошо известны в данной области техники. С целью селекции трансформированных клеток-хозяев, вектор или плазмида может содержать маркер для селекции.
Шестой аспект настоящего изобретения обеспечивает клетку-хозяина, содержащую один или несколько векторов или плазмид в соответствии с пятым аспектом настоящего изобретения. Шестой аспект также обеспечивает культуру клеток, содержащих один или несколько векторов или плазмид в соответствии с пятым аспектом настоящего изобретения, такую как монокультура, в которой все или по существу все клетки содержат один или несколько векторов или плазмид в соответствии с пятым аспектом настоящего изобретения. Такие монокультуры могут быть получены, например, путем отбора клеток на наличие одного или нескольких селектируемых маркеров на одной или нескольких плазмидах или векторах, и необязательно, поддержки давления отбора во время роста выбранных клеток в культуре.
Если антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения содержит более одной полипептидной цепи, клетку-хозяина можно трансформировать с одним вектором или плазмидой, содержащими нуклеиновую кислоту, кодирующую последовательность каждой полипептидной цепи, так чтобы клетка-хозяин, трансформированная вектором или плазмидой, могла экспрессировать все полипептидные цепи, присутствующие в антителе или фрагменте антитела.
Альтернативно, если антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения содержат более одной полипептидной цепи, клетку-хозяин можно трансформировать более чем одним вектором или плазмидой, включающими нуклеиновую кислоту, кодирующую последовательность по меньшей мере одной из полипептидных цепей, так чтобы клетка-хозяин, трансформированная более чем одним вектором или плазмидой, могла экспрессировать все полипептидные цепи, присутствующие в антителе или фрагменте антитела.
В другом альтернативном варианте осуществления, где антитело или фрагмент антитела в соответствии с первым аспектом настоящего изобретения содержат более одной полипептидной цепи, множество клеток-хозяев можно трансформировать вектором или плазмидой, включающими последовательности различных нуклеиновых кислот, кодирующих один или нескольких различных элементов различных полипептидных цепей, образующих антитело или фрагмент антитела, и каждую из разных клеток-хозяев можно культивировать по отдельности для экспрессии каждой полипептидной цепи. Полученные различные полипептидные цепи можно затем объединить для получения антитела или фрагмента антитела.
Любую подходящую клетку-хозяина можно применять в пятом и/или шестом аспектах настоящего изобретения. Например, клетка-хозяин может быть прокариотической клеткой, такой как клетка Escherichia coli. Клетка-хозяин может быть эукариотической клеткой, такой как животная клетка, растительная клетка, и грибковая клетка. Подходящие животные клетки могут включать клетки млекопитающих, клетки птиц, и клетки насекомых. Подходящие клетки млекопитающих могут включать СНО клетки и COS клетки. Подходящие грибковые клетки могут включать дрожжевые клетки, такие как клетки Saccharomyces cerevisiae. Клетки млекопитающих могут включать или не включать человеческие клетки, и могут включать или не включать эмбриональные клетки.
Седьмой аспект настоящего изобретения обеспечивает способ получения антигенсвязывающей последовательности антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения, включающий культивирование одной или нескольких трансформированных клеток-хозяев, как описано выше, и получение из них антитела или фрагмента антитела в соответствии с первым аспектом настоящего изобретения.
Восьмой аспект настоящего изобретения обеспечивает способ приготовления варианта антитела или фрагмента антитела из первого аспекта настоящего изобретения, где вариант сохраняет способность к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина, где способ включает:
(i) обеспечение нуклеиновой кислоты в соответствии с четвертым аспектом настоящего изобретения, кодирующей исходное антитело или фрагмент антитело, или полипептидную цепь, образующую его часть;
(ii) введение одной или нескольких нуклеотидных мутаций (необязательно, до 50, 40, 30, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотидных мутаций), в участки последовательности нуклеиновых кислот, кодирующие аминокислоты, необязательно в пределах областей, кодирующих VH и/или VL домен(ы), так чтобы мутантная нуклеиновая кислота кодировала вариантное антитело или фрагмент антитела, имеющие отличающуюся аминокислотную последовательность, по сравнению с исходным антителом или фрагментом антитела;
(iii) экспрессию вариантного антитела или фрагмента антитела, или полипептидной цепи, образующей его часть, кодированных мутантной последовательностью нуклеиновых кислот; и
(iv) сравнение способности вариантного антитела или фрагмента антитела и исходного антитела или фрагмента антитела к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина.
В соответствии с восьмым аспектом настоящего изобретения, нуклеотидные мутации могут быть введены в участки последовательности нуклеиновых кислот, кодирующие аминокислоты, произвольно, или сайт-специфическим образом. Такие мутации могут приводить к участку, кодирующему аминокислотную последовательность, содержащую добавление одной или несколько аминокислот, делецию одной или нескольких аминокислот, и/или замену одной или нескольких аминокислот, по сравнению с аминокислотной последовательностью, кодированной нуклеиновой кислотой до мутации.
Такие нуклеотидные мутации могут приводить или не приводить к области, кодирующей аминокислотную последовательность, содержащую одну или несколько вариаций последовательности в антигенсвязывающей области. Такие нуклеотидные мутации могут, например, приводить к вариации в аминокислотной последовательности (т.е. добавлениям одной или нескольких аминокислот, делециям одной или нескольких аминокислот, и/или заменам одной или нескольких аминокислот), присутствующей или находящейся исключительно в аминокислотной последовательности, образующей одну или несколько каркасных областей. В дополнение или альтернативно, такие нуклеотидные мутации могут, например, приводить к вариации в аминокислотной последовательности (т. е. добавлениям одной или нескольких аминокислот, делециям одной или нескольких аминокислот, и/или заменам одной или нескольких аминокислот), присутствующей или находящейся исключительно в аминокислотной последовательности, образующей одну или несколько гипервариабельных областей. Уровни аминокислотных вариаций/модификаций, допустимые в отношении каркасных областей, CDR и/или VH или VL доменов в целом обсуждается выше в отношении первого аспекта настоящего изобретения, и может применяться, с необходимыми поправками, к уровню вариаций/модификаций, которые можно внести в соответствии со способом из восьмого аспекта настоящего изобретения.
В дополнение или альтернативно, такие нуклеотидные мутации могут приводить или не приводить к области, кодирующей аминокислотную последовательность, содержащую одну или несколько вариаций последовательности в одной или нескольких частей антитела или фрагмента антитела, иных, чем антигенсвязывающая область, таких как в одной или нескольких из CH1, СН2, СН3, CL областей или других областей.
Если одна или несколько нуклеотидных мутаций приводят к одной или нескольким аминокислотным заменам в кодированном продукте, то одна или несколько замен могут каждая независимо быть консервативными или неконсервативными заменами. Под «консервативными заменами» подразумеваются такие комбинации, как Gly, Ala, Val, Ile, Leu, Asp, Glu, Asn, Gln, Ser, Thr, Lys, Arg, Phe, Tyr.
Нуклеотидные мутации могут, например, быть введены для обеспечения последовательности кодируемого антитела или фрагментов антитела, близкой к последовательности антител эмбрионального типа; для повышения стабильности антитела или фрагмента антитела, содержащего вариантную(е) антигенсвязывающую(е) область(и); для снижения иммуногенности антитела или фрагмента антитела, содержащего вариантную(е) антигенсвязывающую(е) область(и); и/или для устранения или уменьшения свойств, которые могут быть нежелательными в процессе производства.
Такие нуклеотидные мутации могут быть получены с помощью способов, хорошо известных в данной области техники.
В соответствии с восьмым аспектом настоящего изобретения, этап оценки способности вариантного антитела или фрагмента антитела к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина может дополнительно включать выбор тех вариантов, которые обладают по существу равной или повышенной способностью к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина, по сравнению с исходным антителом.
Способность вариантов и исходных молекул к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина можно оценить посредством таких способов, как те, что обсуждались выше по отношению к первому аспекту настоящего изобретения.
Способ из восьмого аспекта настоящего изобретения может необязательно дополнительно включать извлечение молекулы нуклеиновой кислоты, содержащей мутантную последовательность нуклеиновых кислот, кодирующую вариантное антитело или фрагмент антитела, и необязательно трансформацию клетки-хозяина композицией, содержащей извлеченную молекулу нуклеиновой кислоты, и далее необязательно экспрессию вариантного антитела или фрагмента антитела клеткой-хозяином, и далее необязательно извлечение экспрессированного вариантного антитела или фрагмента антитела из клетки-хозяина, и далее необязательно, получение фармацевтически приемлемой композиции из извлеченного вариантного антитела или фрагмента антитела.
Восьмой аспект настоящего изобретения также обеспечивает вариантное антитело или фрагмент антитела, полученный или получаемый посредством способа из восьмого аспекта настоящего изобретения, или фармацевтически приемлемую композицию, полученную или получаемую посредством способов из восьмого аспекта настоящего изобретения, для применения в медицине.
Восьмой аспект из настоящего изобретения также обеспечивает вариантное антитело или фрагмент антитела, полученные или получаемые посредством способа из восьмого аспекта настоящего изобретения, или фармацевтически приемлемую композицию, полученную или получаемую посредством способа из восьмого аспекта настоящего изобретения, для применения с целью:
(i) предотвращения, профилактики и/или лечения атеросклероза, связанного с атеросклерозом заболевания, или сердечно-сосудистого заболевания у млекопитающих, включая людей;
(ii) профилактики, предотвращения и/или лечения болезни Альцгеймера; и/или
(iii) иммунизации или профилактики, или предотвращения или лечения метаболического заболевания у млекопитающих, включая людей.
Другими словами, восьмой аспект настоящего изобретения также обеспечивает применение вариантного антитела или фрагмента антитела, полученного или получаемого посредством способа из восьмого аспекта настоящего изобретения, или применение фармацевтически приемлемой композиции, полученной или получаемой посредством способа из восьмого аспекта настоящего изобретения, в производстве медикамента для:
(i) предотвращения, профилактики и/или лечения атеросклероза, связанного с атеросклерозом заболевания, или сердечно-сосудистого заболевания у млекопитающих, включая людей;
(ii) профилактики, предотвращения и/или лечения болезни Альцгеймера; и/или
(iii) иммунизации или профилактики, или предотвращения или лечения метаболического заболевания у млекопитающих, включая людей.
Соответственно, в восьмом аспекте настоящего изобретения также обеспечен способ для:
(i) предотвращения, профилактики и/или лечения, атеросклероза, связанного с атеросклерозом заболевания, или сердечно-сосудистого заболевания у млекопитающих, включая людей;
(ii) иммунизации и профилактики, предотвращения и/или лечения болезни Альцгеймера у субъекта; и/или
(iii) иммунизации или профилактики, или лечения метаболического заболевания у млекопитающего, такого как человек;
где способ включает этап применения у млекопитающего или субъекта вариантного антитела или фрагмента антитела, полученного или получаемого посредством способа из восьмого аспекта настоящего изобретения, или применения фармацевтически приемлемой композиции, полученной или получаемой посредством способа из восьмого аспекта настоящего изобретения.
Метаболическое заболевание, которое упоминают или лечат в соответствии с восьмым аспектом настоящего изобретения, может, например, быть состоянием, выбранным из группы, состоящей из метаболического синдрома, резистентности к инсулину, нарушения толерантности к глюкозе, гипергликемии, диабета I типа, диабета II типа, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии, и синдрома поликистозных яичников (СПКЯ).
Фосфорилхолин
Фосфорилхолин (ФХ) означает фосфорилхолин согласно формуле:
Фосфорилхолиновый конъюгат означает фосфорилхолиновый компонент, связанный с носителем, предпочтительно через спейсер. Фосфорилхолиновый компонент может быть ковалентно или нековалентно связан с носителем. Предпочтительно, фосфорилхолиновый компонент связан с носителем через фосфатную группу.
Носителем может быть, например, белок, углевод, полимер, латексные бусы, или коллоидный металл.
Конъюгатом фосфорилхолина может быть, например, конъюгат белок-ФХ, такой как конъюгат человеческого сывороточного альбумина (ЧСА)-ФХ, конъюгат трансферрин-ФХ, конъюгат гемоцианин лимфы улитки (ГЛУ)-ФХ, или конъюгат бычий сывороточный альбумин (БСА)-ФХ.
Если конъюгат ФХ содержит ФХ, связанный с носителем через спейсер, то можно применять любой подходящий спейсер. He-ограничивающие примеры спейсеров включают связующие агенты (как правило, бифункциональные соединения), такие как дикарбоновые кислоты, как янтарная и глутаровая кислота; соответствующие диальдегиды; диамины, такие как 1,6-диаминогексан; двухзамещенные фенолы, такие как п-аминофенол, п-диазо-фенол, п-фенилендиамин, п-бензохинон, и тому подобные.
Сердечно-сосудистое заболевание
Термин «сердечно-сосудистое заболевание» предназначен для включения атеросклероза, острого коронарного синдрома, острого инфаркта миокарда, инфаркта миокарда (сердечного приступа), стабильной и нестабильной стенокардии, аневризм, болезни коронарных артерий (БКА), ишемической болезни сердца, ишемии миокарда, сердечной смерти и внезапной сердечной смерти, кардиомиопатии, застойной сердечной недостаточности, сердечной недостаточности, стеноза, болезни периферических артерий (БПА), перемежающейся хромоты, критической ишемии конечностей, и инсульта; но не ограничивается ими.
Лечение или профилактика сердечно-сосудистых заболеваний с применением антител к фосфорилхолину и конъюгатам фосфорилхолина обсуждается, например, в WO 2005/100405 и US 2007-0286868, содержание которых включено в настоящей заявке посредством ссылки.
Болезнь Альцгеймера
В соответствии с настоящим изобретением, антитело или фрагмент антитела в соответствии с первым аспектом можно применять для лечения или профилактики болезни Альцгеймера у индивидуумов, нуждающихся в лечении или подверженных риску заболевания.
В WO 2010/003602 и патентной заявке US №61/078677 описано лечение или профилактика болезни Альцгеймера с применением антител, обладающих реактивностью к фосфорилхолину и конъюгатам фосфорилхолина, и их содержание включено в настоящей заявке посредством ссылки для дополнительного раскрытия способов, посредством которых антитела или фрагменты антител в соответствии с первым аспектом можно применять для лечения или профилактики болезни Альцгеймера.
Метаболические заболевания
Термин «метаболические заболевания» предназначен для включения метаболического синдрома X, резистентности к инсулину (ИР), нарушения толерантности к глюкозе, гипергликемии, диабета I типа, диабета II типа, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии, синдрома поликистозных яичников (СПКЯ), и родственных заболеваний, но не ограничивается ими.
Дальнейшее обсуждения метаболических заболеваний для лечения антителами к фосфорилхолину и конъюгатам фосфорилхолина обсуждается в WO 2012/010291, содержание которого также включено посредством ссылки для дальнейшего раскрытия способов применения антител или фрагментов антител в соответствии с первым аспектом для лечения или профилактики метаболических заболеваний.
Идентичность аминокислотной последовательности
Процент идентичности двух аминокислотных последовательностей определяют следующим образом. Во-первых, аминокислотную последовательность сравнивают, например, с SEQ ID NO: 1 с применением программы BLAST 2 Sequences (Bl2seq) из автономной версии BLASTZ, содержащей BLASTN версию n 2,0,14 и BLASTP версию 2,0,14. Эту автономную версию BLASTZ можно получить на веб-сайте Национального центра биотехнологической информации США www.ncbi.nlm.nih.gov. Инструкции, объясняющие, как применять программу Bl2seq, можно найти в файле «readme», сопровождающем BLASTZ. Bl2seq обеспечивает сравнение двух аминокислотных последовательностей с применением алгоритма BLASTP. Для сравнения двух аминокислотных последовательностей, опции Bl2seq устанавливают следующим образом: - i присваивают файлу, содержащему первую аминокислотную последовательность, которую нужно сравнить (например, C:\seq1.txt); - j присваивают файлу, содержащему вторую аминокислотную последовательность, которую нужно сравнить (например, C:\seq2.txt); - р присваивают blastp; - о присваивают любое необходимое имя файла (например, C:\output.txt); а для всех других опций оставляют значения по умолчанию. Например, можно применять следующую команду для создания выходного файла, содержащего сравнение двух аминокислотных последовательностей: C:\Bl2seq - i c:\seq1.txt - j c:\seq2.txt - p blastp - о c:\output.txt. Если две сравниваемые последовательности являются гомологичными, то обозначенный выходной файл представит гомологичные участки в виде выровненных последовательностей. Если две сравниваемые последовательности не имеют гомологии, то обозначенный выходной файл не будет представлять выровненные последовательности. При выравнивании число совпадений определяется путем подсчета числа положений, где идентичный нуклеотид или аминокислотный остаток присутствует в обеих последовательностях.
Процент идентичности определяют путем деления числа совпадений на длину последовательности, изложенной в идентифицированной последовательности, с последующим умножением полученного значения на 100. Например, если последовательность сравнивают с последовательностью, установленной в SEQ ID NO: А (где длина последовательности, изложенной в SEQ ID NO: А, составляет 10), а число совпадений составляет 9, то последовательность имеет процент идентичности 90% (т.е. 9/10×100=90) с последовательностью, установленной в SEQ ID NO: A.
Антитела
Термин «антитело или фрагмент антитела», как упоминается в контексте настоящего изобретения, включает целые антитела и любой антигенсвязывающий фрагмент, обозначенный как «антигенсвязывающая область», или их отдельные цепи.
«Антитело» может означать белок, содержащий по меньшей мере две тяжелых (Н) цепи и две легких (L) цепи, соединенные дисульфидными связями, или его антигенсвязывающую часть. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначенную как VH) и константную область тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, СН2, и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой как VL) и константной области легкой цепи. Константная область легкой цепи содержит один домен, CL.
VH и VL области можно дополнительно подразделить на области гипервариабельности, обозначаемые областями, определяющими комплементарность (CDR), перемежаемые более консервативными участками, называемыми каркасными областями (FR). Каждая VH область, как правило, содержит три CDR и четыре FR области, расположенные от аминоконцевой части до карбоксиконцевой части в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Подобным образом, каждая VL область, как правило, содержит три CDR и четыре FR области, расположенные от аминоконцевой части до карбоксиконцевой части в следующем порядке: FR5, CDR4, FR6, CDR5, FR7, CDR6, FR8. Вариабельные области тяжелых и легких цепей содержат связывающий домен, взаимодействующий с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, клетки-эффекторы) и первый компонент (C1q) классического пути системы комплемента.
Термин «антигенсвязывающий участок», как применяется в настоящей заявке, относится к одному или нескольким фрагментам антитела, сохраняющим способность к специфическому связыванию с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами первичного антитела. Примеры связывающих фрагментов, охваченных термином «антигенсвязывающий участок» антитела включают:
(i) Fab фрагмент, одновалентный фрагмент, состоящий из VL, VH, CL и СН1 доменов;
(ii) F(ab')2 фрагмент, двухвалентный фрагмент, состоящий из двух Fab фрагментов, связанных дисульфидным мостиком в шарнирной области;
(iii) Fab' фрагмент, который по существу является Fab с частью шарнирной области;
(iv) Fd фрагмент, состоящий из VH и СН1 доменов;
(v) Fv фрагмент, состоящий из VL и VH доменов одного плеча антитела;
(vi) dAb фрагмент, состоящий из VH домена;
(vii) изолированную гипервариабельную область (CDR); и
(viii) нанотело, вариабельную область тяжелой цепи, содержащую один вариабельный домен и два константных домена.
Далее, хотя два домена из Fv фрагмента, VL и VH, кодируются отдельными генами, они могут быть соединены, с применением рекомбинантных способов, синтетическим линкером, обеспечивающим их получение в виде единой белковой цепи, в которой VL и VH области спарены с формированием одновалентных молекул (известных как одноцепочечные Fv (scFv)). Такие одноцепочечные антитела также охватываются термином «антигенсвязывающая часть» антитела.
Диатела состоят из двух полипептидов, каждый из которых содержит вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) на одной и той же полипептидной цепи (VH-VL), соединенной пептидным линкером. Эти фрагменты антител получают с применением обычных методик, известных специалистам в данной области техники, и проводят скрининг фрагментов на возможность применения таким же образом, как у интактных антител.
«Изолированное антитело», как применяется в настоящей заявке, означает антитело, по существу свободное от других антител, обладающих отличающимися антигенными специфичностями (например, изолированное антитело, специфически связывающее фосфорилхолин, по существу свободное от антител, специфически связывающихся с иными антигенами, чем фосфорилхолин). Далее, изолированное антитело может быть по существу свободным от другого клеточного материала и/или химикатов.
Термин «моноклональное антитело» или «композиция моноклональных антител», как применяется в настоящей заявке, означает препарат молекул антител одного молекулярного состава. Композиция моноклональных антител проявляет единственную специфичность связывания и аффинность к конкретному эпитопу.
Термин «гуманизированное антитело» относится к антителам, в которых CDR последовательности, полученные из зародышевой линии других видов млекопитающих, таких как мышь, привиты на человеческие каркасные последовательности. Дополнительные модификации каркасной области могут быть выполнены в пределах человеческих каркасных последовательностей.
Термин «химерное антитело» предназначен для обозначения антител, в которых последовательности вариабельной области получены от одного вида, а последовательности константной области получены от другого вида, например, антитела, в котором последовательности вариабельной области получены из мышиного антитела, а последовательности константной области получены из человеческого антитела.
Фармацевтические композиции
Фармацевтическая композиция в соответствии с настоящим изобретением может содержать связывающий белок в соответствии с настоящим изобретением в смеси с фармацевтически приемлемым носителем и/или наполнителем, который, как правило, выбирают в зависимости от назначенного способа применения и стандартной фармацевтической практики. Композиция может быть в форме приложений для немедленного, замедленного или контролируемого высвобождения. Предпочтительно, рецептура является лекарственной формой, содержащей суточную дозу или единицу, суточную субдозу или ее подходящую фракцию, от активного ингредиента.
Фармацевтическая композиция в соответствии с настоящим изобретением может предназначаться или не предназначаться, и таким образом, составляется способом, чтобы быть пригодной для парентерального, внутривенного, внутриартериального, интраперитонеального, внутримышечного, интрацеребровентрикулярного, или подкожного введения, или применяться посредством инфузии. Ее можно лучше всего применять в форме стерильного водного раствора, который может содержать другие вещества, например, соли или глюкозу, чтобы сделать раствор изотоничным с кровью или цереброспинальной жидкостью (ЦСЖ). Водные растворы могут быть подходящим образом буферированы (предпочтительно, до рН от 3 до 9), если необходимо. Приготовление подходящих фармацевтических рецептур в стерильных условиях легко осуществляется с помощью стандартных фармацевтических методик, хорошо известных специалистам в данной области техники.
Такие рецептуры могут включать водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферные вещества, бактериостатики и осмолиты, придающие рецептуре изотоничность с кровью и ЦСЖ назначенного реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Рецептуры могут присутствовать в однодозовых и многодозовых контейнерах, например, герметичных ампулах и флаконах, и могут храниться в лиофилизированном (высушенном посредством сублимации) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Растворы и суспензии для немедленного введения могут быть приготовлены из стерильных порошков, гранул и таблеток ранее описанного вида.
Терапевтически эффективное количество антитела или фрагмента антитела в соответствии с настоящим изобретением для применения у пациента, такого как человек, составляет на основе суточного уровня дозы от 0,01 до 1000 мг антитела или фрагмента антитела для взрослого (например, около 0,001-20 мг на кг массы тела пациента, такой как от 0,01 до 10 мг/кг, например, более 0,1 мг/кг и менее 20, 10, 5, 4, 3 или 2 мг/кг, такой как около 1 мг/кг), при введении в одной или раздельных дозах.
Врач в любом случае будет определять действительную дозировку, наиболее пригодную для какого-либо отдельного пациента, и она может варьировать в зависимости от возраста, массы тела, и ответа конкретного пациента. Вышеуказанные дозы являются примерами среднего случая. Конечно, возможны отдельные случаи, когда необходимы более высокие или низкие диапазоны доз, и это тоже находится в пределах объема настоящего изобретения.
Описание чертежей
Фигура 1. Расчет аффинности связывания из анализа равновесного связывания с помощью Biacore
(♦) М99-В05 (серия W21573) (Kd=160±32 нМ), (○) М99-В05 (серия W22595) (Kd=148±8 нМ). На графике сравниваются два различных препарата антител.
Фигура 2. Связывание очищенного IgG с ФХ-БСА по результатам ИФА
(•) M4-G02 (ЕС50=0,14 нМ), (○) M73-G03 (ЕС50=0,91 нМ), (Δ) М99-В05 (ЕС50=0,11 нМ). Данные были приспособлены для четырехпараметрического логистического уравнения с общим Bmax для получения значений ЕС50.
Фигура 3. Ингибирование притока СР45-позитивных лейкоцитов в медиальную часть обернутой манжетой бедренной артерии мыши.
Трансгенные мыши-самцы АроЕ*3 Leiden получали рацион с высоким содержанием холестерина и жира, содержащий 1% холестерина и 0,05% холата для индукции гиперхолестеринемии. Спустя три недели потребления рациона с высоким содержанием жира, мышей подвергали анестезии, и бедренную артерию отделяли от окружающих тканей и свободно обертывали несуживающей полиэтиленовой манжетой (Portex, внутренний диаметр 0,40 мм, внешний диаметр 0,80 мм, длина 2,0 мм). У мышей применяли 10 мг/кг рекомбинантных анти-ФХ IgG антител, растворенных в ФБР (фосфатном буферном растворе), 10 мг/кг антистрептавидин А2 IgG антител, растворенных в ФБР, или только ФБР, посредством интраперитонеального введения на 0 сутки. Мышей умерщвляли спустя три дня после операции, и бедренные артерии с манжетой извлекали и заливали парафином. Готовили серии поперечных срезов (5 мкм) по всей длине сегмента бедренной артерии с манжетой для гистохимического анализа. *р<0,01, n=15.
Фигура 4. Ингибирование утолщения интимы в бедренной артерии мыши, обернутой манжетой
Трансгенные мыши-самцы АроЕ*3 Leiden получали рацион с высоким содержанием холестерина и жира, содержащий 1% холестерина и 0,05% холата для индукции гиперхолестеринемии. Спустя три недели потребления рациона с высоким содержанием жира, мышей подвергали анестезии, и бедренную артерию отделяли от окружающих тканей и свободно обертывали несуживающей полиэтиленовой манжетой (Portex, внутренний диаметр 0,40 мм, внешний диаметр 0,80 мм, длина 2,0 мм). У мышей применяли 10 мг/кг рекомбинантных анти-ФХ IgG антител, растворенных в ФБР, 10 мг/кг антистрептавидин А2 IgG антител, растворенных в ФБР, или только ФБР, посредством интраперитонеального введения на 0, 3, 7 и 10 сутки после операции. Мышей умерщвляли спустя 14 дней после операции, и бедренные артерии с манжетой извлекали и заливали парафином. Готовили серии поперечных срезов (5 мкм) по всей длине сегмента бедренной артерии с манжетой для гистохимического анализа.
A. Сравнение интимальной области (показана стрелкой) на трех панелях указывает, что антитела М99-В05 уменьшали утолщение интимы, наблюдавшееся спустя 14 суток после индуцированного манжетой повреждения сосуда.
B. Утолщение интимы в мкм2, n=10, *р<0,05
Фигура 5. Активность связывания ФХ у М99-В05 мутантов при определении с помощью ИФА
(•) М99-В05 (ЕС50=0,28 нМ), (○) Х19-А01 (ЕС50=0,42 нМ), (▼) Х19-А03 (ЕС50=0,54 нМ), (Δ) Х19-А05 (ЕС50=0,52 нМ), (■) Х19-А07 (ЕС50=0,62 нМ), (□) Х19-А09 (ЕС50=0,58 нМ), (♦) Х19-А11 (ЕС50=0,97 нМ), (◊) Х19-С01 ЕС50=1,4 нМ).
Фигура 6. Иммуногистохимическое окрашивание замороженной ткани человека, пораженной атеросклерозом, с применением антифосфорилхолинового антитела.
Человеческую ткань, пораженную атеросклерозом, вместе с нормальной контрольной тканью получали коммерческим путем из банка замороженных тканей человека Biochain. Ткань инкубировали с 0,1 мкг/мл биотинилированного М99-В05 анти-фосфорилхолин-IgG в течение ночи при 4°С. Визуализацию антитела, связавшегося с тканью, проводили после добавления конъюгата стрептавидин-пероксидаза хрена (ПОХ) и субстрата ПОХ. На связывание с антителом указывала окраска, генерируемая субстратом ПОХ. Не отмечалось связывания в изотипическом контроле (данные не показаны).
Фигура 7. Ингибирование утолщения интимы в бедренной артерии мышей, обернутой манжетой.
Трансгенные мыши-самцы АроЕ*3 Leiden получали рацион с высоким содержанием холестерина и жира, содержащий 1% холестерина и 0,05% холата для индукции гиперхолестеринемии. Спустя три недели потребления рациона с высоким содержанием жира, мышей подвергали анестезии, и бедренную артерию отделяли от окружающих тканей и свободно обертывали несуживающей полиэтиленовой манжетой (Portex, внутренний диаметр 0,40 мм, внешний диаметр 0,80 мм, длина 2,0 мм). Мышам вводили указанное антитело в указанном количестве, растворенное в ФБР, путем интраперитонеального введения на 0, 3, 7 и 10 сутки после операции. Мышей умерщвляли спустя 14 дней после операции, и бедренные артерии с манжетой извлекали и заливали парафином. Готовили серии поперечных срезов (5 мкм) по всей длине сегмента бедренной артерии с манжетой для гистохимического анализа, и рассчитывали утолщение интимы в мкм2, n=10, *р<0,05.
Примеры
Следующие примеры включены для дополнительной иллюстрации различных аспектов изобретения. Специалисту в данной области техники необходимо понять, что методики, раскрытые в примерах, следуют представленным методикам и/или композициям, раскрытым изобретателем, для осуществления изобретения, и таким образом, могут рассматриваться как составляющие предпочтительные варианты осуществления. Однако специалисту в данной области техники в свете представленного описания понятно, что можно внести много изменений в раскрытые специфические варианты осуществления, с получением такого же или схожего результата, без отделения от сущности и объема настоящего изобретения.
Скрининг библиотеки антител полученной путем фагового дисплея
Проводили операцию выбора и скрининга антител, экспонированных на фагах для идентификации человеческих антител, связывающихся с ФХ и нейтрализующих провоспалительную активность ФХ, проявляющуюся на оЛПНП или апоптотических эндотелиальных клетках при сердечно-сосудистом заболевании.
Выбор анти-ФХ антител проводили с применением ФХ, конъюгированного с бычьим сывороточным альбумином (БСА) и с чередованием с циклами с применением ФХ, конъюгированного с ферритином.
В качестве итога селекции с помощью ИФА отбирали индивидуальные фаги по связыванию с ФХ-БСА, и для найденных фагов проводили секвенирование ДНК для идентификации точного числа уникальных антител; все эти антитела превращали рекомбинантным путем в IgG. В целом, после проведения выбора из двух различных библиотек фагового дисплея было идентифицировано и получено 41 полных человеческих IgG. Эти антитела были идентифицированы после скрининга в целом 10,660 различных фаговых клонов путем ИФА, из которых было выявлено 1,511 положительных результатов при ИФА.
Положительный результат при ИФА определяли как сигнал на иммобилизованной мишени (т. е. ФХ-БСА), который был по меньшей мере в три раза выше фонового сигнала (для планшета, покрытого стрептавидином).
После секвенирования 1,511 положительных результатов ИФА и преобразования антител из Fab фрагментов, отображаемых на фаге до полных человеческих IgG, было получено 56 различных последовательностей антител, связывающихся с ФХ, 26 из первой фагемидной библиотеки и 30 из второй фаговой библиотеки.
Реформатирование, экспрессия и очистка IgG
Мы описываем результаты получения 40 из 56 антител после рекомбинантного реформатирования от Fab, экспонированных на фаге, до полных IgG.
ДНК для каждого IgG готовили и трансфицировали в клетки почки человека 293Т для временной генерации IgG спустя 10 суток культивирования. IgG, используемый для исследований in vitro, очищали с применением белок-А-сефарозы (MabSelect), и проводили замену буферного раствора на ФБР.
IgG, предназначенные для анализа in vivo, были очищены с помощью белок-А-сефарозы, с последующей катионообменной хроматографией (Poros HS) с градиентной элюцией. Проводили замену буферного раствора для IgG антител, предназначенных для in vivo анализа, на буферный раствор для рецептуры антител (0,1 M цитрат-фосфат, 50 мМ NaCl, 0,01% Твин-80, 2% трегалоза, рН 6,0). Концентрацию антител определяли в очищенных образцах по поглощению при 280 нм (оптическая плотность 1 мг/мл = 1,4).
In vitro анализы
40 образцов IgG анализировали с применением батареи in vitro анализов для идентификации антител с необходимыми свойствами. В Таблице 1 обобщены связывающие свойства для выбранных полных человеческих IgG антифосфорилхолиновых антител.
Во второй колонке (колонка А) в Таблице 1 показан ИФА сигнал, полученный с применением всего 15,6 нг/мл IgG при добавлении к ФХ-БСА, иммобилизованному на поверхности 96-лууночного планшета. Ожидалось, что антитела с ИФА сигналом >1 являются антителами с более высокой аффинностью.
В третьей колонке (колонка В) в Таблице 1 показан сигнал, полученный, когда антитела вводили над аминофенилфосфорилхолином, ковалентно иммобилизованным на биосенсорном чипе, и определяли связывание путем поверхностного плазмонного резонанса с применением прибора Biacore 3000. Чем выше был сигнал Biacore, тем большее наблюдалось связывание.
В четвертой колонке (колонка С) в Таблице 1 показаны результаты анализа для определения специфичности антител к фосфорилхолину, путем оценки связывания с ковалентно иммобилизованным аминофенолом, который является линкером, используемым для ковалентного сцепления фосфорилхолина с БСА или биосенсорным чипом. Некоторые из антител связывались с линкерной молекулой также как, или лучше, чем с аминофенилфосфорилхолином. Эти антитела, вероятно, не являются эффективными терапевтическими антифосфорилхолиновыми антителами.
В пятой колонке (колонка D) в Таблице 1 обобщены результаты анализа способности антител к ингибированию поглощения оЛПНП макрофагами, которое является ранним событием при сердечно-сосудистом воспалении, и приводит к образованию пенистых клеток. Поглощение макрофагами контролировали путем проточной цитометрии с применением флуоресцентно модифицированных оЛПНП в присутствии или при отсутствии 80 мкг/мл анализируемого антитела. 100 мкг/мл аффинно очищенных IgM анти-ФХ поликлональных антител использовали в качестве положительного контроля. Количество оЛПНП, поглощенных в присутствии анализируемых моноклональных антител, измеренное флуоресценцией, делили на флуоресценцию, наблюдаемую в присутствии поликлонального антитела, и затем умножали на 100. Таким образом, значение ниже 100 указывает, что антитело в концентрации 80 мкг/мл было более эффективным в ингибировании поглощения оЛПНП, чем поликлональное анти-ФХ антитело, экстрагированное из человеческой сыворотки в концентрации 100 мкг/мл. Подобным образом, значение выше 100 указывает, что антитело было менее эффективным, чем поликлональное анти-ФХ антитело.
Отмечалось, что некоторые из антител ингибировали поглощение подобно, или лучше, чем поликлональный анти-ФХ контроль. Кроме того, отмечалось, что некоторые антитела стимулировали поглощение оЛПНП макрофагами, из-за этого свойства эти антитела исключали из отбора.
В последней колонке (колонка Е) Таблицы 1 показаны данные ИФА, полученные при добавлении IgG в лунки 96-луночного планшета, содержащего оЛПНП или нативные ЛПНП. Отношение сигнала ИФА, наблюдаемого при связывании оЛПНП, к сигналу, наблюдаемому для ЛПНП, показано в Таблице 1 для каждого анализируемого антитела. Очевидно, что некоторые антитела лучше связываются с оЛПНП, чем с ЛПНП.
Таблица 1. Краткая сводка связывающих свойства полных человеческих IgG анти-ФХ антител
Подробные заголовки колонок:
A) Связывание с ФХ, конъюгированным с БСА, путем ИФА при 15,6 нг/мл антител (оптическая плотность)
B) Связывание с аминофенил-ФХ при анализе с помощью Biacore (усл. ед.)
C) Связывание с аминофеноловым линкером при анализе с помощью Biacore (усл. ед.)
D) Процент поглощения оЛПНП макрофагами в присутствии 80 мкг/мл антител (а)
E) Связывание с оЛПНП против ЛПНП при ИФА (сигнал оЛПНП/сигнал ЛПНП) (b)
а) Поглощение оЛПНП макрофагами. Поглощение Дил-меченых (меченых 1,1'-диокатдецил- -3,3,3',3'-тетраметилиндокарбоцианин перхлоратом) окисленных медью ЛПНП (оЛПНП, Intracel Corp, США) исследовали на макрофагах, полученных из человеческих ТНР-1 моноцитов (АТСС, США). Дифференцировку индуцировали путем инкубации с 100 нМ ФМА (Sigma-Aldrich) в среде RPMI с добавлением 10% ЭТС в течение 24 часов, после чего среду заменяли, и клетки оставляли еще на 48 часов. Клетки инкубировали с антителами, как указано, при 37°С в течение 50-60 минут. Далее, добавляли 20 мкг/мл оЛПНП, и продолжали инкубацию в течение 5 часов. В конце периода инкубации клетки отмывали два раза ледяным ФБР/0,2% БСА, и еще раз ФБР. Клетки собирали в ФБР, содержащем 2% ПФА. Для получения и анализа данных использовали FACS Calibur с программным обеспечением Cell Quest. Для каждого образца анализировали минимум 10,000 клеток.
b) ИФА оЛПНП. чЛПНП (Kalen Biomedical # 770200-4), оЛПНП (Kalen Biomedical # 770252-7) (эти данные не показаны) наносили в концентрации 10 мкг/мл и в объеме 100 мкл/лунку на ИФА планшет (Immulon 2НВ) в течение ночи при 4°С. Неспецифическое связывание на планшетах блокировали 1% раствором БСА (300 мкг/лунку) в течение 2 часов при комнатной температуре. После промывания планшет инкубировали с указанными антителами (100 мкл/лунку; 25-100 нМ) в течение 1 часов при комнатной температуре. Конъюгированные с АП вторичные антитела козы к иммуноглобулинам человека (ThermoScientific # 31316) в разведении 1:5000 добавляли к отмытому планшету в количестве 100 мкл/лунку, и инкубировали в течение 1 часа при комнатной температуре. Добавляли реагент для детекции (ThermoScientific # 37621) (100 мкл/лунку), и планшет немедленно считывали в кинетическом режиме при 405 нм при температуре 30°С. Результаты показаны в виде ОПоЛПНП/ОПЛПНП.
Анализ аффинности анти-ФХ IgG к ФХ посредством ППР
Проводили скрининг IgG на связывание с ФХ с применением биосенсора для поверхностного плазмонного резонанса (ППР) Biacore. Аминофенилфосфорилхолин (Biosearch Technologies) связывали через свободную аминогруппу с одной проточной кюветой из СМ5 чипа до плотности 120 усл. ед. Аминофеноловый линкер связывали с другой проточной кюветой того же самого СМ5 чипа до плотности около 120 усл. ед. ФХ-ГЛУ и ФХ-БСА также связывали с отдельными проточными кюветами СМ5 чипа.
С применением этих поверхностей с ФХ, иммобилизованным в различных контекстах, антитела вводили при 100 нМ 50 мкл/мин и получали сенсограммы связывания. Аффинность М99-В05 определяли путем пропускания различных концентраций антител над поверхностью при 50 мкл/мин. По отношению к иммобилизованному антигену антитела проявляли быструю скорость ассоциации и быструю скорость диссоциации, что не позволило получить надежные значения константы ассоциации и константы диссоциации из кинетических сенсограмм.
Наблюдаемый сигнал для каждой концентрации антитела рядом с концом введения наносили на график против концентрации антитела, и подгоняли данные до стандартного гиперболического уравнения равновесного связывания (Фигура 1). Как видно на Фигуре 1, М99-В05, как кажется, связывается с аминофенил-ФХ с кажущейся константной диссоциации примерно 150 нМ. Оба анализируемых препарата имели эквивалентные значения константы диссоциации, но значения Rmax (максимального ответа) отличались. Значения кажущейся константы диссоциации, наблюдаемые для каждого антитела на этой поверхности, могут представлять или не представлять аффинность, наблюдаемую на более физиологических субстратах.
Скрининг очищенных анти-ФХ IgG с помощью ИФА
Также проводили скрининг очищенных IgG на связывание с ФХ с применением ИФА с ФХ-БСА. Эти данные были подогнаны для получения расчетных значений ЕС50 (Фигура 2).
Ингибирование оЛПНП-индуцированного высвобождения МСР-1 из моноцитов
Некоторые из антител тестировали на их способность к блокаде высвобождения хемокина МСР-1 из моноцитов в ответ на стимуляцию оЛПНП. Как показано в Таблице 2, М99-В05 было очень эффективным в блокаде оЛПНП-индуцированного высвобождения МСР-1. Это антитело сильно ингибировало высвобождение МСР-1 с IC50 в наномолярном диапазоне.
МСР-1 является мощным провоспалительным цитокином, стимулирующим приток лейкоцитов в участок атеросклеротического поражения (Reape and Groot. 1999. Chemokines and atherosclerosis. Atherosclerosis 147, 213-225 («Хемокины и атеросклероз»)). При использовании IgG антистрептавидина А2 в качестве отрицательного контроля не выявлено ингибирования оЛПНП-индуцированного высвобождения МСР-1 из моноцитов (данные не показаны).

Моноциты выделяли из человеческой крови и стимулировали 2 мкг/мл окисленных медью оЛПНП в присутствии или при отсутствии 10 пмоль - 40 нмоль анти-ФХ IgG. Уровни МСР-1 в клеточной среде определяли с применением коммерческого МСР-специфичного ИФА набора.
Также было показано, что антитело (М99-В05) связывается с тканью человека, пораженной атеросклерозом (Фигура 6).
Анализы in vivo
На основании комбинации благоприятных связывающих свойств in vitro и функциональности в анализах in vitro, антитела M4-G2, M73-G03 и М99-В05 далее тестировали на модели коронарного воспаления in vivo.
На этой мышиной модели определяли приток воспалительных клеток в субэндотелиальную ткань (т. е. медию) в ответ на повреждение сосуда, индуцированное путем размещения ограничительной манжеты вокруг выделенной бедренной артерии (Фигура 3). На Фигуре 3 видно, что М99-В05 ограничивал приток лейкоцитов в субэндотелиальный слой, наблюдаемое снижение было статистически значимым. Напротив, и несмотря на благоприятные связывающие свойства in vitro и функциональность в анализах in vitro, ни M4-G2, ни M73-G03 не показали какого-либо статистически значимого снижения по сравнению с контрольным антителом (антистрептавидин А2 IgG, обозначенным как «HuIgG1 a-A2»).
Очень отличающийся эффект М99-В05 в этом анализе, по сравнению с M4-G2 и M73-G03, нельзя было предвидеть, и он был неожиданным для авторов изобретения. Это показало, что эффективность анти-ФХ антител in vivo нельзя ожидать из положительных данных анализов in vitro.
Соответственно, М99-В05 анализировали на модели сосудистого рестеноза у мышей, где повреждение индуцировали путем размещения манжеты вокруг бедренной артерии, но оставляя для прогрессирования на 14 суток вместо 3 суток. Степень стеноза, наблюдаемую по утолщению неотимы сосуда в пораженных артериях, затем анализировали гистохимическим способом (Фигура 4). На Фигуре 4 видно, что М99-В05 существенно подавляет утолщение стенки сосуда после индуцированного манжетой повреждения сосуда. Это дополнительно показало, что М99-В05 обладает высокой эффективностью in vivo.
Конструкция эмбрионального типа и стабильных мутантов
Анализ аминокислотной последовательности вариабельных доменов тяжелых и легких цепей М99-В05 антитела установил аминокислотные замены для конструкций из настоящего изобретения со снижением возможной иммуногенности и предотвращением модификации чувствительных аминокислот, которая возможна при экспрессии и очистке антител.
В следующих таблицах показано выравнивание аминокислотной последовательности вариабельного домена с наиболее близкородственной последовательностью антитела эмбрионального типа с применением базы данных Kabat. Также в таблицах выделены аминокислотные замены, выполненные в антителах, чтобы обеспечить их близость с эмбриональным типом, в дополнение к мутантам с удаленными возможными участками деамидирования, HCDR3 дисульфидной связи, которые могут создавать проблемы для технологичности (так называемые «стабильные мутанты»).
Мутанты М99-В05
Мутант Х19-А01 имеет те же самые аминокислотные последовательности тяжелых и легких цепей, как и М99-В05 дикого типа, за тем исключением, что первая аминокислота в легкой цепи М99-В05 (глутамин) удалена в X19-А01 для лучшего совпадения с последовательностью эмбрионального типа.
Последовательность Х19-А03 кодирует полное антитело эмбрионального типа, относительно последовательностей эмбрионального типа VH3-23, JH3 тяжелой цепи и VK4-B3, JK1 легкой цепи, без вставки фенилаланина (F) в каркасную часть 1 вариабельной области тяжелой цепи (HV-FR1), плюс аминокислотных замен (стабилизирующие мутации), для возможного снижения изменений аминокислот в белке при экспрессии и очистке. Было установлено, что М99-В05 имеет делецию аминокислоты F в хвосте HV-FR1, по сравнению с последовательностью эмбрионального типа. Вставка F в это положение делает антитело более близким к последовательности эмбрионального типа, и возможно, снижает иммуногенность. Мутант Х19-А03 был сконструирован содержащим все другие замены эмбрионального типа, за исключением вставки F в случае, если эта вставка влияла на связывание с ФХ. Стабильные мутанты, содержащие замену G на А в HV-CDR3, были получены для разрушения возможного участка деамидирования (NG), и замену N на Q в LV-CDR1 для удаления другого возможного участка деамидирования.
Последовательность Х19-А05 мутанта содержит все замены эмбрионального типа, включая вставку F in HV-FR1, и стабилизирующие мутации. Антитело Х19-А05 является единственным мутантным антителом, генерированном в этом примере, которое содержит все замены эмбрионального типа и стабилизирующие мутации.
Мутант Х19-А11 имеет ту же последовательность, что и Х19-А01, но содержит две замены С на S в HV-CDR3 для удаления дисульфида, который, как ожидается, может формироваться в этой области.
Х19-С01 является антителом эмбрионального типа, без вставки F, и с стабилизирующими мутациями с заменами С на S для удаления дисульфида. Антителом сравнения (до удаления дисульфида) является Х19-А03.

Мутации последовательности эмбрионального типа показаны жирным шрифтом. Мутации остатков, которые могут создавать проблемы, связанные с технологичностью, выделены подчеркиванием. CDR области 

Мутации последовательности эмбрионального типа показаны жирным шрифтом. Мутации остатков, которые могут создавать проблемы, связанные с технологичностью, выделены подчеркиванием. CDR области 
Во избежание неопределенности, чтобы избежать любого случайного несоответствия между представлениями последовательностей в данной заявке, последовательности, обеспеченные для VH и VL доменов и различных CDR последовательностей в Таблицах 3 и 4, являются точно определенными последовательностями.
Связывание мутантов М99-В05 с ФХ
Связывание мутантов М99-В05 с ФХ оценивали путем ИФА (Фигура 5). По данным ИФА (Фигура 5) видно, что многие из мутаций в М99-В05 не оказывают существенного влияния на связывание с ФХ. Однако, замена цистеиновых остатков в Hv-CDR3 серином (Х19-А11 и Х19-С01) снижает аффинность. Ожидается, что эти цистеиновые остатки образуют дисульфид, и присутствуют в последовательности антитела эмбрионального типа, кодируемой VK4-B3. Различия в наблюдаемых сигналах связывания могут быть обусловлены различием в количествах активного антитела в каждом препарате и/или небольшими ошибками при измерении концентрации. Мутантом антитела М99-В05, содержащим максимальное число допустимых замен, оптимизирующих последовательность, был Х19-А05. Это антитело содержало все стабилизирующие замены и замены эмбрионального типа, но сохраняло Hv-CDR3.
Сравнение эффектов М99-В05 and Х19-А05 in vivo
М99-В05 и Х19-А05 тестировали на модели сосудистого рестеноза у мышей, у которых индуцировали повреждение путем размещения манжеты вокруг бедренной артерии, но оставляя для прогрессирования на 14 суток вместо 3 суток. Степень стеноза, оцениваемую по утолщению неоинтимы сосуда в поврежденных артериях, анализировали посредством гистохимического способа, и рассчитывали утолщение интимы (Фигура 7). На Фигуре 7 видно, что Х19-А05 существенно подавляет утолщение стенки сосуда после индуцированного манжетой повреждения сосуда до сходной степени, по сравнению с М99-В05. Эффект Х19-А05 также продемонстрировал явную зависимость от дозы.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ ИНГИБИТОРА ПУТИ ТКАНЕВОГО ФАКТОРА И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2705540C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С HLA-A2/WT1 | 2018 |
|
RU2815176C2 |
| АНТИТЕЛА ПРОТИВ ВИРУСА ГЕПАТИТА В И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2803082C2 |
| АНТИТЕЛО К CLDN18.2 И ЕГО ПРИМЕНЕНИЯ | 2018 |
|
RU2797709C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2810924C2 |
| АНТИТЕЛА И ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, СПЕЦИФИЧНЫЕ К CD19 | 2015 |
|
RU2741105C2 |
| НОВЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ СПЕЦИФИЧЕСКИ СВЯЗЫВАТЬСЯ С CD40 И FAP | 2018 |
|
RU2766234C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
| ТРИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ IL-17A, IL-17F И ДРУГОЙ ПРОВОСПАЛИТЕЛЬНОЙ МОЛЕКУЛЫ | 2016 |
|
RU2680011C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2832669C2 |






















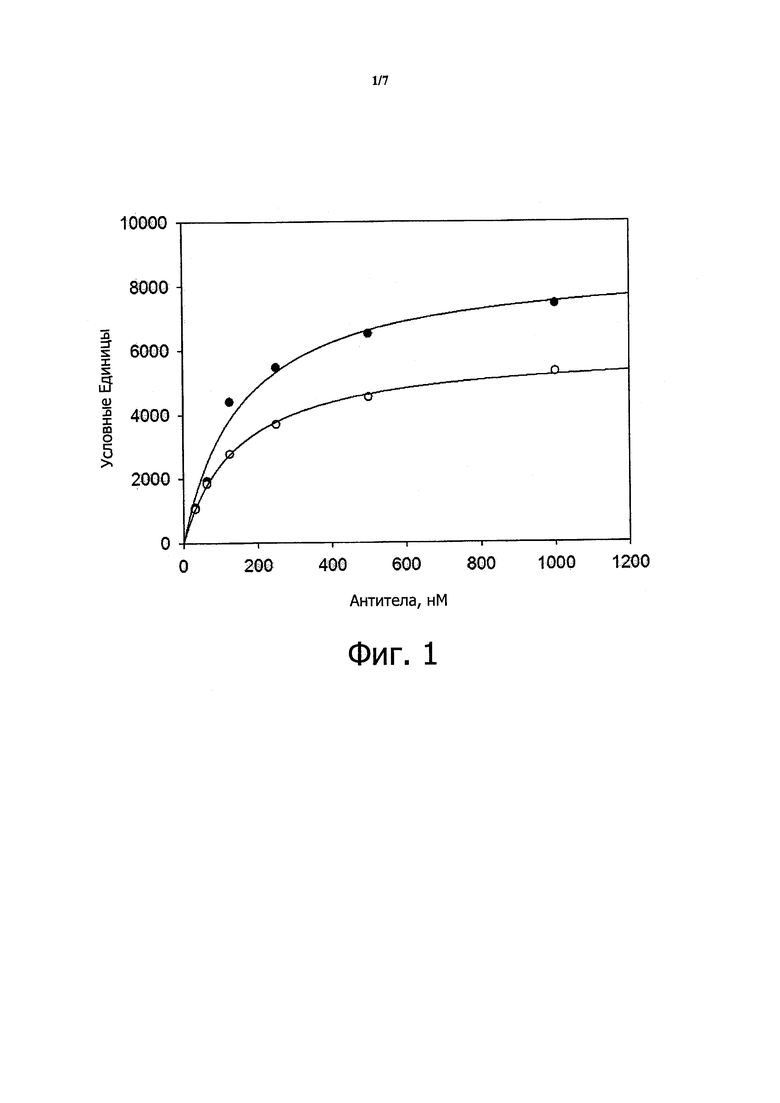
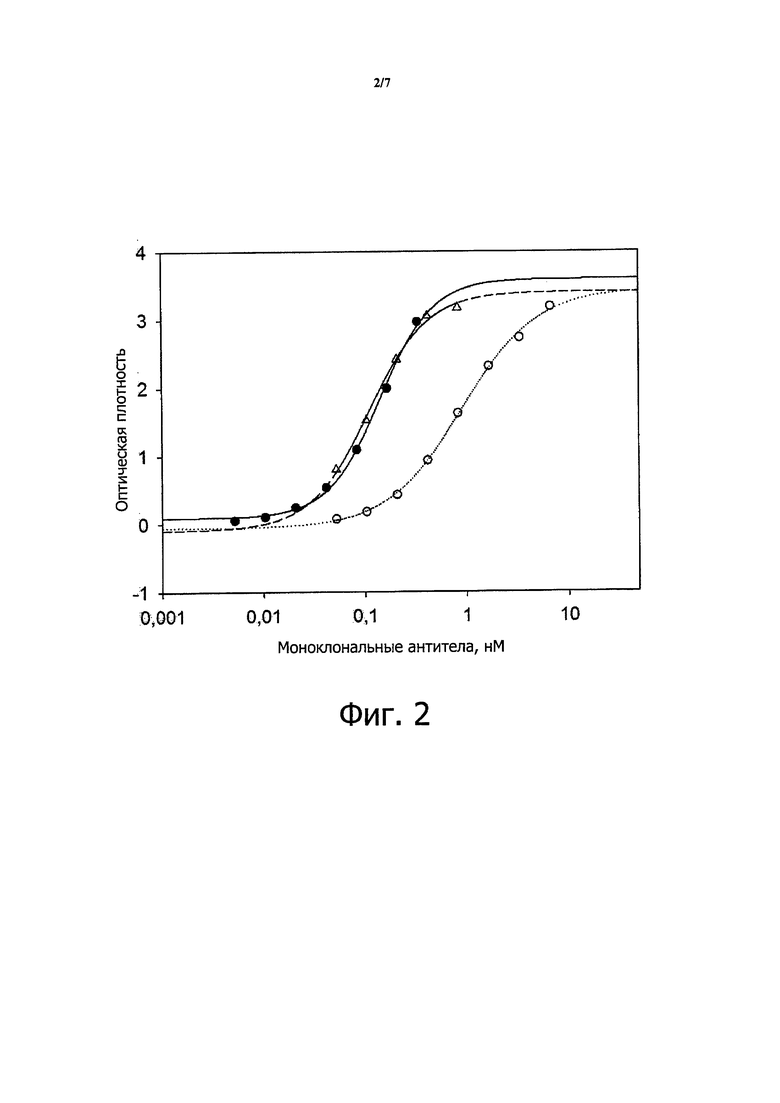
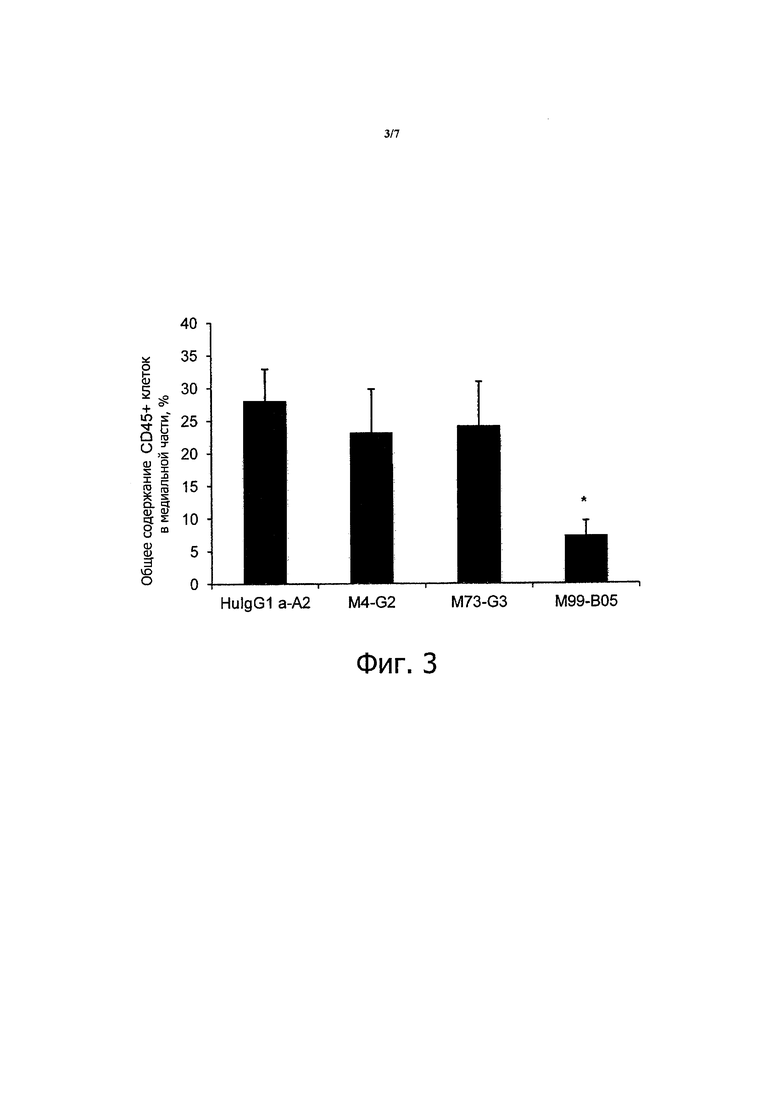
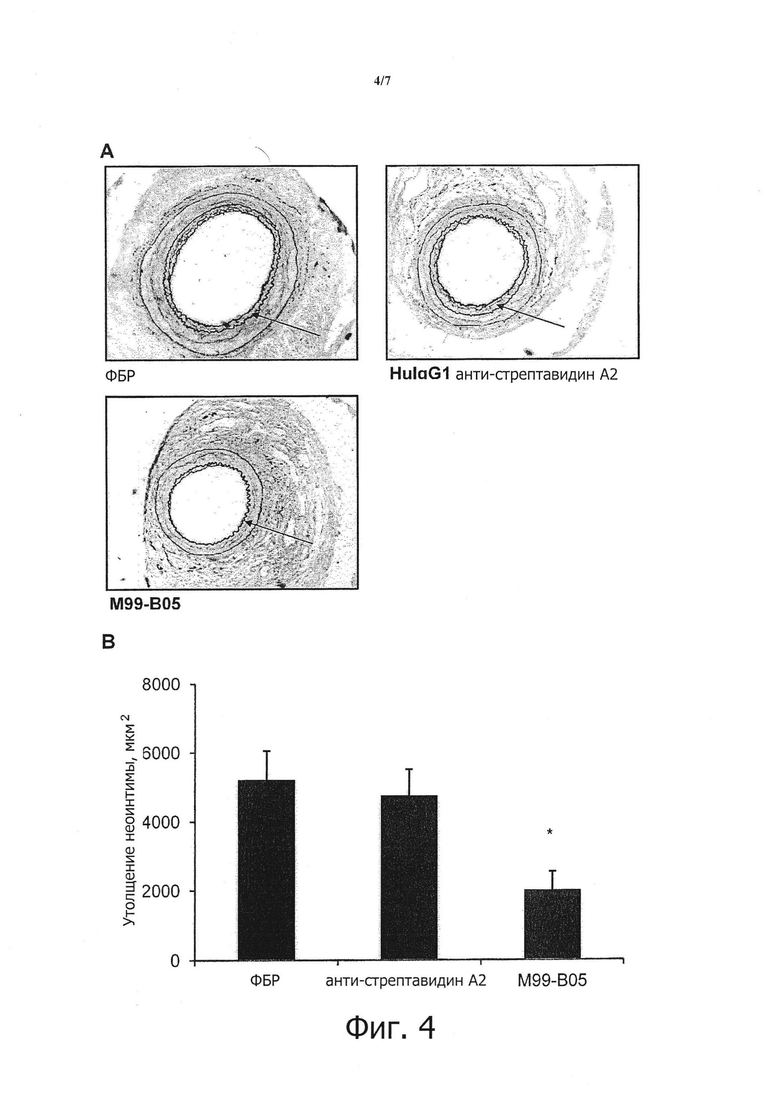
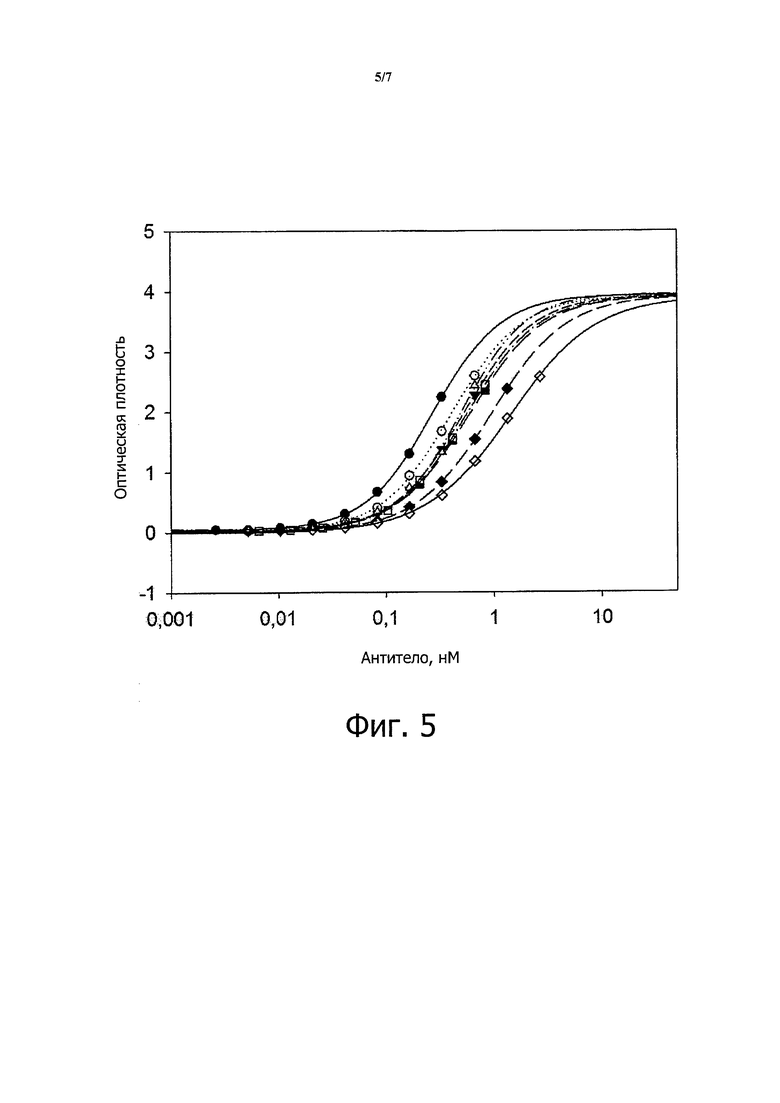

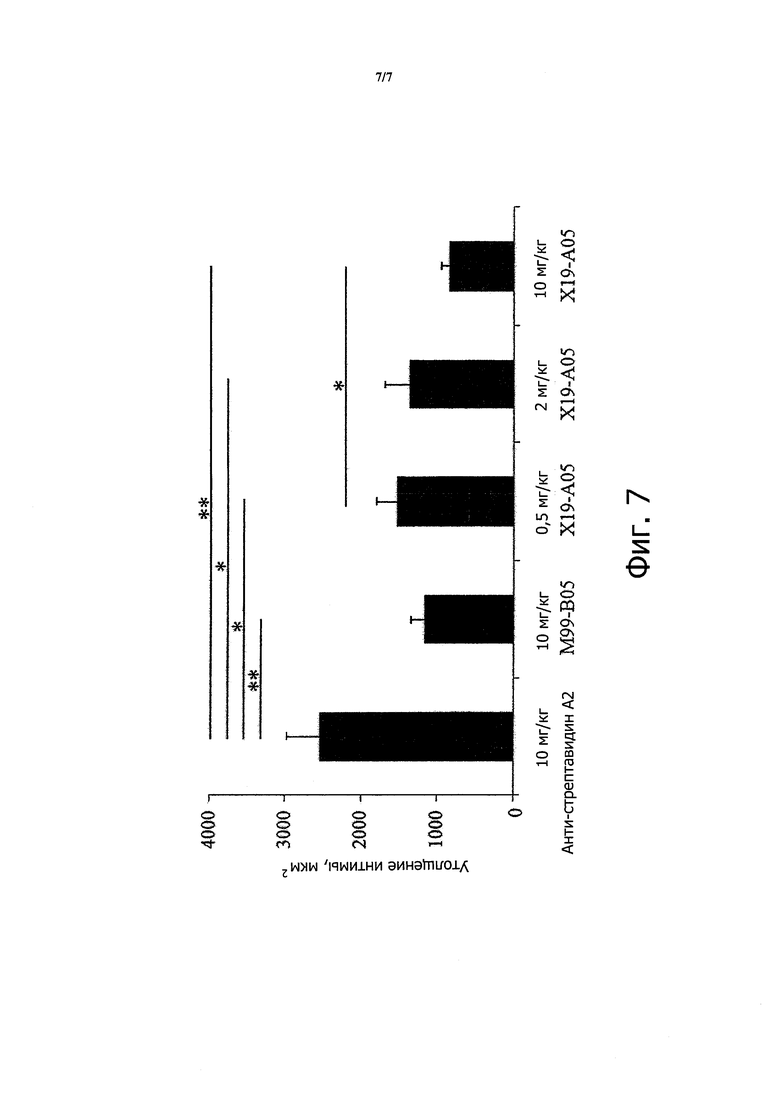
Настоящее изобретение относится к области иммунологии. Предложены антитело и фрагмент антитела, способные к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина. Также рассмотрена фармацевтическая композиция, нуклеиновая кислота, кодирующая антитело или его фрагмент, экспрессирующий вектор, клетка-хозяин и способ получения антитела или фрагмента антитела. Кроме того, описан способ приготовления варианта антитела, способного связываться с фосфорилином и/или конъюгатом фосфорилхолина, или фрагмента такого антитела. Данное изобретение может найти дальнейшее применение в терапии различных состояний, в частности, сердечно-сосудистых заболеваний и болезни Альцгеймера. 7 н. и 9 з.п. ф-лы, 7 ил., 5 табл.
1. Антитело или фрагмент антитела, способные к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина, где антитело или фрагмент, способные к связыванию с конъюгатом фосфорилхолина, специфично связывают фосфорилхолиновый фрагмент в конъюгате фосфорилхолина, где антитело или фрагмент антитела содержит вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) и где:
(а) VH домен содержит аминокислотную последовательность, включающую три гипервариабельных участка (CDR), выбранных из группы, состоящей из:
CDR1 последовательности, содержащей аминокислотную последовательность, обладающую 100%-ной идентичностью последовательности с последовательностью SEQ ID NO: 17;
CDR2 последовательности, содержащей аминокислотную последовательность, обладающую 100%-ной идентичностью последовательности с последовательностью SEQ ID NO: 18; и
CDR3 последовательности, содержащей аминокислотную последовательность, обладающую 100%-ной идентичностью последовательности с последовательностью SEQ ID NO: 19, 20, 21 или 22; и
(b) VL домен содержит аминокислотную последовательность, включающую три гипервариабельных участка (CDR), выбранных из группы, состоящей из:
CDR4 последовательности, содержащей аминокислотную последовательность, обладающую 100%-ной идентичностью последовательности с последовательностью SEQ ID NO: 23 или 24;
CDR5 последовательности, содержащей аминокислотную последовательность, обладающей 100%-ной идентичностью последовательности с последовательностью SEQ ID NO: 25;
CDR6 последовательности, содержащей аминокислотную последовательность, обладающей 100%-ной идентичностью последовательности с последовательностью SEQ ID NO: 26.
2. Антитело или фрагмент антитела по п. 1, в котором:
VH домен содержит аминокислотную последовательность, включающую CDR1, CDR2 и CDR3 последовательности, присутствующие в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 и 15, или аминокислотной последовательности, обладающей по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью последовательности с аминокислотной последовательностью из любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15; и/или
VL домен содержит аминокислотную последовательность, включающую CDR4, CDR5 и CDR6 последовательности, присутствующие в аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16, или аминокислотной последовательности, обладающей по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью последовательности с аминокислотной последовательностью из любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16.
3. Антитело или фрагмент антитела по п. 1, в котором:
VH домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, или аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью последовательности с аминокислотной последовательностью из любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15; и
VL домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16, или аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90% или 95%-ной идентичностью последовательности с аминокислотной последовательностью из любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16.
4. Антитело или фрагмент антитела по п. 1, в котором:
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 1, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 2;
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 3, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 4;
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 5, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 6;
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 7, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 8;
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 9, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 10;
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 11, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 12;
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 13, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 14; или
VH домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 15, и
VL домен содержит аминокислотную последовательность, обладающую по меньшей мере 80%, 85%, 90%, 95% или 100%-ной идентичностью последовательности с SEQ ID NO: 16.
5. Антитело или фрагмент антитела по п. 1, являющееся человеческим или гуманизированным антителом или фрагментом антитела, таким как человеческое или гуманизированное моноклональное антитело.
6. Антитело или фрагмент антитела по любому из пп. 1-5 для применения в медицине.
7. Антитело или фрагмент антитела по любому из пп. 1-5 для применения в предотвращении, профилактике и/или лечении млекопитающих, включая людей, против атеросклероза, связанного с атеросклерозом заболевания или сердечно-сосудистого заболевания, для применения в предотвращении, профилактике и/или лечении болезни Альцгеймера, и/или для применения в иммунизации или профилактике, предотвращении или лечении метаболических заболеваний у млекопитающих, включая людей, где метаболическое заболевание является состоянием, выбранным из группы, включающей инсулиновую резистентность, непереносимость глюкозы, гипергликемию, диабет I типа, диабет II типа, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, дислипидемию и синдром поликистоза яичников (PCOS).
8. Антитело или фрагмент антитела по п. 7, где сердечно-сосудистое заболевание выбрано из группы, включающей атеросклероз, острый коронарный синдром, острый инфаркт миокарда, инфаркт миокарда (сердечный приступ), стабильную и нестабильную стенокардии, аневризму, болезнь коронарных артерий (БКА), ишемическую болезнь сердца, ишемию миокарда, сердечную смерть и внезапную сердечную смерть, кардиомиопатию, застойную сердечную недостаточность, сердечную недостаточность, стеноз, болезнь периферических артерий (БПА), перемежающуюся хромоту, критическую ишемию конечностей и инсульт.
9. Фармацевтическая композиция для профилактики, предотвращения или лечения состояния, включающая или состоящая по существу из эффективного количества антитела или фрагмента антитела как определено в любом из предыдущих пунктов, и фармацевтическим приемлемого носителя или наполнителя, где указанное состояние, выбрано из группы, включающей атеросклероз, связанное с атеросклерозом заболевание, сердечно-сосудистое заболевание, болезнь Альцгеймера, метаболическое заболевание, выбранное из группы, включающей резистентность к инсулину, нарушение толерантности к глюкозе, гипергликемию, диабет I типа, диабет II типа, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, дислипидемию, и синдром поликистозных яичников (СПКЯ), где сердечно-сосудистое заболевание выбрано из группы, включающей атеросклероз, острый коронарный синдром, острый инфаркт миокарда, инфаркт миокарда (сердечный приступ), стабильную и нестабильную стенокардии, аневризму, болезнь коронарных артерий (БКА), ишемическую болезнь сердца, ишемию миокарда, сердечную смерть и внезапную сердечную смерть, кардиомиопатию, застойную сердечную недостаточность, сердечную недостаточность, стеноз, болезнь периферических артерий (БПА), перемежающуюся хромоту, критическую ишемию конечностей, и инсульт.
10. Фармацевтическая композиция по п. 9 для применения в медицине.
11. Фармацевтическая композиция по п. 9 для применения в предотвращении, профилактике и/или лечении млекопитающих, включая людей, против атеросклероза, связанного с атеросклерозом заболевания или сердечно-сосудистого заболевания, для применения в предотвращении, профилактике и/или лечении болезни Альцгеймера, и/или для применения в иммунизации или профилактике, предотвращении или лечении метаболических заболеваний у млекопитающих, включая людей, где метаболическое заболевание является состоянием, выбранным из группы, включающей инсулиновую резистентность, непереносимость глюкозы, гипергликемию, диабет I типа, диабет II типа, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, дислипидемию и синдром поликистоза яичников (PCOS).
12. Нуклеиновая кислота, кодирующая антитело или фрагмент антитела по любому из пп. 1-8.
13. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п. 12.
14. Клетка-хозяин для получения антитела или его фрагмента по любому из пп. 1-8, включающая нуклеиновую кислоту по п. 12 и/или вектор по п. 13.
15. Способ получения антитела или фрагмента антитела по любому из пп. 1-8, включающий культивирование клетки-хозяина которая определена в п. 14, и извлечение из нее антитела или фрагмента антитела которые определены в пп. 1-8.
16. Способ приготовления варианта антитела или фрагментов антител по любому из пп. 1-8, где вариант сохраняет способность к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина, включающий:
(i) обеспечение нуклеиновой кислоты которая определена в п. 12, кодирующей исходное антитело или фрагмент антитела;
(ii) введение одной или нескольких нуклеотидных мутаций в области последовательности нуклеиновой кислоты, кодирующие аминокислоты, необязательно в пределах областей, кодирующих VH и/или VL домен(ы), так чтобы мутантная нуклеиновая кислота, кодирующая вариантное антитело или фрагмент антитела, имела отличающуюся аминокислотную последовательность, по сравнению с исходным антителом или фрагментом;
(iii) экспрессию вариантного антитела или фрагмента антитела, кодируемых мутантной последовательностью нуклеиновой кислоты; и
(iv) сравнение способности вариантного антитела или фрагмента антитела и исходного антитела или фрагмента антитела к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина,
и дополнительно включает выбор тех вариантов, которые обладают по существу равной или повышенной способностью к связыванию с фосфорилхолином и/или конъюгатом фосфорилхолина, по сравнению с исходным антителом.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БЕЛКОВ, СПЕЦИФИЧНЫХ К ФОСФОРИЛХОЛИНУ | 1991 |
|
RU2014609C1 |
| PLUCKTHUN A., PFITZINGER I | |||
| "Comparison of the Fv fragments of different phosphorylcholine binding antibodies expressed in Escherichia coli." Annals of the New York Academy of Sciences, 1991; 646(1): 115-124 | |||
| KANFER J.N., MCCARTNEY D.G | |||
| "Reduced phosphorylcholine hydrolysis by homogenates of temporal regions of Alzheimer's brain." Biochemical and biophysical research communications, 1986; 139(1): 315-319. | |||
Авторы
Даты
2018-05-21—Публикация
2012-08-08—Подача