ПЕРЕКРЕСТНАЯ ССЫЛКА
Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США № 61/726006, поданной 13 ноября 2012, которая включена в настоящее описание в виде ссылки в полном объеме для всех целей.
УРОВЕНЬ ТЕХНИКИ
Все организмы имеют совершенные развитые метаболические пути, которые поддерживают энергетический гомеостаз за счет поддержания баланса поглощения и метаболического потребления энергии в соответствии необходимыми затратами организма. У млекопитающих такие пути регулируют потребление пищи, гомеостаз глюкозы, запасания энергии в жировой ткани и/или в мышцах, и расходование энергии, например, за счет физической активности. Нарушение функционирования таких путей часто возникает в результате избыточного потребления энергии по сравнению с расходом энергии, что приводит к несбалансированному энергетическому гомеостазу, что в свою очередь может привести к многочисленным метаболическим расстройствам. К таким расстройствам относятся ожирение, диабет, гипертония, артериосклероз, высокий уровень холестерина и гиперлипидемия.
Высокая частота метаболических расстройств у людей и связанное с этим влияние на здоровье и смертность представляют собой значительную нагрузку для здравоохранения. Например, ожирением, клинически определяемым как состояние в случае индекса массы тела более 30 кг/м2, судя по оценкам, поражено 35,7% популяции взрослых людей в США. Ожирение повышает вероятность многих заболеваний, таких как болезнь сердца и диабет типа II, и ожирение является одно из лидирующих причин смертности во всем мире, которую можно предотвратить. По оценкам, в США ожирение вызывает около 110000-365000 смертей в год. Диабет является метаболическим расстройством, характеризуемым высокими уровнями глюкозы в крови или низко толерантностью к глюкозе и по оценкам поражает 8% популяции в США. Диабет также в значительной степени ассоциирован с высоким риском смерти вследствие заболевания сосудов, злокачественной опухоли, заболевания почек, инфекционных болезней, экзогенных факторов, преднамеренного причинения себе вреда, расстройств нервной системы и хронического легочного заболевания (N. Engl. J. Med. 2011; 364: 829-841). Метаболическим синдромом, при котором субъекты имеют центральное ожирение и по меньшей мере два других метаболического расстройства (таких как высокий уровень холестерина, высокое кровяное давление или диабет), по оценкам поражено 25% популяции в США.
Сиртуины являются высоко консервативными деацетилазами белков и/или АДФ-рибозилтрансферазами, которые, как было показано, увеличивают продолжительность жизни низших организмов в моделях, таких как дрожжи, C. elegans и Drosophila. Было показано, что у млекопитающих сиртуины действуют в качестве метаболических сенсоров, отвечающих на сигналы окружающей среды, координируя активность генов, которые регулируют множественные пути гомеостаза энергии. Например, исследования показали, что активация сиртуинов имитирует эффекты ограничения калорий, вмешательство, которое, как показано, продлевает продолжительность жизни, и активирует гены, которые улучшают гомеостаз глюкозы и превращение жира с получением энергии за счет окисления жирных кислот.
Путь сиртуинов также включает фосфодиэстеразы (PDE). PDE являются ферментами, которые взаимодействуют с циклическим аденозинмонофосфатом (цАМФ) и циклическим гуанозинмонофосфатом (цГМФ). Семейство ферментов PDE включает в себя несколько подклассов, включая PDE 1-11 человека. Ингибиторы таких фосфодиэстераз могут предотвращать инактивацию цАМФ и цГМФ и могут оказывать множество различных физиологических эффектов. Ингибиторы PDE могут быть избирательными, предпочтительно ингибирующими один подкласс PDE по сравнению с другим подклассом, или неизбирательными, которые имеют значительно более низкую степень избирательности по отношению к отдельным подклассам PDE. Силденафил является примером избирательного ингибитора PDE, который демонстрировал избирательное ингибирование PDE 5. Силденафил является фармацевтически активным средством, которое использовали для лечения легочной гипертензии, эректильной дисфункции и высотной болезни.
Были предприняты многочисленные попытки разработать средства лечения метаболических расстройств за счет целенаправленного воздействия на специфичные пути энергетического обмена. Такие попытки привели, например, к разработке, изофлавонов (заявка на выдачу патента США № 20110165125), тетрагидролипстатин (патент США № 6004996) и композиции, которые модулируют пути SIRT1 и AMPK (заявки на выдачу патента США № 20100210692, 20100009992, 20070244202 и 20080176822). Однако такие попытки имели ограниченный успех. Например, применение активатора SIRT1 ресвератрола на человеке приостановлено из-за его ограниченной биодоступности, необходимости в высоких дозах, которые привели к проблемам, связанным с безопасностью. Таким образом, сохраняется большая потребность в средствах лечения, которые могут решить проблему широкого круга метаболических расстройств за счет безопасной регуляции метаболических путей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в общем, относится к области регулирования энергетического обмена. В некоторых вариантах настоящее изобретение относится к композициям, способам и наборам для регулирования энергетического обмена с использованием ингибиторов PDE, таких как PDE 5 и аминокислот с разветвленными цепями.
Композиции, содержащие ингибиторы PDE, могут быть эффективными в регулировании энергетического обмена, так как PDE являются компонентами пути сиртуинов. Поскольку такие ингибиторы PDE могут оказывать влияние на путь сиртуина, композиции, содержащие ингибиторы PDE, как избирательные, так и неизбирательные, могут оказывать полезное влияние на регулирование энергетического обмена.
Настоящее изобретение направлено на удовлетворение потребности в улучшенных композициях и добавках для регулирования энергетического обмена. Регулирование энергетического обмена может обеспечить возможность уменьшения жировой ткани, усилению окисления жиров или повышения чувствительности к инсулину и/или уменьшения воспаления или окислительного стресса. Такие эффекты могут представлять собой путь повышения или регуляции энергетического обмена, включая клеточный метаболизм и митохондриальный биогенез.
Настоящая заявка относится к композициям, применимым для индукции повышения уровня окисления жирных кислот и митохондриального биогенеза у субъекта. Композиции также вызывают активацию Sirt1 и Sirt3, таким образом опосредуя полезные последующие эффекты, включая профилактику и лечение диабета, сердечнососудистого заболевания и воспалительного заболевания. Такие композиции содержат ингибитор PDE, включая, но без ограничения, ингибитор PDE5, такой как аванафил, иоденафил, мироденафил, силденафил, тадалафил, икариин, варденафил, уденафил или запринст в сочетании с аминокислотой с разветвленной цепью и/или ее метаболитами (например, бета-гидроксиметилбутиратом (HMB), лейцином, кето-изокапроновой кислотой (KIC) или сочетанием HMB, KIC и/или лейцина). Аминокислотой с разветвленной цепью может быть лейцин, и метаболитами могут быть HMB и KIC. Настоящая заявка также относится к способам повышения уровня окисления жирных кислот у субъекта, включающим в себя введение описанных композиций.
Один аспект изобретения относится к композиции, эффективной в отношении усиления энергетического обмена, содержащей: (a) ингибитор PDE, например, ингибитор PDE5; и (b) лейцин и/или метаболит лейцина. В некоторых вариантах композиция усиливает энергетический обмен у субъекта в более высокой степени по сравнению с введением субъекту компонентом (a) или (b) отдельно. В некоторых вариантах лейцин и/или метаболит лейцина присутствуют в форме свободной аминокислоты и/или свободного метаболита аминокислоты. Например, лейцин может присутствовать в форме, которая не содержит пептидной связи.
В некоторых вариантах усиленный энергетический обмен измеряют по повышению окисления жирных кислот адипоцита по меньшей мере примерно на 300%, повышению утилизации глюкозы адипоцитом по меньшей мере на 150%, повышению утилизации глюкозы адипоцитом в случае изменения по меньшей мере на 60%, или увеличению митохондриальной биомассы по меньшей мере примерно на 15%.
В некоторых вариантах усиленный энергетический обмен измеряют по снижению постпрандиального уровня глюкозы по меньшей мере на 20%, снижению постпрандиального уровня инсулина по меньшей мере на 30%, снижению уровня глюкозы натощак по меньшей мере на 40%, снижению уровня инсулина натощак по меньшей мере на 40%, снижению уровня глюкозы в крови в ответ на нагрузку глюкозой по меньшей мере на 15%, двукратному улучшению результатов измерения толерантности к инсулину или снижению воспалительного стресса по меньшей мере на 20%. В некоторых вариантах уровень глюкозы в крови в ответ на нагрузку глюкозой измеряют по площади под кривой толерантности к глюкозе.
В некоторых вариантах ингибитором PDE5 является аванафил, иоденафил, мироденафил, силденафил, тадалафил, икариин, варденафил, уденафил или запринст. В других вариантах ингибитором PDE5 является силденафил или икариин. В некоторых вариантах ингибитором PDE5 является икариин. В некоторых вариантах компонентом (b) является HMB. В некоторых вариантах компонентом (b) является свободный лейцин. В других вариантах композиция дополнительно содержит неизбирательный ингибитор PDE. В других вариантах композиция дополнительно содержит витамин B6.
В некоторых вариантах композиция дополнительно содержит фармацевтически активное средство. Композиция дополнительно может содержать два фармацевтически активных средства. Одним из двух фармацевтически активных средств может быть силденафил. В некоторых вариантах композиция приготовлена для перорального приема.
Композиция может быть в виде стандартной лекарственной дозы, содержащей субтерапевтическое количество компонента (a). Субтерапевтическое количество компонента (a) может составлять примерно от 0,1 до 20 мг силденафила. Субтерапевтическое количество компонента (a) может составлять примерно от 0,1 до 10 мг силденафила. Субтерапевтическое количество компонента (a) может составлять примерно 0,5-50 мг аванафила, 0,05-10 мг иоденафила, 0,25-25 мг мироденафила, 0,01-1,25 мг тадалафила, 0,01-1,25 мг варденафила, 0,5-50 мг уденафила, 0,5-50 мг запринста или 0,05-100 мг икариина. Компонент (b) может содержать по меньшей мере примерно 500 мг лейцина. Компонент (b) может содержать по меньшей мере примерно 200 мг HMB. В некоторых вариантах компонент (b) содержит 50-1000 мг свободного лейцина. Компонент (b) может содержать 500-700 мг свободного лейцина.
Другой аспект изобретения относится к композиции, эффективной для усиления энергетического обмена, содержащей: (a) ингибитор PDE5; и (b) полифенол, при этом композиция усиливает энергетический обмен у субъекта в более высокой степени по сравнению с введением субъекту компонента (a) или (b) отдельно. Полифенолом может быть ресвератрол.
Полифенолом может быть стильбен или гидроксикоричная кислота. Полифенолом может быть хлорогеновая кислота, ресвератрол, кофеиновая кислота, пикеатаннол, эллаговая кислота, галлат эпигаллокатехина (EGCG), экстракт виноградных косточек или любой их аналог. Композиция может дополнительно содержать лейцин и/или метаболит лейцина.
Один аспект изобретения относится к способу регулирования энергетического обмена у субъекта, нуждающегося в таком регулировании, включающему в себя введение субъекту композиции, описанной в настоящем описании. Композицию можно вводить перорально.
Другой аспект изобретения относится к способу регулирования энергетического обмена, включающему в себя идентификацию субъекта, имеющего или склонного к ожирению или диабету, введение субъекту композиции, описанной в настоящей публикации.
Изобретение также относится к способу регулирования энергетического обмена у субъекта, нуждающегося в таком регулировании, включающему в себя введение субъекту стандартной дозы, содержащей субтерапевтическое количество ингибитора PDE, например, ингибитора PDE5 и по меньшей мере примерно 500 мг лейцина или 200 мг HMB. Субтерапевтическое количество ингибитора PDE, например, ингибитора PDE5, может быть меньше, чем примерно 10 мг/сутки. Ингибитор PDE5 может представлять собой силденафил. Лейцин может быть в форме свободной аминокислоты, например, в интактной форме. Например, лейцин может присутствовать в форме, которая не содержит пептидной связи.
Один аспект изобретения относится к способу повышения энергетического обмена у субъекта, включающему в себя: введение композиции, описанной в настоящей публикации, в соответствии с выбранным уровнем дозы, при этом выбранный уровень дозы индуцирует у субъекта уровень в циркуляции примерно 1 нМ силденафила и примерно 0,5 мМ лейцина. Лейцин может быть в форме свободной аминокислоты, например, в интактной форме. Например, лейцин может присутствовать в форме, которая не содержит пептидной связи. В некоторых случаях любой из способов согласно изобретению включает в себя введение композиции в течение более чем 1 недели, в течение более чем 2 недель или в течение более чем 6 недель.
Изобретение также относится к способу лечения диабета у субъекта, нуждающегося в таком лечении, включающему в себя введение субъекту терапевтически эффективной композиции, содержащей ингибитор PDE5; и аминокислоту с разветвленной цепью в форме свободной аминокислоты или ее метаболит. Диабет может представлять собой, например, диабет типа I или диабет типа II. Например, введение композиции может улучшить чувствительность к инсулину у субъекта. Диабет типа I можно охарактеризовать пониженной способностью продуцировать инсулин по сравнению с субъектом, не имеющим диабета типа I. Введение композиции, описанной в настоящее публикации, может улучшить чувствительность субъекта с диабетом типа I к инсулину, который продуцируется в организме субъекта или который вводят субъекту. Улучшенная чувствительность может быть больше, чем чувствительность субъекта, которую измеряли до введения композиции. Диабет типа II можно охарактеризовать пониженной чувствительностью к инсулину. Соответственно, введение композиции, описанной в настоящей публикации, может улучшить чувствительность к инсулину у субъекта с диабетом типа II. Диабет может представлять собой индуцированный питанием диабет. В некоторых вариантах аминокислотой с разветвленной цепью является свободный лейцин. В некоторых вариантах метаболитом аминокислоты с разветвленной цепью является HMB. Понятно, что терапевтически эффективной композицией может быть любая из композиций, описанных в настоящей публикации.
В некоторых вариантах ингибитором PDE5 является икариин. В некоторых вариантах ингибитором PDE5 является силденафил. В некоторых вариантах ингибитором PDE5 является тадалафил. В некоторых вариантах ингибитором PDE5 является варденафил. В некоторых вариантах ингибитором PDE5 является уденафил. В некоторых вариантах ингибитором PDE5 является запринст.
В некоторых вариантах способ включает в себя введение терапевтически эффективной композиции перорально. В некоторых вариантах способ включает в себя введение терапевтически эффективной композиции в течение по меньшей мере одной недели. В некоторых вариантах способ включает в себя введение терапевтически эффективной композиции по меньшей мере в течение двух недель. В некоторых вариантах способ включает в себя введение терапевтически эффективной композиций по меньшей мере в течение шести недель.
В некоторых вариантах введение терапевтически эффективной композиции улучшает симптом диабета у субъекта. Симптомом диабета может быть симптом диабета типа I и/или типа II. Улучшение симптома диабета можно измерить по снижению постпрандиального уровня глюкозы в крови по меньшей мере на 20%, снижению постпрандиального уровня инсулина по меньшей мере на 30%, снижению уровня глюкозы в крови натощак по меньшей мере на 40%, снижению уровня инсулина натощак по меньшей мере на 40%, снижению уровня глюкозы в крови в ответ на нагрузку глюкозой по меньшей мере на 15%, двукратному улучшению результатов оценки толерантности к инсулину или снижению воспалительного стресса по меньшей мере на 20%. В некоторых вариантах уровень глюкозы в крови в ответ на нагрузку глюкозой измеряют по площади под кривой толерантности к глюкозе.
Другой аспект изобретения относится к набору, содержащему многодневный запас стандартных доз композиции, описанной в настоящей публикации, и инструкции по введению указанного многодневного запаса в течение периода времени, составляющего множество дней. В некоторых вариантах набор дополнительно содержит переносной датчик активности.
ВКЛЮЧЕНИЕ В ВИДЕ ССЫЛКИ
Все публикации, патенты и заявки на выдачу патентов, упоминаемые в настоящем описании, включены в виде ссылки в такой же степени, как в том случае, если бы было указано, что каждая отдельная публикация, патент или заявка на патент специально и отдельно включены в виде ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Новые отличительные признаки изобретения подробно указаны в прилагаемой формуле изобретения. Лучшее представление об отличительных признаках и преимуществах настоящего изобретения будет получено при обращении к следующему подробному описанию, в котором представлены иллюстративные варианты осуществления изобретения, в которых использованы принципы изобретения, и к сопровождающим чертежам, на которых:
На фигуре 1 изображена диаграмма, показывающая путь сиртуина.
На фигуре 2 показаны интерактивные эффекты силденафила с HMB, лейцином и ресвератролом на окисление жирных кислот в миотрубочки C2C12. Окисление жирных кислот измеряли в виде потребления O2 в ответ на инъекцию пальмитата и выражали в виде изменения в % от исходного уровня до инъекции. Вертикальная линия показывает время инъекции пальмитата; точки данных слева от такой линии представляют измерения исходного уровня, и точки данных справа от линии показывают ответ в виде потребления O2.
На фигуре 3 показаны интерактивные эффекты силденафила с HMB, лейцином и ресвератролом на окисление жирных кислот в миотрубочках C2C12. Данные выражены в виде изменения в % от контрольного значения. *p=0,013; **p=0,015.
На фигуре 4 показаны интерактивные эффекты силденафила с HMB, лейцином и ресвератролом на окисление жирных кислот в адипоцитах 3T3-L1. Данные выражены в виде изменения в % от контрольного значения. *p<0,05.
На фигуре 5 показаны интерактивные эффекты силденафила с HMB, лейцином и ресвератролом на утилизацию глюкозы в миотрубочках C2C12. Утилизацию глюкозы измеряли в виде подкисления внеклеточной среды в ответ на инъекцию глюкозы. *p=0,04.
На фигуре 6 показаны интерактивные эффекты силденафила с HMB, лейцином и ресвератролом на утилизацию глюкозы в адипоцитах 3T3-L1. Утилизацию глюкозы измеряли в виде подкисления внеклеточной среды в ответ на инъекцию глюкозы. *p=0,05.
На фигуре 7 показаны интерактивные эффекты икариина с HMB, лейцином и ресвератролом на окисление жирных кислот в миотрубочках C2C12. Окисление жирных кислот измеряли в виде потребления O2 в ответ на инъекцию пальмитата и выражали в виде изменения в % от исходного уровня до инъекции. Вертикальная линия показывает время инъекции пальмитата; точки данных слева от такой линии представляют измерения исходного уровня, и точки данных справа от линии показывают ответ в виде потребления O2.
На фигуре 8 показаны интерактивные эффекты икариина с HMB, лейцином и ресвератролом на окисление жирных кислот в миотрубочках C2C12. Данные выражены в виде изменения в % от контрольного значения. *p=0,03; **p=0,002.
На фигуре 9 показаны интерактивные эффекты икариина с HMB, лейцином и ресвератролом на окисление жирных кислот в адипоцитах 3T3-L1. Данные выражены в виде изменения в % от контрольного значения. *p<0,05.
На фигуре 10 показаны интерактивные эффекты силденафила с HMB, лейцином и ресвератролом на продукцию оксида азота в миотрубочках C2C12. *p<0,0001 по сравнению с контролем; **p=0,0003 по сравнению со всеми другими обработками.
На фигуре 11 показаны интерактивные эффекты икариина с HMB, лейцином и ресвератролом на продукцию оксида азота в миотрубочках C2C12. p<0,0001 по сравнению с контролем; **p=0,00013 по сравнению со всеми другими обработками.
На фигуре 12 показаны интерактивные эффекты силденафила с HMB, лейцином и ресвератролом на митохондриальный биогенез, измеряемый в виде митохондриальной массы в миотрубочках C2C12. *p<0,0001 по сравнению с контролем; **p=0,0003 по сравнению со всеми другими обработками.
На фигуре 13 показаны интерактивные эффекты икариин (1 нМ) с HMB (5 мкМ), лейцином и ресвератролом на митохондриальный биогенез, измеряемый в виде митохондриальной массы в миотрубочках C2C12. p<0,0001 по сравнению с контролем; **p=0,00013 по сравнению со всеми другими обработками.
На фигуре 14 показаны результаты, полученные во внутрибрюшинном тесте на толерантность к глюкозе у мышей после шести недель содержания на рационе с низким или высоким содержанием жира.
На фигуре 15 показаны эффекты семидневного лечения лейцином или лейцином + икариином на постпрандиальные уровни глюкозы в крови у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 16 показаны эффекты четырнадцатидневного лечения лейцином или лейцином + икариином на постпрандиальные уровни глюкозы в крови у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 17 показаны эффекты четырнадцатидневного лечения лейцином или лейцином + икариином на постпрандиальные уровни инсулина в плазме у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 18 показаны эффекты четырнадцатидневного лечения лейцином или лейцином + икариином на измерения инсулинорезистентности при оценке в гомеостатической модели у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 19 показаны уровни глюкозы в крови в ответ на 1,2 единицы инсулина/кг массы тела после 28-дневного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 20 показаны уровни глюкозы в крови через 30-минут в ответ на 1,2 единицы инсулина/кг массы тела после 28-дневного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 21 показаны результаты теста на толерантность к глюкозе, измеренные в случае 5-недельного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 22 показан рассчитанный интегрированный уровень глюкозы в крови в ответ на нагрузку глюкозой с течением времени, полученный в тесте на толерантность к глюкозе, изображенном на фигуре 21.
На фигуре 23 показаны уровни глюкозы в крови натощак после 6-недельного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 24 показаны уровни инсулина натощак после 6-недельного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 25 показана оценка инсулинорезистентности в гомеостатической модели после 6-недельного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 26 показана масса печени после 6-недельного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
На фигуре 27 показаны уровни маркера воспаления C-реактивного белка после 6-недельного лечения лейцином или лейцином + икариином у мышей, содержащихся на рационе с высоким содержанием жира, по сравнению с не подвергнутыми лечению мышами на рационе с низким содержанием жира.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ниже описано несколько аспектов изобретения со ссылкой на примерные применения для иллюстрации. Следует понимать, что многочисленные конкретные подробности, взаимосвязи и способы приведены для того, чтобы получить полное представление об изобретении. Однако специалист в соответствующей области легко понимает, что изобретение может быть осуществлено на практике без одной или нескольких конкретных деталей или с использованием других способов. Если не указано иное, настоящее изобретение не ограничено проиллюстрированным порядком действий или явлений, так как некоторые действия могут быть осуществлены в другом порядке и/или одновременно с другими действиями или явлениями. Кроме того, не все проиллюстрированные действия или явления, необходимые для осуществления способа согласно настоящему изобретению. Концентрации различных компонентов в описанных композициях являются иллюстративными и как таковые не предназначены для ограничения приведенных концентраций.
В используемом в настоящем описании смысле термин «субъект» или «индивидуум» включает млекопитающих. Не ограничивающие примеры млекопитающих включают человека и мышей, в том числе трансгенных и нетрансгенных мышей. Способы, описанные в настоящей публикации, полезны как в терапии человека, так и в доклиничексих и ветеринарных применениях. В некоторых вариантах субъектом является млекопитающее, и в некоторых вариантах субъектом является человек. Другие млекопитающие включают без ограничения человекообразных обезьян, шимпанзе, орангутанов, мартышек; домашних животных (комнатных животных), таких как собаки, кошки, морские свинки, хомячки, мыши, крысы, кролики и хорьки; домашние сельскохозяйственные животные, такие как коровы, буйволы, бизоны, лошади, ослы, свиньи, овцы и козы; или экзотические животные, обычно находящиеся в зоопарках, такие как медведи, львы, тигры, пантеры, слоны, гиппопотамы, носороги, жирафы, антилопы, ленивцы, газели, зебры, гну, луговые собачки, коалы, кенгуру, панды, большие панды, гимены, тюлени, морские львы и морские слоны.
Термины «вводить», «введенный», «вводит» и «введение» определяют как обеспечение субъекта композицией таким путем, который известен в данной области, включая, но без ограничения, внутривенный, внутриартериальный, пероральный, парентеральный, буккальный, местный, трансдермальный, ректальный, внутримышечный, подкожный, внутрикостный, трансмукозальный или внутрибрюшинный пути введения. В некоторых вариантах настоящей заявки предпочтительным может быть пероральный путь введения.
В используемом в настоящем описании смысле «средство» или «биологически активное средство» относится к биологическому, фармацевтическому или химическому соединению или другому компоненту. Не ограничивающие примеры включают простую или сложную органическую или неорганическую молекулу, пептид, белок, пептидо-нуклеиновую кислоту (ПНК), олигонуклеотид (включая, например, аптамер и полинуклеотиды), антитело, производное антитела, фрагмент антитела, производное витамина, углевод, токсин или химиотерапевтическое соединение. Могут быть синтезированы различные соединения, например, малые молекулы и олигомеры (например, олигопептиды и олигонуклеотиды), и синтетические органические соединения, основанные на различных структурах сердцевины. Кроме того, различные природные источники могут обеспечивать соединения для скрининга, такие как растительные или животные экстракты и тому подобное. Специалист в данной области легко поймет, что нет ограничения средств согласно настоящему изобретению по структурной природе.
Термин «эффективное количество» или «терапевтически эффективной количество» относится к такому количеству соединения, описанного в настоящей публикации, которое достаточно для осуществления предполагаемого применения, включая, но без ограничения, лечение заболевания, которое определено ниже. Терапевтически эффективной количество может варьировать в зависимости от предполагаемого применения (in vitro или in vivo) или субъекта и патологического состояния, подвергаемого лечению, например, от массы и возраста субъекта, тяжести патологического состояния, способа введения и тому подобного, которые легко может определить специалист в данной области. Термин также применим к дозе, которая будет индуцировать конкретный ответ в клетках-мишенях, например, снижение пролиферации или понижающая регуляция активности белка-мишени. Конкретная доза будет варьировать в зависимости от конкретных выбранных соединений, схемы дозирования, которой необходимо следовать, от того, вводят ли ее в сочетании с другими соединениями, от времени введения, ткани, в которую ее вводят и физической системы доставки, в которой она находится.
Термин «энергетический обмен» в используемом в настоящем описании смысле относится к трансформации энергии, которая сопровождает биохимические реакции в организме, включая клеточный метаболизм и биогенез в митохондриях. Энергетический обмен можно оценить количественно, используя различные измерения, описанные в настоящей публикации, например, но без ограничения, потерю массы, потерю жира, чувствительность к инсулину, окисление жирных кислот, утилизацию глюкозы, содержание триглицеридов, уровень экспрессии Sirt 1, уровень экспрессии AMPK, окислительный стресс и биомассу митохондрий.
Термин «изолированный», который применим к данным компонентам, например, ингибитору PDE5, включая, но без ограничения, силденафил и икариин, лейцин и метаболиты лейцина (такие как HMB) и ресвератрол, относится к препарату вещества, лишенного по меньшей мере некоторых других компонентов, которые также могут присутствовать в том случае, когда вещество или сходное вещество встречается в природе или исходно получено из природы. Таким образом, например, изолированное вещество может быть получено с использованием способа очистки, позволяющего обогащать его из исходной смеси. Обогащение можно измерить в абсолютном значении, например, в виде массы на объем раствора, или его можно измерить по отношению ко второму, потенциально мешающему веществу, присутствующему в исходной смеси. Повышаемое обогащение согласно вариантам осуществления изобретения предпочтительно все в более возрастающей степени. Таким образом, 2-кратное обогащение является предпочтительным, 10-кратное обогащение является более предпочтительным, 100-кратное обогащение является более предпочтительным, 1000-кратное обогащение является еще более предпочтительным. Вещество также может быть получено в изолированном состоянии с использованием способа искусственной сборки, такого как химический синтез.
«Модулятор» пути относится к веществу или средству, которое модулирует активность одного или нескольких клеточных белков, картированных в одном и том же конкретном пути сигнальной трансдукции. Модулятор может увеличивать или подавлять активность и/или уровень или картину экспрессии передающей сигнал молекулы. Модулятор может активировать компонент в пути посредством непосредственного связывания с компонентом. Модулятор также может непосредственно активировать компонент в пути за счет взаимодействия с одним или несколькими ассоциированными компонентами. Результаты на выходе пути могут быть измерены в виде уровня экспрессии или активности белков. Уровень экспрессии белка в пути может отражаться в уровнях соответствующей мРНК или связанных факторов транскрипции, а также в уровне белка в субклеточном положении. Например, некоторые белки активируются при перемещении внутрь или из конкретного субклеточного компонента, включая, но без ограничения, ядро, митохондрию, эндосому, лизомому или другую мембранную структуру клетки. Результаты на выходе пути также можно измерить в виде физиологических эффектов, таких как митохондриальный биогенез, окисление жирных кислот или усвоение глюкозы.
«Активатор» относится к модулятору, который влияет на путь таким образом, что увеличивает результат на выходе пути. Активация конкретной мишени может прямой (например, за счет взаимодействия с мишенью) или опосредованной (например, за счет взаимодействия с белком, находящимся выше мишени в пути передачи сигнала, включающего в себя мишень).
Термин «избирательное ингибирование» или «избирательно ингибировать» в связи с биологически активным средством относится к способности средства предпочтительно снижать целевую активность в передаче сигнала по сравнению с внецелевой активностью в передаче сигнала за счет прямого или опосредованного взаимодействия с мишенью.
«Супрессор» может представлять собой модулятор, который влияет на путь таким образом, который снижает результат на выходе пути.
Термин «по существу не содержит» в используемом в настоящем описании смысле относится к композициям, которые имеют менее чем примерно 10%, менее чем примерно 5%, менее чем примерно 1%, менее чем примерно 0,5%, менее чем 0,1% или еще меньше конкретного компонента. Например, композиция, которая по существу не содержит аминокислот с неразветвленными цепями, может иметь менее чем примерно 1% аминокислоты с неразветвленной цепью лизина. Например, по существу отсутствие аминокислоты с неразветвленной цепью может быть подтверждено наличием менее чем 1% аминокислоты с неразветвленной цепью по сравнению с остальной частью аминокислот в данной композиции.
«Субтерапевтическое количество» средства, активатора или терапевтического средства представляет собой количество, которое меньше, чем эффективное количество такого средства, активатора или терапевтического средства, но в том случае, когда сочетание с эффективным или субтерапевтическим количеством другого средства или терапевтического средства может продуцировать требуемый результат вследствие, например, синергии в отношении получаемых в результате эффективных воздействий и/или пониженных побочных эффектов.
«Синергический» или «синергетический» эффект может быть таким, что один или несколько эффектов комбинированных композиций превышают один или несколько эффектов каждого компонента отдельно на сравнимом уровне дозирования, или они могут быть выше, чем предполагаемая сумма эффектов всех компонентов в случае сравнимого уровня дозы, если полагать, что каждый компонент действует независимо. Синергетический эффект может составлять или быть больше, чем примерно 10, 20, 30, 50, 75, 100, 110, 120, 150, 200, 250, 350 или 500% или еще больше, чем эффект, оказываемый на субъекта с использованием одного из компонентов отдельно, или аддитивные эффекты, которые измеряют, когда каждый из компонентов вводят отдельно. Эффектом может быть любой из измеряемых эффектов, описанных в настоящей публикации.
Термины «форма свободной аминокислоты» или «форма отдельной аминокислоты» в используемом в настоящем описании смысле могут относиться к аминокислотам, которые не связаны с другими аминокислотами, например, пептидными связями. Например, «свободный» или «отдельный» лейцин относится к лейцину, не связанному с другими аминокислотами пептидными связями.
Композиции
Композиции согласно настоящему изобретению могут включать избирательные ингибиторы фосфодиэстеразы (PDE). Ингибиторы PDE могут иметь избирательность против одного или нескольких ферментов PDE или мишеней. Например, ингибитором PDE может быть избирательным ингибитором PDE 1, 2, 3, 4, 5, 6, 9 или 11. Путь сиртуина включает в себя без ограничения такие сигнальные молекулы, как Sirt1, Sirt3 и AMPK. Ингибитор PDE можно сочетать с другим компонентом, который обеспечивает синергетический эффект, например, ингибитор PDE можно сочетать с лейцином и/или его метаболитами. В некоторых вариантах композиции могут содержать ингибитор PDE5, такой как силденафил или икариин, и лейцин и/или его метаболит, такой как гидроксиметилбутират (HMB).
Изобретение относится к композициям, которые могут увеличивать или модулировать результат пути сиртуина. Результат на выходе пути можно определить по уровню экспрессии и/или активности пути и/или по физиологическому эффекту. В некоторых вариантах активация пути Sirt1 включает стимуляцию PGC1-α и/или последующую стимуляцию митохондриального биогенеза и окисление жирных кислот. В общем, активатором пути сиртуина является соединение, которое активирует или повышает количество одного или нескольких компонентов пути сиртуина. Повышение или активацию пути сиртуина можно наблюдать по увеличению активности белкового компонента пути. Например, белком может быть Sirt1, PGC1-α, AMPK, Epac1, аденилилциклаза, Sirt3 или любые другие белки и соответствующие ассоциированные с ними белки вдоль пути передачи сигнала, изображенного на фигуре 1 (Park с соавторами, «Resveratrol Ameliorates Aging-Related Metabolic Phenotypes by Inhibiting cAMP Phosphodiesterases», Cell 148, 421-433 February 3, 2012). Не ограничивающие примеры физиологических эффектов, которые могут служить в качестве меры результата на выходе пути сиртуина, включают митохондриальный биогенез, митохондриальную биомассу, окисление жирных кислот, поглощение глюкозы, продукцию оксида азота, поглощение пальмитата, потребление кислорода, продукцию диоксида углерода, потерю массы, теплопродукцию, потерю висцеральной жировой ткани, дыхательный коэффициент, чувствительность к инсулину, уровень маркеров воспаления, расширение сосудов, образование бурых жировых клеток и продукция иризина. Примеры признаков образования бурых жировых клеток включают без ограничения повышенное окисление жирных кислот и экспрессию одного или нескольких избирательных для бурой жировой ткани генов (например, Ucp1, Cidea, Prdm16, и Ndufs1). В некоторых вариантах изменения одного или нескольких физиологических эффектов, которые могут служить в качестве меры результата на выходе пути сиртуина, индуцируются повышением продукции иризина, например, при введении композиции согласно изобретению.
Усиление митохондриального биогенеза может быть подтверждено увеличением образования новых митохондрий, увеличением митохондриальной биомассы и/или повышением митохондриальных функций, таких как повышенное окисление жирных кислот, повышенное образование тепла, повышенная чувствительность к инсулину, повышенное поглощение глюкозы, повышенное расширение сосудов, пониженная масса, уменьшенный объем жира и пониженный воспалительный ответ или маркеры у субъекта.
Композиции могут представлять собой комбинированные композиции, которые содержат один или несколько синергетических компонентов. Композиция, содержащая множество компонентов, может быть такой, что синергетический эффект представляет собой усиление клеточного метаболизма, и такой, что клеточный метаболизм повышается в более высокой степени, чем в случае суммы эффектов введения каждого компонента, которая была определена, если бы каждый компонент оказывал свое влияние независимо, что в настоящем описании также называют предполагаемым аддитивным эффектом. Например, если композиция, содержащая компонент (a) дает эффект в виде 20% улучшения клеточного метаболизма, и композиция, содержащая компонент (b) дает эффект в виде 50% улучшения клеточной композиции, то композиция, содержащая оба компонента, компонент (a) и компонент (b), может оказывать синергетическое действие, если влияние комбинированной композиции на клеточный метаболизм больше 70%.
Синергетическая комбинированная композиция может оказывать большее влияние, чем предполагаемый аддитивный эффект введения каждого компонента комбинированной композиции отдельно в случае, если компонент оказывает свой эффект независимо. Например, если предполагаемый аддитивный эффект составляет 70%, то фактический эффект, составляющий 140%, на 70% больше, чем предполагаемый аддитивный эффект или 1-кратно выше, чем предполагаемый аддитивный эффект. Синергетический эффект может быть по меньшей мере примерно на 20, 50, 75, 90, 100, 150, 200 или 300% выше, чем предполагаемый аддитивный эффект. Альтернативно, синергетический эффект может быть по меньшей мере примерно в 0,2, 0,5, 0,9, 1,1, 1,5, 1,7, 2 или 3 раза выше, чем предполагаемый аддитивный эффект.
В некоторых вариантах синергетический эффект комбинированных композиций может обеспечивать возможность использования меньшего количества доз, приводя к пониженным побочным эффектам у субъекта и меньшей стоимости лечения. В других вариантах синергетический эффект может обеспечить получение результатов, которые не могут быть достигнуты в результате любого другого обычного лечения. Комбинированные композиции согласно настоящему изобретению обеспечивают значимое улучшение регуляции энергетического обмена.
В некоторых вариантах композиции могут представлять собой комбинированные композиции, содержащие одну или несколько аминокислот с разветвленной цепью и/или их метаболиты, и активатор пути сиртуина может иметь одну или несколько характеристик. Одна или несколько разветвленных аминокислот могут быть в форме свободной аминокислоты. Комбинированные композиции (a) могут оказывать синергетическое действие в повышении результатов на выходе пути сиртуина, (b) повышать результат на выходе пути сиртуина по меньшей мере примерно в 1, 2, 5, 7, 10 или 20 раз, (c) иметь молярное отношение аминокислот с разветвленной цепью и/или их метаболитов к результату на выходе пути сиртуина больше чем примерно 20, (d) быть приготовленными в виде стандартной дозы для перорального приема, при этом активатор пути сиртуина представляет собой по существу гомогенную популяцию молекул полифенола, и (e) могут оказывать синергетическое действие и дополнительно содержать пищевой носитель. Любая из композиций, описанных в настоящей публикации, может иметь одну или несколько из указанных характеристик. Примеры активаторов пути сиртуина, применяемых в сочетании с одной или несколькими аминокислотами с разветвленной цепью, описаны в заявках на выдачу патента США № 13/549381 и 13/549399, каждая из которых включена в настоящее описание в виде ссылки в полном объеме.
В некоторых вариантах настоящее изобретение относится к композиции, содержащей (a) один или несколько типов разветвленных аминокислот и/или их метаболитов и (b) избирательный ингибитор PDE, присутствующий в субтерапевтическом количестве, при этом композиция является синергетически эффективной в увеличении результата на выходе пути сиртуина по меньшей мере примерно в 5, 10, 50, 100, 200, 500 или большее количество раз по сравнению с эффективностью компонента (a) или (b) при их отдельном применении. Аминокислоты с разветвленной цепью в композиции могут быть в форме свободной аминокислоты.
Ингибиторы фосфодиэстеразы
В некоторых вариантах активатор пути сиртуина модулирует активность фосфодиэстеразы (PDE). Активатор пути сиртуина может модулировать активность PDE как ингибитор PDE. Ингибитор PDE может быть избирательным или неизбирательным. Ингибитор PDE может вызывать избирательное ингибирование подкласса PDE, например PDE 5. Примеры избирательных ингибиторов PDE включают ингибиторы PDE 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11. Неизбирательным ингибитором PDE может быть ингибитор, который не различает подклассы фосфодиэстераз. Кроме того, некоторые неизбирательные ингибиторы PDE могут взаимодействовать с более чем одним метаболическим путем. Например, некоторые неизбирательные ингибиторы PDE могут быть производными ксантина и могут служить в качестве антагонистов аденозина, и имеют неизвестные взаимодействия с другими метаболическими путями. Избирательные ингибиторы PDE могут представлять собой ингибиторы PDE, которые предпочтительно взаимодействуют с выбранной PDE. Например, ингибитор PDE может иметь сильное взаимодействие с PDE 5 и очень слабое взаимодействие с другими подклассами PDE.
Любые средства, которые избирательно и негативно регулируют экспрессию или активность подкласса PDE, такого как PDE 5, можно применять в качестве избирательных ингибиторов PDE в композициях и способах согласно изобретению.
Например, избирательным ингибитором PDE альтернативно может быть средство, которое имеет 50% ингибирующую концентрацию (IC50) по отношению к подклассу PDE, такому как PDE 5, которая по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 1000 раз, по меньшей мере в 10000 раз ниже, чем IC50 ингибитора по отношению к одному, двум, трем или большему количеству других подклассов PDE. В некоторых вариантах избирательный ингибитор PDE может представлять собой средство, которое имеет 50% ингибирующую концентрацию (IC50) по отношению к подклассу PDE, такому как PDE 5, которая по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 1000 раз, по меньшей мере в 10000 раз или большее количество раз ниже, чем IC50 ингибитора по отношению к любому другому подклассу PDE.
В одном аспекте IC50 является определением концентрации, при которой 50% данной PDE ингибируется в основанном на клетках анализе. Определения IC50 могут быть осуществлены с использованием обычных способов, известных в данной области. В общем, IC50 можно определить, измеряя активность данного фермента в присутствии диапазона концентраций исследуемого ингибитора. Экспериментально полученные значения ферментативной активности затем откладывают на графике против используемых концентраций ингибитора. Концентрация ингибитора, которая дает 50% ферментативную активность (по сравнению с активностью в отсутствие любого ингибитора) принимают в качестве значения «IC50». Аналогично, другие ингибирующие концентрации могут быть определены посредством соответствующих определений активности. Например, в некоторых условиях может быть желательным установление ингибирующей на 90% концентрации, т.е. IC90, и т.д.
Способы измерения избирательности ингибиторов PDE описаны в публикациях
 которые включены в настоящее описание в виде ссылки в полном объеме.
которые включены в настоящее описание в виде ссылки в полном объеме.
Биологически активное средство согласно настоящему изобретению может ингибировать активность PDE со значением IC50 примерно 100 нМ или меньше, предпочтительно примерно 50 нМ, примерно 25 нМ, примерно 10 нМ, примерно 5 nM, примерно 1 нМ, 100 пМ, 50 пМ, 25 пМ, 10 пМ, 1 пМ или меньше, которое устанавливают в основанном на клетках анализе или в анализе киназ in vitro.
В некоторых вариантах активатор пути сиртуина представляет собой ингибитор PDE 1, такой как нимодипин, винпоцетин и IC224. Ингибитор PDE 1 может взаимодействовать с PDE 1, которая является Ca2+/кальмодулин-регулируемой фосфодиэстеразой, которая служит для распада как цАМФ, так и цГМФ. Винпоцетин может быть получен из экстракта барвинка, и он может служить в качестве средства, расширяющего сосуды головного мозга. Винпоцетин может быть в форме пищевой добавки.
В других вариантах активатором пути сиртуина является ингибитор PDE 3, такой как мерибендан, аринон и цилостамид. Активатором пути сиртуина может быть ингибитор PDE 4, такой как апремиласт, мезембрин, ибудиласт, пикламиласт, лутеолин, рофлумиласт, циломиласт, диазепам, ролипрам и YM796. Активатором пути сиртуина может быть ингибитор PDE 4, такой как ролипрам и YM796. Ингибитор PDE 4 может взаимодействовать с PDE 4, которая является цАМФ-специфичной фосфодиэстеразой, которая преобладает в иммунных клетках.
В некоторых вариантах активатором пути сиртуина является ингибитор PDE5, такой как аванафил, иоденафил, мироденафил, силденафил, тадалафил, икариин, варденафил, уденафил или запринст. В других вариантах активатором пути сиртуина является силденафил или икариин. Ингибитор PDE5 может взаимодействовать с PDE 5, которая является цГМФ-специфичной PDE. Повышение передачи сигнала цГМФ может усиливать митохондриальный биогенез, как in vitro, так и in vivo. Ингибитор PDE5 может повышать передачу сигнала оксида азота и может быть эффективным сосудорасширяющим средством. Примеры ингибиторов PDE5 описан в патентах США № 5250534 и 6469012, каждый из которых включен в настоящее описание в виде ссылки в полном объеме.
В некоторых вариантах активатором пути сиртуина может быть избирательный ингибитор PDE. В других вариантах активатором пути сиртуина является неизбирательный ингибитор PDE. Ингибиторы PDE могут быть встречающимися в природе или не встречающимися в природе (например, произведенными), и могут быть представлены в форме природного источника, содержащего ингибитор PDE, или его экстракта (например, очищенного). Примеры неизбирательных ингибиторов PDE включают, но без ограничения, кофеин, теофиллин, теобромин, 3-изобутил-1-метилксантин (IBMX), пентоксифиллин (3,7-дигидро-3,7-диметил-1-(5-оксогексил)-1H-пурин-2,6-дион), аминофиллин, параксантин и их соли, производные, метаболиты, катаболиты, анаболиты, предшественники и аналоги. Не ограничивающие примеры природных источников ингибиторов PDE включают кофе, чай, гуарану, парагвайский чай, какао и шоколад (например, темный шоколад).
Дополнительные активаторы пути сиртуина
В некоторых вариантах полифенол, такой как ресвератрол, или другой активатор пути сиртуина вводят вместо или в дополнение к ингибитору PDE-5. В некоторых вариантах композиции, содержащие один или несколько компонентов, описанных в настоящей публикации, содержат ингибитор PDE вместо или в дополнение к ресвератролу или другому активатору пути сиртуина. Обычно ингибитор PDE предоставляется в количестве, которое действует синергетически с одним или несколькими другими компонентами композиции или способа лечения.
Полифенолом может быть стильбен или гидроксикоричная кислота. В некоторых вариантах активатором пути сиртуина или активатором пути AMPK может быть полифенол. Например, полифенолом может быть хлорогеновая кислота, ресвератрол, кофеиновая кислота, пикеатаннол, эллаговая кислота, галлат эпигаллокатехина (EGCG), экстракт виноградных косточек или любой их аналог. В некоторых вариантах активатором может быть ресвератрол, его аналог или его метаболит. Например, активатором может быть птеростильбен или низкомолекулярный аналог ресвератрола. Примеры низкомолекулярных аналогов ресвератрола описаны в заявках на выдачу патента США № 20070014833, 20090163476 и 20090105246, которые включены в настоящее описание в виде ссылки в полном объеме.
Полифенол может представлять собой по существу гомогенную популяцию полифенолов. Полифенол может представлять собой один тип полифенола, при этом в композиции могут быть исключены все другие типы полифенолов. В других вариантах композиция может содержать два, три или четыре типа полифенолов, и в композиции исключены все другие типы полифенолов. В некоторых вариантах композиция может содержать 1, 2, 3 или 4 типа полифенолов и менее чем 0,1, 0,5, 1 или 2% любых других типов полифенолов.
В различных других вариантах композиции готовят таким образом, чтобы они не содержали (или исключали) один или несколько из следующих ингредиентов: кофеин, экстракт зеленого чая или экстракты из семян гуараны или растений гуараны.
В других вариантах активатором пути сиртуина или активатором пути AMPK может быть иризин, хинная кислота, коричная кислота, феруловая кислота, фукоксантин, бигуанид (такой как метформин), росиглитазон или любой их аналог. Альтернативно активатором пути сиртуина или активатором пути AMPK могут быть изофлавоны, пиролохинолин (PQQ), кверцетин, L-карнитин, липоевая кислота, кофермент Q10, пируват, 5-аминоимидазол-4-карбоксамид-рибонуклеотид (ALCAR), безфибрат, олтипраз и/или генистеин. В некоторых вариантах активатором пути сиртуина является ингибитор PDE.
В некоторых вариантах композиция может содержать избирательный ингибитор PDE-5 в сочетании с одним или несколькими из следующих средств: метформином, ресвератролом и аминокислотой с разветвленной цепью или ее метаболитом (например, уровень HMB).
В некоторых вариантах композиция может содержать синергетически действующие сочетания активаторов пути сиртуина. Например, композиция может содержать синергетически действующие количества метформина и ингибитора PDE. В некоторых вариантах композиция содержит метформин и кофеин.
В некоторых вариантах активатор пути сиртуина, который можно сочетать с ингибитором PDE-5, включает средство, которое стимулирует экспрессию Fndc5, PGC1-α или UCP1. Экспрессию можно измерять в виде уровня экспрессии гена или белка. Альтернативно, активатором пути сиртуина может быть иризин. Способы повышения уровня иризина описаны Bostrom с соавторами («A PGC1-α-dependent myokine that drives brown-fatlike development of white fat and thermogenesis», Nature, Jan 11, 2012.
В некоторых вариантах активаторами пути сиртуина, которые можно сочетать, являются флавоны или халкон. В одном варианте иллюстративными активаторами сиртуина являются активаторы, описанные Howitz с соавторами (2003) (Nature 425: 191), и включают, например, ресвератрол (3,5,4'-тригидрокси-транс-стильбен), бутеин (3,4,2',4'-тетрагидроксихалкон), пикеатаннол (3,5,3',4'-тетрагидрокси-транс-стильбен), изоликвиритигенин (4,2',4'-тригидроксихалкон), физетин (3,7,3',4'-тетрагидроксифлавон), кверцетин (3,5,7,3',4'-пентагидроксифлавон), дезоксирапонтин (3,5-дигидрокси-4'-метоксистильбен-3-O-β-D-глюкозид); транс-стильбен; рапонтин (3,3',5-тригидрокси-4'-метоксистильбен-3-O-β-D-глюкозид); цис-стильбен; бутеин (3,4,2'4'-тетрагидроксихалкон); 3,4,2'4'6'-пентагидроксихалкон; халкон; 7,8,3',4'-тетрагидроксифлавон; 3,6,2',3'-тетрагидроксифлавон; 4'-гидроксифлавон; 5,4'-дигидроксифлавон; 5,7-дигидроксифлавон; морин (3,5,7,2',4'-пентагидроксифлавон); флавон; 5-гидроксифлавон; (-)-эпикатехин (гидрокси-сайты: 3,5,7,3',4'); (-)-катехин (гидрокси-сайты: 3,5,7,3',4'); (-)-галлокатехин (гидрокси-сайты: 3,5,7,3',4',5') (+)-катехин (гидрокси-сайты: 3,5,7,3',4'); 5,7,3',4',5'-пентагидроксифлавон; лутеолин (5,7,3',4'-тетрагидроксифлавон); 3,6,3',4'-тетрагидроксифлавон; 7,3',4',5'-тетрагидроксифлавон; кемпферол (3,5,7,4'-тетрагидроксифлавон); 6-гидроксиапигенин (5,6,7,4'-тетрагидроксифлавон); скутеллареин); апигенин (5,7,4'-тригидроксифлавон); 3,6,2',4'-тетрагидроксифлавон; 7,4'-дигидроксифлавон; дайдзеин (7,4'-дигидроксиизофлавон); генистеин (5,7,4'-тригидроксифлаванон); нарингенин (5,7,4'-тригидроксифлаванон); 3,5,7,3',4'-пентагидроксифлаванон; флаванон; хлорид пеларгонидина (хлорид 3,5,7,4'-тетрагидроксифлавилия); хинокитиол (b-туйяплицин; 2-гидрокси-4- изопропил-2,4,6-циклогептатриен-1-он); L-(+)-эрготионеин (внутренняя соль (S)-a-карбокси-2,3-дигидро-N,N,N-триметил-2-тиоксо-1H-имидазол-4-этанаминия); фениловый эфир кофеиновой кислоты; MCI-186 (3-метил-1-фенил-2-пиразолин-5-он); HBED (N,N'-ди-(2-гидроксибензил)этилендиамин-N,N'-диуксусная кислота-H2O); амброксол (транс-4-(2-амино-3,5-дибромбензиламино)циклогексан-HCl; и U-83836E ((-)-2-((4-(2,6-ди-1-пирролидинил-4-пиримидинил)-1-пиперазинил)метил)-3,4-дигидро-2,5,7,8-тетраметил-2H-1-бензопиран-6-ол, 2HCl). Также могут быть использованы их аналоги и производные.
В настоящей заявке предлагаются композиции, применимые для индукции повышения окисления жирных кислот и усиления митохондриального биогенеза у субъекта. Такие композиции содержат: HMB в сочетании с ресвератролом; лейцин в сочетании с ресвератролом; и лейцин и HMB в сочетании с ресвератролом; KIC в сочетании с ресвератролом; и KIC и HMB в сочетании с ресвератролом; и KIC и лейцин в сочетании с ресвератролом; или KIC, HMB и лейцин в сочетании с ресвератролом.
Аминокислоты с разветвленной цепью
Аминокислоты с разветвленной цепью, которые можно сочетать с ингибитором PDE-5, имеют алифатические боковые цепи с атомом углерода ветвления, который связан с двумя или большим количеством других атомов. Другие атомы могут представлять собой атомы углерода. Примеры аминокислот с разветвленной цепью включают лейцин, изолейцин и валин. Аминокислоты с разветвленной цепью также могут включать другие соединения, такие как 4-гидроксиизолейцин. В некоторых вариантах композиции по существу не содержат никакой одной или нескольких или всех аминокислот с неразветвленной цепью. В некоторых вариантах композиции по существу не содержат никакой одной или нескольких или всех аминокислот с не разветвленной цепью в форме свободной аминокислоты. Например, композиции по существу могут не содержать аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана и/или тирозина. Композиции могут по существу не содержать аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана и/или тирозина в форме свободной аминокислоты. В некоторых вариантах аминокислотой с разветвленной цепью является лейцин. В некоторых вариантах композиции могут по существу не содержать изолейцина и/или валина, которые могут быть в свободной форме. Синергетические эффекты между лейцином и ингибитором PDE5, которые описаны в настоящей публикации, не наблюдаются в том случае, когда лейцин заменяют изолейцином и валином. Не имея намерения быть связанными с какой-либо конкретной теорией, полагают, что изолейцин, валин и лейцин конкурируют друг с другом в отношении транспорта и/или всасывания, и включение изолейцина и валина в композицию может снижать эффективность лейцина в композиции. Кроме того, и у изолейцина и у валина отсутствует важная способность активировать путь передачи сигнала sirt, включающего Sirt1 и/или AMPK.
Аминокислоты с разветвленной цепью могут присутствовать в композиции в форме свободной аминокислоты. Композиция может по существу не содержать аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозин или валина в форме свободной аминокислоты. В некоторых вариантах композиция по существу не содержит аминокислот с неразветвленной цепью, которые находятся в несвободной форме (например, аминокислоты с разветвленной цепью, которые образовали пептидные связи с другими аминокислотами).
Не ограничиваясь какой-либо теорией, полагают, что прием аминокислот с разветвленной цепью, таких как лейцин, может стимулировать синтез белка в тканях как mTOR-зависимым, так и mTOR -независимым путями, а также оказывать антипротеолитическое действие. Такие эффекты преобладают в мышцах, но также могут проявляться в других тканях, включая жировую ткань. Учитывая энергетические затраты на синтез и метаболизм белков, полагают, что лейцин может повышать окисление жирных кислот и утилизацию чистой энергии и уменьшать ожирение. Действительно, сообщалось, что лейцин оказывает термогенное действие и усиливает потерю массы и жировой ткани во время ограничения энергии. Также, лейцин и обогащенная лейцином пища может благотворно модулировать картины воспалительных цитокинов в адипоцитах и у мышей.
В некоторых вариантах любая из композиций, описанных в настоящей публикации, может содержать соли, производные, метаболиты, катаболиты, анаболиты, предшественники и аналоги любой из аминокислот с разветвленной цепью. Метаболитами могут быть метаболиты лейцина, такие как HMB. Метаболиты аминокислот с разветвленной цепью могут включать гидроксиметилбутират (HMB), α-гидроксиизокапроновую кислоту и кето-изокапроновую кислоту (KIC), кетоизовалерат и кетоизокапроат. Не ограничивающие примеры анаболитов аминокислот с разветвленной цепью могут включать глутамат, глутамин, треонин, α-кетобутират, α-ацето-α-гидроксибутират, α,β-дигидрокси-β-метилвалерат, α-кето-β-метилвалерат, α,β-дигидроксиизовалерат и α-кетоизовалерат.
В некоторых вариантах осуществления изобретения любая из композиций, описанных в настоящей публикации, может быть приготовлена таким образом, чтобы она не содержала (или из нее были исключены) одну или несколько аминокислот, выбранных из группы, состоящей из лизина, глутамата, пролина, аргинина, валина, изолейцина, аспарагиновой кислоты, аспарагина, глицина, треонина, серина, фенилаланина, тирозина, гистидина, аланина, триптофана, метионина, глутамина, таурина, карнитина, цистина и цистеина. В некоторых вариантах осуществления изобретения любая из композиций, описанных в настоящей публикации, может быть приготовлена так, чтобы она не содержала (или из нее были исключены) одну или несколько свободных аминокислот, выбранных из группы, состоящей из лизина, глутамата, пролина, аргинина, валина, изолейцина, аспарагиновой кислоты, аспарагина, глицина, треонина, серина, фенилаланина, тирозина, гистидина, аланина, триптофана, метионина, глутамина, таурина, карнитина, цистина и цистеина. В некоторых случаях композиции не содержат никакой аминокислоты с неразветвленной цепью. В некоторых случаях композиции не содержат никакой аминокислоты с разветвленной цепью в форме свободной аминокислоты. Масса или молярное количество аминокислоты с неразветвленной цепью может составлять менее чем 0,01, 0,1, 0,5, 1, 2 или 5% от общей композиции. Масса или молярное количество аминокислоты с неразветвленной цепью в форме свободной аминокислоты может составлять меньше чем 0,01, 0,1, 0,5, 1, 2 или 5% от общей композиции. Масса или молярное количество любой аминокислоты с разветвленной цепью или ее метаболита, кроме лейцина или его метаболитов, может составлять менее чем 0,01, 0,1, 0,5, 1, 2, или 5% от общей композиции. Масса или молярное количество любой аминокислоты с разветвленной цепью в форме свободной аминокислоты или ее метаболита, кроме лейцина или его метаболитов, может составлять менее чем 0,01, 0,1, 0,5, 1, 2 или 5% от общей композиции.
Витамин B6
В некоторых вариантах композиция, описанная в настоящей публикации, может содержать ингибитор PDE5, лейцин и/или метаболит лейцина и витамин B6. В других вариантах композиция может содержать силденафил, ресвератрол и витамин B6. Лейцин может быть в форме свободной аминокислоты.
Не имея намерения ограничиваться какой-либо конкретной теорией или способом действия, полагают, что повышение уровня активного метаболита B6 (пиридоксальфосфата) может снижать тонус и активность кальциевых каналов в адипоцитах. Внутриклеточный свободный Ca2+ является основным регулятором экспрессии и активности синтазы жирных кислот в адипоцитах, который может приводить к подавлению как экспрессии, так и активности синтазы жирных кислот, которая в свою очередь является одной из ограничивающих скорость стадий в синтезе нейтральных липидов в адипоцитах.
В используемом в настоящем описании смысле, витамин B6 включают свои различные формы, включая пиридоксин, пиридоксин-5'-фосфат, пиридоксаль, пиридоксальфосфат, пиридоксаль-5'-фосфат, пиридоксамин, пиридоксамин-5'-фосфат. В других вариантах витамин B6 также может включать 4-пиридоксиновую кислоту, которая является катаболитом указанных выше форм витамина B6, которая экскретируется. Композиции, описанные в настоящей публикации, могут содержать любую одну или несколько из таких форм витамина B6.
Активной формой витамина B6 в организме является пиридоксаль-5-фосфат, который является коферментом для всех реакций трансаминирования и некоторых реакций декарбоксилирования и дезаминирования. Кроме того, пиридоксаль-5-фосфат необходим в качестве кофермента для всех реакций трансаминирования, которые происходят в организме 

В некоторых вариантах любая из композиций, описанных в настоящей публикации, может включать соли, производные, метаболиты, катаболиты, анаболиты, предшественники и аналоги любой из форм витамина B6. Примеры катаболитов витамина B6 включают 2-метил-3-гидрокси-5-формилпиридин-4-карбоксилат и 3-гидрокси-2-метилпиридин-4,5-дикарбоксилат. Примеры аналогов витамина B6 описаны в патентах СЩА № 7230009 и 6369042. Примеры предшественников витамина B6 описаны в патенте США № 7495101.
Фармацевтически активные средства
Композиции согласно настоящему изобретению дополнительно могут содержать одно или несколько фармацевтически активных средств, отличных от ингибитора PDE-5. Примеры терапевтически активных средств включают ибупрофен, алдорил и гемфеброзил, верапамил, максзид, диклофенак и метролол, мапролтилин, триазолам и миноксидил. Например, комбинированные композиции могут содержать фармацевтически активное антидиабетическое средство, средство для потери массы или средство регуляции кальция. В патенте США № 7109198 и заявке на выдачу патента США № 20090142336, которые включены в настоящее описание в виде ссылки, описано множество фармацевтически активных средств или терапевтически активных средств, подходящих для включения в комбинированную композицию, описанную в настоящей публикации. Примеры антидиабетических средств включают бигуаниды (такие как метформин), тиазолидиндионы и меглитиниды (такие как репаглинид, пиоглитазон и росиглитазон), ингибиторы альфа-глюкозидазы (такие как акарбоза), сульфонилмочевины (такие как толбутамид, ацетогексамид, толазамид, хлорпропамид, глипизид, глибурид, глимепирид, гликлазид), инкретины, алкалоиды спорыньи (такие как бромкриптин) и ингибиторы DPP (такие как ситаглиптин, вилдаглиптин, саксаглиптин, линглиптин, дутоглиптин, гемиглиптин, алоглиптин и берберин). Антидиабетическое средство может представлять собой пероральное антидиабетическое средство. Антидиабетическим средством также могут быть инъекционные антидиабетические лекарственные средства, включая инсулин, аналоги амилина (такие как прамлинтид) и миметики инкретина (такие как эксенатид и лираглутид). Примеры терапевтических средств против ожирения включают ингибиторы липазы (такие как орлистат), допаминергические, норадренергические и серотонинергические соединения, антагонисты рецепторов каннабиноидов (такие как римонабант), эксенатид, прамлинтид и CNS-средства (такие как топимерат). Приведенные примеры предлагаются только в целях обсуждения и предназначены для демонстрации широкого объема применимости изобретения к широкому многообразию лекарственных средств. Они никоим образом не предназначены для ограничения объема изобретения.
В некоторых вариантах ингибитор PDE-5 можно сочетать с парой следующих фармацевтически активных средств: глипизидом и метформином; глибуридом и метформином; пиоглитазоном и глимепиридом; пиоглитазоном и метформином; репаглинидом и метформином; росиглитазоном и глимепиридом; росиглитазоном и метформином; и ситаглиптином и метформином.
Количество фармацевтического средства или любого другого компонента, используемого в комбинированной композиции, описанной в настоящей публикации, может при использовании представлять собой количество, которое является терапевтически эффективным. Количество фармацевтического средства или любого другого компонента, используемого в комбинированной композиции, описанной в настоящей публикации, может при использовании представлять собой количество, которое является субтерапевтическим. В некоторых вариантах использование субтерапевтических количеств средства или компонента может снижать побочные эффекты средства. Использование субтерапевтических количеств может все еще быть эффективным, особенно при использовании синергетически с другими средствами или компонентами.
Субтерапевтическое количество средства или компонента может быть таким, что оно представляет собой количество, которое меньше, чем количество, которое можно считать терапевтическим. Например, в руководстве FDA может быть предложен конкретный уровень дозы для лечения конкретного состояния, и субтерапевтическое количество может представлять собой любой уровень, который ниже предложенного FDA уровня дозы. Субтерапевтическое количество может быть примерно на 1, 5, 10, 15, 20, 25, 30, 35, 50, 75, 90 или 95% меньше, чем количество, которое считается терапевтическим количеством. Терапевтическое количество можно оценивать для отдельных субъектов или для группы субъектов. Группа субъектов может представлять собой всех потенциальных субъектов или субъектов, имеющих конкретную характеристику, такую как возраст, масса, раса, пол или уровень физической активности.
В случае гидрохлорида метформина исходная доза, рекомендуемая врачом, составляет 1000 мг в сутки, при этом конкретная доза для субъекта имеет диапазон от 500 мг до максимум 2500 мг в сутки (таблетки гидрохлорида метформина длительного высвобождения www.accessdata.fda.gov/drugsatfda_docs/label/2008/021574s0101bl.pdf). Конкретная доза для субъекта может быть определена лечащим врачом путем титрования дозы и измерения терапевтического ответа. Уровень терапевтической дозы может быть определен посредством измерения уровней глюкозы в плазме натощак и измерения гликозилированного гемоглобина. Субтерапевтическое количество может быть любого уровня, который ниже рекомендуемой дозы метформина. Например, если определяемый уровень терапевтической дозы для субъекта составляет 700 мг в сутки, то доза 600 мг может представлять собой субтерапевтическое количество. Альтернативно, субтерапевтическое количество может быть определено в отношении группы субъектов, а не отдельного субъекта. Например, если среднее терапевтическое количество метформина для субъектов, имеющих массу более 300 фунтов (135 кг) составляет 2000 мг, то субтерапевтическим количеством может быть любое количество ниже 2000 мг. В некоторых вариантах доза может быть рекомендована медицинскими работниками, включая, но без ограничения, врача, лечащего пациента, медсестру, диетолога, фармацевта или другого специалиста в области здравоохранения. Специалистом в области здравоохранения может быть человек или субъект, который связан с системой здравоохранения. Примеры специалистов в области здравоохранения могут включать хирургов, стоматологов, отоларингологов, дефектологов, лечащих врачей (в том числе врачей и специалистов общей практики), фельдшеров, медсестер, акушерок, экспертов по фармацевтическим средствам/фармацевтов, диетологов, терапевтов, психологов, физиотерапевтов, флеботомистов, физиотерапевтов, профпатологов, оптометристов, мануальных терапевтов, специалистов-клиницистов, специалистов скорой помощи, фельдшеров, медицинских лаборантов, рентгенологов, техников-протезистов, социальных работников и широкий спектр других рабочих кадров, обученных предоставлению определенного типа медицинских услуг.
Дозовые количества
Изобретение относится к композициям, которые представляют собой сочетания изолированных компонентов, таких как лейцин, метаболиты лейцина, такие как HMB, силденафил, икариин и ресвератрол, которые были выделены из одного или нескольких источников. Изобретение относится к композициям, которые обогащены лейцином, метаболитами лейцина, такими как HMB, силденафилом, икариином и/или ресвератролом. Компоненты могут быть выделены из природных источников или созданы из синтетических источников и затем обогащены, чтобы повысить чистоту компонентов. Например, силденафил может быть получен из синтетического источника и затем обогащен одним или несколькими способами очистки. Кроме того, лейцин (например, свободный лейцин) может быть выделен из природного источника и затем обогащен одним или несколькими способами разделения. Выделенные и обогащенные компоненты, такие как силденафил и лейцин, затем могут быть объединены и приготовлены в виде препарата для введения субъекту.
В некоторых вариантах композиция содержит определенное количество избирательного ингибитора PDE (например, ингибитора PDE-5, включая, но без ограничения, силденафил или икариин). Количество ингибитора PDE может представлять собой субтерапевтическое количество и/или количество, которое действует синергетически с одним или несколькими другими соединениями в композиции или одним или несколькими соединениями, вводимыми одновременно или близко по времени с композицией. В некоторых вариантах ингибитор PDE вводят в низкой дозе, средней дозе или высокой дозе, что описывает взаимосвязь между двумя дозами и обычно не определяет какой-либо конкретный диапазон доз.
Суточная доза силденафила может составлять примерно или меньше чем примерно 0,05, 0,1, 0,5, 1, 2, 5, 10, 20, 40, 60, 80, или 100 мг силденафила. В других вариантах суточная доза икариина может составлять примерно или меньше чем примерно 1, 10, 20, 50, 100, 150, 300, 400, 500, 750, 1000, 1500 или 2000 мг икариина. Низкая суточная доза ресвератрола может содержать примерно, меньше чем примерно или больше чем примерно 0,5 мг/кг, 1 мг/кг, 2,5 мг/кг, 5 мг/кг, 7,5 мг/кг, 10 мг/кг, 12,5 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг или больше; средняя суточная доза ресвератрола может содержать примерно, меньше чем примерно или больше чем примерно 20 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг, 125 мг/кг, 150 мг/кг, 175 мг/кг, 200 мг/кг, 250 мг/кг или больше; и высокая суточная доза ресвератрола может содержать примерно, меньше чем примерно или больше чем примерно 150 мг/кг, 175 мг/кг, 200 мг/кг, 225 мг/кг, 250 мг/кг, 300 мг/кг, 350 мг/кг, 400 мг/кг или больше.
Другой аспект изобретения относится к композициям, содержащим синергетически действующие количества ингибитора PDE-5, такого как силденафил и икариин, в сочетании с лейцином, HMB, KIC, витамином D, витамином K2 и/или ресвератролом. Такие синергетически действующие количества могут представлять собой следующие количества: лейцина примерно, меньше чем примерно или больше чем примерно 0,5-3,0 г/сутки (например, 0,5, 0,75, 1, 1,25, 1,5, 1,75, 2, 2,5, 3 или больше г/сутки); HMB примерно, меньше чем примерно или больше чем примерно 0,20-3,0 г/сутки (например, 0,2, 0,4, 0,5, 0,75, 1, 1,5, 2, 2,5, 3 или больше г/сутки); KIC примерно, меньше чем примерно или больше чем примерно 0,2-3,0 г/сутки (например, 0,2, 0,4, 0,5, 0,75, 1, 1,25, 1,5, 1,75, 2, 2,5, 3 или больше г/сутки); витамина D примерно, меньше чем примерно или больше чем примерно 2,5-25 мкг/сутки (например, 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25 или больше мкг/сутки); витамина K2 примерно, меньше чем примерно или больше чем примерно 5-200 мкг/сутки (например, 5, 10, 25, 50, 75, 100, 150, 200 или больше мкг/сутки); силденафила примерно, меньше чем примерно или больше чем примерно 0,05-100 мг/сутки (например, 0,05, 0,1, 0,5, 1, 2, 5, 10, 20, 40, 60, 80 или 100 мг/сутки); икариина примерно, меньше чем примерно или больше чем примерно 1-2000 мг (например, 1, 10, 20, 50, 100, 150, 300, 400, 500, 750, 1000, 1500, или 2000 мг/сутки) и/или ресвератрола примерно, меньше чем примерно или больше чем примерно 10-500 мг/сутки (например, 10, 25, 50, 51, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500 или больше мг/сутки). Таким образом, в одном варианте осуществления изобретения предлагается композиция, содержащая лейцин в количестве примерно от 0,75 до примерно 3,0 г (от 0,75 до 3,0 г) и силденафил в количестве примерно от 0,05 до примерно 100 мг (или от 0,05 до 100 мг). В другом варианте предлагается композиция, содержащая HMB в количестве 0,40-3,0 г (или от 0,40 до 3,0 г) и силденафил в количестве 0,05-100 мг (или от 0,050 до 100 мг). В другом варианте предлагается композиция, содержащая лейцин в количестве примерно 0,75-примерно 3,0 г (или от 0,75 до 3,0 г), HMB в количестве примерно от 0,40 до примерно 3,0 г (или от 0,40 до 3,0 г) и силденафил в количестве примерно от 0,05 до примерно 100 мг (или от 0,05 до 100 мг). В композициях, содержащих ингибитор PDE, или способах, включающих в себя введение ингибитора PDE (раздельно или одновременно с одним или несколькими другими компонентами), ингибитор PDE может быть предоставлен в количестве, которое дает пиковую концентрацию в плазме примерно, меньше чем примерно или больше чем примерно 0,1, 1, 5, 10, 25, 50, 100, 500, 1000, 2500, 5000, 10000 или больше нМ.
В другом варианте предлагается композиция, содержащая синергетически действующие количества силденафила и ресвератрола в сочетании с HMB или лейцином. В таких композициях общее количество лейцина и HMB в композиции может быть меньше чем 3,0 г (или меньше чем примерно 3,0 г; например, меньше чем примерно 0,7, 0,75, 1, 1,5, 2, 2,5, 3 грамма) и по меньшей мере 0,70 г (или по меньшей мере примерно 0,70 г; например по меньшей мере примерно 0,7, 0,75, 1, 1,5, 2, 2,5, 3 грамм). Композиции, содержащие как лейцин, так и HMB, могут содержать количества лейцина и HMB, которые составляют всего примерно, меньше чем примерно или больше чем примерно от 0,70 г до 3,0 г (примерно от 0,70 г до примерно 3,0 г; например, 0,7, 1, 1,25, 1,5, 1,75, 2, 2,5, 3, или больше грамм), от 0,75 г до 3,0 г (примерно от 0,75 г до примерно 3,0 г) или от 1,0 г до 3,0 г (примерно от 1,0 г до примерно 3,0 г) в композиции, и ресвератрол в синергетически действующих количествах (по меньшей мере 35 мг ресвератрола и не больше чем 500 (или примерно 500) мг ресвератрола (например, примерно, меньше чем примерно или больше чем примерно 35, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг ресвератрола) или количество ресвератрола от 50 до 500 мг (или примерно от 50 до примерно 500 мг).
В некоторых вариантах стандартная доза может содержать ингибитор PDE5, такой как силденафил, в сочетании с одним или несколькими другими компонентами. В некоторых вариантах стандартная доза содержит один или несколько из следующих компонентов: примерно, меньше чем примерно или больше чем примерно, может быть примерно или меньше чем примерно, 0,05, 0,1, 0,5, 1, 2, 5, 10, 20, 40, 60, 80 или 100 мг избирательного ингибитора PDE-5 (например, силденафила); примерно, меньше чем примерно или больше чем примерно 50, 100, 200, 300, 400, 500 или больше мг HMB; примерно, меньше чем примерно или больше чем примерно 10, 20, 30, 40, 50, 75, 100 или больше мг ресвератрола; примерно, меньше чем примерно или больше чем примерно 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20 или больше мг витамина B6; примерно, меньше чем примерно или больше чем примерно 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25 или больше мкг витамина D; примерно, меньше чем примерно или больше чем примерно 5, 10, 25, 50, 75, 100, 150, 200 или больше мкг витамина K2; и примерно, меньше чем примерно или больше чем примерно 400, 500, 600, 700, 800, 900, 1000, 1100, 1250, 1500 или больше мг лейцина. Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 500 мг бета-гидроксил-, бета-метилбутирата и примерно, меньше чем примерно или больше чем примерно 50 мг ресвератрола. Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 500 мг бета-гидрокси-, бета-метилбутирата; и примерно, меньше чем примерно или больше чем примерно 50 мг ресвератрола; и примерно, меньше чем примерно или больше чем примерно 15 мг витамина B6.
В некоторых вариантах стандартная доза может содержать примерно от 0,1 до 10 мг силденафила. В некоторых вариантах стандартная доза может содержать примерно 0,5-100 мг аванафила, 0,05-20 мг иоденафила, 0,25-50 мг мироденафила, 0,01-2,5 мг тадалафила, 0,01-2,5 мг варденафила, 0,5-100 мг уденафила или 0,5-100 мг запринста. В некоторых вариантах стандартная доза может содержать примерно 0,5-50 мг аванафила, 0,05-10 мг иоденафила, 0,25-25 мг мироденафила, 0,01-1,25 мг тадалафила, 0,01-1,25 мг варденафила, 0,5-50 мг уденафила или 0,5-50 мг запринста.
В некоторых вариантах стандартная доза может содержать хлорогеновую кислоту (например, примерно, меньше чем примерно или больше чем примерно 25, 50, 75, 100, 150, 200 или больше мг) в сочетании с одним или несколькими другими компонентами в примерно, меньше чем примерно или больше чем примерно указанных количествах. Стандартная доза может содержать 500 мг бета-гидрокси-, бета-метилбутирата (например, 50, 100, 200, 300, 400, 500 или больше мг) и 100 мг хлорогеновой кислоты. Стандартная доза может содержать 500 мг бета-гидрокси-, бета-метилбутирата (например, 50, 100, 200, 300, 400, 500 или больше мг); и 100 мг хлорогеновой кислоты; и 15 мг витамина B6. Стандартная доза может содержать 1,125 г лейцина (например, 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 или больше мг) и 100 мг хлорогеновой кислоты. Стандартная доза может содержать 1,125 г лейцина (например, 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 или больше мг); 100 мг хлорогеновой кислоты; и 15 мг витамина B6 (например, 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20 или больше мг). Стандартная доза может содержать 750 мг лейцина, 75 мг хлорогеновой кислоты и 10 мг витамина B6.
В некоторых вариантах стандартная доза может содержать хинную кислоту в примерно, меньше чем примерно или больше чем примерно указанных количествах (например, 10, 15, 20, 25, 30, 40, 50 или больше мг), в сочетании с одним или несколькими другими компонентами в количествах, в примерно, меньше чем примерно или больше чем примерно указанных количествах. Стандартная доза может содержать 500 мг бета-гидрокси-, бета-метилбутирата (например, 50, 100, 200, 300, 400, 500 или больше мг) и 25 мг хинной кислоты. Стандартная доза может содержать 500 мг бета-гидрокси-, бета-метилбутирата (например, 50, 100, 200, 300, 400, 500 или больше мг), 25 мг хинной кислоты и 15 мг витамина B6 (например, 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20 или больше мг). Стандартная доза может содержать 1,125 г лейцина (например, 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 или больше мг) и 25 мг хинной кислоты. Стандартная доза может содержать 1,125 г лейцина (например, 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 или больше мг), 25 мг хинной кислоты и 15 мг витамина B6 (например, 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20 или больше мг). Стандартная доза может содержать 750 мг лейцина, 15 мг хинной кислоты и 10 мг витамина B6.
В некоторых вариантах стандартная доза может содержать фукоксантин в примерно, меньше чем примерно или больше чем примерно указанных количествах (например, 0,5, 0,75, 1, 1,25, 1,5, 1,75, 2, 2,25, 2,5, 3, 5 или больше мг) в сочетании с одним или несколькими другими компонентами в примерно, меньше чем примерно, или больше чем примерно указанных количествах. Стандартная доза может содержать 500 мг бета-гидрокси-, бета-метилбутирата (например, 50, 100, 200, 300, 400, 500 или больше мг) и 2,5 мг фукоксантина. Стандартная доза может содержать 500 мг бета-гидрокси-, бета-метилбутирата (например, 50, 100, 200, 300, 400, 500 или больше мг), 2,5 мг фукоксантина и 15 мг витамина B6 (например, 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20 или больше мг). Стандартная доза может содержать 1,125 г лейцина (например, 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 или больше мг) и 2,5 мг фукоксантина. Стандартная доза может содержать 1,125 г лейцина (например, 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 или больше мг), 2,5 мг фукоксантина и 15 мг витамина B6 (например, 2,5, 5, 7,5, 10, 12,5, 15, 17,5, 20 или больше мг). Стандартная доза может содержать 750 мг лейцина, 1,5 мг фукоксантина и 10 мг витамина B6.
В некоторых вариантах композиция содержит некоторое количество антидиабетического средства, такого как бигуанид (например, метформин). Количество антидиабетического средства может представлять собой субтерапевтическое количество и/или количество, которое действует синергетически с одним или несколькими другими соединениями в композиции или одним или несколькими соединениями, вводимыми одновременно или близко по времени с композицией. В некоторых вариантах антидиабетическое средство вводят в очень низкой дозе, низкой дозе, средней дозе или высокой дозе, что описывает взаимосвязь между двумя дозами и обычно не определяет какой-либо конкретный диапазон доз. Например, суточная очень низкая доза метформина может содержать примерно, меньше чем примерно или больше чем примерно 5 мг/кг, 10 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг или больше; низкая суточная доза метформина может содержать примерно, меньше чем примерно или больше чем примерно 75 мг/кг, 100 мг/кг, 150 мг/кг, 175 мг/кг, 200 мг/кг или больше; средняя суточная доза метформина может содержать примерно, меньше чем примерно или больше чем примерно 150 мг/кг, 175 мг/кг, 200 мг/кг, 250 мг/кг, 300 мг/кг; и высокая суточная доза метформина может содержать примерно, меньше чем примерно или больше чем примерно 200 мг/кг, 250 мг/кг, 300 мг/кг, 350 мг/кг, 400 мг/кг, 500 мг/кг, 700 мг/кг или больше.
В некоторых вариантах стандартная доза может содержать метформин в примерно, меньше чем примерно или больше чем примерно указанных количествах (например, 25, 50, 100, 150, 200, 250, 300, 400, 500 или больше мг) в сочетании с одним или несколькими другими компонентами в примерно, меньше чем примерно или больше чем примерно указанных количествах (таких как 10, 20, 30, 40, 50, 75, 100 или больше мг ресвератрола; 50, 100, 200, 300, 400, 500 или больше мг HMB; и/или 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 или больше мг лейцина). Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 50 мг метформина, 500 мг бета-гидрокси-, бета-метилбутирата и 50 мг ресвератрола. Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 50 мг метформина, 1,125 г лейцина и 50 мг ресвератрола. Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 100 мг метформина, 500 мг бета-гидрокси-, бета-метилбутирата и 50 мг ресвератрола. Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 100 мг метформина, 1,125 г лейцина и 50 мг ресвератрола. Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 250 мг метформина, 500 мг бета-гидрокси-, бета-метилбутирата и 50 мг ресвератрола. Стандартная доза может содержать примерно, меньше чем примерно или больше чем примерно 250 мг метформина, 1,125 г лейцина и 50 мг ресвератрола. В некоторых вариантах композиция дополнительно содержит ингибитор PDE в синергетически действующем количестве. В некоторых вариантах композиция метформина дополнительно содержит избирательный ингибитор PDE в синергетически действующем количестве.
В некоторых вариантах стандартная доза содержит лейцин и икариин. Стандартная доза может содержать примерно от 500 до примерно 2000 мг лейцина. Стандартная доза может содержать примерно от 700 до примерно 1500 мг лейцина. Стандартная доза может содержать примерно от 900 до примерно 1300 мг лейцина. Массовое отношение икариина к лейцину может составлять 0,01-0,1. Массовое отношение икариина к лейцину может составлять 0,02-0,06. Массовое отношение икариина к лейцину может составлять 0,03-0,05. Пример препарата стандартной дозы, содержащего лейцин и икариин, показан в таблице 1.
Препарат 1
В некоторых вариантах стандартная доза содержит лейцин, икариин и ресвератрол. Стандартная доза может содержать примерно от 500 до примерно 2000 мг лейцина. Стандартная доза может содержать примерно от 700 до примерно 1500 мг лейцина. Стандартная доза может содержать примерно от 900 до примерно 1300 мг лейцина. Массовое отношение икариина к лейцину может составлять 0,01-0,1. Массовое отношение икариина к лейцину может составлять 0,02-0,06. Массовое отношение икариина к лейцину может составлять 0,03-0,05. Массовое отношение ресвератрола к лейцину может составлять 0,01- 0,1. Массовое отношение ресвератрола к лейцину может составлять 0,02-0,06. Массовое отношение ресвератрола к лейцину может составлять 0,03-0,05. Пример препарата стандартной дозы, содержащего лейцин, икариин и ресвератрол, показан в таблице 2.
Препарат 2
В некоторых вариантах стандартная доза содержит лейцин, икариин и метформин. Стандартная доза может содержать примерно от 500 до примерно 2000 мг лейцина. Стандартная доза может содержать примерно от 700 до примерно 1500 мг лейцина. Стандартная доза может содержать примерно от 900 до примерно 1300 мг лейцина. Массовое отношение икариина к лейцину может составлять 0,01-0,1. Массовое отношение икариина к лейцину может составлять 0,02-0,06. Массовое отношение икариина к лейцину может составлять 0,03-0,05. Массовое отношение метформина к лейцину может составлять 0,01-0,6. Массовое отношение метформина к лейцину может составлять 0,1-0,5. Массовое отношение метформина к лейцину может составлять 0,15-0,3. Массовое отношение метформина к лейцину может составлять 0,22-0,23. Пример препарата стандартной дозы, содержащего лейцин, икариин и метформин, показан в таблице 3.
Препарат 3
В некоторых вариантах стандартная доза содержит лейцин и силденафил. Стандартная доза может содержать примерно от 500 до примерно 2000 мг лейцина. Стандартная доза может содержать примерно от 700 до примерно 1500 мг лейцина. Стандартная доза может содержать примерно от 900 до примерно 1300 мг лейцина. Массовое отношение силденафила к лейцину может составлять 0,00001-0,05. Массовое отношение силденафила к лейцину может составлять 0,0001-0,03. Массовое отношение силденафила к лейцину может составлять 0,001-0,02. Массовое отношение силденафила к лейцину может составлять 0,005-0,015. Пример препарата стандартной дозы, содержащего лейцин и силденафил, показан в таблице 4.
Препарат 4
В некоторых вариантах стандартная доза содержит лейцин, ресвератрол и силденафил. Стандартная доза может содержать примерно от 500 до примерно 2000 мг лейцина. Стандартная доза может содержать примерно от 700 до примерно 1500 мг лейцина. Стандартная доза может содержать 900-1300 мг лейцина. Массовое отношение ресвератрола к лейцину может составлять 0,00001-0,05. Массовое отношение ресвератрола к лейцину может составлять 0,0001-0,03. Массовое отношение ресвератрола к лейцину может составлять 0,001-0,02. Массовое отношение силденафила к лейцину может составлять 0,00001-0,05. Массовое отношение силденафила к лейцину может составлять 0,0001-0,03. Массовое отношение силденафила к лейцину может составлять 0,001-0,02. Массовое отношение силденафила к лейцину может составлять 0,005-0,015. Пример препарата стандартной дозы, содержащего лейцин, ресвератрол и силденафил, показан в таблице 5.
Препарат 5
В некоторых вариантах стандартная доза содержит HMB и икариин. Стандартная доза может содержать примерно 50-1000 мг HMB. Стандартная доза может содержать примерно 100-500 мг HMB. Стандартная доза может содержать 150-400 мг HMB. Стандартная доза может содержать 200-300 мг HMB. Массовое отношение икариина к HMB может составлять 0,05-0,5. Массовое отношение икариина к HMB может составлять 0,07-0,4. Массовое отношение икариина к HMB может составлять 0,1-0,3. Пример препарата стандартной дозы, содержащего HMB и икариин, показан в таблице 6.
Препарат 6
В некоторых вариантах стандартная доза содержит HMB, икариин и ресвератрол. Стандартная доза может содержать примерно 50-1000 мг HMB. Стандартная доза может содержать примерно 100-500 мг HMB. Стандартная доза может содержать примерно 150-400 мг HMB. Стандартная доза может содержать 200-300 мг HMB. Массовое отношение икариина к HMB может составлять 0,05-0,5. Массовое отношение икариина к HMB может составлять 0,07-0,4. Массовое отношение икариина к HMB может составлять 0,1-0,3. Массовое отношение ресвератрола к HMB может составлять 0,05-0,5. Массовое отношение ресвератрола к HMB может составлять 0,07-0,4. Массовое отношение ресвератрола к HMB может составлять 0,1-0,3. Пример препарата стандартной дозы, содержащего HMB, икариин и ресвератрол, показан в таблице 7.
Препарат 7
В некоторых вариантах стандартная доза содержит HMB, икариин и метформин. Стандартная доза может содержать примерно от 50 до примерно 1000 мг HMB. Стандартная доза может содержать примерно от 100 до примерно 500 мг HMB. Стандартная доза может содержать примерно от 150 до примерно 400 мг HMB. Стандартная доза может содержать примерно от 200 до примерно 300 мг HMB. Массовое отношение икариина к HMB может составлять 0,05-0,5. Массовое отношение икариина к HMB может составлять 0,07-0,4. Массовое отношение икариина к HMB может составлять 0,1-0,3. Массовое отношение метформина к HMB может составлять 0,2-4. Массовое отношение метформина к HMB может составлять 0,5-2. Массовое отношение метформина к HMB может составлять 0,75-1,25. Пример препарата стандартной дозы, содержащего HMB, икариин и метформин, показан в таблице 8.
Препарат 8
В некоторых вариантах стандартная доза содержит HMB и силденафил. Стандартная доза может содержать примерно 50-1000 мг HMB. Стандартная доза может содержать примерно 100-500 мг HMB. Стандартная доза может содержать примерно 150-400 мг HMB. Стандартная доза может содержать 200-300 мг HMB. Массовое отношение силденафила к HMB может составлять 0,01-0,1. Массовое отношение силденафила к HMB может составлять 0,02-0,08. Массовое отношение силденафила к HMB может составлять 0,03-0,05. Пример препарата стандартной дозы, содержащий HMB и силденафил, показан в таблице 9.
Препарат 9
В некоторых вариантах стандартная доза содержит HMB, силденафил и ресвератрол. Стандартная доза может содержать примерно 50-1000 мг HMB. Стандартная доза может содержать примерно 100-500 мг HMB. Стандартная доза может содержать примерно 150-400 мг HMB. Стандартная доза может содержать 200-300 мг HMB. Массовое отношение силденафила к HMB может составлять 0,01-0,1. Массовое отношение силденафила к HMB может составлять 0,02-0,08. Массовое отношение силденафила к HMB может составлять 0,03-0,05. Массовое отношение ресвератрола к HMB может составлять 0,01-0,1. Массовое отношение ресвератрола к HMB может составлять 0,02-0,08. Массовое отношение ресвератрола к HMB может составлять 0,03-0,05. Пример препарата стандартной дозы, содержащего HMB и силденафил, показан в таблице 10.
Препарат 10
В некоторых вариантах любые стандартные дозы, указанные в настоящем описании, например, описанные в таблицах 1-10, дополнительно содержат витамин B6. В некоторых вариантах любые стандартные дозы, указанные в настоящем описании, например, описанные в таблицах 1-10, дополнительно содержат 15 мг витамина B6. Стандартные дозы могут дополнительно содержать примерно 5-50 мг витамина B6. Массовое отношение витамина B6 к HMB, если он присутствует, может составлять примерно 0,06, 0,002-0,18, 0,03-0,12 или 0,05-0,07. Массовое отношение витамина B6 к лейцину, если он присутствует, может составлять примерно 0,0135, 0,005-0,03, 0,007-0,025 или 0,01-0,017.
В некоторых вариантах композиции, описанные в настоящей публикации, могут по существу не содержать одного или нескольких конкретных компонентов или иметь конкретные уровни таких компонентов. Композиции, например, композиции, описанные в таблицах 1-10, могут по существу не содержать или содержать меньше чем 40, 20, 10, 15, 5 или 1% от общей массы вызывающих гликемию углеводов. Композиции могут по существу не содержать или содержать меньше чем 40, 20, 10, 15, 5, или 1% от общей массы сахаров, включая без ограничения глюкозу, декстрозу, фруктозу и сахарозу. Композиции могут по существу не содержать или содержать меньше чем 40, 20, 10, 15, 5 или 1% от общей массы углеводов с высоким гликемическим индексом. Композиции могут по существу не содержать или содержать меньше чем 40, 20, 10, 15, 5 или 1% от общей массы сложных углеводов. Композиции могут по существу не содержать или содержать меньше чем 40, 20, 10, 15, 5 или 1% от общей массы простых углеводов. Композиции могут по существу не содержать или содержать меньше чем 40, 20, 10, 15, 5, или 1% от общей массы крахмала, кукурузной патоки, короткозерного белого риса, муки высшего или первого сорта.
В некоторых вариантах осуществления изобретения комбинированные композиции могут иметь конкретное отношение аминокислот с разветвленной цепью и/или их метаболитов к избирательному ингибитору PDE. Конкретное отношение может обеспечивать эффективную и/или синергетическую регуляцию энергетического обмена. Например, конкретное отношение может вызывать снижение прибавления массы у субъекта, увеличение окисления жиров у субъекта, повышение чувствительности к инсулину у субъекта, увеличение поглощения глюкозы в мышцах субъекта, уменьшение маркеров воспаления, увеличение расширения сосудов и/или повышение температуры тела. Такие полезные эффекты могут быть, отчасти, результатом усиления митохондриального биогенеза или множества других изменений в пути энергетического обмена. Отношение аминокислот с разветвленной цепью и/или метаболитов к активатору избирательного ингибитора PDE может представлять собой массовой отношение, молярное отношение или объемное отношение.
В некоторых вариантах молярное отношение (a) аминокислот с разветвленной цепью и/или их метаболитов к (b) избирательному ингибитору PDE примерно равно или больше, чем примерно 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 100, 120 или 150. В других вариантах молярное отношение одной или нескольких аминокислот с разветвленной цепью и/или их метаболитов к избирательному ингибитору PDE, находящемуся в композициях согласно изобретению, примерно равно или больше, чем примерно 20, 30, 40, 50, 60, 70, 80, 90, 95, 90, 95, 100, 105, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 220, 250, 300, 350, 400 или 500. В некоторых вариантах молярное отношение компонента (a) к (b) в указанной композиции больше чем примерно 20, 40, 60, 80, 100, 120, или 150. В некоторых вариантах молярное отношение компонента (a) к (b) в указанной композиции больше чем примерно 80, 100, 120 или 150. В некоторых вариантах, молярное отношение компонента (a) к (b) в указанной композиции больше чем примерно 80, 100, 120 или 150. В некоторых вариантах молярное отношение компонента (a) к (b) в указанной композиции больше чем примерно 200, 250, или 300. В некоторых вариантах молярное отношение компонента (a) к (b) в указанной композиции больше чем примерно 40, 150, 250 или 500.
В некоторых вариантах дозирование лейцина, любых метаболитов лейцина, ингибитора PDE (такого как ингибитор PDE5, подобный силденафилу) может быть запланировано так, чтобы достичь конкретной физиологической концентрации или уровня циркулирующего лейцина, метаболитов лейцина и/или ингибитора PDE5. Физиологическая концентрация может представлять собой циркулирующий уровень, который измеряют в кровотоке у субъекта. Субъектом может быть человека или животное. Выбранные дозы могут быть изменены на основе характеристик субъекта, таких как масса, скорость энергетического обмена, генетика, этническая принадлежность, рост или любая другая характеристика. Количество лейцина в стандартной дозе может быть таким, что уровень циркулирующего лейцина в организме субъекта составляет примерно или больше чем примерно 0,25 мМ, 0,5 мМ, 0,75 мМ или 1 мМ. Доза примерно 1,125 мг лейцина (например, свободного лейцина) может обеспечить достижение уровня циркулирующего лейцина в организме субъекта, который составляет примерно 0,5 мМ. Доза примерно 300 мг лейцина (например, свободного лейцина) может обеспечить достижение уровня циркулирующего лейцина в организме субъекта, который составляет примерно 0,25 мМ. Доза примерно силденафила может обеспечить достижение циркулирующей концентрации примерно или меньше чем примерно 0,1, 0,5, 1, 2, 5 или 10 нМ. В некоторых вариантах целевая или достигаемая концентрация циркулирующего силденафила меньше чем примерно 1 нМ. Стандартная доза примерно 20 мг силденафила может обеспечить достижение циркулирующей концентрации примерно 100 нМ силденафила. Стандартная доза примерно 0,2 мг силденафила может обеспечить достижение циркулирующей концентрации примерно 1 нМ силденафила. Доза примерно икариина может обеспечить достижение циркулирующей концентрации примерно или меньше чем примерно 0,1, 0,5, 1, 2, 5 или 10 нМ. В некоторых вариантах целевая или достигаемая циркулирующая концентрация икариина меньше чем примерно 1 нМ. Стандартная доза примерно 20 мг икариина может обеспечить достижение циркулирующей концентрации примерно 100 нМ икариина. Стандартная доза примерно 0,1 мг икариина может обеспечить достижение циркулирующей концентрации примерно 1 нМ икариина.
В некоторых вариантах молярные или массовые соотношения представляют собой молярные или массовые соотношения в циркуляции, достигаемые после введения одной или нескольких композиций субъекту. Композиции могут представлять собой комбинированные композиции, описанные в настоящей публикации. Молярное соотношение в комбинированной композиции в форме дозирования может быть скорректировано для достижения требуемого молярного соотношения в циркуляции. Молярное соотношение может быть скорректировано с учетом биодоступности, поглощения и метаболической переработки одного или нескольких компонентов комбинированной композиции. Например, если биодоступность компонента низкая, то молярное количество такого компонента может быть увеличено относительно других компонентов в комбинированной композиции. В некоторых вариантах молярное или массовое соотношение в циркуляции достигается в пределах примерно 0,1, 0,5, 0,75, 1, 3, 5 или 10, 12, 24 или 48 часов после введения. Молярное или массовое соотношение в циркуляции может поддерживаться в течение периода времени, составляющего примерно или больше чем примерно 0,1, 1, 2, 5, 10, 12, 18, 24, 36, 48, 72 или 96 часов.
В некоторых вариантах молярное отношение лейцина к силденафилу в циркуляции составляет примерно или больше чем примерно 100000, 250000, 500000, 750000 или больше. В некоторых вариантах молярное отношение HMB к силденафилу в циркуляции составляет примерно или больше чем примерно 1000, 2500, 5000, 7500 или больше. В некоторых вариантах молярное отношение ресвератрола к силденафилу в циркуляции составляет примерно или больше чем примерно 50, 100, 200, 400, 800 или больше.
Композиции можно вводить субъекту так, чтобы субъекту была введена выбранная суммарная суточная доза композиции. Суммарную суточную дозу можно определить как сумму доз, вводимых в течение 24-часового периода. Суммарная суточная доза композиции может содержать примерно 0,05, 0,1, 0,5, 1, 2, 5, 10, 20, 40, 60, 80 или 100 мг силденафила. Суммарная суточная доза композиции может содержать примерно 1, 10, 20, 50, 100, 150, 300, 400, 500, 750, 1000, 1500 или 2000 мг икариина. Суммарная суточная доза композиции может содержать по меньшей мере примерно 250, 500, 750, 1000, 1125, 2000, 2250 мг или больше аминокислоты с разветвленной цепью или ее метаболита. Аминокислотой с разветвленной цепью может быть лейцин, HMB или любая другая аминокислота с разветвленной цепью, описанная в настоящей публикации. Суммарная суточная доза композиции может содержать по меньшей мере примерно 3, 7,5, 15, 30, 45, 90 мг или больше B6. Суммарная суточная доза композиции может иметь массовое отношение аминокислот с разветвленной цепью или их метаболитов к витамину B6, которое составляет примерно, больше чем примерно или меньше чем примерно 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 100, 110, 120, 130, 140, 150, 175, 200, 250, 500, 750, 1000 или больше.
В некоторых вариантах выбранная доза композиции может быть введена субъекту так, чтобы в организме субъекта был достигнут требуемый уровень циркулирующей композиции. Требуемый уровень циркулирующей композиции может составлять по меньшей мере примерно 0,25, 0,5, 0,75, 1 мМ или больше лейцина. Требуемый уровень циркулирующей композиции может составлять по меньшей мере примерно 10, 25, 50, 100, 150 или 200 нМ или больше B6. Требуемый уровень циркулирующей композиции может составлять примерно 0,1, 0,5, 1, 2, 5, 10 нМ или больше силденафила. Требуемый уровень циркулирующей композиции может составлять примерно 0,1, 0,5, 1, 2, 5, 10 нМ или больше икариина. Выбираемая доза может быть выбрана на основе характеристик субъекта, таких как масса, рост, этническая принадлежность или генетика.
Формы дозирования
Композиции, описанные в настоящей публикации, могут быть приготовлены в виде множества разных форм дозирования. Ее можно применять перорально в виде таблеток, жевательных таблеток, капсуловидных таблеток, капсул, мягких желатиновых капсул, пастилок или раствора. Ее также можно применять в виде назального спрея или для инъекции, когда она находится в форме раствора. В некоторых вариантах композиция может представлять собой жидкую композицию, подходящую для перорального приема. Композиции согласно изобретению, подходящие для перорального введения, могут быть представлены в виде дискретных дозированных форм, таких как капсулы, крахмальные капсулы или таблетки, или жидкостей или аэрозольных спреев, каждая из которых содержит предварительно определяемое количество активного ингредиента, в виде порошка или гранул, раствора или суспензии в водной или неводной жидкости, эмульсии типа «масло в воде» или эмульсии типа «вода в масле», включая жидкие дозированные формы (например, суспензию или взвесь) и пероральные твердые дозированные формы (например, таблетку или нефасованный порошок). Пероральные формы дозирования могут быть приготовлены в виде таблеток, пилюль, драже, капсул, эмульсий, липофильных и гидрофильных суспензий, жидкостей, гелей, сиропов, взвесей, суспензий и тому подобного для перорального приема индивидуумом или пациентом, которого необходимо лечить. Такие формы дозирования могут быть приготовлены любым из способов приготовления препаратов. Например, активные ингредиенты могут быть приведены в ассоциацию с носителем, который состоит из одного или нескольких необходимых ингредиентов. Капсулы, подходящие для перорального введения, включают плотно закрываемые твердые набиваемые капсулы, изготовленные из желатина, а также мягкие герметичные капсулы, сделанные из желатина и пластификатора, такого как глицерин или сорбит. Плотно закрываемые твердые капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связывающими веществами, такими как крахмалы, и/или скользящими веществами, такими как тальк или стеарат магния, и необязательно стабилизаторами. Необязательно, композиция согласно изобретению для перорального применения может быть получена смешиванием композиции с твердым эксципиентом, необязательно измельчением полученной смеси и обработкой смеси гранул после добавления, при необходимости, подходящих вспомогательных веществ, чтобы получить таблетки или сердцевины драже. Подходящими эксципиентами, в частности, являются наполнители, такие как сахара, включая лактозу, сахарозу, манит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). В общем, композиции готовят посредством создания равномерной и однородной смеси активного ингредиента с жидкими носителями или тонкодисперсными твердыми носителями или обоими указанными носителями, и затем при необходимости в результате формования продукта с получением требуемого препарата. Например, таблетка может быть получена прессованием или формованием, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием в подходящем аппарате активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанного с эксципиентом, таким как без ограничения связывающее средство, скользящее вещество, инертный разбавитель и/или, поверхностно-активное или диспергирующее средство. Формованные таблетки могут быть получены формованием в подходящем аппарате смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
Жидкие формы, в которых препараты, раскрытые в настоящем описании, могут быть включены для введения перорально или путем инъекции, включают водный раствор, соответствующим образом скоррегированные сиропы, водные или масляные суспензии и скоррегированные эмульсии со съедобными маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и сходные фармацевтические носители. Подходящие диспергирующие или суспендирующие средства для водных суспензий включают синтетические природные камеди, такие как трагакантовая камедь, аравийская камедь, альгинат, декстран, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин.
Субъекта можно лечить сочетанием инъекционной композиции и перорально принимаемой композиции.
Жидкие препараты для перорального введения могут иметь, например, форму растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для перерастворения в воде или других подходящих наполнителях перед применением. Такие жидкие препараты могут быть приготовлены обычными способами с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сорбитовый сироп, производные целлюлозы или гидрогенизированные съедобные жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные наполнители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт); консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота); и искусственные или природные красители и/или подсластители.
Приготовление фармацевтических композиций согласно настоящему изобретению осуществляют согласно обычно применяемым способам получения фармацевтических препаратов. Смотри, например, Remington's Pharmaceutical Sciences 18th Edition (1990), E. W. Martin ed., Mack Publishing Co., PA. В зависимости от предполагаемого применения и способа введения может быть желательной дополнительная обработка соединением, содержащим противоион магния, при приготовлении фармацевтических композиций. Соответствующая обработка может включать в себя смешивание с подходящими нетоксичными и не взаимодействующими компонентами, стерилизацию, деление на стандартные дозы и заключение в устройство для доставки.
Настоящее изобретение, кроме того, охватывает безводные композиции и формы дозирования, содержащие активный ингредиент, так как вода может способствовать распаду некоторых соединений. Например, вода может быть добавлена (например, 5%) на практике в качестве средства для имитации длительного хранения, чтобы определить такие характеристики как срок годности или стабильность препаратов с течением времени. Безводные композиции и формы дозирования согласно изобретению могут быть приготовлены с использованием безводных ингредиентов или ингредиентов с низким содержанием влаги и в условия низкой влажности или низкой сырости. Композиции и формы дозирования согласно изобретению, которые содержат лактозу, могут быть получены без воды, если предполагается значительный контакт с влажностью и/или сыростью во время производства, упаковки и/или хранения. Безводная композиция может быть получена и может подвергаться хранению так, чтобы сохранялась ее безводная природа. Соответственно, безводные композиции могут быть упакованы с использованием материалов, которые, как известно, предотвращают воздействие воды, таким образом, они могут быть включены в подходящие фармакологические наборы. Примеры подходящих упаковок включают, но без ограничения, герметично закрытую фольгу, пластик или тому подобное, стандартные емкости для доз, блистерные упаковки и контурные упаковки.
Ингредиент, описанный в настоящей публикации, можно объединять в однородной смеси с фармацевтическим носителем согласно обычным способам приготовления фармацевтических смесей. Носитель может иметь широкое множество форм, в зависимости от формы препарата, необходимого для введения. В случае приготовления композиций для пероральной дозированной формы в качестве носителей можно использовать обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты, корригенты, консерванты, красители и тому подобное в случае пероральных жидких препаратов (таких как суспензии, растворы и эликсиры) или аэрозолей; или такие носители, как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие средства, скользящие вещества, связывающие агенты и дезинтегрирующие агенты можно использовать в случае пероральных твердых препаратов, в некоторых вариантах без применения лактозы. Например, подходящие носители включают порошки, капсулы и таблетки, содержащие твердые пероральные препараты. При необходимости таблетки могут быть покрыты стандартными способами с использованием или без использования воды.
Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразная трагакантовая камедь; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор соли; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфтного буфера; и (21) другие нетоксичные совместимые вещества, используемые в фармацевтических препаратах.
Связывающие средства, подходящие для применения в дозированных формах, включают, но без ограничения, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, альгиновая кислота, другие альгинаты, порошкообразная трагакантовая камедь, гуаровая камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальций-карбосиметилцеллюлозу, натрий-карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, пептизированный крахмал, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу и их смеси.
Скользящие вещества, которые можно использовать для образования композиций и дозированных форм согласно изобретению включают, но без ограничения стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрогенизированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар или их смеси. Дополнительные скользящие вещества включают, например, силикагель силоид, коагулированный аэрозоль синтетического диоксида кремния или их смеси. Скользящее вещество необязательно можно добавлять в композицию в количестве меньше чем примерно 1 массовый процент.
Скользящие вещества также можно использовать вместе с тканевыми барьерами, который включают, но без ограничения, полисахариды, полигликаны, сепрафилм, интерсид и гиалуроновую кислоту.
Дезинтегрирующие средства могут быть использованы в композициях согласно изобретению для того, чтобы обеспечить дезинтеграцию таблеток при воздействии водной среды. Слишком большое количество дезинтегрирующего средства может привести к получению таблеток, которые могут разрушаться во флаконе. Слишком малое количество может быть недостаточным для того, чтобы происходила дезинтеграция и, следовательно, может изменять скорость и степень высвобождения активного ингредиента (ингредиентов) из дозированной формы. Таким образом, для получения дозированных форм соединений, описанных в настоящей публикации, может быть использовано достаточное количество дезинтегрирующего средства, которое не слишком мало и не слишком велико, чтобы неблагоприятно изменять высвобождение активного ингредиента (ингредиентов). Количество используемого дезинтегрирующего средства может варьировать в зависимости от типа препарата и способа введения и легко может быть определено специалистами в данной области. Примерно от 0,5 до примерно 15 массовых процентов дезинтегрирующего средства или примерно от 1 до примерно 5 массовых процентов дезинтегрирующего средства можно использовать в фармацевтической композиции. Дезинтегрирующие средства, которые можно использовать для создания композиций и дозированных форм согласно изобретению включают, но без ограничения, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натрий-кроскармелозу, кросповидон, полакрилин натрия, гликолят крахмала натрия, картофельный крахмал или крахмал тапиока, другие крахмалы, пептизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди или их смеси.
Примеры подходящих наполнителей для применения в композициях и дозированных формах, описанных в настоящей публикации, включают, но без ограничения, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, пептизированный крахмал и их смеси.
В том случае, когда для перорального введения требуются водные суспензии и/или эликсиры, активный ингредиент, находящийся в них, можно объединять с различными подсластителями или корригентами, красящими веществами или красителями и при необходимости эмульгаторами и/или суспендирующими средствами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различными сочетаниями.
Таблетки могу быть без покрытия или могут быть покрыты известными способами, чтобы замедлить дезинтеграцию и всасывание в желудочно-кишечном тракте и тем самым обеспечить длительное действие в течение более длительного периода. Например, можно использовать вещество, вызывающее замедление, такое как глицерилмоностеарат или глицерилдистеарат. Препараты для перорального применения также могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом.
В одном варианте композиция может содержать солюбилизатор для обеспечения хорошей солюбилизации и/или растворения соединения согласно настоящему изобретению и минимизации преципитации соединения согласно настоящему изобретению. Это может быть особенно важным в случае композиций, которые используют отличным от перорального способом, например, композиций для инъекции. Солюбилизатор также может быть добавлен для повышения растворимости гидрофильного лекарственного средства и/или других компонентов, таких как поверхностно-активные вещества, или для поддержания композиции в виде стабильного или гомогенного раствора или дисперсии.
Композиция может дополнительно содержать одну или несколько фармацевтически приемлемых добавок и эксципиентов. Такие добавки и эксципиенты включают без ограничения средства для снижения вязкости, средства против вспенивания, буферные средства, полимеры, антиоксиданты, консерванты, хелатообразующие средства, модуляторы вязкости, средства для поддержания тоничности, корригенты, красители, отдушки, средства, придающие мутность, суспендирующие средства, связывающие вещества, наполнители, пластификаторы, скользящие вещества и их смеси. Не исчерпывающий список примеров эксципиентов включает моноглицериды, стеарат магния, модифицированный пищевой крахмал, желатин, микрокристаллическую целлюлозу, глицерин, стеариновую кислоту, диоксид кремния, желтый пчелиный воск, лецитин, гидроксипропилцеллюлозу, натрий-кроскармелозу и кросповидон.
Композиции, описанные в настоящей публикации, также могут быть приготовлены для замедленного высвобождения, пролонгированного высвобождения или растянутого во времени высвобождения, так чтобы один или несколько компонентов высвобождались на протяжении определенного периода времени. Замедленное высвобождение может быть достигнуто путем приготовления препарата одного или нескольких компонентов в матриксе из различных веществ или путем микроинкапсулирования. Композиции могут быть приготовлены для высвобождения одного или нескольких компонентов в течение периода времени, составляющего 4, 6, 8, 12, 16, 20 или 24 часа. Высвобождение одного или нескольких компонентов может осуществляться с постоянной или изменяющейся скоростью.
При использовании дозированных форм с контролируемым высвобождением, предлагаемых в настоящем изобретении, один или несколько кофакторов могут высвобождаться в своей дозированной форме с более медленной скоростью, чем скорость, наблюдаемая в случае препарата немедленного высвобождения, содержащего такое же количество компонентов. В некоторых вариантах скорость изменения в биологическом образце, измеряемая как изменение концентрации на протяжении определенного периода времени от введения до максимальной концентрации в случае препарата с контролируемым высвобождением составляет меньше чем примерно 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10% от скорости для препарата немедленного высвобождения. Кроме того, в некоторых вариантах скорость изменения концентрации с течение времени составляет меньше чем примерно 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10% от скорости в случае препарата немедленного высвобождения.
В некоторых вариантах скорость изменения концентрации с течением времени снижена за счет увеличения периода времени до максимальной концентрации относительно пропорциональным образом. Например, двукратное увеличение периода времени до максимальной концентрации может снижать скорость изменения концентрации примерно с коэффициентом 2. В результате один или несколько кофакторов могут быть обеспечены таким образом, что они достигают своей максимальной концентрации со скоростью, которая значительно снижена по сравнению с дозированной формой с немедленным высвобождением. Композиции согласно настоящему изобретению могут быть приготовлены так, чтобы обеспечить сдвиг максимальной концентрации на 24 часа, 16 часов, 8 часов, 4 часа, 2 часа или по меньшей мере на 1 час. Ассоциированное снижение скорости изменения концентрации может быть примерно в 0,05, 0,10, 0,25, 0,5 или по меньшей мере в 0,8 раз. В некоторых вариантах это сопровождается высвобождением меньше чем примерно 30%, 50%, 75%, 90% или 95% одного или нескольких кофакторов в циркуляцию в течение одного часа после такого введения.
Необязательно препараты с контролируемым высвобождением дают кривые концентрации в плазме, имеющие начальные (например, от 2 часов после введения до 4 часов после введения) наклоны меньше чем 75%, 50%, 40%, 30%, 20% или 10% от наклонов в случае препарата немедленного высвобождения с такой же дозой такого же кофактора.
В некоторых вариантах скорость высвобождения кофактора, которую измеряют в исследованиях диссоциации, составляет меньше чем примерно 80%, 70%, 60% 50%, 40%, 30%, 20% или 10% от скорости в случае препарата немедленного высвобождения такого же кофактора в течение первых 1, 2, 4, 6, 8, 10 или 12 часов.
Препараты с контролируемым высвобождением, предлагаемые в настоящем изобретении, могут иметь множество форм. В некоторых вариантах препарат представляет собой пероральную дозированную форму, включая жидкие дозированные формы (например, суспензию или взвесь) и пероральные твердые дозированные формы (например, таблетку или нефасованный порошок), такие как, но без ограничения, формы, описанные в настоящей публикации.
Таблетка с длительным высвобождением препарата, описанного в настоящей публикации, может представлять собой матрикс, емкость или осмотическую систему. Хотя любая из трех систем является подходящей, последние две системы могут иметь более оптимальную емкость для заключения в них относительно большой массы, например, внесения в них большого количества одного кофактора или внесения в них множества кофакторов, в зависимости от генетического статуса индивидуума. В некоторых вариантах таблетка с медленным высвобождением основана на резервуарной системе, в которой сердцевина, содержащая один или несколько кофакторов, заключена в пористое мембранное покрытие, которое при увлажнении обеспечивает возможность диффузии одного или нескольких кофакторов через такое покрытие. Поскольку объединенная масса эффективных ингредиентов обычно составляет граммовые количества, то эффективная система доставки может обеспечить оптимальные результаты.
Таким образом, таблетки и пилюли также могут быть покрыты или приготовлены иным образом для получения формы дозирования, которая имеет преимущество длительного действия. Например, таблетка или пилюля может содержать внутренний компонент дозы и наружный компонент дозы, при этом последний имеет форму оболочки для первого. Два компонента могут быть разделены кишечнорастворимым слоем, который служит для противодействия дезинтеграции в желудке и обеспечивает возможность для прохождения внутреннего компонента интактным в двенадцатиперстную кишку или замедления высвобождения. Можно использовать множество различных веществ для таких кишечнорастворимых слоев или покрытий, такие вещества включают ряд полимерных кислот и смесей полимерных кислот с такими веществами, как шеллак, цетиловый спирт и ацетат целлюлозы. В некоторых вариантах препарат, содержащий множество кофакторов, может иметь разные кофакторы, высвобождаемые с разными скоростями или в разные периоды времени. Например, могут существовать дополнительные слои кофакторов, чередуемые с кишечнорастворимыми слоями.
Способы получения таблеток длительного высвобождения известны в данной области, смотри, например, публикации патентов США 2006/051416 и 2007/0065512 или другие ссылки, приведенные в настоящем описании. Такие способы, как способы, описанные в патентах США № 4606909, 4769027, 4897268 и 5395626, можно использовать для получения препаратов длительного высвобождения одного или нескольких кофакторов, определяемых генетическим статусом индивидуума. В некоторых вариантах препарат готовят, используя методику OROS®, которая описана в патентах США № 6919373, 6923800, 6929803 и 6939556. Другие способы, такие как способы, описанные в патентах США № 6797283, 6764697 и 6635268, также можно использовать для получения препаратов, описанных в настоящей публикации.
В некоторых вариантах композиции могут быть приготовлены в виде пищевой композиции. Например, композиции могут быть в виде напитка или других жидкостей, твердой пищи, полутвердой пищи с пищевым носителем или без него. Например, композиции могут содержать черный чай с добавлением любой из композиций, описанных в настоящей публикации. Композиция может представлять собой молочный продукт с добавлением любой из композиций, описанных в настоящей публикации. В некоторых вариантах композиции могут быть приготовлены в виде пищевой композиции. Например, композиции могут содержать напиток, твердый пищевой продукт, полутвердый пищевой продукт или пищевой носитель.
В некоторых вариантах можно использовать жидкие пищевые носители, например, в форме напитков, таких как содержащие добавки соки, кофе, чай, газированная вода, содержащая корригенты вода и тому подобное. Например, напиток может содержать препарат, а также жидкий компонент, такой как различные дезодорирующие средства и природные углеводы, присутствующие в обычных напитках. Примеры природных углеводов включают, но без ограничения, моносахариды, такие как глюкоза и фруктоза; дисахариды, такие как мальтоза и сахароза; обычные сахара, такие как декстрин и циклодекстрин; и сахарные спирты, такие как ксилит и эритрит. Также можно использовать природный дезодорант, такой как тауматин, экстракт стевии, леваудиозид A, глицирризин, и синтетический дезодорант, такой как сахарин и аспартам. Также можно использовать такие средства, как корригенты, красители и другие. Например, также можно использовать пектиновую кислоту и ее соль, альгиновую кислоту и ее соль, органическую кислоту, защитное коллоидное адгезивное средство, регулирующее pH средство, стабилизатор, консервант, глицерин, спирт или средства для карбонизации. Фрукты и овощи также можно использовать для получения пищевых продуктов или напитков, содержащих препараты, обсуждаемые в настоящем описании.
Альтернативно композиции могут представлять собой энергетический батончик с добавлением любой из композиций, описанных в настоящей публикации. Например, энергетический батончик может представлять собой шоколадный батончик, батончик с мюсли или батончик со смесью сухофруктов и орехов. В еще одном варианте пищевую добавку или пищевые композиции согласно изобретению готовят так, чтобы они имели подходящий и желательный вкус, консистенцию и вязкость для потребления. Любой подходящий пищевой носитель можно использовать в пищевых композициях согласно настоящему изобретению. Пищевые носители согласно настоящему изобретению включают практически любой пищевой продукт. Примеры таких пищевых носителей включают без ограничения пищевые батончики (батончики с мюсли, белковые батончики, конфеты и т.д.), зерновые продукты (овсяные хлопья, готовые зерновые завтраки, мюсли и т.д.), хлебобулочные изделия (хлеб, пончики, крекеры, рогалики, пирожные, торты и т.д.), напитки (напитки на основе молока, спортивные напитки, фруктовые соки, алкогольные напитки, бутилированная вода), макаронные изделия, крупы (рис, кукуруза, овес, рожь, пшеница, мука, и т.д.), яичные продукты, закуски (конфеты, чипсы, жевательная резинка, шоколад и т.д.), мясо, фрукты и овощи). В одном варианте пищевые носители, используемые в настоящем изобретении, могут маскировать нежелательный вкус (например, горечь). В том случае, когда это необходимо, пищевая композиция, предлагаемая в изобретении, имеет более подходящую консистенцию и желательный аромат, чем у любого из компонентов, описанных в настоящей публикации. Например, жидкие пищевые носители могут быть использованы согласно изобретению для получения пищевых композиций, предлагаемых в настоящем изобретении, в виде напитков, таких как имеющие добавки соки, кофе, чай и тому подобное. В других вариантах согласно изобретению могут быть использованы твердые пищевые носители для получения пищевых композиций согласно изобретению в виде заменителей пищи, таких как содержащие добавки энергетические батончики, макароны, хлеб и тому подобное. В других вариантах согласно изобретению могут быть использованы полутвердые пищевые носители для получения пищевых композиций согласно изобретению в виде камедей, жевательных конфет или сухих завтраков и тому подобное.
Доза комбинированных композиций может быть введена примерно, меньше чем примерно или больше чем примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше раз в сутки. Субъект может получать дозы в течение периода времени, составляющего примерно, меньше чем примерно или больше чем примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или больше суток, недель или месяцев. Стандартная доза может представлять собой часть суточной дозы, например, суточной дозы, разделенной на ряд стандартных доз, вводимых в сутки. Стандартная доза может составлять часть суточной дозы, то есть суточной дозы, разделенной на ряд стандартных доз, вводимых в сутки, и дополнительно разделенной на ряд стандартных доз (например, таблеток) на введение. Количество стандартных доз на введение может составлять примерно, меньше чем примерно или больше чем примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше. Количество доз в сутки может составлять примерно, меньше чем примерно или больше чем примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше. Количество стандартных доз в сутки может быть определено делением суточной дозы на стандартную дозу, и может составлять примерно, меньше чем примерно или больше чем примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 6, 17, 18, 19, 20 или больше стандартных доз в сутки. Например, стандартная доза может составлять примерно 1/2, 1/3, 1/4, 1/5, 1/6, 1/7, 1/8, 1/9, 1/10. Стандартная доза может составлять примерно одну третью часть суточного количества, и ее можно вводить субъекту три раза в сутки. Стандартная доза может составлять примерно половину суточного количества, и ее можно вводить субъекту дважды в сутки. Стандартная доза может составлять примерно одну четвертую часть суточного количества, при этом по две стандартных дозы вводят субъекту дважды в сутки. В некоторых вариантах стандартная доза содержит примерно, меньше чем примерно или больше чем примерно 50 мг ресвератрола. В некоторых вариантах стандартная доза содержит примерно, меньше чем примерно или больше чем примерно 550 мг лейцина. В некоторых вариантах стандартная доза содержит примерно, меньше чем примерно или больше чем примерно 200 мг одного или нескольких метаболитов лейцина. В некоторых вариантах стандартную дозу (например, стандартную дозу, содержащую лейцин) вводят в виде двух стандартных доз два раза в сутки. В некоторых вариантах стандартная доза (например, стандартная доза, содержащая один или несколько метаболитов лейцина, таких как HMB) вводят в виде одной стандартной дозы два раза в сутки.
Композиции, раскрытые в настоящем описании, могут дополнительно содержать корригент и может быть в виде твердого вещества, жидкости, геля или эмульсии.
Способы
В настоящей заявке предлагаются способы повышения результата на выходе пути сиртуина (включая AMPK, передающую сигнал молекулу в пути сиртуина) в организме субъекта с использованием избирательного ингибитора PDE. Как описано в настоящей публикации, результат на выходе пути сиртуина может быть охарактеризован на молекулярном уровне или по получаемому в результате физиологическому эффекту. В некоторых вариантах изобретение относится к способам повышения окисления жирных кислот в организме субъекта, включающим в себя введение субъекту композиции, которая раскрыта в настоящем описании. В различных вариантах осуществления изобретения композицию вводят субъекту в количестве, которое обеспечивает доставку синергетически действующих количеств одной или нескольких разветвленных аминокислот или их метаболитов, таких как лейцин или HMB, и ингибитора PDE5, такого как силденафил или икариин, достаточных для повышения окисления жирных кислот в клетках организма субъекта.
Способы, описанные в настоящей публикации, могут быть полезными в различных применениях. Такие применения включают (a) повышение результата на выходе пути сиртуина, (b) усиление митохондриального биогенеза, (c) увеличение образования новых митохондрий, (d) увеличение митохондриальных функций, (e) повышение окисления жирных кислот, (f) повышение генерирования тепла, (g) повышение чувствительности к инсулину, (h) усиление поглощения глюкозы, (i) увеличение расширения сосудов, (j) снижение массы, (k) снижение объема жировой ткани, (1) снижение воспалительного ответа или воспалительных маркеров в организме субъекта, и (m) увеличение продукции иризина. Любое из таких применений может быть достигнуто при введении одной или нескольких композиций, описанных в настоящей публикации.
Соответственно, изобретение относится к способу введения композиции, содержащей (a) один или несколько типов разветвленных аминокислот и/или их метаболитов и (b) избирательный ингибитор PDE, присутствующий в субтерапевтическом количестве, при этом композиция синергетически эффективна в отношении повышения результата на выходе пути сиртуина по меньшей мере примерно в 5 раз по сравнению с эффективностью компонента (a) или (b) при их использовании отдельно.
Результат на выходе путей можно измерить, используя один или несколько способов, раскрытых в настоящем описании и/или известных в данной области. Например, окисление жирных кислот можно определить, измеряя потребление кислорода или окисление 3H-меченого пальмитата. Митохондриальный биогенез можно измерить, используя митохондриальных зонд и используя флуоресценцию. Активность AMPK можно определить, измеряя фосфорилирование AMPK в анализе ELISA или с использованием Вестерн-блота. Активность Sirt1 можно определить, измеряя деацетилирование субстрата, которое можно выявить, используя флуорофор.
Увеличение sirt1, sirt2 или sirt3 наблюдают, применяя соответствующий субстрат в анализе деацилирования, осуществляемом in vitro. Субстратом для измерения активности SIRT1 может быть любой субстрат, известный в данной области (например, пептид, содержащий аминокислоты 379-382 p53 человека (Arg-His-Lys-Lys[Ac]). Субстратом для измерения активности SIRT3 может быть любой субстрат, известный в данной области (например, пептид, содержащий аминокислоты 317-320 p53 человека (Gin-Pro-Lys-Lys[Ac])). В некоторых случаях повышение активности sirt в одном или нескольких анализах, проводимых в присутствии одной или нескольких комбинированных композиций, описанных в настоящей публикации, приводит к повышению активности по меньшей мере примерно в 1, 2, 3, 5 или 10 раз по сравнению с активностью, измеряемой в присутствии только одного компонента комбинированных композиций. Например, применение комбинированной композиции, содержащей (a) активатор пути сиртуина (такой как силденафил) и (b) аминокислоту с разветвленной цепью или ее метаболит (такой как HMB) приводит к повышению активности sirt3 по меньшей мере примерно в 5 раз по сравнению с активностью, измеряемой в присутствии (a) или (b) отдельно. Также, применение композиции согласно изобретению приводит к повышению активности sirt1, которая становится в 1,5, 2, 5 или 10 раз выше, чем активность, измеряемая в присутствии только одного компонента композиции.
Изобретение относится к способу введения композиции, содержащей: (a) один или несколько типов разветвленных аминокислот и/или их метаболитов, и (b) избирательный ингибитор PDE, при этом целевое или достигаемое молярное отношение компонента (a) к (b) в циркуляции в организме субъекта, которому вводят указанную композиция, составляет больше чем примерно 100000, 200000 или 500000, и при этом композиция при введении субъекту, нуждающемуся в таком введении, синергетически усиливает энергетический обмен, что измеряют по снижению прибавления массу у субъекта, снижению объема висцерального жира у субъекта, повышению окисления жира у субъекта, повышению чувствительности к инсулину у субъекта, повышению поглощения глюкозы в мышцах субъекта, снижению уровня маркеров воспаления, увеличению расширения сосудов и/или повышению температуры тела.
Изобретение относится к способу введения пищевой композиции, содержащей: (a) один или несколько типов разветвленных аминокислот и/или их метаболитов; (b) избирательный ингибитор PDE (например, силденафил или икариин), при этом (a) и (b) присутствуют в количестве, которое синергетически влияет на уменьшение прибавления массы у субъекта, уменьшение объема висцерального жира у субъекта, повышение окисления жира у субъекта, повышение чувствительности к инсулину у субъекта, повышение поглощения глюкозы в мышцах субъекта, повышение расширения сосудов, снижение окислительного стресса, снижение воспалительного стресса и/или повышение температуры тела; и (c) пищевой носитель.
Изобретение относится к способу введения композиции, содержащей: сочетание (a) одного или нескольких типов разветвленных аминокислот и/или их метаболитов; и (b) ингибитор PDE-5, при этом композиция по существу не содержит неразветвленных аминокислот, при этом сочетание при введении субъекту, нуждающемуся в таком введении, усиливает митохондриальный биогенез в большей степени по сравнению с введением данного компонента (a) или компонента (b) отдельно, и при этом усиленный митохондриальный биогенез измеряют по снижению массы субъекта, уменьшению объема висцерального жира у субъекта, повышению окисления жира у субъекта, повышению чувствительности к инсулину у субъекта, повышению поглощения глюкозы в мышцах субъекта, повышению расширения сосудов, снижению окислительного стресса, снижению воспалительного стресса и/или повышению температуры тела. В некоторых вариантах количество (a) и количество (b) являются синергетически действующими.
Изобретение относится к способу введения композиции, содержащей: сочетание (a) одного или нескольких типов разветвленных аминокислот и/или их метаболитов; и (b) ингибитор PDE-5, при этом композиция по существу не содержит неразветвленных аминокислот, при этом сочетание при введении субъекту, нуждающемуся в таком введении, усиливает митохондриальный биогенез в более высокой степени по сравнению с введением субъекту компонента (a) или компонента (b) отдельно, и при этом усиленный митохондриальный биогенез измеряют по снижению массы субъекта, уменьшению объема висцерального жира у субъекта, повышению окисления жира у субъекта, повышению чувствительности к инсулину у субъекта, повышению поглощения глюкозы в мышцах субъекта, повышению расширения сосудов, снижению окислительного стресса, снижению воспалительного стресса и/или повышению температуры тела. В некоторых вариантах количество (a) и количество (b) являются синергетически действующими.
Изобретение относится к способу усиления окисления жира у субъекта, нуждающегося в таком усилении, включающему в себя введение субъекту любой из композиций, описанных в настоящей публикации, в течение определенного периода времени, при этом окисление жира у субъекта повышается в течение такого периода времени. Окисление жира может повышаться примерно или больше чем примерно на 5, 10, 15, 20, 50, 100, 200 или 500%.
Изобретение относится к способу снижения воспалительного ответа у субъекта, нуждающегося в таком снижении, включающему в себя введение субъекту любой из композиций, описанных в настоящей публикации в течение определенного периода времени, при этом воспалительный ответ у субъекта снижается в течение такого периода времени. Воспалительный ответ может быть снижен примерно или больше чем примерно на 5, 10, 15, 20, 50 или 100%.
Уровни маркеров воспаления и цитокинов, включая, но без ограничения, IL-6, адипонектин, TNF-α и CRP в плазме можно определить в иммунных анализах, таких как ELISA (Assay Designs, Ann Arbor, MI; Linco Research, St. Charles, MO; и Bioscience, San Diego, CA).
Изобретение относится к способу повышения или поддержания температуры тела в организме субъекта, включающему в себя введение субъекту любой из композиций, описанных в настоящей публикации, в течение определенного периода времени, при этом температура тела у субъекта повышается в течение такого периода времени. Температура тела может быть повышена примерно или больше чем примерно на 1, 2, 3, 4, 5, 10, 15 или 20%.
Изобретение относится к способу индукции расширения сосудов, включающему в себя введение субъекту любой из композиций, описанных в настоящей публикации, в течение определенного периода времени, при этом расширение сосудов у субъекта индуцируется в течение такого периода времени. Расширение кровеносных сосудов может быть повышено примерно или больше чем примерно на 1, 2, 3, 5, 10, 20, 50 или 100%. Расширение сосудов может быть измерено оптически, путем измерения вазорестрикции или множеством других способов. Такие способы включают инвазивный способ в области предплечья, способ ультразвукового исследования плечевой артерии и анализ пульсовой волны. Способы измерения расширения сосудов описаны в
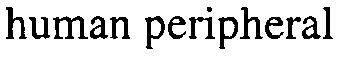
Изобретение относится к способу повышения продукции иризина, включающему в себя введение субъекту любой из композиций, описанных в настоящей публикации, при этом продукция иризина у субъекта повышается в течение определенного периода времени. В некоторых вариантах повышение продукции иризина (или показателя, свидетельствующего о таком повышении) представляет собой повышение примерно или больше чем примерно на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 125%, 150%, 175%, 200% или больше. В некоторых вариантах повышение продукции иризина (или показателя, свидетельствующего о таком повышении) представляет собой повышение примерно или больше чем примерно в 1 раз, 3 раза, 5 раз, 6 раз, 8 раз, 10 раз, 15 раз, 20 раз, 50 раз или больше. В некоторых вариантах повышение продукции иризина подтверждается повышением экспрессии FNDC5 (например, измеряемой по уровню мРНК и/или белка). В некоторых вариантах повышение продукции иризина подтверждается повышением одного или нескольких показателей образования бурых жировых клеток (например, окисление жирных кислот и/или повышение экспрессии одного или нескольких генов, избирательных для бурого жира в жировой ткани). Не ограничивающие примеры избирательных для бурого жира генов включают Ucp1, Cidea, Prdm16 и Ndufs. В некоторых вариантах повышение продукции иризина подтверждается повышенной секрецией иризина из клетки (например, судя по измерению в среде, в которой культивируют клетку, или в циркулирующей плазме в организме субъекта). Повышение уровней экспрессии генов может быть измерено непосредственно (например, по изменению уровней мРНК или белка) или опосредованно (по изменениям эффектов, ассоциированных с повышением экспрессия, таких как повышенная экспрессия нижележащего гена). Способы выявления изменений уровня генной экспрессии известны в данной области и включают, без ограничения, способы выявления мРНК (например, ОТ-ПЦР, Нозерн-блот и гибридизация на микроматрице), выявление белковых продуктов (например, Вестерн-блот и ELISA), выявление одной или нескольких активностей транслированного белка (например, анализы ферментативной активности).
Изобретение относится к способу лечения субъекта с диабетом, например, субъекта с диабетом типа I, диабетом типа II и/или индуцированного питанием диабета, включающему в себя введение субъекту любой из композиций, описанных в настоящей публикации, в течение определенного периода времени. Диабет может характеризоваться пониженными уровнями инсулина, резистентностью к инсулину или сочетанием обоих признаков. В некоторых вариантах введение является эффективным в отношении улучшения симптома диабета у субъекта. Например, введение композиции может улучшать чувствительность к инсулину у субъекта. Диабет типа I можно характеризоваться пониженной продукцией инсулина по сравнению с субъектом без диабета типа I. Введение композиции, описанной в настоящей публикации, может улучшать чувствительность субъекта с диабетом типа I (например, имеющего пониженный уровень инсулина) к инсулину, который продуцируется или который вводят субъекту. Диабет типа II может характеризоваться пониженной чувствительностью к инсулину. Соответственно, введение композиции, описанной в настоящей публикации, может улучшать чувствительность к инсулину у субъекта с диабетом типа II.
Примером симптома диабета является пониженная чувствительность к инсулину. Чувствительность к инсулину может быть определена способами, известными в данной области. Например, чувствительность к инсулину может быть определена в результате измерения уровней глюкозы в крови в организме субъекта, в некоторых случаях в течение определенного периода времени после введения болюса инсулина. Субъекты с пониженной чувствительностью к инсулину обычно имеют ослабленное падение уровней глюкозы в крови после введения инсулина по сравнению с субъектом с нормальной чувствительностью к инсулину. Введение композиции, описанной в настоящей публикации, может повышать чувствительность к инсулину у субъекта. Введение композиции, описанной в настоящей публикации, может повышать чувствительность к инсулину у субъекта, по сравнению, например, с уровнем чувствительности к инсулину у субъекта до введения. Чувствительность к инсулину может быть повышена примерно или больше чем примерно на 1, 2, 3, 5, 10, 20, 50, 100 или 200%, по сравнению с уровнем чувствительности к инсулину у субъекта до введения композиции.
Другим примером симптома диабета является пониженная толерантность к глюкозе. Толерантность к глюкозе может быть определена любыми способами, известными в данной области. Например, толерантность к глюкозе может быть определена путем измерения уровней глюкозы в крови в организме субъекта, в некоторых случаях в течение определенного периода времени после введения болюса глюкозы. Субъекты с пониженной толерантностью к глюкозе обычно имеют повышенные уровни глюкозы в крови и/или более медленный клиренс глюкозы из крови по сравнению с субъектами с нормальной толерантностью к глюкозе. Введение композиции, описанной в настоящей публикации, может повышать толерантность к глюкозе у субъекта. Введение композиции, описанной в настоящей публикации, может повышать толерантность к глюкозе у субъекта, по сравнению, например, с уровнем толерантности к глюкозе у субъекта до введения. Толерантность к глюкозе может быть повышена примерно или больше чем примерно на 1, 2, 3, 5, 10, 20, 50, 100, или 200%, по сравнению, например, с уровнем толерантности к глюкозе у субъекта до введения.
Другим симптомом диабета являются повышенные постпрандиальные уровни глюкозы в крови или уровни глюкозы в крови натощак. Уровни глюкозы в крови можно определить любыми способами, известными в данной области. Например, уровни глюкозы в крови могут быть определены, например, в результате контроля уровня глюкозы. Повышенный уровень глюкозы в крови может представлять собой, например, повышение уровней глюкозы в крови в организме субъекта с диабетом по сравнению с уровнями глюкозы в крови в организме субъекта или контрольной популяции без диабета. Введение композиции, описанной в настоящей публикации, может снижать уровни глюкозы в крови (например, постпрандиальный уровень глюкозы в крови и/или уровень глюкозы в крови натощак) в организме субъекта. Введение композиции, описанной в настоящей публикации, может снижать уровни глюкозы в крови (например, например, постпрандиальный уровень глюкозы в крови и/или уровень глюкозы в крови натощак) у субъекта, по сравнению, например, с уровнем глюкозы в крови у субъекта до введения. Введение композиция, описанной в настоящей публикации, может снижать уровни глюкозы в крови примерно или больше чем примерно на 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 или 100%, по сравнению с уровнями глюкозы в крови у субъекта до введения. Введение композиции, описанной в настоящей публикации, может снижать уровни глюкозы в крови до нормальных уровней, например, уровней, встречающихся в контрольной популяции, которая не имеет диабета.
Другим симптомом диабета является повышенная гомеостатическая оценка инсулинорезистентности (HOMAIR). HOMAIR может быть определен любыми способами, известными в данной области, например, с использованием следующего уравнения: HOMAIR = [инсулин (микроЕд./мл) X глюкоза (мМ)]/22,5. Введение композиции, описанной в настоящей публикации, может снижать уровни HOMAIR у субъекта. Повышенный HOMAIR может представлять собой, например, повышение уровней HOMAIR у субъекта с диабетом по сравнению с уровнями HOMAIR у субъекта или контрольной популяции без диабета. Введение композиции, описанной в настоящей публикации, может снижать уровни HOMAIR у субъекта. Введение композиции, описанной в настоящей публикации, может снижать уровни HOMAIR у субъекта, по сравнению, например, с уровнями HOMAIR у субъекта до введения композиции, описанной в настоящей публикации. Введение композиции может снижать уровни HOMAIR примерно или больше чем примерно на 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 или 100%, по сравнению с уровнями HOMAIR у субъекта до введения композиции. Уровни HOMAIR могут быть снижены до нормальных уровней, например, до уровней, встречающихся в контрольной популяции, которая не имеет диабета.
Другим симптомом диабета является увеличенная масса печени. Массу печени можно оценить любыми способами, известными в данной области, например, путем визуализации или с использованием биопсии. Увеличенная масса печени может представлять собой, например, увеличение массы печени у субъекта с диабетом по сравнению с массой печени у субъекта или в контрольной популяции без диабета. Введение композиции, описанной в настоящей публикации, может уменьшать массу печени у субъекта. Введение композиции, описанной в настоящей публикации, может уменьшать массу печени у субъекта по сравнению, например, с массой печени субъекта до введения композиции, описанной в настоящей публикации. Введение композиции может уменьшать массу печени примерно или больше чем примерно на 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 или 100%, по сравнению с массой печени субъекта до введения композиции. Введение композиции может уменьшать массу печени субъекта до нормальной, например, до средней массы печени, встречающейся в контрольной популяции, которая не имеет диабета.
Другим симптомом диабета является повышенное воспаление. Воспаление в организме субъекта можно оценить любыми способами, известными в данной области, например, в результате анализа маркеров, ассоциированных с воспалением в организме субъекта или в биологическом образце, полученном от субъекта. Маркеры, ассоциированные с воспалением, известны в данной области и включают, например, типы воспалительных клеток, рецепторы белков, воспалительные молекулы и другие показатели, вовлеченные в пути воспаления. Примеры маркеров, ассоциированных с воспалением, включают, но без ограничения, цитокины, IL-6, адипонектин, MCP-1 и C-реактивный белок (CRP). Биологическим образцом может быть, например, цельная кровь, плазма, сыворотка, слюна, мокрота, моча, кал, кожа, волосы или биопсия ткани. Биологический образец может быть получен любыми способами, известными в данной области. Маркеры могут быть выявлены и/или оценены любыми способами, известными в данной области, например, с использованием визуализации, иммунофлуоресценции, иммуногистохимиии, анализа экспрессии генов, гибридизации in situ, анализа защиты от РНК-азы, анализа репортера, ELISA или любым другим способом. Введение композиции, описанной в настоящей публикации, может снижать воспаление у субъекта. Введение композиции, описанной в настоящей публикации, может снижать воспаление у субъекта по сравнению, например, с уровнями воспаления у субъекта до введения. Повышенное воспаление может представлять собой, например, повышение уровней воспаления в организме субъекта с диабетом по сравнению с уровнями воспаления у субъекта или в контрольной популяции без диабета. Введение композиции, описанной в настоящей публикации, может снижать примерно или больше чем примерно 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 или 100% по сравнению с уровнями воспаления у субъекта до введения. Введение композиции, описанной в настоящей публикации, может снижать воспаление у субъекта до нормальных уровней, например, до средних уровней воспаления, встречающихся в контрольной популяции, которая не имеет диабета.
В некоторых вариантах также может быть измерена передача сигнала инсулина. Передачу сигнала инсулина можно измерить благодаря измерению общих и фосфорилированных Akt, GSK-β, IGF-1R, IR, IRS-1, p70S6K и PRAS40 в лизатах тканей с использованием наборов Luminex «Akt Pathway Total 7-Plex Panel» (№ в каталоге LHO0002) и «Akt Pathway Phospho 7-Plex Panel» (№ в каталоге LHO0001) из Invitrogen Life Science.
В некоторых вариантах аминокислоту с разветвленной цепью (или ее метаболит) и/или избирательный ингибитор PDE вводят в количестве, которое снижает терапевтически эффективную дозу метформина для субъекта. В некоторых вариантах терапевтически эффективная доза метформина снижается примерно или больше чем примерно на 50%, 60%, 70%, 80%, 90%, 95%, 97,5%, 99,9%, 99,99% или больше. В некоторых вариантах введение композиций согласно изобретению снижает уровень жира в организме (например, висцерального жира) примерно или больше чем примерно на 5%, 10%, 15%, 20%, 25%, 50% или больше.
В настоящем изобретении также предлагаются способы усиления митохондриального биогенеза в организме субъекта, включающие в себя введение субъекту композиции, раскрытой в настоящем описании. В различных вариантах осуществления изобретения композицию вводят субъекту в количестве, которое обеспечивает доставку синергетически действующего количества избирательного ингибитора PDE, достаточного для усиления митохондриального биогенеза в клетках субъекта. В другом варианте предлагается введение субъекту композиции, содержащей синергетически действующие количества лейцина и ингибитора PDE (например, ингибитора PDE-5) в количестве, достаточном для усиления митохондриального биогенеза в клетках субъекта. Следующие варианты относятся к введению субъекту композиции, содержащей синергетически действующие количества лейцина, ингибитора PDE (например, ингибитора PDE-5) и ресвератрола в количестве, достаточном для усиления митохондриального биогенеза у субъекта. Митохондриальный биогенез и окисление жира могут быть индуцированы в различных клетках, включая мышечные клетки и адипоциты.
Другой аспект изобретения относится к способам уменьшения прибавки массы или снижения объема жира в организме субъекта, включающим в себя введение композиций, раскрытых в настоящем описании. Массу тела можно измерить с использованием поверенной шкалы и роста, измеряемого с помощью настенного ростомера, и индекс массы тела можно вычислить с использованием стандартного уравнения (кг/м2). Массу жира можно оценить с использованием двухэнергетической рентгеновской абсорбциометрии на исходном уровне и через 12 и 24 недели. Система двухэнергетической рентгеновской абсорбциометрии LUNAR Prodigy (GE Healthcare, Madison, WI) или любая другая система для рентгеновской абсорбциометрии, известная в данной области, может быть налажена и откалибрована для применения. Можно оценивать фантом позвоночника каждый день, чтобы определить, происходит ли какое-либо смещение в устройстве с последующим блокированием повседневной поверки.
В данном аспекте изобретения композицию вводят субъекту в количестве, которое обеспечивает доставку синергетически действующего количества избирательного ингибитора PDE в сочетании с одним или несколькими средствами: лейцином, HMB и ресвератролом, достаточного для уменьшения прибавки массы у субъекта.
Введение композиций, раскрытых в настоящем описании, которые повышают активность SIRT1 и SIRT3, может быть полезным для любого субъекта, нуждающегося в метаболической активации адипоцитов или одной или нескольких из его мышц, например, скелетной мышцы, гладкой мышцы или сердечной мышцы или его мышечных клеток. Субъектом может быть субъект, имеющий кахексию или мышечную слабость. Повышение активности SIRT3 также может быть использовано для повышения или поддержания температуры тела, например, у субъектов с гипотермией, и повышение активности SIRT1 полезно при лечении диабета (диабета типа 2) и нарушенной толерантности к глюкозе и для снижения воспалительных ответов у субъекта.
Повышение активности SIRT3 также можно использовать для лечения или профилактики сердечнососудистых заболеваний, снижения кровяного давления за счет расширения сосудов, улучшения состояния сердца и сосудов и усиления сократительной функции тканей сосудов, например, кровеносных сосудов и артерий (например, за счет влияния на гладкую мускулатуру). В общем, активацию SIRT3 можно применять для стимуляции метаболизма адипоцитов или мышц любого типа, например, мышц кишечника или пищеварительной системы или мочевыводящего пути, и следовательно, можно использовать для регуляции перистальтики кишечника, например, запора и недержания. Активация SIRT3 также может быть применима при эректильной дисфункции. Ее также можно использовать, например, для стимуляции подвижности сперматозоидов, и использовать в качестве лекарственных средств от бесплодия. Другие варианты, в которых может быть полезным повышение SIRT3, включают восстановление мышц, например, после операции или несчастного случая, увеличение мышечной массы; и повышение результативности атлетов.
Таким образом, изобретение относится к способам, которыми получают полезные эффекты за счет осуществления контакта одной или нескольких мышечных клеток со средством, которое увеличивает количество белка уровень активности SIRT3 в клетке. Такие способы эффективно способствуют, повышают или стимулируют один или несколько из следующих процессов: имитацию полезного действия ограничения калорий или физических упражнений для мышечной клетки, усиление митохондриального биогенеза или метаболизма, повышение митохондриальной активности и/или выносливости мышечной клетки, сенсибилизацию мышечной клетки к поглощению глюкозы, повышение окисления жирных кислот в мышечной клетке, снижение уровня активных форм кислорода (ROS) в мышечной клетке, повышение экспрессии PGC-1α и/или UCP3 и/или GLUT4 в мышечной клетке, и активацию AMP-активируемой протеинкиназы (AMPK) в мышечной клетке. Различные типы мышечных клеток могут быть подвергнуты контакту согласно изобретению. В некоторых вариантах мышечная клетка представляет собой скелетную мышечную клетку. В некоторых вариантах мышечной клеткой является клетка медленно сокращающейся мышцы, такой как клетка камбаловидной мышцы.
Скорость метаболизма в состоянии покоя (RMR)/окисление субстрата измеряют непрямой калориметрией, используя способ открытого контура с 6 часов утра до 10 часов утра после 12-часового голодания и 48-часовой воздержания от физических упражнений, используя метаболическую камеру SensorMedics Vmax 29n (Sensor Medics, Anaheim, CA). После опорожнения мочевого пузыря участник спокойно отдыхает в течение 30 минут в изолированной комнате с контролируемой температурой (21-24°C) окружающей среды. Субъекта затем помещаются под вытяжным колпаком минимум на 30 минут, пока не будет достигнуто стационарное состояние. Критериями для достоверного измерения могут быть: минимум 15 минут стационарного состояния, при этом стационарное состояние определяют как наличие менее чем 10% колебание минутного объема вентиляции легких и потребления кислорода и менее чем 5% колебание дыхательного коэффициента. Скорость метаболизма вычисляют, используя уравнение Weir, RQ вычисляют в виде отношения продукция CO2/потребление O2 и окисление субстрата вычисляют на основании RQ после коррекции в отношении потерь азота с мочой.
Поглощение глюкозы может быть измерено с использованием способов in vivo или in vitro. Например, поглощение глюкозы может быть измерено in vivo с применением ПЭТ-сканирования с использованием меченой глюкозы или аналога глюкозы. Измерения поглощения глюкозы можно количественно оценить на основании ПЭТ-сканирования или любым другим способом, известным в данной области. В некоторых вариантах поглощение глюкозы можно измерить в результате количественной оценки поглощения экзогенно вводимой 18-F-дезоксиглюкозы с помощью ПЭТ.
ROS/окислительный стресс можно измерить, отбирая кровь в обработанные EDTA пробирки, центрифугируя для отделения плазмы и делением образцов на аликвоты для отдельных анализов. Плазму можно хранить при -80°C в азоте, чтобы предотвратить окислительные изменения до измерений. Малональдегид (MDA) в плазме можно измерить, используя флуорометрический анализ, и 8-изопростан F2α в плазме измеряли в ELISA (Assay Designs, Ann Arbor, MI).
В другом варианте предлагается введение субъекту композиции, содержащей синергетически действующие количества лейцина и ресвератрола в количестве, достаточном для повышения окисления жирных кислот в клетках субъекта. В других вариантах предлагается введение субъекту композиции, содержащей синергетически действующие количества лейцина, HMB и ресвератрола в количестве, достаточном для повышения окисления жирных кислот у субъекта. Лейцин может быть в форме свободной аминокислоты.
Композиции могут быть введены субъекту перорально или любыми другими способами. Способы перорального введения включают введение композиции в виде жидкости, твердого вещества или полутвердого вещества, которое может быть взято в форме пищевой добавки или продукта питания.
Композиции можно вводить периодически. Например, композиции можно вводить один, два, три, четыре раза в сутки или даже чаще. Субъекту можно проводить введение каждые 1, 2, 3, 4, 5, 6 или 7 дней. В некоторых вариантах композиции вводят три раза в сутки. Введение может быть осуществлено во время приема пищи субъектом. Период лечения или введение добавок в пищу может составлять примерно 1, 2, 3, 4, 5, 6, 7, 8 или 9 дней, 1 неделю или дольше, 2 недели или дольше, шесть недель или дольше, 1-11 месяцев или дольше, 1 год или дольше, 2 года или дольше или 5 лет или дольше. В некоторых вариантах осуществления изобретения дозы, которые вводят субъекту, могут изменяться или оставаться постоянными в течение периода лечения. Например, суточные дозовые количества могут быть увеличены или уменьшены на протяжении периода введения.
Композиции могут быть терапевтически эффективными в течение длительного периода времени, так чтобы сохранялись полезные эффекты. Полезные эффекты могут поддерживаться введением композиций, описанных в настоящей публикации, в течение периода, составляющего по меньшей мере примерно 4, 6, 8, 10 или 12 недель или, по меньшей мере примерно 4, 6, 12, 24, 48 или 72 месяца.
Композиции можно вводить субъекту так, чтобы субъекту была введена выбранная суммарная суточная доза композиции, которая описана в настоящей публикации. Например, суммарная суточная доза композиции может содержать примерно 0,05, 0,1, 0,5, 1, 2, 5, 10, 20, 40, 60, 80 или 100 мг силденафила.
В некоторых вариантах выбранная доза композиции может быть введена субъекту так, чтобы у субъекта был достигнут требуемый уровень циркулирующей композиции, которая описана в настоящей публикации. Например, требуемый уровень циркулирующей композиции может составлять примерно 0,1, 0,5, 1, 2, 5, 10 нМ или больше силденафила и требуемый уровень циркулирующей композиции может составлять по меньшей мере примерно 0,25, 0,5, 0,75, 1 мМ или больше лейцина. Выбираемая доза может быть выбрана на основе таких характеристик субъекта, как масса, рост, этническая принадлежность или генетика.
В другом аспекте изобретение относится к способу усиления энергетического обмена в организме субъекта, включающему в себя введение композиции, описанной в настоящей публикации, такой как композиция, содержащая избирательный ингибитор PDE, субъекту, нуждающемуся в таком введении, в течение периода времени, протяжение которого усиливают энергетический обмен у субъекта. Изобретение также относится к способу усиления окисления жира у субъекта, нуждающегося в таком усилении, включающему в себя введение композиции, описанной в настоящей публикации по меньшей мере два раза в сутки в течение определенного периода времени, при этом окисление жира у субъекта повышается в течение такого периода времени по сравнению с окислением жира у субъекта до указанного периода времени. Энергетический обмен у субъекта может быть измерен до лечения и после лечения, чтобы определить, повысился ли энергетический обмен у субъекта. Альтернативно, субъекты могут быть объединены в группу тестирования и контрольную группу, при этом усиление энергетического обмена измеряют в сравнении в разных группах.
Продолжительность периода введения и/или дозовые количества могут быть определены лечащим врачом, диетологом или клиницистом любого другого типа. Период времени может составлять одну, две, три, четыре или больше недель. Альтернативно, период времени может составлять один, два, три, четыре, пять, шесть или больше месяцев.
В другом аспекте изобретение относится к способу усиления энергетического обмена в организме субъекта, включающему в себя введение композиции, описанной в настоящей публикации, на выбранном уровне дозы, при этом выбранный уровень дозы индуцирует у субъекта циркулирующий уровень, составляющий примерно 0,5 мМ лейцина и примерно 1 нМ силденафила. Уровень дозы можно корректировать на основе характеристик субъекта, таких как масса, рост, этническая принадлежность, генетика или исходный уровень энергетического обмена.
Лечащий врач, диетолог или клиницист могут наблюдать ответ субъекта на вводимые композиции и корректировать дозу на основе активности субъекта или измеряемых циркулирующих уровней лейцина, ингибитора PDE5 или любого другого компонента композиции. Например, уровни доз могут быть повышены в случае субъектов, у которых наблюдают пониженные эффекты в регуляции энергии или циркулирующих уровней ингибитора PDE5 или лейцина, которые ниже требуемых целевых уровней.
В некоторых вариантах композиции, вводимые субъекту, могут быть оптимизированы для данного субъекта. Например, отношение аминокислот с разветвленной цепью к избирательному ингибитору PDE или конкретным компонентам в комбинированной композиции может быть скорректировано. Соотношение и/или конкретные компоненты могут быть выбраны после оценки субъекта после введения одной или нескольких композиций с разными отношениями аминокислот с разветвленной цепью к избирательному ингибитору PDE или разными компонентами комбинированной композиции.
В некоторых вариантах способы, описанные в настоящей публикации, включают в себя введение композиции согласно изобретению отдельно. Однако любые способы, описанные в настоящей публикации, могут включать в себя комбинированную терапию. Комбинированная терапия может включать в себя введение композиции, описанной в настоящей публикации (например, композиции, содержащей аминокислоту с разветвленной цепью или ее метаболит и ингибитор PDE) в сочетании с дополнительным терапевтическим средством. Дополнительным терапевтическим средством может быть, например, терапевтическое средство для лечения диабета. В используемом в настоящем описании смысле подразумевается, что термины «совместное введение», «вводимый в сочетании с» и их грамматические эквиваленты охватывают введение композиции согласно изобретению и дополнительного терапевтического средства одному субъекту, и подразумевают схемы лечения, согласно которым вводят композицию и дополнительное терапевтическое средство одним и тем же или разными путями введения или в одно и то же или разное время. В некоторых вариантах композицию, описанную в настоящей публикации, вводят совместно с одним или несколькими дополнительными терапевтическими средствами. Указанные термины охватывают введение субъекту композиции согласно изобретению и дополнительного терапевтического средства так, чтобы активные ингредиенты композиции согласно изобретению, дополнительное терапевтическое средство(ва) и/или их метаболиты присутствовали в организме субъекта одновременно. Термины вкачают одновременное введение в виде разных композиций, введение в разное время в виде разных композиций и/или введение в виде одной композиции, в которой присутствуют ингибитор PDE, аминокислота с разветвленной цепью и дополнительное терапевтическое средство. Таким образом, в некоторых вариантах ингибитор PDE, аминокислоту с разветвленной цепью и дополнительное терапевтическое средство вводят в виде одной композиции. В некоторых вариантах ингибитор PDE, аминокислоту с разветвленной цепью и дополнительное терапевтическое средство смешивают в одной композиции. Примеры дополнительных терапевтических средств описаны в настоящей публикации.
В некоторых вариантах дополнительным терапевтическим средством является бигуанид. В некоторых случаях бигуаниды снижают уровни глюкозы в крови и/или плазме. Примеры бигуанидов включают без ограничения метформин, буформин, фенформин, прогуанил или тому подобное.
В некоторых вариантах дополнительным терапевтическим средством является миметик инкретина. В некоторых вариантах инкретиновый миметик увеличивает ответ поджелудочной железы на поглощение пищи. В некоторых случаях введение миметика инкретина в сочетании с любым из соединений, описанных в настоящей публикации, снижает уровни глюкозы в крови и/или плазме. Примеры миметиков инкретина включают, но без ограничения, эксенатид (Byetta®). Одним из применяемых способов лечения диабета в настоящее время является подкожная инъекция эксенатида (Byetta®).
В некоторых варианта дополнительным терапевтическим средством является тиазолидиндион. В некоторых случаях тиазолидиндионы отменяют резистентность к инсулину и снижают уровни глюкозы в крови и/или плазме. Примеры тиазолидиндионов включают без ограничения росиглитазон (авандия), пиоглитазон (актос), троглитазон (резулин), MCC-555, ривоглитазон, циглитазон или тому подобное.
В некоторых вариантах дополнительным терапевтическим средством является энтероэндокриннный пептид. В некоторых вариантах энтероэндокринные пептиды отменяют резистентность к инсулину и снижают уровни глюкозы в крови и/или плазме. Примеры энтероэндокринных пептидов, которые вводят в качестве дополнительных терапевтических средств, включают без ограничения GLP-1 или аналоги GLP-1, такие как таспоглутид® (ипсен), или тому подобное.
В конкретных вариантах дополнительное терапевтическое средство ингибирует деградацию энтероэндокринных пептидов L-клеток. В некоторых вариантах дополнительным терапевтическим средством является ингибитор DPP-IV. Ингибиторы DPP-IV, подходящие для применения в способах, описанных в настоящей публикации, включают без ограничения (2S)-1-{2-[(3-гидрокси-1-адамантил)амино]ацетил}пирролидин-2-карбонитрил (вилдаглиптин), (3R)-3-амино-1-[9-(трифторметил)-1,4,7,8-тетразабицикло[4,3,0]нона-6,8-диен-4-ил]-4-(2,4,5-трифторфенил)бутан-1-он (ситаглиптин), (1S,3S,5S)-2-[(2S)-2-амино-2-(3-гидрокси-1-адамантил)ацетил]-2-азабицикло[3,1,0]гексан-3-карбонитрил (саксаглиптин) и 2-({6-[(3R)-3-аминопиперидин-1-ил]-3-метил-2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил}метил)бензонитрил (алоглиптин). Другим средством терапии, который в настоящее время является стандартом лечения в случае лечения диабета, является метформин или сочетание метформина и ситаглиптина (Janumet®).
В некоторых вариантах конкретный выбор соединений зависит от диагноза, поставленного лечащими врачами, и их суждения о состоянии человека и подходящего протокола лечения. Соединения необязательно вводят одновременно (например, в одно и то же время, по существу в одно и то же время или в рамках одного и того же протокола лечения) или последовательно, в зависимости от природы заболевания, расстройства или состояния, состояния здоровья индивидуума и фактического выбора используемых соединений. В некоторых случаях определение порядка введения и количества повторов введения каждого терапевтического средства при осуществлении протокола лечения основано на оценке заболевания, подвергаемого лечению, и состояния индивидуума.
В некоторых вариантах терапевтически эффективные дозы варьируют в том случае, когда лекарственные средства применяют в сочетаниях при лечении. Способы экспериментального определения терапевтически эффективных доз лекарственных средств и других средств для применения в схемах комбинированной терапии описаны в литературе.
В некоторых вариантах комбинированной терапии, описанной в настоящей публикации, дозы совместно вводимых соединений варьируют, в зависимости от типа совместно используемого лекарственного средства, от конкретного используемого лекарственного средства, от заболевания или состояния, подвергаемого лечению и т.д. Кроме того, при совместном введении с одним или несколькими биологически активными средствами соединения, предлагаемые в настоящем изобретении, необязательно вводят либо одновременно с биологически активным средством(ами), либо последовательно. В некоторых случаях, при одновременном введении лечащий врач может принимать решение о подходящей последовательности введения терапевтического соединения, описанного в настоящей публикации, в сочетании с дополнительным терапевтическим средством.
Необязательно вводят множество терапевтических средств в любом порядке или даже одновременно. В случае одновременного введения терапевтические средства необязательно дают в виде одной единой формы или в виде множественных форм (только в качестве примера, либо в виде одной пилюли, либо в виде двух отдельных пилюль). В некоторых случаях одно из терапевтических средств необязательно дают в виде многократных доз. В других случаях оба средства необязательно дают в виде многократных доз. Если введение осуществляют не одновременно, то период времени между многократными дозами представляет собой подходящий период времени, например, больше чем 0 недель, но меньше чем четыре недели. Кроме того, способы сочетания, композиции и препараты не ограничены применением только двух средств; также предусмотрено применение множества терапевтических сочетаний (включая два или больше соединений, описанных в настоящей публикации).
В некоторых вариантах схему дозирования для лечения, профилактики или улучшения состояния(ий), в случае которого ищут способ облегчения, модифицируют в соответствии с разными факторами. Такие факторы включают расстройство, от которого страдает субъект, а также возраст, массу, пол, питание и общее состояние здоровья субъекта. Таким образом, в различных вариантах схема дозирования, применяемая в действительности, варьирует и отклоняется от схемы дозирования, указанной в настоящем описании.
В некоторых вариантах фармацевтические средства, которые входят в состав комбинированной терапии, описанной в настоящей публикации, предоставляются в виде объединенной формы дозирования или в виде отдельных форм дозирования, предназначенных по существу для одновременного введения. В некоторых вариантах фармацевтические средства, которые входят в состав комбинированной терапии, вводят последовательно с любым терапевтическим соединением, вводимым по схеме, что требует двухстадийного введения. В некоторых вариантах схема двухстадийного введения требует последовательного введения активных средств или пространственно разделенного введения отдельных активных средств. В некоторых вариантах период времени между стадиями многократного введения варьирует, в качестве не ограничивающего примера, от нескольких минут до нескольких часов, в зависимости от свойств каждого фармацевтического средства, таких как эффективность, растворимость, биодоступность, время полужизни в плазме и кинетический профиль фармацевтического средства.
В некоторых вариантах способы, описанные в настоящей публикации, включают в себя введение композиции, описанной в настоящей публикации, и осуществление схемы физической активности. Схема физической активности может представлять собой схему физических упражнений. Схема физической активности может быть рекомендована субъекту, например, лицом, обеспечивающим уход за пациентом, или может быть осуществлена субъектом по собственной инициативе субъекта. Схема физической активности может включать в себя один или несколько эпизодов или туров какой-либо физической активности или упражнений, включая, только в качестве примера, ходьбу, спортивную ходьбу, походы, туризм, бег, бег трусцой, бег по городским улицам (фриран), паркур, езду на велосипеде, плавание, прогулки, ходьбу на месте, занятия на велотренажере, греблю, йогу, езду на пони, тяжелую атлетику, танцы, гимнастику, боевые искусства, занятия легкой атлетикой, занятия атлетикой, занятия такими видами спорта, как, например, футбол, бейсбол, софтбол, крикет, кикбол, вышибалы, американский футбол, баскетбол, хоккей, катание на коньках, катание на роликовых коньках, роликах, скейтборде, серфинг, боулинг, катание на лыжах, поло, водное поло, лакросс, сноуборд, регби, борьбу, бокс, выполнение фигур высшего пилотажа, стрельбу из лука, фехтование, бадминтон, теннис, настольный теннис, сквош, подводное плавание, фризби, алтимат фризби, альпинизм, например, скалолазание, бильярд, верховую езду, гольф, ориентирование, цирковое искусство, такое как, например, прыжки на батуте, трапеции, пластическая акробатика, жонглирование, упражнения на подвесных тканях и тому подобное. Эпизод или тур физической активности может быть предпринят на протяжении периода времени, составляющего, например, 1-10 минут, 5-20 минут, 15-30 минут, 30-60 минут (1 час), 2 часа, 4 часа, 8 часов, 12 часов, 24 часа или больше чем 24 часа. Тур физической активности может продолжаться меньше 30 минут. Субъект может участвовать в одном туре физической активности в месяц, в неделю, в 2 турах в неделю, 3 турах в неделю или больше, в одном туре активности в день, два раза в день или больше чем в два раза в день. Схема физической активности может включать в себя, только в качестве примера, 1 тур физической активности в день, при этом тур физической активности продолжается, например, 20 минут. Введение композиции, описанной в настоящей публикации, в сочетании со схемой физической активности может оказывать синергетическое благотворное влияние на субъекта, например, синергетические терапевтические эффекты.
Введение субъекту композиции, описанной в настоящей публикации, такой как комбинированная композиция, может обеспечивать возможность регуляции или поддержания энергетического обмена субъекта. Регуляция или поддержание энергетического обмена может позволять субъекту получить ряд полезных эффектов. Такие полезные эффекты включают снижение массы, уменьшение жировой ткани, повышение окисления жирных кислот, повышение чувствительности к инсулину, снижение окислительного стресса и/или снижение воспаления. По сравнению с исходным уровнем до лечения такие эффекты могут приводить к улучшению примерно или больше чем примерно на 5, 10, 15, 20, 30, 40, 50, 75, 100, 125, 150, 200, 250, 300, 400 или 500%. Альтернативно, введение композиции, описанной в настоящей публикации, может позволять поддерживать массу субъекта, количество жировой ткани, количественный уровень окисления жирных кислот, уровень чувствительности к инсулину, уровень окислительного стресса и/или уровень воспаления. Такие количества и/или уровни могут поддерживаться в пределах 0, 1, 5 или 10% от количеств и/или уровней в начале введения.
Другой аспект изобретения относится к достижению требуемых эффектов у одного или нескольких субъектов после введения комбинированной композиции, описанной в настоящей публикации, в течение конкретного периода времени.
После 6-недельного периода введения композиции комбинированная композиция, содержащая (a) определенный уровень дозы ингибитор PDE5 и определенный уровень дозы HMB или (b) определенный уровень дозы ингибитора PDE, например, ингибитора PDE5 и определенный уровень дозы лейцина (например, свободного лейцина), может снижать прирост массы у одного или нескольких субъектов по меньшей мере примерно на 10, 15, 20 или 20,5%. p-значение может быть меньше 0,05 (например, меньше чем примерно 0,05, 0,03, 0,02, 0,01, 0,001, 0,0001 или меньше). Один или несколько субъектов, подвергаемых лечению с использованием одного и того же уровня дозы одного из компонентов (силденафила, икариина, ресвератрола, лейцина или HMB) могут иметь незначительное снижение массы или снижение массы, которое составляет меньше чем примерно 0, 5 или 10%.
После 2-недельного периода введения композиция, содержащая (a) определенный уровень дозы ингибитора PDE, например, ингибитора PDE5, и определенный уровень дозы HMB или (b) определенный уровень дозы ресвератрола и определенный уровень дозы лейцина (например, свободного лейцина), может повышать окисление жира в целом организме у одного или нескольких субъектов по меньшей мере примерно на 10, 15 или 20%. p-значение может быть меньше 0,05 (например, меньше чем примерно 0,05, 0,03, 0,02, 0,01, 0,001, 0,0001 или меньше). Повышение окисления жира в целом организме может быть длительным, пока субъектам вводят композицию, или в течение периода, составляющего по меньшей мере 2, 4, 6, 10, 13, 26 или 52 недели. Один или несколько субъектов, подвергаемых лечению с использованием одного и того же уровня дозы одного из компонентов (силденафила, икариина, ресвератрола, лейцина или HMB) могут иметь незначительное повышение окисления жира в целом организме, или повышение окисления жира в целом организме, которое составляет меньше чем примерно 0, 5 или 10%.
После 2-недельного периода введения композиция, содержащая (a) определенный уровень дозы ингибитора PDE, например, ингибитора PDE5, и определенный уровень дозы HMB или (b) определенный уровень дозы ресвератрола и определенный уровень дозы лейцина (например, свободного лейцина), может повышать тепловой эффект пищи у одного или нескольких субъектов по меньшей мере примерно на 10, 15, 17 или 20%. p-значение может быть меньше 0,05 (например, меньше чем примерно 0,05, 0,03, 0,02, 0,01, 0,001, 0,0001 или меньше). Повышение теплового эффекта пищи может быть длительным, пока субъектам вводят композицию, или в течение периода, составляющего по меньшей мере 2, 4, 6, 10, 13, 26 или 52 недели. Один или несколько субъектов, подвергаемых лечению с использованием одного и того же уровня дозы одного из компонентов (силденафила, икариина, ресвератрола, лейцина или HMB) могут иметь незначительное повышение теплового эффекта пищи или повышение теплового эффекта пищи, которое составляет меньше чем примерно 0, 5 или 10%.
После 2-недельного периода введения композиция, содержащая (a) определенный уровень дозы ингибитора PDE, например, ингибитора PDE5, и определенный уровень дозы HMB или (b) определенный уровень дозы ингибитора PDE, например, ингибитора PDE5, и определенный уровень дозы лейцина (например, свободного лейцина), может повышать общий расход энергии у одного или нескольких субъектов по меньшей мере примерно на 10, 15, 17 или 20%. p-значения может быть меньше 0,05 (например, меньше чем примерно 0,05, 0,03, 0,02, 0,01, 0,001, 0,0001 или меньше). Повышение общего расхода энергии может быть длительным, пока субъектам вводят композицию, или в течение периода, составляющего по меньшей мере 2, 4, 6, 10, 13, 26 или 52 недели. Один или несколько субъектов, подвергаемых лечению с использованием одного и того же уровня дозы одного из компонентов (силденафила, икариина, ресвератрола, лейцина или HMB), могут иметь незначительное повышение общего расхода энергии или повышение общего расхода энергии, которое составляет меньше чем примерно 0, 5 или 10%.
Введение субъекту композиции, описанной в настоящей публикации, такой как комбинированная композиция, может обеспечивать возможность регуляции или поддержания энергетического обмена субъекта. Регуляция или поддержание энергетического обмена может позволять субъекту получить ряд полезных эффектов. Такие полезные эффекты включают снижение массы, уменьшение жировой ткани, повышение окисления жирных кислот, повышение образования бурого жира в жировой ткани (которое показано на основании одного или нескольких показателей образования бурых жировых клеток), повышение чувствительности к инсулину, снижение окислительного стресса и/или снижение воспаления. По сравнению с исходным уровнем до лечения такие эффекты могут приводить к улучшению примерно или больше чем примерно на 5%, 10%, 15%, 20%, 30%, 40%, 50%, 75% или больше. В некоторых вариантах по сравнению с исходным уровнем до лечения такие эффекты могут приводить к улучшению примерно или больше чем примерно на 100%, 125%, 150%, 200%, 250%, 300%, 400%, 500% или больше. Альтернативно, введение композиции, описанной в настоящей публикации, может обеспечить возможность поддержания массы субъекта, количества жировой ткани, количественного уровня окисления жирных кислот, уровня чувствительности к инсулину, уровня окислительного стресса и/или уровня воспаления. Такие количества и/или уровни могут поддерживаться в пределах примерно 0%, 1%, 5% или 10% от количеств и/или уровней в начале введения.
Изобретение относится к способу лечения субъектов, включающему в себя идентификацию пула субъектов, подлежащих лечению. Стадия идентификации может включать в себя один или несколько скрининговых тестов или анализов. Например, субъекты, которые были идентифицированы как имеющие диабет, как имеющие резистентность к инсулину, или которые имеют индексы массы тела и/или массу выше средних или значительно выше средних значений, могут быть отобраны для лечения. Стадия идентификации может включать в себя генетический тест, который выявляет один или несколько генетических вариантов, которые свидетельствуют о том, что субъект подлежит лечению. Идентифицированные субъекты затем могут быть подвергнуты лечению одной или несколькими композициями, описанными в настоящей публикации. В одном варианте изобретение относится к способу регулирования энергетического обмена, включающему в себя: (a) идентификацию субъекта, имеющего или склонного к ожирению или диабету; и (b) введение субъекту композиции, описанной в настоящей публикации, например, любой композиции по пп. 1-29. Например, их можно лечить комбинированной композицией, содержащей избирательный ингибитор PDE, такой как ингибитор PDE5, и аминокислоту с разветвленной цепью.
Изобретение также относится к способам производства композиций, описанных в настоящей публикации. В некоторых вариантах производство композиции, описанной в настоящей публикации, включает в себя смешивание или объединение двух или более компонентов. Такие компоненты могут включать избирательный ингибитор PDE, включая, но без ограничения, ингибитор PDE5, в сочетании с лейцином (например, свободным лейцином) и/или метаболитами лейцина. Кроме того, композиция может содержать дополнительно активатор сиртуина или пути AMPK (такой как полифенол или предшественник полифенола, подобный ресвератролу, хлорогеновой кислоте, кофеиновой кислоте, коричной кислоте, феруловой кислоте, EGCG, пикеатаннолу или экстракту виноградных косточек, или другое средство, подобное хинной кислоте и фукоксантину. В некоторых вариантах активатором сиртуина является полифенол. В других вариантах активатором сиртуина является предшественник полифенола. Количество или соотношение компонентов может быть таким, которое описано в настоящей публикации.
В некоторых вариантах композиции можно сочетать или смешивать с другим фармацевтически активным средством, отличным от ингибитора PDE-5, носителем и/или эксципиентом. Примеры таких компонентов описаны в настоящей публикации. Объединенные композиции могут быть приготовлены в виде стандартной дозы, такой как таблетки, капсулы, гелевые капсулы, таблетки медленного высвобождения или тому подобные.
В некоторых вариантах композицию готовят, так что получают твердую композицию, содержащую по существу гомогенную смесь одного или нескольких компонентов, так что один или несколько компонентов равномерно распределены по всей композиции, так что композиция может быть легко разделена на эквивалентно эффективные стандартные дозированные формы, такие как таблетки, пилюли и капсулы.
Наборы
Изобретение также относится к наборам. Наборы включают в себя одну или несколько композиций, описанных в настоящей публикации, в подходящей упаковке и письменный материал, который может содержать инструкции по применению, обсуждение клинических исследований, перечисление побочных эффектов и тому подобное. Такие наборы также могут содержать такую информацию, как ссылки на научную литературу, материалы в виде вкладышей в упаковку, результаты клинических испытаний и/или перечень указанного и тому подобное, в которых показаны или определены активности и/или преимущества композиции и/или в которых описаны дозы, введение, побочные эффекты, взаимодействия лекарственных средств или другая информация, полезная для медицинского работника. Такая информация может быть основана на результатах различных исследований, например, исследований с использованием экспериментальных животных, включенных в модели in vivo, и исследований, основанных на клинических испытаниях на человеке. Набор дополнительно может содержать другое средство. В некоторых вариантах соединение согласно настоящему изобретению и средство представлены в виде отдельных композиций в отдельных емкостях в наборе. В некоторых вариантах соединение согласно настоящему изобретению и средство представлены в виде одной композиции в одной емкости в наборе. Подходящая упаковка и дополнительные изделия для применения (например, мерный стаканчик для жидких препаратов, обертка из фольги для того, чтобы минимизировать воздействие воздуха и тому подобное) известны в данной области и могут быть включены в набор. Наборы, описанные в настоящей публикации, могут быть получены, куплены и/или внедрены медицинскими работниками, включая лечащих врачей, медсестер, фармацевтов, составителей рецептур и тому подобных. В некоторых вариантах наборы также могут быть проданы непосредственно потребителю.
В некоторых вариантах набор может содержать запас стандартных доз, рассчитанный на много дней. Стандартные дозы могут представлять собой любую стандартную дозу, описанную в настоящей публикации. Набор может содержать инструкции по введению рассчитанного на много дней запаса стандартных доз в течение многодневного периода. Рассчитанный на много дней запас может представлять собой запас на один месяц, запас на 30 дней или запас на несколько недель. Запас, рассчитанный на много дней, может представлять собой запас на 90 дней, 180 дней, 3 месяца или 6 месяцев. Набор может содержать упакованные суточные стандартные дозы, такие как упаковки, содержащие 1, 2, 3, 4 или 5 стандартных доз. Набор может быть упакован вместе с другими пищевыми добавками, витаминами и заменителями пищи в виде батончиков, смесями и напитками.
В некоторых вариантах набор может дополнительно содержать переносное устройство, контролирующее активность. Переносное устройство, контролирующее активность, может контролировать физическую и/или амбулаторную активность в качестве шагомера или измерителя ускорения. Примеры переносных устройств, контролирующих активность, включают, например, наряду с прочими: Fitbit®, Jawbone UP®, LarkLife™, Nike FuelBand, Striiv Play, BodyMedia FitCore. Такие переносные устройства, контролирующие активность, описаны в патентах США №: 8403845, 8398546, 8382590, 8369936, 8275635, 8157731, 8073707, 7959567, 7689437, 7502643, 7285090, 7261690, 7153262, 7020508, 6605038, 6595929, 6527711, 8562489, 8517896, 8469862, 8408436, 8370549, 8088044, 8088043 и в заявках на выдачу патента США № 20130158369 и 20130151196, которые включены в настоящее описание в виде ссылки. Такие наборы могут дополнительно содержать инструкции для субъекта о том, как применять схему физической активности, в дополнение к инструкциям по применению композиции. Такие наборы могут дополнительно содержать инструкции по применению переносных устройств, контролирующих активность. Такие наборы также могут содержать вспомогательное оборудование для устройства, контролирующего активность, такое как, например, зарядное устройство и/или порт или беспроводной передатчик для передачи данных от устройства, контролирующего активность, в компьютер или на сервер.
ПРИМЕРЫ
ПРИМЕР 1 - Ингибиторы PDE 1 для регуляции энергетического обмена
Винпоцетин, который является ингибитором PDE 1, тестировали в сочетании с лейцином, HMB и ресвератролом в отношении его влияния на энергетический обмен. Зависимость доза-ответ показывает, что концентрации винпоцетина 0,1 нМ или ниже не оказывают влияния; соответственно, такую концентрацию использовали в данных экспериментах. Винпоцетин не проявлял синергии ни с лейцином (0,5 мМ), ни с HMB (5 мкМ) ни в отношении окисления жира, ни в отношении утилизации глюкозы, хотя он оказывал синергетическое действие с ресвератролом в низкой дозе (200 нМ), приводя к 70% повышению утилизации глюкозы в адипоцитах (p=0,03).
ПРИМЕР 2 - Ингибиторы PDE 3 для регуляции энергетического обмена
Исследовали два ингибитора PDE 3, амринон и цилостамид, в сочетании с лейцином и HMB в отношении их влияния на энергетический обмен. Зависимость доза-ответ показывает, что концентрации 10 нМ или ниже обоих ингибиторов PDE 3 не оказывали влияния; соответственно, такую концентрацию ингибиторов PDE 3 использовали в данных экспериментах. Амринон не проявлял значимой синергии ни с лейцином, ни с HMB. Однако сочетание либо лейцина (0,5 мМ), либо HMB (5 мкМ) с цилостамидом приводило к 92% повышению окисления жира (p<0,05) в мышечных клетках и 58% повышению в адипоцитах (p<0,05). Цилостамид-HMB, смешанные в синергетически действующих количествах, повышали утилизацию глюкозы на 202% в мышечных клетках (p=0,024) и на 83% в адипоцитах (p=0,05), тогда как смешанные цилостамид-лейцин не оказывали влияния.
ПРИМЕР 3 - Ингибиторы PDE 4 для регуляции энергетического обмена
Исследовали два ингибитора PDE 4, ролипрам и YM796, в сочетании с лейцином и HMB в отношении их влияния на энергетический обмен. Зависимость доза-ответ показывает, что концентрации 0,1 нМ или ниже ролипрама и YM796 не оказывали влияния; соответственно, такую концентрацию использовали в данных экспериментах. Не было синергетического эффекта ролипрама с лейцином, HMB или ресвератролом в отношении окисления жира, утилизации глюкозы или активности AMPK в мышечных клетках; хотя ролипрам активировал фосфорилирование AMPK, такой эффект не возрастал ни в присутствии лейцина, ни в присутствии HMB. Однако синергия в отношении окисления жира была очевидной в адипоцитах со 125% повышением окисления жира в ответ на сочетание ролипрам-лейцин (p=0,026) и 63% повышением в ответ на сочетание ролипрам-HMB. Однако синергии не было обнаружено в отношении утилизации глюкозы или активации AMPK.
ПРИМЕР 4 - Ингибиторы PDE 5 для регуляции энергетического обмена
Клетки обрабатывали сочетаниями силденафила (1 нМ), икариина (1 нМ), лейцина (0,5 мМ), HMB (5 мкМ) и ресвератрола (200 нМ). Обработка 0,5 мМ лейцина соответствует циркулирующему уровню такой же молярности, достигаемого при введении человеку с пищей примерно 1,125 мг лейцина. Обработка 0,25 мМ лейцином соответствует циркулирующему уровню такой же молярности, достигаемому при введении человеку с пищей примерно 300 мг лейцина. Обработка 1 нМ силденафилом соответствует циркулирующему уровню такой же молярности, достигаемому при введении человеку с пищей примерно 0,2 мг силденафила. Обработка 1 нМ силденафила соответствует циркулирующему уровню такой же молярности, достигаемому при введении человеку с пищей примерно 0,1 мг силденафила.
Кривые доза-ответ для силденафила показывают, что концентрации ниже 1 нМ не оказывают влияния; соответственно, такую концентрацию использовали в экспериментах по оценке синергии. Примерно 1% пиковая концентрация в плазме (~100 нМ) достигается в ответ на низкую дозу лекарственного средства (20 мг). Обработка миотрубочек C2C12 силденафилом отдельно приводила к изменению окисления жирных кислот по сравнению с исходным уровнем примерно на 50%. Лечение лейцином отдельно стимулирует окисление жирных кислот до 73%, p<0,05. Силденафил в такой концентрации проявлял значимую синергию в стимуляции окисления жира в миотрубочках как с HMB (увеличение на 203%, p=0,003), так и с лейцином (увеличение на 232%, p=0,015), но не взаимодействовал с ресвератролом в мышечных клетках (фигура 2 и фигура 3).
В адипоцитах 3T3-L1 обработка лейцином повышает окисление жирных кислот до 27%, p<0,05, и обработка HMB стимулирует окисление жирных кислот до 29%, p<0,05. Как в случае клеток C2C12, силденафил-лейцин и силденафил-HMB синергетически повышали окисление жира в адипоцитах на 137% и 240%, соответственно (p<0,05; фигура 4). Добавление ресвератрола (200 нМ) либо к сочетанию силденафил-лейцин, либо к сочетанию силденафил-HMB не оказывало дополнительного влияния и значимо не отличалось от таких смесей в отсутствие ресвератрола.
Силденафил также проявлял синергию с лейцином и HMB в стимуляции утилизации глюкозы, как в миотрубочках, так и в адипоцитах. Обработка миотрубочек C2C12 лейцином отдельно повышала утилизацию глюкозы до 9,3%. Силденафил-лейцин и силденафил-HMB синергетически повышали утилизацию глюкозы в миотрубочках на 53 и 66%, соответственно (p=0,04, фигура 5), и силденафил также проявлял синергию с ресвератролом, давая сходно повышение (53%, p=0,04). Обработка лейцином стимулирует утилизацию глюкозы в клетках 3T3-L1 до 48,6%, p<0,05. В адипоцитах 3T3-L1 силденафил-лейцин повышал утилизацию глюкозы на 285% (p=0,05, фигура 6), при этом ни HMB, ни ресвератрол не проявляли никакой значимой синергии с силденафилом.
Икариин является встречающимся в природе флавонолом со значительной активностью, ингибирующей PDE 5. Кривые доза-ответ показывают, что концентрации икариина ниже 1 нМ не оказывают влияния; соответственно, такую концентрацию использовали в экспериментах по оценке синергии. Обработка миотрубочек C2C12 лейцином отдельно стимулирует окисление жирных кислот до 73%, p<0,05. Икариин в такой концентрации проявлял значимую синергию в стимуляции окисления жира в миотрубочках C2C12 как с HMB (повышение на 75%), так и с лейцином (повышение 77%) (p=0,03, фигура 7 и фигура 8), в то время как ресвератрол давал независимый синергетический эффект (повышение на 157%, p=0,002, фигура 8). Сходные данные получали в адипоцитах (p<0,05; фигура 9); однако икариин не давал значимой синергии в отношении утилизации глюкозы.
Имели место значимые синергетические взаимодействия обоих средств, силденафила и икариина, с лейцином, HMB, ресвератролом и их сочетаниями в отношении продукции оксида азота. На фигуре 10 показано взаимодействие между силденафилом и лейцином, HMB и ресвератролом, и на фигуре 11 показано взаимодействие между икариином и лейцином, HMB и ресвератролом. Каждое из средств, лейцин, HMB и ресвератрол, взаимодействовали с силденафилом в низкой дозе (1 нМ), приводя к небольшому значимому повышению продукции оксида азота (повышение на 15-30%, p<0,0001), тогда как сочетание силденафила, лейцина и ресвератрола приводило к более сильному ответу (повышение на 52%, p=0,0003 по сравнению со всеми другими обработками, фигура 10). Сходные эффекты были отмечены в случае икариина, лейцина, HMB и ресвератрола, при этом каждый из них взаимодействовал, вызывая небольшие значимые эффекты (p<0,0001), при этом более сильный эффект был обнаружен с сочетанием силденафила, лейцина и ресвератрола (фигура 11; p=0,00013).
Было показано, что оксид азота регулирует PGC1 и таким образом стимулирует митохондриальный биогенез; соответственно, авторы оценивали эффекты сочетаний силденафила и икариина с лейцином, HMB и ресвератролом на митохондриальный биогенез, который измеряли по митохондриальной биомассе. Клетки C2C12, обработанные лейцином отдельно, имели митохондриальную биомассу 22,05 +/- 0,4 условных единиц флуоресценции/мкг белка, p<0,05. Фигура 12 демонстрирует значимую синергию между силденафилом (1 нМ) и либо лейцином, либо HMB, так как и лейцин-силденафил и лейцин-HMB стимулировали значимые увеличения митохондриальной биомассы (p<0,01), тогда как не было значимого эффекта ресвератрола на такое взаимодействие. Подобным образом, икариин проявлял значимую синергию как с лейцином, так и с HMB, приводя к повышающей регуляции митохондриального биогенеза (p<0,001), тогда как ресвератрол не проявлял значимого взаимодействия (фигура 13).
Наблюдаемая синергия между лейцином/HMB и силденафилом в повышении окислительного метаболизма не является очевидной, так как недавнее сообщение свидетельствует о том, что близко родственный представитель такого класса лекарственных средств, тадалафил (торговое название сиалис) подавляет аэробный метаболизм в такой же клеточной системе (миотрубочки C2C12). Однако хроническое (12-недельное) введение силденафила приводило к повышенному расходу энергии, пониженной прибавке массы и жира и повышенной чувствительности к инсулину, хотя острое введение не давало эффекта. Полученные авторами данные свидетельствуют, что сочетание значимо более низких концентраций, чем концентрации, используемые для лечения эректильной дисфункции, либо с лейцином, либо с HMB, может быть полезной терапевтической методикой лечения диабета. В качестве альтернативы силденафилу икариин является встречающимся в природе флавонолом, найденным в растениях семейства Epimedium (горянки крупноцветковая), который также обладает активностью, ингибирующей PDE5, и оказывает сходное влияние.
ПРИМЕР 5 - Влияние in vivo ингибиторов PDE5 на гликемию и чувствительность к инсулину
Интерактивные эффекты икариина, флаванола со свойствами специфичного ингибирования PDE5, на гликемию и чувствительность к инсулину оценивали у мышей с индуцированным питанием ожирением, которых можно использовать в качестве мышиной модели диабета типа 2.
Способы
Самцов мышей C57/BL6 помещали на стандартный корм с низким содержанием жира (контроль; 10% энергии за счет жира) или с высоким содержанием жира (60% энергии за счет жира, Research Diets №D 12492, Research Diets, Inc, New Brunswick, NJ) в шестинедельном возрасте, чтобы индуцировать резистентность к инсулину. У мышей на корме с высоким содержанием жира наблюдали нарушенную толерантность к глюкозе после 6 недель воздействия по сравнению с мышами на корме с низким содержанием жира (смотри фигуру 14).
Затем животных рандомизированно распределяли на группы с указанным ниже кормлением еще в течение шести недель, по 10 животных на группу: контроль на корме с низким содержанием жира (LFD); контроль на корме с высоким содержанием жира (HFD); HFD+лейцин (24 г/кг корма, двукратное повышение по сравнению с контрольными уровнями); HFD+лейцин (24 г/кг корма) + икариин (25 мг/кг корма). Ранее опубликованные исследования икариина не выявили эффекта выбранного уровня (25 мг/кг корма; ~4 мг/кг массы тела).
Мыши голодали в течение ночи (~16 часов) перед измерением уровня глюкозы в крови натощак, толерантности к инсулину и глюкозе. Толерантность к глюкозе определяли после измерения уровня глюкозы натощак посредством внутрибрюшинного введения глюкозы (1,2 г/кг массы тела) с последующим измерением уровня глюкозы в крови во временных точках 15, 30, 60, 90 и 120 минут. Постпрандиальные уровни глюкозы измеряли в течение одного часа после прекращения приема пищи. Толерантность к инсулину измеряли, используя тест на толерантность к инсулину (ITT). Корм удаляли за 4-6 часов до ITT и измеряли исходный уровень глюкозы в крови. Затем мышам внутрибрюшинно инъецировали инсулин (1,2 единицы/кг массы тела) и измеряли уровень глюкозы в крови через 15, 30, 60, 90 и 120 минут после инъекции инсулина. Оценку гомеостатической модели инсулинорезистентности (HOMAIR) использовали в качестве скринингового показателя изменений чувствительности к инсулину. HOMAIR вычисляют по стандартной формуле на основании уровня инсулина и глюкозы в плазме натощак следующим образом: HOMAIR = [инсулин (микроединиц/мл)×глюкоза (мМ)]/22,5. Концентрации глюкозы и инсулина в плазме измеряли, используя набор для анализа глюкозы Biovision (Milpitas, CA) и набор для анализа инсулина Millipore (Billerica, MA), соответственно. Уровни CRP в плазме определяли в ELISA (CRP: Life Diagnostics, West Chester, PA).
Данные анализировали, используя однофакторный дисперсионный анализ; при этом анализ ANOVA показал значимые различия, средние значения разделяли, используя критерий множественного сравнения Тьюки (Graphpad Prism, Version 6,0). p-значения меньше чем 0,05 обычно считали статистически значимыми.
Результаты
Постпрандиальный уровень глюкозы был заметно повышен в ответ на потребление корма с высоким содержанием жира к 7 дню обработки (фигура 15). Хотя лейцин не оказывал независимого влияния на уровень глюкозы, сочетание лейцина и икариина вызывало значимое снижение примерно на 10% постпрандиального уровня глюкозы после 7 дней обработки по сравнению с необработанными HFD-мышами (p<0,01 при сравнении с HFD, фигура 15). Величина такого эффекта возрастала через 14 дней примерно до 20%, так что обработка сочетанием лейцин-икариин HFD-мышей снижала постпрандиальные уровни глюкозы до уровней, встречающихся у мышей, которых содержат на корме с низким содержанием жира (p<0,001 при сравнении с HFD, фигура 16).
Постпрандиальные уровни инсулина или уровни циркулирующего инсулина измеряли во всех экспериментальных группах после 14 дневной обработки. У HFD-мышей наблюдали ~5-кратное повышение уровня циркулирующего инсулина по сравнению с LFD-мышами (фигура 17). Однако 14-дневная обработка HFD-мышей инсулином отдельно снижала циркулирующий уровень инсулин на ~30% по сравнению с необработанными HFD-мышами (фигура 17). 14-дневная обработка HFD-мышей лейцином и икариином дополнительно снижала уровни циркулирующего инсулина примерно на 50% по сравнению с необработанными HFD-мышами (p<0,01 при сравнении с HFD, фигура 17).
Чувствительность к инсулину измеряли используя оценку гомеостатической модели инсулинорезистентности (HOMAIR) во всех экспериментальных группах после 14-дневной обработки (HOMAIR = инсулин (микроединиц/мл)×глюкоза (мМ)/22,5). У HFD-мышей наблюдали 10-кратное повышение HOMAIR по сравнению с LFD-мышами (фигура 18). Однако 14-дневная обработка HFD-мышей инсулином отдельно снижала HOMAIR на ~40% по сравнению с необработанными HFD-мышами (p<0,001 по сравнению с HFD, фигура 18). 14-дневная обработка HFD-мышей лейцином и икариином дополнительно снижала уровни HOMAIR примерно на 65% по сравнению с необработанными HFD-мышами (p<0,001 при сравнении со всеми группами, фигура 18).
Чувствительность к инсулину измеряли, используя тест на толерантность к инсулину во всех экспериментальных группах после 28-дневной обработки. Как показано на фигуре 19, добавление лейцина и икариина к корму с высоким содержанием жира улучшало ответ на инсулин до уровня, который совпадал с уровнем, который обнаружен в случае корма с низким содержанием жира. Так как максимальное снижение уровня глюкозы в крови было обнаружено во временной точке 30 минут, статистический анализ выполняли в отношении изменения уровня глюкозы в крови в точке 30 минут (фигура 20). Анализ временной точки 30 минут в тесте оценки толерантности к инсулину показал, что клиренс глюкозы у HFD-мышей был снижен примерно на 50% по сравнению с LFD-мышами (фигура 20). Однако обработка HFD-мышей лейцином и икариином полностью восстанавливала клиренс глюкозы до уровней, найденных у LFD-мышей, двукратное изменение по сравнению с HFD-мышами, которых не обрабатывали лейцином и икариином (p<0,02 при сравнении с HFD, фигура 20). Такой анализ показал, что ослабленный ответ на инсулин, вызванный рационом с высоким содержанием жира, был полностью отменен в результате добавления сочетания лейцин-икариин.
Толерантность к глюкозе оценивали во всех экспериментальных группах после пятинедельной обработки. На фигуре 21 изображены результаты теста толерантности к глюкозе, измеренные после пяти недель после обработки, и показано значимое снижение ответа в виде уровня глюкозы в крови на провокационное введение глюкозы. Измерения площади под кривой (AUC) осуществляли на кривых концентраций глюкозы, показанных на фигуре 21, чтобы получить показатель интегрального ответа в виде уровня глюкозы на нагрузку глюкозой в течение определенного периода времени. AUC увеличивалась на ~75% по сравнению с LFD-мышами (p<0,01, фигура 22). Обработка HFD-мышей лейцином и икариином значимо снижала глюкозную нагрузку примерно на 40% по сравнению с необработанными HFD-мышами (p<0,01 при сравнении с HFD-мышами, фигура 22).
В конце 6-недельного исследования оценивали уровни глюкозы в крови натощак, уровни инсулина, HOMAIR, массу печени и циркулирующий C-реактивный белок (биомаркер воспаления) во всех экспериментальных группах (фигура 23-27). Оценка уровня глюкозы в крови натощак в конце 6-недельного исследования выявила, что у HFD-мышей наблюдается ~1-кратное увеличение уровня глюкозы натощак по сравнению с LFD-мышами (фигура 23). 6-недельная обработка HFD-мышей лейцином отдельно снижала уровень глюкозы натощак на ~20% по сравнению с необработанными HFD-мышами (фигура 23). 6-недельная обработка HFD-мышей лейцином + икариином снижала уровень глюкозы натощак примерно на 40% по сравнению с необработанными HFD-мышами (p=0,0014 при сравнении с HFD, фигура 23). Оценка уровней инсулина натощак в конце 6-недельного исследования показала, что у HFD-мышей наблюдается 8-кратное повышение уровня циркулирующего инсулина по сравнению с LFD-мышами (фигура 24). 6-недельная обработка HFD-мышей лейцином отдельно снижала уровень циркулирующего инсулина во время голодания на ~25% по сравнению с необработанными HFD-мышами (фигура 24). 6-недельная обработка HFD-мышей лейцином + икариином снижала уровень циркулирующего инсулина во время голодания примерно на 40% по сравнению с необработанными HFD-мышами (p<0,05 при сравнении с HFD, фигура 24). Оценка HOMAIR в конце 6-недельного исследования показала, что у HFD-мышей наблюдается ~10-кратное повышение уровня циркулирующего инсулина по сравнению с LFD-мышами (фигура 25). 6-недельная обработка HFD-мышей лейцином отдельно снижала HOMAIR на ~30% по сравнению с необработанными HFD-мышами (фигура 25). 6-недельная обработка HFD-мышей лейцином + икариином снижала HOMAIR примерно на 45% по сравнению с необработанными HFD-мышами (p<0,03 при сравнении с HFD, фигура 25). Полученные результаты показывают, что комбинированное введение разветвленной аминокислоты (например, свободного лейцина) и ингибитора PDE5 остается терапевтически эффективным против диабета в течение длительного периода без потери эффективности даже после 6 недель введения мышам. Учитывая среднюю продолжительность жизни лабораторных мышей по сравнению с продолжительностью жизни среднего человека, такая эффективность у мышей свидетельствует о том, что комбинированное введение разветвленной аминокислоты (например, свободного лейцина) и ингибитора PDE5 может оставаться терапевтически эффективным (например, против диабета) в течение четырех лет или больше.
Хроническое потребление пищи с высоким содержанием жира ассоциировано с другими вредными последствиями. Например, хроническое потребление пищи с высоким содержанием жира может увеличивать массу печени, вероятно в результате накопления жира в печени. Хроническое потребление пищи с высоким содержанием жира также ассоциировано с хроническим воспалением, которое может вносить вклад в ряд заболеваний. Чтобы определить влияние введения лейцина или лейцина + икариин на дополнительные последствиями потребления пищи с высоким содержанием жира, оценивали массу печени и уровень C-реактивного белка (биомаркера воспаления) во всех экспериментальных группах в конце 6-недельного исследования. Оценка массы печени в конце 6-недельного исследования показала, что у HFD-мышей наблюдается ~40% увеличение массы печени по сравнению с LFD-мышами (p=0,01, фигура 26). 6-недельная обработка HFD-мышей лейцином отдельно снижала массу печени на ~10% по сравнению с необработанными HFD-мышами (фигура 26). 6-недельная обработка HFD-мышей лейцином + икариином снижала массу печени примерно на 25% по сравнению с необработанными HFD-мышами (p<0,01 при сравнении с HFD, фигура 26). Оценка C-реактивного белка в конце 6-недельного исследования показала, что у HFD-мышей наблюдается ~30% увеличение массы печени по сравнению с LFD-мышами (фигура 27). 6-недельная обработка HFD-мышей лейцином + икариином снижала уровни C-реактивного белка примерно на 20% по сравнению с необработанными HFD-мышами (p<0,05 при сравнении с HFD, фигура 27).
Вместе взятые полученные данные демонстрируют значимое сильное улучшение уровня глюкозы натощак и постпрандиального уровня глюкозы, толерантности к глюкозе и чувствительности к инсулину в ответ на низкую дозу икариина в сочетании с лейцином. Такое улучшение сравнимо с улучшением при использовании антидиабетических фармацевтических средств в такой животной модели, что свидетельствует о терапевтическом потенциале такого сочетания. Кроме того, такое сочетание приводило к значимому улучшению массы печени и уровня биомаркера воспаления C-реактивного белка.
Следует понимать, исходя из приведенного выше, что хотя были проиллюстрирован и описаны конкретные воплощения изобретения, могут быть осуществлены различные модификации, которые предусмотрены в настоящем изобретении. Также не следует считать, что изобретение ограничено конкретными примерами, предлагаемыми в настоящем описании. Хотя изобретение было раскрыто со ссылкой на указанное выше описание, описание и иллюстрации предпочтительных вариантов, приведенные в настоящей публикации, не предполагается их использованием в ограничивающем смысле. Кроме того, следует понимать, что все аспекты изобретения не ограничены конкретными изображениями, конфигурации или относительными соотношениями, указанными в настоящей публикации, которые зависят от множества условий и переменных. Различные модификации формы и детали вариантов осуществления изобретения будут очевидны для специалиста в данной области. Поэтому предполагается, что изобретение должно охватывать любые такие модификации, изменения и эквиваленты.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ | 2012 |
|
RU2631597C2 |
| ЛЕЧЕНИЕ НАРУШЕНИЙ СО СТОРОНЫ ПЕЧЕНИ, ЖЕЛЧНЫХ ПУТЕЙ И ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2017 |
|
RU2740913C2 |
| СПОСОБЫ МОДУЛЯЦИИ КИШЕЧНОЙ МИКРОБИОТЫ | 2017 |
|
RU2738265C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ | 2016 |
|
RU2780758C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ AKKERMANSIA MUCINIPHILA И ЭКСТРАКТ ЗЕЛЕНОГО ЧАЯ | 2021 |
|
RU2829638C1 |
| КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ФОСФОДИЭСТЕРАЗЫ 5 И ЕЕ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2301259C2 |
| НОВЫЕ БЫСТРОДЕЙСТВУЮЩИЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СОЕДИНЕНИЯ, АКТИВНЫЕ ПРИ СЕКСУАЛЬНОЙ ДИСФУНКЦИИ, И ПОРОШОК КАКАО, И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2312665C2 |
| Способ лечения фиброза печени | 2017 |
|
RU2740902C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ УЛУЧШЕНИЯ ФУНКЦИИ МИТОХОНДРИЙ И ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ И КОГНИТИВНЫХ РАССТРОЙСТВ | 2011 |
|
RU2745439C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ УСИЛЕНИЯ ИЛИ ПОДДЕРЖАНИЯ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ | 2011 |
|
RU2606763C2 |
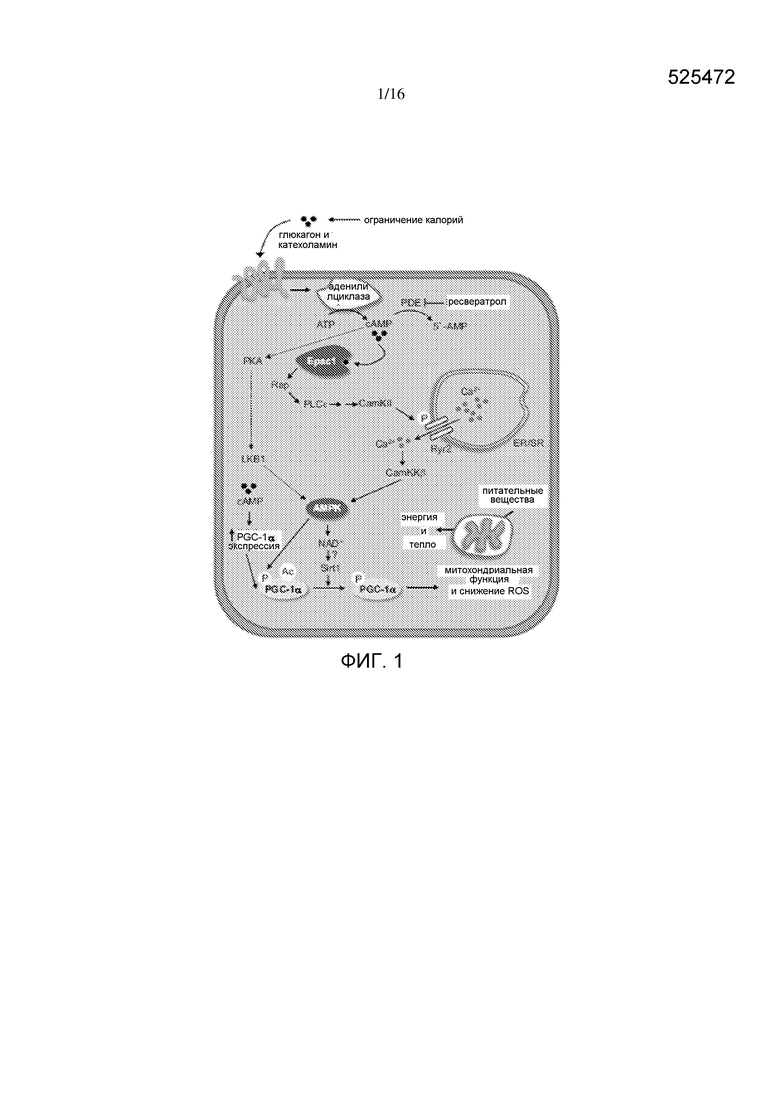
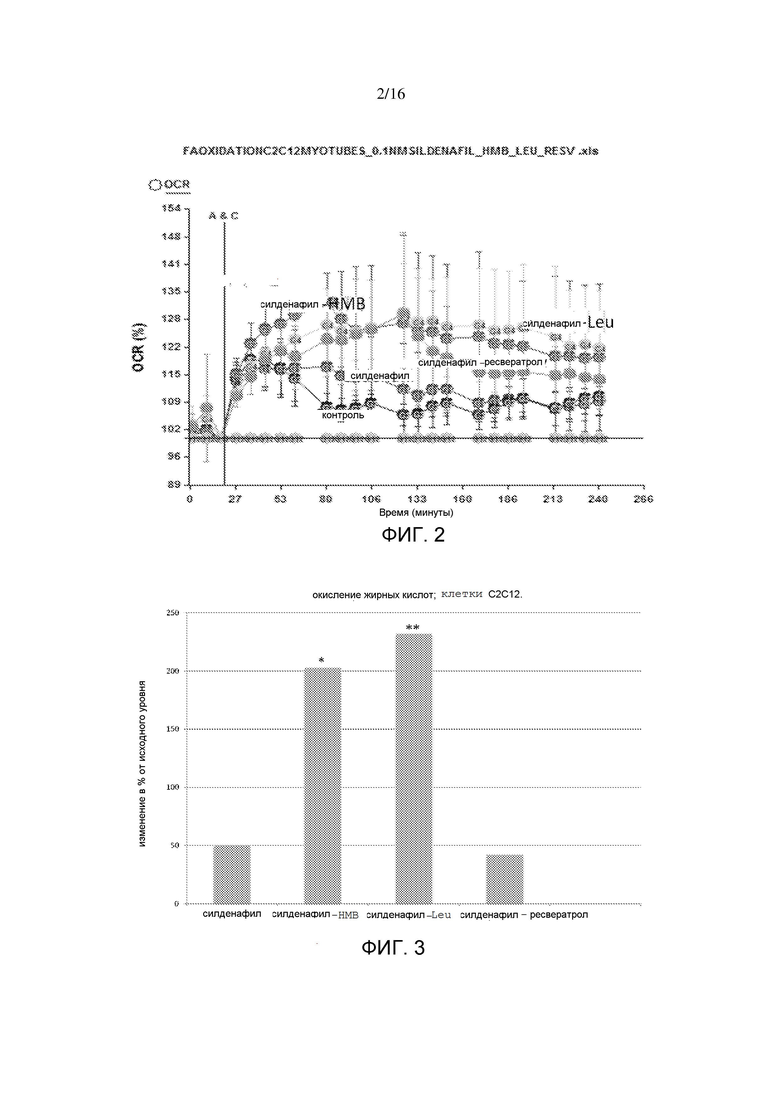
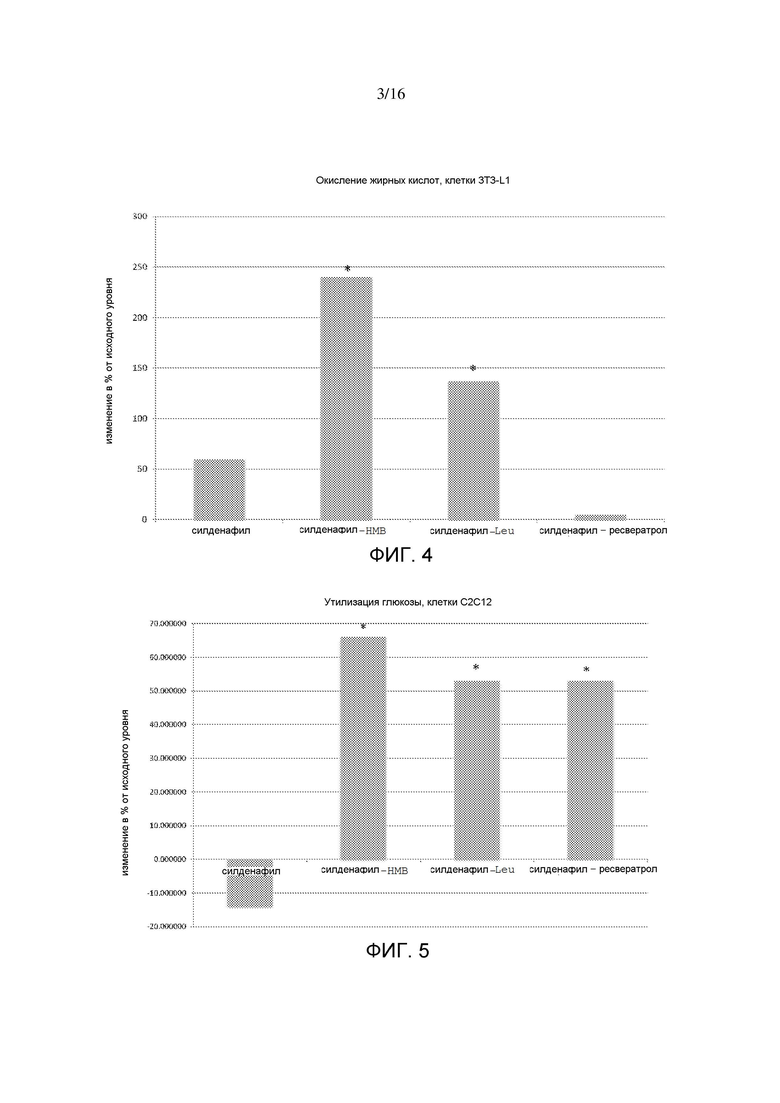
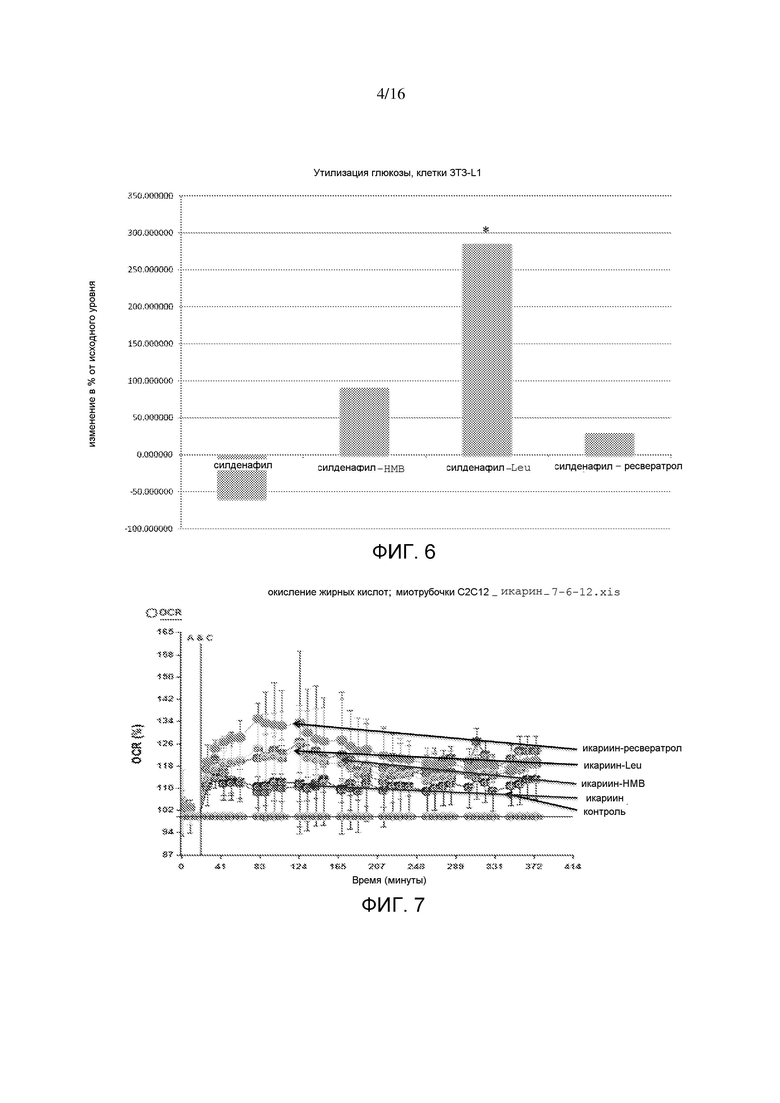
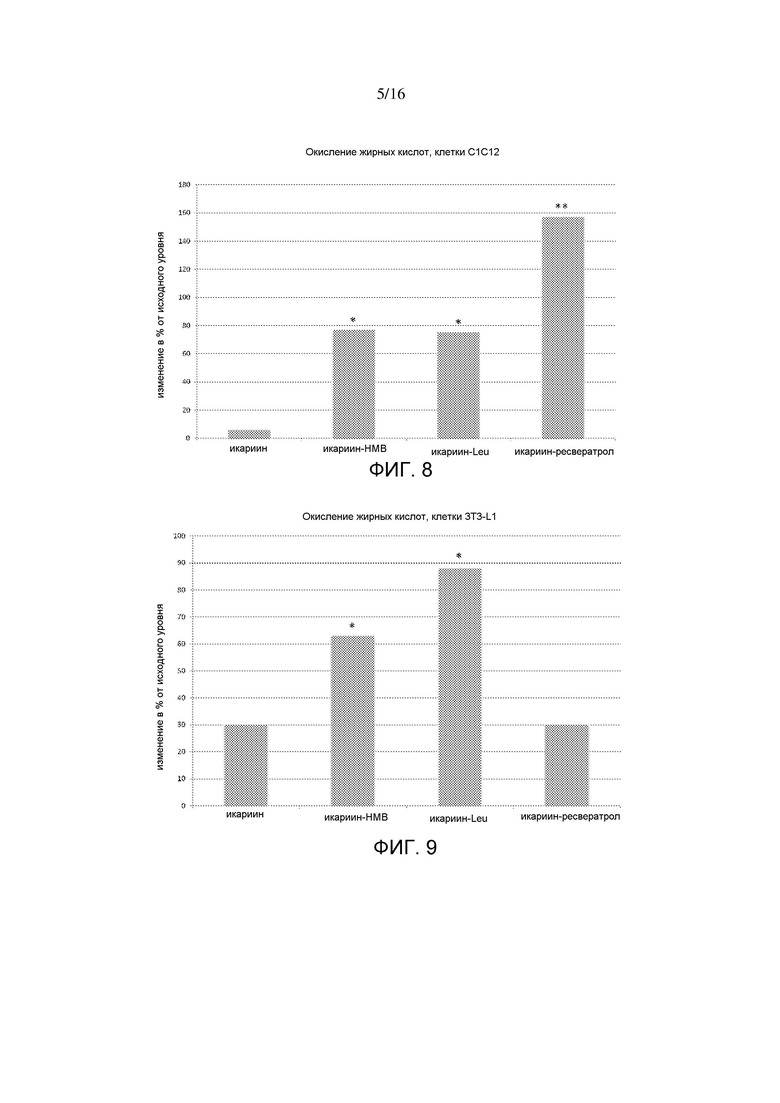
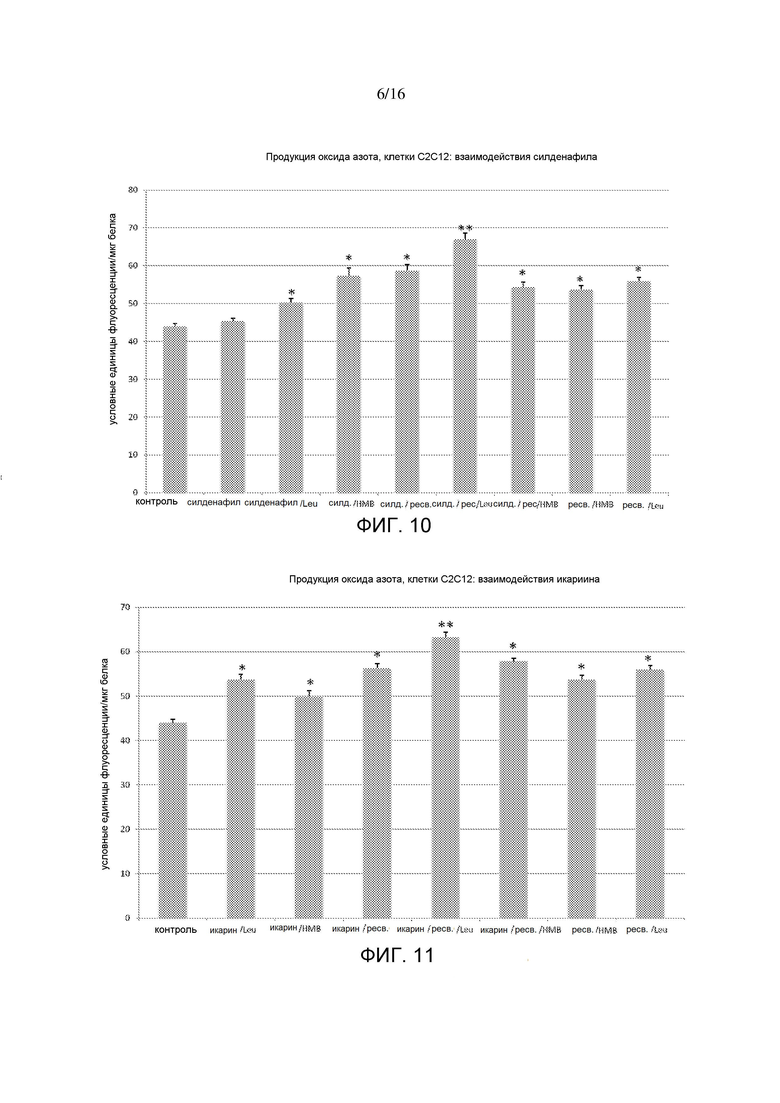
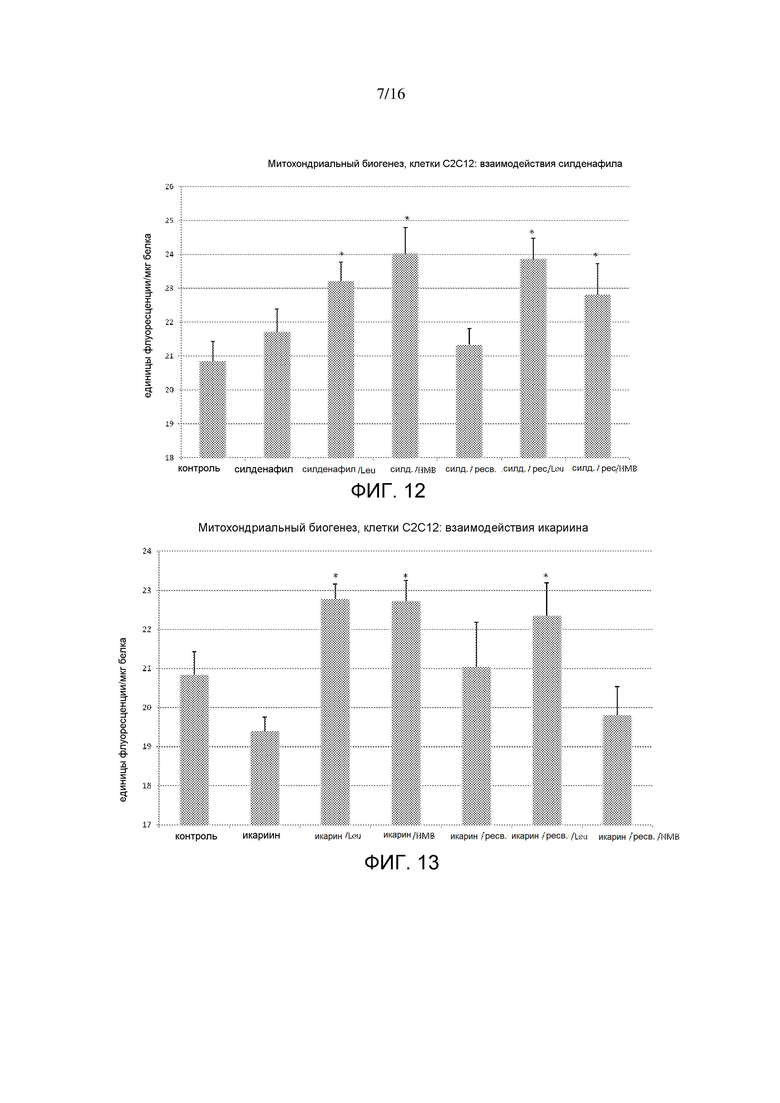
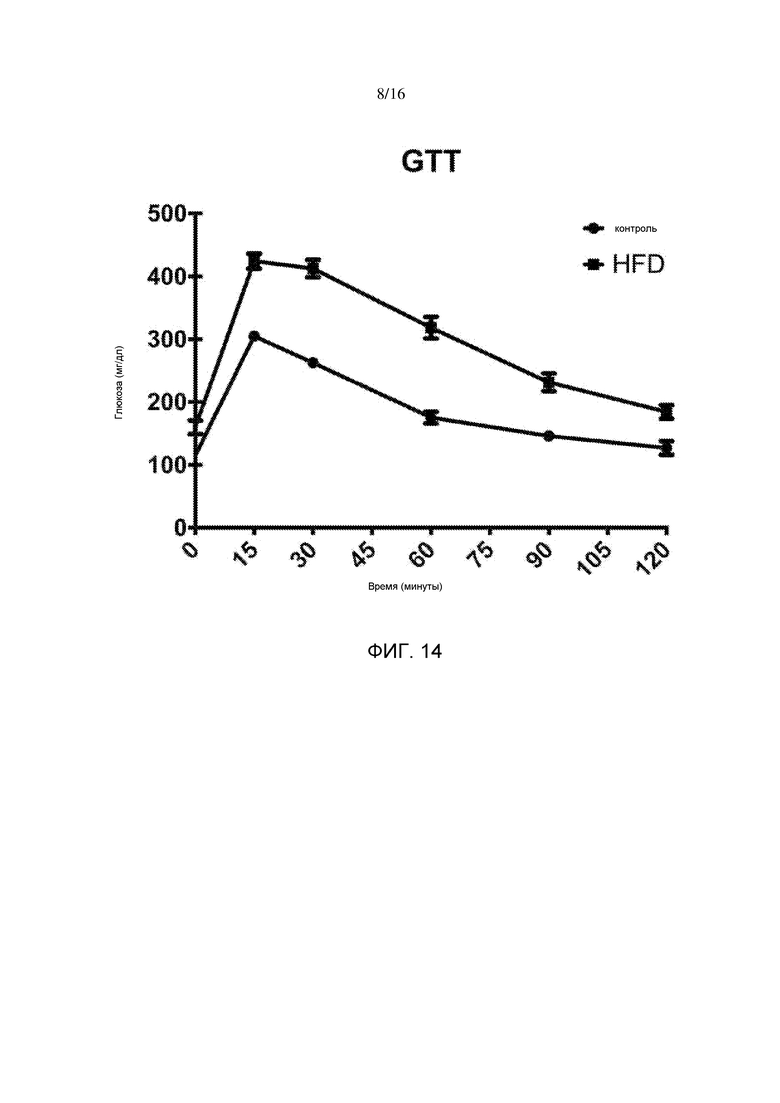
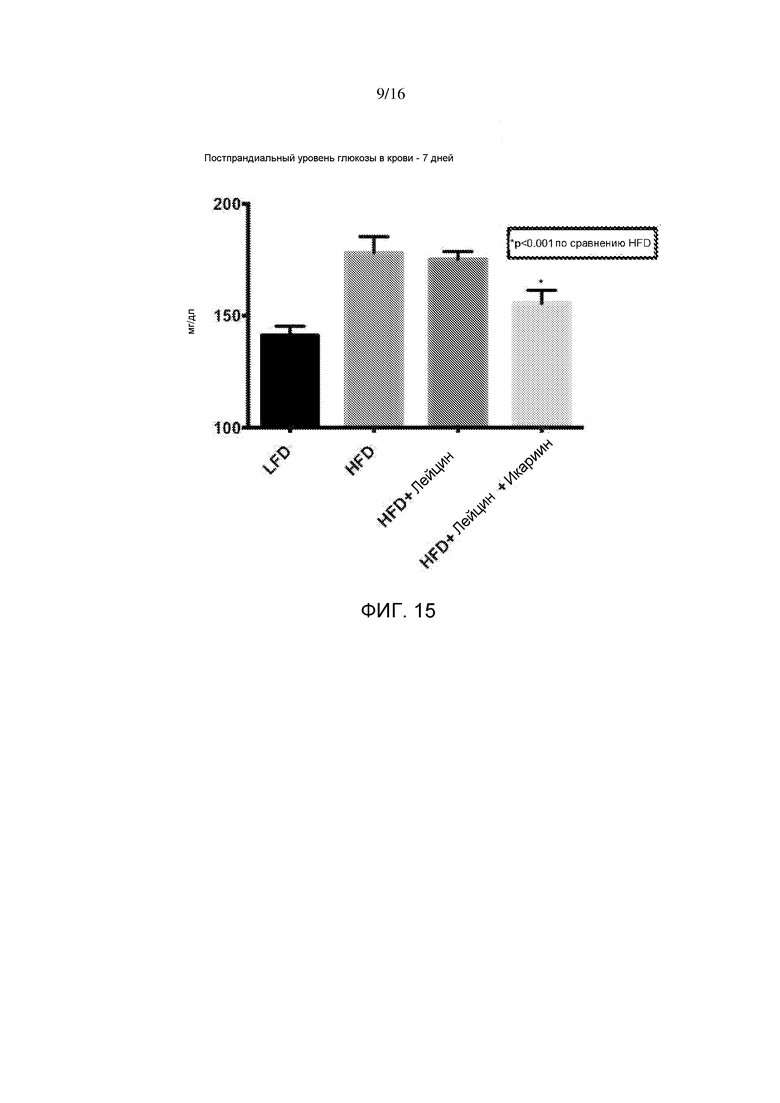
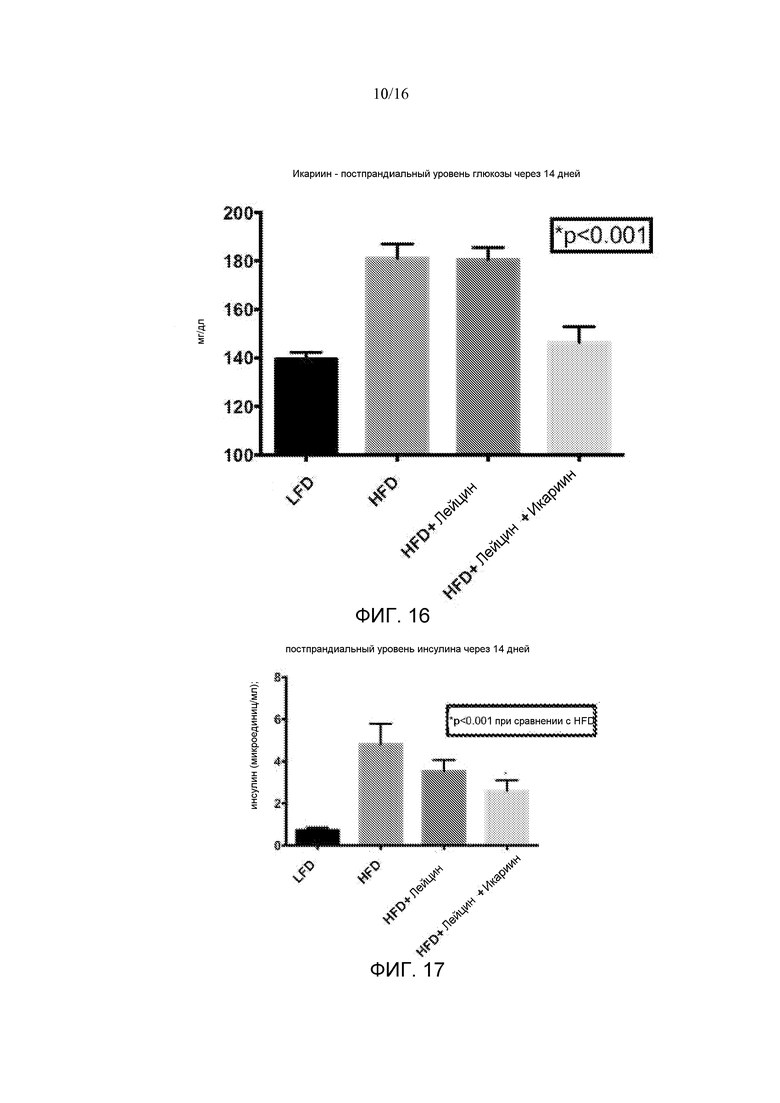
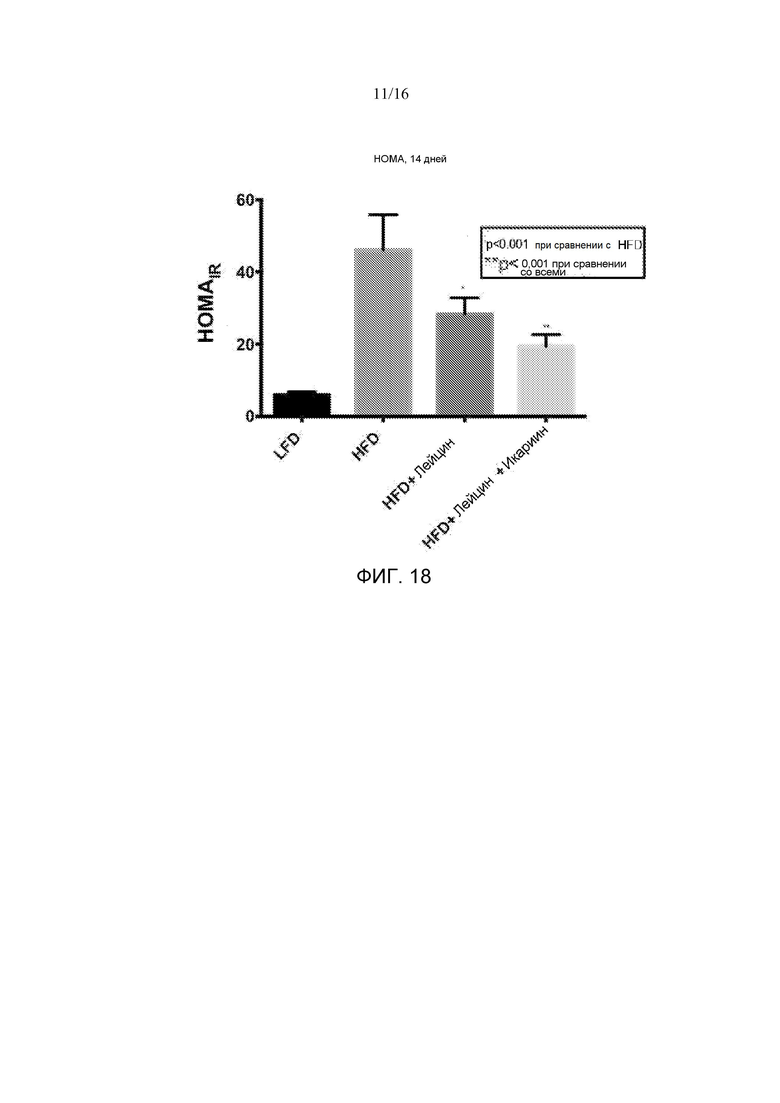
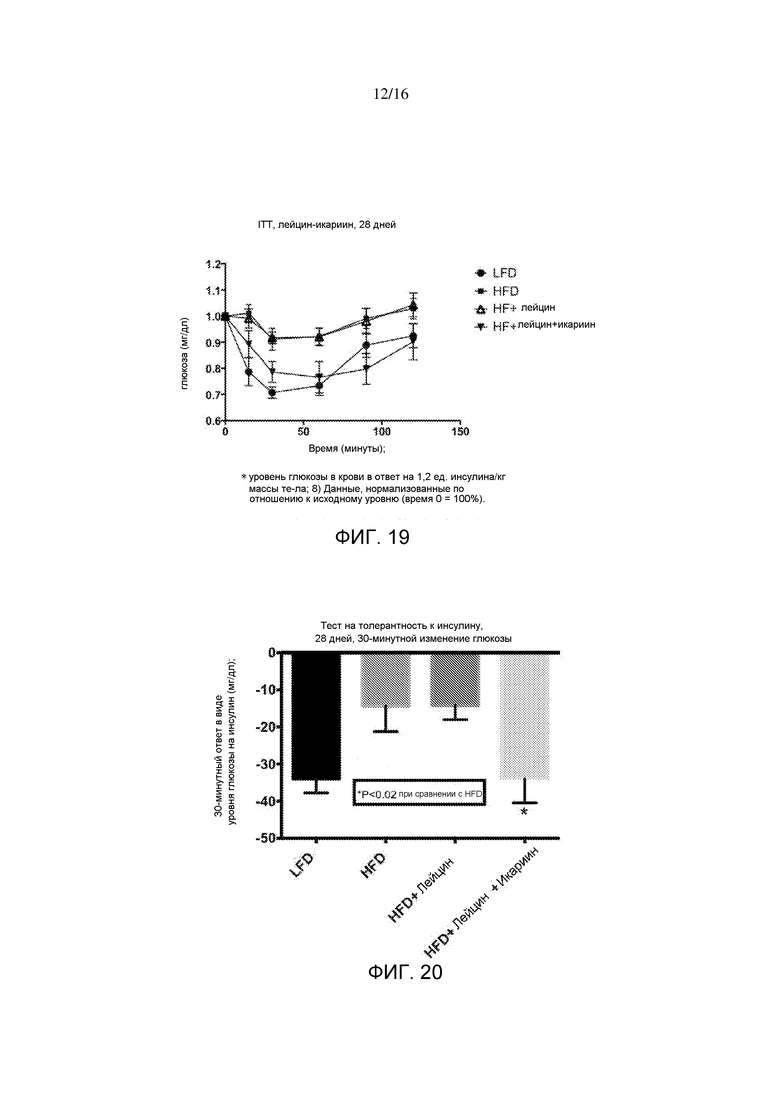
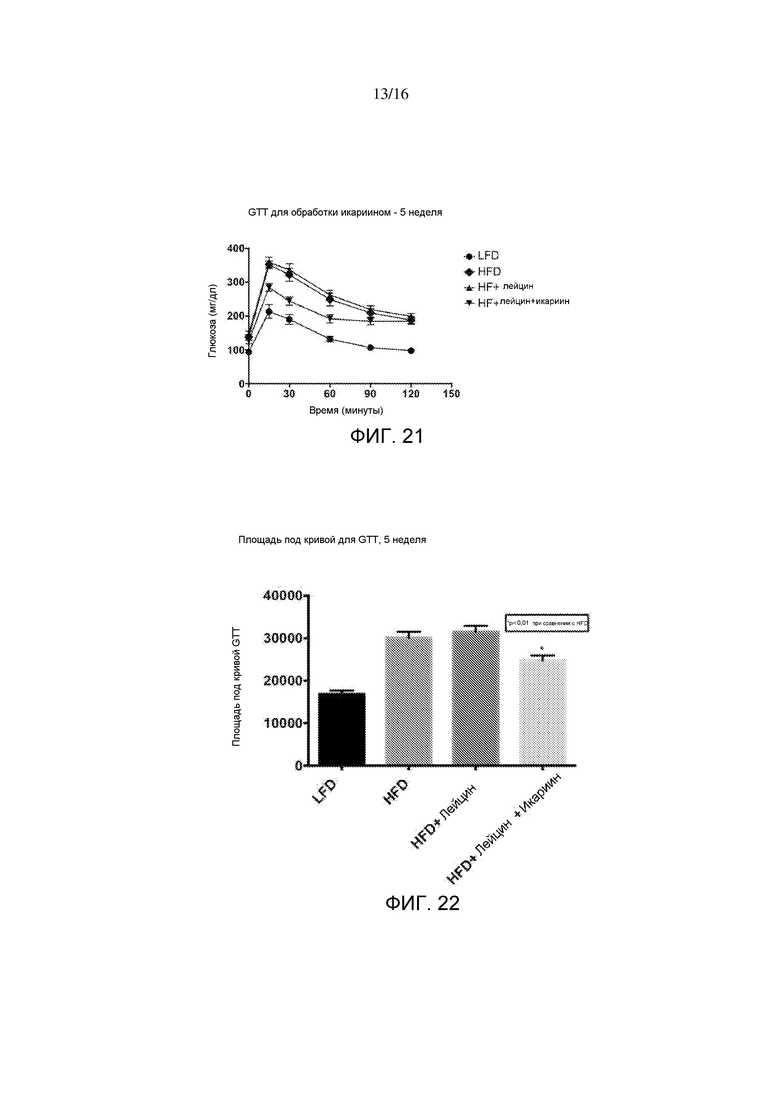
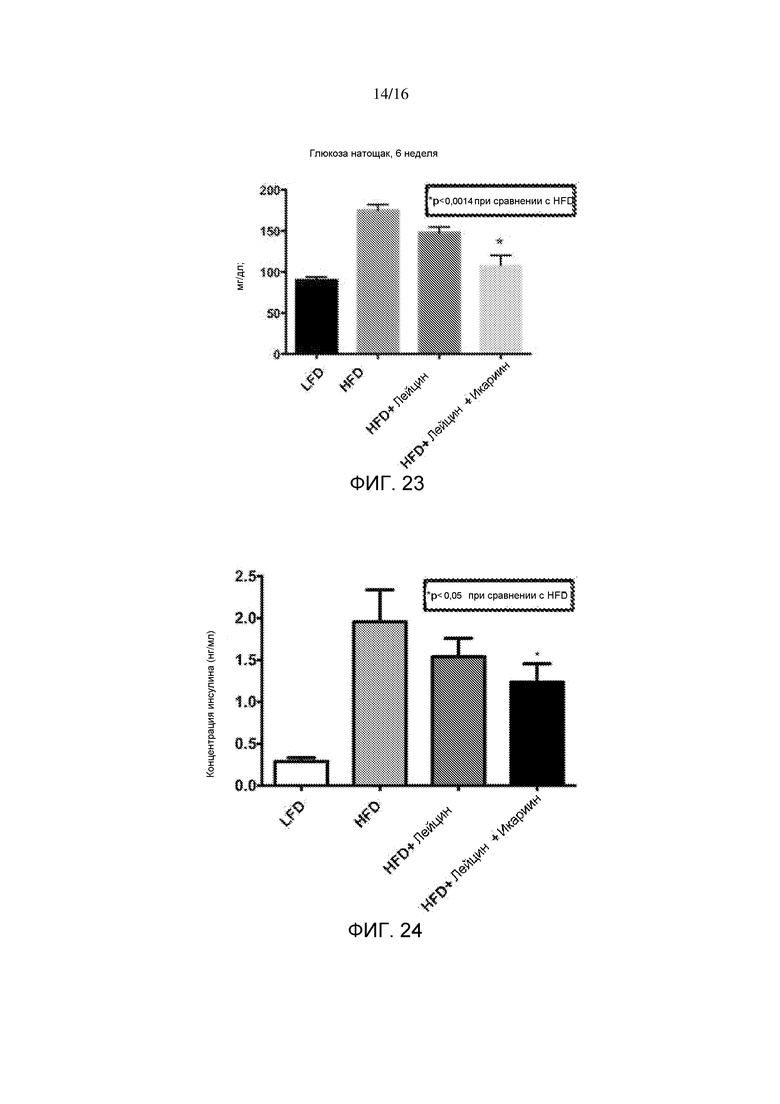
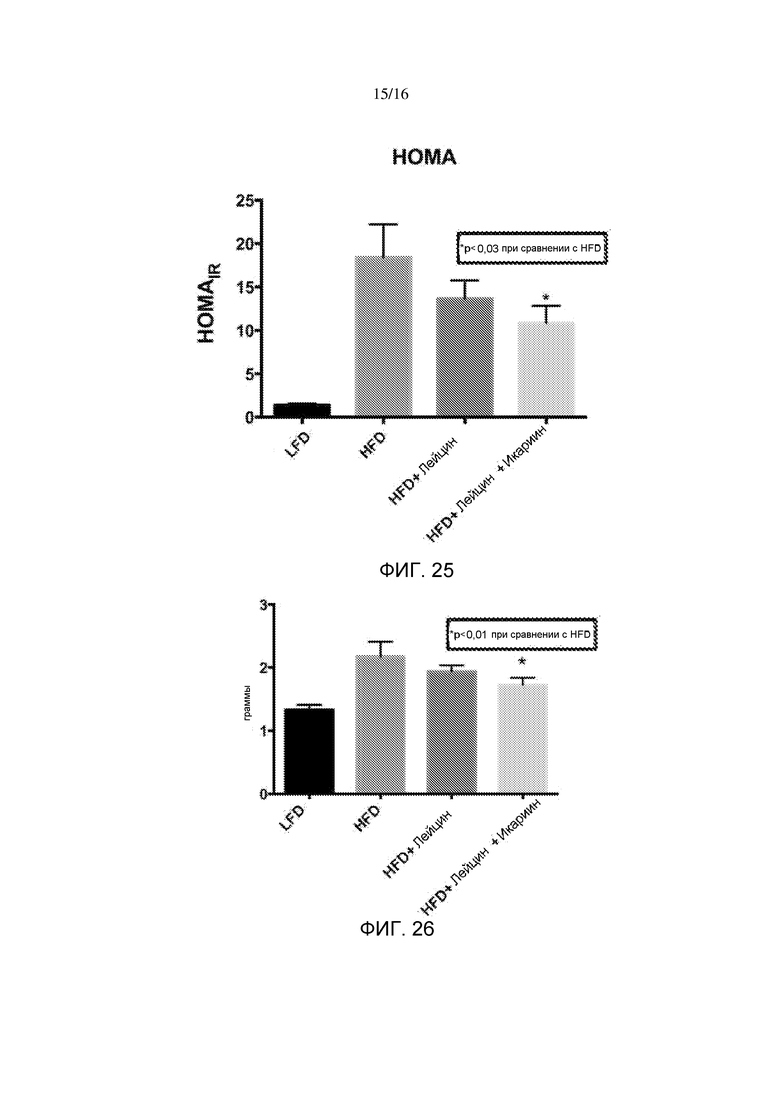
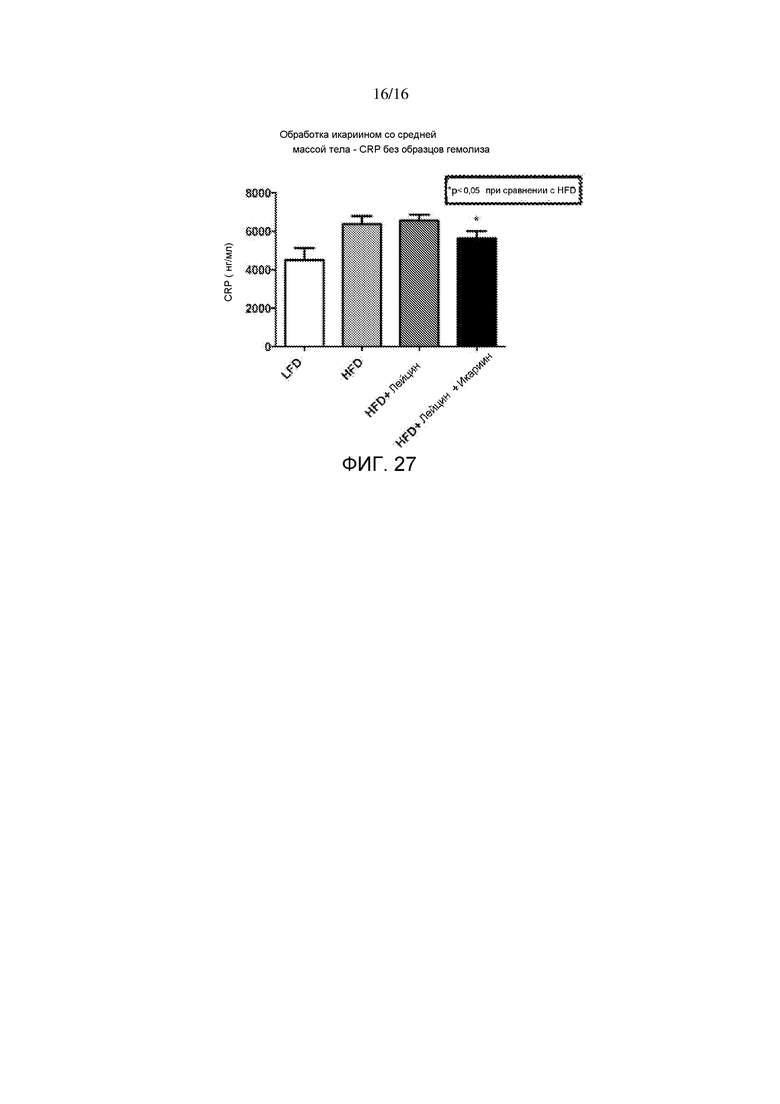
Изобретение относится к фармацевтической промышленности и представляет собой композицию, эффективную для усиления энергетического обмена, содержащую по меньшей мере 0,05 мг ингибитора фосфодиэстеразы 5 (PDE 5) и по меньшей мере 500 мг лейцина и/или по меньшей мере 200 мг метаболита лейцина, где ингибитор PDE 5 содержит силденафил и где указанный метаболит лейцина выбран из группы, состоящей из бета-гидроксиметилбутирата (HMB), кето-изокапроновой кислоты (KIC) и α-гидроксиизокапроновой кислоты. Изобретение обеспечивает эффективное усиление регулирования энергетического обмена, заключающегося в синергетическом увеличении окисления жирных кислот в адипоцитах и утилизации глюкозы. 23 з.п. ф-лы, 27 ил., 10 табл., 5 пр.
1. Композиция, эффективная для усиления энергетического обмена, содержащая:
a) по меньшей мере 0,05 мг ингибитора фосфодиэстеразы 5 (PDE 5); и
b) по меньшей мере 500 мг лейцина и/или по меньшей мере 200 мг метаболита лейцина,
где ингибитор PDE 5 содержит силденафил и
где указанный метаболит лейцина выбран из группы, состоящей из бета-гидроксиметилбутирата (HMB), кето-изокапроновой кислоты (KIC) и α-гидроксиизокапроновой кислоты.
2. Композиция по п.1, в которой определенное количество PDE 5 представляет собой субтерапевтическое количество.
3. Композиция по п.1, которая сформирована в виде единичной дозированной формы.
4. Композиция по п.1, в которой ингибитор PDE 5 содержит силденафил.
5. Композиция по п.3, где единичная дозированная форма содержит субтерапевтическое количество компонента (а), которое составляет от 0,1 до 20 мг силденафила.
6. Композиция по п.3, где единичная дозированная форма содержит субтерапевтическое количество компонента (а), которое составляет от 0,1 до 10 мг силденафила.
7. Композиция по п.2, в которой субтерапевтическое количество компонента (a) составляет 0,1-10 мг силденафила.
8. Композиция по п.1, в которой компонентом (b) является свободный лейцин.
9. Композиция по п.1, в которой компонент (b) содержит от 500 до 2000 мг свободного лейцина.
10. Композиция по п.1, в которой компонент (b) содержит по меньшей мере 200 мг метаболита лейцина, содержащего бета-гидроксиметилбутират (HMB).
11. Композиция по п.1, дополнительно содержащая антидиабетический агент.
12. Композиция по п.1, дополнительно содержащая субтерапевтическое количество антидиабетического агента.
13. Композиция по п.11, где антидиабетический агент представляет собой бигуанидин или тиазолидиндион.
14. Композиция по п.11, где антидиабетический агент представляет собой метформин или росиглитазон.
15. Композиция по п.11, где антидиабетический агент содержит по меньшей мере 25 мг метформина.
16. Композиция по п.1, дополнительно содержащая ресвератрол.
17. Композиция по п.11, где компонент (а) содержит 0,1-10 мг силденафила, компонент (b) содержит 500-2000 мг свободного лейцина и антидиабетический агент содержит по меньшей мере 250 мг метформина.
18. Композиция по п.1, дополнительно содержащая другое фармацевтически активное средство, отличное от ингибитора PDE 5.
19. Композиция по п.1, которая содержит менее чем 1% аминокислоты, выбранной из группы, состоящей из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина в форме свободной аминокислоты.
20. Композиция по п.1, которая содержит менее 1% изолейцина и валина.
21. Композиция по п.1, которая не содержит изолейцин и валин.
22. Композиция по п.1, которая содержит менее 1% аргинина.
23. Композиция по п.1, которая не содержит аргинин.
24. Композиция по п.1, которая сформирована в виде таблетки или капсулы.
| US 20120225139 А1, 06.09.2012 | |||
| US2004186046 A1, 23.09.2004 | |||
| Sung-Jun Park et all "Resveratrol Amelioration Aging-Related | |||
| Metabolic Phenotypes by Inhibiting cAMP Phosphodiesterases", Cell. | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Antje Bruckbauer et all "Synergistic effect of leucine and resveratrol | |||
| on insulin sensitivity and fat metabolism in adipocytes and mice" | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| US 8299083 B2, 30.10.2012 | |||
| US 7744930 B2, 29.06.2010 | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПРОИЗВОДСТВА НАКОЛА ИГЛЫ В ПРИБОРАХ ДЛЯ ПРОВЕРКИ НАВОДКИ ПУЛЕМЕТА | 1928 |
|
SU12300A1 |
| Gabriel J Wilson et all "Effects of beta-hydroxy-beta-methylbutyrate (HMB) on exercise performance and body composition across varying levels of age, sex, and training experience: A reviewа", Nutrition & Metabolism 2008, 5:1, найдено в Интернет сайте: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2245953/pdf/1743-7075-5-1.pdf | |||
| М | |||
| И | |||
| Балабкин и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Харкевич Д.А | |||
| Фармакология: Учебник | |||
| М.: ГЭОТАР-Медиа, 2006 | |||
| ЦУГАЛЬТНЫЙ ВИСЯЧИЙ ЗАМОК | 1923 |
|
SU736A1 |
| С | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| А.И | |||
| Венгеровский "Фармакологическая несовместимость", Бюллетень сибирской медицины, 3, 2003, найдено в Интернет на сайте: http://old.ssmu.ru/bull/03/3/1684.pdf. | |||
Авторы
Даты
2018-05-29—Публикация
2013-11-13—Подача