Область техники
Данное изобретение относится к производному 4-метоксипиррола или его фармацевтически приемлемой соли и содержащей его фармацевтической композиции.
Уровень техники
Язва пищеварительного тракта, гастрит и рефлюкс-эзофагит возникают, когда равновесие между агрессивными факторами (например, желудочным соком, пепсином бактерии Helicobacter, стрессом, алкоголем и табаком и т.д.) и защитными факторами (например, слизистая желудка, бикарбонатом, простагландином, степенью кровоснабжения и т.д.) нарушается. Поэтому терапевтические агенты для лечения повреждений желудочно-кишечного тракта, таких как язва пищеварительного тракта, гастрит и рефлюкс-эзофагит разделены на лекарственные средства для ингибирования агрессивных факторов и лекарственные средства для улучшения защитных факторов. В качестве лекарственных средств для ингибирования агрессивных факторов известны антацид, антихолинергическое лекарственное средство, антагонист рецептора H2, ингибитор протонного насоса (ИПН), антагонист кислотного насоса (АКН), также называемый ингибитором обратимого протонного насоса, и подобные. Например, в качестве лекарственных средств, обладающих антагонистическим действием насосу желудочного сока, в WO2006/025716 описаны производные пирроло[2,3-c]пиридина и в WO2007/072146 описаны производные бензимидазола. Кроме того, в WO2006/036024 описаны производные пиррола, обладающие ингибирующим действием на обратимый протонный насос.
С другой стороны, описано, что язва пищеварительного тракта, гастрит и рефлюкс-эзофагит вызывают язвы даже без увеличения секреции желудочного сока. Таким образом, при увеличении агрессивных факторов считается, что снижение защитного фактора из-за патологического изменения слизистой желудка играет важную роль в возникновении желудочных язв. Таким образом, кроме лекарственных средств для ингибирования агрессивных факторов, лекарственные средства для улучшения защитных факторов применяют для лечения язвы пищеварительного тракта и гастрита. В качестве лекарственных средств для улучшения защитных факторов известны лекарственные средства для защиты слизистой, которые присоединяются к месту язвы для образования физико-химической мембраны, и лекарственные средства, которые способствуют синтезу и секреции слизи.
С другой стороны, известно, что Helicobacter pylori (H. pylori), которая представляет собой бактерию, присутствующую в желудке, вызывает хронический гастрит, язву желудка, язву двенадцатиперстной кишки и подобные, и множество пациентов с повреждениями желудочно-кишечного тракта заражены H. pylori. Поэтому такие пациенты должны принимать антибиотики, такие как кларитромицин, амоксициллин, метронидазол, тетрациклин, вместе с противоязвенными агентами, такими как ингибитор протонного насоса или антагонист кислотного насоса. Следовательно, были описаны различные побочные эффекты.
Поэтому существует необходимость в разработке противоязвенных лекарств, которые ингибируют выделение желудочного сока (например, ингибируют протонный насос) и улучшают защитные факторы (например, увеличение секреции слизи) и, одновременно, обладают уничтожающим действием против H. pylori.
Далее также были проведены исследования сопряженного с G-белком рецептора (GPCR), который вызывает серьезные заболевания.
Более конкретно, 5-гидрокситриптамин (5-ГТ, серотонин) является эффективным фактором желудочно-кишечного тракта, регулятором тромбоцитов и нейтротрансмиттером центральной нервной системы, полученным из триптофана, и может влиять на практически все физиологические и поведенческие функции, такие как эмоции, аппетит, познавательная способность, рвота, функция эндокринной системы, функция пищеварительной системы, двигательные функции, нейротрофическая, восприятие, чувствительность, секс, сон и сердечнососудистая функция.
Также 5-ГТ вовлечен в различные функции, и причина, как известно, обусловлена клеточными телами 5-ГТ, которые концентрируются в соединении ядра ствола головного мозга, анатомической структуре серотонергической системы, имеющей большой нейрит, который влияет на все области осевой части центральной нервной системы, молекулярным различием разных подтипов рецептора 5-ГТ, присутствующих в клеточной мембране, и характеристического цитологического распределения (Mohammad-Zadeh, L. F.; Moses, L.; Gwaltney-Brant, S. Serotonin: a review. J. Vet. Pharmacol. Therap. (2008) 31, 187-199, Glennon, R. A.; Dukat, M.; Westkaemper, R. B. Psychopharmacology - The Fourth Generation of Progress).
Эти 5-ГТ рецепторы классифицированы на семь семейств (от 5-ГТ1 до 5-ГТ7), включая 14 подтипа рецептора, в зависимости от структурных, функциональных и фармакологических стандартов, вреди них, за исключением 5-ГТ3 рецептора, который является открывающим/закрывающим проходом лиганда, все рецепторы соответствуют GPCR. В частности, 5-ГТ2 рецепторы классифицированы на 5-ГТ2A, 5-ГТ2B и 5-ГТ2C рецепторы, и все эти рецепторы повышают производство инозит 1,4,5-трифосфата (ИФ3) через активацию фосфолипазы C (ФЛС). Таким образом известно, что большинство лекарственных средств, которые применяют для лечения психиатрических расстройств (например, депрессии, маниакальной депрессии, шизофрении, аутизма, обсессивно-компульсивного невроза, тревожного расстройства и т.д.), действуют через серотогенный механизм. Далее, описано, что заболевания, такие как мигрень, гипертензия, расстройства питания и синдром раздраженного кишечника (СРК), также ассоциируются с 5-ГТ.
С другой стороны, ацетилхолин является нейротрансмиттером автономной нервной системы и действует на центральную нервную систему и периферийную нервную систему, тем самым влияя на мозговую и мышечную систему. Такой ацетилхолиновый рецептор может быть поделен на никотиновый рецептор ацетилхолина (nAChR) в качестве ионного рецептора и мускариновый рецептор ацетилхолина (mAChR) в качестве метаболитного рецептора. Среди них мускариновый ацетилхолиновый рецептор (mAChR) идентифицирован как включающий пять разных подтипов рецептора, каждый из которых обозначен как M1-M5 рецепторы, и они также соответствуют GPCR.
В частности, M1 рецепторы присутствуют в коре головного мозга и гиппокампе и вовлечены в вегетативный нерв, слюнную железу, желудочную секрецию и подобные. M2 рецепторы присутствуют в сердце, коре головного мозга и гиппокампе, и вовлечены в снижение частоты сердечных сокращений, снижение силы сокращения предсердий, снижение скорости проведения импульса АВ-узла и подобные. Конкретно, под воздействием ацетилхолина в течение вплоть до нескольких секунд, пирамидальный нейрон коры головного мозга ингибируется через M1 мускариновый рецептор, связанный с альфа подъединицей G белков Gq-типа. Поэтому, когда активирован M1 рецептор, кальций, хранящийся в клетках, выделяется с образованием проведения калия, активированного выделением кальция, тем самым может ингибироваться выбросы пирамидальных нейронов.
Ингибированием действия этих M1 и M2 рецепторов можно лечить или предотвращать множество заболеваний. Конкретно, в качестве терапевтических агентов для ингибирования действия M1 рецепторов известны терапевтический агент для лечения пептической язвы, такой как пирензепин, с применением эффектов предотвращения секреции выброса желудочного сока и снижения желудочных колик, терапевтический агент для лечения диабетической невропатии с применением эффекта снижения скорости проводимости нерва и предотвращения тактильной аллодинии и тепловой гипоальгезии, и подобные. В качестве терапевтических агентов для ингибирования действия рецепторов M2 известны терапевтический агент для лечения гиперреактивности мочевого пузыря с применением эффектов ингибирования аллергических реакций, вызванных рецепторами M2, терапевтический агент для лечения астмы и подобные. Поэтому представляется, что мускариновый антагонист ацетилхолина вероятно будет разрабатываться как терапевтический агент для лечения таких заболеваний, как пептическая язва, диабетическая невропатия, астма и гиперактивность мочевого пузыря.
Следовательно, для профилактики и лечения заболеваний, связанных с 5-ГТ и ацетилхолином, необходимо изучать соединения, которые могут обладать ингибирующим действием на их GPCR, в частности, 5-ГТ2A, M1 и M2 мускариновые рецепторы.
С учетом вышесказанного, авторы данного изобретения провели множество исследований и обнаружили, что производные 4-метоксипиррола или их фармацевтически приемлемые соли обладают превосходным противоязвенным действием (т.е. ингибирующим действием на протонный насос, и т.д.) и уничтожающим действием против H. pylori, и поэтому могут быть полезными для профилактики и лечения повреждений желудочно-кишечного тракта из-за язвы пищеварительного тракта, гастрита, рефлюкс-эзофагита или H. pylori. Кроме того, авторы данного изобретения обнаружили, что эти производные 4-метоксипиррола или их фармацевтически приемлемые соли обладают ингибирующим действием против GPCR, которые вызывают заболевания, например, 5-ГТ2A, M1 и M2 мускариновых рецепторов и подобных, и поэтому могут эффективно применяться для профилактики и лечения заболеваний, медиированных 5-ГТ рецептором или мускариновым рецептором ацетилхолина. Данное изобретение было завершено на основе этих открытий.
Подробное описание изобретения
Техническая проблема
Объектом данного изобретения является получение производного 4-метоксипиррола или его фармацевтически приемлемой соли и содержащей его фармацевтической композиции.
Техническое решение
Согласно одному варианту изобретения представлено производное 4-метоксипиррола или его фармацевтически приемлемая соль, обладающее противоязвенным действием (т.е., ингибирующим действием на протонный насос, и т.д.), уничтожающим действием против H. pylori и ингибирующим действием против GPCR.
Согласно одному варианту изобретения, представлена фармацевтическая композиция для профилактики и лечения повреждений желудочно-кишечного тракта из-за язвы пищеварительного тракта, гастрита, рефлюкс-эзофагита или H. pylori, содержащая указанное выше соединение или его фармацевтически приемлемую соль.
Согласно одному варианту изобретения, представлена фармацевтическая композиция для профилактики и лечения медиированных 5-ГТ рецептором или медиированных мускариновым рецептором ацетилхолина заболеваний, содержащая указанное выше соединение или его фармацевтически приемлемую соль.
Преимущественное действие
Соединения в соответствии с данным изобретением, то есть производные 4-метоксипиррола или их фармацевтически приемлемые соли, обладают не только превосходным ингибирующим действием на протонный насос, ингибирующим действием на повреждения желудочно-кишечного тракта и улучшающим защитные факторы действием, но также обладают превосходным уничтожающим действием против H. pylori. Поэтому производные 4-метоксипиррола или их фармацевтически приемлемые соли могут эффективно применяться для профилактики и лечения повреждения желудочно-кишечного тракта из-за язвы пищеварительного тракта, гастрита, рефлюкс-эзофагита или H. pylori. Более того, соединения в соответствии с данным изобретением, то есть производные 4-метоксипиррола или их фармацевтически приемлемые соли, обладают ингибирующим действием против GPCR и, таким образом, могут эффективно применяться для профилактики и лечения медиированных 5-ГТ рецептором или медиированных мускариновым рецептором ацетилхолина заболеваний.
Подробное описание вариантов
В данном изобретении описано соединение, представленное следующей химической формулой 1, или его фармацевтически приемлемая соль:
Химическая формула 1
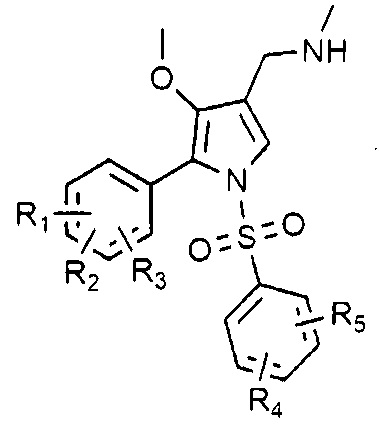
в химической формуле 1,
R1, R2 и R3 каждый независимо является водородом или галогеном,
R4 и R5 каждый независимо является водородом, галогеном, C1-4 алкилом, C1-4 алкокси, C1-4 галоалкилом или C1-4 галоалкокси,
при условии, что R1, R2 и R3 не могут быть водородом одновременно, и R4 и R5 не могут быть водородом одновременно.
Предпочтительно, R1, R2 и R3 каждый независимо является водородом, фтором или хлором.
Также предпочтительно, R4 и R5 каждый независимо является водородом, хлором, фтором, метилом, трифторметилом, метокси или дифторметокси.
Согласно одному варианту, указанные выше соединения могут быть представлены следующей химической формулой 1-1:
Химическая формула 1-1
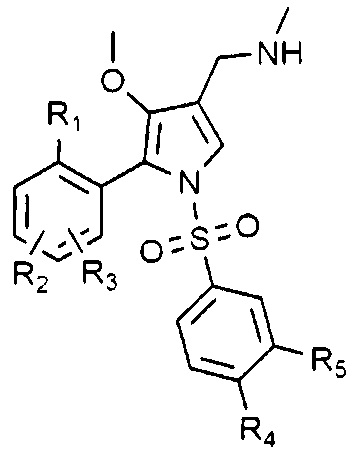
в химической формуле 1-1, R1, R2 и R3 каждый может быть независимо водородом или галогеном. Однако R1, R2 и R3 не могут быть водородом одновременно.
Предпочтительно, R1, R2 и R3 каждый независимо является водородом, фтором или хлором.
Также предпочтительно, R1 является галогеном, и R2 и R3 каждый независимо является водородом или галогеном.
Еще более предпочтительно, R1 является фтором, и R2 и R3 каждый независимо является водородом, фтором или хлором; или R1 является хлором и R2 и R3 могут быть водородом.
В химической формуле 1-1, R4 и R5 каждый независимо является водородом, галогеном, C1-4 алкилом, C1-4 алкокси, C1-4 галоалкилом или C1-4 галоалкокси. Однако R4 и R5 не могут быть водородом одновременно.
Предпочтительно, R4 и R5 каждый независимо является водородом, хлором, фтором, метилом, трифторметилом, метокси или дифторметокси.
Также предпочтительно, R4 является водородом, R5 является хлором, фтором, метилом, трифторметилом, метокси или дифторметокси; или R4 и R5 каждый может быть независимо хлором или фтором.
Также предпочтительно, R1 является фтором, и R2 и R3 каждый независимо является водородом или фтором, R4 является водородом, и R5 может быть хлором или трифторметилом.
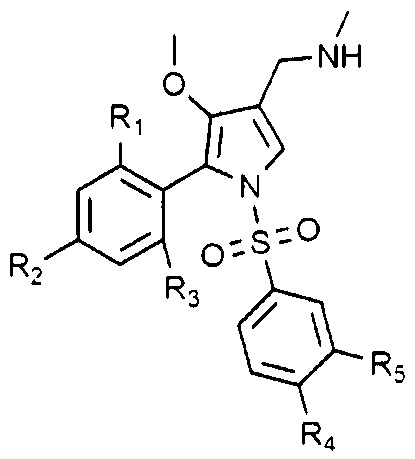
Согласно одному варианту, указанные выше соединения могут быть выбраны из группы, представленной следующими химическими формулами от 1-2 до 1-4, но не ограничены ими:
Химическая формула 1-2
Химическая формула 1-3
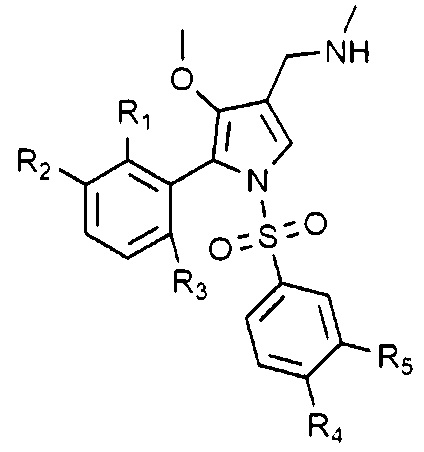
Химическая формула 1-4
в химических формулах от 1-2 до 1-4, R1 - R5 такие, как определены выше.
Согласно одному варианту, указанное выше соединение выбирают из группы, включающей следующие соединения:
1) 1-(5-(2-фторфенил)-4-метокси-1-((3-хлорфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
2) 1-(5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
3) 1-(5-(2-фторфенил)-4-метокси-1-((3-метоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
4) 1-(5-(2-фторфенил)-4-метокси-1-((3-дифторметоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
5) 1-(5-(2-хлорфенил)-4-метокси-1-((3-метоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
6) 1-(5-(2-фтор-4-хлорфенил)-4-метокси-1-((3-хлорфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
7) 1-(5-(2-фтор-4-хлорфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
8) 1-(5-(2,4-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
9) 1-(5-(2,4-дифторфенил)-1-((3-(трифторметил)фенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
10) 1-(5-(2,4-дифторфенил)-1-((3-метилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
11) 1-(5-(2,4-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
12) 1-(5-(2,4-дифторфенил)-1-((3-дифторметоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
13) 1-(5-(2,6-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
14) 1-(5-(2,6-дифторфенил)-1-((3-хлорфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
15) 1-(5-(2,6-дифторфенил)-1-((3-(трифторметил)фенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
16) 1-(5-(2,6-дифторфенил)-1-((3-метилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
17) 1-(5-(2,6-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
18) 1-(5-(2,6-дифторфенил)-1-((3-хлор-4-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
19) 1-(5-(2,6-дифторфенил)-1-((3,4-дифторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
20) 1-(5-(2-фтор-6-хлорфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
21) 1-(5-(2-фтор-6-хлорфенил)-1-((3-хлорфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
22) 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
23) 1-(1-((3-хлорфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
24) 1-(1-((3-трифторметилфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
25) 1-(1-((3-метоксифенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
26) 1-(1-((3,4-дифторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метанамин;
27) 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
28) 1-(1-((3-хлорфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
29) 1-(1-((3-трифторметилфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
30) 1-(1-((3-метоксифенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
31) 1-(5-(2,5-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
32) 1-(5-(2,5-дифторфенил)-1-((3-трифторметилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин; и
33) 1-(5-(2,5-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин.
Соединение, представленное химической формулой 1, или его соль могут иметь замещающую группу, содержащую асимметрический атом. В таком случае, соединение химической формулы 1 или его соль могут быть представлены как оптический изомер, такой как (R), (S) или рацемат (RS). Поэтому, если не указано иначе, соединение химической формулы 1 или его соль включает все оптические изомеры, такие как (R), (S) или рацемат (RS).
Соединение, представленное химической формулой 1, может быть в форме фармацевтически приемлемой соли. Соль включает обычные кислотно-аддитивные соли, например, соли, полученные из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота или азотная кислота, и соли, полученные из органических кислот, таких как уксусная кислота, пропионовая кислота, янтарная кислота, гликолевая кислота, стеариновая кислота, малеиновая кислота, гидроксималеиновая кислота, фенилуксусная кислота, глутаминовая кислота, бензойная кислота, салициловая кислота, сульфаниловая кислота, 2-ацетоксибензойная кислота, фумаровая кислота, толуолсульфоновая кислота, метандисульфоновая кислота, этандисульфоновая кислота, щавелевая кислота или трифторуксусная кислота. Предпочтительно, соль может быть гидрохлорид или фумарат.
В качестве примера, соединение, представленное химической формулой 1, может быть получено способом, показанным на следующей схеме реакции 1:
Схема реакции 1
на схеме реакции 1, R1 - R5 такие, как определены выше.
Также соединение, представленное химической формулой 2 на схеме реакции 1, пожжет быть получено способом, показанным на следующей схеме реакции 2 или 3:
Схема реакции 2
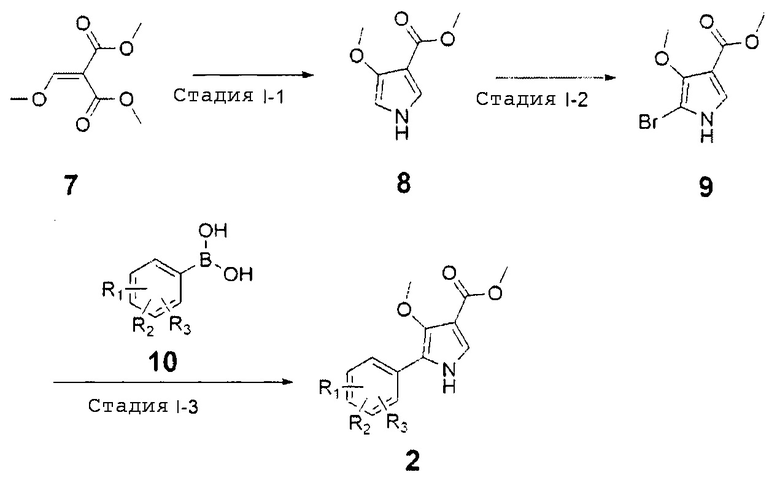
Схема реакции 3
на схемах реакций 2 и 3, R1 - R3 такие, как определены выше, и 'Ac' означает ацетил.
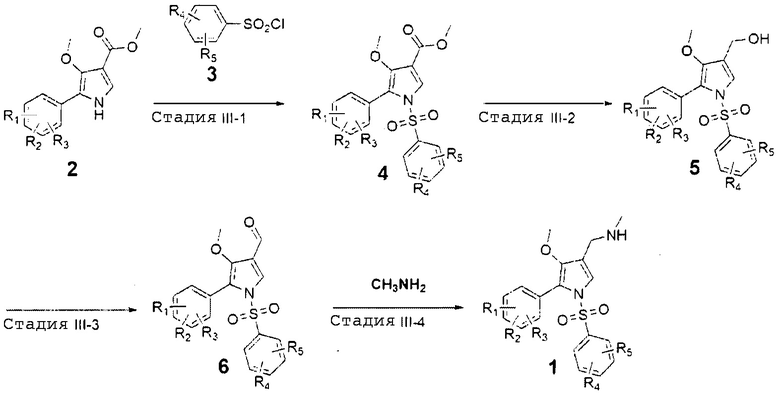
Сначала, способ, представленный на схеме реакции 2, которым могут быть получены соединения химической формулы 2, может проводиться через стадии I-1 - I-3.
Стадия I-1 является стадией взаимодействия диметил 2-(метоксиметилен)малоната, представленного химической формулой 7, с тозилметилизоцианатом с получением соединения, представленного химической формулой 8, что является стадией циклизации пиррола. Реакция может проводиться в органическом растворителе, таком как ацетонитрил.
Стадия I-2 является стадией бромирования соединения, представленного химической формулой 8, с получением соединения, представленного химической формулой 9. Бромирование может проводиться с применением реагента, такого как N-бромсукцинимид (NBS), который может ввести бром в положение водорода пиррола в соединении, представленном химической формулой 8. Также, реакция может проводиться в органическом растворителе, таком как тетрагидрофуран.
Стадия I-3 является стадией взаимодействия соединения, представленного химической формулой 9 с соединением, представленным химической формулой 10 в присутствии металлического катализатора с получением соединения, представленного химической формулой 2. В качестве металлического катализатора может применяться обычный палладиевый (Pd) катализатор. Не ограничивающие примеры могут включать Pd(PPh3)4, Pd(OAc)2, PdCl2, PdCl2(PPh3)4, PdBr2, Pd(acac)2, Pd2(dba)3, Pd(dba)2 и подобные. Здесь 'Ph' означает фенил, 'acac' означает ацетилацетонат и 'dba' означает дибензилиденацетон. Также, реакция может проводиться в полярном растворителе, таком как метанол, этанол, трет-бутанол, ацетон, диметилформамид, ацетонитрил или вода.
Альтернативно, соединения химической формулы 2 могут быть получены по схеме реакции 3, и способ, представленный на схеме реакции 3, может проводиться через стадии II-1 - II-4.
Стадия II-1 является стадией взаимодействия соединения, представленного химической формулой 11, с диметил 2-(метоксиметилен)малонатом, представленным химической формулой 7, с получением соединения, представленного химической формулой 12. Реакция может проводиться в спиртовом растворителе, таком как метанол, этанол или трет-бутанол, в течение от 1 до 4 часов.
Стадия II-2 является стадией взаимодействия соединения, представленного химической формулой 12, с уксусным ангидридом (Ac2O) с получением соединения, представленного химической формулой 13, что является стадией циклизации пиррола. Реакция может проводиться в присутствии основания, такого как триэтиламин, в течение от 1 до 2 часов.
Стадия II-3 является стадией гидролиза соединения, представленного химической формулой 13, с получением соединения, представленного химической формулой 14. На этой стадии гидроксигруппа может быть введена в пиррол. Также, гидролиз может проводиться с применением основания, такого как гидроксид натрия, в течение от 10 минут до 30 минут.
Стадия II-4 является стадией метилирования соединения, представленного химической формулой 14, с получением соединения, представленного химической формулой 2. Метилирование может проводиться с применением метилирующего агента, такого как триметилсилилдиазометан (TMS-CH2N2) или взаимодействием с диметилсульфатом в присутствии гидроксида натрия. Также, реакция может проводиться в органическом растворителе, таком как диметилформамид или диэтиловый эфир, в течение от 1 до 48 часов.
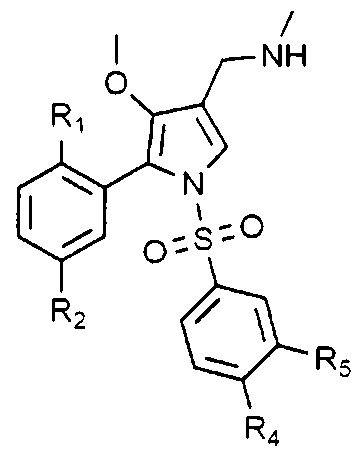
Затем соединение, представленное химической формулой 1, может быть получено согласно схеме реакции 1. Способ, представленный на схеме реакции 1, может осуществляться через стадии III-1 - III-4.
Стадия III-1 является стадией взаимодействия соединения, представленного химической формулой 2, с соединением, представленным химической формулой 3, с получением соединения, представленного химической формулой 4, что является стадией введения замещенной фенилсульфонильной группы в пиррол соединения, представленного химической формулой 2. Реакцию проводят в органическом растворителе, таком как диметилформамид, в присутствии гидрида натрия в течение от 20 до 30 минут.
Стадия III-2 является стадией восстановления соединения, представленного химической формулой 4, с получением соединения, представленного химической формулой 5. Восстановление может проводиться в органическом растворителе, таком как тетрагидрофуран, с применением восстанавливающего агента, такого как гидрид диизобутилалюминия (DIBAL).
Стадия III-3 является стадией окисления соединения, представленного химической формулой 5, с получением соединения, представленного химической формулой 6. Окисление спиртовой группы соединения, представленного химической формулой 5, может проводиться в органическом растворителе, таком как дихлорметан, с применением окисляющего агента, такого как хлорформиат пиридиния (PCC) в течение от 30 минут до 2 часов.
Стадия III-4 является стадией взаимодействия соединения, представленного химической формулой 6, с метиламином с получением соединения, представленного химической формулой 1, что является стадией восстановительного аминирования. Восстановительное аминирование может проводиться в органическом растворителе, таком как тетрагидрофуран, с применением восстанавливающего агента, такого как боргидрид натрия, в течение от 30 минут до 1 часа.
При необходимости, фармацевтически приемлемые кислотно-аддитивные соли, такие как гидрохлорид или фумарат, могут быть получены добавлением кислоты, такой как хлористоводородная кислота или фумаровая кислота, к соединению, представленному химической формулой 1, полученному как описано выше. Например, соединение, представленное химической формулой 1, может взаимодействовать с раствором кислоты в органическом растворителе, таком как дихлорметан, в течение от 1 до 2 часов с получением кислотно-аддитивной соли.
С другой стороны, в данном изобретении представлена фармацевтическая композиция для профилактики и лечения повреждения желудочно-кишечного тракта из-за язвы пищеварительного тракта, гастрита, рефлюкс-эзофагита или H. pylori, содержащая соединения, представленные химической формулой 1, или их фармацевтически приемлемые соли.
Также в данном изобретении представлена фармацевтическая композиция для профилактики и лечения медиированных 5-ГТ рецептором или медиированных мускариновым рецептором ацетилхолина заболеваний, содержащая соединения, представленные химической формулой 1, или их фармацевтически приемлемые соли. В этом случае медиированными 5-ГТ рецептором или медиированными мускариновым рецептором ацетилхолина заболеваниями могут быть депрессия, маниакальная депрессия, шизофрения, аутизм, обсессивно-компульсивный невроз, тревожное расстройство, мигрень, гипертензия, расстройства питания, синдром раздраженного кишечника (СРК), пептическая язва, диабетическая невропатия, астма и гиперреактивность мочевого пузыря.
Фармацевтические композиции могут содержать фармацевтически приемлемые носители, которые обычно применяют, такие как наполнители, разрыхлители, подсластители, смазывающие или вкусовые агенты. Фармацевтическая композиция может быть составлена в препараты для перорального введения, такие как таблетки, капсулы, порошки, гранулы, суспензии, эмульсии или сиропы; или препараты для парентерального введения, такие как инъекции, с применением обычных способов. Препараты могут быть составлены в различных формах, например, в виде единичной лекарственной формы или множественных лекарственных форм.
Композиции могут вводиться перорально или парентерально, включая внутривенный, внутримышечный, внутрибрюшинный, подкожный, ректальный и местный способы введения. Композиции могут предпочтительно вводиться перорально. Поэтому композиция может быть составлена в различные формы, такие как таблетки, капсулы, водные растворы или суспензии. В таблетки для перорального введения обычно добавляют носители, такие как лактоза или кукурузный крахмал, и смазывающие агенты, такие как стеарат магния. В капсулах для перорального введения в качестве разбавителя может применяться лактоза и/или высушенный кукурузный крахмал. Если водная суспензия вводится перорально, активный ингредиент может быть объединен с эмульсиями и/или суспензиями. При необходимости могут быть добавлены определенные подсластители и/или вкусовые добавки. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного введения обычно готовят стерильные растворы активного ингредиента, и pH раствором должен быть соответственно скорректирован и буферирован. Для внутривенного введения общая концентрация растворимых веществ должна контролироваться для того, чтобы препарат оставался изотоническим. Композиция может быть в форме водного раствора, содержащего фармацевтически приемлемый носитель, например, солевой раствор, при уровне pH 7,4. Раствор может быть введен во внутримышечный кровоток пациента местной инъекцией болюса.
В этом случае фармацевтическая композиция может вводиться в терапевтически эффективном количестве. Поэтому соединение, представленное химической формулой 1, или его фармацевтически приемлемая соль, содержащееся в фармацевтической композиции, может вводиться пациенту в эффективном количестве от около 0,01 мг/кг до около 100 мг/кг в сутки. Конечно, доза может быть изменена в соответствии с возрастом, массой тела, восприимчивостью пациента, симптомами или эффективностью соединения.
Ниже данное изобретение описано с помощью примеров и экспериментальных примеров. Эти примеры представлены только для иллюстрации и не ограничивают объем изобретения.
Анализ соединений, полученных в примерах ниже, проводят следующим образом: анализ спектра ядерного магнитного резонанса (ЯМР) проводят на спектрометре Bruker 400 МГц, химический сдвиг анализируют в ч./млн., хроматографию на колонке проводят на силикагеле (Merck, 70-230 меш) (W.C. Still, J. Org. Chem., (43), 2923, 1978). А также исходные материалы в каждом примере синтезируют из известных соединений или покупают в Sigma Aldrich.
Пример 2: Получение гидрохлорида 1-(5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метиламина
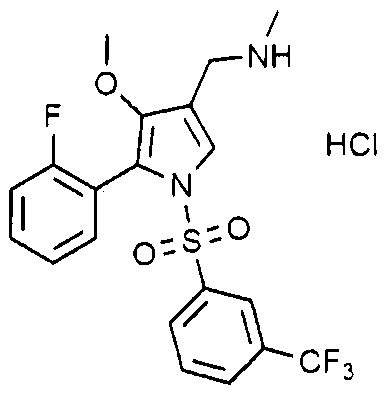
(Стадия 2-1) Получение 2-(2-фторфенил)-2-((3-метокси-2-(метоксикарбонил)-3-оксопроп-1-ен-1-ил)амино)уксусной кислоты
2-Фторфенилглицин (200,0 г, 1,18 моль), диметил 2-(метоксиметилен)малонат (187,2 г, 1,07 моль) и ацетат натрия (97,0 г, 1,18 моль) добавляют к метанолу (1000,0 мл), и смесь затем кипятят с обратным холодильником при 60°C в течение 4 часов. Реакционную смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении. К полученному остатку добавляют воду (140,0 мл) и 1N водный раствор HCl (561,0 мл) и затем фильтруют. Полученное твердое вещество сушат при пониженном давлении с получением 301,0 г указанного в заголовке соединения. (Выход: 81,8%).
1H-ЯМР (500 МГц, CDCl3): 9,97 (кв, 1H), 8,1 (д, 1H), 7,46-7,40 (м, 2H), 7,25 (т, 1H), 7,20 (т, 1H), 5,57 (д, 1H), 3,75 (с, 3H), 3,64 (с, 3H)
(Стадия 2-2) Получение метил 4-ацетокси-1-ацетил-5-(2-фторфенил)-1H-пиррол-3-карбоксилата
Уксусный ангидрид (1440,0 мл), молекулярные сита (4Å, 96,0 г) и триэтиламин (960,0 мл) добавляют к 2-(2-фторфенил)-2-((3-метокси-2-(метоксикарбонил)-3-оксопроп-1-ен-1-ил)амино)уксусной кислоте (301,0 г, 0,96 моль), полученной на стадии 2-1. Реакционную смесь кипятят с обратным холодильником при 140°C в течение 1 часа и затем охлаждают до 0°C. К реакционной смеси добавляют ледяную воду (2425,0 мл) при 0°C, перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:3 (об./об.)) с получением 48,8 г указанного в заголовке соединения. (Выход: 15,1%).
1H-ЯМР (500 МГц, CDCl3): 7,87 (с, 1H), 7,40-7,38 (кв, 1H), 7,30-7,26 (кв, 1H), 7,18 (т, 1H), 7,11 (т, 1H), 3,83 (с, 3H), 2,16 (с, 3H), 2,21 (с, 3H)
(Стадия 2-3) Получение метил 5-(2-фторфенил)-4-гидрокси-1H-пиррол-3-карбоксилата
Тетрагидрофуран (130,0 мл) и воду (32,5 мл) добавляют к метил 4-ацетокси-1-ацетил-5-(2-фторфенил)-1H-пиррол-3-карбоксилату (48,8 г, 152,8 ммоль), полученному на стадии 2-2. Реакционную смесь охлаждают до 0°C, туда добавляют гидроксид натрия (11,7 г, 305,6 моль) и затем перемешивают при 0°C в течение 10 минут. Реакционную смесь нейтрализуют с применением 1N водного раствора хлористоводородной кислоты и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 30,5 г указанного в заголовке соединения. (Выход: 89,05%)
1H-ЯМР (500 МГц, CDCl3): 8,92 (с, 1H), 8,20-8,16 (м, 2H), 7,20 (т, 1H), 7,14-7,06 (м, 3H), 3,87 (с, 3H)
(Стадия 2-4) Получение метил 5-(2-фторфенил)-4-метокси-1H-пиррол-3-карбоксилата
Метил 5-(2-фторфенил)-4-гидрокси-1H-пиррол-3-карбоксилат (30,3 г, 128,7 ммоль), полученный на стадии 2-3, растворяют в диметилформамиде (150,0 мл). К полученному раствору добавляют гидрид натрия (60%, дисперсия в жидком парафине) (5,2 г, 128,7 ммоль) при 0°C и затем перемешивают при 0°C в течение 30 минут. Диметилсульфат (12,2 мл, 128,7 ммоль) добавляют к реакционной смеси и затем перемешивают при 0°C в течение 1 часа. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 22,8 г указанного в заголовке соединения. (Выход: 71,0%)
1H-ЯМР (500 МГц, CDCl3): 8,91 (с, 1H), 8,17-8,15 (м, 1H), 7,32 (д, 1H), 7,22-7,17 (м, 2H), 7,14-7,09 (м, 1H), 3,89 (с, 3H), 3,86 (с, 3H)
(Стадия 2-5) Получение метил 5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-карбоксилата
Метил 5-(2-фторфенил)-4-метокси-1H-пиррол-3-карбоксилат (22,47 г, 90,0 ммоль), полученный на стадии 2-4, растворяют в диметилформамиде (113,0 мл). К полученному раствору добавляют гидрид натрия (60%, дисперсия в жидком парафине) (4,35 г, 108,2 ммоль) при 0°C и затем перемешивают при 0°C в течение 20 минут. 3-(Трифторметил)бензолсульфонилхлорид (28,77 г, 108,2 ммоль) добавляют к реакционной смеси и перемешивают при комнатной температуре в течение 30 минут. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 28,04 г указанного в заголовке соединения. (Выход: 92,2%)
1H-ЯМР (500 МГц, CDCl3): 8,01 (с, 1H), 7,84 (д, 1H), 7,66 (д, 1H), 7,58 (т, 1H), 7,53 (с, 1H), 7,44-7,42 (м, 1H), 7,17-7,15 (м, 2H), 6,96 (т, 1H), 3,87 (с, 3H), 3,59 (с, 3H)
(Стадия 2-6) Получение (5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)метанола
Метил 5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-карбоксилат (27,7 г, 60,8 ммоль), полученный на стадии 2-5, растворяют в тетрагидрофуране (140,0 мл). К полученному раствору добавляют гидрид диизопропилбутилалюминия (1,0 M раствор в тетрагидрофуране) (182,2 мл, 182,2 ммоль) при 0°C и затем перемешивают при комнатной температуре в течение 1 часа. Воду добавляют к реакционной смеси при 0°C и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 21,55 г указанного в заголовке соединения. (Выход: 82,6%)
1H-ЯМР (500 МГц, CDCl3): 7,80 (д, 1H), 7,66 (д, 1H), 7,57-7,54 (м, 2H), 7,40(кв, 1H), 7,36 (с, 1H), 7,19-7,12 (м, 2H), 6,98 (т, 1H), 4,57 (д, 2H), 3,46 (с, 3H)
(Стадия 2-7) Получение 5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-карбальдегида
(5-(2-Фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)метанол (21,4 г, 50,0 ммоль), полученный на стадии 2-6, растворяют в дихлорметане (214,0 мл). К полученному раствору добавляют хлорхромат пиридиния (32,4 г, 150,0 ммоль), перемешивают при комнатной температуре в течение 30 минут и затем фильтруют через слой целита (32,4 г). Фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:2 (об./об.)) с получением 15,1 г указанного в заголовке соединения. (Выход: 70,7%)
1H-ЯМР (500 МГц, CDCl3): 9,91 (с, 1H), 8,02 (с, 1H), 7,86 (д, 1H), 7,66 (д, 1H), 7,59 (т, 1H), 7,47-7,42 (м, 1H), 7,21-7,15 (м, 2H), 6,95 (т, 1H), 3,60 (с, 3H)
(Стадия 2-8) Получение 1-(5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
5-(2-Фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-карбальдегид (14,9 г, 34,9 ммоль), полученный на стадии 2-7, растворяют в тетрагидрофуране (74,5 мл). Метиламин (2,0 M раствор в тетрагидрофуране) (174,2 мл, 348,4 ммоль) добавляют к полученному раствору и перемешивают при комнатной температуре в течение 30 минут. Боргидрид натрия (5,27 г, 139,3 ммоль) добавляют к реакционной смеси, перемешивают при комнатной температуре в течение 30 минут, нейтрализуют 1N водным раствором хлористоводородной кислоты и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:2 (об./об.)) с получением 9,2 г указанного в заголовке соединения. (Выход: 70,7%)
1H-ЯМР (500 МГц, MeOD): 8,01 (с, 1H), 7,78-7,72 (м, 3H), 7,55-7,50 (м, 2H), 7,19 (т, 1H), 7,14 (т, 1H), 7,03 (т, 1H), 4,07 (с, 2H), 3,42 (с, 3H), 2,70 (с, 3H)
(Стадия 2-9) Получение гидрохлорида 1-(5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
1-(5-(2-Фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин (9,2 г, 20,8 ммоль), полученный на стадии 2-8, растворяют в дихлорметане (18,4 мл). Раствор хлористоводородной кислоты (2,0 M раствор в диэтиловом эфире) (21,8 мл, 43,6 ммоль) добавляют к полученному раствору, перемешивают при 0°C в течение 1 часа и затем фильтруют. Полученное твердое вещество сушат при пониженном давлении с получением 9,48 г указанного в заголовке соединения. (Выход: 88,5%)
Молекулярная масса: 478,89
1H-ЯМР (500 МГц, MeOD): 8,00 (д, 1H), 7,77-7,71 (м, 2H), 7,68 (с, 1H), 7,55 (с, 1H), 7,50 (кв, 1H), 7,18 (т, 1H), 7,71 (т, 1H), 7,03 (т, 1H), 4,02 (с, 2H), 3,42 (с, 3H), 2,67 (с, 3H)
Пример 8: Получение гидрохлорида 1-(5-(2,4-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
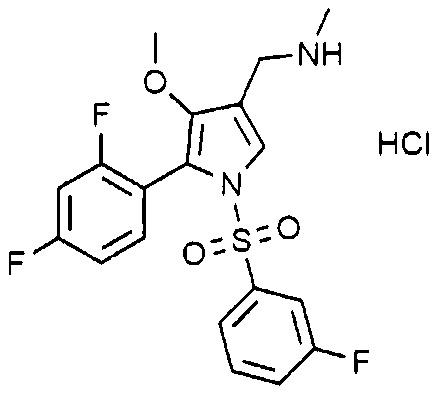
(Стадия 8-1) Получение 2-(2,4-дифторфенил)-2-((3-метокси-2-(метоксикарбонил)-3-оксопроп-1-ен-1-ил)амино)уксусной кислоты
2,4-Дифторфенилглицин (150,0 г, 801,5 ммоль), диметил 2-(метоксиметилен)малонат (126,9 г, 728,6 ммоль) и ацетат натрия (65,8 г, 801,5 ммоль) добавляют к метанолу (800,0 мл) и затем кипятят с обратным холодильником при 60°C в течение 4 часов. Реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении для удаления около 70% метанола и затем фильтруют. Полученное твердое вещество сушат при пониженном давлении с получением 190,0 г указанного в заголовке соединения. (Выход: 79,2%)
1H-ЯМР (500 МГц, CDCl3): 8,02-7,99 (м, 1H), 7,45-7,40 (м, 1H), 7,00-6,95 (м, 2H), 5,16 (с, 1H), 3,74 (с, 3H), 3,76 (с, 3H)
(Стадия 8-2) Получение метил 5-(2,4-дифторфенил)-4-гидрокси-1H-пиррол-3-карбоксилата
Уксусный ангидрид (1731,2 мл) и триэтиламин (577,1 мл) добавляют к 2-(2,4-дифторфенил)-2-((3-метокси-2-(метоксикарбонил)-3-оксопроп-1-ен-1-ил)амино)уксусной кислоте (190,0 г, 577,1 ммоль), полученной на стадии 8-1. Реакционную смесь кипятят с обратным холодильником при 140°C в течение 30 минут и затем охлаждают до 0°C. К реакционной смеси добавляют ледяную воду (577,1 мл) при 0°C, перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученное соединение фильтруют с применением силикагеля для удаления твердого вещества и затем концентрируют при пониженном давлении.
Тетрагидрофуран (140,0 мл) и воду (120,0 мл) добавляют к полученному остатку, охлаждают до 0°C, затем добавляют гидроксид натрия (46,17 г, 1154,2 ммоль). Реакционную смесь перемешивают при 0°C в течение 30 минут, нейтрализуют с применением 1N водного раствора хлористоводородной кислоты и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 22,0 г указанного в заголовке соединения. (Выход: 15,1%)
1H-ЯМР (500 МГц, CDCl3): 8,80 (с, 1H), 8,17-8,12 (м, 2H), 7,13 (д, 1H), 6,95 (т, 1H), 6,86-6,83 (м, 1H), 3,88 (с, 3H)
(Стадия 8-3) Получение метил 5-(2,4-дифторфенил)-4-метокси-1H-пиррол-3-карбоксилата
Метил 5-(2,4-дифторфенил)-4-гидрокси-1H-пиррол-3-карбоксилат (22,0 г, 86,9 ммоль), полученный на стадии 8-2, растворяют в тетрагидрофуране (434,5 мл) и метаноле (173,9 мл). (Триметилсилил)диазометан (2,0 M раствор в диэтиловом эфире, 173,8 мл) добавляют к реакционной смеси и затем перемешивают при комнатной температуре в течение 48 часов. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 18,1 г указанного в заголовке соединения. (Выход: 75,3%)
1H-ЯМР (500 МГц, CDCl3): 8,78 (с, 1H), 8,12 (м, 1H), 7,30 (д, 1H), 6,95 (т, 1H), 6,88 (т, 1H), 3,87 (с, 3H), 3,85 (с, 3H)
(Стадия 8-4) Получение метил 5-(2,4-дифторфенил)-4-метокси-1-((3-фторфенил)сульфонил)-1H-пиррол-3-карбоксилата
Метил 5-(2,4-дифторфенил)-4-метокси-1H-пиррол-3-карбоксилат (18,0 г, 67,4 ммоль), полученный на стадии 8-3, растворяют в диметилформамиде (335,0 мл). Гидрид натрия (60% дисперсия в жидком парафине) (4,0 г, 101,0 ммоль) добавляют к полученному раствору при комнатной температуре и перемешивают при комнатной температуре в течение 10 минут. 3-Фторбензолсульфонилхлорид (13,37 мл, 101,0 ммоль) добавляют к реакционной смеси и перемешивают при комнатной температуре в течение 1 часа. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 26,1 г указанного в заголовке соединения. (Выход: 91,1%)
1H-ЯМР (500 МГц, CDCl3): 7,98 (с, 1H), 7,43-7,39 (м, 1H), 7,30 (т, 1H), 7,23 (д, 1H), 7,15 (кв, 1H), 7,67 (кв, 1H), 6,91 (т, 1H), 6,77 (т, 1H), 3,87 (с, 3H), 3,61 (с, 3H)
(Стадия 8-5) Получение 5-(2,4-дифторфенил)-4-метокси-1-((3-фторфенил)сульфонил)-1H-пиррол-3-карбальдегида
Метил 5-(2,4-дифторфенил)-4-метокси-1-((3-фторфенил)сульфонил)-1H-пиррол-3-карбоксилат (26,0 г, 61,1 ммоль), полученный на стадии 8-4, растворяют в тетрагидрофуране (300,0 мл). Гидрид диизобутилалюминия (1,0 M раствор в тетрагидрофуране) (183,4 мл, 183,4 ммоль) добавляют к полученному раствору при 0°C, перемешивают при комнатной температуре в течение 1 часа, нейтрализуют с применением 1N раствора хлористоводородной кислоты и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении.
Полученный остаток растворяют в дихлорметане (300,0 мл), туда добавляют целит (26,0 г) и хлорхромат пиридиния (39,5 г, 183,4 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и затем фильтруют для удаления твердого вещества. Фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:2 (об./об.)) с получением 17,2 г указанного в заголовке соединения. (Выход: 70,9%)
1H-ЯМР (500 МГц, CDCl3): 9,89 (с, 1H), 7,99 (с, 1H), 7,45-7,41 (м, 1H), 7,33 (с, 1H), 7,25 (д, 1H), 7,18 (кв, 1H), 7,05 (с, 1H), 6,92 (т, 1H), 6,77 (т, 1H), 3,63 (с, 3H)
(Стадия 8-6) 1-(5-(2,4-дифторфенил)-4-метокси-1-((3-фторфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин
5-(2,4-дифторфенил)-4-метокси-1-((3-фторфенил)сульфонил)-1H-пиррол-3-карбальдегид (17,0 г, 43,0 ммоль), полученный на стадии 8-5, растворяют в метаноле (430,0 мл). Метиламин (9,8 M раствор в этаноле) (87,8 мл, 860,0 ммоль) добавляют к полученному раствору и затем перемешивают при комнатной температуре в течение 30 минут. Боргидрид натрия (16,3 г, 430,0 ммоль) добавляют к реакционной смеси и перемешивают при комнатной температуре в течение 30 минут. Воду добавляют к реакционной смеси и затем экстрагируют этилацетатом. Полученный экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:2 (об./об.)) с получением 15,2 г указанного в заголовке соединения. (Выход: 86,1%)
1H-ЯМР (500 МГц, CDCl3): 7,39-7,35 (м, 1H), 7,26-7,20 (м, 2H), 7,15 (кв, 1H), 7,06 (д, 1H), 6,87 (т, 1H), 6,78 (т, 1H), 3,60 (д, 2H), 3,44 (с, 3H), 2,45 (с, 3H)
(Стадия 8-7) Получение гидрохлорида 1-(5-(2,4-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметана
1-(5-(2,4-дифторфенил)-4-метокси-1-((3-фторфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин (15,0 г, 36,6 ммоль), полученный на стадии 8-6, растворяют в этилацетате (36,6 мл) и затем туда добавляют раствор хлористоводородной кислоты (2,0 M раствор в диэтиловом эфире) (36,6 мл, 73,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и затем фильтруют. Полученное твердое вещество сушат при пониженном давлении с получением 15,1 г указанного в заголовке соединения. (Выход: 92,5%).
Молекулярная масса: 446,87
1H-ЯМР (500 МГц, MeOD): 7,69 (с, 1H), 7,58-7,53 (м, 1H), 7,45 (т, 1H), 7,30 (д, 1H), 7,20-7,15 (м, 2H), 7,02-6,94 (м, 2H), 4,07 (д, 2H), 3,46 (с, 3H), 2,71 (с, 3H)
Пример 22: Получение гидрохлорида 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
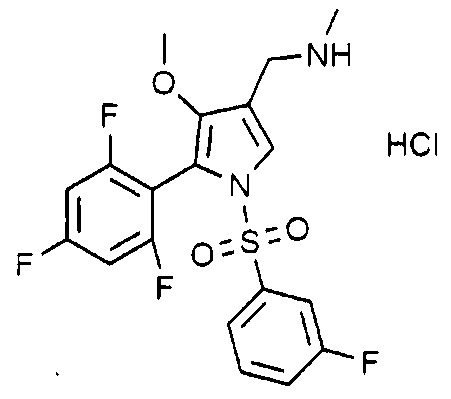
(Стадия 22-1) Получение метил 4-ацетокси-1-ацетил-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилата
Цианид натрия (16,1 г, 327,9 ммоль) и хлорид аммония (17,5 г, 327,9 ммоль) добавляют к воде (156 мл) и затем перемешивают при комнатной температуре в течение 10 минут. Раствор 2,4,6-трифторбензальдегида (50,0 г, 312,3 ммоль) в метаноле (156,0 мл) добавляют к реакционной смеси и затем перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь концентрируют при пониженном давлении и затем экстрагируют дихлорметаном. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. 6 N водный раствор хлористоводородной кислоты (312,0 мл) добавляют к полученному остатку и кипятят с обратным холодильником при 100°C в течение 48 часов. Реакционную смесь охлаждают до комнатной температуры и затем сушат при пониженном давлении с получением 2,4,6-трифтор-фенилглицина.
Полученный 2,4,6-трифторфенилглицин, диметил-2-(метоксиметилен)малонат (61,5 г, 272,7 ммоль) и ацетат натрия (24,6 г, 300,0 ммоль) растворяют в метаноле (300,0 мл) и затем кипятят с обратным холодильником при 60°C в течение 4 часов. Реакционную смесь охлаждают до 0°C и затем фильтруют. Уксусный ангидрид (900,0 мл) и триэтиламин (300,0 мл) добавляют к фильтрату. Реакционную смесь кипятят с обратным холодильником при 140°C в течение 30 минут и затем охлаждают до 0°C. Ледяную воду (900,0 мл) добавляют к реакционной смеси при 0°C, перемешивают при комнатной температуре в течение одного часа и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 10,3 г указанного в заголовке соединения. (Выход: 9,3%)
1H-ЯМР (500 МГц, CDCl3): 7,86 (с, 1H), 6,75-6,75 (кв, 3H), 3,82 (с, 3H), 2,55 (с, 3H), 2,17 (с, 3H)
(Стадия 22-2) Получение метил 4-гидрокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилата
Тетрагидрофуран (24,0 мл) и воду (6,0 мл) добавляют к метил 4-ацетокси-1-ацетил-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилату (10,0 г, 28,1 ммоль), полученному на стадии 22-1. Реакционную смесь охлаждают до 0°C, туда добавляют гидроксид натрия (2,3 г, 56,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, нейтрализуют с применением 1 N водного раствора хлористоводородной кислоты и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 4,7 г указанного в заголовке соединения. (Выход: 61,7%)
1H-ЯМР (500 МГц, CDCl3): 8,18 (с, 1H), 7,87 (с, 1H), 7,23 (д, 1H), 6,76 (т, 3H), 3,87 (с, 3H)
(Стадия 22-3) Получение метил 4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилата
Метил 4-гидрокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилат (4,5 г, 16,6 ммоль), полученный на стадии 22-2, добавляют к тетрагидрофурану (83,0 мл) и метанолу (33,2 мл). (Триметилсилил)диазометан(2,0 M раствор в диэтиловом эфире) (33,2 мл) добавляют к полученному раствору и затем перемешивают при комнатной температуре в течение 48 часов. Воду добавляют к реакционной смеси и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 3,9 г указанного в заголовке соединения. (Выход: 81,3%)
1H-ЯМР (500 МГц, CDCl3): 8,17 (с, 1H), 7,39 (д, 1H), 6,7 (т, 2H), 3,86 (с, 3H), 3,84 (с, 3H)
(Стадия 22-4) Получение метил 1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилата
Метил 4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилат (3,8 г, 13,3 ммоль), полученный на стадии 22-3, растворяют в диметилформамиде (150,0 мл). Гидрид натрия (60% дисперсия в жидком парафине) (0,78 г, 20,0 ммоль) добавляют к полученному раствору при комнатной температуре и затем перемешивают при комнатной температуре в течение 10 минут. 3-фтор-бензолсульфонилхлорид (2,64 мл, 20,0 ммоль) добавляют к реакционной смеси и перемешивают при комнатной температуре в течение 1 часа. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:4 (об./об.)) с получением 4,4 г указанного в заголовке соединения. (Выход: 74,1%)
1H-ЯМР (500 МГц, CDCl3): 8,01 (с, 1H), 7,47-7,43 (м, 1H), 7,35-7,30 (м, 2H), 7,15 (д, 1H), 6,69 (т, 2H), 3,87 (с, 3H), 3,67 (с, 3H)
(Стадия 22-5) Получение 1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбальдегида
Метил 1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбоксилат (4,3 г, 9,7 ммоль), полученный на стадии 22-4, растворяют в тетрагидрофуране (100,0 мл). Гидрид диизобутилалюминия (1,0 M раствор в тетрагидрофуране) (29,1 мл, 29,1 ммоль) добавляют к полученному раствору при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, нейтрализуют с применением 1N водного раствора хлористоводородной кислоты и затем экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении.
Полученный остаток растворяют в дихлорметане (100,0 мл), туда добавляют целит (4,3 г) и хлорхромат пиридиния (6,3 г, 29,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и затем фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат:н-гексан=1:2 (об./об.)) с получением 1,8 г указанного в заголовке соединения. (Выход: 44,9%)
1H-ЯМР (500 МГц, CDCl3): 9,89 (с, 1H), 8,01 (с, 1H), 7,49-7,45 (м, 1H), 7,37-7,31 (м, 2H), 7,15 (д, 1H), 6,70 (т, 2H), 3,68 (с, 3H)
(Стадия 22-6) Получение 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-карбальдегид (1,5 г, 3,6 ммоль), полученный на стадии 22-5, растворяют в метаноле (35,0 мл). Метиламин (9,8 M раствор в метаноле) (7,4 мл, 72,6 ммоль) добавляют к полученному раствору и перемешивают при комнатной температуре в течение 30 минут. Боргидрид натрия (1,4 г, 36,3 ммоль) добавляют к реакционной смеси и перемешивают при комнатной температуре в течение 30 минут. Воду добавляют к реакционной смеси и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (дихлорметан:метанол=10:1 (об./об.)) с получением 1,2 г указанного в заголовке соединения. (Выход: 84,9%)
1H-ЯМР (500 МГц, MeOD): 7,51-7,52 (м, 1H), 7,47 (с, 1H), 7,43 (т, 1H), 7,36 (д, 1H), 7,23 (д, 1H), 6,91 (т, 2H), 3,59 (с, 2H), 3,50 (с, 3H), 2,39 (с, 3H)
(Стадия 22-7) Получение гидрохлорида 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин (1,2 г, 3,1 ммоль), полученный на стадии 22-6, растворяют в этилацетате (5,0 мл). Раствор хлористоводородной кислоты (2,0 M раствор в диэтиловом эфире) (3,1 мл, 6,1 ммоль) добавляют к полученному раствору, перемешивают при комнатной температуре в течение 1 часа и затем фильтруют. Полученное твердое вещество сушат при пониженном давлении с получением 1,1 г указанного в заголовке соединения. (Выход: 77,6%)
Молекулярная масса: 464,86
1H-ЯМР (500 МГц, MeOD): 7,64 (с, 1H), 7,60-7,56 (м, 1H), 7,49 (т, 1H), 7,37 (д, 1H), 7,26 (д, 1H), 6,95 (т, 2H), 4,08 (с, 2H), 3,52 (с, 3H), 2,70 (с, 3H)
Указанные в заголовках соединения следующих дополнительных примеров получают способом получения, таким как описан в примерах выше, однако их получают подходящей заменой исходных материалов в соответствии со структурой получаемых соединений, со ссылкой на схемы реакций 1-3 в описании.
Пример 1: Получение гидрохлорида 1-(5-(2-фторфенил)-4-метокси-1-((3-хлорфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
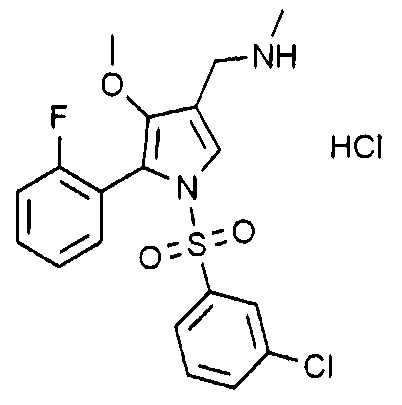
Молекулярная масса: 445,33
1H-ЯМР (500 МГц, CD3OD): 7,69 (д, 1H), 7,66 (с, 1H), 7,54 (кв, 1H), 7,49 (т, 1H), 7,40 (д, 1H), 7,28 (с, 1H), 7,21 (т, 1H), 7,15 (т, 1H), 7,08 (т, 1H), 4,05 (с, 2H), 3,44 (с, 3H), 2,70 (с, 3H)
Пример 3: Получение гидрохлорида 1-(5-(2-фторфенил)-4-метокси-1-((3-метоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
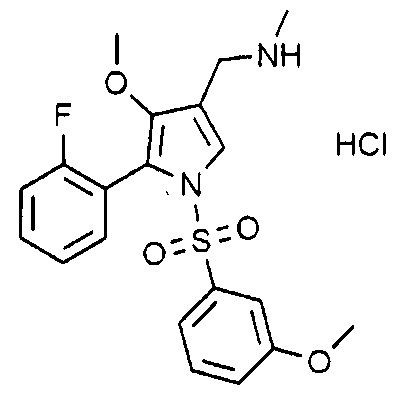
Молекулярная масса: 440,91
1H-ЯМР (500 МГц, CD3OD): 7,67 (с, 1H), 7,50 (кв, 1H), 7,38 (т, 1H), 7,15-7,22 (м, 2H), 7,02-7,12 (м, 3H), 6,83 (с, 1H), 4,08 (с, 2H), 3,75 (с, 3H), 3,48 (с, 3H), 2,71 (с, 3H)
Пример 4: Получение гидрохлорида 1-(5-(2-фторфенил)-4-метокси-1-((3-дифторметоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
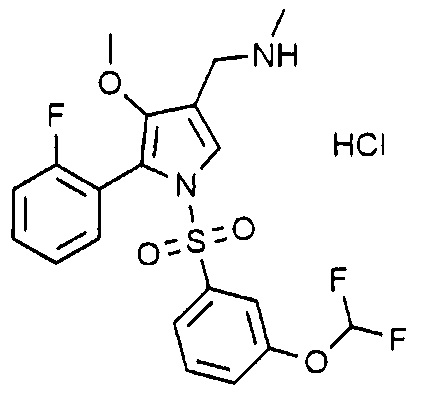
Молекулярная масса: 476,9
1H-ЯМР (500 МГц, CD3OD): 7,70 (с, 1H), 7,52-7,55 (м, 2H), 7,46 (д, 1H), 7,33 (д, 1H), 7,18 (т, 1H), 7,11-7,13 (м, 2H), 7,06 (т, 1H), 6,88 (т, 1H), 4,09 (с, 2H), 3,43 (с, 3H), 2,71 (с, 3H)
Пример 5: Получение гидрохлорида 1-(5-(2-хлорфенил)-4-метокси-1-((3-метоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
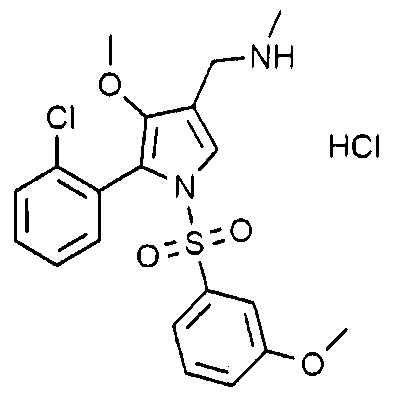
Молекулярная масса: 457,37
1H-ЯМР (500 МГц, CD3OD): 7,66 (с, 1H), 7,45 (т, 1H), 7,36-7,40 (м, 2H), 7,32 (т, 1H), 7,23 (д, 1H), 7,20 (дд, 1H), 7,04 (д, 1H), 6,82 (т, 1H), 4,08 (с, 2H), 3,76 (с, 3H), 3,41 (с, 3H), 2,71 (с, 3H)
Пример 6: Получение гидрохлорида 1-(5-(2-фтор-4-хлорфенил)-4-метокси-1-((3-хлорфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
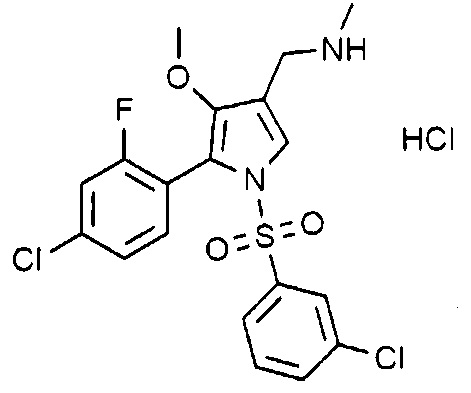
Молекулярная масса: 479,77
1H-ЯМР (500 МГц, CD3OD): 7,70-7,72 (м, 2H), 7,52 (т, 1H), 7,44 (д, 1H), 7,31 (т, 1H), 7,27 (дд, 1H), 7,21 (дд, 1H), 7,15 (т, 1H), 4,08 (с, 2H), 3,46 (с, 3H), 2,71 (с, 3H)
Пример 7: Получение гидрохлорида 1-(5-(2-фтор-4-хлорфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамина
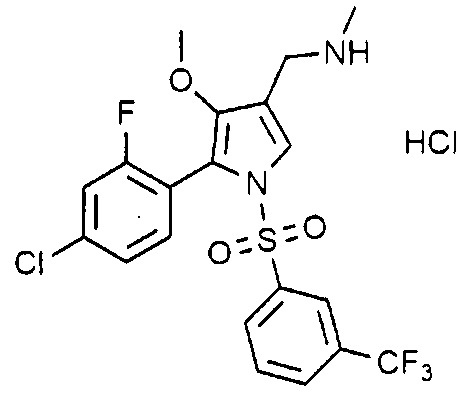
Молекулярная масса: 513,33
1H-ЯМР (500 МГц, CDCl3): 7,81 (д, 1H), 7,69 (д, 1H), 7,59-7,55 (м, 2H), 7,33 (с, 1H), 7,16-7,11 (м, 2H), 7,05 (д, 1H), 3,63 (с, 2H), 3,45 (с, 3H), 2,46 (с, 3H)
Пример 9: Получение гидрохлорида 1-(5-(2,4-дифторфенил)-1-((3-(трифторметил)фенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
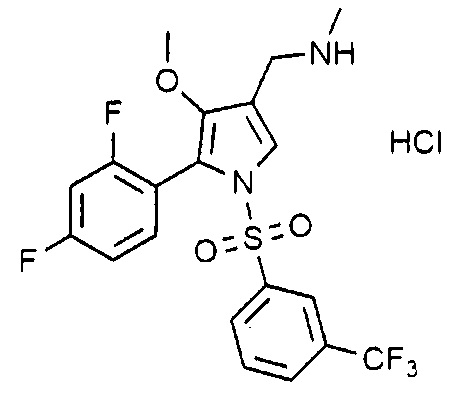
Молекулярная масса: 496,88
1H-ЯМР (500 МГц, CDCl3): 7,91 (д, 1H), 7,83 (д, 1H), 7,66 (т, H), 7,53 (с, 1H), 7,18-7,13 (кв, 1H), 6,88 (т, 1H), 6,74 (т, 1H), 4,04 (с, 2H), 3,43 (с, 3H), 2,67 (с, 3H)
Пример 10: Получение гидрохлорида 1-(5-(2,4-дифторфенил)-1-((3-метилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
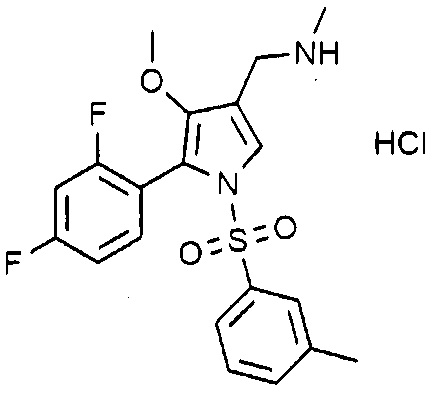
Молекулярная масса: 442,91
1H-ЯМР (500 МГц, CDCl3): 7,78 (с, 1H), 7,46 (с, 1H), 7,36-7,20 (м, 3H), 7,15-7,10 (кв, 1H), 6,86 (т, 1H), 6,74 (т, 1H), 4,03 (с, 2H), 3,47 (с, 3H), 2,65 (т, 3H), 2,33 (с, 3H)
Пример 11: Получение гидрохлорида 1-(5-(2,4-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
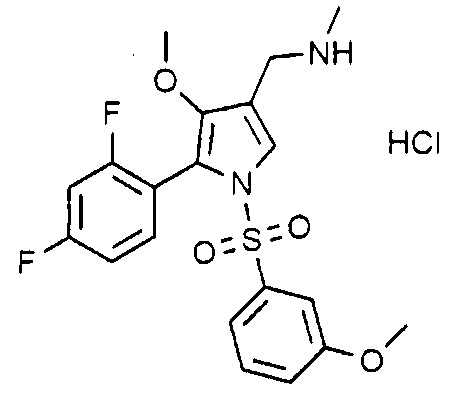
Молекулярная масса: 458,9
1H-ЯМР (500 МГц, ДМСО): 7,78 (д, 1H), 7,36 (м, 1H), 7,20-7,05 (м, 3H), 6,87 (м, 2H), 6,74 (т, 1H), 4,03 (д, 2H), 3,75 (д, 3H), 3,42 (д, 3H), 2,65 (с, 3H)
Пример 12: Получение гидрохлорида 1-(5-(2,4-дифторфенил)-1-((3-дифторметоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
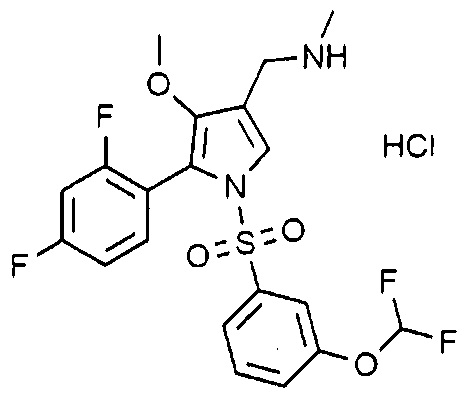
Молекулярная масса: 494,89
1H-ЯМР (500 МГц, CDCl3): 7,41 (м, 1H), 7,36 (с, 1H), 7,31 (д, 2H), 7,15-7,13 (м, 2H), 6,87 (т, 1H), 6,77 (т, 1H), 6,65-6,37 (т, 1H), 3,67 (с, 2H), 3,44 (с, 3H), 2,48 (с, 3H)
Пример 13: Получение гидрохлорида 1-(5-(2,6-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
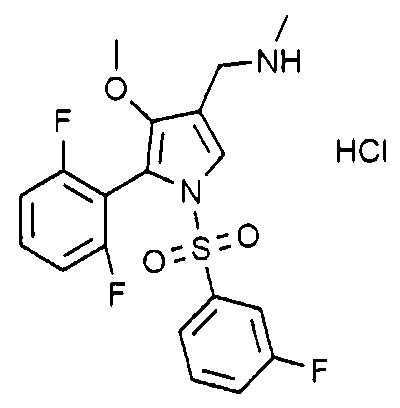
Молекулярная масса: 446,87
1H-ЯМР (500 МГц, CD3OD): 7,74 (с, 1H), 7,53-7,61 (м, 2H), 7,47 (т, 1H), 7,33 (д, 1H), 7,18 (д, 1H), 7,01 (т, 2H), 4,07 (с, 2H), 3,50 (с, 3H), 2,71 (с, 3H)
Пример 14: Получение гидрохлорида 1-(5-(2,6-дифторфенил)-1-((3-хлорфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
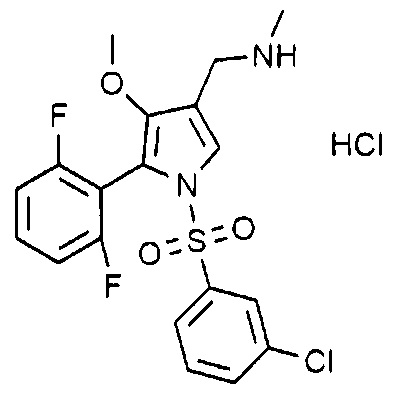
Молекулярная масса: 463,32
1H-ЯМР (500 МГц, CD3OD): 7,75 (с, 1H), 7,71 (д, 1H), 7,59-7,62 (м, 1H), 7,51 (т, 1H), 7,46 (д, 1H), 7,36 (с, 1H), 7,02 (т, 2H), 4,08 (с, 2H), 3,50 (с, 3H), 2,71 (с, 3H)
Пример 15: Получение гидрохлорида 1-(5-(2,6-дифторфенил)-1-((3-(трифторметил)фенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
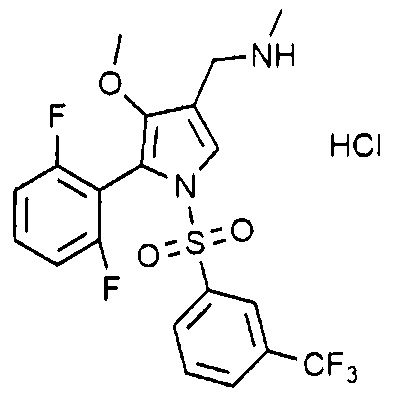
Молекулярная масса: 466,85
1H-ЯМР (500 МГц, CD3OD): 8,03 (д, 1H), 7,83 (д, 1H), 7,76 (т, 1H), 7,64 (с, 1H), 7,59 (т, 1H), 6,99 (т, 1H), 4,05 (с, 2H), 3,49 (с, 3H), 2,69 (с, 3H)
Пример 16: Получение фумарата 1-(5-(2,6-дифторфенил)-1-((3-метилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
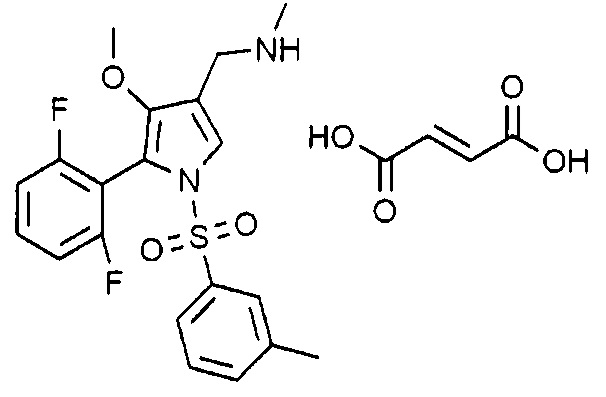
Молекулярная масса: 522,52
1H-ЯМР (500 МГц, CD3OD): 7,70 (д, 1H), 7,57 (т, 1H), 7,49 (д, 1H), 7,37 (т, 1H), 7,30 (д, 1H), 7,19 (с, 1H), 6,97 (т, 2H), 6,67 (с, 2H), 4,60 (с, 3H), 4,04 (д, 2H), 3,48 (с, 3H), 2,69 (т, 3H), 2,33 (с, 3H)
Пример 17: Получение гидрохлорида 1-(5-(2,6-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
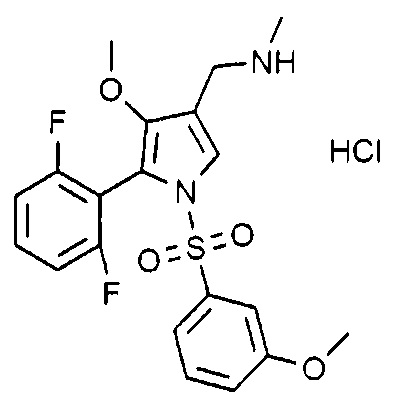
Молекулярная масса: 458,9
1H-ЯМР (500 МГц, CD3OD): 7,71 (д, 1H), 7,57 (т, 1H), 7,39 (т, 1H), 7,22 (д, 1H), 7,08 (д, 1H), 6,99 (т, 1H), 6,90 (с, 1H), 4,03 (д, 2H), 3,77 (с, 3H), 3,49 (с, 3H), 2,68 (д, 3H)
Пример 18: Получение гидрохлорида 1-(5-(2,6-дифторфенил)-1-((3-хлор-4-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
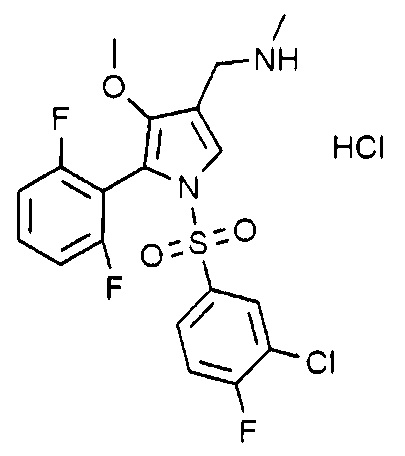
Молекулярная масса: 481,31
1H-ЯМР (500 МГц, CD3OD): 7,71 (с, 1H), 7,65-7,57 (м, 1H), 7,58-7,50 (м, 2H), 7,45 (т, 1H), 7,05 (т, 2H), 4,03 (с, 2H), 3,50 (с, 3H), 2,72 (с, 3H)
Пример 19: Получение гидрохлорида 1-(5-(2,6-дифторфенил)-1-((3,4-дифторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
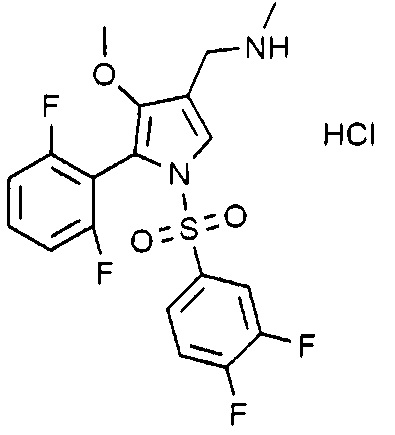
Молекулярная масса: 464,86
1H-ЯМР (500 МГц, CD3OD): 7,73 (с, 1H), 7,61 (т, 1H), 7,58-7,02 (м, 4H), 7,02 (т, 2H), 4,07 (с, 1H), 3,50 (с, 3H), 2,71 (с, 3H)
Пример 20: Получение гидрохлорида 1-(5-(2-фтор-6-хлорфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
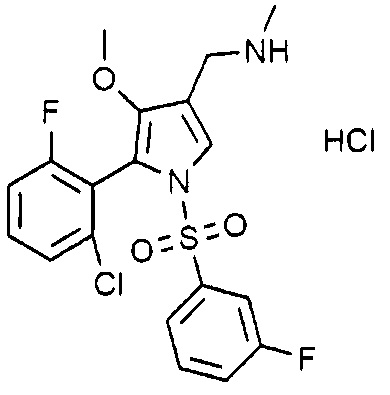
Молекулярная масса: 463,32
1H-ЯМР (500 МГц, CD3OD): 7,54-7,48 (м, 3H), 7,42 (т, 1H), 7,35 (д, 1H), 7,27 (д, 1H), 7,17 (д, 1H), 7,12 (т, 1H), 3,65 (с, 2H), 3,45 (с, 3H), 2,43 (с, 3H)
Пример 21: Получение гидрохлорида 1-(5-(2-фтор-6-хлорфенил)-1-((3-хлорфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
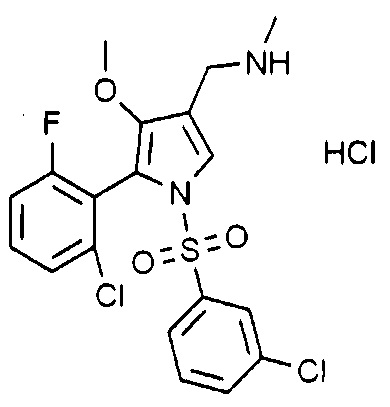
Молекулярная масса: 479,77
1H-ЯМР (500 МГц, CD3OD): 7,70 (с, 2H), 7,56-7,55 (м, 3H), 7,51-7,48 (м, 1H), 7,30 (д, 1H), 7,18-7,16 (м, 1H), 4,60 (с, 2H), 4,00 (с, 3H), 2,66 (с, 3H)
Пример 23: Получение гидрохлорида 1-(1-((3-хлорфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
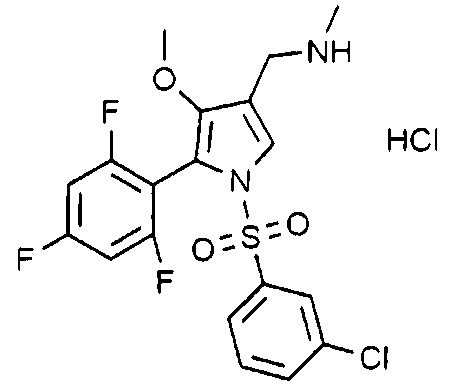
Молекулярная масса: 481,31
1H-ЯМР (500 МГц, CD3OD): 7,74-7,72 (м, 2H), 7,54 (т, 1H), 7,50 (д, 1H), 7,43 (т, 1H), 6,95 (т, 1H), 4,05 (с, 2H), 3,53 (с, 3H), 2,69 (с, 3H)
Пример 24: Получение гидрохлорида 1-(1-((3-трифторметилфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
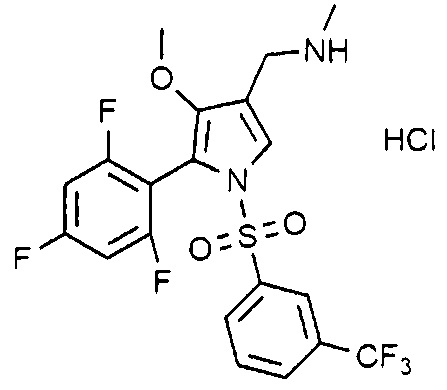
Молекулярная масса: 514,87
1H-ЯМР (500 МГц, CD3OD): 8,05 (д, 1H), 7,87 (д, 1H), 7,88-7,78 (м, 2H), 7,69 (с, 1H), 6,94-6,91 (м, 2H), 4,07 (с, 2H), 3,52 (с, 3H), 2,70 (с, 3H)
Пример 25: Получение гидрохлорида 1-(1-((3-метоксифенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
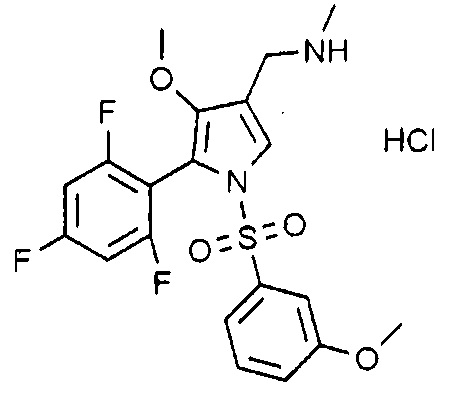
Молекулярная масса: 476,90
1H-ЯМР (500 МГц, CD3OD): 7,74 (с, 1H), 7,44 (т, 1H), 7,25 (д, 1H), 7,12 (д, 1H), 6,95-6,91 (м, 3H), 4,07 (с, 2H), 3,80 (с, 3H), 3,52 (с, 3H), 2,71 (с, 3H)
Пример 26: Получение гидрохлорида 1-(1-((3,4-дифторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
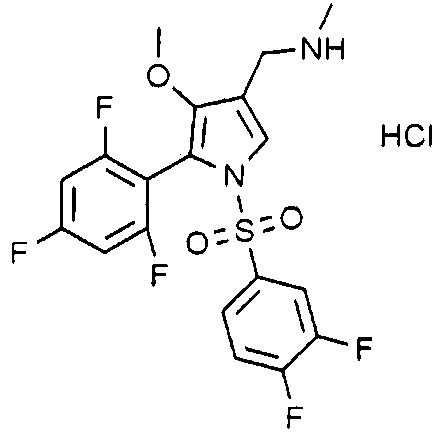
Молекулярная масса: 482,85
1H-ЯМР (500 МГц, CD3OD): 7,73 (с, 1H), 7,52-7,48 (м, 2H), 7,41-7,39 (м, 1H), 6,99-6,96 (м, 2H), 4,07 (с, 2H), 3,52 (с, 3H), 2,69 (с, 3H)
Пример 27: Получение гидрохлорида 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
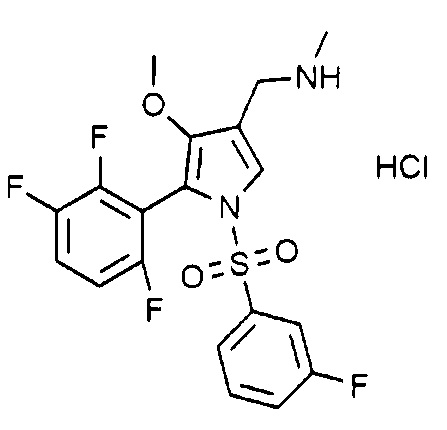
Молекулярная масса: 464,86
1H-ЯМР (500 МГц, CD3OD): 7,61 (с, 1H), 7,60~7,49 (м, 3H), 7,25 (д, 1H), 4,08 (с, 2H), 3,53 (с, 3H), 2,72 (с, 3H)
Пример 28: Получение гидрохлорида 1-(1-((3-хлорфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
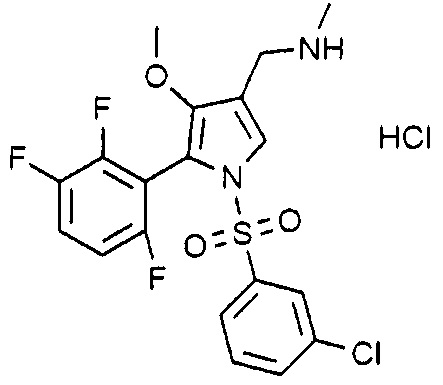
Молекулярная масса: 481,31
1H-ЯМР (500 МГц, CD3OD): 7,78 (с, 1H), 7,74 (д, 1H), 7,73~7,48 (м, 3H), 7,42 (д, 1H), 4,08 (с, 2H), 3,53 (с, 3H), 2,72 (с, 3H)
Пример 29: Получение гидрохлорида 1-(1-((3-трифторметилфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
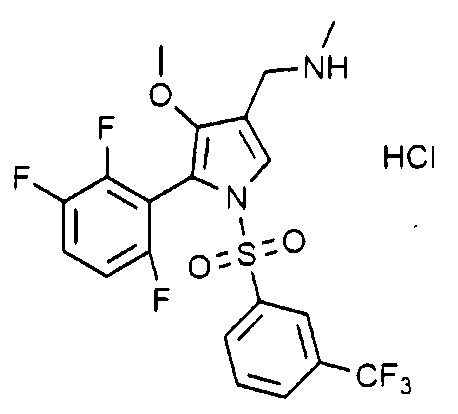
Молекулярная масса: 514,87
1H-ЯМР (500 МГц, CD3OD): 8,55 (д, 1H), 7,87~7,77 (м, 3H), 7,68 (с, 1H), 7,55~7,52 (м, 1H), 7,03~6,99 (м, 1H), 4,09 (с, 2H), 3,52 (с, 3H), 2,71 (с, 3H)
Пример 30: Получение гидрохлорида 1-(1-((3-метоксифенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамина
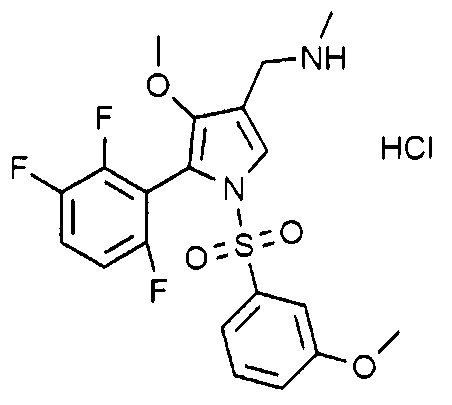
Молекулярная масса: 476,9
1H-ЯМР (500 МГц, CD3OD): 7,77 (с, 1H), 7,54~7,48 (м, 1H), 7,43 (т, 1H), 7,26 (д, 1H), 7,11 (д, 1H), 7,04~6,99 (м, 1H), 6,93 (с, 1H), 4,89 (с, 2H), 3,79 (с, 3H), 3,52 (с, 3H), 2,71 (с, 3H)
Пример 31: Получение гидрохлорида 1-(5-(2,5-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
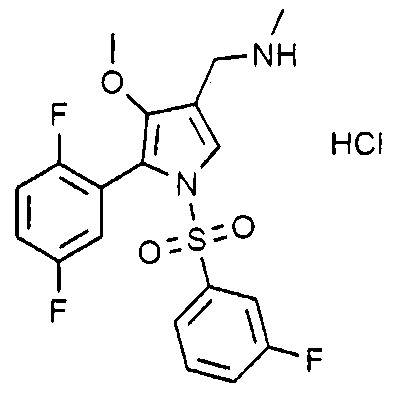
Молекулярная масса: 446,87
1H-ЯМР (500 МГц, CD3OD): 7,71 (с, 1H), 7,54-7,58 (м, 1H), 7,47 (т, 1H), 7,32 (д, 1H), 7,27-7,30 (м, 1H), 7,18 (д, 1H), 7,08-7,12 (м, 1H), 6,90-6,93 (м, 1H), 4,08 (с, 2H), 3,49 (с, 3H), 2,72 (с, 3H)
Пример 32: Получение гидрохлорида 1-(5-(2,5-дифторфенил)-1-((3-трифторметилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
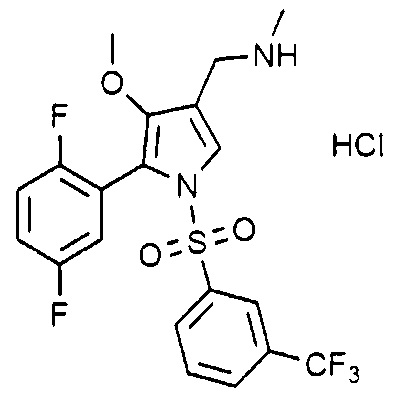
Молекулярная масса: 496,88
1H-ЯМР (500 МГц, CD3OD): 8,02 (д, 1H), 7,84 (д, 1H), 7,76-7,79 (м, 2H), 7,62 (с, 1H), 7,26-7,30 (м, 1H), 7,05-7,10 (м, 1H), 6,91-6,94 (м, 1H), 4,09 (с, 2H), 3,47 (с, 3H), 2,71 (с, 3H)
Пример 33: Получение гидрохлорида 1-(5-(2,5-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамина
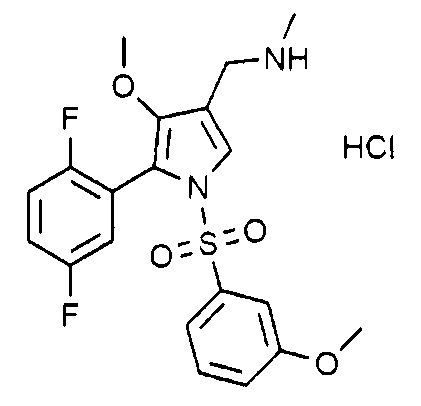
Молекулярная масса: 458,9
1H-ЯМР (500 МГц, CD3OD): 7,71 (с, 1H), 7,42 (т, 1H), 7,22-7,27 (м, 2H), 7,07-7,10 (м, 2H), 6,89 (т, 1H), 6,82-6,86 (м, 1H), 4,08 (с, 2H), 3,78 (с, 3H), 3,48 (с, 3H), 2,71 (с, 3H)
Тестовый пример 1: Ингибирующее действие на активность протонного насоса (H+/K+-АТФаза)
Ингибирующее действие на активность протонного насоса (H+/K+-АТФаза) соединений, полученных в примерах 2, 8 и 22, измеряют следующим образом.
Гастрические носители получают из желудка свиньи известным способом (Edd C. Rabon et al., Preparation of Gastric H+,K+-ATPase., Methods in enzymology, vol,157 Academic Press Inc.,(1988), pp,649-654). Содержание белка полученных гастрических носителей количественно измеряют с применением набора с бицинхониновой кислотой (БХК) (Thermo Co.).
80 мкл (заданная концентрация тестируемого соединения, 0,5% ДМСО, 2,5 мМ MgCl2, 12,5 мМ KCl, 1,25 мМ ЭДТК, 60 мМ Tris-HCl, pH 7,4) добавляют в каждую лунку 96-луночного планшета. 10 мкл реакционного раствора, содержащего гастрические носители (60 ммоль/л, Tris-HCl буферный раствор, pH 7,4) и 10 мкл раствора Tris буфера, содержащего аденозинтрифосфат (10 мМ АТФ, Tris-HCl буферный раствор, pH 7,4) добавляют в каждую лунку и подвергают ферментной реакции при 37°C в течение 40 минут. Туда добавляют 50 мкл раствора малахитового зеленого (0,12% раствор малахитового зеленого в 6,2 N серной кислоте, 5,8% аммония-молибдена и 11% Tween 20, смешанный в соотношении 100:67:2) для остановки ферментной реакции, и туда добавляют 50 мкл 15,1% цитрата натрия. Количество монофосфата (Pi) в реакционном растворе измеряют при 570 нм с применением микропланшетного ридера (FLUOstar Omega, BMG Co.). Степень ингибирования (%) измеряют из значения активности контрольной группы и значения активности тестируемого соединения в различных концентрациях и концентрацию (IC50), которая ингибирует активность H+/K+-АТФазы на 50% рассчитывают из каждого значения % ингибирования соединений с применением логарифмической 4-параметрической функции программы Sigmaplot 8,0. Результаты показаны в таблице 1 ниже.
Таблица 1
Тестовый пример 2. Ингибирующее действие на базальную секрецию желудочного сока у крыс с лигированным привратником.
Ингибирующее действие соединений, полученных в примерах 2, 8 и 22, на базальную секрецию желудочного сока измеряют на крысиной модели Шея (Shay, H., et al., 1945, gastroenterology, 5, p43-61). Самцов крыс Sprague Dawley (SD) (масса тела 180-220 г) делят на 4 группы (n=6-7) и держат голодными в течение 18 часов при свободном доступе к воде. Под анестезией изофлураном брюшину крыс рассекают и затем лигируют привратник. Сразу после лигирования контрольной группе вводят 2 мл/кг 0,5% водного раствора метилцеллюлозы (МЦ) в двенадцатиперстную кишку, и другим группам вводят тестируемые соединения, суспендированные в 0,5% водном растворе метилцеллюлозы (МЦ) в дозе 2,0 мг/кг/2 мл. Через 5 часов после лигирования тестируемых животных умерщвляют и удаляют содержимое желудка. Удаленное содержимое центрифугируют при 4000×g в течение 10 минут, и надосадочную жидкость отделяют с получением желудочного сока. Количество и pH желудочного сока измеряют, и кислотность желудочного сока измеряют 0,1 N объемом NaOH (мэкв/мл), требуемым для титрования желудочного сока до pH 7,0. Общую кислотную продукцию измеряют умножением кислотности желудочного сока на количество желудочного сока. % ингибирующего действия тестируемых соединений рассчитывают согласно следующему уравнению, и результаты показаны в таблице 2.
Уравнение 1
% ингибирующего действия тестируемого соединения=[(общая кислотная продукция контрольной группы - общая кислотная продукция группы, леченной тестируемыми соединениями)/общая кислотная продукция контрольной группы] × 100
Таблица 2
Тестовый пример 3: Ингибирующее действие на повреждение желудка, вызванное индометацином у крыс
Ингибирующее действие на повреждение желудка соединений, полученных в примерах 2 и 8 измеряют с применением модели индометацина (Chiou., Et al., 2005, gastroenterology, 128, p63-73). Самцов крыс Sprague Dawley (SD) (масса тела 180-220 г) делят на 5 групп (n=10) и держат голодными в течение 24 часов при свободном доступе к воде. Контрольной группе перорально вводят 5 мл/кг 0,5% водного раствора метилцеллюлозы (MC) и другим группам перорально вводят тестируемые соединения, суспендированные в 0,5% водном растворе метилцеллюлозы (MC) в дозе 2,0 мг/кг/5 мл. Для сравнения соединение из примера 134 (сравнительный пример 1) и соединение из примера 165 (сравнительный пример 2) в публикации международного патента № WO2006/036024 перорально вводят в дозе 2,0 мг/кг/5 мл, суспендируя в 0,5% водном растворе метилцеллюлозы (MC), соответственно. Через 1 час после перорального введения перорально вводят индометацин в дозе 80 мг/кг/10 мл. Через 4 часа 30 минут тестируемых животных умерщвляют для удаления желудка. Поверхность удаленных желудков промывают солевым раствором и затем отсекают половину вдоль большой кривизны желудка. Рассеченный желудок помещают в зажим, фиксируют фиксирующим штифтом, раскладывая с усилием и затем измеряют площадь повреждения желудка. % ингибирующего действия тестируемых соединений рассчитывают согласно уравнению 2, и результаты показаны в таблице 3.
Уравнение 2
% ингибирующего действия тестируемого соединения=[1-(% площади повреждения желудка группы, леченной тестируемыми соединениями)/(% площади повреждения желудка контрольной группы)] × 100
Таблица 3
Тестовый пример 4: Противомикробное действие против H. pylori
Противомикробное действие против H. pylori соединений, полученных в примерах 8 и 22 оценивают измерением значений минимальной ингибирующей концентрации (МИК) через тестирование чувствительности методом разведений в агаре. Штаммы H. pylori получают из банка выделенных штаммов Helicobacter (HpKTCC, KNMRRC) в Microbiology Classroom of the Professional Graduate School of Medicine in Gyeongsang National University, South Korea. Тестируемый материал, растворенный в ДМСО, подвергают двукратному серийному разведению стерильным буфером с получением раствор образца. В это время каждую концентрацию серийно разведенного раствора корректируют до 10-кратной концентрации, применяемой для тестирования чувствительности. Таким образом, концентрацию корректируют так, чтобы добавлять в объеме 1/10 во время получения среды. При нагревании резервуара для воды до 55-60°C, 5 мл раствора образца с каждой концентрацией серийно разбавленного раствора, нагретого до той же температуры, добавляют в агарную среду Brucella (каждая 45 мл аликвота), содержащую 10% бычью сыворотку и готовят до конечной тестируемой концентрации (тестируемая концентрация: 5000 мкг/мл, 2500 мкг/мл, 1250 мкг/мл, 625 мкг/мл, 312,5 мкг/мл, 150 мкг/мл, 75 мкг/мл, 37,5 мкг/мл, 18,75 мкг/мл, 9 мкг/мл, 4,5 мкг/мл, 2,25 мкг/мл). Перед затвердеванием среды ее делят и распределяют в две чашки Петри с получением агарной среды для планшеты. H. pylori, культивированные в агарной среде Brucella, готовят в каждой бактериальной суспензии с ФРФБ (5,0×108 КОЕ/мл) и распределяют в ячейку множественного инокулятора Steers. Бактерии инокулируют на поверхность планшетной среды от стороны с низкой концентрацией вещества в направлении стороны с высокой концентрацией вещества с применением множественного инокулятора Steers. После культивирования в 10% CO2 инкубаторе при 37°C в течение 5 дней присутствие или отсутствие роста каждой бактерии визуально идентифицируют для определения минимальной ингибирующей концентрации (МИК, наименьшей концентрации, при которой бактерии не наблюдаются). Результаты показаны в таблицах 4 и 5 ниже.
Таблица 4
Таблица 5
Тестовый пример 5: Ингибирующее действие на вызванное 100% этанолом (EtOH) повреждение желудка у крыс и эффект усиления защитных факторов (слизь)
Ингибирующее действие и эффект усиления защитного фактора соединение, полученным в примере 8, измеряют с применением модели вызванного 100% этанолом (EtOH) повреждения желудка (Paul V. Tan et al., 2002, Journal of Ethnopharmacology, 82, p 69-74). Самцов крыс Sprague Dawley (SD) (масса тела 180-200 г) держат голодными в течение 24 часов при свободном доступе к воде. Контрольной группе перорально вводят 5 мл/кг 0,5% водный раствор метилцеллюлозы (МЦ), и другим группам перорально вводят тестируемые соединения, суспендированные в 0,5% водном растворе МЦ в дозе 3,0, 10,0 и 30,0 мг/кг/5 мл. Для сравнения соединение из примера 134 (сравнительный пример 1), соединение из примера 165 (Сравнительный пример 2) и соединение из примера 166 (Сравнительный пример 3) в публикации международного патента № WO2006/036024 перорально вводят в той же дозе, суспендируя в 0,5% водном растворе МЦ, соответственно. Через 1 час после перорального введения перорально вводят 1 мл 100% EtOH. Через 1 час после введения EtOH тестируемых животных умерщвляют для удаления желудка. У десяти из 20 животных соскабливают слизь желудка с помощью предметного стекла, и содержимое слизи анализируют для расчета ED50. Результаты показаны в таблице 6. У оставшихся 10 животных поверхность удаленных желудков промывают солевым раствором и затем половину отсекают вдоль большой кривизны желудка. Рассеченный желудок помещают в зажим, фиксируют фиксирующим штифтом, раскладывая с усилием, и затем измеряют площадь повреждения желудка для расчета ED50. Результаты показаны в таблице 7.
Таблица 6
Таблица 7
Из результатов тестовых примеров 1-5 видно, что соединения в соответствии с данным изобретением обладают не только превосходным ингибирующим действием на протонный насос, ингибирующим действием на повреждения желудка и усиливающим защитный фактор действием, но также превосходным уничтожающим действием против H. pylori. В частности, соединение в соответствии с данным изобретением обладает не только превосходным ингибирующим действием на протонный насос, ингибирующим действием на повреждения желудка и усиливающим защитный фактор действием, но также превосходным уничтожающим действием против H. pylori по сравнению со структурно похожим соединением, например, соединением, не имеющим заместителей или замещенным метилом в положении 4 пиррола.
Тестовый пример 6. Ингибирующее действие на GPCR
Для подтверждения того, что соединения, полученные в примерах выше, действуют как агонисты или антагонисты цели GPCR, проводят анализ избыточного выделения кальция в аналитическом планшете, в который добавляют соединения, полученные в примерах, контрольный носитель и ссылочные соединения с применением ридера флуорометрической рентгенографической пластины (FLIPR tetra).
Анализ избыточного выделения кальция оценивают, передавая анализ профайлера GPCR в анализы панели безопасности Eurofins. С применением кальциевого красителя Fluo-8AM, возбуждение измеряют при длине волны от 470 до 495 нм, и испускание измеряют при длине волны в интервале 515-575 нм. GPCR аналитический буфер для анализа избыточного выделения кальция получают добавлением 20 мМ HEPES и 2,5 мМ Пробенецида в сбалансированный солевой раствор Хэнкса (ССРХ) до pH 7,4. Соединения из примеров для оценки GPCR разводят ДМСО в концентрации 10 мМ с получением исходного раствора, и затем готовят разведением в GPCR аналитическом буфере в концентрации, эквивалентной трехкратной конечной концентрации. Сначала для оценки GPCR ингибирующее действие соединений из примеров оценивают в единой концентрации 10 мкМ, и затем соответствующие выбранные цели четырехкратно разводят от 10 мкМ в нижнюю сторону для расчета 50% ингибирующей концентрации (IC50), с получением всего 8 концентраций 10, 2,5, 0,62, 0,15, 0,04, 0,01, 0,0024, 0,0006 мкм, и проводят анализ избыточного выделения кальция для GPCR. Для оценки агониста и антагониста, определяют % степени ингибирования активности GPCR до и после лечения соединениями и ингибирующее действие соединений из примеров.
В результате, если эффективность в отношении альфа-гет-5-ГТ и ацетилхолина соединений, полученных в примерах, была 100%, оценивают степень ингибирования (%) в единой концентрации 10 мкМ, результаты показаны в таблице 8. 50% ингибирующие концентрации (IC50, мкМ) для некоторых соединений, полученных в примерах, обладающих превосходной степенью ингибирования, рассчитывают и показывают в таблице 9 ниже.
Таблица 8
Таблица 9
Как показано в таблице 8, можно увидеть, что соединения, полученные в примерах, имеют высокую степень ингибирования в отношении 5-ГТ2A, M1 и M2 рецептором и, следовательно, могут применяться в качестве антагонистов этих рецепторов. Далее, как показано в таблице 9, соединения, имеющие высокую степень ингибирования в отношении 5-ГТ2A, M1 и M2 рецепторов, демонстрируют превосходное ингибирующее действие на рецепторы даже в незначительном количестве 3 мкМ или менее.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ ИНГИБИТОР КИСЛОТНОЙ СЕКРЕЦИИ И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2815697C1 |
| ПИРРОЛОХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ 5-НТ6 АНТАГОНИСТОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2013 |
|
RU2688161C2 |
| МОДУЛЯТОРЫ МОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ | 2019 |
|
RU2797323C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2734390C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2681849C2 |
| НОВОЕ ПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ, ОБЛАДАЮЩЕЕ ЭФФЕКТОМ ИНГИБИРОВАНИЯ РОСТА РАКОВЫХ КЛЕТОК, И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2744168C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-МЕТОКСИПИРРОЛА | 2019 |
|
RU2763287C1 |
| ПИРИДИЛДИМЕТИЛСУЛЬФОНОВОЕ ПРОИЗВОДНОЕ | 2006 |
|
RU2404968C2 |
| КОНДЕНСИРОВАННЫЕ КОЛЬЦЕВЫЕ ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ TRK | 2015 |
|
RU2708674C2 |
| ПИРРОЛОПИРИМИДИНЫ В КАЧЕСТВЕ ПОТЕНЦИАТОРОВ МВТР | 2017 |
|
RU2757457C2 |
Изобретение относится к производному 4-метоксипиррола формулы I, где R1, R2 и R3 каждый независимо является водородом или галогеном, при условии, что R1, R2 и R3 не могут быть водородом одновременно, и R4 и R5 каждый независимо является водородом, галогеном, C1-4 алкилом, C1-4 алкокси, C1-4 галоалкилом или C1-4 галоалкокси, при условии, что R4 и R5 не могут быть водородом одновременно, или его фармацевтически приемлемой соли и содержащим его фармацевтическим композициям. Производные 4-метоксипиррола или их фармацевтически приемлемые соли в соответствии с изобретением могут эффективно применяться для профилактики и лечения повреждений желудочно-кишечного тракта из-за язвы пищеварительного тракта, гастрита, рефлюкс-эзофагита или H. pylori. Также производные 4-метоксипиррола или их фармацевтически приемлемые соли обладают ингибирующим действием против GPCR и поэтому могут эффективно применяться для профилактики и лечения медиированных 5-ГТ рецептором или медиированных мускариновым рецептором ацетилхолина заболеваний. 3 н. и 13 з.п. ф-лы, 9 табл., 33 пр.
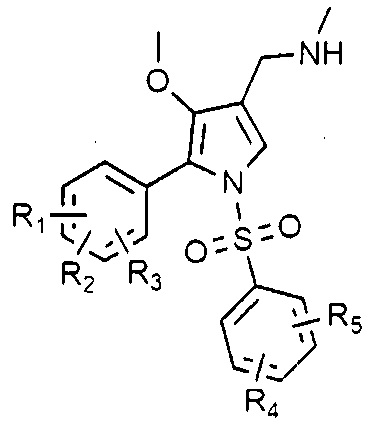
формула 1
1. Соединение, представленное следующей химической формулой 1, или его фармацевтически приемлемая соль:
Химическая формула 1
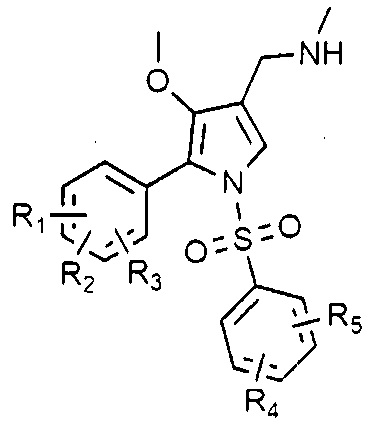
в химической формуле 1
R1, R2 и R3 каждый независимо является водородом или галогеном, при условии, что R1, R2 и R3 не могут быть водородом одновременно, и
R4 и R5 каждый независимо является водородом, галогеном, C1-4 алкилом, C1-4 алкокси, C1-4 галоалкилом или C1-4 галоалкокси, при условии, что R4 и R5 не могут быть водородом одновременно.
2. Соединение или его фармацевтически приемлемая соль по п.1,
где R1, R2 и R3 каждый независимо является водородом, фтором или хлором, при условии, что R1, R2 и R3 не могут быть водородом одновременно.
3. Соединение или его фармацевтически приемлемая соль по п.1,
где R4 и R5 каждый независимо является водородом, хлором, фтором, метилом, трифторметилом, метокси или дифторметокси, при условии, что R4 и R5 не могут быть водородом одновременно.
4. Соединение или его фармацевтически приемлемая соль по п.1,
где соединение представлено следующей химической формулой 1-1:
Химическая формула 1-1
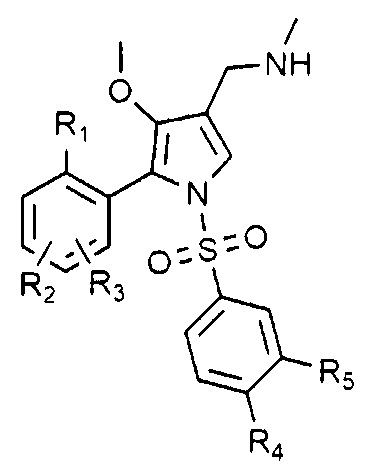
в химической формуле 1-1
R1 - R5 такие, как определены в п. 1.
5. Соединение или его фармацевтически приемлемая соль по п.4,
где R1, R2 и R3 каждый независимо является водородом, фтором или хлором, при условии, что R1, R2 и R3 не могут быть водородом одновременно.
6. Соединение или его фармацевтически приемлемая соль по п.4,
где R1 является галогеном и R2 и R3 каждый независимо является водородом или галогеном.
7. Соединение или его фармацевтически приемлемая соль по п.4,
где R1 является фтором и R2 и R3 каждый независимо является водородом, фтором или хлором, или
R1 является хлором и R2 и R3 являются водородом.
8. Соединение или его фармацевтически приемлемая соль по п.4,
где R4 и R5 каждый независимо является водородом, хлором, фтором, метилом, трифторметилом, метокси или дифторметокси, при условии, что R4 и R5 не могут быть водородом одновременно.
9. Соединение или его фармацевтически приемлемая соль по п.4,
где R4 является галогеном и R5 является хлором, фтором, метилом, трифторметилом, метокси или дифторметокси, или
R4 и R5 каждый независимо является хлором или фтором.
10. Соединение или его фармацевтически приемлемая соль по п.4,
где R1 является фтором и R2 и R3 каждый независимо является водородом или фтором, R4 является водородом и R5 является хлором или трифторметилом.
11. Соединение или его фармацевтически приемлемая соль по п.1,
где соединение выбирают из группы, представленной следующими химическими формулами 1-2-1-4:
Химическая формула 1-2
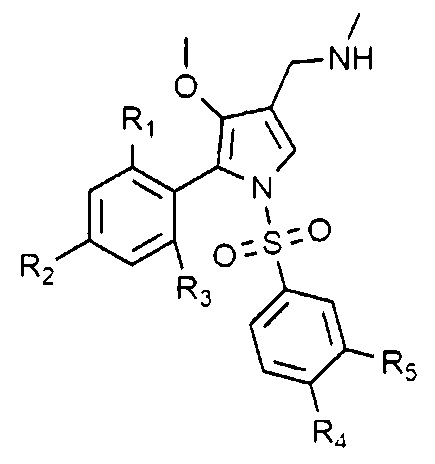
Химическая формула 1-3
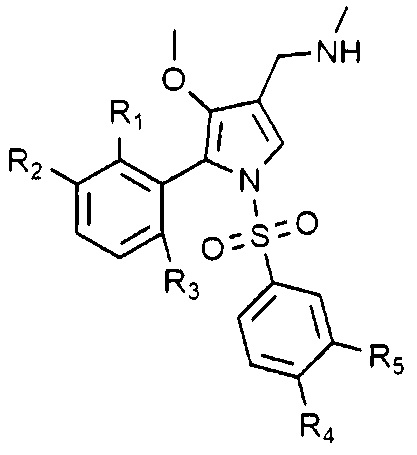
Химическая формула 1-4
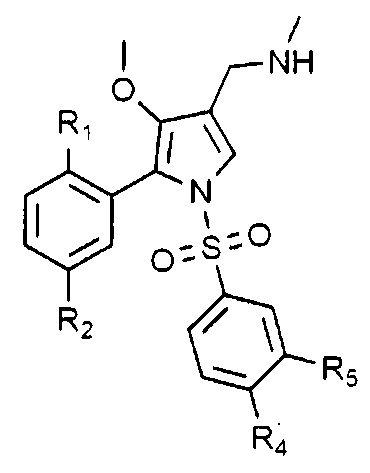
в химических формулах 1-2-1-4
R1 - R5 такие, как определены в п.1.
12. Соединение или его фармацевтически приемлемая соль по п.1,
где соединение выбирают из группы, включающей следующие соединения:
1) 1-(5-(2-фторфенил)-4-метокси-1-((3-хлорфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
2)1-(5-(2-фторфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
3) 1-(5-(2-фторфенил)-4-метокси-1-((3-метоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
4) 1-(5-(2-фторфенил)-4-метокси-1-((3-дифторметоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
5) 1-(5-(2-хлорфенил)-4-метокси-1-((3-метоксифенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
6) 1-(5-(2-фтор-4-хлорфенил)-4-метокси-1-((3-хлорфенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
7) 1-(5-(2-фтор-4-хлорфенил)-4-метокси-1-((3-(трифторметил)фенил)сульфонил)-1H-пиррол-3-ил)-N-метилметанамин;
8) 1-(5-(2,4-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метилокси-1H-пиррол-3-ил)-N-метилметанамин;
9) 1-(5-(2,4-дифторфенил)-1-((3-(трифторметил)фенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
10) 1-(5-(2,4-дифторфенил)-1-((3-метилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
11) 1-(5-(2,4-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
12) 1-(5-(2,4-дифторфенил)-1-((3-дифторметоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
13) 1-(5-(2,6-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
14) 1-(5-(2,6-дифторфенил)-1-((3-хлорфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
15) 1-(5-(2,6-дифторфенил)-1-((3-(трифторметил)фенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
16) 1-(5-(2,6-дифторфенил)-1-((3-метилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
17) 1-(5-(2,6-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
18) 1-(5-(2,6-дифторфенил)-1-((3-хлор-4-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
19) 1-(5-(2,6-дифторфенил)-1-((3,4-дифторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
20) 1-(5-(2-фтор-6-хлорфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
21) 1-(5-(2-фтор-6-хлорфенил)-1-((3-хлорфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
22) 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
23) 1-(1-((3-хлорфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
24) 1-(1-((3-трифторметилфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
25) 1-(1-((3-метоксифенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
26) 1-(1-((3,4-дифторфенил)сульфонил)-4-метокси-5-(2,4,6-трифторфенил)-1H-пиррол-3-ил)-N-метанамин;
27) 1-(1-((3-фторфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
28) 1-(1-((3-хлорфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
29) 1-(1-((3-трифторметилфенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
30) 1-(1-((3-метоксифенил)сульфонил)-4-метокси-5-(2,3,6-трифторфенил)-1H-пиррол-3-ил)-N-метилметанамин;
31) 1-(5-(2,5-дифторфенил)-1-((3-фторфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин;
32) 1-(5-(2,5-дифторфенил)-1-((3-трифторметилфенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин; и
33) 1-(5-(2,5-дифторфенил)-1-((3-метоксифенил)сульфонил)-4-метокси-1H-пиррол-3-ил)-N-метилметанамин.
13. Соединение или его фармацевтически приемлемая соль по п.1,
где фармацевтически приемлемой солью является гидрохлорид или фумарат.
14. Фармацевтическая композиция для профилактики и лечения повреждений желудочно-кишечного тракта из-за язвы пищеварительного тракта, гастрита, рефлюкс-эзофагита или H. pylori, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-13.
15. Фармацевтическая композиция для профилактики и лечения медиированных 5-ГТ рецептором или медиированных мускариновым рецептором ацетилхолина заболеваний, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-13.
16. Фармацевтическая композиция по п.15,
где медиированными 5-ГТ рецептором или медиированными мускариновым рецептором ацетилхолина заболеваниями являются депрессия, маниакальная депрессия, шизофрения, аутизм, обсессивно-компульсивный невроз, тревожное расстройство, мигрень, гипертензия, расстройства питания, синдром раздраженного кишечника (СРК), пептическая язва, диабетическая невропатия, астма и гиперреактивность мочевого пузыря.
| Микрометр | 1991 |
|
SU1803709A1 |
| RU 2015122126 A, 10.01.2017 | |||
| СПОСОБ ОБРАБОТКИ ШКУРОК КРОЛИКА | 1996 |
|
RU2114917C1 |
| EP 1919865 A1, 14.05.2008 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2018-08-13—Публикация
2016-04-27—Подача